Cozaar 25mg, 50mg, 100mg Losartan 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Cozaar 50mg とは何ですか? どのように使用されますか?
Cozaar は、高血圧 (高血圧) の症状を治療し、心臓病や糖尿病性神経痛 (神経障害) のある特定の人々の脳卒中のリスクを下げるために使用される処方薬です。 Cozaar 100mg は、単独で使用することも、他の薬と併用することもできます。
Cozaar 25mg は、アンギオテンシン II 受容体拮抗薬 (ARB) と呼ばれるクラスの薬に属しています。
Cozaar 25mg が 6 歳未満の子供に安全で有効であるかどうかはわかっていません。
Cozaar 100mg の副作用の可能性は何ですか?
Cozaar 100mg は、次のような重大な副作用を引き起こす可能性があります。
- 立ちくらみ、
- 排尿時の痛みや灼熱感、
- 吐き気、
- 弱点、
- ピリピリ感、
- 胸痛、
- 不規則な心拍、
- 動きの喪失、
- 排尿がほとんどまたはまったくない、
- 急激な体重増加、および
- 手、足、足首の腫れ
上記の症状がある場合は、すぐに医療機関を受診してください。
Cozaar の最も一般的な副作用は次のとおりです。
- めまい、
- 背中の痛みと
- かぜの諸症状(鼻づまり、くしゃみ、のどの痛み)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは Cozaar の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
胎児毒性
妊娠が判明したら、できるだけ早くコザールを中止してください。レニン-アンギオテンシン系に直接作用する薬は、発育中の胎児に損傷や死を引き起こす可能性があります[参照 警告と注意事項 ]。
説明
COZAAR (ロサルタン カリウム) は、AT1 受容体サブタイプに作用するアンギオテンシン II 受容体遮断薬です。非ペプチド分子であるロサルタン カリウムは、化学的に 2-ブチル-4-クロロ-1-[p-(o-1H-テトラゾール-5-イルフェニル)ベンジル]イミダゾール-5-メタノール一カリウム塩として記述されます。
その実験式は C22H22ClKN6O であり、その構造式は次のとおりです。
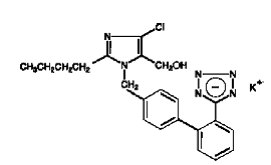
ロサルタン カリウムは、分子量 461.01 の白色からオフホワイトのさらさらした結晶性粉末です。水に溶けやすく、アルコールに溶け、アセトニトリルやメチルエチルケトンなどの一般的な有機溶媒に溶けにくい。イミダゾール環の 5-ヒドロキシメチル基が酸化されると、ロサルタンの活性代謝物が生成されます。
COZAAR 100mg は、25mg、50mg、または 100mg のロサルタン カリウムと、次の不活性成分を含む経口投与用の錠剤として入手できます。
COZAAR 25 mg、50 mg、および 100 mg 錠剤には、それぞれ 2.12 mg (0.054 mEq)、4.24 mg (0.108 mEq)、および 8.48 mg (0.216 mEq) のカリウムが含まれています。 COZAAR 25 mg、COZAAR 50 mg、および COZAAR 100 mg には、カルナバワックスも含まれている場合があります。
適応症
高血圧症
COZAAR® は、血圧を下げるために、成人および 6 歳以上の小児患者の高血圧の治療に適応されます。血圧を下げると、主に脳卒中や心筋梗塞などの致命的および非致命的な心血管 (CV) イベントのリスクが低下します。これらの利点は、ロサルタンを含むさまざまな薬理学的クラスの降圧薬の対照試験で見られました。
高血圧の管理は、必要に応じて、脂質管理、糖尿病管理、抗血栓療法、禁煙、運動、およびナトリウム摂取制限を含む包括的な心血管リスク管理の一部であるべきです。多くの患者は、血圧目標を達成するために複数の薬を必要とします。目標と管理に関する具体的なアドバイスについては、全国高血圧教育プログラムの高血圧の予防、検出、評価、および治療に関する合同全国委員会 (JNC) のガイドラインなど、公開されているガイドラインを参照してください。
さまざまな薬理学的クラスから、異なる作用機序を持つ多数の降圧薬が、ランダム化比較試験で心血管疾患の罹患率と死亡率を低下させることが示されています。これらの利点の主な原因です。最大かつ最も一貫した心血管転帰の利点は、脳卒中のリスクの低下ですが、心筋梗塞と心血管死亡率の低下も定期的に見られています.
収縮期圧または拡張期圧の上昇は心血管リスクの増加を引き起こし、mmHg あたりの絶対リスク増加は血圧が高いほど大きくなるため、重度の高血圧をわずかに低下させるだけでもかなりの利益が得られます。血圧低下による相対リスク低下は、絶対リスクが異なる集団間で類似しているため、高血圧とは無関係にリスクが高い患者 (たとえば、糖尿病または高脂血症の患者) では絶対的利益が大きくなり、そのような患者は利益を得ることが期待されます。より積極的な治療から低血圧の目標まで。
一部の降圧薬は、黒人患者では(単剤療法として)血圧への影響が小さく、多くの降圧薬には追加の承認された適応症と効果があります(例、狭心症、心不全、または糖尿病性腎疾患)。これらの考慮事項は、治療法の選択の指針となる場合があります。
COZAAR は、他の降圧剤と併用して投与することができます。
左心室肥大を伴う高血圧患者
COZAAR 25mg は、高血圧および左心室肥大の患者の脳卒中のリスクを軽減することが示されていますが、この利点は黒人患者には当てはまらないという証拠があります [参照 特定の集団での使用 と 臨床薬理学 ] .
2型糖尿病患者における腎症
COZAAR は、2 型糖尿病と高血圧の病歴を有する入院患者の血清クレアチニンとタンパク尿の上昇 (尿中アルブミンとクレアチニンの比率が 300 mg/g 以上) を伴う糖尿病性腎症の治療に適応されます。この集団では、COZAAR 50mg は、血清クレアチニンの倍増または末期腎疾患 (透析または腎移植の必要性) の発生によって測定される腎症の進行速度を低下させます [参照 臨床研究 ] .
投薬と管理
高血圧症
成人高血圧
コザール50mgの通常の開始用量は、1日1回50mgです。血圧をコントロールするために、必要に応じて 1 日 1 回 100 mg まで増量できます。 臨床研究 ] .血管内枯渇の可能性がある患者(利尿剤治療中など)には、25 mg の開始用量が推奨されます。
小児高血圧症
通常の推奨開始用量は、錠剤または懸濁液として 1 日 1 回 1 kg あたり 0.7 mg (合計で 50 mg まで) です。 懸濁液の調製(2.5 mg/mL 懸濁液 200 mL 用) ] .血圧反応により適宜増減する。 1 日 1.4 mg/kg を超える (または 100 mg を超える) 用量は、小児患者では研究されていません [ 臨床薬理学 、 臨床研究 と 警告と注意事項 ] .
COZAAR は、6 歳未満の小児患者、または推定糸球体濾過率が 30 mL/分/1.73m 2 未満の小児患者には推奨されません [ 特定の集団での使用 、 臨床薬理学 と 臨床研究 ] .
左心室肥大を伴う高血圧患者
通常、コザールとして 50mg を 1 日 1 回から開始する。ヒドロクロロチアジドを 1 日 12.5 mg 追加するか、COZAAR の用量を 1 日 1 回 100 mg に増量し、続いて血圧反応に基づいてヒドロクロロチアジドを 1 日 1 回 25 mg に増量する必要があります [ 臨床研究 ] .
2型糖尿病患者における腎症
通常の開始用量は、1 日 1 回 50 mg です。血圧反応に基づいて、1 日 1 回 100 mg に増量する必要があります。 臨床研究 ] .
肝障害患者における用量変更
軽度から中等度の肝障害のある患者では、COZAAR の推奨開始用量は 1 日 1 回 25 mg です。 COZAAR は、重度の肝障害のある患者では研究されていません [参照 特定の集団での使用 と 臨床薬理学 ] .
懸濁液の調製(2.5 mg/mL 懸濁液 200 mL 用)
10 mL の精製水 USP を、10 個の 50 mg COZAAR タブレットが入っている 8 オンス (240 mL) の琥珀色のポリエチレン テレフタレート (PET) ボトルに加えます。すぐに少なくとも 2 分間振ってください。濃縮液を 1 時間放置した後、1 分間振って錠剤の内容物を分散させます。 Ora-Plus™ と Ora-Sweet SF™ の 50/50 容量混合物を別々に調製します。 50/50 Ora-Plus™/Ora-Sweet SF™ 混合物 190 mL を錠剤に加え、PET ボトル内の水スラリーを 1 分間振って成分を分散させます。懸濁液は 2 ~ 8°C (36 ~ 46°F) で冷蔵する必要があり、最大 4 週間保存できます。各使用前に懸濁液を振って、すぐに冷蔵庫に戻してください。
供給方法
剤形と強度
- COZAAR 100mg、25mgは、片面にコード951の白い楕円形のフィルムコーティング錠です。
- COZAAR 50 mg は、白色の楕円形のフィルムコーティング錠で、片面にコード 952 があり、もう片面にスコアが付けられています。
- コザール 25mg、100mg は、片面にコード 960 が記載された白色の涙滴型のフィルムコーティング錠です。
保管と取り扱い
コザール は白色のフィルムコーティング錠で、次のように供給されます。
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) [USP 制御室温を参照してください] まで許容されます。容器は密閉して保管してください。光から保護します。
製造元: ORGANON & Co., Jersey City, NJ 07302, USAの子会社Organon LLC。改訂: 2021 年 10 月。
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
高血圧症
COZAAR は、本態性高血圧症の治療を受けた 3,300 人以上の成人患者と、全体で 4,058 人の患者/被験者において安全性が評価されています。 1200 人以上の患者が 6 か月以上、800 人以上が 1 年以上治療を受けました。
COZAAR 25mgによる治療は忍容性が高く、有害事象の全体的な発生率はプラセボと同様でした.対照臨床試験では、COZAAR 25mg で治療された患者の 2.3% とプラセボを投与された患者の 3.7% で、有害事象による治療の中止が発生しました。 1000 人以上の患者がさまざまな用量 (10 ~ 150 mg) のロサルタン カリウムを投与され、300 人以上の患者がプラセボを投与された 4 つの臨床試験で、COZAAR 25 mg で治療された患者の 2% 以上で発生し、プラセボよりも一般的に見られた有害事象は次のとおりでした。 % vs. 2%)、上気道感染症 (8% vs. 7%)、鼻づまり (2% vs. 1%)、背中の痛み (2% vs. 1%)。
以下のあまり一般的でない副作用が報告されています。
血液およびリンパ系の障害: 貧血。
精神障害: うつ。
神経系障害: 傾眠、頭痛、睡眠障害、感覚異常、片頭痛。
耳と迷路の障害: めまい、耳鳴り。
心疾患: 動悸、失神、心房細動、CVA。
呼吸器、胸部および縦隔の障害: 呼吸困難。
胃腸障害: 腹痛、便秘、吐き気、嘔吐。
皮膚および皮下組織の障害: 蕁麻疹、かゆみ、かぶれ、光線過敏症。
筋骨格および結合組織障害: 筋肉痛、関節痛。
生殖器系および乳房障害: インポテンス。
一般的な障害および投与部位の状態: 浮腫。
咳
持続性の空咳(発生率は数パーセント)は ACE 阻害剤の使用に関連しており、実際には ACE 阻害剤療法の中止の原因となる可能性があります。 ACE阻害薬療法を受けている間に咳を経験した高血圧患者の咳の発生率に対するロサルタンの効果を評価するために、2つの前向き並行群二重盲検無作為対照試験が実施されました。リシノプリルでチャレンジしたときに典型的な ACE 阻害薬の咳があり、プラセボで咳が消えた患者は、ロサルタン 50 mg、リシノプリル 20 mg、またはプラセボ (1 つの研究、n=97) または 25 mg ヒドロクロロチアジド (n=135) のいずれかに無作為に割り付けられました。二重盲検治療期間は最大8週間続きました。咳の発生率を以下の表 1 に示します。
これらの研究は、ロサルタン療法に関連する咳の発生率は、ACE阻害剤療法に関連する咳を全員が持っている集団において、ヒドロクロロチアジドまたはプラセボ療法に関連するものと同様であることを示しています.
陽性の再チャレンジを含む咳の症例は、市販後の経験でロサルタンを使用して報告されています.
左心室肥大を伴う高血圧患者
Losartan Intervention for Endpoint (LIFE) 研究では、COZAAR 100mg の副作用は、高血圧患者について以前に報告されたものと同様でした。
2 型糖尿病患者における腎症
COZAAR 100mgまたはプラセボで治療された1513人の患者を対象とした、アンジオテンシンII受容体拮抗薬ロサルタン(RENAAL)によるNIDDMのエンドポイントの減少研究では、報告された有害事象の全体的な発生率は2つのグループで類似していました.副作用による COZAAR の中止は、プラセボと同様でした (COZAAR 100mg で 19%、プラセボで 24%)。薬物関係に関係なく、COZAAR 50mg で治療された患者の 4% 以上の発生率で報告され、従来の降圧療法の背景にあるロサルタン群とプラセボ群で 2% 以上の差で発生した有害事象は、無力症/疲労、胸痛でした。 、低血圧、起立性低血圧、下痢、貧血、高カリウム血症、低血糖、腰痛、筋力低下、尿路感染症。
市販後の経験
COZAAR の市販後の経験では、次の追加の副作用が報告されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません。
消化器: 肝炎。
一般的な障害および投与部位の状態: 沈滞。
血液学: 血小板減少症。
過敏症: 喉頭と声門の腫れを含む血管性浮腫は、ロサルタンで治療された患者ではめったに報告されていません。これらの患者の何人かは、以前にACE阻害剤を含む他の薬で血管性浮腫を経験しました. Henoch-Schönlein紫斑病を含む血管炎が報告されています。アナフィラキシー反応が報告されています。
代謝と栄養: 低ナトリウム血症。
筋骨格: 横紋筋融解症。
神経系障害: 味覚異常。
肌: 紅皮症。
薬物相互作用
血清カリウムを増加させる薬剤
ロサルタンと血清カリウム値を上昇させる他の薬との同時投与は、高カリウム血症を引き起こす可能性があります.そのような患者では血清カリウムをモニターしてください。
リチウム
リチウムとアンギオテンシン II 受容体拮抗薬の併用投与中に、血清リチウム濃度の上昇とリチウム毒性が報告されています。併用中は血清リチウム濃度を監視してください。
選択的シクロオキシゲナーゼ-2阻害剤(COX-2阻害剤)を含む非ステロイド性抗炎症薬(NSAID)
高齢者、体液量が減少している患者(利尿薬治療中の患者を含む)、または腎機能が低下している患者では、選択的 COX-2 阻害剤を含む NSAID とアンギオテンシン II 受容体拮抗薬(ロサルタンを含む)を併用すると、腎機能が低下する可能性があります。急性腎不全の可能性を含みます。これらの影響は通常可逆的です。ロサルタンと NSAID 療法を受けている患者では、腎機能を定期的にモニタリングしてください。
ロサルタンを含むアンギオテンシン II 受容体拮抗薬の降圧効果は、選択的 COX-2 阻害剤を含む NSAID によって減弱される可能性があります。
レニン-アンジオテンシン系 (RAS) の二重遮断
アンジオテンシン受容体遮断薬、ACE 阻害薬、またはアリスキレンによる RAS の二重遮断は、単剤療法と比較して、低血圧、失神、高カリウム血症、および腎機能の変化 (急性腎不全を含む) のリスクの増加と関連しています。
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) 試験では、2 型糖尿病患者 1448 人が登録され、尿アルブミン対クレアチニン比が上昇し、推定糸球体濾過率が低下し (GFR 30 から 89.9 mL/分)、リシノプリルに無作為化されました。またはロサルタン療法のバックグラウンドでプラセボを追跡し、中央値で2.2年間追跡しました。ロサルタンとリシノプリルの併用療法を受けた患者は、GFR の低下、末期腎疾患、または死亡という複合エンドポイントについて、単剤療法と比較して追加の利益を得ることはありませんでしたが、単剤療法群と比較して高カリウム血症および急性腎障害の発生率が増加しました。
ほとんどの患者では、2 種類の RAS 阻害剤の併用による利益はありません。 RAS阻害剤との併用は原則として避けてください。 COZAAR 100mgおよびRASに影響を与える他の薬剤を服用している患者の血圧、腎機能、および電解質を注意深く監視してください。
糖尿病患者にはアリスキレンとコザール100mgを併用しないでください。腎機能障害のある患者(GFR
警告
の一部として含まれています "予防" セクション
予防
胎児毒性
COZAAR を妊婦に投与すると、胎児に害を及ぼす可能性があります。妊娠の第 2 および第 3 期にレニン-アンギオテンシン系に作用する薬物を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。結果として生じる羊水過少症は、胎児の肺形成不全および骨格の変形に関連している可能性があります。潜在的な新生児の副作用には、頭蓋形成不全、無尿症、低血圧、腎不全、および死亡が含まれます。妊娠が判明したら、速やかにコザール100mgを中止してください。 特定の集団での使用 ] .
体液量または塩分が枯渇した患者における低血圧
活性化されたレニン-アンギオテンシン系の患者、例えば、体液量または塩分が枯渇している患者(例えば、高用量の利尿薬で治療されている患者)では、COZAAR による治療の開始後に症候性低血圧が発生することがあります。 COZAAR 投与前の正しい量または減塩 [参照 投薬と管理 ] .
腎機能の低下
急性腎不全を含む腎機能の変化は、レニン-アンギオテンシン系を阻害する薬剤や利尿薬によって引き起こされる可能性があります。腎機能がレニン-アンギオテンシン系の活性に部分的に依存している可能性がある患者(例、腎動脈狭窄、慢性腎疾患、重度のうっ血性心不全、または体液量減少の患者)は、COZAAR で急性腎不全を発症するリスクが特に高い可能性があります。これらの患者の腎機能を定期的に監視します。 COZAAR で臨床的に重大な腎機能の低下が見られた患者では、治療の差し控えまたは中止を検討してください。 薬物相互作用 と 特定の集団での使用 ] .
高カリウム血症
血清カリウムを定期的に監視し、適切に治療してください。 COZAAR 25mgの減量または中止が必要になる場合があります[参照 有害反応 ] .
血清カリウムを上昇させる可能性のある他の薬の併用は、高カリウム血症を引き起こす可能性があります[参照 薬物相互作用 ] .
患者相談情報
FDA 承認の患者ラベル (患者情報) を読むよう患者に助言します。
妊娠
妊娠中のCOZAAR 100mgへの曝露の影響について、妊娠可能年齢の女性患者に助言してください。妊娠を計画している女性と治療の選択肢について話し合います。できるだけ早く医師に妊娠を報告するように患者に伝えます [ 警告と注意事項 と 特定の集団での使用 ] .
カリウムサプリメント
COZAAR を受けている患者には、医療提供者に相談せずにカリウム サプリメントまたはカリウムを含む塩代替物を使用しないようにアドバイスしてください [ 薬物相互作用 ] .
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
ロサルタン カリウムは、ラットとマウスにそれぞれ 105 週間と 92 週間、最大耐用量で投与した場合、発がん性はありませんでした。最高用量 (270 mg/kg/日) を与えられた雌ラットは、膵腺房腺腫の発生率がわずかに高かった。最大耐量 (ラットで 270 mg/kg/日、マウスで 200 mg/kg/日) では、ロサルタンとその薬理学的に活性な代謝産物の全身暴露は、約 160 倍と 90 倍 (ラット)、30 倍と 15 倍 (マウス) でした。 1 日あたり 100 mg を与えられた 50 kg のヒトの暴露。
ロサルタン カリウムは、微生物突然変異誘発試験および V-79 哺乳類細胞突然変異誘発試験、in vitro アルカリ溶出試験、in vitro および in vivo 染色体異常試験で陰性でした。さらに、活性代謝物は、微生物突然変異誘発、in vitro アルカリ溶出、および in vitro 染色体異常アッセイにおいて遺伝毒性の証拠を示さなかった。
ロサルタンカリウムを約150mg/kg/日まで経口投与した雄ラットを用いた研究では、繁殖力と生殖能力に影響はありませんでした。女性における毒性用量レベルの投与 (300/200 mg/kg/日) は、黄体/女性、移植片/女性、および Cmax での生存胎児/女性の数の有意な (p
特定の集団での使用
妊娠
リスクの概要
COZAAR を妊婦に投与すると、胎児に害を及ぼす可能性があります。妊娠の第 2 および第 3 期にレニン-アンギオテンシン系に作用する薬物を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。妊娠初期に降圧薬の使用にさらされた後の胎児の異常を調べる疫学研究のほとんどは、レニン-アンギオテンシン系に影響を与える薬物を他の降圧薬と区別していません。妊娠が判明したら、できるだけ早くコザールを中止してください。 臨床上の考慮事項 )。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の高血圧は、子癇前症、妊娠糖尿病、早産、分娩合併症(帝王切開の必要性、分娩後出血など)のリスクを高めます。高血圧は、胎児の子宮内発育制限および子宮内死亡のリスクを高めます。高血圧症の妊婦は注意深く監視し、それに応じて管理する必要があります。
胎児/新生児の有害反応
妊娠第 2 期および第 3 期にレニン-アンギオテンシン系に影響を与える薬剤を使用する妊婦の羊水過少症は、次の結果をもたらす可能性があります。 、そして死。特定の患者のレニン-アンジオテンシン系に影響を与える薬物による治療に代わる適切な方法がないというまれなケースでは、母親に胎児への潜在的なリスクについて知らせてください。
妊娠中に COZAAR を服用している患者では、一連の超音波検査を行って羊膜内環境を評価します。妊娠週に基づいて、胎児検査が適切な場合があります。羊水過少症が観察された場合は、母親の命を救うと考えられる場合を除き、コザール 50mg を中止してください。ただし、患者と医師は、胎児が不可逆的な損傷を受けるまで羊水過少症が現れない可能性があることに注意する必要があります。
低血圧、乏尿、および高カリウム血症のために子宮内でCOZAARに曝露した病歴のある新生児を注意深く観察してください。 COZAAR 100mgの子宮内曝露歴のある新生児で、乏尿または低血圧が発生した場合は、血圧と腎灌流をサポートしてください。低血圧を逆転させ、腎機能を置き換える手段として、交換輸血または透析が必要になる場合があります。
データ
動物データ
ロサルタン カリウムは、妊娠後期から授乳までの期間 (妊娠 15 日目から授乳日 20 日目まで) のラットに 10、25、および 100 mg/kg/日の用量で経口投与されました。ロサルタン カリウムは、ラットの胎児および新生児に、体重の減少、身体的および行動的発達の遅延、死亡率、腎毒性などの悪影響をもたらすことが示されています。新生児の体重増加 (10 mg/kg/日の低用量で影響を受けた) を除いて、これらの影響に関連する用量は 25 mg/kg/日を超えました (1 mg あたり 100 mg の最大推奨ヒト用量の約 3 倍)。 /m 基準)。これらの調査結果は、妊娠後期および授乳中の薬物曝露に起因すると考えられています。かなりのレベルのロサルタンとその活性代謝物が、妊娠後期のラット胎児血漿およびラットミルクに存在することが示されました。
授乳
リスクの概要
ロサルタンが母乳に排泄されるかどうかは不明ですが、かなりのレベルのロサルタンとその活性代謝物がラットのミルクに存在することが示されました.授乳中の乳児に悪影響を与える可能性があるため、母親にとっての薬の重要性を考慮して、授乳を中止するか薬を中止するかを決定する必要があります。
小児用
COZAAR の降圧効果は、6 歳から 16 歳までの小児高血圧患者で確立されています。 6 歳未満の小児患者、または糸球体濾過量が 30 mL/min/1.73 m2 未満の小児患者における安全性と有効性は確立されていません。 投薬と管理 、 臨床薬理学 と 臨床研究 ] .
高齢者の使用
高血圧症の対照臨床試験でコザール 25mg を投与された患者の総数のうち、391 人の患者 (19%) が 65 歳以上で、37 人の患者 (2%) が 75 歳以上でした。タンパク尿を伴う 2 型糖尿病患者の腎保護に関する対照臨床研究では、248 人の患者 (33%) が 65 歳以上でした。左心室肥大を伴う高血圧患者における心血管死、脳卒中および心筋梗塞の複合リスクの低減に関する対照臨床研究では、2857 人の患者 (62%) が 65 歳以上であり、808 人の患者 (18%) が 75 歳以上でした。 .これらの患者と若い患者との間で有効性または安全性の全体的な違いは観察されませんでしたが、一部の高齢者の感度が高いことを排除することはできません.
人種
LIFE研究では、アテノロールで治療された高血圧と左心室肥大の黒人患者は、COZAARで治療された黒人患者と比較して、一次複合エンドポイントを経験するリスクが低かった(大多数の患者でヒドロクロロチアジドと共治療された).主要エンドポイントは、治療意図(ITT)アプローチを使用して分析された、脳卒中、心筋梗塞、または心血管死の最初の発生でした。黒人患者のサブグループ (n=533、LIFE 試験患者の 6%) では、アテノロールの 263 人の患者に 29 の主要評価項目 (11%、1000 患者年あたり 26) があり、270 人の患者に 46 の主要評価項目 (17%) がありました。 、1000 患者年あたり 42 人)。この所見は、人種以外の人口の違いや治療グループ間の不均衡に基づいて説明することはできませんでした.さらに、両方の治療グループの血圧低下は、黒人患者と非黒人患者の間で一貫していました。大規模な試験でサブセットの違いを解釈するのが難しいことを考えると、観察された違いが偶然の結果であるかどうかを知ることはできません.しかし、LIFE研究は、左心室肥大を伴う高血圧患者の心血管イベントのリスクを軽減するCOZAAR 100mgの利点が黒人患者に適用されるという証拠を提供していません[参照] 臨床研究 ] .
腎障害
腎不全の患者は、腎機能が正常な被験者と比較して、ロサルタンとその活性代謝物の血漿濃度が上昇しています。腎機能障害のある患者も体液量が枯渇していない限り、腎機能障害のある患者では用量調整は必要ありません。 投薬と管理 、 警告と注意事項 と 臨床薬理学 ] .
肝障害
COZAAR の推奨開始用量は、軽度から中等度の肝障害のある患者では 25 mg です。軽度から中等度の肝障害のある患者に経口投与した後、ロサルタンとその活性代謝物の血漿濃度は、健康なボランティアで見られる値のそれぞれ 5 倍と 1.7 倍でした。 投薬と管理 と 臨床薬理学 ] .
過剰摂取
1000 mg/kg と 2000 mg/kg をそれぞれ経口投与した後、マウスとラットで有意な致死率が観察されました。これは、mg/m2 ベースでヒトの最大推奨用量の約 44 倍と 170 倍です。
ヒトの過剰摂取に関して入手できるデータは限られています。過剰摂取の最も可能性の高い兆候は、低血圧と頻脈です。徐脈は、副交感神経 (迷走神経) の刺激によって発生する可能性があります。症候性低血圧が発生した場合は、支持療法を開始する必要があります。
ロサルタンもその活性代謝物も血液透析では除去できません。
禁忌
COZAAR 50mgは禁忌です:
- この製品の成分に過敏な患者。
- 糖尿病患者におけるアリスキレンとの併用。
臨床薬理学
作用機序
アンギオテンシン II [アンギオテンシン変換酵素 (ACE、キニナーゼ II) によって触媒される反応でアンギオテンシン I から形成される] は、強力な血管収縮剤であり、レニン-アンギオテンシン系の主要な血管作動性ホルモンであり、高血圧の病態生理学における重要な要素です。また、副腎皮質によるアルドステロン分泌を刺激します。ロサルタンとその主な活性代謝物は、多くの組織 (血管平滑筋、副腎など) に見られる AT1 受容体へのアンギオテンシン II の結合を選択的に遮断することにより、アンギオテンシン II の血管収縮作用とアルドステロン分泌作用を遮断します。また、多くの組織で見られる AT1 受容体もありますが、心臓血管の恒常性に関連することは知られていません。ロサルタンもその主要な活性代謝物も AT1 受容体で部分アゴニスト活性を示さず、どちらも AT1 受容体よりも AT1 受容体に対してはるかに大きな親和性 (約 1000 倍) を持っています。インビトロ結合研究は、ロサルタンがAT1受容体の可逆的で競合的な阻害剤であることを示しています。活性代謝物は、ロサルタンよりも重量で 10 ~ 40 倍強力であり、AT1 受容体の可逆的な非競合的阻害剤であると思われます。
ロサルタンもその活性代謝物も ACE (キニナーゼ II、アンギオテンシン I をアンギオテンシン II に変換し、ブラジキニンを分解する酵素) を阻害せず、心血管調節において重要であることが知られている他のホルモン受容体またはイオンチャネルに結合したりブロックしたりしません。
薬力学
ロサルタンは、アンギオテンシン II (およびアンギオテンシン I) 注入の昇圧効果を阻害します。 100 mg の用量は、昇圧効果をピーク時に約 85% 抑制し、25 ~ 40% の抑制が 24 時間持続します。アンギオテンシン II の負のフィードバックを除去すると、血漿レニン活性が 2 倍から 3 倍になり、その結果、高血圧患者のアンギオテンシン II 血漿濃度が上昇します。ロサルタンはブラジキニンへの反応に影響を与えませんが、ACE阻害剤はブラジキニンへの反応を増加させます。アルドステロン血漿濃度は、ロサルタン投与後に低下します。アルドステロン分泌に対するロサルタンの効果にもかかわらず、血清カリウムに対する効果はほとんど観察されなかった.
ロサルタンの効果は1週間以内に実質的に現れますが、いくつかの研究では最大の効果が3〜6週間で発生しました.長期追跡研究 (プラセボ対照なし) では、ロサルタンの効果は最大 1 年間維持されるようでした.ロサルタンの突然の中止後、明らかなリバウンド効果はありません.対照試験では、ロサルタンで治療された患者の平均心拍数に本質的に変化はありませんでした.
薬物動態
吸収
経口投与後、ロサルタンは十分に吸収され、実質的な初回通過代謝を受けます。ロサルタンの全身バイオアベイラビリティは約 33% です。ロサルタンとその活性代謝物の平均ピーク濃度は、それぞれ 1 時間と 3 ~ 4 時間で到達します。ロサルタンとその活性代謝物の最大血漿濃度はほぼ同じですが、代謝物のAUC(曲線下面積)はロサルタンの約4倍です。食事はロサルタンの吸収を遅らせ、その Cmax を低下させますが、ロサルタンの AUC または代謝産物の AUC への影響はわずかです (約 10% の減少)。ロサルタンとその活性代謝物の薬物動態は、200 mg までの経口ロサルタン用量で直線的であり、経時的に変化しません。
分布
ロサルタンと活性代謝物の分布量は、それぞれ約 34 リットルと 12 リットルです。ロサルタンとその活性代謝物はどちらも血漿タンパク質、主にアルブミンに高度に結合しており、血漿を含まない画分はそれぞれ 1.3% と 0.2% です。血漿タンパク質結合は、推奨用量で達成される濃度範囲にわたって一定です。ラットでの研究は、ロサルタンが血液脳関門を通過したとしても、ほとんど通過しないことを示しています.
代謝
ロサルタンは、シトクロム P450 酵素による実質的な初回通過代謝を受ける経口活性剤です。一部は、ロサルタン治療後のアンギオテンシン II 受容体拮抗作用のほとんどを担う活性カルボン酸代謝物に変換されます。ロサルタンの経口投与量の約 14% が活性代謝物に変換されます。活性カルボン酸代謝物に加えて、いくつかの不活性代謝物が形成されます。インビトロ研究は、シトクロム P450 2C9 および 3A4 がロサルタンの代謝物への生体内変換に関与していることを示しています。
排除
ロサルタンと活性代謝物の総血漿クリアランスは、それぞれ約 600 mL/分と 50 mL/分であり、腎クリアランスはそれぞれ約 75 mL/分と 25 mL/分です。ロサルタンの最終半減期は約 2 時間で、代謝産物の半減期は約 6 ~ 9 時間です。経口投与されたロサルタンの単回投与後、投与量の約 4% が未変化のまま尿中に排泄され、約 6% が活性代謝物として尿中に排泄されます。胆汁排泄は、ロサルタンとその代謝産物の排除に寄与します。 14C 標識ロサルタンの経口投与後、放射能の約 35% が尿から回収され、約 60% が糞便から回収されます。 14C 標識ロサルタンの静脈内投与後、放射能の約 45% が尿中に回収され、50% が糞便中に回収されます。ロサルタンもその代謝物も、1日1回の反復投与では血漿に蓄積しません。
特定の集団
小児科
6歳から16歳の高血圧患者25名に錠剤としてロサルタン(平均用量0.7mg/kg、範囲0.36から0.97mg/kg)を複数回投与した後の薬物動態パラメータを以下の表4に示す。ロサルタンとその活性代謝物の薬物動態は、調査対象の年齢層全体で一般的に類似しており、成人の過去の薬物動態データと類似していました。成人および小児における主な薬物動態パラメータを下表に示します。
懸濁液製剤のバイオアベイラビリティは、健康な成人のロサルタン錠剤と比較されました。懸濁液と錠剤は、ロサルタンと活性代謝物の両方に関して生物学的利用能が似ています[ 投薬と管理 ] .
高齢者と性別
ロサルタンの薬物動態は、高齢者 (65 ~ 75 歳) および男女両方で調査されています。ロサルタンとその活性代謝物の血漿濃度は、高齢者と若年高血圧者で類似しています。ロサルタンの血漿中濃度は、女性の高血圧患者で男性の高血圧患者の約 2 倍高かったが、活性代謝物の濃度は男性と女性で類似していた。投与量の調整は必要ありません [参照 投薬と管理 ] .
人種
人種による薬物動態の違いは研究されていない[参照 特定の集団での使用 ] .
腎不全
経口投与後、ロサルタンとその活性代謝物の血漿濃度と AUC は、軽度 (クレアチニンクリアランス 50 ~ 74 mL/分) または中等度 (クレアチニンクリアランス 30 ~ 49 mL/分) の腎不全患者で 50 ~ 90% 増加します。 .この研究では、軽度または中等度の腎不全患者のロサルタンとその活性代謝物の両方で、腎クリアランスが 55 ~ 85% 減少しました。ロサルタンもその活性代謝物も、血液透析によって除去することはできません。 警告と注意事項 と 特定の集団での使用 ] .
肝不全
軽度から中等度のアルコール性肝硬変患者に経口投与した後、ロサルタンとその活性代謝物の血漿濃度は、若い男性ボランティアのそれぞれ 5 倍と約 1.7 倍でした。正常な被験者と比較して、肝不全のロサルタン入院患者の総血漿クリアランスは約 50% 低く、経口バイオアベイラビリティは約 2 倍でした。軽度から中等度の肝障害のある患者には、25 mg の開始用量を使用してください。 COZAAR 50mg は、重度の肝障害のある患者では研究されていません [ 投薬と管理 と 特定の集団での使用 ] .
薬物相互作用
ロサルタンカリウムとヒドロクロロチアジド、ジゴキシン、ワルファリン、シメチジンおよびフェノバルビタールとの研究では、臨床的に重要な薬物相互作用は発見されていません。シトクロムP450 2C9の阻害剤であるフルコナゾールは、活性代謝物のAUCを約40%減少させたが、複数回投与後、ロサルタンのAUCを約70%増加させた.静脈内投与後のロサルタンの活性代謝物への変換は、ケトコナゾールの影響を受けない. P450 3A4 の阻害剤。経口ロサルタン後の活性代謝物の AUC は、P450 3A4 の阻害剤であるエリスロマイシンの影響を受けませんでしたが、ロサルタンの AUC は 30% 増加しました。
ロサルタンと P450 2C9 阻害剤の併用による薬力学的影響は検討されていません。ロサルタンの活性代謝物を代謝しない被験者は、シトクロム P450 2C9 に特異的でまれな欠陥があることが示されています。これらのデータは、ロサルタンのその活性代謝物への変換が、P450 3A4 ではなく、主に P450 2C9 によって媒介されることを示唆しています。
臨床研究
高血圧症
成人高血圧
コザール 25 mg の降圧効果は、ベースラインの拡張期血圧が 95 ~ 115 の患者を対象に、1 日あたり 10 ~ 150 mg を 6 ~ 12 週間投与した 4 つのプラセボ対照試験で主に示されました。この研究では、1 日 1 回または 1 日 2 回のレジメンとしての 2 つの用量 (50 ~ 100 mg/日) の比較、ピーク効果とトラフ効果の比較、および性別、年齢、および人種による反応の比較が可能でした。さらに 3 つの研究で、ロサルタンとヒドロクロロチアジドの併用による降圧効果が調べられました。
ロサルタン単剤療法の 4 つの研究には、数回のロサルタン投与に無作為に割り付けられた合計 1075 人の患者と、プラセボに 334 人の患者が含まれていました。 10 mg および 25 mg の用量では、ピーク時 (投与後 6 時間) にある程度の効果が得られましたが、反応の谷間 (24 時間後) は小さく一貫性がありませんでした。 50、100、150 mg を 1 日 1 回投与すると、5.5 ~ 10.5/3.5 ~ 7.5 mmHg の範囲のプラセボと比較して、統計的に有意な収縮期 / 拡張期の平均血圧低下が見られ、150 mg の投与量では 50 を超える影響はありませんでした。 100mg。 50-100 mg/日で 1 日 2 回投与すると、同じ総用量で 1 日 1 回投与するよりも一貫して大きなトラフ応答が得られました。ピーク (6 時間) の影響は、谷の影響よりも一様ではあるが適度に大きく、収縮期および拡張期の応答の谷とピークの比率はそれぞれ 50 ~ 95% および 60 ~ 90% でした。
低用量のヒドロクロロチアジド (12.5 mg) をロサルタン 50 mg に 1 日 1 回追加すると、プラセボ調整血圧が 15.5/9.2 mmHg 低下しました。
患者の年齢、性別、人種のサブグループを分析したところ、男性と女性、および 65 歳以上と 65 歳未満の患者は、一般的に同様の反応を示しました。 COZAAR 25mg は、人種に関係なく血圧を下げる効果がありましたが、黒人患者 (通常は低レニン集団) では効果がやや低かった.
小児高血圧症
ロサルタンの降圧効果は、6 歳から 16 歳までの 177 人の高血圧の小児患者を登録した 1 つの試験で研究されました。体重が 50 kg 未満の子供には毎日 2.5、25、または 50 mg のロサルタンが投与され、体重が 50 kg 以上の患者には毎日 5、50、または 100 mg のロサルタンが投与されました。最低用量群の子供には、懸濁液製剤のロサルタンが投与された[参照 投薬と管理 .小児の大多数は、腎疾患および泌尿生殖器疾患に関連する高血圧症を患っていました。研究への参加時の座位拡張期血圧 (SiDBP) は、患者の年齢、性別、および身長の 95 パーセンタイル レベルよりも高かったです。 3週間の終わりに、ロサルタンは、用量依存的に、谷で測定された収縮期および拡張期血圧を低下させました.全体として、2 つの高用量 (50 kg 未満の患者では 25 ~ 50 mg、50 kg 以上の患者では 50 ~ 100 mg) は、使用された最低用量 (50 kg 未満の患者では 2.5 mg) よりも拡張期血圧を 5 ~ 6 mmHg 低下させました。 ; 50kg以上の患者では5mg)。 0.07 mg/kg の平均 1 日用量に対応する最低用量は、一貫した降圧効果を提供するようには見えませんでした。患者が 2 つの高用量でロサルタンを継続するか、3 週間の治療後にプラセボに無作為に割り付けられた場合、トラフ拡張期血圧は、ロサルタンを継続するように無作為に割り付けられた患者よりも 5 ~ 7 mmHg の間でプラセボの患者で上昇しました。低用量のロサルタンを無作為に中止した場合、トラフ拡張期血圧の上昇は、プラセボを投与された患者とロサルタンを継続している患者で同じであり、最低用量では有意な降圧効果がなかったことを再度示唆しています.全体として、患者を年齢(
左心室肥大を伴う高血圧患者
LIFE研究は、心電図で記録された左心室肥大を有する9193人の高血圧患者を対象に、COZAAR 50mgとアテノロールを比較した多国籍二重盲検研究でした。無作為化前の 6 か月以内に心筋梗塞または脳卒中を発症した患者は除外されました。患者は無作為に1日1回COZAAR 50mgまたはアテノロール50mgを投与されました。目標血圧 (
無作為化された患者のうち、4963 人 (54%) が女性で、533 人 (6%) が黒人でした。平均年齢は 67 歳で、5,704 人 (62%) が 65 歳以上でした。ベースラインでは、1195 人 (13%) が糖尿病、1326 人 (14%) が孤立性収縮期高血圧、1469 人 (16%) が冠動脈疾患、728 人 (8%) が脳血管疾患でした。ベースラインの平均血圧は、両方の治療群で 174/98 mmHg でした。追跡調査の平均期間は 4.8 年でした。試験終了時または主要評価項目前の最後の来院時に、COZAAR 50mg で治療したグループの 77% と、アテノロールで治療したグループの 73% が、まだ治験薬を服用していました。まだ治験薬を服用している患者のうち、COZAAR とアテノロールの平均投与量は両方とも約 80 mg/日であり、15% が単剤療法としてアテノロールまたはロサルタンを服用していましたが、77% はヒドロクロロチアジドも投与されていました (平均投与量は 20 mg/日)。各グループ)。トラフで測定された血圧低下は、両方の治療群で同様でしたが、血圧は 1 日のどの時間帯にも測定されませんでした。試験終了時または主要評価項目前の最終来院時の平均血圧は、COZAAR で治療したグループで 144.1/81.3 mmHg、アテノロールで治療したグループで 145.4/80.9 mmHg でした。 1.3 mmHg の収縮期血圧 (SBP) の差は有意 (p
主要エンドポイントは、心血管死、致命的でない脳卒中、または致命的でない心筋梗塞の最初の発生でした。致命的ではないイベントが発生した患者は試験に残ったため、最初のイベントでなくても、各タイプの最初のイベントの検査も行われました(たとえば、最初の心筋梗塞に続く脳卒中は、脳卒中の分析にカウントされます)。 COZAAR 50mg による治療により、アテノロール群と比較して、主要評価項目のリスクが 13% (p=0.021) 減少しました (図 1 および表 3 を参照)。この違いは、主に致命的および非致命的な脳卒中への影響の結果でした。 COZAAR による治療は、アテノロールと比較して脳卒中のリスクを 25% 減少させました (p=0.001) (図 2 および表 3 を参照)。
図 1: COZAAR 100mg およびアテノロールで治療されたグループにおける心血管死、非致死的脳卒中、または非致死的心筋梗塞までの時間の主要エンドポイントのカプラン-マイヤー推定値。リスク低減は、ベースラインのフラミンガム リスク スコアと心電図による左心室肥大のレベルに合わせて調整されます。
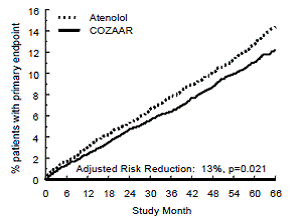
図 2: COZAAR 50mg とアテノロールで治療されたグループの致命的/非致命的な脳卒中までの時間のカプラン-マイヤー推定値。リスク低減は、ベースラインのフラミンガム リスク スコアと心電図左心室肥大のレベルに合わせて調整されます。
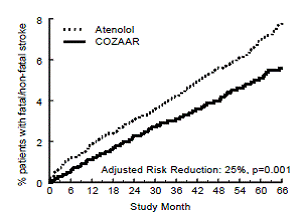
表 3 は、主要な複合エンドポイントと個々のエンドポイントの結果を示しています。主要エンドポイントは、ITT アプローチを使用して分析された、脳卒中、心筋梗塞、または心血管死の最初の発生でした。この表は、各コンポーネントのイベント数を 2 つの異なる方法で示しています。コンポーネントのプライマリ エンドポイント (最初のイベントとして) は、プライマリ エンドポイントを定義するイベントのみをカウントしますが、セカンダリ エンドポイントは、異なるタイプのイベントが先行しているかどうかにかかわらず、特定のタイプのすべての最初のイベントをカウントします。
主要評価項目に関して、LIFE 研究はアテノロールよりも COZAAR を支持しましたが (p=0.021)、この結果は単一の研究によるものであり、したがって、COZAAR とプラセボの差よりも説得力がありません。直接測定されていませんが、アテノロール自体が高血圧患者の脳卒中を含む心血管イベントの減少に効果的であるという証拠があるため、COZAAR とプラセボの違いは説得力があります。
LIFE試験のその他の臨床的評価項目は、総死亡率、心不全または狭心症による入院、冠動脈または末梢血行再建術、および蘇生心停止でした。 COZAAR 群とアテノロール群の間で、これらのエンドポイントの発生率に有意差はありませんでした。
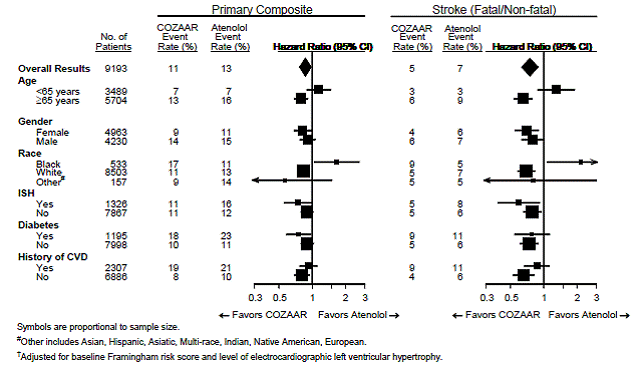
主要評価項目と脳卒中について、年齢、性別、人種、および孤立性収縮期高血圧症 (ISH)、糖尿病、および心血管疾患 (CVD) の病歴の有無によって定義された患者サブグループにおける COZAAR 25mg の効果を以下の図 3 に示します。 .サブグループ分析は解釈が難しい場合があり、これらが真の違いを表しているのか偶然の影響を表しているのかは不明です。
図 3: 人口学的サブグループ内の主要なエンドポイント イベント†
2型糖尿病患者における腎症
RENAAL 研究は、腎症を伴う 2 型糖尿病患者 1,513 人を対象に世界中で実施された無作為化プラセボ対照二重盲検多施設研究です (女性または男性で血清クレアチニン 1.3 ~ 3.0 mg/dL、60 kg 以下および 1.5 ~ 3.0 mg と定義)。 60 kg を超える男性でタンパク尿 [尿中アルブミンとクレアチニンの比が 300 mg/g 以上] の場合は /dL)。
患者は、ACE 阻害薬とアンギオテンシン II 拮抗薬を除く従来の降圧療法を背景に、1 日 1 回の COZAAR 50 mg またはプラセボを投与される群に無作為に割り付けられました。 1 か月後、トラフ血圧の目標 (140/90 mmHg) が達成されなかった場合、研究者は 1 日 1 回 100 mg まで試験薬を滴定するように指示されました。全体として、患者の 72% が、治験薬を服用している時間の 50% 以上で 100 mg の 1 日用量を投与されました。この研究は両群で同等の血圧コントロールを達成するように設計されているため、他の降圧薬(利尿薬、カルシウムチャネル遮断薬、アルファ遮断薬またはベータ遮断薬、および中枢作用薬)を必要に応じて両方の群で追加できます。患者は平均3.4年間追跡されました。
研究集団は人種に関して多様でした (アジア人 16.7%、黒人 15.2%、ヒスパニック系 18.3%、白人 48.6%)。全体として、患者の 63.2% が男性で、66.4% が 65 歳未満でした。ほとんどすべての患者 (96.6%) に高血圧の病歴があり、ベースラインで平均血清クレアチニンが 1.9mg/dL、平均タンパク尿 (尿中アルブミン/クレアチニン) が 1808mg/g で試験に参加しました。
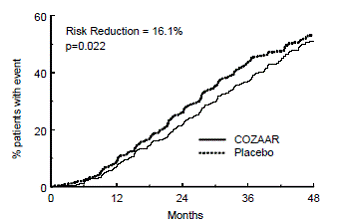
この研究の主要評価項目は、血清クレアチニンの倍増、末期腎疾患 (ESRD) (透析または移植の必要性)、または死亡のいずれかが最初に発生するまでの時間でした。 COZAAR による治療は、このエンドポイントで 16% のリスク低減をもたらしました (図 4 および表 4 を参照)。 COZAARによる治療はまた、別々のエンドポイントとして、血清クレアチニンの持続的倍増の発生を25%、ESRDを29%減少させたが、全体的な死亡率には影響を及ぼさなかった(表4参照)。
平均ベースライン血圧は、COZAAR と従来の降圧療法の併用で 152/82 mmHg、プラセボと従来の降圧療法の併用で 153/82 mmHg でした。試験終了時の平均血圧は、コザール 100mg で治療したグループで 143/76 mmHg、プラセボで治療したグループで 146/77 mmHg でした。
図 4: 血清クレアチニンの倍増、末期の腎疾患 (透析または移植の必要性) または死亡の主要な複合エンドポイントのカプラン-マイヤー曲線
この研究の副次的評価項目は、タンパク尿の変化、腎疾患の進行速度の変化、心血管系の原因による罹患率と死亡率の複合でした (心不全による入院、心筋梗塞、血行再建術、脳卒中、不安定狭心症による入院、または心血管疾患による入院)。プラセボと比較して、COZAAR はタンパク尿を平均 34% 大幅に減少させました。これは、治療開始から 3 か月以内に明らかな効果でした。血清クレアチニン濃度の逆数。心血管疾患の罹患率と死亡率の複合エンドポイントの発生率に有意差はありませんでした。
COZAAR の好ましい効果は、他の降圧薬(アンギオテンシン II 受容体拮抗薬およびアンギオテンシン変換酵素阻害薬は許可されていません)、経口血糖降下薬および脂質低下薬を服用している患者にも見られました。
主要評価項目と ESRD について、年齢、性別、人種によって定義された患者サブグループにおける COZAAR の効果を以下の表 5 に示します。サブグループ分析は解釈が難しい場合があり、これらが真の違いを表しているのか偶然の影響を表しているのかは不明です。
患者情報
コザール® (CO-zar) (ロサルタンカリウム錠) 25mg、50mg、100mg
COZAAR の服用を開始する前、およびリフィルを入手するたびに、COZAAR に付属の患者情報をお読みください。新しい情報があるかもしれません。このリーフレットは、あなたの状態と治療について医師と話す代わりにはなりません.
COZAAR について知っておくべき最も重要な情報は何ですか?
- COZAAR は、胎児に危害や死をもたらす可能性があります。
- 妊娠を計画している場合は、血圧を下げる他の方法について医師に相談してください。
- COZAAR の服用中に妊娠した場合は、すぐに医師に相談してください。
コザール100mgとは?
コザール100mgは、アンジオテンシン受容体遮断薬(ARB)と呼ばれる処方薬です。それは使用されます:
- 高血圧(高血圧)を下げるために、単独で、または他の血圧薬と併用してください。
- 高血圧と左心室肥大と呼ばれる心臓の問題を抱えている患者の脳卒中の可能性を下げるために。 COZAAR は、この問題を抱えた黒人患者を助けないかもしれません。
- 高血圧の 2 型糖尿病患者の糖尿病性腎疾患 (腎症) の悪化を遅らせる。
COZAAR 25mg は、6 歳未満の子供または特定の腎臓に問題のある子供では研究されていません。
高血圧(高血圧) .血圧は、心臓が鼓動するときと心臓が休むときの血管にかかる力です。力が強すぎると高血圧になります。 COZAAR 25mg は血管を弛緩させ、血圧を下げるのに役立ちます。
左心室肥大 (LVH) 心臓の左室 (心臓の主なポンプ室) の壁の拡大です。 LVH は、いくつかの原因で発生する可能性があります。高血圧はLVHの最も一般的な原因です。
腎症を伴う2型糖尿病 2型糖尿病は、主に成人に発症する糖尿病の一種です。糖尿病性腎症がある場合、糖尿病による損傷のために腎臓が適切に機能していないことを意味します.
COZAAR 100mgを服用してはいけない人は?
- COZAARの成分にアレルギーがある場合は、COZAAR 25mgを服用しないでください。 . COZAAR の成分の完全なリストについては、このリーフレットの最後を参照してください。
- 糖尿病を患っており、血圧を下げるためにアリスキレンと呼ばれる薬を服用している場合は、COZAAR を服用しないでください。
COZAAR 50mgを服用する前に医師に何を伝えるべきですか?
以下の場合を含め、すべての病状について医師に伝えてください。
- 妊娠中または妊娠を計画している。 見る " COZAAR 25mgについて知っておくべき最も重要な情報は何ですか? "
- 授乳中です COZAAR 50mg が母乳に移行するかどうかは不明です。コザール 50mg を服用するか、母乳で育てるかのいずれかを選択する必要がありますが、両方を選択することはできません。
- 嘔吐が多い、または下痢が多い
- 肝臓に問題がある
- 腎臓に問題がある
処方薬、非処方薬、ビタミン、ハーブのサプリメントなど、服用しているすべての薬について医師に伝えてください。 COZAAR と特定の他の医薬品は相互に作用する可能性があります。特に以下を服用している場合は医師に相談してください:
- カリウムサプリメント
- カリウムを含む塩代替物
- 血清カリウムを増加させる可能性のある他の薬
- 水の丸薬(利尿薬)
- リチウム(特定の種類のうつ病の治療に使用される薬)
- COX-2阻害剤を含む、非ステロイド性抗炎症薬(NSAID)と呼ばれる、痛みや関節炎の治療に使用される薬
- 血圧を下げる他の薬
COZAAR 25mgはどのように服用すればよいですか?
- COZAAR 100mg を医師の指示どおりに服用してください。必要に応じて、医師が用量を変更することがあります。
- COZAAR 50mg は食事の有無にかかわらず服用できます。
- 飲み忘れた場合は、気がついたらすぐに服用してください。次の服用時間が近い場合は、飲み忘れた分は服用しないでください。通常の時間に次の用量を服用してください。
- COZAAR の服用量が多すぎる場合は、医師または毒物管理センターに連絡するか、すぐに最寄りの病院の緊急治療室に行ってください。
COZAAR の考えられる副作用は何ですか?
COZAAR 25mg は、次の重大な副作用を引き起こす可能性があります。
- 胎児の負傷または死亡。 「COZAAR について知っておくべき最も重要な情報は何ですか?」を参照してください。
- アレルギー反応 .アレルギー反応の症状は、顔、唇、のど、または舌の腫れです。すぐに救急医療を受け、COZAAR の使用を中止してください。
- 低血圧(低血圧) .低血圧により、めまいや失神を感じることがあります。めまいや失神を感じたら横になってください。すぐに医師に連絡してください。
- すでに腎臓に問題がある人は、腎臓の働きが悪化することがあります。 足、足首、または手にむくみがある場合、または原因不明の体重増加がある場合は、医師に連絡してください。
- カリウムの血中濃度が高い
高血圧の人におけるCOZAAR 50mgの最も一般的な副作用は次のとおりです。
- 「風邪」(上気道感染症)
- めまい
- 鼻づまり
- 背中の痛み
糖尿病性腎疾患を伴う2型糖尿病患者におけるCOZAAR 50mgの最も一般的な副作用は次のとおりです。
- 下痢
- 疲れ
- 低血糖
- 胸痛
- 高血中カリウム
- 低血圧
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これは いいえ 副作用の完全なリスト。完全なリストについては、医師または薬剤師にお尋ねください。
COZAAR 100mgの保管方法を教えてください。
- COZAAR タブレットは 59°F ~ 86°F (15°C ~ 30°C) で保管してください。
- COZAAR は、薬を光から保護する密閉容器に保管してください。
- COZAAR とすべての医薬品は子供の手の届かないところに保管してください。
COZAARに関する一般情報
医薬品は、患者情報リーフレットに記載されていない状態に対して処方されることがあります。コザールが処方されていない状態には使用しないでください。他の人があなたと同じ症状であっても、コザールを与えないでください。それらに害を及ぼす可能性があります。
このリーフレットには、COZAAR に関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた COZAAR に関する情報については、薬剤師または医師にお尋ねください。
コザール25mgの成分は?
有効成分: ロサルタンカリウム
不活性成分:
微結晶セルロース、含水ラクトース、α化デンプン、ステアリン酸マグネシウム、ヒドロキシプロピルセルロース、ヒプロメロース、二酸化チタン。 COZAAR 25 mg、COZAAR 50 mg、および COZAAR 100 mg には、カルナバワックスも含まれる場合があります。
