Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Coreg 25mg とは何ですか? どのように使用されますか?
Coreg は、心不全および高血圧 (高血圧) の症状を治療するために使用される処方薬です。 Coreg 25mg は、単独で使用することも、他の薬と併用することもできます。
Coreg は、ベータ ブロッカー、アルファ アクティビティと呼ばれる薬物のクラスに属します。
Coreg 25mg が子供に安全で効果的かどうかは不明です。
Coreg の考えられる副作用は何ですか?
Coreg は、次のような重大な副作用を引き起こす可能性があります。
- 立ちくらみ、
- 遅いまたは不均一な心拍、
- 手足の冷えやしびれ、
- 胸痛、
- 乾いた咳
- 喘鳴、
- 胸の圧迫感、
- 腫れ、
- 急激な体重増加、
- 息切れを感じ、
- 喉の渇きが増し、
- 排尿の増加、
- ドライマウスと
- フルーティーな口臭
上記の症状がある場合は、すぐに医療機関を受診してください。
Coreg 6.25mg の最も一般的な副作用は次のとおりです。
- めまい、
- 遅い心拍、
- 下痢、
- 体重の増加、
- ドライアイと
- コンタクトレンズの使用が困難
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Coreg の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
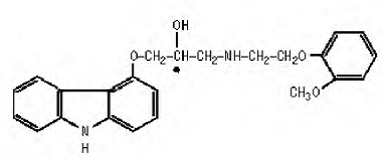
カルベジロールは、α1遮断活性を持つ非選択的なβアドレナリン遮断薬です。 (±)-1(カルバゾール-4-イルオキシ)-3-[[2-(o-メトキシフェノキシ)エチル]アミノ]-2-プロパノールです。カルベジロールは、次の構造を持つラセミ混合物です。
COREG 6.25mg は、3.125mg、6.25mg、12.5mg、または 25mg のカルベジロールを含む白色の楕円形のフィルムコーティング錠です。 6.25 mg、12.5 mg、および 25 mg の錠剤は TILTAB 錠剤です。不活性成分は、コロイド状二酸化ケイ素、クロスポビドン、ヒプロメロース、ラクトース、ステアリン酸マグネシウム、ポリエチレングリコール、ポリソルベート 80、ポビドン、スクロース、および二酸化チタンで構成されています。
カルベジロールは白色からオフホワイトの粉末で、分子量は 406.5、分子式は C24H26N2O4 です。ジメチルスルホキシドに溶けやすい。塩化メチレンおよびメタノールに可溶。 95% エタノールおよびイソプロパノールにやや溶けにくい。エチルエーテルにわずかに溶ける;水、胃液(シミュレート、TS、pH 1.1)、および腸液(シミュレート、パンクレアチンを含まない TS、pH 7.5)にほとんど溶けません。
適応症
心不全
COREG は、虚血性または心筋症に起因する軽度から重度の慢性心不全の治療に適用され、通常は利尿薬、ACE 阻害薬、およびジギタリスに加えて、生存率を高め、入院のリスクを軽減します [参照 薬物相互作用 、 臨床研究 ]。
心筋梗塞後の左心室機能不全
COREG は、心筋梗塞の急性期を生き延び、左心室駆出率が 40% 以下である (症候性心不全の有無にかかわらず) 臨床的に安定した患者の心血管死亡率を低下させることが示されている [参照 臨床研究 ]。
高血圧症
COREG 25mg は、本態性高血圧の管理に適応されます [参照 臨床研究 ]。単独で使用することも、他の降圧薬、特にサイアザイド系利尿薬と組み合わせて使用することもできます。 薬物相互作用 ]。
投薬と管理
吸収速度を遅くし、起立性効果の発生を減らすために、COREG は食事と一緒に摂取する必要があります。
心不全
投与量は個別化され、漸増中は医師が注意深く監視する必要があります。 COREG 12.5mg を開始する前に、体液貯留を最小限に抑えることをお勧めします。 COREG の推奨開始用量は、3.125 mg を 1 日 2 回、2 週間服用することです。忍容性がある場合、患者は、少なくとも 2 週間の連続した間隔で 1 日 2 回、6.25、12.5、および 25 mg に用量を増やすことができます。高用量が許容されない場合、患者は低用量で維持する必要があります。体重が 85 kg (187 lbs) を超える軽度から中等度の心不全の患者には、最大用量 50 mg が 1 日 2 回投与されています。
患者は、治療の開始と(程度は低いが)用量の増加が、投薬後最初の 1 時間以内にめまいまたは立ちくらみ(まれに失神)の一時的な症状に関連する可能性があることを知らされるべきである.これらの期間中、患者は運転や危険な作業など、症状が怪我につながる可能性のある状況を避ける必要があります。血管拡張症状はしばしば治療を必要としませんが、COREG 6.25mg の投与時期を ACE 阻害剤の投与時期から離すか、ACE 阻害剤の投与量を一時的に減らすことが有用な場合があります。心不全の悪化または血管拡張の症状が安定するまで、COREG 12.5mgの用量を増やさないでください。
体液貯留(一時的な心不全症状の悪化の有無にかかわらず)は、利尿薬の投与量を増やすことで治療する必要があります。
患者が徐脈(心拍数が毎分 55 回未満)を経験した場合は、COREG の投与量を減らす必要があります。
COREG 3.12mg の開始中のめまいまたは体液貯留のエピソードは、通常、治療を中止せずに管理でき、その後のカルベジロールの滴定の成功または良好な反応を妨げるものではありません。
心筋梗塞後の左心室機能不全
投与量は、アップタイトレーション中に個別化および監視する必要があります。 COREGによる治療は、入院患者または外来患者として開始でき、患者の血行動態が安定し、体液貯留が最小限に抑えられた後に開始する必要があります。 COREG 3.12mg を 1 日 2 回 6.25mg から開始し、忍容性に基づいて 3 ~ 10 日後に 12.5mg を 1 日 2 回に増やし、その後目標用量の 25mg を 1 日 2 回に増やすことをお勧めします。より低い開始用量(3.125 mg 1 日 2 回)を使用するか、臨床的に必要な場合(例えば、低血圧または心拍数、または体液貯留のため)、漸増速度を遅くすることができます。高用量が許容されない場合、患者は低用量で維持する必要があります。心筋梗塞の急性期に静注または経口β遮断薬による治療を受けた患者では、推奨される投薬レジメンを変更する必要はありません。
高血圧症
投与量は個別化する必要があります。 COREG 6.25mg の推奨開始用量は、1 日 2 回 6.25mg です。この用量に耐えられる場合は、投与後約 1 時間に測定した収縮期血圧を目安として、7 ~ 14 日間投与量を維持し、必要に応じてトラフ血圧に基づいて 1 日 2 回 12.5 mg に増量します。耐性の目安として、服用後 1 時間の収縮期血圧を測定します。この用量も7~14日間維持する必要があり、忍容性があり必要な場合は、その後1日2回25mgまで調整できます. COREG 6.25mg の完全な降圧効果は、7 ~ 14 日以内に見られます。 1日の総投与量は50mgを超えてはなりません。
利尿薬との併用投与は、相加効果を生み出し、カルベジロール作用の起立性成分を誇張することが期待できます。
肝障害
COREG 25 mg は、重度の肝障害のある患者には投与しないでください [ 禁忌 ]。
供給方法
投与量と強度
白色の楕円形のフィルムコーティング錠は、次の強度で利用できます。
- 3.125 mg – 「39」と「SB」の刻印
- 6.25 mg – 「4140」と「SB」の刻印
- 12.5 mg – 「4141」と「SB」の刻印
- 25 mg – 「4142」と「SB」の刻印
保管と取り扱い
白色の楕円形のフィルムコーティング錠は、次の強度で利用できます。
- 3.125 mg – 「39」と「SB」の刻印
- 6.25 mg – 「4140」と「SB」の刻印
- 12.5 mg – 「4141」と「SB」の刻印
- 25 mg – 「4142」と「SB」の刻印
6.25 mg、12.5 mg、および 25 mg の錠剤は TILTAB 錠剤です。
- 100 の 3.125 mg ボトル: NDC 0007-4139-20
- 100 の 6.25 mg ボトル: NDC 0007-4140-20
- 100 の 12.5 mg ボトル: NDC 0007-4141-20
- 100 の 25 mg ボトル: NDC 0007-4142-20
30°C (86°F) 以下で保管してください。湿気から保護してください。遮光性の密閉容器に分注してください。
製造元: GlaxoSmithKline Research Triangle Park, NC 27709. 改訂: 2017 年 9 月.
副作用
臨床研究経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
COREG 25mg は、心不全 (軽度、中等度、および重度) の被験者、心筋梗塞後の左心室機能不全の被験者、および高血圧の被験者における安全性が評価されています。観察された有害事象プロファイルは、薬物の薬理学および臨床試験における被験者の健康状態と一致していました。これらの患者集団のそれぞれについて報告された有害事象を以下に示します。一般的すぎて情報を提供できないと考えられる有害事象、および治療中の状態に関連しているか、治療集団で非常に一般的であるため、薬物の使用と合理的に関連していない有害事象は除外されます。有害事象の発生率は、一般的に人口統計学的サブセット (男性と女性、高齢者と非高齢者、黒人と非黒人) で同様でした。
心不全
COREG 12.5mg は、世界中の 4,500 人以上の被験者で心不全の安全性が評価されており、そのうち 2,100 人以上がプラセボ対照臨床試験に参加しています。プラセボ対照臨床試験では、全治療人口の約 60% が少なくとも 6 か月間 COREG 3.12mg を受け取り、30% が少なくとも 12 か月間 COREG を受け取りました。 COMET 試験では、軽度から中等度の心不全患者 1,511 人が COREG で最大 5.9 年間 (平均 4.8 年) 治療を受けました。 COREG 3.12mg の 1 日最大 100 mg (n = 765) とプラセボ (n = 437) を比較した軽度から中等度の心不全を対象とした米国の臨床試験と、重度の心不全を対象とした多国籍臨床試験 (COPERNICUS )は、最大50mgのCOREG(n = 1,156)をプラセボ(n = 1,133)と比較した.プラセボ対照臨床試験では、カルベジロールでより頻繁に発生する 1% を超える中止の唯一の原因はめまいでした (COPERNICUS 試験では、カルベジロールで 1.3%、プラセボで 0.6%)。
表 1 は、米国のプラセボ対照臨床試験に登録された軽度から中等度の心不全の被験者、および COPERNICUS 試験に登録された重度の心不全の被験者で報告された有害事象を示しています。示されているのは、因果関係に関係なく、カルベジロールで治療された被験者で3%を超える発生率で、プラセボで治療された被験者よりも薬物で治療された被験者でより頻繁に発生した有害事象です。軽度から中等度の心不全の試験では、カルベジロールとプラセボの被験者の両方で、試験薬物曝露の中央値は6.3ヶ月であり、重度の心不全の被験者の試験では10.4ヶ月でした.長期 COMET 試験で観察された COREG 3.12mg の有害事象プロファイルは、米国の心不全試験で観察されたものとほぼ同様でした。
これらの試験では心不全と呼吸困難も報告されましたが、プラセボを投与された被験者の発生率は同等かそれ以上でした。
以下の有害事象は、軽度から中等度の心不全の被験者または被験者の米国プラセボ対照試験のいずれかで、1%を超えるが3%以下の頻度で報告され、COREG 3.12mgでより頻繁に報告されました。 COPERNICUS試験で重度の心不全を発症。
発生率が 1% を超えて 3% 以下
全身: アレルギー、倦怠感、循環血液量減少、発熱、脚の浮腫。
心臓血管: 体液過剰、体位性低血圧、悪化した狭心症、房室ブロック、動悸、高血圧。
中枢および末梢神経系: 感覚鈍麻、めまい、感覚異常。
胃腸: 下血、歯周炎。
肝臓と胆道系: SGPTが増加し、SGOTが増加しました。
代謝と栄養: 高尿酸血症、低血糖、低ナトリウム血症、アルカリホスファターゼの増加、糖尿、血液量増加、真性糖尿病、GGTの増加、体重減少、高カリウム血症、クレアチニンの増加。
筋骨格: 筋肉のけいれん。
血小板、出血、および凝固: プロトロンビン減少、紫斑、血小板減少。
精神的: 傾眠。
生殖、男性: インポテンス。
特別な感覚: ぼやけた視界。
泌尿器系: 腎不全、蛋白尿、血尿。
心筋梗塞後の左心室機能不全
COREG は、COREG 6.25mg を投与された 969 人の被験者とプラセボを投与された 980 人の被験者を対象とした CAPRICORN 試験において、左心室機能不全を伴う急性心筋梗塞の生存者における安全性が評価されています。被験者の約 75% が少なくとも 6 か月間 COREG 25mg を受け取り、53% が少なくとも 12 か月間 COREG 12.5mg を受け取りました。被験者は、COREG 12.5mg とプラセボで、それぞれ平均 12.9 か月と 12.8 か月治療を受けました。
CAPRICORN 試験で COREG 25mg で報告された最も一般的な有害事象は、米国の心不全試験および COPERNICUS 試験における薬物のプロファイルと一致していました。 CAPRICORN で報告された唯一の追加の有害事象は、被験者の 3% を超え、より一般的にカルベジロールで報告されたのは、呼吸困難、貧血、および肺水腫でした。インフルエンザ症候群、脳血管発作、末梢血管障害、筋緊張低下、うつ病、胃腸痛、関節炎、痛風などの有害事象が、1%超3%以下の頻度で報告され、COREGではより頻繁に報告されました。有害事象による中止の全体的な割合は、両方の被験者グループで同様でした。このデータベースでは、1% を超え、カルベジロールでより頻繁に発生する中止の唯一の原因は低血圧でした (カルベジロールで 1.5%、プラセボで 0.2%)。
高血圧症
COREG は、米国の臨床試験では 2,193 人以上の被験者、国際的な臨床試験では 2,976 人の被験者で、高血圧症の安全性が評価されています。全治療人口の約 36% が少なくとも 6 か月間 COREG を受けました。 COREG 25mg による治療中に報告されたほとんどの有害事象は、軽度から中程度の重症度でした。 COREG 12.5mg を最大 50 mg (n = 1,142) の用量でプラセボ (n = 462) と直接比較した米国の対照臨床試験では、COREG 6.25mg を投与された被験者の 4.9% が有害事象のために中止されたのに対し、プラセボ被験者の 5.2% が中止されました。中止率に全体的な差はありませんでしたが、カルベジロール群では体位性低血圧の中止がより一般的でした (1% 対 0)。米国のプラセボ対照試験における有害事象の全体的な発生率は、COREGの用量が増加するにつれて増加しました。個々の有害事象については、これはめまいについてのみ区別でき、1 日総投与量が 6.25 mg から 50 mg に増加するにつれて、めまいの頻度が 2% から 5% に増加しました。
表2は、因果関係に関係なく1%以上の発生率で発生し、プラセボ治療被験者よりも薬物治療被験者でより頻繁に発生した高血圧の米国プラセボ対照臨床試験における有害事象を示しています。
これらの試験では呼吸困難と疲労も報告されましたが、プラセボを投与された被験者ではその割合が同等かそれ以上でした。
上記に記載されていない以下の有害事象は、高血圧または心不全の被験者を対象とした COREG 12.5mg の世界的なオープン試験または対照試験で、COREG 25mg に関連する可能性がある、またはおそらく関連すると報告されています。
発生率 0.1% 以上 1% 以下
心臓血管: 末梢虚血、頻脈。
中枢および末梢神経系 m: 運動機能低下。
胃腸: ビリルビン血症、肝酵素の増加(高血圧患者の 0.2% および心不全患者の 0.4% は、肝酵素の増加のために治療を中止した)[参照 市販後の経験 ]。
精神的: 神経質、睡眠障害、うつ病の悪化、集中力の低下、異常な思考、パロニリア、情緒不安定。
呼吸器系: 喘息[参照 禁忌 ]。
生殖、男性: 性欲減退。
皮膚と付属物: そう痒症、紅斑性発疹、斑点状発疹、乾癬様発疹、光線過敏反応。
特別な感覚: 耳鳴り。
泌尿器系: 排尿頻度が増加した。
自律神経系: 口渇、発汗増加。
代謝と栄養: 低カリウム血症、高トリグリセリド血症。
血液学: 貧血、白血球減少。
次のイベントは被験者の 0.1% 以下で報告されており、潜在的に重要です: 完全房室ブロック、脚ブロック、心筋虚血、脳血管障害、痙攣、片頭痛、神経痛、麻痺、アナフィラキシー様反応、脱毛症、剥脱性皮膚炎、記憶喪失、消化管出血、気管支痙攣、肺水腫、聴力低下、呼吸性アルカローシス、BUN の増加、HDL の減少、汎血球減少症、および異型リンパ球。
実験室の異常
COREGによる治療中に、血清トランスアミナーゼ(ALTまたはAST)の可逆的な上昇が観察されています。対照臨床試験中に観察されたトランスアミナーゼ上昇率(通常の上限の2〜3倍)は、COREGで治療された被験者とプラセボで治療された被験者の間で一般的に類似していました.ただし、再攻撃によって確認されたトランスアミナーゼの上昇は、COREGで観察されています。重度の心不全における長期のプラセボ対照試験では、COREG 25mgで治療された被験者は、プラセボで治療された被験者よりも肝臓トランスアミナーゼの値が低かった.または肝血流の改善。
COREG 25mg は、血清カリウム、総トリグリセリド、総コレステロール、HDL コレステロール、尿酸、血中尿素窒素、またはクレアチニンの臨床的に有意な変化とは関連していません。高血圧患者の空腹時血清グルコースに臨床的に関連する変化は認められませんでした。空腹時血清グルコースは、心不全の臨床試験では評価されませんでした。
市販後の経験
COREGの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液とリンパ系の病気
再生不良性貧血。
免疫系疾患
過敏症(例、アナフィラキシー反応、血管性浮腫、蕁麻疹)。
腎および尿路疾患
尿失禁。
呼吸器、胸部、および縦隔の疾患
間質性肺炎。
皮膚および皮下組織の疾患
スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、多形紅斑。
薬物相互作用
CYP2D6阻害剤と代謝不良者
カルベジロールと CYP2D6 イソ酵素の強力な阻害剤 (キニジン、フルオキセチン、パロキセチン、プロパフェノンなど) との相互作用は研究されていませんが、これらの薬剤はカルベジロールの R(+) エナンチオマーの血中濃度を上昇させると予想されます [ 臨床薬理学 ]。臨床試験における副作用のレトロスペクティブ分析では、2D6代謝が不十分な人は、おそらく高濃度のα-ブロッキングR(+)エナンチオマーの血管拡張効果に起因して、アップタイトレーション中にめまいの割合が高いことが示されました.
降圧剤
β遮断薬とカテコールアミンを枯渇させる可能性のある薬(レセルピンやモノアミンオキシダーゼ阻害薬など)を服用している患者は、低血圧や重度の徐脈の徴候がないか注意深く観察する必要があります。
β遮断薬とクロニジンの併用投与は、低血圧および徐脈を引き起こす可能性があります。 β遮断薬とクロニジンによる併用治療を中止する場合は、まずβ遮断薬を中止する必要があります。クロニジン療法は、数日後に投与量を徐々に減らして中止することができます。
シクロスポリン
慢性血管拒絶反応を患っている 21 人の腎移植患者において、カルベジロール治療の開始後、平均トラフ シクロスポリン濃度のわずかな増加が観察されました。被験者の約 30% では、シクロスポリン濃度を治療範囲内に維持するためにシクロスポリンの用量を減らす必要がありましたが、残りの被験者では調整は必要ありませんでした。グループの平均で、シクロスポリンの投与量は、これらの被験者で約 20% 減少しました。必要な用量調整は個人差が大きいため、カルベジロール療法の開始後はシクロスポリン濃度を注意深く監視し、シクロスポリンの用量を適切に調整することをお勧めします。
ジギタリス配糖体
ジギタリス配糖体とβ遮断薬の両方が房室伝導を遅くし、心拍数を低下させます。併用は徐脈のリスクを高める可能性があります。ジゴキシンとカルベジロールを併用すると、ジゴキシン濃度は約15%上昇します。したがって、COREG を開始、調整、または中止する場合は、ジゴキシンのモニタリングを強化することが推奨されます [参照 臨床薬理学 ]。
肝代謝の誘導剤/阻害剤
リファンピンは、カルベジロールの血漿濃度を約 70% 低下させた [参照 臨床薬理学 ]。シメチジンは AUC を約 30% 増加させたが、Cmax には変化をもたらさなかった [参照 臨床薬理学 ]。
アミオダロン
アミオダロンとその代謝産物であるデスエチルアミオダロン、CYP2C9 の阻害剤、および P-糖タンパク質は、カルベジロールの S(-)-エナンチオマーの濃度を少なくとも 2 倍増加させた [ 臨床薬理学 ]。アミオダロンまたはフルコナゾールなどの他の CYP2C9 阻害剤を COREG と併用投与すると、β 遮断活性が増強され、心拍数または心臓伝導がさらに遅くなる可能性があります。徐脈または心ブロックの兆候がないか患者を観察する必要があります。特に、既存の治療に他の薬剤を追加した場合は注意が必要です。
カルシウムチャネル遮断薬
COREG 25mgをジルチアゼムと同時投与すると、伝導障害(血行動態の妥協を伴うことはめったにありません)が観察されています。他のβ遮断薬と同様に、COREG 25mgをベラパミルまたはジルチアゼム型のカルシウムチャネル遮断薬と一緒に投与する場合は、心電図と血圧を監視することをお勧めします.
インスリンまたは経口血糖降下薬
β遮断薬は、インスリンおよび経口血糖降下薬の血糖低下効果を高める可能性があります。したがって、インスリンまたは経口血糖降下薬を服用している患者では、血糖値の定期的なモニタリングが推奨されます[ 警告と注意事項 ]。
麻酔
COREGによる治療を周術期に継続する場合、エーテル、シクロプロパン、トリクロロエチレンなどの心筋機能を低下させる麻酔薬を使用する場合は特に注意する必要があります。 過剰摂取 ]。
警告
の一部として含まれています "予防" セクション
予防
治療の中止
COREGで治療されている冠動脈疾患の患者は、治療を突然中止しないようにアドバイスする必要があります。 β遮断薬による治療を突然中止した狭心症患者では、狭心症の重篤な増悪と心筋梗塞および心室性不整脈の発生が報告されています。最後の 2 つの合併症は、狭心症の増悪の有無にかかわらず発生する可能性があります。他のβ遮断薬と同様に、COREGの中止が計画されている場合は、患者を注意深く観察し、身体活動を最小限に制限するようにアドバイスする必要があります. COREG は、可能な限り 1 ~ 2 週間で中止する必要があります。狭心症が悪化したり、急性冠動脈不全が発生した場合は、COREG を少なくとも一時的に速やかに再開することをお勧めします。冠動脈疾患は一般的であり、認識されていない可能性があるため、高血圧または心不全のみの治療を受けている患者であっても、COREG 3.12mg による治療を突然中止しないことが賢明です。
徐脈
臨床試験では、COREG 25mg は、高血圧患者の約 2%、心不全患者の 9%、心筋梗塞および左心室機能障害患者の 6.5% で徐脈を引き起こしました。脈拍数が毎分 55 回を下回る場合は、投与量を減らす必要があります。
低血圧
主に軽度から中等度の心不全の臨床試験では、低血圧と体位性低血圧が 9.7% で発生し、COREG を投与された被験者の 3.4% で失神が発生しましたが、プラセボ被験者ではそれぞれ 3.6% と 2.5% でした。これらの事象のリスクは、漸増期間に対応する投与の最初の 30 日間で最も高く、プラセボ被験者の 0.4% と比較して、COREG 12.5mg を投与された被験者の 0.7% で治療中止の原因となりました。重度の心不全における長期のプラセボ対照試験(COPERNICUS)では、COREGを受けた心不全被験者の15.1%で低血圧および起立性低血圧が発生し、プラセボ被験者のそれぞれ8.7%および2.3%と比較して失神が2.9%発生しました。これらの事象は、プラセボ被験者の 0.8% と比較して、COREG を受けた被験者の 1.1% で治療中止の原因でした。
起立性低血圧は高血圧患者の 1.8% で発生し、失神は 0.1% で発生し、主に初回投与後または投与量の増加時に発生し、1% の患者で治療中止の原因となりました。
急性心筋梗塞の生存者を対象とした CAPRICORN 試験では、プラセボ被験者の 12.6% と比較して、COREG を受けた被験者の 20.2% で低血圧または体位性低血圧が発生しました。失神は、被験者のそれぞれ 3.9% と 1.9% で報告されました。これらの事象は、プラセボ被験者の 0.2% と比較して、COREG を受けた被験者の 2.5% で治療中止の原因でした。
低用量から開始し、食事と一緒に投与し、徐々に増量すると、失神または過度の低血圧の可能性が減少するはずです[参照 投薬と管理 ]。治療の開始中、患者は、運転や危険な作業など、失神が発生した場合に怪我をする可能性がある状況を避けるように注意する必要があります。
心不全/体液貯留
カルベジロールの増量中に、心不全または体液貯留が悪化する可能性があります。このような症状が発生した場合は、利尿薬を増量し、カルベジロールの投与量を臨床的安定が回復するまで増やさないようにする必要があります。 投薬と管理 ]。場合によっては、カルベジロールの用量を下げるか、一時的に中止する必要があります。このようなエピソードは、その後のカルベジロールの滴定の成功、またはカルベジロールへの良好な反応を妨げるものではありません。重度の心不全患者を対象としたプラセボ対照試験では、最初の 3 か月間にカルベジロールとプラセボで同程度の心不全の悪化が報告されました。治療が 3 か月を超えて維持された場合、プラセボよりもカルベジロールで治療された被験者で、心不全の悪化が報告される頻度が低くなりました。長期治療中に観察される心不全の悪化は、カルベジロールによる治療よりも、患者の基礎疾患に関連している可能性が高い.
非アレルギー性気管支痙攣
一般に、気管支痙攣性疾患(例、慢性気管支炎、肺気腫)の患者はβ遮断薬を受けるべきではありません。ただし、COREG は、他の降圧薬に反応しない、または許容できない患者には注意して使用することができます。 COREG を使用する場合は、内因性または外因性のβ-アゴニストの阻害を最小限に抑えるために、最小の有効用量を使用することが賢明です。
心不全の被験者の臨床試験では、気管支痙攣性疾患を治療するために経口または吸入薬を必要としない場合、気管支痙攣性疾患の被験者が登録されました。そのような患者では、カルベジロールを慎重に使用することをお勧めします。用量の推奨事項に厳密に従う必要があり、アップタイトレーション中に気管支痙攣の証拠が観察された場合は用量を下げる必要があります。
2型糖尿病における血糖コントロール
一般に、β遮断薬は、低血糖、特に頻脈の症状の一部を覆い隠す可能性があります。非選択的β遮断薬は、インスリン誘発性の低血糖を増強し、血清グルコースレベルの回復を遅らせる可能性があります。自然発生的な低血糖症の患者、またはインスリンまたは経口血糖降下薬を投与されている糖尿病患者は、これらの可能性について注意する必要があります。
心不全と糖尿病の患者では、カルベジロール療法が高血糖の悪化につながる可能性があり、これは血糖降下療法の強化に反応します。カルベジロールの投与を開始、調整、または中止するときは、血糖を監視することをお勧めします。糖尿病および心不全患者の血糖コントロールに対するカルベジロールの効果を調べるように設計された試験は実施されていません。
軽度から中等度の高血圧症と十分にコントロールされた 2 型糖尿病患者の血糖コントロールに対するカルベジロールの効果を調べるために設計された試験では、HbA1c 測定値に基づいて、カルベジロールは血糖コントロールに悪影響を及ぼさなかった [参照 臨床研究 ]。
末梢血管疾患
β遮断薬は、末梢血管疾患患者の動脈不全の症状を誘発または悪化させる可能性があります。そのような人には注意が必要です。
腎機能の低下
まれに、心不全患者にカルベジロールを使用すると、腎機能が低下することがあります。危険にさらされている患者は、低血圧 (収縮期血圧が 100 mmHg 未満)、虚血性心疾患およびびまん性血管疾患、および/または根底にある腎不全を有する患者と思われます。カルベジロールを中止すると、腎機能はベースラインに戻りました。これらの危険因子を有する患者では、カルベジロールの漸増中は腎機能を監視し、腎機能の悪化が生じた場合は薬剤を中止するか、投与量を減らすことが推奨されます。
主要な手術
慢性的に投与されているβ遮断療法は、大手術の前に定期的に中止すべきではありません。ただし、反射アドレナリン刺激に反応する心臓の能力が低下すると、全身麻酔や外科的処置のリスクが高まる可能性があります。
甲状腺中毒症
β-アドレナリン遮断薬は、頻脈などの甲状腺機能亢進症の臨床的徴候を隠す可能性があります。 β遮断薬の突然の中止は、甲状腺機能亢進症の症状の悪化が続くか、または甲状腺ストームを引き起こす可能性があります.
褐色細胞腫
褐色細胞腫の患者では、β遮断薬を使用する前にα遮断薬を開始する必要があります。カルベジロールはα遮断薬理活性とβ遮断薬理活性の両方を持っていますが、この状態での使用経験はありません。したがって、褐色細胞腫が疑われる患者へのカルベジロールの投与には注意が必要です。
Prinzmetal のバリアント狭心症
非選択的 β 遮断活性を持つ薬剤は、プリンツメタルのバリアント狭心症の患者に胸痛を引き起こす可能性があります。これらの患者にカルベジロールを使用した臨床経験はありませんが、α遮断活性はそのような症状を予防する可能性があります.ただし、プリンツメタル変異型狭心症が疑われる患者へのカルベジロールの投与には注意が必要です。
アナフィラキシー反応のリスク
β遮断薬を服用している間、さまざまなアレルゲンに対する重度のアナフィラキシー反応の病歴を持つ患者は、偶発的、診断的、または治療的な攻撃の繰り返しに対してより反応する可能性があります.このような患者は、アレルギー反応の治療に使用される通常の用量のエピネフリンに反応しない場合があります。
術中フロッピー虹彩症候群
術中フロッピー虹彩症候群 (IFIS) は、白内障手術中にアルファ 1 遮断薬 (COREG はアルファ/ベータ遮断薬) で治療された一部の患者で観察されています。この小瞳孔症候群の変種は、術中の灌流に反応してうねる弛緩した虹彩、標準的な散瞳薬による術前の拡張にもかかわらず進行性の術中の縮瞳、水晶体超音波乳化吸引術の切開部に向かって虹彩が脱出する可能性の組み合わせによって特徴付けられます。患者の眼科医は、アイリス フック、アイリス ダイレーター リング、または粘弾性物質の利用など、手術手技の可能な変更について準備する必要があります。白内障手術の前にα-1ブロッカー療法を中止しても、利益はないようです。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
COREGを服用している患者には、次のことを知らせる必要があります。
- 患者は食事と一緒に COREG を服用する必要があります。
- 患者は、医師の助言なしに COREG 25mg の使用を中断または中止してはなりません。
- 心不全の患者は、体重増加や息切れの増加など、心不全の悪化の徴候や症状を経験した場合は、医師に相談する必要があります.
- 立っていると血圧が低下し、めまいや、まれに失神することがあります。血圧低下のこれらの症状が発生した場合、患者は座るか横になる必要があります。
- めまいや疲労感がある場合は、運転や危険な作業を避ける必要があります。
- めまい、失神などの症状があらわれた場合は、用量を調節する必要があるため、医師に相談してください。
- 糖尿病患者は、血糖値の変化を医師に報告する必要があります。
- コンタクトレンズ装用者は、流涙の減少を経験するかもしれません.
COREG 25mg、COREG 3.12mg CR、および TILTAB は、GSK グループ企業が所有またはライセンス供与している商標です。
記載されている他のブランドは、その所有者が所有またはライセンス供与している商標であり、GSK グループ企業が所有またはライセンス供与しているものではありません。このブランドのメーカーは、GSK グループの企業またはその製品と提携しておらず、推奨もしていません。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
カルベジロールを 1 日 1 kg あたり最大 75 mg (m2 あたりの mg として MRHD の 12 倍) の用量で投与されたラット、または 1 日あたり 1 kg あたり最大 200 mg (MRHD の 16 倍) を投与されたラットで実施された 2 年間の研究では、 m2)、カルベジロールには発がん作用はありませんでした。
カルベジロールは、一連の遺伝毒性アッセイで試験した場合、陰性でした。これには、変異原性に関する Ames および CHO/HGPRT アッセイ、染色体異常誘発性に関する in vitro ハムスター小核および in vivo ヒトリンパ球細胞試験が含まれます。
受胎能/発生/出生後の複合毒性試験で、ラットにカルベジロール (1 日 1 kg あたり 12、60、300 mg) を、交配前の 2 週間、および交配、妊娠、および雌の場合は 62雄の交配前および交配中の数日間。 1 日 1 kg あたり 300 mg (1 m2 あたりの mg として MRHD の 50 倍以上) の投与量で、カルベジロールは成体ラットに対して毒性があり (鎮静作用、体重増加の減少)、成功した交配数の減少、長期化と関連していました。交配時間、ダムあたりの黄体とインプラントの減少、同腹あたりの生きている子の数の減少、および身体的成長/発達の遅延。明白な毒性および受胎能の障害に対する無影響レベルは、1 日あたり 1 kg あたり 60 mg (1 m2 あたりの mg として MRHD の 10 倍) でした。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性におけるCOREG 12.5mgの使用に関する入手可能なデータは、有害な発達転帰の薬物関連リスクがあるかどうかを判断するには不十分です.妊娠中の高血圧の管理が不十分な場合、母親と胎児にリスクが伴います。妊娠後期にベータ遮断薬を使用すると、新生児の低血圧、徐脈、低血糖、呼吸抑制のリスクが高まる可能性がある [ 臨床上の考慮事項を参照してください ]。動物の繁殖研究では、臨床的に適切な用量で有害な発生結果の証拠はありませんでした[ データを見る ]。器官形成中の妊娠ラットへのカルベジロールの経口投与は、最大推奨ヒト用量(MRHD)の50倍の母体毒性用量で、着床後の損失、胎児体重の減少、および胎児の骨格発達遅延の頻度の増加をもたらしました。さらに、器官形成期の妊娠中のウサギにカルベジロールを経口投与すると、MRHDの25倍の用量で着床後の損失が増加した[ データを見る ]。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の高血圧は、子癇前症、妊娠糖尿病、早産、分娩合併症(帝王切開や分娩後出血の必要性など)のリスクを高めます。高血圧は、胎児の子宮内発育制限および子宮内死亡のリスクを高めます。高血圧症の妊婦は注意深く監視し、それに応じて管理する必要があります。
胎児/新生児の有害反応
妊娠後期にベータ遮断薬で治療された高血圧症の女性の新生児は、低血圧、徐脈、低血糖、および呼吸抑制のリスクが高くなる可能性があります。新生児の低血圧、徐脈、低血糖、呼吸抑制の症状を観察し、それに応じて管理します。
データ
動物データ
胎児の器官形成中にカルベジロールを投与されたラットとウサギで実施された研究では、1 日 1 kg あたり 300 mg の母体毒性用量 (m2 あたりの mg として MRHD の 50 倍) のラットとウサギ (母体の非存在下) で、着床後の損失が増加したことが明らかになりました。毒性) 1 日あたり 1 kg あたり 75 mg (m2 あたりの mg として MRHD の 25 倍) の用量で。ラットでは、1 日 1 kg あたり 300 mg (m2 あたりの mg として MRHD の 50 倍) で胎児の体重も減少し、骨格の発達が遅れた胎児の発生率が増加しました。ラットでは、胚・胎児毒性の無影響レベルは 1 日 1 kg あたり 60 mg (1 m2 あたりの mg として MRHD の 10 倍) でした。ウサギでは、1 日あたり 15 mg/kg (mg/m2 として MRHD の 5 倍) でした。妊娠後期から授乳期までカルベジロールを投与されたラットの出生前および出生後の発生研究では、1 日あたり 1 kg あたり 200 mg の母体毒性用量で胚致死率の増加が観察されました (1 m2あたりの mg として MRHD の約 32 倍)。母体毒性がない場合、60 mg/kg/日 (MRHD の 10 倍の mg/m2) で仔の死亡率と身体的成長/発達の遅延が観察された。無影響レベルは 12 mg/kg/日 (mg/m2 として MRHD の 2 倍) でした。カルベジロールはラット胎児組織に存在していました。
授乳
リスクの概要
母乳中のカルベジロールの存在、母乳育児への影響、または乳生産への影響に関するデータはありません。カルベジロールは、授乳中のラットのミルクに含まれています。母乳育児の発達上および健康上の利点は、COREGに対する母親の臨床的必要性、およびCOREG 3.12mgまたは母体の基礎疾患による母乳育児への潜在的な悪影響とともに考慮されるべきです。
小児用
18歳未満の患者におけるCOREG 3.12mgの有効性は確立されていません。
二重盲検試験では、慢性心不全 [NYHA クラス II-IV、左心室駆出率 40% 未満] の小児 161 人 (平均年齢: 6 歳、範囲: 2 か月から 17 歳、45% が 2 歳未満)標準的なバックグラウンド治療を受けていた全身性左心室(LV)の子供、およびエコーによる質的に中等度から重度の心室機能不全の子供向け] 標準的なバックグラウンド治療を受けている子供たちは、プラセボまたは2つの用量レベルのカルベジロールに無作為に割り付けられました。これらの用量レベルでは、1 分あたり 4 ~ 6 心拍のプラセボ補正心拍数の減少が生じ、β 遮断活性が示されました。曝露は、成人よりも小児被験者の方が低いように見えました。 8 か月の追跡調査後、臨床転帰に対する治療の有意な効果はありませんでした。 COREG で治療された被験者の 10% 以上で発生し、プラセボで治療された被験者の 2 倍の割合で発生したこの試験での有害反応には、胸痛 (17% 対 6%)、めまい (13% 対 2%)、および呼吸困難 ( 11% 対 0%)。
高齢者の使用
米国の臨床試験でCOREG 6.25mgにランダム化された心不全患者765人のうち、31%(235人)が65歳以上、7.3%(56人)が75歳以上でした。重度の心不全を対象とした長期のプラセボ対照試験で、COREG 3.12mg に無作為に割り付けられた 1,156 人の被験者のうち、47% (547) が 65 歳以上、15% (174) が 75 歳以上でした。世界中の心不全試験で COREG 6.25mg を投与された 3,025 人の被験者のうち、42% が 65 歳以上でした。
CAPRICORN 試験で COREG に無作為に割り付けられた 975 人の心筋梗塞患者のうち、48% (468) が 65 歳以上、11% (111) が 75 歳以上でした。
COREG 25mgで治療された有効性または安全性の米国臨床試験における2,065人の高血圧患者のうち、21%(436人)が65歳以上でした。世界中で実施された高血圧臨床試験でCOREGを受けた3,722人の被験者のうち、24%が65歳以上でした。
高血圧被験者のめまいを除いて (発生率は高齢者で 8.8% 対若年者で 6%)、安全性または有効性 (図 2 および 4 を参照) の全体的な違いは、高齢者と若年者の間で観察されませんでした。これらの集団。同様に、他の報告された臨床経験では、高齢者と若年者の間の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.
過剰摂取
過剰摂取は、重度の低血圧、徐脈、心不全、心原性ショック、および心停止を引き起こす可能性があります。呼吸器系の問題、気管支痙攣、嘔吐、意識消失、全般発作も起こることがあります。
患者は仰臥位に置かれ、必要に応じて観察下に置かれ、集中治療条件下で治療されるべきです。以下の薬剤が投与されることがあります:
過度の徐脈の場合 :アトロピン、2mg IV。
心血管機能をサポートする グルカゴン 5 ~ 10 mg を 30 秒かけて急速に静脈内投与し、続いて 1 時間あたり 5 mg を持続的に注入します。交感神経刺激薬(ドブタミン、イソプレナリン、アドレナリン)を体重と効果に応じた用量で。
末梢血管拡張が優勢な場合は、循環状態を継続的に監視しながらアドレナリンまたはノルアドレナリンを投与する必要がある場合があります。治療抵抗性の徐脈に対しては、ペースメーカー療法を実施する必要があります。気管支痙攣には、β交感神経刺激薬(エアロゾルまたは静注)またはアミノフィリン静注を投与する必要があります。発作が起きた場合は、ジアゼパムまたはクロナゼパムをゆっくりと IV 注射することをお勧めします。
注: ショックの症状がある重度の中毒の場合、カルベジロールの 7 ~ 10 時間の半減期と一致する十分な期間、解毒剤による治療を継続する必要があります。
COREG 3.12mg を単独で、または他の薬剤と組み合わせて過剰摂取した事例が報告されています。場合によっては、摂取量が 1,000 ミリグラムを超えました。経験した症状には、低血圧と心拍数が含まれていました。標準的な支持療法が提供され、患者は回復しました。
禁忌
COREG 25mg は、次の条件では禁忌です。
- 気管支喘息または関連する気管支痙攣状態。 COREGの単回投与後に、喘息重積症による死亡が報告されています。
- 2度または3度の房室ブロック。
- 洞不全症候群。
- 重度の徐脈 (恒久的なペースメーカーが設置されている場合を除く)。
- -心原性ショックの患者、または静脈内強心療法の使用を必要とする非代償性心不全の患者。このような患者は、COREG を開始する前に、まず静脈内療法から離脱する必要があります。
- 重度の肝障害のある患者。
- -この薬の成分またはカルベジロールを含む他の薬に対する重篤な過敏症反応(例、スティーブンス・ジョンソン症候群、アナフィラキシー反応、血管性浮腫)の既往のある患者。
臨床薬理学
作用機序
COREG 3.12mg は、非選択的 β-アドレナリン受容体遮断活性が S(-) 鏡像異性体に存在し、α1-アドレナリン遮断活性が R(+) および S(-) 鏡像異性体の両方に等しい効力で存在するラセミ混合物です。 COREG 6.25mg には、固有の交感神経刺激活性はありません。
薬力学
心不全
心不全におけるCOREGの有益な効果の根拠は確立されていません。
つのプラセボ対照試験では、利尿薬、ACE 阻害薬、およびジギタリスを投与された NYHA クラス II ~ IV 心不全の被験者 59 人および 49 人を対象に、COREG の急性血行動態効果をベースライン測定値と比較しました。全身血圧、肺動脈圧、肺毛細血管楔入圧、および心拍数が大幅に低下しました。心拍出量、一回拍出量指数、および全身血管抵抗に対する初期の影響は小さく、ばらつきがありました。
これらの試験では、12 ~ 14 週間で血行動態の効果が再度測定されました。 COREG 25mg は、全身血圧、肺動脈圧、右心房圧、全身血管抵抗、および心拍数を大幅に低下させ、1 回拍出量指数を増加させました。
つの米国プラセボ対照試験で 26 ~ 52 週間治療を受けた NYHA クラス II ~ III 心不全の 839 人の被験者のうち、放射性核種心室造影法で測定された平均左心室駆出率 (EF) は、COREG 6.25 を投与された被験者で 9 EF 単位 (%) 増加しました。 1 日 2 回 25 ~ 50 mg の目標用量でプラセボ被験者に mg および 2 EF 単位。駆出率に対するカルベジロールの効果は用量に関連していた。 6.25 mg を 1 日 2 回、12.5 mg を 1 日 2 回、25 mg を 1 日 2 回投与すると、プラセボ補正後の EF がそれぞれ 5 EF 単位、6 EF 単位、8 EF 単位増加しました。これらの効果はそれぞれ名目上統計的に有意でした。
心筋梗塞後の左心室機能不全
急性心筋梗塞後の左心室機能不全患者におけるCOREG 25mgの有益な効果の根拠は確立されていません。
高血圧症
β遮断薬が降圧効果を生み出すメカニズムは確立されていません。
β-アドレナリン受容体遮断活性は、カルベジロールが (1) 正常な被験者の心拍出量を減少させること、(2) 運動および/またはイソプロテレノール誘発性頻脈を減少させること、および (3) 反射性起立性頻脈を減少させることを示す動物およびヒトの研究で実証されています。有意なβ-アドレナリン受容体遮断効果は、通常、薬物投与の 1 時間以内に見られます。
α1-アドレナリン受容体遮断活性は、ヒトおよび動物の研究で実証されており、カルベジロールが (1) フェニレフリンの昇圧効果を弱め、(2) 血管拡張を引き起こし、(3) 末梢血管抵抗を減少させることが示されています。これらの効果は血圧の低下に寄与し、通常は投薬後 30 分以内に見られます。
カルベジロールのα1受容体遮断作用により、仰臥位よりも立位の方が血圧が低下し、まれに失神を含む起立性低血圧(1.8%)の症状が現れることがあります。経口投与後、起立性低血圧が発生した場合、それは一過性であり、COREG が推奨される開始用量で食事とともに投与され、滴定の増分が厳密に守られている場合はまれです。 投薬と管理 ]。
腎機能が正常な高血圧患者では、治療用量の COREG により腎血管抵抗が減少し、糸球体濾過率や腎血漿流量は変化しませんでした。腎機能が正常な高血圧患者におけるナトリウム、カリウム、尿酸、およびリンの排泄の変化は、COREGとプラセボの後で同様でした。
COREG 3.12mg は、血漿カテコールアミン、血漿アルドステロン、または電解質レベルにほとんど影響を与えませんが、少なくとも 4 週間投与すると、血漿レニン活性を大幅に低下させます。また、心房性ナトリウム利尿ペプチドのレベルを上昇させます。
薬物動態
COREG は、経口投与後に急速かつ広範囲に吸収され、初回通過代謝がかなり高いため、絶対バイオアベイラビリティは約 25% ~ 35% です。経口投与後、カルベジロールの見かけの平均最終消失半減期は、一般に 7 ~ 10 時間の範囲です。達成される血漿濃度は、投与される経口用量に比例します。食物と一緒に投与すると、血漿レベルのピークに達するまでの時間の遅延によって証明されるように、吸収速度が遅くなり、バイオアベイラビリティの程度に有意差はありません。 COREGを食事と一緒に服用すると、起立性低血圧のリスクが最小限に抑えられます。
カルベジロールは広範囲に代謝されます。放射性標識カルベジロールを健康なボランティアに経口投与した後、カルベジロールは、曲線下面積 (AUC) で測定した血漿中の総放射能の約 7% しか占めませんでした。投与量の 2% 未満が未変化のまま尿中に排泄されました。カルベジロールは、主に芳香環の酸化とグルクロン酸抱合によって代謝されます。
酸化代謝産物は、グルクロン酸抱合および硫酸化を介した抱合によってさらに代謝されます。カルベジロールの代謝産物は、主に胆汁を介して糞便に排泄されます。フェノール環での脱メチル化とヒドロキシル化により、β 受容体遮断活性を持つ 3 つの活性代謝物が生成されます。前臨床研究に基づくと、4'-ヒドロキシフェニル代謝物は、カルベジロールよりも約 13 倍強力なβ遮断を示します。
カルベジロールと比較して、3 つの活性代謝物は弱い血管拡張活性を示します。活性代謝物の血漿中濃度は、カルベジロールで観察された濃度の約 10 分の 1 であり、親と同様の薬物動態を示します。
カルベジロールは立体選択的初回通過代謝を受け、健康な被験者に経口投与した後、R(+)-カルベジロールの血漿レベルは S(-)-カルベジロールよりも約 2 ~ 3 倍高くなります。 R(+)-カルベジロールの見かけの平均最終消失半減期は、S(-)-エナンチオマーの 7 から 11 時間と比較して、5 から 9 時間の範囲です。
ヒト肝ミクロソームにおける R(+) および S(-)-カルベジロールの両方の代謝に関与する主要な P450 酵素は、CYP2D6 および CYP2C9 であり、程度は低いものの CYP3A4、2C19、1A2、および 2E1 でした。 CYP2D6 は、カルベジロールの 4' および 5' ヒドロキシル化における主要な酵素であると考えられており、3A4 が寄与している可能性があります。 CYP2C9 は、S(-)-カルベジロールの O-メチル化経路において最も重要であると考えられています。
カルベジロールは、デブリソキン (シトクロム P450 2D6 のマーカー) の低代謝者による遺伝子多型の影響を受けやすく、R(+)-カルベジロールの血漿中濃度は、高代謝者と比較して 2 ~ 3 倍高くなります。対照的に、S(-)-カルベジロールの血漿レベルは、代謝不良者では約 20% から 25% しか増加せず、このエナンチオマーが R(+)-カルベジロールよりもシトクロム P450 2D6 によって代謝される程度が低いことを示しています。カルベジロールの薬物動態は、S-メフェニトインの低代謝者 (シトクロム P450 2C19 が欠乏している患者) で異なるようには見えません。
カルベジロールは、主にアルブミンを含む血漿タンパク質に 98% 以上結合しています。血漿タンパク質結合は、治療範囲にわたる濃度とは無関係です。カルベジロールは、血管外組織への実質的な分布を示す、約 115 L の定常状態分布体積を持つ塩基性の親油性化合物です。血漿クリアランスは、500 ~ 700 mL/min の範囲です。
特定の集団
心不全
カルベジロールとそのエナンチオマーの定常状態の血漿濃度は、心不全患者の 6.25 ~ 50 mg の用量範囲で比例して増加しました。健康な被験者と比較して、心不全の被験者はカルベジロールとそのエナンチオマーの平均 AUC および Cmax 値が増加しており、NYHA クラス IV 心不全の被験者 6 人で最大 50% から 100% 高い値が観察されました。カルベジロールの見かけの最終消失半減期の平均は、健康な被験者で観察されたものと同様でした。
高齢者
カルベジロールの血漿レベルは、若い被験者と比較して高齢者で平均約 50% 高くなります。肝障害 健康な被験者と比較して、重度の肝障害 (肝硬変) の患者は、カルベジロールレベルが 4 ~ 7 倍増加します。カルベジロールは、重度の肝障害のある患者には禁忌です。
腎障害
カルベジロールは主に肝臓で代謝されますが、腎障害のある患者ではカルベジロールの血漿濃度が上昇することが報告されています。平均AUCデータに基づくと、高血圧で中等度から重度の腎機能障害を持つ被験者では、高血圧で正常な腎機能を持つ被験者の対照群と比較して、約40%から50%高いカルベジロールの血漿濃度が観察されました。ただし、AUC 値の範囲は両方のグループで類似していました。平均ピーク血漿レベルの変化はそれほど顕著ではなく、腎機能障害のある被験者では約 12% から 26% 高くなりました。
カルベジロールは、その高度の血漿タンパク質結合と一致して、血液透析によって有意に除去されるようには見えません。
薬物間相互作用
カルベジロールは実質的な酸化的代謝を受けるため、カルベジロールの代謝および薬物動態は、シトクロム P450 酵素の誘導または阻害によって影響を受ける可能性があります。
アミオダロン
日本人心不全患者106人を対象に実施された薬物動態試験では、アミオダロンとカルベジロールの少量負荷および維持用量の同時投与により、S(-)-カルベジロールの定常状態トラフ濃度が少なくとも2倍増加した[参照 薬物相互作用 ]。
シメチジン
10 人の健康な男性被験者で実施された薬物動態試験では、シメチジン (1 日あたり 1,000 mg) は、Cmax の変化なしにカルベジロールの定常状態の AUC を 30% 増加させた [参照 薬物相互作用 ]。
ジゴキシン
カルベジロール (25 mg 1 日 1 回) とジゴキシン (0.25 mg 1 日 1 回) を 14 日間併用投与した後、高血圧の 12 人の被験者で、定常状態の AUC とジゴキシンのトラフ濃度がそれぞれ 14% と 16% 増加した [参照 薬物相互作用 ]。
グリブリド
12 人の健常者において、カルベジロール (1 日 1 回 25 mg) とグリブリドの単回投与の併用投与は、いずれの化合物についても臨床的に関連する薬物動態学的相互作用をもたらしませんでした。
ヒドロクロロチアジド
カルベジロール 25 mg の単回経口投与は、12 人の高血圧患者におけるヒドロクロロチアジド 25 mg の単回経口投与の薬物動態を変化させませんでした。同様に、ヒドロクロロチアジドはカルベジロールの薬物動態に影響を与えませんでした。
リファンピン
8 人の健康な男性被験者で行われた薬物動態試験では、リファンピン (1 日 600 mg を 12 日間) は、カルベジロールの AUC と Cmax を約 70% 減少させました [ 薬物相互作用 ]。
トルセミド
12 人の健康な被験者を対象とした試験では、カルベジロール 25 mg を 1 日 1 回、トルセミド 5 mg を 1 日 1 回 5 日間組み合わせて経口投与しても、薬物単独の投与と比較して薬物動態に有意差はありませんでした。
ワルファリン
カルベジロール (12.5 mg 1 日 2 回) は、定常状態のプロトロンビン時間比に影響を与えず、9 人の健康なボランティアにワルファリンを併用投与した後、R(+)-および S(-)-ワルファリンの薬物動態を変化させませんでした。
臨床研究
心不全
カルベジロールのプラセボ対照試験では、軽度から重度の心不全の合計 6,975 人の被験者が評価されました。
軽度から中等度の心不全
カルベジロールは、5 つの多施設共同プラセボ対照試験と、軽度から中等度の心不全患者を対象とした 1 つの実薬対照試験 (COMET 試験) で研究されました。
米国の 4 つの多施設二重盲検プラセボ対照試験に、NYHA クラス II ~ III の心不全で駆出率が 0.35 以下の 1,094 人の被験者 (696 人がカルベジロールにランダム化) が登録されました。大多数は、治験登録時にジギタリス、利尿薬、および ACE 阻害薬を服用していました。患者は、運動能力に基づいて試験に割り当てられました。オーストラリアとニュージーランドの二重盲検プラセボ対照試験では、心不全の重症度が低い 415 人の被験者 (半分はカルベジロールに無作為化) が登録されました。すべてのプロトコルは、7.5 ~ 15 か月の二重盲検追跡期間中に心臓移植を受ける予定の被験者を除外しました。無作為化されたすべての被験者は、1日2回のカルベジロール6.25mgの2週間のコースに耐えました。
各試験には、心不全の進行 (米国の試験 1 件) または運動耐性 (登録目標を達成した米国の試験 2 件とオーストラリア-ニュージーランドの試験) のいずれかの主要エンドポイントがありました。これらの試験では、NYHA 分類、患者と医師の全体的な評価、心血管系の入院など、多くの副次的評価項目が指定されました。前向きに計画されていないその他の分析には、死亡の合計と心血管系の入院の合計が含まれていました。試験の主要エンドポイントが治療の有意な利益を示さない状況では、有意値を他の結果に割り当てることは複雑であり、そのような値は慎重に解釈する必要があります。
米国とオーストラリア - ニュージーランドの試験結果は次のとおりです。
心不全の進行を遅らせる
米国の 1 つの多施設共同試験 (被験者 366 人) では、主要エンドポイントとして、心血管死亡率、心血管系入院、および心不全治療薬の継続的な増加の合計がありました。心不全の進行は、平均 7 か月のフォローアップ中に 48% (P = 0.008) 減少しました。
オーストラリアとニュージーランドの試験では、18 ~ 24 か月で死亡者数と総入院数が約 25% 減少しました。米国で行われた 3 つの最大の試験では、死亡率と総入院率が 19%、39%、49% 減少し、最後の 2 つの試験では名目上統計的に有意でした。オーストラリアとニュージーランドの結果は、統計的にボーダーラインでした。
機能対策
NYHA分類を一次エンドポイントとした多施設試験はなかったが、そのような試験はすべて二次エンドポイントとした。すべての試験で、少なくとも NYHA クラスの改善傾向が見られました。 3 件の試験では、運動耐容能が主要エンドポイントでした。統計的に有意な効果は見られませんでした。
主観的尺度
標準的なアンケートで測定した健康関連の生活の質 (1 試験の主要エンドポイント) は、カルベジロールの影響を受けませんでした。しかし、患者と治験責任医師の総合評価では、ほとんどの試験で大幅な改善が見られました。
死亡
死はどの試験でも事前に指定されたエンドポイントではありませんでしたが、すべての試験で分析されました。全体として、これら 4 つの米国の試験では死亡率が減少し、名目上は 2 つの試験で大幅に減少しました。
COMETトライアル
この二重盲検試験では、NYHA クラス II~IV の心不全 (左心室駆出率が 35% 以下) の 3,029 人の被験者が無作為に割り付けられ、カルベジロール (目標用量: 25 mg を 1 日 2 回) または即時放出メトプロロールのいずれかを投与されました。酒石酸塩(目標用量:50mgを1日2回)。被験者の平均年齢は約 62 歳で、80% が男性で、ベースラインでの平均左心室駆出率は 26% でした。被験者の約 96% が NYHA クラス II または III の心不全を患っていました。併用治療には、利尿薬 (99%)、ACE 阻害薬 (91%)、ジギタリス (59%)、アルドステロン拮抗薬 (11%)、および「スタチン」脂質低下薬 (21%) が含まれていました。追跡調査の平均期間は 4.8 年でした。カルベジロールの平均投与量は 1 日あたり 42 mg でした。
この試験には 2 つの主要エンドポイントがありました。全死因死亡率と、何らかの理由による死亡と入院の複合です。 COMET の結果を以下の表 3 に示します。全死因死亡率が統計的重みの大部分を占め、試験規模の主要な決定要因でした。全死因死亡率は、カルベジロールで治療された被験者で 34%、即時放出メトプロロール群で 40% でした (P = 0.0017; ハザード比 = 0.83、95% CI: 0.74 ~ 0.93)。死亡率への影響は、主に心血管死の減少によるものでした。複合エンドポイントに関する 2 つのグループ間の差は有意ではありませんでした (P = 0.122)。推定平均生存期間は、カルベジロールで 8.0 年、即時放出型メトプロロールで 6.6 年でした。
この任意の用量のメトプロロール製剤または任意の製剤中のこの低用量のメトプロロールが、心不全患者の生存または入院に何らかの影響を与えるかどうかはわかっていません。したがって、この試験は、カルベジロールが心不全の生存に利益をもたらす時間を延長しますが、カルベジロールが心不全に利益をもたらすメトプロロール(TOPROL-XL)の製剤よりも転帰を改善するという証拠ではありません.
重度の心不全(COPERNICUS)
二重盲検試験 (COPERNICUS) では、ジギタリス (66%)、利尿薬 (99%)、およびACE 阻害剤 (89%) は、プラセボまたはカルベジロールに無作為に割り付けられました。カルベジロールは、開始用量の 3.125 mg を 1 日 2 回から最大耐用量まで、または最大 25 mg を 1 日 2 回まで、最低 6 週間にわたって滴定されました。ほとんどの被験者が目標用量の 25 mg を達成しました。この試験は、東ヨーロッパと西ヨーロッパ、米国、イスラエル、カナダで実施されました。グループごとに同数の被験者 (約 100 人) が、滴定期間中に離脱しました。
試験の主要エンドポイントは全死因死亡率でしたが、死因別死亡率と死亡または入院のリスク (合計、心血管 [CV]、または心不全 [HF]) も調べられました。開発中の試験データはデータ監視委員会によって追跡され、死亡率分析はこれらの複数の外観に合わせて調整されました。死亡率が 35% 減少したことが観察されたため (プラセボ群の 19.7%/患者年からカルベジロール群の 12.8% に、ハザード比 0.65、95% CI: 0.52 から 0.81、 P = 0.0014、調整済み) (図 1 を参照)。 COPERNICUS の結果を表 4 に示します。
図 1. COPERNICUS の生存分析 (Intent-to-Treat) 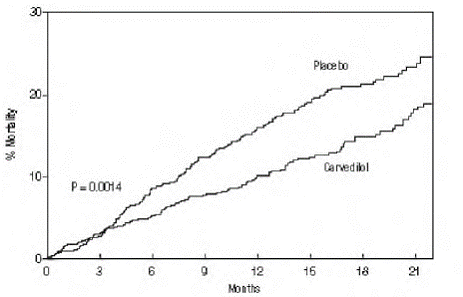
死亡率への影響は、主に、心不全を悪化させることなく被験者の突然死率が低下した結果でした。
カルベジロールで治療された被験者がプラセボと比較された患者の全体的な評価は、治療後の臨床状態がベースラインと比較して改善、悪化、または変化なしを示したかどうかに関して、事前に指定された定期的な患者の自己評価に基づいていました。カルベジロールで治療された被験者は、COPERNICUS でプラセボで治療された被験者と比較して、全体的な評価で有意な改善を示しました。
プロトコルでは、入院が評価されることも明記されていました。プラセボよりも COREG 6.25mg の被験者の方が、何らかの理由 (372 対 432、P = 0.0029)、心血管の理由 (246 対 314、P = 0.0003)、または心不全の悪化 (198 対 268、P = 0.0001) で入院した被験者は少なかった。 )。
COREG 6.25mg は、全死因死亡率、ならびに全死因死亡率と入院 (合計、CV、または心不全) の合計エンドポイントに対して、試験集団全体および調査したすべてのサブグループで一貫した有益な効果がありました。男性と女性、高齢者と非高齢者、黒人と非黒人、糖尿病患者と非糖尿病患者 (図 2 を参照)。
図 2. COPERNICUS におけるサブグループの死亡率への影響 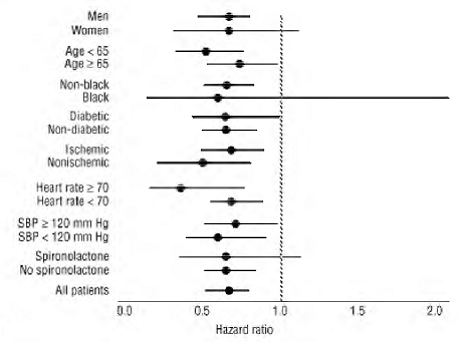
心筋梗塞後の左心室機能不全
CAPRICORN は、最近 (21 日以内に) 心筋梗塞を起こし、左心室駆出率が 40% 以下で、心不全の症状がある (47%) またはない 1,959 人の被験者を対象に、カルベジロールとプラセボを比較する二重盲検試験でした。カルベジロールを投与された被験者は 6.25 mg を 1 日 2 回投与され、1 日 2 回 25 mg まで耐容性が滴定されました。被験者は、収縮期血圧が 90 mm Hg を超え、座位での心拍数が毎分 60 回を超え、β 遮断薬の使用を禁忌としない必要がありました。指標梗塞の治療には、アスピリン (85%)、静注または経口 β 遮断薬 (37%)、硝酸薬 (73%)、ヘパリン (64%)、血栓溶解薬 (40%)、および急性血管形成術 (12%) が含まれていました。バックグラウンド治療には、ACE阻害薬またはアンギオテンシン受容体遮断薬(97%)、抗凝固薬(20%)、脂質低下薬(23%)、および利尿薬(34%)が含まれていました。ベースライン集団の特徴には、平均年齢 63 歳、男性 74%、白人 95%、平均血圧 121/74 mm Hg、糖尿病患者 22%、高血圧歴患者 54% が含まれていました。カルベジロールの平均投与量は、1 日 2 回 20 mg でした。フォローアップの平均期間は15ヶ月でした。
図に示すように、総死亡率はプラセボ群で 15%、カルベジロール群で 12% であり、カルベジロールで治療された被験者のリスクが 23% 減少したことを示しています (95% CI: 2% ~ 40%、P = 0.03)。 3. さまざまなサブグループにおける死亡率への影響を図 4 に示します。ほぼすべての死亡は心血管系であり (カルベジロールによって 25% 減少)、これらの死亡のほとんどは突然またはポンプ不全に関連していました (両方のタイプの死亡が減少しました)。カルベジロールによる)。別の試験のエンドポイントである総死亡率と全原因による入院では、有意な改善は見られませんでした。
また、カルベジロールで治療されたグループで観察された致命的または非致命的な心筋梗塞の有意な 40% の減少がありました (95% CI: 11% から 60%、P = 0.01)。心不全におけるカルベジロールのプラセボ対照試験のメタアナリシスでも、心筋梗塞のリスクの同様の低下が観察されました。
図 3. CAPRICORN の生存分析 (Intent-to-Treat) 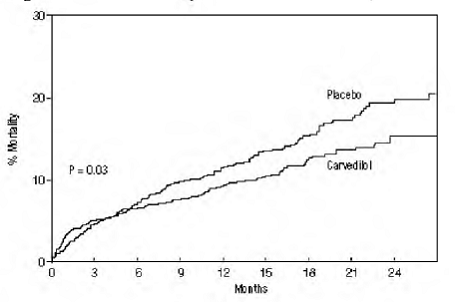
図 4. CAPRICORN のサブグループの死亡率への影響 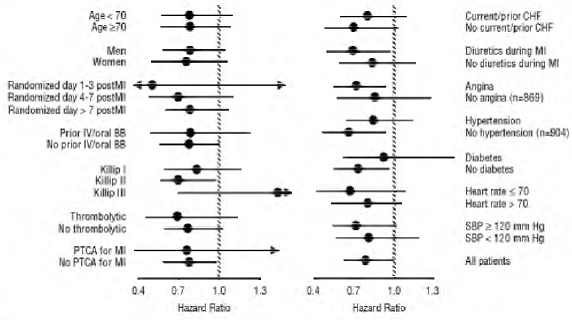
高血圧症
COREG 25 mg は、1 日 2 回、1 日 12.5 ~ 50 mg の用量で投与する 2 つのプラセボ対照試験で研究されました。これらの試験やその他の試験では、開始用量は 12.5 mg を超えませんでした。 1 日 50 mg で、COREG は座位トラフ (12 時間) 血圧を約 9/5.5 mm Hg 低下させました。 1 日 25 mg で、効果は約 7.5/3.5 mm Hg でした。トラフからピークまでの血圧の比較では、血圧応答のトラフからピークまでの比率が約 65% であることが示されました。心拍数は、1 日 50 mg で 1 分あたり約 7.5 ビート低下しました。一般に、他のβブロッカーと同様に、反応は非黒人被験者より黒人被験者の方が小さかった。年齢や性別による反応の違いはありませんでした。
降圧効果のピークは、投与後 1 ~ 2 時間で発生しました。用量に関連した血圧反応は、副作用の用量に関連した増加を伴っていた[参照 有害反応 ]。
2型糖尿病による高血圧
二重盲検試験(GEMINI)では、ACE阻害剤またはアンギオテンシン受容体遮断薬に追加されたCOREG 25mgが、軽度から中等度の高血圧症および十分に管理された2型糖尿病の集団で評価されました.ベースラインでの平均 HbA1c は 7.2% でした。 COREG は 1 日 2 回の平均用量 17.5 mg に滴定され、5 か月間維持されました。 HbA1c 測定に基づくと、COREG は血糖コントロールに悪影響を及ぼさなかった (0.02% のベースラインからの平均変化、95% CI: -0.06 から 0.10、P = NS) [参照 警告と注意事項 ]。
患者情報
コアレッグ (Co-REG) (カルベジロール) 錠
COREG の服用を開始する前、およびリフィルを入手するたびに、COREG に付属の患者情報をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医師と話すことに代わるものではありません。 COREG 3.12mg について質問がある場合は、医師または薬剤師にお尋ねください。
コアレッグ3.12mgとは?
COREGは、「β遮断薬」と呼ばれるグループに属する処方薬です。 COREG 6.25mg は、多くの場合、他の医薬品とともに、次の状態に使用されます。
- 特定の種類の心不全患者の治療
- 心臓発作により心臓のポンプ機能が低下した患者の治療に
- 高血圧(高血圧症)の患者を治療する
COREG は、18 歳未満の子供への使用は承認されていません。
COREGを服用してはいけない人は?
次の場合は、COREG 6.25mg を服用しないでください。
- 重度の心不全を患っており、集中治療室に入院しているか、循環をサポートするのに役立つ特定の静脈内薬(強心薬)を必要としています。
- 喘息やその他の呼吸の問題を起こしやすい。
- 心臓の鼓動が遅い、または鼓動をスキップする (不規則な鼓動)。
- 肝臓に問題があります。
- COREGの成分のいずれかにアレルギーがある.有効成分はカルベジロールです。 COREG のすべての成分のリストについては、このリーフレットの最後を参照してください。
COREGを服用する前に医師に何を伝えるべきですか?
以下の場合を含め、すべての病状について医師に伝えてください。
- 喘息または他の肺の問題(気管支炎または肺気腫など)がある。
- 足や脚の血流に問題がある (末梢血管疾患)。 COREG 3.12mg は、症状の一部を悪化させる可能性があります。
- 糖尿病です。
- 甲状腺に問題があります。
- 褐色細胞腫という病気があります。
- 重度のアレルギー反応を起こしたことがある。
- 妊娠している、または妊娠しようとしている。 COREG が胎児にとって安全かどうかは不明です。あなたと主治医は、妊娠中の高血圧をコントロールする最善の方法について話し合う必要があります.
- 授乳中です。 COREGが母乳に移行するかどうかは不明です。 COREGを服用している場合は、赤ちゃんに与える最善の方法について医師に相談してください.
- 手術が予定されており、麻酔薬が投与されます。
- 白内障手術の予定があり、COREGを服用している、または現在服用中の方。
- 処方薬または市販薬、ビタミン、ハーブのサプリメントを服用している。 COREG と特定の他の薬は互いに影響し合い、深刻な副作用を引き起こす可能性があります。 COREG 3.12mg は、他の医薬品の作用に影響を与える可能性があります。また、他の医薬品が COREG 25mg の効果に影響を与える可能性があります。
服用しているすべての薬のリストを保管してください。新しい薬を始める前に、このリストを医師と薬剤師に見せてください。
COREGはどのように服用すればよいですか?
医師の指示に従って、毎日薬を服用することが重要です。 COREG の服用を突然中止すると、胸痛や心臓発作を起こす可能性があります。医師が COREG 6.25mg の服用を中止する必要があると判断した場合、医師は完全に中止する前に、一定期間にわたって用量をゆっくりと下げることがあります。
- COREGを処方どおりに服用してください。医師は、服用する錠剤の数と頻度を教えてくれます。副作用の可能性を最小限に抑えるために、医師は低用量から始めて、徐々に用量を増やしていくことがあります。
- COREGの服用を中止したり、医師に相談せずに服用するCOREGの量を変更したりしないでください.
- COREGの服用中に体重が増えたり、呼吸が困難になったりした場合は、医師に相談してください。
- COREGは食事と一緒に服用してください。
- COREG 3.12mg を飲み忘れた場合は、次の服用時でない限り、思い出したらすぐに服用してください。通常の時間に次の用量を服用してください。 2回分を同時に服用しないでください。
- COREG 25mg を過剰に摂取した場合は、すぐに医師または毒物管理センターに連絡してください。
COREG 3.12mgを服用している間、何を避けるべきですか?
- COREG は、めまい、疲労、失神を引き起こす可能性があります。これらの症状がある場合は、車を運転したり、機械を使用したり、注意が必要なことをしたりしないでください。
COREGの副作用にはどのようなものがありますか?
- 低血圧(立ち上がったときにめまいや失神を引き起こす可能性があります). これらが発生した場合は、すぐに座るか横になり、医師に相談してください。
- 疲れ。 疲れやめまいを感じたら、車を運転したり、機械を使用したり、注意が必要なことをしたりしないでください。
- 心拍が遅い。
- 血糖値の変化。糖尿病の場合は、血糖値に変化があった場合は医師に相談してください。
- COREG は、低血糖の症状の一部、特に速い心拍を隠すことがあります。
- COREG は、甲状腺機能亢進症 (甲状腺機能亢進症) の症状を隠す可能性があります。
- 重度のアレルギー反応の悪化。
- まれではあるが深刻なアレルギー反応(顔、唇、舌、および/または呼吸や嚥下の困難を引き起こす可能性のある顔、唇、舌、および/または喉の腫れまたは腫れを含む)が、COREGを服用していた患者に発生しました.これらの反応は生命を脅かす可能性があります。
COREG のその他の副作用には、息切れ、体重増加、下痢、コンタクト レンズを着用している場合に気になる涙やドライアイの減少などがあります。
気になる副作用や治らない副作用がある場合は、医師に連絡してください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA1088 で副作用を FDA に報告できます。
COREG 6.25mgの保管方法は?
- COREG は 86°F (30°C) 未満で保管してください。錠剤を乾燥した状態に保ちます。
- 古くなった、または不要になった COREG は安全に破棄してください。
- COREG 6.25mg とすべての医薬品は子供の手の届かないところに保管してください。
COREGに関する一般情報
医薬品は、患者情報リーフレットに記載されているもの以外の状態で処方されることがあります。処方されていない状態で COREG 3.12mg を使用しないでください。他の人があなたと同じ症状を持っている場合でも、COREG を与えないでください。それらに害を及ぼす可能性があります。
このリーフレットには、COREG に関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医師に相談してください。医療従事者向けに書かれた COREG 6.25mg に関する情報については、医師または薬剤師にお尋ねください。
COREGの成分は何ですか?
有効成分:カルベジロール。
不活性成分: コロイド状二酸化ケイ素、クロスポビドン、ヒプロメロース、ラクトース、ステアリン酸マグネシウム、ポリエチレングリコール、ポリソルベート 80、ポビドン、スクロース、および二酸化チタン。
カルベジロール錠剤には、3.125 mg、6.25 mg、12.5 mg、25 mg の強度があります。
高血圧(高血圧症)とは?
血圧は、心臓が鼓動するときと心臓が休むときの血管内の血液の力です。力が強すぎると高血圧になります。高血圧は、心臓が体中に血液を送り出すのを難しくし、血管に損傷を与えます。 COREG は血管を弛緩させ、血圧を下げるのに役立ちます。血圧を下げる薬は、脳卒中や心臓発作のリスクを下げる可能性があります。
