Avapro 150mg, 300mg Irbesartan 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Avapro 300mg とは何ですか?
Avapro 300mg は、2 型糖尿病によって引き起こされる高血圧 (高血圧)、神経痛の症状を治療するために使用される処方薬です。アバプロは、単独で使用することも、他の薬と併用することもできます。
Avapro 300mg は、薬物 ARB のクラスに属します。
Avapro 150mg が 6 歳未満の子供に安全で効果的かどうかはわかっていません。
Avapro 300mg の可能な副作用は何ですか?
Avapro は、次のような重大な副作用を引き起こす可能性があります。
- 原因不明の筋肉痛、
- 優しさや弱さ、
- 熱、
- 異常な疲労感
- 濃い色の尿、
- 立ちくらみ、
- 排尿がほとんどまたはまったくない、
- 腫れ、
- 急激な体重増加、
- 錯乱、
- 食欲減少、
- 嘔吐、および
- あなたの側または腰の痛み
上記の症状がある場合は、すぐに医療機関を受診してください。
Avapro の最も一般的な副作用は次のとおりです。
- 下痢、
- 胸焼け、
- 胃のむかつき、そして
- 疲労感
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Avapro の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
胎児毒性
- 妊娠が判明したら、できるだけ早くアバプロを中止してください。
- システム内のレニン-アンギオテンに直接作用する薬物は、発育中の胎児に傷害や死亡を引き起こす可能性があります [警告と注意事項を参照]。
説明
AVAPRO (irbesartan) は、アンギオテンシン II 受容体 (AT1 サブタイプ) 拮抗薬です。
イルベサルタンは非ペプチド化合物であり、化学的には 2-ブチル-3-[p-(o-1H-テトラゾール-5-イルフェニル)ベンジル]-1,3-ジアザスピロ[4.4]ノン-1-エン-4 -1。
その実験式は C25H28N6O であり、構造式は次のとおりです。
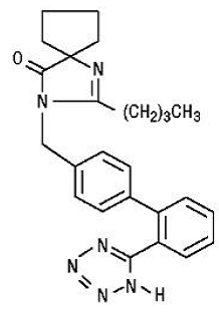
Irbesartan は、分子量 428.5 の白色からオフホワイトの結晶性粉末です。これは、pH 7.4 で分配係数 (オクタノール/水) が 10.1 の非極性化合物です。イルベサルタンは、アルコールと塩化メチレンに溶けにくく、水にはほとんど溶けません。
AVAPRO は、75 mg、150 mg、または 300 mg のイルベサルタンを含む、スコアのない錠剤で経口投与できます。不活性成分には、ラクトース、微結晶性セルロース、アルファ化デンプン、クロスカルメロース ナトリウム、ポロキサマー 188、二酸化ケイ素、ステアリン酸マグネシウムが含まれます。
適応症
高血圧症
AVAPRO® は、血圧を下げるために高血圧の治療に適応されます。血圧を下げると、主に脳卒中や心筋梗塞などの致命的および非致命的な心血管 (CV) イベントのリスクが低下します。これらの利点は、この薬を含むさまざまな薬理学的クラスの降圧薬の対照試験で見られました。
高血圧の管理は、必要に応じて、脂質管理、糖尿病管理、抗血栓療法、禁煙、運動、およびナトリウム摂取制限を含む包括的な心血管リスク管理の一部であるべきです。多くの患者は、血圧目標を達成するために複数の薬を必要とします。目標と管理に関する具体的なアドバイスについては、国立高血圧教育プログラムの高血圧の予防、検出、評価、および治療に関する合同全国委員会 (JNC) のガイドラインなど、公開されているガイドラインを参照してください。
さまざまな薬理学的クラスから、作用機序の異なる多数の降圧薬が無作為対照試験で示され、心血管疾患の罹患率と死亡率を低下させることが示されています。これらの利点の大部分を担っているのは薬です。最大かつ最も一貫した心血管転帰の利点は、脳卒中のリスクの低下ですが、心筋梗塞と心血管死亡率の低下も定期的に見られています.
収縮期圧または拡張期圧の上昇は心血管リスクの増加を引き起こし、mmHg あたりの絶対リスク増加は血圧が高いほど大きくなるため、重度の高血圧をわずかに低下させるだけでもかなりの利益が得られます。血圧低下による相対リスク低下は、絶対リスクが異なる集団全体で類似しているため、高血圧とは無関係にリスクが高い患者 (たとえば、糖尿病や高脂血症の患者) では絶対的利益が大きくなり、そのような患者は、より積極的な治療により、より低い血圧の目標を達成することができます。
一部の降圧薬は、黒人患者では(単剤療法として)血圧への影響が小さく、多くの降圧薬には追加の承認された適応症と効果があります(例、狭心症、心不全、または糖尿病性腎疾患)。これらの考慮事項は、治療法の選択の指針となる場合があります。
AVAPRO 300mg は、単独で使用することも、他の降圧薬と組み合わせて使用することもできます。
2型糖尿病患者における腎症
AVAPRO は、2 型糖尿病および高血圧、血清クレアチニンの上昇、タンパク尿 (>300 mg/日) を有する患者の糖尿病性腎症の治療に適応されます。この集団では、アバプロは、血清クレアチニンの倍増または末期腎疾患(透析または腎移植の必要性)の発生によって測定される腎症の進行速度を低下させます[参照 臨床研究 ]。
投薬と管理
一般的な考慮事項
AVAPRO は、他の降圧剤と一緒に、また食事の有無にかかわらず投与することができます。
高血圧症
AVAPRO 300mg の推奨初期用量は、1 日 1 回 150mg です。血圧をコントロールするために、必要に応じて 1 日 1 回 300 mg まで増量できます。 臨床研究 ]。
2型糖尿病患者における腎症
推奨用量は 1 日 1 回 300 mg です。 臨床研究 ]。
体液量および減塩患者における用量調節
血管内容積または塩分が枯渇している患者(例えば、利尿薬または血液透析で精力的に治療されている患者)の推奨される初期用量は、1日1回75mgである[ 警告と注意事項 ]。
供給方法
剤形と強度
AVAPRO 75 mg は、白色からオフホワイトの両凸楕円形のフィルムコーティング錠で、片面にハート、もう片面に「2871」のデボス加工が施されています。
AVAPRO 150 mg は、白色からオフホワイトの両凸楕円形のフィルムコーティング錠で、片面にハート、もう片面に「2872」のデボス加工が施されています。
AVAPRO 300 mg は、白色からオフホワイトの両凸楕円形のフィルムコーティング錠で、片面にハート、もう片面に「2873」のデボス加工が施されています。
保管と取り扱い
AVAPRO (イルベサルタン) は、白色からオフホワイトの両凸楕円形のフィルムコーティング錠として入手でき、片面にハート型の型押し、もう片面にコードが刻印されています (下の表を参照)。使用単位ボトルには、次のように 30 個または 90 個のフィルムコーティングされた錠剤が含まれています。
25°C (77°F) で保管してください。 15°C–30°C (59°F–86°F) [参照 USP制御の室温 ]。
sanofi-aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY.改訂: 2021 年 9 月
副作用
次の重要な副作用は、ラベルの別の場所に記載されています。
- 体液量または減塩患者の低血圧 [参照 警告と注意事項 ]
- 腎機能障害 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。しかし、臨床試験からの有害反応情報は、薬物使用に関連すると思われる有害事象を特定し、発生率を概算するための基礎を提供します。
高血圧症
AVAPRO は、4,300 人以上の高血圧患者と全体で約 5,000 人の被験者で安全性が評価されています。この経験には、6 か月以上治療を受けた 1303 人の患者と、1 年以上治療を受けた 407 人の患者が含まれます。
プラセボ対照臨床試験では、AVAPRO で治療された患者の少なくとも 1% (n=1965) で次の副作用が報告され、プラセボ (n=641) よりも高い発生率でした。治療中の状態に関連していたか、治療を受けた集団で非常に一般的であるため、薬物の使用と合理的に関連していません。下痢(3%対2%)、消化不良/胸やけ(2%対1%)、および疲労が含まれます(4% 対 3%)。
イルベサルタンの使用は、一般的に ACE 阻害剤の使用に関連する空咳の発生率の増加とは関連していませんでした。プラセボ対照研究では、イルベサルタン治療を受けた患者の咳の発生率は、プラセボを受けた患者の2.7%に対して2.8%でした.
2型糖尿病患者における腎症
高カリウム血症
イルベサルタン糖尿病性腎症試験(IDNT)(タンパク尿≧900mg/日、血清クレアチニン範囲1.0~3.0mg/dL)では、カリウムが6mEq/Lを超える患者の割合は、AVAPRO 300mg群に対して18.6%でした。プラセボ群では6.0%。 AVAPRO 150mg群の高カリウム血症による中止は、プラセボ群の0.4%に対して2.1%でした。
IDNTでは、有害反応は、プラセボ群に対してAVAPRO 150mg群でより頻繁に発生した起立性症状の発生率の増加を除いて、高血圧患者で見られたものと同様でした:めまい(10.2%対6.0%)、起立性めまい(5.4%) % vs 2.7%) および起立性低血圧 (5.4% vs 3.2%)。
市販後の経験
AVAPROの承認後の使用中に、次の副作用が確認されました。これらの反応は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
蕁麻疹;血管性浮腫 (顔、唇、咽頭、および/または舌の腫れを伴う);アナフィラキシーショックを含むアナフィラキシー反応;肝機能検査の増加;黄疸;肝炎;高カリウム血症;貧血;血小板減少症; CPKの増加;耳鳴り;糖尿病患者の低血糖。
薬物相互作用
血清カリウムを増加させる薬剤
血清カリウム値を上昇させる他の薬剤と AVAPRO を併用すると、高カリウム血症を引き起こすことがあり、重篤な場合もあります。そのような患者では血清カリウムをモニターしてください。
リチウム
イルベサルタンとリチウムの併用により、血清リチウム濃度の上昇とリチウム毒性が報告されています。イルベサルタンとリチウムを投与されている患者のリチウム濃度を監視します。
選択的シクロオキシゲナーゼ-2阻害剤(COX-2阻害剤)を含む非ステロイド性抗炎症薬(NSAID)
高齢者、体液量が減少している患者(利尿薬治療中の患者を含む)、または腎機能が低下している患者では、選択的COX-2阻害薬を含むNSAIDとアンギオテンシンII受容体拮抗薬(イルベサルタンを含む)を併用すると、腎機能が低下する可能性があります、可能性のある急性腎不全を含む。これらの影響は通常可逆的です。イルベサルタンと NSAID 療法を受けている患者では、腎機能を定期的に監視します。
イルベサルタンを含むアンギオテンシン II 受容体拮抗薬の降圧効果は、選択的 COX-2 阻害剤を含む NSAID によって減弱される可能性があります。
レニン-アンジオテンシン系 (RAS) の二重遮断
アンジオテンシン受容体遮断薬、ACE 阻害薬、またはアリスキレンによる RAS の二重遮断は、単剤療法と比較して、低血圧、高カリウム血症、および腎機能の変化 (急性腎不全を含む) のリスクの増加と関連しています。 2 種類の RAS 阻害剤を組み合わせて投与されているほとんどの患者は、単剤療法と比較して追加の利益を得ることはありません。 RAS阻害剤との併用は原則として避けてください。 AVAPRO 150mgおよびRASに影響を与える他の薬剤を服用している患者の血圧、腎機能、電解質を注意深く監視してください。
糖尿病患者にアリスキレンと AVAPRO を併用しないでください。腎機能障害のある患者(GFR
警告
の一部として含まれています 予防 セクション。
予防
胎児毒性
AVAPRO 150mg を妊婦に投与すると、胎児に害を及ぼす可能性があります。妊娠第 2 期および第 3 期にレニンアンギオテンシン系に作用する薬物を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。結果として生じる羊水過少症は、胎児の肺形成不全および骨格の変形に関連している可能性があります。潜在的な新生児の副作用には、頭蓋形成不全、無尿症、低血圧、腎不全、および死亡が含まれます。妊娠が判明したら、できるだけ早く AVAPRO を中止してください [ 特定の集団での使用 ]。
体液量の低血圧または減塩患者
体液量や塩分が不足している患者(例えば、高用量の利尿剤で治療されている患者)など、活性化されたレニン-アンギオテンシン系を有する患者では、AVAPROによる治療の開始後に症候性低血圧が発生する可能性があります。 AVAPRO 300mgの投与前に正しい量または塩分を枯渇させるか、より低い開始用量を使用してください[ 投薬と管理 ]。
腎機能障害
急性腎不全を含む腎機能の変化は、レニン-アンギオテンシン系を阻害する薬剤によって引き起こされる可能性があります。腎機能がレニン-アンギオテンシン系の活性に部分的に依存している可能性がある患者(例、腎動脈狭窄、慢性腎疾患、重度の心不全、または容量枯渇の患者)は、急性腎不全または死亡を発症するリスクが特に高い可能性があります。アバプロで。これらの患者の腎機能を定期的に監視します。 AVAPRO 投与中に臨床的に重大な腎機能の低下がみられた患者では、治療の差し控えまたは中止を検討してください。 薬物相互作用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
イルベサルタンをラットで最大 500/1000 mg/kg/日 (それぞれオス/メス)、マウスで最大 1000 mg/kg/日の用量で 2 年間投与した場合、発がん性の証拠は観察されませんでした。雄および雌ラットの場合、500 mg/kg/日は、イルベサルタンへの平均全身暴露 (AUC 0-24 時間、結合および非結合) をそれぞれ約 3 倍および 11 倍提供し、最大推奨されるヒトの平均全身暴露一方、1000 mg/kg/日 (女性のみに投与) では、MRHD で報告されたヒトの約 21 倍の平均全身暴露が得られました。オスとメスのマウスの場合、1000 mg/kg/日は、300 mg/日の人間の暴露量の約 3 倍と 5 倍のイルベサルタン暴露量を提供しました。
イルベサルタンは一連の in vitro 試験 (エイムズ微生物試験、ラット肝細胞 DNA 修復試験、V79 哺乳動物細胞前方遺伝子変異試験) で変異原性を示さなかった。イルベサルタンは、染色体異常の誘発に関するいくつかの試験(in vitro-ヒトリンパ球アッセイ、in vivo-マウス小核試験)で陰性でした。
イルベサルタンは 650 mg/kg/日以下の経口投与量で雄または雌ラットの受胎能または交配に悪影響を及ぼさなかった.イルベサルタンへの全身曝露(AUC 0-24 時間、結合および非結合)を提供する最高用量は、その約 5 倍である. 300 mg/日の MRHD を摂取しているヒトに見られます。
特定の集団での使用
妊娠
リスクの概要
AVAPRO を妊婦に投与すると、胎児に害を及ぼす可能性があります。妊娠第 2 期および第 3 期にレニンアンギオテンシン系に作用する薬剤を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が上昇する [参照 臨床上の考慮事項 ]。妊娠初期に降圧薬の使用にさらされた後の胎児の異常を調べるほとんどの疫学研究では、レニン-アンギオテンシン系に影響を与える薬物を他の降圧薬と区別していません。妊娠が判明したら、できるだけ早くアバプロ 150mg を中止してください。
すべての妊娠には、薬物への曝露に関係なく、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
疾患に関連する母体および/または胚・胎児のリスク
妊娠中の高血圧は、子癇前症、妊娠糖尿病、早産、分娩合併症(例、帝王切開や分娩後出血の必要性)のリスクを高めます。高血圧は、胎児の子宮内発育制限および子宮内死亡のリスクを高めます。高血圧症の妊婦は注意深く監視し、それに応じて管理する必要があります。
胎児/新生児の有害反応
妊娠第 2 および第 3 期にレニン-アンギオテンシン系に影響を与える薬剤を使用する妊婦の羊水過少症は、次の結果をもたらす可能性があります: 無尿および腎不全につながる胎児腎機能の低下、胎児肺形成不全、頭蓋骨形成不全を含む骨格変形、低血圧、そして死。
特定の患者のレニン-アンギオテンシン系に影響を与える薬物による治療に代わる適切な方法がないという異常なケースでは、母親に胎児への潜在的なリスクについて知らせてください。
羊膜内環境を評価するためにシリアル超音波検査を実行します。妊娠週に基づいて、胎児検査が適切な場合があります。ただし、患者と医師は、胎児が不可逆的な損傷を受けるまで羊水過少症が現れない可能性があることに注意する必要があります。羊水過少症が観察された場合は、代替治療を検討してください。低血圧、乏尿、高カリウム血症、およびその他の腎障害の症状について、子宮内でアバプロに暴露したことのある乳児を注意深く観察してください。 AVAPRO 300mg への子宮内曝露歴のある新生児で、乏尿または低血圧が発生した場合は、血圧および腎灌流のサポートに注意を向けてください。交換輸血または透析は、低血圧の逆転および/または障害のある腎機能の代替手段として必要になる場合があります。
データ
動物データ
イルベサルタンは、ラットとウサギの胎盤を通過します。交配前に妊娠および授乳期に 50、180、または 650 mg/kg/日 (体表面積に基づく最大推奨ヒト用量 (MRHD) の 1.6 ~ 21.1 倍) の経口用量でイルベサルタンを投与された雌ラットにおいて、胎児を検査した。妊娠 20 日目には、すべてのイルベサルタン投与群で尿管水管および腎盂キャビテーションの発生率の増加、および/または腎乳頭の欠如が示されました。皮下浮腫も母体用量 180 mg/kg/日以上(MRHD の 5.8 倍)で胎児に発生した。これらの異常は、メスのラットが交配前から妊娠 20 日までイルベサルタンを投与された場合に発生したが、同じ研究で出生後の仔では観察されなかった。 50 から 450 mg/kg/日の経口用量 (MRHD の最大 14.6 倍)。さらに、妊娠 15 日目から授乳 24 日目まで 50、180、または 650 mg/kg/日 (MRHD の最大 21.1 倍) の用量でイルベサルタンを投与された母動物の仔では、腎臓の発達に対する悪影響は観察されませんでした。観察された影響は、薬物の妊娠後期の影響であると考えられています。イルベサルタン 30 mg/kg/日 (体表面積に基づく MRHD の 1.9 倍) を経口投与された妊娠ウサギは、高い確率で母体の死亡率と流産を経験しました。生き残った雌では、早期吸収がわずかに増加し、それに対応して生きている胎児が減少しました。
放射性標識イルベサルタンの経口投与後、妊娠後期のラットとウサギの胎児に放射能が存在した。
授乳
母乳中のイルベサルタンの存在、乳生産への影響、または母乳で育てられた乳児に関する入手可能なデータはありません。イルベサルタンまたはイルベサルタンの一部の代謝物は、授乳中のラットの乳汁中に分泌されます [参照 臨床薬理学 ]。授乳中の乳児に悪影響を与える可能性があるため、授乳中の女性に AVAPRO 150mg を使用することはお勧めしません。
小児用
イルベサルタンは、最大 4.5 mg/kg/日の用量で 1 日 1 回の研究で、6 歳から 16 歳の小児患者の血圧を効果的に低下させるようには見えませんでした。
AVAPRO は、6 歳未満の小児患者では研究されていません。
高齢者の使用
高血圧症の対照臨床試験で AVAPRO を投与された 4925 人の被験者のうち、911 人 (18.5%) が 65 歳以上で、150 人 (3.0%) が 75 歳以上でした。これらの被験者と若い被験者の間で有効性または安全性に全体的な違いは観察されませんでしたが、一部の高齢者の感度が高いことは除外できません. [見る 臨床薬理学 と 臨床研究 ]
過剰摂取
ヒトの過剰摂取に関するデータはありません。しかし、8 週間にわたる 900 mg の 1 日用量は十分に許容されました。過剰摂取の最も可能性の高い症状は、低血圧と頻脈であると予想されます。徐脈は、過剰摂取によっても発生する可能性があります。イルベサルタンは血液透析では除去されません。
マウスおよびラットにおけるイルベサルタンの急性経口毒性試験では、急性致死量が 2000 mg/kg を超え、体表面積に基づく MRHD (300 mg) のそれぞれ約 25 倍および 50 倍であることが示されました。
禁忌
AVAPRO 150mg は、この製品の成分に過敏な患者には禁忌です。
糖尿病患者には、アリスキレンとアバプロ 300mg を併用しないでください。
臨床薬理学
作用機序
アンギオテンシン II は、アンギオテンシン変換酵素 (ACE、キニナーゼ II) によって触媒される反応でアンギオテンシン I から形成される強力な血管収縮剤です。アンギオテンシン II は、レニンアンギオテンシン系の主要な血管作動性ホルモンであり、高血圧の病態生理学における重要な要素です。また、副腎皮質によるアルドステロン分泌を刺激します。イルベサルタンは、多くの組織 (血管平滑筋、副腎など) に見られる AT1 アンギオテンシン II 受容体に選択的に結合することにより、アンギオテンシン II の血管収縮作用およびアルドステロン分泌作用をブロックします。多くの組織にも AT2 受容体がありますが、心血管の恒常性には関与していません。
イルベサルタンは、AT2 受容体よりも AT1 受容体に対してはるかに高い親和性 (8500 倍以上) を持ち、アゴニスト活性を持たない、AT1 受容体の特異的な競合的アンタゴニストです。
AT1 受容体の遮断は、レニン分泌に対するアンギオテンシン II の負のフィードバックを取り除きますが、結果として生じる血漿レニン活性の増加と循環アンギオテンシン II は、血圧に対するイルベサルタンの影響を克服しません。
Irbesartan は、ACE やレニンを阻害したり、血圧やナトリウム恒常性の心血管調節に関与することが知られている他のホルモン受容体やイオン チャネルに影響を与えたりしません。
薬力学
健康な被験者では、最大 300 mg の単回経口イルベサルタン投与により、アンギオテンシン II 注入の昇圧効果が用量依存的に抑制されました。阻害は 150 mg または 300 mg の経口投与の 4 時間後に完全に (100%) なり、部分的な阻害は 24 時間持続しました (300 mg および 150 mg でそれぞれ 60% および 40%)。
高血圧患者では、イルベサルタンの慢性投与後のアンギオテンシン II 受容体阻害により、アンギオテンシン II 血漿濃度が 1.5 倍から 2 倍に上昇し、血漿レニン濃度が 2 倍から 3 倍に上昇します。イルベサルタンの投与後、アルドステロンの血漿中濃度は一般に低下しますが、推奨用量では血清カリウム値に大きな影響はありません。
高血圧患者では、イルベサルタンの長期経口投与 (最大 300 mg) は、糸球体濾過率、腎血漿流量、または濾過画分に影響を与えませんでした。高血圧患者を対象とした複数回投与試験では、空腹時トリグリセリド、総コレステロール、または HDL コレステロール濃度に臨床的に重要な影響はありませんでした。慢性経口投与中の血清尿酸への影響はなく、尿酸の影響もありませんでした。
薬物動態
吸収
イルベサルタンの経口吸収は迅速かつ完全であり、平均絶対バイオアベイラビリティは 60% から 80% です。 AVAPRO の経口投与後、イルベサルタンのピーク血漿濃度は、投与後 1.5 ~ 2 時間で達成されます。食事はイルベサルタンのバイオアベイラビリティーに影響しません。
イルベサルタンは、治療用量範囲にわたって線形の薬物動態を示します。
分布
Irbesartan は 90% が血清タンパク質 (主にアルブミンと α 酸性糖タンパク質) に結合し、血液の細胞成分への結合はごくわずかです。平均流通量は53~93リットル。
動物での研究は、放射性標識イルベサルタンが血液脳関門と胎盤を弱く通過することを示しています。イルベサルタンは、授乳中のラットの乳中に排泄されます。
排除
総血漿および腎クリアランスは、それぞれ 157 ~ 176 mL/min および 3.0 ~ 3.5 mL/min の範囲です。イルベサルタンの終末半減期は平均11~15時間です。定常状態の濃度は 3 日以内に達成されます。イルベサルタンの限られた蓄積 (
代謝
イルベサルタンは、活性型への生体内変化を必要としない経口活性剤です。イルベサルタンは、グルクロニドの抱合と酸化によって代謝されます。 C標識イルベサルタンの経口または静脈内投与後、循環血漿放射能の80%以上が未変化のイルベサルタンに起因します。一次循環代謝産物は、不活性なイルベサルタン グルクロニド抱合体 (約 6%) です。残りの酸化的代謝物は、イルベサルタンの薬理活性にあまり影響を与えません。
インビトロ研究は、イルベサルタンが主に CYP2C9 によって酸化されることを示しています。 CYP3A4 による代謝はごくわずかです。
排泄
イルベサルタンとその代謝物は、胆道と腎臓の両方の経路で排泄されます。 14C 標識イルベサルタンを経口または静脈内投与すると、放射能の約 20% が尿中に回収され、残りはイルベサルタンまたはイルベサルタン グルクロニドとして糞中に回収されます。
特定の集団
セックス
健康な高齢者 (65 ~ 80 歳) または健康な若い (18 ~ 40 歳) の被験者では、薬物動態の性差は観察されません。高血圧患者の研究では、半減期または蓄積に性差はありませんが、イルベサルタンの血漿濃度は女性の方がやや高い (11% ~ 44%) ことが観察されています。性別による用量調節は必要ありません。
老年医学
高齢者 (65 ~ 80 歳) では、イルベサルタン排泄半減期に大きな変化はありませんが、AUC および Cmax 値は、若い被験者 (18 ~ 40 歳) よりも約 20% ~ 50% 大きくなります。高齢者は用量調節の必要はありません。
人種・民族
健康な黒人被験者では、イルベサルタンの AUC 値は白人よりも約 25% 大きくなります。 Cmax 値に違いはありません。
腎障害
イルベサルタンの薬物動態は、腎障害のある患者または血液透析患者では変化しません。イルベサルタンは血液透析では除去されません。軽度から重度の腎機能障害のある患者では、腎機能障害のある患者で容量が枯渇していない限り、投与量の調整は必要ありません。 警告と注意事項 と 投薬と管理 ]。
肝不全
反復経口投与後のイルベサルタンの薬物動態は、軽度から中等度の肝硬変の患者では有意な影響を受けません。肝不全患者では用量調整は必要ありません。
薬物間相互作用
In vitro 研究では、既知のシトクロム CYP2C9 基質/阻害剤であるスルフェナゾール、トルブタミド、およびニフェジピンによる酸化イルベサルタン代謝産物の形成の有意な阻害が示されています。しかし、臨床研究では、ワルファリンの薬力学に対するイルベサルタンの併用の影響はごくわずかでした。 in vitro データに基づくと、代謝がシトクロム P450 アイソザイム 1A1、1A2、2A6、2B6、2D6、2E1、または 3A4 に依存する薬物との相互作用は予想されません。
ワルファリン、ヒドロクロロチアジド、またはジゴキシンの維持用量を投与されている患者の別の研究では、イルベサルタンを 7 日間投与しても、ワルファリンの薬力学 (プロトロンビン時間) またはジゴキシンの薬物動態に影響はありません。イルベサルタンの薬物動態は、ニフェジピンまたはヒドロクロロチアジドの同時投与による影響を受けません。
臨床研究
高血圧症
AVAPRO の降圧効果は、ベースラインの拡張期血圧が 95 ~ 110 mmHg の患者を対象とした 7 つのプラセボ対照 8 ~ 12 週間試験で調べられました。イルベサルタンの用量範囲を十分に調査するために、これらの試験には 1 ~ 900 mg の用量が含まれていました。これらの研究では、150 mg/日での 1 日 1 回または 2 回のレジメンの比較、ピーク効果とトラフ効果の比較、および性別、年齢、および人種による反応の比較が可能になりました。上記の 7 つのプラセボ対照試験のうち 2 つでは、イルベサルタンとヒドロクロロチアジドの併用による降圧効果が調査されました。
イルベサルタン単独療法に関する 7 件の研究には、イルベサルタン (1 ~ 900 mg) に無作為に割り付けられた合計 1915 人の患者と、プラセボに無作為に割り付けられた 611 人の患者が含まれていました。 150 mg と 300 mg の 1 日 1 回投与は、プラセボと比較して、治療の 6 ~ 12 週間後にトラフ効果 (投与後 24 時間) を伴う収縮期および拡張期血圧の統計的および臨床的に有意な低下をもたらしました。それぞれ 5 ~ 6 mmHg と 8 ~ 12/5 ~ 8 mmHg。 300 mg を超える投与量では、効果のさらなる増加は見られませんでした。収縮期圧および拡張期圧への影響の用量反応関係を図 1 および 2 に示します。
図 1: トラフ SeSBP のプラセボを差し引いた減少。統合分析
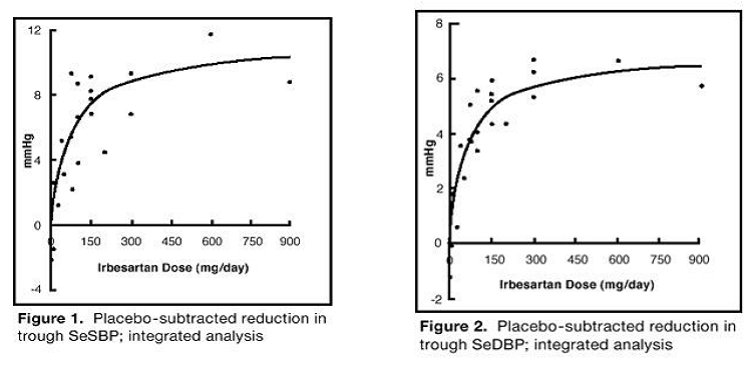
図 2: トラフ SeSBP のプラセボを差し引いた減少。統合分析
治療用量のイルベサルタンを 1 日 1 回投与すると、約 3 ~ 6 時間で効果がピークに達し、ある外来血圧モニタリング研究では、再び約 14 時間で効果が現れました。これは、1 日 1 回投与と 1 日 2 回投与の両方で見られました。収縮期および拡張期反応のトラフ対ピーク比は、一般に 60% から 70% の間でした。継続的な外来血圧モニタリング研究では、150 mg を 1 日 1 回投与すると、同じ 1 日総投与量で 1 日 2 回投与を受けた患者で観察されたものと同様のトラフおよび平均 24 時間応答が得られました。
対照試験では、6.25 mg、12.5 mg、または 25 mg の用量のヒドロクロロチアジドにイルベサルタンを追加すると、同じ単剤療法用量のイルベサルタンで達成されたものと同様の、用量に関連したさらなる血圧低下が生じました。 HCTZ には、ほぼ相加効果もありました。
患者の年齢、性別、および人種のサブグループの分析により、男性と女性、および 65 歳以上と以下の患者は、一般的に同様の反応を示すことが示されました。イルベサルタンは人種に関係なく血圧を下げる効果がありましたが、黒人(通常は低レニン集団)では効果がやや低かった.
irbesartan の効果は最初の投与後に明らかであり、2 週間後に観察された完全な効果に近づいています。 8 週間の曝露の最後に、降圧効果の約 2/3 が、最後の投与から 1 週間後にまだ存在していました。反跳性高血圧は観察されなかった。対照試験では、イルベサルタン治療を受けた患者の平均心拍数に本質的な変化はありませんでした。
2型糖尿病患者における腎症
イルベサルタン糖尿病性腎症試験 (IDNT) は、2 型糖尿病、高血圧 (SeSBP >135 mmHg または SeDBP >85 mmHg)、および腎症 (血清クレアチニンが女性で 1.0 ~ 3.0 mg/dL、男性で 1.2 ~ 3.0 mg/dL、タンパク尿が 900 mg/日以上)。患者は、AVAPRO 75 mg、アムロジピン 2.5 mg、または一致するプラセボを 1 日 1 回投与される群に無作為に割り付けられました。患者は、耐えられるように、維持用量の AVAPRO 300 mg またはアムロジピン 10 mg に漸増されました。すべてのグループの患者の血圧目標(収縮期血圧が 135/85 以下、または収縮期血圧が 160 mmHg を超える場合は 10 mmHg の低下)を達成するために、必要に応じて追加の降圧薬(ACE 阻害薬、アンギオテンシン II 受容体拮抗薬、およびカルシウム チャネル遮断薬を除く)が追加されました。 .
調査対象人口は、男性 66.5%、65 歳未満 72.9%、白人 72% (アジア/太平洋諸島系住民 5.0%、黒人 13.3%、ヒスパニック系 4.8%) でした。平均ベースライン着座収縮期および拡張期血圧は、それぞれ 159 mmHg および 87 mmHg でした。患者は、平均血清クレアチニン 1.7 mg/dL、平均タンパク尿 4144 mg/日で試験に参加しました。
達成された平均血圧は、AVAPRO で 142/77 mmHg、アムロジピンで 142/76 mmHg、プラセボで 145/79 mmHg でした。全体として、患者の 83.0% が 50% 以上の確率でイルベサルタンの目標用量を投与されました。患者は平均2.6年間追跡されました。
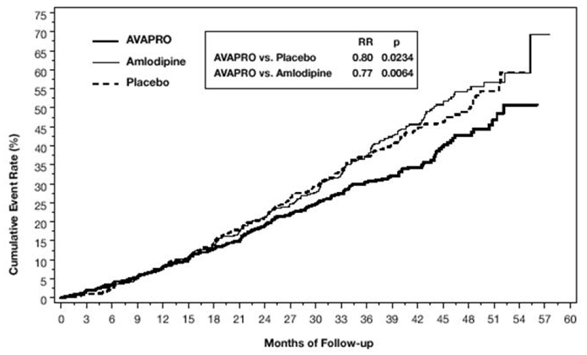
主要な複合エンドポイントは、次のイベントのいずれかが発生するまでの時間でした: ベースラインの血清クレアチニンの倍増、末期腎疾患 (ESRD; 血清クレアチニン≧6 mg/dL、透析、または腎移植によって定義)、または死亡. AVAPRO 150mg による治療は、プラセボに対して 20% のリスク低減をもたらしました (p=0.0234) (図 3 および表 1 を参照)。 AVAPRO 150mg による治療は、別のエンドポイントとして、血清クレアチニンの持続的な 2 倍の発生も減少させましたが (33%)、ESRD のみに有意な影響はなく、全体的な死亡率には影響しませんでした (表 1 を参照)。
図 3: IDNT: 主要評価項目の Kaplan-Meier 推定値 (血清クレアチニンの倍増、末期腎疾患または全死因死亡率)
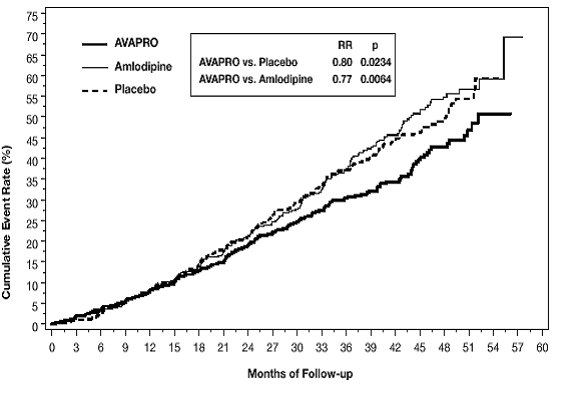
研究の過程でイベントを経験した患者のパーセンテージは、以下の表1で見ることができます:
この研究の副次評価項目は、心血管死亡率と罹患率(心筋梗塞、心不全による入院、永久的な神経障害を伴う脳卒中、切断)の複合でした。これらのエンドポイントでは、治療群間で統計的に有意な差はありませんでした。プラセボと比較して、AVAPRO 150mg はタンパク尿を約 27% 大幅に減少させました。この効果は、治療開始から 3 か月以内に明らかになりました。 AVAPRO は、血清クレアチニン濃度の逆数で測定されるように、腎機能の喪失率 (糸球体濾過率) を 18.2% 大幅に減少させました。
表 2 は、人口統計サブグループの結果を示しています。サブグループ分析は解釈が難しく、これらの観察結果が真の違いを表しているのか偶然の影響を表しているのかは不明です。主要評価項目については、他の降圧薬(アンギオテンシン II 受容体拮抗薬、アンギオテンシン変換酵素阻害薬、およびカルシウム チャネル遮断薬は許可されていません)、経口血糖降下薬、および脂質代謝薬を服用している患者でも、AVAPRO の好ましい効果が見られました。低下剤。
患者情報
妊娠
妊娠可能な年齢の女性患者には、妊娠中の AVAPRO への曝露の影響について助言してください。妊娠を計画している女性と治療の選択肢について話し合います。患者は、できるだけ早く主治医に妊娠を報告するよう求められるべきです。
カリウムサプリメント
AVAPRO の投与を受けている患者には、医療提供者に相談せずにカリウム サプリメントまたはカリウムを含む塩代替物を使用しないようにアドバイスしてください [ 薬物相互作用 ]。
