Aceon 2mg, 4mg, 8mg Perindopril 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Aceon 4mg とは何ですか?
Aceon 8mg は、高血圧 (高血圧) および安定冠動脈疾患 (CAD) の症状を治療するために使用される処方薬です。エーセオンは、単独で、または他の薬と併用して使用できます。
エーセオンは、ACE阻害剤と呼ばれる薬物のクラスに属しています。
Aceon が子供に安全で有効であるかどうかはわかっていません。
Aceon 4mg の副作用の可能性は何ですか?
Aceon は、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 弱点、
- 遅いまたは不規則な心拍、
- 失神、
- 吐き気、
- 嘔吐、
- 食欲減少、
- 腹痛、
- 目や皮膚が黄色くなる(黄疸)
- 暗い尿、および
- 重度のめまい
上記の症状がある場合は、すぐに医療機関を受診してください。
Aceon 2mg の最も一般的な副作用は次のとおりです。
- めまい、
- 立ちくらみ、
- 疲労感と
- 乾いた咳
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Aceon の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
胎児毒性
- 妊娠が検出されたら、できるだけ早くACEON 4mgを中止してください。 警告と注意事項
- レニン-アンギオテンシン系に直接作用する薬は、発育中の胎児に傷害や死亡を引き起こす可能性があります。 警告と注意事項
説明
ACEON® (ペリンドプリル エルブミン) 錠剤には、非スルフヒドリル アンギオテンシン変換酵素 (ACE) 阻害剤のエチルエステルであるペリンドプリルの tert-ブチルアミン塩が含まれています。ペリンドプリルエルブミンは、化学的に (2S,3DS,7DS)-1-[(S)-N-[(S)-1-カルボキシ-ブチル]アラニル]ヘキサヒドロ-2-インドリンカルボン酸、1-エチルエステル、 tert-ブチルアミン (1:1)。その分子式は C19H32N2O5C4H11N です。その構造式は次のとおりです。
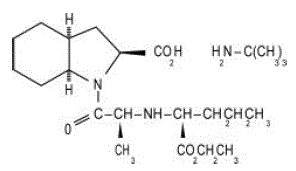
ペリンドプリル エルブミンは、分子量が 368.47 (遊離酸) または 441.61 (塩形態) の白色の結晶性粉末です。水(60% w/w)、アルコール、クロロホルムに溶けやすい。
ペリンドプリルは、ペリンドプリルエルブミンの遊離酸形態であり、プロドラッグであり、生体内でエステル基の加水分解によって代謝され、生物学的に活性な代謝物であるペリンドプリラトを形成します。
ACEON は、経口投与用に 2 mg、4 mg、および 8 mg の強度で入手できます。ペリンドプリル エルブミンに加えて、各錠剤には次の不活性成分が含まれています: コロイダルシリカ (疎水性)、ラクトース、ステアリン酸マグネシウム、微結晶性セルロース。 4 mg と 8 mg の錠剤には、酸化鉄も含まれています。
適応症
高血圧症
ACEON は、本態性高血圧症患者の治療に適応されます。 ACEON は、単独で使用することも、他のクラスの降圧薬、特にサイアザイド系利尿薬と併用することもできます。
安定冠動脈疾患
ACEON 8mg は、安定した冠動脈疾患を有する患者の治療に適応され、心血管死亡または非致死性心筋梗塞のリスクを軽減します。 ACEON は、抗血小板療法、降圧療法、脂質低下療法など、冠動脈疾患の管理のための従来の治療法と併用できます。
投薬と管理
高血圧症
合併症のない高血圧患者への使用
本態性高血圧症の患者では、推奨される初期用量は 1 日 1 回 4 mg です。用量は、必要に応じて、1 日あたり最大 16 mg まで滴定することができます。通常の維持量の範囲は、1 日 1 回または 2 回に分けて 4 mg から 8 mg です。
高齢患者への使用
高齢者のエーセオン 4mg の 1 日開始推奨用量は、1 日 4mg であり、1 回または 2 回に分けて投与されます。 ACEON の使用経験は、8 mg を超える用量の高齢者では限られています。 8 mg を超える用量は、注意深い血圧モニタリングと用量調節を行って投与する必要があります [参照 特定の集団での使用 ]。
利尿剤との併用
現在利尿薬で治療されている患者では、ACEON の初回投与後に症候性低血圧が発生する可能性があります。 ACEON を開始する前に、利尿薬の投与量を減らすことを検討してください [ 薬物相互作用 ]。
安定冠動脈疾患
安定した冠動脈疾患の患者では、ACEON 4mg を 4mg の初期用量で 1 日 1 回 2 週間投与し、その後、忍容性に応じて 1 日 1 回 8mg の維持用量まで増量する必要があります。高齢患者(70 歳以上)の場合、ACEON は最初の 1 週間は 2 mg を 1 日 1 回、2 週目は 4 mg を 1 日 1 回、耐えられる場合は維持量として 8 mg を 1 日 1 回投与する必要があります。
腎障害および透析における用量調整
ペリンドプリラトの排泄は、腎障害のある患者では減少します。 ACEON は、クレアチニンクリアランスが 30 mL/min 未満の患者には推奨されません。障害の程度がより低い患者の場合、初回投与量は 2 mg/日とし、投与量は 8 mg/日を超えてはなりません。透析中、ペリンドプリルは腎機能が正常な患者と同じクリアランスで除去されます。
供給方法
剤形と強度
錠剤は長方形で、片側にスコアがあります。
2 mg の錠剤は白色で、切り目を入れていない側に「ACN 2」と刻印されています。
4 mg 錠剤はピンク色で、スコアのない側に「ACN 4」と刻印されています。
8 mg 錠剤はサーモンで、スコアのない面に「ACN 8」とデボス加工されています。
保管と取り扱い
錠剤は長方形で、片側にスコアがあります。
子供の手の届かないところに保管してください。
20°~25°C (68°~77°F) に制御された室温で保管してください [USP を参照]。湿気から保護してください。
詳細については、医療通信部門のフリーダイヤル 888-985-7657 までお問い合わせください。
製造元: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 USA.改訂: 2017 年 9 月
副作用
臨床試験はさまざまな条件下で実施されるため、ある薬剤の臨床試験で観察された有害事象の発生率を別の薬剤の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
臨床試験の経験
次の有害反応は、ラベルの他の場所で説明されています。
- 血管性浮腫を含むアナフィラキシー様反応[参照 警告と注意事項 ]
- 低血圧 [参照 警告と注意事項 ]
- 好中球減少症および無顆粒球症 [参照 警告と注意事項 ]
- 腎機能障害[参照 警告と注意事項 ]
- 高カリウム血症 [参照 警告と注意事項 ]
- 咳 [参照 警告と注意事項 ]
高血圧症
ACEON 4mg は、米国および海外の臨床試験において約 3,400 人の高血圧患者を対象に安全性が評価されています。ここに示されているデータは、米国の臨床試験に参加した 1,417 人の ACON 治療を受けた患者の結果に基づいています。これらの患者のうち 220 人以上が、少なくとも 1 年間、ACEON® (ペリンドプリル エルブミン) で治療されました。
プラセボ対照の米国臨床試験では、有害事象による治療の早期中止の発生率は、ACEON 2 mg で治療された患者で 6.5%、プラセボで治療された患者で 6.7% でした。最も一般的な原因は、咳、頭痛、無力症、めまいでした。
プラセボ対照米国試験の 1,012 人の患者のうち、報告された有害事象の全体的な頻度は、ACEON で治療された患者とプラセボで治療された患者で類似していました (各グループで約 75%)。 ACEON 4mg の発生率がプラセボよりも 2% 以上高い唯一の有害事象は、咳 (12% 対 4.5%) と背部痛 (5.8% 対 3.1%) でした。
めまいは、プラセボ群(8.5%)よりもペリンドプリル群(8.2%)で頻繁に報告されませんでしたが、その可能性は用量とともに増加し、ペリンドプリルとの因果関係が示唆されました.
安定冠動脈疾患
ペリンドプリルは、安定した冠状動脈疾患の患者 12,218 人を対象とした二重盲検プラセボ対照試験である EUROPA で安全性が評価されています。全体的な中止率は、薬剤とプラセボで約 22% でした。プラセボよりもペリンドプリルでより頻繁に見られた中止の最も一般的な医学的理由は、咳、薬物不耐症、および低血圧でした.
市販後の経験
ACEON 8mg との因果関係が不明であり、ACEON を服用している患者の有害事象の自発的な報告には、市場導入以降に次のようなものがあります。腎不全、腎炎、肝不全、黄疸(肝細胞または胆汁うっ滞)、症候性低ナトリウム血症、水疱性類天疱瘡、天疱瘡、急性膵炎、転倒、乾癬、剥脱性皮膚炎、および以下を含む症候群:関節痛/関節炎、血管炎、漿膜炎、筋肉痛、発熱、発疹またはその他の皮膚症状、陽性の抗核抗体 (ANA)、白血球増加症、好酸球増加症、または赤血球沈降速度 (ESR) の上昇。
臨床検査結果
血液学
ヘモグロビンとヘマトクリットのわずかな減少は、ACEON 8mg で治療された高血圧患者で頻繁に発生しますが、臨床的に重要になることはめったにありません。対照臨床試験では、貧血を発症したために治療を中止した患者はいませんでした。白血球減少症 (好中球減少症を含む) は、米国の臨床試験で 0.1% の患者で観察された [参照 警告と注意事項 ]。
肝機能検査
ALT(ACEON 1.6% vs プラセボ 0.9%)および AST(ACEON 2mg 0.5% vs プラセボ 0.4%)の上昇が、プラセボ対照臨床試験で観察されています。上昇は一般に軽度で一過性であり、治療の中止後に解消されました。
薬物相互作用
利尿薬
利尿薬を服用している患者、特に最近開始した患者は、ACEON 治療の開始後に過度の血圧低下を経験することがあります。降圧効果の可能性は、ペリンドプリルによる治療を開始する前に、利尿薬の用量を減らすか中止するか、塩分摂取量を増やすことで最小限に抑えることができます。利尿薬療法を変更できない場合は、ACEON の初回投与時に少なくとも 2 時間、血圧がさらに 1 時間安定するまで綿密な医学的監督を行ってください。 警告と注意事項 ]。
ペリンドプリルの吸収と排泄の速度と程度は、併用利尿薬の影響を受けません。しかし、ペリンドプリラートのバイオアベイラビリティは利尿薬によって低下し、これは血漿 ACE 阻害の低下と関連していました。
カリウムサプリメントとカリウム保持性利尿薬
ACEON 8mg は、アルドステロン産生を減少させる可能性があるため、血清カリウムを増加させる可能性があります。カリウム保持利尿薬(スピロノラクトン、アミロライド、トリアムテレンなど)、カリウムサプリメント、または血清カリウムを増加させる他の薬(インドメタシン、ヘパリン、シクロスポリンなど)の使用は、高カリウム血症のリスクを高める可能性があります。したがって、そのような薬剤の併用が必要な場合は、患者の血清カリウムを頻繁に監視してください。
リチウム
リチウムと ACE 阻害薬の併用療法を受けている患者では、血清リチウムの上昇とリチウム毒性の症状が報告されています。血清リチウム濃度を頻繁にモニタリングすることをお勧めします。利尿薬を使用すると、リチウム中毒のリスクがさらに高まる可能性があります。
金
ニトリトイド反応(顔面紅潮、吐き気、嘔吐、低血圧などの症状)は、注射可能な金(金チオリンゴ酸ナトリウム)およびACEONを含む併用ACE阻害剤療法を受けている患者でまれに報告されています。
ジゴキシン
制御された薬物動態研究では、ACEON と同時投与した場合、血漿ジゴキシン濃度に影響がないことが示されていますが、ペリンドプリル/ペリンドプリラトの血漿濃度に対するジゴキシンの影響は除外されていません。
ゲンタマイシン
動物データは、ペリンドプリルとゲンタマイシン間の相互作用の可能性を示唆しています。ただし、これは人間の研究では調査されていません。
選択的シクロオキシゲナーゼ-2阻害剤(COX-2阻害剤)を含む非ステロイド性抗炎症剤
高齢者、体液量が減少している患者(利尿薬治療中の患者を含む)、または腎機能が低下している患者では、選択的 COX-2 阻害剤を含む NSAID とペリンドプリルを含む ACE 阻害剤を併用すると、腎機能が低下する可能性があります。 、可能性のある急性腎不全を含む。これらの影響は通常可逆的です。ペリンドプリルと NSAID 療法を受けている患者では、腎機能を定期的にモニタリングしてください。
ペリンドプリルを含む ACE 阻害剤の降圧効果は、選択的 COX-2 阻害剤を含む NSAID によって減弱される可能性があります。
レニン-アンジオテンシン系 (RAS) の二重遮断
アンジオテンシン受容体遮断薬、ACE 阻害薬、またはアリスキレンによる RAS の二重遮断は、単剤療法と比較して、低血圧、高カリウム血症、および腎機能の変化 (急性腎不全を含む) のリスクの増加と関連しています。 2 種類の RAS 阻害剤を組み合わせて投与されているほとんどの患者は、単剤療法と比較して追加の利益を得ることはありません。 RAS阻害剤との併用は原則として避けてください。 ACEON 2mg および RAS に影響を与える他の薬剤を服用している患者の血圧、腎機能、および電解質を注意深く監視します。
糖尿病患者にアリスキレンとACEON 8mgを併用しないでください。腎障害のある患者(GFR
mTOR阻害剤
mTOR(ラパマイシンの哺乳類標的)阻害剤療法を併用している患者は、血管性浮腫のリスクが高くなる可能性があります[参照 警告と注意事項 ]。
ネプリライシン阻害剤
ネプリライシン阻害剤を併用している患者は、血管性浮腫のリスクが高くなる可能性があります。 [見る 警告と注意事項 ]
警告
の一部として含まれています "予防" セクション
予防
アナフィラキシーおよびおそらく関連する反応
おそらく、アンギオテンシン変換酵素阻害剤は、内因性ブラジキニンを含むエイコサノイドおよびポリペプチドの代謝に影響を与えるため、ACE阻害剤(ACEONを含む)を投与されている患者は、さまざまな有害事象にさらされる可能性があり、その中には深刻なものもあります. ACE阻害薬を投与されている黒人患者は、非黒人と比較して血管性浮腫の発生率が高くなります。
頭頸部血管性浮腫
顔面、四肢、唇、舌、声門、または喉頭の血管性浮腫が、ACEON を含む ACE 阻害剤で治療された患者で報告されています (米国の臨床試験では、ACEON で治療された患者の 0.1%)。舌、声門、または喉頭の関与に関連する血管性浮腫は、致命的となる可能性があります。このような場合は、すぐにACEONの使用を中止し、腫れが引くまで観察してください。舌、声門、または喉頭の関与が気道閉塞を引き起こす可能性があると思われる場合は、1:1000 (0.3 ~ 0.5 mL) のエピネフリン溶液を皮下に投与するなどの適切な治療を速やかに行います。
mTOR阻害剤(例、テムシロリムス)療法またはネプリライシン阻害剤を併用している患者は、血管性浮腫のリスクが高くなる可能性がある[参照 薬物相互作用 ]。
腸血管性浮腫
ACE阻害薬で治療された患者では、腸の血管性浮腫が報告されています。これらの患者は、腹痛(吐き気や嘔吐の有無にかかわらず)を呈しました。場合によっては、顔面血管浮腫の既往がなく、C-1エステラーゼレベルが正常でした.血管性浮腫は、腹部 CT スキャンや超音波などの手順、または手術で診断され、ACE 阻害薬の中止後に症状は解消しました。腸管浮腫は、腹痛を呈する ACE 阻害薬を服用している患者の鑑別診断に含めるべきです。
低血圧
ACEON 4mg は、症候性低血圧を引き起こす可能性があります。 ACEON は、米国のプラセボ対照試験で合併症のない高血圧患者の 0.3% で低血圧と関連付けられています。起立性低血圧に関連する症状は、別の 0.8% の患者で報告されました。
症候性低血圧は、長期にわたる利尿療法、食事の塩分制限、透析、下痢または嘔吐の結果として、体液量または塩分が枯渇した患者で発生する可能性が最も高い[参照. 投薬と管理 ]。
ACE阻害薬は過度の低血圧を引き起こす可能性があり、乏尿または高窒素血症と関連している可能性があり、まれに急性腎不全および死亡に関連している可能性があります.虚血性心疾患や脳血管疾患の患者さんでは、血圧が過度に低下すると、心筋梗塞や脳血管障害を引き起こす可能性があります。
過度の低血圧のリスクがある患者では、ACEON 療法は綿密な医学的監督の下で開始する必要があります。患者は、治療の最初の 2 週間と、ACEON 2mg および/または利尿薬の用量が増加するたびに、綿密に追跡する必要があります。
過度の低血圧が発生した場合は、患者をすぐに仰臥位にし、必要に応じて生理食塩水の静脈内注入で治療する必要があります。通常、ACEON 4mg の治療は、体量と血圧が回復した後に継続できます。

好中球減少症/無顆粒球症
ACE阻害薬は無顆粒球症および骨髄抑制と関連しており、腎機能障害のある患者、特に全身性エリテマトーデスまたは強皮症などのコラーゲン血管疾患の患者に最も頻繁に関連しています。
胎児毒性
妊娠カテゴリーD
妊娠第 2 期および第 3 期にレニン-アンギオテンシン系に作用する薬剤を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。結果として生じる羊水過少症は、胎児の肺形成不全および骨格の変形に関連している可能性があります。潜在的な新生児の副作用には、頭蓋形成不全、無尿症、低血圧、腎不全、および死亡が含まれます。妊娠が検出されたら、できるだけ早くACEON 4mgを中止してください[ 特定の集団での使用 ]。
腎機能障害
レニン-アンギオテンシン-アルドステロン系の阻害の結果として、感受性のある個人では腎機能の変化が予想される場合があります。 ACEON を投与されている患者では、腎機能を定期的にモニタリングする必要があります [参照 投薬と管理 ]、 [見る 薬物相互作用 ]。
腎機能がレニン-アンギオテンシナルドステロン系の活性に依存している重度のうっ血性心不全の患者では、ACEON を含む ACE 阻害剤による治療は、乏尿、進行性高窒素血症、まれに急性腎不全および死亡に関連している可能性があります。
片側または両側の腎動脈狭窄を伴う高血圧患者では、血中尿素窒素および血清クレアチニンの増加が起こることがあります。通常はACE阻害薬を中止すると元に戻ります。そのような患者では、治療の最初の数週間は腎機能を監視する必要があります。
一部のACEON治療患者は、特に利尿薬を併用治療している患者で、血中尿素窒素と血清クレアチニンの軽度かつ一時的な増加を発症しました.
高カリウム血症
血清カリウムの上昇は、ACEON を含む ACE 阻害剤で治療された一部の患者で観察されています。ほとんどの症例は、臨床的に関連性がないと思われる孤立した単一の値であり、離脱の原因となることはめったにありませんでした。高カリウム血症を発症する危険因子には、腎機能不全、真性糖尿病、およびカリウム保持性利尿薬、カリウム サプリメント、および/またはカリウム含有塩代替物などの薬剤の併用が含まれます。 薬物相互作用 ]。
ACEON を投与されている患者では、血清カリウムを定期的に監視する必要があります。
咳
おそらく、内因性ブラジキニンの分解が阻害されるため、すべての ACE 阻害剤で持続性の非生産性の咳が報告されており、通常は治療の中止後に解消します。咳の鑑別診断では、ACE阻害薬による咳を考慮してください。
肝不全
まれに、ACE阻害薬が、胆汁うっ滞性黄疸から始まり、劇症肝壊死に進行し、時には死に至る症候群と関連している.この症候群のメカニズムは理解されていません。黄疸または肝酵素の著しい上昇を発症するACE阻害薬を投与されている患者は、ACE阻害薬を中止し、適切な医学的フォローアップを受ける必要があります。
手術・麻酔
手術を受けている患者、または低血圧を引き起こす薬剤による麻酔中の患者では、ACEON は代償性レニン放出に続発するアンギオテンシン II 形成をブロックする可能性があります。このメカニズムに起因する低血圧は、ボリューム拡張によって修正できます。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん性
ペリンドプリルを最大で提案された臨床用量 (16 mg/日) の最大 20 倍 (mg/kg) または 2 から 4 倍 (mg/m2) の用量で投与した場合、ラットおよびマウスの研究で発がん性の影響の証拠は観察されませんでした。 104週。
突然変異誘発
Ames 試験、Saccharomyces cerevisiae D4 試験、培養ヒトリンパ球、TK ± マウスリンパ腫試験、マウスおよびラットの小核試験、チャイニーズハムスターを含むさまざまな in vitro および in vivo 試験において、ACEON、ペリンドプリラートおよびその他の代謝物について遺伝毒性の可能性は検出されませんでした。骨髄アッセイ。
生殖能力の障害
オスの精子形成期または卵形成および妊娠期に、ACEON 2mg の提案された最大臨床用量の 30 倍 (mg/kg) または 6 倍 (mg/m2) まで与えられたラットの生殖能力または受胎能に有意な影響はありませんでした。女性で。
特定の集団での使用
妊娠
妊娠カテゴリーD [参照 ボックス警告 と 警告と注意事項 ]。
妊娠第 2 期および第 3 期にレニン-アンギオテンシン系に作用する薬剤を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。結果として生じる羊水過少症は、胎児の肺形成不全および骨格の変形に関連している可能性があります。潜在的な新生児の副作用には、頭蓋形成不全、無尿症、低血圧、腎不全、および死亡が含まれます。妊娠が判明したら、できるだけ早くACEONを中止してください。これらの有害な結果は、通常、妊娠の第 2 および第 3 期におけるこれらの薬物の使用に関連しています。妊娠初期に降圧薬の使用にさらされた後の胎児の異常を調べるほとんどの疫学研究では、レニン-アンギオテンシン系に影響を与える薬物を他の降圧薬と区別していません。
妊娠中の母親の高血圧を適切に管理することは、母親と胎児の両方の転帰を最適化するために重要です。
特定の患者のレニン-アンギオテンシン系に影響を与える薬物による治療に代わる適切な方法がないという異常なケースでは、母親に胎児への潜在的なリスクについて知らせてください。羊膜内環境を評価するためにシリアル超音波検査を実行します。羊水過少症が観察された場合は、母親の命を救うと考えられる場合を除き、ACEON 2mg の投与を中止してください。妊娠週に基づいて、胎児検査が適切な場合があります。ただし、患者と医師は、胎児が不可逆的な損傷を受けるまで羊水過少症が現れない可能性があることに注意する必要があります。低血圧、乏尿、および高カリウム血症のために子宮内でACEONに暴露したことのある乳児を注意深く観察する[参照 小児用 ]。
妊娠ラットに 14C-ペリンドプリルを投与すると、胎児に放射能が検出された。
授乳中の母親
14C-ペリンドプリル投与後、授乳中のラットの乳汁には放射能が含まれていた。ペリンドプリルが母乳に分泌されるかどうかはわかっていません。多くの薬物が母乳中に分泌されるため、ACEON を授乳中の母親に投与する場合は注意が必要です。
小児用
ACEON への子宮内曝露歴のある新生児
乏尿または低血圧が発生した場合は、血圧および腎灌流のサポートに注意を向けてください。交換輸血または透析は、低血圧の逆転および/または障害のある腎機能の代替手段として必要になる場合があります。胎盤を通過するペリンドプリルは、理論的にはこれらの手段によって新生児の循環から除去できますが、限られた経験では、そのような除去がこれらの乳児の治療の中心であることは示されていません.
小児患者におけるACEON 8mgの安全性と有効性は確立されていません。
高齢者の使用
ペリンドプリルの平均血圧効果は、有意差はありませんでしたが、60歳以上の患者では若い患者よりもやや小さかった.ペリンドプリルとペリンドプリラトの両方の血漿濃度は、若い患者の濃度と比較して、高齢の患者で増加しました。めまいと場合によっては発疹を除いて、年配の患者で明らかな悪影響はありませんでした。
低用量から開始し、必要に応じてゆっくりと滴定してください。転倒の可能性があるため、めまいに注意してください。
8 mg を超える 1 日用量で高齢患者に ACON 8 mg を使用した経験は限られています。
腎障害
腎障害患者では投与量の調整が必要な場合がある [参照 投薬と管理 と 臨床薬理学 ]。
肝障害
ペリンドプリラトのバイオアベイラビリティは、肝機能障害のある患者で増加します[参照 臨床薬理学 ]。
過剰摂取
動物では、マウスで 2,500 mg/kg、ラットで 3,000 mg/kg、イヌで 1,600 mg/kg までのペリンドプリルの用量は非致死的でした。過去の経験はほとんどありませんでしたが、他の ACE 阻害剤の過剰摂取も人間にかなりよく許容されることを示唆していました。最も可能性の高い症状は低血圧であり、治療は対症療法的で支持的なものでなければなりません。 ACE阻害薬による治療を中止し、患者を観察する必要があります。脱水、電解質の不均衡、および低血圧は、確立された手順で治療する必要があります。
報告されたペリンドプリルの過剰摂取の症例の中で、80mgから120mgの用量を摂取したことが知られている患者は、補助換気と循環補助を必要としました.さらに 1 人の患者が、最大 180 mg のペリンドプリルを摂取した後、低体温症、循環停止を発症し、死亡しました。ペリンドプリルの過剰摂取に対する介入には、積極的なサポートが必要な場合があります。
ペリンドプリルとその代謝物の血清レベルの実験室での測定は広く利用可能ではなく、そのような測定は、いずれにせよ、ペリンドプリルの過剰摂取の管理において確立された役割を持っていません.
ペリンドプリルとその代謝産物の排出を促進する可能性のある生理学的操作 (例、尿の pH を変化させる操作) を示唆するデータは入手できません。ペリンドプリルは血液透析で除去でき、ペリンドプリルのクリアランスは 52 mL/分、ペリンドプリラトのクリアランスは 67 mL/分です。
アンギオテンシン II はおそらく、ペリンドプリルの過剰摂取の解決において特定のアンタゴニスト - 解毒剤として機能する可能性がありますが、アンギオテンシン II は、散在する研究施設の外では本質的に利用できません。ペリンドプリルの降圧効果は血管拡張と効果的な循環血液量減少によって達成されるため、通常の生理食塩水の注入によってペリンドプリルの過剰摂取を治療することは合理的です.
禁忌
ACEON® (ペリンドプリル エルブミン) は、この製品または他の ACE 阻害剤に対して過敏症 (血管性浮腫を含む) であることが知られている患者には禁忌です。 ACEON 4mg は、遺伝性または特発性の血管性浮腫の患者にも禁忌です。
糖尿病患者にアリスキレンとACEONを併用しないでください。 [見る 薬物相互作用 ]
ACEON は、ネプリライシン阻害剤(例、サクビトリル)との併用は禁忌です。ネプリライシン阻害剤であるサクビトリル/バルサルタンへの切り替えから 36 時間以内に、ACEON 8mg を投与しないでください。 警告と注意事項 ]。
臨床薬理学
作用機序
ACEON® (ペリンドプリル エルブミン) は、人間や動物の ACE を阻害するペリンドプリラトのプロドラッグです。ペリンドプリラトが血圧を下げるメカニズムは、主にACE活性の阻害であると考えられています。 ACEは、不活性なデカペプチドであるアンギオテンシンIから血管収縮剤であるアンギオテンシンIIへの変換を触媒するペプチジルジペプチダーゼです。アンギオテンシン II は強力な末梢血管収縮剤であり、副腎皮質によるアルドステロン分泌を刺激し、レニン分泌に負のフィードバックを提供します。 ACE の阻害は、血漿アンギオテンシン II の減少をもたらし、血管収縮の減少、血漿レニン活性の増加、およびアルドステロン分泌の減少をもたらします。後者は利尿とナトリウム利尿をもたらし、血清カリウムのわずかな増加と関連している可能性があります。
ACEは、ブラジキニンを分解する酵素であるキニナーゼIIと同一です。強力な血管抑制ペプチドであるブラジキニンのレベルの上昇が、ACEON 4mg の治療効果に関与しているかどうかは、まだ解明されていません。
血圧低下におけるペリンドプリルの主な機序は、レニン-アンギオテンシナルドステロン系によるものと考えられていますが、ACE阻害剤は明らかな低レニン高血圧にもある程度の効果があります。ペリンドプリルは、比較的少数の黒人患者、通常は低レニン集団で研究されており、ペリンドプリルに対する拡張期血圧の平均反応は、非黒人患者で見られる反応の約半分であり、他の ACE 阻害剤の以前の経験と一致する結果でした。
薬力学
ペリンドプリルの投与後、ACE は投与量と血中濃度に関連する形で阻害され、8 mg で達成される 80 ~ 90% の最大阻害は 10 ~ 12 時間持続します。これらの投与後、24時間のACE阻害は約60%である。所定の用量で達成される ACE 阻害の程度は、時間の経過とともに減少するようです (ID50 は増加します)。アンギオテンシン I 注入に対する昇圧反応はペリンドプリルによって減少しますが、この効果は ACE に対する効果ほど持続的ではありません。 12 mg の投与後 24 時間で約 35% の阻害があります。
薬物動態
吸収
ACEON を経口投与すると、約 1 時間後に血漿濃度がピークに達します。ペリンドプリルの絶対的な経口バイオアベイラビリティは約 75% です。吸収後、全身で利用可能なペリンドプリルの約 30 ~ 50% が加水分解されて、その活性代謝物であるペリンドプリラトが生成されます。ペリンドプリラトの平均生物学的利用能は約 25% です。ペリンドプリラトのピーク血漿濃度は、ペリンドプリル投与後 3 ~ 7 時間で達成されます。 ACEON 8mg を食事と一緒に経口投与しても、絶食状態と比べてペリンドプリルの吸収率や程度が大幅に低下することはありません。しかし、ペリンドプリルから活性代謝物であるペリンドプリラートへの生体内変換の程度は約 43% 減少し、その結果、血漿 ACE 阻害曲線が約 20% 減少し、おそらく臨床的に重要ではありません。臨床試験では、ペリンドプリルは一般的に非絶食状態で投与されました。
ACEON の 4 mg、8 mg、および 16 mg の用量では、ペリンドプリルおよびペリンドプリラトの Cmax および AUC は、単回経口投与後および 1 日 1 回の複数回投与レジメン中の定常状態の両方で、用量に比例して増加します。
分布
循環ペリンドプリルの約 60% が血漿タンパク質に結合しており、ペリンドプリラトの 10 ~ 20% のみが結合しています。したがって、タンパク質結合への影響を介した薬物相互作用は予想されません。
代謝と排泄
経口投与後、ペリンドプリルは深部組織コンパートメント (ACE 結合部位) を含むマルチコンパートメント薬物動態を示します。ほとんどの排泄に関連するペリンドプリルの平均半減期は、約 0.8 ~ 1 時間です。
ペリンドプリルは、経口投与後に広範囲に代謝され、尿中に未変化のまま回収されるのは投与量の 4 ~ 12% のみです。脱水による加水分解、グルクロン酸抱合および環化から生じる6つの代謝産物が同定されています。これらには、活性ACE阻害剤、ペリンドプリラート(加水分解ペリンドプリラート)、ペリンドプリルおよびペリンドプリラートグルクロニド、脱水ペリンドプリルおよび脱水ペリンドプリラートのジアステレオ異性体が含まれる。ヒトでは、肝臓のエステラーゼがペリンドプリルの加水分解に関与しているようです。
活性代謝物であるペリンドプリラトも、ACEON の経口投与後にマルチコンパートメントの薬物動態を示します。ペリンドプリラートの形成は緩やかで、血漿中濃度のピークは 3 時間から 7 時間の間に発生します。その後の血漿濃度の低下は、血漿/組織 ACE 結合からのペリンドプリラトの解離が遅いため、30 から 120 時間の延長された最終排出半減期を伴う、3 から 10 時間の明らかな平均半減期を示します。サイト。ペリンドプリルを 1 日 1 回繰り返し経口投与すると、ペリンドプリラートは約 1.5 ~ 2 倍蓄積し、3 ~ 6 日で定常状態の血漿レベルに達します。ペリンドプリラトとその代謝産物のクリアランスは、ほぼ独占的に腎臓で行われます。
お年寄り
高齢患者(70 歳以上)のペリンドプリルとペリンドプリラトの両方の血漿中濃度は、ペリンドプリルからペリンドプリラトへの変換の増加とペリンドプリラトの腎排泄の減少の両方を反映して、若い患者で観察される濃度の約 2 倍です。 投薬と管理 と 特定の集団での使用 ]。
心不全
うっ血性心不全患者ではペリンドプリラトのクリアランスが低下し、投与間隔 AUC が 40% 高くなります。
腎障害
2mgから4mgのペリンドプリル用量では、ペリンドプリラトのAUCは腎機能の低下とともに増加します。クレアチニンクリアランスが 30 ~ 80 mL/min の場合、AUC は 100 mL/min の場合の約 2 倍になります。クレアチニン クリアランスが 30 mL/min を下回ると、AUC はより顕著に増加します。
研究された限られた数の患者では、透析によるペリンドプリルクリアランスは約40~80 mL/minの範囲でした。透析によるペリンドプリラトのクリアランスは、約 40 ~ 90 mL/min の範囲でした。 投薬と管理 ]。
肝障害
ペリンドプリラトのバイオアベイラビリティは、肝機能障害のある患者で増加します。肝機能障害患者のペリンドプリラートの血漿中濃度は、健常者や肝機能が正常な高血圧患者よりも約 50% 高かった。
臨床研究
高血圧症
平均血圧が約 150/100 mm Hg の患者を対象としたペリンドプリル単剤療法 (2 mg から 16 mg を 1 日 1 回) のプラセボ対照研究では、2 mg ではほとんど効果がありませんでしたが、4 mg から 16 mg の用量では血圧が低下しました。 8 mg と 16 mg の投与量は区別がつかず、どちらも 4 mg の投与量よりも大きな効果がありました。これらの研究では、1 日あたり 8 mg および 16 mg の用量で、仰臥位のトラフ血圧が 9 ~ 15/5 ~ 6 mm Hg 低下しました。 1日1回と1日2回の投薬を比較すると、1日2回の投薬レジメンが一般にわずかに優れていたが、約0.5mmHg~1mmHg以下であった。ペリンドプリルの 2 mg から 16 mg の投与後、トラフ平均収縮期および拡張期血圧効果は、ピーク効果の約 75 から 100% でした。
血圧に対するペリンドプリルの効果は、単独で与えられた場合と 25 mg のヒドロクロロチアジドのバックグラウンドで与えられた場合で同様でした。
ACEON® (ペリンドプリル エルブミン) の正式な相互作用研究は、チアジド系以外の降圧剤とは実施されていません。 ACEON 2mg をカルシウム チャネル遮断薬、ループ利尿薬、または 3 剤療法 (ベータ遮断薬、血管拡張薬、利尿薬) と併用投与した対照試験および非対照試験の限られた経験では、予想外の相互作用は示唆されていません。一般に、ベータアドレナリン遮断薬と一緒に与えられた場合、ACE阻害薬は相加効果よりも少ない効果しか持たない.
インスリン依存性糖尿病患者を対象とした管理されていない研究では、ペリンドプリルは血糖コントロールに影響を与えないようでした.長期使用では、これらの患者の尿タンパク排泄への影響は見られませんでした。
ACEON 4mg の有効性は性別の影響を受けず、黒人患者では非黒人患者よりも効果が低かった.高齢患者 (60 歳以上) では、有意差はありませんでしたが、平均血圧への影響は若年患者よりもやや小さくなりました。
安定冠動脈疾患
安定冠動脈疾患におけるペリンドプリルによる心臓イベントの減少に関するヨーロッパの試験 (EUROPA) は、臨床的心不全を伴わない安定冠動脈疾患の証拠を有する 12,218 人の患者を対象に実施された、多施設、無作為化、二重盲検、およびプラセボ対照試験です。 -患者は、スクリーニングの3か月以上前の心筋梗塞、スクリーニングの6か月以上前の冠動脈血行再建術、血管造影による狭窄の証拠(1つ以上の主要な冠動脈の少なくとも70%の狭窄)、または正のストレスによって記録された冠動脈疾患の証拠を持っていました胸痛の病歴のある男性でテストします。すべての患者が 2 ~ 8 mg のペリンドプリルを投与される 4 週間の慣らし期間の後、患者は 1 日 1 回のペリンドプリル 8 mg (n=6,110) または一致するプラセボ (n=6,108) に無作為に割り当てられました。平均追跡期間は 4.2 年でした。この研究では、安定冠動脈疾患患者の心血管死亡率、致命的でない心筋梗塞、または心停止の最初のイベントまでの時間に対するペリンドプリルの長期的な影響を調べました。
患者の平均年齢は 60 歳でした。 85%が男性、92%が血小板阻害薬、63%がβ遮断薬、56%が脂質低下療法を受けていました。 EUROPA 研究では、ペリンドプリルが主要エンドポイントのイベントの相対リスクを大幅に低下させることが示されました (表 1)。この有益な効果は、致命的ではない心筋梗塞のリスクの減少に大きく起因しています。一次転帰に対するペリンドプリルのこの有益な効果は、約 1 年間の治療後に明らかでした (図 1)。結果は、年齢、基礎疾患、または併用薬によって事前に定義されたすべてのサブグループで同様でした (図 2)。
図 1. 主要エンドポイントの最初の発生までの時間 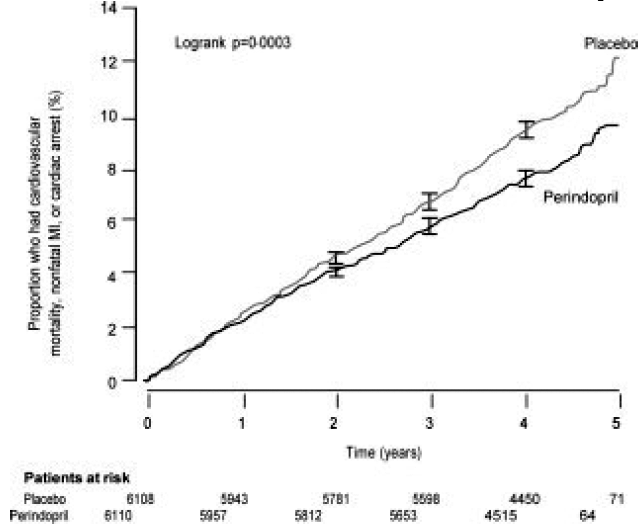
図 2. 事前定義されたサブグループにおける主要評価項目に対するペリンドプリル治療の有益な効果 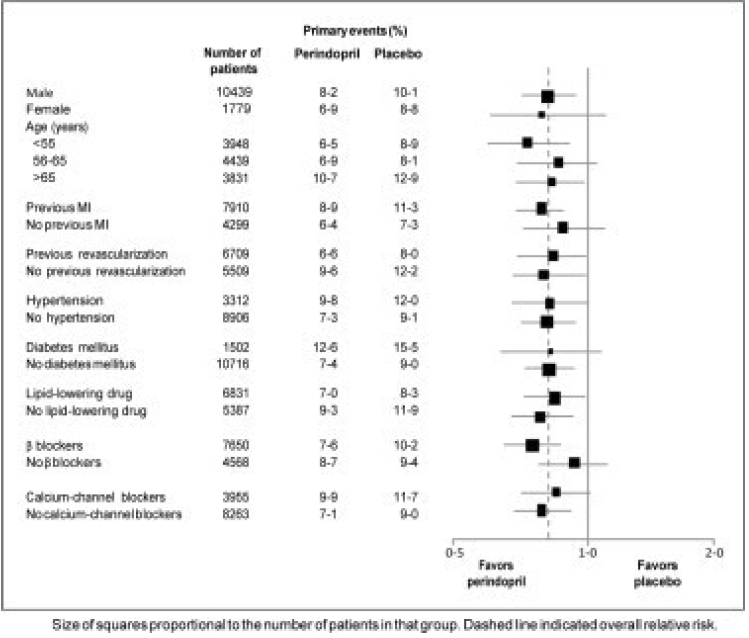
患者情報
妊娠可能年齢の女性患者は、妊娠中のACEON 2mgへの曝露の影響について説明する必要があります.妊娠を計画している女性と治療の選択肢について話し合います。患者は、できるだけ早く主治医に妊娠を報告するよう求められるべきです。
好中球減少症の徴候である可能性のある感染の徴候(例、喉の痛み、発熱)を速やかに報告するよう患者に伝えます。
