Vasotec 2.5mg, 5mg, 10mg Enalapril 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Vasotec とは何ですか? また、どのように使用されますか?
Vasotec は、高血圧 (高血圧)、左心室機能障害、およびうっ血性心不全の症状を治療するために使用される処方薬です。 Vasotec は、単独で使用することも、他の薬と併用することもできます。
- Vasotec は、ACE 阻害剤と呼ばれる薬物のクラスに属します。
- Vasotec が生後 1 か月未満の子供に安全で効果的であるかどうかは不明です。
Vasotec 2.5mg の副作用の可能性は何ですか?
Vasotec 2.5mg は、次のような深刻な副作用を引き起こす可能性があります。
- 立ちくらみ、
- 胸痛、
- 皮膚や目の黄変(黄疸)、
- 排尿がほとんどまたはまったくない、
- 熱、
- 寒気、
- 喉の痛み、
- 吐き気、
- 弱点、
- ピリピリ感、
- 不規則な心拍、および
- 動きの喪失
上記の症状がある場合は、すぐに医療機関を受診してください。
Vasotec の最も一般的な副作用は次のとおりです。
- めまい、
- 疲労感と
- 立ちくらみ
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Vasotec の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
胎児毒性
- 妊娠が検出されたら、できるだけ早く VASOTEC® を中止してください。
- レニン-アンギオテンシン系に直接作用する薬は、発育中の胎児に傷害や死亡を引き起こす可能性があります。警告を参照してください: 胎児毒性
説明
VASOTEC® (マレイン酸エナラプリル) は、長時間作用型アンギオテンシン変換酵素阻害剤であるエナラプリラトのエチルエステルであるエナラプリルのマレイン酸塩です。マレイン酸エナラプリルは、化学的に (S)-1[N-[1-(エトキシカルボニル)-3-フェニルプロピル]-L-アラニル]-L-プロリン、(Z)-2-ブテン二酸塩 (1:1) と表されます。その実験式は C20H28N2O5•C4H4O4 であり、その構造式は次のとおりです。
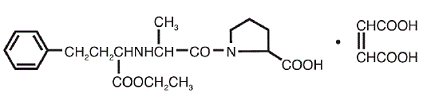
マレイン酸エナラプリルは、白色からオフホワイトの結晶性粉末で、分子量は 492.53 です。水にやや溶けやすく、エタノールに溶けやすく、メタノールに溶けやすい。
エナラプリルはプロドラッグです。経口投与後、活性アンギオテンシン変換酵素阻害剤であるエナラプリラートへのエチルエステルの加水分解によって生物活性化されます。
マレイン酸エナラプリルは、経口投与用の 2.5 mg、5 mg、10 mg、および 20 mg の錠剤として提供されます。有効成分マレイン酸エナラプリルに加えて、各錠剤には、ラクトース、ステアリン酸マグネシウム、重炭酸ナトリウム、デンプンなどの不活性成分が含まれています。 10 mg と 20 mg の錠剤には、酸化鉄も含まれています。
適応症
高血圧症
VASOTEC は、高血圧の治療に適応されます。
VASOTEC は、単独で、または他の降圧剤、特にサイアザイド型利尿薬と組み合わせて効果的です。 VASOTEC 10mg とチアジドの血圧降下効果はほぼ相加的です。
心不全
VASOTEC は、通常、利尿薬およびジギタリスと組み合わせて、症候性うっ血性心不全の治療に適応されます。これらの患者では、VASOTEC 5mg は症状を改善し、生存率を高め、入院の頻度を減らします ( 臨床薬理学 、 心不全 、 生存試験の詳細と限界については死亡試験 )。
無症候性左心室機能不全
左心室機能不全(駆出率≦35%)の臨床的に安定した無症候性患者では、VASOTEC 5mgは顕性心不全の発症率を低下させ、心不全による入院の発生率を低下させます( 臨床薬理学 、 心不全 、 生存試験の詳細と限界については死亡試験 )。
VASOTEC 2.5mg を使用する際には、別のアンギオテンシン変換酵素阻害剤であるカプトプリルが、特に腎機能障害またはコラーゲン血管疾患の患者で無顆粒球症を引き起こしているという事実を考慮に入れる必要があります。同様のリスクがあります(参照 警告 )。
VASOTEC の使用を検討する際には、管理された臨床試験において、ACE 阻害剤が血圧に及ぼす影響は、非黒人よりも黒人患者の方が小さいことに注意する必要があります。さらに、ACE阻害薬を服用している黒人患者は、非黒人と比較して血管性浮腫の発生率が高いことが報告されていることに注意する必要があります( 警告 、 頭頸部血管性浮腫 )。
投薬と管理
高血圧症
現在利尿薬で治療されている患者では、VASOTEC の初回投与後に症候性低血圧が時折発生することがあります。低血圧の可能性を減らすために、可能であれば、VASOTEC による治療を開始する前に、利尿薬を 2 ~ 3 日間中止する必要があります。 警告 )。患者の血圧が VASOTEC だけでコントロールされていない場合は、利尿剤治療を再開することができます。
利尿薬を中止できない場合は、医師の監督下で 2.5 mg の初回用量を少なくとも 2 時間使用し、血圧が安定するまで少なくとも 1 時間使用する必要があります。 警告 と 予防 、 薬物相互作用 )。
利尿薬を服用していない患者の推奨初期用量は、1 日 1 回 5 mg です。投与量は、血圧反応に応じて調整する必要があります。通常、1日10~40mgを1回または2回に分けて服用します。 1日1回治療を受けた一部の患者では、投与間隔の終わりに向かって降圧効果が減少する可能性があります.このような患者では、用量の増加または 1 日 2 回の投与を考慮する必要があります。 VASOTEC 2.5mg 単独で血圧がコントロールされない場合は、利尿薬を追加することがあります。 VASOTEC 5mg とカリウム サプリメント、カリウム塩代替物、またはカリウム保持性利尿薬を併用すると、血清カリウム値が上昇する可能性があります。 予防 )。
腎障害のある高血圧患者における用量調整
エナラプリルの通常の用量は、クレアチニンクリアランスが 30 mL/分を超える患者に推奨されます (血清クレアチニンは約 3 mg/dL まで)。クレアチニンクリアランスが 30 mL/min 以下 (血清クレアチニンが 3 mg/dL 以上) の患者の場合、最初の用量は 2.5 mg を 1 日 1 回です。投与量は、血圧が制御されるまで、または 1 日最大 40 mg まで漸増することができます。
心不全
VASOTEC は、通常、利尿剤およびジギタリスと組み合わせて、症候性心不全の治療に適応されます。改善された生存率を示したプラセボ対照研究では、患者は 2 回に分けて投与され、最大 40 mg まで耐容されるように滴定されました。
推奨される初回用量は 2.5 mg です。推奨用量範囲は、1 日 2 回 2.5 ~ 20 mg です。用量は、忍容性に応じて、数日または数週間にわたって漸増する必要があります。臨床試験で投与された 1 日最大用量は、分割用量で 40 mg でした。
VASOTEC の初回投与後、少なくとも 2 時間は医師の監督下で患者を観察し、血圧が安定するまで少なくともさらに 1 時間は観察する必要があります。 警告 と 薬物相互作用 )。可能であれば、併用利尿薬の投与量を減らす必要があります。これにより、低血圧の可能性が減少する可能性があります。 VASOTEC の初回投与後の低血圧の出現は、低血圧の効果的な管理に続いて、薬剤によるその後の慎重な用量設定を妨げるものではありません。
無症候性左心室機能不全
有効性が実証された試験では、患者は 2.5 mg を 1 日 2 回服用し始め、目標とする 1 日量 20 mg (分割用量) に耐えられるように滴定されました。
VASOTEC 10mg の初回投与後、少なくとも 2 時間は医師の監督下で患者を観察し、血圧が安定するまでさらに 1 時間以上観察する必要があります。 警告 と 薬物相互作用 )。可能であれば、併用利尿薬の投与量を減らす必要があります。これにより、低血圧の可能性が減少する可能性があります。 VASOTEC 5mg の初回投与後の低血圧の出現は、低血圧の効果的な管理に続いて、薬物によるその後の慎重な用量調整を妨げるものではありません。
心不全および腎障害または低ナトリウム血症の患者における用量調整
低ナトリウム血症 (血清ナトリウムが 130 mEq/L 未満) または血清クレアチニンが 1.6 mg/dL を超える心不全患者では、綿密な医学的監督の下で、毎日 2.5 mg で治療を開始する必要があります (以下を参照)。 心不全 、 警告 と 薬物相互作用 )。用量は、必要に応じて 2.5 mg 1 日 2 回、その後 5 mg 1 日 2 回以上に増量することができます。通常、用量調整時に過度の低血圧や腎機能の著しい悪化がない場合は、4 日以上の間隔をあけてください。 1日の最大摂取量は40mgです。
小児高血圧患者
通常の推奨開始用量は、1 日 1 回 0.08 mg/kg (最大 5 mg) です。投与量は、血圧反応に応じて調整する必要があります。 0.58 mg/kg を超える (または 40 mg を超える) 用量は、小児患者では研究されていません ( 臨床薬理学 、 小児患者における臨床薬理学 )。
VASOTEC 5mg は、データがないため、糸球体濾過率が 30 mL/分/1.73 m² 未満の新生児および小児患者には推奨されません。
懸濁液の調製 (1.0 mg/mL 懸濁液 200 mL 用)
VASOTEC 10mg の 20mg 錠剤が 10 個入っているポリエチレン テレフタレート (PET) ボトルに 50mL の Bicitra® を加え、少なくとも 2 分間振とうします。濃縮液を 60 分間放置します。 60分間保持した後、濃縮液をさらに1分間振ってください。ペットボトルの原液にオラスイートSF™2を150mL加え、振って成分を分散させます。懸濁液は 2 ~ 8°C (36 ~ 46°F) で冷蔵する必要があり、最大 30 日間保存できます。使用前に毎回懸濁液を振ってください。
供給方法
保管所
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。
容器は密閉して保管してください。
湿気から保護してください。
製品パッケージが小分けされている場合は、USP に従って密閉容器に分配してください。
製造元: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA.製造元: Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Canada.改訂: 2017 年 7 月。
副作用
VASOTEC は、1 年以上治療を受けた 1000 人以上の患者を含む 10,000 人以上の患者で安全性が評価されています。 VASOTEC 10mg は、2,987 人の患者を対象とした対照臨床試験で、一般的に忍容性が良好であることがわかっています。ほとんどの場合、不利な経験は軽度で一時的なものでした。臨床試験では、高血圧患者の 3.3% と心不全患者の 5.7% で、臨床的有害事象による治療の中止が必要でした。有害な経験の頻度は、通常の投与量範囲内の 1 日総投与量とは関係がありませんでした。高血圧症患者において、VASOTEC で治療された患者の全体的な割合は、有害な経験を報告しており、プラセボと同等でした。
高血圧症
対照臨床試験で VASOTEC 2.5mg で治療された高血圧患者の 1% 以上に発生した有害事象を以下に示します。 VASOTEC で治療された患者では、最大治療期間は 3 年でした。プラセボ治療を受けた患者では、最大治療期間は 12 週間でした。
心不全
VASOTEC 5mg で治療された心不全患者の 1% 以上に発生する有害な経験を以下に示します。発生率は、対照臨床試験と非対照臨床試験の両方の経験を表しています (治療の最大期間は約 1 年でした)。プラセボで治療された患者では、報告された発生率は対照試験からのものです (治療の最大期間は 12 週間です)。重度の心不全 (NYHA クラス IV) の患者の割合は、VASOTEC 2.5mg とプラセボで治療された患者でそれぞれ 29% と 43% でした。
薬剤が上市されてから発生したその他の重篤な臨床的有害事象、または臨床試験で高血圧または心不全患者の 0.5 ~ 1.0% に発生した有害事象を以下に示します。
体全体
アナフィラキシー反応(参照 警告 、 アナフィラキシーおよびおそらく関連する反応 )。
心臓血管
心停止;心筋梗塞または脳血管発作、おそらく高リスク患者の過度の低血圧に続発 警告 、 低血圧 );肺塞栓症および梗塞;肺水腫;心房性頻脈および徐脈を含むリズム障害;心房細動;動悸、レイノー現象。
消化器
イレウス、膵炎、肝不全、肝炎(肝細胞性[再投与で証明済み]または胆汁うっ滞性黄疸)( 警告 、 肝不全 )、下血、食欲不振、消化不良、便秘、舌炎、口内炎、口渇。
血液学
好中球減少症、血小板減少症、骨髄抑制のまれなケース。
筋骨格
筋肉のけいれん。
神経・精神科
抑うつ、錯乱、運動失調、傾眠、不眠症、神経過敏、末梢神経障害(感覚異常、感覚異常など)、夢異常。
呼吸器
気管支痙攣、鼻漏、咽頭痛および嗄声、喘息、上気道感染症、肺浸潤、好酸球性肺炎。
肌
剥脱性皮膚炎、中毒性表皮壊死融解症、スティーブンス・ジョンソン症候群、天疱瘡、帯状疱疹、多形紅斑、蕁麻疹、かゆみ、脱毛症、紅潮、発汗、光線過敏症。
特別な感覚
かすみ目、味覚の変化、嗅覚障害、耳鳴り、結膜炎、ドライアイ、流涙。
泌尿生殖器
腎不全、乏尿、腎機能障害( 予防 と 投薬と管理 )、脇腹の痛み、女性化乳房、インポテンス。
その他
次のいくつかまたはすべてを含む可能性のある複合症状が報告されています: ANA陽性、赤血球沈降速度の上昇、関節痛/関節炎、筋肉痛/筋炎、発熱、漿液性炎、血管炎、白血球増多症、好酸球増加症、光線過敏症、発疹およびその他の皮膚疾患徴候。
血管性浮腫
血管性浮腫は、VASOTEC 2.5mg を投与された患者で報告されており、黒人ではない患者よりも黒人で発生率が高くなっています。喉頭浮腫に伴う血管性浮腫は、致命的な場合があります。顔、四肢、唇、舌、声門および/または喉頭の血管性浮腫が発生した場合、VASOTECによる治療を中止し、適切な治療を直ちに開始する必要があります。 警告 )。
低血圧
高血圧患者では、低血圧が 0.9% で発生し、0.5% で失神が初回投与後または延長治療中に発生しました。低血圧または失神は、高血圧患者の 0.1% で治療中止の原因でした。心不全患者では、患者の 6.7% で低血圧が発生し、患者の 2.2% で失神が発生しました。低血圧または失神は、心不全患者の 1.9% で治療中止の原因でした ( 警告 )。
咳
見る 予防 、 咳 .
小児患者
小児患者の有害な経験プロファイルは、成人患者に見られるものと似ているようです。
臨床検査結果
血清電解質
高カリウム血症(参照 予防 )、低ナトリウム血症。
クレアチニン、血中尿素窒素
対照臨床試験では、血中尿素窒素と血清クレアチニンのわずかな増加が、治療の中止により回復可能であり、VASOTEC 単独で治療された本態性高血圧患者の約 0.2% で観察されました。利尿薬を併用している患者や腎動脈狭窄のある患者では、増加する可能性が高くなります。 予防 )。ジギタリスの有無にかかわらず利尿薬も投与されている心不全患者では、血中尿素窒素または血清クレアチニンの増加が、通常は VASOTEC 5mg および/またはその他の利尿薬併用療法の中止により回復し、患者の約 11% で観察されました。血中尿素窒素またはクレアチニンの増加は、患者の 1.2% で中止の原因でした。
血液学
ヘモグロビンとヘマトクリットのわずかな減少 (それぞれ約 0.3 g% と 1.0 vol% の平均減少) は、VASOTEC 5mg で治療された高血圧またはうっ血性心不全患者のいずれかで頻繁に発生しますが、貧血の別の原因が共存しない限り、臨床的に重要なことはめったにありません。臨床試験では、貧血のために治療を中止した患者は 0.1% 未満でした。 G6PD欠乏症患者の溶血の症例を含む溶血性貧血が報告されています。エナラプリルとの因果関係は否定できない。
肝機能検査
肝酵素および/または血清ビリルビンの上昇が発生している( 警告 、 肝不全 )。
疑わしい有害反応を報告するには、Valeant Pharmaceuticals North America LLC (1-800-321-4576) または FDA (1-800-FDA-1088) または www.fda.gov/medwatch に連絡してください。
薬物相互作用
ネプリライシン阻害剤
ネプリライシン阻害剤を併用している患者は、血管性浮腫のリスクが高くなる可能性があります。 (見る 警告 )
レニン-アンジオテンシン系 (RAS) の二重遮断
アンジオテンシン受容体遮断薬、ACE 阻害薬、またはアリスキレンによる RAS の二重遮断は、単剤療法と比較して、低血圧、高カリウム血症、および腎機能の変化 (急性腎不全を含む) のリスクの増加と関連しています。 2 種類の RAS 阻害剤を組み合わせて投与されているほとんどの患者は、単剤療法と比較して追加の利益を得ることはありません。 RAS阻害剤との併用は原則として避けてください。 VASOTEC 2.5mg および RAS に影響を与えるその他の薬剤を服用している患者の血圧、腎機能、および電解質を注意深く監視します。
糖尿病患者には、アリスキレンと VASOTEC 5mg を併用しないでください。腎機能障害のある患者(GFR
低血圧 - 利尿薬治療中の患者
利尿薬を服用している患者、特に利尿薬治療を最近開始した患者は、エナラプリルによる治療の開始後に過度の血圧低下を経験することがあります.エナラプリルによる降圧効果の可能性は、利尿薬を中止するか、エナラプリルによる治療を開始する前に塩分摂取量を増やすことで最小限に抑えることができます.利尿薬を継続する必要がある場合は、最初の投与後少なくとも 2 時間、さらに 1 時間以上血圧が安定するまで、綿密な医師の監督を受けてください (以下を参照)。 警告 と 投薬と管理 )。
レニン放出を引き起こす薬剤
VASOTEC 10mg の降圧効果は、レニン放出を引き起こす降圧剤 (利尿剤など) によって増強されます。
選択的シクロオキシゲナーゼ-2阻害剤(COX-2阻害剤)を含む非ステロイド性抗炎症剤
高齢者、体液量が減少している患者(利尿薬治療中の患者を含む)、または腎機能が低下している患者では、選択的 COX-2 阻害剤を含む NSAID とエナラプリルを含む ACE 阻害剤を併用すると、以下を含む腎機能が悪化する可能性があります。急性腎不全の可能性があります。これらの影響は通常可逆的です。エナラプリルと NSAID 療法を受けている患者では、腎機能を定期的にモニタリングしてください。
臨床薬理研究では、インドメタシンまたはスリンダクが VASOTEC を受けている高血圧患者に投与されました。この研究では、VASOTEC の降圧作用の鈍化の証拠はありませんでした。しかし、報告によると、NSAIDs は ACE 阻害剤の降圧効果を弱める可能性があります。
その他の心血管薬
VASOTEC 10mg は、ベータアドレナリン遮断薬、メチルドーパ、硝酸塩、カルシウム遮断薬、ヒドララジン、プラゾシン、ジゴキシンと併用されていますが、臨床的に重大な有害相互作用の証拠はありません。
血清カリウムを増加させる薬剤
VASOTEC は、サイアザイド系利尿薬によるカリウム損失を軽減します。カリウム保持性利尿薬(例、スピロノラクトン、トリアムテレン、またはアミロリド)、カリウムサプリメント、またはカリウム含有塩代替物は、血清カリウムの有意な増加につながる可能性があります.したがって、低カリウム血症が示されているためにこれらの薬剤の併用が必要な場合は、注意して使用し、血清カリウムを頻繁に監視する必要があります。カリウム保持剤は、一般に、VASOTEC を投与されている心不全患者には使用しないでください。
リチウム
リチウム毒性は、ACE阻害剤を含むナトリウムの除去を引き起こす薬剤と同時にリチウムを投与されている患者で報告されています。 VASOTEC とリチウムを併用している患者では、リチウム中毒の数例が報告されており、両方の薬剤を中止すると元に戻りました。エナラプリルをリチウムと同時に投与する場合は、血清リチウム濃度を頻繁にモニタリングすることをお勧めします。
金
ニトリトイド反応(顔面紅潮、吐き気、嘔吐、低血圧などの症状)は、注射可能な金(金チオリンゴ酸ナトリウム)による治療とVASOTECを含む併用ACE阻害薬治療を受けている患者でまれに報告されています。
mTOR (ラパマイシンの哺乳類標的) 阻害剤
ACE阻害薬とmTOR阻害薬(例、テムシロリムス、シロリムス、エベロリムス)療法の同時投与を受けている患者は、血管性浮腫のリスクが高くなる可能性があります( 警告 )。
警告
アナフィラキシーおよびおそらく関連する反応
おそらく、アンギオテンシン変換酵素阻害剤は、内因性ブラジキニンを含むエイコサノイドおよびポリペプチドの代謝に影響を与えるため、ACE阻害剤(VASOTECを含む)を投与されている患者は、さまざまな副作用にさらされる可能性があり、その中には深刻なものもあります.
頭頸部血管性浮腫
顔、四肢、唇、舌、声門、および/または喉頭の血管性浮腫は、VASOTECを含むアンギオテンシン変換酵素阻害剤で治療された患者で報告されています。これは、治療中にいつでも発生する可能性があります。このような場合、VASOTEC 2.5mg は速やかに中止し、徴候や症状が完全かつ持続的に解消するまで、適切な治療とモニタリングを行う必要があります。腫れが顔と唇に限定されている例では、抗ヒスタミン薬が症状の緩和に役立ちましたが、一般的には治療なしで状態は解消されます.喉頭浮腫に伴う血管性浮腫は、致命的な場合があります。 舌、声門、または喉頭の関与があり、気道閉塞を引き起こす可能性がある場合、適切な治療、例えば皮下エピネフリン溶液 1:1000 (0.3 mL ~ 0.5 mL) および/または確実に気道を確保するために必要な措置を迅速に講じる必要があります。提供された (見る 有害反応 )。
ACE阻害薬とmTOR(ラパマイシンの哺乳類標的)阻害薬(例、テムシロリムス、シロリムス、エベロリムス)療法またはネプリライシン阻害薬の同時投与を受けている患者は、血管性浮腫のリスクが高くなる可能性があります( 予防 )。
腸血管性浮腫
ACE阻害薬で治療された患者では、腸の血管性浮腫が報告されています。これらの患者は、腹痛(吐き気や嘔吐の有無にかかわらず)を呈しました。場合によっては、顔面血管浮腫の既往がなく、C-1エステラーゼレベルが正常でした.血管性浮腫は、腹部 CT スキャンや超音波などの手順、または手術で診断され、ACE 阻害薬の中止後に症状は解消しました。腸管浮腫は、腹痛を呈する ACE 阻害薬を服用している患者の鑑別診断に含めるべきです。
ACE阻害薬療法とは無関係の血管性浮腫の既往歴のある患者は、ACE阻害薬の投与中に血管性浮腫のリスクが高くなる可能性があります(以下も参照)。 適応症と使用法 と 禁忌 )。
脱感作中のアナフィラキシー様反応
膜翅目毒による脱感作治療を受けている 2 人の患者は、ACE 阻害剤を受けながら、生命を脅かすアナフィラキシー様反応を持続しました。同じ患者では、ACE阻害薬を一時的に控えるとこれらの反応は回避されましたが、不注意に再投与すると再発しました。
膜曝露中のアナフィラキシー様反応
アナフィラキシー様反応は、ハイフラックス膜で透析され、ACE 阻害剤を併用して治療された患者で報告されています。アナフィラキシー反応は、デキストラン硫酸吸収を伴う低密度リポタンパク質アフェレーシスを受けている患者でも報告されています。
低血圧
過度の低血圧は、VASOTEC 5mg 単独で治療された合併症のない高血圧患者ではまれです。 VASOTEC を投与された心不全患者は、一般に、特に最初の投与で血圧がある程度低下しますが、投与指示に従っていれば、通常、症候性低血圧が続くための治療の中止は必要ありません。治療を開始するときは注意が必要です( 投薬と管理 )。時には乏尿および/または進行性高窒素血症に関連し、まれに急性腎不全および/または死亡を伴う過度の低血圧のリスクがある患者には、次の状態または特徴を持つ患者が含まれます: 心不全、低ナトリウム血症、高用量利尿薬療法、最近の集中治療利尿または利尿薬用量の増加、腎透析、または病因による深刻な量および/または塩分の枯渇。過度の低血圧のリスクがあり、そのような調整に耐えることができる患者では、VASOTEC 10mg による治療を開始する前に、利尿剤を排除する (心不全患者を除く)、利尿剤の投与量を減らす、または塩分摂取量を慎重に増やすことが推奨される場合があります (以下を参照)。 薬物相互作用 と 有害反応 )。過度の低血圧のリスクがある患者では、非常に綿密な医学的監督の下で治療を開始する必要があり、そのような患者は、治療の最初の 2 週間、およびエナラプリルおよび/または利尿薬の用量が増加するたびに綿密に追跡する必要があります。同様の考慮事項は、虚血性心疾患または脳血管疾患の患者にも当てはまり、血圧が過度に低下すると心筋梗塞または脳血管障害を引き起こす可能性があります。
過度の低血圧が発生した場合は、患者を仰臥位にし、必要に応じて生理食塩水の静脈内注入を行う必要があります。一過性の低血圧反応は、VASOTEC 2.5mg の追加投与に対する禁忌ではありません。通常、血圧が安定すれば問題なく投与できます。症候性低血圧が発生した場合は、VASOTEC または併用利尿薬の減量または中止が必要になる場合があります。
好中球減少症/無顆粒球症
別のアンギオテンシン変換酵素阻害剤であるカプトプリルは、無顆粒球症および骨髄抑制を引き起こすことが示されており、合併症のない患者ではめったに発生しませんが、特にコラーゲン血管疾患もある場合は、腎障害のある患者でより頻繁に発生します.エナラプリルの臨床試験から入手可能なデータは、エナラプリルが同様の割合で無顆粒球症を引き起こさないことを示すには不十分です.マーケティングの経験から、エナラプリルとの因果関係を排除できない好中球減少症または無顆粒球症の症例が明らかになりました。コラーゲン血管疾患および腎疾患の患者では、白血球数の定期的なモニタリングを検討する必要があります。
肝不全
まれに、ACE阻害薬が、胆汁うっ滞性黄疸から始まり、劇症肝壊死に進行する症候群、および(場合によっては)死亡に関連している.この症候群のメカニズムは理解されていません。黄疸または肝酵素の著しい上昇を発症するACE阻害薬を投与されている患者は、ACE阻害薬を中止し、適切な医学的フォローアップを受ける必要があります。
胎児毒性
妊娠第 2 期および第 3 期にレニン-アンギオテンシン系に作用する薬剤を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。結果として生じる羊水過少症は、胎児の肺形成不全および骨格の変形に関連している可能性があります。潜在的な新生児の副作用には、頭蓋形成不全、無尿症、低血圧、腎不全、および死亡が含まれます。妊娠が検出されたら、できるだけ早く VASOTEC 10mg を中止してください。これらの有害な結果は、通常、妊娠の第 2 および第 3 期におけるこれらの薬物の使用に関連しています。妊娠初期に降圧薬の使用にさらされた後の胎児の異常を調べるほとんどの疫学研究では、レニン-アンギオテンシン系に影響を与える薬物を他の降圧薬と区別していません。妊娠中の母親の高血圧を適切に管理することは、母親と胎児の両方の転帰を最適化するために重要です。
特定の患者のレニンアンギオテンシン系に影響を与える薬物による治療に代わる適切な方法がないという異常なケースでは、胎児への潜在的なリスクについて母親に知らせてください。羊膜内環境を評価するためにシリアル超音波検査を実行します。羊水過少症が観察された場合は、母親の命を救うと考えられない限り、VASOTEC を中止してください。妊娠週に基づいて、胎児検査が適切な場合があります。ただし、患者と医師は、胎児が不可逆的な損傷を受けるまで羊水過少症が現れない可能性があることに注意する必要があります。低血圧、乏尿、高カリウム血症のために子宮内で VASOTEC に暴露したことのある乳児を注意深く観察してください (以下を参照)。 予防 、 小児用 )。
妊娠中のラットとウサギの研究では、エナラプリルの催奇形作用は見られませんでした.体表面積に基づいて、使用された用量は、それぞれ最大推奨ヒト 1 日用量 (MRHDD) の 57 倍と 12 倍でした。
予防
全般的
大動脈弁狭窄症・肥大型心筋症
すべての血管拡張薬と同様に、エナラプリルは左心室の流出路に閉塞がある患者には注意して投与する必要があります。
腎機能障害
レニン-アンギオテンシン-アルドステロン系の阻害の結果として、感受性のある個人では腎機能の変化が予想される場合があります。腎機能がレニン-アンギオテンシン-アルドステロン系の活性に依存している可能性がある重度の心不全患者では、VASOTEC を含むアンギオテンシン変換酵素阻害剤による治療は、乏尿および/または進行性高窒素血症と関連し、まれに急性腎不全と関連している可能性があります。 /または死(参照 薬物相互作用 )。
片側または両側の腎動脈狭窄を伴う高血圧患者の臨床研究では、患者の 20% で血中尿素窒素と血清クレアチニンの増加が観察されました。これらの増加は、ほとんどの場合、エナラプリルおよび/または利尿薬の中止により元に戻りました。このような患者では、治療の最初の数週間は腎機能を監視する必要があります。
明らかな既存の腎血管疾患のない高血圧または心不全の一部の患者は、特に VASOTEC が利尿薬と併用されている場合、血中尿素および血清クレアチニンの増加を発症しましたが、通常は軽微で一過性です。これは、既存の腎機能障害のある患者で発生する可能性が高くなります。利尿薬および/またはVASOTEC 5mgの減量および/または中止が必要になる場合があります。
高血圧または心不全の患者の評価には、常に腎機能の評価を含める必要があります (見る 投薬と管理 )。
高カリウム血症
血清カリウムの上昇 (5.7 mEq/L を超える) は、臨床試験で高血圧患者の約 1% で観察されました。ほとんどの場合、これらは孤立した値であり、治療を継続しても解消されました。高カリウム血症は、高血圧患者の 0.28% で治療中止の原因でした。心不全の臨床試験では、患者の 3.8% で高カリウム血症が観察されましたが、中止の原因にはなりませんでした。
高カリウム血症を発症する危険因子には、腎機能不全、真性糖尿病、およびカリウム保持性利尿薬、カリウム サプリメントおよび/またはカリウム含有塩代用品の併用が含まれます。 薬物相互作用 )。
咳
おそらく内因性ブラジキニンの分解の阻害により、すべての ACE 阻害剤で持続性の非生産性の咳が報告されており、治療の中止後に常に解消されます。咳の鑑別診断では、ACE阻害薬による咳を考慮する必要があります。
手術・麻酔
大手術を受けている患者、または低血圧を引き起こす薬剤による麻酔中の患者では、エナラプリルは、代償性レニン放出に続発するアンギオテンシン II 形成をブロックする可能性があります。低血圧が発生し、このメカニズムによるものと考えられる場合は、ボリューム拡張によって修正できます。
発がん、突然変異誘発、生殖能力の障害
エナラプリルをオスとメスのラットに 90 mg/kg/日までの用量で 106 週間投与した場合、またはオスとメスのマウスに 90 および 180 mg/kg/日までの用量で 94 週間投与した場合、腫瘍形成効果の証拠はありませんでした。日、それぞれ。これらの用量は、体表面積ベースで比較すると、ヒトの最大推奨一日用量(MRHDD)の 26 倍(ラットおよび雌マウス)および 13 倍(雄マウス)である。
マレイン酸エナラプリルも活性二酸も、代謝活性化の有無にかかわらず、Ames 微生物変異原試験で変異原性を示さなかった。エナラプリルは、次の遺伝毒性試験でも陰性でした:rec-アッセイ、大腸菌を用いた復帰突然変異アッセイ、哺乳類培養細胞を用いた姉妹染色分体交換、マウスを用いた小核試験、およびマウス骨髄を用いた in vivo 細胞遺伝学的試験。 .
最大 90 mg/kg/日のエナラプリル (体表面積ベースで比較すると MRHDD の 26 倍) で処理された雄と雌のラットの生殖能力に悪影響はありませんでした。
妊娠
授乳中の母親
エナラプリルとエナラプリラトは、ヒトの母乳から検出されています。エナラプリルによる授乳中の乳児の深刻な副作用の可能性があるため、母親にとっての薬物の重要性を考慮して、授乳を中止するか、VASOTEC 2.5mgを中止するかを決定する必要があります.
小児用
VASOTECへの子宮内曝露の歴史を持つ新生児
乏尿または低血圧が発生した場合は、血圧および腎灌流のサポートに注意を向けてください。交換輸血または透析は、低血圧の逆転および/または障害のある腎機能の代替手段として必要になる場合があります。胎盤を通過するエナラプリルは、腹膜透析によって新生児循環から除去されており、臨床的にある程度の利点があり、理論的には交換輸血によって除去される可能性がありますが、後者の手順の経験はありません.
VASOTEC の降圧効果は、生後 1 か月から 16 歳の高血圧の小児患者で確立されています。これらの年齢層における VASOTEC 5mg の使用は、小児患者および成人患者における VASOTEC 2.5mg の適切かつ十分に管理された研究から得られた証拠、および小児患者に関する公表された文献によって裏付けられています (以下を参照)。 臨床薬理学 、 小児患者における臨床薬理学 と 投薬と管理 )。
利用可能なデータがないため、VASOTEC は新生児および糸球体濾過率が 30 mL/分/1.73 m² 未満の小児患者には推奨されません。
過剰摂取
ヒトの過剰摂取に関して入手できるデータは限られています。
エナラプリルの 1,000 mg/kg 以上および 1,775 mg/kg 以上の単回経口投与は、それぞれマウスおよびラットの致死率と関連していました。
過剰摂取の最も可能性の高い徴候は低血圧であり、通常の治療は通常の生理食塩水の静脈内注入です.
エナラプリラートは、血液透析によって全身循環から除去される可能性があり、腹膜透析によって新生児循環から除去されています。 警告 、 膜曝露中のアナフィラキシー様反応 )。
禁忌
VASOTEC 2.5mg は、この製品に過敏な患者、アンギオテンシン変換酵素阻害剤による以前の治療に関連した血管性浮腫の既往のある患者、および遺伝性または特発性の血管性浮腫の患者には禁忌です。
糖尿病患者には、アリスキレンと VASOTEC を併用しないでください( 薬物相互作用 )。
VASOTEC 10mg は、ネプリライシン阻害剤(例:サクビトリル)との併用は禁忌です。ネプリライシン阻害剤であるサクビトリル/バルサルタンへの切り替えから 36 時間以内に VASOTEC を投与しないでください ( 警告 )。
臨床薬理学
作用機序
エナラプリルは、エナラプリラトへの加水分解後、ヒト被験者および動物のアンギオテンシン変換酵素 (ACE) を阻害します。 ACE は、アンギオテンシン I から血管収縮物質であるアンギオテンシン II への変換を触媒するペプチジルジペプチダーゼです。アンジオテンシン II は、副腎皮質によるアルドステロン分泌も刺激します。高血圧および心不全におけるエナラプリルの有益な効果は、主にレニン-アンギオテンシン-アルドステロン系の抑制に起因するようです。 ACE の阻害は、血漿アンギオテンシン II の減少をもたらし、血管収縮活性の低下とアルドステロン分泌の低下をもたらします。後者の減少は小さいですが、血清カリウムのわずかな増加をもたらします。 VASOTEC 単独で最大 48 週間治療された高血圧患者では、約 0.2 mEq/L の血清カリウムの平均増加が観察されました。 VASOTEC 5mg とサイアザイド系利尿薬で治療された患者では、血清カリウムに本質的な変化はありませんでした ( 予防 )。レニン分泌に対するアンギオテンシン II の負のフィードバックを除去すると、血漿レニン活性が増加します。
ACEは、ブラジキニンを分解する酵素であるキニナーゼと同一です。強力な血管抑制ペプチドであるブラジキニンのレベルの増加が VASOTEC の治療効果に関与しているかどうかは、まだ解明されていません。
VASOTEC 5mg が血圧を下げるメカニズムは主にレニン-アンギオテンシン-アルドステロン系の抑制であると考えられていますが、VASOTEC 10mg は低レニン高血圧症の患者でも降圧効果があります。 VASOTEC は調査したすべての人種で降圧効果がありましたが、黒人高血圧患者 (通常は低レニン高血圧集団) は、非黒人患者よりもエナラプリル単剤療法に対する平均反応が小さかった.
薬物動態と代謝
VASOTEC の経口投与後、エナラプリルのピーク血清濃度は約 1 時間以内に発生します。尿中の回復に基づくと、エナラプリルの吸収の程度は約 60% です。エナラプリルの吸収は、胃腸管内の食物の存在によって影響を受けません.吸収後、エナラプリルはエナラプリルに加水分解されます。これは、エナラプリルよりも強力なアンギオテンシン変換酵素阻害剤です。エナラプリラートは経口投与すると吸収されにくい。エナラプリルのピーク血清濃度は、マレイン酸エナラプリルの経口投与の 3 ~ 4 時間後に発生します。 VASOTEC の排泄は主に腎臓です。投与量の約 94% がエナラプリラトまたはエナラプリルとして尿および糞便中に回収されます。尿中の主成分は、投与量の約 40% を占めるエナラプリラトと無傷のエナラプリルです。エナラプリラト以外のエナラプリルの代謝物の証拠はありません。
エナラプリラートの血清濃度プロファイルは、延長された終末期を示しており、明らかに投与量のわずかな部分が ACE に結合していることを示しています。結合量は用量とともに増加せず、結合の飽和部位を示します。マレイン酸エナラプリルの複数回投与後のエナラプリラト蓄積の有効半減期は 11 時間です。腎機能不全患者におけるエナラプリルおよびエナラプリラトの体内動態は、糸球体濾過率が 30 mL/分以下になるまでは、腎機能が正常な患者と同様です。糸球体濾過速度が 30 mL/min 以下の場合、エナラプリラートのピーク値と谷値が上昇し、濃度がピークに達するまでの時間が長くなり、定常状態に達するまでの時間が遅れる可能性があります。マレイン酸エナラプリルの複数回投与後のエナラプリラトの有効半減期は、腎不全のこのレベルでは延長されます( 投薬と管理 )。 Enalaprilat は 62 mL/min の速度で透析可能です。
イヌでの研究は、エナラプリルが血液脳関門を通過したとしてもほとんど通過しないことを示しています。エナラプリラートは脳に入りません。マレイン酸エナラプリルをラットに複数回投与しても、どの組織にも蓄積しません。 14C-マレイン酸エナラプリルの投与後、授乳中のラットのミルクには放射能が含まれています。妊娠中のハムスターに標識薬剤を投与すると、放射能が胎盤を通過することがわかった。
薬力学と臨床効果
高血圧症
軽度から重度の範囲の重症度の高血圧を有する患者への VASOTEC の投与は、通常、起立性コンポーネントなしで、仰臥位および立位血圧の両方の低下をもたらします。したがって、症候性体位性低血圧はまれですが、体液量が枯渇した患者では予想される場合があります( 警告 )。
研究されたほとんどの患者では、エナラプリルの単回経口投与後、1時間で降圧活性の開始が見られ、血圧のピーク低下は4〜6時間で達成されました.
推奨用量で、降圧効果は少なくとも 24 時間維持されています。一部の患者では、投与間隔の終わりに向かって効果が減少する場合があります( 投薬と管理 )。
一部の患者では、最適な血圧低下を達成するには数週間の治療が必要になる場合があります。
VASOTEC の降圧効果は、長期治療中も持続しています。 VASOTEC 10mg の突然の中止は、血圧の急激な上昇とは関連していません。
本態性高血圧患者の血行動態研究では、血圧の低下は、心拍出量の増加を伴う末梢動脈抵抗の低下を伴い、心拍数の変化はほとんどまたはまったくありませんでした。 VASOTEC の投与後、腎血流が増加します。通常、糸球体濾過率は変化しません。効果は、腎血管性高血圧症の患者でも同様のようです。
サイアザイド系利尿薬と一緒に投与すると、VASOTEC 5mg の血圧降下効果はほぼ加算されます。
臨床薬理研究では、インドメタシンまたはスリンダクが VASOTEC を受けている高血圧患者に投与されました。この研究では、VASOTEC の降圧作用の鈍化の証拠はありませんでした ( 薬物相互作用 )。
心不全
ジギタリスと利尿薬で治療された患者を対象とした試験では、エナラプリルによる治療により、体血管抵抗、血圧、肺毛細血管楔入圧、心臓サイズが減少し、心拍出量と運動耐性が増加しました。心拍数は変化しないかわずかに減少し、平均駆出率は変化しないか増加しました。ニューヨーク心臓協会 (NYHA) 分類によって測定される心不全の重症度、および呼吸困難と疲労の症状に有益な効果がありました。最初の投与後に血行力学的効果が観察され、4 ヶ月間続く非管理研究で維持されているように見えました。運動耐容能、心臓の大きさ、および心不全の重症度と症状に対する影響は、8 週間から 1 年以上続くプラセボ対照試験で観察されました。
心不全、死亡試験
多施設のプラセボ対照臨床試験では、あらゆる程度の症候性心不全で駆出率が 35% 以下の 2,569 人の患者がプラセボまたはエナラプリルに無作為に割り付けられ、最大 55 か月間追跡されました (SOLVD-治療)。エナラプリルの使用は、全死亡率の 11% の減少と、心不全による入院の 30% の減少に関連していました。研究への登録から患者を除外した疾患には、重度の安定狭心症 (1 日に 2 回以上の発作)、血行力学的に重大な弁または流出路の閉塞、腎不全 (クレアチニン > 2.5 mg/dL)、脳血管疾患 (例えば、重大な頸動脈疾患) が含まれます。 、進行性肺疾患、悪性腫瘍、活動性心筋炎および収縮性心膜炎。エナラプリルに関連する死亡率の改善は、ジギタリスの存在に依存していないようです。
番目の多施設試験では、無症候性または症状が最小限の患者の研究に SOLVD プロトコルが使用されました。心室駆出率が 35% 以下で、症候性心不全の既往がない SOLVD 予防患者は、プラセボ (n=2117) またはエナラプリル (n=2111) に無作為に割り付けられ、最大 5 年間追跡されました。 SOLVD-Prevention 試験に参加した患者の大部分は、虚血性心疾患の病歴がありました。患者の 80% に心筋梗塞の病歴があり、34% に現在の狭心症、37% に高血圧の病歴がありました。この集団では、統計的に有意な死亡率への影響は示されませんでした。エナラプリルで治療を受けた被験者は、心不全による最初の入院が 32% 少なく、心不全による入院の合計が 32% 少なかった.プラセボと比較して、エナラプリルを投与された患者は、顕性心不全の症状を発症した患者が 32% 少なかった.心血管系の理由による入院も減少しました。エナラプリル治療群では、あらゆる原因による入院のわずかな減少が見られました (エナラプリルとプラセボの場合、最初の入院はそれぞれ 1,166 対 1,201、総入院は 2,649 対 2,840 でした)。効果。
SOLVD-Prevention 試験は、駆出率が低い無症候性患者の治療が入院の予防に関して優れているかどうかを判断するために設計されたものではありません。しかし、SOLVD-Prevention 試験でのフォローアップの条件下 (研究クリニックで 4 か月ごと、必要に応じてかかりつけの医師) では、心不全で入院したプラセボを服用している患者の 68% に以前の症状が記録されていなかったため、治療開始の合図。
また、SOLVD-Prevention 試験は、エナラプリルが根底にある心疾患の進行を改善したかどうかを示すようには設計されていません。
別の多施設プラセボ対照試験(CONSENSUS)では、NYHA クラス IV のうっ血性心不全と心臓肥大の X 線写真上の証拠を有する患者に限定され、エナラプリルの使用は生存率の改善と関連していました。結果を次の表に示します。
CONSENSUS試験とSOLVD治療試験の両方で、患者は通常、ジギタリス、利尿薬、またはその両方を受けていました。
小児患者における臨床薬理学
0.07 ~ 0.14 mg/kg マレイン酸エナラプリルを毎日経口投与した後、生後 2 か月から 16 歳までの 40 人の高血圧の男女の小児患者を対象に、反復投与薬物動態研究が実施されました。定常状態では、エナラプリラト蓄積の平均有効半減期は 14 時間であり、24 時間での総エナラプリルとエナラプリラトの平均尿中回収率は投与量の 68% でした。エナラプリルからエナラプリラトへの変換は、63~76%の範囲でした。この研究の全体的な結果は、生後 2 か月から 16 歳以下の高血圧児におけるエナラプリルの薬物動態が、研究対象の年齢層全体で一貫しており、健康な成人の薬物動態の過去のデータと一致していることを示しています。
歳から 16 歳の高血圧の小児患者 110 人を対象とした臨床研究では、体重が 50 kg 未満の患者は毎日 0.625、2.5、または 20 mg のエナラプリルを投与され、体重が 50 kg 以上の患者は 1.25、5、または 40 mg のいずれかが投与されました。毎日エナラプリル。エナラプリルを 1 日 1 回投与すると、用量依存的にトラフ血圧が低下しました。エナラプリルの用量依存的な降圧効果は、すべてのサブグループ (年齢、タナー期、性別、人種) で一貫していました。しかし、研究された最低用量である 0.625 mg と 1.25 mg は、1 日 1 回平均 0.02 mg/kg に相当し、一貫した降圧効果を提供するようには見えませんでした。この試験では、VASOTEC 2.5mg の忍容性は概ね良好でした。
上記の小児科の研究では、マレイン酸エナラプリルは VASOTEC の錠剤として投与され、錠剤を飲み込むことができない、または錠剤の形で入手できるよりも低用量を必要とする子供や乳児のために、エナラプリルは懸濁製剤で投与されました( 投薬と管理 、 サスペンションの準備 )。
患者情報
血管性浮腫
喉頭浮腫を含む血管性浮腫は、エナラプリルを含むアンギオテンシン変換酵素阻害剤による治療中にいつでも発生する可能性があります。患者は、血管性浮腫を示唆する徴候や症状(顔、四肢、目、唇、舌の腫れ、嚥下や呼吸の困難)を直ちに報告し、処方医に相談するまで薬を服用しないように指示されるべきです.
低血圧
特に治療の最初の数日間は、立ちくらみを報告するように患者に注意する必要があります。実際に失神が起こった場合、患者は処方医に相談するまで薬を中止するように言われるべきです.すべての患者は、過度の発汗や脱水によって体液量が減少するため、血圧が過度に低下する可能性があることに注意する必要があります。嘔吐や下痢などの体液量減少の他の原因も、血圧の低下につながる可能性があります。患者は医師に相談するようにアドバイスされるべきです。
高カリウム血症
患者は、医師に相談せずにカリウムを含む塩代替物を使用しないように指示されるべきです.
好中球減少症
患者は、好中球減少症の徴候である可能性のある感染の徴候(例、喉の痛み、発熱)を速やかに報告するように指示されるべきです。
妊娠
妊娠可能年齢の女性患者は、妊娠中の VASOTEC への曝露の影響について説明する必要があります。妊娠を計画している女性と治療の選択肢について話し合います。患者は、できるだけ早く主治医に妊娠を報告するよう求められるべきです。
注:他の多くの薬と同様に、エナラプリルで治療されている患者への特定のアドバイスが保証されています.この情報は、この薬の安全で効果的な使用を支援することを目的としています。考えられるすべての悪影響または意図された影響を開示するものではありません。
