Benicar 10mg, 20mg, 40mg Olmesartan 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ベニカー 40mg とは何ですか? どのように使用されますか?
ベニカーは、高血圧の症状を治療するために使用される処方薬です。ベニカー 10mg は、単独で使用することも、他の薬と併用することもできます。
ベニカーは、アンギオテンシン II 受容体遮断薬または ARB です。
ベニカーが 6 歳未満の子供に安全で効果があるかどうかはわかっていません。
ベニカー 40mg の副作用の可能性は何ですか?
ベニカーは、次のような重大な副作用を引き起こす可能性があります。
- 立ちくらみ
- 排尿がほとんどまたはまったくない
- 手や足のむくみ
- 吐き気
- 弱点
- チクチクする感じ
- 胸痛
- 速いまたは不規則な心拍
- 動きの喪失
上記の症状がある場合は、すぐに医療機関を受診してください。
ベニカーの最も一般的な副作用は次のとおりです。
- めまい
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ベニカーの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
胎児毒性
- 妊娠が検出されたら、できるだけ早くベニカー 40mg を中止してください [警告と注意事項を参照してください]。
- システム内のレニン-アンギオテンに直接作用する薬物は、発育中の胎児に傷害や死亡を引き起こす可能性があります[警告と注意事項を参照]
説明
プロドラッグであるオルメサルタン メドキソミルは、消化管からの吸収中にオルメサルタンに加水分解されます。オルメサルタンは選択的 AT1 サブタイプのアンギオテンシン II 受容体拮抗薬です。
オルメサルタン メドキソミルは、化学的に 2,3-ジヒドロキシ-2-ブテニル 4-(1 ヒドロキシ-1-メチルエチル)-2-プロピル-1-[p-(o-1H-テトラゾール-5-イルフェニル)ベンジル]イミダゾール-と記載されています。 5 カルボン酸塩、環状 2,3- 炭酸塩。
その実験式は C29H30N6O6 であり、その構造式は次のとおりです。
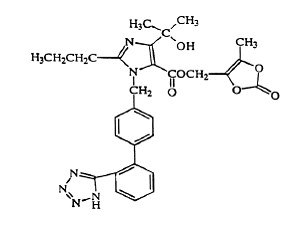
オルメサルタン メドキソミルは、白色から淡黄白色の粉末または結晶性粉末で、分子量は 558.59 です。水にほとんど溶けず、メタノールにやや溶けにくい。ベニカー 20mg は、5 mg、20 mg、または 40 mg のオルメサルタン メドキソミルと次の不活性成分を含むフィルムコーティング錠として経口使用できます: ヒドロキシプロピル セルロース、ヒプロメロース、乳糖一水和物、低置換度ヒドロキシプロピル セルロース、ステアリン酸マグネシウム、微結晶性セルロース、タルク、二酸化チタン、および (5 mg のみ) 黄酸化鉄。
適応症
ベニカー 40mg は、血圧を下げるために、成人および 6 歳以上の子供の高血圧の治療に適応されます。血圧を下げると、主に脳卒中や心筋梗塞などの致命的および非致命的な心血管イベントのリスクが低下します。これらの利点は、この薬が主に属するクラスを含む、さまざまな薬理学的クラスの降圧薬の対照試験で見られました。ベニカーによるリスク軽減を示す対照試験はありません。
高血圧の管理は、必要に応じて、脂質管理、糖尿病管理、抗血栓療法、禁煙、運動、およびナトリウム摂取制限を含む包括的な心血管リスク管理の一部であるべきです。多くの患者は、血圧目標を達成するために複数の薬を必要とします。目標と管理に関する具体的なアドバイスについては、国立高血圧教育プログラムの高血圧の予防、検出、評価、および治療に関する合同全国委員会 (JNC) のガイドラインなど、公開されているガイドラインを参照してください。
さまざまな薬理学的クラスから、作用機序の異なる多数の降圧薬が無作為対照試験で示され、心血管疾患の罹患率と死亡率を低下させることが示されています。これらの利点の大部分を担っているのは薬です。最大かつ最も一貫した心血管転帰の利点は、脳卒中のリスクの低下ですが、心筋梗塞と心血管死亡率の低下も定期的に見られています.
収縮期圧または拡張期圧の上昇は心血管リスクの増加を引き起こし、mmHg あたりの絶対リスク増加は血圧が高いほど大きくなるため、重度の高血圧をわずかに低下させるだけでもかなりの利益が得られます。血圧低下による相対リスク低下は、絶対リスクが異なる集団全体で類似しているため、高血圧とは無関係にリスクが高い患者 (たとえば、糖尿病や高脂血症の患者) では絶対的利益が大きくなり、そのような患者は、より積極的な治療により、より低い血圧の目標を達成することができます。
一部の降圧薬は、黒人患者では(単剤療法として)血圧への影響が小さく、多くの降圧薬には追加の承認された適応症と効果があります(例、狭心症、心不全、または糖尿病性腎疾患)。これらの考慮事項は、治療法の選択の指針となる場合があります。
単独で使用することも、他の降圧薬と組み合わせて使用することもできます。
投薬と管理
成人高血圧
投与量は個別化する必要があります。ベニカー 20mg の通常の推奨開始用量は、体積収縮していない患者に単剤療法として使用する場合、1 日 1 回 20mg です。 2 週間の治療後にさらに血圧を下げる必要がある患者の場合、ベニカーの用量を 40 mg に増やすことができます。 40 mg を超える用量では、より大きな効果があるようには見えません。 1 日 2 回の投与は、1 日 1 回の同じ総投与量よりも利点はありません。
血管内容積の枯渇の可能性がある患者(例えば、利尿薬で治療されている患者、特に腎機能障害のある患者)の場合、綿密な医学的監督の下でベニカーを開始し、より低い開始用量の使用を検討してください[ 警告と注意事項 ]。
小児高血圧症(6歳以上)
投与量は個別化する必要があります。錠剤を飲み込める子供の場合、ベニカーの通常の推奨開始用量は、体重が 20 ~ 35 kg (44 ~ 77 ポンド) 未満の患者では 1 日 1 回 10 mg、体重が 35 kg 以上の患者では 1 日 1 回 20 mg です。 2 週間の治療後にさらに血圧を下げる必要がある患者の場合、ベニカーの用量は、体重が 35 kg 未満の患者の場合は 1 日 1 回最大 20 mg、体重が 35 kg 以上の患者の場合は 1 日 1 回 40 mg まで増量できます。
1 歳未満の子供にベニカー 10mg を使用することは推奨されない [参照 警告と注意事項 と 特定の集団での使用 ]。
錠剤を飲み込むことができない子供には、以下に説明するように即時懸濁液を使用して同じ用量を与えることができます[ 臨床薬理学 ]。ベニカーを懸濁液として投与するには、以下の懸濁液の調製手順に従ってください。
懸濁液の調製(2 mg/mL 懸濁液 200 mL 用)
ベニカー 20 mg 錠剤 20 個が入った琥珀色のポリエチレン テレフタレート (PET) ボトルに 50 mL の精製水を加え、最低 5 分間静置します。容器を少なくとも 1 分間振とうし、懸濁液を少なくとも 1 分間静置します。 1 分間の振とうと 1 分間の静置をさらに 4 回繰り返します。 100 mL の ORA-Sweet® と 50 mL の ORA-Plus®* を懸濁液に加え、少なくとも 1 分間よく振ってください。懸濁液は 2 ~ 8°C (36 ~ 46°F) で冷蔵する必要があり、最大 4 週間保存できます。各使用前に懸濁液をよく振って、すぐに冷蔵庫に戻してください。
供給方法
剤形と強度
- 片面に Sankyo、もう片面に C12 のデボス加工が施された、5 mg の黄色の円形のフィルムコーティングされた、スコアのない錠剤
- 片面に三協、もう片面にC14の型押しが施された、20mgの白色、円形、フィルムコーティングされた、スコアのない錠剤
- 片面に三共、もう片面にC15を刻印した40mgの白色、楕円形、フィルムコーティング、無割線錠
保管と取り扱い
Benicar は、5 mg のオルメサルタン メドキソミルを含む黄色の丸いフィルム コーティングの無罫錠剤、20 mg のオルメサルタン メドキソミルを含む白色の円形のフィルム コーティングの無罫錠剤、および白色の楕円形として供給されます。 、オルメサルタン メドキソミル 40 mg を含む、フィルム コーティングされたスコアのない錠剤。錠剤は、5、20、および 40 mg 錠剤の片面に Sankyo、反対面にそれぞれ C12、C14、または C15 のデボス加工が施されています。
タブレットは次のように提供されます。
保管所
20 ~ 25°C (68 ~ 77°F) で保管してください [USP 制御室温を参照]。
第一三共株式会社、Basking Ridge、NJ 07920 向けに製造。2019 年 10 月改訂。
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
成人高血圧
ベニカーは、対照試験で高血圧治療を受けた 3,275 人以上の患者を含む 3,825 人以上の患者/被験者で安全性が評価されています。この経験には、少なくとも 6 か月間治療を受けた約 900 人の患者と、少なくとも 1 年間治療を受けた 525 人以上の患者が含まれていました。事象は一般に軽度で一過性であり、ベニカーの投与量とは関係がありませんでした。
性別、年齢、人種グループの分析では、ベニカー 40mg とプラセボで治療された患者の間に違いは見られませんでした。高血圧患者のすべての試験における副作用による離脱率は、ベニカー 40mg で治療された患者の 2.4% (すなわち、79/3278) および対照患者の 2.7% (すなわち、32/1179) でした。プラセボ対照試験では、ベニカー 20mg で治療された患者の 1% 以上で発生し、プラセボよりも高い発生率であった唯一の副作用はめまいでした (3% 対 1%)。
ベニカーを投与された 5 人の患者で顔面浮腫が報告されました。血管性浮腫は、アンギオテンシン II 拮抗薬で報告されています。
小児高血圧症
歳から 16 歳までの小児患者の有害経験プロファイルと、以前に報告された成人患者のプロファイルとの間に関連する違いは確認されませんでした。
市販後の経験
市販後の経験から、以下の副作用が報告されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
全身: 無力症、血管性浮腫、アナフィラキシー反応
胃腸: 嘔吐、スプルー様腸疾患[参照 警告と注意事項 ]
代謝および栄養障害: 高カリウム血症
筋骨格: 横紋筋融解症
泌尿生殖器系: 急性腎不全、血中クレアチニン値の上昇
皮膚と付属物: 脱毛症、かゆみ、蕁麻疹
ある対照試験と疫学的研究のデータは、高用量のオルメサルタンが糖尿病患者の心血管 (CV) リスクを増加させる可能性があることを示唆していますが、全体的なデータは決定的なものではありません.無作為化、プラセボ対照、二重盲検 ROADMAP 試験 (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial、n=4447) では、2 型糖尿病、正常アルブミン尿症、および心血管疾患の危険因子が少なくとも 1 つ追加されている。この試験は主要評価項目である微量アルブミン尿の発症の遅延を達成しましたが、オルメサルタンは糸球体濾過率 (GFR) の低下に対して有益な効果はありませんでした。プラセボ群と比較して、オルメサルタン群では心血管死亡率(判定された突然の心臓死、致命的な心筋梗塞、致命的な脳卒中、血行再建による死亡)の増加が認められた(15 オルメサルタン対 3 プラセボ、HR 4.9、95% 信頼区間 [CI ], 1.4, 17)、しかしオルメサルタンでは非致死性心筋梗塞のリスクが低かった (HR 0.64, 95% CI 0.35, 1.18)。
疫学的研究には、全体で 300,000 患者年以上の暴露を受けた 65 歳以上の患者が含まれていました。高用量のオルメサルタン (40 mg/日) を 6 か月以上投与されている糖尿病患者のサブグループでは、他のものを服用している同様の患者と比較して、死亡リスクが高いように見えました (HR 2.0、95% CI 1.1、3.8)。アンギオテンシン受容体遮断薬。対照的に、非糖尿病患者における高用量のオルメサルタンの使用は、他のアンギオテンシン受容体遮断薬を服用している同様の患者と比較して、死亡リスクの低下と関連しているように見えました (HR 0.46、95% CI 0.24、0.86)。他のアンギオテンシン遮断薬と比較して低用量のオルメサルタンを投与されたグループ、または 6 か月未満の治療を受けたグループの間に差は観察されませんでした。
全体として、これらのデータは、糖尿病患者における高用量のオルメサルタンの使用に関連する CV リスクの増加の可能性に関する懸念を引き起こします。しかし、心血管リスクの増加という発見の信憑性には懸念があります。特に、糖尿病患者の有害な発見と同様の大きさの非糖尿病患者の生存利益に関する大規模な疫学研究での観察です。
薬物相互作用
血清カリウムを増加させる薬剤
オルメサルタンと、レニン-アンギオテンシン系を遮断する他の薬剤、カリウム保持性利尿薬(例、スピロノラクトン、トリアムテレン、アミロリド)、カリウム サプリメント、カリウムを含む塩代替物、またはカリウム レベルを上昇させる可能性のある他の薬剤(例、ヘパリン)との併用は、血清カリウム値の上昇につながります。併用が必要と考えられる場合は、血清カリウムのモニタリングが推奨されます。
選択的シクロオキシゲナーゼ-2阻害剤(COX-2阻害剤)を含む非ステロイド性抗炎症剤
高齢者、体液量が減少している患者(利尿薬治療中の患者を含む)、または腎機能が低下している患者では、オルメサルタン メドキソミルなどのアンギオテンシン II 受容体拮抗薬と選択的 COX-2 阻害薬を含む NSAID を併用すると、悪化する可能性があります。可能性のある急性腎不全を含む腎機能の。これらの影響は通常可逆的です。オルメサルタン メドキソミルと NSAID 療法を受けている患者では、腎機能を定期的に監視します。
オルメサルタン メドキソミルを含むアンギオテンシン II 受容体拮抗薬の降圧効果は、選択的 COX-2 阻害剤を含む NSAID によって減弱される可能性があります。
レニン-アンジオテンシン系 (RAS) の二重遮断
アンジオテンシン受容体遮断薬、ACE 阻害薬、またはアリスキレンによる RAS の二重遮断は、単剤療法と比較して、低血圧、高カリウム血症、および腎機能の変化 (急性腎不全を含む) のリスクの増加と関連しています。 2 種類の RAS 阻害剤を組み合わせて投与されているほとんどの患者は、単剤療法と比較して追加の利益を得ることはありません。 RAS阻害剤との併用は原則として避けてください。ベニカーやその他の RAS に影響を与える薬剤を服用している患者の血圧、腎機能、電解質を注意深く監視します。
糖尿病患者にベニカーとアリスキレンを併用してはならない[参照 禁忌 ]。腎機能障害のある患者(GFR
リチウム
BENICAR を含むアンギオテンシン II 受容体拮抗薬とリチウムを併用投与すると、血清リチウム濃度の上昇とリチウム毒性が報告されています。併用中は血清リチウム濃度をモニターしてください。
コレセベラム塩酸塩
胆汁酸封鎖剤コレセベラム塩酸塩の同時投与は、オルメサルタンの全身曝露とピーク血漿濃度を低下させます。コレセベラム塩酸塩の少なくとも4時間前にオルメサルタンを投与すると、薬物相互作用効果が減少しました。コレセベラム塩酸塩の投与の少なくとも4時間前にオルメサルタンを投与することを検討してください[ 臨床薬理学 ]。
警告
の一部として含まれています "予防" セクション
予防
胎児毒性
ベニカー 10mg を妊婦に投与すると、胎児に害を及ぼす可能性があります。妊娠第 2 期および第 3 期にレニン-アンギオテンシン系 (RAS) に作用する薬物を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。結果として生じる羊水過少症は、胎児の肺形成不全および骨格の変形に関連している可能性があります。潜在的な新生児の副作用には、頭蓋形成不全、無尿症、低血圧、腎不全、および死亡が含まれます。妊娠が検出されたら、できるだけ早くベニカーを中止してください [ 特定の集団での使用 ]。
幼児の罹患率
歳未満の子供へのベニカーの使用は推奨されません。レニン-アンジオテンシン-アルドステロン系(RAAS)に直接作用する薬は、未熟な腎臓の発達に影響を与える可能性があります[参照 特定の集団での使用 ]。
体液量または塩分が枯渇した患者における低血圧
活性化されたレニン-アンギオテンシン-アルドステロン系を有する患者、例えば、体液量および/または塩分が枯渇している患者 (例えば、高用量の利尿薬で治療されている患者) では、ベニカーによる治療の開始後に症候性低血圧が予想される場合があります。綿密な医学的監督の下で治療を開始し、低用量から開始することを検討してください。低血圧が発生した場合は、患者を仰臥位にし、必要に応じて通常の生理食塩水を静脈内注入します[参照 投薬と管理 ]。一過性の低血圧反応は、その後の治療に対する禁忌ではありません。血圧が安定すれば、通常は問題なく継続できます。
腎機能障害
レニン-アンギオテンシン-アルドステロン系の阻害の結果として、ベニカーで治療された感受性のある個人では、腎機能の変化が予想される場合があります。腎機能がレニン-アンギオテンシナルドステロン系の活性に依存している可能性がある患者(例、重度のうっ血性心不全の患者)では、アンギオテンシン変換酵素(ACE)阻害薬およびアンギオテンシン受容体拮抗薬による治療は、乏尿および/または進行性高窒素血症と関連しています。急性腎不全および/または死亡を伴うことはめったにありません。ベニカーで治療された患者でも同様の結果が期待できる[参照 投薬と管理 、 薬物相互作用 、 特定の集団での使用 と 臨床薬理学 ]。
片側または両側の腎動脈狭窄症患者における ACE 阻害薬の研究では、血清クレアチニンまたは血中尿素窒素 (BUN) の増加が報告されています。片側性または両側性腎動脈狭窄症の患者にベニカーを長期間使用した例はありませんが、同様の結果が期待できます。
スプルー様腸症
オルメサルタンを服用してから数か月から数年後に、大幅な体重減少を伴う重度の慢性下痢が報告されています。患者の腸生検は、しばしば絨毛萎縮を示した。患者がオルメサルタンによる治療中にこれらの症状を発症した場合は、他の病因を除外してください。他の病因が特定されていない場合は、代替の降圧療法を検討してください。

高カリウム血症
ベニカーを投与されている患者では、血清カリウムを監視する必要があります。レニン・アンギオテンシン系を阻害する薬は、高カリウム血症を引き起こす可能性があります。高カリウム血症を発症する危険因子には、腎不全、真性糖尿病、およびカリウム保持性利尿薬、カリウムサプリメント、および/またはカリウム含有塩代用品の併用が含まれます[参照 薬物相互作用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
オルメサルタン メドキソミルは、最大 2 年間ラットに混餌投与した場合、発がん性はありませんでした。テストされた最高用量 (2000 mg/kg/日) は、mg/m2 ベースで、40 mg/日の最大推奨ヒト用量 (MRHD) の約 480 倍でした。マウスで実施された 2 つの発がん性研究、p53 ノックアウト マウスでの 6 か月の胃管強制経口投与研究、および Hras2 トランスジェニック マウスでの 6 か月の食事投与研究が、最大 1000 mg/kg/日 (MRHD の約 120 倍) の用量で行われました。 、オルメサルタン メドキソミルの発がん作用の証拠がないことを明らかにしました。
オルメサルタン メドキソミルとオルメサルタンは両方とも、インビトロのシリアンハムスター胚細胞形質転換試験で陰性であり、エームス(細菌変異原性)試験で遺伝毒性の証拠を示さなかった.しかし、どちらも in vitro で培養細胞 (チャイニーズハムスターの肺) に染色体異常を誘発することが示され、in vitro マウスリンパ腫アッセイでチミジンキナーゼ変異が陽性であることがテストされました。オルメサルタン メドキソミルは、2000 mg/kg までの経口投与で、MutaMouse の腸と腎臓の変異、およびマウス骨髄の染色体異常誘発性 (小核試験) について in vivo で陰性であることがテストされました (オルメサルタンはテストされていません)。
オルメサルタン メドキソミルを 1000 mg/kg/日 (MRHD の 240 倍) という高い用量レベルで投与しても、交配の 2 週間前 (メス) または 9 週間前 (オス) に投与を開始した研究では、ラットの生殖能力は影響を受けませんでした。
特定の集団での使用
妊娠
リスクの概要
ベニカー 10mg を妊婦に投与すると、胎児に害を及ぼす可能性があります。妊娠第 2 期および第 3 期にレニン-アンギオテンシン系に作用する薬剤を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。妊娠初期に降圧薬の使用にさらされた後の胎児の異常を調べるほとんどの疫学研究では、レニン-アンギオテンシン系に影響を与える薬物を他の降圧薬と区別していません。動物の生殖研究では、器官形成中のベニカー治療は、母体毒性用量よりも低い用量でラットの胎児毒性を増加させました。
妊娠が検出されたら、できるだけ早くベニカーを中止してください。妊娠中は代替降圧療法を検討してください。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天異常および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の高血圧は、子癇前症、妊娠糖尿病、早産、分娩合併症(帝王切開や分娩後出血の必要性など)のリスクを高めます。高血圧は、胎児の子宮内発育制限および子宮内死亡のリスクを高めます。高血圧症の妊婦は注意深く監視し、それに応じて管理する必要があります。
胎児/新生児の有害反応
妊娠第 2 および第 3 期にレニン-アンギオテンシン系に影響を与える薬剤を使用する妊婦の羊水過少症は、次の結果をもたらす可能性があります: 無尿および腎不全につながる胎児腎機能の低下、胎児肺形成不全、頭蓋骨形成不全を含む骨格変形、低血圧そして死。妊娠中にベニカー 20mg を服用している患者では、一連の超音波検査を実施して羊膜内環境を評価します。妊娠週に基づいて、胎児検査が適切な場合があります。ただし、患者と医師は、胎児が不可逆的な損傷を受けるまで羊水過少症が現れない可能性があることに注意する必要があります。
低血圧、乏尿、および高カリウム血症のためにベニカー 40mg に子宮内で曝露した歴史を持つ乳児を注意深く観察してください。ベニカーへの子宮内暴露歴のある新生児で、乏尿または低血圧が発生した場合は、適切な血圧と腎灌流を維持するための手段を利用してください。低血圧を逆転させ、腎機能をサポートする手段として、交換輸血または透析が必要になる場合があります。
データ
動物データ
オルメサルタン メドキソミルを妊娠ラットに最大 1000 mg/kg/日 (mg/m2 に基づく最大推奨ヒト用量 (MRHD) の 240 倍) まで経口投与した場合、または妊娠ウサギに経口投与した場合、催奇形性の影響は観察されませんでした。 1 mg/kg/日 (mg/m2 ベースで MRHD の半分。より高い用量は胎児の発育への影響を評価できなかった)。ラットでは、1.6 mg/kg/日以上の用量で仔の出生時体重の有意な減少と体重増加が観察され、発達マイルストーンの遅延 (耳介の分離の遅延、下切歯の萌出、腹毛の出現、精巣の下降、およびまぶたの分離)および腎盂の拡張の発生率の用量依存的な増加が、8 mg/kg/日以上の用量で観察されました。ラットにおける発生毒性の無影響用量は 0.3 mg/kg/日であり、MRHD の 40 mg/日の約 10 分の 1 である。
授乳
リスクの概要
母乳中のオルメサルタンの存在、母乳育児への影響、または乳生産への影響に関する情報はありません.オルメサルタンは、授乳中のラットの乳汁中に低濃度で分泌されます (参照 データ )。授乳中の乳児に悪影響を与える可能性があるため、母親にとっての薬の重要性を考慮して、授乳を中止するか薬を中止するかを決定する必要があります。
データ
母乳中のオルメサルタンの存在は、授乳中のラットに 5 mg/kg [14C] オルメサルタン メドキソミルを単回経口投与した後に観察されました。
小児用
ベニカーの降圧効果は、1 歳から 16 歳の小児患者を対象としたランダム化二重盲検臨床試験で評価された [ 臨床研究 ]。ベニカーの薬物動態は、1 歳から 16 歳の小児患者で評価された [参照 臨床薬理学 ]。ベニカー 10mg は、一般的に小児患者での忍容性が良好であり、副作用のプロファイルは成人の場合と同様でした。
ベニカー 20mg は、6 歳未満の子供の高血圧に有効であることが示されていません。
1 歳未満の子供へのベニカーの使用は推奨されません [参照 警告と注意事項 ]。レニン-アンギオテンシン-アルドステロン系 (RAAS) は、腎臓の発達において重要な役割を果たしています。 RAAS 遮断は、非常に若いマウスで異常な腎臓の発達につながることが示されています。レニンアンギオテンシン アルドステロン系 (RAAS) に直接作用する薬物を投与すると、正常な腎臓の発達が変化する可能性があります。
高齢者の使用
臨床試験でベニカーを投与された高血圧患者の総数のうち、20% 以上が 65 歳以上であり、5% 以上が 75 歳以上でした。高齢患者と若年患者の間で、有効性または安全性に全体的な差は認められませんでした。他の報告された臨床経験では、高齢患者と若年患者の間の反応の違いは確認されていませんが、一部の高齢者の感受性が高いことは除外できません[参照] 臨床薬理学 ]。
肝障害
AUC0-∞ と Cmax の増加は、対応する対照と比較して中等度の肝障害を持つ患者で観察され、AUC は約 60% 増加しました。中等度から重度の肝機能障害のある患者には、初期用量調整は推奨されない[ 臨床薬理学 ]。
腎障害
腎不全の患者は、正常な腎機能を持つ被験者と比較して、オルメサルタンの血清濃度が上昇しています。反復投与後、AUC は重度の腎障害 (クレアチニンクリアランス 投薬と管理 、 警告と注意事項 と 臨床薬理学 ]。
黒人患者
ベニカー 10mg の降圧効果は、ACE 阻害剤、ベータ遮断薬、および他のアンギオテンシン受容体遮断薬で見られたように、黒人患者 (通常は低レニン集団) では小さかった.
過剰摂取
ヒトの過剰摂取に関して利用できるデータは限られています。過剰摂取の最も可能性の高い症状は、低血圧と頻脈です。副交感神経 (迷走神経) の刺激が発生すると、徐脈が発生する可能性があります。症候性低血圧が発生した場合は、支持療法を開始します。オルメサルタンの透析性は不明です。
禁忌
糖尿病患者にベニカー 20mg とアリスキレンを併用してはならない [参照 薬物相互作用 ]。
臨床薬理学
作用機序
アンギオテンシン II は、アンギオテンシン変換酵素 (ACE、キニナーゼ II) によって触媒される反応で、アンギオテンシン I から形成されます。アンジオテンシン II は、血管収縮、合成の刺激、アルドステロンの放出、心臓の刺激、ナトリウムの腎再吸収などの効果を持つ、レニン-アンジオテンシン系の主要な昇圧剤です。オルメサルタンは、血管平滑筋の AT1 受容体へのアンギオテンシン II の結合を選択的にブロックすることにより、アンギオテンシン II の血管収縮作用をブロックします。したがって、その作用は、アンギオテンシン II 合成の経路とは無関係です。
AT2 受容体は多くの組織にも見られますが、この受容体が心臓血管の恒常性に関連していることは知られていません。オルメサルタンは、AT2 受容体よりも AT1 受容体に対して 12,500 倍以上の親和性を持っています。
アンギオテンシン I からアンギオテンシン II の生合成を阻害する ACE 阻害剤によるレニン-アンギオテンシン系の遮断は、高血圧の治療に使用される多くの薬剤のメカニズムです。 ACE阻害剤は、ACEによって触媒される反応であるブラジキニンの分解も阻害します。オルメサルタン メドキソミルは ACE (キニナーゼ II) を阻害しないため、ブラジキニンに対する反応には影響しません。この違いに臨床的な関連性があるかどうかはまだわかっていません。
アンギオテンシン II 受容体の遮断は、レニン分泌に対するアンギオテンシン II の負の調節フィードバックを阻害しますが、結果として生じる血漿レニン活性の増加と循環アンギオテンシン II レベルは、オルメサルタンの血圧への影響を克服しません。
薬力学
2.5 mg から 40 mg のベニカー用量は、アンギオテンシン I 注入の昇圧効果を阻害します。阻害効果の持続時間は用量に関連しており、40 mg を超えるベニカーの用量では 24 時間で 90% を超える阻害が得られました。
健常人および高血圧患者にベニカー10mgを単回および反復投与すると、血漿中のアンギオテンシンIおよびアンギオテンシンII濃度とレニン活性(PRA)が上昇します。最大 80 mg のベニカーの反復投与では、アルドステロン レベルへの影響は最小限で、血清カリウムへの影響はありませんでした。
薬物動態
吸収
オルメサルタン メドキソミルは、消化管からの吸収中にオルメサルタンへのエステル加水分解によって迅速かつ完全に生物活性化されます。
ベニカー錠とベニカー錠から調製された懸濁製剤は生物学的に同等である [参照 投薬と管理 ]。
オルメサルタンの絶対バイオアベイラビリティは約 26% です。経口投与後、オルメサルタンの最高血漿濃度 (Cmax) は 1 ~ 2 時間後に到達します。食事はオルメサルタンのバイオアベイラビリティーに影響しません。ベニカーは食事の有無にかかわらず投与できます。
分布
オルメサルタンの分布量は約 17 L です。オルメサルタンは血漿タンパク質との結合性が高く (99%)、赤血球を透過しません。タンパク質結合は、推奨用量で達成される範囲をはるかに超える血漿オルメサルタン濃度で一定です。
ラットでは、オルメサルタンは血液脳関門を通過したとしてもほとんど通過しませんでした.オルメサルタンはラットの胎盤関門を通過し、胎児に分配されました。オルメサルタンは、ラットで低レベルで牛乳に分配されました.
代謝と排泄
吸収中にオルメサルタン メドキソミルがオルメサルタンに急速かつ完全に変換された後、実質的にオルメサルタンのそれ以上の代謝はありません。オルメサルタンの総血漿クリアランスは 1.3 L/h、腎クリアランスは 0.6 L/h です。吸収された線量の約 35% から 50% が尿中に回収され、残りは胆汁を介して糞便中に排出されます。
オルメサルタンは、約 13 時間の最終排出半減期で二相性で排出されるようです。オルメサルタンは、最大 320 mg の単回経口投与および最大 80 mg の複数回経口投与後に直線的な薬物動態を示します。オルメサルタンの定常状態レベルは 3 ~ 5 日以内に達成され、1 日 1 回の投与では血漿への蓄積は発生しません。
特定の集団
高齢患者
オルメサルタンの薬物動態は、高齢者(65歳以上)で研究されました。全体として、オルメサルタンの最大血漿濃度は、若年成人と高齢者で類似していました。オルメサルタンの中程度の蓄積が、高齢者の反復投与で観察されました。 AUCss、τ は高齢患者で 33% 高く、これは CLR の約 30% の減少に相当する [参照 投薬と管理 と 特定の集団での使用 ]。
小児患者
オルメサルタンの薬物動態は、1 ~ 16 歳の小児高血圧患者で研究されました。小児患者のオルメサルタンのクリアランスは、体重で調整すると成人患者のクリアランスと同様でした[参照 特定の集団での使用 ]。
オルメサルタンの薬物動態は、1 歳未満の小児患者では調査されていない [参照 警告と注意事項 と 特定の集団での使用 ]。
男性と女性の患者
男性と比較して、女性のオルメサルタンの薬物動態にわずかな違いが観察されました。 AUC と Cmax は、男性よりも女性の方が 10 ~ 15% 高かった。
肝障害のある患者
AUC0-∞ と Cmax の増加は、対応する対照と比較して中等度の肝障害を持つ患者で観察され、AUC は約 60% 増加しました [参照 投薬と管理 と 特定の集団での使用 ]。
腎障害のある患者
腎不全の患者では、オルメサルタンの血清濃度は、正常な腎機能の被験者と比較して上昇していました.反復投与後、AUC は重度の腎障害 (クレアチニンクリアランス 投薬と管理 、 警告と注意事項 と 特定の集団での使用 ]。
薬物相互作用研究
胆汁酸封鎖剤 コレセベラム
健康な被験者にオルメサルタン メドキソミル 40 mg と塩酸コレセベラム 3750 mg を同時に投与すると、オルメサルタンの Cmax が 28% 減少し、AUC が 39% 減少しました。塩酸コレセベラムの 4 時間前にオルメサルタン メドキソミルを投与した場合、Cmax と AUC のそれぞれ 4% と 15% の減少という、より少ない効果が観察された [ 薬物相互作用 ]。
その他の研究
健康なボランティアにオルメサルタン メドキソミルをジゴキシンまたはワルファリンと併用投与した研究では、有意な薬物相互作用は報告されていません。
オルメサルタンのバイオアベイラビリティは、制酸剤 [Al(OH)3/Mg(OH)2] の同時投与によって有意に変化しませんでした。
オルメサルタン メドキソミルはシトクロム P450 システムによって代謝されず、P450 酵素に影響を与えません。したがって、これらの酵素によって阻害、誘導、または代謝される薬物との相互作用は予想されません。
臨床研究
成人高血圧
ベニカー 10 mg の降圧効果は、2.5 mg から 80 mg の範囲の用量で 6 週間から 12 週間にわたる 7 つのプラセボ対照研究で実証されており、それぞれの研究で最高血圧と最低血圧の統計的に有意な低下が示されています。本態性高血圧症の合計 2693 人の患者 (ベニカー 2145 人、プラセボ 548 人) が研究されました。ベニカー 40mg を 1 日 1 回服用すると、拡張期血圧と収縮期血圧が低下しました。次のグラフに示すように、応答は用量に関連していました。ベニカーを毎日 20 mg 服用すると、プラセボより約 10/6 mmHg 低い座位血圧 (BP) が低下し、毎日 40 mg を服用すると、プラセボより約 12/7 mmHg 低い座位血圧 (BP) が低下します。ベニカー 10mg の用量が 40mg を超えると、追加の効果はほとんどありませんでした。降圧効果の発現は 1 週間以内に発生し、2 週間後に大部分が明らかになりました。
ベニカー 40mg 用量反応 プラセボ調整後の血圧低下 (mmHg) 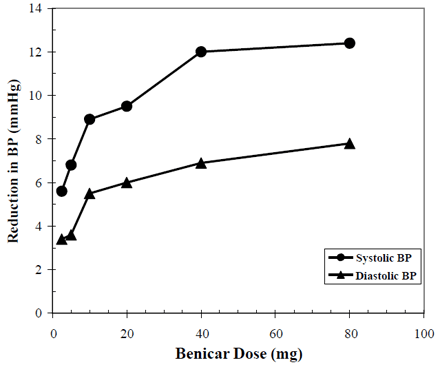
上記のデータは、7 つのプラセボ対照試験 (ベニカー患者 2,145 人、プラセボ患者 548 人) からのものです。血圧降下効果は、ベニカーを 1 日 1 回投与した場合、24 時間にわたって維持され、収縮期および拡張期反応のトラフ対ピーク比は 60 ~ 80% でした。
ベニカー 40mg の血圧降下効果は、ヒドロクロロチアジドの有無にかかわらず、最長 1 年間治療を受けた患者で維持されました。ベニカーによる長期治療中のタキフィラキシーや、1 年間の治療後にオルメサルタン メドキソミルを突然中止した後のリバウンド効果の証拠はありませんでした。
ベニカーの降圧効果は、男性と女性、および 65 歳以上の患者でも同様でした。 ACE阻害薬、ベータ遮断薬、その他のアンギオテンシン受容体遮断薬で見られたように、黒人患者(通常は低レニン集団)では効果が小さかった.ベニカーは、ヒドロクロロチアジドに追加すると、追加の血圧降下効果がありました.
高血圧患者の心血管リスクの低下を示すベニカーの試験はありませんが、少なくとも 1 つの薬理学的に類似した薬がそのような利点を示しています。
小児高血圧症
小児集団におけるベニカー 40mg の降圧効果は、6 歳から 16 歳までの 302 人の高血圧患者を対象とした無作為二重盲検試験で評価されました。研究集団は、112 人の患者からなるすべて黒人のコホートと、38 人の黒人患者を含む 190 人の患者からなる混合人種コホートで構成されていました。高血圧の病因は、主に本態性高血圧でした (黒人コホートの 87% と混合コホートの 67%)。体重が 20 から 35 kg 未満の患者は、ベニカー 2.5 mg または 20 mg の 1 日 1 回投与に無作為に割り付けられ、体重が 35 kg 以上の患者はベニカー 5 mg または 40 mg の 1 日 1 回投与に無作為に割り付けられました。 3 週間の終わりに、患者はベニカーを継続するか、最大 2 週間プラセボを服用するかのいずれかに再ランダム化されました。初期の用量反応段階で、ベニカー 40mg は収縮期血圧と拡張期血圧の両方を、体重調整した用量依存的に有意に低下させました。全体として、ベニカーの 2 つの用量レベル (低および高) は、収縮期血圧をベースラインからそれぞれ 6.6 および 11.9 mmHg 大幅に低下させました。これらの収縮期血圧の低下には、薬物効果とプラセボ効果の両方が含まれていました。プラセボへの無作為化中止期間中、ベニカー 40mg の投与を継続している患者では、プラセボへの中止患者よりも谷の平均収縮期血圧が 3.2 mmHg 低く、谷の平均拡張期血圧が 2.8 mmHg 低かった。これらの違いは統計的に異なっていました。成人集団で観察されたように、血圧の低下は黒人患者の方が小さかった.
同じ研究で、体重が 5 kg 以上の 1 歳から 5 歳の患者 59 人が非盲検期に 0.3 mg/kg のベニカー 10 mg を 1 日 1 回 3 週間投与され、その後、二重盲検でベニカーまたはプラセボに無作為に割り付けられました。段階。離脱の第 2 週の終わりに、ベニカーに無作為に割り付けられたグループでは、谷の平均収縮期/拡張期血圧が 3/3 mmHg 低かった。この血圧の差は統計的に有意ではありませんでした (95% CI -2 から 7/-1 から 7)。
患者情報
妊娠
妊娠中のベニカー 20mg への曝露の影響について、妊娠可能年齢の女性患者に助言する。妊娠を計画している女性と治療の選択肢について話し合います。できるだけ早く医師に妊娠を報告するように患者に伝えます [ 警告と注意事項 と 特定の集団での使用 ]。
授乳
授乳中の女性には、BENICAR による治療中は授乳しないようにアドバイスしてください [参照 特定の集団での使用 ]。
高カリウム血症
医療提供者に相談せずに、カリウムのサプリメントやカリウムを含む塩代用品を使用しないように患者に助言する[参照 薬物相互作用 ]。
