Zyvox 600mg Linezolid 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Zyvox 600mg とは何ですか?
Zyvox は、肺炎、皮膚感染症、および他の抗生物質に耐性のある感染症などの細菌感染症の症状を治療するために使用される処方薬です。 Zyvox 600mg は、単独で使用することも、他の薬剤と併用することもできます。
Zyvox は、抗生物質、その他と呼ばれる薬物のクラスに属します。オキサゾリジノン。
Zyvox が子供に安全で有効であるかどうかはわかっていません。
Zyvox の考えられる副作用は何ですか?
Zyvox は、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔やのどの腫れ、
- 重度の皮膚反応、
- 熱、
- 喉の痛み、
- 燃える目、
- 皮膚の痛み、
- 水ぶくれやはがれを伴う赤または紫の皮膚発疹、
- 視力の問題、
- あなたのビジョンの変化、
- 激しい胃痛、
- 水様または血様の下痢、
- 発作、
- 発汗、
- 不安になったり、震えたり、
- 攪拌、
- 幻覚、
- 熱、
- 震え、
- 速い心拍数、
- 筋肉の硬直、
- けいれん、
- 調整の喪失、
- 吐き気、
- 嘔吐、
- 下痢、
- 異常な筋肉痛、
- 呼吸困難、
- 胃痛、
- 不規則な心拍数、
- めまい、
- 寒いです、
- 極度の脱力感や疲労感、
- 錯乱、
- 口内炎、
- 皮膚のただれ、
- あざができやすい、
- 不正出血、
- 薄い肌、
- 手足の冷え、
- 立ちくらみ、および
- 呼吸困難
上記の症状がある場合は、すぐに医療機関を受診してください。
Zyvox の最も一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- 下痢、
- 軽度の皮膚発疹、
- 貧血(低赤血球)、
- 頭痛と
- めまい
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Zyvox の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
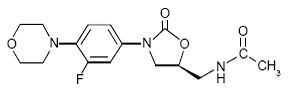
ZYVOX 600mg IV 注射剤、ZYVOX 錠、および経口懸濁液用の ZYVOX には、リネゾリドが含まれています。リネゾリドは、オキサゾリジノン クラスの合成抗菌剤です。リネゾリドの化学名は、(S)-N-[[3-[3-フルオロ-4-(4モルホリニル)フェニル]-2-オキソ-5-オキサゾリジニル]メチル]-アセトアミドです。
実験式は C16H20FN3O4 です。分子量は 337.35 で、化学構造は以下のとおりです。
ZYVOX 600mg IV 注射は、静脈内注入用のすぐに使用できる無菌等張液として供給されます。各 mL には 2 mg のリネゾリドが含まれています。不活性成分は、静脈内投与用の水性ビヒクル中のクエン酸ナトリウム、クエン酸、およびデキストロースです。ナトリウム (Na+) 含有量は 0.38 mg/mL (5 mEq/300 mL バッグおよび 1.7 mEq/100 mL バッグ) です。
経口投与用の ZYVOX 錠には、フィルムコーティングされた圧縮錠として 600 mg のリネゾリドが含まれています。不活性成分は、コーンスターチ、微結晶性セルロース、ヒドロキシプロピルセルロース、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、ヒプロメロース、ポリエチレングリコール、二酸化チタン、カルナバワックスです。ナトリウム (Na+) 含有量は、600 mg 錠剤あたり 2.92 mg (0.1 mEq/錠剤) です。
ZYVOX 600mg for Oral Suspension は、経口投与用の懸濁液に構成するためのオレンジ風味の顆粒/粉末として供給されます。構成後、各 5 mL には 100 mg のリネゾリドが含まれています。不活性成分は、スクロース、クエン酸、クエン酸ナトリウム、微結晶性セルロースおよびカルボキシメチルセルロースナトリウム、アスパルテーム、キサンタンガム、マンニトール、安息香酸ナトリウム、コロイド状二酸化ケイ素、塩化ナトリウム、香料 [参照 患者情報 ]。ナトリウム (Na+) 含有量は 8.52 mg/5 mL (0.4 mEq/5 mL) です。
適応症
院内肺炎
ZYVOX は、黄色ブドウ球菌 (メチシリン感受性および耐性の分離株) または肺炎連鎖球菌によって引き起こされる院内肺炎の治療に適応されます [参照 臨床研究 ]。
市中肺炎
ZYVOX 600mg は、菌血症または黄色ブドウ球菌 (メチシリン感受性分離株のみ) を併発した症例を含む、肺炎連鎖球菌によって引き起こされる市中肺炎の治療に適応されます [参照 臨床研究 ]。
複雑な皮膚および皮膚構造の感染症
ZYVOX 600mg は、黄色ブドウ球菌 (メチシリン感受性および耐性分離株)、化膿連鎖球菌、または Streptococcus agalactiae によって引き起こされる、付随する骨髄炎を伴わない、糖尿病性足感染症を含む複雑な皮膚および皮膚構造感染症の治療に適応されます。 ZYVOX は、褥瘡の治療において研究されていません [参照 臨床研究 ]。
合併症のない皮膚および皮膚構造の感染症
ZYVOX 600mg は、黄色ブドウ球菌 (メチシリン感受性分離株のみ) または化膿連鎖球菌 [参照 臨床研究 ]。
バンコマイシン耐性エンテロコッカス・フェシウム感染症
ZYVOX 600mg は、菌血症を併発している症例を含む、バンコマイシン耐性のエンテロコッカス・フェシウム感染症の治療に適応されています。 臨床研究 ]。
使用制限
- ZYVOX 600mg は、グラム陰性菌感染症の治療には適応されません。付随するグラム陰性病原体が記録されているか、疑われる場合は、特定のグラム陰性菌療法を直ちに開始することが重要です[参照 警告と注意事項 ]。
- 28日以上投与されたZYVOX 600mg製剤の安全性と有効性は、対照臨床試験で評価されていません[参照 臨床研究 ]。
使用法
薬剤耐性菌の発生を減らし、ZYVOX 600mg およびその他の抗菌薬の有効性を維持するために、ZYVOX は、感受性のある細菌によって引き起こされることが証明されているか、強く疑われる感染症を治療または予防するためにのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
一般的な用法・用量
感染症治療のための ZYVOX 600mg 製剤の推奨投与量を表 1 に示します。
静脈内投与から経口投与に変更する場合、用量調整は必要ありません。
静脈内投与
ZYVOX 600mg IV 注射は、単回投与のすぐに使用できる輸液バッグで提供されます。非経口製剤は、投与前に粒子状物質がないか視覚的に検査する必要があります。袋をしっかりと絞って微量の漏れがないか確認してください。漏れが検出された場合は、無菌性が損なわれる可能性があるため、溶液を廃棄してください。輸液バッグは、使用するまでオーバーラップに入れて保管してください。室温で保管してください。凍結から保護してください。 ZYVOX 600mg IV 注射は、効力に悪影響を与えることなく、時間の経過とともに強くなる黄色を示す場合があります。
ZYVOX IV 注射剤は、30 ~ 120 分間かけて静脈内注入して投与する必要があります。この点滴バッグを直列接続で使用しないでください。この溶液には添加物を入れないでください。 ZYVOX 600mg IV 注射を他の薬剤と同時に投与する場合は、各製品の推奨用量と投与経路に従って、各薬剤を個別に投与する必要があります。未使用部分は廃棄してください。
同じ静脈ラインを複数の薬剤の連続注入に使用する場合、ZYVOX IV 注射の注入の前後に、ZYVOX 600mg IV 注射およびこの共通ラインを介して投与される他の薬剤と互換性のある輸液でラインを洗浄する必要があります。 .
互換性
互換性のある静脈内溶液には、0.9% 塩化ナトリウム注射液 (USP)、5% ブドウ糖注射液 (USP)、および乳酸リンゲル液注射液 (USP) が含まれます。
非互換性
ZYVOX 600mg IV 注射を、Y 部位の模擬投与中に次の薬物と組み合わせた場合、身体的不適合が生じました: アンホテリシン B、クロルプロマジン HCl、ジアゼパム、ペンタミジン イソチオネート、エリスロマイシン ラクトビオネート、フェニトイン ナトリウム、およびトリメトプリム-スルファメトキサゾール。さらに、ZYVOX IV 注射剤をセフトリアキソン ナトリウムと組み合わせた場合、化学的不適合性が生じました。
経口懸濁液の構成
ZYVOX for Oral Suspension は、構成用の粉末/顆粒として供給されます。ボトルを軽く叩いて粉末をほぐします。合計 123 mL の蒸留水を 2 回に分けて追加します。最初の半分を加えた後、激しく振って粉末全体を濡らします。次に残りの半分の水を加え、激しく振って均一な懸濁液にします。構成後、5 mL の懸濁液には 100 mg のリネゾリドが含まれています。使用前にボトルを3~5回転倒混和してください。振らないでください。懸濁液を室温で保存する。構成後21日以内に使用してください。
供給方法
剤形と強度
ZYVOX 600mg IV 注射: 200 mg/100 mL (2 mg/mL) および 600 mg/300 mL (2 mg/mL) リネゾリド単回投与、すぐに使用できる柔軟なプラスチック輸液バッグで、ホイル ラミネート オーバーラップに入っています。
ZYVOX 600 mg 錠:
片面に「ZYV」、もう片面に「600」とデボス加工された白いカプセル型のフィルムコーティング錠 経口懸濁液用の ZYVOX 600mg: 乾燥、白色からオフホワイト、オレンジ風味の顆粒/粉末。指示どおりに構成されている場合、各ボトルには、各 5 mL あたり 100 mg のリネゾリドに相当する 150 mL の懸濁液が含まれます。
保管と取り扱い
注入
ザイボックス 600mg IV 注射剤は、ホイルラミネートオーバーラップに入った、すぐに使用できる柔軟なプラスチック輸液バッグに入った単回投与で入手できます。輸液バッグとポートは、天然ゴム ラテックス製ではありません。輸液バッグは、次のパッケージ サイズで利用できます。
200mg/100mL(2mg/mL)リネゾリド×10 - NDC 0009-5137-04 600mg/300mL (2mg/mL) リネゾリド×10 - NDC 0009-5140-04
錠剤
ザイボックス600mg錠 次のように使用できます。
600mg(片面に「ZYV」、片面に「600」と刻印された白色のカプセル型フィルムコーティング錠)
HDPE ボトルに 20 錠 - NDC 0009-5138-02 30錠の単位用量パッケージ - NDC 0009-5138-03
経口懸濁液
経口懸濁液用 ZYVOX 乾燥した白からオフホワイトのオレンジ風味の顆粒/粉末として入手できます。指示どおりに構成されている場合、各ボトルには、各 5 mL あたり 100 mg のリネゾリドに相当する 150 mL の懸濁液が含まれます。経口懸濁液用の ZYVOX は、次のように供給されます。
240 mL ガラス瓶で 100 mg/5 mL - NDC 0009-5136-01
保管と取り扱い
25°C (77°F) で保管してください。光から保護します。湿気から保護するために、ボトルをしっかりと閉じて保管してください。輸液バッグは、使用するまでオーバーラップで保管することをお勧めします。輸液バッグを凍結から保護します。
Pfizer Inc, NY, NY 10017 の Pharmacia & Upjohn Co Division によって配布されています。改訂: 2021 年 11 月。
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
大人
ZYVOX 600mg 製剤の安全性は、7 つの第 III 相比較対照臨床試験に登録された 2,046 人の成人患者で評価され、最長 28 日間治療を受けました。
合併症のない皮膚および皮膚構造感染症 (uSSSI) の治療を受けた患者のうち、ZYVOX 治療を受けた患者の 25.4% とコンパレータ治療を受けた患者の 19.6% が、少なくとも 1 つの薬物関連の有害事象を経験しました。他のすべての適応症では、ZYVOX で治療された患者の 20.4% と、コンパレータで治療された患者の 14.3% が、少なくとも 1 つの薬物関連の有害事象を経験しました。
表 2 は、ZYVOX の投与量ごとに、これらの試験で少なくとも 1% の成人患者で報告された、すべての因果関係のある治療に起因する副作用の発生率を示しています。
uSSSI の治療を受けた患者のうち、ZYVOX 治療を受けた患者の 3.5% とコンパレータ治療を受けた患者の 2.4% が、薬物関連の有害事象のために治療を中止しました。他のすべての適応症では、薬物関連の有害事象による中止は、ZYVOX 治療を受けた患者の 2.1% およびコンパレータ治療を受けた患者の 1.7% で発生しました。治療の中止につながる最も一般的に報告された薬物関連の有害事象は、吐き気、頭痛、下痢、および嘔吐でした.
小児患者
ZYVOX 製剤の安全性は、出生から 11 歳までの 215 人の小児患者と、5 歳から 17 歳までの 248 人の小児患者で評価されました (これらの 248 人のうち 146 人は 5 歳から 11 歳で、102 人は 12 歳から 17 歳でした)。これらの患者は、2 つの第 III 相比較対照臨床試験に登録され、最大 28 日間治療を受けました。 2 対 1 (リネゾリド: バンコマイシン) にランダム化されたグラム陽性感染症の入院小児患者 (出生から 11 歳まで) の研究では、死亡率はリネゾリド群で 6.0% (13/215)、3.0% (3/101) でした。バンコマイシンアームで。しかし、患者集団に深刻な基礎疾患があることを考えると、因果関係を確立することはできませんでした。
uSSSI の治療を受けた小児患者のうち、ZYVOX 治療を受けた患者の 19.2% とコンパレータ治療を受けた患者の 14.1% が、少なくとも 1 つの薬物関連の有害事象を経験しました。他のすべての適応症では、ZYVOX 治療を受けた患者の 18.8% とコンパレータ治療を受けた患者の 34.3% が、少なくとも 1 つの薬物関連の有害事象を経験しました。
表 3 は、第 3 相比較対照試験において、いずれかの治療群の小児患者の 1% 以上 (および 1 人以上の患者) で報告された、全因果関係のある治療に起因する副作用の発生率を示しています。
uSSSI の治療を受けた小児患者のうち、ZYVOX 治療を受けた患者の 1.6% とコンパレータ治療を受けた患者の 2.4% が、薬物関連の有害事象のために治療を中止しました。他のすべての適応症では、薬物関連の有害事象による中止は、ZYVOX 治療を受けた患者の 0.9% およびコンパレータ治療を受けた患者の 6.1% で発生しました。
実験室の異常
ZYVOX は、最大 28 日間、12 時間ごとに最大 600 mg の用量で使用した場合、血小板減少症と関連しています。第 III 相比較対照試験では、血小板数が大幅に減少した成人患者の割合 (正常値および/またはベースラインの下限の 75% 未満と定義) は 2.4% (研究間の範囲: 0.3 ~ 10.0%) でした。 ZYVOX 600mg と 1.5% (研究間の範囲: 0.4 から 7.0%) との比較。出生から 11 歳までの入院小児患者の研究では、血小板数が大幅に低下した患者の割合 (正常値および/またはベースラインの下限の 75% 未満と定義) は、ZYVOX 600mg で 12.9% でした。バンコマイシンで13.4%。 5 歳から 17 歳までの小児患者の外来研究では、実質的に低い血小板数を発症した患者の割合は、ZYVOX で 0%、セファドロキシルで 0.4% でした。 ZYVOX の使用に伴う血小板減少症は、治療期間 (一般的に 2 週間以上の治療) に依存しているようです。ほとんどの患者の血小板数は、フォローアップ期間中に正常範囲/ベースラインに戻りました。血小板減少症を発症している患者を対象とした第 3 相臨床試験では、関連する臨床的有害事象は確認されませんでした。 ZYVOX の人道的使用プログラムにおいて、血小板減少症の患者で出血イベントが確認されました。これらのイベントにおけるリネゾリドの役割は決定できません[参照 警告と注意事項 ]。
薬物関係に関係なく、他の実験室パラメーターに見られる変化は、ZYVOX 600mg と比較対象の間に実質的な違いがないことを明らかにしました。これらの変化は一般的に臨床的に重要ではなく、治療の中止にはつながらず、元に戻すことができました。少なくとも 1 つの実質的に異常な血液学的または血清化学値を持つ成人および小児患者の発生率を表 4、5、6、および 7 に示します。
市販後の経験
ZYVOXの承認後の使用中に、次の副作用が確認されました。これらの反応は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
- 骨髄抑制(貧血、白血球減少症、汎血球減少症、および血小板減少症を含む)[参照 警告と注意事項 ];鉄芽球性貧血。
- 末梢神経障害、およびときに視力喪失に進行する視神経障害[参照 警告と注意事項 ]。
- 乳酸アシドーシス [参照 警告と注意事項 ]。これらの報告は主に、最大推奨期間である 28 日間よりも長い期間治療を受けた患者で報告されていますが、これらの事象はより短い期間の治療を受けている患者でも報告されています。
- セロトニン症候群は、選択的セロトニン再取り込み阻害薬(SSRI)やオピオイドなどの抗うつ薬、および ZYVOX などのセロトニン作動薬を併用している患者で報告されています。 警告と注意事項 ]。
- けいれん[参照 警告と注意事項 ]。
- アナフィラキシー、血管性浮腫、中毒性表皮壊死融解症やスティーブンス・ジョンソン症候群などの重度の皮膚有害反応 (SCAR) を含む水疱性皮膚障害、および過敏性血管炎。
- リネゾリドの使用により、表面の歯の変色と舌の変色が報告されています。歯の変色は、結果がわかっているケースでは、プロのデンタル クリーニング (手動のスケール除去) で除去できました。
- 症候性エピソードを含む低血糖[参照 警告と注意事項 ]。
- 低ナトリウム血症および/または不適切な抗利尿ホルモン分泌症候群 (SIADH) [参照 警告と注意事項 ]。
薬物相互作用
モノアミンオキシダーゼ阻害剤
リネゾリドは、モノアミンオキシダーゼの可逆的な非選択的阻害剤です [参照 禁忌 と 臨床薬理学 ]。
アドレナリンおよびセロトニン作動薬
リネゾリドは、アドレナリン作動薬およびセロトニン作動薬と相互作用する可能性があります [参照 警告と注意事項 と 臨床薬理学 ]。
警告
の一部として含まれています "予防" セクション
予防
骨髄抑制
リネゾリドを投与された患者では、骨髄抑制(貧血、白血球減少症、汎血球減少症、血小板減少症を含む)が報告されています。結果がわかっている場合、リネゾリドが中止されたとき、影響を受けた血液学的パラメーターは治療前のレベルに向かって上昇しました。リネゾリドを投与されている患者、特にリネゾリドを 2 週間以上投与されている患者、既存の骨髄抑制がある患者、骨髄抑制を引き起こす併用薬を投与されている患者、または-以前または併用の抗菌薬療法を受けた。骨髄抑制を発症または悪化している患者では、リネゾリドによる治療の中止を検討する必要があります。
末梢および視神経障害
ZYVOX 600mg で治療された患者、主に 28 日間の最大推奨期間よりも長く治療された患者で、末梢神経障害および視神経障害が報告されています。視力喪失に進行した視神経症の症例では、患者は最大推奨期間を超えて長期間治療されました. ZYVOX で 28 日未満の治療を受けた一部の患者では、視覚のぼやけが報告されています。末梢神経障害および視神経障害も子供で報告されています。
患者が視力の変化、色覚の変化、かすみ目、または視野欠損などの視覚障害の症状を経験した場合は、迅速な眼科的評価が推奨されます。 ZYVOX を長期間 (3 か月以上) 服用しているすべての患者、および ZYVOX による治療期間に関係なく、新たな視覚症状を報告しているすべての患者の視覚機能を監視する必要があります。末梢神経障害または視神経障害が発生した場合、これらの患者に ZYVOX 600mg を継続して使用することは、潜在的なリスクと比較検討する必要があります。
セロトニン症候群
ZYVOX と、選択的セロトニン再取り込み阻害薬 (SSRI) などの抗うつ薬を含むセロトニン作動薬の併用に関連する死亡例を含む、セロトニン症候群の自発的な報告が報告されています。
臨床的に適切であり、患者がセロトニン症候群または神経弛緩性悪性症候群様(NMS様)反応の徴候および/または症状について注意深く観察されていない限り、リネゾリドはカルチノイド症候群の患者および/または以下のいずれかの薬を服用している患者に投与すべきではありません. : セロトニン再取り込み阻害薬、三環系抗うつ薬、ブプロピオン、ブスピロン、セロトニン 5-HT1 受容体アゴニスト (トリプタン)、メペリジンを含むオピオイド [参照 薬物相互作用 と 臨床薬理学 ]。
場合によっては、すでにセロトニン作動性抗うつ薬またはブスピロンを投与されている患者は、リネゾリドによる緊急治療が必要になる場合があります。リネゾリドの代替品がなく、リネゾリドの潜在的な利点がセロトニン症候群または NMS 様反応のリスクを上回る場合は、セロトニン作動性抗うつ薬を速やかに中止し、リネゾリドを投与する必要があります。患者は 2 週間 (フルオキセチンを服用した場合は 5 週間)、またはリネゾリドの最終投与から 24 時間後までのいずれか早い方で監視する必要があります。セロトニン症候群または NMS 様反応の症状には、高体温、硬直、ミオクローヌス、自律神経の不安定、せん妄や昏睡に至る極度の興奮を含む精神状態の変化が含まれます。患者は、抗うつ薬の中止症状についても監視する必要があります(関連する中止症状の説明については、指定された薬剤の添付文書を参照してください)。
カテーテル部位感染症を含むカテーテル関連血流感染症患者の調査研究における死亡率の不均衡
血管内カテーテル関連感染症の重症患者を対象とした非盲検試験では、バンコマイシン/ジクロキサシリン/オキサシリンと比較して、リネゾリドで治療された患者で死亡率の不均衡が見られた [78/363 (21.5%) vs. 58/363 (16.0%) );オッズ比 1.426、95% CI 0.970、2.098]。因果関係は確立されていませんが、この観察された不均衡は主に、ベースラインでグラム陰性病原体、グラム陰性病原体とグラム陽性病原体の混合、または病原体が特定されなかったリネゾリド治療患者で発生しましたが、グラム陽性感染症のみ。
リネゾリドは承認されておらず、カテーテル関連の血流感染症またはカテーテル部位感染症の患者の治療には使用しないでください。
リネゾリドはグラム陰性病原体に対する臨床活性がなく、グラム陰性感染症の治療には適応されません。付随するグラム陰性病原体が記録されているか、疑われる場合は、特定のグラム陰性菌療法を直ちに開始することが重要です[参照 適応症 ]。
Clostridioides Difficile関連下痢症
Clostridioides difficile 関連下痢症 (CDAD) は、ZYVOX 600mg を含むほぼすべての抗菌薬の使用で報告されており、重症度は軽度の下痢から致命的な大腸炎までさまざまです。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。 CDAD は、抗菌薬の使用後に下痢を呈するすべての患者で考慮しなければなりません。
CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗菌薬の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗菌薬治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
血圧上昇を引き起こす潜在的な相互作用
血圧上昇の可能性について患者を監視しない限り、リネゾリドは、コントロールされていない高血圧、褐色細胞腫、甲状腺中毒症の患者、および/または次の種類の薬を服用している患者に投与すべきではありません。血管抑制剤(例、エピネフリン、ノルエピネフリン)、ドーパミン作動薬(例、ドーパミン、ドブタミン)[参照 薬物相互作用 と 臨床薬理学 ]。
乳酸アシドーシス
ZYVOXの使用により、乳酸アシドーシスが報告されています。報告された症例では、患者は吐き気と嘔吐の繰り返しのエピソードを経験しました。 ZYVOX の投与中に再発性の悪心または嘔吐、原因不明のアシドーシス、または低重炭酸塩レベルを発症した患者は、直ちに医学的評価を受ける必要があります。
痙攣
リネゾリドで治療された患者では、痙攣が報告されています。これらのケースのいくつかでは、発作の履歴または発作の危険因子が報告されました。
低血糖症
可逆的な非選択的 MAO 阻害剤であるリネゾリドで治療した場合、インシュリンまたは経口血糖降下薬を投与された真性糖尿病患者において、症候性低血糖症の市販後症例が報告されています。一部の MAO 阻害剤は、インスリンまたは血糖降下薬を投与されている糖尿病患者の低血糖エピソードと関連しています。リネゾリドと低血糖との因果関係は確立されていませんが、糖尿病患者は、リネゾリドで治療した場合の潜在的な低血糖反応について警告する必要があります。
低血糖が発生した場合は、インスリンまたは経口血糖降下薬の投与量を減らすか、経口血糖降下薬、インスリン、またはリネゾリドの中止が必要になる場合があります。
低ナトリウム血症および/または不適切な抗利尿ホルモン分泌症候群 (SIADH)
低ナトリウム血症および/または不適切な抗利尿ホルモン分泌症候群 (SIADH) の市販後の症例が、リネゾリドで治療された患者で観察されています。報告された症例では、徴候と症状には錯乱、傾眠、全身の脱力感が含まれ、重度の症例では呼吸不全や死に至ることさえありました。高齢者、利尿剤を服用している患者、および ZYVOX を服用している間、低ナトリウム血症および/または SIADH のリスクがある他の患者の血清ナトリウム値を定期的に監視してください。低ナトリウム血症および/またはSIADHの徴候や症状が発生した場合は、ZYVOX 600mgを中止し、適切な支持手段を講じてください.
フェニルケトン尿症患者のリスク
フェニルアラニンは、フェニルケトン尿症 (PKU) の患者に有害な場合があります。 ZYVOX for Oral Suspension には、アスパルテームの成分であるフェニルアラニンが含まれています。 100 mg/5 mL の経口懸濁液の各 5 mL には、20 mg のフェニルアラニンが含まれています。 PKU 患者に経口懸濁液用 ZYVOX 600mg を処方する前に、経口懸濁液用 ZYVOX を含むすべての供給源からのフェニルアラニンの合計 1 日量を考慮してください。
他の ZYVOX 製剤にはフェニルアラニンは含まれていません。
薬剤耐性菌の発生
証明された、または強く疑われる細菌感染、または予防適応がない場合に ZYVOX を処方することは、患者に利益をもたらす可能性が低く、薬剤耐性菌の発生のリスクを高めます。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
リネゾリドの発がん性を評価するための動物での生涯試験は実施されていません。一連の試験では、変異原性も染色体異常誘発性の可能性も見出されませんでした: 変異原性のアッセイ (Ames 細菌復帰および CHO 細胞変異)、in vitro 不定期 DNA 合成 (UDS) アッセイ、ヒトリンパ球における in vitro 染色体異常アッセイ、およびin vivo マウス小核アッセイ。
リネゾリドは、妊娠 7 日目までの交配前の 14 日間、最大 100 mg/kg/日を経口投与された成体雌ラットの生殖能力または生殖能力に影響を与えませんでした。 50 mg/kg/日以上の用量で、予想されるヒトの暴露レベルとほぼ同等またはそれ以上の暴露 (暴露の比較は AUC に基づく)。可逆的な生殖能力の影響は、精子形成の変化によって媒介されました。影響を受けた精子細胞は、異常に形成され、配向されたミトコンドリアを含み、生存不能でした。精巣上体における上皮細胞の肥大および過形成が、生殖能力の低下と関連して観察された。同様の精巣上体の変化は犬では見られませんでした。
若年期に薬物に暴露された性的に成熟した雄ラットでは、リネゾリドでの治療後、性的発達のほとんどの期間 (生後 7 日から 36 日まで 50 mg/kg/日、および 100 mg/kg/日生後 37 日から 55 日まで)、3 か月から 11 歳の小児患者で観察された平均 AUC の最大 1.7 倍の曝露がありました。受胎能の低下は、より短い治療期間では観察されず、これは新生児期初期(妊娠6日目から生後5日目まで)、新生児期(生後5日目から21日目)までの子宮内曝露、または幼若期の曝露(生後22日目から35日目)に相当する。 )。精子の運動性の可逆的な低下と精子の形態の変化が、生後22日から35日まで処理されたラットで観察されました。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性にリネゾリドを使用した公表済みおよび市販後の症例報告から入手可能なデータでは、薬物に関連する主要な先天性欠損症、流産、または母体または胎児の有害転帰のリスクは特定されていません。器官形成期に投与された場合、リネゾリドはマウス、ラット、またはウサギに奇形を引き起こさなかったが、AUC に基づくと、母親の曝露レベルは、臨床治療曝露の約 6.5 倍 (マウス)、同等 (ラット)、または 0.06 倍 (ウサギ) であった。しかし、ヒトの推定暴露量の 6.5 倍の濃度で、マウスでは胚・胎児の致死率が観察された。泌乳期の器官形成期にメスのラットに投与した場合、AUC に基づくヒトの推定暴露量にほぼ等しい用量で、出生後の子ラットの生存率が低下した( データ )。
示された集団の主要な先天性欠損症および流産の背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
データ
動物データ
マウスでは、胚・胎児毒性は、母体毒性(臨床徴候および体重増加の減少)を引き起こす用量でのみ観察された。妊娠日 (GD) 6 ~ 16 (AUC に基づく推定ヒト暴露量の 6.5 倍) の 450 mg/kg/日の経口投与量は、総産仔数の減少、胎児体重の減少、および肋軟骨融合の発生率の増加。 150 mg/kg/日までの用量では、母体毒性も胚胎児毒性も観察されませんでした。胎児奇形は観察されなかった。
ラットでは、GD 6-17 に経口投与された 15 および 50 mg/kg/日で胎児毒性が観察された (AUC に基づく推定ヒト暴露のそれぞれ 0.22 倍の暴露)。影響は、胎児体重の減少と胸骨の骨化の減少からなり、胎児体重の減少に関連してしばしば見られる所見である。胎児奇形は観察されなかった。体重増加の減少という形での母体毒性が 50 mg/kg/日で見られた。
ウサギでは、GD 6-20 から与えられた 15 mg/kg/日の経口用量で投与された場合、母体毒性 (臨床徴候、体重増加の減少、摂餌量の減少) が存在する場合にのみ胎児体重の減少が起こりました (0.06 倍)。 AUC に基づくヒトの推定ばく露)。胎児奇形は観察されなかった。
雌ラットを妊娠中および授乳中 (GD 6 から授乳 20 日目まで) に 50 mg/kg/日 (AUC に基づく推定ヒト暴露量にほぼ相当) のリネゾリドで処理した場合、出生後 1 ~ 4 日で仔の生存率が低下しました。繁殖可能な年齢まで成熟させたオスとメスの子犬は、交配すると着床前損失の増加を示した。
授乳
リスクの概要
リネゾリドは母乳に含まれています。公開された症例報告のデータに基づくと、乳児が母乳から摂取するリネゾリドの 1 日量は、乳児の推奨治療用量 (8 時間ごとに 10 mg/kg) の約 6% から 9% になります。母乳で育てられた乳児に対するリネゾリドの影響に関する情報はありません。しかし、下痢と嘔吐は、リネゾリドを治療的に受けている乳児の臨床試験で報告された最も一般的な副作用でした[ 有害反応 ]および(臨床的考慮事項を参照)。リネゾリドの乳量への影響に関する情報はありません。母乳育児の発達上および健康上の利点は、リネゾリドに対する母親の臨床的必要性、およびリネゾリドまたは基礎となる母体の状態から母乳で育てられた子供への潜在的な悪影響とともに考慮されるべきです.
臨床上の考慮事項
授乳中の女性には、母乳で育てられた乳児の下痢と嘔吐を監視するようアドバイスしてください。
生殖能力のある雌と雄
不妊
男性
ラットでの研究結果に基づくと、ZYVOX は男性患者の生殖能力を可逆的に損なう可能性があります [参照 非臨床毒性学 )]。
小児用
以下の感染症の小児患者の治療における ZYVOX 600mg の安全性と有効性は、成人を対象とした適切かつ十分に管理された研究からの証拠、小児患者の薬物動態データ、およびグラム陽性菌の比較対照研究からの追加データによって裏付けられています。出生時から 11 歳までの年齢の小児患者における感染症 [参照 適応症 、 臨床薬理学 と 臨床研究 ]:
- 院内肺炎
- 複雑な皮膚および皮膚構造の感染症
- 市中肺炎 (生後 8 か月から 12 歳までの範囲の患者を対象とした非管理研究の証拠によっても裏付けられています)
- バンコマイシン耐性エンテロコッカス・フェシウム感染症
以下の感染症の小児患者の治療における ZYVOX 600mg の安全性と有効性は、5 歳から 17 歳までの小児患者を対象とした比較対照試験で確立されています [参照 臨床研究 ]:
- 黄色ブドウ球菌(メチシリン感受性菌株のみ)または化膿連鎖球菌による単純な皮膚および皮膚構造の感染症
脳室腹腔シャントを有する小児患者で生成された薬物動態情報は、リネゾリドの単回および複数回投与後の脳脊髄液 (CSF) リネゾリド濃度の変動を示しました。治療濃度は、CSFで一貫して達成または維持されませんでした。したがって、中枢神経系感染症の小児患者の経験的治療にリネゾリドを使用することは推奨されません。
リネゾリドの薬物動態は、出生から 17 歳までの小児患者で評価されています。一般に、リネゾリドの体重ベースのクリアランスは、小児患者の年齢が上がるにつれて徐々に減少します。ただし、早産(在胎週数 投薬と管理 と 臨床薬理学 ]。
限られた臨床経験では、ZYVOX 600mg で治療された最小発育阻止濃度 (MIC) が 4 mcg/mL のグラム陽性病原体による感染症の小児患者 6 人中 5 人 (83%) が臨床治癒しました。ただし、小児患者は、成人と比較して、リネゾリドクリアランスと全身暴露 (AUC) の変動性が大きくなります。臨床反応が最適ではない小児患者、特に MIC が 4 mcg/mL の病原体を有する小児患者では、臨床反応を評価する際に、全身曝露、感染部位および重症度が低く、基礎疾患を考慮する必要があります。 臨床薬理学 と 投薬と管理 ]。
高齢者の使用
第 3 相比較対照臨床試験で ZYVOX 600mg で治療された 2,046 人の患者のうち、589 人 (29%) が 65 歳以上、253 人 (12%) が 75 歳以上でした。これらの患者と若い患者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは特定されていませんが、一部の高齢者の感受性が高いことは除外できません.
過剰摂取
過剰摂取の場合は、糸球体濾過を維持しながら支持療法を行うことをお勧めします。血液透析は、リネゾリドのより迅速な除去を促進する可能性があります。第 1 相臨床試験では、リネゾリド投与の 3 時間後に開始する 3 時間の血液透析セッション中に、リネゾリド投与量の約 30% が除去されました。腹膜透析または血液灌流によるリネゾリドの除去に関するデータはありません。動物における急性毒性の臨床徴候は、3,000 mg/kg/日および 2,000 mg/kg/日でそれぞれ処置されたラットの活動低下および運動失調、イヌの嘔吐および振戦であった。
禁忌
過敏症
ZYVOX 製剤は、リネゾリドまたはその他の製品成分に対する過敏症があることがわかっている患者への使用は禁忌です。
モノアミンオキシダーゼ阻害剤
リネゾリドは、モノアミンオキシダーゼ A または B を阻害する医薬品(フェネルジン、イソカルボキサジドなど)を服用している患者、またはそのような医薬品を服用してから 2 週間以内に使用しないでください。
臨床薬理学
作用機序
ZYVOX は抗菌薬です。 微生物学 ]。
薬力学
無作為化、陽性およびプラセボ対照クロスオーバー QT 研究では、40 人の健康な被験者に、1 時間の IV 注入による ZYVOX 600 mg の単回投与、1 時間の IV 注入による ZYVOX 1,200 mg の単回投与、プラセボ、および陽性対照の単回経口投与。 600 mg と 1,200 mg の ZYVOX 600 mg の両方の用量で、QTc 間隔に対する有意な影響は、ピーク血漿濃度またはその他の時点で検出されませんでした。
薬物動態
単回および複数回の経口および静脈内投与後の成人におけるリネゾリドの平均薬物動態パラメーターを表 8 にまとめます。
図 1. 12 時間ごとの経口投与後の定常状態における成人のリネゾリドの血漿中濃度 (平均 ± 標準偏差、n=16)
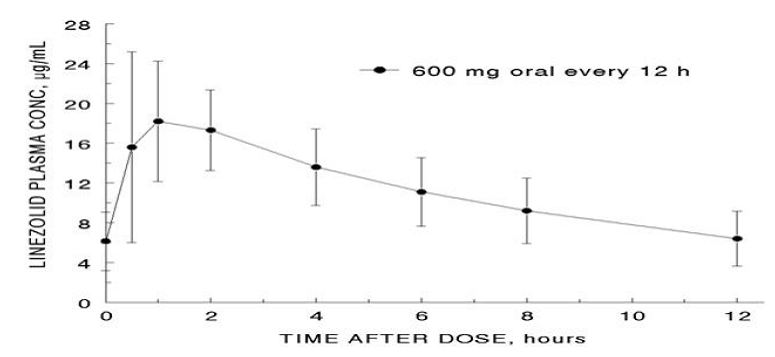
吸収
リネゾリドは、経口投与後に広範囲に吸収されます。投与後約 1 ~ 2 時間で最大血漿濃度に達し、絶対バイオアベイラビリティは約 100% です。したがって、リネゾリドは用量調整なしで経口または静脈内投与することができます。
リネゾリドは、食事のタイミングに関係なく投与できます。高脂肪食をリネゾリドと一緒に与えると、最大濃度に達する時間が 1.5 時間から 2.2 時間に遅延し、Cmax が約 17% 減少します。ただし、AUC0-∞として測定された総曝露量は、両方の条件下で類似しています。
分布
動物およびヒトの薬物動態研究は、リネゾリドが十分に灌流された組織に容易に分布することを示しています。リネゾリドの血漿タンパク質結合は約 31% で、濃度に依存しません。定常状態でのリネゾリドの分布量は、健康な成人ボランティアで平均 40 ~ 50 リットルでした。
リネゾリド濃度は、リネゾリドの複数回投与後の第 1 相ボランティア研究で、限られた数の被験者のさまざまな体液で測定されています。血漿に対する唾液中のリネゾリドの比率は 1.2 対 1 であり、血漿に対する汗中のリネゾリドの比率は 0.55 対 1 でした。
代謝
リネゾリドは、主にモルホリン環の酸化によって代謝され、アミノエトキシ酢酸代謝物 (A) とヒドロキシエチルグリシン代謝物 (B) の 2 つの不活性な開環カルボン酸代謝物が生成されます。代謝物 A の形成は酵素経路を介して形成されると推定されますが、代謝物 B は in vitro で非酵素的化学酸化メカニズムによって媒介されます。 in vitro 研究では、リネゾリドの代謝は最小限であり、ヒトチトクローム P450 によって媒介される可能性があることが示されています。しかし、リネゾリドの代謝経路は完全には理解されていません。
排泄
非腎クリアランスは、リネゾリドの総クリアランスの約 65% を占めます。定常状態では、用量の約 30% がリネゾリドとして、40% が代謝物 B として、10% が代謝物 A として尿中に現れます。リネゾリドの平均腎クリアランスは 40 mL/分であり、正味の尿細管再吸収を示唆しています。リネゾリドは実質的に糞便中には現れませんが、用量の約 6% が代謝物 B として、3% が代謝物 A として糞便中に現れます。
リネゾリドの投与量が増加すると、クリアランスにわずかな非線形性が観察されました。しかし、クリアランスの差は小さく、明らかな消失半減期には反映されませんでした。
特定の集団
高齢患者
リネゾリドの薬物動態は、高齢患者 (65 歳以上) では有意に変化しません。したがって、高齢患者の用量調整は必要ありません。
小児患者
単回静脈内投与後のリネゾリドの薬物動態は、出生から 17 歳までの年齢の小児患者 (未熟児および満期新生児を含む)、12 歳から 17 歳までの年齢の健康な思春期被験者、および1週間から12歳までの年齢。リネゾリドの薬物動態パラメーターは、単回静脈内投与後の小児集団および健康な成人被験者について、表 9 にまとめられています。
リネゾリドの Cmax と分布容積 (Vss) は、小児患者の年齢に関係なく類似しています。しかし、リネゾリドの血漿クリアランスは年齢の関数として変化します。生後 1 週間未満の早産児を除外すると、体重に基づくクリアランスは、生後 1 週間未満から 11 歳までの範囲の最も若い年齢層で最も急速であり、その結果、単回投与の全身暴露 (AUC) が低くなり、成人に比べて半減期が短い。小児患者の年齢が上がるにつれて、リネゾリドの体重ベースのクリアランスは徐々に減少し、思春期までに平均クリアランス値は成人集団で観察される値に近づきます。成人と比較して、すべての小児年齢層で、リネゾリドクリアランスと全身薬物曝露 (AUC) の被験者間変動が増加しています。
出生から 11 歳まで 8 時間ごとに投与された小児患者では、12 時間ごとに投与された青年または成人と比較して、同様の 1 日平均 AUC 値が観察されました。したがって、11 歳までの小児患者の投与量は、8 時間ごとに 10 mg/kg とします。 12 歳以上の小児患者は、12 時間ごとに 600 mg を投与する必要があります。 投薬と管理 ]。
性別
女性は男性よりもリネゾリドの分布量がわずかに少ない.血漿中濃度は男性よりも女性の方が高く、これは一部には体重の違いによるものです。 600 mg の投与後、平均経口クリアランスは男性よりも女性で約 38% 低くなります。しかし、見かけの消失率定数または半減期の平均値には、有意な性差はありません。したがって、女性の薬物曝露は、十分に許容されることが知られているレベルを超えて大幅に増加するとは予想されません。したがって、性別による用量調節は必要ないと思われる。
腎障害
親薬であるリネゾリドの薬物動態は、腎機能障害の程度にかかわらず変化しません。しかし、リネゾリドの 2 つの主要な代謝産物は、腎障害のある患者に蓄積し、蓄積量は腎機能障害の重症度とともに増加します (表 10 を参照)。リネゾリドとその 2 つの代謝産物の薬物動態は、血液透析を受けている末期腎疾患 (ESRD) の患者でも研究されています。 ESRD 研究では、14 人の患者がリネゾリド 600 mg を 12 時間ごとに 14.5 日間投与されました (表 11 を参照)。リネゾリドの血漿中濃度は腎機能に関係なくほぼ同じになるため、腎機能障害のある患者には用量調整は推奨されません。しかし、一次代謝産物の蓄積の臨床的意義に関する情報がないことを考えると、腎機能障害のある患者におけるリネゾリドの使用は、これらの代謝産物の蓄積の潜在的なリスクと比較検討する必要があります。リネゾリドと 2 つの代謝産物の両方が血液透析によって除去されます。リネゾリドの薬物動態に対する腹膜透析の影響に関する情報はありません。リネゾリド投与の 3 時間後に開始する 3 時間の血液透析セッションで、投与量の約 30% が除去されました。したがって、血液透析後にリネゾリドを投与する必要があります。
肝障害
リネゾリドの薬物動態は、軽度から中等度の肝障害 (Child-Pugh クラス A または B) の患者 (n=7) では変化しません。利用可能な情報に基づいて、軽度から中等度の肝障害を持つ患者には用量調整は推奨されません。重度の肝障害患者におけるリネゾリドの薬物動態は評価されていません。
薬物相互作用
シトクロム P450 によって代謝される薬物
リネゾリドは、ラットにおけるシトクロム P450 (CYP450) の誘導物質ではありません。さらに、リネゾリドは、臨床的に重要なヒト CYP アイソフォーム (例、1A2、2C9、2C19、2D6、2E1、3A4) の活性を阻害しません。したがって、リネゾリドは、これらの主要な酵素によって代謝される他の薬物の薬物動態に影響を与えるとは予想されません。リネゾリドの同時投与は、CYP2C9 によって広範囲に代謝される (S)-ワルファリンの薬物動態特性を実質的に変化させません。 CYP2C9 基質であるワルファリンやフェニトインなどの薬剤は、投与計画を変更せずにリネゾリドとともに投与することができます。
抗菌薬
アズトレオナム: リネゾリドまたはアズトレオナムの薬物動態は、一緒に投与しても変化しません。
ゲンタマイシン: リネゾリドまたはゲンタマイシンの薬物動態は、一緒に投与しても変化しません。
酸化防止剤
リネゾリドと抗酸化物質のビタミン C およびビタミン E との薬物間相互作用の可能性が、健康なボランティアで研究されました。被験者は 1 日目に 600 mg のリネゾリドを経口投与され、8 日目にさらに 600 mg のリネゾリドが投与されました。日)。リネゾリドの AUC0-∞ は、ビタミン C との併用で 2.3%、ビタミン E との併用で 10.9% 増加しました。ビタミン C またはビタミン E との併用では、リネゾリドの用量調整は推奨されません。
強力な CYP 3A4 インデューサー
リファンピン
リネゾリドの薬物動態に対するリファンピンの効果は、16 人の健康な成人男性の研究で評価されました。リファンピン 600 mg を 1 日 1 回 8 日間、経口リネゾリド 600 mg を 1 日 2 回 5 回投与した。リファンピンとリネゾリドの同時投与により、リネゾリド Cmax が 21% 減少し [90% CI、15% - 27%]、リネゾリド AUC0-12 が 32% 減少しました [90% CI、27% - 37%]。この相互作用の臨床的意義は不明です。この相互作用のメカニズムは完全には理解されておらず、肝臓酵素の誘導に関連している可能性があります。肝臓酵素の他の強力な誘導物質 (例えば、カルバマゼピン、フェニトイン、フェノバルビタール) は、リネゾリド曝露の同様のまたはより小さな減少を引き起こす可能性があります。
モノアミンオキシダーゼ阻害
リネゾリドは、モノアミンオキシダーゼの可逆的非選択的阻害剤です。したがって、リネゾリドはアドレナリン作動薬およびセロトニン作動薬と相互作用する可能性があります。
アドレナリン作動薬
ZYVOX 600mg を投与された一部の個人は、間接作用型の交感神経刺激薬、昇圧剤、またはドーパミン作動薬に対する昇圧反応の可逆的な増強を経験する可能性があります。フェニルプロパノールアミンやプソイドエフェドリンなどの一般的に使用される薬物は、特に研究されています。ドーパミンやエピネフリンなどのアドレナリン作動薬の初期用量は、望ましい反応を達成するために減量し、滴定する必要があります。
チラミン
リネゾリドとチラミンを 100 mg を超える用量で投与された正常な成人被験者では、有意な昇圧反応が観察されています。したがって、リネゾリドを投与されている患者は、チラミンを多く含む食品や飲料を大量に摂取することを避ける必要があります[ 患者情報 ]。
プソイドエフェドリンHClまたはフェニルプロパノールアミンHCl
リネゾリドを正常血圧の健康な被験者に投与すると、プソイドエフェドリン HCl (PSE) またはフェニルプロパノールアミン HCl (PPA) のいずれかの昇圧反応の可逆的な増強が観察されます [ 警告と注意事項 と 薬物相互作用 ]。同様の研究は、高血圧患者では実施されていません。正常血圧の被験者で実施された相互作用研究では、プラセボ、PPA または PSE 単独、リネゾリド単独、および定常状態のリネゾリド (600 mg を 12 時間ごとに 3 日間) と 2 用量の PPA ( 25 mg) または PSE (60 mg) を 4 時間間隔で投与。心拍数は、どの治療によっても影響を受けませんでした。両方の併用療法で血圧が上昇しました。最高血圧レベルは、PPA または PSE の 2 回目の投与の 2 ~ 3 時間後に見られ、ピークの 2 ~ 3 時間後にベースラインに戻りました。 PPA 研究の結果は、mmHg での平均 (および範囲) 最大収縮期血圧を示しています。プラセボ = 121 (103 ~ 158)。リネゾリド単独 = 120 (107 ~ 135); PPA 単独 = 125 (106 から 139);リネゾリドを含む PPA = 147 (129 ~ 176)。 PSE 研究の結果は、PPA 研究の結果と同様でした。リネゾリドとプソイドエフェドリンまたはフェニルプロパノールアミンの同時投与中のベースラインを超える収縮期血圧の平均最大上昇は、それぞれ 32 mm Hg (範囲: 20 ~ 52 mm Hg) および 38 mm Hg (範囲: 18 ~ 79 mm Hg) でした。
セロトニン作動薬
デキストロメトルファン
デキストロメトルファンとの潜在的な薬物間相互作用は、健康なボランティアで研究されました。被験者には、リネゾリドの有無にかかわらず、デキストロメトルファン(20 mg を 4 時間間隔で 2 回投与)が投与されました。リネゾリドとデキストロメトルファンを投与された正常な被験者では、セロトニン症候群の影響(混乱、せん妄、落ち着きのなさ、振戦、赤面症、発汗、高熱)は観察されていません。
微生物学
作用機序
リネゾリドは、オキサゾリジノン クラスの合成抗菌剤であり、好気性グラム陽性菌によって引き起こされる感染症の治療に臨床的に有用です。リネゾリドの in vitro 活性スペクトルには、特定のグラム陰性菌や嫌気性菌も含まれます。リネゾリドは、細菌の 23S リボソーム RNA 上の 50S サブユニットの部位に結合し、細菌の繁殖に不可欠な機能的な 70S 開始複合体の形成を防ぎます。タイムキル研究の結果は、リネゾリドが腸球菌およびブドウ球菌に対して静菌性であることを示しています。レンサ球菌については、リネゾリドは大部分の分離株に対して殺菌性があることがわかった.
抵抗
in vitro 研究では、23S rRNA の点変異がリネゾリド耐性と関連していることが示されています。バンコマイシン耐性エンテロコッカス・フェシウムがリネゾリドの臨床使用中に耐性になるという報告が発表されています。黄色ブドウ球菌 (メチシリン耐性) が臨床使用中にリネゾリドに対する耐性を獲得したという報告があります。これらの生物のリネゾリド耐性は、生物の 23S rRNA の点変異 (2576 位のグアニンをチミンに置換) に関連しています。 23S rRNA またはリボソームタンパク質 (L3 および L4) をコードする染色体遺伝子の変異によるオキサゾリジノン耐性生物は、一般にリネゾリドに対して交差耐性です。また、酵素メチルトランスフェラーゼによって媒介されるブドウ球菌のリネゾリド耐性も報告されています。この耐性は、ブドウ球菌間で伝達可能なプラスミド上に位置する cfr (クロラムフェニコール-フロルフェニコール) 遺伝子によって媒介されます。
他の抗菌薬との相互作用
in vitro 研究では、リネゾリドとバンコマイシン、ゲンタマイシン、リファンピン、イミペネム-シラスタチン、アズトレオナム、アンピシリン、またはストレプトマイシンとの間の相加性または無差別性が実証されています。
リネゾリドは、in vitro および臨床感染症の両方で、以下の微生物のほとんどの分離株に対して活性があることが示されています [参照 適応症 ]。
グラム陽性菌
Enterococcus faecium (バンコマイシン耐性分離株のみ) Staphylococcus aureus (メチシリン耐性分離株を含む) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
以下の in vitro データが利用可能ですが、それらの臨床的意義は不明です。以下の細菌の 90% 以上が、同様の属の生物のリネゾリド感受性ブレークポイント以下の in vitro MIC を示します。これらの細菌による臨床感染症の治療におけるリネゾリドの安全性と有効性は、十分に管理された臨床試験では確立されていません。
グラム陽性菌
Enterococcus faecalis (バンコマイシン耐性分離株を含む) Enterococcus faecium (バンコマイシン感受性分離株を含む) Staphylococcus epidermidis (メチシリン耐性分離株を含む) Staphylococcus haemolyticus Viridans group streptococci
グラム陰性菌
パスツレラ・マルトシダ
感受性試験
感受性試験の解釈基準、関連する試験方法、およびこの薬剤について FDA によって認められた品質管理基準に関する具体的な情報については、https://www.fda.gov/STIC を参照してください。
動物毒物学および/または薬理学
リネゾリド毒性の標的臓器は、幼若および成体のラットおよびイヌで類似していた。骨髄の低細胞性/造血の減少、脾臓および肝臓の髄外造血の減少、および循環赤血球、白血球、および血小板のレベルの減少によって証明されるように、用量および時間依存性の骨髄抑制が動物実験で見られました。リンパ系の枯渇は、胸腺、リンパ節、および脾臓で発生しました。一般に、リンパ系の所見は、食欲不振、体重減少、および体重増加の抑制と関連しており、観察された効果に寄与した可能性があります。
リネゾリドを 6 か月間経口投与したラットでは、80 mg/kg/日で坐骨神経の非可逆性の軽度から軽度の軸索変性が観察されました。坐骨神経の軽微な変性も、3 ヶ月間の中間剖検でこの用量レベルの雄 1 匹で観察された。視神経変性の証拠を調査するために、灌流固定組織の高感度な形態学的評価を行った。 2 匹の雄ラットに投与 6 ヶ月後に軽度から中等度の視神経変性が認められたが、所見の急性性とその非対称分布のために、薬物との直接的な関係は曖昧であった.観察された神経変性は、老化したラットで報告された自発的な片側性視神経変性と微視的に匹敵し、一般的な背景変化の悪化である可能性があります。
これらの影響は、一部のヒト被験者で観察されたレベルに匹敵する暴露レベルで観察されました。造血およびリンパ系への影響は可逆的であったが、一部の研究では、回復期間中に完全な回復は見られなかった.
臨床研究
大人
院内肺炎
臨床的および放射線学的に文書化された院内肺炎の成人患者は、ランダム化された多施設二重盲検試験に登録されました。患者は7~21日間治療を受けました。 1 つのグループは 12 時間ごとに ZYVOX IV 注射 600 mg を投与され、もう 1 つのグループは 12 時間ごとにバンコマイシン 1 g を静脈内投与されました。両方のグループはアズトレオナム(8時間ごとに1~2gの静脈内投与)を併用投与され、臨床的に必要な場合は継続することができました。この研究には、リネゾリドで治療された 203 人の患者とバンコマイシンで治療された 193 人の患者が登録されました。 122 (60%) のリネゾリド治療患者と 103 (53%) のバンコマイシン治療患者が臨床的に評価可能でした。臨床的に評価可能な患者の治癒率は、リネゾリド治療患者で 57%、バンコマイシン治療患者で 60% でした。臨床的に評価可能な人工呼吸器関連肺炎患者の治癒率は、リネゾリド治療患者で 47%、バンコマイシン治療患者で 40% でした。 94 人のリネゾリド治療患者と 83 人のバンコマイシン治療患者の修正された治療意図 (MITT) 分析には、治療前に病原体が分離された被験者が含まれていました。 MITT 分析の治癒率は、リネゾリド治療患者で 57%、バンコマイシン治療患者で 46% でした。微生物学的に評価可能な患者の病原体別の治癒率を表 12 に示します。
複雑な皮膚および皮膚構造の感染症
複雑な皮膚および皮膚構造の感染症が臨床的に記録されている成人患者が、無作為化多施設共同二重盲検二重ダミー試験に登録され、静脈内投与された治験薬と経口投与された薬を合計 10 ~ 21 日間の治療で比較しました。患者の 1 つのグループは、12 時間ごとに ZYVOX IV 注射 600 mg を投与され、続いて 12 時間ごとに ZYVOX 600 mg 錠剤 600 mg が投与されました。もう一方のグループは、オキサシリン 2 g を 6 時間ごとに静脈内投与し、続いてジクロキサシリン 500 mg を 6 時間ごとに経口投与しました。臨床的に必要な場合、患者はアズトレオナムを併用することができます。この研究には、リネゾリドで治療された 400 人の患者とオキサシリンで治療された 419 人の患者が登録されました。 245 (61%) のリネゾリド治療患者と 242 (58%) のオキサシリン治療患者が臨床的に評価可能でした。臨床的に評価可能な患者の治癒率は、リネゾリド治療患者で 90%、オキサシリン治療患者で 85% でした。 316 人のリネゾリド治療患者と 313 人のオキサシリン治療患者の修正された治療意図 (MITT) 分析には、研究登録のすべての基準を満たした被験者が含まれていました。 MITT 分析の治癒率は、リネゾリド治療患者で 86%、オキサシリン治療患者で 82% でした。微生物学的に評価可能な患者の病原体別の治癒率を表 13 に示します。
別の研究では、メチシリン耐性黄色ブドウ球菌 (MRSA) 感染症の治療における ZYVOX の使用に関する追加の経験が提供されました。これは、MRSA感染が記録されているか疑われる成人入院患者を対象とした無作為化非盲検試験でした。
患者の 1 つのグループは、12 時間ごとに ZYVOX IV 注射 600 mg を投与され、続いて 12 時間ごとに ZYVOX 錠 600 mg が投与されました。患者の他のグループは、バンコマイシン 1 g を 12 時間ごとに静脈内投与しました。どちらのグループも 7 ~ 28 日間治療を受け、臨床的に必要な場合はアズトレオナムまたはゲンタマイシンを併用することができました。微生物学的に評価可能な MRSA 皮膚および皮膚構造感染症患者の治癒率は、リネゾリド治療患者で 26/33 (79%)、バンコマイシン治療患者で 24/33 (73%) でした。
糖尿病性足感染症
複雑な皮膚および皮膚構造の感染症 (「糖尿病性足感染症」) が臨床的に記録されている成人の糖尿病患者が、無作為化 (2:1 比)、多施設、非盲検試験に登録され、静脈内または経口投与された治験薬を合計で14~28日間の治療。患者の 1 つのグループは、静脈内または経口で 12 時間ごとに ZYVOX 600 mg を投与されました。もう一方のグループには、アンピシリン/スルバクタム 1.5 ~ 3 g を静脈内投与するか、アモキシシリン / クラブラン酸 500 ~ 875 mg を 8 ~ 12 時間ごとに経口投与しました。アンピシリン/スルバクタムが販売されていない国では、アモキシシリン/クラブラン酸 500 mg ~ 2 g を 6 時間ごとに静脈内投与レジメンに使用しました。 MRSAが足の感染症から分離された場合、対照群の患者はバンコマイシン1gを12時間ごとに静脈内投与することもできた.感染部位からグラム陰性桿菌が分離されたいずれかの治療群の患者も、8~12時間ごとに1~2gのアズトレオナムを静脈内投与することができました。すべての患者は、糖尿病性足感染症の治療で通常必要とされる、デブリードマンやオフロードなどの適切な補助治療を受ける資格があり、ほとんどの患者がこれらの治療を受けました。インテント・トゥ・トリート(ITT)研究集団には、リネゾリドで治療された患者が 241 人、コンパレータで治療された患者が 120 人いました。 212 例 (86%) のリネゾリド治療患者と 105 例 (85%) の比較治療患者が臨床的に評価可能でした。 ITT集団では、治癒率はリネゾリド治療患者で68.5%(165/241)、比較治療患者で64%(77/120)であり、結果が不確定で欠落している患者は失敗と見なされました。臨床的に評価可能な患者(転帰が不確定または欠落している患者を除く)の治癒率は、リネゾリドおよびコンパレータで治療された患者でそれぞれ83%(159/192)および73%(74/101)でした。重要な事後分析は、感染部位または血液からグラム陽性病原体が分離され、全体の研究集団よりも基礎となる骨髄炎の証拠が少なく、禁止されている抗菌薬を受け取っていません。その分析に基づくと、治癒率はリネゾリド治療患者で 71% (86/121)、コンパレータ治療患者で 63% (38/60) でした。上記の分析のいずれも、補助療法の使用について調整されていません。微生物学的に評価可能な患者の病原体別の治癒率を表 14 に示します。
バンコマイシン耐性腸球菌感染症
バンコマイシン耐性腸球菌感染が記録されているか疑われる成人患者は、高用量の ZYVOX (600 mg) と低用量の ZYVOX (200 mg) を 12 時間ごとに比較する無作為多施設二重盲検試験に登録されました。静脈内(IV)または経口で7〜28日間。患者は、アズトレオナムまたはアミノグリコシドを併用することができます。 79 人の患者が高用量リネゾリドに無作為に割り付けられ、66 人が低用量リネゾリドに無作為に割り付けられました。ベースラインでバンコマイシン耐性腸球菌感染が記録されている治療目的(ITT)集団は、高用量群で65人の患者、低用量群で52人の患者で構成されていました。
ベースラインでのバンコマイシン耐性腸球菌感染が記録されている ITT 集団の治癒率を、感染源別に表 15 に示します。これらの治癒率には、転帰が不明または不確定な患者は含まれません。治癒率は高用量群の方が低用量群より高かったが、その差は 0.05 レベルで統計的に有意ではなかった.
小児患者
グラム陽性菌による感染症
安全性と有効性の研究では、院内肺炎、複雑な皮膚および皮膚構造の感染症、およびメチシリン耐性および感受性の黄色ブドウ球菌を含むグラム陽性細菌病原体によるその他の感染症の治療のために小児患者に ZYVOX 600mg を使用した経験が提供されました。およびバンコマイシン耐性エンテロコッカス・フェシウム。出生時から 11 歳までの年齢で、グラム陽性菌が記録されている、または疑われる感染症を患っている小児患者が、無作為化、openPage ラベル、比較対照試験に登録されました。患者の 1 つのグループは、ZYVOX 600mg IV 注射 10 mg/kg を 8 時間ごとに投与され、続いて ZYVOX 600mg 経口懸濁液 10 mg/kg を 8 時間ごとに投与されました。 2 番目のグループには、年齢と腎クリアランスに応じて、バンコマイシン 10 ~ 15 mg/kg を 6 ~ 24 時間ごとに静脈内投与しました。 VRE 感染が確認された患者は、研究の第 3 群に配置され、ZYVOX 10 mg/kg を 8 時間ごとに静脈内および/または経口で投与されました。すべての患者は合計 10 ~ 28 日間治療を受け、臨床的に必要な場合は、グラム陰性菌の抗菌薬を併用することができました。治療意図 (ITT) 集団では、206 人の患者がリネゾリドに無作為に割り付けられ、102 人の患者がバンコマイシンに無作為に割り付けられました。 ITT、MITT、および臨床的に評価可能な患者の治癒率を表 16 に示します。研究が完了した後、生後 4 日から 16 歳までの範囲の追加の 13 人の患者が、VRE アームの非盲検拡大に登録されました。勉強。表17は、この研究の延長からのバンコマイシン耐性エンテロコッカス・フェシウムを有する微生物学的に評価可能な患者を含む、微生物学的に評価可能な患者の病原体による臨床治癒率を提供する。
患者情報
重要な管理手順
ZYVOX は食事の有無にかかわらず服用できることを患者に伝えてください。
末梢および視神経障害
ZYVOX の服用中に視力の変化を経験した場合は、医師に知らせるように患者に助言する [ 警告と注意事項 ]。
セロトニン症候群
セロトニン再取り込み阻害薬やその他の抗うつ薬やオピオイドを含むセロトニン作動薬を服用している場合は、医師に知らせるよう患者に助言する[参照 警告と注意事項 ]。
血圧上昇を引き起こす潜在的な相互作用
- 高血圧の病歴がある場合は、医師に知らせるように患者に助言してください。
- ZYVOX を服用している間は、チラミンを多く含む食品や飲料を大量に摂取しないよう患者に助言してください。チラミン含有量の高い食品には、熟成チーズ、発酵肉または風乾肉、ザワークラウト、醤油、生ビール、赤ワインなど、風味を改善するために熟成、発酵、酸洗、または喫煙によってタンパク質が変化した可能性があるものが含まれます.タンパク質が豊富な食品のチラミン含有量は、長期間保存したり、不適切に冷蔵したりすると増加する可能性があります.
- かぜ薬やうっ血除去薬など、プソイドエフェドリン HCl またはフェニルプロパノールアミン HCl を含む薬を服用している場合は、医師に知らせるように患者に助言する [ 警告と注意事項 ]。
乳酸アシドーシス
ZYVOX の投与中に吐き気や嘔吐が繰り返される場合は、医師に知らせるよう患者に助言する [ 警告と注意事項 ]。
痙攣
発作または痙攣の既往歴がある場合は、医師に知らせるように患者に助言する[参照 警告と注意事項 ]。
低血糖症
患者に糖尿病がある場合は医師に知らせるようにアドバイスしてください。リネゾリドで治療すると、発汗や震えなどの低血糖反応が低血糖測定値とともに発生する可能性があります。そのような反応が生じた場合、患者は適切な治療のために医師または他の医療専門家に連絡する必要があります[参照 警告と注意事項 ]。
低ナトリウム血症および/またはSIADH
低ナトリウム血症のリスクがある患者には、錯乱、傾眠、全身の衰弱、呼吸困難など、低ナトリウム血症および/またはSIADHの徴候や症状が見られた場合は、医師に知らせるように助言する[参照 警告と注意事項 ]。
フェニルケトン尿症
フェニルケトン尿症 (PKU) の患者には、経口懸濁液用の 100 mg/5 mL ZYVOX の各 5 mL に 20 mg のフェニルアラニンが含まれていることを伝えてください。他の ZYVOX 600mg 製剤にはフェニルアラニンが含まれていません。フェニルアラニンは、フェニルケトン尿症の患者に有害な場合があります。経口懸濁液用の ZYVOX 600mg を処方された場合は、医師または薬剤師に連絡してください [ 警告と注意事項 ]。
抗菌耐性
ZYVOX を含む抗菌薬は細菌感染症の治療にのみ使用するよう患者に説明する必要があります。ウイルス感染症(風邪など)は治療しません。細菌感染症の治療に ZYVOX 600mg が処方された場合、患者は治療の初期に気分が良くなることはよくあることですが、指示どおりに薬を服用する必要があることを患者に伝えてください。投与をスキップしたり、治療の全過程を完了しないと、当面の治療の有効性が低下し、細菌が耐性を獲得し、将来的に ZYVOX や他の抗菌薬で治療できなくなる可能性が高くなる可能性があります。
下痢
下痢は抗菌薬によって引き起こされる一般的な問題であり、通常は抗菌薬の使用を中止すると治ります。抗菌薬による治療を開始した後、患者は、抗菌薬の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合、患者はできるだけ早く医師に連絡する必要があります[参照 警告と注意事項 ]。
不妊
男性患者には、ZYVOX が生殖能力を可逆的に損なう可能性があることを助言する [参照 特定の集団での使用 ]。
この製品のラベルは更新されている可能性があります。最新の処方情報については、www.pfizer.com をご覧ください。
