Amoxil 250mg, 500mg, 625mg, 1000mg Amoxicillin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
アモキシシリンとは何ですか?どのように使用されますか?
アモキシル1000mgとは?
アモキシルは、扁桃炎、気管支炎、肺炎、耳、鼻、のど、皮膚、尿路の感染症など、さまざまな種類の細菌感染症の症状を治療するために使用される処方薬です。 Amoxil 1000mg は、単独で使用することも、他の薬と併用することもできます。
アモキシルは、ペニシリン、アミノと呼ばれる薬のクラスに属しています。
アモキシルの副作用の可能性は何ですか?
アモキシルは、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 熱、
- 喉の痛み、
- 燃える目、
- 皮膚の痛み、
- 水ぶくれやはがれを伴う赤または紫の皮膚発疹、
- 激しい胃痛と、
- 水様または血様の下痢(最後の服用から数か月後に発生した場合でも)
上記の症状がある場合は、すぐに医療機関を受診してください。
アモキシルの最も一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- 下痢、および
- 発疹
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Amoxil の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
AMOXIL の製剤には、半合成抗生物質であるアモキシシリンが含まれており、アンピシリンの類似体であり、多くのグラム陽性菌およびグラム陰性菌に対する幅広い殺菌活性を備えています。化学的には、(2S,5,R,6,R)-6-[(,R)-(-)-2-アミノ-2-(p-ヒドロキシフェニル)アセトアミド]-3,3-ジメチル-7-オキソ-4-チア-1-アザビシクロ[3.2.0]ヘプタン-2-カルボン酸三水和物。構造的に次のように表すことができます。
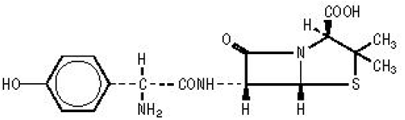
アモキシシリンの分子式は C16H19N3O5S•3H2O で、分子量は 419.45 です。
カプセル ロイヤルブルーの不透明なキャップとピンク色の不透明なボディを持つAMOXILの各カプセルには、三水和物として250mgまたは500mgのアモキシシリンが含まれています。 250 mg カプセルのキャップとボディには、製品名 AMOXIL 1000 mg および 250 が刻印されています。 500 mg カプセルのキャップとボディには、AMOXIL 1000 mg と 500 が刻印されています。不活性成分: D&C 赤 28 号、FD&C 青 1 号、FD&C 赤 40 号、ゼラチン、ステアリン酸マグネシウム、二酸化チタン。
各錠剤には、三水和物として 500 mg または 875 mg のアモキシシリンが含まれています。フィルムコーティングされたカプセル型のピンク色の各錠剤は、それぞれ 500 または 875 を中心にアモキシル 500mg でデボス加工されています。 875 mg の錠剤は裏面にスコアが付けられています。不活性成分: コロイド状二酸化ケイ素、クロスポビドン、FD&C Red No. 30 アルミニウム レーキ、ヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、デンプン グリコール酸ナトリウム、および二酸化チタン。
経口懸濁液用粉末 再構成された懸濁液 5 mL には、三水和物として 125 mg、200 mg、250 mg、または 400 mg のアモキシシリンが含まれています。 125 mg の再構成された懸濁液の各 5 mL には、0.11 mEq (2.51 mg) のナトリウムが含まれています。 200 mg の再構成された懸濁液の各 5 mL には、0.15 mEq (3.39 mg) のナトリウムが含まれています。 250 mg の再構成懸濁液の各 5 mL には、0.15 mEq (3.36 mg) のナトリウムが含まれています。 400 mg の再構成された懸濁液の各 5 mL には、0.19 mEq (4.33 mg) のナトリウムが含まれています。不活性成分: FD&C 赤 No. 3、香料、シリカゲル、安息香酸ナトリウム、クエン酸ナトリウム、スクロース、キサンタンガム。
適応症
耳、鼻、喉の感染症
AMOXIL® は、影響を受けやすい (β-ラクタマーゼ陰性のみ) 連鎖球菌種の分離株による感染症の治療に使用されます。 (α-およびβ-溶血性分離株のみ)、肺炎連鎖球菌、ブドウ球菌属、またはインフルエンザ菌。
泌尿生殖器の感染症
AMOXIL® は、Escherichia coli、Proteus mirabilis、または Enterococcus faecalis の感受性分離株 (β-ラクタマーゼ陰性のみ) による感染症の治療に適応されます。
皮膚および皮膚構造の感染症
AMOXIL® は、影響を受けやすい (β-ラクタマーゼ陰性のみ) 連鎖球菌属の分離株による感染症の治療に適応されます。 (α-およびβ-溶血性分離株のみ)、ブドウ球菌属、または大腸菌。
下部気道の感染症
AMOXIL® は、影響を受けやすい (β-ラクタマーゼ陰性のみ) 連鎖球菌属の分離株による感染症の治療に適応されます。 (α-およびβ-溶血性分離株のみ)、肺炎球菌、ブドウ球菌属、またはインフルエンザ菌。
ヘリコバクター・ピロリ感染症
クラリスロマイシンとランソプラゾールによるヘリコバクター・ピロリの3剤併用療法
AMOXIL は、クラリスロマイシンとランソプラゾールの 3 剤療法と組み合わせて、H. pylori 感染および十二指腸潰瘍疾患 (活動性または 1 年間の十二指腸潰瘍歴) を有する患者の H. pylori を根絶するための治療に適応されます。 H. pylori の除菌は、十二指腸潰瘍の再発リスクを低下させることが示されています。
ピロリ菌に対するランソプラゾールによる二重療法
AMOXIL は、二重療法としてランソプラゾール遅延放出カプセルと組み合わせて、H. pylori 感染および十二指腸潰瘍疾患 (十二指腸潰瘍の活動性または 1 年の病歴) を有する患者の治療に適応されます。 クラリスロマイシンに対するアレルギーまたは不耐性のある人、またはクラリスロマイシンに対する耐性が知られている、または疑われる人。 (見る クラリスロマイシンの添付文書 、 微生物学 .) H. pylori の除菌は、十二指腸潰瘍の再発リスクを軽減することが示されています。
使用法
薬剤耐性菌の発生を減らし、アモキシル (アモキシシリン) および他の抗菌薬の有効性を維持するために、アモキシル 250mg は、細菌が原因であることが証明されているか、強く疑われる感染症の治療にのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
成人および小児患者の投薬 > 3 ヶ月齢
治療は、患者が無症候性になった後、または細菌根絶の証拠が得られた後、最低でも 48 ~ 72 時間継続する必要があります。急性リウマチ熱の発生を防ぐために、化膿連鎖球菌による感染症に対して少なくとも 10 日間の治療を受けることをお勧めします。一部の感染症では、数週間の治療が必要になる場合があります。治療の中止後、数ヶ月間は臨床的および/または細菌学的なフォローアップを続ける必要があるかもしれません。
生後12週間以下(生後3ヶ月以下)の新生児および乳児への投与
治療は、患者が無症候性になった後、または細菌根絶の証拠が得られた後、最低でも 48 ~ 72 時間継続する必要があります。急性リウマチ熱の発生を防ぐために、化膿連鎖球菌による感染症に対して少なくとも 10 日間の治療を受けることをお勧めします。この年齢層では腎機能が不完全に発達しているため、アモキシシリンの排泄に影響を与えるため、推奨される AMOXIL の上限用量は 30 mg/kg/日で、12 時間ごとに分割されます。現在、腎機能障害のある小児患者に対する投与に関する推奨事項はありません。
ピロリ菌感染症の投薬
トリプルセラピー
成人の推奨経口投与量は、アモキシル 1000mg 1 グラム、クラリスロマイシン 500 mg、ランソプラゾール 30 mg で、すべて 1 日 2 回 (12 時間ごと)、14 日間投与されます。
二重療法
成人の推奨経口投与量は、1 グラムの AMOXIL 625mg と 30 mg のランソプラゾールを、それぞれ 1 日 3 回 (8 時間ごとに) 14 日間投与します。クラリスロマイシンとランソプラゾールの完全な処方情報を参照してください。
腎障害における投薬
- 腎機能障害のある患者は、障害が重度でない限り、一般に用量を減らす必要はありません。
- 糸球体濾過率が 30 mL/min 未満の重度障害患者。 875 mg の用量を服用しないでください。
- 糸球体濾過速度が 10 ~ 30 mL/min の患者には、感染の重症度に応じて、12 時間ごとに 500 mg または 250 mg を投与する必要があります。
- 糸球体濾過率が 10 mL/min 未満の患者には、感染の重症度に応じて、24 時間ごとに 500 mg または 250 mg を投与する必要があります。
- 血液透析患者は、感染の重症度に応じて、24 時間ごとに 500 mg または 250 mg を投与する必要があります。透析中および透析終了時に追加投与する必要があります。
経口懸濁液の調合方法
すべての粉末が自由に流れるまでボトルを軽くたたきます。再構成のために水の総量の約 1/3 を追加し (表 2 を参照)、激しく振って粉末を湿らせます。残りの水を加えて、もう一度激しく振ってください。
再構成後、必要な量の懸濁液を子供の舌の上に直接置き、飲み込む必要があります。別の投与方法は、粉ミルク、牛乳、フルーツ ジュース、水、ジンジャー エール、または冷たい飲み物に必要な量の懸濁液を加えることです。これらの準備はすぐに行う必要があります。
注意:使用前にオーラルサスペンションをよく振ってください。ボトルをしっかり閉めてください。再構成された懸濁液の未使用部分は、14 日後に廃棄する必要があります。冷蔵が望ましいですが、必須ではありません。
供給方法
剤形と強度
カプセル
250mg、500mg。 AMOXIL 625mg の各カプセルは、ロイヤル ブルーの不透明なキャップとピンク色の不透明な本体で、三水和物として 250 mg または 500 mg のアモキシシリンを含んでいます。 250 mg カプセルのキャップとボディには、製品名 AMOXIL と 250 が刻印されています。 500 mg カプセルのキャップとボディには、AMOXIL と 500 が刻印されています。
錠剤
500mg、875mg。各錠剤には、三水和物として 500 mg または 875 mg のアモキシシリンが含まれています。フィルムコーティングされたカプセル型のピンク色の各錠剤は、それぞれ 500 または 875 を中心としたアモキシルでデボス加工されています。 875 mg の錠剤は裏面にスコアが付けられています。
経口懸濁液用粉末
125mg/5mL、200mg/5mL、250mg/5mL、400mg/5mL。再構成されたイチゴ風味の懸濁液の各 5 mL には、三水和物として 125 mg のアモキシシリンが含まれています。再構成されたバブルガム風味の懸濁液の各 5 mL には、三水和物として 200 mg、250 mg、または 400 mg のアモキシシリンが含まれています。
保管と取り扱い
カプセル: AMOXIL の各カプセルは、ロイヤル ブルーの不透明なキャップとピンク色の不透明なボディで、三水和物として 250 mg または 500 mg のアモキシシリンを含んでいます。 250 mg カプセルのキャップとボディには、製品名 AMOXIL と 250 が刻印されています。 500 mg カプセルのキャップとボディには、AMOXIL と 500 が刻印されています。
250mgカプセル
NDC 43598-025-01 100本入 NDC 43598-025-05 500本入りボトル
500mgカプセル
NDC 43598-005-01 100本入りボトル NDC 43598-005-05 500本入りボトル
各錠剤には、三水和物として 500 mg または 875 mg のアモキシシリンが含まれています。フィルムコーティングされたカプセル型のピンク色の各錠剤は、それぞれ 500 または 875 を中心としたアモキシルでデボス加工されています。 875 mg の錠剤は裏面にスコアが付けられています。
500mg錠
NDC 43598-024-01 100本入 NDC 43598-024-05 500本入りボトル
875mg錠
NDC 43598-019-01 100本入りボトル NDC 43598-019-14 20本入
経口懸濁液用粉末: 再構成されたイチゴ風味の懸濁液の各 5 mL には、三水和物として 125 mg のアモキシシリンが含まれています。再構成された風船ガム風味の懸濁液 5 mL には、三水和物として 200 mg、250 mg、または 400 mg のアモキシシリンが含まれています。
125mg/5mL
NDC 43598-022-80 80mLボトル NDC 43598-022-52 100mLボトル NDC 43598-022-53 150mLボトル
200mg/5mL
NDC 43598-023-50 50mLボトル NDC 43598-023-51 75mLボトル NDC 43598-023-52 100mLボトル
250mg/5mL
NDC 43598-009-80 80mLボトル NDC 43598-009-52 100mLボトル NDC 43598-009-53 150mLボトル
400mg/5mL
NDC 43598-007-50 50mLボトル NDC 43598-007-51 75mLボトル NDC 43598-007-52 100mLボトル
20° C (68° F) 以下で保管してください - 250 mg および 500 mg カプセル、125 mg および 250 mg 未溶解粉末。
25° C (77° F) 以下で保管してください。
密閉容器に分注してください。
製造された。提供者: Dr. Reddy's Laboratories Tennessee, LLC.ブリストル、テネシー州 37620。改訂: 2015 年 9 月
副作用
以下は、ラベル付けの他のセクションで詳しく説明されています。
- アナフィラキシー反応 [参照 警告と注意事項 ]
- CDAD [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
アモキシル カプセル、錠剤、または経口懸濁液の臨床試験で観察された最も一般的な副作用 (> 1%) は、下痢、発疹、嘔吐、吐き気でした。
トリプルセラピー : 3 剤療法 (アモキシシリン/クラリスロマイシン/ランソプラゾール) を受けた患者で最も頻繁に報告された有害事象は、下痢 (7%)、頭痛 (6%)、および味覚倒錯 (5%) でした。
二重療法 : アモキシシリン/ランソプラゾールの二重療法を受けた患者で最も頻繁に報告された有害事象は、下痢 (8%) と頭痛 (7%) でした。クラリスロマイシンまたはランソプラゾールによる副作用の詳細については、添付文書の副作用のセクションを参照してください。
市販後またはその他の経験
臨床試験から報告された有害事象に加えて、ペニシリンの市販後の使用中に次の事象が確認されました。それらは未知のサイズの母集団から自発的に報告されるため、頻度の推定はできません。これらのイベントは、その深刻さ、報告の頻度、または AMOXIL との潜在的な因果関係の組み合わせにより、含めるために選択されました。
- 感染症と蔓延 :皮膚粘膜カンジダ症。
- 胃腸 : 黒い毛むくじゃらの舌、および出血性/偽膜性大腸炎。偽膜性大腸炎の症状の発症は、抗菌薬治療中または治療後に発生する可能性があります[参照 警告と注意事項 ]。
- 過敏反応 :アナフィラキシー[参照] 警告と注意事項 ]。血清病様反応、紅斑性黄斑丘疹発疹、多形紅斑、スティーブンス・ジョンソン症候群、剥脱性皮膚炎、中毒性表皮壊死融解症、急性汎発性発疹性膿疱症、過敏性血管炎、蕁麻疹が報告されています。
- 肝臓 :AST や ALT の中程度の上昇が認められているが、その意義は不明。胆汁うっ滞性黄疸、肝胆汁うっ滞、急性細胞溶解性肝炎などの肝機能障害が報告されています。
- 腎臓 :結晶尿症が報告されている[参照] 過剰摂取 ]。
- 血液とリンパ系 溶血性貧血、血小板減少症、血小板減少性紫斑病、好酸球増加症、白血球減少症、無顆粒球症などの貧血が報告されています。これらの反応は通常、治療を中止すると元に戻り、過敏症現象であると考えられています。
- 中枢神経系 可逆的な多動、動揺、不安、不眠症、錯乱、痙攣、行動変化、および/またはめまいが報告されています
- その他 :歯の変色(茶色、黄色、または灰色の着色)が報告されています。ほとんどの報告は小児患者で発生しました。ほとんどの場合、変色はブラッシングまたはデンタルクリーニングで軽減または除去されました。
薬物相互作用
プロベネシド
プロベネシドは、アモキシシリンの尿細管分泌を減少させます。アモキシシリンとプロベネシドを同時に使用すると、アモキシシリンの血中濃度が上昇し、長期化する可能性があります。
経口抗凝固薬
プロトロンビン時間の異常な延長 (国際正規化比 [INR] の増加) は、アモキシシリンおよび経口抗凝固薬を受けている患者で報告されています。抗凝固薬が同時に処方されている場合は、適切なモニタリングを実施する必要があります。望ましいレベルの抗凝固作用を維持するために、経口抗凝固薬の投与量の調整が必要になる場合があります。
アロプリノール
アロプリノールとアモキシシリンの同時投与は、アモキシシリンのみを投与された患者と比較して、両方の薬剤を投与された患者の発疹の発生率を増加させます。このアモキシシリン発疹の増強がアロプリノールによるものなのか、これらの患者に存在する高尿酸血症によるものなのかは不明です。
経口避妊薬
AMOXIL は腸内フローラに影響を与える可能性があり、エストロゲンの再吸収を低下させ、エストロゲンとプロゲステロンを組み合わせた経口避妊薬の有効性を低下させます。

その他の抗菌剤
クロラムフェニコール、マクロライド、スルホンアミド、およびテトラサイクリンは、ペニシリンの殺菌効果を妨げる可能性があります。これは in vitro で実証されています。ただし、この相互作用の臨床的意義は十分に文書化されていません。
臨床検査への影響
アンピシリンの尿中濃度が高いと、CLINITEST®、ベネディクト液、またはフェーリング液を使用して尿中のブドウ糖の存在を検査する際に、偽陽性反応が生じる可能性があります。この影響はアモキシシリンでも発生する可能性があるため、酵素グルコースオキシダーゼ反応に基づくグルコース検査 (CLINISTIX® など) を使用することをお勧めします。
妊婦へのアンピシリンまたはアモキシシリンの投与後、抱合型エストリオール、エストリオール-グルクロニド、抱合型エストロン、およびエストラジオールの総血漿濃度の一時的な減少が認められています。
警告
の一部として含まれています 予防 セクション。
予防
アナフィラキシー反応
アモキシシリンを含むペニシリン療法を受けている患者では、重篤で時として致命的な過敏症(アナフィラキシー)反応が報告されています。アナフィラキシーは、非経口療法の後により頻繁に発生しますが、経口ペニシリンを服用している患者に発生しています。これらの反応は、ペニシリン過敏症の病歴および/または複数のアレルゲンに対する過敏症の病歴を持つ個人で発生する可能性が高くなります.ペニシリン過敏症の病歴があり、セファロスポリンで治療すると重度の反応を経験したという報告があります。 AMOXIL による治療を開始する前に、ペニシリン、セファロスポリン、または他のアレルゲンに対する過去の過敏症反応について慎重に調査する必要があります。
クロストリジウム・ディフィシル関連下痢症
クロストリジウム ディフィシル関連下痢症 (CDAD) は、AMOXIL を含むほぼすべての抗菌剤の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性であり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗菌薬の使用後に下痢を呈するすべての患者で CDAD を考慮する必要があります。抗菌薬投与後 2 ヶ月以上の CDAD が報告されているため、慎重な病歴が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗生物質の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗生物質治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
薬剤耐性菌の発生
証明された、または強く疑われる細菌感染がない場合に AMOXIL を処方することは、患者に利益をもたらす可能性が低く、薬剤耐性菌の発生のリスクを高めます。
単核症患者への使用
アモキシシリンを投与された単核球症患者の高い割合で、紅斑性皮膚発疹が発生します。したがって、単核球症の患者にはアモキシシリンを投与すべきではありません。
フェニルケトン尿薬
アモキシル 250mg チュアブル錠には、フェニルアラニンを含むアスパルテームが含まれています。各 200 mg のチュアブル タブレットには、1.82 mg のフェニルアラニンが含まれています。各 400 mg のチュアブル タブレットには、3.64 mg のフェニルアラニンが含まれています。アモキシルの経口懸濁液にはフェニルアラニンが含まれておらず、フェニルケトン尿症患者にも使用できます。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん性の可能性を評価するための動物での長期研究は実施されていません。アモキシシリン単独の変異原性を検出する研究は実施されていません。ただし、次の情報は、アモキシシリンとクラブラン酸カリウムの 4:1 混合物 (AUGMENTIN) のテストから入手できます。 AUGMENTIN は、Ames 細菌変異アッセイおよび酵母遺伝子変換アッセイで非変異原性でした。 AUGMENTIN はマウスリンパ腫アッセイで弱陽性でしたが、このアッセイで変異頻度が増加する傾向は、細胞生存率の低下にも関連する用量で発生しました。 AUGMENTIN は、マウス小核試験およびマウスの優性致死試験で陰性でした。クラブラン酸カリウム単独は、Ames 細菌変異試験およびマウス小核試験で試験され、これらの各試験で陰性でした。ラットの多世代繁殖試験では、500 mg/kg (体表面積に基づくヒトの用量 3 g の約 2 倍) までの用量で、生殖能力の障害やその他の生殖への悪影響は見られませんでした。
特定の集団での使用
妊娠
催奇形性効果
妊娠カテゴリー B. 生殖試験は、マウスとラットで最大 2000 mg/kg の用量で実施されています (体表面積に基づいて、3 g のヒト用量の 3 倍と 6 倍)。アモキシシリンによる胎児への害の証拠はありませんでした。しかし、妊娠中の女性を対象とした十分に管理された研究はありません。動物の繁殖研究は常にヒトの反応を予測できるわけではないため、アモキシシリンは明らかに必要な場合にのみ妊娠中に使用する必要があります.
労働と配達
経口アンピシリンは分娩中に吸収されにくい。分娩中または分娩中のヒトへのアモキシシリンの使用が、胎児に即時または遅延の悪影響を与えるか、分娩期間を延長するか、または産科介入の必要性を高めるかどうかはわかっていません。
授乳中の母親
ペニシリンは、母乳中に排泄されることが示されています。授乳中の母親によるアモキシシリンの使用は、乳児の感作につながる可能性があります。授乳中の女性にアモキシシリンを投与する場合は注意が必要です。
小児用
新生児および幼児では腎機能が不完全に発達しているため、アモキシシリンの排泄が遅れる場合があります。 AMOXIL 625mg の投与量は、生後 12 週間以下 (≦ 3 ヶ月) の小児患者では変更する必要があります。 [見る 投薬と管理 ]
高齢者の使用
アモキシル 250mg の臨床研究の分析は、65 歳以上の被験者が若い被験者と異なる反応を示すかどうかを判断するために実施されました。これらの分析では、年配の患者と若い患者の間の反応の違いは特定されていませんが、一部の年配の個人の感度が高いことは除外できません。
この薬は腎臓から実質的に排泄されることが知られており、腎機能が低下している患者では、この薬に対する毒性反応のリスクが高くなる可能性があります。高齢患者は腎機能が低下している可能性が高いため、投与量の選択には注意が必要であり、腎機能のモニタリングが役立つ場合があります。
腎障害における投薬
アモキシシリンは主に腎臓で排泄され、通常、重度の腎機能障害 (GFR 腎障害における投薬 腎機能障害のある患者への具体的な推奨事項について。
過剰摂取
過剰摂取の場合は、投薬を中止し、対症療法を行い、必要に応じて支持手段を講じてください。毒物管理センターの 51 人の小児患者を対象とした前向き研究では、250 mg/kg 未満のアモキシシリンの過剰摂取は重大な臨床症状と関連していないことが示唆されました。
アモキシシリンの過剰摂取後、少数の患者で乏尿性腎不全を引き起こす間質性腎炎が報告されています1。
場合によっては腎不全に至る結晶尿症も、成人および小児患者におけるアモキシシリンの過剰摂取後に報告されています。過剰摂取の場合、アモキシシリン結晶尿症のリスクを軽減するために、適切な水分摂取と利尿を維持する必要があります。
腎機能障害は、薬物投与を中止すると元に戻るようです。腎機能障害のある患者では、アモキシシリンの腎クリアランスが低下するため、血中濃度が高くなりやすい可能性があります。アモキシシリンは、血液透析によって循環から除去されることがあります。
禁忌
AMOXIL 625mg は、AMOXIL または他の β-ラクタム系抗生物質 (ペニシリンやセファロスポリンなど) に対して深刻な過敏反応 (アナフィラキシーまたはスティーブンス・ジョンソン症候群など) を経験した患者には禁忌です。
臨床薬理学
作用機序
アモキシシリンは抗菌薬です。 [見る 微生物学 ]。
薬物動態
吸収
アモキシシリンは胃酸の存在下で安定しており、経口投与後に急速に吸収されます。アモキシルの錠剤および懸濁液からのアモキシシリンの吸収に対する食物の影響は、部分的に調査されています。 400 mg および 875 mg の製剤は、軽食の開始時に投与された場合にのみ研究されています。
250 mg および 500 mg のアモキシシリン カプセルを経口投与すると、投与後 1 ~ 2 時間の平均血中濃度は、それぞれ 3.5 mcg/mL ~ 5.0 mcg/mL および 5.5 mcg/mL ~ 7.5 mcg/mL の範囲になります。 .
アモキシル 875 mg と 875 mg の AUGMENTIN® (アモキシシリン/クラブラン酸カリウム) を比較した 27 人の成人を対象としたオープン 2 部構成の単回投与クロスオーバー生物学的同等性試験からの平均アモキシシリン薬物動態パラメータは、アモキシル 500 mg の 875 mg 錠剤が35.4 ± 8.1 mcg•hr/mL の AUC0-∞ および 13.8 ± 4.1 mcg/mL の Cmax。投与は、一晩絶食した後の軽食の開始時に行った。
アモキシシリン懸濁液 125 mg/5 mL および 250 mg/5 mL を経口投与すると、投与後 1 ~ 2 時間で平均血中濃度が 1.5 mcg/mL ~ 3.0 mcg/mL および 3.5 mcg/mL ~それぞれ 5.0 mcg/mL。
400 mg のチュアブル錠と 400 mg/5 mL のアモキシル 625 mg 懸濁液を 24 人の成人ボランティアに単回経口投与すると、同等の薬物動態データが得られました。
分布
アモキシシリンは、髄膜が炎症を起こしている場合を除いて、脳と脊髄液を除いて、ほとんどの体組織と体液に容易に拡散します.血清では、アモキシシリンは約 20% タンパク質に結合しています。 1グラムの投与量に続いて、特別なスキンウィンドウ技術を利用して抗生物質のレベルを決定したところ、間質液に治療レベルが見つかったことが注目されました.
代謝と排泄
アモキシシリンの半減期は 61.3 分です。アモキシシリンの経口投与量の約 60% が 6 ~ 8 時間以内に尿中に排泄されます。検出可能な血清レベルは、アモキシシリンの経口投与後 8 時間まで観察されます。アモキシシリンの大部分は変化せずに尿中に排泄されるため、プロベネシドの同時投与によってその排泄を遅らせることができます。 薬物相互作用 ]。
微生物学
作用機序
アモキシシリンは、活発な増殖段階での感受性細菌に対する殺菌作用においてペニシリンに似ています。それは、細菌の死につながる細胞壁生合成の阻害を通じて作用します。
抵抗のメカニズム
アモキシシリンに対する耐性は、主に、アモキシシリンのベータラクタム環を切断して不活性にするベータラクタマーゼと呼ばれる酵素によって媒介されます。
アモキシシリンは、in vitro および臨床感染の両方で、以下にリストされている細菌のほとんどの分離株に対して活性であることが示されています。 適応症と使用法 セクション。
グラム陽性菌
Enterococcus faecalis Staphylococcus spp.肺炎連鎖球菌 Streptococcus spp. (アルファ溶血性およびベータ溶血性)
グラム陰性菌
大腸菌 インフルエンザ菌 ヘリコバクター ピロリ プロテウス ミラビリス
感受性試験方法
利用可能な場合、臨床微生物検査室は、地域の病院および診療所で使用される抗菌薬の累積的な in vitro 感受性試験結果を、院内および市中感染病原体の感受性プロファイルを説明する定期報告として医師に提供する必要があります。これらのレポートは、医師が最も効果的な抗菌薬を選択するのに役立つはずです。
希釈法: 定量的方法は、抗菌剤の最小発育阻止濃度 (MIC) を決定するために使用されます。これらの MIC は、抗菌化合物に対する細菌の感受性の推定値を提供します。 MIC は、標準化された試験方法 (培養液または寒天) を使用して決定する必要があります 2,4。 MIC 値は、表 4 の基準に従って解釈する必要があります。
拡散テクニック: ゾーンの直径の測定を必要とする定量的方法は、抗菌化合物に対する細菌の感受性の再現可能な推定値を提供することもできます。ゾーンのサイズは、標準化されたテスト方法を使用して決定する必要があります3。
エンテロコッカス種、腸内細菌科、およびインフルエンザ菌のアモキシシリンに対する感受性は、アンピシリンをテストすることで推測できます 4。ブドウ球菌属およびベータ溶血性レンサ球菌属のアモキシシリンに対する感受性は、ペニシリンをテストすることで推測できます 4。エンテロコッカス種の分離株の大部分。アンピシリンまたはアモキシシリンに耐性があるものは、TEM 型のベータラクタマーゼを生成します。 β-ラクタマーゼ試験は、アンピシリンとアモキシシリンに対する耐性を迅速に判断する手段を提供します4。
Streptococcus pneumoniae (非髄膜炎分離株) のアモキシシリンに対する感受性は、ペニシリンまたはオキサシリンをテストすることによって推測される場合があります 4。 S. pneumoniae からアモキシシリンへの解釈基準を表 44 に示します。
「感受性」の報告は、抗菌化合物が感染部位で病原体の増殖を阻害するのに必要な濃度に達した場合、抗菌剤が病原体の増殖を阻害する可能性が高いことを示します。 「中間」のレポートは、結果が曖昧であると見なされるべきであり、微生物が代替の臨床的に実行可能な薬物に完全に感受性でない場合、テストを繰り返す必要があることを示します。このカテゴリーは、薬物が生理学的に集中している身体部位での臨床応用の可能性を示唆しています。このカテゴリは、制御されていない小さな技術的要因が解釈に大きな矛盾を引き起こすのを防ぐ緩衝地帯も提供します。 「耐性」の報告は、抗菌化合物が感染部位で通常達成可能な濃度に達した場合、抗菌剤が病原体の増殖を阻害する可能性が低いことを示します。他の治療法を選択する必要があります。
ヘリコバクター・ピロリの感受性試験
最小発育阻止濃度 (MIC) およびゾーン サイズを決定するためのアモキシシリンの in vitro 感受性試験方法は、ピロリ菌の試験について標準化、検証、または承認されていません。 H. pylori およびクラリスロマイシン感受性検査結果の検体は、3 剤併用療法に失敗した患者の分離株から取得する必要があります。クラリスロマイシン耐性が見つかった場合は、クラリスロマイシンを含まないレジメンを使用する必要があります。
品質管理
標準化された感受性試験手順 2、3、4 では、分析に使用される消耗品と試薬の精度と精度、および試験管理を実施する個人の技術を監視および保証するために、実験室管理を使用する必要があります。標準的なアモキシシリン粉末は、表 54 に示す次の範囲の MIC 値を提供する必要があります。拡散法については、表 5 に示す基準を達成する必要があります。
臨床研究
ピロリ菌の除菌で十二指腸潰瘍の再発リスクを軽減
ヘリコバクター・ピロリおよび十二指腸潰瘍疾患(活動性潰瘍または1年以内の潰瘍の病歴と定義)の患者を対象に米国で実施されたランダム化二重盲検臨床試験では、アモキシシリンカプセルおよびクラリスロマイシン錠剤と組み合わせたランソプラゾールの有効性が評価されました。ヘリコバクター・ピロリの根絶のために、トリプル 14 日間療法として、またはデュアル 14 日間療法としてアモキシシリン カプセルと組み合わせて使用します。これらの研究の結果に基づいて、2 つの異なる根絶レジメンの安全性と有効性が確立されました: トリプル療法: アモキシシリン 1 グラムを 1 日 2 回/クラリスロマイシン 500 mg を 1 日 2 回/ランソプラゾール 30 mg を 1 日 2 回 (表 6 を参照)。二重療法: アモキシシリン 1 グラムを 1 日 3 回/ランソプラゾール 30 mg を 1 日 3 回 (表 7 を参照。すべての治療は 14 日間行われました。 3剤併用療法は2剤併用療法よりも有効であることが示された. 2剤併用療法は両方の単剤療法よりも効果的であることが示された. ピロリ菌の除菌は十二指腸潰瘍の再発リスクを低下させることが示されている.
参考文献
1. Swanson-Biearman B、Dean BS、Lopez G、Krenzelok EP. 6 歳未満の小児におけるペニシリンおよびセファロスポリン摂取の影響。獣医ハム毒. 1988; 30: 66-67.
2. Clinical and Laboratory Standards Institute (CLSI)。好気的に増殖する細菌の希釈抗菌薬感受性試験の方法;承認された標準 – 第 10 版。 CLSI ドキュメント M07-A10、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA、2015。
3. Clinical and Laboratory Standards Institute (CLSI)。抗菌ディスク拡散感受性試験の性能基準;承認された標準 – 第 12 版。 CLSI ドキュメント M02-A12、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA、2015。
4. Clinical and Laboratory Standards Institute (CLSI)。抗菌薬感受性試験の性能基準;第 25 情報補足、CLSI ドキュメント M100-S25。 CLSI ドキュメント M100-S25、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA、2015。
患者情報
- 処方された用量に応じて、8時間ごとまたは12時間ごとにアモキシルを服用できることを患者に説明する必要があります。
- AMOXIL を含む抗菌薬は、細菌感染症の治療にのみ使用するよう患者に説明する必要があります。ウイルス感染症(風邪など)は治療しません。細菌感染症の治療に AMOXIL 250mg が処方された場合、治療の初期に気分が良くなるのが一般的ですが、指示どおりに服用する必要があることを患者に伝えてください。投与をスキップしたり、治療の全コースを完了しないと、(1) 即時治療の有効性が低下し、(2) 細菌が耐性を獲得し、将来的にアモキシル 625mg または他の抗菌薬で治療できなくなる可能性が高くなります。 .
- 下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると治まることを患者に説明する必要があります。抗生物質による治療を開始した後、抗生物質の最終投与後 2 か月以上経っても水様便や血便(胃痙攣や発熱の有無にかかわらず)が現れることがあります。これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
- 患者は、AMOXIL にはペニシリン クラスの医薬品が含まれており、一部の個人ではアレルギー反応を引き起こす可能性があることに注意する必要があります。
