Omnicef 300mg Cefdinir 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
オムニセフとは?
オムニセフ(セフジニル)は、細菌によって引き起こされるさまざまな種類の感染症の治療に使用されるセファロスポリン系抗生物質です。ブランド名 Omnicef は、米国では廃止されました。Omnicef は一般的な形で入手できます。
オムニセフの副作用は?
オムニセフ 300mg の一般的な副作用は次のとおりです。
- 下痢、
- 吐き気、
- 嘔吐、
- 胃痛、
- 消化不良、
- 頭痛、
- めまい、
- 液体セフジニルを服用している幼児のおむつかぶれ、
- かゆみ、または
- 皮膚発疹、
ノート: このリストには、考えられるすべての副作用が含まれているわけではありません。
薬剤耐性菌の発生を減らし、オムニセフ 300mg および他の抗菌薬の有効性を維持するために、オムニセフは、細菌によって引き起こされることが証明されているか、強く疑われる感染症の治療または予防にのみ使用する必要があります。
説明
オムニセフ(セフジニル)カプセルおよび経口懸濁液用オムニセフ(セフジニル)には、経口投与用の有効成分である拡張スペクトルの半合成セファロスポリンであるセフジニルが含まれています。化学的には、セフジニルは [6R-[6α, 7β (Z)]]-7-[[(2-アミノ-4-チアゾリル)(ヒドロキシイミノ)アセチル]アミノ]3-エテニル-8-オキソ-5-チア-1 -アザビシクロ[4.2.0]オクタ-2-エン-2-カルボン酸。セフジニルは白色からわずかに茶色がかった黄色の固体です。希塩酸にわずかに溶け、0.1 M pH 7.0 リン酸緩衝液にやや溶けにくい。実験式は C14H13N5O5S2 で、分子量は 395.42 です。セフジニルの構造式は以下のとおりです。
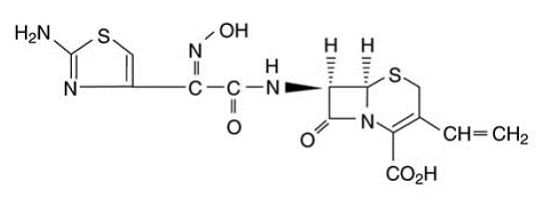
OMNICEF 300mg カプセルには、300mg のセフジニルと次の不活性成分が含まれています。ポリオキシル 40 ステアレート、NF;およびステアリン酸マグネシウム、NF。カプセルシェルにはFD&C Blue #1が含まれています。 FD&C レッド #40; D&C レッド #28;二酸化チタン、NF;ゼラチン、NF;二酸化ケイ素、NF;およびラウリル硫酸ナトリウム、NF。
OMNICEF 経口懸濁液用 300mg は、再構成後、5 mL あたり 125 mg のセフジニルまたは 5 mL あたり 250 mg のセフジニルと、次の不活性成分を含みます。クエン酸、USP;クエン酸ナトリウム、USP;安息香酸ナトリウム、NF;キサンタンガム、NF;グアーガム、NF;人工のストロベリーとクリームのフレーバー。二酸化ケイ素、NF;およびステアリン酸マグネシウム、NF。
適応症
薬剤耐性菌の発生を減らし、オムニセフ 300mg および他の抗菌薬の有効性を維持するために、オムニセフ 300mg は、感受性菌によって引き起こされることが証明されている、または強く疑われる感染症の治療または予防にのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
オムニセフ (セフジニル) カプセルおよび経口懸濁液用のオムニセフ (セフジニル) は、以下にリストされた条件で指定された微生物の感受性株によって引き起こされる軽度から中等度の感染症の患者の治療に適応されます。
大人と青少年
市中肺炎
インフルエンザ菌(β-ラクタマーゼ産生株を含む)、パラインフルエンザ菌(β-ラクタマーゼ産生株を含む)、肺炎連鎖球菌(ペニシリン感受性株のみ)、およびモラクセラ・カタラーリス(β-ラクタマーゼ産生株を含む)によって引き起こされる( 臨床研究 )。
慢性気管支炎の急性増悪
インフルエンザ菌(β-ラクタマーゼ産生株を含む)、ヘモフィルス・パラインフルエンザ(β-ラクタマーゼ産生株を含む)、肺炎連鎖球菌(ペニシリン感受性株のみ)、およびモラクセラ・カタラーリス(β-ラクタマーゼ産生株を含む)によって引き起こされます。
急性上顎洞炎
インフルエンザ菌(β-ラクタマーゼ産生株を含む)、肺炎連鎖球菌(ペニシリン感受性株のみ)、およびモラクセラ・カタラーリス(β-ラクタマーゼ産生株を含む)によって引き起こされます。
ノート: 小児患者への使用に関する情報については、 小児用 と 投薬と管理 .
咽頭炎/扁桃炎
化膿連鎖球菌によって引き起こされます(参照 臨床研究 )。
ノート: セフジニルは、中咽頭からの化膿性連鎖球菌の根絶に効果的です。しかし、化膿性連鎖球菌咽頭炎/扁桃炎に続くリウマチ熱の予防についてセフジニルは研究されていません。筋肉内ペニシリンのみがリウマチ熱の予防に有効であることが実証されています。
合併症のない皮膚および皮膚構造の感染症
黄色ブドウ球菌(β-ラクタマーゼ産生株を含む)および化膿連鎖球菌によって引き起こされます。
小児患者
急性細菌性中耳炎 インフルエンザ菌(β-ラクタマーゼ産生株を含む)、肺炎連鎖球菌(ペニシリン感受性株のみ)、およびモラクセラ・カタラーリス(β-ラクタマーゼ産生株を含む)によって引き起こされます。
咽頭炎/扁桃炎
化膿連鎖球菌によって引き起こされます(参照 臨床研究 )。
ノート: セフジニルは、中咽頭からの化膿性連鎖球菌の根絶に効果的です。しかし、化膿性連鎖球菌咽頭炎/扁桃炎に続くリウマチ熱の予防についてセフジニルは研究されていません。筋肉内ペニシリンのみがリウマチ熱の予防に有効であることが実証されています。
合併症のない皮膚および皮膚構造の感染症
黄色ブドウ球菌(β-ラクタマーゼ産生株を含む)および化膿連鎖球菌によって引き起こされます。
投薬と管理
(見る 適応症と使用法 為に 適応病原体 )
カプセル
成人および青年の感染症の推奨用量と治療期間は、次の表に記載されています。すべての感染症の 1 日総投与量は 600 mg です。 1 日 1 回 10 日間の投与は、BID 投与と同じくらい効果的です。肺炎や皮膚感染症での 1 日 1 回の投与は研究されていません。したがって、オムニセフ カプセルは、これらの感染症では 1 日 2 回投与する必要があります。オムニセフカプセルは食事に関係なく服用できます。
大人と青少年(13歳以上)
粉末経口懸濁液用
小児患者の感染症に対する推奨用量と治療期間は、次の表に記載されています。すべての感染に対する 1 日あたりの総投与量は 14 mg/kg で、1 日あたりの最大投与量は 600 mg です。 1 日 1 回 10 日間の投与は、BID 投与と同じくらい効果的です。皮膚感染症における 1 日 1 回の投与は研究されていません。したがって、経口懸濁液用オムニセフ 300mg は、この感染症では 1 日 2 回投与する必要があります。オムニセフ経口懸濁液は、食事に関係なく投与できます。
小児患者(生後6か月から12歳まで)
経口懸濁液用オムニセフ小児用用量チャート
腎不全の患者
クレアチニンクリアランスが 30 mL/min 未満の成人患者の場合、セフジニルの用量は 300 mg を 1 日 1 回投与する必要があります。
クレアチニンクリアランスは、外来患者で測定することは困難です。ただし、成人患者のクレアチニンクリアランス (CLcr) を推定するには、次の式を使用できます。推定値が有効であるためには、血清クレアチニン値が腎機能の定常状態レベルを反映している必要があります。
クレアチニン クリアランスの単位は mL/分、年齢の単位は年、体重の単位はキログラム、血清クレアチニンの単位は mg/dL.4
次の式は、小児患者のクレアチニンクリアランスを推定するために使用できます。
CLcr = K×体長または身長/血清クレアチニン
ここで、K = 1 歳以上の小児患者の場合は 0.55、幼児 (1 歳まで) の場合は 0.45 です。
上記の式では、クレアチニン クリアランスの単位は mL/min/1.73 m²、体長または身長の単位はセンチメートル、血清クレアチニンの単位は mg/dL です。
クレアチニンクリアランスが 30 mL/min/1.73 m² 未満の小児患者の場合、セフジニルの用量は 7 mg/kg (最大 300 mg) を 1 日 1 回投与する必要があります。
血液透析患者
血液透析は、体からセフジニルを除去します。慢性血液透析を受けている患者の場合、推奨される初回投与量は 300 mg または 7 mg/kg を隔日投与することです。
各血液透析セッションの終わりに、300 mg (または 7 mg/kg) を投与する必要があります。その後、1 日おきに (300 mg または 7 mg/kg) を投与します。
オムニセフ 300mg 経口懸濁剤の調合方法
混合後、懸濁液は室温 (25°C/77°F) で保存できます。容器はしっかりと密閉し、各投与前に懸濁液をよく振ってください。懸濁液は 10 日間使用できます。その後、未使用部分は廃棄する必要があります。
供給方法
オムニセフカプセル 製品名が刻印されたラベンダーとターコイズのカプセルとして、300 mgのセフジニルを含む、次のように入手できます。
60カプセル/ボトル NDC 0074-3769-60 OMNI-PAC™ カートン 3 単位使用、5 日間、10 カプセルのブリスター カード NDC 0074-3769-30
オムニセフ経口懸濁剤300mg クリーム色の粉末製剤で、指示に従って再構成すると、セフジニル 125 mg/5 mL またはセフジニル 250 mg/5 mL が含まれます。再構成された懸濁液は、クリーム色とイチゴの風味を持っています。パウダーは次のように入手できます。
125mg/5mL
60mLボトル NDC 0074-3771-60 100mLボトル NDC 0074-3771-13 250mg/5mL 60mLボトル NDC 0074-6151-60 100mLボトル NDC 0074-6151-13
カプセルと懸濁していない粉末は 25°C (77°F) で保管してください。 15°-30°C (59°-86°F) [USP 制御室温を参照] まで許容されます。再構成後、経口懸濁液は制御された室温で 10 日間保存できます。
製造元: CEPH International Corporation Carolina, Puerto Rico 00986. For: AbbVie Inc., North Chicago, IL 60064, USA, Under License of: Astellas Pharma Inc. Tokyo, Japan. 2015 年 11 月改訂
副作用
有害事象
臨床試験 - OMNICEF カプセル (成人および思春期患者)
臨床試験では、成人および思春期の患者 5,093 人 (米国人 3,841 人、非米国人 1,252 人) が推奨用量のセフジニル カプセル (600 mg/日) で治療されました。ほとんどの有害事象は軽度で、自己制限的でした。セフジニルに起因する死亡や永続的な障害はありませんでした。 5093 人の患者のうち 147 人 (3%) の患者が、セフジニル療法に関連する可能性がある、おそらく、または確実に関連すると研究者が考えた有害事象のために投薬を中止しました。中止は、主に胃腸障害、通常は下痢または吐き気のためでした。 5093 人中 19 人 (0.4%) の患者が、セフジニル投与に関連する発疹の考えのために中止されました。
米国では、複数回投与の臨床試験(N = 3841のセフジニル治療患者)において、次の有害事象がセフジニルカプセルに関連している可能性があり、おそらく、または確実に関連していると研究者が考えていました。
セフジニルカプセルに関連する有害事象 成人および思春期患者における米国の試験 (N = 3841)
米国で実施された臨床試験では、セフジニルによる治療との関係に関係なく、臨床的に重要な可能性のある次の臨床検査値の変化が見られました。
セフジニルカプセルで観察された臨床検査値の変化
臨床試験 - 経口懸濁液用オムニセフ(小児患者)
臨床試験では、2289 人の小児患者 (1783 人の米国人および 506 人の非米国人) がセフジニル懸濁液の推奨用量 (14 mg/kg/日) で治療されました。ほとんどの有害事象は軽度で、自己制限的でした。セフジニルに起因する死亡や永続的な障害はありませんでした。 2289 人の患者のうち 40 人 (2%) の患者が、治験責任医師がセフジニル療法に関連する可能性がある、おそらく、または確実に関連すると考えられる有害事象のために投薬を中止しました。中止は主に胃腸障害、通常は下痢のためでした。 2289 人中 5 人 (0.2%) の患者が、セフジニル投与に関連する発疹の考えのために中止されました。
米国では、以下の有害事象が、複数回投与の臨床試験におけるセフジニルの中断に関連している可能性があり、おそらく、または確実に関連していると研究者によって考えられていました (N = 1783 人のセフジニル治療患者)。
セフジニル懸濁液に関連する有害事象 小児患者における米国の試験 (N = 1783)a
注: セフジニルとコントロールの両方で治療を受けた患者では、最年少の小児患者で下痢と発疹の発生率が高かった.セフジニル治療を受けている 2 歳以下の患者の下痢の発生率は 17% (95/557) であったのに対し、2 歳以上の患者では 4% (51/1226) でした。発疹 (主に若い患者のおむつかぶれ) の発生率は、2 歳以上の患者では 1% (8/1226) であるのに対し、2 歳以下の患者では 8% (43/557) でした。
米国で実施された臨床試験では、セフジニルによる治療との関係に関係なく、臨床的に重要な可能性のある次の臨床検査値の変化が見られました。
セフジニル懸濁液で観察された可能性のある臨床的意義の臨床検査値の変化小児患者における米国の試験(N = 1783)
市販後の経験
セフジニルとの関係に関係なく、1991 年に日本で承認されて以来、広範な市販後の経験の中で、以下の有害な経験および実験室試験の変更が報告されています。血清病様反応、結膜炎、口内炎、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、剥脱性皮膚炎、多形紅斑、結節性紅斑、急性肝炎、胆汁うっ滞、劇症肝炎、肝不全、黄疸、アミラーゼ上昇、急性腸炎、血性下痢、出血性大腸炎、下血、偽膜性大腸炎、汎血球減少症、顆粒球減少症、白血球減少症、血小板減少症、特発性血小板減少性紫斑病、溶血性貧血、急性呼吸不全、喘息発作、薬剤性肺炎、好酸球性肺炎、特発性間質性肺炎、発熱、急性腎不全、腎症、出血傾向、凝固障害秩序、播種性血管内凝固症候群、上部消化管出血、消化性潰瘍、イレウス、意識消失、アレルギー性血管炎、セフジニル-ジクロフェナク相互作用の可能性、心不全、胸痛、心筋梗塞、高血圧、不随意運動、および横紋筋融解症。
セファロスポリンクラスの有害事象
一般に、セファロスポリンクラスの抗生物質について、以下の有害事象および実験室試験の変更が報告されています。
アレルギー反応、アナフィラキシー、スティーブンス・ジョンソン症候群、多形紅斑、中毒性表皮壊死融解症、腎機能障害、中毒性腎症、胆汁うっ滞を含む肝機能障害、再生不良性貧血、溶血性貧血、出血、尿糖偽陽性検査、好中球減少症、汎血球減少症、無顆粒球症.偽膜性大腸炎の症状は、抗生物質治療中または治療後に始まることがあります( 警告 )。
いくつかのセファロスポリンは、特に腎機能障害のある患者において、投与量を減らさなかった場合に、発作の誘発に関与していることが示されています (以下を参照)。 投薬と管理 と 過剰摂取 )。薬物療法に関連する発作が発生した場合は、薬物を中止する必要があります。臨床的に必要な場合は、抗けいれん療法を行うことができます。
薬物相互作用
制酸剤(アルミニウムまたはマグネシウム含有)
300 mg のセフジニル カプセルと 30 mL の Maalox® TC 懸濁液を併用投与すると、吸収速度 (Cmax) と吸収範囲 (AUC) が約 40% 低下します。 Cmax に達するまでの時間も 1 時間延長されます。制酸剤がセフジニルの 2 時間前または 2 時間後に投与された場合、セフジニルの薬物動態に有意な影響はありません。 OMNICEF 300mg の治療中に制酸剤が必要な場合は、制酸剤の少なくとも 2 時間前または後に OMNICEF 300mg を服用する必要があります。
プロベネシド
他のβ-ラクタム系抗生物質と同様に、プロベネシドはセフジニルの腎排泄を阻害し、その結果、AUC が約 2 倍になり、ピーク セフジニル血漿レベルが 54% 増加し、見かけの排出 t½ が 50% 延長されます。
鉄分サプリメントと鉄分強化食品
セフジニルと 60 mg の元素鉄 (FeSO4 として) を含む治療用鉄サプリメント、または 10 mg の元素鉄を補給したビタミンとの併用投与により、吸収の程度がそれぞれ 80% および 31% 減少しました。 OMNICEF 300mg の治療中に鉄のサプリメントが必要な場合、OMNICEF はサプリメントの少なくとも 2 時間前または後に摂取する必要があります。
鉄元素を高度に強化した食品 (主に鉄強化の朝食用シリアル) がセフジニルの吸収に及ぼす影響は研究されていません。
同時に投与された鉄分強化乳児用調合乳 (2.2 mg 元素鉄/6 オンス) は、セフジニルの薬物動態に有意な影響を与えません。したがって、経口懸濁液用のオムニセフは、鉄分を強化した乳児用調製粉乳で投与することができます。
セフジニルを投与されている患者では、便が赤みを帯びているという報告があります。多くの場合、患者は鉄含有製品も受け取っていました。赤みがかった色は、セフジニルまたはその分解生成物と胃腸管内の鉄との間の非吸収性複合体の形成によるものです。
薬物/実験室試験の相互作用
尿中のケトンの偽陽性反応は、ニトロプルシドを使用した検査で発生する可能性がありますが、ニトロフェリシアニドを使用した検査では発生しません.セフジニルの投与により、クリニテスト®、ベネディクト液、またはフェーリング液を使用した尿中のブドウ糖に対する偽陽性反応が生じる可能性があります。酵素的グルコースオキシダーゼ反応(Clinistix®やTes-Tape®など)に基づくグルコース検査を使用することをお勧めします。セファロスポリンは、時折、直接クームス試験で陽性を誘発することが知られています。
警告
オムニセフ(セフジニル)による治療を開始する前に、患者が以前にセフジニル、他のセファロスポリン、ペニシリン、または他の薬物に対して過敏反応を示したかどうかを判断するために、慎重な問診を行う必要があります。セフジニルがペニシリン感受性患者に投与される場合、β-ラクタム系抗生物質間の交差過敏症が明確に文書化されており、ペニシリンアレルギーの既往のある患者の最大 10% で発生する可能性があるため、注意が必要です。セフジニルに対するアレルギー反応が発生した場合は、薬を中止する必要があります。深刻な急性過敏症反応は、臨床的に示されているように、酸素、静脈内輸液、静脈内抗ヒスタミン薬、コルチコステロイド、プレッサーアミン、および気道管理を含む、エピネフリンおよびその他の緊急措置による治療を必要とする場合があります。
クロストリジウム ディフィシル関連下痢症 (CDAD) は、OMNICEF を含むほぼすべての抗菌薬の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗菌薬の使用後に下痢を呈するすべての患者で CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗菌薬の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗菌治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
予防
全般的
証明された、または強く疑われる細菌感染がない場合、または予防的適応がない場合にOMNICEF 300mgを処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌の発生のリスクが高まります。
他の広域抗生物質と同様に、長期にわたる治療は、耐性菌の出現と過剰増殖の可能性をもたらす可能性があります.患者の注意深い観察が不可欠です。治療中に重複感染が発生した場合は、適切な代替療法を実施する必要があります。
セフジニルは、他の広域抗菌薬 (抗生物質) と同様に、大腸炎の既往歴のある人には慎重に処方する必要があります。
一過性または持続性の腎機能不全 (クレアチニンクリアランス 投薬と管理 )。
発がん、突然変異誘発、生殖能力の障害
セフジニルの発がん性は評価されていません。 V79 チャイニーズハムスター肺細胞のヒポキサンチン-グアニンホスホリボシルトランスフェラーゼ遺伝子座 (HGPRT) での細菌復帰突然変異アッセイ (Ames) または点突然変異アッセイでは、変異原性の影響は見られませんでした。 V79 チャイニーズハムスター肺細胞の構造的染色体異常試験で in vitro で、またはマウス骨髄での小核試験で in vivo で、染色体異常誘発効果は観察されなかった。ラットでは、1000 mg/kg/日までの経口用量でセフジニルの受胎能および生殖能に影響はありませんでした (mg/kg/日ではヒト用量の 70 倍、mg/m²/日では 11 倍)。
妊娠
催奇形性効果
妊娠カテゴリーB
セフジニルは、最大 1000 mg/kg/日 (mg/kg/日に基づくヒトの用量の 70 倍、mg/m²/日に基づくと 11 倍) の経口用量でラットにおいて、または最大 10 の経口用量でウサギにおいて催奇形性を示さなかった。 mg/kg/日 (mg/kg/日に基づくヒト用量の 0.7 倍、mg/m²/日に基づく 0.23 倍)。母体毒性 (体重増加の減少) は、最大耐用量 10 mg/kg/日のウサギで観察され、子孫への悪影響はありませんでした。 100 mg/kg/日以上でラット胎児に、32 mg/kg/日以上でラット子孫に体重減少が生じた。母体の生殖パラメーターまたは子孫の生存、発育、行動、または生殖機能への影響は観察されませんでした。
しかし、妊娠中の女性を対象とした十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるわけではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
労働と配達
分娩中のセフジニルの使用については研究されていません。
授乳中の母親
単回 600 mg の投与後、セフジニルは母乳中に検出されませんでした。
小児用
新生児および生後 6 か月未満の乳児における安全性と有効性は確立されていません。小児患者(生後 6 か月から 12 歳)の急性上顎副鼻腔炎の治療にセフジニルを使用することは、成人および青年を対象とした適切かつ十分に管理された研究、成人および小児患者における急性副鼻腔炎と同様の病態生理学から得られた証拠によって裏付けられています。小児集団における比較薬物動態データ。
高齢者の使用
有効性は、高齢患者と若年成人で同等です。セフジニルはすべての年齢層で十分に許容されていますが、臨床試験では、高齢患者は若い成人よりも下痢などの有害事象の発生率が低かった.腎機能が著しく低下していない限り、高齢患者の用量調整は必要ありません( 投薬と管理 )。
過剰摂取
ヒトにおけるセフジニルの過剰摂取に関する情報は入手できません。げっ歯類の急性毒性試験では、5600 mg/kg を 1 回経口投与しても悪影響はありませんでした。他のβ-ラクタム系抗生物質を過剰摂取した後の毒性徴候や症状には、吐き気、嘔吐、上腹部痛、下痢、痙攣などがあります。血液透析は、体からセフジニルを除去します。これは、特に腎機能が損なわれている場合、過剰摂取による深刻な毒性反応の場合に役立つ可能性があります.
禁忌
OMNICEF (セフジニル) は、セファロスポリンクラスの抗生物質に対する既知のアレルギーのある患者には禁忌です。
臨床薬理学
薬物動態と薬物代謝
吸収
経口バイオアベイラビリティ
最大の血漿セフジニル濃度は、カプセルまたは懸濁液の投与後、投与後 2 ~ 4 時間で発生します。血漿セフジニル濃度は用量とともに増加しますが、その増加は 300 mg (7 mg/kg) から 600 mg (14 mg/kg) まで用量に比例しません。健康な成人に懸濁液を投与した後のセフジニルのバイオアベイラビリティは、カプセルと比較して 120% です。セフジニル カプセルの推定バイオアベイラビリティは、300 mg のカプセル用量の投与後に 21%、600 mg のカプセル用量の投与後に 16% です。セフジニル懸濁液の推定絶対バイオアベイラビリティは 25% です。 250 mg/5 mL 強度のセフジニル経口懸濁液は、絶食条件下の健康な成人の 125 mg/5 mL 強度と生物学的に同等であることが示されました。
食事の影響
カプセルからのセフジニルの Cmax と AUC は、高脂肪の食事と一緒に与えられた場合、それぞれ 16% と 10% 減少します。高脂肪食とともに 250 mg/5 mL 経口懸濁液を投与された成人では、セフジニルの Cmax と AUC がそれぞれ 44% と 33% 減少しました。小児患者における経口懸濁液の安全性と有効性の研究は食物摂取に関係なく実施されたため、これらの減少の大きさは臨床的に重要である可能性は低い.したがって、セフジニルは食事に関係なく服用できます。
セフジニルカプセル
成人被験者へのセフジニルの 300 mg および 600 mg の単回経口投与後のセフジニルの血漿中濃度および薬物動態パラメータ値を次の表に示します。
成人被験者へのカプセル投与後の平均(± SD)血漿セフジニル薬物動態パラメータ値
セフジニル懸濁液
小児被験者(生後 6 か月~12 歳)にセフジニルの 7 および 14 mg/kg を単回経口投与した後のセフジニルの血漿中濃度および薬物動態パラメータ値を次の表に示します。
小児被験者への懸濁液の投与後の平均(± SD)血漿セフジニル薬物動態パラメータ値
複数回投与
セフジニルは、腎機能が正常な被験者に 1 日 1 回または 2 回投与した後、血漿中に蓄積しません。
分布
成人被験者におけるセフジニルの平均分布容積 (Vdarea) は 0.35 L/kg (± 0.29) です。小児対象(生後 6 か月~12 歳)では、セフジニル Vdarea は 0.67 L/kg(± 0.38)です。セフジニルは、成人と小児の被験者の両方で血漿タンパク質に 60% から 70% 結合しています。結合は濃度に依存しません。
皮膚の水ぶくれ
成人被験者では、300 mg および 600 mg の投与から 4 ~ 5 時間後に、それぞれ 0.65 (0.33-1.1) および 1.1 (0.49-1.9) μg/mL の最大水疱液セフジニル濃度の中央値 (範囲) が観察されました。平均 (± SD) ブリスター Cmax および AUC (0-∞) 値は、対応する血漿値の 48% (± 13) および 91% (± 18) でした。
扁桃腺組織
待機的扁桃摘出術を受けている成人患者では、300 mg および 600 mg の単回投与の 4 時間後の扁桃組織のセフジニル濃度の中央値は、それぞれ 0.25 (0.220.46) および 0.36 (0.22-0.80) μg/g でした。平均扁桃腺組織濃度は、対応する血漿濃度の 24% (± 8) でした。
副鼻腔組織
上顎洞および篩骨洞の待機的手術を受ける成人患者では、300 mg および 600 mg の単回投与の 4 時間後の洞組織のセフジニル濃度の中央値は、それぞれ
肺組織
診断用気管支鏡検査を受ける成人患者では、単回 300 mg および 600 mg 投与の 4 時間後の気管支粘膜セフジニル濃度の中央値は、それぞれ 0.78 (
中耳液
急性細菌性中耳炎の小児患者 14 人において、単回 7 および 14 mg/kg 用量の投与から 3 時間後のそれぞれの中耳液中セフジニル濃度の中央値は、0.21 (
CSF
ヒトの脳脊髄液へのセフジニルの浸透に関するデータは入手できません。
代謝と排泄
セフジニルはほとんど代謝されません。活動は主に親薬物によるものです。セフジニルは主に腎排泄を介して排出され、平均血漿排出半減期 (t½) は 1.7 (± 0.6) 時間です。腎機能が正常な健康な被験者では、腎クリアランスは 2.0 (± 1.0) mL/min/kg であり、300 および 600 の投与後の見かけの経口クリアランスは 11.6 (± 6.0) および 15.5 (± 5.4) mL/min/kg です。 -mg、それぞれ。 300 mg および 600 mg の投与後に尿中に変化せずに回収された投与量の平均パーセントは、それぞれ 18.4% (± 6.4) および 11.6% (± 4.6) です。セフジニルクリアランスは、腎機能障害のある患者では低下します( 特別な集団 - 腎不全患者 )。
腎排泄が排泄の主な経路であるため、腎機能が著しく低下している患者や血液透析を受けている患者では、投与量を調整する必要があります。 投薬と管理 )。
特別な集団
腎不全患者
セフジニルの薬物動態は、さまざまな程度の腎機能を持つ 21 人の成人被験者で調査されました。セフジニル排出率、見かけの経口クリアランス (CL/F)、および腎クリアランスの減少は、クレアチニンクリアランス (CLcr) の減少にほぼ比例していました。その結果、血漿セフジニル濃度は、腎障害のない被験者よりも腎障害のある被験者の方が高く、長く持続しました。 CLcr が 30 ~ 60 mL/min の被験者では、Cmax と t½ が約 2 倍、AUC が約 3 倍に増加しました。 CLcr 投薬と管理 )。
血液透析
セフジニルの薬物動態は、血液透析を受けている 8 人の成人被験者で研究されました。透析 (4 時間) により、体から 63% のセフジニルが除去され、見かけの排出 t½ が 16 (± 3.5) 時間から 3.2 (± 1.2) 時間に短縮されました。この患者集団では用量調整が推奨されます( 投薬と管理 )。
肝疾患
セフジニルは主に腎臓で排泄され、ほとんど代謝されないため、肝機能障害のある患者での研究は行われませんでした。この集団では投与量の調整が必要になるとは予想されていません。
高齢患者
300 mg 単回投与後のセフジニルの薬物動態に対する年齢の影響は、19 ~ 91 歳の 32 人の被験者で評価されました。セフジニルへの全身暴露は、高齢の被験者 (N = 16) で大幅に増加し、Cmax は 44%、AUC は 86% 増加しました。この増加は、セフジニルクリアランスの減少によるものでした。分布の見かけの体積も減少したため、見かけの排泄 t½ に顕著な変化は観察されませんでした (高齢者: 2.2 ± 0.6 時間 vs 若年者: 1.8 ± 0.4 時間)。セフジニルクリアランスは、主に年齢ではなく腎機能の変化に関連していることが示されているため、高齢の患者は、腎機能が著しく損なわれていない限り、投与量を調整する必要はありません (クレアチニンクリアランス 上記の腎不全患者 )。
性別と人種
臨床薬物動態のメタアナリシスの結果 (N = 217) は、性別または人種がセフジニルの薬物動態に有意な影響を与えないことを示しました。
微生物学
作用機序
他のセファロスポリンと同様に、セフジニルの殺菌活性は細胞壁合成の阻害に起因します。セフジニルは、すべてではありませんが一部のβ-ラクタマーゼ酵素の存在下で安定しています。その結果、ペニシリンに耐性のある多くの生物と一部のセファロスポリンは、セフジニルに感受性があります。
抵抗のメカニズム
セフジニルに対する耐性は、主に一部のβ-ラクタマーゼによる加水分解、ペニシリン結合タンパク質 (PBP) の変化、および透過性の低下によるものです。セフジニルは、エンテロバクター属、シュードモナス属、エンテロコッカス属、ペニシリン耐性連鎖球菌、メチシリン耐性ブドウ球菌のほとんどの菌株に対して不活性です。 β-ラクタマーゼ陰性、アンピシリン耐性 (BLNAR) のインフルエンザ菌株は、通常、セフジニルに対して非感受性です。
抗菌活性
セフジニルは、in vitro および臨床感染の両方で、以下の微生物のほとんどの菌株に対して活性であることが示されています。 適応症と使用法 .
グラム陽性菌
黄色ブドウ球菌(メチシリン感受性株のみ) 肺炎連鎖球菌(ペニシリン感受性株のみ) 化膿連鎖球菌
グラム陰性菌
インフルエンザ菌 パラインフルエンザ菌 モラクセラ・カタラーリス
以下の in vitro データが利用可能ですが、それらの臨床的意義は不明です。
セフジニルは、以下の微生物の菌株 (≥ 90%) に対して 1 mcg/mL 以下の in vitro 最小発育阻止濃度 (MIC) を示します。ただし、これらの微生物による臨床感染症の治療におけるセフジニルの安全性と有効性は、十分に管理された臨床試験では確立されていません。
グラム陽性菌
表皮ブドウ球菌(メチシリン感受性株のみ) Streptococcus agalactiae Viridans group streptococci
グラム陰性菌
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
感受性試験方法
可能であれば、臨床微生物検査室は、潜在的な院内および市中感染病原体の地域/局所感受性プロファイルを説明する定期レポートを提供する必要があります。これらのレポートは、医師が治療用の抗菌薬を選択する際に役立つはずです。
希釈法
定量的方法は、抗菌剤の最小発育阻止濃度 (MIC) を決定するために使用されます。これらの MIC は、抗菌化合物に対する細菌の感受性の推定値を提供します。 MIC は、標準化された試験方法 1 (培養液および/または寒天) を使用して決定する必要があります。 MIC 値は、表 1 に示す基準に従って解釈する必要があります。
拡散テクニック
ゾーンの直径の測定を必要とする定量的方法も、抗菌化合物に対する細菌の感受性の再現可能な推定値を提供します。ゾーンのサイズは、標準化された方法を使用して決定する必要があります。2 この手順では、5 mcg のセフジニルを含浸させた紙ディスクを使用して、細菌の感受性をテストします。ディスク拡散の解釈基準を表 1 に示します。
ブドウ球菌のセフジニルに対する感受性は、ペニシリンとセフォキシチンまたはオキサシリンのいずれかをテストすることで推定できます。オキサシリン(セフォキシチン)に感受性のあるブドウ球菌は、セフジニルに感受性があると見なすことができます.3
「感受性」の報告は、抗菌化合物が感染部位で病原体の増殖を阻害するのに必要な濃度に達した場合、抗菌剤が病原体の増殖を阻害する可能性が高いことを示しています。 「中間」のレポートは、結果が曖昧であると見なされるべきであり、微生物が代替の臨床的に実行可能な薬物に完全に感受性でない場合、テストを繰り返す必要があることを示します。このカテゴリーは、薬物が生理学的に集中している身体部位、または高用量の薬物を使用できる状況での臨床応用の可能性を示唆しています。このカテゴリは、制御されていない小さな技術的要因が解釈に大きな矛盾を引き起こすのを防ぐ緩衝地帯も提供します。 「耐性」の報告は、抗菌化合物が感染部位で通常達成可能な濃度に達した場合、抗菌剤が病原体の増殖を阻害する可能性が低いことを示しています。他の治療法を選択する必要があります。
品質管理
標準化された感受性試験手順では、検査に使用される消耗品と試薬の精度と精度、および試験を実施する個人の技術を監視および保証するために、実験室管理を使用する必要があります.1,2,3 標準セフジニル粉末は、次の範囲を提供する必要があります。表 2 に示すように MIC 値の。5 mcg ディスクを使用した拡散法では、表 2 の基準を達成する必要があります。
臨床研究
市中細菌性肺炎
米国で実施された成人および青年を対象とした対照二重盲検試験では、セフジニル BID がセファクロル 500 mg TID と比較されました。厳格な評価可能性と微生物学的/臨床反応基準を使用して、治療後 6 ~ 14 日で、次の臨床治癒率、推定微生物学的根絶率、および統計的結果が得られました。
米国の市中肺炎研究 セフジニル vs セファクロル
主にヨーロッパで実施された成人および青年を対象とした 2 番目の対照調査者盲検研究では、セフジニル BID がアモキシシリン/クラブラン酸 500/125 mg TID と比較されました。厳密な評価可能性および治療後 6 ~ 14 日での臨床反応基準を使用して、以下の臨床治癒率、推定微生物根絶率、および統計的結果が得られました。
欧州共同体獲得肺炎研究セフジニル対アモキシシリン/クラブラン酸
連鎖球菌性咽頭炎/扁桃炎
米国で実施された 4 つの対照研究では、セフジニルは、成人、青年、および小児患者を対象に 10 日間のペニシリンと比較されました。 2 つの研究 (1 つは成人および青年、もう 1 つは小児患者) では、10 日間のセフジニル QD または BID をペニシリン 250 mg または 10 mg/kg QID と比較しました。厳格な評価可能性と微生物学的/臨床反応基準を使用して、治療後 5 ~ 10 日で、次の臨床治癒率、微生物学的根絶率、および統計的結果が得られました。
咽頭炎/扁桃炎の研究 セフジニル (10 日間) vs ペニシリン (10 日間)
2 つの研究 (1 つは成人および青年、もう 1 つは小児患者) では、5 日間のセフジニル BID と 10 日間のペニシリン 250 mg または 10 mg/kg QID が比較されました。厳格な評価可能性と微生物学的/臨床反応基準を使用して、治療後 4 ~ 10 日で、次の臨床治癒率、微生物学的根絶率、および統計的結果が得られました。
咽頭炎/扁桃炎の研究 セフジニル (5 日間) vs ペニシリン (10 日間)
参考文献
1. Clinical and Laboratory Standards Institute (CLSI)。好気的に増殖する細菌の希釈抗菌薬感受性試験の方法。承認された標準 – 第 10 版。 CLSI ドキュメント M07-A10 [2015]、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA。
2. Clinical and Laboratory Standards Institute (CLSI)。抗菌ディスク拡散感受性試験の性能基準;承認された標準 – 第 12 版。 CLSI ドキュメント M02-A12 [2015]、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA。
3. Clinical and Laboratory Standards Institute (CLSI)。抗菌薬感受性試験の性能基準;第 25 情報補足、CLSI ドキュメント M100-S25 [2015]、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA。
4. コッククロフト DW、ゴート MH。血清クレアチニンからのクレアチニンクリアランスの予測。ネフロン 1976;16:31-41。
5. Schwartz GJ、Haycock GB、Edelmann CM、Spitzer A. 体長と血漿クレアチニンに基づく子供の糸球体濾過率の単純な推定。小児科 1976;58:259-63。
6. シュワルツ GJ、フェルド LG、ラングフォード DJ。生後 1 年間の正期産児の糸球体濾過率の単純な推定。 J 小児科 1984;104:849-54。
患者情報
OMNICEF 300mg を含む抗菌薬は、細菌感染症の治療にのみ使用するよう患者に説明する必要があります。ウイルス感染症(風邪など)は治療しません。オムニセフ 300mg が細菌感染症の治療のために処方された場合、患者は、治療過程の早い段階で気分が良くなるのが一般的ですが、指示どおりに薬を服用する必要があることを伝えなければなりません.投与をスキップしたり、治療の全コースを完了しなかったりすると、(1) 即時治療の有効性が低下し、(2) 細菌が耐性を獲得し、将来的にオムニセフ 300mg または他の抗菌薬で治療できなくなる可能性が高くなる可能性があります。
マグネシウムまたはアルミニウムを含む制酸剤は、セフジニルの吸収を妨げます。 OMNICEF 300mg の治療中にこのタイプの制酸剤が必要な場合は、制酸剤の少なくとも 2 時間前または後に OMNICEF を服用する必要があります。
鉄を含むマルチビタミンを含む鉄のサプリメントは、セフジニルの吸収を妨げます. OMNICEF 300mg の治療中に鉄のサプリメントが必要な場合、OMNICEF はサプリメントの少なくとも 2 時間前または後に摂取する必要があります。
鉄分を強化した乳児用調合乳は、セフジニルの吸収を著しく妨げません。したがって、経口懸濁液用オムニセフ 300mg は、鉄分を強化した乳児用調製粉乳と一緒に投与することができます。
糖尿病患者と介護者は、経口懸濁液には小さじ 1 杯あたり 2.86 g のスクロースが含まれていることに注意する必要があります。
下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると終了します。抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
