Cleocin 150mg, 300mg Clindamycin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
クレオシン 300mg 塩酸塩カプセルとは?
クレオシン塩酸塩カプセルには、感受性嫌気性細菌によって引き起こされる深刻な感染症の治療に適応される抗生物質が含まれています。クレオシン 150mg 塩酸塩は、連鎖球菌、肺炎球菌、ブドウ球菌の感受性株による深刻な感染症の治療にも適応されます。その使用は、ペニシリンアレルギー患者、または医師の判断でペニシリンが不適切である他の患者に限定されるべきです.クレオシン塩酸塩は一般的な形で入手できます。
クレオシン 300mg 塩酸塩カプセルの副作用は何ですか?
クレオシン塩酸塩の一般的な副作用は次のとおりです。
- クロストリジウム・ディフィシル大腸炎、
- 腹痛、
- 偽膜性大腸炎、
- 食道炎、
- 吐き気、
- 嘔吐、
- 下痢、
- 皮膚発疹、
- 蕁麻疹、
- 重度のアレルギー反応(アナフィラキシー)、
- 過敏反応、
- かゆみ、
- おりものや不快感、
- 肌のむくみ、
- 皮膚や目が黄色くなる(黄疸)
- 異常な肝機能検査、および
- 関節痛。
薬剤耐性菌の発生を減らし、クレオシン 300mg HCl およびその他の抗菌薬の有効性を維持するために、クレオシン 300mg HCl は、細菌が原因であることが証明されているか、強く疑われる感染症の治療または予防にのみ使用してください。
警告
クロストリジウム ディフィシル関連下痢症 (CDAD) は、CLEOCIN HCl を含むほぼすべての抗菌剤の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な菌叢を変化させ、C. difficle の異常増殖を引き起こします。
CLEOCIN 150mg HCl療法は、致命的に終わる可能性のある重度の大腸炎と関連しているため、毒性の低い抗菌剤が不適切な重篤な感染症のために予約する必要があります。 適応症と使用法 セクション。ほとんどの上気道感染症などの非細菌感染症の患者には使用しないでください。
C. difficle は、CDAD の発症に寄与するトキシン A および B を生成します。 C. difficle の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗生物質の使用後に下痢を呈するすべての患者で、CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficle に対するものではない継続的な抗生物質の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficle の抗生物質治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
説明
クリンダマイシン塩酸塩は、クリンダマイシンの水和塩酸塩です。クリンダマイシンは、親化合物リンコマイシンの 7(R)-水酸基の 7(S)-クロロ置換によって生成される半合成抗生物質です。
クレオシン HCl カプセルには、75 mg、150 mg、または 300 mg のクリンダマイシンに相当する塩酸クリンダマイシンが含まれています。
不活性成分: 75 mg - コーンスターチ、FD&C ブルー no. 1、FD&CイエローNo. 5、ゼラチン、乳糖、ステアリン酸マグネシウム、タルク。 150 mg - コーンスターチ、FD&C ブルー No. 1、FD&CイエローNo. 5、ゼラチン、乳糖、ステアリン酸マグネシウム、タルク、二酸化チタン。 300 mg - コーンスターチ、FD&C ブルー No. 1、ゼラチン、乳糖、ステアリン酸マグネシウム、タルク、二酸化チタン。
構造式は次のとおりです。
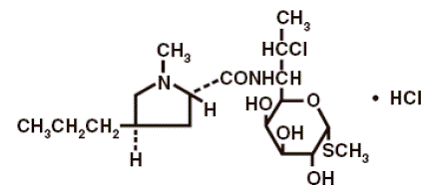
クリンダマイシン塩酸塩の化学名は、メチル 7-クロロ-6,7,8-トリデオキシ-6-(1-メチル-トランス-4-プロピル-L-2-ピロリジンカルボキサミド)-1-チオ-L-トレオ-α-です。 D-ガラクト-オクトピラノシド一塩酸塩。
適応症
クリンダマイシンは、感受性嫌気性細菌によって引き起こされる深刻な感染症の治療に適応されます。
クリンダマイシンは、連鎖球菌、肺炎球菌、ブドウ球菌の感受性株による重篤な感染症の治療にも適応されます。その使用は、ペニシリンアレルギー患者、または医師の判断でペニシリンが不適切である他の患者に限定されるべきです.囲み警告に記載されているように、大腸炎のリスクがあるため、医師はクリンダマイシンを選択する前に、感染の性質と毒性の低い代替薬 (エリスロマイシンなど) の適合性を考慮する必要があります。
嫌気性菌: 膿胸、嫌気性肺炎、肺膿瘍などの重篤な呼吸器感染症;深刻な皮膚および軟部組織の感染;敗血症;腹膜炎および腹腔内膿瘍などの腹腔内感染(通常、正常な消化管に常駐する嫌気性生物に起因する);子宮内膜炎、非淋菌性卵管卵巣膿瘍、骨盤内蜂巣炎、および術後の膣カフ感染などの女性の骨盤および生殖管の感染。
連鎖球菌: 深刻な気道感染;深刻な皮膚および軟部組織の感染症。
ブドウ球菌: 深刻な気道感染;深刻な皮膚および軟部組織の感染症。
肺炎球菌: 深刻な気道感染症。
原因微生物とそのクリンダマイシンに対する感受性を決定するために、細菌学的研究を実施する必要があります。
薬剤耐性菌の発生を減らし、クレオシン HCl および他の抗菌薬の有効性を維持するために、クレオシン HCl は、感受性のある細菌によって引き起こされることが証明されている、または強く疑われる感染症の治療または予防にのみ使用してください。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
治療中に重大な下痢が発生した場合は、この抗生物質の使用を中止する必要があります ( 囲み警告 )。
大人
重篤な感染症 6 時間ごとに 150 ~ 300 mg。より深刻な感染症 - 6 時間ごとに 300 ~ 450 mg。
小児患者(カプセルを飲み込むことができる子供向け):
重篤な感染症 8 から 16 mg/kg/日 (4 から 8 mg/ポンド/日) を 3 回または 4 回の等量に分けます。より重篤な感染症 - 16 ~ 20 mg/kg/日 (8 ~ 10 mg/ポンド/日) を 3 回または 4 回に分けて均等に服用します。
食道刺激の可能性を避けるために、CLEOCIN 300mg HCl カプセルは一杯の水で服用してください。
クレオシン HCl カプセルは、丸ごと飲み込めないお子様には適していません。カプセルは正確な mg/kg 用量を提供しないため、場合によってはパルミチン酸クリンダマイシン経口溶液を使用する必要があります。
嫌気性細菌による深刻な感染症は、通常、CLEOCIN PHOSPHATE® Sterile Solution で治療されます。ただし、臨床的に適切な状況では、医師は治療を開始するか、CLEOCIN 150mg HCl カプセルによる治療を継続するかを選択できます。
β溶血性連鎖球菌感染症の場合、治療は少なくとも10日間継続する必要があります。
供給方法
クレオシンHClカプセル 以下の強度、色、サイズをご用意しています。
75mg グリーンボトル100本 NDC 0009-0331-02
150mg ライトブルーとグリーンの100本入りボトル NDC 0009-0225-02
300mg ライトブルー 100本入 NDC 0009-0395-14
20° ~ 25° C (68° ~ 77° F) に制御された室温で保管してください [参照 USP ]。
販売元: Pharmacia & Upjohn Co, Division of Pfizer Inc, NY, NY 10017. 2017 年改訂
副作用
クリンダマイシンの使用により、以下の反応が報告されています。
感染症と蔓延: クロストリジウム・ディフィシル大腸炎
胃腸: 腹痛、偽膜性大腸炎、食道炎、吐き気、嘔吐、下痢( 囲み警告 )。偽膜性大腸炎の症状の発症は、抗菌治療中または治療後に起こることがあります( 警告 )。食道潰瘍が報告されています。経口投与後、不快または金属の味が報告されています。
過敏反応: 全身性の軽度から中等度の蕁麻疹様(斑状丘疹)の皮膚発疹が最も多く報告されている副作用です。薬物療法中には、蕁麻疹と同様に水疱性発疹が観察されています。中毒性表皮壊死症などの重度の皮膚反応が報告されており、致命的な結果をもたらすものもあります ( 警告 )。急性汎発性発疹性膿疱症(AGEP)、多形紅斑、スティーブンス・ジョンソン症候群に似たもの、アナフィラキシーショック、アナフィラキシー反応、過敏症の症例も報告されています。
皮膚および粘膜: そう痒症、膣炎、血管性浮腫、および剥脱性皮膚炎のまれな例が報告されています。 (見る 過敏反応 .)
肝臓: 黄疸および肝機能検査の異常は、クリンダマイシン療法中に観察されています。
腎臓: クリンダマイシンと腎障害との直接的な関係は確立されていませんが、高窒素血症、乏尿、および/またはタンパク尿によって証明される腎機能障害が観察されています。
造血: 一過性の好中球減少症(白血球減少症)および好酸球増加症が報告されています。無顆粒球症および血小板減少症の報告がなされています。前述のいずれにおいても、併用クリンダマイシン療法との直接的な病因関係は確認できませんでした。
免疫系: 好酸球増加症および全身症状を伴う薬物反応(DRESS)の症例が報告されています。
筋骨格: 多発性関節炎の症例が報告されています。
薬物相互作用
クリンダマイシンは、他の神経筋遮断剤の作用を増強する神経筋遮断特性を有することが示されています。したがって、そのような薬剤を投与されている患者には注意して使用する必要があります。
クリンダマイシンは主に CYP3A4 によって代謝され、CYP3A5 によって少量代謝され、主要代謝物であるクリンダマイシン スルホキシドと少量代謝物である N-デスメチルクリンダマイシンになります。したがって、CYP3A4 および CYP3A5 の阻害剤は、クリンダマイシンの血漿濃度を上昇させる可能性があり、これらのイソ酵素の誘導剤は、クリンダマイシンの血漿濃度を低下させる可能性があります。強力な CYP3A4 阻害剤が存在する場合は、副作用を監視してください。リファンピシンなどの強力な CYP3A4 誘導物質の存在下では、有効性の損失を監視します。
in vitro 研究では、クリンダマイシンは CYP1A2、CYP2C9、CYP2C19、CYP2E1 または CYP2D6 を阻害せず、CYP3A4 を中程度しか阻害しないことが示されています。
インビトロでクリンダマイシンとエリスロマイシンとの間の拮抗作用が実証されている。臨床的に重要な可能性があるため、これら 2 つの薬剤を同時に投与することはできません。
警告
見る 囲み警告
クロストリジウム・ディフィシル関連下痢症
クロストリジウム・ディフィシル関連下痢症 (CDAD) は、CLEOCIN 300mg HCl を含むほぼすべての抗菌剤の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な菌叢を変化させ、C. difficle の異常増殖を引き起こします。
C. difficle は、CDAD の発症に寄与するトキシン A および B を生成します。 C. difficle の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗生物質の使用後に下痢を呈するすべての患者で、CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficle に対するものではない継続的な抗生物質の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficle の抗生物質治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
アナフィラキシーおよび重度の過敏反応
アナフィラキシーショックとアナフィラキシー反応が報告されています( 有害反応 )。
中毒性表皮壊死融解症 (TEN)、好酸球増加症および全身症状を伴う薬物反応 (DRESS)、およびスティーブンス・ジョンソン症候群 (SJS) などの重度の皮膚反応を含む重度の過敏症反応が報告されており、致命的な結果をもたらすものもあります (以下を参照)。 有害反応 )。
このようなアナフィラキシーまたは重度の過敏症反応が発生した場合は、治療を永久に中止し、適切な治療を開始してください。
薬物やその他のアレルゲンに対する以前の過敏症に関して、慎重な調査を行う必要があります。
髄膜炎での使用
クリンダマイシンは脳脊髄液に十分に拡散しないため、髄膜炎の治療には使用しないでください。
予防
全般的
これまでの経験を振り返ると、重篤な疾患を伴う高齢患者のサブグループは、下痢にあまり耐えられない可能性があることが示唆されています。これらの患者にクリンダマイシンが適応となる場合、排便回数の変化を注意深く監視する必要があります。
CLEOCIN 300mg HCl は、胃腸疾患、特に大腸炎の既往歴のある個人には注意して処方する必要があります。
CLEOCIN 300mg HCl は、アトピーの人には注意して処方する必要があります。
指示された外科的処置は、抗生物質療法と併せて実施する必要があります。
CLEOCIN 150mg HCl を使用すると、非感受性生物、特に酵母の過剰増殖が生じることがあります。重複感染が発生した場合は、臨床状況に応じて適切な措置を講じる必要があります。
腎疾患のある患者では、クリンダマイシンの用量変更は必要ない場合があります。中等度から重度の肝疾患の患者では、クリンダマイシン半減期の延長が認められています。しかし、研究から、8時間ごとに投与された場合、蓄積はめったに起こらないはずであると仮定されました.したがって、肝疾患患者の用量変更は必要ない場合があります。ただし、重度の肝疾患の患者を治療する場合は、定期的な肝酵素測定を行う必要があります。
75 mg と 150 mg のカプセルには FD&C イエロー no. 5 (タルトラジン) は、特定の感受性のある個人にアレルギー型反応 (気管支喘息を含む) を引き起こす可能性があります。 FD&C 黄色の全体的な発生率はありません。一般集団における 5 (タートラジン) 感受性は低く、アスピリン過敏症の患者にもよく見られます。
証明された、または強く疑われる細菌感染がない場合、または予防的適応がない場合に CLEOCIN 150mg HCl を処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌が発生するリスクが高まります。
臨床検査
長期の治療中は、定期的に肝機能と腎機能の検査と血球計算を行う必要があります。
発がん、突然変異誘発、生殖能力の障害
発がん性の可能性を評価するためのクリンダマイシンによる動物での長期研究は実施されていません。実施された遺伝毒性試験には、ラット小核試験とエイムズ・サルモネラ復帰試験が含まれていました。どちらの検査も陰性でした。
最大 300 mg/kg/日 (mg/m² に基づく成人の推奨最高用量の約 1.6 倍) を経口投与されたラットの生殖能力研究では、生殖能力または交配能力に影響がないことが明らかになりました。
妊娠
催奇形性効果
妊娠中の女性を対象とした臨床試験では、妊娠第 2 期および第 3 期におけるクリンダマイシンの全身投与は、先天性異常の頻度の増加と関連していません。
クリンダマイシンは、明らかに必要な場合にのみ、妊娠初期に使用する必要があります。妊娠初期の妊婦を対象とした適切で十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるとは限らないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
最大600mg/kg/日(mg/m²に基づく成人の最高推奨用量のそれぞれ3.2倍および1.6倍)の経口用量のクリンダマイシンまたは最大250mg/kgのクリンダマイシンの皮下用量を使用して、ラットおよびマウスで実施された生殖研究/日 (mg/m² に基づく成人の最高推奨用量のそれぞれ 1.3 倍および 0.7 倍) は、催奇形性の証拠を明らかにしませんでした。
授乳中の母親
クリンダマイシンは、母乳中に 0.7 ~ 3.8 mcg/mL の範囲で出現すると報告されています。クリンダマイシンは、母乳で育てられた乳児の胃腸フローラに悪影響を与える可能性があります.授乳中の母親がクリンダマイシンの経口または静脈内投与を必要とする場合、それは母乳育児を中止する理由にはなりませんが、別の薬が好まれる場合があります。下痢、カンジダ症(ツグミ、おむつかぶれ)、またはまれに、抗生物質関連大腸炎の可能性を示す便中の血液など、消化管フローラへの悪影響について乳児を監視します。
母乳育児の発達上および健康上の利点は、クリンダマイシンに対する母親の臨床的必要性、およびクリンダマイシンまたは基礎となる母体の状態から母乳で育てられた子供への潜在的な悪影響とともに考慮されるべきです.
小児用
CLEOCIN 300mg HCl が小児集団 (出生から 16 歳まで) に投与される場合、臓器系機能の適切なモニタリングが望まれます。
高齢者の使用
クリンダマイシンの臨床研究では、65 歳以上の患者が若い患者と異なる反応を示すかどうかを判断するのに十分な数の患者が含まれていませんでした。しかし、他の報告された臨床経験は、ほとんどの抗生物質に関連して見られる抗生物質関連の大腸炎と下痢(クロストリジウム・ディフィシルによる)が高齢者(> 60歳)でより頻繁に発生し、より深刻になる可能性があることを示しています.これらの患者は、下痢の発生について注意深く監視する必要があります。
クリンダマイシンの薬物動態研究では、経口または静脈内投与後に正常な肝機能と正常な (年齢調整された) 腎機能を持つ若年者と高齢者の間で臨床的に重要な違いは示されていません。
過剰摂取
マウスでは 855 mg/kg の静脈内投与で、ラットでは約 2618 mg/kg の経口または皮下投与で有意な死亡率が観察された。マウスでは、けいれんと抑うつが観察されました。
血液透析および腹膜透析は、血清からクリンダマイシンを除去するのに効果的ではありません。
禁忌
CLEOCIN 150mg HCl は、クリンダマイシンまたはリンコマイシンを含む製剤に対して過敏症の既往歴のある個人には禁忌です。
臨床薬理学
ヒト薬理学
吸収
24 人の健常成人ボランティアに 150 mg の塩酸クリンダマイシンを経口投与した血清レベルの研究では、経口投与後にクリンダマイシンが急速に吸収されることが示されました。 45 分で 2.50 mcg/mL の平均ピーク血清レベルに達しました。血清レベルは、3 時間で平均 1.51 mcg/mL、6 時間で 0.70 mcg/mL でした。経口投与の吸収は事実上完全であり(90%)、食物の同時投与は血清濃度をそれほど変化させません。血清レベルは均一であり、個人間および用量間で予測可能でした. CLEOCIN 150mg HCl を最大 14 日間複数回投与した後の血清レベルの研究では、薬物の蓄積や代謝の変化の証拠は示されていません。 1 日 2 グラムまでのクリンダマイシンを 14 日間投与しても、健康なボランティアは十分に耐えられますが、投与量が多いほど胃腸の副作用の発生率が高くなります。
分布
血清中のクリンダマイシン濃度は、用量の増加とともに直線的に増加しました。血清レベルは、通常推奨される用量の投与後、少なくとも 6 時間は、ほとんどの対象微生物の MIC (最小発育阻止濃度) を超えます。クリンダマイシンは、体液および組織 (骨を含む) に広く分布しています。炎症を起こした髄膜が存在する場合でも、脳脊髄液中に有意なレベルのクリンダマイシンは達成されません。
代謝
ヒトの肝臓および腸のミクロソームにおける in vitro 研究では、クリンダマイシンは主にシトクロム P450 3A4 (CYP3A4) によって代謝され、CYP3A5 からの寄与はわずかであり、クリンダマイシン スルホキシドと少量の代謝産物である N-デスメチルクリンダマイシンを形成することが示されました。
排泄
平均生物学的半減期は 2.4 時間です。生物活性の約 10% が尿に排泄され、3.6% が糞便に排泄されます。残りは生物不活性代謝物として排泄されます。
特別な集団
腎障害
腎機能が著しく低下した患者では、クリンダマイシンの血清半減期がわずかに増加します。血液透析および腹膜透析は、血清からクリンダマイシンを除去するのに効果的ではありません。
高齢者での使用
高齢のボランティア (61 ~ 79 歳) および若年成人 (18 ~ 39 歳) の薬物動態研究では、年齢だけではクリンダマイシンの薬物動態 (クリアランス、消失半減期、分布量、および血清濃度-時間曲線下の面積) は変化しないことが示されています。 ) リン酸クリンダマイシンの IV 投与後。塩酸クリンダマイシンの経口投与後、排泄半減期は、若年成人の 3.2 時間 (範囲 2.1 ~ 4.2 時間) と比較して、高齢者では約 4.0 時間 (範囲 3.4 ~ 5.1 時間) に増加します。しかし、吸収の程度は年齢グループ間で差がなく、正常な肝機能と正常な (年齢調整された) 腎機能を持つ高齢者には用量の変更は必要ありません 1。
微生物学
作用機序
クリンダマイシンは、リボソームの 50S サブユニットの 23S RNA に結合することにより、細菌のタンパク質合成を阻害します。クリンダマイシンは静菌性です。
抵抗
クリンダマイシンに対する耐性は、ほとんどの場合、23S リボソーム RNA の特定の塩基の修飾によって引き起こされます。クリンダマイシンとリンコマイシン間の交差耐性は完全です。これらの抗菌薬の結合部位が重複しているため、リンコサミド、マクロライド、およびストレプトグラミン B の間で交差耐性が観察されることがあります。ブドウ球菌およびベータ溶血性レンサ球菌のマクロライド耐性分離株は、D ゾーン テストを使用して、クリンダマイシン耐性の誘導についてスクリーニングする必要があります。
抗菌活性
クリンダマイシンは、in vitro および臨床感染の両方で、以下の微生物の分離株のほとんどに対して活性であることが示されています。 適応症と使用法 セクション。
グラム陽性菌
黄色ブドウ球菌(メチシリン感受性株) 肺炎連鎖球菌(ペニシリン感受性株) 化膿連鎖球菌
嫌気性細菌
クロストリジウム・パーフリンゲンス フソバクテリウム・ネクロフォラム フソバクテリウム・ヌクレアタム ペプトストレプトコッカス・アナエロビウス プレボテラ・メラニノジェニカ
以下にリストされた微生物の少なくとも 90% は、表 1 に示されているものと同様のタイプの生物のクリンダマイシン感受性 MIC ブレークポイント以下の in vitro 最小発育阻止濃度 (MIC) を示します。これらの微生物による感染症は、十分に管理された臨床試験では確立されていません。
グラム陽性菌
表皮ブドウ球菌(メチシリン感受性株) Streptococcus agalactiae Streptococcus anginosus Streptococcus mitis Streptococcus oralis
嫌気性細菌
Actinomyces israelii Clostridium clostridioforme Eggerthella lenta Finegoldia (Peptostreptococcus) magna Micromonas (Peptostreptococcus) micros Prevotella bivia Prevotella intermedia プロピオニバクテリウム アクネス
感受性試験方法
利用可能な場合、臨床微生物検査室は、地域の病院および診療所で使用される抗菌薬の累積的な in vitro 感受性試験結果を、院内および市中感染病原体の感受性プロファイルを説明する定期報告として医師に提供する必要があります。これらのレポートは、医師が治療用の抗菌薬を選択する際に役立つはずです。
希釈法
定量的方法は、抗菌剤の最小発育阻止濃度 (MIC) を決定するために使用されます。これらの MIC は、抗菌化合物に対する細菌の感受性の推定値を提供します。 MIC は、標準化された試験方法 2,3 (培養液および/または寒天) を使用して決定する必要があります。 MIC 値は、表 1 に示す基準に従って解釈する必要があります。
拡散テクニック
ゾーンの直径の測定を必要とする定量的方法は、抗菌化合物に対する細菌の感受性の再現可能な推定値を提供することもできます。ゾーンのサイズは、標準化された方法を使用して決定する必要があります2,5。この手順では、2 mcg のクリンダマイシンを含浸させた紙ディスクを使用して、細菌のクリンダマイシンに対する感受性をテストします。ディスク拡散ブレークポイントを表 1 に示します。
無酸素法
嫌気性細菌の場合、クリンダマイシンに対する感受性は、標準化された試験方法によって決定できます2,4。得られた MIC 値は、表 1 に示す基準に従って解釈する必要があります。
Susceptible (S ) の報告は、抗菌薬が感染部位で通常達成可能な濃度に達した場合、抗菌薬が病原体の増殖を阻害する可能性が高いことを示しています。中間 (I) のレポートは、結果が曖昧であると見なされるべきであり、微生物が代替の臨床的に実行可能な薬剤に完全に感受性でない場合、試験を繰り返す必要があることを示しています。このカテゴリーは、薬物が生理学的に集中している身体部位、または高用量の薬物を使用できる状況での臨床応用の可能性を示唆しています。このカテゴリは、制御されていない小さな技術的要因が解釈に大きな矛盾を引き起こすのを防ぐ緩衝地帯も提供します。 Resistant (R) のレポートは、抗菌薬が感染部位で通常達成可能な濃度に達した場合、抗菌薬が病原体の増殖を阻害する可能性が低いことを示しています。他の治療法を選択する必要があります。
品質管理
標準化された感受性試験手順では、実験室での管理を使用して、アッセイで使用される消耗品と試薬の精度と精度、および試験を実施する個人の技術を監視および確認する必要があります.2,3,4,5 標準クリンダマイシン粉末は、表 2 の MIC 範囲。2 mcg クリンダマイシン ディスクを使用したディスク拡散法では、表 2 に示す基準を達成する必要があります。
嫌気性菌は、培養液微量希釈法または寒天希釈法のいずれかで検査できます。 NA=該当なし ATCC® は American Type Culture Collection の登録商標です
参考文献
1. Smith RB、Phillips JP: 高齢者集団における CLEOCIN HCl および CLEOCIN リン酸の評価。アップジョン TR 8147-82-9122-021、1982 年 12 月。
2.CLSI。抗菌薬感受性試験の性能基準:第 26 版。 CLSI サプリメント M100S。ペンシルバニア州ウェイン: 臨床および検査基準協会。 2016年。
3.CLSI。好気的に増殖する細菌の希釈抗菌薬感受性試験の方法;承認された標準 - 第 10 版。 CLSI ドキュメント M07-A10。ペンシルバニア州ウェイン: 臨床および検査基準協会。 2015年。
4.CLSI。嫌気性細菌の抗菌薬感受性試験の方法;承認された標準第 8 版。 CLSI ドキュメント M11-A8。ペンシルバニア州ウェイン: 臨床および検査基準協会。 2012年。
5.CLSI。抗菌性ディスク感受性試験の性能基準;承認された標準 - 第 12 版。 CLSI ドキュメント M02-A12。ペンシルバニア州ウェイン: 臨床および検査基準協会。 2015年。
患者情報
CLEOCIN HCl を含む抗菌薬は、細菌感染症の治療にのみ使用するよう患者に説明する必要があります。ウイルス感染症(風邪など)は治療しません。 CLEOCIN HCl が細菌感染症の治療に処方される場合、治療の初期に気分が良くなるのが一般的ですが、指示どおりに薬を服用する必要があることを患者に伝えてください。投与をスキップしたり、治療の全コースを完了しなかったりすると、(1) 当面の治療の有効性が低下し、(2) 細菌が耐性を獲得し、将来的にクレオシン 150mg HCl または他の抗菌薬で治療できなくなる可能性が高くなる可能性があります。
下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると終了します。抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
