Biaxin 250mg, 500mg Clarithromycin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Biaxin 500mg とは何ですか?
Biaxin は、胃潰瘍やヘリコバクター ピロリなど、さまざまな細菌感染症の症状を治療するために使用される処方薬です。 Biaxin は、単独で使用することも、他の薬と併用することもできます。
Biaxin 500mgは抗生物質です。
Biaxinが生後6か月未満の子供に安全で効果的であるかどうかは不明です.
Biaxin 250mgの副作用の可能性は何ですか?
Biaxin 500mg は、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 血を含む下痢、
- 心臓の鼓動が速くなったり、ドキドキしたり、
- 胸の中でときめき、
- 呼吸困難、
- 突然のめまい、
- 錯乱、
- 回転する感覚、
- 食欲減少、
- 上腹部の痛み、
- 疲れ、
- 暗い尿、
- 粘土色の便、
- 目や皮膚が黄色くなる(黄疸)、
- 尿がほとんどまたはまったくない、
- 足や足首のむくみ、
- 疲労感、
上記の症状がある場合は、すぐに医療機関を受診してください。
Biaxinの最も一般的な副作用は次のとおりです。
- 胃痛、
- 吐き気、
- 嘔吐、
- 下痢、
- あなたの口の中で異常または不快な味、
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Biaxin の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
クラリスロマイシンは、経口用の半合成マクロライド系抗菌薬です。化学的には、6-0-メチルエリスロマイシンです。分子式はC38H69NO13、分子量は747.96です。構造式は次のとおりです。
図 1: クラリスロマイシンの構造
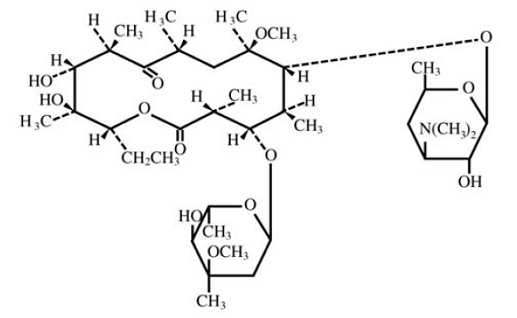
クラリスロマイシンは白色からオフホワイトの結晶性粉末です。アセトンに溶け、メタノール、エタノール、アセトニトリルに溶けにくく、水にほとんど溶けない。
BIAXIN は、速放性錠剤、徐放性錠剤、および経口懸濁液用の顆粒として入手できます。
黄色の楕円形のフィルムコーティングされた即時放出 BIAXIN Filmtab 錠剤 (クラリスロマイシン錠剤、USP) には、250 mg または 500 mg のクラリスロマイシンと次の不活性成分が含まれています。
- 250mg錠:ヒプロメロース、ヒドロキシプロピルセルロース、クロスカルメロースナトリウム、D&C黄色10号、FD&C青色1号、ステアリン酸マグネシウム、微結晶セルロース、ポビドン、α化デンプン、プロピレングリコール、二酸化ケイ素、ソルビン酸、モノオレイン酸ソルビタン、ステアリン酸、タルク、二酸化チタン、バニリン。
- 500 mg 錠剤: ヒプロメロース、ヒドロキシプロピル セルロース、コロイド状二酸化ケイ素、クロスカルメロース ナトリウム、D&C 黄色 10 号、ステアリン酸マグネシウム、微結晶性セルロース、ポビドン、プロピレン グリコール、ソルビン酸、モノオレイン酸ソルビタン、二酸化チタン、およびバニリン。
黄色の楕円形フィルムコーティング BIAXIN XL Filmtab 錠剤 (クラリスロマイシン持続放出錠剤) には、それぞれ 500 mg のクラリスロマイシンと次の不活性成分が含まれています: セルロースポリマー、D&C イエロー No. 10、ラクトース一水和物、ステアリン酸マグネシウム、プロピレングリコール、ソルビン酸、ソルビタンモノオレエート、タルク、二酸化チタン、およびバニリン。
BIAXIN 500mg再構成懸濁液(経口懸濁液用クラリスロマイシン、USP)の各5 mLには、125 mgまたは250 mgのクラリスロマイシンが含まれています。 BIAXIN 顆粒の各ボトルには、1250 mg (50 mL サイズ)、2500 mg (50 および 100 mL サイズ)、または 5000 mg (100 mL サイズ) のクラリスロマイシンと、次の不活性成分が含まれています: カルボマー、ヒマシ油、クエン酸、フタル酸ヒプロメロース、マルトデキストリン、ソルビン酸カリウム、ポビドン、二酸化ケイ素、スクロース、キサンタンガム、二酸化チタン、フルーツポンチフレーバー。
適応症
慢性気管支炎の急性細菌性増悪
BIAXIN (Filmtab、顆粒) および BIAXIN XL Filmtab は成人で、ヘモフィルス インフルエンザ、ヘモフィルス パラインフルエンザ、モラクセラ カタルリス、または肺炎連鎖球菌 [ 適応症と使用法 ]。
急性上顎洞炎
BIAXIN (Filmtab、顆粒) および BIAXIN 500mg XL Filmtab (成人用) は、インフルエンザ菌、モラクセラ・カタラーリス、または肺炎球菌による感受性分離株によって引き起こされる軽度から中等度の感染症の治療に適応されます [参照 適応症と使用法 ]。
市中肺炎
BIAXIN (Filmtab、顆粒) および BIAXIN XL Filmtab が示されています [参照 適応症と使用法 感受性分離株によって引き起こされる軽度から中等度の感染症の治療用:
- インフルエンザ菌(成人)
- ヘモフィルス・パラインフルエンザ(成人ではBIAXIN 500mg XL Filmtab)
- Moraxella catarrhalis (大人の BIAXIN 250mg XL Filmtab)
- 肺炎マイコプラズマ、肺炎球菌、肺炎クラミジア (BIAXIN 500mg XL Filmtab [成人]; BIAXIN Filmtab および BIAXIN 顆粒 [成人および小児患者])
咽頭炎/扁桃炎
BIAXIN 500mg Filmtab および BIAXIN 500mg 顆粒は、一次治療を使用できない個人の代替手段として、化膿性レンサ球菌による感受性分離株によって引き起こされる軽度から中等度の感染症の治療に適応されます。
合併症のない皮膚および皮膚構造の感染症
BIAXIN Filmtab および BIAXIN Granules は、黄色ブドウ球菌または化膿性連鎖球菌による感受性分離株によって引き起こされる軽度から中等度の感染症の治療に適応されます。
急性中耳炎
BIAXIN Filmtab および BIAXIN 250mg 顆粒は、インフルエンザ菌、モラクセラ・カタラーリス、または肺炎連鎖球菌による感受性分離株によって引き起こされる軽度から中等度の感染症の治療のために小児患者に適応されます [参照 臨床研究 ]。
播種性抗酸菌感染症の治療と予防
BIAXIN 500mg Filmtab および BIAXIN 250mg 顆粒は、進行した HIV 感染患者の Mycobacterium avium または Mycobacterium intracellulare による感受性分離株によって引き起こされる軽度から中等度の感染症の治療に適応されます [ 臨床研究 ]。
ヘリコバクター・ピロリ感染と十二指腸潰瘍
BIAXIN 250mg Filmtab は、H. pylori を根絶するために、下記のように成人に他の薬剤と組み合わせて投与されます。 H. pylori の根絶は、十二指腸潰瘍の再発のリスクを軽減することが実証されています。 臨床研究 ]。
- アモキシシリンおよび PREVACID (ランソプラゾール) または PRILOSEC (オメプラゾール) 遅延放出カプセルと組み合わせた BIAXIN Filmtab は、3 剤療法として、H. pylori 感染および十二指腸潰瘍疾患 (十二指腸の活動歴または 5 年間の病歴) を有する患者の治療に適応されます。潰瘍) ピロリ菌を根絶します。
- BIAXIN 250mg Filmtab と PRILOSEC (オメプラゾール) カプセルの併用は、H. pylori 感染に関連する活動性十二指腸潰瘍の患者の治療に適応されます。 BIAXIN 250mg Filmtab を単一の抗菌剤として含むレジメンは、治療に失敗した患者のクラリスロマイシン耐性の発生に関連する可能性が高くなります。クラリスロマイシンを含むレジメンは、クラリスロマイシン耐性分離株が既知または疑われる患者には使用しないでください。この状況では治療効果が低下するためです。
使用制限
BIAXIN 500mg XL Filmtab は、急性上顎副鼻腔炎、慢性気管支炎の急性細菌性増悪、および成人の市中肺炎にのみ適応されます。 BIAXIN Filmtab および BIAXIN Granules が承認されている他の感染症の治療における BIAXIN 500mg XL Filmtab の有効性と安全性は確立されていません。
肺炎連鎖球菌および黄色ブドウ球菌によって引き起こされる特定の細菌感染症では、マクロライドに対する耐性があります。感受性試験は、臨床的に必要な場合に実施する必要があります。
使用法
薬剤耐性菌の発生を減らし、BIAXIN および他の抗菌薬の有効性を維持するために、BIAXIN は、感受性のある細菌によって引き起こされることが証明されている、または強く疑われる感染症の治療または予防にのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
重要な管理手順
BIAXIN Filmtab および BIAXIN 250mg 顆粒は、食事の有無にかかわらず投与できます。
BIAXIN XL Filmtab は食事と一緒に服用してください。 BIAXIN 500mg XL Filmtab 全体を飲み込みます。 BIAXIN 500mg XL Filmtabを噛んだり、壊したり、つぶしたりしないでください。
大人の投与量
成人の軽度から中等度の感染症の治療における BIAXIN 250mg Filmtab および BIAXIN 250mg XL Filmtab の推奨用量を表 1 に示します。
ヘリコバクター ピロリ感染に対する併用投与レジメン
- トリプル療法:BIAXIN 500mg Filmtab/ランソプラゾール/アモキシシリン 成人の推奨用量は、BIAXIN 500mg Filmtab 500mg、ランソプラゾール 30mg、アモキシシリン 1g で、すべて 12 時間ごとに 10 日間または 14 日間投与されます [ 適応症と使用法 と 臨床研究 ]。
- トリプル療法:BIAXIN Filmtab/オメプラゾール/アモキシシリン 成人の推奨用量は、BIAXIN 250mg Filmtab 500mg、オメプラゾール 20mg、アモキシシリン 1g です。すべて10日間、12時間ごとに与えられます。治療開始時に潰瘍が存在する患者では、潰瘍の治癒と症状の緩和のために、オメプラゾール 20 mg を 1 日 1 回、さらに 18 日間投与することが推奨される [ 適応症と使用法 と 臨床研究 ]。
- デュアル療法: BIAXIN 500mg Filmtab/オメプラゾール 成人の推奨用量は、BIAXIN 250mg Filmtab 500 mg を 8 時間ごとに、オメプラゾール 40 mg を毎朝 1 回 14 日間投与することです。潰瘍の治癒と症状の緩和のために、オメプラゾール 20 mg を 1 日 1 回、さらに 14 日間投与することが推奨されます [ 適応症と使用法 と 臨床研究 ]。
小児への投与量
1日1kgあたり15mgを12時間おきに10日間(成人用量まで)服用することをお勧めします。追加の投与量情報については、小児患者におけるマイコバクテリア感染症の投与計画を参照してください。 マイコバクテリア感染症の投与計画 ]。
マイコバクテリア感染症の投与計画
Mycobacterium avium complex (MAC) による播種性感染症の治療には、BIAXIN Filmtab と BIAXIN 500mg 顆粒剤が主な薬剤として推奨されます。 BIAXIN Filmtab および BIAXIN Granules は、MAC に対する in vitro 活性または MAC 治療における臨床的利益を示した他の抗マイコバクテリア薬 (エタンブトールなど) と組み合わせて使用する必要があります [参照 臨床研究 ]。
成人患者
成人のマイコバクテリア感染症の治療と予防のために、BIAXIN の推奨用量は 12 時間ごとに 500 mg です。
小児患者
小児患者のマイコバクテリア感染症の治療と予防のための推奨用量は、12 時間ごとに 7.5 mg/kg、12 時間ごとに 500 mg です。 [見る 特定の集団での使用 と 臨床研究 ]。
臨床反応が観察された場合、BIAXIN 250mg 療法を継続する必要があります。患者が播種性感染症のリスクが低いと考えられる場合、BIAXIN は中止できます。
腎障害患者における用量調節
アタザナビルまたはリトナビルを含むレジメンの併用の有無にかかわらず、中等度または重度の腎機能障害を有する患者における用量調整については、表 2 を参照してください。 薬物相互作用 ]。
薬物相互作用による用量調節
アタザナビルと同時投与する場合、BIAXIN 500mg の投与量を 50% 減らします [参照 薬物相互作用 ]。薬物相互作用のため、BIAXIN 250mg と併用する場合、他の薬物の用量調整が推奨される場合があります [参照 薬物相互作用 ]。
BIAXIN顆粒の再構成
付属の BIAXIN 250mg 顆粒は、BIAXIN を経口懸濁液として投与する前に、水で再構成する必要があります。以下の表 3 は、元に戻すときに追加する水の量を示しています。再構成するには:
毎回使用前によく振ってください。混合後、15°~30°C (59°~86°F) で保管し、14 日以内に使用してください。冷蔵しないでください。
供給方法
剤形と強度
BIAXIN 500mg は次のように入手できます。
- BIAXIN 250mg Filmtab (黄色の楕円形のフィルムコーティング錠):
- 250 mg: 青で「a」のロゴと KT が刻印されています。
- 500 mg: 片面に「a」ロゴ、反対面に KL の型押し
- BIAXIN XL Filmtab (黄色の楕円形のフィルムコーティングされた徐放性錠剤):
- 500mg:「a」ロゴとKJの型押し
- BIAXIN 顆粒 (再構成前の白からオフホワイトの顆粒; 再構成後の白からオフホワイトの不透明な懸濁液):
- 50 mL および 100 mL ボトルで 125 mg/5 mL の濃度が利用可能
- 50 mL および 100 mL ボトルで 250 mg/5 mL の濃度が利用可能
保管と取り扱い
BIAXIN 250mg Filmtab (クラリスロマイシン錠剤、USP) 黄色の楕円形のフィルムコーティング錠として、次の包装サイズで提供されます: 250 mg 錠剤: (青色で「a」のロゴと KT が刻印)
60本のボトル( NDC 0074-3368-60) および 100 個の単位用量ストリップ パッケージ ( NDC 0074-3368-11)。
BIAXIN Filmtab 250 mg は、密閉容器に入れて 15° ~ 30°C (59° ~ 86°F) に制御された室温で保管してください。光から保護します。
500mg錠 (片面に「a」ロゴ、反対面に KL の型押し)
60 個のボトル (NDC 0074-2586-60) および 100 個の単位用量ストリップ パッケージ ( NDC 0074-2586-11)。
BIAXIN Filmtab 500 mg は、密閉容器に入れ、室温 20° ~ 25°C (68° ~ 77°F) に管理して保管してください。
BIAXIN XL Filmtab(クラリスロマイシン徐放錠) は、次の包装サイズの黄色の楕円形のフィルムコーティング錠として提供されます。
500mg錠 : (「a」ロゴと KJ の型押し)
60 のボトル (NDC 0074-3165-60)、100 の単位用量ストリップ パッケージ ( NDC 0074-3165-11)、BIAXIN XL PAC カートンには 4 つのブリスター パッケージがあり、それぞれ 14 錠 ( NDC 0074-3165-41)。
BIAXIN 500mg XL Filmtab は 20° ~ 25°C (68° ~ 77°F) で保管してください。 15° から 30°C (59° から 86°F) まで許容されるエクスカーション。 [見る USP制御の室温 .]
BIAXIN 500mg 顆粒 (経口懸濁液用のクラリスロマイシン、USP) は、次の強度とサイズの白色からオフホワイトの顆粒として提供されます。
BIAXIN 500mg 顆粒は、密閉容器に入れ、25°C (77°F) 以下で保管してください。再構成された BIAXIN 500mg 顆粒を冷蔵しないでください。
BIAXIN Filmtab 250 mg および 500 mg と BIAXIN 250mg XL Filmtab 500 mg Mfd. AbbVie LTD、Barceloneta、PR 00617による。BIAXIN顆粒、125mg/5mLおよび250mg/5mL Mfd. AbbVie Inc., North Chicago, IL 60064 による AbbVie Inc., North Chicago, IL 60064, USA 改訂: 2018 年 11 月。
副作用
次の重篤な副作用は、以下およびラベルの他の場所に記載されています。
- 急性過敏症反応 [参照 警告と注意事項 ]
- QT延長[参照 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- 他の薬剤との併用による重篤な副作用 [参照 警告と注意事項 ]
- Clostridium difficile 関連する下痢 [参照 警告と注意事項 ]
- 重症筋無力症の悪化 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
すべての適応症にわたってプールされたデータに基づくと、臨床試験で観察された成人および小児集団の両方で最も頻繁に見られる副作用は、腹痛、下痢、吐き気、嘔吐、および味覚障害です。また、消化不良、肝機能検査異常、アナフィラキシー反応、カンジダ症、頭痛、不眠症、発疹も報告されています。
以降のサブセクションでは、H. pylori 感染に関連するマイコバクテリア感染および十二指腸潰瘍の予防および治療のための最も一般的な副作用をリストします。一般に、これらのプロファイルは、上記のプールされたデータと一致しています。
マイコバクテリア感染症の予防
M. avium に対する予防のために長期間 BIAXIN で治療された AIDS 患者では、BIAXIN 投与に関連する可能性のある有害反応と、潜在的な HIV 疾患または併発疾患とを区別することはしばしば困難でした。治療期間の中央値は、BIAXIN グループで 10.6 か月、プラセボ グループで 8.2 か月でした。
検査値の変化
682人の患者を対象とした無作為化二重盲検臨床試験で、BIAXINで治療された成人患者の2%以上で治療中に報告された実験室での有害な経験を選択して、表5に示します。
M. avium に対する予防を受けている免疫不全患者では、検査値の評価は、指定された検査の重大な異常値 (すなわち、極端な上限または下限) の外側の値を分析することによって行われました。
マイコバクテリア感染症の治療
500 mg と 1000 mg の 1 日 2 回投与レジメンの副作用プロファイルは類似していました。
マイコバクテリア感染のために長期間にわたって高用量のBIAXINで治療されたAIDS患者およびその他の免疫不全患者では、BIAXIN 250mgの投与に関連する可能性のある有害反応をHIV疾患または併発疾患の潜在的な徴候と区別することはしばしば困難でした.
次の分析は、BIAXIN による治療の最初の 12 週間の経験をまとめたものです。データは、試験 1 (無作為化、二重盲検) と試験 2 (非盲検、人道的使用) について別々に報告されており、組み合わせても報告されています。有害反応は、試験 2 ではあまり報告されていませんでしたが、これは、2 つの試験間のモニタリングの違いが原因の 1 つかもしれません。
BIAXIN 500 mg を 1 日 2 回投与された成人患者において、5% 以上の発生率で、治験薬に関連する可能性がある、または関連する可能性があると考えられる、最も頻繁に報告された副作用を以下に示します (表 6)。 500 mg を 1 日 2 回投与された患者の約 8%、および 1000 mg を 1 日 2 回投与された患者の 12% が、治療の最初の 12 週間に薬物関連の副作用のために治療を中止しました。少なくとも 2 人の患者の中止につながった副作用には、吐き気、嘔吐、腹痛、下痢、発疹、および無力症が含まれていました。
限られた数の小児エイズ患者が、マイコバクテリア感染のために BIAXIN 懸濁液で治療されています。患者の併存疾患によるものを除いて、最も頻繁に報告された副作用は、成人患者で観察されたものと一致していました。
検査値の変化
BIAXIN 500 mg を 1 日 2 回服用し始めてから最初の 12 週間で、患者の 3% で SGOT が増加し、患者の 2% で SGPT が試験 2 (469 人の登録された成人患者) の正常上限の 5 倍以上増加しましたが、試験 1 では(登録患者 154 人) は、トランスアミナーゼの上昇はありませんでした。これには、ベースライン値が正常範囲内または境界線が低い患者のみが含まれます。
ピロリ菌感染に伴う十二指腸潰瘍
BIAXIN 500mg とオメプラゾールおよびアモキシシリンを組み合わせた併用療法を使用した臨床試験では、これらの薬剤の組み合わせに特有の副作用は観察されていません。発生した有害反応は、BIAXIN 250mg、オメプラゾールまたはアモキシシリンで以前に報告されたものに限定されています。
BIAXIN 500 mg を 1 日 3 回、オメプラゾール 40 mg を 1 日 14 日間投与した後、オメプラゾール 20 mg を 1 日 1 回投与した 4 つのランダム化二重盲検臨床試験の副作用プロファイルを以下に示します (表 7)。 (3 つの研究) または 40 mg を 1 日 1 回 (1 つの研究)、さらに 14 日間。併用療法を受けた 346 人の患者のうち、3.5% の患者が副作用のために投薬を中止しました。
検査値の変化
945 人の患者を対象とした 4 つの無作為化二重盲検試験で、BIAXIN とオメプラゾールを服用している患者の臨床的意義の可能性がある臨床検査値の変化は次のとおりです。
肝臓 直接ビリルビンの上昇
クラリスロマイシンの臨床試験中に観察される頻度の低い有害反応
すべての適応症にわたってプールされたデータに基づくと、クラリスロマイシンを使用した臨床試験では、以下の有害反応が 1% 未満の割合で観察されました。
血液およびリンパ系の障害: 白血球減少症、好中球減少症、血小板血症、好酸球増加症
心疾患: 心電図 QT延長、心停止、心房細動、期外収縮、動悸
耳と迷路の障害: めまい、耳鳴り、難聴
胃腸障害: 口内炎、舌炎、食道炎、胃食道逆流症、胃炎、肛門痛、腹部膨満、便秘、口渇、おくび、鼓腸
一般的な障害および投与部位の状態: 倦怠感、発熱、無力症、胸痛、悪寒、倦怠感
肝胆道疾患: 胆汁うっ滞、肝炎
免疫系障害: 過敏症
感染症と蔓延: 蜂窩織炎、胃腸炎、感染症、膣感染症
調査: 血中ビリルビン上昇、血中アルカリホスファターゼ上昇、血中乳酸脱水素酵素上昇、アルブミングロブリン比異常
代謝および栄養障害: 食欲不振、食欲減退
筋骨格および結合組織障害: 筋肉痛、筋肉のけいれん、項部硬直
神経系障害: めまい、振戦、意識消失、ジスキネジア、傾眠
精神障害: 不安、緊張
腎および尿路疾患: 血中クレアチニン上昇、血中尿素上昇
呼吸器、胸部および縦隔の障害: 喘息、鼻出血、肺塞栓症
皮膚および皮下組織の疾患: 蕁麻疹、水疱性皮膚炎、かゆみ、多汗症、発疹・黄斑丘疹
胃腸の有害反応
慢性気管支炎および急性上顎副鼻腔炎の急性増悪に関する研究では、BIAXIN 250mg Filmtab または BIAXIN 500mg XL Filmtab のいずれかを服用している患者の同程度の割合で、全体的な胃腸の有害反応が報告されました。しかし、BIAXIN 500mg XL Filmtab を服用している患者は、BIAXIN 250mg Filmtab を服用している患者と比較して、重度の胃腸症状が有意に少ないと報告しました。さらに、BIAXIN 500mg XL Filmtab を服用している患者は、BIAXIN Filmtab と比較して、薬物関連の胃腸または異常な味覚の有害反応による早期中止が有意に少なかった.
BIAXIN曝露から1〜10年後の冠動脈疾患患者の全死因死亡率
冠動脈疾患患者の転帰に対するクラリスロマイシンによる治療を評価するある臨床試験では、クラリスロマイシンに無作為に割り付けられた患者で全死因死亡のリスクの増加が観察されました。冠動脈疾患の治療のためのクラリスロマイシンは承認された適応症ではありません。患者はクラリスロマイシンまたはプラセボで 14 日間治療され、主要転帰イベント(例、全死因死亡または非致死的心臓イベント)が数年間観察されました。ハザード比 1.06 (95% 信頼区間 0.98 ~ 1.14) で観察されました。しかし、治療後 10 年間の追跡調査では、クラリスロマイシン群で 866 人 (40%) が死亡し、プラセボ群で 815 人 (37%) が死亡し、全死因死亡率のハザード比は 1.10 (95%) でした。信頼区間 1.00 から 1.21)。死亡者数の差は、治療終了後1年以上経過してから現れました。
全死因死亡率の違いの原因は確立されていません。このリスクを評価する他の疫学研究では、さまざまな結果が示されている [参照 警告と注意事項 ]。
市販後の経験
BIAXINの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系: 血小板減少症、無顆粒球症
心臓: 心室性不整脈、心室性頻脈、トルサード ド ポアント
耳と迷路: 難聴は主に年配の女性で報告されており、通常は可逆的でした。
胃腸: 急性膵炎、舌の変色、歯の変色が報告されており、通常は薬の中止時に専門家によるクリーニングで回復しました。
便中のBIAXIN 250mg XL Filmtabの報告があり、その多くは解剖学的(回腸造瘻術または結腸造設術を含む)または消化管通過時間が短縮された機能性胃腸障害の患者で発生しています.いくつかの報告では、錠剤の残留物が下痢の状況で発生しています.便に錠剤が残り、状態が改善されない患者は、別のクラリスロマイシン製剤(懸濁液など)または別の抗菌薬に切り替えることをお勧めします。
肝胆道: 肝不全、肝細胞性黄疸。肝機能障害に関連する有害反応がクラリスロマイシンで報告されている[参照 警告と注意事項 ]。
感染症と蔓延: 偽膜性大腸炎 [参照 警告と注意事項 ]
免疫系: アナフィラキシー反応、血管性浮腫
調査: プロトロンビン時間延長、白血球数減少、国際標準化比上昇。肝不全に関連した異常な尿の色が報告されています。
代謝と栄養: 低血糖症は、経口血糖降下薬またはインスリンを服用している患者で報告されています。
筋骨格および結合組織: ミオパシーの横紋筋融解症が報告されており、一部の報告では、クラリスロマイシンがスタチン、フィブラート、コルヒチンまたはアロプリノールと併用投与されていた[参照 禁忌 と 警告と注意事項 ]。
神経系: 知覚異常、無嗅覚症、失調症、感覚異常および痙攣
精神的: 異常行動、錯乱状態、離人症、失見当識、幻覚、抑うつ、躁病行動、異常夢、精神病性障害。これらの障害は通常、薬を中止すると解消します。
腎臓と尿: 間質性腎炎、腎不全
皮膚および皮下組織: スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、好酸球増加症および全身症状を伴う薬剤性発疹(DRESS)、ヘノッホ・シェーンライン紫斑病、にきび、急性汎発性発疹性膿疱症
血管: 出血
薬物相互作用
BIAXIN 250mg の同時投与は CYP3A を阻害することが知られており、主に CYP3A によって代謝される薬物は薬物濃度の上昇と関連している可能性があり、併用薬物の治療効果と副作用の両方を増加または延長させる可能性があります。
BIAXINは、CYP3A酵素基質であることが知られている他の薬物による治療を受けている患者には注意して使用する必要があります。特に、CYP3A基質の安全域が狭い場合(カルバマゼピンなど)および/または基質がこの酵素によって広範囲に代謝される場合.クラリスロマイシンを同時に投与されている患者では、必要に応じて投与量を調整し、主に CYP3A によって代謝される薬物の血清濃度を注意深く監視してください。
警告
の一部として含まれています 予防 セクション。
予防
急性過敏反応
アナフィラキシー、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、好酸球増多症および全身症状を伴う薬物発疹(DRESS)、ヘノッホ・シェーンライン紫斑病、および急性汎発性発疹性膿疱症などの重度の急性過敏症反応が発生した場合は、BIAXIN 250mg 治療を直ちに中止し、適切な治療を開始します。
QT延長
BIAXIN 500mg は、QT 間隔の延長とまれな不整脈と関連しています。 BIAXINを投与されている患者の市販後調査中に、torsades de pointesの症例が自発的に報告されています。死亡者が報告されています。
次の患者では BIAXIN を避けてください。
- QT間隔の延長が知られている患者、心室性不整脈、torsades de pointesを含む
- QT間隔を延長することが知られている薬を服用している患者[以下も参照 禁忌 ]
- 低カリウム血症や低マグネシウム血症などの進行中の催不整脈状態の患者、臨床的に重大な徐脈、およびクラス IA (例、キニジン、プロカインアミド、ジソピラミド) またはクラス III (例、ドフェチリド、アミオダロン、ソタロール) 抗不整脈薬を受けている患者。
高齢患者は、QT 間隔に対する薬物関連の影響を受けやすい可能性があります [参照 特定の集団での使用 ]。
肝毒性
肝酵素の増加を含む肝機能障害、および黄疸を伴うまたは伴わない肝細胞性および/または胆汁うっ滞性肝炎が、クラリスロマイシンで報告されています。この肝機能障害は重度の場合があり、通常は可逆的です。いくつかの例では、致命的な転帰を伴う肝不全が報告されており、一般的に深刻な基礎疾患および/または併用薬と関連しています。肝炎の症状には、食欲不振、黄疸、暗色尿、かゆみ、腹部の圧痛などがあります。肝炎の徴候や症状が現れた場合は、BIAXIN 500mg を直ちに中止してください。
他の薬との併用による重篤な副作用
CYP3A4 によって代謝される薬物
CYP3A4基質と同時にBIAXINを服用している患者では、深刻な副作用が報告されています。これらには、コルヒチンによるコルヒチン毒性が含まれます。シンバスタチン、ロバスタチン、アトルバスタチンによる横紋筋融解症;ジソピラミドによる低血糖および心不整脈(例、torsades de pointes); CYP3A4 によって代謝されるカルシウム チャネル遮断薬 (例、ベラパミル、アムロジピン、ジルチアゼム、ニフェジピン) による低血圧および急性腎障害。 CYP3A4 によって代謝されるカルシウム チャネル遮断薬による急性腎障害のほとんどの報告には、65 歳以上の高齢患者が含まれていました。シトクロム CYP3A4 酵素を誘導する薬剤と同時に投与する場合は、BIAXIN 500mg を慎重に使用してください。 BIAXIN 250mg をシンバスタチン、ロバスタチン、エルゴタミン、またはジヒドロエルゴタミンと一緒に使用することは禁忌です。 禁忌 と 薬物相互作用 ]。
コルヒチン
BIAXINとコルヒチンで治療された患者では、生命を脅かす致命的な薬物相互作用が報告されています。クラリスロマイシンは強力な CYP3A4 阻害剤であり、この相互作用は推奨用量で両方の薬剤を使用しているときに発生する可能性があります。腎機能と肝機能が正常な患者に BIAXIN とコルヒチンの同時投与が必要な場合は、コルヒチンの投与量を減らしてください。コルヒチン毒性の臨床症状について患者を監視します。 BIAXIN 500mg とコルヒチンの併用投与は、腎障害または肝障害のある患者には禁忌です [参照 禁忌 と 薬物相互作用 ]。
HMG-CoAレダクターゼ阻害剤(スタチン)
BIAXIN とロバスタチンまたはシンバスタチンの併用は禁忌です。 禁忌 これらのスタチンは CYP3A4 によって広範囲に代謝され、BIAXIN との併用治療は血漿濃度を増加させ、横紋筋融解症を含むミオパシーのリスクを増加させるためです。横紋筋融解症の症例は、これらのスタチンと併用して BIAXIN を服用している患者で報告されています。 BIAXIN による治療が避けられない場合は、治療中はロバスタチンまたはシンバスタチンによる治療を中断する必要があります。
BIAXIN 250mg をアトルバスタチンまたはプラバスタチンと一緒に処方する場合は注意してください。 BIAXIN とアトルバスタチンまたはプラバスタチンの併用が避けられない状況では、アトルバスタチンの用量は 1 日あたり 20 mg を超えてはならず、プラバスタチンの用量は 1 日あたり 40 mg を超えてはなりません。 CYP3A 代謝に依存しないスタチン(例:フルバスタチン)の使用を考慮することができます。併用が避けられない場合は、最低登録用量を処方することをお勧めします。
経口血糖降下薬・インスリン
BIAXIN 500mg と経口血糖降下薬および/またはインスリンの併用は、重大な低血糖を引き起こす可能性があります。ナテグリニド、ピオグリタゾン、レパグリニド、ロシグリタゾンなどの特定の血糖降下薬では、クラリスロマイシンによるCYP3A酵素の阻害が関与している可能性があり、併用すると低血糖を引き起こす可能性があります.グルコースの注意深いモニタリングが推奨される [ 薬物相互作用 ]。
クエチアピン
クエチアピンとクラリスロマイシンの併用には注意が必要です。併用投与により、クエチアピンへの曝露が増加し、傾眠、起立性低血圧、意識状態の変化、神経弛緩性悪性症候群、および QT 延長などのクエチアピン関連毒性が生じる可能性があります。クラリスロマイシンなどの CYP3A4 阻害剤と同時投与する場合の減量に関する推奨事項については、クエチアピンの処方情報を参照してください。 薬物相互作用 ]。
経口抗凝固薬
BIAXIN をワルファリンと併用すると、重度の出血や INR およびプロトロンビン時間の大幅な上昇のリスクがあります。患者が BIAXIN と経口抗凝固薬を同時に投与されている間は、INR とプロトロンビン時間を頻繁に監視してください [ 薬物相互作用 ]。
ベンゾジアゼピン
BIAXIN 250mgとトリアゾラムやミダゾラムなどのトリアゾロベンゾジアゼピンの併用投与により、鎮静の増加と鎮静の延長が報告されています[ 薬物相互作用 ]。
BIAXIN曝露から1〜10年後の冠動脈疾患患者の全死因死亡率
冠動脈疾患患者のアウトカムに対するクラリスロマイシン治療を評価するある臨床試験では、クラリスロマイシン投与に無作為に割り付けられた患者で、治療終了後 1 年以上経過した全死因死亡リスクの増加が観察されました。動脈疾患は承認された適応症ではありません。リスク増加の原因は特定されていません。このリスクを評価する他の疫学研究では、さまざまな結果が示されている [参照 有害反応 ]。冠動脈疾患が疑われる、または確認された患者に BIAXIN を処方する場合は、この潜在的なリスクと治療上の利点のバランスを考慮してください。
クロストリジウム・ディフィシル関連下痢症
クロストリジウム ディフィシル関連下痢症 (CDAD) は、BIAXIN を含むほぼすべての抗菌剤の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗菌薬の使用後に下痢を呈するすべての患者で CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗菌薬の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗菌治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
胚胎児毒性
クラリスロマイシンは、代替療法が適切でない臨床状況を除いて、妊娠中の女性に使用すべきではありません.妊娠中にBIAXIN 500mgを使用する場合、または患者がこの薬を服用している間に妊娠が発生した場合、患者は胎児への潜在的な危険性について知らされるべきです.クラリスロマイシンは、サル、ラット、マウス、およびウサギにおいて、ヒトの最大推奨用量で治療されたヒトで達成される血清レベルの 2 倍から 17 倍の血漿レベルを生成する用量で、妊娠転帰および/または胚・胎児の発育に悪影響を及ぼすことが実証されている [参照 特定の集団での使用 ]。
重症筋無力症の悪化
BIAXIN 250mg療法を受けている患者では、重症筋無力症の症状の悪化と筋無力症症候群の症状の新たな発症が報告されています。
薬剤耐性菌の開発
証明された、または強く疑われる細菌感染、または予防適応がない場合にBIAXINを処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌の発生のリスクが高まります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
以下の in vitro 変異原性試験がクラリスロマイシンで実施されています。
- サルモネラ/哺乳類ミクロソーム試験
- 細菌誘発変異頻度試験
- In Vitro 染色体異常試験
- ラット肝細胞 DNA 合成アッセイ
- マウスリンパ腫アッセイ
- マウス優性致死試験
- マウス小核試験
ある試験で陽性で別の試験で陰性であった in vitro 染色体異常試験を除いて、すべての試験で陰性の結果が得られました。さらに、クラリスロマイシン代謝産物に対して細菌復帰突然変異試験(エイムズ試験)が実施され、結果は陰性でした。
生殖能力の障害
生殖能力と繁殖に関する研究では、雄と雌のラットに 1 日あたり最大 160 mg/kg の用量を投与しても、発情周期、生殖能力、分娩、子孫の数と生存能力に悪影響を及ぼさないことが示されています。 150 mg/kg/日後のラットの血漿レベルは、ヒト血清レベルの 2 倍でした。
精巣萎縮は、ラットで 7 倍の用量、イヌで 3 倍の用量、サルでヒトの 1 日最大用量 (体表面積ベース) の 8 倍の用量で発生した。
特定の集団での使用
妊娠
催奇形性効果
妊娠カテゴリーC
クラリスロマイシンは、代替療法が適切でない臨床状況を除いて、妊娠中の女性に使用すべきではありません.この薬を服用中に妊娠が起こった場合、患者は胎児への潜在的な危険性について知らされるべきです[ 警告と注意事項 ]。
ラットでの 4 つの催奇形性試験 (主要な器官形成期に 160 mg/kg/日までの経口投与で 3 件、静脈内投与で 1 件) およびウサギでの 125 mg/kg/日までの経口投与での 2 件 (約 2 倍) mg/m² に基づく推奨最大ヒト用量)または妊娠 6 ~ 18 日に投与された 30 mg/kg/日の静脈内用量では、クラリスロマイシンによる催奇形性は示されませんでした。同様の用量および同様の条件での別のラット系統における 2 つの追加の経口試験では、妊娠 6 ~ 15 日に投与された 150 mg/kg/日の用量で心血管異常の発生率が低いことが示されました。
150 mg/kg/日後の血漿レベルは、ヒト血清レベルの 2 倍でした。マウスでの 4 つの研究では、妊娠 6 から 15 日の間に 1000 mg/kg/日 (mg/m² に基づくヒトの推奨最大用量のそれぞれ 2 倍および 4 倍) を経口投与した後、口蓋裂の発生率が変動することが明らかになりました。 500 mg/kg/日で見られます。 1000 mg/kg/日の曝露により、血漿レベルはヒト血清レベルの 17 倍になりました。サルでは、70 mg/kg/日の経口投与により、ヒト血清レベルの 2 倍の血漿レベルで胎児の発育遅延が生じました。
授乳中の母親
BIAXIN を授乳中の女性に投与する場合は注意が必要です。母乳育児の発達と健康上の利点は、BIAXIN に対する母親の臨床的必要性、および母乳を与えられた子供への薬物または基礎となる母体の状態からの潜在的な悪影響とともに考慮されるべきです。
クラリスロマイシンとその活性代謝物である 14-ヒドロキシ クラリスロマイシンは母乳中に排泄されます。 BIAXIN 250 mg を 1 日 2 回経口摂取している 12 人の授乳中の女性を対象に発表された 1 つの研究から、定常状態で 3 日間の治療後に血清と乳汁のサンプルが得られました。この研究の限られたデータに基づいて、母乳の消費量を 150 mL/kg/日と仮定すると、母乳だけで育てられた乳児は、この母体用量で、推定平均 136 mcg/kg/日のクラリスロマイシンとその活性代謝物を受け取ることになります。レジメン。これは、母体の体重で調整した用量 (母体の平均体重 64 kg に基づく 7.8 mg/kg/日) の 2% 未満であり、小児の用量 (15 mg/kg/日) の 1% 未満です。 6ヶ月以上の子供。
マクロライド系抗菌薬を服用している母親から母乳で育てられた 55 人の乳児 (6 人はクラリスロマイシンにさらされた) の前向き観察研究が、アモキシシリンを服用している母親から母乳で育てられた 36 人の乳児と比較された.有害反応は両群で同等でした。マクロライドにさらされた乳児の 12.7% で、発疹、下痢、食欲不振、傾眠などの有害反応が発生しました。
小児用
BIAXIN Filmtab および BIAXIN 500mg 顆粒の安全性と有効性は、生後 6 か月以上の小児患者の以下の状態または疾患の治療に対して確立されています。これらの適応症での使用は、小児患者における臨床試験、または小児患者における追加の薬物動態および安全性データを含む成人における適切かつ十分に管理された研究に基づいています。
- 咽頭炎/扁桃炎
- 市中肺炎
- 急性上顎洞炎
- 急性中耳炎 [参照 臨床研究 ]
- 合併症のない皮膚および皮膚構造の感染症
BIAXIN 500mg Filmtab および BIAXIN 500mg 顆粒の安全性と有効性は、高度な HIV 感染を伴う 20 か月以上の小児患者における播種性 Mycobacterium avium complex (MAC) 疾患の予防のために確立されています。 MAC予防のためのBIAXINの研究は小児集団で実施されておらず、予防に推奨される用量はMAC小児科治療研究から得られたものです.
小児患者の治療における BIAXIN 500mg XL Filmtab の安全性と有効性は確立されていません。
生後6か月未満の小児患者におけるBIAXIN 250mgの安全性と有効性は確立されていません。 BIAXIN 500mg の安全性は、生後 20 か月未満の MAC 患者では研究されていません。
高齢者の使用
健康な高齢者 (65 歳から 81 歳) に 500 mg の BIAXIN を 12 時間ごとに投与した定常状態の研究では、クラリスロマイシンと 14-OH クラリスロマイシンの最大血清濃度と曲線下面積は、健康な若年成人で達成されたもの。薬物動態におけるこれらの変化は、既知の加齢に伴う腎機能の低下と平行しています。臨床試験では、年配の患者は、若い患者と比較して副作用の発生率が増加していませんでした。重度の腎機能障害のある高齢患者では用量調節を考慮してください。高齢の患者は、若い患者よりもトルサード ド ポワント不整脈を発症しやすい可能性がある [参照 警告と注意事項 ]。
CYP3A4 によって代謝されるカルシウム チャネル遮断薬 (例、ベラパミル、アムロジピン、ジルチアゼム、ニフェジピン) による急性腎障害の報告のほとんどは、65 歳以上の高齢患者 [参照 警告と注意事項 ]。
特に高齢患者では、クラリスロマイシンとコルヒチンの併用によるコルヒチン毒性の報告があり、そのうちのいくつかは腎不全の患者で発生しました.一部の患者で死亡が報告されている[参照 禁忌 と 警告と注意事項 ]。
腎および肝障害
BIAXIN 500mg は主に肝臓と腎臓から排泄されます。 BIAXIN は、肝機能障害および正常な腎機能を有する患者に投与量を調整せずに投与することができます。しかし、重度の腎機能障害があり、肝機能障害を併発している、または併存していない場合は、投与量を減らすか、投与間隔を延長することが適切な場合があります。 投薬と管理 ]。
参考文献
1.Winkel P、Hilden J、Hansen JF、Kastrup J、Kolmos HJ、Kjøller E、他。安定した冠状動脈性心疾患に対するクラリスロマイシンは、CLARICOR 無作為化盲検臨床試験において、10 年間にわたって全原因および心血管死亡率と脳血管罹患率を増加させます。 Int J Cardiol 2015;182:459-65。
過剰摂取
BIAXIN の過剰摂取は、腹痛、嘔吐、吐き気、下痢などの胃腸症状を引き起こす可能性があります。
過剰摂取に伴う有害反応は、吸収されていない薬物を速やかに除去し、補助的な手段で治療します。他のマクロライドと同様に、BIAXIN 血清濃度は、血液透析または腹膜透析の影響をあまり受けないと予想されます。
禁忌
過敏症
BIAXIN は、クラリスロマイシン、エリスロマイシン、またはいずれかのマクロライド系抗菌薬に対する既知の過敏症のある患者には禁忌です [ 警告と注意事項 ]。
心不整脈
BIAXIN とシサプリドおよびピモジドの併用は禁忌です。 薬物相互作用 ]。
クラリスロマイシンがシサプリドまたはピモジドと併用投与された場合の薬物相互作用の市販後の報告があり、その結果、心不整脈 (QT 延長、心室頻脈、心室細動、トルサード ド ポワント) が発生した可能性が最も高いのは、BIAXIN によるこれらの薬物の代謝の阻害によるものです。 .死亡者が報告されています。
胆汁うっ滞性黄疸・肝機能障害
BIAXINは、クラリスロマイシンの以前の使用に関連する胆汁うっ滞性黄疸または肝機能障害の病歴のある患者には禁忌です。
コルヒチン
BIAXIN とコルヒチンの併用投与は、腎障害または肝障害のある患者には禁忌です。
HMG-CoAレダクターゼ阻害剤
横紋筋融解症を含むミオパシーのリスクが高まるため、CYP3A4 (ロバスタチンまたはシンバスタチン) によって広範囲に代謝される HMG-CoA レダクターゼ阻害剤 (スタチン) と BIAXIN を併用しないでください [ 警告と注意事項 と 薬物相互作用 ]。
麦角アルカロイド
クラリスロマイシンとエルゴタミンまたはジヒドロエルゴタミンの併用は禁忌です[ 薬物相互作用 ]。
併用薬の禁忌
BIAXIN と併用する他の薬剤の禁忌については、完全な処方情報 (禁忌セクション) を参照してください。
臨床薬理学
作用機序
クラリスロマイシンはマクロライド系抗菌薬です。 微生物学 ]。
薬物動態
吸収
BIAXIN 250mg Filmtab 即時放出錠
250 mg クラリスロマイシン錠剤の絶対バイオアベイラビリティは約 50% でした。クラリスロマイシン 500 mg を 1 回投与した場合、食物はクラリスロマイシンの吸収開始をわずかに遅らせ、ピーク時間を約 2 時間から 2.5 時間に延長します。食物もクラリスロマイシンのピーク血漿濃度を約 24% 増加させますが、クラリスロマイシンのバイオアベイラビリティの程度には影響しません。食物は、活性代謝物である 14-OH クラリスロマイシンの形成の開始またはそのピーク血漿濃度に影響を与えませんが、血漿濃度-時間曲線 (AUC) の下の面積の 11% の減少によって示される、代謝物の形成の程度をわずかに減少させます。 .したがって、BIAXIN Filmtab は食事に関係なく投与することができます。絶食していない健康なヒト被験者 (男性および女性) では、経口投与後 2 ~ 3 時間以内に最高血漿濃度に達しました。
BIAXIN 500mg XL Filmtab 徐放錠
クラリスロマイシン持続放出錠剤は、経口投与後に胃腸管からのクラリスロマイシンの長期吸収を提供します。即時放出クラリスロマイシン錠剤の等しい 1 日総投与量と比較して、クラリスロマイシン徐放性錠剤は、より低く、より遅い定常状態のピーク血漿濃度を提供しますが、クラリスロマイシンとその微生物学的に活性な代謝物である 14-OH クラリスロマイシンの両方の 24 時間 AUC は同等です。 BIAXIN 500mg XL Filmtab (2 x 500 mg 錠剤を 1 日 1 回) の投与後の 14-OH クラリスロマイシンの形成の程度は食物の影響を受けませんが、絶食条件下での投与は、食物との投与と比較して約 30% 低いクラリスロマイシン AUC と関連しています。 .したがって、BIAXIN 250mg XL Filmtab は食事と一緒に摂取する必要があります。
図 2: 定常状態のクラリスロマイシン血漿濃度-時間プロファイル 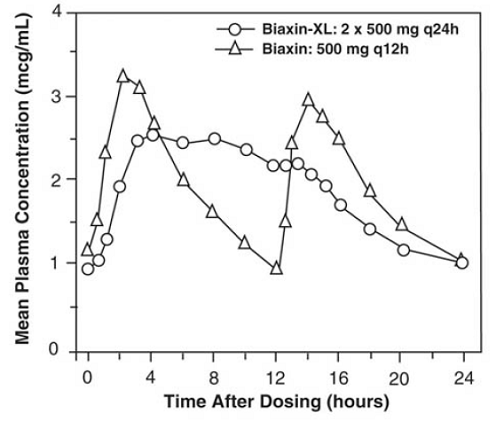
経口懸濁液用BIAXIN顆粒
BIAXIN として 250 mg の用量のクラリスロマイシンを経口懸濁液として空腹時の健康な成人被験者に投与した場合、投与後約 3 時間でピーク血漿濃度に達しました。
成人患者の場合、125 mg/5 mL 懸濁液 10 mL または 250 mg/5 mL 懸濁液 10 mL のバイオアベイラビリティは、それぞれ 250 mg または 500 mg 錠剤と同様です。
懸濁液として 250 mg のクラリスロマイシンを投与された成人 (n = 22) では、食事により平均ピーク血漿クラリスロマイシン濃度が 1.2 (± 0.4) mcg/mL から 1.0 (± 0.4) mcg/mL に減少し、吸収範囲が 7.2 (± 2.5) hr•mcg/mL から 6.5 (± 3.7) hr•mcg/mL。
分布
クラリスロマイシンおよび 14-OH クラリスロマイシン代謝産物は、体組織および体液に容易に分布します。脳脊髄液の浸透に関する利用可能なデータはありません。細胞内濃度が高いため、組織濃度は血清濃度よりも高くなります。組織および血清濃度の例を以下に示します。
代謝と排泄
BIAXIN 500mg Filmtab 即時放出錠
定常状態のピーク血漿クラリスロマイシン濃度は 3 日以内に達成され、12 時間ごとに投与される 250 mg の用量で約 1 mcg/mL から 2 mcg/mL であり、500 mg の用量が 12 時間ごとに投与されると 3 mcg/mL から 4 mcg/mL でした。 8時間から12時間。クラリスロマイシンの消失半減期は、250 mg を 12 時間ごとに投与すると約 3 時間から 4 時間でしたが、500 mg を 8 時間から 12 時間ごとに投与すると 5 時間から 7 時間に増加しました。クラリスロマイシンの薬物動態の非線形性は、8 時間から 12 時間ごとに投与される 250 mg および 500 mg の推奨用量ではわずかです。 12 時間ごとに 250 mg を投与すると、主要な代謝産物である 14-OH クラリスロマイシンは、約 0.6 mcg/mL のピーク定常状態濃度に達し、5 時間から 6 時間の消失半減期を持ちます。 8 時間から 12 時間ごとに 500 mg を投与すると、14-OH クラリスロマイシンのピーク定常状態濃度はわずかに高くなり (最大 1 mcg/mL)、その消失半減期は約 7 時間から 9 時間です。これらの投薬レジメンのいずれでも、この代謝産物の定常状態の濃度は、一般に 3 日から 4 日以内に達成されます。
250 mg の錠剤を 12 時間ごとに服用すると、投与量の約 20% がクラリスロマイシンとして尿中に排泄されますが、500 mg の錠剤を 12 時間ごとに服用すると、クラリスロマイシンの尿中排泄はやや多くなり、約 30% になります。対照的に、懸濁液 250 mg (125 mg/5 mL) を 12 時間ごとに経口投与すると、約 40% がクラリスロマイシンとして尿中に排泄されます。しかしながら、クラリスロマイシンの腎クリアランスは、用量サイズとは比較的無関係であり、正常な糸球体濾過速度に近似している.尿中に見出される主要な代謝物は 14-OH クラリスロマイシンであり、250 mg または 500 mg の錠剤を 12 時間ごとに投与すると、用量の 10% から 15% を占めます。
BIAXIN 250mg XL Filmtab 徐放錠
健康なヒト被験者では、1000 mg BIAXIN 250 mg XL Filmtab を 1 日 1 回経口投与してから約 5 時間から 8 時間後に、約 2 mcg/mL から 3 mcg/mL の定常状態のピーク血漿クラリスロマイシン濃度が達成されました。 14-OH クラリスロマイシンでは、約 0.8 mcg/mL の定常状態ピーク血漿濃度が、投与後約 6 時間から 9 時間で達成されました。 BIAXIN XL Filmtab 500 mg を 1 日 1 回経口投与してから約 5 時間から 6 時間後に、約 1 mcg/mL から 2 mcg/mL の定常状態のピーク血漿クラリスロマイシン濃度が達成されました。 14-OH クラリスロマイシンの場合、投与後約 6 時間で約 0.6 mcg/mL の定常状態のピーク血漿濃度が達成されました。
定常状態のピーク血漿濃度は 2 日から 3 日で達成され、250 mg 用量のクラリスロマイシン懸濁液を 12 時間ごとに投与した場合、クラリスロマイシンの場合は約 2 mcg/mL、14-OH クラリスロマイシンの場合は 0.7 mcg/mL でした。クラリスロマイシンの消失半減期 (3 時間から 4 時間) と 14-OH クラリスロマイシンの消失半減期 (5 時間から 7 時間) は、等量の BIAXIN Filmtab を投与した後の定常状態で観察されたものと同様でした。
BIAXIN Filmtab、BIAXIN 500mg XL Filmtab、および BIAXIN 250mg 顆粒製剤の特定の集団
小児患者の経口懸濁液のための BIAXIN 顆粒
クラリスロマイシンは、滲出性中耳炎の小児患者の中耳液に浸透します。
小児患者 (n = 10) に 7.5 mg/kg の BIAXIN 500 mg を経口懸濁液として単回経口投与した場合、食物により血漿クラリスロマイシンの平均ピーク濃度が 3.6 (± 1.5) mcg/mL から 4.6 (± 2.8) mcg/mL に増加しました。 mL および 10.0 (± 5.5) 時間・mcg/mL から 14.2 (± 9.4) 時間・mcg/mL までの吸収の程度。
抗菌療法を必要とする小児患者では、経口懸濁液として BIAXIN を 12 時間ごとに 7.5 mg/kg 投与すると、通常、クラリスロマイシンで 3 mcg/mL から 7 mcg/mL、1 mcg/mL から 2 mcg/mL の定常状態のピーク血漿濃度が得られました。 14-OH クラリスロマイシンの mcg/mL。
12 時間ごとに 15 mg/kg の BIAXIN を経口懸濁液として服用している HIV 感染した小児患者では、定常状態のクラリスロマイシンのピーク濃度は一般に 6 mcg/mL から 15 mcg/mL の範囲でした。
HIV感染症
HIV 感染の成人患者に 12 時間ごとに 500 mg のクラリスロマイシンを投与した後に観察されたクラリスロマイシンおよび 14-OH クラリスロマイシンの定常状態濃度は、健康なボランティアで観察されたものと同様でした。 12 時間ごとに 500 mg または 1000 mg のクラリスロマイシンを服用している成人の HIV 感染患者では、定常状態のクラリスロマイシンの Cmax 値は、それぞれ 2 mcg/mL から 4 mcg/mL および 5 mcg/mL から 10 mcg/mL の範囲でした。 .
肝障害
肝機能障害のある被験者のクラリスロマイシンの定常状態濃度は、正常な被験者の濃度と変わらなかった。ただし、14-OH クラリスロマイシン濃度は、肝障害のある被験者の方が低かった。 14-OH クラリスロマイシンの形成の減少は、健康な被験者と比較した場合、肝機能障害のある被験者におけるクラリスロマイシンの腎クリアランスの増加によって、少なくとも部分的に相殺されました。
腎障害
クラリスロマイシンの薬物動態は、腎機能障害のある被験者でも変化した[参照 特定の集団での使用 と 投薬と管理 ]。
薬物相互作用
フルコナゾール
21 人の健康なボランティアにフルコナゾール 200 mg を毎日、クラリスロマイシン 500 mg を 1 日 2 回投与した後、定常状態のクラリスロマイシンの Cmin と AUC はそれぞれ 33% と 18% 増加しました。クラリスロマイシン曝露は増加し、14-OH クラリスロマイシンの定常状態濃度は、フルコナゾールの同時投与によって有意な影響を受けませんでした。
コルヒチン
コルヒチン 0.6 mg の単回投与とクラリスロマイシン 250 mg BID を 7 日間投与した場合、コルヒチン単独の投与と比較して、コルヒチンの Cmax は 197% 増加し、AUC0-∞ は 239% 増加しました。
アタザナビル
クラリスロマイシン (500 mg 1 日 2 回) とアタザナビル (400 mg 1 日 1 回) の投与後、クラリスロマイシン AUC は 94% 増加し、14-OH クラリスロマイシン AUC は 70% 減少し、アタザナビル AUC は 28% 増加しました。
リトナビル
クラリスロマイシンとリトナビルの同時投与 (n = 22) により、クラリスロマイシンの AUC が 77% 増加し、14-OH クラリスロマイシンの AUC が 100% 減少しました。
サキナビル
クラリスロマイシン(500 mg 1 日 2 回)およびサキナビル(ソフト ゼラチン カプセル、1 日 1200 mg)を 12 人の健康なボランティアに投与した後、定常状態のサキナビル AUC および Cmax は、サキナビル単独の投与と比較して、それぞれ 177% および 187% 増加しました。クラリスロマイシンの AUC と Cmax はそれぞれ 45% と 39% 増加しましたが、14-OH クラリスロマイシンの AUC と Cmax は、クラリスロマイシン単独の投与と比較してそれぞれ 24% と 34% 減少しました。
ジダノシン
クラリスロマイシン錠剤とジダノシンを 12 人の HIV 感染成人患者に同時に投与しても、ジダノシンの薬物動態に統計的に有意な変化はありませんでした。
ジドブジン
クラリスロマイシン 500 mg 錠剤を 1 日 2 回、ジドブジン 100 mg を 4 時間ごとに投与した後、定常状態のジドブジン AUC は、ジドブジン単独の投与と比較して 12% 減少しました (n=4)。個々の値は、34% の減少から 14% の増加までの範囲でした。クラリスロマイシン錠剤がジドブジンの 2 ~ 4 時間前に投与された場合、定常状態のジドブジン Cmax は 100% 増加しましたが、AUC は影響を受けませんでした (n=24)。
オメプラゾール
クラリスロマイシン 500 mg を 8 時間ごとに、毎日 40 mg のオメプラゾールと組み合わせて、健康な成人被験者に投与しました。クラリスロマイシンの同時投与により、オメプラゾールの定常状態の血漿濃度が増加した (Cmax、AUC0-24、および t1/2 がそれぞれ 30%、89%、および 34% 増加)。
クラリスロマイシンと 14-OH クラリスロマイシンの血漿レベルは、オメプラゾールの同時投与によって増加しました。クラリスロマイシンについては、クラリスロマイシンをオメプラゾールと一緒に投与した場合、クラリスロマイシンを単独で投与した場合よりも、平均 Cmax が 10% 大きく、平均 Cmin が 27% 大きく、平均 AUC0-8 が 15% 大きかった。 14-OH クラリスロマイシンについても同様の結果が見られ、平均 Cmax は 45%、平均 Cmin は 57%、平均 AUC0-8 は 45% 大きかった。胃組織および粘液中のクラリスロマイシン濃度もまた、オメプラゾールの同時投与によって増加した。
クラリスロマイシン 投与 2 時間後の組織濃度 (mcg/mL)/(mcg/g)
テオフィリン
テオフィリンがクラリスロマイシンとともに投与された 2 つの研究 (テオフィリン徐放性製剤は、250 または 500 mg の 12 時間毎のクラリスロマイシンとともに 6.5 mg/kg または 12 mg/kg で投与された) では、Cmax、Cmin の定常状態レベルは、テオフィリンの血清濃度時間曲線下面積 (AUC) は約 20% 増加しました。
ミダゾラム
ミダゾラムの単回投与をクラリスロマイシン錠剤 (500 mg を 1 日 2 回、7 日間) と同時投与した場合、ミダゾラムの AUC は、ミダゾラムの静脈内投与後に 174%、経口投与後に 600% 増加しました。
BIAXIN と併用する他の薬剤については、完全な処方情報を参照してください。 臨床薬理学 セクション。
微生物学
作用機序
クラリスロマイシンは、感受性細菌の50Sリボソームサブユニットに結合することにより抗菌作用を発揮し、タンパク質合成を阻害します。
抵抗
耐性の主な経路は、50S リボソーム サブユニットの 23S rRNA の非感受性または薬物排出ポンプへの修飾です。 β-ラクタマーゼ産生は、クラリスロマイシン活性に影響を与えるべきではありません。
メチシリン耐性およびオキサシリン耐性ブドウ球菌のほとんどの分離株は、クラリスロマイシンに耐性です。
クラリスロマイシンを含む併用レジメンによる治療後にピロリ菌が根絶されない場合、患者はピロリ菌分離株にクラリスロマイシン耐性を発症する可能性があります。したがって、治療に失敗した患者には、可能であればクラリスロマイシン感受性検査を行うべきです。クラリスロマイシン耐性 H. pylori の患者は、次のいずれの治療も受けるべきではありません。オメプラゾール/クラリスロマイシン/アモキシシリンのトリプル療法;ランソプラゾール/クラリスロマイシン/アモキシシリンのトリプル療法;または唯一の抗菌剤としてクラリスロマイシンを含む他のレジメン。
抗菌活性
クラリスロマイシンは、in vitro および臨床感染症の両方で、以下の微生物のほとんどの分離株に対して活性があることが示されています [参照 適応症と使用法 ]。
グラム陽性菌
- 黄色ブドウ球菌
- 肺炎連鎖球菌
- 化膿連鎖球菌
グラム陰性菌
- インフルエンザ菌
- ヘモフィルス・パラインフルエンザ
- モラクセラ・カタラーリス
その他の微生物
- クラミドフィラ・ニューモニエ
- ヘリコバクター・ピロリ
- M. avium と M. intracellulare からなる Mycobacterium avium complex (MAC)
- マイコプラズマ肺炎
以下にリストされた微生物の少なくとも 90% は、表 11 に示されている微生物と同様のタイプの微生物のクラリスロマイシン感受性 MIC ブレークポイント以下の in vitro 最小発育阻止濃度 (MIC) を示します。これらの微生物のために、十分に管理された臨床試験では確立されていません。
グラム陽性菌
- 連鎖球菌アガラクティエ
- 連鎖球菌 (グループ C、F、G)
- ビリダンス群連鎖球菌
グラム陰性菌
- レジオネラ・ニューモフィラ
- パスツレラ・マルトシダ
嫌気性細菌
- ウェルシュ菌
- ペプトコッカス・ニジェール
- Prevotella melaninogenica
- プロピオン酸アクネス
感受性試験
感受性試験の解釈基準、関連する試験方法、FDA が承認したこの薬剤の品質管理基準に関する具体的な情報については、http://www.fda.gov/STIC を参照してください。
動物毒物学および/または薬理学
角膜混濁は、イヌでは 12 倍の用量で、サルではヒトの 1 日最大用量 (体表面積ベース) の 8 倍の用量で発生しました。リンパ系の枯渇は、イヌでは 3 倍以上の用量で、サルでは最大ヒト 1 日用量の 2 倍以上の用量で発生しました (体表面積ベース)。
臨床研究
マイコバクテリア感染症
マイコバクテリア感染症の予防
無作為化二重盲検臨床試験 (試験 3) では、CDC 定義の AIDS および CD4 数が 100 細胞/μL 未満の患者を対象に、クラリスロマイシン 500 mg を 1 日 2 回投与する場合とプラセボを比較する場合があります。この試験では、1992 年 11 月から 1994 年 1 月までに 682 人の患者が登録され、登録時の CD4 細胞数の中央値は 30 細胞/mcL でした。 BIAXIN 500mg の期間の中央値は、プラセボの 8.2 か月に対して 10.6 か月でした。 BIAXIN 群よりもプラセボ群の患者の方が、早期に試験を中止した患者が多かった (それぞれ 75.6% と 67.4%)。しかし、鳥型結核菌複合体(MAC)または死亡による早期中止を除外すると、各群の患者のほぼ同率(BIAXIN群で54.8%、プラセボ群で52.5%)が他の理由で治験薬を早期に中止しました。この試験は、次のエンドポイントを評価するように設計されました。
MAC 菌血症
BIAXIN に無作為に割り付けられた患者では、MAC 菌血症のリスクがプラセボと比較して 69% 減少しました。グループ間の差は統計的に有意でした (p
サバイバル
プラセボと比較して BIAXIN の統計的に有意な生存利益が観察されました (図 3 および表 13 を参照)。 18 か月での分析には、もはや予防を受けていない患者が含まれているため、BIAXIN 250mg の生存利益は過小評価されている可能性があります。
図 3: 試験 3 における無作為化されたすべての AIDS 患者の経時的な生存率 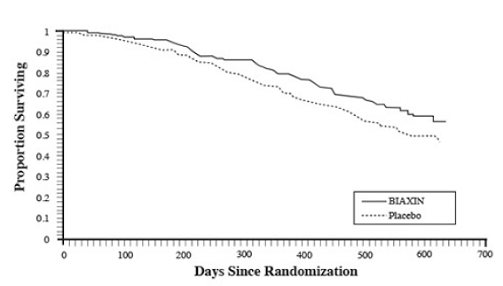
臨床的に重要な播種性 MAC 疾患
MAC 菌血症の発生率の低下に関連して、BIAXIN にランダム化されたグループの患者は、発熱、寝汗、体重減少、貧血などの播種性 MAC 疾患の徴候と症状の減少を示しました。
マイコバクテリア感染症の治療
MACの成人AIDS患者における用量範囲単剤療法試験
つの無作為化臨床試験 (試験 1 および 2) では、CDC 定義の AIDS および CD4 数が 100 細胞/mcL 未満の患者を対象に、異なる用量の BIAXIN を比較しました。これらの試験では、1991 年 5 月から 1992 年 3 月まで患者が登録されました。試験 500 は無作為化二重盲検試験でした。試験 577 は非盲検の人道的使用試験でした。どちらの試験でも、BIAXIN の 500 mg と 1000 mg を 1 日 2 回投与しました。試験 1 には、1 日 2 回 2000 mg の BIAXIN 500 mg 群もありました。試験 1 には 154 人の成人患者が登録され、試験 2 には 469 人の成人患者が登録されました。大多数の患者は、研究登録時に CD4 細胞数が 50 細胞/mcL 未満でした。試験は、次のエンドポイントを評価するように設計されました。
試行 1 の結果を以下に示します。試行 2 の結果は、試行 1 の結果と同様でした。
MAC 菌血症
すべての BIAXIN 500mg 投与群の大部分の患者で、MAC 菌血症または陰性血液培養の減少が見られました。 1000 mg (n=32) 1 日 2 回および 2000 mg (n=26) 1 日 2 回のレジメンでの 4 週間の治療後のベースラインからの MAC コロニー形成単位 (CFU) の平均減少は、1.5 Log CFU と比較して 2.3 Log CFU でした。 BIAXIN 500 mg を 1 日 2 回 (n=35) レジメン。 4 剤レジメン 2 (シプロフロキサシン、エタンブトール、リファンピシン、およびクロファジミン) を用いた別の試験では、平均 1.4 Log CFU の減少がありました。
クラリスロマイシン単剤療法の異なる投与レジメンで評価された臨床転帰を表 14 に示します。それ以上は大きな差は見られませんでした。分離株のすべては、前処理で 8 mcg/mL 未満の MIC を持っていました。再発は、ほとんどの場合、MIC の増加を伴いました。
臨床的に重要な播種性 MAC 疾患
治療前に寝汗を経験している患者のうち、84% が 12 週間の BIAXIN 500 mg から 2000 mg を 1 日 2 回投与した時点で解消または改善を示しました。同様に、患者の 77% が、ある時点で熱の解消または改善を報告しました。 MACの臨床徴候に対する応答率を以下の表15に示す。
臨床徴候および症状の改善または解消として定義される反応期間の中央値は、2週間から6週間でした。
この試験は、12 週間を超えて単剤療法の利点を判断するように設計されていないため、12 週間後も臨床反応を示し続けた 25% から 33% の患者の反応期間は過小評価されている可能性があります。
サバイバル
試験参加からの生存期間の中央値 (試験 1) は、1000 mg の 1 日 2 回投与では 215 日であったのに対し、500 mg の 1 日 2 回投与では 249 日でした。しかし、治療の最初の 12 週間で、500 mg を 1 日 2 回投与したグループでは 53 人の患者で 2 人が死亡したのに対し、1000 mg を 1 日 2 回投与したグループでは 51 人の患者で 13 人が死亡しました。この明らかな死亡率の違いの理由はわかっていません。 2 つのグループの生存率は、12 週間を超えても同様でした。これらの投与量の生存期間の中央値は、併用療法で治療した場合の MAC の最近の歴史的対照と同様でした.2
試験 2 に参加してからの生存期間の中央値は、500 mg を 1 日 2 回投与した場合で 199 日、1000 mg を 1 日 2 回投与した場合で 179 日でした。治療の最初の 4 週間、患者は最初に割り当てられた用量で維持されていましたが、500 mg を 1 日 2 回服用している 255 人の患者で 11 人の死亡があり、1000 mg を 1 日 2 回服用している 214 人の患者で 18 人の死亡がありました。
MACの小児エイズ患者における用量範囲単剤療法試験
試験 4 は、CDC 定義の AIDS および CD4 数が 100 細胞/mcL 未満の患者を対象に、3.75 mg/kg、7.5 mg/kg、および 15 mg/kg の BIAXIN を 1 日 2 回投与する小児試験でした。この試験には、1 歳から 20 歳までの 25 人の患者が登録されました。この試験では、成人の試験 1 および 2 と同じエンドポイントが評価されました。成人試験では 1 日 2 回のレジメン。
播種性MACのエイズ患者における併用療法
試験 5 では、播種性 MAC (dMAC) 感染症の治療において、エタンブトールと組み合わせた BIAXIN 250mg と、エタンブトールおよびクロファジミンと組み合わせた BIAXIN 250mg の安全性と有効性を比較しました。この 24 週間の試験には、AIDS および dMAC の 106 人の患者が登録され、55 人の患者が BIAXIN 500mg とエタンブトールの投与を受けるように無作為に割り付けられ、51 人の患者がクラリスロマイシン、エタンブトール、およびクロファジムの投与を受けるように無作為に割り付けられました。 BIAXIN 500mg、エタンブトール、およびクロファザイム群で CFU 数の中央値が少なくとも 1 log 高いことを除いて、治療群間のベースライン特性は類似していました。
クラリスロマイシン単剤療法の以前の経験と比較して、クラリスロマイシンとエタンブトールの 2 剤レジメンは、主にクラリスロマイシン耐性株の出現を抑制することにより、微生物学的再発までの時間を延長しました。しかし、レジメンにクロファジミンを追加しても、追加の微生物学的または臨床的利点は追加されませんでした。両方の多剤レジメンの忍容性は、最も一般的な有害事象である胃腸に匹敵するものでした。クロファジミンを含むレジメンを受けた患者は、生存率が低下しました。ただし、ベースラインのマイコバクテリアのコロニー数はより高かった。この試験の結果は、最初の dMAC 感染症の治療のためにクラリスロマイシンにエタンブトールを追加することを支持していますが、3 番目の薬剤としてクロファジミンを追加することは支持していません。
中耳炎
BIAXIN対経口セファロスポリンの中耳炎試験
米国で実施された急性中耳炎の小児患者を対象とした対照臨床試験では、β-ラクタマーゼ産生生物が有意な割合で発見され、BIAXIN 500mg が経口セファロスポリンと比較されました。この試験では、厳密な評価可能性基準を使用して臨床反応を判定しました。臨床効果が評価された 223 人の患者について、治療後の来院時の臨床的成功率 (すなわち、治癒と改善) は、BIAXIN 500mg で 88%、セファロスポリンで 91% でした。
少数の患者では、治療前の来院時に微生物学的測定が行われました。推定される除菌/臨床治癒結果 (すなわち、臨床的成功) を表 16 に示します。
BIAXIN vs. 抗菌剤/β-ラクタマーゼ阻害剤の中耳炎試験
米国で実施された急性中耳炎の他の2つの対照臨床試験では、かなりの割合でベータ-ラクタマーゼを産生する微生物が発見され、BIAXINは特定のベータ-ラクタマーゼ阻害剤を含む経口抗菌剤と比較されました.これらの試験では、臨床反応を決定するために厳密な評価可能性基準が使用されました。臨床効果について評価された 233 人の患者では、治療後の来院時の複合臨床成功率 (すなわち、治癒と改善) は、BIAXIN 500mg と対照群の両方で 91% でした。
治療前の来院時に微生物学的測定を行った患者について、推定される細菌根絶/臨床治癒結果(すなわち、臨床的成功)を表17に示します。
ピロリ菌の除菌で十二指腸潰瘍の再発リスクを低減
BIAXIN + ランソプラゾールとアモキシシリン
ピロリ菌と十二指腸潰瘍疾患 (活動性潰瘍または 1 年以内の活動性潰瘍の病歴と定義) を有する患者を対象とした米国の 2 つのランダム化二重盲検臨床試験 (試験 6 および試験 7) では、BIAXIN 500 mg の有効性が 2 回評価されました。ランソプラゾール 30 mg を 1 日 2 回、アモキシシリン 1 gm を 1 日 2 回と組み合わせて、ピロリ菌の根絶のための 14 日間の 3 剤療法として毎日。
H. pylori の除菌は、治療終了後 4 週間から 6 週間での 2 回の陰性検査 (培養および組織学) として定義されました。
BIAXIN とランソプラゾールおよびアモキシシリンの 3 剤併用療法は、H. pylori の根絶に効果的でした (表 18 の結果を参照)。 H. pylori の除菌は、十二指腸潰瘍の再発リスクを低下させることが示されています。
ピロリ菌と十二指腸潰瘍疾患 (1 年以内の活動性潰瘍または潰瘍の病歴として定義) の患者を対象に米国で実施された無作為化二重盲検臨床試験 (試験 8) では、BIAXIN 250mg とランソプラゾールとアモキシシリンを 10 日間と 14 日間の 3 剤療法として。この試験は、ピロリ菌の根絶において、10日間の三重療法が14日間の三重療法と同等であることを立証した(表18の結果を参照)。
BIAXIN + オメプラゾールおよびアモキシシリン療法
ピロリ菌感染症および十二指腸潰瘍疾患(n = 558)の患者を対象とした 3 つの米国のランダム化二重盲検臨床試験では、BIAXIN + オメプラゾールおよびアモキシシリンを BIAXIN 250mg + アモキシシリンと比較しました。 2 つの試験 (試験 9 および 10) は、活動性の十二指腸潰瘍を有する患者で実施され、3 つ目の試験 (試験 11) は、過去 5 年間に十二指腸潰瘍を有する患者で実施されたが、登録時に潰瘍は存在しなかった.試験での投与計画は、BIAXIN 500 mg を 1 日 2 回、オメプラゾール 20 mg を 1 日 2 回、アモキシシリン 1 グラムを 1 日 2 回、10 日間投与するものでした。試験 9 および 10 では、オメプラゾール レジメンを服用した患者は、1 日 1 回、オメプラゾール 20 mg をさらに 18 日間投与されました。調査されたエンドポイントは、ピロリ菌の根絶と十二指腸潰瘍の治癒でした (試験 9 と 10 のみ)。ヘリコバクター ピロリの状態は、3 つの試験すべてで CLOtest®、組織学、および培養によって決定されました。特定の患者について、これらの検査のうち少なくとも 2 つが陰性で、陽性が 1 つもなかった場合、H. pylori は根絶されたと見なされます。 BIAXIN とオメプラゾールおよびアモキシシリンの組み合わせは、ピロリ菌の根絶に効果的でした (表 19 の結果を参照)。
BIAXIN + オメプラゾール療法
つのランダム化二重盲検多施設試験 (試験 12、13、14、および 15) では、BIAXIN 500 mg を 1 日 3 回、さらにオメプラゾール 40 mg を 1 日 1 回 14 日間投与した後、オメプラゾール 20 mg を 1 日 1 回投与した (試験 12、13、および 15)、またはオメプラゾール 40 mg を 1 日 1 回 (試験 14)、さらに 14 日間、H. pylori に関連する活動性十二指腸潰瘍の患者に投与した。試験 12 と 13 は米国とカナダで実施され、それぞれ 242 名と 256 名の患者が登録されました。ヘリコバクター ピロリ感染と十二指腸潰瘍は、試験 12 で 219 人の患者、試験 13 で 228 人の患者で確認されました。これらの試験では、併用レジメンをオメプラゾールおよび BIAXIN 単剤療法と比較しました。試験 14 と 15 はヨーロッパで実施され、それぞれ 154 名と 215 名の患者が登録されました。 H. pylori 感染と十二指腸潰瘍は、試験 14 では 148 人の患者、試験 15 では 208 人の患者で確認されました。これらの試験では、併用療法とオメプラゾール単剤療法を比較しました。これらの試験の有効性分析の結果を表 20、21、および 22 に示します。
十二指腸潰瘍の治癒
BIAXIN 250mg とオメプラゾールの組み合わせは、十二指腸潰瘍の治癒に対してオメプラゾール単独と同程度に効果的でした (表 20 を参照)。
十二指腸潰瘍に関連するピロリ菌の除菌
BIAXIN 500mg とオメプラゾールの組み合わせは、ピロリ菌の根絶に有効でした (表 21 を参照)。 H. pylori の根絶は、治療終了後 4 週間で陽性検査 (培養または組織学) がないことと定義され、根絶されたと見なされるには 2 つの陰性検査が必要でした。プロトコルごとの分析では、次の患者は除外されました:脱落者、主要なプロトコル違反のある患者、治療後のピロリ菌検査が欠落している患者、および治療終了後4週間でピロリ菌の除菌について評価されなかった患者。治療終了時に潰瘍が治癒していないことが判明したため、治療を中止しました。
十二指腸潰瘍の再発
治療後に潰瘍が治癒した患者について、治療終了後6ヶ月および12ヶ月での潰瘍再発を評価した(表22の結果を参照)。このように、H. pylori 感染に伴う十二指腸潰瘍の患者では、H. pylori の除菌により潰瘍の再発が減少しました。
参考文献
2.Kemper CA 他AIDS における Mycobacterium avium Complex 菌血症の 4 剤経口レジメンによる治療。アンインターン医。 1992;116:466-472。
患者情報
BIAXIN 250mgに関する次の指示または情報を患者に提供します。
- BIAXIN(クラリスロマイシン)を含む抗菌薬は、細菌感染症の治療にのみ使用するよう患者に助言してください。ウイルス感染症(風邪など)は治療しません。 BIAXIN 250mg が細菌感染症の治療に処方される場合、患者は治療の初期に気分が良くなることはよくあることですが、指示どおりに薬を服用する必要があることを患者に伝えてください。投与をスキップしたり、治療の完全なコースを完了しないと、(1) 即時治療の有効性が低下し、(2) 細菌が耐性を獲得し、将来 BIAXIN 250mg または他の抗菌薬で治療できなくなる可能性が高くなります。
- 下痢は BIAXIN (クラリスロマイシン) などの抗菌薬によって引き起こされる一般的な問題であり、通常は抗菌薬を中止すると終了することを患者にアドバイスします。抗菌薬による治療を開始した後、患者は、抗菌薬の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合は、患者にできるだけ早く医療提供者に連絡するように指示してください。
- BIAXIN(クラリスロマイシン)が一部の薬物と相互作用する可能性があることを患者に助言します。したがって、他の薬の使用については医療提供者に報告するよう患者に助言してください。
- BIAXIN (クラリスロマイシン) Filmtab と経口懸濁液は、食事の有無にかかわらず服用でき、牛乳と一緒に服用できることを患者にアドバイスします。ただし、BIAXIN 250mg XL Filmtab (クラリスロマイシン徐放錠) は食事と一緒に服用する必要があります。懸濁液を冷蔵しないでください。
- BIAXIN(クラリスロマイシン)が運転や機械の使用に及ぼす影響に関するデータはありません。ただし、薬によって起こる可能性のあるめまい、めまい、混乱、見当識障害の可能性について患者に相談してください。患者が機械を運転または使用する前に、これらの副作用の可能性を考慮に入れる必要があります。
- この薬を服用中に妊娠した場合、胎児に危険が及ぶ可能性があることを患者に伝えてください。 警告と注意事項 と 特定の集団での使用 ]。
- BIAXIN 500mgは、BIAXIN治療終了後数年で死亡リスクの増加と関連している可能性があるため、冠動脈疾患の患者には、冠動脈疾患の投薬とライフスタイルの変更を継続するようアドバイスしてください.
