Minocin 50mg, 100mg Minocycline Hydrochloride 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ミノシン経口懸濁液とは何ですか?
ミノシン (ミノサイクリン塩酸塩) は、尿路感染症、呼吸器感染症、皮膚感染症、重度の座瘡、淋病、ダニ熱、クラミジアなど、さまざまな細菌感染症の治療に使用されるテトラサイクリン系抗生物質です。
ミノシン経口懸濁液の副作用は何ですか?
ミノシンの一般的な副作用は次のとおりです。
- めまい、
- 疲労感、
- 回転する感覚、
- 関節痛や筋肉痛、
- 皮膚や爪、歯茎の変色、
- 吐き気、
- 下痢、
- 胃のむかつき、
- 皮膚の発疹やかゆみ、
- 舌の腫れ、または
- 膣のかゆみまたは分泌物。
ミノシン 50mg の重大な副作用がある場合は、医師に相談してください。
- 胃痙攣、
- 水様または血様の下痢、
- インフルエンザの症状、
- 口やのどの痛み、
- 弱点、
- 濃い色の尿、
- 不正出血、
- 皮膚の下の紫または赤のピンポイントスポット、
- 熱、
- 皮膚発疹、
- あざ、
- 重度のうずきやしびれ、
- 筋力低下、
- 食欲減少、
- 皮膚や目の黄変、
- 胸痛、
- 不規則な心拍リズム、
- 咳、
- 喘鳴、
- 呼吸困難、
- 錯乱、
- 嘔吐、
- 腫れ、
- 体重の増加、
- 排尿がいつもより少ない、またはまったくない、
- 頭痛や目の奥の痛み、
- あなたの耳に鳴り響く、
- 視力の問題、
- 発熱を伴う関節の痛みや腫れ、
- 腫れた腺、
- 筋肉痛、
- 一般的な不快感、
- 異常な思考や行動、
- 発作(けいれん)、または
- 重度の皮膚反応。
薬剤耐性菌の発生を減らし、MINOCIN® 経口懸濁液およびその他の抗菌薬の有効性を維持するために、MINOCIN 経口懸濁液は、細菌によることが証明されているか、強く疑われる感染症の治療または予防にのみ使用してください。
説明
MINOCIN 100mg ミノサイクリン塩酸塩は、テトラサイクリン、4,7ビス(ジメチルアミノ)-1,4,4a,5,5a,6,11,12a-オクタヒドロ-3,10,12,12a-テトラヒドロキシ-1,11の半合成誘導体です。 -ジオキソ-2ナフタセンカルボキサミド一塩酸塩。
その構造式は次のとおりです。
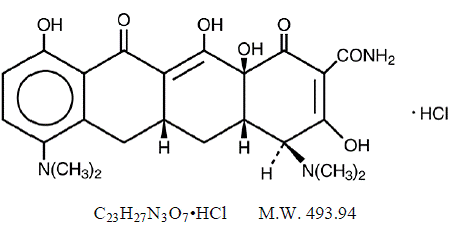 C23H27N3O7•HCl MW 493.94
C23H27N3O7•HCl MW 493.94 ミノシン 50mg 経口懸濁液には、5 mL あたり 50 mg のミノサイクリンに相当するミノサイクリン塩酸塩 (10 mg/mL) と次の不活性成分が含まれています: アルコール、ブチルパラベン、水酸化カルシウム、セルロース、テトラオレイン酸デカグリセリル、エデト酸カルシウム二ナトリウム、グアーガム、ポリソルベート 80 、プロピルパラベン、プロピレングリコール、サッカリンナトリウム、亜硫酸ナトリウム( 警告 )およびソルビトール。
適応症
MINOCIN 100mg経口懸濁液は、指定された微生物の感受性株による次の感染症の治療に適応されます。
ロッキー山紅斑熱、チフス熱およびチフス群、Q熱、リケッチア痘およびリケッチアによるダニ熱。
マイコプラズマ・ニューモニエによる気道感染症。
クラミジア・トラコマチスが原因のリンパ肉芽腫。
Chlamydophila psittaciによるオウム病(鳥類症)。
クラミジア・トラコマチスが原因のトラコーマ。ただし、免疫蛍光法で判断すると、感染性病原体が常に排除されるわけではありません。
クラミジア・トラコマチスによる封入体結膜炎。
Ureaplasma urealyticum または Chlamydia trachomatis によって引き起こされる成人の非淋菌性尿道炎、子宮頸管内感染症、または直腸感染症。
再発性ボレリアによる回帰熱。
Haemophilus ducreyi による下疳。
ペスト菌によるペスト。
Francisella tularensisによる野兎病。
コレラ菌が原因のコレラ。
カンピロバクター胎児によるカンピロバクター胎児感染症。
ブルセラ種によるブルセラ症(ストレプトマイシンと併用)。
バルトネラ菌によるバルトネラ症。
クレブシエラ・グラニュロマチスによる鼠径肉芽腫。
ミノサイクリンは、細菌学的検査で薬剤に対する適切な感受性が示された場合に、以下のグラム陰性微生物によって引き起こされる感染症の治療に適応されます。
大腸菌。
エンテロバクター・エアロゲネス。
赤痢菌種。
アシネトバクター種。
インフルエンザ菌による気道感染症。
Klebsiella 種によって引き起こされる気道および尿路の感染症。
MINOCIN経口懸濁液は、細菌学的検査により薬剤に対する適切な感受性が示された場合に、以下のグラム陽性微生物によって引き起こされる感染症の治療に適応されます:
肺炎連鎖球菌による上気道感染症。黄色ブドウ球菌によって引き起こされる皮膚および皮膚構造の感染症(注:ミノサイクリンは、どのタイプのブドウ球菌感染症の治療においても選択される薬ではありません).
ペニシリンが禁忌である場合、ミノサイクリンは次の感染症の治療における代替薬です。
Neisseria gonorrhoeae による男性の合併症のない尿道炎およびその他の淋菌感染症の治療。
淋菌による女性の感染症。
Treponema pallidum 亜種 pallidum によって引き起こされる梅毒。
Treponema pallidum の亜種によって引き起こされるヨーは永続します。
リステリア・モノサイトゲネスによるリステリア症。
炭疽菌による炭疽菌。
Fusobacterium fusiforme による Vincent の感染症。
Actinomyces israelii による放線菌症。
クロストリジウム種による感染症。
急性腸アメーバ症では、ミノサイクリンはアメーバ駆除剤の有用な補助剤となる可能性があります。
重度のにきびでは、ミノサイクリンが有用な補助療法となる場合があります。
経口ミノサイクリンは、鼻咽頭から髄膜炎菌を除去するために、髄膜炎菌の無症候性キャリアの治療に適応されます。無症候性髄膜炎菌保菌者の治療におけるミノサイクリンの有用性を維持するために、血清型検査や感受性試験を含む診断検査手順を実施して、保因者の状態と正しい治療法を確立する必要があります。ミノサイクリンの予防的使用は、髄膜炎菌性髄膜炎のリスクが高い状況に限定することをお勧めします。
経口ミノサイクリンは、髄膜炎菌感染症の治療には適応されません。
制御された臨床効果研究は実施されていませんが、限られた臨床データは、経口ミノサイクリン塩酸塩が、マイコバクテリウム・マリヌムによる感染症の治療に使用されていることを示しています。
薬剤耐性菌の発生を減らし、MINOCIN 100mg経口懸濁液および他の抗菌薬の有効性を維持するために、MINOCIN経口懸濁液は、感受性細菌によって引き起こされることが証明されているか、強く疑われる感染症を治療または予防するためにのみ使用する必要があります.培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
ミノサイクリンの通常の投与量と投与頻度は、他のテトラサイクリンとは異なります。推奨用量を超えると、副作用の発生率が増加する可能性があります。
治療は、症状と発熱が治まってから少なくとも 24 ~ 48 時間継続する必要があります。
これまでの研究によると、ミノシン経口懸濁液の吸収は、食品や乳製品の影響を特に受けないことが示されています。
腎機能障害 (CLCR 警告 )。
レンサ球菌感染症の治療では、治療用量のテトラサイクリンを少なくとも 10 日間投与する必要があります。
8歳以上の小児患者向け
ミノシンの小児への通常の投与量は、最初は 4mg/kg で、その後 12 時間ごとに 2mg/kg で、通常の成人の投与量を超えないようにします。
大人
MINOCIN の通常の投与量は、最初は 200 mg で、その後 12 時間ごとに 100 mg が続きます。
梅毒の治療では、ミノシンの通常の投与量を10~15日間かけて投与する必要があります。臨床検査を含む綿密なフォローアップが推奨されます。
ペニシリンに敏感な淋病患者は、MINOCIN 50mg で治療することができます。最初は 200mg として投与し、その後 12 時間ごとに 100mg を最低 4 日間投与し、治療後は 2 ~ 3 日以内に培養します。
髄膜炎菌キャリア状態の治療では、推奨用量は 100 mg を 12 時間ごとに 5 日間です。
Mycobacterium marinum 感染症: 最適な用量は確立されていませんが、100 mg を 12 時間ごとに 6 ~ 8 週間服用すると、限られた数の症例で成功裏に使用されています。
Chlamydia trachomatis または Ureaplasma urealyticum によって引き起こされる成人の合併症のない尿道、子宮頸部、または直腸の感染症: 少なくとも 7 日間、12 時間ごとに 100 mg を経口投与します。
男性の合併症のない淋菌性尿道炎の治療では、100 mg を 1 日 2 回、5 日間経口投与することをお勧めします。
供給方法
ミノシン(ミノサイクリン塩酸塩)内服液 小さじ1杯(5mL)あたりミノサイクリン50mg相当の塩酸ミノサイクリンを含有しています。プロピルパラベン 0.10% およびブチルパラベン 0.06%、USP 5% v/v のアルコールで保存。カスタード風味。
NDC 16781-473-60 - ボトル 2 fl。オズ。 (60mL)
20°~25°C (68°~77°F) に制御された室温で保管してください。
凍結しないでください。
製造元: Onset Dermatologics, LLC Cumberland, RI 02864. 改訂: 2018 年 11 月
副作用
経口ミノサイクリンは実質的に完全に吸収されるため、下部腸への副作用、特に下痢はまれです。テトラサイクリンを服用している患者では、次の副作用が観察されています。
ボディ全体: 発熱、分泌物の変色。
胃腸: 食欲不振、吐き気、嘔吐、下痢、消化不良、口内炎、舌炎、嚥下障害、エナメル質形成不全、腸炎、偽膜性大腸炎、膵炎、口腔および肛門性器領域の炎症性病変(モニリア過増殖を伴う)。
泌尿生殖器: 外陰膣炎。
肝毒性: 高ビリルビン血症、肝胆汁うっ滞、肝酵素の増加、致命的な肝不全、黄疸。自己免疫性肝炎を含む肝炎、および肝不全が報告されています( 予防 )。

肌: 脱毛症、結節性紅斑、爪の色素沈着過剰、かゆみ、中毒性表皮壊死融解症、血管炎、斑状丘疹発疹および紅斑性発疹。剥脱性皮膚炎が報告されています。亀頭炎を含む固定薬疹が報告されています。多形紅斑とスティーブンス・ジョンソン症候群が報告されています。感光性については上記で説明されています ( 警告 )。皮膚や粘膜の色素沈着が報告されています。
呼吸器: 咳、呼吸困難、気管支痙攣、喘息の増悪、肺炎。
腎毒性: 間質性腎炎。 BUN の上昇が報告されており、明らかに用量に関連している( 警告 )。可逆性急性腎不全が報告されています。
筋骨格: 関節痛、関節炎、骨の変色、筋肉痛、関節のこわばり、関節の腫れ。
過敏反応: 蕁麻疹、血管神経性浮腫、多発性関節痛、アナフィラキシー/アナフィラキシー様反応 (ショックや致死を含む)、アナフィラキシー様紫斑病、心筋炎、心膜炎、全身性エリテマトーデスの増悪、好酸球増多を伴う肺浸潤が報告されています。一過性狼瘡様症候群および血清病様反応も報告されています。
血: 無顆粒球症、溶血性貧血、血小板減少症、白血球減少症、好中球減少症、汎血球減少症、および好酸球増加症が報告されています。
中枢神経系: 痙攣、めまい、感覚鈍麻、感覚異常、鎮静、めまい。成人における偽大脳腫瘍(良性頭蓋内圧亢進症)および乳児における大泉門の隆起(参照 予防 - 全般的 )。頭痛も報告されています。
他の: 甲状腺がんは、ミノサイクリン製品に関連して、市販後の設定で報告されています。ミノサイクリン療法を長期間にわたって行う場合は、甲状腺がんの徴候のモニタリングを考慮する必要があります。長期間にわたって投与された場合、テトラサイクリンは、甲状腺の黒褐色の顕微鏡的変色を引き起こすことが報告されています.甲状腺機能異常の症例が報告されています。
8歳未満の子供の歯の変色( 警告 )また、成人でも報告されています。
口腔の変色(舌、唇、歯肉を含む)が報告されています。
ミノシン(ミノサイクリン塩酸塩)を服用している患者では、耳鳴りと聴力低下が報告されています。
以下の症候群が報告されています。これらの症候群が関与するいくつかのケースでは、死亡が報告されています。他の深刻な副作用と同様に、これらの症候群のいずれかが認められた場合は、直ちに薬を中止する必要があります。
皮膚反応(発疹や剥脱性皮膚炎など)、好酸球増加症、および肝炎、肺炎、腎炎、心筋炎、および心膜炎の 1 つまたは複数からなる過敏症症候群。発熱およびリンパ節腫脹がみられる場合があります。
陽性の抗核抗体からなる狼瘡様症候群;関節痛、関節炎、関節のこわばり、または関節の腫れ;発熱、筋肉痛、肝炎、発疹、血管炎の 1 つまたは複数。
発熱からなる血清病様症候群;蕁麻疹または発疹;関節痛、関節炎、関節のこわばり、または関節の腫れとリンパ節腫脹。好酸球増加症の可能性があります。
疑わしい有害反応を報告するには、Valeant Pharmaceuticals North America LLC (1-800-321-4576) または FDA (1-800-FDA-1088) または www.fda.gov/medwatch に連絡してください。
薬物相互作用
テトラサイクリンは血漿プロトロンビン活性を低下させることが示されているため、抗凝固療法を受けている患者は、抗凝固剤の投与量を下方調整する必要がある場合があります。
静菌薬はペニシリンの殺菌作用を妨げる可能性があるため、ペニシリンと組み合わせてテトラサイクリン系の薬を投与することは避けることをお勧めします。
テトラサイクリンの吸収は、アルミニウム、カルシウム、またはマグネシウムを含む制酸剤、および鉄を含む製剤によって損なわれます。
テトラサイクリンとメトキシフルランの同時使用は、致命的な腎毒性をもたらすと報告されています。
テトラサイクリンと経口避妊薬を同時に使用すると、経口避妊薬の効果が低下する可能性があります。
イソトレチノインの投与は、ミノサイクリン療法の直前、最中、直後は避けるべきです。各薬剤単独では、偽大脳腫瘍と関連しています( 予防 )。
麦角アルカロイドまたはその誘導体をテトラサイクリンと一緒に投与すると、麦角症のリスクが高まります。
警告
歯の発達
MINOCIN 経口懸濁液は、他のテトラサイクリン系抗生物質と同様に、妊婦に投与すると胎児に害を及ぼす可能性があります。妊娠中にテトラサイクリンを使用する場合、または患者がこれらの薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきです。歯の発育期(妊娠後期、乳児期、小児期から8歳まで)にテトラサイクリン系の薬剤を使用すると、永久的な歯の変色(黄~灰褐色)が生じることがあります。
この有害反応は、薬物の長期使用中により一般的ですが、短期間の経過を繰り返した後に観察されています.エナメル質形成不全も報告されています。したがって、テトラサイクリン系薬剤は、他の薬剤が効果的である可能性が低いか禁忌でない限り、歯の発達中に使用すべきではありません.
骨格の発達
すべてのテトラサイクリンは、骨形成組織で安定したカルシウム複合体を形成します。 6 時間ごとに 25 mg/kg の用量で経口テトラサイクリンを与えられた未熟児で、腓骨の成長速度の低下が観察されています。この反応は、薬を中止すると元に戻ることが示されました。
妊娠中の使用
動物研究の結果は、テトラサイクリンが胎盤を通過し、胎児組織に見られ、発達中の胎児に毒性作用を及ぼす可能性があることを示しています(多くの場合、骨格発達の遅延に関連しています).胚毒性の証拠は、妊娠初期に処置された動物で認められています。ミノシンの妊娠中の安全性は確立されていません。
皮膚反応
ミノサイクリンの使用により、致死例を含む好酸球増多および全身症状を伴う薬疹(DRESS)が報告されています。この症候群が認められた場合は、直ちに薬を中止する必要があります。
アナボリック作用
テトラサイクリンの抗アナボリック作用により、BUN が増加する可能性があります。これは腎機能が正常な人には問題ありませんが、腎機能が著しく低下している患者では、テトラサイクリンの血清レベルが高いと、高窒素血症、高リン血症、およびアシドーシスにつながる可能性があります。このような条件下では、クレアチニンと BUN のモニタリングが推奨され、1 日総投与量が 24 時間で 200 mg を超えてはなりません ( 投薬と管理 )。腎障害が存在する場合、通常の経口または非経口投与でも、薬物の全身蓄積および肝毒性の可能性につながる可能性があります。
感光性
テトラサイクリンを服用している一部の個人では、誇張された日焼け反応によって現れる光過敏症が観察されています.これはミノサイクリンで報告されています。
中枢神経系への影響
ミノサイクリン療法では、ふらつき、めまい、めまいなどの中枢神経系の副作用が報告されています。これらの症状を経験した患者は、ミノサイクリン治療中に車両を運転したり、危険な機械を使用したりすることについて注意する必要があります.これらの症状は治療中に消失する場合があり、通常は薬を中止すると急速に消失します。
クロストリジウム・ディフィシル関連下痢症
クロストリジウム・ディフィシル関連下痢症 (CDAD) は、MINOCIN 50mg を含むほぼすべての抗菌薬の使用で報告されており、重症度は軽度の下痢から致命的な大腸炎までさまざまです。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗生物質の使用後に下痢を呈するすべての患者で、CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗生物質の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗生物質治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
亜硫酸ナトリウムに対する過敏症
MINOCIN Oral Suspension には亜硫酸ナトリウムが含まれています。亜硫酸ナトリウムは、特定の感受性のある人にアナフィラキシー症状や生命を脅かす、または軽度の喘息エピソードなどのアレルギー反応を引き起こす可能性があります。一般集団における亜硫酸過敏症の全体的な有病率は不明であり、おそらく低い.亜硫酸過敏症は、喘息でない人よりも喘息患者に多く見られます。
頭蓋内圧亢進症
頭蓋内圧亢進症 (IH、偽脳腫瘍) は、MINOCIN を含むテトラサイクリンの使用に関連付けられています。 IH の臨床症状には、頭痛、かすみ目、複視、視力低下などがあります。乳頭浮腫は、眼底検査で見つけることができます。過体重または IH の病歴がある出産適齢期の女性は、テトラサイクリン関連 IH を発症するリスクが高くなります。イソトレチノインは偽脳腫瘍を引き起こすことも知られているため、イソトレチノインとミノシンの併用は避けるべきです。
IH は通常、治療の中止後に解消しますが、永久的な視力喪失の可能性が存在します。治療中に視覚症状が発生した場合は、迅速な眼科的評価が必要です。頭蓋内圧は断薬後数週間上昇したままになる可能性があるため、患者は安定するまで監視する必要があります。
予防
全般的
他の抗生物質製剤と同様に、この薬の使用は、真菌を含む非感受性生物の異常増殖を引き起こす可能性があります.重複感染が発生した場合は、抗生物質の使用を中止し、適切な治療を開始する必要があります。
肝毒性はミノサイクリンで報告されています。したがって、ミノサイクリンは、肝機能障害のある患者には注意して使用し、他の肝毒性薬と併用する必要があります。
必要に応じて、切開排膿またはその他の外科的処置を抗生物質療法と併用して実施する必要があります。
細菌感染症が証明されている、または強く疑われる場合、または予防的適応がない場合にMINOCIN経口懸濁液を処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌が発生するリスクが高まります。
臨床検査
造血、腎臓、肝臓を含む臓器系の定期的な検査評価を実施する必要があります。
淋病のすべての患者は、診断時に梅毒の血清学的検査を受ける必要があります。ミノサイクリンで治療された患者は、3 か月後に梅毒のフォローアップ血清学的検査を受ける必要があります。
薬物/実験室試験の相互作用
尿中カテコールアミン レベルの誤った上昇は、蛍光検査との干渉により発生する可能性があります。
発がん、突然変異誘発、生殖能力の障害
ラットの長期腫瘍原性研究におけるミノサイクリンの食事投与は、甲状腺腫瘍産生の証拠をもたらしました。ミノサイクリンは、ラットとイヌで甲状腺過形成を引き起こすこともわかっています。さらに、関連する抗生物質であるオキシテトラサイクリン (すなわち、副腎および下垂体の腫瘍) を用いた研究で、ラットにおける発癌活性の証拠がありました。同様に、ミノサイクリンの変異原性試験は実施されていませんが、関連する抗生物質(テトラサイクリン塩酸塩およびオキシテトラサイクリン)について、in vitro 哺乳動物細胞アッセイ(マウスリンパ腫およびチャイニーズハムスター肺細胞)で陽性結果が報告されています。セグメント I (生殖能力および一般的な生殖) の研究は、ミノサイクリンが雄ラットの生殖能力を損なうという証拠を提供しています。
妊娠
リスクの概要
すべての妊娠には、薬物への曝露に関係なく、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。妊娠中の女性におけるミノサイクリンの使用に関する十分に管理された研究はありません。ミノサイクリンは、他のテトラサイクリン系の抗生物質と同様に、胎盤を通過し、妊婦に投与すると胎児に害を及ぼす可能性があります.四肢の縮小を含む先天異常のまれな自発的報告が、市販後の経験で報告されています。これらのレポートに関しては、限られた情報しか入手できません。したがって、因果関係に関する結論は確立できません。妊娠中にミノサイクリンを使用する場合、またはこの薬を服用中に患者が妊娠した場合は、胎児への潜在的な危険性について患者に通知する必要があります。
非催奇形性効果: (参照 警告 )。
労働と配達
陣痛および分娩に対するテトラサイクリンの影響は不明です。
授乳中の母親
テトラサイクリンは母乳中に排泄されます。テトラサイクリン系薬剤は授乳中の乳児に重篤な副作用を引き起こす可能性があるため、母親にとっての薬剤の重要性を考慮して、授乳を中止するか薬剤を中止するかを決定する必要があります( 警告 )。
小児用
ミノサイクリンは、治療の期待される利益がリスクを上回らない限り、8 歳未満の子供に使用することは推奨されません ( 警告 )。
高齢者の使用
経口ミノサイクリンの臨床研究では、65 歳以上の対象者が若い対象者と異なる反応を示すかどうかを判断するのに十分な数の対象者が含まれていませんでした。一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝機能、腎機能、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。 警告 、 投薬と管理 )。
ミノシン 50mg 経口懸濁液には、5 mL あたり 4.3 mg (0.18 mEq) のナトリウムが含まれています。
過剰摂取
過剰摂取でより一般的に見られる有害事象は、めまい、吐き気、嘔吐です。
ミノサイクリンに対する特異的な解毒剤は知られていません。
過剰摂取の場合は、投薬を中止し、対症療法を行い、支持療法を開始してください。ミノサイクリンは、血液透析または腹膜透析によって大量に除去されることはありません。
禁忌
この薬は、テトラサイクリンまたは製品製剤の成分のいずれかに過敏症を示した人には禁忌です。
臨床薬理学
100 mg ミノサイクリン HCl 粉末充填カプセル 2 個を 10 人の正常な成人ボランティアに単回投与した後、血清レベルは 1 時間で 0.74 ~ 4.45 mcg/mL の範囲でした (平均 2.24)。 12 時間後、それらは 0.34 から 2.36 mcg/mL (平均 1.25) の範囲でした。 12 人の本質的に正常なボランティアに 200 mg を 1 回投与した後の血清半減期は、11 時間から 17 時間の範囲でした。肝機能障害の 7 人の患者では 11 時間から 16 時間の範囲であり、腎機能障害の患者 5 人では 18 時間から 69 時間の範囲でした。ミノサイクリンを 12 人の正常なボランティアに投与したときの尿中および糞便中の回復は、他のテトラサイクリンの 2 分の 1 から 3 分の 1 でした。
微生物学
作用機序
テトラサイクリンは主に静菌性であり、タンパク質合成の阻害によって抗菌効果を発揮すると考えられています。ミノサイクリンを含むテトラサイクリンは、広範囲のグラム陽性菌およびグラム陰性菌に対して同様の抗菌スペクトルを持っています。これらの生物のテトラサイクリンに対する交差耐性は一般的です。
抗菌活性
ミノサイクリンは、以下の微生物のほとんどの菌株に対して、in vitro および臨床感染の両方で活性があることが示されています。 適応症 セクション:
グラム陽性菌
炭疽菌 リステリア菌 黄色ブドウ球菌 肺炎球菌
グラム陰性菌
Bartonella bacilliformis Brucella 種 Klebsiella Granulomatis Campylobacter fetus Francisella tularensis Haemophilus ducreyi Vibrio cholerae エルシニア ペスティス Acinetobacter 種 Enterobacter aerogenes Escherichia coli インフルエンザ菌 Klebsiella 種 Neisseria gonorrhoeae Neisseria meningitidis Shigella 種
その他の微生物
Actinomyces 種 Borrelia recurrentis Chlamydophila psittaci Chlamydia trachomatis Clostridium 種 Entamoeba 種 Fusobacterium nucleatum 亜種 fusiforme Mycobacterium marinum Mycoplasma pneumoniae プロピオニバクテリウム アクネス Rickettsiae Treponema pallidum 亜種 pallidum Treponema pallidum 亜種 pertenue Ureaplasma urealyticum
感受性試験
感受性試験の解釈基準、関連する試験方法、およびこの薬剤について FDA が承認した品質管理基準に関する具体的な情報については、以下を参照してください。 https://www.fda.gov/STIC.
動物薬理学および毒物学
ミノサイクリン HCl は、実験動物 (ラット、ミニブタ、イヌ、およびサル) で甲状腺の暗い変色を引き起こすことが観察されています。ラットでは、ミノサイクリン塩酸塩による慢性治療により、放射性ヨウ素の取り込みの上昇と甲状腺腫瘍の形成の証拠を伴う甲状腺腫が生じました。ミノサイクリン塩酸塩は、ラットとイヌで甲状腺過形成を引き起こすこともわかっています。
患者情報
下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると終了します。抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
テトラサイクリンを服用している一部の個人では、誇張された日焼け反応によって現れる光過敏症が観察されています.直射日光や紫外線にさらされる傾向のある患者は、テトラサイクリン系薬剤でこの反応が起こる可能性があることを知らされ、皮膚の紅斑の最初の兆候が見られたら治療を中止する必要があります。この反応は、ミノサイクリンの使用で報告されています。
中枢神経系の症状を経験した患者は、ミノサイクリン療法中に車両を運転したり、危険な機械を使用したりすることについて注意する必要があります。 警告 )。
テトラサイクリンと経口避妊薬を同時に使用すると、経口避妊薬の効果が低下する可能性があります( 薬物相互作用 )。
MINOCIN 50mg 経口懸濁液を含む抗菌薬は、細菌感染症の治療にのみ使用するよう患者に説明する必要があります。ウイルス感染症(風邪など)は治療しません。 MINOCIN 経口懸濁液が細菌感染症の治療のために処方される場合、患者は、治療過程の早い段階で気分が良くなるのが一般的ですが、指示どおりに薬を服用する必要があることを伝えなければなりません.投与をスキップしたり、治療の全コースを完了しないと、(1)当面の治療の有効性が低下し、(2)細菌が耐性を獲得し、ミノシン 50mg 経口懸濁液または他の抗菌薬によって将来的に治療できなくなる可能性が高くなります。 .
未使用のテトラサイクリン抗生物質は、有効期限までに廃棄する必要があります。
