Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Cipro 750mg とは何ですか? どのように使用されますか?
Cipro 500mg は、細菌感染症の症状を治療するために使用される処方薬です。シプロは、単独で、または他の薬と併用して使用できます。
シプロは、フルオロキノロンと呼ばれる薬物のクラスに属しています。
Cipro 750mg が 1 歳未満の子供に安全で有効であるかどうかは不明です。
シプロの副作用にはどのようなものがありますか?
シプロは、次のような重大な副作用を引き起こす可能性があります。
- 低血糖、
- 頭痛、
- 飢え、
- 発汗、
- 過敏症、
- めまい、
- 吐き気、
- 速い心拍数、
- 不安になったり、ふらふらしたり、
- 手、腕、脚または足のしびれ、
- 弱点、
- ヒリヒリしたり焼けるような痛み、
- 緊張感、
- 錯乱、
- 攪拌、
- パラノイア、
- 幻覚、
- メモリの問題、
- 集中するのが苦手、
- 自殺の考え、
- 突然の痛み、
- 腫れ、
- あざ、
- 優しさ、
- 剛性、
- 動きの問題、
- 任意の関節でのスナップまたはポッピング、
- 重度または絶え間ない胸の痛み、胃または背中、
- 水様または血様の下痢、
- 胸の中でときめき、
- 呼吸困難、
- 立ちくらみ、
- 発疹、
- 呼吸の問題、
- 排尿がほとんどまたはまったくない、
- 皮膚や目の黄変、
- 激しい頭痛、
- あなたの耳に鳴り響く、
- 視力の問題、および
- 目の奥の痛み
上記の症状がある場合は、すぐに医療機関を受診してください。
Cipro 1000mg の最も一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- 下痢、
- 胃痛、
- 膣のかゆみや分泌物、
- 頭痛と
- 異常な肝機能検査
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Cipro の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
腱炎、腱断裂、末梢神経障害、中枢神経系への影響および重症筋無力症の悪化を含む重篤な有害反応
- Cipro 250mgを含むフルオロキノロンは、一緒に発生した無効化および潜在的に不可逆的な重篤な副作用に関連しています[警告と注意事項を参照]。
- 腱炎および腱断裂 [警告と注意事項を参照]
- 末梢神経障害 [警告と注意事項を参照]
- 中枢神経系への影響 [警告と注意事項を参照]
これらの重篤な副作用を経験した患者では、Cipro 750mg を直ちに中止し、Cipro を含むフルオロキノロンの使用を避けてください。 警告と注意事項 ]
- Cipro 750mg を含むフルオロキノロン系薬剤は、重症筋無力症患者の筋力低下を悪化させる可能性があります。重症筋無力症の既往歴のある患者ではシプロを避けてください。 [警告と注意事項を参照]
- CIPRO 500mg を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため [警告と注意事項を参照]、合併症のない尿路感染症に対する代替治療選択肢がない患者に使用するために CIPRO を予約しておいてください [適応症を参照]
説明
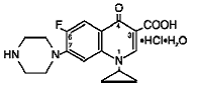
Cipro (cipro 750mgfloxacin*) 徐放性錠剤には、経口投与用の合成抗菌剤である cipro 500mgfloxacin が含まれています。 Cipro 1000mg 錠剤は、コーティングされた二層錠剤で、即時放出層と浸食マトリックス型の制御放出層で構成されています。シプロフロキサシンの原薬であるシプロフロキサシン塩酸塩とシプロフロキサシンベタイン(基剤)の2種類を配合した錠剤です。 Cipro 750mgフロキサシン塩酸塩は、1-シクロプロピル-6-フルオロ-1,4ジヒドロ-4-オキソ-7-(1-ピペラジニル)-3-キノリンカルボン酸塩酸塩です。それは、一水和物とセスキ水和物の混合物として提供されます。一水和物の実験式は C17H18FN3O3 です。塩酸。 H2O で、分子量は 385.8 です。セスキ水和物の実験式は C17H18FN3O3 です。塩酸。 1.5 H2O で、分子量は 394.8 です。原薬は、微黄色~淡黄色の結晶性物質です。一水和物の化学構造は次のとおりです。
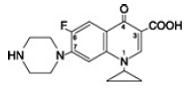
シプロ 1000mg フロキサシン ベタインは、1-シクロプロピル-6-フルオロ-1, 4-ジヒドロ-4-オキソ-7-(1-ピペラジニル)-3-キノリンカルボン酸です。水和物として、その実験式は C17H18FN3O3 です。 3.5 H2O で、その分子量は 394.3 です。淡黄色から淡黄色の結晶性物質であり、その化学構造は次のとおりです。
Cipro は、500 mg および 1000 mg (cipro 500mgfloxacin に相当) の錠剤強度で入手できます。シプロ錠は、ほぼ白色からわずかに黄色がかった、フィルムコーティングされた長方形の錠剤です。各シプロ 500 mg 錠剤には、シプロフロキサシン HCl として 500 mg のシプロフロキサシン (287.5 mg、乾燥ベースでシプロフロキサシンとして計算) およびシプロ 1000 mg フロキサシン† (212.6 mg、乾燥ベースで計算) が含まれています。各シプロ 1000 mg 錠剤には、シプロフロキサシン HCl として 1000 mg のシプロフロキサシン (574.9 mg、乾燥ベースでシプロフロキサシンとして計算) およびシプロ 750 mg フロキサシン† (425.2 mg、乾燥ベースで計算) が含まれています。不活性成分は、クロスポビドン、ヒプロメロース、ステアリン酸マグネシウム、ポリエチレングリコール、シリカコロイド無水物、コハク酸、および二酸化チタンです。
* cipro 500mgfloxacin† および cipro 250mgfloxacin Hydrochloride † として、USP モノグラフの乾燥減量試験および強熱試験残留物に準拠していません。
適応症
皮膚および皮膚構造の感染症
CIPRO 1000mg は、大腸菌、肺炎桿菌、Enterobacter cloacae、Proteus mirabilis、Proteus vulgaris、Providencia stuartii、Morganella morganii、Citrobacter freundii、Pseudomonas aeruginosa、メチシリン感受性黄色ブドウ球菌、メチシリン感受性表皮ブドウ球菌、または化膿連鎖球菌。
骨と関節の感染症
CIPRO 750mg は、Enterobacter cloacae、Serratia marcescens、または Pseudomonas aeruginosa によって引き起こされる成人患者の骨および関節感染症の治療に適応されます。
複雑な腹腔内感染症
CIPRO 250mg は、大腸菌、緑膿菌、ミラビリス菌、肺炎桿菌、またはバクテロイデス フラジリスによって引き起こされる複雑な腹腔内感染症 (メトロニダゾールと組み合わせて使用) の治療のために成人患者に適応されます。
感染性下痢
CIPRO 500mg は、抗菌療法が必要な場合に、大腸菌 (腸毒素原性分離株)、カンピロバクター ジェジュニ、シゲラ ボーイディ †、赤痢菌赤痢菌、シゲラ フレクスネリ、またはシゲラ ソンネイ† によって引き起こされる感染性下痢の治療のために成人患者に適応されます。
†この器官系におけるこの生物による感染症の治療は臨床的に重要な結果を示しましたが、有効性は10人未満の患者で研究されました.
腸チフス(腸熱)
CIPRO 1000mg は、チフス菌による腸チフスの治療のために成人患者に適応されます。慢性腸チフスキャリア状態の根絶におけるシプロフロキサシンの有効性は実証されていません。
合併症のない子宮頸部および尿道の淋病
CIPRO は、ナイセリア ゴノレーによる合併症のない子宮頸部および尿道の淋病の成人患者の治療に適応されます [参照 警告と注意事項 ]。
吸入性炭疽菌(暴露後)
CIPRO 250mg は、エアロゾル化した炭疽菌への曝露後の疾患の発生率または進行を軽減するために、出生から 17 歳までの吸入炭疽 (曝露後) の成人および小児患者に適応されます。
ヒトで達成されたシプロ 500mg フロキサシンの血清濃度は、臨床的利益を予測する合理的な可能性のある代替エンドポイントとして機能し、この適応症の承認の最初の基礎を提供しました. 2001 [参照 臨床研究 ]。
ペスト
CIPRO 1000mg は、ペスト菌 (Y.pestis) による肺ペストおよび敗血症性ペストを含むペストの治療、ならびに出生から 17 歳までの成人および小児患者におけるペストの予防に適応します。 cipro 250mgfloxacin の有効性研究は、実行可能性の理由から、ペストに罹患したヒトでは実施できませんでした。したがって、この適応症は、動物のみで実施された有効性試験に基づいています [参照 臨床研究 ]。
慢性細菌性前立腺炎
CIPRO は、大腸菌またはプロテウス ミラビリスによって引き起こされる慢性細菌性前立腺炎の成人患者の治療に適応されます。
下気道感染症
CIPRO 750mg は、大腸菌、肺炎桿菌、エンテロバクター クロアカエ、ミラビリス プロテウス、緑膿菌、インフルエンザ菌、パラインフルエンザ菌、または肺炎連鎖球菌による下気道感染症の成人患者の治療に適応されます。
CIPRO は、肺炎球菌による肺炎と推定される、または確認された肺炎の治療における第一選択薬ではありません。
CIPRO は、Moraxella catarrhalis によって引き起こされる慢性気管支炎 (AECB) の急性増悪の治療に適応されます。
CIPRO を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため [参照 警告と注意事項 一部の患者では、AECB は自己制限的であり、代替治療の選択肢がない患者では、AECB の治療のために CIPRO 750mg を予約します。
尿路感染症
成人の尿路感染症
CIPRO 500mg は、大腸菌、肺炎桿菌、エンテロバクター・クロアカエ、セラチア・マルセッセンス、プロテウス・ミラビリス、プロビデンシア・レットゲリ、モルガネラ・モルガニ、シトロバクター・コセリ、シトロバクター・フロウンディ、緑膿菌、メチシリン感受性のエピデルミジロコッカスによる尿路感染症の成人患者の治療に適応されます。 、Staphylococcus saprophyticus、またはEnterococcus faecalis。
合併症のない急性膀胱炎
CIPRO 750mg は、大腸菌または黄色ブドウ球菌に起因する合併症のない急性膀胱炎の成人女性患者の治療に適応されます。
CIPRO を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため [参照 警告と注意事項 ] また、一部の患者では合併症のない急性膀胱炎は自然治癒するため、代替治療の選択肢がない患者の合併症のない急性膀胱炎の治療のために CIPRO を予約してください。
小児患者における複雑性尿路感染症と腎盂腎炎
CIPRO は、1 歳から 17 歳までの小児患者を対象に、複雑性尿路感染症 (cUTI) および大腸菌による腎盂腎炎の治療を適応としています [参照 特定の集団での使用 ]。
CIPRO は臨床試験では効果的ですが、関節や周辺組織に関連する反応など、コントロールと比較して副作用の発生率が高いため、小児集団では第一選択薬ではありません。 CIPRO 250mg は、他のフルオロキノロン系薬剤と同様に、幼若動物の体重負荷関節における関節症および組織病理学的変化と関連しています [参照 警告と注意事項 、 有害反応 、 特定の集団での使用 と 非臨床毒性学 ]。
急性副鼻腔炎
CIPRO は、インフルエンザ菌、肺炎連鎖球菌、またはモラクセラ・カタラーリスによる急性副鼻腔炎の成人患者の治療に適応されます。
CIPRO を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため [参照 警告と注意事項 一部の患者の急性副鼻腔炎は自己制限的であり、別の治療選択肢がない患者の急性副鼻腔炎の治療のために CIPRO を予約します。
使用法
薬剤耐性菌の発生を減らし、CIPRO 1000mg およびその他の抗菌薬の有効性を維持するために、CIPRO 500mg は、感受性菌によることが証明されているか、その可能性が強く疑われる感染症の治療または予防にのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
嫌気性微生物が感染に関与している疑いがある場合は、適切な治療を行う必要があります。適切な培養および感受性試験は、感染の原因となる生物を分離および特定し、シプロフロキサシンに対する感受性を決定するために、治療前に実施する必要があります。 CIPRO による治療は、これらの検査の結果が判明する前に開始される場合があります。結果が得られたら、適切な治療を継続する必要があります。
他の薬剤と同様に、緑膿菌の一部の分離株は、シプロ 1000mg フロキサシンによる治療中にかなり急速に耐性を獲得する可能性があります。治療中に定期的に実施される培養および感受性試験は、抗菌剤の治療効果だけでなく、細菌耐性の出現の可能性に関する情報も提供します。
投薬と管理
CIPRO 1000mg 錠剤および経口懸濁液は、適切な用量ガイドラインの表に記載されているように経口投与する必要があります。
大人の投与量
特定の患者に対する投与量と期間の決定には、感染の重症度と性質、原因微生物の感受性、患者の宿主防御機構の完全性、および腎機能と肝機能の状態を考慮に入れる必要があります。 . CIPRO 錠または CIPRO for Oral Suspension は、医師の裁量で臨床的に適応がある場合、成人患者に投与することができます。共同パッケージされた目盛り付きスプーンを使用して、経口懸濁液用の CIPRO を管理します [参照 投薬と管理 ]。
成人における IV から経口投与への変換
CIPRO IV で治療を開始した患者は、医師の裁量で臨床的に適応があれば、CIPRO 750mg 錠または経口懸濁液に切り替えることができます (表 2) [参照 臨床薬理学 ]。
小児患者における用量
cUTIまたは腎盂腎炎の投与量と初期治療経路(つまり、IVまたは経口)は、感染の重症度によって決定する必要があります。 CIPRO は、表 3 に記載されているとおりに投与する必要があります。経口懸濁液用の CIPRO は、同梱されている目盛付きスプーンを使用して投与します [ 投薬と管理 ]。
腎障害患者における用量変更
Cipro 250mgfloxacin は、主に腎排泄によって排出されます。ただし、薬物は肝臓の胆道系と腸を介して代謝され、部分的に除去されます。これらの薬物排泄の代替経路は、腎機能障害患者の腎排泄の減少を補うようです。それにもかかわらず、特に重度の腎機能障害のある患者には、投与量の変更が推奨されます。腎障害のある患者に使用するための投与ガイドラインを表 4 に示します。
血清クレアチニン濃度のみがわかっている場合、次の式を使用してクレアチニンクリアランスを推定できます。
血清クレアチニンは、腎機能の定常状態を表す必要があります。
重度の感染症および重度の腎障害のある患者では、750 mg の単位用量を上記の間隔で投与することができます。患者を注意深く監視する必要があります。
中等度から重度の腎不全の小児患者は、cUTIおよび腎盂腎炎の臨床試験から除外されました。中等度から重度の腎不全 (つまり、クレアチニンクリアランスが 50 mL/分/1.73m² 未満) の小児患者に必要な用量調整に関する情報はありません。
重要な管理手順
多価カチオンあり
マグネシウム/アルミニウム制酸剤の少なくとも 2 時間前または 6 時間後に CIPRO を投与します。ポリマーリン酸塩結合剤(例えば、セベラマー、炭酸ランタン)またはスクラルファート; Videx® (ジダノシン) チュアブル/緩衝錠または経口溶液用の小児用粉末;他の高度に緩衝された薬;またはカルシウム、鉄または亜鉛を含む他の製品。
乳製品入り
CIPRO 500mg と乳製品(牛乳やヨーグルトなど)またはカルシウム強化ジュースのみとの同時投与は、吸収が低下する可能性があるため避ける必要があります。ただし、CIPRO はこれらの製品を含む食事と一緒に摂取することができます。
CIPRO を投与されている患者の水分補給
高濃度尿の形成を防ぐために、CIPRO 1000mg を投与されている患者の十分な水分補給を確保してください。結晶尿症はキノロンで報告されています。
CIPRO 1000mg の適切な投与について患者に指示する [参照 患者相談情報 ]。
飲み忘れ
飲み忘れた場合はいつでも服用する必要がありますが、次の予定の服用の 6 時間前までに服用してください。次の服用までの残り時間が 6 時間未満の場合は、飲み忘れた分は服用せず、次の予定の服用量で処方されたとおりに治療を継続する必要があります。飲み忘れを補うために、2回分を服用してはいけません。
CIPRO 1000mg錠の分割
CIPRO 750mg 錠、250mg および 500mg は機能的に分割された錠剤で、分割線で半分に分割して、それぞれ 125mg および 250mg の強度を提供できます。
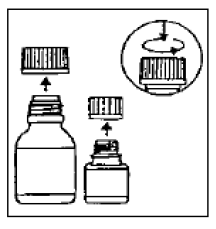
経口懸濁液用の CIPRO 500mg マイクロカプセルの再構成の指示
CIPRO 750mg 経口懸濁液は、5% (100 mL 中にシプロフロキサシン 5 g) および 10% (100 mL 中にシプロ 750mgフロキサシン 10 g) の濃度で提供されます。 CIPRO 250mg 経口懸濁液は、調剤前に組み合わせる必要がある 2 つの成分 (マイクロカプセルと希釈剤) で構成されています。
懸濁液の調製
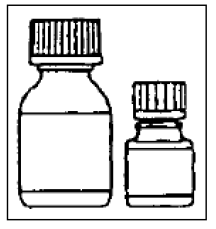
ステップ1
小さいボトルにはマイクロカプセルが入っており、大きいボトルには希釈剤が入っています。

ステップ2
両方のボトルを開きます。チャイルドプルーフキャップ:左に回しながら、キャップの指示に従って押し下げます。

ステップ 3
 マイクロカプセルを希釈液の大きなボトルに完全に注ぎます。 懸濁液に水を加えないでください .
ステップ 4
 希釈液ボトルのラベルの最上層をはがします(CIPRO 1000mg 経口懸濁液のラベルが見えるように)。キャップの指示に従って大瓶を完全に閉め、約15秒間激しく振ってください。サスペンションはすぐに使用できます。
ステップ 5
再構成された経口懸濁液の有効期限をボトルのラベルに記入してください。
再構成された製品は、30°C (86°F) 以下で 14 日間保存できます。凍結から保護してください。
混合された最終的なシプロフロキサシン懸濁液には何も追加しないでください。 CIPRO 1000mg 経口懸濁液は、その物理的特性により、栄養チューブまたは NG (経鼻胃) チューブを介して投与しないでください。
再構成後の経口懸濁液のためのCIPROの投与方法
- シプロ 750mg 経口懸濁液は、使用前に毎回約 15 秒間激しく振ってください。
- 患者用に同梱されている目盛り付き小さじ 1 杯を使用して、CIPRO 経口懸濁液を投与します (図 1 を参照)。
図 1: 共同パッケージされた 5 mL の目盛り付き小さじ 1 杯
1/2 (2.5 mL) と 1/1 (5 mL) の目盛りが付いた共同パッケージの目盛付き小さじ 1 杯 (5 mL) が提供されます。
- ご使用後は、ティースプーン1杯分を食器用洗剤で流水で洗い、よく乾かしてください。
- シプロ 250mg 経口懸濁液中のマイクロカプセルは、噛まずに丸ごと飲み込んでください。
- その後、水分を摂取することができます。
- キャップの指示に従って、使用後は毎回ボトルを正しく閉めてください。
- 治療が完了した後、シプロ 1000mg 経口懸濁液を再使用しないでください。
成人および小児患者における同時包装スプーンを使用した経口懸濁液のための CIPRO の投与
供給方法
剤形と強度
錠剤
- 250 mg、わずかに黄色がかった、フィルムコーティングされた、丸形、機能的にスコアリングされた、片面に「BAYER」、もう片面に「CIP 250」と刻印されています。
- 500 mg、わずかに黄色がかった、フィルムコーティング、カプセル形状、機能スコア、片面に「BAYER」、もう片面に「CIP 500」と刻印されています。
経口懸濁液
- 5% 経口懸濁液: 再構成後 5 mL あたり 250 mg シプロ 750 mg フロキサシン
- 10% 経口懸濁液: 再構成後 5 mL あたり 500 mg シプロ 250 mg フロキサシン
保管と取り扱い
CIPRO (シプロ 750mgフロキサシン塩酸塩) 錠剤は、シプロ 500mg フロキサシン 250 mg を含む、やや黄色がかった円形のフィルムコーティング錠として入手できます。 250 mg の錠剤は、片面に「BAYER」という言葉でコード化され、裏面には機能スコアと「CIP 250」が刻印されています。 CIPRO は、500 mg のシプロフロキサシンを含有する、わずかに黄色がかったフィルムコーティングされたカプセル型の錠剤としても入手できます。 500 mg の錠剤は、片面に「BAYER」という言葉でコード化され、裏面には機能スコアと「CIP 500」が刻印されています。 CIPRO 250 mg と 500 mg は 100 個入りのボトルで入手できます。
20° ~ 25°C (68° ~ 77°F) で保管してください。 15° から 30°C (59° から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。
CIPRO Oral Suspension は 5% と 10% の濃度で提供されます。製剤は、薬剤師が混合する必要がある 2 つの成分 (有効成分と希釈剤を含むマイクロカプセル) で構成されています。 投薬と管理 ]。
マイクロカプセルと希釈液は 25°C (77°F) 未満で保管してください。エクスカーションは 15°C から 30°C (59°F から 86°F) まで許容されます [参照 USP制御の室温 ]。凍結から保護してください。
再構成された製品は、25°C (77°F) で 14 日間保存できます。エクスカーションは 15°C から 30°C (59°F から 86°F) まで許容されます [参照 USP制御の室温 ]。凍結から保護してください。
1/2 (2.5 mL) と 1/1 (5 mL) の目盛りが付いた小さじ 1 杯 (5 mL) が患者に提供されます。
参考文献
1. 21 CFR 314.510 (サブパート H - 生命を脅かす病気に対する新薬の迅速承認)。
2. Friedman J、Polifka J. 薬物の催奇形性効果: 臨床医のためのリソース (TERIS)。メリーランド州ボルチモア: Johns Hopkins University Press, 2000:149-195.
3. Loebstein R、Addis A、Ho E、他。フルオロキノロンへの妊娠中の曝露後の妊娠転帰:多施設前向き対照研究。抗菌剤ケモザー。 1998;42(6):1336-1339。
製造元: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. 改訂: 2021 年 11 月
副作用
次の重篤な、または重要な副作用については、ラベル表示の他のセクションで詳しく説明しています。
- 不可逆的で潜在的に不可逆的な重篤な有害反応 [参照 警告と注意事項 ]
- 腱炎および腱断裂 [参照 警告と注意事項 ]
- 末梢神経障害 [参照 警告と注意事項 ]
- 中枢神経系への影響 [参照 警告と注意事項 重症筋無力症の悪化 [参照 警告と注意事項 ]
- その他の深刻な、時には致命的な有害反応 [を参照してください。 警告と注意事項 ]
- 過敏反応 [参照 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- 大動脈瘤および解離のリスク [参照 警告と注意事項 ]
- 併用テオフィリンによる重篤な有害反応 [参照 警告と注意事項 ]
- Clostridioides difficile 関連の下痢 [参照 警告と注意事項 ]
- QT間隔の延長[参照 警告と注意事項 ]
- 小児患者における筋骨格障害 [参照 警告と注意事項 ]
- 光線過敏症・光毒性[参照 警告と注意事項 ]
- 薬剤耐性菌の開発 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
成人患者
経口および非経口 CIPRO 750mg による臨床調査中、49,038 人の患者がこの薬剤のコースを受けました。
すべての製剤、すべての投与量、すべての薬物治療期間、およびシプロフロキサシン療法のすべての適応症の臨床試験で最も頻繁に報告された副作用は、吐き気 (2.5%)、下痢 (1.6%)、肝機能検査の異常 (1.3%) でした。 )、嘔吐(1%)、発疹(1%)。
CIPRO は、呼吸器感染症患者を対象に、CIPRO 錠 [500 mg 1 日 2 回 (BID)] をセフロキシム アキセチル (250 mg–500 mg BID) およびクラリスロマイシン (500 mg BID) と比較したランダム化二重盲検比較臨床試験で、対照薬に匹敵するCNS有害反応プロファイル。
小児患者
歳から 17 歳の小児患者(平均年齢 6 ± 4 歳)の cUTI または腎盂腎炎の治療における、シプロフロキサシンの経口/静脈内投与の短期(6 週間)および長期(1 年)の筋骨格および神経学的安全性をセファロスポリンと比較しました。 )国際多施設試験で。治療期間は 10 ~ 21 日でした (平均治療期間は 11 日で、範囲は 1 ~ 88 日でした)。合計 335 人のシプロ 250mg フロキサシン治療患者と 349 人の比較治療を受けた患者が登録されました。
独立した小児安全委員会 (IPSC) は、異常な歩行または異常な関節検査 (ベースラインまたは治療緊急) を含む筋骨格系の有害反応のすべてのケースを検討しました。治療開始から 6 週間以内に、筋骨格系の有害反応の発生率は、シプロ 750mg フロキサシン治療群で 9.3% (31/335) であったのに対し、比較治療を受けた患者では 6% (21/349) でした。 6週間までに発生したすべての筋骨格系の有害反応は、通常は治療終了から30日以内に解消されました(徴候と症状の臨床的解消)。放射線評価は、有害反応の解決を確認するために日常的に使用されていませんでした。 Cipro 500mgフロキサシンで治療された患者は、対照患者と比較して、複数の有害反応を複数回報告する可能性が高くなりました.筋骨格系の有害反応の発生率は、すべての年齢サブグループにわたって、対照群と比較してシプロフロキサシン群で一貫して高かった. 1年の終わりに、その期間中の任意の時点で報告されたこれらの有害反応の割合は、シプロ250mgフロキサシン治療群で13.7%(46/335)であったのに対し、比較治療患者では9.5%(33/349)でした(表 9)。
治療開始から 6 週間以内の神経学的有害反応の発生率は、CIPRO 群で 3% (9/335)、対照群で 2% (7/349) であり、めまい、神経過敏、不眠症、および傾眠が含まれていました。
この試験では、治療開始から 6 週間以内の副作用の全体的な発生率は、シプロ 250mg フロキサシン群で 41% (138/335) であったのに対し、対照群では 31% (109/349) でした。最も頻繁に見られた有害反応は胃腸でした。シプロフロキサシン患者の 15% (50/335) に対して、対照患者の 9% (31/349) でした。深刻な有害反応は、対照患者の 5.7% (20/349) と比較して、シプロフロキサシン治療患者の 7.5% (25/335) で見られました。副作用による薬剤の中止は、シプロフロキサシン治療を受けた患者の 3% (10/335) に対して、対照患者の 1.4% (5/349) で観察されました。シプロフロキサシン患者の少なくとも 1% で発生したその他の副作用は、下痢 4.8%、嘔吐 4.8%、腹痛 3.3%、消化不良 2.7%、吐き気 2.7%、発熱 2.1%、喘息 1.8%、発疹 1.8% でした。
cipro 1000mgfloxacin の短期安全性データは、嚢胞性線維症患者 (5 ~ 17 歳) の急性肺増悪の治療に関するランダム化二重盲検臨床試験でも収集されました。 67 人の患者が CIPRO IV 10 mg/kg/用量を 8 時間ごとに 1 週間投与され、続いて CIPRO 250mg 錠剤 20 mg/kg/用量が 12 時間ごとに投与され、10 ~ 21 日間の治療が完了しました。 mg/kg/用量を 8 時間ごとに、トブラマイシン 3 mg/kg/用量を 8 時間ごとに静脈内投与し、合計 10 ~ 21 日間。定期的な筋骨格評価は、治療を盲検化した検査官によって実施されました。患者は、治療終了後平均 23 日間 (範囲 0 ~ 93 日) 追跡されました。筋骨格系の有害反応は、シプロフロキサシン群の患者の 22%、比較群の 21% で報告されました。可動域の減少は、シプロフロキサシン群の被験者の 12%、比較群の 16% で報告されました。関節痛は、シプロ 500mg フロキサシン群の患者の 10%、比較群の 11% で報告されました。その他の有害反応は、治療群間で性質と頻度が類似していました。小児嚢胞性線維症患者の急性肺増悪の治療に対する CIPRO の有効性は確立されていません。
臨床試験で小児患者に報告された有害反応に加えて、臨床試験または市販後の経験中に成人で報告された有害反応が小児患者にも発生する可能性があることが予想されます。
市販後の経験
CIPRO を含むフルオロキノロン類の世界的なマーケティング経験から、次の副作用が報告されています。これらの反応は、不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません (表 10)。
実験室の有害な変化
CIPRO 250mg を服用中の検査パラメータの変化を以下に示します。
肝臓 –ALT(SGPT)、AST(SGOT)、アルカリホスファターゼ、LDH、血清ビリルビンの上昇。
血液学 –好酸球増加症、白血球減少症、血小板減少、血小板上昇、汎血球減少症。
腎臓 – 血清クレアチニン、BUN、結晶尿、円柱尿、血尿の上昇が報告されています。
発生したその他の変化は、血清ガンマグルタミルトランスフェラーゼの上昇、血清アミラーゼの上昇、血糖の低下、尿酸の上昇、ヘモグロビンの低下、貧血、出血素因、血中単球の増加、および白血球増多でした。
薬物相互作用
シプロフロキサシンは、ヒトチトクローム P450 1A2 (CYP1A2) を介した代謝の阻害剤です。 CIPRO と、主に CYP1A2 によって代謝される他の薬物との同時投与は、これらの薬物の血漿中濃度の上昇をもたらし、同時投与された薬物の臨床的に重大な有害事象につながる可能性があります。
警告
の一部として含まれています 予防 セクション。
予防
腱炎や腱断裂、末梢神経障害、中枢神経系への影響など、不可逆的で不可逆的な深刻な副作用
CIPRO を含むフルオロキノロンは、同じ患者で同時に発生する可能性がある、さまざまな身体システムからの不可逆的で潜在的に不可逆的な重篤な副作用に関連しています。一般的に見られる副作用には、腱炎、腱断裂、関節痛、筋肉痛、末梢神経障害、および中枢神経系への影響 (幻覚、不安、抑うつ、不眠、重度の頭痛、錯乱) などがあります。これらの反応は、CIPRO を開始してから数時間から数週間以内に発生する可能性があります。あらゆる年齢の、または既存の危険因子のない患者は、これらの有害反応を経験しています[ 警告と注意事項 ]。
重大な副作用の最初の兆候または症状が現れたら、CIPRO 250mg を直ちに中止してください。さらに、フルオロキノロンに関連するこれらの重篤な副作用を経験した患者には、CIPRO 500mg を含むフルオロキノロンの使用を避けてください。
腱炎と腱断裂
CIPRO を含むフルオロキノロン系薬剤は、すべての年齢層で腱炎および腱断裂のリスク増加と関連しています。 警告と注意事項 と 有害反応 ]。この副作用は、アキレス腱に最も頻繁に関与し、回旋筋腱板 (肩)、手、上腕二頭筋、親指、およびその他の腱でも報告されています。腱炎または腱断裂は、CIPRO 500mg の開始から数時間または数日以内に、またはフルオロキノロン療法の完了後数か月以内に発生する可能性があります。腱炎および腱断裂は、両側性に発生する可能性があります。
フルオロキノロン関連の腱炎および腱断裂を発症するリスクは、60 歳以上の患者、コルチコステロイド薬を服用している患者、および腎臓、心臓、または肺の移植を受けた患者で増加します。腱断裂のリスクを独立して増加させる可能性のあるその他の要因には、激しい身体活動、腎不全、および関節リウマチなどの以前の腱障害が含まれます.腱炎および腱断裂は、上記の危険因子を持たないフルオロキノロンを服用している患者にも発生しています。患者が痛み、腫れ、炎症、または腱の断裂を経験した場合は、CIPRO 250mg を直ちに中止してください。腱障害の病歴があるか、腱炎または腱断裂を経験した患者では、CIPRO 250mgを含むフルオロキノロンを避ける[参照 有害反応 ]。
末梢神経障害
CIPRO を含むフルオロキノロン系薬剤は、末梢神経障害のリスク増加と関連しています。 CIPRO を含むフルオロキノロン薬を投与されている患者では、知覚障害、知覚鈍麻、感覚異常、衰弱をもたらす、小さな軸索および/または大きな軸索に影響を与える感覚または感覚運動軸索多発神経障害の症例が報告されています。症状は CIPRO の開始直後に発生することがあり、一部の患者では元に戻せない場合があります [参照 警告と注意事項 と 有害反応 ]。
患者が痛み、灼熱感、うずき、しびれ、脱力感などの末梢神経障害の症状を経験した場合、または軽い接触、痛み、温度、位置感覚、振動感覚、および/または運動強度などの感覚に他の変化が見られた場合は、CIPRO を直ちに中止してください。不可逆的な状態の発生を最小限に抑えるために。以前に末梢神経障害を経験した患者では、CIPRO 500mg を含むフルオロキノロンを避ける [ 有害反応 ]。
中枢神経系への影響
精神医学的副作用
CIPRO を含むフルオロキノロンは、以下を含む精神医学的有害反応のリスク増加と関連しています。うつ病、または自殺未遂または完了などの自傷行為;不安、動揺、または緊張;混乱、せん妄、見当識障害、または注意の乱れ;不眠症または悪夢;記憶障害。これらの反応は、最初の投与後に発生する可能性があります。 CIPRO の投与を受けている患者には、これらの反応が生じた場合は直ちに医療提供者に連絡し、薬剤の使用を中止し、適切なケアを開始するようアドバイスしてください。
中枢神経系の有害反応
CIPRO 750mg を含むフルオロキノロン系薬剤は、発作 (痙攣)、頭蓋内圧亢進 (偽脳腫瘍)、めまい、振戦のリスク増加と関連しています。 CIPRO は、他のフルオロキノロン系薬剤と同様に、発作を誘発したり、発作閾値を低下させたりすることが知られています。てんかん重積症の症例が報告されています。すべてのフルオロキノロンと同様に、てんかん患者、および発作の素因となる可能性のある、または発作閾値を下げる可能性がある既知または疑われる CNS 障害のある患者 (たとえば、重度の脳動脈硬化症、痙攣の既往歴、脳血流の減少、脳の変化など) には注意して CIPRO を使用してください。構造、または脳卒中)、または発作の素因となる可能性のある、または発作閾値を下げる可能性のある他の危険因子の存在下で (たとえば、特定の薬物療法、腎機能障害)。発作が起きた場合は、CIPRO 500mg の使用を中止し、適切なケアを開始してください [参照 有害反応 と 薬物相互作用 ]。
重症筋無力症の悪化
CIPRO を含むフルオロキノロン系薬剤には神経筋遮断作用があり、重症筋無力症患者の筋力低下を悪化させる可能性があります。重症筋無力症患者におけるフルオロキノロンの使用には、死亡や換気補助の必要性など、市販後の重篤な副作用が関連しています。重症筋無力症の既往歴のある患者では CIPRO を避ける [参照 有害反応 ]。
その他の深刻な、時には致命的な副作用
CIPROを含むキノロンによる治療を受けている患者では、過敏症によるものや不確かな病因によるものなど、他の重篤で時には致命的な副作用が報告されています。これらの事象は重度である可能性があり、通常、複数回の投与後に発生します。臨床症状には、次の 1 つまたは複数が含まれる場合があります。
- 発熱、発疹、または重度の皮膚反応(中毒性表皮壊死融解症、スティーブンス・ジョンソン症候群など);
- 血管炎;関節痛;筋肉痛;血清病;
- アレルギー性肺炎;
- 間質性腎炎;急性腎不全または腎不全;
- 肝炎;黄疸;急性肝壊死または肝不全;
- 溶血性および再生不良性を含む貧血;血栓性血小板減少性紫斑病を含む血小板減少症;白血球減少;無顆粒球症;汎血球減少;および/またはその他の血液学的異常。
皮膚の発疹、黄疸、またはその他の過敏症の徴候が初めて現れた場合は、CIPRO 500mg を直ちに中止し、支援措置を講じてください。 有害反応 ]。
過敏反応
CIPRO を含むフルオロキノロン療法を受けている患者では、重篤で時として致命的な過敏症 (アナフィラキシー) 反応が報告されており、最初の投与後に発生するものもあります。一部の反応には、心血管虚脱、意識喪失、うずき、咽頭または顔面の浮腫、呼吸困難、蕁麻疹、およびかゆみが伴いました。過敏反応の既往歴のある患者はごくわずかでした。深刻なアナフィラキシー反応には、エピネフリンによる緊急治療と、酸素、静脈内輸液、静脈内抗ヒスタミン薬、コルチコステロイド、昇圧アミン、および指示に従って挿管を含む気道管理を含むその他の蘇生措置が必要です[ 有害反応 ]。
肝毒性
肝壊死、生命を脅かす肝不全、および致命的なイベントを含む重度の肝毒性の症例が CIPRO で報告されています。急性肝障害は急速に発症し (範囲 1 ~ 39 日)、過敏症を伴うことがよくあります。損傷のパターンは、肝細胞性、胆汁うっ滞性、または混合性である可能性があります。致命的な結果をもたらしたほとんどの患者は、55 歳以上でした。肝炎の徴候や症状(食欲不振、黄疸、暗色尿、かゆみ、腹部の圧痛など)が見られた場合は、直ちに治療を中止してください。
トランスアミナーゼ、アルカリホスファターゼ、または胆汁うっ滞性黄疸が一時的に増加する可能性があり、特に CIPRO で治療されている以前の肝障害のある患者では [参照 有害反応 ]。
大動脈瘤と解離のリスク
疫学的研究では、特に高齢患者において、フルオロキノロンの使用後 2 か月以内に大動脈瘤および解離の発生率が増加したことが報告されています。リスク増加の原因は特定されていません。既知の大動脈瘤を有する患者、または大動脈瘤のリスクが高い患者では、代替の抗菌治療が利用できない場合にのみ使用するために CIPRO 750mg を予約してください。
併用テオフィリンによる重篤な副作用
CIPRO 250mg とテオフィリンの同時投与を受けた患者では、重篤で致命的な反応が報告されています。これらの反応には、心停止、発作、てんかん重積症、および呼吸不全が含まれます。吐き気、嘔吐、振戦、過敏症、または動悸の事例も発生しています。
テオフィリン単剤で同様の重篤な副作用が報告されていますが、これらの副作用がシプロによって増強される可能性は否定できません。併用が避けられない場合は、テオフィリンの血清レベルを監視し、適切に投与量を調整します[ 薬物相互作用 ]。
Clostridioides Difficile関連下痢症
Clostridioides difficile (C. difficile) 関連下痢症 (CDAD) は、CIPRO を含むほぼすべての抗菌薬の使用で報告されており、重症度は軽度の下痢から致命的な大腸炎までさまざまです。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生分離株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除が必要になる可能性があるため、罹患率と死亡率の増加を引き起こします。抗菌薬の使用後に下痢を呈するすべての患者で CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗菌薬の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗菌治療、および臨床的に必要な外科的評価の開始 [参照 有害反応 ]。
QT間隔の延長
CIPRO 750mg を含む一部のフルオロキノロンは、心電図の QT 間隔の延長および不整脈の症例と関連しています。 CIPRO を含むフルオロキノロンを投与されている患者の市販後調査中に、トルサード ド ポワントの症例が報告されています。
QT間隔の延長が知られている患者、QT延長の危険因子またはトルサード・ド・ポワント(例えば、先天性QT延長症候群、低カリウム血症または低マグネシウム血症などの補正されていない電解質不均衡、および心不全、心筋症などの心疾患)がある患者では、CIPRO 1000mgを避けてください。クラス IA の抗不整脈薬(キニジン、プロカインアミド)、またはクラス III の抗不整脈薬(アミオダロン、ソタロール)、三環系抗うつ薬、マクロライド、および抗精神病薬を投与されている患者。高齢患者はまた、QT 間隔に対する薬物関連の影響を受けやすい可能性があります [参照 有害反応 、 特定の集団での使用 ]。
小児患者の筋骨格障害と動物の関節障害の影響
CIPRO 250mg は、小児患者 (18 歳未満) では、cUTI、吸入性炭疽 (曝露後) の予防、およびペストに対してのみ適応となります [参照 適応症と使用法 ]。コントロールと比較して、関節および/または周囲の組織に関連する反応を含む有害反応の発生率の増加が観察されています[ 有害反応 ]。
前臨床試験では、CIPRO の経口投与により、未熟な犬に跛行が引き起こされました。これらの犬の体重を支える関節の組織病理学的検査により、軟骨の永続的な損傷が明らかになりました。関連するキノロン系の薬物はまた、さまざまな種の未熟な動物において、体重を支える関節の軟骨のびらんやその他の関節症の徴候を引き起こします。 特定の集団での使用 と 非臨床毒性学 ]。
光線過敏症・光毒性
中等度から重度の光過敏性/光毒性反応。後者は、光にさらされた領域 (典型的には顔、皮膚の「V」領域) を含む過度の日焼け反応 (例えば、灼熱感、紅斑、滲出液、水疱、水ぶくれ、浮腫) として現れることがあります。首、前腕の伸筋表面、手の背) は、日光または紫外線にさらされた後の CIPRO を含むキノロンの使用に関連している可能性があります。したがって、これらの光源に過度にさらされることは避けてください。光毒性が発生した場合は、CIPRO 250mg を中止してください [ 有害反応 ]。
薬剤耐性菌の開発
CIPRO 250mg 錠および CIPRO 経口懸濁液を、証明された、または強く疑われる細菌感染がない場合、または予防適応症がない場合に処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌が発生するリスクが高まります。
シトクロム P450 1A2 酵素によって代謝される薬物の併用に伴う潜在的なリスク
CIPRO 750mg は、肝臓の CYP1A2 酵素経路の阻害剤です。 CIPRO と主に CYP1A2 によって代謝される他の薬物 (テオフィリン、メチルキサンチン、カフェイン、チザニジン、ロピニロール、クロザピン、オランザピン、ゾルピデムなど) の同時投与は、同時投与された薬物の血漿中濃度の上昇をもたらし、臨床的に重要な同時投与された薬物の薬力学的副作用[参照 薬物相互作用 と 臨床薬理学 ]。
梅毒のタイムリーな診断の妨害
CIPRO 1000mg が梅毒の治療に有効であることは証明されていません。淋病を治療するために短期間高用量で使用される抗菌剤は、潜伏梅毒の症状を隠したり遅らせたりする可能性があります。診断時に淋病のすべての患者で梅毒の血清学的検査を行います。 CIPRO 治療の 3 か月後に、梅毒のフォローアップ血清学的検査を実施します。
クリスタルリア
シプロフロキサシンの結晶は、人間の被験者の尿でめったに観察されませんが、通常はアルカリ性である実験動物の尿でより頻繁に観察されています[ 非臨床毒性学 ]。人間の尿は通常酸性であるため、CIPRO に関連する結晶尿が人間で報告されることはめったにありません。 CIPRO を投与されている患者の尿がアルカリ性にならないようにしてください。高濃度の尿が形成されるのを防ぐために、患者を十分に水分補給する [参照 投薬と管理 ]。
血糖障害
CIPRO を含むフルオロキノロンは、通常、経口血糖降下薬(グリブリドなど)またはインスリンによる併用治療を受けている糖尿病患者において、症候性高血糖および低血糖を含む血糖障害と関連しています。これらの患者では、血糖の注意深いモニタリングが推奨されます。昏睡または死亡に至る重度の低血糖症の症例が報告されています。 CIPRO による治療を受けている患者に低血糖反応が生じた場合は、CIPRO 750mg を中止し、直ちに適切な治療を開始してください。 有害反応 、 薬物相互作用 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )
重篤な副作用
副作用を経験した場合は CIPRO 250mg の服用を中止し、別の抗菌薬による治療の全過程を完了するためのアドバイスを得るために医療提供者に連絡するよう患者にアドバイスしてください。
CIPRO またはその他のフルオロキノロンの使用に関連した以下の重篤な副作用について患者に知らせてください。
- 同時に発生する可能性のある無効化および潜在的に不可逆的な重篤な副作用: 腱炎および腱断裂、末梢神経障害、および中枢神経系への影響を含む、無効化および潜在的に不可逆的な重篤な副作用が CIPRO 1000mg の使用に関連しており、同じ患者に同時に発生する可能性があることを患者に知らせてください。副作用が現れた場合は、直ちに CIPRO の服用を中止し、医療提供者に連絡するよう患者に伝えてください。
- 腱炎および腱断裂: 患者に、腱の痛み、腫れ、炎症、または関節の衰弱または使用不能を経験した場合は、医療提供者に連絡するように指示します。休息し、運動を控えてください。 CIPRO 750mgの治療を中止してください。症状は元に戻らない場合があります。フルオロキノロンによる重度の腱障害のリスクは、通常 60 歳以上の高齢の患者、コルチコステロイド薬を服用している患者、および腎臓、心臓、または肺の移植を受けた患者で高くなります。
- 末梢神経障害: 末梢神経障害がシプロフロキサシンの使用に関連していることを患者に知らせてください。症状は治療開始直後に発生する可能性があり、元に戻せない可能性があります。痛み、灼熱感、ヒリヒリ感、しびれ、衰弱などの末梢神経障害の症状が現れた場合は、直ちに CIPRO の使用を中止し、医師に連絡するよう伝えてください。
- 中枢神経系への影響 (例えば、けいれん、めまい、立ちくらみ、頭蓋内圧亢進): シプロフロキサシンを含むフルオロキノロン系薬剤を服用している患者でけいれんが報告されていることを患者に伝えます。けいれんの既往歴がある場合は、この薬を服用する前に医師に知らせるよう患者に指示してください。自動車や機械を操作する前、または精神的な覚醒と調整を必要とするその他の活動に従事する前に、CIPRO にどのように反応するかを知っておく必要があることを患者に伝えます。かすみ目を伴うまたは伴わない持続性頭痛が発生した場合は、医師に連絡するよう患者に指示します。
- 重症筋無力症の悪化: 重症筋無力症の病歴を医師に知らせるように患者に指示します。呼吸困難などの筋力低下の症状が見られた場合は、医師に知らせるよう患者に指示してください。
- 過敏反応: シプロフロキサシンは単回投与後でも過敏症反応を引き起こす可能性があることを患者に伝え、皮膚発疹、蕁麻疹またはその他の皮膚反応、急速な心拍、嚥下または呼吸困難、血管性浮腫を示唆する腫れの最初の兆候が見られたら、薬物を中止する必要があります (たとえば、唇、舌、顔の腫れ、喉の圧迫感、嗄声)、またはアレルギー反応の他の症状.
- 肝毒性: CIPRO を服用している患者で重度の肝毒性(急性肝炎や致死的事象を含む)が報告されていることを患者に知らせてください。食欲不振、吐き気、嘔吐、発熱、脱力感、疲労感、右上腹部の圧痛、かゆみ、皮膚や目の黄変、薄い色の排便など、肝障害の徴候や症状が見られた場合は、医師に知らせるよう患者に指示してください。または濃い色の尿。
- 大動脈瘤と解離: 突然の胸、胃、または背中の痛みを感じた場合は、救急医療を求めるよう患者に伝えてください。
- 下痢: 下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると終了します。抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.このような場合は、できるだけ早く医師に連絡するよう患者に指示してください。
- QT間隔の延長: 低カリウム血症、徐脈、または最近の心筋虚血などのQT延長または催不整脈状態の個人歴または家族歴を医師に知らせるように患者に指示します。クラス IA (キニジン、プロカインアミド)、またはクラス III (アミオダロン、ソタロール) の抗不整脈薬を服用している場合。動悸の長期化や意識喪失など、QT 間隔の延長の症状がある場合は、医師に知らせるように患者に指示してください。
- 小児患者の筋骨格障害: この薬を服用する前に、子供に関節関連の問題の病歴がある場合は、親に子供の医師に知らせるように指示してください.小児患者の親に、シプロ 1000mg フロキサシン治療中または治療後に関節関連の問題が発生した場合は、子供の医師に知らせるように伝えてください [ 警告と注意事項 と 特定の集団での使用 ]。
- チザニジン: すでにチザニジンを服用している場合は、シプロ 250mg フロキサシンを使用しないよう患者に指示してください。 CIPRO は、チザニジン (Zanaflex®) の効果を高めます。
- テオフィリン: シプロ 250mg フロキサシン CIPRO 1000mg がテオフィリンの効果を高める可能性があることを患者に知らせます。生命を脅かす中枢神経系への影響や不整脈が発生する可能性があります。発作、動悸、または呼吸困難を経験した場合は、直ちに医師の診察を受けるよう患者にアドバイスしてください。
- カフェイン: CIPRO 500mg がカフェインの影響を増加させる可能性があることを患者に知らせてください。キノロン類を服用中にカフェインを含む製品を摂取すると、カフェインが蓄積する可能性があります。
- 光過敏症/光毒性: フルオロキノロンを投与されている患者で光過敏症/光毒性が報告されていることを患者に知らせてください。キノロンを服用している間は、自然または人工の日光(日焼けベッドまたは UVA/B 治療)への曝露を最小限に抑えるか避けるように患者に伝えてください。患者がキノロンを使用している間、屋外にいる必要がある場合は、皮膚を日光から保護するゆったりとした衣服を着用するように指示し、他の日焼け防止対策について医師に相談してください。日焼けのような反応や皮膚の発疹が生じた場合は、医師に連絡するよう患者に指示してください。
- 血糖障害: 糖尿病患者で、インスリンまたは経口血糖降下薬による治療を受けているときに血糖降下反応が生じた場合は、CIPRO 250mg の使用を中止し、医師に相談する必要があることを患者に伝えてください。
- 授乳: 吸入性炭疽 (暴露後) 以外の適応症については、Cipro による治療中および最後の投与からさらに 2 日間は授乳が推奨されないことを女性に助言してください。あるいは、女性は、治療中および最後の投与後さらに 2 日間、搾乳して廃棄することができます [参照 特定の集団での使用 ]。
抗菌耐性
CIPRO 250mg 錠剤および CIPRO 1000mg 経口懸濁液を含む抗菌薬は、細菌感染症の治療にのみ使用する必要があることを患者に伝えてください。ウイルス感染症(風邪など)は治療しません。 CIPRO 500mg 錠剤および CIPRO 500mg 経口懸濁液が細菌感染症の治療のために処方された場合、治療の初期に気分が良くなることはよくあることですが、指示どおりに服用する必要があることを患者に伝えてください。投与をスキップしたり、治療の全コースを完了しないと、(1) 即時治療の有効性が低下し、(2) 細菌が耐性を獲得し、CIPRO 500mg 錠剤および CIPRO 250mg 経口懸濁液または他の抗菌剤で治療できなくなる可能性が高くなる可能性があります。今後の薬。
管理手順
患者に指示する
- シプロ オーラル サスペンションは、使用前に約 15 秒間、毎回激しく振ってください。
- 正確な用量を得るために、1/2 (2.5 mL) と 1/1 (5 mL) の目盛りが付いた同梱の目盛付き計量スプーンを常に使用します。
- 使用後は、目盛付き計量スプーンを食器用洗剤で流水で洗い、よく乾かしてください。
- マイクロカプセルは噛むのではなく、丸ごと飲み込んでください。
- その水は後で取ることができます。
- キャップの指示に従って、使用後は毎回ボトルを正しく閉めてください。
- 治療が完了した後、シプロ 1000mg 経口懸濁液を再使用しないでください。
CIPRO 250mg は食事の有無にかかわらず服用できることを患者に伝えてください。
高濃度の尿の形成および尿中の結晶の形成を避けるために、CIPRO を服用している間は十分に水分を摂取するように患者に伝えてください。
マグネシウムまたはアルミニウムを含む制酸剤、スクラルファート、鉄などの金属陽イオン、および亜鉛またはジダノシンを含むマルチビタミン製剤は、CIPRO 1000mg 投与の少なくとも 2 時間前または 6 時間後に服用する必要があることを患者に伝えます。シプロフロキサシンの吸収が著しく低下する可能性があるため、シプロを乳製品(牛乳やヨーグルトなど)またはカルシウム強化ジュースと一緒に摂取しないでください。ただし、CIPRO 500mg は、これらの製品を含む食事と一緒に摂取することができます。
飲み忘れた場合は、いつでも服用する必要がありますが、次の予定の服用の 6 時間前までに服用する必要があることを患者に伝えてください。次の服用までの残り時間が 6 時間未満の場合は、飲み忘れた分は服用せず、次の予定の服用量で処方されたとおりに治療を継続する必要があります。飲み忘れを補うために、2回分を服用してはいけません。
CIPRO 500mg 錠 (250 mg および 500 mg) にはスコアが付けられており、スコアラインで半分に分割して、それぞれ 125 mg または 250 mg の強度を提供できることを患者にアドバイスします。
薬物相互作用 経口糖尿病治療薬
シプロ 250mg フロキサシンと経口抗糖尿病薬を併用した場合に低血糖が報告されていることを患者に知らせます。 CIPRO 750mgで低血糖が発生した場合は、医師に相談し、抗菌薬を変更する必要があるかもしれないことを伝えてください.
炭疽菌とペストの研究
これらの状態で CIPRO を投与された患者には、有効性の研究は実現可能性の理由からヒトでは実施できなかったことを伝えてください。したがって、これらの条件の承認は、動物で実施された有効性研究に基づいていました。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
cipro 500mgfloxacin を使用して 8 つの in vitro 変異原性試験が実施され、試験結果は以下のとおりです。
- サルモネラ/ミクロソーム検査 (陰性)
- 大腸菌DNA修復アッセイ(陰性)
- マウスリンパ腫細胞前方変異アッセイ(陽性)
- チャイニーズハムスター V79 細胞 HGPRT テスト (陰性)
- シリアンハムスター胚細胞形質転換アッセイ(陰性)
- Saccharomyces cerevisiae Point Mutation Assay (陰性)
- Saccharomyces cerevisiae 有糸分裂クロスオーバーおよび遺伝子変換アッセイ (ネガティブ)
- ラット肝細胞 DNA 修復アッセイ (陽性)
したがって、8 つのテストのうち 2 つが陽性でしたが、次の 3 つの in vivo テスト システムの結果は陰性でした。
- ラット肝細胞 DNA 修復アッセイ
- 小核試験(マウス)
- 優性致死試験(マウス)
ラットとマウスでの長期発がん性試験では、シプロ 500mg フロキサシンによる発がん性または腫瘍形成性の影響は、ラットとマウスでそれぞれ最大 250 mg/kg と 750 mg/kg の毎日の経口投与レベルで発生しませんでした (約 1.7 倍および 2.5 倍)。それぞれ、体表面積に基づく最高推奨治療用量)。
光共発がん性試験の結果は、cipro 1000mgfloxacin が、ビヒクル対照と比較して、UV 誘発性皮膚腫瘍の出現までの時間を短縮しないことを示しています。ヘアレス (Skh-1) マウスは、同時にシプロフロキサシンを投与されている間、2 週間ごとに 5 回、最大 78 週間、3.5 時間 UVA 光にさらされました。最初の皮膚腫瘍の発症までの時間は、UVA と cipro 1000mgfloxacin を同時に投与したマウスでは 50 週間でした (マウスの投与量は、体表面積に基づくヒトの最大推奨用量とほぼ同じです)。と車両。皮膚腫瘍の発生までの時間は、UVA と他のキノロンで同時に治療されたマウスで 16 週間から 32 週間の範囲でした.5
このモデルでは、シプロフロキサシンのみで治療されたマウスは、皮膚または全身の腫瘍を発症しませんでした。有色マウスおよび/または完全に毛のあるマウスを使用した同様のモデルからのデータはありません。ヒトに対するこれらの所見の臨床的意義は不明です。
シプロ 250mg フロキサシンを 100 mg/kg までの経口用量 (体表面積に基づいた最高推奨治療経口用量の約 0.6 倍) のオスおよびメスのラットで実施した受胎能研究では、障害の証拠は明らかにされませんでした。オスのラットには交配前の 10 週間、シプロフロキサシンを経口投与し、メスには妊娠 7 日目までの交配前の 3 週間投与しました。
特定の集団での使用
妊娠
リスクの概要
妊娠中に投与されたシプロ1000mgフロキサシンに関する症例報告、症例対照研究、および観察研究から入手可能な公表された情報に基づく、数十年にわたる妊婦におけるシプロ1000mgフロキサシンの長期にわたる経験は、主要な先天性欠損症、流産または有害な薬物関連リスクを特定していません。母体または胎児の転帰(参照 データ )。妊娠中のマウスおよびラットに最大 100 mg/kg、妊娠したウサギに最大 30 mg/kg の用量で器官形成中にシプロ 500mg フロキサシンを経口投与しても、胎児の奇形は引き起こされませんでした。 データ )。これらの用量は、体表面積に基づいて、マウス、ラット、およびウサギの最大推奨臨床経口用量のそれぞれ最大 0.3、0.6、および 0.4 倍でした。示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
データ
ヒューマンデータ
利用可能な研究ではリスクがないことを明確に証明することはできませんが、数十年にわたる前向き観察研究から発表されたデータでは、妊娠中のシプロ 250mg フロキサシンの使用と、主要な先天性欠損症、流産、または母体または胎児の有害転帰との関連性は確立されていません。利用可能な研究には、サンプルサイズが小さいなどの方法論上の制限があり、それらのいくつかはシプロフロキサシンに特異的ではありません.制御された前向き観察研究では、妊娠中にフルオロキノロンに曝露された 200 人の女性 (52.5% がシプロ 250mg フロキサシンに曝露され、68% が妊娠初期に曝露された) を追跡しました。胚形成中のフルオロキノロンへの子宮内曝露は、主要な奇形のリスク増加と関連していませんでした。報告された主要な先天性奇形の発生率は、フルオロキノロン群で 2.2%、対照群で 2.6% でした (主要な奇形のバックグラウンド発生率は 1 ~ 5%)。自然流産、未熟児、低出生体重の割合はグループ間で差がなく、シプロ 500mg フロキサシンに暴露された子供たちには、1 歳まで臨床的に重大な筋骨格機能障害はありませんでした。
別の前向きフォローアップ研究では、フルオロキノロンに暴露された 549 人の妊娠が報告されました (妊娠初期の暴露の 93%)。シプロ 500mg フロキサシンの曝露は 70 回あり、すべて妊娠初期に行われました。シプロ750mgフロキサシンおよびフルオロキノロン全体に曝露された生児の奇形率は、どちらもバックグラウンド発生率の範囲内でした.先天性異常の特定のパターンは見つかりませんでした。この研究では、シプロフロキサシンへの子宮内曝露による明確な有害反応は明らかになりませんでした。
妊娠中にシプロフロキサシンにさらされた女性では、未熟児、自然流産、または出生時体重の割合に違いは見られませんでした.しかし、これらの小規模な市販後疫学研究は、ほとんどの経験が短期間の妊娠初期の暴露によるものであり、あまり一般的でない欠陥のリスクを評価したり、妊娠中の女性とその発育中の胎児におけるシプロフロキサシンの安全性に関する信頼できる決定的な結論を与えるには不十分です. .
動物データ
シプロ 500mg フロキサシンを用いて、ラット、マウス、およびウサギで発生毒性研究が実施されています。ラットとマウスでは、器官形成期 (妊娠 GD、6 ~ 17 日) に投与された 100 mg/kg までの経口用量は、胚胎児毒性や奇形などの有害な発達転帰とは関連がありませんでした。ラットとマウスでは、100 mg/kg の用量は、体表面積に基づいて、ヒトの 1 日最大経口用量 (1500 mg/日) のそれぞれ約 0.6 倍と 0.3 倍です。一連のウサギ発生毒性研究において、器官形成の期間をカバーすることを意図した、GD 6 ~ 10、GD 10 ~ 14、または GD 14 ~ 18 の 5 日間のいずれかで、シプロ 250mg フロキサシンを経口または静脈内投与されました。これは、母親の食物消費の減少と体重減少によって明らかになる抗菌剤を投与されたウサギで観察された胃腸不耐性を軽減する試みであり、胚胎児吸収または自然流産につながる可能性があります.シプロ 750mg フロキサシンの 100 mg/kg の経口投与 (体表面積に基づいた最高推奨臨床経口投与量の約 1.3 倍) は、胎児の過度の母体毒性交絡評価を引き起こした。 30 mg/kg の経口用量 (推奨される最高の臨床経口用量の約 0.4 倍) は、母体および胎児の体重増加の抑制と関連していましたが、胎児の奇形は観察されませんでした。妊娠中のウサギへの 20 mg/kg までの用量の静脈内投与 (体表面積に基づく最高推奨臨床経口用量の約 0.3 倍) は、母体への毒性はなく、胚胎児毒性も胎児奇形も観察されませんでした。
周産期および出生後の研究では、ラットは GD 16 から 22 日後までシプロ 1000mg フロキサシンを最大 200 mg/kg/日 (経口) または最大 30 mg/kg/日 (皮下) 投与されました。 200 mg/kg の用量は、体表面積に基づく最大推奨臨床経口用量の約 1.3 倍です。母体毒性も、仔の成長と発育への悪影響も観察されず、仔の後脚の関節に関節症の兆候も見られませんでした。シプロフロキサシンおよび他のキノロンは、直接投与された場合、テストされたほとんどの種の未熟な動物で関節症を引き起こすことが示されています[ 警告と注意事項 と 非臨床毒性学 ]。
授乳
リスクの概要
公開された文献では、シプロ 1000mg フロキサシンが静脈内および経口投与後に母乳中に存在すると報告されています。 CIPRO の乳量または母乳育児に対する影響に関する情報はありません。若年動物の研究で示されている関節症を含む、母乳で育てられた乳児における深刻な有害反応の潜在的なリスクのため[ 特定の集団での使用 、(臨床的考慮事項)]、ほとんどの適応症について、授乳中の女性は、CIPRO 500mgによる治療中、および最後の投与からさらに2日(5つの半減期)後に、搾乳して母乳を捨てることを検討できます.または、CIPRO の投与中および最後の投与後 2 日間 (半減期の 5 倍) は授乳が推奨されないことを女性にアドバイスしてください。
しかし、炭疽菌の吸入 (暴露後) については、炭疽菌への暴露につながる事故の間、母親 (および場合によっては乳児) が CIPRO を使用している間、母乳育児を継続することのリスク-ベネフィット評価が許容される場合があります [参照 投薬と管理 、 小児用 、 と 臨床研究 ]。母乳育児の発達上および健康上の利点は、CIPRO に対する母親の臨床的必要性、および CIPRO 1000mg または基礎となる母体の状態による授乳中の子供への潜在的な悪影響と併せて考慮する必要があります。
臨床上の考慮事項
シプロ 1000mg フロキサシンは、授乳中の乳児の腸内細菌叢の変化を引き起こす可能性があります。母乳で育てられた乳児の軟便や血便、およびカンジダ症 (ツグミ、おむつかぶれ) を監視するよう女性にアドバイスします。
小児用
CIPRO 750mg は、臨床試験では効果的ですが、対照群と比較して副作用の発生率が高いため、小児集団の第一選択薬ではありません。 CIPRO を含むキノロン系薬剤は、幼若動物に関節症 (関節痛、関節炎) を引き起こします [ 警告と注意事項 と 非臨床毒性学 ]。
複雑性尿路感染症と腎盂腎炎
CIPRO 250mg は、1 歳から 17 歳までの小児患者における大腸菌による cUTI および腎盂腎炎の治療に適応されます。 CIPRO 500mg は、臨床試験では有効ですが、対照群と比較して、関節および/または周囲の組織に関連する事象を含む有害反応の発生率が高いため、小児集団の第一選択薬ではありません。 有害反応 と 臨床研究 ]。
吸入性炭疽菌(暴露後)
CIPRO 750mg は、出生時から 17 歳までの小児患者の吸入炭疽 (暴露後) に適用されます。リスクベネフィット評価は、小児患者へのシプロフロキサシンの投与が適切であることを示しています[ 投薬と管理 と 臨床研究 ]。
ペスト
CIPRO 500mg は、出生時から 17 歳までの小児患者を対象とし、ペスト菌 (Y.pestis) による肺炎および敗血症性ペストを含むペストの治療およびペストの予防に適応します。 CIPRO の有効性研究は、実行可能性の理由から、肺ペストのヒトでは実施できませんでした。したがって、この適応の承認は、動物で実施された有効性試験に基づいています。リスクベネフィット評価は、小児患者への CIPRO の投与が適切であることを示しています [参照 適応症と使用法 、 投薬と管理 と 臨床研究 ]。
高齢者の使用
高齢患者は、CIPRO などのフルオロキノロンで治療されている場合、腱断裂を含む重度の腱障害を発症するリスクが高くなります。このリスクは、コルチコステロイド療法を併用している患者ではさらに増加します。腱炎または腱断裂は、アキレス腱、手、肩、または他の腱部位に関与する可能性があり、治療中または治療終了後に発生する可能性があります。フルオロキノロン治療後数ヶ月までに発生した症例が報告されています。 CIPRO 500mg を高齢の患者、特にコルチコステロイドを使用している患者に処方する場合は注意が必要です。患者は、この潜在的な有害反応について知らされ、CIPRO 500mg の使用を中止し、腱炎または腱断裂の症状が発生した場合は医療提供者に連絡するように勧められる必要があります [参照 囲み警告 、 警告と注意事項 、 と 有害反応 ]。
疫学的研究では、特に高齢患者において、フルオロキノロンの使用後 2 か月以内に大動脈瘤および解離の発生率が増加したことが報告されている [参照 警告と注意事項 ]。
3,500 人を超えるシプロフロキサシン治療を受けた患者を対象とした 23 件の CIPRO の反復投与対照臨床試験のレトロスペクティブ分析では、患者の 25% が 65 歳以上、10% が 75 歳以上でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていませんが、薬物療法に対する一部の高齢者の感受性が高いことは除外できません.シプロフロキサシンは腎臓から実質的に排泄されることが知られており、腎機能障害のある患者では副作用のリスクが高くなる可能性があります。腎機能が正常な 65 歳以上の患者では、投与量を変更する必要はありません。しかし、一部の高齢者は高齢のために腎機能が低下しているため、高齢患者の用量選択には注意が必要であり、これらの患者では腎機能のモニタリングが役立つ場合があります[参照 投薬と管理 と 臨床薬理学 ]。
一般に、高齢の患者は QT 間隔に対する薬物関連の影響を受けやすい可能性があります。したがって、CIPRO 500mgをQT間隔の延長をもたらす可能性のある併用薬(クラスIAまたはクラスIIIの抗不整脈薬など)またはトルサード・ド・ポワントの危険因子(既知のQT延長薬など)と併用する場合は注意が必要です。 、未修正の低カリウム血症) [参照 警告と注意事項 ]。
腎障害
Cipro 500mgfloxacin は、主に腎排泄によって排出されます。ただし、薬物は肝臓の胆道系と腸を介して代謝され、部分的に除去されます。これらの薬物排泄の代替経路は、腎機能障害患者の腎排泄の減少を補うようです。それにもかかわらず、特に重度の腎機能障害のある患者には、投与量のいくらかの変更が推奨される[ 投薬と管理 と 臨床薬理学 ]。
肝障害
安定した慢性肝硬変患者を対象とした予備研究では、シプロフロキサシンの薬物動態に有意な変化は観察されていません。急性肝不全患者における cipro 500mgfloxacin の薬物動態は研究されていません。
過剰摂取
急性の過剰摂取の場合、可逆的な腎毒性がいくつかのケースで報告されています。嘔吐を誘発するか、胃洗浄によって胃を空にします。患者を注意深く観察し、必要に応じて腎機能、尿pHの監視、酸性化などの支持療法を行い、結晶尿を予防し、シプロ750mgフロキサシンの吸収を低下させる可能性のある制酸剤を含むマグネシウム、アルミニウム、またはカルシウムを投与します。十分な水分補給を維持する必要があります。シプロ 250mg フロキサシンは、血液透析または腹膜透析後に体外に排出される量はわずか (10% 未満) です。
禁忌
過敏症
シプロ 1000mg は、シプロ 750mg フロキサシン、抗菌剤のキノロン系のメンバー、または製品成分のいずれかに対する過敏症の病歴のある人には禁忌です [ 警告と注意事項 ]。
チザニジン
チザニジンとの併用は禁忌です[参照 薬物相互作用 ]。
臨床薬理学
作用機序
シプロフロキサシンは、抗菌剤のフルオロキノロン系のメンバーです [ 微生物学 ]。
薬物動態
吸収
シプロ 500mg フロキサシンの経口錠剤として投与された場合の絶対バイオアベイラビリティは約 70% であり、初回通過代謝による実質的な損失はありません。シプロフロキサシンの最大血清濃度 (Cmax) および曲線下面積 (AUC) は、250 mg から 1000 mg の用量範囲のチャートに示されています (表 12)。
経口投与後 1 ~ 2 時間で最高血中濃度に達します。 250、500、または 750 mg を投与してから 12 時間後の平均濃度は、それぞれ 0.1、0.2、および 0.4 mcg/mL です。腎機能が正常な被験者の血清排出半減期は約 4 時間です。血清濃度は、1000 mg までの投与量に比例して増加します。
12 時間ごとに 500 mg を経口投与すると、CIPRO 1000 mg 400 mg を 12 時間ごとに 60 分かけて静脈内注入した場合と同等の AUC が得られることが示されています。 12 時間ごとに 750 mg を経口投与すると、8 時間ごとに 60 分かけて 400 mg を静脈内注入した場合と同等の定常状態の AUC が得られることが示されています。 750 mg の経口投与では、400 mg の静脈内投与で観察されたものと同様の Cmax が得られました (表 13)。 12 時間ごとに 250 mg を経口投与すると、CIPRO 1000 mg 200 mg を 12 時間ごとに注入した場合と同等の AUC が得られます。
食べ物
シプロ錠を食事と一緒に投与すると、薬物の吸収に遅延が生じ、投与後 1 時間ではなく 2 時間近くでピーク濃度が発生しますが、シプロ 750mg 懸濁液を食事と一緒に投与した場合は遅延は観察されません。 .ただし、CIPRO 1000mg 錠剤または CIPRO 500mg 懸濁液の全体的な吸収には実質的な影響はありません。懸濁液として与えられた cipro 750mgfloxacin の薬物動態も、食物の影響を受けません。吸収が低下する可能性があるため、シプロと乳製品(牛乳やヨーグルトなど)またはカルシウム強化ジュースのみの併用は避けてください。ただし、CIPRO 1000mg は、これらの製品を含む食事と一緒に摂取することができます
経口投与の場合、10 mL の 5% CIPRO 懸濁液 (250 mg シプロフロキサシン/5 mL を含む) として与えられる 500 mg の用量は、500 mg 錠剤と生物学的に同等です。 5% CIPRO 1000mg 懸濁液 (シプロフロキサシン 250 mg/5mL を含む) の 10 mL 容量は、10% CIPRO 750mg 懸濁液 (シプロ 1000mg フロキサシン 500 mg/5mL を含む) の 5 mL 容量と生物学的に同等です。
分布
シプロフロキサシンの血清タンパク質への結合は 20% から 40% であり、他の薬物との有意なタンパク質結合相互作用を引き起こすほど高くはありません。
経口投与後、cipro 250mgfloxacin は全身に広く分布します。組織濃度は、特に前立腺を含む生殖器組織において、男性と女性の両方で血清濃度を超えることがよくあります。シプロフロキサシンは、唾液、鼻および気管支の分泌物、副鼻腔の粘膜、痰、皮膚水疱液、リンパ液、腹水、胆汁、および前立腺分泌物中に活性型で存在します。シプロ 500mg フロキサシンは、肺、皮膚、脂肪、筋肉、軟骨、骨でも検出されています。薬は脳脊髄液 (CSF) に拡散します。ただし、CSF 濃度は通常、ピーク血清濃度の 10% 未満です。低レベルの薬物が眼の房水および硝子体液で検出されています。
代謝
ヒトの尿中には 4 つの代謝物が同定されており、これらは合わせて経口投与量の約 15% を占めています。代謝物には抗菌活性がありますが、未変化のシプロ 500mgフロキサシンよりも活性が低くなります。 Cipro 500mgfloxacin は、ヒトチトクローム P450 1A2 (CYP1A2) を介した代謝の阻害剤です。シプロフロキサシンと、主に CYP1A2 によって代謝される他の薬物との同時投与は、これらの薬物の血漿濃度の増加をもたらし、同時投与された薬物の臨床的に重大な有害事象につながる可能性があります [ 禁忌 、 警告と注意事項 、 と 薬物相互作用 ]。
排泄
腎機能が正常な被験者の血清排出半減期は約 4 時間です。経口投与量の約 40 ~ 50% が未変化体として尿中に排泄されます。 250 mg の経口投与後、シプロ 500 mg フロキサシンの尿中濃度は通常、最初の 2 時間で 200 mcg/mL を超え、投与後 8 ~ 12 時間で約 30 mcg/mL になります。シプロフロキサシンの尿中排泄は、投与後 24 時間以内に事実上完了します。シプロ 250mg フロキサシンの腎クリアランスは、約 300 mL/分であり、通常の糸球体濾過速度である 120 mL/分を超えています。したがって、活発な尿細管分泌は、その排除において重要な役割を果たしているようです.プロベネシドとシプロフロキサシンの同時投与により、シプロフロキサシンの腎クリアランスが約 50% 減少し、全身循環中の濃度が 50% 増加します。
cipro 250mgfloxacin の胆汁中濃度は、経口投与後の血清中濃度よりも数倍高くなりますが、投与された用量のごく一部が未変化の薬物として胆汁から回収されます。さらに投与量の 1% から 2% が胆汁から代謝物の形で回収されます。経口投与の約 20% から 35% が、投与後 5 日以内に糞便から回収されます。これは、胆汁クリアランスまたは経腸排泄のいずれかから生じる可能性があります。
特定の集団
お年寄り
シプロ 250 mg フロキサシンの経口 (単回投与) および静脈内 (単回および複数回投与) 形態の薬物動態研究は、シプロフロキサシンの血漿濃度が、若年成人と比較して高齢者 (65 歳以上) で高いことを示しています。 Cmax は 16% から 40% 増加しますが、平均 AUC の増加は約 30% であり、高齢者の腎クリアランスの減少に少なくとも部分的に起因する可能性があります。排泄半減期は、高齢者ではわずかに (~20%) しか延長されません。これらの違いは、臨床的に重要とは見なされません [参照 特定の集団での使用 ]。
腎障害
腎機能が低下した患者では、シプロフロキサシンの半減期がわずかに延長されます。投与量の調整が必要な場合があります [参照 特定の集団での使用 と 投薬と管理 ]。
肝障害
安定した慢性肝硬変患者を対象とした予備研究では、シプロフロキサシンの薬物動態に有意な変化は観察されていません。急性肝不全患者における cipro 750mgfloxacin の動態は、十分に研究されていません。
小児科
表14は、静脈内治療を受けている1歳未満から12歳未満の小児患者における薬物動態パラメーターをまとめたものである。
これらの値は、成人の治療用量で報告されている範囲内です。さまざまな感染症の小児患者の集団薬物動態分析に基づいて、子供の予測される平均半減期は約 4 ~ 5 時間であり、経口懸濁液のバイオアベイラビリティは約 60% です。
薬物間相互作用
制酸剤
水酸化マグネシウムまたは水酸化アルミニウムを含む制酸剤を同時に投与すると、シプロ 500mg フロキサシンのバイオアベイラビリティが 90% も低下する可能性があります [ 投薬と管理 と 薬物相互作用 ]。
ヒスタミンH2受容体拮抗薬
ヒスタミン H2 受容体拮抗薬は、cipro 250mgfloxacin のバイオアベイラビリティに有意な影響を与えないようです。
メトロニダゾール
シプロフロキサシンとメトロニダゾールの血清濃度は、これら 2 つの薬剤を併用しても変化しませんでした。
チザニジン
薬物動態研究では、チザニジン (4 mg の単回投与) の全身暴露は、薬剤が CIPRO (500 mg を 1 日 2 回、3 日間) と同時に投与された場合、有意に増加しました (Cmax は 7 倍、AUC は 10 倍)。チザニジンと CIPRO の同時投与は、チザニジンの降圧作用と鎮静作用の増強により禁忌です。 禁忌 ]。
ロピニロール
パーキンソン病患者 12 人を対象に実施された研究では、ロピニロール 6 mg を 1 日 1 回、CIPRO 250 mg 500 mg を 1 日 2 回投与したところ、ロピニロールの平均 Cmax と平均 AUC がそれぞれ 60% と 84% 増加しました。ロピニロール関連の有害反応のモニタリングとロピニロールの適切な用量調整は、CIPRO との併用投与中および直後に推奨されます [参照 警告と注意事項 ]。
クロザピン
CIPRO 500mg 250 mg とクロザピン 304 mg を 7 日間併用投与すると、クロザピンと N-デスメチルクロザピンの血清濃度がそれぞれ 29% と 31% 増加しました。クロザピンに関連する有害反応を注意深く監視し、CIPRO との併用投与中および投与直後にクロザピン投与量を適切に調整することをお勧めします。
シルデナフィル
健康な被験者にシルデナフィル 50 mg とシプロ 1000 mg 500 mg を単回経口投与した後、シルデナフィルの平均 Cmax と平均 AUC はどちらも約 2 倍に増加しました。 CIPRO の同時投与によりシルデナフィルの曝露が 2 倍に増加すると予想されるため、CIPRO 500mg と同時投与する場合は注意してシルデナフィルを使用してください。
デュロキセチン
臨床研究では、フルボキサミンなどの CYP450 1A2 アイソザイムの強力な阻害剤とデュロキセチンを併用すると、デュロキセチンの平均 AUC が 5 倍増加し、平均 Cmax が 2.5 倍増加する可能性があることが実証されました。
リドカイン
人の健康なボランティアで実施された研究では、1.5 mg/kg の IV リドカインと CIPRO 500 mg を 1 日 2 回併用すると、リドカインの Cmax と AUC がそれぞれ 12% と 26% 増加しました。リドカイン治療は、この高い曝露量で十分に許容されましたが、同時投与時に CIPRO との相互作用の可能性とリドカインに関連する有害反応の増加が発生する可能性があります。
メトクロプラミド
メトクロプラミドは、経口シプロ 750mg フロキサシンの吸収を大幅に加速し、最大血漿濃度に到達するまでの時間を短縮します。シプロフロキサシンのバイオアベイラビリティに有意な影響は観察されませんでした。
オメプラゾール
CIPRO を 1000 mg の単回用量でオメプラゾール (40 mg を 1 日 1 回、3 日間) と併用して 18 人の健康なボランティアに投与した場合、シプロフロキサシンの平均 AUC と Cmax はそれぞれ 20% と 23% 減少しました。この相互作用の臨床的意義は特定されていません。
微生物学
作用機序
cipro 750mgfloxacin の殺菌作用は、細菌の DNA 複製、転写、修復、および組換えに必要な酵素トポイソメラーゼ II (DNA ジャイレース) およびトポイソメラーゼ IV (両方とも II 型トポイソメラーゼ) の阻害に起因します。
抵抗のメカニズム
シプロフロキサシンを含むフルオロキノロンの作用機序は、ペニシリン、セファロスポリン、アミノグリコシド、マクロライド、およびテトラサイクリンの作用機序とは異なります。したがって、これらのクラスの薬剤に耐性のある微生物は、シプロフロキサシンの影響を受けやすい可能性があります。フルオロキノロンに対する耐性は、主に DNA ジャイレースの変異、外膜透過性の低下、または薬物流出のいずれかによって発生します。シプロフロキサシンに対する in vitro 耐性は、複数の段階変異によってゆっくりと発達します。自然突然変異によるシプロフロキサシンへの耐性は、10-9 未満から 1x10-6 の間の一般的な頻度で発生します。
交差抵抗
cipro 1000mgfloxacin と他のクラスの抗菌薬との間に既知の交差耐性はありません。
シプロフロキサシンは、in vitro および臨床感染症の両方で、以下の細菌のほとんどの分離株に対して活性があることが示されています [参照 適応症と使用法 ]。
グラム陽性菌
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (メチシリン感受性分離株のみ) Staphylococcus epidermidis (メチシリン感受性分離株のみ) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
グラム陰性菌
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
以下の in vitro データが利用可能ですが、それらの臨床的意義は不明です。以下の細菌の少なくとも 90% は、同様の属または生物群の分離株に対する cipro 750mgfloxacin の感受性ブレークポイント以下の in vitro 最小発育阻止濃度 (MIC) を示します。しかし、これらの細菌によって引き起こされる臨床感染症の治療におけるcipro 500mgfloxacinの有効性は、適切かつ十分に管理された臨床試験では確立されていません.
グラム陽性菌
Staphylococcus haemolyticus (メチシリン感受性分離株のみ) Staphylococcus hominis (メチシリン感受性分離株のみ)
グラム陰性菌
Acinetobacter lwoffi Aeromonas Hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
感受性試験
感受性試験の解釈基準、関連する試験方法、およびこの薬剤について FDA によって認められた品質管理基準に関する具体的な情報については、https://www.fda.gov/STIC を参照してください。
臨床研究
複雑な尿路感染症と腎盂腎炎 – 小児患者における有効性
歳から 17 歳 (平均年齢 6 ± 4 歳) の小児患者の cUTI および腎盂腎炎の治療において、静脈内および/または経口投与された CIPRO をセファロスポリンと比較しました。試験は、米国、カナダ、アルゼンチン、ペルー、コスタリカ、メキシコ、南アフリカ、ドイツで実施されました。治療期間は 10 ~ 21 日でした (平均治療期間は 11 日で、範囲は 1 ~ 88 日でした)。この研究の主な目的は、筋骨格および神経学的安全性を評価することでした。
患者は、治療後 5 ~ 9 日で、臨床的成功とベースライン生物の細菌学的根絶について評価され、新しい感染または重複感染はありませんでした(治癒または TOC のテスト)。プロトコルごとの集団には、ベースラインでプロトコルに指定されたコロニー数を持つ原因生物があり、プロトコル違反はなく、早期の中止やフォローアップの喪失はありませんでした (他の基準の中で)。
以下に示すように、Per Protocol 集団における臨床的成功率と細菌学的根絶率は、CIPRO 250mg と対照群との間で類似していました。
成人および小児科における吸入性炭疽菌
吸入炭疽のアカゲザルモデルにおける生存率の統計的に有意な改善に関連するシプロフロキサシンの平均血清濃度は、経口および静脈内投与レジメンを受けている成人および小児患者で到達またはそれを超えています。 Cipro 500mgフロキサシンの薬物動態は、さまざまなヒト集団で評価されています。 12 時間ごとに 500 mg を経口投与された成人の定常状態で達成される平均ピーク血清濃度は 2.97 mcg/mL であり、12 時間ごとに 400 mg を静脈内投与された後は 4.56 mcg/mL です。これらのレジメンの両方の定常状態での平均トラフ血清濃度は 0.2 mcg/mL です。 6 歳から 16 歳までの 10 人の小児患者の研究では、達成された平均ピーク血漿濃度は 8.3 mcg/mL であり、トラフ濃度は 0.09 mcg/mL から 0.26 mcg/mL の範囲であり、10 の 2 回の 30 分間の静脈内注入の後mg/kg を 12 時間間隔で投与。 2 回目の静脈内注入後、患者は 12 時間ごとに経口で 15 mg/kg に切り替え、最初の経口投与後に 3.6 mcg/mL の平均ピーク濃度に達しました。小児患者への CIPRO 投与後の、軟骨への影響を含む長期的な安全性データは限られています。ヒトで達成されたシプロ 1000mg フロキサシン血清濃度は、臨床的利益を予測する可能性が合理的にあり、この適応症の根拠を提供する代理エンドポイントとして機能します.1
11 LD50 の平均吸入用量 (~5.5 x 105 胞子 (範囲 5-30 LD50) の炭疽菌) にさらされたアカゲザルにおけるプラセボ対照動物研究が実施されました。この研究で使用された炭疽株は 0.08 mcg/mL でした. 研究された動物では、経口投与から定常状態までの予想 Tmax (投与後 1 時間) で達成されたシプロ 1000mg フロキサシンの平均血清濃度は、0.98 mcg/mL から 1.69 mcg/mL の範囲でした。 mcg/mL. 投与後 12 時間での平均定常トラフ濃度は 0.12 mcg/mL から 0.19 mcg/mL の範囲であった. - ばく露は、プラセボ群 (9/10) と比較して有意に低かった (1/9) [p= 0.001]. 炭疽菌で死亡した 1 匹の CIPRO 処置動物は、30 日間の薬物投与期間後に死亡した.7
2001 年には 9,300 人以上が、炭疽菌への吸入暴露の可能性に対して最低 60 日間の抗菌薬による予防を完了するように推奨されました。CIPRO 250mg は、予防レジメンのすべてまたは一部について、これらの個人のほとんどに推奨されました。炭疽菌ワクチンを接種したり、別の抗菌薬に切り替えたりした人もいます。予防的治療としてCIPRO 1000mgまたは他の治療を受けた人は、その後吸入性炭疽を発症しませんでした.曝露後予防レジメンの全部または一部として CIPRO を投与された人の数は不明です。
ペスト
エルシニア ペスティス (CO92 株) の吸入平均用量 110 LD50 (範囲 92 ~ 127 LD50) に暴露されたアフリカミドリザルでのプラセボ対照動物研究が実施されました。この研究で使用したペスト菌株のシプロフロキサシンの最小発育阻止濃度 (MIC) は 0.015 mcg/mL でした。 60 分間の 1 回の注入終了時に達成されたシプロフロキサシンの平均ピーク血清濃度は、2 日目に 3.49 ± mcg/mL 0.55 mcg/mL、3.91 mcg/mL ± 0.58 mcg/mL、および 4.03 mcg/mL ± 1.22 mcg/mL でした。アフリカミドリザルでの治療のそれぞれ 6 日目と 10 日目 すべてのトラフ濃度 (2 日目、6 日目、10 日目) は
動物毒物学および/または薬理学
シプロ 250mg フロキサシンおよび他のキノロン系薬剤は、試験したほとんどの種の未成熟動物に関節症を引き起こすことが示されている [ 警告と注意事項 ]。体重を支える関節の損傷は、幼若のイヌとラットで観察されました。若いビーグル犬では、シプロフロキサシン 100 mg/kg を 4 週間毎日投与すると、膝関節の関節の変性変化が起こりました。 30 mg/kg では、関節への影響は最小限でした。若いビーグル犬を対象としたその後の研究では、シプロ 750mg フロキサシン 30 mg/kg および 90 mg/kg のシプロ 750mg フロキサシン経口投与 (比較血漿 AUC に基づくと、小児用量の約 1.3 倍および 3.5 倍) を 2 週間毎日投与すると、関節痛が引き起こされました。 5 ヶ月の無治療期間後も組織病理学的に観察された変化。 10 mg/kg (比較血漿 AUC に基づく小児用量の約 0.6 倍) では、関節への影響は観察されませんでした。この用量は、さらに 5 か月間の無治療期間後も関節毒性とは関連していませんでした。別の研究では、関節から体重負荷を取り除くことで病変が軽減されましたが、完全に予防することはできませんでした.
シプロフロキサシンを投与された実験動物では、二次性腎症を伴うこともある結晶尿症が発生します。これは主に、試験動物の尿中で優勢なアルカリ性条件下でのシプロフロキサシンの溶解度の低下に関連しています。ヒトの場合、尿は通常酸性であるため、結晶尿はまれです。アカゲザルでは、5 mg/kg という低用量の単回経口投与後に、腎症を伴わない結晶尿症が認められました。 (体表面積に基づく最高推奨治療用量の約 0.07 倍)。 10 mg/kg/日の静脈内投与の 6 か月後、腎病理学的変化は見られませんでした。しかし、20 mg/kg/日を同じ期間 (体表面積に基づいた最高推奨治療用量の約 0.2 倍) 投与した後に、腎症が観察されました。
イヌでは、シプロフロキサシン 3 mg/kg および 10 mg/kg を迅速な静脈内注射 (15 秒) で投与すると、顕著な降圧効果が得られます。これらの効果は、抗ヒスタミン剤であるピリラミンによって部分的に拮抗されるため、ヒスタミンの放出に関連していると考えられています。アカゲザルでは、急速な静脈内注射も低血圧を引き起こしますが、この種の効果は一貫しておらず、それほど顕著ではありません.
マウスでは、フェニルブタゾンやインドメタシンなどの非ステロイド性抗炎症薬とキノロンの併用投与により、キノロンの中枢神経刺激作用が増強されることが報告されています。
一部の関連薬剤で見られる眼毒性は、シプロフロキサシンで治療された動物では観察されていません
参考文献
1. 21 CFR 314.510 (サブパート H - 生命を脅かす病気に対する新薬の迅速承認)。
5. 1993 年 3 月 31 日、メリーランド州シルバースプリングで開催された FDA の抗感染薬および皮膚科用医薬品の諮問委員会で発表されたレポート。レポートは FDA、CDER、Advisors and Consultants Staff、HFD-21、1901 Chapman Avenue、Room 200、Rockville、MD 20852、USA から入手できます。
6. ケリー DJ 他アカゲザルにおける長期治療中のペニシリン、ドキシサイクリン、およびシプロフロキサシンの血清濃度。 J Infect Dis 1992; 166:1184-7。
7. フリードランダー AM 他実験的吸入炭疽に対する暴露後予防。 J Infect Dis 1993; 167:1239-42。
8. 抗感染薬諮問委員会会議、2012 年 4 月 3 日 - 肺ペストの治療に対するシプロフロキサシンの有効性。
患者情報
シプロ® (一口)(シプロフロキサシン塩酸塩)錠、経口用
シプロ® (Sip-row) (cipro 1000mgfloxacin) 経口懸濁液用
CIPRO 500mg の服用を開始する前、およびリフィルを入手するたびに、この投薬ガイドをお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
CIPRO 500mg について知っておくべき最も重要な情報は何ですか?
フルオロキノロン系抗菌薬である CIPRO は、深刻な副作用を引き起こす可能性があります。これらの深刻な副作用のいくつかは同時に発生する可能性があり、死に至る可能性があります.
CIPRO の服用中に次の深刻な副作用のいずれかが発生した場合は、CIPRO 750mg の服用を直ちに中止し、直ちに医師の診察を受けてください。
1. 腱断裂または腱の腫れ (腱炎)。
- 腱の問題は、CIPRO を服用しているすべての年齢の人に発生する可能性があります。 腱は、筋肉を骨につなぐ丈夫な組織の索です。 腱の問題の症状には次のようなものがあります。
- 痛み
- 腫れ
- 足首の後ろ(アキレス)、肩、手、親指、またはその他の腱部位を含む腱の断裂および腫れ。
- 次の場合、CIPRO の服用中に腱の問題が発生するリスクが高くなります。
- 60歳以上である
- ステロイド(コルチコステロイド)を服用している
- 腎臓、心臓または肺の移植を受けた。
- 上記の危険因子を持たない人でも、CIPRO を服用すると腱の問題が発生する可能性があります。
- 腱の問題のリスクを高める可能性のあるその他の理由には、次のものがあります。
- 身体活動または運動
- 腎不全
- 関節リウマチ(RA)患者など、過去の腱の問題。
- 腱の痛み、腫れ、または炎症の最初の兆候が見られたら、直ちに CIPRO の使用を中止し、医師の診察を受けてください。 痛みや腫れの最も一般的な領域は、足首の後ろにあるアキレス腱です。これは、他の腱でも発生する可能性があります。
- 腱断裂は、CIPRO の服用中または服用終了後に発生する可能性があります。 腱断裂は、CIPRO を服用してから数時間または数日以内に発生する可能性があり、フルオロキノロンの服用を終了してから最大数か月後に発生します。
- 次の兆候または腱断裂の症状が見られた場合は、CIPRO 500mg の服用を直ちに中止し、直ちに医師の診察を受けてください。
- 腱の領域でスナップまたはポップを聞いたり感じたりする
- 腱領域の損傷直後のあざ
- 患部を動かすことができない、または体重を支えることができない
腱の問題は永久的な場合があります。
2. 感覚の変化と神経損傷の可能性 (末梢神経障害)。 CIPROを含むフルオロキノロンを服用している人では、腕、手、脚、または足の神経に損傷が生じる可能性があります.腕、手、脚、または足に末梢神経障害の次の症状が現れた場合は、CIPRO 750mg の服用を直ちに中止し、すぐに医療提供者に相談してください。
- 痛み
- しびれ
- 燃焼
- 弱点
- チクチクする
永続的な神経損傷を防ぐために、CIPRO 500mg を中止する必要がある場合があります。
3. 中枢神経系 (CNS) への影響。 CIPRO を含むフルオロキノロン系抗菌薬を服用している人々では、メンタルヘルスの問題や発作が報告されています。発作の既往歴がある場合は、CIPRO の服用を開始する前に医療提供者に伝えてください。中枢神経系の副作用は、CIPRO の初回投与後すぐに発生する可能性があります。これらの副作用、またはその他の気分や行動の変化が見られた場合は、直ちに CIPRO の使用を中止し、医療提供者に相談してください。
- 発作
- 寝られない
- 声が聞こえる、物が見える、または存在しないものを感じる (幻覚)
- 悪夢
- 立ちくらみやめまいを感じる
- 興奮する
- 疑念を抱く(パラノイア)
- 震え
- 自殺念慮または自殺行為
- 不安や緊張を感じる
- 有無にかかわらず、消えない頭痛
- 混乱 かすみ目
- うつ
- メモリの問題
- 周囲の意識の低下
- 誤った、または奇妙な考えや信念 (妄想)
これらの変更は永続的な場合があります。
4. 重症筋無力症(筋力低下を引き起こす問題)の悪化。 CIPRO 500mg のようなフルオロキノロンは、筋力低下や呼吸障害などの重症筋無力症の症状を悪化させる可能性があります。重症筋無力症の病歴がある場合は、CIPRO の服用を開始する前に医療提供者に伝えてください。筋力低下や呼吸障害が悪化した場合は、すぐに医療提供者に連絡してください。
シプロ750mgとは?
CIPRO は、細菌と呼ばれる特定の細菌によって引き起こされる特定の感染症を治療するために 18 歳以上の成人に使用されるフルオロキノロン系抗菌薬です。これらの細菌感染には以下が含まれます:
-
- 尿路感染
- 骨と関節の感染症
- 合併症のない子宮頸部および尿道の淋病
- 慢性前立腺感染症
- 院内肺炎
- 白血球数が少なく、熱がある人
- 下気道感染症
- 腹腔内感染、複雑
- 吸入炭疽菌
- 副鼻腔感染症
- 感染性下痢
- ペスト
- 皮膚感染症
- 腸チフス熱
- ペストと炭疽菌はヒトでは研究できなかったため、ペストと炭疽菌の治療に使用するCIPRO 1000mgの研究は動物でのみ行われました.
- CIPRO 250mg は、慢性気管支炎の急性増悪、合併症のない急性膀胱炎、および副鼻腔感染症の患者には、他に利用可能な治療オプションがある場合は使用しないでください。
- CIPRO 750mg は、肺炎連鎖球菌と呼ばれる特定の種類の細菌によって引き起こされる下気道感染症を治療するための抗菌薬の第一選択として使用しないでください。
- CIPRO 1000mg は 18 歳未満の小児にも使用されます 複雑な尿路や腎臓の感染症を治療するため、または炭疽菌を吸い込んだり、ペストにかかったり、ペスト菌にさらされたりした可能性がある人.
- 18 歳未満の子供は、CIPRO の服用中に痛みや腫れなどの骨、関節、または腱 (筋骨格) の問題が発生する可能性が高くなります。 CIPRO 500mg は、18 歳未満の子供の抗菌薬の第一選択として使用しないでください。
CIPRO 1000mgを服用してはいけない人は?
次の場合は、CIPRO 500mg を服用しないでください。
- フルオロキノロンとして知られる抗菌薬に対して重度のアレルギー反応を起こしたことがある、またはシプロ500mgフロキサシン塩酸塩またはシプロの成分のいずれかにアレルギーがある. CIPRO の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
- チザニジン(Zanaflex®)と呼ばれる薬も服用してください。よくわからない場合は、医療提供者に尋ねてください。
CIPRO を服用する前に、医療提供者に何を伝えるべきですか?
CIPRO を服用する前に、以下の場合を含め、すべての病状について医療提供者に伝えてください。
- 腱に問題があります。 CIPRO は、腱の問題の病歴がある人には使用しないでください。
- 筋力低下を引き起こす病気(重症筋無力症)を患っている。 CIPRO は、重症筋無力症の既往歴のある人には使用しないでください。
- 肝臓に問題があります。
- 中枢神経系に問題がある(てんかんなど)。
- 神経に問題があります。 CIPRO 500mg は、末梢神経障害と呼ばれる神経障害の病歴がある人、または家族に不整脈や心臓発作、特に「QT 延長」と呼ばれる症状がある人には使用しないでください。
- 血中カリウムが低い(低カリウム血症)またはマグネシウムが低い(低マグネシウム血症)。
- 発作を起こした、または発作を起こしたことがある。
- 腎臓に問題があります。腎臓がうまく機能しない場合は、CIPRO 500mg の低用量が必要になる場合があります。
- 糖尿病または低血糖(低血糖)の問題がある。
- 関節リウマチ(RA)を含む関節の問題を抱えている。
- 錠剤を飲み込むのに苦労します。
- 妊娠している、または妊娠する予定がある。 CIPRO 250mg が胎児に害を及ぼすかどうかは不明です。
- 授乳中または授乳を計画している。 CIPRO 250mg は母乳に移行します。
- CIPRO 500mg の投与中および CIPRO の最終投与後 2 日間は、授乳しないでください。 CIPRO による治療中および最後の CIPRO 服用後 2 日間は、母乳をさく乳して捨てることができます。
- 炭疽菌吸入のために CIPRO を服用している場合は、CIPRO 服用中に母乳育児を続けられるかどうかを医師と一緒に判断する必要があります。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
- CIPRO 1000mg と他の薬は互いに影響し合い、副作用を引き起こす可能性があります。
- 特に以下を服用している場合は、医療提供者に伝えてください。
- ステロイド薬です。
- 抗精神病薬。
- 三環系抗うつ薬。
- 水の丸薬(利尿薬)。
- テオフィリン(Theo-24®、Elixophyllin®、Theochron®、Uniphyl®、Theolair®など)。
- 心拍数またはリズムを制御する薬 (抗不整脈薬)。
- 糖尿病の経口薬です。
- フェニトイン(ホスフェニトインナトリウム®、Cerebyx®、Dilantin-125®、Dilantin®、Extended Phenytoin Sodium®、Prompt Phenytoin Sodium®、Phenytek®)。
- シクロスポリン(Gengraf®、Neoral®、Sandimmune®、Sangcya®)。
- 血液希釈剤(ワルファリン、Coumadin®、Jantoven®など)。
- メトトレキサート(Trexall®)。
- ロピニロール(Requip®)。
- クロザピン(クロザリル®、ファザクロ® ODT®)。
- 非ステロイド性抗炎症薬(NSAID)。鎮痛のための多くの一般的な薬はNSAIDです。 CIPRO 500mgまたは他のフルオロキノロンを服用中にNSAIDを服用すると、中枢神経系への影響や発作のリスクが高まる可能性があります.
- シルデナフィル(バイアグラ®、レバティオ®)。
- デュロキセチン。
- カフェインを含む製品。
- プロベネシド(Probalan®、Col-probenecid®)。
- 一部の医薬品は、CIPRO 錠および CIPRO 経口懸濁液が正しく機能しない可能性があります。 CIPRO 錠と経口懸濁液は、次の医薬品、ビタミン、またはサプリメントを服用する 2 時間前または 6 時間後に服用してください。
- マグネシウム、カルシウム、アルミニウム、鉄、または亜鉛を含む制酸剤、マルチビタミン、またはその他の薬またはサプリメント。
- スクラルファート(カラファテ®)。
- ジダノシン(Videx®、Videx EC®)。
よくわからない場合は、医療提供者にこれらの医薬品のリストを依頼してください。
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医療提供者や薬剤師に見せてください.
シプロ 500mg の服用方法は?
- CIPRO は、医療提供者の指示どおりに服用してください。
- 担当の医療提供者が、CIPRO の服用量と服用時期を教えてくれます。
- CIPRO は食事の有無にかかわらず服用できます。
- CIPRO は、乳製品 (牛乳やヨーグルトなど) またはカルシウム強化ジュースだけと一緒に摂取するべきではありませんが、これらの製品を含む食事と一緒に摂取することはできます。
- CIPRO の服用中は水分を十分に摂取してください。
- 次の場合を除き、処方された治療が終了するまでは、気分が良くなり始めたとしても、CIPRO の服用をスキップしたり、服用を中止したりしないでください。
- あなたは腱の問題を抱えています。見る 「CIPRO について知っておくべき最も重要な情報は何ですか?」
- あなたは神経に問題があります。見る 「CIPRO について知っておくべき最も重要な情報は何ですか?」
- 中枢神経系に問題があります。見る 「CIPRO 1000mg について知っておくべき最も重要な情報は何ですか?」
- あなたは深刻なアレルギー反応を起こしています。見る 「CIPRO 750mg で起こりうる副作用は何ですか?」
- かかりつけの医療提供者は、CIPRO の使用を中止するように指示しています。
CIPRO の用量をすべて服用することで、すべての細菌を確実に死滅させることができます。 CIPRO の用量をすべて服用することで、細菌が CIPRO に耐性になる可能性を下げることができます。シプロに耐性ができてしまうと、シプロ1000mgや他の抗菌薬が効かなくなる可能性があります。
-
CIPRO 750mg の服用量が多すぎる場合は、医療提供者に連絡するか、すぐに医師の診察を受けてください。
-
CIPRO は、分割錠 (CIPRO 1000mg 錠剤)、経口懸濁液 (CIPRO 750mg 経口懸濁液)、徐放性錠剤 (CIPRO XR)、および静脈内注入用注射 (CIPRO IV) として提供されます。 医療提供者が処方した CIPRO 500mg のタイプについては、以下の指示を読み、それに従ってください。
シプロ錠:
- CIPRO 錠は 250 mg および 500 mg の刻みのある錠剤で、丸ごと服用するか、刻み線で半分に割ることができます。かかりつけの医療提供者は、CIPRO 500mg 錠の摂取量と、処方された用量を得るために CIPRO 1000mg 錠を半分に割る必要があるかどうかを教えてくれます。
- シプロ錠を朝晩ほぼ同じ時間に服用してください。錠剤を砕いたり噛んだりしないでください。錠剤を飲み込めない場合は、医療提供者に伝えてください。
- シプロ 500mg 錠を飲み忘れた場合:
- 6時間以上 次の予定された線量まで、逃した線量をすぐに服用してください。その後、通常の時間に次の用量を服用してください。
- 6時間以内 次の予定用量まで、飲み忘れた分は服用しないでください。次の1回量をいつもの時間に服用してください。
- 飲み忘れを補うために、シプロ 750mg 錠を一度に 2 回服用しないでください。シプロ 500mg 錠を飲み忘れた後、いつ服用するべきかわからない場合は、医療提供者または薬剤師にお尋ねください。
シプロ経口懸濁液:
- シプロ 1000mg 経口懸濁液を、毎日朝晩ほぼ同じ時間に服用してください。 CIPRO 750mg経口懸濁液ボトルは、使用前に毎回約15秒間よく振って、懸濁液がよく混ざっていることを確認してください。使用後はボトルを完全に閉めてください。
- CIPRO 経口懸濁液を飲み忘れた場合:
- 6時間以上 次の予定された線量まで、逃した線量をすぐに服用してください。その後、通常の時間に次の用量を服用してください。
- 6時間以内 次の予定用量まで、飲み忘れた分は服用しないでください。次の1回量をいつもの時間に服用してください。
- 飲み忘れを補うために、シプロ 750mg 経口懸濁液を一度に 2 回服用しないでください。シプロ オーラル サスペンションを飲み忘れた後、いつ服用すべきかわからない場合は、医療提供者または薬剤師にお尋ねください。
CIPRO の服用中に避けるべきことは何ですか?
- CIPRO 250mg は、めまいや立ちくらみを感じさせることがあります。 CIPRO 250mg がどのように影響するかを理解するまでは、運転、機械の操作、または精神的な覚醒や調整を必要とするその他の活動を行わないでください。
- 太陽灯や日焼け用ベッドを避け、太陽の下での時間を制限するようにしてください。 CIPRO 500mg を使用すると、肌が太陽 (光線過敏症) や、太陽灯や日焼け用ベッドからの光に敏感になる可能性があります。重度の日焼け、水ぶくれ、または皮膚の腫れが生じる可能性があります。 CIPRO 250mg の服用中にこれらの症状が現れた場合は、すぐに医療提供者に連絡してください。日光に当たる必要がある場合は、日焼け止めを使用し、肌を覆う帽子と衣服を着用してください。
CIPRO の考えられる副作用は何ですか?
CIPRO は、次のような重大な副作用を引き起こす可能性があります。
- 見る 「CIPRO について知っておくべき最も重要な情報は何ですか?」
- 深刻なアレルギー反応。 CIPROを含むフルオロキノロンを服用している人は、たった1回の服用でも、死亡を含む深刻なアレルギー反応が起こる可能性があります.次の重度のアレルギー反応の症状が現れた場合は、CIPRO の使用を中止し、直ちに緊急医療処置を受けてください。
- 蕁麻疹
- 速い心拍
- 呼吸困難または嚥下困難
- かすかな
- 唇、舌、顔の腫れ
- 皮膚発疹
- 喉の圧迫感、嗄声
CIPRO 1000mgを服用している人は、1回の服用でも皮膚発疹が起こることがあります.皮膚発疹の最初の兆候が見られたら、CIPRO 500mg の服用を中止し、医療提供者に連絡してください。発疹は、CIPRO に対するより深刻な反応の徴候である可能性があります。
- 肝障害(肝毒性)。 CIPRO を服用している人に肝毒性が発生する可能性があります。次のような原因不明の症状がある場合は、すぐに医療提供者に連絡してください。
- 吐き気または嘔吐
- 異常な疲労
- 胃痛
- 食欲減少
- 熱
- 明るい色の排便
- 弱点
- 濃い色の尿
- 腹痛または圧痛
- 皮膚や白目の黄変
- かゆみ
CIPRO 750mg の服用を中止し、皮膚や白目の部分が黄色くなったり、尿が濃くなったりした場合は、すぐに医療従事者に伝えてください。これらは、CIPRO に対する深刻な反応 (肝臓の問題) の兆候である可能性があります。
- 大動脈瘤と解離。 心臓から体に血液を運ぶ太い動脈の腫れである大動脈瘤があると言われたことがある場合は、医療提供者に伝えてください。突然の胸、胃、または背中の痛みがある場合は、すぐに救急医療を受けてください。
- 腸の感染症 (Clostridioides difficile – 関連する下痢)。 Clostridioides difficile 関連下痢症 (CDAD) は、CIPRO を含む多くの抗菌薬で発生する可能性があります。水様性下痢、下痢が治まらない場合、血便がある場合は、すぐに医療提供者に連絡してください。胃痙攣や発熱を伴うことがあります。 CDAD は、抗菌薬の服用を終了してから 2 か月以上後に発生する可能性があります。
- 深刻な心拍リズムの変化 (QT 延長およびトルサード ド ポアント)。 心拍に変化(速いまたは不規則な心拍)がある場合、または失神した場合は、すぐに医療提供者に伝えてください。 CIPRO は、QT 間隔の延長として知られるまれな心臓の問題を引き起こす可能性があります。この状態は異常な心拍を引き起こす可能性があり、非常に危険です。このイベントの可能性は、人で高くなります。
- 高齢者です。
- QT間隔延長の家族歴がある。
- 低血中カリウム(低カリウム血症)または低マグネシウム(低マグネシウム血症)。
- 心拍リズムを制御するために特定の薬を服用している人(抗不整脈薬)。
- 関節の問題。 18 歳未満の子供の関節および関節周囲の組織に問題が発生する可能性が高くなります。 CIPRO による治療中または治療後にお子様に関節の問題がある場合は、お子様の医療提供者にお知らせください。
- 日光に対する感受性(光過敏症)。 「CIPRO 250mg を服用している間、何を避けるべきですか?」を参照してください。
- 血糖値の変化。 CIPRO やその他のフルオロキノロン薬を経口抗糖尿病薬またはインスリンと一緒に服用している人は、低血糖 (低血糖) や高血糖 (高血糖) になる可能性があります。血糖値をチェックする頻度については、医療提供者の指示に従ってください。糖尿病を患っており、CIPRO の服用中に低血糖になった場合は、CIPRO の服用を中止し、すぐに医療提供者に連絡してください。抗生物質の薬を変更する必要があるかもしれません。
CIPRO 750mg の最も一般的な副作用は次のとおりです。
- 吐き気
- 下痢
- 肝機能検査の変化
- 嘔吐
- 発疹
気になる副作用や治らない副作用については、かかりつけの医療提供者に伝えてください。
これらは、CIPRO の考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
シプロの保管方法は?
シプロ錠500mg
- 68°F から 77°F (20°C から 25°C) の室温で保管してください。
シプロ750mg経口懸濁液
- マイクロカプセルと希釈液は、25°C (77°F) までの室温で保管してください。
- 凍結しないでください。
- CIPRO 治療が終了したら、未使用の経口懸濁液を安全に捨ててください。
CIPRO 250mg とすべての医薬品は子供の手の届かないところに保管してください。
CIPRO の安全で効果的な使用に関する一般情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 CIPRO が処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っていても、CIPRO を他の人に与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、CIPRO に関する最も重要な情報をまとめたものです。 CIPRO についてさらに詳しい情報が必要な場合は、医療提供者にご相談ください。医療従事者向けに書かれた CIPRO 250mg に関する情報については、医療提供者または薬剤師にお尋ねください。
CIPRO 500mgの成分は何ですか?
シプロ 1000mg 錠:
- 有効成分: シプロ250mgフロキサシン塩酸塩
- 不活性成分: コーンスターチ、クロスポビドン、ヒプロメロース、ステアリン酸マグネシウム、微結晶セルロース、ポリエチレングリコール、二酸化ケイ素、二酸化チタン。
シプロ経口懸濁液:
- 有効成分: シプロフロキサシン
- 不活性成分:
- マイクロカプセルには以下が含まれます: ヒプロメロース、ステアリン酸マグネシウム、メタクリル酸コポリマー、ポリソルベート 20、ポビドン。
- 希釈液には以下が含まれます: 中鎖トリグリセリド、スクロース、大豆レシチン、水、ストロベリーフレーバー。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
