Levaquin 250mg, 500mg, 750mg Levofloxacin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
レバキン 750mg とは何ですか? どのように使用されますか?
レバキンは、さまざまな細菌感染症の症状を治療するために使用される処方薬です。レバキンは、単独で使用することも、他の薬と併用することもできます。
レバキン 500mg は、フルオロキノロンと呼ばれる薬物のクラスに属します。
Levaquin が 14 日間以上の治療期間中、小児に安全かつ有効であるかどうかはわかっていません。
レバキン 500mg の副作用の可能性は何ですか?
レバキン 750mg は、次のような重大な副作用を引き起こす可能性があります。
- 頭痛、
- 飢え、
- 発汗、
- 過敏症、
- めまい、
- 吐き気、
- 速い心拍数、
- 不安になったり、ふらふらしたり、
- 手、腕、脚、足のしびれやうずき、
- 腕、手、脚または足の衰弱、
- 腕、手、脚、または足の灼熱の痛み、
- 深刻な気分や行動の変化、
- 緊張感、
- 錯乱、
- 攪拌、
- パラノイア、
- 幻覚、
- メモリの問題、
- 集中するのが苦手、
- 自殺の考え、
- 腱断裂、
- 突然の痛み、
- 腫れ、
- あざ、
- 優しさ、
- 剛性、
- 動きの問題、
- 関節のどこかでパチパチという音、
- 激しい胃痛、
- 水様または血様の下痢、
- 胸の中でときめき、
- 呼吸困難、
- 皮膚発疹、
- 呼吸の問題、
- 発作(けいれん)、
- 激しい頭痛、
- 視力の問題、
- 目の奥の痛み、
- 上腹部の痛み、
- 食欲減少、
- 暗い尿、
- 粘土色の便、および
- 皮膚や目の黄変(黄疸)
上記の症状がある場合は、すぐに医療機関を受診してください。
レバキン 250mg の最も一般的な副作用は次のとおりです。
- 吐き気、
- 便秘、
- 下痢、
- 頭痛、
- めまい、および
- 寝られない
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Levaquin の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
腱炎、腱断裂、末梢神経障害、中枢神経系への影響および重症筋無力症の悪化を含む重篤な有害反応
- LEVAQUIN®を含むフルオロキノロン系薬剤は、以下を含む、身体を無効にする可能性のある不可逆的な重篤な副作用と関連しています[警告と注意事項を参照]。
- 腱炎および腱断裂 [警告と注意事項を参照]
- 末梢神経障害 [警告と注意事項を参照]
- 中枢神経系への影響 [警告と注意事項を参照]
これらの重篤な副作用を経験した患者では、LEVAQUIN® を直ちに中止し、LEVAQUIN® を含むフルオロキノロンの使用を避けてください [警告と注意事項を参照してください]。
- LEVAQUIN®を含むフルオロキノロン系薬剤は、重症筋無力症患者の筋力低下を悪化させる可能性があります。重症筋無力症の既往歴のある患者では LEVAQUIN® を避ける [参照 警告と注意事項 ]。
- LEVAQUIN®を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため[ 警告と注意事項 ]、次の適応症に対する代替治療選択肢がない患者への使用のために LEVAQUIN® を予約します。
- 合併症のない尿路感染症 [参照 適応症 ]
- 慢性気管支炎の急性細菌性増悪[参照 適応症 ]
- 急性細菌性副鼻腔炎 [参照 適応症 ]。
説明
LEVAQUIN® 錠は、経口投与用の合成抗菌剤です。化学的には、キラルフッ素化カルボキシキノロンであるレボフロキサシンは、ロキサシンのラセミ原薬の純粋な (-)-(S)-エナンチオマーです。化学名は (-)-(S)-9-フルオロ-2,3-ジヒドロ-3-メチル-10-(4-メチル-1-ピペラジニル)-7-オキソ-7H-ピリド[1,2, 3-de]-1,4-ベンゾオキサジン-6-カルボン酸半水和物。
図 1: レボフロキサシンの化学構造
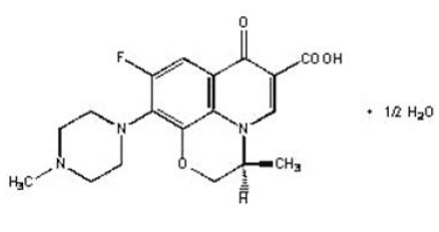
実験式はC18H20FN3O4・½H2Oで分子量は370.38です。レボフロキサシンは、淡黄白色から黄白色の結晶または結晶性粉末です。この分子は、小腸の pH 条件で両性イオンとして存在します。
データは、pH 0.6 から 5.8 まで、レボフロキサシンの溶解度が本質的に一定であることを示しています (約 100 mg/mL)。レボフロキサシンは、USP 命名法で定義されているように、この pH 範囲で可溶性から自由に溶けると考えられています。 pH 5.8 を超えると、溶解度は急速に増加し、pH 6.7 (272 mg/mL) で最大となり、この範囲では自由に溶解すると見なされます。 pH 6.7 を超えると、溶解度が低下し、pH 約 6.9 で最小値 (約 50 mg/mL) に達します。
レボフロキサシンは、多くの金属イオンと安定した配位化合物を形成する可能性があります。この in vitro キレート化ポテンシャルは、形成順序が次のとおりです: Al+3>Cu+2>Zn+2>Mg+2>Ca+2。
LEVAQUIN® 錠はフィルムコーティング錠として入手でき、次の不活性成分が含まれています。
- 250 mg (無水物として表示): クロスポビドン、ヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、ポリソルベート 80、合成酸化鉄、二酸化チタン。
- 500 mg (無水形態で表示): クロスポビドン、ヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、ポリソルベート 80、合成赤酸化鉄および黄酸化鉄、二酸化チタン。
- 750 mg (無水物として表示): クロスポビドン、ヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、ポリソルベート 80、二酸化チタン。
適応症
院内肺炎
LEVAQUIN® は、メチシリン感受性黄色ブドウ球菌、緑膿菌、セラチア菌、大腸菌、肺炎桿菌、インフルエンザ菌、または肺炎連鎖球菌による院内肺炎の成人患者の治療に適応されます。補助療法は、臨床的に必要な場合に使用する必要があります。緑膿菌が文書化された、または推定される病原体である場合、抗緑膿菌β-ラクタムとの併用療法が推奨されます[ 臨床研究 ]。
市中肺炎
7~14日間の治療レジメン
LEVAQUIN®は、メチシリン感受性黄色ブドウ球菌、肺炎球菌(多剤耐性肺炎連鎖球菌[MDRSP]を含む)、インフルエンザ菌、パラインフルエンザ菌、肺炎桿菌、カタラーリス菌による市中肺炎の成人患者の治療に適応されます。 、Chlamydophila pneumoniae、Legionella pneumophila、または Mycoplasma pneumoniae [参照 投薬と管理 と 臨床研究 ]。
MDRSP分離株は、ペニシリン(MIC≧2 mcg/mL)、セフロキシム、マクロライド、テトラサイクリン、トリメトプリム/スルファメトキサゾールなどの第2世代セファロスポリンの2つ以上に耐性のある分離株です。
市中肺炎
5日間の治療レジメン
LEVAQUIN®は、肺炎連鎖球菌(多剤耐性分離株[MDRSP]を除く)、インフルエンザ菌、パラインフルエンザ菌、マイコプラズマ・ニューモニエ、またはクラミドフィラ・ニューモニエによる市中肺炎の成人患者の治療に適応されます[参照 投薬と管理 と 臨床研究 ]。
複雑な皮膚および皮膚構造の感染症
LEVAQUIN® は、メチシリン感受性黄色ブドウ球菌、大便連鎖球菌、化膿連鎖球菌、またはミラビリス プロテウスによる複雑な皮膚および皮膚構造の感染症の治療のために、成人患者に適応されます。 臨床研究 ]。
合併症のない皮膚および皮膚構造の感染症
LEVAQUIN® は、メチシリン感受性黄色ブドウ球菌または化膿連鎖球菌による、膿瘍、蜂窩織炎、せつ、膿痂疹、膿皮症、創傷感染を含む合併症のない皮膚および皮膚構造感染症 (軽度から中等度) の治療のために成人患者に適応されます。
慢性細菌性前立腺炎
LEVAQUIN® は、大腸菌、腸球菌、またはメチシリン感受性表皮ブドウ球菌による慢性細菌性前立腺炎の成人患者の治療に適応されます。 臨床研究 ]。
吸入性炭疽菌(暴露後)
LEVAQUIN® は、成人および生後 6 か月以上の小児患者におけるエアロゾル化炭疽菌への曝露後の疾患の発生または進行を軽減するための吸入炭疽 (曝露後) に適応されます。 投薬と管理 ]。 LEVAQUIN®の有効性は、ヒトで達成された血漿濃度に基づいており、臨床的利益を予測する可能性が合理的に高い代替エンドポイントです。
LEVAQUIN® は、暴露後の吸入炭疽菌の予防について、ヒトで試験されていません。治療期間が 28 日を超える成人における LEVAQUIN® の安全性、または治療期間が 14 日を超える小児患者における LEVAQUIN® の安全性は研究されていません。長期にわたる LEVAQUIN® 療法は、利益がリスクを上回る場合にのみ使用する必要があります [参照 臨床研究 ]。
ペスト
LEVAQUIN® は、ペスト菌 (Y.pestis) による肺ペストおよび敗血症性ペストを含むペストの治療、および生後 6 か月以上の成人および小児患者におけるペストの予防 [参照 投薬と管理 ]。
LEVAQUIN®の有効性研究は、倫理的および実現可能性の理由から、ペストに罹患したヒトでは実施できませんでした。したがって、この適応症の承認は、動物で実施された有効性試験に基づいています[参照 臨床研究 ]。
複雑な尿路感染症
5日間の治療レジメン
LEVAQUIN®は、大腸菌、肺炎桿菌、またはプロテウス・ミラビリスによる複雑な尿路感染症の治療のために成人患者に適応されます[参照 臨床研究 ]。
複雑な尿路感染症
10日間の治療レジメン
LEVAQUIN® は、Enterococcus faecalis、Enterobacter cloacae、Escherichia coli、Klebsiella pneumoniae、Proteus mirabilis、または Pseudomonas aeruginosa [参照 臨床研究 ]。
急性腎盂腎炎
5日または10日間の治療レジメン
LEVAQUIN®は、菌血症を併発した症例を含む、大腸菌による急性腎盂腎炎の成人患者の治療に適応されます。 臨床研究 ]。
合併症のない尿路感染症
LEVAQUIN® は、大腸菌、肺炎桿菌、または黄色ブドウ球菌による合併症のない尿路感染症 (軽度から中等度) の成人患者の治療に適応されます。
LEVAQUIN® を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため [参照 警告と注意事項 また、一部の患者では合併症のない尿路感染症は自然治癒するため、代替治療の選択肢がない患者の合併症のない尿路感染症の治療のために LEVAQUIN® を予約してください。
慢性気管支炎の急性細菌性増悪
LEVAQUIN® は、メチシリン感受性黄色ブドウ球菌、肺炎連鎖球菌、インフルエンザ菌、パラインフルエンザ菌、またはモラクセラ・カタラーリスによる慢性気管支炎の急性細菌性増悪 (ABECB) の成人患者の治療に適応されます。
LEVAQUIN® を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため [参照 警告と注意事項 ] 一部の患者では、ABECB は自己制限的であり、代替治療オプションがない患者の ABECB の治療のために LEVAQUIN® を予約します。
急性細菌性副鼻腔炎
日間および 10 ~ 14 日間の治療レジメン
LEVAQUIN® は、肺炎球菌、インフルエンザ菌、またはモラクセラ・カタラーリスによる急性細菌性副鼻腔炎 (ABS) の治療のために成人患者に適応されます [参照 臨床研究 ]。
LEVAQUIN® を含むフルオロキノロン系薬剤は重篤な副作用と関連しているため [参照 警告と注意事項 一部の患者では ABS は自己制限的であり、代替治療の選択肢がない患者の ABS の治療のために LEVAQUIN® を予約してください。
使用法
薬剤耐性菌の発生を減らし、LEVAQUIN® およびその他の抗菌薬の有効性を維持するために、LEVAQUIN® は、感受性のある細菌によって引き起こされることが証明されているか、強く疑われる感染症の治療または予防にのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
培養および感受性試験
適切な培養および感受性試験は、感染の原因となる生物を分離および特定し、レボフロキサシンに対する感受性を決定するために、治療前に実施する必要があります。 微生物学 ]。 LEVAQUIN® による治療は、これらの検査の結果が判明する前に開始される場合があります。結果が得られたら、適切な治療法を選択する必要があります。
このクラスの他の薬剤と同様に、緑膿菌の一部の分離株は、LEVAQUIN® による治療中にかなり急速に耐性を獲得する可能性があります。治療中に定期的に実施される培養および感受性試験は、抗菌剤に対する病原体の継続的な感受性、および細菌耐性の出現の可能性に関する情報を提供します。
投薬と管理
クレアチニンクリアランスが 50 mL/分以上の成人患者における LEVAQUIN® 錠の投与量
LEVAQUIN® 錠の通常の投与量は、24 時間ごとに 250 mg、500 mg、または 750 mg を経口投与します。これは、感染によって示され、表 1 に記載されています。
これらの推奨事項は、クレアチニン クリアランスが 50 mL/分以上の患者に適用されます。クレアチニンクリアランスが 50 mL/min 未満の患者では、投与レジメンの調整が必要です [ 腎障害のある成人における用量調整 ]。
吸入炭疽またはペストの小児患者におけるLEVAQUIN®錠の投与量
体重 30 kg 以上の小児患者における吸入炭疽 (暴露後) およびペストに対する LEVAQUIN® 錠の投与量は、以下の表 2 に記載されています。利用可能な強度の。体重が 30 kg 未満の小児患者には、レボフロキサシンの代替製剤が考慮される場合があります。
腎障害のある成人における用量調整
腎機能障害のある患者には、LEVAQUIN® を慎重に投与してください。これらの患者ではレボフロキサシンの排出が減少する可能性があるため、治療前および治療中には、慎重な臨床観察と適切な臨床検査を実施する必要があります。
腎障害のある患者(クレアチニンクリアランスが 50 mL/min 未満)では、クリアランスの低下によるレボフロキサシンの蓄積を避けるために、投与計画の調整が必要です。 特定の集団での使用 ]。クレアチニンクリアランスが 50 mL/分以上の患者には調整は必要ありません。
表 3 は、クレアチニンクリアランスに基づいて用量を調整する方法を示しています。
キレート剤との薬物相互作用
制酸剤、スクラルファート、金属カチオン、マルチビタミン
LEVAQUIN® 錠は、マグネシウム、アルミニウム、スクラルファート、鉄などの金属陽イオン、および亜鉛またはジダノシンを含むマルチビタミン製剤を含む制酸剤または経口溶液用の小児用粉末の少なくとも 2 時間前または 2 時間後に投与する必要があります。 [見る 薬物相互作用 と 患者情報 ]。
管理手順
LEVAQUIN®錠は食事に関係なく服用できます。
LEVAQUIN® 錠を投与されている患者の水分補給
高濃度尿の形成を防ぐために、LEVAQUIN®を投与されている患者の十分な水分補給を維持する必要があります。結晶尿および円柱尿がキノロン系薬剤で報告されている[参照 有害反応 と 患者情報 ]。
供給方法
剤形と強度
錠剤、フィルムコーティング、カプセル形状
- 片面に「250」、もう片面に「LEVAQUIN」と刻印された250mgのテラコッタピンクの錠剤
- 片面に「500」、もう片面に「LEVAQUIN」と刻印された500mgの桃の錠剤
- 片面に「750」、片面に「LEVAQUIN」と刻印された750mgの白色の錠剤
保管と取り扱い
LEVAQUIN® 錠は、250、500、および 750 mg のカプセル型コーティング錠として提供されます。
レバキン®錠 次の構成でボトルにパッケージされています。
- 250mgの錠剤はテラコッタピンクで、片面に「LEVAQUIN®」、もう片面に「250」と刻印されています
- 50本のボトル( NDC 50458-920-50)
- 500mgの錠剤は桃色で、片面に「LEVAQUIN®」、もう片面に「500」と刻印されています
- 50本のボトル( NDC 50458-925-50)
- 750 mg の錠剤は白色で、片面に「LEVAQUIN®」、もう片面に「750」と刻印されています。
- 20本のボトル( NDC 50458-930-20)
LEVAQUIN® 錠剤は、密閉容器に入れ、15° ~ 30°C (59° ~ 86°F) で保管してください。
製造元:有効成分日本製。改訂: 2018 年 7 月
副作用
深刻な、またはその他の重要な副作用
次の重篤な、または重要な副作用については、ラベル表示の他のセクションで詳しく説明しています。
- 不可逆的で潜在的に不可逆的な重篤な有害反応 [参照 警告と注意事項 ]
- 腱炎および腱断裂 [参照 警告と注意事項 ]
- 末梢神経障害 [参照 警告と注意事項 ]
- 中枢神経系への影響 [参照 警告と注意事項 ]
- 重症筋無力症の悪化 [参照 警告と注意事項 ]
- その他の重篤でときに致命的な反応 [参照 警告と注意事項 ]
- 過敏反応 [参照 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- クロストリジウム・ディフィシル関連下痢[参照 警告と注意事項 ]
- QT間隔の延長[参照 警告と注意事項 ]
- 小児患者における筋骨格障害 [参照 警告と注意事項 ]
- 血糖障害 [参照 警告と注意事項 ]
- 光線過敏症・光毒性[参照 警告と注意事項 ]
- 薬剤耐性菌の開発 [参照 警告と注意事項 ]
結晶尿および円柱尿は、LEVAQUIN® を含むキノロン系薬剤で報告されています。したがって、高濃度尿の形成を防ぐために、LEVAQUIN® を投与されている患者の十分な水分補給を維持する必要があります。 投薬と管理 ]。
治験経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
下記のデータは、29 のプールされた第 3 相臨床試験における 7537 人の患者における LEVAQUIN® への曝露を反映しています。調査対象の集団の平均年齢は 50 歳 (人口の約 74% が 65 歳未満)、50% が男性、71% が白人、19% が黒人でした。患者は、さまざまな感染症に対してLEVAQUIN®で治療されました[参照 適応症 ]。患者は LEVAQUIN® 750 mg を 1 日 1 回、250 mg を 1 日 1 回、または 500 mg を 1 日 1 回または 2 回投与されました。
治療期間は通常 3 ~ 14 日で、平均治療日数は 10 日でした。
有害反応の全体的な発生率、種類、および分布は、LEVAQUIN® 750 mg 1 日 1 回、250 mg 1 日 1 回、および 500 mg 1 日 1 回または 2 回の投与を受けた患者で同様でした。
副作用による LEVAQUIN® の中止は、全体の患者の 4.3%、250 mg および 500 mg の用量で治療された患者の 3.8%、および 750 mg の用量で治療された患者の 5.4% で発生しました。 250 mg および 500 mg の用量で中止に至った最も一般的な副作用は胃腸 (1.4%) で、主に吐き気 (0.6%) でした。嘔吐 (0.4%);めまい(0.3%);および頭痛 (0.2%)。 750 mg の用量で中止に至った最も一般的な副作用は、胃腸 (1.2%)、主に吐き気 (0.6%)、嘔吐 (0.5%) でした。めまい(0.3%);および頭痛 (0.3%)。
LEVAQUIN® 治療を受けた患者の 1% 以上に発生する有害反応と、LEVAQUIN® 治療を受けた患者の 0.1 ~ 1% 未満に発生するあまり一般的ではない副作用を、それぞれ表 4 および表 5 に示します。最も一般的な副作用 (3% 以上) は、吐き気、頭痛、下痢、不眠症、便秘、およびめまいです。
複数回投与療法を使用した臨床試験では、LEVAQUIN® を含むキノロン剤による治療を受けている患者に、白内障や複数の点状水晶体混濁などの眼科的異常が認められています。これらの事象に対する薬物の関係は、現在確立されていません。
市販後の経験
表 6 に、承認後の LEVAQUIN® 使用中に確認された副作用を示します。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
薬物相互作用
キレート剤
制酸剤、スクラルファート、金属カチオン、マルチビタミン
二価陽イオンによるキレート化は他のフルオロキノロンよりも目立ちませんが、マグネシウムやアルミニウムを含む制酸剤、スクラルファート、鉄などの金属陽イオン、亜鉛を含むマルチビタミン製剤と LEVAQUIN® 錠を同時に投与すると、消化管吸収を妨げる可能性があります。レボフロキサシンの量が減少し、全身レベルが望ましいよりもかなり低くなります。マグネシウム、アルミニウム、スクラルファート、鉄などの金属カチオンを含む制酸剤を含む錠剤、および亜鉛またはジダノシンを含むマルチビタミン製剤は、レボフロキサシンの胃腸吸収を実質的に妨げ、全身レベルが望ましいよりもかなり低くなる可能性があります.これらの薬剤は、LEVAQUIN®の経口投与の少なくとも 2 時間前または 2 時間後に服用する必要があります。
ワルファリン
健康なボランティアを対象とした臨床研究では、R-およびS-ワルファリンのピーク血漿濃度、AUC、およびその他の体内動態パラメーターに対するLEVAQUIN®の有意な効果は検出されませんでした。同様に、レボフロキサシンの吸収および体内動態に対するワルファリンの明らかな影響は観察されませんでした。しかし、患者の市販後の経験において、LEVAQUIN®がワルファリンの効果を高めるという報告がありました。ワルファリンと LEVAQUIN® を同時に使用している環境でのプロトロンビン時間の上昇は、出血のエピソードと関連しています。 LEVAQUIN® をワルファリンと併用投与する場合は、プロトロンビン時間、国際正規化比 (INR)、またはその他の適切な抗凝固検査を注意深く監視する必要があります。患者はまた、出血の証拠を監視する必要があります[を参照してください。 有害反応 と 患者情報 ]。
糖尿病治療薬
高血糖症および低血糖症を含む血糖の障害は、フルオロキノロンおよび抗糖尿病薬を併用して治療された患者で報告されています。したがって、これらの薬剤を併用する場合は、血糖値を注意深くモニタリングすることが推奨されます [参照 警告と注意事項 、 有害反応 、 と 患者情報 ]。
非ステロイド性抗炎症薬
LEVAQUIN® を含むフルオロキノロンと非ステロイド性抗炎症薬の併用投与は、CNS 刺激および痙攣発作のリスクを高める可能性があります [参照 警告と注意事項 ]。
テオフィリン
健康なボランティアを対象とした臨床研究では、テオフィリンの血漿中濃度、AUC、およびその他の体内動態パラメーターに対する LEVAQUIN® の有意な影響は検出されませんでした。同様に、レボフロキサシンの吸収と体内動態に対するテオフィリンの明らかな影響は観察されませんでした。しかし、他のフルオロキノロンとテオフィリンの併用投与は、排泄半減期の延長、血清テオフィリン濃度の上昇、およびその後の患者集団におけるテオフィリン関連の有害反応のリスクの増加をもたらしました。したがって、LEVAQUIN® を併用投与する場合は、テオフィリン レベルを注意深く監視し、適切な用量調整を行う必要があります。発作を含む有害反応は、血清テオフィリン濃度の上昇の有無にかかわらず発生する可能性があります[参照 警告と注意事項 ]。
シクロスポリン
健康なボランティアを対象とした臨床研究では、シクロスポリンのピーク血漿濃度、AUC、およびその他の体内動態パラメーターに対する LEVAQUIN® の有意な効果は検出されませんでした。しかし、シクロスポリンの血清レベルの上昇が、他のフルオロキノロンと同時投与された患者集団で報告されています。レボフロキサシンの Cmax と ke はわずかに低く、Tmax と t1/2 はシクロスポリンの存在下で併用薬なしの他の研究で観察されたものよりもわずかに長かった。しかし、その違いは臨床的に重要であるとは考えられていません。したがって、LEVAQUIN®またはシクロスポリンを併用する場合、用量調整は必要ありません。
ジゴキシン
健康なボランティアを対象とした臨床研究では、ジゴキシンのピーク血漿濃度、AUC、およびその他の体内動態パラメーターに対する LEVAQUIN® の有意な効果は検出されませんでした。レボフロキサシンの吸収と体内動態は、ジゴキシンの存在下でも非存在下でも同様でした。したがって、併用投与する場合、LEVAQUIN®またはジゴキシンの用量調整は必要ありません。
プロベネシドとシメチジン
健康なボランティアを対象とした臨床試験では、レボフロキサシンの Cmax に対するプロベネシドまたはシメチジンの有意な影響は観察されませんでした。 LEVAQUIN(登録商標)単独と比較して、プロベネシドまたはシメチジンによるLEVAQUIN(登録商標)の同時治療中、レボフロキサシンのAUCおよびt1/2はより高く、CL/FおよびCLRはより低かった。ただし、これらの変更は、プロベネシドまたはシメチジンが併用投与されている場合、LEVAQUIN®の用量調整を保証するものではありません。
臨床検査または診断検査との相互作用
LEVAQUIN® を含む一部のフルオロキノロン系薬剤は、市販のイムノアッセイ キットを使用したアヘン剤の尿スクリーニング結果が偽陽性となる場合があります。より具体的な方法による陽性アヘン剤スクリーニングの確認が必要になる場合があります。
警告
の一部として含まれています "予防" セクション
予防
腱炎や腱断裂、末梢神経障害、中枢神経系への影響など、不可逆的で不可逆的な深刻な副作用
LEVAQUIN® を含むフルオロキノロンは、同じ患者で同時に発生する可能性がある、さまざまな身体システムからの不可逆的で潜在的に不可逆的な重篤な副作用に関連しています。一般的に見られる副作用には、腱炎、腱断裂、関節痛、筋肉痛、末梢神経障害、および中枢神経系への影響 (幻覚、不安、抑うつ、不眠、重度の頭痛、錯乱) などがあります。これらの反応は、LEVAQUIN® を開始してから数時間から数週間以内に発生する可能性があります。あらゆる年齢の、または既存の危険因子のない患者は、これらの有害反応を経験しています[ 腱炎および腱断裂、末梢神経障害、中枢神経系への影響 ]。
深刻な副作用の最初の徴候または症状が見られたら、直ちに LEVAQUIN® を中止してください。さらに、フルオロキノロンに関連するこれらの重篤な副作用のいずれかを経験した患者には、LEVAQUIN® を含むフルオロキノロンの使用を避けてください。
腱炎と腱断裂
LEVAQUIN® を含むフルオロキノロンは、すべての年齢層で腱炎および腱断裂のリスク増加と関連しています。 腱炎や腱断裂、末梢神経障害、中枢神経系への影響など、不可逆的で不可逆的な深刻な副作用 と 有害反応 ]。この有害反応は、アキレス腱に最も頻繁に関係し、回旋筋腱板 (肩)、手、上腕二頭筋、親指、およびその他の腱部位でも報告されています。腱炎または腱断裂は、LEVAQUIN®の開始から数時間または数日以内に、またはフルオロキノロン療法の完了後数か月にわたって発生する可能性があります。腱炎および腱断裂は、両側性に発生する可能性があります。
フルオロキノロン関連の腱炎および腱断裂を発症するリスクは、60 歳以上の患者、コルチコステロイド薬を服用している患者、および腎臓、心臓、または肺の移植を受けた患者で増加します。腱断裂のリスクを独立して増加させる可能性のあるその他の要因には、激しい身体活動、腎不全、および関節リウマチなどの以前の腱障害が含まれます.上記の危険因子を持たないフルオロキノロンを服用している患者では、腱炎および腱断裂が報告されています。患者が痛み、腫れ、炎症、または腱の断裂を経験した場合は、LEVAQUIN® を直ちに中止してください。患者は、腱炎または腱断裂の最初の兆候が見られたら安静にし、非キノロン系抗菌薬への変更について医療提供者に連絡するようにアドバイスする必要があります。腱障害または腱断裂の病歴がある患者では LEVAQUIN® を避ける [参照 有害反応 と 患者情報 ]。
末梢神経障害
LEVAQUIN® を含むフルオロキノロンは、末梢神経障害のリスク増加と関連しています。 LEVAQUIN® を含むフルオロキノロン系薬剤を投与されている患者において、知覚障害、知覚鈍麻、感覚異常および脱力をもたらす、小型および/または大型の軸索に影響を与える感覚または感覚運動性軸索多発神経障害の症例が報告されています。症状は、LEVAQUIN®の開始直後に発生する可能性があり、一部の患者では不可逆的である可能性があります [参照 腱炎や腱断裂、末梢神経障害、中枢神経系への影響など、不可逆的で不可逆的な深刻な副作用 と 有害反応 ]。
患者が痛み、灼熱感、うずき、しびれ、脱力感などの神経障害の症状、または軽い接触、痛み、温度、位置感覚、振動感覚などの感覚の変化を経験した場合は、LEVAQUIN® の使用を直ちに中止してください。以前に末梢神経障害を経験した患者では、LEVAQUIN® を含むフルオロキノロン系薬剤を避ける [参照 有害反応 と 患者情報 ]。
中枢神経系への影響
LEVAQUIN® を含むフルオロキノロン系薬剤は、痙攣、中毒性精神病、頭蓋内圧亢進 (偽脳腫瘍を含む) などの中枢神経系 (CNS) への影響のリスク増加と関連しています。フルオロキノロンはまた、振戦、落ち着きのなさ、不安、立ちくらみ、混乱、幻覚、パラノイア、うつ病、悪夢、および不眠症につながる可能性のある中枢神経系の刺激を引き起こす可能性があります.自殺念慮、および自殺未遂または自殺未遂も、特にうつ病の病歴またはうつ病の潜在的な危険因子を有する患者で発生する可能性があります。これらの反応は、最初の投与後に発生する可能性があります。これらの反応が LEVAQUIN® を投与されている患者に発生した場合は、LEVAQUIN® の使用を中止し、適切な措置を講じてください。他のフルオロキノロンと同様に、LEVAQUIN®は、発作の素因となる、または発作閾値を下げる可能性がある既知または疑われる中枢神経系 (CNS) 障害 (例えば、重度の脳動脈硬化症、てんかん) を有する患者、またはその存在下で使用する場合は注意して使用する必要があります。けいれんの素因となる、またはけいれんの閾値を下げる可能性のあるその他の危険因子(例、特定の薬物療法、腎機能障害)。 [見る 有害反応 、 薬物相互作用 、 と 患者情報 ]。
重症筋無力症の悪化
LEVAQUIN® を含むフルオロキノロン系薬剤には神経筋遮断作用があり、重症筋無力症患者の筋力低下を悪化させる可能性があります。重症筋無力症患者におけるフルオロキノロンの使用には、死亡や換気補助の必要性を含む市販後の重篤な副作用が関連しています。重症筋無力症の既往歴のある患者では LEVAQUIN® を避ける [参照 有害反応 と 患者情報 ]。
その他の深刻な、時には致命的な副作用
LEVAQUIN® を含むフルオロキノロンによる治療を受けている患者では、過敏症や不確実な病因によるその他の重篤で、時には致命的な副作用がまれに報告されています。これらの事象は重度である可能性があり、通常、複数回の投与後に発生します。臨床症状には、次の 1 つまたは複数が含まれる場合があります。
- 発熱、発疹、または重度の皮膚反応(例、中毒性表皮壊死融解症、スティーブンス・ジョンソン症候群);
- 血管炎;関節痛;筋肉痛;血清病;
- アレルギー性肺炎;
- 間質性腎炎;急性腎不全または腎不全;
- 肝炎;黄疸;急性肝壊死または肝不全;
- 溶血性および再生不良性を含む貧血;血栓性血小板減少性紫斑病を含む血小板減少症;白血球減少;無顆粒球症;汎血球減少;および/またはその他の血液学的異常。
皮膚の発疹、黄疸、またはその他の過敏症の徴候が最初に現れた場合は、直ちに LEVAQUIN® の使用を中止し、支持措置を講じてください [参照 有害反応 と 患者情報 ]。
過敏反応
LEVAQUIN® を含むフルオロキノロンによる治療を受けている患者では、重篤で時として致命的な過敏症および/またはアナフィラキシー反応が報告されています。これらの反応は、最初の服用後に起こることがよくあります。一部の反応には、心血管虚脱、低血圧/ショック、発作、意識喪失、うずき、血管性浮腫 (舌、喉頭、喉、または顔面の浮腫/腫れを含む)、気道閉塞 (気管支痙攣、息切れ、および急性呼吸器障害を含む) が伴います。苦痛)、呼吸困難、蕁麻疹、かゆみ、およびその他の深刻な皮膚反応。 LEVAQUIN® は、皮膚発疹またはその他の過敏症の徴候が最初に現れた時点で直ちに中止する必要があります。深刻な急性過敏症反応には、エピネフリンによる治療と、臨床的に必要とされる酸素、静脈内輸液、抗ヒスタミン薬、コルチコステロイド、昇圧アミン、および気道管理を含むその他の蘇生措置が必要になる場合があります[ 有害反応 と 患者情報 ]。
肝毒性
LEVAQUIN®で治療された患者について、重度の肝毒性(急性肝炎および致死的事象を含む)に関する市販後の報告が寄せられています。 7,000 人以上の患者を対象とした臨床試験では、重篤な薬物関連の肝毒性の証拠は検出されませんでした。重度の肝毒性は通常、治療開始から 14 日以内に発生し、ほとんどの場合は 6 日以内に発生しました。重度の肝毒性のほとんどの症例は、過敏症と関連していませんでした。 その他の深刻な、時には致命的な副作用 ]。
致命的な肝毒性の報告の大部分は 65 歳以上の患者で発生しており、そのほとんどは過敏症とは関連していませんでした。患者に肝炎の徴候や症状が現れた場合は、LEVAQUIN® を直ちに中止する必要があります。 有害反応 と 患者情報 ]。
クロストリジウム・ディフィシル関連下痢症
クロストリジウム・ディフィシル関連下痢症 (CDAD) は、LEVAQUIN® を含むほぼすべての抗菌剤の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗生物質の使用後に下痢を呈するすべての患者で、CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗生物質の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗生物質治療、および外科的評価を、臨床的に必要な場合に開始する必要があります [ 有害反応 と 患者情報 ]。
QT間隔の延長
LEVAQUIN® を含む一部のフルオロキノロンは、心電図での QT 間隔の延長およびまれな不整脈と関連しています。まれに、LEVAQUIN®を含むフルオロキノロン系薬剤を投与されている患者の市販後調査中に、トルサード ド ポワントの症例が自然発生的に報告されています。 LEVAQUIN®は、QT間隔の延長が判明している患者、低カリウム血症が改善されていない患者、およびクラスIA(キニジン、プロカインアミド)またはクラスIII(アミオダロン、ソタロール)の抗不整脈薬を投与されている患者では避けるべきです。高齢患者は、QT 間隔に対する薬物関連の影響を受けやすい可能性があります [参照 有害反応 、 特定の集団での使用 、 と 患者情報 ]。
小児患者の筋骨格障害と動物の関節障害の影響
LEVAQUIN® は、小児患者 (生後 6 か月以上) の吸入炭疽 (曝露後) およびペストの予防のみに適応となる [参照 適応症 ]。 LEVAQUIN®を投与された小児患者では、対照と比較して筋骨格障害(関節痛、関節炎、腱障害、および歩行異常)の発生率の増加が観察されています[参照 特定の集団での使用 ]。
未熟なラットとイヌでは、レボフロキサシンの経口および静脈内投与により、骨軟骨症が増加しました。レボフロキサシンを投与された未熟なイヌの体重負荷関節の組織病理学的検査により、軟骨の持続性病変が明らかになった。他のフルオロキノロンもまた、さまざまな種の未熟な動物の体重を支える関節に同様のびらんやその他の関節症の徴候を引き起こします。 動物薬理学 ]。
血糖障害
他のフルオロキノロンと同様に、症状を伴う高血糖および低血糖を含む血糖障害が LEVAQUIN® で報告されており、通常は経口血糖降下薬(グリブリドなど)またはインスリンによる併用治療を受けている糖尿病患者で報告されています。これらの患者では、血糖の注意深いモニタリングが推奨されます。 LEVAQUIN® による治療を受けている患者に低血糖反応が生じた場合、LEVAQUIN® の使用を中止し、適切な治療を直ちに開始する必要があります。 有害反応 、 薬物相互作用 と 患者情報 ]。
光線過敏症・光毒性
中等度から重度の光過敏性/光毒性反応。後者は、光にさらされた領域(典型的には顔、首の「V」領域)を含む過度の日焼け反応(例えば、灼熱感、紅斑、滲出液、水疱、水ぶくれ、浮腫)として現れることがある、前腕の伸筋表面、手の背など)は、日光または紫外線にさらされた後のフルオロキノロンの使用に関連している可能性があります。したがって、これらの光源への過度の露出は避ける必要があります。光過敏症/光毒性が発生した場合は、薬物療法を中止する必要があります[参照 有害反応 と 患者情報 ]。
薬剤耐性菌の開発
証明された、または強く疑われる細菌感染がない場合、または予防適応がない場合に LEVAQUIN® を処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌が発生するリスクが高まります。 患者情報 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
重篤な副作用
有害反応を経験した場合は、LEVAQUIN®の服用を中止し、別の抗菌薬による治療の全過程を完了するために医療提供者に連絡するよう患者にアドバイスしてください。
LEVAQUIN®または他のフルオロキノロンの使用に関連した以下の重篤な副作用について患者に知らせてください。
- 同時に発生する可能性のある無効化および潜在的に不可逆的な深刻な有害反応: LEVAQUIN®の使用に関連して、腱炎および腱断裂、末梢神経障害、および中枢神経系への影響を含む、身体に障害をもたらし、潜在的に不可逆的な重篤な副作用が発生し、同じ患者に同時に発生する可能性があることを患者に知らせてください。有害反応を経験した場合は、LEVAQUIN®の服用を直ちに中止し、医療提供者に連絡するよう患者に伝えてください。
- 腱炎および腱断裂: 患者に、腱の痛み、腫れ、炎症、または関節の衰弱または使用不能を経験した場合は、医療提供者に連絡するように指示します。休息し、運動を控えてください。 LEVAQUIN®治療を中止してください。症状は元に戻らない場合があります。フルオロキノロンによる重度の腱障害のリスクは、通常 60 歳以上の高齢の患者、コルチコステロイド薬を服用している患者、および腎臓、心臓、または肺の移植を受けた患者で高くなります。
- 末梢神経障害 : 末梢神経障害がレボフロキサシンの使用に関連していることを患者に知らせてください。症状は治療開始直後に発生し、元に戻せない可能性があります。痛み、灼熱感、ヒリヒリ感、しびれ、衰弱などの末梢神経障害の症状が現れた場合は、直ちに LEVAQUIN® の使用を中止し、医師に連絡するよう伝えてください。
- 中枢神経系への影響 (たとえば、けいれん、めまい、立ちくらみ、頭蓋内圧亢進): レボフロキサシンを含むフルオロキノロン系薬剤を投与されている患者でけいれんが報告されていることを患者に伝えます。けいれんの既往歴がある場合は、この薬を服用する前に医師に知らせるよう患者に指示してください。自動車や機械を操作する前、または精神的な覚醒と協調を必要とするその他の活動に従事する前に、LEVAQUIN®にどのように反応するかを知っておく必要があることを患者に伝えてください。かすみ目を伴うまたは伴わない持続性頭痛が発生した場合は、医師に連絡するよう患者に指示します。
- 重症筋無力症の悪化 : 重症筋無力症の病歴を医師に知らせるように患者に指示します。呼吸困難などの筋力低下の症状が見られた場合は、医師に知らせるよう患者に指示してください。
- 過敏反応 : レボフロキサシンは単回投与後でも過敏症反応を引き起こす可能性があることを患者に伝え、皮膚発疹、蕁麻疹またはその他の皮膚反応、急速な心拍、嚥下または呼吸困難、血管性浮腫を示唆する腫れの最初の兆候が見られたら、薬物の使用を中止してください (たとえば、唇、舌、顔の腫れ、喉の圧迫感、嗄声)、またはアレルギー反応の他の症状.
- 肝毒性: LEVAQUIN®を服用している患者で重度の肝毒性(急性肝炎や致死的事象を含む)が報告されていることを患者に知らせてください。食欲不振、吐き気、嘔吐、発熱、脱力感、疲労感、右上腹部の圧痛、かゆみ、皮膚や目の黄変、薄い色の排便など、肝障害の徴候や症状が見られた場合は、医師に知らせるよう患者に指示してください。または濃い色の尿。
- 下痢: 下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると終了します。抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.このような場合は、できるだけ早く医師に連絡するよう患者に指示してください。
- QT間隔の延長: 低カリウム血症、徐脈、または最近の心筋虚血などのQT延長または催不整脈状態の個人歴または家族歴を医師に知らせるように患者に指示します。クラス IA (キニジン、プロカインアミド)、またはクラス III (アミオダロン、ソタロール) の抗不整脈薬を服用している場合。動悸の長期化や意識喪失など、QT 間隔の延長の症状がある場合は、医師に知らせるように患者に指示してください。
- 小児患者の筋骨格障害: この薬を服用する前に、子供に関節関連の問題の病歴がある場合は、親に子供の医師に知らせるように指示してください。小児患者の親に、レボフロキサシン治療中または治療後に関節関連の問題が発生した場合は、子供の医師に知らせるように伝えてください [参照 警告と注意事項 と 特定の集団での使用 ]。
- 光過敏症/光毒性: フルオロキノロンを投与されている患者で光過敏症/光毒性が報告されていることを患者に知らせてください。フルオロキノロンを服用している間は、自然または人工の日光(日焼けベッドまたは UVA/B 治療)への曝露を最小限に抑えるか避けるように患者に伝えてください。フルオロキノロンを使用している間、患者が屋外にいる必要がある場合は、皮膚を日光から保護するゆったりした服を着るように指示し、他の日焼け防止対策について医師と相談してください。日焼けのような反応や皮膚の発疹が生じた場合は、医師に連絡するよう患者に指示してください。
抗菌耐性
LEVAQUIN® を含む抗菌薬は、細菌感染症の治療にのみ使用してください。ウイルス感染症(風邪など)は治療しません。細菌感染を治療するために LEVAQUIN® が処方される場合、患者は、治療過程の早い段階で気分が良くなるのが一般的ですが、指示どおりに薬を服用する必要があることを伝えなければなりません。投与をスキップしたり、治療を完全に完了しなかったりすると、(1) 即時治療の有効性が低下し、(2) 細菌が耐性を獲得し、将来的に LEVAQUIN® または他の抗菌薬で治療できなくなる可能性が高くなる可能性があります。
食物、液体、および併用薬による投与
LEVAQUIN® 錠は食事の有無にかかわらず服用できることを患者に知らせる必要があります。錠剤は毎日同じ時間に服用する必要があります。
高濃度尿の形成および尿中の結晶形成を避けるために、患者は LEVAQUIN® を服用している間は自由に水分を摂取する必要があります。
マグネシウムまたはアルミニウムを含む制酸剤、スクラルファート、鉄などの金属陽イオン、および亜鉛またはジダノシンを含むマルチビタミン製剤は、経口 LEVAQUIN® 投与の少なくとも 2 時間前または 2 時間後に服用する必要があります。
インスリン、経口血糖降下薬、ワルファリンとの薬物相互作用
糖尿病患者で、インスリンまたは経口血糖降下薬による治療を受けているときに血糖降下反応が生じた場合は、LEVAQUIN®の使用を中止し、医師に相談する必要があることを患者に説明する必要があります。
患者には、ワルファリンと LEVAQUIN® の同時投与が、国際標準化比 (INR) またはプロトロンビン時間の増加および出血の臨床エピソードと関連していることを知らされるべきです。患者は、ワルファリンを服用している場合は医師に通知し、出血の証拠を監視し、ワルファリンを併用している間は抗凝固検査を綿密に監視する必要があります.
ペストと炭疽菌研究
これらの状態で LEVAQUIN® を投与された患者には、倫理的および実現可能性の理由から、ヒトでの有効性試験を実施できないことを通知する必要があります。したがって、これらの条件の承認は、動物で実施された有効性研究に基づいていました。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
ラットの生涯バイオアッセイでは、レボフロキサシンは 2 年間の毎日の食事投与後に発がん性の可能性を示さなかった。最高用量 (100 mg/kg/日) は、相対的な体表面積に基づくヒトの最高推奨用量 (750 mg) の 1.4 倍でした。レボフロキサシンは、どのレボフロキサシン用量レベルでも無毛アルビノ (Skh-1) マウスの UV 誘発皮膚腫瘍の腫瘍発生までの時間を短縮しなかったため、この研究の条件下では光発がん性はありませんでした。ヘアレス マウスの皮膚レボフロキサシン濃度は、光発がん性試験で使用されたレボフロキサシンの最高用量レベル (300 mg/kg/日) で 25 ~ 42 mcg/g の範囲でした。比較すると、750 mg の LEVAQUIN® を投与されたヒト被験者の皮膚レボフロキサシン濃度は、Cmax で平均約 11.8 mcg/g でした。
レボフロキサシンは、次のアッセイで変異原性を示さなかった: Ames 細菌変異アッセイ (S. typhimurium および E. coli)、CHO/HGPRT 前方変異アッセイ、マウス小核試験、マウス優性致死試験、ラット不定期 DNA 合成アッセイ、およびマウス姉妹染色分体。交換アッセイ。これは、in vitro 染色体異常 (CHL 細胞株) および姉妹染色分体交換 (CHL/IU 細胞株) アッセイで陽性でした。
レボフロキサシンは、360 mg/kg/日の経口用量でラットの受胎能または生殖能力の障害を引き起こさなかった.これは、相対的な体表面積に基づくヒトの最高推奨用量の 1.2 倍に相当します。
特定の集団での使用
妊娠
妊娠カテゴリーC
レボフロキサシンは、810 mg/kg/日の高用量でラットにおいて催奇形性を示さなかった.ラットへの 810 mg/kg/日の経口投与により、胎児の体重が減少し、胎児の死亡率が増加した。相対体表面積に基づいて推奨されるヒトの最高経口用量の 1.1 倍に相当する 50 mg/kg/日という高用量をウサギに経口投与した場合、催奇形性は観察されませんでした。
しかし、妊娠中の女性を対象とした十分に管理された研究はありません。潜在的な利点が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に LEVAQUIN® を使用する必要があります。
授乳中の母親
他のフルオロキノロンに関するデータと LEVAQUIN® に関する非常に限られたデータに基づいて、レボフロキサシンは母乳中に排泄されると推測できます。授乳中の乳児に対する LEVAQUIN® による重篤な副作用の可能性があるため、母親にとっての薬の重要性を考慮して、授乳を中止するか薬を中止するかを決定する必要があります。
小児用
レボフロキサシンを含むキノロン系薬剤は、いくつかの種の幼若動物に関節症および骨軟骨症を引き起こします。 [見る 警告と注意事項 と 動物薬理学 ]。
吸入性炭疽菌(暴露後)
レボフロキサシンは、生後 6 か月以上の小児患者の吸入炭疽 (暴露後) に適応となります。リスクベネフィット評価は、小児患者へのレボフロキサシンの投与が適切であることを示しています。 14日以上治療を受けた小児患者におけるレボフロキサシンの安全性は研究されていない[参照 適応症 、 投薬と管理 と 臨床研究 ]。
ペスト
レボフロキサシンは、生後 6 か月以上の小児患者に、ペスト菌 (Y.pestis) による肺炎および敗血症性ペストを含むペストの治療およびペストの予防に適応されます。 LEVAQUIN®の有効性研究は、倫理的および実現可能性の理由から、肺ペストのヒトで実施できませんでした。したがって、この適応の承認は、動物で実施された有効性試験に基づいています。リスクベネフィット評価は、小児患者へのレボフロキサシンの投与が適切であることを示している[参照 適応症 、 投薬と管理 と 臨床研究 ]。
生後6か月未満の小児患者におけるLEVAQUIN®の安全性と有効性は確立されていません。
静脈内投与後の薬物動態
単回静脈内投与後のレボフロキサシンの薬物動態が、生後 6 か月から 16 歳までの範囲の小児患者で調査されました。小児患者は成人患者よりも早くレボフロキサシンを除去した結果、一定の mg/kg 用量で成人よりも血漿曝露量が低くなりました [参照 臨床薬理学 と 臨床研究 ]。
吸入炭疽またはペストの小児患者における投与量
吸入性炭疽またはペストの小児患者における LEVAQUIN® 錠剤の推奨用量については、以下を参照してください。 投薬と管理 . LEVAQUIN® 錠は、使用可能な強度に制限があるため、体重が 30 kg 未満の小児患者には投与できません。体重が 30 kg 未満の小児患者には、レボフロキサシンの代替製剤が考慮される場合があります。
有害反応
臨床試験では、1534 人の小児患者 (生後 6 か月から 16 歳まで) が経口および静脈内投与の LEVAQUIN® で治療されました。生後 6 か月から 5 歳の小児患者には LEVAQUIN® 10 mg/kg を 1 日 2 回、5 歳以上の小児患者には 10 mg/kg を 1 日 1 回(1 日最大 500 mg)約 10 日間投与しました。 LEVAQUIN® 錠は、利用可能な強度の制限により、30 kg 以上の吸入性炭疽 (曝露後) またはペストの小児患者にのみ投与できます [ 投薬と管理 ]。
臨床試験に参加した小児患者のサブセット (1340 人の LEVAQUIN® 治療および 893 人の非フルオロキノロン治療) は、プロトコールで定義された筋骨格障害 (関節痛、関節炎、腱障害、歩行異常) の発生率を評価するための前向き長期調査に登録されました。 ) 治験薬の初回投与後 60 日と 1 年間。表 7 に示すように、LEVAQUIN® で治療された小児患者は、フルオロキノロンで治療されていない小児と比較して、筋骨格障害の発生率が有意に高かった.利用可能な強度の制限により、30kg以上の人[参照 投薬と管理 ]。
関節痛は、両方の治療群で最も頻繁に発生する筋骨格障害でした。両方のグループの筋骨格障害のほとんどは、複数の体重負荷関節に関係していました。障害は 8/46 (17%) の小児で中等度であり、35/46 (76%) の LEVAQUIN® 治療を受けた小児患者で軽度であり、ほとんどが鎮痛剤で治療されました。回復までの時間の中央値は、LEVAQUIN® で治療された小児患者で 7 日、非フルオロキノロンで治療された子供で 9 日でした (両方のグループで 2 か月以内に約 80% が回復しました)。重度または重篤な障害を有する小児患者はおらず、すべての筋骨格障害は後遺症なしに解決しました。
嘔吐と下痢が最も頻繁に報告された有害反応であり、LEVAQUIN® で治療された小児患者とフルオロキノロンで治療されていない小児患者で同様の頻度で発生しました。
臨床試験において小児患者で報告された副作用に加えて、臨床試験中または市販後の経験において成人で報告された副作用[参照 有害反応 は、小児患者にも発生することが予想されます。
高齢者の使用
高齢患者は、LEVAQUIN® などのフルオロキノロンで治療されている場合、腱断裂を含む重度の腱障害を発症するリスクが高くなります。このリスクは、コルチコステロイド療法を併用している患者ではさらに増加します。腱炎または腱断裂は、アキレス腱、手、肩、または他の腱部位に関与する可能性があり、治療中または治療終了後に発生する可能性があります。フルオロキノロン治療後数ヶ月までに発生した症例が報告されています。特にコルチコステロイドを服用している高齢患者に LEVAQUIN® を処方する場合は注意が必要です。患者は、この潜在的な副作用について知らされ、腱炎または腱断裂の症状が発生した場合は、LEVAQUIN® の使用を中止し、医療提供者に連絡するようにアドバイスされるべきです [参照 ボックス警告 ; 警告と注意事項 ;と 有害反応 ]。
第 3 相臨床試験では、1,945 人の LEVAQUIN® 治療患者 (26%) が 65 歳以上でした。これらのうち、1,081 人の患者 (14%) は 65 ~ 74 歳で、864 人の患者 (12%) は 75 歳以上でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されませんでしたが、一部の高齢者の感度が高いことは除外できません.
LEVAQUIN® に関連して、重度の、時には致命的な肝毒性の症例が市販後に報告されています。致命的な肝毒性の報告の大部分は 65 歳以上の患者で発生しており、そのほとんどは過敏症とは関連していませんでした。患者に肝炎の徴候や症状が現れた場合は、LEVAQUIN® を直ちに中止する必要があります。 警告と注意事項 ]。
高齢患者は、QT 間隔に対する薬物関連の影響を受けやすい可能性があります。したがって、LEVAQUIN®を QT 間隔の延長をもたらす可能性のある併用薬(クラス IA またはクラス III の抗不整脈薬など)と併用する場合、またはトルサード ド ポワントの危険因子(既知の QT 延長、未修正など)を有する患者に使用する場合は注意が必要です。低カリウム血症)[参照 警告と注意事項 ]。
クレアチニンクリアランスを考慮すると、若年成人と高齢者のレボフロキサシンの薬物動態特性に大きな違いはありません。しかし、この薬は腎臓から実質的に排泄されることが知られているため、腎機能が低下している患者では、この薬に対する毒性反応のリスクが高くなる可能性があります。高齢患者は腎機能が低下している可能性が高いため、用量の選択には注意が必要であり、腎機能のモニタリングが有用な場合があります [参照 臨床薬理学 ]。
腎障害
レボフロキサシンのクリアランスは大幅に減少し、血漿排出半減期は腎機能障害のある患者 (クレアチニンクリアランス 投薬と管理 ]。
肝障害
肝機能障害のある患者における薬物動態研究は実施されていません。レボフロキサシン代謝の範囲が限られているため、レボフロキサシンの薬物動態は肝障害の影響を受けないと予想されます。
過剰摂取
急性の過剰摂取の場合は、胃を空にする必要があります。患者を観察し、適切な水分補給を維持する必要があります。レボフロキサシンは、血液透析または腹膜透析では効率的に除去されません。
LEVAQUIN® の急性毒性の可能性は低いです。マウス、ラット、イヌ、サルは、単回高用量の LEVAQUIN® を投与された後、運動失調、眼瞼下垂、自発運動の低下、呼吸困難、衰弱、震え、痙攣などの臨床症状を示しました。 1500 mg/kg を超える経口投与と 250 mg/kg IV を超える投与量は、齧歯動物に有意な死亡率をもたらしました。
禁忌
LEVAQUIN® は、レボフロキサシンまたは他のキノロン系抗菌薬に対する過敏症が知られている人には禁忌です [ 警告と注意事項 ]。
臨床薬理学
作用機序
レボフロキサシンは、抗菌剤のフルオロキノロン系のメンバーです [ 微生物学を参照 ]。
薬物動態
経口錠剤の投与後の単一および定常状態条件下で決定されたレボフロキサシンの平均±SD薬物動態パラメータを表8に要約する。
レボフロキサシンの薬物動態は、単回および複数回の経口または IV 投与レジメン後に直線的で予測可能です。 500 mg または 750 mg を 1 日 1 回投与すると、48 時間以内に定常状態に達します。複数回の 1 日 1 回の経口投与レジメン後に得られた平均±標準偏差のピークおよびトラフ血漿濃度は、500 mg 投与後では約 5.7 ± 1.4 および 0.5 ± 0.2 mcg/mL、750 mg 投与後では 8.6 ± 1.9 および 1.1 ± 0.4 mcg/mL でした。 mg用量、それぞれ。複数回の 1 日 1 回の IV レジメン後に得られた平均 ± SD のピークおよびトラフ血漿濃度は、500 mg 投与後では約 6.4 ± 0.8 および 0.6 ± 0.2 mcg/mL、750 mg 投与後では 12.1 ± 4.1 および 1.3 ± 0.71 mcg/mL でした。用量、それぞれ。
吸収
レボフロキサシンは、経口投与後、迅速かつ本質的に完全に吸収されます。通常、経口投与後 1 ~ 2 時間で最高血漿中濃度に達します。 LEVAQUIN® の 500 mg 錠剤および 750 mg 錠剤からのレボフロキサシンの絶対バイオアベイラビリティは両方とも約 99% であり、レボフロキサシンの完全な経口吸収を示しています。健康なボランティアに LEVAQUIN® を単回静脈内投与した後、達成された平均 ± SD ピーク血漿濃度は、500 mg の用量を 60 分かけて注入した後に 6.2 ± 1.0 mcg/mL、750 mg の用量を注入した後に 11.5 ± 4.0 mcg/mL でした。 90分。 500 mg の LEVAQUIN® を食事と一緒に経口投与すると、ピーク濃度までの時間が約 1 時間延長され、錠剤の場合はピーク濃度が約 14%、経口溶液の場合は約 25% 低下します。そのため、LEVAQUIN®錠は食事に関係なく服用することができます。
IV 投与後のレボフロキサシンの血漿中濃度プロファイルは、同等の用量 (mg/mg) を投与した場合に LEVAQUIN® 錠で観察された曝露量 (AUC) と同様であり、匹敵します。したがって、経口投与経路と IV 投与経路は互換性があると見なすことができます。
分布
レボフロキサシンの分布の平均体積は、通常、500 mg または 750 mg の単回および複数回の投与後に 74 ~ 112 L の範囲であり、体組織への広範な分布を示しています。レボフロキサシンは、投与後約 3 時間で、健常者の皮膚組織および水疱液中のレベルがピークに達します。健康な被験者に LEVAQUIN® 750 mg および 500 mg を 1 日 1 回複数回経口投与した後の皮膚組織生検と血漿の AUC 比は約 2 であり、水疱液と血漿の AUC 比は約 1 です。レボフロキサシンは、肺組織にもよく浸透します。肺組織濃度は一般に血漿中濃度の 2 ~ 5 倍高く、500 mg の単回経口投与後 24 時間で約 2.4 ~ 11.3 mcg/g の範囲でした。
in vitro では、血清/血漿レボフロキサシン濃度の臨床的に関連する範囲 (1 ~ 10 mcg/mL) にわたって、レボフロキサシンは、平衡透析法によって決定されるように、研究されたすべての種にわたって血清タンパク質に約 24 ~ 38% 結合しています。レボフロキサシンは、主にヒトの血清アルブミンに結合します。血清タンパク質へのレボフロキサシンの結合は、薬物濃度とは無関係です。
排除
代謝
レボフロキサシンは、血漿および尿中で立体化学的に安定しており、代謝的にそのエナンチオマーである D-オフロキサシンに反転しません。レボフロキサシンはヒトでは限られた代謝しか受けず、主に未変化の薬物として尿中に排泄されます。経口投与後、投与量の約 87% が 48 時間以内に未変化の薬物として尿中に回収されましたが、72 時間で糞便中に回収されたのは投与量の 4% 未満でした。投与量の 5% 未満が、ヒトで同定された唯一の代謝物である脱メチルおよび N-オキシド代謝物として尿中に回収されました。これらの代謝産物には、関連する薬理活性はほとんどありません。
排泄
レボフロキサシンは、大部分が未変化の薬物として尿中に排泄されます。レボフロキサシンの平均最終血漿排出半減期は、経口または静脈内投与されたレボフロキサシンの単回または複数回投与後、約 6 ~ 8 時間の範囲です。平均見かけの全身クリアランスおよび腎クリアランスは、それぞれ約 144 ~ 226 mL/min および 96 ~ 142 mL/min の範囲です。糸球体濾過速度を超える腎クリアランスは、糸球体濾過に加えて、レボフロキサシンの尿細管分泌が起こることを示唆しています。シメチジンまたはプロベネシドのいずれかを併用投与すると、レボフロキサシンの腎クリアランスがそれぞれ約 24% および 35% 減少し、レボフロキサシンの分泌が腎近位尿細管で起こることが示されます。 LEVAQUIN® を投与された被験者から新たに採取された尿サンプルのいずれにも、レボフロキサシンの結晶は検出されませんでした。
特定の集団
高齢患者
若年者と高齢者の間でレボフロキサシンの薬物動態に有意差はありません。クレアチニンクリアランスの違いが考慮されます。健康な高齢者 (66 ~ 80 歳) に LEVAQUIN® 500 mg を経口投与した後、レボフロキサシンの平均終末血漿排出半減期は、若年成人の約 6 時間と比較して、約 7.6 時間でした。この差は、被験者の腎機能状態の違いによるものであり、臨床的に有意であるとは考えられませんでした。薬物の吸収は年齢による影響を受けないようです。年齢だけに基づいた LEVAQUIN® の用量調整は必要ありません [参照 特定の集団での使用 ]。
小児患者
単回 7 mg/kg 静脈内投与後のレボフロキサシンの薬物動態が、6 か月から 16 歳までの年齢の範囲の小児患者で調査されました。小児患者は、レボフロキサシンを成人患者よりも早く除去し、その結果、一定の mg/kg 用量で成人よりも血漿曝露量が低くなりました。その後の薬物動態分析では、生後 6 か月から 17 歳までの小児患者に対して 12 時間ごとに 8 mg/kg の投与計画 (1 回の投与で 250 mg を超えないこと) により、同等の定常状態の血漿曝露 (AUC0-24 および Cmax ) が達成されることが予測されました。レボフロキサシン 500 mg を 24 時間ごとに投与された成人患者で観察されたもの。 LEVAQUIN® 錠は、利用可能な強度の制限により、30 kg 以上の吸入性炭疽 (曝露後) またはペストの小児患者にのみ投与できます [ 投薬と管理 ]。
男性と女性の被験者
レボフロキサシンの薬物動態には、男性と女性の被験者の間で有意差はありません。クレアチニンクリアランスの違いが考慮されます。健康な男性被験者に LEVAQUIN® 500 mg を経口投与した後、レボフロキサシンの平均終末血漿排出半減期は、女性被験者の約 6.1 時間と比較して、約 7.5 時間でした。この違いは、男性と女性の被験者の腎機能状態の違いに起因するものであり、臨床的に重要であるとは考えられていませんでした。薬物の吸収は被験者の性別による影響を受けないようです。性別だけで用量を調整する必要はありません。
人種または民族グループ
レボフロキサシンの薬物動態に対する人種の影響は、72 人の被験者 (白人 48 人、非白人 24 人) からのデータに対して実行された共変量分析によって調べられました。見かけの全身クリアランスと見かけの分布容積は、被験者の人種による影響を受けませんでした。
腎障害のある患者
レボフロキサシンのクリアランスは大幅に減少し、血漿排出半減期は腎機能障害のある成人患者 (クレアチニンクリアランス 投薬と管理 と 特定の集団での使用 ]。
肝障害のある患者
肝障害患者における薬物動態研究は実施されていません。レボフロキサシン代謝の範囲が限られているため、レボフロキサシンの薬物動態は肝障害の影響を受けないと予想される[ 特定の集団での使用 ]。
細菌感染症の患者
深刻な市中感染細菌感染症患者におけるレボフロキサシンの薬物動態は、健康な被験者で観察されるものに匹敵します。
薬物相互作用研究
LEVAQUIN® と制酸剤、ワルファリン、テオフィリン、シクロスポリン、ジゴキシン、プロベネシド、およびシメチジンとの間の薬物動態学的薬物相互作用の可能性が評価されています [ 薬物相互作用 ]。
微生物学
作用機序
レボフロキサシンは、キノロン系抗菌剤であるオフロキサシンのラセミ体の L 異性体です。オフロキサシンの抗菌活性は、主に L 異性体に存在します。レボフロキサシンおよび他のフルオロキノロン系抗菌薬の作用機序には、細菌のトポイソメラーゼ IV および DNA ジャイレース (どちらも II 型トポイソメラーゼ)、DNA の複製、転写、修復、および組換えに必要な酵素の阻害が含まれます。
抵抗
フルオロキノロン耐性は、キノロン耐性決定領域 (QRDR) と呼ばれる DNA ジャイレースまたはトポイソメラーゼ IV の定義された領域の変異、または流出の変化によって生じる可能性があります。
レボフロキサシンを含むフルオロキノロンは、アミノグリコシド、マクロライド、およびペニシリンを含むβ-ラクタム系抗生物質とは化学構造および作用機序が異なります。したがって、フルオロキノロンは、これらの抗菌剤に耐性のある細菌に対して有効である可能性があります。
in vitro での自然突然変異によるレボフロキサシン耐性はまれです (範囲: 10-9 から 10-10)。レボフロキサシンと一部の他のフルオロキノロンとの間に交差耐性が観察されており、他のフルオロキノロンに耐性のある一部の微生物はレボフロキサシンに感受性がある可能性があります。
抗菌活性
レボフロキサシンは、グラム陰性菌およびグラム陽性菌に対して in vitro 活性を示します。
レボフロキサシンは、in vitro および臨床感染症の両方で、次の細菌のほとんどの分離株に対して活性であることが示されています。 適応症 :
好気性細菌
グラム陽性菌
Enterococcus faecalisStaphylococcus aureus (メチシリン感受性分離株)Staphylococcus epidermidis (メチシリン感受性分離株)Staphylococcus saprophyticus Streptococcus pneumoniae (多剤耐性分離株 [MDRSP]1 を含む)Streptococcus pyogenes
グラム陰性菌
エンテロバクター・クロアカエエシェリヒア・コリインフルエンザ菌ヘモフィルス・パラインフルエンザ肺炎桿菌レジオネラ・ニューモフィラモラクセラ・カタラーリスプロテウス・ミラビリス緑膿菌セラチア・マルセッセンス
その他の微生物
クラミドフィラ・ニューモニエマイコプラズマ・ニューモニエ
以下の in vitro データが入手可能ですが、それらの臨床的意義は不明です。しかし、これらの細菌による臨床感染症の治療におけるLEVAQUIN®の安全性と有効性は、十分に管理された臨床試験では確立されていません。
MDRSP (多剤耐性肺炎連鎖球菌) 分離株は、次の抗生物質の 2 つ以上に耐性を持つ分離株です。マクロライド、テトラサイクリン、トリメトプリム/スルファメトキサゾール。
好気性細菌
グラム陽性菌
Staphylococcus haemolyticusβ-溶血性連鎖球菌 (グループ C/F)β-溶血性連鎖球菌 (グループ G)Streptococcus agalactiaeStreptococcus milleriViridans グループ連鎖球菌Bacillus anthracis
グラム陰性菌
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteus vulgarisProvidencia rettgeriProvidencia stuartiiPseudomonas fluorescensYersiniapestis
嫌気性細菌
グラム陽性菌
ウェルシュ菌
感受性試験
感受性試験の解釈基準、関連する試験方法、およびこの薬剤について FDA が承認した品質管理基準に関する具体的な情報については、以下を参照してください。 https://www.fda.gov/STIC.
動物毒物学および/または薬理学
レボフロキサシンおよび他のキノロンは、試験されたほとんどの種の未熟な動物に関節症を引き起こすことが示されている[参照 警告と注意事項 ]。未熟なイヌ(生後 4 ~ 5 か月)では、レボフロキサシンを 10 mg/kg/日で 7 日間経口投与し、4 mg/kg/日で 14 日間静脈内投与すると、関節障害が生じた。 300 mg/kg/日の経口用量で 7 日間投与し、60 mg/kg/日の静脈内用量で 4 週間投与すると、若年ラットに関節症が生じました。 40 mg/kg/日のレボフロキサシンを経口投与された生後 3 か月のビーグル犬は、臨床的に重度の関節毒性を示し、14 日間の投与ルーチンの 8 日目に投与が中止されました。全体的な病理学的または組織病理学的効果がない場合、わずかな筋骨格の臨床効果が、2.5 mg/kg/日の最低用量レベルから生じた (AUC 比較に基づく小児用量の約 0.2 倍)。滑膜炎および関節軟骨病変が、10 および 40 mg/kg の用量レベルで観察された (AUC 比較に基づいて、それぞれ小児用量の約 0.7 倍および 2.4 倍)。関節軟骨の全体的な病理学と組織病理学は、10 および 40 mg/kg/日の用量レベルからこれらの犬の 18 週間の回復期間の終わりまで持続しました。
マウスの耳腫脹バイオアッセイで試験したところ、レボフロキサシンはオフロキサシンと同程度の光毒性を示したが、他のキノロンよりも光毒性が低かった。
いくつかの静脈内ラット試験で結晶尿が観察されていますが、尿結晶は膀胱で形成されず、排尿後にのみ存在し、腎毒性とは関連していません.
マウスでは、キノロンの CNS 刺激効果は、非ステロイド性抗炎症薬の同時投与によって強化されます。
イヌでは、レボフロキサシンを 6 mg/kg 以上で急速静脈内注射すると、降圧効果が生じた。これらの効果は、ヒスタミン放出に関連していると考えられていました。
動物での in vitro および in vivo 研究は、レボフロキサシンがヒトの治療血漿濃度範囲で酵素誘導剤でも阻害剤でもないことを示しています。したがって、他の薬物または薬剤との薬物代謝酵素関連の相互作用は予想されません。
臨床研究
院内肺炎
臨床的および放射線学的に記録された院内肺炎の成人患者が、静脈内投与の LEVAQUIN® (750 mg 1 日 1 回) と経口 LEVAQUIN® (750 mg 1 日 1 回) を合計 7 ~ 15 日間比較する多施設無作為化非盲検試験に登録されました。静脈内イミペネム/シラスタチン (毎日 6 ~ 8 時間ごとに 500 ~ 1000 mg)、続いて経口シプロフロキサシン (毎日 12 時間ごとに 750 mg) を合計 7 ~ 15 日間。 LEVAQUIN® で治療された患者は、平均 7 日間の静脈内治療を受けました (範囲: 1 ~ 16 日)。コンパレーターで治療された患者は、平均 8 日間の静脈内治療を受けました (範囲: 1 ~ 19 日)。
全体として、臨床的および微生物学的に評価可能な集団において、LEVAQUIN® 群では 93 人中 56 人 (60.2%) の患者、比較群では 94 人中 53 人 (56.4%) の患者で補助療法が試験登録時に経験的に開始されました。補助療法の平均期間は、LEVAQUIN®群で 7 日間、対照群で 7 日間でした。緑膿菌感染が記録されている臨床的および微生物学的に評価可能な患者では、17 人中 15 人 (88.2%) が LEVAQUIN® 群でセフタジジム (N = 11) またはピペラシリン/タゾバクタム (N = 4) を投与され、17 人中 16 人 (94.1%) がコンパレータアームのアミノグリコシド。全体として、臨床的および微生物学的に評価可能な患者では、バンコマイシンが、LEVAQUIN® 群の 93 人中 37 人 (39.8%) の患者と、比較群の 94 人中 28 人 (29.8%) の患者の治療レジメンに追加され、メチシリン耐性菌が疑われました。黄色ブドウ球菌の感染。
治療後の来院時に臨床的および微生物学的に評価可能な患者の臨床的成功率(治療終了後 3 ~ 15 日目に評価された主要試験エンドポイント)は、LEVAQUIN® で 58.1%、比較対象で 60.6% でした。奏効率の差(LEVAQUIN® マイナス コンパレータ)の 95% CI は [-17.2, 12.0] でした。治療後の来院時の微生物学的根絶率は、LEVAQUIN® で 66.7%、コンパレータで 60.6% でした。除菌率の差 (LEVAQUIN® マイナス コンパレータ) の 95% CI は [-8.3, 20.3] でした。病原体別の臨床的成功率と微生物学的根絶率を表 9 に示します。
市中肺炎
7~14日間の治療レジメン
市中感染性細菌性肺炎と診断された成人の入院患者および外来患者が、2 つの重要な臨床研究で評価されました。最初の研究では、590 人の患者がプロスペクティブ多施設非盲検ランダム化試験に登録され、LEVAQUIN® 500 mg を 1 日 1 回経口または 7 ~ 14 日間静脈内投与した場合と、セフトリアキソン 1 ~ 2 グラムを 1 日 1 回または等分割用量で 1 日 2 回静脈内投与した場合を比較しました。その後、セフロキシム アキセチル 500 mg を 1 日 2 回、合計 7 ~ 14 日間経口投与します。対照レジメンでの治療に割り当てられた患者は、非定型病原体による感染が疑われるか証明された場合、エリスロマイシン(またはエリスロマイシン不耐症の場合はドキシサイクリン)を受けることが許可されました.臨床的および微生物学的評価は、治療中、治療後 5 ~ 7 日、および治療後 3 ~ 4 週間に実施されました。治療後 5 ~ 7 日での LEVAQUIN® による臨床的成功 (治癒と改善) は、この研究の主要な有効性変数であり、対照群 (83%) よりも優れていました (95%)。奏効率の差 (LEVAQUIN® マイナス コンパレータ) の 95% CI は [-6, 19] でした。 2 つ目の研究では、264 人の患者が LEVAQUIN® 500 mg を 1 日 1 回 7 ~ 14 日間経口または静脈内投与する前向き多施設非比較試験に登録されました。臨床的に評価可能な患者の臨床的成功率は 93% でした。どちらの研究でも、クラミドフィラ ニューモニエ、マイコプラズマ ニューモニエ、レジオネラ ニューモフィラによる非定型肺炎患者の臨床的成功率は、それぞれ 96%、96%、70% でした。両方の研究における微生物根絶率を表 10 に示します。
多剤耐性肺炎連鎖球菌による市中肺炎
LEVAQUIN® は、多剤耐性肺炎連鎖球菌 (MDRSP) による市中肺炎の治療に有効でした。 MDRSP 分離株は、次の抗菌薬の 2 つ以上に耐性のある分離株です: ペニシリン (MIC ≧2 mcg/mL)、第 2 世代セファロスポリン (例えば、セフロキシム、マクロライド、テトラサイクリン、およびトリメトプリム/スルファメトキサゾール)。 MDRSP 分離株を有する微生物学的に評価可能な 40 人の患者のうち、38 人の患者 (95.0%) が治療後に臨床的および細菌学的な成功を収めました。臨床および細菌の成功率を表 11 に示します。
すべての分離株が、試験したすべての抗菌クラスに耐性を示したわけではありません。成功率と根絶率を表 12 にまとめます。
市中肺炎
5日間の治療レジメン
LEVAQUIN®の高用量および短期コースの安全性と有効性を評価するために、臨床的および放射線学的に軽度から重度の市中肺炎と診断された 528 人の外来および入院成人が、LEVAQUIN を比較する二重盲検無作為化前向き多施設研究で評価されました。 ® 750 mg、IV または経口、毎日 5 日間、または LEVAQUIN® 500 mg IV または経口、毎日 10 日間。
臨床的に評価可能な集団における臨床的成功率(治癒と改善)は、LEVAQUIN® 750 mg グループで 90.9%、LEVAQUIN® 500 mg グループで 91.1% でした。奏効率の差 (LEVAQUIN® 750 から LEVAQUIN® 500 を差し引いたもの) の 95% CI は [-5.9, 5.4] でした。臨床的に評価可能な集団(登録後 31 ~ 38 日)では、LEVAQUIN® 750 mg 群では 151 例中 7 例、LEVAQUIN® 500 mg 群では 147 例中 2 例で肺炎が観察されました。観測された数が少ないため、この発見の重要性を統計的に判断することはできません。 5 日間レジメンの微生物学的有効性は、表 13 に記載されている感染症について記録されています。
急性細菌性副鼻腔炎
日間および 10 ~ 14 日間の治療レジメン
LEVAQUIN® は、急性細菌性副鼻腔炎 (ABS) の治療に承認されており、経口で 750 mg × 5 日間、または経口で 500 mg を 1 日 1 回 × 10 ~ 14 日間使用します。 LEVAQUIN®の高用量短期コースの安全性と有効性を評価するために、臨床的および放射線学的に急性細菌性副鼻腔炎と診断された 780 人の外来患者の成人が、1 日 1 回経口で LEVAQUIN® 750 mg を比較する二重盲検無作為化前向き多施設研究で評価されました。 5 日間、LEVAQUIN® 500 mg を 1 日 1 回、10 日間経口投与。
微生物学的に評価可能な集団における臨床的成功率(治療前の徴候およびABSの症状の完全または部分的な解決として定義され、それ以上の抗生物質治療が必要でないと判断されたものとして定義されます)は、微生物学的に評価可能な集団でLEVAQUIN®で91.4%(139/152)でした。硬化試験(TOC)来院時のLEVAQUIN® 500 mg群では750 mg群と88.6%(132/149)(LEVAQUIN® 750 mgからLEVAQUIN® 500 mgを差し引いた場合の95% CI [-4.2, 10.0]) .
試験開始時に洞穿刺によって採取された標本を有する微生物学的に評価可能な集団における病原体による臨床的成功率は、治療後22日の硬化試験来院時に5日間および10日間のレジメンで同等の結果を示した(表14を参照)。 .
複雑な皮膚および皮膚構造の感染症
399人の患者が、複雑な皮膚および皮膚構造の感染症に関する非盲検無作為化比較研究に登録されました。患者は LEVAQUIN® 750 mg を 1 日 1 回 (IV、その後経口) 投与されるか、または承認された対照薬を中央値 10 ± 4.7 日間投与されるように無作為に割り付けられました。複雑な皮膚および皮膚構造の感染症で予想されるように、LEVAQUIN® および対照群で外科的処置が行われました。外科手術(切開およびドレナージまたはデブリドマン)は、LEVAQUIN® 治療を受けた患者の 45% およびコンパレータ治療を受けた患者の 44% に、抗生物質治療の直前または最中に実施され、この適応症の治療の不可欠な部分を形成しました。
治験薬の完了から 2 ~ 5 日後に臨床的に評価できた患者のうち、全体的な成功率 (改善または治癒) は、LEVAQUIN® で治療された患者で 116/138 (84.1%)、治療された患者で 106/132 (80.3%) でした。コンパレーター付き。
成功率は診断の種類によって異なり、感染した潰瘍のある患者の 68% から、感染した傷や膿瘍のある患者の 90% まで幅がありました。これらの割合は、比較薬で見られる割合と同等でした。
慢性細菌性前立腺炎
前立腺炎の臨床診断を受けた成人患者と、前立腺マッサージ (VB3) 後に採取された尿サンプルまたは Meares-Stamey 法によって得られた発現前立腺分泌物 (EPS) 標本からの微生物培養結果が、比較する多施設無作為化二重盲検研究に登録されました。経口 LEVAQUIN® 500 mg、1 日 1 回、合計 28 日間、経口シプロフロキサシン 500 mg、1 日 2 回、合計 28 日間。主要有効性エンドポイントは、微生物学的に評価可能な患者における微生物学的有効性でした。微生物学的に評価可能な合計 136 人の患者と 125 人の患者が、それぞれ LEVAQUIN® 群とシプロフロキサシン群に登録されました。治療終了後 5 ~ 18 日での患者感染による微生物根絶率は、LEVAQUIN®群で 75.0%、シプロフロキサシン群で 76.8% でした (95% CI [-12.58, 8.98] LEVAQUIN® マイナス シプロフロキサシン)。対象病原体の全体的な根絶率を表 15 に示します。
S. epidermidis の根絶率は、他の共同病原体と一緒に発見された場合、純粋な分離株で見られる率と一致しています。
治療完了後 5 ~ 18 日での微生物学的に評価可能な集団における臨床的成功 (さらなる抗生物質治療を必要としない治癒 + 改善) 率は、LEVAQUIN® 治療患者で 75.0%、シプロフロキサシン治療患者で 72.8% でした (95% CI [- 8.87, 13.27] LEVAQUIN® からシプロフロキサシンを差し引いたもの)。臨床的長期成功率 (治療完了後 24 ~ 45 日) は、LEVAQUIN® 治療患者で 66.7%、シプロフロキサシン治療患者で 76.9% でした (95% CI [-23.40, 2.89] LEVAQUIN® マイナス シプロフロキサシン)。
複雑性尿路感染症と急性腎盂腎炎
5日間の治療レジメン
LEVAQUIN®の高用量および短期コースの安全性と有効性を評価するために、2004 年 11 月から 2006 年 4 月まで米国で実施された LEVAQUIN® 750 を比較するランダム化二重盲検多施設臨床試験に 1,109 人の cUTI および AP 患者が登録されました。 mg IV または経口で 1 日 1 回 5 日間 (546 人の患者)、シプロフロキサシン 400 mg IV または 500 mg を 1 日 2 回経口で 10 日間 (563 人の患者)。根底にある腎疾患または完全閉塞、手術、移植、同時感染または先天性奇形などの状態を合併したAP患者は除外されました。有効性は、ベースラインで病原体が同定された患者の治療後の来院時に、ベースライン生物の細菌学的根絶によって測定されました。治療後(治験)の来院は、LEVAQUIN®の最終有効投与から 10 ~ 14 日後、および有効シプロフロキサシンの最終投与から 5 ~ 9 日後に行われました。
ベースラインで文書化された病原体を持つすべての患者のグループ(修正された治療意図またはmITT)およびmITT集団の患者グループの硬化テスト(TOC)訪問時のLEVAQUIN®およびコントロールの全体的な細菌学的治癒率プロトコルに厳密に従った (微生物学的に評価可能) 人を表 16 にまとめます。
LEVAQUIN® 治療に無作為に割り付けられた患者から回収された個々の病原体について、TOC で微生物学的に評価可能な集団における微生物根絶率を表 17 に示します。
複雑性尿路感染症と急性腎盂腎炎
10日間の治療レジメン
LEVAQUIN® の 250 mg 用量、10 日間レジメンの安全性と有効性を評価するために、合併症のない UTI、軽度から中等度の cUTI、および軽度から中等度の AP を有する 567 人の患者が無作為化二重盲検多施設試験に登録されました。 1993 年 6 月から 1995 年 1 月まで米国で実施された臨床試験では、LEVAQUIN® 250 mg を 1 日 1 回 10 日間経口投与 (患者 285 人) とシプロフロキサシン 500 mg を 1 日 2 回経口投与 10 日間 (患者 282 人) と比較しました。耐性病原体、再発性UTI、55歳以上の女性、および留置カテーテルを有する患者は、登録の30%後に行われたプロトコル修正の前に、最初に除外されました.微生物学的有効性は、ベースラインで病原体が同定された患者の治療後 1 ~ 12 日でのベースライン微生物の細菌学的根絶によって測定されました。
ベースラインで文書化された病原体を持つすべての患者のグループ(修正された治療意図またはmITT)およびmITT集団の患者グループの硬化テスト(TOC)訪問時のLEVAQUIN®およびコントロールの全体的な細菌学的治癒率プロトコルに厳密に従った (微生物学的に評価可能) 人を表 18 にまとめます。
吸入性炭疽菌(暴露後)
この適応症に対する LEVAQUIN® の有効性は、ヒトで達成された血漿濃度に基づいており、臨床的利益を合理的に予測する可能性が高い代理エンドポイントです。 LEVAQUIN® は、暴露後の吸入炭疽菌の予防について、ヒトで試験されていません。吸入炭疽のアカゲザルモデルにおいてプラセボよりも統計的に有意な生存率の改善に関連する LEVAQUIN® の平均血漿中濃度は、推奨される経口および静脈内投与レジメンを受けている成人および小児患者で到達またはそれを超えています。 適応症 と 投薬と管理 ]。
レボフロキサシンの薬物動態は、成人および小児患者で評価されています。 500 mg を 1 日 1 回経口または静脈内投与した成人の平均(± SD)定常状態ピーク血漿濃度は、それぞれ 5.7 ± 1.4 および 6.4 ± 0.8 mcg/mL です。対応する総血漿曝露量 (AUC) は、それぞれ 47.5 ± 6.7 および 54.6 ± 11.1 mcg.h/mL です。 12 時間ごとに 8 mg/kg を経口投与された 6 か月から 17 歳までの範囲の小児患者における予測された定常状態の薬物動態パラメータは、500 mg を投与された成人で観察されたものと同等であると計算されました。経口で 1 日 1 回 [参照 臨床薬理学 ]。
LEVAQUIN® 錠は、利用可能な強度の制限により、30 kg 以上の吸入性炭疽 (曝露後) またはペストの小児患者にのみ投与できます [ 投薬と管理 ]。
成人では、最長 28 日間の治療期間における LEVAQUIN® の安全性が十分に特徴付けられています。ただし、1 日 500 mg を 60 日間までの長期使用に関する情報は限られています。成人における長期の LEVAQUIN® 療法は、利益がリスクを上回る場合にのみ使用する必要があります。
小児患者では、14 日を超える治療期間に対するレボフロキサシンの安全性は研究されていません。最大 14 日間の治療期間の臨床研究では、対照群と比較して筋骨格系の有害事象 (関節痛、関節炎、腱障害、歩行異常) の発生率の増加が観察されています。小児患者へのレボフロキサシン投与後の軟骨への影響を含む長期安全性データは限られている[参照 警告と注意事項 と 特定の集団での使用 ]。
B. anthracis (Ames 株) の吸入平均用量 49 LD50 (~2.7 × 106) 胞子 (範囲 17 – 118 LD50) にばく露されたアカゲザルにおけるプラセボ対照動物試験が実施されました。この研究で使用された炭疽菌株のレボフロキサシンの最小発育阻止濃度 (MIC) は 0.125 mcg/mL でした。研究した動物では、定常状態への経口投与後、予想される Tmax (投与後 1 時間) で達成されたレボフロキサシンの平均血漿濃度は、2.79 から 4.87 mcg/mL の範囲でした。投与後 24 時間の定常状態のトラフ濃度は、0.107 ~ 0.164 mcg/mL の範囲でした。平均 (SD) 定常状態 AUC0-24 は 33.4 ± 3.2 mcg.h/mL (範囲 30.4 ~ 36.0 mcg.h/mL) でした。暴露後 24 時間から 30 日間の経口 LEVAQUIN® レジメンを受けた動物の炭疽による死亡率は、プラセボ群 (9/10) と比較して有意に低かった (1/10) [P = 0.0011、両側 Fisher 39;s 正確なテスト]。炭疽菌で死亡した 1 匹のレボフロキサシン処置動物は、30 日間の薬物投与期間後に死亡しました。
ペスト
LEVAQUIN®の有効性研究は、倫理的および実現可能性の理由から、肺ペストのヒトで実施できませんでした。したがって、この適応の承認は、動物で実施された有効性試験に基づいています。
肺ペストのアフリカミドリザルモデルにおいてプラセボよりも統計的に有意な生存率の改善に関連する LEVAQUIN® の平均血漿濃度は、推奨される経口および静脈内投与レジメンを受けている成人および小児患者で到達またはそれを超えています。 適応症 と 投薬と管理 ]。
レボフロキサシンの薬物動態は、成人および小児患者で評価されています。 500 mg を 1 日 1 回経口または静脈内投与した成人の平均(± SD)定常状態ピーク血漿濃度は、それぞれ 5.7 ± 1.4 および 6.4 ± 0.8 mcg/mL です。対応する総血漿曝露量 (AUC0-24) は、それぞれ 47.5 ± 6.7 および 54.6 ± 11.1 mcg.h/mL です。 12 時間ごとに 8 mg/kg を経口投与された 6 か月から 17 歳までの範囲の小児患者における予測された定常状態の薬物動態パラメータは、500 mg を投与された成人で観察されたものと同等であると計算されました。経口で 1 日 1 回 [参照 臨床薬理学 ]。 LEVAQUIN® 錠は、利用可能な強度の制限により、30 kg 以上の吸入性炭疽 (曝露後) またはペストの小児患者にのみ投与できます [ 投薬と管理 ]。
平均吸入用量 65 LD (範囲 3 ~ 145 LD50) のペスト菌 (CO92 株) に曝露したアフリカミドリザルでのプラセボ対照動物試験が実施されました。この研究で使用したペスト菌株のレボフロキサシンの最小発育阻止濃度 (MIC) は 0.03 mcg/mL でした。レボフロキサシンの平均血漿濃度は、アフリカミドリザルで 2.84 ~ 3.50 mcg/mL の範囲でした。投与後 24 時間のトラフ濃度は、
患者情報
レバキン® (Leave ah kwin)(レボフロキサシン)錠
LEVAQUIN 500mg について知っておくべき最も重要な情報は何ですか?
フルオロキノロン系抗生物質である LEVAQUIN 500mg は、深刻な副作用を引き起こす可能性があります。これらの深刻な副作用のいくつかは同時に発生する可能性があり、死に至る可能性があります.
LEVAQUIN 500mg を服用中に、次の重大な副作用がある場合は、 LEVAQUIN の服用を直ちに中止し、直ちに医師の診察を受けてください。
- 腱の問題は、LEVAQUIN を服用しているすべての年齢の人に発生する可能性があります。 腱は、筋肉を骨につなぐ丈夫な組織の索です。 いくつかの腱の問題は次のとおりです。
- 痛み
- 腫れ
- 足首の後ろ(アキレス)、肩、手、または他の腱部位を含む腱の断裂および腫れ。
- 次の場合、LEVAQUIN の服用中に腱の問題が発生するリスクが高くなります。
- 60歳以上である
- 腎臓、心臓または肺の移植を受けた。
- LEVAQUIN を服用すると、上記の危険因子を持たない人でも腱の問題が発生する可能性があります。
- 腱の問題のリスクを高める可能性のあるその他の理由には、次のものがあります。
- 身体活動または運動
- 腎不全
- 関節リウマチ(RA)患者などの過去の腱の問題
- LEVAQUIN の使用を直ちに中止し、腱の痛み、腫れ、または炎症の最初の兆候が見られたら、すぐに医師の診察を受けてください。運動や患部の使用は避けてください。
- 痛みや腫れの最も一般的な領域は、足首の後ろにあるアキレス腱です。これは、他の腱でも発生する可能性があります。感染症を治療するために、フルオロキノロン系ではない別の抗生物質が必要になる場合があります。
- LEVAQUIN の服用中または服用終了後に腱断裂が起こる可能性があります。腱断裂は、LEVAQUIN を服用してから数時間または数日以内に発生する可能性があり、フルオロキノロンの服用を終了してから最大数か月後に発生します。
- 次のような腱断裂の徴候や症状が見られた場合は、すぐに LEVAQUIN 750mg の服用を中止し、医師の診察を受けてください。
- 腱の領域でスナップまたはポップを聞いたり感じたりする
- 腱領域の損傷直後のあざ
- 患部を動かすことができない、または体重を支えることができない
- 痛み
- 燃焼
- チクチクする
- しびれ
- 弱点
神経損傷は永久的な場合があります。
- 発作
- 声が聞こえる、物が見える、または存在しないものを感じる (幻覚)
- 落ち着かない
- 震え
- 不安や緊張を感じる
- 錯乱
- うつ
- 寝られない
- 悪夢
- 立ちくらみやめまいを感じる
- 疑念を抱く(パラノイア)
- 自殺念慮または自殺行為
- かすみ目の有無にかかわらず、消えない頭痛
レバキンとは?
LEVAQUIN 500mg は、細菌と呼ばれる特定の細菌によって引き起こされる特定の感染症を治療するために 18 歳以上の成人に使用されるフルオロキノロン系抗生物質です。これらの細菌感染には以下が含まれます:
- 院内肺炎
- 市中肺炎
- 複雑な皮膚感染症と単純な皮膚感染症
- 慢性前立腺感染症
- 吸入炭疽菌
- ペスト
- 尿路感染症、複雑および単純
- 急性腎感染症(腎盂腎炎)
- 急性副鼻腔感染症
- 急性増悪または慢性気管支炎
ペストと炭疽菌はヒトでは研究できなかったため、ペストと炭疽菌の治療に使用するための LEVAQUIN の研究は動物でのみ行われました。
LEVAQUIN は、合併症のない尿路感染症、慢性気管支炎の急性細菌性増悪、または他の治療選択肢がある場合、急性細菌性副鼻腔炎の患者には使用しないでください。
LEVAQUIN 750mg 錠剤は、体重が 66 ポンド (または 30 キログラム以上) 以上で、炭疽菌を吸い込んだ、ペストに感染した、またはペスト菌にさらされた可能性がある子供の治療にも使用されます。 LEVAQUIN が生後 6 か月未満の子供に安全で有効であるかどうかはわかっていません。
14 日以上 LEVAQUIN® で治療された小児の安全性と有効性は不明です。
レバキン750mgを服用してはいけない人は?
レバキンを服用しないでください: フルオロキノロンとして知られる抗生物質に対して重度のアレルギー反応を起こしたことがある場合、またはレボフロキサシンまたはLEVAQUINの成分のいずれかにアレルギーがある場合. LEVAQUIN の全成分リストについては、このリーフレットの最後を参照してください。
LEVAQUIN を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 腱に問題がある; LEVAQUIN 250mg は、腱に問題のある人には使用しないでください。
- 筋力低下を引き起こす問題がある (重症筋無力症); LEVAQUIN は、重症筋無力症の既往歴のある人には使用しないでください。
- 発作(てんかん)などの中枢神経系の問題がある。
- 神経に問題がある; LEVAQUIN 250mg は、末梢神経障害と呼ばれる神経障害の病歴がある患者には使用しないでください。
- 持っているか、あなたの家族の誰かが不整脈、特に「QT延長」と呼ばれる状態を持っています.
- 血中カリウムが低い(低カリウム血症)。
- 骨に問題があります。
- 関節リウマチ(RA)を含む関節の問題を抱えている。
- 腎臓に問題があります。腎臓がうまく機能しない場合は、LEVAQUIN の用量を減らす必要があるかもしれません。
- 肝臓に問題があります。
- 糖尿病または低血糖(低血糖)の問題がある。
- 妊娠している、または妊娠する予定がある。 LEVAQUIN 750mg が胎児に害を及ぼすかどうかは不明です。
- 授乳中または授乳を計画している。 LEVAQUIN が母乳に移行するかどうかは不明です。 LEVAQUIN 250mg を服用するか、母乳で育てるかは、あなたと担当の医療提供者が決定する必要があります。両方を行うべきではありません。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
LEVAQUIN と他の薬は互いに影響し合い、副作用を引き起こす可能性があります。
特に以下を服用している場合は、医療提供者に伝えてください。
- ステロイド薬です。
- 抗精神病薬。
- 三環系抗うつ薬。
- 水の丸薬(利尿薬)。
- 特定の医薬品は、LEVAQUIN 750mg が正しく作用しない可能性があります。 LEVAQUIN® は、これらの医薬品またはサプリメントを服用する 2 時間前または 2 時間後に服用してください。
- マグネシウム、アルミニウム、鉄、または亜鉛を含む制酸剤、マルチビタミン、またはその他の医薬品またはサプリメント
- スクラルファート(カラファテ®)
- ジダノシン(Videx®、Videx® EC)
- 抗凝血剤(ワルファリン、クマディン、ヤントーベン)。
- 経口抗糖尿病薬またはインスリン。
- NSAID(非ステロイド性抗炎症薬)です。鎮痛のための多くの一般的な薬はNSAIDです。 LEVAQUIN 250mg または他のフルオロキノロンを服用中に NSAID を服用すると、中枢神経系への影響や発作のリスクが高まる可能性があります。
- テオフィリン(Theo-24®、Elixophyllin®、Theochron®、Uniphyl®、Theolair®)。
- 心拍数またはリズムを制御する薬 (抗不整脈薬)。
あなたの薬のいずれかが上記にリストされているかどうかわからない場合は、医療提供者に尋ねてください.服用している薬を知る。服用している薬のリストを保管し、新しい薬を入手したときに、医療従事者や薬剤師に提示してください。
レバキン 500mg の服用方法は?
- LEVAQUIN は、医療提供者の指示どおりに服用してください。
- LEVAQUIN 750mg を毎日ほぼ同じ時間に服用してください。
- LEVAQUIN を服用している間は、水分を十分に摂取してください。
- LEVAQUIN は食事の有無にかかわらず服用できます。
- レバキン 500mg を飲み忘れた場合は、気がついたらすぐに服用してください。 1日に1回以上服用しないでください。
- 次の場合を除き、処方された治療が終了するまでは、気分が良くなり始めたとしても、LEVAQUIN 750mg の服用をスキップしたり、服用を中止したりしないでください。
- あなたは腱の問題を抱えています。見る 「LEVAQUIN 500mg について知っておくべき最も重要な情報は何ですか?」.
- あなたは神経に問題があります。見る 「LEVAQUIN の考えられる副作用は何ですか?」.
- あなたは中枢神経系に問題があります。見る 「LEVAQUIN 750mg の考えられる副作用は何ですか?」.
- あなたは深刻なアレルギー反応を起こしています。見る 「LEVAQUIN 250mg の考えられる副作用は何ですか?」.
- かかりつけの医療提供者が LEVAQUIN の服用を中止するように指示した場合。
LEVAQUIN 500mg の用量をすべて服用することで、すべての細菌を確実に死滅させることができます。 LEVAQUIN 250mg をすべて服用することで、細菌が LEVAQUIN に耐性を持つ可能性を下げることができます。 LEVAQUIN 750mg を服用しても感染症が改善しない場合は、感染症を引き起こしている細菌が LEVAQUIN に耐性を持っている可能性があります。感染症が改善しない場合は、医療提供者に連絡してください。感染症が改善しない場合、LEVAQUIN やその他の同様の抗生物質薬が将来効かなくなる可能性があります。
- LEVAQUIN の服用量が多すぎる場合は、医療提供者に連絡するか、すぐに医師の診察を受けてください。
LEVAQUIN 500mg を服用している間、何を避けるべきですか?
- LEVAQUIN は、めまいや立ちくらみを感じさせることがあります。 しない LEVAQUIN がどのように影響するかを理解するまでは、車の運転、機械の操作、または精神的な覚醒や調整を必要とするその他の活動を行ってください。
- 太陽灯や日焼け用ベッドを避け、太陽の下での時間を制限するようにしてください。 LEVAQUIN 750mg を使用すると、皮膚が太陽 (光線過敏症) や、太陽灯や日焼けベッドからの光に敏感になる可能性があります。重度の日焼け、水ぶくれ、または皮膚の腫れを引き起こす可能性があります。 LEVAQUIN の服用中にこれらの症状が現れた場合は、すぐに医療提供者に連絡してください。日光に当たる必要がある場合は、日焼け止めを使用し、肌を覆う帽子と衣服を着用してください。
LEVAQUIN 750mg で起こりうる副作用は何ですか?
LEVAQUIN 750mg は、次のような重大な副作用を引き起こす可能性があります。
- 見る 「LEVAQUIN 250mg について知っておくべき最も重要な情報は何ですか?」
- 深刻なアレルギー反応。
アレルギー反応は、LEVAQUIN 500mg を含むフルオロキノロン系薬剤を 1 回服用しただけでも起こる可能性があります。次の重度のアレルギー反応の症状がある場合は、LEVAQUIN 500mg の服用を中止し、直ちに緊急医療処置を受けてください。
- 蕁麻疹
- 呼吸困難または嚥下困難
- 唇、舌、顔の腫れ
- 喉の圧迫感、嗄声
- 速い心拍
- かすかな
- 皮膚発疹
レバキン500mgを服用している人は、1回の服用でもかぶれが起こることがあります。皮膚発疹の最初の兆候が見られたら、LEVAQUIN 250mg の服用を中止し、すぐに医療提供者に連絡してください。皮膚の発疹は、LEVAQUIN に対するより深刻な反応の徴候である可能性があります。
- 肝障害(肝毒性): LEVAQUIN®を服用している人では、肝毒性が発生する可能性があります。次のような原因不明の症状がある場合は、すぐに医療提供者に連絡してください。
- 吐き気または嘔吐
- 胃痛
- 熱
- 弱点
- 腹痛または圧痛
- かゆみ
- 異常な疲労
- 食欲減少
- 明るい色の排便
- 濃い色の尿
- 皮膚や白目が黄色くなる
LEVAQUIN 750mg の服用を中止し、皮膚や白目の部分が黄色くなったり、尿が濃くなったりした場合は、すぐに医療提供者に伝えてください。これらは、LEVAQUIN (肝臓の問題) に対する深刻な反応の徴候である可能性があります。
- 腸の感染症(偽膜性大腸炎) 偽膜性大腸炎は、LEVAQUIN を含む多くの抗生物質で発生する可能性があります。水様性下痢、下痢が治まらない場合、血便がある場合は、すぐに医療提供者に連絡してください。胃痙攣や発熱を伴うことがあります。偽膜性大腸炎は、抗生物質の服用を終了してから 2 か月以上経ってから発生する可能性があります。
- 深刻な心拍リズムの変化 (QT 延長および torsades depointes) 心拍に変化(速いまたは不規則な心拍)がある場合、または失神した場合は、すぐに医療提供者に伝えてください。 LEVAQUIN 250mg は、QT 間隔の延長として知られるまれな心臓の問題を引き起こす可能性があります。この状態は異常な心拍を引き起こす可能性があり、非常に危険です。これが起こる可能性は、人で高くなります。
- 高齢者
- QT間隔延長の家族歴がある
- 低血中カリウム(低カリウム血症)
- 心拍リズムを制御するために特定の薬を服用している人(抗不整脈薬)
- 関節の問題 子供の関節や関節周辺の組織に問題が発生する可能性が高くなります。 LEVAQUIN による治療中または治療後にお子様に関節の問題がある場合は、お子様の医療提供者にお知らせください。
- 血糖値の変化 LEVAQUIN および他のフルオロキノロン薬を経口抗糖尿病薬またはインスリンと一緒に服用している人は、低血糖 (低血糖) および高血糖 (高血糖) になる可能性があります。血糖値をチェックする頻度については、医療提供者の指示に従ってください。糖尿病を患っており、LEVAQUIN の服用中に低血糖になった場合は、LEVAQUIN 500mg の服用を中止し、すぐに医療提供者に連絡してください。抗生物質の薬を変更する必要があるかもしれません。
- 日光に対する感受性(光過敏症) 見る 「LEVAQUIN を服用している間、何を避けるべきですか?」 LEVAQUIN 250mg の最も一般的な副作用は次のとおりです。
- 吐き気
- 頭痛
- 下痢
- 不眠症
- 便秘
- めまい
炭疽病またはペストを治療するために LEVAQUIN を服用する 6 か月以上の子供では、嘔吐も一般的です。
LEVAQUIN は、一部の市販のキットを使用してテストを行うと、アヘン剤の尿スクリーニング結果が偽陽性になる可能性があります。陽性の結果は、より具体的なテストを使用して確認する必要があります。これらは、LEVAQUIN の考えられるすべての副作用ではありません。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
LEVAQUIN 250mg の保存方法を教えてください。
- LEVAQUIN 500mg は 59°F ~ 86° F (15°C ~ 30°C) の室温で保管してください。
- LEVAQUIN 500mg は密閉容器に保管してください。
LEVAQUIN の安全で効果的な使用に関する一般的な情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態で LEVAQUIN を使用しないでください。他の人があなたと同じ症状を持っている場合でも、LEVAQUIN 500mg を与えないでください。それらに害を及ぼす可能性があります。この投薬ガイドは、LEVAQUIN に関する最も重要な情報をまとめたものです。 LEVAQUIN 750mg についてさらに詳しい情報が必要な場合は、医療提供者にご相談ください。医療従事者向けに書かれた LEVAQUIN 500mg に関する情報については、医療提供者または薬剤師にお尋ねください。
レバキン500mgの成分は?
有効成分: レボフロキサシン
不活性成分 : クロスポビドン、ヒプロメロース、ステアリン酸マグネシウム、微結晶セルロース、ポリエチレングリコール、ポリソルベート80、二酸化チタン。
LEVAQUIN 250 mg 錠には、合成赤色酸化鉄も含まれています。
LEVAQUIN 500 mg 錠には、合成赤色酸化鉄と合成黄色酸化鉄も含まれています。
この投薬ガイドは、米国食品医薬品局によって承認されています
