Vantin 200mg, 100mg Cefpodoxime 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
バンタン 100mg とは何ですか? どのように使用されますか?
バンタン 100mg は、気管支炎、肺炎、副鼻腔炎、咽頭炎、扁桃炎、尿路感染症、皮膚感染症、淋病などのさまざまな細菌感染症の症状を治療するために使用される処方薬です。バンチン 200mg は、単独で使用することも、他の薬と併用することもできます。
バンチンは、第 3 世代のカハロースポリンと呼ばれる種類の薬に属しています。
Vantin が生後 2 か月未満の子供に安全で有効であるかどうかはわかっていません。
バンタン 200mg の副作用の可能性は何ですか?
バンチンは、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 熱、
- 喉の痛み、
- あなたの目に燃える、
- 皮膚の痛み、
- 赤または紫の発疹が広がり、水ぶくれやはがれを引き起こします。
- 激しい胃痛、
- 水様または血様の下痢、
- 腫れた腺、
- 関節痛、
- 一般的な不快感、
- ドキドキする心臓の鼓動、
- 胸の中でときめき、
- 息切れ、および
- 発作
上記の症状がある場合は、すぐに医療機関を受診してください。
バンチンの最も一般的な副作用は次のとおりです。
- 膣のかゆみや分泌物、
- この薬を使用している幼児のおむつかぶれ、
- 吐き気、
- 嘔吐、
- 下痢、
- 胃痛、そして
- 頭痛
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Vantin の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
薬剤耐性菌の発生を抑え、バンタン 100mg および他の抗菌薬の有効性を維持するために、バンタン 100mg は、細菌が原因であることが証明されているか、強く疑われる感染症の治療または予防にのみ使用する必要があります。
説明
セフポドキシム プロキセチルは、セファロスポリン クラスの経口投与される拡張スペクトルの半合成抗生物質です。化学名は (RS)-1(イソプロポキシカルボニルオキシ) エチル (+)-(6R,7R)-7-[2-(2-アミノ-4-チアゾリル)-2-{(Z)メトキシイミノ}アセトアミド]-3 -メトキシメチル-8-オキソ-5-チア-1-アザビシクロ[4.2.0]オクタ-2-エン-2-カルボキシレート。その実験式は C21H27N5O9S2 であり、その構造式は以下に表されます。
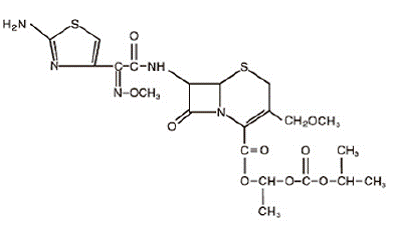
セフポドキシム プロキセチルの分子量は 557,6 です。
セフポドキシム プロキセチルはプロドラッグです。その活性代謝物はセフポドキシムです。この挿入物におけるセフポドキシム プロキセチルのすべての用量は、活性なセフポドキシム部分に関して表される。この薬は、フィルムコーティングされた錠剤と経口懸濁液用のフレーバー顆粒の両方として供給されます。
VANTIN 錠には、100 mg または 200 mg のセフポドキシム活性に相当するセフポドキシム プロキセチルと、次の不活性成分が含まれています。二酸化チタン。さらに、100 mg フィルムコーティング錠には D&C 黄色 10 号が含まれ、200 mg フィルムコーティング錠には FD&C 赤色 40 号が含まれています。
VANTIN 経口懸濁液 5 mL には、構成後のセフポドキシム活性 50 mg または 100 mg に相当するセフポドキシム プロキセチルと、次の不活性成分が含まれています: 人工香料、ブチル化ヒドロキシ アニソール (BHA)、カルボキシメチルセルロース ナトリウム、微結晶性セルロース、カラギーナン、クエン酸、コロイド二酸化ケイ素、クロスカルメロースナトリウム、ヒドロキシプロピルセルロース、乳糖、マルトデキストリン、天然香料、アルギン酸プロピレングリコール、クエン酸ナトリウム、安息香酸ナトリウム、デンプン、スクロース、植物油。
適応症
セフポドキシム プロキセチルは、以下にリストされている状態で、指定された微生物の感受性株によって引き起こされる軽度から中等度の感染症の患者の治療に適応されます。
推奨される投与量、治療期間、および該当する患者集団は、これらの感染症によって異なります。具体的な推奨事項については、投与量と投与量を参照してください。急性中耳炎 肺炎連鎖球菌(ペニシリン耐性株を除く)、化膿連鎖球菌、インフルエンザ菌(β-ラクタマーゼ産生株を含む)、またはモラクセラ(ブランハメラ)カタラーリス(β-ラクタマーゼ産生株を含む)によって引き起こされる。
化膿連鎖球菌による咽頭炎および/または扁桃炎。
ノート: 筋肉内投与経路によるペニシリンのみが、リウマチ熱の予防に有効であることが示されています。セフポドキシム プロキセチルは一般に、中咽頭からのレンサ球菌の根絶に効果的です。ただし、その後のリウマチ熱の予防に対するセフポドキシム プロキセチルの有効性を確立するデータは入手できません。
市中肺炎 S. pneumoniae または H. Influenzae (ベータ-ラクタマーゼ産生株を含む) によって引き起こされる。
慢性気管支炎の急性細菌性増悪 肺炎球菌、インフルエンザ菌(非ベータラクタマーゼ産生株のみ)、または M. catarrhalis によって引き起こされます。現時点では、インフルエンザ菌のβ-ラクタマーゼ産生菌株によって引き起こされる慢性気管支炎の急性細菌性増悪患者における有効性を確立するには、データが不十分です。
合併症のない急性の尿道および子宮頸部淋病 Neisseria gonorrhoeae (ペニシリナーゼ産生株を含む) によって引き起こされます。
女性の急性で合併症のない肛門直腸感染症 Neisseria gonorrhoeae(ペニシリナーゼ産生株を含む)による。
ノート: 淋菌による直腸感染症の男性患者の治療におけるセフポドキシムの有効性は確立されていません。データは、男性または女性の淋菌による咽頭感染症の治療におけるセフポドキシム プロキセチルの使用を支持していません。
合併症のない皮膚および皮膚構造の感染症 黄色ブドウ球菌(ペニシリナーゼ産生株を含む)または化膿連鎖球菌によって引き起こされます。膿瘍は、臨床的に示されるように外科的に排出する必要があります。
ノート: 臨床試験では、合併症のない皮膚および皮膚構造の感染症の治療の成功は用量依存性でした。皮膚感染症の有効治療用量は、他の推奨適応症で使用される用量よりも高かった。 (見る 投薬と管理 .)
急性上顎洞炎 インフルエンザ菌(β-ラクタマーゼ産生株を含む)、肺炎連鎖球菌、モラクセラ・カタラーリスによって引き起こされます。
合併症のない尿路感染症(膀胱炎) Escherichia coli、Klebsiella pneumoniae、Proteus mirabilis、または Staphylococcus saprophyticus によって引き起こされます。
ノート: 膀胱炎の治療におけるセフポドキシム プロキセチルの使用を検討する際には、セフポドキシム プロキセチルのより低い細菌根絶率を、増加した根絶率および他のクラスの承認された薬剤の異なる安全性プロファイルと比較検討する必要があります。 (見る 臨床研究 セクション。)
原因菌を分離・同定し、セフポドキシムに対する感受性を判断するために、細菌学的検査に適した検体を採取する必要があります。これらの研究の結果を待っている間に、治療が開始される場合があります。これらの結果が得られたら、それに応じて抗菌薬療法を調整する必要があります。
薬剤耐性菌の発生を減らし、バンタン 100mg および他の抗菌薬の有効性を維持するために、バンタン 200mg は、感受性菌によって引き起こされることが証明されている、または強く疑われる感染症の治療または予防にのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
(見る 適応症と使用法 示された病原体について。)
フィルムコーティング錠
バンタン錠は、吸収を高めるために食事と一緒に経口投与する必要があります。 (見る 臨床薬理学 .)
推奨用量、治療期間、および該当する患者集団は、次の表に記載されているとおりです。
成人および青少年(12 歳以上)
経口懸濁液用顆粒
バンタン経口懸濁液は、食品に関係なく投与できます。推奨用量、治療期間、および該当する患者集団は、次の表に記載されているとおりです。
成人および青少年(12 歳以上)
乳児および小児患者(生後2か月から12歳まで)
腎機能障害のある患者
重度の腎機能障害 (
血清クレアチニンレベルのみが利用可能な場合、次の式(患者の性別、体重、および年齢に基づく)を使用して、クレアチニンクリアランス(mL/分)を推定できます。この推定値が有効であるためには、血清クレアチニン レベルが腎機能の定常状態を表している必要があります。
男性(mL/分): 体重 (kg) x (140 - 年齢)/72 x 血清クレアチニン (mg/100 mL)
女性(mL/分) : 0.85 x 上記の値
肝硬変患者
肝硬変患者(腹水の有無にかかわらず)におけるセフポドキシムの薬物動態は、健常者と同様である。この集団では用量調整は必要ありません。
サスペンションの準備
構成 経口懸濁液の指示
混合後、懸濁液は 2° ~ 8°C (36° ~ 46°F) の冷蔵庫に保管してください。よく振ってからご使用ください。容器は密閉して保管してください。混合物は14日間使用できます。未使用部分は 14 日後に廃棄してください。
供給方法
バンタン錠 次の強度 (セフポドキシム相当)、色、およびサイズで利用できます。
100mg(ライトオレンジ、楕円形、U3617の型押し)
20本のボトル NDC 0009-3617-01 100本入 NDC 0009-3617-02 100 単位用量パック NDC 0009-3617-03
200 mg (コーラルレッド、楕円形、U3618 で型押し)
20本のボトル NDC 0009-3618-01 100本入 NDC 0009-3618-02
200 mg (コーラルレッド、楕円形、U3618 で型押し)
100個の単位用量パック NDC 0009-3618-03
錠剤は 20° ~ 25°C (68° ~ 77°F) に制御された室温で保管してください [ USP ]。
開けるたびにキャップをしっかりと閉めてください。単位用量パックを過度の湿気から保護してください。
バンタン 200mg 経口懸濁液 mL 懸濁液あたり 50 mg または 100 mg のセフポドキシムに相当する量を提供し (指示どおりに構成されている場合)、次のサイズのレモン クリーム フレーバーがあります。
50mg/5mL
100mL懸濁液 NDC 0009-3531-01 75mL 懸濁液 NDC 0009-3531-02 50mL 懸濁液 NDC 0009-3531-03
100mg/5mL
100mL懸濁液 NDC 0009-3615-01 75mL 懸濁液 NDC 0009-3615-02 50mL 懸濁液 NDC 0009-3615-03
懸濁していない顆粒は、制御された室温 20° ~ 25°C (68° ~ 77°F) で保管してください [ USP ]。
混ぜ方はラベルに書いてあります。混合後、懸濁液は 2° ~ 8°C (36° ~ 46°F) の冷蔵庫に保管してください。よく振ってからご使用ください。容器は密閉して保管してください。混合物は14日間使用できます。未使用部分は 14 日後に廃棄してください。
販売元: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. 改訂: 2016 年 8 月
副作用
臨床試験
フィルムコーティング錠(複数回服用)
を使用した臨床試験では 複数回投与 セフポドキシム プロキセチル フィルムコーティング錠の 4,696 人の患者がセフポドキシムの推奨用量 (100 ~ 400 mg Q 12 時間) で治療されました。薬物毒性に関連すると考えられる死亡や永続的な障害はありませんでした。 129 人 (2.7%) の患者が、薬物毒性に関連する可能性がある、またはおそらく関連すると考えられる有害事象のために投薬を中止しました。治療を中止した 178 人の患者のうち 93 人 (52%) (薬物治療に関連すると考えられていたかどうかに関係なく) が、胃腸障害、吐き気、嘔吐、または下痢のために中止しました。有害事象のために治験薬を中止したセフポドキシム プロキセチル治療患者の割合は、1 日 400 mg または 200 mg の用量よりも 1 日 800 mg の用量で有意に高かった。反復投与臨床試験 (N=4696 セフポドキシム治療患者) で、セフポドキシムに関連する可能性がある、またはおそらく関連すると考えられる有害事象は次のとおりです。
1%を超える発生率
下痢 7.0%
下痢または軟便は用量に関連しており、1 日 800 mg を投与された患者の 10.4% から、1 日 200 mg を投与された患者の 5.7% に減少しました。下痢患者の 10% の便に C. difficile 菌または毒素が含まれていました。 (見る 警告 .)
吐き気 3.3% 膣真菌感染症 1.0% 外陰膣感染症 1.3% 腹痛 1.2% 頭痛 1.0%
1%未満の発生率
体のシステム別の降順
臨床研究
患者の 1% 未満 (N=4696) で発生した、セフポドキシム プロキセチルに関連する可能性がある、またはおそらく関連すると考えられる有害事象
体 - 真菌感染症、腹部膨満、倦怠感、疲労、無力症、発熱、胸痛、背中の痛み、悪寒、全身痛、微生物検査異常、モニリア症、膿瘍、アレルギー反応、顔面浮腫、細菌感染症、寄生虫感染症、局所浮腫、局所痛.
心臓血管 - うっ血性心不全、片頭痛、動悸、血管拡張、血腫、高血圧、低血圧。
消化器 - 嘔吐、消化不良、口渇、鼓腸、食欲減退、便秘、口腔モニリア症、食欲不振、おくび、胃炎、口内炎、胃腸障害、直腸障害、舌障害、歯障害、口渇、口腔病変、テネスムス、喉の渇き、歯痛.
血行性およびリンパ性 - 貧血。
代謝と栄養 - 脱水症、痛風、末梢浮腫、体重増加。
筋骨格 筋肉痛。
緊張 - めまい、不眠、傾眠、不安、ふらつき、神経過敏、脳梗塞、夢の変化、集中力の低下、錯乱、悪夢、感覚異常、めまい。
呼吸器 - 喘息、咳、鼻出血、鼻炎、喘鳴、気管支炎、呼吸困難、胸水、肺炎、副鼻腔炎。
肌 - 蕁麻疹、発疹、非適用部位のかゆみ、発汗、斑状丘疹発疹、真菌性皮膚炎、落屑、乾燥肌、非適用部位の脱毛、水疱性発疹、日焼け。
特別な感覚 - 味覚の変化、目の刺激、味覚の喪失、耳鳴り。
泌尿生殖器 - 血尿、尿路感染症、子宮出血、排尿障害、頻尿、夜間頻尿、陰茎感染症、タンパク尿、膣痛。
懸濁用顆粒(反復投与)
経口懸濁液用のセフポドキシム プロキセチル顆粒の複数回投与を使用した臨床試験では、2128 人の小児患者 (93% が 12 歳未満) がセフポドキシムの推奨用量 (10 mg/kg/日 Q 24 時間または分割) で治療されました。 Q 12 時間から最大等価成人用量まで)。これらの研究では、どの患者にも死亡や永続的な障害はありませんでした。 24 人の患者 (1.1%) が、治験薬に関連する可能性がある、またはおそらく関連すると思われる有害事象のために投薬を中止しました。主に、これらの中止は胃腸障害、通常は下痢、嘔吐、または発疹のためのものでした.
反復投与臨床試験 (セフポドキシムで治療された N = 2128 患者) における経口懸濁液のセフポドキシム プロキセチルとの可能性または関連性が疑われる、または関連性が不明であると考えられる有害事象は次のとおりです。
1%を超える発生率
下痢 6.0% 乳幼児(生後 1 か月から 2 歳)の下痢の発生率は 12.8% でした。おむつかぶれ・真菌性皮膚かぶれ 2.0% (モニリア症を含む) 乳幼児のおむつかぶれの発生率は 8.5% でした。その他の皮疹 1.8% 嘔吐 2.3%
1%未満の発生率
体: 局所的な腹痛、腹部痙攣、頭痛、モニリア、全身の腹痛、無力症、発熱、真菌感染。
消化器: 吐き気、モニリア、食欲不振、口渇、口内炎、偽膜性大腸炎。
ヘミック&リンパ: 血小板血症、直接クームス試験陽性、好酸球増加症、白血球増加症、白血球減少症、部分トロンボプラスチン時間の延長、血小板減少性紫斑病。
代謝と栄養: SGPT の増加。
筋骨格: 筋肉痛。
緊張: 幻覚、多動症、神経過敏、傾眠。
呼吸器: 鼻出血、鼻炎。

肌: 皮膚モニリア症、蕁麻疹、真菌性皮膚炎、にきび、剥脱性皮膚炎、黄斑丘疹の発疹。
特別な感覚: 味の倒錯。
フィルムコーティング錠(単回)
を使用した臨床試験では、 単回投与 セフポドキシム プロキセチル フィルムコーティング錠の場合、509 人の患者がセフポドキシムの推奨用量 (200 mg) で治療されました。これらの研究では、薬物毒性に関連すると考えられる死亡や永続的な障害はありませんでした。
米国で実施された単回投与の臨床試験で、セフポドキシムに関連する可能性がある、またはおそらく関連すると考えられた有害事象は次のとおりです。
1%を超える発生率
吐き気 1.4% 下痢 1.2%
1%未満の発生率
中枢神経系:めまい、頭痛、失神。皮膚科:発疹。性器:膣炎。胃腸:腹痛。精神科:不安。
実験室の変更
薬物関係に関係なく、セフポドキシム プロキセチルの臨床試験で成人および小児患者で報告された重要な実験室の変化は次のとおりです。
肝臓: AST (SGOT)、ALT (SGPT)、GGT、アルカリホスファターゼ、ビリルビン、LDH の一過性上昇。
血液学: 好酸球増加症、白血球増加症、リンパ球増加症、顆粒球増加症、好塩基球増加症、単球増加症、血小板増加症、ヘモグロビン減少、ヘマトクリット減少、白血球減少症、好中球減少症、リンパ球減少症、血小板減少症、血小板減少症、クームス試験陽性、PTおよびPTTの延長。
血清化学: 高血糖、低血糖、低アルブミン血症、低タンパク血症、高カリウム血症、低ナトリウム血症。
腎臓: BUNとクレアチニンの増加。
これらの異常のほとんどは一過性であり、臨床的に重要ではありませんでした。
マーケティング後の経験
以下の重篤な有害事象が報告されています:スティーブンス・ジョンソン症候群を含むアレルギー反応、中毒性表皮壊死融解症、多形紅斑および血清病様反応、偽膜性大腸炎、腹痛を伴う血性下痢、潰瘍性大腸炎、低血圧を伴う直腸出血、アナフィラキシーショック、急性肝障害、流産を伴う子宮内曝露、紫斑病性腎炎、好酸球増加症を伴う肺浸潤、および眼瞼皮膚炎。
1 人の死亡は、偽膜性大腸炎と播種性血管内凝固症候群によるものでした。
セファロスポリンクラスの標識
セフポドキシム プロキセチルで治療された患者で観察された上記の有害反応に加えて、セファロスポリン クラスの抗生物質について、次の有害反応および臨床検査の変更が報告されています。
有害反応および異常な臨床検査: 腎機能障害、中毒性腎症、胆汁うっ滞を含む肝機能障害、再生不良性貧血、溶血性貧血、血清病様反応、出血、無顆粒球症、および汎血球減少症。
いくつかのセファロスポリンは、特に投与量が減らされなかった場合に腎障害のある患者で発作を引き起こすことに関与しています. (見る 投薬と管理 と 過剰摂取 .) 薬物療法に関連する発作が発生した場合は、薬物を中止する必要があります。臨床的に必要な場合は、抗けいれん療法を行うことができます。
薬物相互作用
制酸剤
高用量の制酸剤(重炭酸ナトリウムと水酸化アルミニウム)またはH2ブロッカーの同時投与は、ピーク血漿レベルを24%から42%、吸収の程度をそれぞれ27%から32%低下させます。これらの併用薬によって吸収率が変わることはありません。経口抗コリン作動薬(例、プロパンテリン)は、ピーク血漿レベルを遅らせますが(Tmax の 47% 上昇)、吸収の程度(AUC)には影響しません。
プロベネシド
他のベータラクタム系抗生物質と同様に、セフポドキシムの腎排泄はプロベネシドによって阻害され、AUC が約 31% 増加し、セフポドキシムのピーク血漿レベルが 20% 増加しました。
腎毒性薬
セフポドキシム プロキセチルを単独で投与した場合の腎毒性は認められていませんが、セフポドキシム プロキセチルを腎毒性の可能性が知られている化合物と併用投与する場合は、腎機能を綿密にモニタリングすることをお勧めします。
薬物/実験室試験の相互作用
セフポドキシム プロキセチルを含むセファロスポリンは、時折、直接クームス試験で陽性を誘発することが知られています。
警告
セフポドキシム プロキシチルによる治療を開始する前に、患者がセフポドキシム、その他のセファロスポリン、ペニシリン、またはその他の薬物に対して以前に過敏反応を示したかどうかを判断するために、慎重な問診を行う必要があります。セフポドキシムがペニシリン感受性患者に投与される場合、β-ラクタム系抗生物質間の交差過敏症が明確に文書化されており、ペニシリンアレルギーの既往のある患者の最大 10% で発生する可能性があるため、注意が必要です。 CEFPODOXIME PROXETIL に対するアレルギー反応が発生した場合は、薬の使用を中止してください。深刻な急性過敏症反応は、臨床的に示されているように、酸素、静脈内輸液、静脈内抗ヒスタミン、および気道管理を含む、エピネフリンおよびその他の緊急措置による治療を必要とする場合があります。
クロストリジウム ディフィシル関連下痢症 (CDAD) は、VANTIN を含むほぼすべての抗菌薬の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗生物質の使用後に下痢を呈するすべての患者で、CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗生物質の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗生物質治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
セフポドキシム治療を受けた下痢患者の C. difficile を監視する協調的な取り組みが行われたのは、健常者を対象とした初期の試験で C. difficile に関連する下痢の発生率が増加したためです。 C. difficile 生物または毒素は、セフポドキシムで治療された下痢の成人患者の 10% で報告されました。ただし、これらの患者では偽膜性大腸炎の特定の診断は行われませんでした。
米国外での市販後の経験では、セフポドキシム プロキセチルの使用に関連する偽膜性大腸炎の報告が寄せられています。
予防
全般的
腎不全による尿量の一時的または持続的な減少がある患者では、セフポドキシム プロキセチルの 1 日総投与量を減らす必要があります。セフポドキシムは、他のセファロスポリンと同様に、強力な利尿薬による同時治療を受けている患者には注意して投与する必要があります。 (見る 投薬と管理 .)
他の抗生物質と同様に、セフポドキシム プロキセチルを長期間使用すると、非感受性生物が異常増殖する可能性があります。患者の状態を繰り返し評価することが不可欠です。治療中に重複感染が発生した場合は、適切な対策を講じる必要があります。
細菌感染が証明されている、または強く疑われる場合、または予防適応がない場合に VANTIN を処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌の発生のリスクが高まります。
発がん、突然変異誘発、生殖能力の障害
セフポドキシム プロキセチルの長期動物発がん研究は実施されていません。セフポドキシムの突然変異誘発研究には、代謝活性化の有無にかかわらずエイムズ試験、染色体異常試験、不定期 DNA 合成試験、有糸分裂組換えおよび遺伝子変換、前方遺伝子変異試験、in vivo 小核試験がすべて陰性でした。 100 mg/kg/日以下 (mg/m² に基づくヒト用量の 2 倍) をラットに経口投与した場合、受胎能または生殖に対する有害な影響は認められませんでした。
妊娠
催奇形性効果
セフポドキシム プロキセチルは、器官形成期のラットに最大 100 mg/kg/日 (mg/m² に基づくヒト用量の 2 倍) まで、またはウサギに最大 30 mg/kg/日 (1 mg/m²に基づくヒト用量の-2倍)。
しかし、妊娠中の女性におけるセフポドキシム プロキセチルの使用に関する十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるわけではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
労働と配達
分娩中のセフポドキシム プロキセチルの使用は研究されていません。明らかに必要な場合にのみ治療を行うべきです。
授乳中の母親
セフポドキシムは母乳中に排泄されます。 3 人の授乳中の女性の研究では、母乳中のセフポドキシムのレベルは、セフポドキシム プロキセチル 200 mg の経口投与後 4 時間で、付随する血清レベルの 0%、2%、および 6% でした。投与後 6 時間で、レベルは付随する血清レベルの 0%、9%、および 16% でした。授乳中の乳児は重篤な反応を起こす可能性があるため、母親にとっての薬の重要性を考慮して、授乳を中止するか薬を中止するかを決定する必要があります。
小児用
生後2ヶ月未満の乳児に対する安全性と有効性は確立されていません。
高齢者の使用
セフポドキシム プロキセチル フィルムコーティング錠の反復投与臨床試験に参加した 3,338 人の患者のうち、521 人 (16%) が 65 歳以上で、214 人 (6%) が 75 歳以上でした。高齢患者と若年患者の間で、有効性または安全性に全体的な差は見られませんでした。腎機能が正常な健康な高齢者では、セフポドキシムの血漿中半減期は平均 4.2 時間で、400 mg を 12 時間ごとに 15 日間投与した後の尿中回復率は平均 21% でした。他の薬物動態パラメーターは、健康な若い被験者で観察されたものと比較して変化がありませんでした。
腎機能が正常な高齢患者の用量調整は必要ありません。
過剰摂取
げっ歯類の急性毒性試験では、5 g/kg を 1 回経口投与しても悪影響はありませんでした。
過剰摂取による深刻な毒性反応が生じた場合、特に腎機能が損なわれている場合は、血液透析または腹膜透析が体からのセフポドキシムの除去に役立つ可能性があります。
β-ラクタム系抗生物質の過剰摂取による中毒症状には、吐き気、嘔吐、上腹部痛、下痢などがあります。
禁忌
セフポドキシム プロキセチルは、セフポドキシムまたは抗生物質のセファロスポリン群に対する既知のアレルギーのある患者には禁忌です。
臨床薬理学
吸収と排泄
セフポドキシム プロキセチルは、胃腸管から吸収され、その活性代謝物であるセフポドキシムに脱エステル化されるプロドラッグです。 100 mg のセフポドキシム プロキセチルを絶食中の被験者に経口投与した後、投与したセフポドキシム用量の約 50% が全身に吸収されました。推奨用量範囲 (100 ~ 400 mg) では、投与されたセフポドキシム用量の約 29 ~ 33% が 12 時間で変化せずに尿中に排泄されました。 in vivo でのセフポドキシムの代謝は最小限です。
食品の影響
フィルムコーティング錠を食事とともに投与すると、吸収の程度 (平均 AUC) と平均ピーク血漿濃度が増加しました。 200 mg の錠剤を食事と一緒に服用した後、AUC は絶食状態よりも 21 ~ 33% 高く、ピーク血漿濃度は平均して摂食対象で 3.1 mcg/mL であったのに対し、絶食対象では 2.6 mcg/mL でした。集中力がピークに達するまでの時間は、摂食した被験者と絶食した被験者の間で有意差はありませんでした。
200 mg の懸濁液を食物と一緒に摂取した場合、摂取した被験者の吸収の程度 (平均 AUC) と平均ピーク血漿濃度は絶食した被験者と有意差はありませんでしたが、吸収速度は食物でより遅くなりました (48% 増加)。 Tmaxで)。
セフポドキシム プロキセチル フィルムコーティング錠の薬物動態
推奨用量範囲 (100 ~ 400 mg) では、セフポドキシムの吸収速度と程度は用量依存性を示しました。用量正規化 Cmax および AUC は、用量の増加とともに最大 32% 減少しました。推奨用量範囲で、Tmax は約 2 ~ 3 時間、T½ は 2.09 ~ 2.84 時間の範囲でした。平均 Cmax は、100 mg 用量で 1.4 mcg/mL、200 mg 用量で 2.3 mcg/mL、400 mg 用量で 3.9 mcg/mL でした。腎機能が正常な患者では、400 mg Q 12 時間までの複数回経口投与後、他の薬物動態パラメーターの蓄積も有意な変化も見られませんでした。
フィルムコーティング錠投与(単回投与)後の絶食成人におけるセフポドキシム血漿レベル(mcg/mL)
セフポドキシム プロキセチル懸濁液の薬物動態
成人被験者では、経口懸濁液の 100 mg 用量は、約 1.5 mcg/mL (範囲: 1.1 ~ 2.1 mcg/mL) の平均ピーク セフポドキシム濃度を生成しました。これは、100 mg 錠剤の投与後に報告された値と同等です。経口懸濁液の血漿濃度のピークまでの時間および血漿濃度-時間曲線下面積 (AUC) も、100 mg の経口投与後の成人のフィルムコーティング錠で得られたものと同等でした。
セフポドキシムの薬物動態は、1 歳から 17 歳までの 29 人の患者で調査されました。各患者は、5 mg/kg のセフポドキシム経口懸濁液を 1 回経口投与されました。血漿および尿サンプルは、投与後 12 時間収集されました。この研究から報告された血漿レベルは次のとおりです。
懸濁液投与後の絶食患者(1~17歳)におけるセフポドキシム血漿レベル(mcg/mL)
分布
セフポドキシムのタンパク質結合は、血清で 22 ~ 33%、血漿で 21 ~ 29% の範囲です。
皮膚の水ぶくれ
200 mg または 400 mg のセフポドキシム プロキセチルを 12 時間ごとに 5 日間反復投与した後、皮膚水ぶくれ液中の平均最大セフポドキシム濃度は、それぞれ平均 1.6 および 2.8 mcg/mL でした。投与後 12 時間の皮膚水ぶくれ液セフポドキシム レベルは、200 mg および 400 mg の複数回投与レジメンで、それぞれ平均 0.2 および 0.4 mcg/mL でした。
扁桃腺組織
セフポドキシム プロキセチル フィルムコーティング錠 100 mg を単回経口投与した後、扁桃腺組織中のセフポドキシムの平均最大濃度は、投与後 4 時間で平均 0.24 mcg/g、投与後 7 時間で 0.09 mcg/g でした。投与後 4 時間以内に、血漿と扁桃腺組織の間で平衡が達成されました。投与の 12 時間後、扁桃組織でのセフポドキシムの検出は報告されませんでした。これらの結果は、セフポドキシムの濃度が、セフポドキシム プロキセチル 100 mg の投与後、少なくとも 7 時間、化膿性連鎖球菌の MIC90 を超えたことを示しています。
肺組織
セフポドキシム プロキセチル フィルムコーティング錠 200 mg を単回経口投与した後、肺組織中の平均セフポドキシム濃度の平均は、投与後 3 時間で 0.63 mcg/g、投与後 6 時間で 0.52 mcg/g、および 0.19 mcg/g でした。投与後12時間。この研究の結果は、セフポドキシムが肺組織に浸透し、S. pneumoniae および H. influenzae の MIC90 を超えるレベルでの投与後、少なくとも 12 時間持続的な薬物濃度を生成することを示しました。
CSF
セフポドキシムのCSFレベルに関する適切なデータは入手できません。
腎機能低下の影響
中等度から重度の腎機能障害のある患者では、セフポドキシムの排出量が減少します ( 予防 と 投薬と管理 .) 軽度の腎機能障害 (クレアチニンクリアランスが 50 ~ 80 mL/分) の被験者では、セフポドキシムの平均血漿半減期は 3.5 時間でした。中等度 (30 ~ 49 mL/分のクレアチニン クリアランス) または重度の腎障害 (5 ~ 29 mL/分のクレアチニン クリアランス) の被験者では、半減期はそれぞれ 5.9 時間および 9.8 時間に増加しました。投与された用量の約 23% が、標準的な 3 時間の血液透析手順で体から除去されました。
肝障害(肝硬変)の影響
肝硬変患者では、吸収は幾分減少し、排泄は変わらなかった.肝硬変患者の平均セフポドキシム T½ と腎クリアランスは、健康な被験者の研究で得られたものと同様でした。腹水は、肝硬変患者の値に影響を与えるようには見えませんでした。この患者集団では、投与量の調整は推奨されません。
高齢者における薬物動態
高齢者は、腎機能が低下していない限り、投与量を調整する必要はありません。 (見る 予防 .) 健康な高齢者では、セフポドキシムの血漿中半減期は平均 4.2 時間 (若い被験者では 3.3 時間) であり、12 時間ごとに 400 mg を投与した後の尿中回復率は平均 21% でした。他の薬物動態パラメーター (Cmax、AUC、および Tmax) は、健康な若い被験者で観察されたものと比較して変化がありませんでした。
微生物学
作用機序
セフポドキシムは、細菌の細胞壁合成を阻害することによって作用する殺菌剤です。セフポドキシムは、グラム陰性菌とグラム陽性菌のいくつかのベータ-ラクタマーゼ (ペニシリナーゼとセファロスポリナーゼの両方) の存在下で活性があります。
抵抗のメカニズム
セフポドキシムに対する耐性は、主にベータ-ラクタマーゼによる加水分解、ペニシリン結合タンパク質 (PBP) の変化、および透過性の低下によるものです。
セフポドキシムは、適応症と使用法 (1) セクションで説明されているように、in vitro および臨床感染症の両方で、以下の細菌のほとんどの分離株に対して活性であることが示されています。
グラム陽性菌
黄色ブドウ球菌(ペニシリナーゼ産生株を含むメチシリン感受性株) 黄色ブドウ球菌 肺炎連鎖球菌(ペニシリン耐性株を除く) 化膿連鎖球菌
グラム陰性菌
Escherichia coli Klebsiella pneumoniae プロテウス・ミラビリス ヘモフィルス・インフルエンザ(β-ラクタマーゼ産生株を含む) Moraxella catarrhalis Neisseria gonorrhoeae(ペニシリナーゼ産生株を含む)
以下の in vitro データが利用可能ですが、それらの臨床的意義は不明です。以下の微生物の少なくとも 90% は、セフポドキシムの感受性ブレークポイント以下の in vitro 最小発育阻止濃度 (MIC) を示します。しかし、これらの微生物による臨床感染症の治療におけるセフポドキシムの有効性は、十分に管理された適切な臨床試験では確立されていません。
グラム陽性菌
Streptococcus agalactiae Streptococcus spp. (グループC、F、G)
グラム陰性菌
シトロバクター ダイバースス クレブシエラ オキシトカ プロテウス ブルガリス プロビデンシア レットゲリ ヘモフィルス パラインフルエンザ
嫌気性グラム陽性菌
ペプトストレプトコッカス・マグナス
感受性試験方法
利用可能な場合、臨床微生物検査室は、院内および市中感染病原体の感受性プロファイルを説明する定期報告として、常駐病院で使用される抗菌薬製品の in vitro 感受性試験の結果を医師に提供する必要があります。これらのレポートは、医師が治療用の抗菌薬を選択するのに役立つはずです。
希釈法
定量的方法は、抗菌剤の最小発育阻止濃度 (MIC) を決定するために使用されます。これらの MIC は、抗菌化合物に対する細菌の感受性の推定値を提供します。 MIC は、標準化された試験方法を使用して決定する必要があります。 MIC 値は、表 1 に示す基準に従って解釈する必要があります。
拡散テクニック
ゾーンの直径の測定を必要とする定量的方法も、抗菌化合物に対する細菌の感受性の再現可能な推定値を提供します。ゾーンのサイズは、抗菌化合物に対する細菌の感受性の推定値を提供します。ゾーンのサイズは、標準化されたテスト方法を使用して決定する必要があります。この手順では、10 mcg のセフポドキシムを含浸させた紙ディスクを使用して、微生物のセフポドキシムに対する感受性をテストします。ディスク拡散の解釈基準を表 1 に示します。
Susceptible のレポートは、抗菌化合物が感染部位で病原体の増殖を阻害するのに必要な濃度に達すると、抗菌剤が病原体の増殖を阻害する可能性が高いことを示しています。中間のレポートは、結果が曖昧であると見なされるべきであることを示しており、微生物が代替の臨床的に実行可能な薬物に対して完全に感受性でない場合は、テストを繰り返す必要があります。このカテゴリーは、薬物が生理学的に集中している身体部位、または高用量の薬物を使用できる状況での臨床応用の可能性を示唆しています。このカテゴリは、制御されていない小さな技術的要因が解釈に大きな矛盾を引き起こすのを防ぐ緩衝地帯も提供します。 Resistant の報告は、抗菌化合物が感染部位で通常達成可能な濃度に達した場合、抗菌剤が病原体の増殖を阻害する可能性が低いことを示しています。他の治療法を選択する必要があります。
品質管理
標準化された感受性試験手順では、実験室での管理を使用して、アッセイで使用される消耗品と試薬の精度と精度、および試験を実施する個人の技術を監視および確認する必要があります1,2,3。標準的なセフポドキシム粉末は、表 2 に示す次の範囲の MIC 値を提供する必要があります。10 mcg ディスクを使用した拡散法では、表 2 の基準を達成する必要があります。
臨床試験
膀胱炎
米国の成人を対象に実施された 2 つの二重盲検 2:1 無作為化比較試験で、セフポドキシム プロキセチルが他のベータラクタム系抗生物質と比較されました。これらの研究では、治療後 5 ~ 9 日で以下の除菌率が得られました。
これらの研究では、セフポドキシム プロキセチルの臨床治癒率と除菌率は比較薬と同等でした。しかし、臨床治癒率と細菌学的根絶率は、膀胱炎の承認された他のクラスの薬剤で観察されたものよりも低かった.
急性中耳炎研究
米国で実施された急性中耳炎の対照研究では、かなりの割合でベータラクタマーゼ産生生物が発見され、セフポドキシム プロキセチルがセフィキシムと比較されました。これらの研究では、治療後 4 ~ 21 日間のフォローアップで非常に厳密な評価基準と微生物学的および臨床反応基準を使用して、次の推定細菌根絶/臨床成功結果 (治癒および改善) が得られました。
参考文献
1. Clinical and Laboratory Standards Institute (CLSI)。好気的に増殖する細菌の希釈抗菌薬感受性試験の方法;承認済み規格 - 第 9 版。 CLSI ドキュメント M07-A9、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA、2012。
2. Clinical and Laboratory Standards Institute (CLSI)。抗菌薬感受性試験の性能基準;第 23 情報補足、CLSI ドキュメント M100-S23。 CLSI ドキュメント M100-S23、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA、2013。
3. Clinical and Laboratory Standards Institute (CLSI)。抗菌ディスク拡散感受性試験の性能基準;承認済み標準 - 第 11 版 CLSI ドキュメント M02-A11、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA、2012。
患者情報
VANTIN を含む抗菌薬は細菌感染症の治療にのみ使用するよう患者に説明する必要があります。ウイルス感染症(風邪など)は治療しません。細菌感染症を治療するために VANTIN が処方された場合、患者は、治療過程の早い段階で気分が良くなるのが一般的ですが、薬は指示どおりに服用する必要があることを伝えなければなりません。投与をスキップしたり、治療の全コースを完了しないと、(1) 即時治療の有効性が低下し、(2) 細菌が耐性を獲得し、将来的にバンタンや他の抗菌薬で治療できなくなる可能性が高くなります。
下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると終了します。抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
