Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ジプレキサ10mgとは何ですか?
ジプレキサは、統合失調症および双極性障害 (躁うつ病) の症状を治療するために使用される処方薬です。ジプレキサは、単独で使用することも、他の薬と併用することもできます。
- ジプレキサは、抗精神病薬、第 2 世代、抗躁薬と呼ばれるクラスの薬に属します。
- ジプレキサが 13 歳未満の子供に安全で有効であるかどうかはわかっていません。
ジプレキサ15mgで起こりうる副作用は何ですか?
ジプレキサは、次のような深刻な副作用を引き起こす可能性があります。
- 顔の制御されていない筋肉の動き (噛む、唇を鳴らす、顔をしかめる、舌の動き、まばたき、目の動き)、
- 話したり飲み込んだりするのに問題があり、
- 手や足のむくみ、
- 錯乱、
- 異常な思考や行動、
- 幻覚、
- 自分を傷つけることについての考え、
- 突然の脱力感や気分の悪さ、
- 熱、
- 寒気、
- 喉の痛み、
- 腫れた歯茎、
- 痛い口内炎、
- 飲み込むときの痛み、
- 皮膚のただれ、
- 風邪やインフルエンザの症状、
- 咳、
- のどが渇いたり、熱くなったり、
- 排尿不能、
- 激しい発汗、
- 暑いまたは乾燥した肌、
- 上腹部の痛み、
- かゆみ、
- 食欲減少、
- 暗い尿、
- 粘土色の便、
- 皮膚や目の黄変(黄疸)、
- 喉の渇きが増し、
- 排尿の増加、
- 飢え、
- 口渇、
- フルーティーな口臭、
- 眠気、
- ぼやけた視界、
- 減量、
- 非常に硬い筋肉、
- 高熱、
- 錯乱、
- 速いまたは不均一な心拍、
- 振戦、および
- 立ちくらみ
上記の症状がある場合は、すぐに医療機関を受診してください。
ジプレキサの最も一般的な副作用は次のとおりです。
- 体重増加(ティーンエイジャーでより一般的)、
- 食欲増進、
- 頭痛、
- めまい、
- 眠気、
- 疲労感や落ち着きのなさ、
- 言語または記憶の問題、
- 震えや震え、
- しびれやチクチク感、
- 性格の変化、
- 口渇、
- 唾液分泌の増加、
- 胃痛、
- 便秘、および
- 腕や脚の痛み
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ジプレキサの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
認知症関連精神病の高齢患者における死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。主に非定型抗精神病薬を服用している患者を対象とした 17 のプラセボ対照試験 (モーダル期間 10 週間) の分析により、薬物治療を受けた患者の死亡リスクは、プラセボ治療を受けた患者の死亡リスクの 1.6 ~ 1.7 倍であることが明らかになりました。典型的な 10 週間の対照試験の過程で、薬物治療を受けた患者の死亡率は約 4.5% であり、プラセボ群では約 2.6% でした。死因はさまざまであるが、ほとんどの死因は心血管疾患(例、心不全、突然死)または感染症(例、肺炎)のいずれかであると思われた。観察研究は、非定型抗精神病薬と同様に、従来の抗精神病薬による治療が死亡率を増加させる可能性があることを示唆しています。観察研究における死亡率の増加の所見が、患者のいくつかの特徴とは対照的に、抗精神病薬に起因する可能性がある程度は明らかではありません.ジプレキサ(オランザピン)は、認知症関連の精神病患者の治療には承認されていません[参照 警告と注意事項 と 患者情報 ]。
ZYPREXA 15mg とフルオキセチンを併用する場合は、Symbyax の添付文書の囲み警告セクションも参照してください。
説明
ジプレキサ(オランザピン)は、チエノベンゾジアゼピン系に属する非定型抗精神病薬です。化学名は、2-メチル-4-(4-メチル-1-ピペラジニル)-10H-チエノ[2,3-b][1,5]ベンゾジアゼピンです。分子式は C17H20N4S で、分子量 312.44 に相当します。化学構造は次のとおりです。
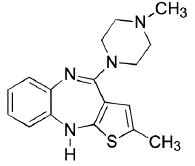
オランザピンは黄色の結晶性固体で、水にほとんど溶けません。
ジプレキサ 7.5mg 錠は、経口投与のみを目的としています。
各錠剤には、2.5 mg (8 μmol)、5 mg (16 μmol)、7.5 mg (24 μmol)、10 mg (32 μmol)、15 mg (48 μmol)、または 20 mg (64 μmol) に相当するオランザピンが含まれています。不活性成分は、カルナウバワックス、クロスポビドン、ヒドロキシプロピルセルロース、ヒプロメロース、ラクトース、ステアリン酸マグネシウム、微結晶性セルロース、およびその他の不活性成分です。カラー コーティングには、二酸化チタン (全強度)、FD&C ブルー No. 2 アルミニウム レーキ (15 mg)、または合成赤色酸化鉄 (20 mg) が含まれています。 2.5、5、7.5、および 10 mg の錠剤は、FD&C Blue No. 2 アルミニウム レーキを含む食用インクで刻印されています。
ジプレキサ 2.5mg ザイディス (オランザピン口腔内崩壊錠) は、経口投与のみを目的としています。
各口腔内崩壊錠には、5mg(16μmol)、10mg(32μmol)、15mg(48μmol)または20mg(64μmol)相当のオランザピンが含まれています。口の中で数秒以内に崩壊し始め、その後、液体の有無にかかわらず内容物を飲み込むことができます。 ZYPREXA 15mg ZYDIS (オランザピン口腔内崩壊錠) には、ゼラチン、マンニトール、アスパルテーム、メチル パラベン ナトリウム、プロピルパラベン ナトリウムの不活性成分も含まれています。
ZYPREXA 2.5mg IntraMuscular (注射用オランザピン) は、筋肉内使用のみを目的としています。
各バイアルは、不活性成分である50mgのラクトース一水和物および3.5mgの酒石酸を含む10mg(32μmol)のオランザピンの投与を提供します。製造時に塩酸や水酸化ナトリウムを添加してpHを調整している場合があります。
適応症
統合失調症
経口ジプレキサは、統合失調症の治療に適応されます。統合失調症の成人患者を対象とした 3 つの臨床試験 (2 つの 6 週間試験と 1 つの維持試験) で有効性が確立されました。思春期の統合失調症患者(13~17 歳)では、1 回の 6 週間の試験で有効性が確立された [参照 臨床研究 ]。
青年期に利用できる代替治療を決定する際、臨床医は、(成人と比較して青年期に) 体重増加と脂質異常症の可能性が高いことを考慮する必要があります。臨床医は、思春期の若者に処方する際に潜在的な長期的なリスクを考慮する必要があり、多くの場合、これにより、思春期の若者に最初に他の薬を処方することを検討するようになる可能性があります [参照 警告と注意事項 ]。
双極Ⅰ型障害(躁病または混合エピソード)
単剤療法
経口ジプレキサは、双極 I 型障害に関連する躁病または混合性エピソードの急性治療、および双極 I 型障害の維持治療に適応されます。有効性は、躁病または双極 I 型障害の混合エピソードを有する成人患者を対象とした 3 つの臨床試験で確立されました。双極 I 型障害に関連する躁病エピソードまたは混合エピソードを有する思春期の患者 (13 ~ 17 歳) では、1 回の 3 週間の試験で有効性が確立されました [参照 臨床研究 ]。
青年期に利用できる代替治療を決定する際、臨床医は、(成人と比較して青年期に) 体重増加と脂質異常症の可能性が高いことを考慮する必要があります。臨床医は、思春期の若者に処方する際に潜在的な長期的なリスクを考慮する必要があり、多くの場合、これにより、思春期の若者に最初に他の薬を処方することを検討するようになる可能性があります [参照 警告と注意事項 ]。
リチウムまたはバルプロ酸の補助療法
経口ジプレキサ 5 mg は、リチウムまたはバルプロ酸の補助として、双極 I 型障害に関連する躁病または混合エピソードの治療に適応されます。有効性は、成人を対象とした 2 つの 6 週間の臨床試験で確立されました。長期使用に対する補助療法の有効性は、対照試験では体系的に評価されていない[参照 臨床研究 ]。
小児統合失調症および双極 I 型障害の治療における特別な考慮事項
小児統合失調症と双極 I 型障害は深刻な精神障害です。ただし、診断は困難な場合があります。小児統合失調症の場合、症状のプロファイルはさまざまであり、双極 I 型障害の場合、小児患者は、躁病または混合症状の周期性のさまざまなパターンを持つ可能性があります。小児の統合失調症および双極 I 型障害の薬物療法は、徹底的な診断評価が行われ、薬物療法に伴うリスクが慎重に考慮された後にのみ開始することをお勧めします。小児統合失調症と双極 I 型障害の薬物治療は、心理的、教育的、社会的介入を含む総合治療プログラムの一部であるべきです。
ジプレキサ 15mg 筋肉内投与: 統合失調症および双極 I マニアに関連する動揺
ZYPREXA 15mg IntraMuscular は、統合失調症および双極Ⅰ型躁病に関連する急性興奮の治療に適応されます。
統合失調症または双極 I 型障害(躁病エピソードまたは混合エピソード)の動揺した成人入院患者を対象とした 3 つの短期(24 時間の IM 治療)プラセボ対照試験で有効性が実証されました。 臨床研究 ]。
「精神運動性激越」は、DSM-IV で「内面の緊張感に伴う過度の運動活動」と定義されています。動揺を経験している患者は、しばしば、診断とケアを妨げる行動を示します。たとえば、脅迫的な行動、エスカレートする行動、緊急に苦痛を与える行動、または自己消耗的な行動などです。
ジプレキサとフルオキセチンの併用: 双極 I 型障害に関連する抑うつエピソード
経口ジプレキサとフルオキセチンの併用は、臨床研究に基づいて、双極 I 型障害に関連する抑うつエピソードの治療に適応されます。ジプレキサ 10mg とフルオキセチンを併用する場合は、Symbyax の添付文書の臨床試験のセクションを参照してください。
ジプレキサ単剤療法は、双極 I 型障害に関連する抑うつエピソードの治療には適応されません。
ジプレキサとフルオキセチンの併用:治療抵抗性うつ病
経口ジプレキサとフルオキセチンの併用は、成人患者の臨床研究に基づいて、治療抵抗性うつ病 (現在のエピソードで適切な用量と期間の異なる抗うつ薬の 2 つの別々の試験に反応しない患者の大うつ病性障害) の治療に適応されます。 . ZYPREXA とフルオキセチンを併用する場合は、Symbyax の添付文書の臨床試験のセクションを参照してください。
ジプレキサ 5mg の単剤療法は、治療抵抗性うつ病の治療には適応されません。
投薬と管理
統合失調症
大人
用量選択
経口オランザピンは、食事に関係なく 1 日 1 回のスケジュールで投与する必要があります。通常、最初は 5 ~ 10 mg から開始し、数日以内に 1 日あたり 10 mg の目標用量を使用します。オランザピンの定常状態は、典型的な患者では約 1 週間で達成されないため、必要に応じてさらに用量を調整する場合は、一般に 1 週間以上の間隔で行う必要があります。投与量の調整が必要な場合は、5 mg QD ずつ投与量を増減することをお勧めします。
統合失調症における有効性は、臨床試験で 10 ~ 15 mg/日の用量範囲で実証されました。ただし、10 mg/日を超える用量は、10 mg/日用量よりも効果的であることが実証されていません。目標用量の 10 mg/日よりも多い用量 (すなわち、15 mg/日以上の用量) への増量は、臨床評価後にのみ推奨されます。オランザピンは、20 mg/日を超える用量での使用には適応されていません。
特別な集団への投与
衰弱している患者、低血圧反応の素因がある患者、またはオランザピンの代謝が遅くなる可能性のある要因の組み合わせを示す患者(例、65 歳以上の非喫煙女性患者)の推奨開始用量は 5 mg です。オランザピンに対して薬力学的に敏感な人[参照 警告と注意事項 、 薬物相互作用 、 と 臨床薬理学 ]。必要に応じて、これらの患者では用量漸増を慎重に行う必要があります。
維持治療
ジプレキサで約8週間安定し、その後再発を追跡した統合失調症患者の治療反応を維持する上での経口オランザピン10mg/日~20mg/日の有効性は、プラセボ対照試験で実証されている[ 臨床研究 ]。ジプレクサを長期間使用することを選択した医療提供者は、個々の患者に対する薬剤の長期的な有用性を定期的に再評価する必要があります。
青少年
用量選択
経口オランザピンは、食事に関係なく 1 日 1 回のスケジュールで投与する必要があり、推奨される開始用量は 2.5 または 5 mg、目標用量は 10 mg/日です。統合失調症の青年における有効性は、臨床試験で 2.5 から 20 mg/日の柔軟な用量範囲に基づいて実証され、平均モーダル用量は 12.5 mg/日 (平均用量は 11.1 mg/日) でした。投与量の調整が必要な場合は、2.5 または 5 mg の投与量の増減が推奨されます。
20 mg/日を超える用量の安全性と有効性は、臨床試験で評価されていません [参照 臨床研究 ]。
維持治療
思春期集団における統合失調症の維持治療に対するジプレキサの有効性は、体系的に評価されていません。ただし、維持の有効性は、成人患者と青年患者におけるオランザピンの薬物動態パラメータの比較とともに、成人データから推定できます。したがって、応答患者は急性応答を超えて継続することが一般的に推奨されますが、寛解を維持するために必要な最低用量です。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります。
双極Ⅰ型障害(躁病または混合エピソード)
大人
単剤療法の用量選択
経口オランザピンは、食事に関係なく 1 日 1 回のスケジュールで投与する必要があり、通常は 10 または 15 mg から開始します。投与量の調整は、必要に応じて、プラセボ対照試験の手順を反映して、一般に 24 時間以上の間隔で行う必要があります。投与量の調整が必要な場合は、5 mg QD ずつ投与量を増減することをお勧めします。
短期間(3~4 週間)の抗躁効果は、臨床試験で 5 ~ 20 mg/日の用量範囲で実証されました。 20 mg/日を超える用量の安全性は、臨床試験で評価されていません [ 臨床研究 ]。
維持単剤療法
平均2週間のレスポンダー状態を達成した後、5~20mg/日の経口ジプレキサ10mgによる単剤療法で双極I型患者を維持することの利点は、対照試験で実証された[参照] 臨床研究 ]。ジプレクサを長期間使用することを選択した医療提供者は、個々の患者に対する薬剤の長期的な有用性を定期的に再評価する必要があります。
補助療法の用量選択
リチウムまたはバルプロ酸の補助療法として投与する場合、オランザピンの経口投与は、通常、食事に関係なく、1 日 1 回 10 mg から開始する必要があります。
抗躁効果は、臨床試験で 1 日 5 ~ 20 mg の用量範囲で実証されています [参照 臨床研究 ]。 20 mg/日を超える用量の安全性は、臨床試験で評価されていません。
青少年
用量選択
経口オランザピンは、食事に関係なく 1 日 1 回のスケジュールで投与する必要があり、推奨される開始用量は 2.5 または 5 mg、目標用量は 10 mg/日です。双極 I 型障害 (躁病または混合エピソード) の青年における有効性は、臨床試験で 2.5 ~ 20 mg/日の柔軟な用量範囲に基づいて実証され、平均モーダル用量は 10.7 mg/日 (平均用量は 8.9 mg/日) )。投与量の調整が必要な場合は、2.5 または 5 mg の投与量の増減が推奨されます。
20 mg/日を超える用量の安全性と有効性は、臨床試験で評価されていません [参照 臨床研究 ]。
維持治療
青少年集団における双極 I 型障害の維持治療に対するジプレキサ 7.5mg の有効性は評価されていません。ただし、維持の有効性は、成人患者と青年患者におけるオランザピンの薬物動態パラメータの比較とともに、成人データから推定できます。したがって、応答患者は急性応答を超えて継続することが一般的に推奨されますが、寛解を維持するために必要な最低用量です。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります。
ジプレキサ ザイディス(オランザピン口腔内崩壊錠)の投与
小袋を開封したら、ブリスターのホイルをはがします。ホイルを通して錠剤を押し出さないでください。ブリスターを開けたらすぐに、乾いた手で錠剤を取り出し、ジプレキサ 15mg ザイディス全体を口に入れます。錠剤は唾液中で急速に崩壊するため、液体の有無にかかわらず簡単に飲み込むことができます。
ジプレキサ 筋肉内: 統合失調症および双極 I マニアに関連する動揺
統合失調症および双極 I マニアの興奮した成人患者の用量選択
これらの障害における激越の制御における注射用筋肉内オランザピンの有効性は、2.5mg~10mgの用量範囲で実証された。これらの患者の推奨用量は 10 mg です。臨床的要因が必要な場合は、5 または 7.5 mg の低用量を考慮してもよい [参照 臨床研究 ]。追加の筋肉内投与を正当化する動揺が最初の投与後に持続する場合は、10 mg までのその後の投与を行うことができます。ただし、興奮状態の患者にオランザピンを筋肉注射で反復投与した場合の有効性は、対照臨床試験で体系的に評価されていません。また、30 mg を超える 1 日総投与量、または 1 回目の投与後 2 時間以上、および 2 回目の投与後 4 時間よりも頻繁に 10 mg を注射した場合の安全性は、臨床試験で評価されていません。筋肉内オランザピンの最大用量 (例えば、2~4 時間間隔で 10 mg を 3 回投与) は、重大な起立性低血圧の実質的な発生と関連している可能性があります [参照 警告と注意事項 ]。したがって、その後の筋肉内注射を必要とする患者は、注射用の筋肉内オランザピンのその後の投与量を投与する前に、起立性低血圧について評価することをお勧めします。収縮期血圧に臨床的に重大な姿勢変化がある患者への追加投与は推奨されません。
進行中のオランザピン療法が臨床的に適応となる場合、経口オランザピンは、臨床的に適切な状態になり次第、5~20mg/日の範囲で開始することができます[ 統合失調症 と 双極Ⅰ型障害(躁病または混合エピソード) ]。
特別な集団における筋肉内投与
高齢患者やその他の臨床的要因が必要な場合は、5 mg/回の投与量を検討する必要があります。衰弱している可能性がある患者、低血圧反応の素因がある患者、またはオランザピンに対する薬力学的感受性が高い患者には、2.5 mg/回の低用量を検討する必要があります。 警告と注意事項 、 薬物相互作用 、 と 臨床薬理学 ]。
ジプレキサの筋肉内投与
ジプレキサ イントラ マッスルは、筋肉内使用のみを目的としています。静脈内または皮下に投与しないでください。ゆっくりと筋肉の奥深くまで注入します。非経口医薬品は、溶液と容器が許す限り、投与前に粒子状物質と変色がないか目視検査する必要があります。
ジプレキサ 2.5mg 筋肉内注射用滅菌水を含む製剤の説明書
オランザピンの約 5 mg/mL を含むソリューションを提供する注射用滅菌水 2.1 mL を使用してバイアルの内容を溶解します。得られた溶液は透明で黄色に見えるはずです。注射用滅菌水で再構成されたジプレキサ 7.5mg 筋肉内注射は、再構成後すぐに (1 時間以内に) 使用する必要があります。未使用部分は廃棄してください。
次の表は、注射用滅菌水で再構成された注射用オランザピンのさまざまな用量を筋肉内投与するための注射量を示しています。
身体的不適合情報
ZYPREXA 15mg IntraMuscular は、滅菌注射用水のみで再構成する必要があります。 ZYPREXA 20mg IntraMuscular は、これらの製品を混合すると沈殿が生じるため、注射器でジアゼパム注射と組み合わせて使用しないでください。ロラゼパム注射は、ジプレキサ イントラマッスルの再構成に使用しないでください。この組み合わせは、再構成に時間がかかるためです。 ZYPREXA IntraMuscular は注射器内でハロペリドール注射と組み合わせて使用しないでください。これは、低 pH が時間の経過とともにオランザピンを分解することが示されているためです。
ジプレキサ 20mg とフルオキセチンの併用: 双極 I 型障害に関連する抑うつエピソード
ジプレキサ 7.5mg とフルオキセチンを併用する場合は、Symbyax の添付文書の臨床試験のセクションも参照してください。
大人
経口オランザピンは、食事に関係なく、通常は経口オランザピン 5 mg とフルオキセチン 20 mg から始めて、1 日 1 回夕方にフルオキセチンと組み合わせて投与する必要があります。必要に応じて、経口オランザピン 5 ~ 12.5 mg およびフルオキセチン 20 ~ 50 mg の用量範囲内で、有効性と忍容性に従って用量調整を行うことができます。オランザピン 6 ~ 12 mg とフルオキセチン 25 ~ 50 mg の用量範囲の成人患者において、ZYPREXA 10 mg とフルオキセチンの併用で抗うつ効果が実証されました。オランザピン 18 mg 以上とフルオキセチン 75 mg の同時投与の安全性は、臨床研究では評価されていません。
子供と青年(10~17歳)
経口オランザピンは、食事に関係なく、1 日 1 回、夜にフルオキセチンと組み合わせて投与する必要があります。通常は、経口オランザピン 2.5 mg とフルオキセチン 20 mg から始めます。必要に応じて、有効性と忍容性に応じて用量を調整することができます。オランザピン 12 mg 以上とフルオキセチン 50 mg の同時投与の安全性は、小児科の臨床研究では評価されていません。
ZYPREXA とフルオキセチンの併用の安全性と有効性は、Symbyax (ZYPREXA とフルオキセチンの固定用量併用) の承認を裏付ける臨床試験で確認されました。 Symbyax は、1 日あたり 3 mg/25 mg (オランザピン/フルオキセチン) から 12 mg/50 mg (オランザピン/フルオキセチン) の間で投与されます。次の表は、Symbyax に対する ZYPREXA 10mg とフルオキセチンの適切な個々の成分用量を示しています。必要に応じて、有効性と忍容性に応じて個々の成分で用量調整を行う必要があります。
ジプレキサとフルオキセチンの併用で治療された患者がどのくらい継続すべきかという疑問に答える証拠はありませんが、双極 I 障害に関連する抑うつエピソードを含む双極 I 障害は慢性疾患であると一般に認められています。慢性的な治療が必要な病気。医療提供者は、継続的な薬物療法の必要性を定期的に再検討する必要があります。
ジプレキサ 5mg 単剤療法は、双極 I 型障害に関連する抑うつエピソードの治療には適応されません。
ジプレキサ 7.5mg とフルオキセチンの併用:治療抵抗性うつ病
ジプレキサとフルオキセチンを併用する場合は、シンビアックスの添付文書の臨床試験のセクションも参照してください。
経口オランザピンは、食事に関係なく、通常は経口オランザピン 5 mg とフルオキセチン 20 mg から始めて、1 日 1 回夕方にフルオキセチンと組み合わせて投与する必要があります。必要に応じて、経口オランザピン 5 ~ 20 mg およびフルオキセチン 20 ~ 50 mg の用量範囲内で、有効性と忍容性に従って用量調整を行うことができます。オランザピン 6 から 18 mg とフルオキセチン 25 から 50 mg の用量範囲の成人患者において、オランザピンとフルオキセチンの組み合わせによる抗うつ効果が実証されました。
フルオキセチンと組み合わせたオランザピンの安全性と有効性は、Symbyax (オランザピンとフルオキセチンの固定用量の組み合わせ) の承認をサポートする臨床試験で決定されました。 Symbyax は、1 日あたり 3 mg/25 mg (オランザピン/フルオキセチン) から 12 mg/50 mg (オランザピン/フルオキセチン) の間で投与されます。上記の表 1 は、Symbyax に対する ZYPREXA およびフルオキセチンの適切な個々の成分用量を示しています。必要に応じて、有効性と忍容性に応じて個々の成分で用量調整を行う必要があります。
ジプレキサとフルオキセチンの併用で治療された患者がどのくらいの期間継続すべきかという疑問に答える証拠はありませんが、一般的に治療抵抗性うつ病 (成人患者における大うつ病性障害で、2 つの治療に反応しないもの) が認められています現在のエピソードで適切な用量と期間のさまざまな抗うつ薬の試験)は、慢性治療を必要とする慢性疾患です。医療提供者は、継続的な薬物療法の必要性を定期的に再検討する必要があります。
オランザピン 18 mg 以上とフルオキセチン 75 mg の同時投与の安全性は、臨床研究では評価されていません。
ジプレキサ 7.5mg 単剤療法は、治療抵抗性うつ病 (現在のエピソードで適切な用量と期間の 2 つの抗うつ薬に反応しない患者における大うつ病性障害) の治療には適応されません。
ジプレキサ 10mg とフルオキセチンの併用:特別な集団での投与
オランザピン 2.5~5 mg とフルオキセチン 20 mg の経口投与の開始用量は、低血圧反応の素因がある患者、肝障害のある患者、またはオランザピンまたはフルオキセチンの併用による代謝を遅らせる可能性のある要因の組み合わせを示す患者に使用する必要があります。 (女性、高齢、禁煙状態)、またはオランザピンに薬力学的に敏感である可能性のある患者。代謝を遅らせる可能性のある要因の組み合わせを示す患者では、投与量の変更が必要になる場合があります。必要に応じて、これらの患者では用量漸増を慎重に行う必要があります。ジプレキサとフルオキセチンの併用は、65 歳以上の患者または 10 歳未満の患者を対象とした体系的な研究は行われていません [ 警告と注意事項 、 薬物相互作用 、 と 臨床薬理学 ]。
供給方法
剤形と強度
ジプレクサの 2.5 mg、5 mg、7.5 mg、および 10 mg の錠剤は白色で丸く、青色のインクで LILLY と錠剤番号が刻印されています。 15 mg の錠剤は楕円形で青色で、LILLY と錠剤番号が刻印されています。 20 mg の錠剤は楕円形でピンク色で、LILLY と錠剤番号が刻印されています。錠剤は採点されません。タブレットは次のように利用できます。
ジプレキサ10mg ザイディス (オランザピン口腔内崩壊錠)は、黄色で丸く、錠剤の強度でデボス加工されています。錠剤は採点されません。タブレットは次のように利用できます。
ジプレキサ 15mg 筋肉内 10 mg バイアル (1 秒) で入手できます。
ジプレクサの 2.5 mg、5 mg、7.5 mg、および 10 mg の錠剤は白色で丸く、青色のインクで LILLY と錠剤番号が刻印されています。 15 mg の錠剤は楕円形で青色で、LILLY と錠剤番号が刻印されています。 20 mg の錠剤は楕円形でピンク色で、LILLY と錠剤番号が刻印されています。タブレットは次のように利用できます。
ジプレキサ 2.5mg ザイディス (オランザピン口腔内崩壊錠)は、黄色で丸く、錠剤の強度でデボス加工されています。タブレットは次のように利用できます。
ジプレキサ イントラマッスル で利用可能です:
NDC 0002-7597-01 (No.VL7597) - 10mgバイアル (1s)
保管と取り扱い
ジプレクサ錠剤、ジプレクサ ザイディス、およびジプレクサ イントラマッスル バイアル (再構成前) は、20° ~ 25°C (68° ~ 77°F) に制御された室温で保管してください [ USP ]。再構成されたジプレキサ 20mg イントラマッスルは、20°~25°C (68°~77°F) に制御された室温で保存できます [参照 USP 必要に応じて最大 1 時間。再構成された ZYPREXA IntraMuscular の未使用部分は廃棄してください。 USP は、制御された室温を、20° ~ 25°C (68° ~ 77°F) の通常および慣習的な作業環境を含むサーモスタットで維持される温度と定義しています。その結果、計算された平均運動温度が 25°C を超えない。また、薬局、病院、倉庫で経験されている 15° ~ 30°C (59° ~ 86°F) の範囲での移動が可能です。
ジプレクサ錠とジプレクサ ザイディスを光と湿気から守ります。 ZYPREXA IntraMuscular を光から保護し、凍結しないでください。
販売元: Lilly USA, LLC, Indianapolis, IN 46285, USA.改訂: 2019 年 10 月
副作用
ジプレキサ 2.5mg とフルオキセチンを併用する場合は、Symbyax の添付文書の副作用のセクションも参照してください。
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映または予測することはできません。
成人における臨床試験
以下のオランザピンに関する情報は、オランザピンに約 4,765 患者年暴露した 10,504 人の成人患者と、オランザピンの筋肉内注射に暴露した 722 人の患者で構成されるオランザピンの臨床試験データベースから得られたものです。このデータベースには次のものが含まれます。(1) 1995 年 2 月 14 日現在、統合失調症およびアルツハイマー病の経口オランザピンの市販前試験に参加した 2,500 人の患者。 (2) 経口オランザピンの市販前双極 I 型障害 (躁病または混合エピソード) 試験に参加した 182 人の患者は、約 66 患者年暴露に相当します。 (3) アルツハイマー病に関連するさまざまな精神症状を有する患者の経口オランザピン試験に参加した 191 人の患者は、約 29 患者年の曝露に相当します。 (4) 2001 年 12 月 31 日現在、88 の経口オランザピン臨床試験からの 5788 人の追加患者。 (5) 2011 年 10 月 31 日現在、41 件のオランザピン臨床試験から 1843 人の追加患者。 (6) 統合失調症、双極 I 型障害 (躁病または混合エピソード)、または認知症の興奮状態の患者を対象に、オランザピンの筋肉内注射による市販前試験に参加した 722 人の患者。また、以下には、リチウムまたはバルプロ酸と組み合わせたオランザピンの市販前 6 週間臨床研究データベースからの情報も含まれています。このデータベースは、約 22 患者年暴露の双極 I 型障害 (躁病または混合エピソード) 試験に参加した 224 人の患者で構成されています。
オランザピンによる治療の条件と期間は大きく異なり、研究の非盲検および二重盲検段階、入院患者と外来患者、固定用量と用量滴定研究、および短期または長期暴露が含まれていました (重複するカテゴリーに)。 .有害反応は、有害反応、身体検査の結果、バイタルサイン、体重、検査分析物、心電図、胸部 X 線、および眼科検査の結果を収集することによって評価されました。
客観的または数値的な安全性パラメーター、すなわち用量依存性の有害反応、バイタルサインの変化、体重増加、臨床検査値の変化、および心電図の変化に関する以下の議論の特定の部分は、統合失調症患者の研究から得られたものであり、双極 I 型障害については再現されていません。 (躁病または混合エピソード)または動揺。ただし、この情報は一般に、双極 I 型障害 (躁病または混合エピソード) および激越にも当てはまります。
曝露中の有害反応は、自発的な報告によって得られ、臨床研究者が独自に選んだ用語を使用して記録されました。したがって、最初に同様のタイプの反応を少数の標準化された反応カテゴリーにグループ化することなく、有害反応を経験している個人の割合の意味のある推定値を提供することはできません.以下の表と表では、報告された副作用を分類するために MedDRA と COSTART 辞書の用語が使用されています。
記載されている有害反応の頻度は、記載されている種類の治療に伴う有害反応を少なくとも 1 回経験した個人の割合を表しています。ベースライン評価後の治療中に反応が初めて発生した場合、または悪化した場合、反応は緊急治療と見なされました。報告された反応には、参考にならないほど一般的な反応用語は含まれていません。ラベルの他の場所に記載されている反応は、以下で繰り返されない場合があります。オランザピンによる治療中に反応が起こったが、必ずしもオランザピンによって引き起こされたわけではないことを強調することは重要です.オランザピンの安全性プロファイルを完全に理解するには、ラベル全体を読む必要があります。
処方者は、患者の特徴やその他の要因が臨床試験で一般的だったものとは異なる通常の医療行為における副作用の発生率を予測するために、表および表の数値を使用できないことに注意する必要があります。同様に、引用された頻度は、異なる治療法、使用法、および研究者を含む他の臨床研究から得られた数値と比較することはできません.しかし、引用された数値は、調査対象集団における有害反応の発生率に対する薬物因子と非薬物因子の相対的な寄与を推定するための根拠を、処方する医療提供者に提供します。
短期、プラセボ対照および併用試験における有害反応の発生率
以下の調査結果は、(1) 統合失調症、双極 I 型障害 (躁病または混合エピソード) に対する経口オランザピンの市販前試験、その後のアルツハイマー病に関連するさまざまな精神症状を有する患者の試験、および市販前の併用試験、および (2 ) 統合失調症または双極Ⅰ型躁病の動揺した患者への注射用の筋肉内オランザピン。
短期間のプラセボ対照試験における治療中止に伴う有害反応
統合失調症
全体として、副作用による中止の発生率に差はありませんでした (経口オランザピンで 5% 対 プラセボで 6%)。ただし、ALT の上昇による中止は薬物に関連していると考えられました (経口オランザピンで 2%、プラセボで 0%)。
双極 I 型障害 (躁病または混合エピソード) 単剤療法
全体として、副作用による中止の発生率に差はありませんでした (経口オランザピンで 2% 対 プラセボで 2%)。
攪拌
全体として、有害反応による中止の発生率に差はありませんでした(オランザピンの筋肉内注射で 0.4% 対 プラセボで 0%)。
短期併用試験における治療中止に伴う有害反応
双極 I 型障害 (躁病または混合エピソード)、リチウムまたはバルプロ酸の補助としてのオランザピン
単剤療法としてリチウムまたはバルプロ酸のいずれかをすでに許容していた患者の研究では、副作用による中止率は、リチウムまたはバルプロ酸の単剤療法を続けた患者の2%と比較して、経口オランザピンとリチウムまたはバルプロ酸の組み合わせで11%でした. 1 人以上の患者で発生した経口オランザピンとリチウムまたはバルプロ酸の組み合わせの中止は、傾眠 (3%)、体重増加 (1%)、および末梢性浮腫 (1%) でした。
短期のプラセボ対照試験でよく観察される有害反応
経口オランザピンの使用に関連して最も一般的に観察された有害反応 (5% 以上の発生率) と、プラセボ治療を受けた患者の間で同等の発生率では観察されなかった (オランザピンの発生率はプラセボの少なくとも 2 倍) は次のとおりです。
オランザピン筋肉内注射
プラセボ投与期間中、オランザピンの筋肉注射による注射治療患者で 5% 以上の発生率で 1 件の有害反応 (傾眠) が観察され、プラセボ治療患者で同等の発生率 (プラセボの少なくとも 2 倍のオランザピン発生率) では観察されませんでした。制御された市販前研究。統合失調症または双極Ⅰ型躁病患者の興奮状態の臨床試験における 24 時間の IM 治療期間中の傾眠の発生率は、オランザピンの筋肉内注射で 6%、プラセボで 3% でした。
短期間のプラセボ対照試験で経口オランザピン治療を受けた患者で 2% 以上の発生率で発生した有害反応
表 11 は、オランザピンの経口投与 (2.5 mg/日以上の用量) で治療された患者の 2% 以上で発生し、急性期に参加したプラセボよりも高い発生率で発生した、最も近いパーセントに四捨五入された治療に伴う有害反応の発生率を列挙しています。プラセボ対照試験の段階。
副作用の用量依存性
疲労、めまい、体重増加、プロラクチン上昇について、用量群の違いが観察されています。統合失調症または統合失調感情の成人患者における経口オランザピン 10 (N=199)、20 (N=200)、および 40 (N=200) mg/日を比較した単一の 8 週間無作為二重盲検固定用量試験障害、疲労の発生率(10 mg/日: 1.5%; 20 mg/日: 2.1%; 40 mg/日: 6.6%)が観察され、10 対 40 および 20 対 40 mg/日で有意差が見られました。めまいの発生率 (10 mg/日: 2.6%; 20 mg/日: 1.6%; 40 mg/日: 6.6%) が観察され、20 対 40 mg の間に有意差がありました。用量群の違いは、体重増加とプロラクチン上昇についても認められた[参照 警告と注意事項 ]。
次の表は、固定用量範囲の経口オランザピンを含む統合失調症試験のデータを使用して、他の有害反応の用量関連性を示しています。これは、3 つの固定用量範囲のグループとプラセボについて、治療に伴う有害反応を起こした患者の割合を列挙しています。データは、プラセボ群を除外して、Cochran-Armitage テストを使用して分析されました。表には、傾向があった有害反応のみが含まれています。
リチウムまたはバルプロ酸の補助としての経口オランザピンの短期試験で一般的に観察される有害反応
双極 I 型障害 (躁病エピソードまたは混合エピソード) 補助プラセボ対照試験で、オランザピンとリチウムまたはバルプロ酸の組み合わせに関連して最も一般的に観察された副作用 (発生率 5% 以上、少なくとも 2 倍のプラセボ) は次のとおりでした。
リチウムまたはバルプロ酸の補助としてのオランザピンの短期試験で、経口オランザピン治療を受けた患者で2%以上の発生率で発生した有害反応
表 14 は、オランザピン (用量 5 mg/日以上) とリチウムまたはバルプロ酸の組み合わせで治療された患者の 2% 以上で発生し、発生率がプラセボ対照併用試験の急性期に参加したリチウムまたはバルプロ酸単独。
リチウムまたはバルプロ酸で観察された有害反応に関する具体的な情報については、これらの他の製品の添付文書の有害反応のセクションを参照してください。
短期間のプラセボ対照試験で、注射治療を受けた患者に対するオランザピンの筋肉内投与で 1% 以上の発生率で発生した有害反応
表 15 は、オランザピンの筋肉内注射 (2.5 ~ 10 mg/注射の用量範囲) で治療された患者の 1% 以上で発生し、プラセボよりも高い発生率で発生した、最も近いパーセントに四捨五入された治療に伴う有害反応の発生率を列挙しています。統合失調症または双極Ⅰ型躁病の興奮状態の患者を対象とした短期のプラセボ対照試験に参加した。
錐体外路症状
次の表は、6週間の統合失調症の治療において、3回の固定用量の経口オランザピンとプラセボを比較した対照臨床試験で、急性治療中の正式な評価尺度のカテゴリー分析によって評価された、治療によって出現した錐体外路症状を有する患者の割合を列挙しています。トライアル。
次の表は、統合失調症の治療における 3 つの固定用量のオランザピンとプラセボを 6 週間比較した同じ対照臨床試験で、急性期治療中に自発的に報告された有害反応によって評価された、治療により出現した錐体外路症状を有する患者の割合を列挙したものです。
次の表は、急性治療中に自発的に報告された有害反応によって評価された、治療によって出現した錐体外路症状を有する青年患者の割合を列挙しています(用量範囲:2.5〜20 mg /日)。
次の表は、一定用量のオランザピン筋肉内注射とプラセボ注射を比較した対照臨床試験中の正式な評価尺度のカテゴリー分析によって評価された、治療によって出現した錐体外路症状を有する患者の割合を列挙しています。各用量群の患者は、試験中に最大 3 回の注射を受けることができた [参照 臨床研究 ]。患者の評価は、注射用筋肉内オランザピンの初回投与後 24 時間に実施されました。
次の表は、興奮状態の統合失調症患者を対象に、固定用量のオランザピン筋肉内注射とプラセボを比較した同じ対照臨床試験で自発的に報告された有害反応によって評価された、治療により出現した錐体外路症状を有する患者の割合を列挙しています。
ジストニア、クラス効果
ジストニアの症状、筋肉群の長期にわたる異常な収縮は、治療の最初の数日間に影響を受けやすい個人に発生する可能性があります.ジストニアの症状には、首の筋肉のけいれん、時には喉の圧迫感、嚥下困難、呼吸困難、および/または舌の突出が含まれます.これらの症状は低用量でも発生する可能性がありますが、第 1 世代の抗精神病薬の効力が高く、用量が多いほど、頻度と重症度が高くなります。一般に、抗精神病薬を服用している男性および若年層では、急性ジストニアのリスクが高くなる可能性があります。ただし、オランザピンの使用により、ジストニアのイベントがまれに(
その他の有害反応
経口オランザピンの臨床試験評価中に観察されたその他の有害反応
以下は、臨床試験で経口オランザピン(1 mg/日以上の複数回投与)で治療された患者によって報告された、治療に伴う副作用のリストです。このリストは、(1) すでに前の表またはラベル付けの他の場所にリストされている反応、(2) 薬物の原因が遠くにある反応、(3) 一般的で参考にならない反応、(4) そうでない反応を含むことを意図したものではありません。 (5) プラセボと同等またはそれ以下の割合で発生した。反応は、次の定義を使用して体のシステムによって分類されます。頻繁な副作用は、少なくとも 1/100 の患者で発生するものです。まれな有害反応は、1/100 から 1/1000 の患者に発生するものです。まれな反応とは、患者の 1/1000 未満で発生する反応です。
全身 - まれ: 悪寒、顔面浮腫、光線過敏反応、自殺企図1;まれ:悪寒と発熱、二日酔い効果、突然死1.
心臓血管系 - まれ:脳血管障害、血管拡張。
消化器系 - まれ:腹部膨満、吐き気と嘔吐、舌浮腫。まれ:イレウス、腸閉塞、肝脂肪沈着。
血液とリンパ系 - まれ:血小板減少症。
代謝および栄養障害 - 頻繁:アルカリホスファターゼが増加。まれ:ビリルビン血症、低タンパク血症。
筋骨格系 - まれ:骨粗しょう症。
神経系 - まれ:運動失調、構音障害、性欲減退、昏迷。レア:昏睡。
呼吸器系 - まれ:鼻出血。まれ:肺水腫。
皮膚と付属物 - まれ:脱毛症。
特別な感覚 - まれ:調節異常、ドライアイ。まれ:散瞳。
泌尿生殖器系 - まれ:無月経 2、乳房痛、月経の減少、インポテンス 2、月経の増加 2、月経過多 2、子宮出血 2、多尿 2、頻尿、尿閉、尿意切迫、排尿障害。
1 これらの用語は重篤な有害事象を表していますが、薬物有害反応の定義を満たしていません。それらは深刻であるため、ここに含まれています。 2 性別調整済み。
注射用筋肉内オランザピンの臨床試験評価中に観察されたその他の有害反応
以下は、臨床試験でオランザピンの筋肉内注射による治療を受けた患者から報告された治療に伴う有害反応のリストです(1回の注射で2.5 mg以上の用量で1回以上)。このリストは、(1) すでに前の表またはラベル付けの他の場所にリストされている反応、(2) 薬物の原因が遠くにある反応、(3) 一般的で参考にならない反応、(4) そうでない反応を含むことを意図したものではありません。 (5) プラセボと同等またはそれ以下の割合で発生した。反応は、次の定義を使用して体のシステムによって分類されます。頻繁な副作用は、少なくとも 1/100 の患者で発生するものです。まれな副作用は、1/100 から 1/1000 の患者に発生するものです。
全身 - 頻繁:注射部位の痛み。
心臓血管系 - まれ:失神。
消化器系 - まれ:吐き気。
代謝および栄養障害 - まれ:クレアチンホスホキナーゼが増加。
思春期患者(13~17歳)を対象とした臨床試験
経口オランザピン短期プラセボ対照試験でよく観察される有害反応
経口オランザピン(用量≧2.5 mg)で治療された思春期の患者における有害反応は、5%以上の発生率で報告され、プラセボ治療患者の少なくとも 2 倍の頻度で報告されています。表 21 にリストされています。
短期間(3~6 週間)のプラセボ対照試験で経口オランザピン治療を受けた患者で 2% 以上の発生率で発生した有害反応
経口オランザピン(2.5mg以上の用量)で治療された思春期の患者における有害反応は、2%以上でプラセボよりも高い発生率で報告されています.表22に記載されています.
バイタルサインと臨床検査
バイタルサインの変化
経口オランザピンは、臨床試験で起立性低血圧および頻脈と関連していました。注射用の筋肉内オランザピンは、臨床試験で徐脈、低血圧、および頻脈と関連していた[参照 警告と注意事項 ]。
実験室の変更
成人におけるオランザピン単剤療法
オランザピンの市販前の経験の評価により、ALT、AST、および GGT の無症候性増加との関連が明らかになりました。ベースラインの ALT が 90 IU/L 以下の約 2400 人の成人患者の元の市販前データベースでは、200 IU/L を超える ALT 上昇の発生率は 2% (50/2381) でした。これらの患者のいずれも、黄疸や肝機能障害に起因するその他の症状を経験しておらず、オランザピン治療を継続している間に正常化する傾向のある一過性の変化がほとんどの患者にみられました。
成人を対象としたプラセボ対照オランザピン単剤療法研究では、臨床的に有意な ALT 上昇 (ベースラインでの正常上限 [ULN] の 3 倍未満から ULN の 3 倍以上への変化) が、オランザピンに曝露した患者の 5% (77/1426) で観察されました。オランザピンは、プラセボにさらされた患者の 1% (10/1187) と比較されました。 ULN の 5 倍以上の ALT 上昇が、プラセボ治療患者の 0.3% (4/1196) と比較して、オランザピン治療患者の 2% (29/1438) で観察されました。 ALT 値は、オランザピンによる治療を継続したかオランザピンを中止した大多数の患者で、最後のフォローアップで正常に戻るか、減少していました。 ALT 値が上昇した患者は、黄疸、肝不全を経験したり、Hy's Rule の基準を満たしたりしませんでした。
経口オランザピンで治療された成人患者を対象とした 41 件の完了した臨床研究の統合データベースの検査データの分析から、患者の 1% (88/5245) で高い GGT レベルが記録されました。
肝機能障害の徴候や症状がある患者、肝機能予備能の制限に関連する既往症のある患者、および肝毒性の可能性のある薬物で治療されている患者には注意が必要です。
オランザピンの投与はまた、血清プロラクチンの増加と関連していた[参照 警告と注意事項 ]、患者の 0.3% で好酸球数が無症候性に上昇し、CPK が上昇します。
経口オランザピンで治療された成人患者を対象とした 41 件の完了した臨床試験の統合データベースの検査データの分析から、尿酸値の上昇が患者の 3% (171/4641) 以上で記録されました。
青少年におけるオランザピン単剤療法
統合失調症または双極 I 型障害 (躁病エピソードまたは混合エピソード) の思春期の患者を対象としたプラセボ対照臨床試験では、いつでも、次の治療に起因する所見のより高い頻度が、プラセボと比較して実験室の分析物で観察されました。ベースラインで ALT を有する患者で
青少年を対象としたプラセボ対照オランザピン単剤療法の研究では、オランザピンに曝露した患者の 2% (2 /109) プラセボにさらされた患者の。 ULN の 5 倍以上の ALT 上昇が、プラセボ治療患者の 1% (1/109) と比較して、オランザピン治療患者の 4% (8/192) で観察されました。 ALT 値は、オランザピンによる治療を継続したかオランザピンを中止した大多数の患者で、最後のフォローアップで正常に戻るか、減少していました。 ALT 値が上昇した思春期の患者で、黄疸、肝不全を経験した人、または Hy の法則の基準を満たした人はいませんでした。
心電図の変化
成人の併合研究と青年の併合研究では、QT、QTc(フリデリシア補正)、およびPR間隔を含む心電図パラメータの潜在的に重要な変化を経験している患者の割合において、オランザピンとプラセボの間に有意差はありませんでした。オランザピンの使用は、プラセボと比較して心拍数の平均増加と関連していました (成人: +2.4 ビート/分 vs プラセボでは変化なし; 青少年: +6.3 ビート/分 vs プラセボで-5.1 ビート)。この心拍数の増加は、オランザピンが起立性変化を誘発する可能性に関連している可能性があります[参照 警告と注意事項 ]。
市販後の経験
ジプレキサの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を評価したりすることは困難です。
市場導入以降に報告されたジプレキサ治療に一時的に関連する (必ずしも因果関係があるとは限らない) 有害反応には、以下が含まれます: アレルギー反応 (例えば、アナフィラキシー様反応、血管性浮腫、そう痒症または蕁麻疹)、胆汁うっ滞性または混合性肝障害、糖尿病性昏睡、糖尿病性ケトアシドーシス、中止反応(発汗、吐き気または嘔吐)、好酸球増加症および全身症状を伴う薬物反応(DRESS)、肝炎、黄疸、好中球減少症、膵炎、持続勃起症、発疹、むずむず脚症候群、横紋筋融解症、吃音1、および静脈血栓塞栓症(肺塞栓症および肺塞栓症を含む)深部静脈血栓症)。 ≥240 mg/dL のランダム コレステロール レベルおよび ≥1000 mg/dL のランダム トリグリセリド レベルが報告されています。
1 吃音は、経口および長時間作用型注射 (LAI) 製剤でのみ研究されました。
薬物相互作用
オランザピンを他の薬と組み合わせて使用するリスクは、体系的な研究で広く評価されていません.
他の薬剤がオランザピンに影響を与える可能性
ジアゼパム
ジアゼパムとオランザピンの同時投与は、オランザピンで観察された起立性低血圧を増強しました。
シメチジンと制酸剤
シメチジン (800 mg) またはアルミニウムおよびマグネシウム含有制酸剤の単回投与は、オランザピンの経口バイオアベイラビリティーに影響を与えませんでした。
CYP1A2のインデューサー
カルバマゼピン療法 (200 mg 1 日 2 回) により、オランザピンのクリアランスが約 50% 増加します。この増加は、カルバマゼピンが CYP1A2 活性の強力な誘導因子であるという事実による可能性があります。カルバマゼピンの 1 日あたりの投与量を増やすと、オランザピンのクリアランスがさらに大きくなる可能性があります。
アルコール
エタノール (45 mg/70 kg の単回投与) は、オランザピンの薬物動態に影響を与えませんでした。アルコール(すなわち、エタノール)とオランザピンの同時投与は、オランザピンで観察された起立性低血圧を増強した[参照 薬物相互作用 ]。
CYP1A2の阻害剤
フルボキサミン
CYP1A2阻害剤であるフルボキサミンは、オランザピンのクリアランスを減少させます。この結果、フルボキサミン投与後のオランザピン Cmax は、女性の非喫煙者で 54%、男性喫煙者で 77% 増加しました。オランザピンの AUC の平均増加率は、それぞれ 52% と 108% です。フルボキサミンによる併用治療を受けている患者では、低用量のオランザピンを検討する必要があります。
CYP2D6の阻害剤
フルオキセチン
フルオキセチン (60 mg の単回投与または 60 mg の 1 日投与を 8 日間) は、オランザピンの最大濃度をわずかに (平均 16%) 増加させ、オランザピンのクリアランスをわずかに (平均 16%) 減少させます。この要因の影響の大きさは、個人間の全体的な変動性と比較して小さいため、用量の変更は通常は推奨されません。ジプレキサとフルオキセチンを組み合わせて使用する場合は、Symbyax の添付文書の薬物相互作用のセクションも参照してください。
ワルファリン
ワルファリン (20 mg 単回投与) は、オランザピンの薬物動態に影響を与えませんでした。
CYP1A2 またはグルクロニルトランスフェラーゼのインデューサー
オメプラゾールとリファンピンは、オランザピンクリアランスの増加を引き起こす可能性があります。
木炭
活性炭 (1 g) の投与により、経口オランザピンの Cmax と AUC が約 60% 減少しました。オランザピンのピークレベルは通常、投与後約6時間まで得られないため、木炭はオランザピンの過剰摂取の有用な治療法である可能性があります.
オランザピンが他の薬剤に影響を与える可能性
中枢神経系作用薬
オランザピンの主な中枢神経系への影響を考えると、オランザピンを他の中枢作用薬やアルコールと組み合わせて服用する場合は注意が必要です.
降圧剤
オランザピンは、低血圧を誘発する可能性があるため、特定の降圧剤の効果を高める可能性があります.
レボドパとドーパミン作動薬
オランザピンは、レボドパおよびドーパミン作動薬の効果に拮抗する可能性があります。
ロラゼパム (IM)
オランザピンの筋肉内注射 (5 mg) の 1 時間後にロラゼパム (2 mg) を筋肉内に投与しても、オランザピン、非抱合型ロラゼパム、または総ロラゼパムの薬物動態に有意な影響はありませんでした。しかし、ロラゼパムの筋肉内注射とオランザピンの筋肉内注射の同時投与は、いずれかの薬物単独で観察される傾眠に追加された[参照 警告と注意事項 ]。
リチウム
オランザピンの複数回投与 (10 mg を 8 日間) は、リチウムの動態に影響を与えませんでした。したがって、オランザピンの併用投与は、リチウムの投与量調整を必要としない[参照 警告と注意事項 ]。
バルプロ酸
オランザピン (毎日 10 mg を 2 週間) は、バルプロ酸の定常状態の血漿濃度に影響を与えませんでした。したがって、オランザピンの併用投与では、バルプロ酸の用量調整は必要ありません。 警告と注意事項 ]。
薬物代謝酵素に対するオランザピンの効果
ヒト肝ミクロソームを利用した in vitro 研究では、オランザピンが CYP1A2、CYP2C9、CYP2C19、CYP2D6、および CYP3A を阻害する可能性はほとんどないことが示唆されています。したがって、オランザピンは、これらの酵素によって媒介される臨床的に重要な薬物相互作用を引き起こす可能性は低い.
イミプラミン
オランザピンの単回投与は、イミプラミンまたはその活性代謝物であるデシプラミンの薬物動態に影響を与えませんでした。
ワルファリン
オランザピンの単回投与は、ワルファリンの薬物動態に影響を与えませんでした。
ジアゼパム
オランザピンは、ジアゼパムまたはその活性代謝物 Ndesmethyldiazepam の薬物動態に影響を与えませんでした。しかし、ジアゼパムをオランザピンと併用すると、いずれかの薬剤を単独で投与した場合に観察された起立性低血圧が増加しました。
アルコール
オランザピンの複数回投与は、エタノールの動態に影響を与えませんでした。
ビペリデン
オランザピンの複数回投与は、ビペリデンの動態に影響を与えませんでした。
テオフィリン
オランザピンの複数回投与は、テオフィリンまたはその代謝物の薬物動態に影響を与えませんでした。
薬物乱用と依存
依存
乱用と依存の可能性を評価するために前向きに設計された研究では、オランザピンは、1 日経口 MRHD (20 mg) の最大 15 倍の経口用量を投与されたラットおよびアカゲザルにおいて、急性抑うつ CNS 効果を有するが、乱用または身体的依存の可能性はほとんどまたはまったくないことが示されました。 mg/m² 体表面積に基づいて、1 日経口 MRHD の最大 8 倍の経口用量を投与します。
オランザピンは、乱用、耐性、または身体的依存の可能性について、ヒトで体系的に研究されていません.臨床試験では薬物探索行動の傾向は明らかになりませんでしたが、これらの観察結果は体系的ではなく、この限られた経験に基づいて、CNS 活性薬物がどの程度誤用され、転用されるかを予測することはできません。 、および/または販売後に悪用されます。したがって、薬物乱用の病歴について患者を注意深く評価する必要があり、そのような患者は、オランザピンの誤用または乱用の徴候(例、耐性の発達、用量の増加、薬物探索行動)について注意深く観察する必要があります。
警告
の一部として含まれています 予防 セクション。
予防
ジプレキサ 7.5mg とフルオキセチンを併用する場合は、Symbyax の添付文書の警告と使用上の注意のセクションも参照してください。
認知症関連精神病の高齢患者
死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。ジプレキサ 20mg は、認知症関連の精神病患者の治療には承認されていません [囲み警告、合併症のある患者への使用、および患者情報を参照]。
認知症関連精神病の高齢患者のプラセボ対照臨床試験では、オランザピンで治療された患者の死亡率は、プラセボで治療された患者よりも有意に高かった (それぞれ 3.5% 対 1.5%)。
脳卒中を含む脳血管有害事象(CVAE)
死亡例を含む脳血管の有害事象(例、脳卒中、一過性脳虚血発作)は、認知症に関連した精神病の高齢患者におけるオランザピンの試験で、患者で報告されました。プラセボ対照試験では、プラセボで治療された患者と比較して、オランザピンで治療された患者で脳血管有害事象の発生率が有意に高かった.オランザピンは、認知症関連の精神病患者の治療には承認されていません [参照 囲み警告 と 患者情報 ]。
自殺
自殺企図の可能性は、統合失調症および双極 I 型障害に固有のものであり、リスクの高い患者の綿密な監視は、薬物療法を伴う必要があります。オランザピンの処方は、過剰摂取のリスクを減らすために、適切な患者管理と一致する最小量の錠剤用に作成する必要があります。
悪性症候群(NMS)
オランザピンを含む抗精神病薬の投与に関連して、神経弛緩性悪性症候群(NMS)と呼ばれることもある致命的な複合症状が報告されています。 NMS の臨床症状は、高熱、筋肉のこわばり、精神状態の変化、および自律神経系の不安定性 (不規則な脈拍または血圧、頻脈、発汗および不整脈) の証拠です。追加の徴候には、クレアチニンホスホキナーゼの上昇、ミオグロビン尿症 (横紋筋融解症)、および急性腎不全が含まれる場合があります。
この症候群の患者の診断評価は複雑です。診断を下す際には、臨床症状に深刻な医学的疾患(例、肺炎、全身感染症など)と未治療または不十分な治療を受けた錐体外路徴候および症状(EPS)の両方が含まれる症例を除外することが重要です。鑑別診断におけるその他の重要な考慮事項には、中枢性抗コリン作動性毒性、熱射病、薬物熱、および原発性中枢神経系の病理が含まれます。
NMS の管理には次のことを含めるべきです。 2) 集中的な対症療法と医学的モニタリング。 3) 特定の治療法が利用可能な付随する深刻な医学的問題の治療。 NMS の特定の薬理学的治療レジメンについては、一般的な合意はありません。
患者が NMS からの回復後に抗精神病薬治療を必要とする場合、薬物療法の再導入の可能性を慎重に検討する必要があります。 NMS の再発が報告されているため、患者を注意深く監視する必要があります。 患者情報 ]。
好酸球増加症および全身症状を伴う薬物反応 (DRESS)
好酸球増多症および全身症状(DRESS)を伴う薬物反応は、オランザピン曝露で報告されています。 DRESSは、皮膚反応(発疹や剥離性皮膚炎など)、好酸球増加症、発熱、および/または肝炎、腎炎、肺炎、心筋炎、および/または心膜炎などの全身性合併症を伴うリンパ節腫脹を呈することがあります。 DRESSは時々致命的です。 DRESSが疑われる場合は、オランザピンを中止してください[ 患者情報 ]。
代謝変化
非定型抗精神病薬は、高血糖、脂質異常症、体重増加などの代謝変化と関連しています。代謝の変化は、心血管/脳血管リスクの増加と関連している可能性があります。オランザピンの特定の代謝プロファイルを以下に示します。
高血糖と糖尿病
医療従事者は、糖尿病の診断が確立されている患者、または血糖値が境界線上にある患者 (空腹時 100 ~ 126 mg/dL、非空腹時 140 ~ 200 mg/dL) にオランザピンを処方する際に、リスクと利点を考慮する必要があります。オランザピンを服用している患者は、血糖コントロールの悪化について定期的に監視する必要があります。オランザピンによる治療を開始する患者は、治療開始時および治療中定期的に空腹時血糖検査を受ける必要があります。非定型抗精神病薬で治療された患者は、多飲、多尿、多食、衰弱などの高血糖の症状を監視する必要があります。非定型抗精神病薬による治療中に高血糖の症状を発症した患者は、空腹時血糖検査を受ける必要があります。場合によっては、非定型抗精神病薬を中止すると高血糖が解消されます。しかし、一部の患者は、疑わしい薬物の中止にもかかわらず、抗糖尿病治療の継続を必要とした[参照 患者情報 ]。
オランザピンを含む非定型抗精神病薬で治療された患者では、ケトアシドーシスまたは高浸透圧性昏睡または死亡を伴う極端な場合もある高血糖が報告されています。非定型抗精神病薬の使用とグルコース異常との関係の評価は、統合失調症患者における真性糖尿病のバックグラウンドリスクの増加の可能性と、一般集団における真性糖尿病の発生率の増加の可能性によって複雑になっています。疫学的研究は、非定型抗精神病薬で治療された患者における治療に起因する高血糖関連の副作用のリスクの増加を示唆しています。相対リスクの推定値には一貫性がありませんが、非定型抗精神病薬と血糖値の上昇との関連性は連続しているようであり、オランザピンは他の非定型抗精神病薬よりも大きな関連性があるようです.
Clinical Antipsychotic Trials of Intervention effectiveness (CATIE) の第 1 相において、オランザピンで治療された患者 (暴露期間の中央値は 9.2 か月) で血糖値の平均上昇が観察されました。ベースラインから 2 つの最高血清濃度の平均までの血清グルコース (空腹時および非空腹時サンプル) の平均増加は 15.0 mg/dL でした。
健康なボランティアを対象とした研究では、オランザピンを 3 週間投与された被験者 (N=22) は、空腹時血糖値がベースラインと比較して平均 2.3 mg/dL 増加しました。プラセボで治療された被験者 (N=19) は、ベースラインと比較して空腹時血糖値が平均 0.34 mg/dL 増加しました。
成人におけるオランザピン単剤療法
治療期間の中央値が約 3 週間の 5 つのプラセボ対照成人オランザピン単剤療法研究の分析では、オランザピンはプラセボと比較して空腹時血糖値の平均変化が大きかった (2.76 mg/dL 対 0.17 mg/dL)。オランザピンとプラセボの平均変化の差は、ベースラインで血糖調節異常の証拠がある患者(真性糖尿病または関連する有害反応と診断された患者、抗糖尿病薬で治療された患者、ベースラインのランダムなグルコースレベルが200mg以上の患者)でより大きかった. dL、および/またはベースライン空腹時血糖値≧126 mg/dL)。オランザピンで治療された患者は、ベースラインからの HbA1c の平均増加が 0.04% (曝露の中央値 21 日) であったのに対し、プラセボで治療された被験者 (曝露の中央値 17 日) での HbA1c の平均減少は 0.06% でした。
つのプラセボ対照研究 (治療曝露の中央値 4 ~ 5 週間) の分析では、プラセボ治療を受けた被験者 (N=599) の 2.8% と比較して、オランザピン治療を受けた被験者 (N=855) の 6.1% が治療に起因する糖尿を有していました。 .表 2 は、成人オランザピン単剤療法研究からの空腹時血糖値の短期的および長期的変化を示しています。
少なくとも 48 週間暴露した患者の空腹時血糖の平均変化は 4.2 mg/dL でした (N=487)。オランザピン療法を 9 ~ 12 か月完了した患者の分析では、空腹時および非空腹時の血糖値の平均変化は時間の経過とともに増加し続けました。
青少年におけるオランザピン単剤療法
オランザピンの安全性と有効性は、13 歳未満の患者では確立されていません。統合失調症 (6 週間) または双極 I 型障害 (躁病または混合エピソード) (3 週間) を含む思春期の患者を対象とした 3 つのプラセボ対照オランザピン単剤療法研究の分析では、オランザピンは空腹時のベースラインからのより大きな平均変化と関連していました。プラセボと比較したグルコースレベル (2.68 mg/dL 対 -2.59 mg/dL)。少なくとも 24 週間暴露した青少年の空腹時血糖の平均変化は 3.1 mg/dL でした (N=121)。表 3 は、思春期のオランザピン単剤療法研究からの空腹時血糖の短期的および長期的変化を示しています。
脂質異常症
オランザピンの使用により、脂質の望ましくない変化が観察されています。オランザピンを使用している患者のベースラインおよび定期的なフォローアップ脂質評価を含む臨床モニタリングが推奨される[参照 患者情報 ]。
オランザピンの使用により、臨床的に重要な、時には非常に高い (>500 mg/dL) トリグリセリドレベルの上昇が観察されています。オランザピンの使用により、総コレステロールのわずかな平均増加も見られました.
成人におけるオランザピン単剤療法
最長 12 週間の治療期間を伴う 5 つのプラセボ対照オランザピン単剤療法研究の分析では、オランザピン治療を受けた患者は、平均空腹時総コレステロール、LDL コレステロール、およびトリグリセリドがベースラインから 5.3 mg/dL、3.0 mg/dL、およびプラセボ治療患者の平均空腹時総コレステロール、LDL コレステロール、およびトリグリセリドがベースラインから 6.1 mg/dL、4.3 mg/dL、および 10.7 mg/dL 減少したのと比較して、それぞれ 20.8 mg/dL でした。空腹時 HDL コレステロールについては、オランザピンで治療された患者とプラセボで治療された患者の間で臨床的に意味のある違いは観察されませんでした。空腹時脂質値 (総コレステロール、LDL コレステロール、およびトリグリセリド) の平均増加は、ベースラインで脂質調節異常の証拠のない患者でより大きかった。またはベースラインの脂質レベルが高い患者。
長期研究 (少なくとも 48 週間) では、患者の平均空腹時総コレステロール、LDL コレステロール、およびトリグリセリドがベースラインからそれぞれ 5.6 mg/dL、2.5 mg/dL、および 18.7 mg/dL 増加しました。空腹時 HDL コレステロールが 0.16 mg/dL 減少しました。 12 か月の治療を完了した患者の分析では、非絶食時の総コレステロールの平均値は、約 4 ~ 6 か月後にそれ以上増加しませんでした。
総コレステロール、LDL コレステロール、またはトリグリセリドが正常または境界線から高値に (少なくとも 1 回) 変化した患者の割合、または HDL コレステロールが正常または境界線から低値に変化した患者の割合は、長期研究 (少なくとも 48 週間) でより高かった。短期留学と比べて。表 4 は、空腹時脂質値のカテゴリ別の変化を示しています。
Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) の第 1 相では、暴露期間の中央値 9.2 か月で、オランザピンを服用している患者のトリグリセリドの平均増加は 40.5 mg/dL でした。 CATIE のフェーズ 1 では、総コレステロールの平均増加は 9.4 mg/dL でした。
青少年におけるオランザピン単剤療法
オランザピンの安全性と有効性は、13 歳未満の患者では確立されていません。統合失調症 (6 週間) または双極 I 型障害 (躁病または混合エピソード) (3 週間) の青少年を対象とした 3 つのプラセボ対照オランザピン単剤療法研究の分析では、オランザピン治療を受けた青少年は、平均空腹時総コレステロール、LDL がベースラインから増加しました。コレステロール、およびトリグリセリドはそれぞれ 12.9 mg/dL、6.5 mg/dL、および 28.4 mg/dL であり、平均空腹時総コレステロールおよび LDL コレステロールはベースラインから 1.3 mg/dL および 1.0 mg/dL 増加し、減少したプラセボを投与された青少年のトリグリセリドは 1.1 mg/dL でした。空腹時 HDL コレステロールについては、オランザピンで治療された青年とプラセボで治療された青年の間で、臨床的に意味のある違いは観察されませんでした。
長期研究 (少なくとも 24 週間) では、若者の平均空腹時総コレステロール、LDL コレステロール、およびトリグリセリドがベースラインからそれぞれ 5.5 mg/dL、5.4 mg/dL、および 20.5 mg/dL 増加し、平均空腹時 HDL コレステロールが 4.5 mg/dL 減少しました。表 5 は、思春期の空腹時脂質値のカテゴリ別変化を示しています。
体重の増加
オランザピンを開始する前に、体重増加の潜在的な結果を考慮する必要があります。オランザピンを投与されている患者は、定期的に体重をモニタリングする必要があります [参照 患者相談情報 ]。
成人におけるオランザピン単剤療法
13 のプラセボ対照オランザピン単剤療法研究の分析では、オランザピン治療を受けた患者は平均 2.6 kg (5.7 ポンド) 増加したのに対し、プラセボ治療を受けた患者では平均 0.3 kg (0.6 ポンド) 体重が減少し、暴露期間の中央値は 6 週間でした。 ;オランザピン治療を受けた患者の 22.2% は、プラセボ治療を受けた患者の 3% と比較して、ベースラインの体重の少なくとも 7% を獲得し、イベントへの曝露の中央値は 8 週間でした。オランザピン治療を受けた患者の 4.2% は、プラセボ治療を受けた患者の 0.3% と比較して、ベースラインの体重の少なくとも 15% 増加し、イベントへの曝露の中央値は 12 週間でした。ベースラインのボディマス指数(BMI)のすべてのカテゴリーで、臨床的に有意な体重増加が観察されました。体重増加による中止は、オランザピン治療患者の 0.2% とプラセボ治療患者の 0% で発生しました。
長期研究 (少なくとも 48 週間) では、平均体重増加は 5.6 kg (12.3 ポンド) でした (曝露の中央値は 573 日、N=2021)。長期暴露によりベースライン体重の少なくとも 7%、15%、または 25% 増加した患者の割合は、それぞれ 64%、32%、および 12% でした。少なくとも 48 週間の曝露後、オランザピン治療患者の 0.4% で体重増加による中止が発生しました。
表 6 には、86 の臨床試験からプールされたオランザピンによる成人の体重増加に関するデータが含まれています。各列のデータは、指定された期間の治療期間を完了した患者のデータを表しています。
体重増加に関して用量群の違いが観察された。統合失調症または統合失調感情障害の成人患者における経口オランザピンの 10 (N=199)、20 (N=200)、および 40 (N=200) mg/日を比較する単一の 8 週間の無作為化二重盲検固定用量研究では、ベースラインからエンドポイントまでの平均体重増加 (10 mg/日: 1.9 kg; 20 mg/日: 2.3 kg; 40 mg/日: 3 kg) が観察され、10 対 40 mg/日で有意差がありました。
青少年におけるオランザピン単剤療法
オランザピンの安全性と有効性は、13 歳未満の患者では確立されていません。青年期の平均体重増加は、成人よりも大きかった。 4 つのプラセボ対照試験では、体重増加による中止は、プラセボ治療患者の 0% と比較して、オランザピン治療患者の 1% で発生しました。
長期研究 (少なくとも 24 週間) では、平均体重増加は 11.2 kg (24.6 ポンド) でした。 (曝露の中央値 201 日、N=179)。長期暴露によりベースライン体重の少なくとも 7%、15%、または 25% 増加した青年の割合は、それぞれ 89%、55%、および 29% でした。思春期の患者では、ベースライン BMI カテゴリ別の平均体重増加は、正常 (N=106)、過体重 (N=26) で、それぞれ 11.5 kg (25.3 ポンド)、12.1 kg (26.6 ポンド)、12.7 kg (27.9 ポンド) でした。と肥満 (N = 17)。オランザピン投与患者の 2.2% で、少なくとも 24 週間の曝露後に体重増加による投与中止が発生しました。
表 8 は、6 つの臨床試験からプールされたオランザピンによる思春期の体重増加に関するデータを示しています。各列のデータは、指定された期間の治療期間を完了した患者のデータを表しています。オランザピンを 6 か月以上使用した青年期の体重増加に関する臨床試験データはほとんどありません。
遅発性ジスキネジア
抗精神病薬で治療されている患者では、潜在的に不可逆的で不随意の運動障害の症候群が発生する可能性があります。この症候群の有病率は高齢者、特に年配の女性の間で最も高いようですが、抗精神病薬治療の開始時に、どの患者がこの症候群を発症する可能性があるかを予測するために有病率の推定に頼ることは不可能です。抗精神病薬製品が遅発性ジスキネジアを引き起こす可能性が異なるかどうかは不明です。
遅発性ジスキネジアを発症するリスクとそれが不可逆的になる可能性は、治療期間と患者に投与される抗精神病薬の総累積用量が増加するにつれて増加すると考えられています。しかし、この症候群は、低用量での比較的短い治療期間の後に発生する可能性があり、あまり一般的ではありませんが、治療の中止後に発生することさえあります.
遅発性ジスキネジアは、抗精神病薬の治療を中止すると、部分的または完全に寛解することがあります。しかし、抗精神病薬の治療自体が、症候群の徴候や症状を抑制 (または部分的に抑制) する可能性があり、それによって潜在的なプロセスを覆い隠す可能性があります。症状の抑制が症候群の長期経過に及ぼす影響は不明です。
これらの考慮事項を考慮すると、遅発性ジスキネジアの発生を最小限に抑える可能性が最も高い方法でオランザピンを処方する必要があります。慢性抗精神病治療は、一般に、(1)抗精神病薬に反応することが知られている慢性疾患に苦しんでいる患者、および(2)同等に効果的であるが潜在的に害の少ない代替治療が利用できない、または適切でない患者のために予約されるべきです.慢性的な治療を必要とする患者では、満足のいく臨床反応をもたらす最小用量と最短の治療期間を追求する必要があります。継続的な治療の必要性は、定期的に再評価する必要があります。
オランザピンを服用している患者に遅発性ジスキネジアの徴候と症状が現れた場合は、薬剤の中止を検討する必要があります。しかし、症候群の存在にもかかわらず、一部の患者はオランザピンによる治療を必要とする場合があります。
リチウムまたはバルプロ酸の警告に関する具体的な情報については、これらの他の製品の添付文書の警告セクションを参照してください。
起立性低血圧
オランザピンは、おそらくそのα1アドレナリン拮抗特性を反映して、めまい、頻脈、徐脈、および一部の患者では失神を伴う起立性低血圧を誘発する可能性があり、特に最初の用量漸増期間中に 患者相談情報 ]。
経口オランザピンで治療された成人患者を対象とした 41 件の完了した臨床試験の統合データベースのバイタル サイン データの分析から、患者の 20% (1277/6030) 以上で起立性低血圧が記録されました。
経口オランザピン療法の場合、起立性低血圧および失神のリスクは、5 mg QD で治療を開始することによって最小限に抑えることができます [参照 投薬と管理 ]。低血圧が発生した場合は、目標用量へのより段階的な漸増を検討する必要があります。
低血圧、低血圧を伴うまたは伴わない徐脈、頻脈、および失神も、オランザピンの筋肉内注射による臨床試験中に報告されました。興奮していない統合失調症患者を対象とした非盲検臨床薬理学研究では、筋肉内オランザピンの安全性と忍容性が最大用量レジメン (4 時間間隔で 10 mg を 3 回投与) で評価され、これらの患者の約 3 分の 1 で有意な収縮期血圧の起立性低下(すなわち、30mmHg以上の低下)[参照 投薬と管理 ]。失神は、フェーズ 2 ~ 3 の経口オランザピン試験でオランザピン治療を受けた患者の 0.6% (15/2500) で報告され、オランザピンの筋肉内注射試験で動揺を伴うオランザピン治療を受けた患者の 0.3% (2/722) で報告されました。オランザピンの筋肉内投与による第 1 相研究の 3 人の正常なボランティアは、低血圧、徐脈、最大 6 秒間の副鼻腔休止を経験しましたが、自然に解消しました (2 例ではオランザピンの筋肉内投与で、1 例ではオランザピンの経口投与で反応が起こりました)。この一連の低血圧、徐脈、および副鼻腔休止のリスクは、向精神薬の特定の効果により適応している可能性のある精神病患者と比較して、非精神病患者の方が大きい可能性があります。注射療法のための筋肉内オランザピンの場合、患者は、注射後に眠気やめまいがする場合は、体位性低血圧、徐脈、および/または低換気を経験していないことが検査で示されるまで、横になったままにする必要があります。
オランザピンは、既知の心血管疾患(心筋梗塞または虚血の病歴、心不全、または伝導異常)、脳血管疾患、および患者が低血圧になりやすい状態(脱水、血液量減少、および降圧薬による治療)のある患者には特に注意して使用する必要があります。 ) 失神、または低血圧および/または徐脈の発生により、患者の医療リスクが高まる可能性がある場合。
低血圧、徐脈、呼吸器系または中枢神経系の抑制を誘発する可能性がある他の薬による治療を受けている患者には注意が必要です。 薬物相互作用 ]。筋肉内オランザピンと非経口ベンゾジアゼピンの併用投与は、過度の鎮静と心肺機能低下の可能性があるため推奨されません。
滝
ジプレキサは、傾眠、起立性低血圧、運動および感覚の不安定性を引き起こす可能性があり、転倒につながる可能性があり、その結果、骨折やその他の怪我につながる可能性があります。これらの影響を悪化させる可能性のある疾患、状態、または投薬を受けている患者については、抗精神病薬治療を開始する際に転倒リスク評価を完了し、長期の抗精神病薬治療を受けている患者については繰り返します。
白血球減少症、好中球減少症、および無顆粒球症
クラス効果
臨床試験および/または市販後の経験では、ジプレキサを含む抗精神病薬に一時的に関連する白血球減少症/好中球減少症のイベントが報告されています。無顆粒球症も報告されています。
白血球減少症/好中球減少症の可能性のある危険因子には、既存の低白血球数 (WBC) および薬物誘発性白血球減少症/好中球減少症の病歴が含まれます。臨床的に有意な低 WBC または薬剤誘発性白血球減少症/好中球減少症の病歴を持つ患者は、治療の最初の数か月間、頻繁に全血球計算 (CBC) を監視する必要があり、臨床的に有意な低下の最初の兆候が見られたら、ジプレキサの中止を検討する必要があります。他の原因因子がない場合の白血球。
臨床的に重大な好中球減少症の患者は、発熱やその他の感染症の症状や徴候を注意深く監視し、そのような症状や徴候が発生した場合は速やかに治療する必要があります。重度の好中球減少症 (絶対好中球数
嚥下障害
食道の運動障害と誤嚥は、抗精神病薬の使用に関連付けられています。誤嚥性肺炎は、進行したアルツハイマー病患者の罹患率と死亡率の一般的な原因です。オランザピンは、アルツハイマー病患者の治療には承認されていません。
発作
市販前試験中に、発作はオランザピン治療患者の 0.9% (22/2500) で発生しました。これらのケースの多くで、発作の発生に寄与した可能性のある交絡因子がありました。オランザピンは、発作の既往歴のある患者や、アルツハイマー型認知症などの発作閾値を下げる可能性のある状態の患者には慎重に使用する必要があります。オランザピンは、アルツハイマー病患者の治療には承認されていません。発作閾値を下げる条件は、65 歳以上の集団でより一般的である可能性があります。
認知障害および運動障害の可能性
傾眠は、オランザピン治療に関連する一般的に報告された有害反応であり、プラセボ患者の 15% と比較して、オランザピン患者で 26% の発生率で発生しました。この有害反応も用量に関連していました。傾眠は、市販前データベースの患者の 0.4% (9/2500) で中止につながりました。
オランザピンは判断力、思考力、または運動能力を損なう可能性があるため、オランザピン療法が患者に悪影響を及ぼさないことを合理的に確信できるまで、患者は自動車を含む危険な機械の操作について注意を払う必要があります。 患者相談情報 ]。
体温調節
深部体温を下げる体の機能の混乱は、抗精神病薬に起因しています。深部体温の上昇に寄与する可能性のある状態、例えば、激しい運動、極度の暑さへの曝露、抗コリン活性を伴う併用薬の投与、または脱水の影響を受ける可能性のある患者にオランザピンを処方する場合は、適切な注意が必要です[参照] 患者情報 ]。
合併症のある患者への使用
特定の全身疾患を併発している患者におけるオランザピンの臨床経験は限られている[参照 臨床薬理学 ]。
オランザピンは、インビトロでムスカリン受容体親和性を示します。オランザピンの市販前臨床試験では、オランザピンは便秘、口渇、頻脈と関連しており、すべての副作用はコリン作動性拮抗作用に関連している可能性があります。このような有害反応は、オランザピンの中止の根拠となることはあまりありませんでしたが、臨床的に重大な前立腺肥大症、狭隅角緑内障、または麻痺性イレウスまたは関連疾患の既往がある患者では、オランザピンを慎重に使用する必要があります。
認知症関連精神病の高齢患者 (n=1184) を対象としたオランザピンの 5 つのプラセボ対照研究では、オランザピンで治療を受けた患者において、少なくとも 2% の発生率で、プラセボよりも有意に高い以下の治療による副作用が報告されました。治療を受けた患者:転倒、傾眠、末梢性浮腫、歩行異常、尿失禁、無気力、体重増加、無力症、発熱、肺炎、口渇、幻視。副作用による中止率は、プラセボよりもオランザピンの方が高かった (13% 対 7%)。オランザピンで治療された認知症関連精神病の高齢患者は、プラセボと比較して死亡リスクが高くなります。オランザピンは、認知症関連の精神病患者の治療には承認されていません [参照 囲み警告 、 認知症関連精神病の高齢患者 、 と 患者情報 ]。
オランザピンは、心筋梗塞または不安定心疾患の最近の病歴を有する患者において、評価されておらず、かなりの範囲で使用されていません.これらの診断を受けた患者は、市販前の臨床試験から除外されました。オランザピンによる起立性低血圧のリスクがあるため、心臓病患者には注意が必要です[ 起立性低血圧 ]。
高プロラクチン血症
ドーパミン D2 受容体に拮抗する他の薬剤と同様に、オランザピンはプロラクチン レベルを上昇させ、この上昇は長期投与中も持続します。高プロラクチン血症は視床下部の GnRH を抑制し、下垂体性ゴナドトロピンの分泌を低下させる可能性があります。これは、女性と男性の両方の患者で生殖腺のステロイド産生を損なうことにより、生殖機能を阻害する可能性があります。プロラクチン上昇化合物を投与されている患者では、乳汁漏出症、無月経、女性化乳房、およびインポテンスが報告されています。性腺機能低下症に関連する長期にわたる高プロラクチン血症は、女性と男性の両方の被験者で骨密度の低下につながる可能性があります。
組織培養実験では、ヒト乳癌の約 3 分の 1 が in vitro でプロラクチン依存性であることが示されています。これは、以前に乳癌が発見された患者でこれらの薬剤の処方が考えられる場合、潜在的に重要な要素です。プロラクチン放出を増加させる化合物に共通することとして、マウスとラットで実施されたオランザピンの発がん性研究で乳腺腫瘍の増加が観察された[ 非臨床毒性学 ]。これまでに実施された臨床研究も疫学研究も、このクラスの薬物の慢性投与とヒトの腫瘍形成との関連を示していません。入手可能な証拠は、現時点では決定的であるにはあまりにも限定的であると考えられています。
プラセボ対照のオランザピン臨床試験(最大12週間)では、プラセボで治療した成人の10.5%と比較して、オランザピンで治療した成人の30%でプロラクチン濃度の正常から高値への変化が観察されました.オランザピンで治療された 8,136 人の成人を含む臨床研究からプールされた分析では、潜在的に関連する臨床症状には、月経関連のイベント 1 (女性の 2% [49/3240])、性機能関連のイベント 2 (女性の 2% [150/8136]) が含まれていました。および男性)、乳房関連のイベント 3 (女性の 0.7% [23/3240]、男性の 0.2% [9/4896])。
統合失調症または双極Ⅰ型障害(躁病エピソードまたは混合エピソード)の思春期患者(最長 6 週間)を対象としたプラセボ対照オランザピン単剤療法研究では、オランザピン治療を受けた患者の 47% でプロラクチン濃度の正常から高値への変化が観察されました。プラセボ治療を受けた患者の%。オランザピンで治療された 454 人の青少年を含む臨床試験からプールされた分析では、潜在的に関連する臨床症状には、月経関連のイベント 1 (女性の 1% [2/168])、性機能関連のイベント 2 (女性および男性の 0.7% [3/454]) が含まれていました。 )、および乳房関連のイベント3(女性の2%[3/168]、男性の2%[7/286])[参照 特定の集団での使用 ]。
無月経、低月経、月経遅延、および乏月経の用語の検索に基づく。
2 次の用語の検索に基づく: 無オルガスミア、遅漏、勃起不全、性欲減退、性欲喪失、異常オルガスム、性機能障害。
次の用語の検索に基づく: 分泌物、肥大または腫脹、乳汁漏出症、女性化乳房、および授乳障害。
プロラクチンの上昇に関して、用量群の違いが観察されています。統合失調症または統合失調感情の成人患者における経口オランザピン 10 (N=199)、20 (N=200)、および 40 (N=200) mg/日を比較した単一の 8 週間無作為二重盲検固定用量試験障害、プロラクチン上昇の発生 >24.2 ng/mL (女性) または >18.77 ng/mL (男性) 試験中の任意の時点 (10 mg/日: 31.2%; 20 mg/日: 42.7%; 40 mg/日: 61.1%) は、10 対 40 mg/日と 20 対 40 mg/日の間に有意差を示しました。
フルオキセチン、リチウム、またはバルプロ酸と組み合わせて使用
ZYPREXA とフルオキセチンを組み合わせて使用する場合、処方者は Symbyax の添付文書の警告と注意事項のセクションも参照する必要があります。リチウムまたはバルプロ酸と組み合わせてジプレキサを使用する場合、処方者は、リチウムまたはバルプロ酸の添付文書の警告および使用上の注意のセクションを参照する必要があります。 薬物相互作用 ]。
臨床検査
治療開始時および治療中は定期的に空腹時血糖検査と脂質プロファイルを行うことが推奨される[参照 代謝変化 と 患者情報 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド 経口製剤用。
患者は、次の問題について知らされ、ジプレキサ 15mg を単独療法として、またはフルオキセチンと組み合わせて服用しているときにこれらの問題が発生した場合は、処方者に警告するよう求められる必要があります。ジプレクサ 2.5mg を服用している間、症状が改善していないと思われる場合、または状態に懸念がある場合は、医師に連絡してください。 ZYPREXA とフルオキセチンを併用する場合は、Symbyax の添付文書の患者カウンセリング情報セクションも参照してください。
認知症関連精神病の高齢患者:死亡率の増加と脳卒中を含む脳血管有害事象(CVAE)
抗精神病薬で治療を受けている認知症関連精神病の高齢患者は、死亡リスクが高いことを患者と介護者に知らせる必要があります。患者と介護者は、ジプレキサで治療された認知症関連精神病の高齢患者は、プラセボと比較して脳血管有害事象(例、脳卒中、一過性脳虚血発作)の発生率が有意に高いことを知らされるべきです。
ジプレキサは、認知症関連精神病の高齢患者には承認されていません [参照 囲み警告 と 警告と注意事項 ]。
悪性症候群(NMS)
患者と介護者は、ZYPREXA を含む抗精神病薬の投与に関連して、NMS と呼ばれることもある致命的な複合症状が報告されていることを説明する必要があります。 NMS の兆候と症状には、高熱、筋肉のこわばり、精神状態の変化、および自律神経系の不安定性 (不規則な脈拍または血圧、頻脈、発汗、および心臓の不整脈) の証拠が含まれます。 警告と注意事項 ]。
好酸球増加症および全身症状を伴う薬物反応 (DRESS)
患者は、好酸球増加症および全身症状を伴う薬物反応 (DRESS) に関連している可能性のある徴候や症状が現れたら、できるだけ早く医療提供者に報告するようにアドバイスする必要があります。 警告と注意事項 ]。
高血糖と糖尿病
患者には、高血糖に関連する有害反応の潜在的なリスクについて説明する必要があります。患者は、血糖コントロールの悪化について定期的に監視する必要があります。糖尿病患者は、ジプレキサを服用している間、どのくらいの頻度で血糖値をチェックするかについて、医師の指示に従う必要があります。 警告と注意事項 ]。
脂質異常症
ジプレキサによる治療中に脂質異常症が発生したことを患者に説明する必要があります。患者は脂質プロファイルを定期的にモニタリングする必要があります [参照 警告と注意事項 ]。
体重の増加
ジプレキサによる治療中に体重が増加したことを患者に説明する必要があります。患者は定期的に体重を測定する必要があります[参照 警告と注意事項 ]。
起立性低血圧
患者は起立性低血圧のリスクについて、特に初回用量漸増の期間中、およびジアゼパムやアルコールなどのジプレキサの起立性効果を増強する可能性のある併用薬の使用に関連して、アドバイスを受ける必要があります。 警告と注意事項 と 薬物相互作用 ]。患者には、起立性低血圧を予防するために慎重に体位を変えるように、まためまいや失神を感じた場合は気分が良くなるまで横になるようにアドバイスする必要があります。患者は、起立性低血圧に関連する次の徴候や症状のいずれかを経験した場合は、医師に連絡するようにアドバイスする必要があります: めまい、速いまたは遅い心拍、または失神。
認知障害および運動障害の可能性
ジプレクサは判断力、思考力、または運動能力を損なう可能性があるため、ジプレクサ療法が患者に悪影響を及ぼさないことが合理的に確信できるまで、患者は自動車を含む危険な機械の操作について注意を払う必要があります。 警告と注意事項 ]。
体温調節
過熱や脱水を避けるための適切なケアについて、患者に助言する必要があります。患者は、重篤な状態になり、これらの脱水症状の一部またはすべてがある場合は、すぐに医師に連絡するようにアドバイスする必要があります。見る 警告と注意事項 ]。
併用薬
患者は、Symbyax を服用している、または服用する予定がある場合は、医療提供者に通知するようにアドバイスする必要があります。相互作用の可能性があるため、患者はまた、ハーブサプリメントを含む処方薬または市販薬を服用している、服用する予定がある、または服用を中止した場合は、医療提供者に知らせるようにアドバイスする必要があります。 薬物相互作用 ]。
アルコール
ジプレキサを服用している間は、アルコールを避けるように患者にアドバイスする必要があります[ 薬物相互作用 ]。
フェニルケトン尿薬
ジプレキサ 10mg ザイディス(オランザピン口腔内崩壊錠)には、フェニルアラニンが含まれています(5、10、15、または 20 mg の錠剤あたり、それぞれ 0.34、0.45、0.67、または 0.90 mg)[参照 説明 ]。
特定の集団での使用
妊娠
ジプレキサによる治療中に妊娠した場合、または妊娠する予定がある場合は、医療提供者に通知するよう女性にアドバイスしてください。ジプレキサが新生児に錐体外路症状および/または離脱症状 (激越、筋緊張亢進、筋緊張低下、振戦、傾眠、呼吸困難、および摂食障害) を引き起こす可能性があることを患者に助言します。妊娠中にジプレキサ 7.5 mg に曝露した女性の妊娠転帰を監視する妊娠曝露登録があることを患者に助言する [ 特定の集団での使用 ]。
授乳
ジプレクサ 20mg を使用している授乳中の女性は、乳児の過剰な鎮静、易刺激性、哺乳不良、錐体外路症状 (振戦および異常な筋肉の動き) を監視し、これらの兆候に気付いた場合は医療機関を受診するようアドバイスしてください。 [見る 特定の集団での使用 ]。
不妊
ジプレキサが血清プロラクチンレベルの上昇により生殖能力を損なう可能性があることを女性に助言する.生殖能力への影響は可逆的です [ 特定の集団での使用 ]。
小児用
ジプレキサ 15 mg は、13 歳から 17 歳の青少年の統合失調症および双極 I 型障害に関連する躁病エピソードまたは混合エピソードの治療に適応されます。成人の臨床試験の患者と比較して、思春期の若者は体重が増加し、鎮静作用が増し、総コレステロール、トリグリセリド、LDL コレステロール、プロラクチン、肝アミノトランスフェラーゼのレベルが大幅に上昇する傾向がありました。患者は、ジプレキサに関連する潜在的な長期リスクについて相談を受けるべきであり、これらのリスクが他の薬剤を最初に検討することにつながる可能性があることを助言する必要があります[参照 適応症と使用法 ]。 13 歳未満の患者におけるジプレキサ 5mg の安全性と有効性は確立されていません。 10~17 歳の患者におけるジプレキサ 15mg とフルオキセチンの併用の安全性と有効性は、双極 I 型障害に関連する抑うつエピソードの急性治療において確立されています。 10歳未満の患者におけるジプレキサとフルオキセチンの併用の安全性と有効性は確立されていません[ 警告と注意事項 と 特定の集団での使用 ]。
小児患者における包括的な治療プログラムの必要性
ZYPREXA 20mg は、統合失調症および双極性障害の小児患者向けの総合治療プログラムの不可欠な部分として適応されており、統合失調症患者向けの他の手段 (心理的、教育的、社会的) を含む場合があります。ジプレキサ 7.5mg の有効性と安全性は、13 歳未満の小児患者では確立されていません。非定型抗精神病薬は、環境要因および/またはその他の原発性精神障害に続発する症状を示す小児患者への使用を意図していません。適切な教育配置が不可欠であり、心理社会的介入が役立つことがよくあります。非定型抗精神病薬を処方する決定は、患者の症状の慢性性と重症度に関する医療従事者の評価に依存します[参照 適応症と使用法 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
経口発がん性試験は、マウスとラットで実施されました。オランザピンは、2 つの 78 週間の研究で、3、10、30/20 mg/kg/日 (mg/m² 体表面積に基づく 1 日経口 MRHD の 0.8 ~ 5 倍に相当) および 0.25、2 の用量でマウスに投与されました。 、8 mg/kg/日 (mg/m² 体表面積に基づく 1 日経口 MRHD の 0.06 ~ 2 倍に相当)。ラットに 0.25、1、2.5、4 mg/kg/日 (雄) および 0.25、1、4、8 mg/kg/日 (雌) を 2 年間投与した (0.13-2 および 0.13-4 に相当)。それぞれ mg/m² 体表面積に基づく毎日の経口 MRHD の倍)。肝臓血管腫および血管肉腫の発生率は、mg/m² 体表面積に基づく毎日の経口 MRHD の 2 倍の雌マウスでの 1 つのマウス研究で有意に増加しました。これらの腫瘍は、mg/m² 体表面積に基づく毎日の経口 MRHD の 2 ~ 5 倍まで投与されたメスの別のマウス研究では増加しませんでした。この試験では、30/20 mg/kg/日群の雄で早期死亡率が高かった。乳腺腺腫および腺癌の発生率は、2 mg/kg/日以上を投与された雌マウスおよび 4 mg/kg/日以上を投与された雌ラットで有意に増加した (mg/m² に基づく 1 日経口 MRHD の 0.5 倍および 2 倍)。体表面積、それぞれ)。抗精神病薬は、げっ歯類のプロラクチンレベルを慢性的に上昇させることが示されています。オランザピンの発がん性試験では、血清プロラクチン値は測定されませんでした。しかし、亜慢性毒性研究中の測定では、発がん性研究で使用されたものと同じ用量で、オランザピンがラットの血清プロラクチンレベルを最大 4 倍上昇させたことが示されました。乳腺腫瘍の増加は、他の抗精神病薬の慢性投与後のげっ歯類で発見されており、プロラクチン媒介と考えられています。げっ歯類におけるプロラクチン介在性内分泌腫瘍の発見のヒトリスクとの関連性は不明である[参照 警告と注意事項 ]。
突然変異誘発
オランザピンの遺伝毒性の可能性の証拠は、Ames 復帰突然変異試験、マウスでの in vivo 小核試験、チャイニーズハムスター卵巣細胞での染色体異常試験、ラット肝細胞での不定期 DNA 合成試験、マウスリンパ腫細胞での前方突然変異誘発試験で発見されなかった。 、またはチャイニーズハムスターの骨髄における in vivo 姉妹染色分体交換試験。
生殖能力の障害
ラットの経口受精能および生殖能力試験では、22.4 mg/kg/日の用量で雄の交尾能は損なわれましたが、受精能は損なわれず、雌の受精能は 3 mg/kg/日の用量で低下しました (11 および 1.5それぞれ mg/m² 体表面積に基づく毎日の経口 MRHD の倍)。オランザピン治療の中止は、オスの交尾成績への影響を逆転させました。雌ラットでは、5 mg/kg/日で性交前期間が増加し、交配指数が減少しました (mg/m² 体表面積に基づく 1 日経口 MRHD の 2.5 倍)。発情期は延長され、発情期は 1.1 mg/kg/日で遅延されました (体表面積 mg/m² に基づく 1 日経口 MRHD の 0.6 倍)。したがって、オランザピンは排卵を遅らせる可能性があります。
特定の集団での使用
ZYPREXA とフルオキセチンを組み合わせて使用する場合は、Symbyax の添付文書の特定集団での使用セクションも参照してください。
妊娠
妊娠暴露登録
妊娠中にジプレキサを含む非定型抗精神病薬に曝露した女性の妊娠転帰を監視する妊娠曝露登録があります。医療提供者は、1-866-961-2388 で非定型抗精神病薬の国家妊娠登録に連絡するか、http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/ にアクセスして、患者を登録することをお勧めします。
リスクの概要
妊娠第三期にジプレキサを含む抗精神病薬にさらされた新生児は、分娩後に錐体外路症状および/または禁断症状のリスクがあります。 臨床上の考慮事項 )。オランザピンに暴露された妊婦の公表された疫学的研究から入手可能な全体的なデータは、主要な先天性欠損症、流産、または母体または胎児への有害転帰の薬物関連リスクを確立していません (以下を参照)。 データ )。未治療の統合失調症または双極 I 型障害、および妊娠中のジプレキサ 7.5 mg を含む抗精神病薬への曝露に関連する母親へのリスクがあります (以下を参照)。 臨床上の考慮事項 )。
オランザピンは、mg/m² 体表面積に基づいて、1 日経口最大推奨用量 (MRHD) の 9 倍および 30 倍の用量で、妊娠中のラットおよびウサギに経口投与した場合、催奇形性はありませんでした。これらの用量では、いくつかの胎児毒性が観察された( データ )。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天異常、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
疾患に関連する母体および胚/胎児のリスク
未治療の統合失調症または双極 I 型障害の母親には、再発、入院、および自殺のリスクの増加を含むリスクがあります。統合失調症および双極 I 型障害は、早産を含む周産期の有害転帰の増加と関連しています。これが病気の直接の結果なのか、他の併存因子によるものなのかは不明です。
胎児/新生児の有害反応
興奮、筋緊張亢進、筋緊張低下、振戦、傾眠、呼吸困難、および摂食障害を含む錐体外路症状および/または禁断症状が、妊娠第 3 期にジプレキサ 2.5mg を含む抗精神病薬にさらされた新生児で報告されています。これらの症状の重症度はさまざまです。新生児の錐体外路および/または禁断症状を監視し、症状を適切に管理します。一部の新生児は、特別な治療を受けなくても数時間または数日で回復しました。他の人は長期の入院を必要としました。
データ
ヒューマンデータ
胎盤の通過は、公開された研究報告で報告されています。しかし、胎盤通過率は、妊娠中の暴露後、出生時の 7% から 167% の範囲で非常にばらつきがありました。この所見の臨床的関連性は不明です。
妊娠中の非定型抗精神病薬の使用を評価した観察研究、出生登録、および症例報告から発表されたデータは、主要な先天性欠損症のリスク増加を立証していません。妊娠中に抗精神病薬にさらされた 9,258 人の女性の Medicaid データベースからのレトロスペクティブ コホート研究では、主要な先天性欠損症の全体的なリスクの増加は示されませんでした。
動物データ
18 mg/kg/日までの用量でのラットおよび 30 mg/kg/日までの用量でのウサギにおける経口生殖試験 (mg/m² 体表面積に基づく、それぞれ 1 日経口 MRHD の 9 倍および 30 倍) では、催奇形性の証拠は観察されなかった。経口ラット奇形学研究では、18 mg/kg/日 (mg/m² 体表面積に基づく 1 日経口 MRHD の 9 倍) の用量で早期吸収と生育不能胎児数の増加が観察され、妊娠期間は 10 で延長されました。 mg/kg/日 (mg/m² 体表面積に基づく 1 日経口 MRHD の 5 倍)。ウサギの経口奇形学研究では、再吸収の増加と胎児重量の減少として現れる胎児毒性が、30 mg/kg/日 (mg/m² 体表面積に基づく 1 日経口 MRHD の 30 倍) の母体毒性用量で発生しました。
授乳
リスクの概要
オランザピンは母乳に含まれています。母乳を通じてオランザピンにさらされた乳児の過剰な鎮静、過敏症、摂食不良、錐体外路症状 (振戦および異常な筋肉運動) の報告があります。 臨床上の考慮事項 )。牛乳生産に対するオランザピンの影響に関する情報はありません。
母乳育児の発達上および健康上の利点は、母親のジプレキサに対する臨床的必要性、およびジプレキサまたは母親の基礎疾患による母乳育児中の子供への潜在的な悪影響とともに考慮されるべきです。
臨床上の考慮事項
ジプレキサ 7.5mg にさらされた乳児は、過度の鎮静、過敏症、哺乳不良、錐体外路症状 (振戦および異常な筋肉運動) について監視する必要があります。
生殖能力のある雌と雄
不妊
女性
オランザピンの薬理学的作用 (D2 受容体拮抗作用) に基づいて、ジプレキサによる治療は血清プロラクチン レベルの上昇をもたらす可能性があり、生殖能力のある女性の受胎能の可逆的な低下につながる可能性があります [参照 警告と注意事項 ]。
小児用
統合失調症および双極Ⅰ型障害に関連する躁病エピソードまたは混合エピソードの治療における経口ジプレキサの安全性と有効性は、青少年 (13 歳から 17 歳) を対象とした短期試験で確立されました。青年におけるジプレキサの使用は、268 人の青年が 2.5 ~ 20 mg/日の範囲でジプレキサ 20 mg を投与された、十分に管理されたジプレキサ 5 mg の研究から得られた証拠によって裏付けられています。 臨床研究 ]。青少年に推奨される開始用量は、成人よりも低い[参照 投薬と管理 ]。成人の臨床試験に参加した患者と比較して、思春期の若者は体重が増え、鎮静作用が強くなり、総コレステロール、トリグリセリド、LDL コレステロール、プロラクチン、肝アミノトランスフェラーゼのレベルが大幅に上昇する可能性が高い [参照 警告と注意事項 と 有害反応 ]。青年期に利用できる代替治療を決定する際、臨床医は、(成人と比較して青年期に) 体重増加と脂質異常症の可能性が高いことを考慮する必要があります。臨床医は、思春期の若者に処方する際に潜在的な長期的なリスクを考慮する必要があり、多くの場合、これにより、思春期の若者に最初に他の薬を処方することを検討するようになる可能性があります [参照 適応症と使用法 ]。
13 歳未満の小児におけるオランザピンの安全性と有効性は確立されていません [ 患者情報 ]。
ジプレキサ 7.5mg とフルオキセチンを併用した小児および青年 (10 歳から 17 歳) における安全性と有効性は、双極 I 型障害に関連する抑うつエピソードの急性治療において確立されています。
10 歳未満の小児におけるジプレキサとフルオキセチンの併用の安全性と有効性は確立されていません。
高齢者の使用
経口オランザピンの市販前臨床試験に参加した 2,500 人の患者のうち、11% (263 人) が 65 歳以上でした。統合失調症患者では、若い患者と比較して高齢者のオランザピンの忍容性に違いがあることを示す兆候はありませんでした.認知症に関連した精神病の高齢患者における研究は、統合失調症の若い患者と比較して、この集団には異なる忍容性プロファイルがある可能性があることを示唆しています。オランザピンで治療された認知症関連精神病の高齢患者は、プラセボと比較して死亡リスクが高くなります。認知症関連精神病の高齢患者におけるオランザピンのプラセボ対照研究では、プラセボで治療された患者と比較して、オランザピンで治療された患者で脳血管有害事象(例えば、脳卒中、一過性脳虚血発作)の発生率が高かった.オランザピンは、認知症関連の精神病患者の治療には承認されていません。また、オランザピンに対する薬物動態学的クリアランスを低下させる、または薬力学的反応を高める可能性のある因子が存在する場合は、高齢患者の開始用量を下げることを検討する必要があります。 囲み警告 、 投薬と管理 、 と 警告と注意事項 ]。
ジプレキサとフルオキセチンの併用に関する臨床研究では、65 歳以上の患者が若い患者と異なる反応を示すかどうかを判断するのに十分な数の患者が含まれていませんでした。
過剰摂取
人間の経験
3,100 人を超える患者および/または正常な被験者を対象とした市販前試験では、オランザピンの偶発的または意図的な急性過剰投与が 67 人の患者で確認されました。確認された最大量の 300 mg を服用した患者では、報告された症状は眠気とろれつが回らないことだけでした。 300mgを服用している患者を含め、病院で評価された限られた数の患者では、検査分析物またはECGに有害な変化を示す観察はありませんでした.バイタルサインは通常、過剰摂取後の正常範囲内でした。
オランザピン単独での過剰摂取に関する市販後の報告では、大多数の症例で症状が報告されています。症候性の患者では、10%以上の発生率の症状には、興奮/攻撃性、構音障害、頻脈、さまざまな錐体外路症状、および鎮静から昏睡までの範囲の意識レベルの低下が含まれます。あまり報告されていない症状の中には、以下の医学的に重篤な可能性のある反応がありました:誤嚥、心肺停止、心不整脈(上室性頻脈、正常なリズムの自然な回復を伴う副鼻腔休止を経験している 1 人の患者など)、せん妄、神経弛緩性悪性症候群の可能性、呼吸抑制/呼吸停止、痙攣、高血圧、低血圧。 Eli Lilly and Company は、オランザピン単独の過剰摂取に関連した死亡例の報告を受けています。 1 例の死亡例では、オランザピンの急性摂取量は経口オランザピン 450 mg 程度である可能性が高いと報告されました。しかし、別のケースでは、約 2 g の経口オランザピンの急性オランザピン摂取で生存した患者が報告されました。
過剰摂取の管理
ジプレクサ (オランザピン) の過剰摂取の管理に関する最新情報については、認定毒物管理センター (1-800-222-1222 または www.poison.org) にお問い合わせください。複数の薬物の関与の可能性を考慮する必要があります。急性の過剰摂取の場合は、気道を確立して維持し、十分な酸素化と換気を確保してください。これには挿管が含まれる場合があります。胃洗浄(挿管後、患者が意識を失っている場合)および下剤と一緒に活性炭の投与を考慮する必要があります。活性炭 (1 g) の投与により、経口オランザピンの Cmax と AUC が約 60% 減少しました。オランザピンのピークレベルは通常、投与後約6時間まで得られないため、木炭はオランザピンの過剰摂取の有用な治療法である可能性があります.
過剰摂取後の頭頸部の鈍化、発作、またはジストニー反応の可能性は、誘発された嘔吐を伴う誤嚥のリスクを生み出す可能性があります.心血管モニタリングを直ちに開始し、不整脈の可能性を検出するために継続的な心電図モニタリングを含める必要があります。
オランザピンに対する特効薬はありません。したがって、適切な支援策を開始する必要があります。低血圧および循環虚脱は、静脈内輸液および/または交感神経刺激薬などの適切な手段で治療する必要があります。 (ベータ刺激は、オランザピン誘発性アルファ遮断の設定で低血圧を悪化させる可能性があるため、エピネフリン、ドーパミン、またはベータ作動薬活性を伴う他の交感神経刺激薬を使用しないでください。)患者が回復するまで、綿密な医学的監督とモニタリングを継続する必要があります。
リチウムまたはバルプロ酸の過剰摂取に関する具体的な情報については、これらの製品の添付文書の過剰摂取セクションを参照してください。オランザピンとフルオキセチンの併用による過剰摂取に関する具体的な情報については、Symbyax の添付文書の「過剰摂取」セクションを参照してください。
禁忌
- ジプレキサ単剤療法ではなし。
- ZYPREXA とフルオキセチンを併用する場合は、Symbyax の添付文書の禁忌のセクションも参照してください。
- リチウムまたはバルプロ酸の禁忌に関する具体的な情報については、これらの他の製品の添付文書の禁忌セクションを参照してください。
臨床薬理学
作用機序
記載された適応症におけるオランザピンの作用機序は不明である。ただし、統合失調症におけるオランザピンの有効性は、ドーパミンとセロトニン 2 型 (5HT2) 拮抗作用の組み合わせによって媒介される可能性があります。
薬力学
オランザピンは次の受容体に高い親和性で結合します: セロトニン 5HT2A/2C、5HT6 (それぞれ Ki=4、11、および 5 nM)、ドーパミン D1-4 (Ki=11-31 nM)、ヒスタミン H1 (Ki=7 nM) )、およびアドレナリンα1受容体(Ki = 19 nM)。オランザピンは、セロトニン 5HT3 (Ki = 57 nM) およびムスカリン M1-5 (それぞれ Ki = 73、96、132、32、および 48 nM) に対して中程度の親和性結合を持つアンタゴニストです。オランザピンは、GABAA、BZD、およびβアドレナリン受容体に低親和性で結合します (Ki > 10 μM)。
薬物動態
経口投与、単剤療法
オランザピンはよく吸収され、経口投与後約 6 時間で最高濃度に達します。全身循環に到達する前に、投与量の約 40% が代謝されて、初回通過代謝によって広範囲に除去されます。食べ物は、オランザピンの吸収率や程度に影響しません。薬物動態研究により、ジプレキサ 5mg 錠とジプレキサ ザイディス (オランザピン口腔内崩壊錠) のオランザピンの剤形は生物学的に同等であることが示されました。
オランザピンは、臨床投与範囲にわたって線形動態を示します。その半減期は 21 ~ 54 時間 (5 ~ 95 パーセンタイル; 平均 30 時間) であり、見かけの血漿クリアランスは 12 ~ 47 L/hr (5 ~ 95 パーセンタイル; 平均 25 L/hr) です。
オランザピンを 1 日 1 回投与すると、約 1 週間で定常状態の濃度になり、単回投与後の濃度の約 2 倍になります。オランザピンの血漿濃度、半減期、およびクリアランスは、喫煙状況、性別、および年齢に基づいて個人間で異なる場合があります.
オランザピンは全身に広く分布しており、分布量は約 1000 L です。7 ~ 1100 ng/mL の濃度範囲で 93% が血漿タンパク質に結合し、主にアルブミンとα1-酸性糖タンパク質に結合します。
代謝と排泄
14C 標識オランザピンの単回経口投与後、オランザピンの投与量の 7% が未変化の薬物として尿中に回収され、オランザピンが高度に代謝されていることが示されました。投与量の約 57% と 30% がそれぞれ尿と糞で回収されました。血漿では、オランザピンは総放射能の AUC の 12% しか占めておらず、代謝物への重大な暴露を示しています。複数の投与後、主要な循環代謝物は 10-N-グルクロニド、オランザピンの濃度の 44% で定常状態で存在し、4´-N-デスメチル オランザピン、オランザピンの濃度の 31% で定常状態で存在.両方の代謝産物は、観察された濃度では薬理活性を欠いています。
直接グルクロン酸抱合およびシトクロム P450 (CYP) を介した酸化は、オランザピンの主要な代謝経路です。 in vitro 研究では、CYP 1A2 と 2D6、およびフラビン含有モノオキシゲナーゼ系がオランザピンの酸化に関与していることが示唆されています。オランザピンのクリアランスは、この酵素が欠乏している被験者では減少しないため、CYP2D6 を介した酸化は in vivo でのマイナーな代謝経路であると思われます。
筋肉内投与
ZYPREXA IntraMuscular は、15 ~ 45 分以内にピーク血漿濃度が発生する急速な吸収をもたらします。健康なボランティアの薬物動態研究に基づいて、注射用の 5 mg のオランザピンの筋肉内投与は、平均して、5 mg のオランザピンの経口投与によって生成される最大血漿濃度よりも約 5 倍高い最大血漿濃度を生成します。筋肉内投与後に達成される曲線下面積は、同じ用量の経口投与後に達成されるものと類似しています。筋肉内投与後に観察される半減期は、経口投与後に観察される半減期と同様です。薬物動態は、臨床投与範囲にわたって直線的です。筋肉内投与後の代謝プロファイルは、経口投与後の代謝プロファイルと質的に類似しています。
特定の集団
腎障害
オランザピンは排泄前に高度に代謝され、薬物のわずか 7% しか変化せずに排泄されるため、腎機能障害のみがオランザピンの薬物動態に大きな影響を与える可能性は低いです。オランザピンの薬物動態特性は、重度の腎障害のある患者と正常な被験者で類似しており、腎障害の程度に基づく用量調整は必要ないことを示しています。さらに、オランザピンは透析によって除去されません。代謝産物の排出に対する腎障害の影響は研究されていません。
肝障害
肝障害の存在はオランザピンのクリアランスを低下させると予想されるかもしれませんが、臨床的に重要な (Childs Pugh 分類 A および B) 肝硬変の被験者 (n=6) における肝機能障害の影響に関する研究では、薬物動態への影響はほとんどないことが明らかになりました。オランザピンの。
高齢者
24人の健康な被験者を対象とした研究では、オランザピンの平均消失半減期は、高齢者(65歳以上)では非高齢者(65歳未満)よりも約1.5倍長かった.特に薬物代謝および/または薬力学的感受性に相加的に影響を与える可能性のある他の要因がある場合は、高齢者への投与には注意が必要です。 投薬と管理 ]。
性別
オランザピンのクリアランスは、男性よりも女性の方が約 30% 低いです。しかし、有効性や副作用に男女差は見られませんでした。性別に基づく用量変更は必要ありません。
喫煙状況
オランザピンのクリアランスは、非喫煙者よりも喫煙者の方が約 40% 高くなっていますが、定期的な投与量の変更は推奨されていません。
人種
in vivo 研究では、日本人、中国人、白人の間で、特に体重の違いを正規化した後では、曝露が類似していることが示されています。したがって、レースのための用量変更は推奨されません。
複合効果
年齢、喫煙、および性別の複合効果により、集団内の薬物動態に大きな違いが生じる可能性があります。たとえば、喫煙する若い男性のクリアランスは、非喫煙の年配の女性のクリアランスよりも 3 倍高い可能性があります。オランザピンの代謝が遅くなる可能性のある要因の組み合わせを示す患者では、用量の変更が必要になる場合があります。 投薬と管理 ]。
青少年(13~17歳)
臨床研究では、ほとんどの青年は非喫煙者であり、この集団は平均体重が低く、その結果、成人と比較してオランザピンの平均曝露が高くなりました.
動物毒物学および/または薬理学
オランザピンの動物実験では、主要な血液学的所見は、10 mg/kg を投与された個々のイヌにおける可逆的な末梢血球減少症 (mg/m² 体表面積に基づく 1 日経口 MRHD の 17 倍)、マウスにおけるリンパ球および好中球の用量依存的な減少でした。 、およびラットのリンパ球減少症。 10 mg/kg で治療された少数の犬は、治療の 1 ~ 10 か月の間に、可逆的な好中球減少症および/または可逆的な溶血性貧血を発症しました。リンパ球と好中球の用量依存的な減少は、3 ヶ月間の研究で 10 mg/kg の用量を与えられたマウス (mg/m² 体表面積に基づく 1 日経口 MRHD の 2 倍に等しい) で見られました。体重増加の減少と一致する非特異的リンパ球減少症は、22.5 mg/kg (mg/m² の体表面積に基づく 1 日経口 MRHD の 11 倍) または 16 mg/kg (1 日経口 MRHD に基づく 1 日経口 MRHD の 8 倍) を 3 か月間投与されたラットで発生しました。 mg/m² 体表面積で) 6 か月または 12 か月間。調べた種のいずれにも、骨髄細胞毒性の証拠は見られなかった。骨髄は正常細胞性または過細胞性であり、循環血液細胞の減少はおそらく末梢 (非骨髄) 因子によるものであることを示しています。
臨床研究
ジプレキサ 7.5mg とフルオキセチンを併用する場合は、Symbyax の添付文書の臨床試験のセクションも参照してください。
統合失調症
大人
統合失調症の治療における経口オランザピンの有効性は、統合失調症の DSM III-R 基準を満たす成人入院患者の 2 つの短期 (6 週間) 対照試験で確立されました。 2件の試験のうち1件では、比較治療として単一のハロペリドール群が含まれていたが、この試験では、両方の臨床的に関連する用量の全範囲でこれら2つの薬剤を比較していなかった。
これらの研究では、精神医学的徴候と症状を評価するためにいくつかの手段が使用されました。その中には、統合失調症の薬物治療の効果を評価するために伝統的に使用されてきた一般的な精神病理学の複数項目の目録である簡易精神医学評価尺度 (BPRS) があります。 BPRS 精神病クラスター (概念の混乱、幻覚行動、疑わしさ、異常な思考内容) は、活発な精神病の統合失調症患者を評価するための特に有用なサブセットと見なされます。 2 番目の従来の評価である臨床全体印象 (CGI) は、患者の全体的な臨床状態について、統合失調症の症状に十分に精通している熟練した観察者の印象を反映しています。さらに、最近開発された 2 つのスケールが採用されました。これらには、BPRS の 18 項目が組み込まれた 30 項目の陽性および陰性症状尺度 (PANSS) と陰性症状評価尺度 (SANS) が含まれていました。以下の試験の概要は、次の結果に焦点を当てています。PANSS 合計および/または BPRS 合計。 BPRS 精神病クラスター; PANSS 負のサブスケールまたは SANS。および CGI 重大度。試行の結果は次のとおりです。
(1) 6 週間のプラセボ対照試験 (n=149) で、オランザピンを 1 および 10 mg/日 (1 日 1 回のスケジュール) の 2 つの固定用量で、オランザピンを 10 mg/日で (ただし 1 mg/日ではなく)日)、PANSS合計スコア(抽出されたBPRS合計でも)、BPRS精神病クラスター、PANSSネガティブサブスケール、およびCGI重症度でプラセボよりも優れていました。
(2) 3 つの固定用量範囲のオランザピン (5 ± 2.5 mg/日、10 ± 2.5 mg/日、および 15 ± 2.5 mg/日) を含む 6 週間のプラセボ対照試験 (n=253)。 1 日 1 回のスケジュールで、オランザピンの 2 つの最高用量グループ (実際の平均用量はそれぞれ 12 および 16 mg/日) は、BPRS 合計スコア、BPRS 精神病クラスター、および CGI 重症度スコアでプラセボよりも優れていました。オランザピンの最高用量グループは、SANS でプラセボよりも優れていました。中用量群よりも高用量群に明確な利点はありませんでした。
(3) 長期試験では、主に統合失調症の DSM-IV 基準を満たし、少なくとも 8 週間の非盲検治療中にオランザピンで安定していた成人の外来患者 (n=326) が、現在のオランザピンの継続に無作為に割り付けられました。用量(10〜20 mg /日の範囲)またはプラセボ。患者の再発を観察するためのフォローアップ期間は、BPRS 陽性症状の増加または入院の観点から定義され、12 か月間計画されましたが、オランザピンの再発と比較してプラセボの再発が過剰であったため、試験を早期に中止する基準が満たされました。 、およびオランザピンは、この研究の主要な結果である再発までの時間においてプラセボよりも優れていました。したがって、オランザピンは、約 8 週間安定し、最大 8 か月の観察期間を追跡した患者において有効性を維持する上で、プラセボよりも効果的でした。
母集団のサブセット (人種と性別) の調査では、これらのサブグループに基づく反応性の違いは明らかになりませんでした。
青少年
青年期(13 歳から 17 歳)の統合失調症の急性期治療における経口オランザピンの有効性は、統合失調症の入院患者および外来患者(n=107)を対象とした 6 週間の二重盲検プラセボ対照ランダム化試験で確立されました。 DSM-IV-TR による診断基準であり、学齢期の子供の現在および生涯版 (K-SADS-PL) の情動障害および統合失調症のキディ スケジュールによって確認されています。
この試験で精神医学的徴候と症状を評価するために使用された主要な評価手段は、子供のための簡単な精神医学的評価尺度(BPRS-C)の合計スコアの固定バージョンでした。
この柔軟な用量試験では、統合失調症と診断された青年の治療において、オランザピン 2.5 ~ 20 mg/日 (平均モーダル用量 12.5 mg/日、平均用量 11.1 mg/日) がプラセボよりも効果的であったことが統計的に裏付けられています。プラセボ群よりもオランザピン治療群の患者の BPRS-C 合計スコアの有意な平均低下。
ジプレキサで治療された思春期の患者がどれくらいの期間維持されるべきかという疑問に答えるための証拠はありませんが、成人と思春期の患者におけるオランザピンの薬物動態パラメーターの比較とともに、成人のデータから維持の有効性を推定することができます。反応のある患者は、急性反応を超えて継続することが一般的に推奨されますが、寛解を維持するために必要な最低用量です。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります。
双極Ⅰ型障害(躁病または混合エピソード)
大人
単剤療法
躁病エピソードまたは混合エピソードの治療における経口オランザピンの有効性は、双極 I 型障害の DSM-IV 基準を満たす成人患者を対象とした 2 つの短期 (1 つは 3 週間、もう 1 つは 4 週間) プラセボ対照試験で確立されました。躁病または混合エピソード。これらの試験には、精神病の特徴の有無にかかわらず、急速なサイクリングコースの有無にかかわらず患者が含まれていました。
これらの試験で躁病の症状を評価するために使用された主要な評価手段は、躁病の症状(過敏性、破壊的/攻撃的な行動、睡眠、気分の高揚、発話、活動の増加、性的関心、言語/思考障害、思考内容、外見、および洞察) を 0 (躁病の特徴なし) から 60 Â (最大スコア) の範囲で評価します。これらの試験の主な結果は、Y-MRS 合計スコアのベースラインからの変化でした。試行の結果は次のとおりです。
(1) オランザピンの用量範囲 (5-20 mg/日、1 日 1 回、10 mg/日から開始) を含む 3 週間のプラセボ対照試験 (n=67) では、オランザピンは以下の点でプラセボよりも優れていました。 Y-MRS 合計スコアの減少。最初の試験と同時に実施された同一のデザインの試験では、オランザピンは同様の治療差を示しましたが、おそらくサンプルサイズと部位のばらつきにより、この結果に関してプラセボよりも優れていることは示されませんでした.
(2) オランザピンの用量範囲 (5-20 mg/日、1 日 1 回、15 mg/日から開始) を含む 4 週間のプラセボ対照試験 (n=115) では、オランザピンは以下の点でプラセボよりも優れていました。 Y-MRS 合計スコアの減少。
(3) 別の試験では、最初の非盲検治療段階で平均して約 2 週間、オランザピン 5 ~ 20 mg/再発の観察のために、同じ用量でのオランザピンの継続(n = 225)またはプラセボ(n = 136)のいずれかに無作為に割り付けられました。患者の約 50% が 59 日目までにオランザピン群を中止し、プラセボ群の 50% が 23 日目までに二重盲検治療を中止しました。非盲検期の奏効は、Y-MRS 合計スコアが 12 以下に、HAM-D 21 が 8 以下に減少したことによって定義されました。二重盲検期間中の再発は、Y-MRS または HAM-D 21 の合計スコアが 15 以上に増加した場合、または躁病またはうつ病で入院した場合と定義されました。無作為化フェーズでは、オランザピンを継続して投与された患者は、再発までの時間が有意に長くなりました。
リチウムまたはバルプロ酸の補助剤
躁病エピソードまたは混合エピソードの治療における経口オランザピンとリチウムまたはバルプロ酸の併用の有効性は、躁病エピソードまたは混合エピソードを伴う双極 I 障害の DSM-IV 基準を満たす患者を対象とした 2 つの対照試験で確立されました。これらの試験には、精神病の特徴の有無にかかわらず、急速なサイクリングコースの有無にかかわらず患者が含まれていました。試行の結果は次のとおりです。
(1) ある 6 週間のプラセボ対照併用試験では、躁病または混合症状の制御が不十分な (Y-MRS ≥16) リチウムまたはバルプロ酸療法を受けている 175 人の外来患者が、元の治療法と組み合わせて、オランザピンまたはプラセボのいずれかを受けるように無作為に割り付けられました。 .オランザピン(5~20 mg/日の用量範囲で、1 日 1 回、10 mg/日から開始)とリチウムまたはバルプロ酸(0.6 mEq/L ~ 1.2 mEq/L または 50 μg/mL ~それぞれ 125 μg/mL) は、Y-MRS 合計スコアの低下において、リチウムまたはバルプロ酸単独よりも優れていました。
(2) 2 回目の 6 週間のプラセボ対照併用試験では、躁病または混合症状の制御が不十分な (Y-MRS ≥16) リチウムまたはバルプロ酸療法を受けている 169 人の外来患者が無作為に割り付けられ、オランザピンまたはプラセボのいずれかを元の薬と組み合わせて投与されました。治療。オランザピン(5~20 mg/日の用量範囲で、1 日 1 回、10 mg/日から開始)とリチウムまたはバルプロ酸(0.6 mEq/L ~ 1.2 mEq/L または 50 μg/mL ~それぞれ 125 μg/mL) は、Y-MRS 合計スコアの低下において、リチウムまたはバルプロ酸単独よりも優れていました。
青少年
急性単剤療法
青年期(13~17歳)の急性躁病または混合エピソードの治療における経口オランザピンの有効性は、診断基準を満たした青年期の入院患者および外来患者を対象とした3週間の二重盲検プラセボ対照ランダム化試験で確立されました。 DSM-IV-TR (n=161) による、双極 I 型障害 (精神病的特徴の有無にかかわらず) に関連する躁病エピソードまたは混合エピソードの基準。診断はK-SADS-PLによって確認されました。
この試験で躁病の症状を評価するために使用された主要な評価手段は、思春期の構造化されたヤングマニア評価尺度(Y-MRS)の合計スコアでした。
この柔軟な用量試験では、オランザピン 2.5 ~ 20 mg/日 (平均モーダル用量 10.7 mg/日、平均用量 8.9 mg/日) は、躁病エピソードまたは双極 I 型に関連する混合エピソードを持つ青年の治療において、プラセボよりも効果的でした。これは、プラセボ群よりもオランザピン治療群の患者の Y-MRS 合計スコアの平均減少が統計的に有意に大きいことによって裏付けられています。
ジプレキサで治療された思春期の患者がどれくらいの期間維持されるべきかという疑問に答えるための証拠はありませんが、成人と思春期の患者におけるオランザピンの薬物動態パラメーターの比較とともに、成人のデータから維持の有効性を推定することができます。反応のある患者は、急性反応を超えて継続することが一般的に推奨されますが、寛解を維持するために必要な最低用量です。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります。
統合失調症および双極 I マニアに関連する動揺
オランザピン筋肉内注射による激越治療の有効性は、統合失調症および双極 I 型障害(躁病エピソードまたは混合エピソード)の 2 つの診断グループの興奮状態の成人入院患者を対象とした 3 つの短期(24 時間の IM 治療)プラセボ対照試験で確立されました。 .各試験には、ハロペリドール注射(統合失調症研究)またはロラゼパム注射(双極 I 躁病研究)の 1 つの実薬比較治療群が含まれていました。試験に登録された患者は、(1) 臨床研究者によって、臨床的に動揺しており、筋肉内投薬による治療に臨床的に適切な候補であると判断され、(2) 14 以上の閾値スコア以上の動揺のレベルを示す必要がありました。ポジティブおよびネガティブ シンドローム スケール (PANSS) 興奮コンポーネント (すなわち、衝動制御不良、緊張、敵意、非協力性および興奮の項目) を構成する 5 項目で、1 ~ 7 の採点システム (1 =なし、4=中等度、7=極度)。研究では、ベースラインの PANSS Excited Component スコアの平均は 18.4 で、スコアは 13 から 32 の範囲 (最大スコア 35 のうち) であり、軽度または重度のレベルの興奮を経験している一部の患者で主に中程度のレベルの興奮を示唆しています。これらの試験で動揺の徴候と症状を評価するために使用された主要な有効性指標は、注射後 2 時間の PANSS 励起成分のベースラインからの変化でした。患者は、24 時間の IM 治療期間中に最大 3 回の注射を受けることができました。ただし、患者は、最初の 2 時間後に最初の有効性測定値が評価されるまで、2 回目の注射を受けることができませんでした。試行の結果は次のとおりです。
(1) 統合失調症の DSM-IV 基準を満たす動揺した入院患者 (n=270) を対象としたプラセボ対照試験では、2.5 mg、5 mg、7.5 mg、および 10 mg の注射用量で 4 つの固定筋肉内オランザピンが評価されました。すべての用量は、注射後 2 時間の PANSS 励起成分でプラセボよりも統計的に優れていました。ただし、効果は 3 つの最高用量でより大きく、より一貫していました。 7.5 mg と 10 mg の用量では、5 mg の用量よりも有意な対差はありませんでした。
(2) 統合失調症の DSM-IV 基準を満たす動揺した入院患者 (n=311) を対象とした 2 回目のプラセボ対照試験では、10 mg の注射用量の 1 つの固定筋肉内オランザピンが評価されました。注射用のオランザピンは、注射後 2 時間の PANSS 励起成分で統計的にプラセボよりも優れていました。
(3) 双極 I 型障害の DSM-IV 基準を満たす興奮状態の入院患者 (現在、精神病の特徴を伴うまたは伴わない急性の躁病または混合エピソードを示している) (n=201) を対象としたプラセボ対照試験では、注射用量として 1 つの固定筋肉内オランザピンの 10 mg が評価されました。注射用のオランザピンは、注射後 2 時間の PANSS 励起成分で統計的にプラセボよりも優れていました。
母集団のサブセット (年齢、人種、および性別) の検査では、これらのサブグループに基づいて異なる応答性は明らかになりませんでした。
患者情報
ジプレキサ® (zy-PREX-a) (オランザピン) 錠
ジプレキサ® ザイディス® (zy-PREX-a ZY-dis) (オランザピン) 錠剤、口腔内崩壊
ジプレクサの服用を開始する前、およびリフィルを入手するたびに、ジプレキサに付属の投薬ガイドをお読みください。新しい情報があるかもしれません。この投薬ガイドは、病状や治療について医師に相談する代わりにはなりません。不明な点がある場合、またはジプレキサについて詳しく知りたい場合は、医師または薬剤師に相談してください。
ジプレキサについて知っておくべき最も重要な情報は何ですか?
ジプレキサ 20mg は、次のような重大な副作用を引き起こす可能性があります。
これらの深刻な副作用について以下に説明します。
1. 混乱し、記憶喪失になり、現実との接触を失った高齢者の死亡リスクの増加 (認知症関連の精神病)。 ジプレキサは、認知症の高齢者の精神病の治療には承認されていません。
2.高血糖(高血糖)。 すでに糖尿病にかかっている場合でも、糖尿病にかかったことがない場合でも、高血糖になる可能性があります。高血糖につながる可能性があります:
- ケトンによる血液中の酸の蓄積(ケトアシドーシス)
- 昏睡
- 死
医師は、ジプレキサ 7.5mg の服用を開始する前と治療中に血糖値をチェックする検査を行う必要があります。糖尿病でない人では、ジプレキサ 7.5mg を中止すると高血糖がなくなることがあります。糖尿病の人や、ジプレキサを服用する前は糖尿病ではなかった一部の人は、ジプレキサの服用を中止した後も高血糖の薬を服用する必要があります。
糖尿病の場合は、ジプレキサを服用している間、血糖値をチェックする頻度について医師の指示に従ってください.
医師に電話する ジプレキサを服用中に高血糖(高血糖)のこれらの症状のいずれかがある場合:
- 非常にのどが渇く
- いつもより多く排尿する必要がある
- とてもお腹がすいた
- 脱力感や疲れを感じる
- 胃が痛い
- 混乱したり、息がフルーティーなにおいがしたりする
3. 血液中の高脂肪レベル (コレステロールとトリグリセリド)。 特にティーンエイジャー(13~17歳)でジプレキサ10mgの治療を受けている人、または子供(10~17歳)でフルオキセチンと併用した場合、脂肪レベルが高くなる可能性があります。症状がない場合もあるため、医師は、ジプレキサの服用を開始する前と治療中に血液検査を行って、コレステロールとトリグリセリドのレベルを確認する必要があります。
4.体重増加。 ジプレキサを服用している人は、体重増加が非常に一般的です。 10 代の若者 (13 歳から 17 歳) は、大人よりも体重が増えやすく、体重が増える可能性が高くなります。ジプレクサ 7.5mg をフルオキセチンと併用した場合、子供 (10 歳から 17 歳) は成人よりも体重が増える可能性が高くなります。ジプレキサを服用している間に体重が大幅に増加する人もいるため、あなたと医師は定期的に体重をチェックする必要があります.健康的でバランスの取れた食事や運動など、体重増加を抑える方法について医師に相談してください。
ジプレキサとは?
ジプレキサは、以下の治療に使用される処方薬です。
- 13 歳以上の統合失調症。
- 以下を含む双極性障害:
- 13 歳以上の双極 I 型障害で起こる躁病エピソードまたは混合エピソード。
- 双極 I 型障害で起こる躁病エピソードまたは混合エピソードで、成人でリチウムまたはバルプロ酸と一緒に使用した場合。
- 成人における双極I型障害の長期治療。
- 10 歳以上の人が薬フルオキセチン (プロザック®) と併用した場合に、双極 I 型障害で起こるうつ病のエピソード。
- 治療抵抗性うつ病とも呼ばれ、フルオキセチン(プロザック)という薬を成人で使用した場合に、他の 2 つの薬を使用しても改善しないうつ病のエピソード。
ジプレキサ 7.5mg は、13 歳未満の子供への使用は承認されていません。ジプレキサ 10mg とフルオキセチンの併用は、10 歳未満の子供への使用は承認されていません。
統合失調症の症状には、声が聞こえる、存在しないものが見える、真実ではない信念を持つ、疑心暗鬼になる、内向的になるなどがあります。
双極 I 型障害の症状には、抑うつと気分の高揚または過敏性の交互の期間、活動の増加と落ち着きのなさ、思考の競争、早口、衝動的な行動、および睡眠の必要性の減少が含まれます。
治療抵抗性うつ病の症状には、気分の低下、興味の低下、罪悪感の増加、エネルギーの低下、集中力の低下、食欲の変化、および自殺念慮または行動が含まれます。
治療によって症状が改善する場合もあります。良くなっていないと思われる場合は、医師に連絡してください。
ジプレキサを服用する前に医師に何を伝えるべきですか?
ジプレキサはあなたに合わないかもしれません。ジプレクサを開始する前に、以下の症状があるかどうかを医師に伝えてください。
- 心の問題
- 発作
- 糖尿病または高血糖(高血糖)
- あなたの血中の高コレステロールまたはトリグリセリドレベル
- 肝臓の問題
- 低血圧または高血圧
- 一過性脳虚血発作(TIA)とも呼ばれる脳卒中または「ミニ脳卒中」
- アルツハイマー病
- 狭隅角緑内障
- 男性の前立腺肥大
- 腸閉塞症
- ZYPREXA 5mg ZYDISにはフェニルアラニンが含まれているため、フェニルケトン尿症
- 乳がん
- 自殺や自分を傷つける考え
- その他の病状
- 妊娠している、または妊娠する予定がある。ジプレキサ 2.5mg が胎児に害を及ぼすかどうかは不明です。
- ジプレクサ 20mg の投与中に妊娠した場合は、非定型抗精神病薬の国家妊娠登録簿への登録について医療提供者に相談してください。 1-866-961-2388 に電話するか、http://womensmentalhealth.org/clinical-andresearch-programs/pregnancyregistry/ にアクセスして登録できます。
- 授乳中または授乳を計画している。ジプレキサは母乳に移行します。ジプレキサを服用している場合は、赤ちゃんに与える最善の方法について医師に相談してください.
運動量が多い場合や、暑い場所にいることが多い場合は、医師に相談してください。
双極 I 型障害、治療抵抗性うつ病、または統合失調症の症状には、以下のものがあります。 自殺への思い または自分自身や他の人を傷つけること。いつでもこれらの考えがある場合は、医師に相談するか、すぐに緊急治療室に行ってください。
服用しているすべての薬について医師に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。ジプレキサ 20mg と一部の医薬品は相互作用を起こし、効果が得られなかったり、深刻な副作用を引き起こす可能性があります。ジプレキサを他の薬と一緒に服用しても安全かどうかは、医師が判断します。最初に医師に相談することなく、ジプレキサを服用している間は薬を開始または中止しないでください.
ジプレキサ 7.5mg の服用方法は?
- ジプレキサを処方されたとおりに服用してください。医師は、ジプレキサ 15mg の投与量を、あなたにとって適切になるまで変更 (調整) する必要があるかもしれません。
- ジプレキサ 20mg を飲み忘れた場合は、思い出したらすぐに飲み忘れた分を服用してください。次の服用時間が近い場合は、忘れた分は飛ばして、通常の時間に次の分を服用してください。ジプレキサ 10mg を同時に 2 回服用しないでください。
- 深刻な副作用を防ぐために、ジプレキサの服用を突然中止しないでください。ジプレキサの服用を中止する必要がある場合は、医師が安全に服用を中止する方法を教えてくれます。
- ジプレキサを過剰に服用した場合は、すぐに医師または毒物管理センター (1-800-222-1222) に電話するか、緊急治療を受けてください。
- ジプレキサ 10mg は食事の有無にかかわらず服用できます。
- ジプレキサは通常、1日1回服用します。
- ジプレキサ 20mg ZYDIS を次のように服用します。
- 手が乾いていることを確認してください。
- 小袋を開けて、ブリスターのホイルをはがします。ホイルを通して錠剤を押し出さないでください。
- ブリスターを開けたらすぐに錠剤を取り出し、口に入れます。
- 錠剤は唾液の中で素早く崩壊するため、液体を飲んでも飲まなくても簡単に飲み込むことができます。
- ジプレキサを服用している間、良くなっていないと思われる場合、または状態について懸念がある場合は、医師に連絡してください。
ジプレキサを服用している間、何を避けるべきですか?
- ジプレキサは眠気を引き起こす可能性があり、意思決定、明確な思考、または迅速な反応に影響を与える可能性があります。ジプレクサ 7.5mg がどのように影響するかを理解するまでは、運転、重機の操作、またはその他の危険な活動を行ってはなりません。
- ジプレキサの服用中は飲酒を避けてください。ジプレキサを服用中にアルコールを飲むと、ジプレキサ 15mg を単独で服用する場合よりも眠くなる可能性があります。
ジプレキサ 5mg の副作用の可能性は何ですか?
ジプレキサ 5mg を服用すると、次のような重大な副作用が発生する可能性があります。
- 「ジプレキサについて知っておくべき最も重要な情報は何ですか?」を参照してください。これは、認知症関連精神病の高齢者の死亡リスクの増加と、高血糖、高コレステロールおよび高トリグリセリド レベル、および体重増加のリスクについて説明しています。
- 認知症関連精神病の高齢者(錯乱や記憶喪失のために現実との接触を失った高齢者)における脳卒中または一過性脳虚血発作(TIA)と呼ばれる「ミニ脳卒中」の発生率の増加。 ジプレキサは、これらの患者には承認されていません。
- 神経弛緩性悪性症候群 (NMS): NMS はまれですが、ジプレキサを含む抗精神病薬を服用している人に発生する可能性がある非常に深刻な状態です。 NMS は死に至る可能性があり、病院で治療する必要があります。重度の病気になり、次のような症状がある場合は、すぐに医師に連絡してください。
- 高熱
- 過度の発汗
- 硬い筋肉
- 錯乱
- 呼吸、心拍、血圧の変化。
- 好酸球増加症および全身症状(DRESS)との薬物反応: DRESSはZYPREXAで発生する可能性があります。 DRESSの特徴には、発疹、発熱、腺の腫れ、および肝臓、腎臓、肺、心臓などの他の内臓の関与が含まれる場合があります. DRESS は時に致命的です。したがって、これらの兆候が見られた場合は、すぐに医師に相談してください。
- 遅発性ジスキネジア: この状態は、あなたがコントロールできない体の動きを引き起こします。これらの動きは通常、顔と舌に影響を与えます。遅発性ジスキネジアは、ジプレキサの服用をやめても治らない場合があります。また、ジプレキサの服用を中止した後に始まることもあります。コントロールできない体の動きがある場合は、医師に相談してください。
- 姿勢を変えると血圧が低下し、めまい、心拍数の増減、失神などの症状が現れる。
- 飲み込むのが困難になり、食べ物や液体が肺に入る可能性があります。
- 発作:ジプレキサによる治療中に発作が起きた場合は、医師に相談してください。
- 体温の制御に関する問題: たとえば、たくさん運動したり、非常に暑い場所に滞在したりすると、非常に熱くなることがあります。脱水症状にならないように水を飲むことが重要です。重度の病気になり、次のような脱水症状がある場合は、すぐに医師に連絡してください。
- 汗をかきすぎる、またはまったく発汗しない
- 口渇
- とても暑い
- 喉が渇いた
- 尿を生成することができません。
ジプレキサの一般的な副作用は次のとおりです。 エネルギー不足、口渇、食欲増進、眠気、震え(揺れ)、硬便またはまれな便、めまい、行動の変化、または落ち着きのなさ.
10 代の若者 (13-17 歳) のその他の一般的な副作用には、次のようなものがあります。 頭痛、胃部(腹部)の痛み、腕や脚の痛み、または疲労。 10 代の若者は、成人と比較して、プロラクチン、肝酵素、および眠気が大幅に増加しました。
気になる副作用や治らない副作用については、医師に相談してください。
これらは、ジプレキサで起こりうる副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
ジプレキサの保管方法は?
- ジプレキサは、20°C~25°C (68°F~77°F) の室温で保管してください。
- ジプレクサは光を避けて保管してください。
- ジプレクサ 15mg を乾燥させ、湿気を避けて保管してください。
ジプレキサ 5mg とすべての医薬品は、子供の手の届かないところに保管してください。
ジプレキサに関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態でジプレキサを使用しないでください。他の人が同じ状態であっても、ジプレキサ 5mg を与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、ジプレキサに関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医師に相談してください。医療従事者向けに書かれたジプレキサ 20mg に関する情報については、医師または薬剤師にお尋ねください。ジプレキサの詳細については、1-800-Lilly-Rx (1-800-545-5979) までお問い合わせください。
ジプレキサの成分は?
有効成分: オランザピン
不活性成分:
カルナバワックス、クロスポビドン、ヒドロキシプロピルセルロース、ヒプロメロース、ラクトース、ステアリン酸マグネシウム、微結晶性セルロース、およびその他の不活性成分。カラーコーティングには、二酸化チタン、FD&C Blue No. 2 アルミニウムレーキ、または合成赤色酸化鉄が含まれています。
ザイディス - ゼラチン、マンニトール、アスパルテーム、メチルパラベンナトリウム、プロピルパラベンナトリウム。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
