Effexor 37.5mg, 75mg Venlafaxine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
患者情報
エフェクサー(ベンラファキシン) (ven-la-fax-een) 錠剤、USP
服用を開始する前、および補充品を入手するたびに、ベンラファキシン錠、USP に付属の投薬ガイドをお読みください。新しい情報があるかもしれません。この投薬ガイドは、あなたの病状や治療について医療提供者に相談する代わりにはなりません.わからないことやもっと知りたいことがある場合は、医療提供者に相談してください。
ベンラファキシン錠 USP について知っておくべき最も重要な情報は何ですか?
ベンラファキシン錠、USP、およびその他の抗うつ薬は、次のような深刻な副作用を引き起こす可能性があります。
1. 自殺願望または行動:
- ベンラファキシン錠剤、USP、およびその他の抗うつ薬は、治療の最初の数か月以内または用量が変更されたときに、一部の子供、ティーンエイジャー、または若年成人の自殺念慮または行動を増加させる可能性があります.
- うつ病やその他の深刻な精神疾患は、自殺念慮や自殺行動の最も重要な原因です。
- これらの変化に注意し、次のことに気付いた場合はすぐに医療提供者に連絡してください。
- 特に重度の場合、気分、行動、行動、思考、または感情の新しいまたは突然の変化。
- ベンラファキシン錠、USP の開始時や用量変更時には特に注意してください。
フォローアップの訪問はすべて医療提供者に任せ、症状が心配な場合は次の訪問まで電話してください。
以下の症状のいずれかがある場合は、すぐに医療提供者に連絡するか、緊急の場合、特に症状が新しい場合、悪化している場合、または心配している場合は、911 に電話してください。
- 自殺しようとする
- 危険な衝動で行動する
- 攻撃的または暴力的な行動
- 自殺や死についての考え
- 新しいまたは悪化したうつ病
- 新しいまたは悪化した不安またはパニック発作
- 動揺、落ち着きのなさ、怒り、または苛立ちを感じる
- 寝られない
- 活動の増加、または通常より多く話す
- 行動や気分のその他の異常な変化
以下の症状がある場合は、すぐに医療提供者に連絡するか、緊急の場合は 911 に電話してください。ベンラファキシン錠、USP は、これらの重大な副作用に関連している可能性があります。
2.セロトニン症候群
この状態は生命を脅かす可能性があり、次のようなものがあります。
- 興奮、幻覚、昏睡またはその他の精神状態の変化
- 調整の問題または筋肉のけいれん (過活動反射)
- レーシングハートビート、高血圧または低血圧
- 発汗または発熱
- 吐き気、嘔吐、または下痢
- 筋肉のこわばり
3. 血圧の変化。ベンラファキシン錠、USP は次の可能性があります。
- 血圧を上げる。治療開始前に高血圧をコントロールし、定期的に血圧を監視する
4.瞳孔拡大(散瞳)。
5.不安と不眠症。
6.食欲や体重の変化。
- 子供と青年は、治療中に身長と体重を監視する必要があります
7. 躁/軽躁エピソード:
- 大幅に増加したエネルギー
- 重度の睡眠障害
- レーシング思考
- 無謀な行動
- 異常に壮大なアイデア
- 過度の幸福または過敏症
- いつもより多くまたは速く話す
8.血中の塩分(ナトリウム)レベルが低い。
高齢者は、このリスクが高くなる可能性があります。症状には次のものがあります。
- 頭痛
- 脱力感または不安定感
- 混乱、集中または思考の問題、または記憶の問題
9. 発作またはけいれん。
10. 異常な出血: ベンラファキシン錠剤、USP、およびその他の抗うつ薬は、特に血液希釈剤ワルファリン (Coumadin®、Jantoven®)、非ステロイド性抗炎症薬 (NSAIDs、イブプロフェンまたはナプロキセン)、またはアスピリン。
11.コレステロールの上昇。
12. 肺疾患および肺炎: ベンラファキシン錠剤、USP はまれに肺の問題を引き起こす可能性があります。症状は次のとおりです。
- 息切れの悪化
- 咳
- 胸の不快感
13.重度のアレルギー反応:
- 呼吸困難
- 顔、舌、目または口の腫れ
- 発疹、かゆみのあるみみずみ(蕁麻疹)または水ぶくれ、単独で、または発熱または関節痛を伴う
14. 視覚的な問題:
- 眼の痛み
- 視覚の変化
- 目の中または周りの腫れまたは赤み
これらの問題の危険にさらされているのは、一部の人々だけです。目の検査を受けて、危険にさらされているかどうかを確認し、危険にさらされている場合は予防治療を受けることをお勧めします。
最初に医療提供者に相談せずに、Venlafaxine 錠、USP を中止しないでください。ベンラファキシン錠や USP をあまりにも早く中止したり、別の抗うつ薬からあまりにも早く変更したりすると、次のような深刻な症状を引き起こす可能性があります。
- 不安、過敏症
- 疲れている、落ち着かない、または睡眠障害を感じている
- 頭痛、発汗、めまい
- 感電のような感覚、震え、錯乱、悪夢
- 嘔吐、吐き気、下痢
ベンラファキシン錠、USPとは何ですか?
ベンラファキシン錠、USP は、うつ病の治療に使用される処方薬です。うつ病を治療するリスクと治療しないリスクについて、担当の医療提供者と話し合うことが重要です。すべての治療法の選択について、医療提供者と話し合う必要があります。
ベンラファキシン錠、USP 治療で症状が改善していないと思われる場合は、医療提供者に相談してください。
ベンラファキシン錠 USP を服用してはいけない人は?
- 次の場合は、ベンラファキシン錠 (USP) を服用しないでください。
- ベンラファキシン錠、USPまたはベンラファキシン錠、USPの成分のいずれかにアレルギーがある.ベンラファキシン錠剤の全成分リスト、USP については、この医薬品ガイドの最後を参照してください。
- コントロールされていない狭隅角緑内障がある
- モノアミンオキシダーゼ阻害剤(MAOI)を服用してください。抗生物質リネゾリドを含む MAOI を服用しているかどうかわからない場合は、医療提供者または薬剤師に尋ねてください。
- 医師の指示がない限り、ベンラファキシン錠 (USP) を中止してから 7 日以内に MAOI を服用しないでください。
- 過去 2 週間以内に MAOI の服用を中止した場合は、医師の指示がない限り、ベンラファキシン錠 (USP) を開始しないでください。
MAOI に近い時期に USP の Venlafaxine 錠を服用する人は、深刻な、または生命を脅かす副作用を起こす可能性があります。次のような症状がある場合は、すぐに医療機関を受診してください。
- 高熱
- 制御されていない筋肉のけいれん
- 筋肉のこわばり
- 心拍数または血圧の急激な変化
- 錯乱
- 意識を失う(失神する)
ベンラファキシン錠 USP を服用する前に、医療提供者に何を伝えるべきですか?わからない場合は質問してください。
ベンラファキシン錠 (USP) を開始する前に、次の場合は医療提供者に伝えてください。
- 次のような特定の薬を服用している:
- 次のような片頭痛の治療に使用される薬:
- トリプタン
- 気分障害、不安障害、精神障害、または思考障害の治療に使用される医薬品:
- 三環系抗うつ薬
- リチウム
- SSRI
- SNRI
- 抗精神病薬
- 次のような痛みを治療するために使用される薬:
- トラマドール
- 次のような血液を薄くするために使用される薬:
- ワルファリン
- 次のような胸やけの治療に使用される薬:
- シメチジン
- 以下のような市販薬またはサプリメント:
- アスピリンまたは他の NSAID
- トリプトファン
- セントジョーンズワート
- 心臓に問題がある
- 糖尿病を持っている
- 肝臓に問題がある
- 腎臓に問題がある
- 甲状腺に問題がある
- 緑内障がある
- 発作またはけいれんがある、またはあった
- 双極性障害または躁病がある
- 血液中のナトリウム濃度が低い
- 高血圧がある
- コレステロールが高い
- 出血の問題がある、またはあった
- 妊娠している、または妊娠する予定がある。 USPのベンラファキシン錠が胎児に害を及ぼすかどうかは不明です.妊娠中のうつ病治療の利点とリスクについて、担当の医療提供者に相談してください。
- 授乳中または授乳を計画している。一部のベンラファキシン タブレット、USP は母乳に移行する場合があります。ベンラファキシン錠 (USP) を服用中に赤ちゃんに食事を与える最善の方法について、医療提供者に相談してください。
処方薬、非処方薬、ビタミン、ハーブのサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。 Venlafaxine 錠剤、USP、および一部の医薬品は、相互に作用し合ったり、効果がなかったり、深刻な副作用を引き起こす可能性があります。
医療提供者または薬剤師は、ベンラファキシン錠 (USP) を他の医薬品と一緒に服用しても安全かどうかを教えてくれます。最初に医療提供者に相談せずに、ベンラファキシン錠、USPを服用している間は、薬を開始または停止しないでください.
ベンラファキシン錠剤(USP)を服用する場合は、ベンラファキシンHClを含む(ベンラファキシン)を含む他の医薬品を服用しないでください。
ベンラファキシン錠 USP はどのように服用すればよいですか?
- ベンラファキシン錠、USP を処方どおりに服用してください。あなたのヘルスケア提供者は、あなたにとって適切な用量になるまで、ベンラファキシン錠剤、USPの用量を変更する必要があるかもしれません.
- ベンラファキシン錠、USP は食事と一緒に服用してください。
- ベンラファキシン錠 (USP) を飲み忘れた場合は、思い出したらすぐに飲み忘れた分を服用してください。次の服用時間が近い場合は、飲み忘れた分を飛ばして、次の通常の時間に服用してください。同時に 2 回分のベンラファキシン錠 (USP) を服用しないでください。
- ベンラファキシン錠 (USP) を過剰に服用した場合は、すぐに医療提供者または毒物管理センターに連絡するか、緊急治療を受けてください。
- 別の抗うつ薬からベンラファキシン錠に切り替える場合、医師は副作用を避けるために最初の抗うつ薬の用量を最初に減らすことを希望する場合があります
ベンラファキシン錠 USP を服用している間、何を避けるべきですか?
Venlafaxine 錠剤、USP は、眠気を引き起こしたり、意思決定、明確な思考、または迅速な反応に影響を与える可能性があります。
ベンラファキシン錠、USPがあなたにどのように影響するかを知るまで、運転したり、重機を操作したり、その他の危険な活動をしたりしないでください.ベンラファキシン錠(USP)を使用している間はアルコールを飲まないでください。
ベンラファキシン錠、USP の副作用の可能性は何ですか?
ベンラファキシン錠、USP は、次のような重大な副作用を引き起こす可能性があります。
- 「Venlafaxine Tablets USP について知っておくべき最も重要な情報は何ですか?」を参照してください。
- コレステロールの増加 - コレステロールを定期的にチェックしてください
- 母親がベンラファキシン錠(USP)を妊娠第 3 期に服用している新生児は、出生直後に次のような問題を抱えている可能性があります。
- 摂食と呼吸の問題
- 発作
- 震え、神経質、絶え間ない泣き声
- 狭隅角緑内障・瞳孔拡大。
次の場合は定期的に眼圧をチェックしてください。
- 眼圧上昇の病歴がある
- 特定の種類の緑内障のリスクがある
ベンラファキシン錠(USP)を服用している人々に起こりうる一般的な副作用には、次のものがあります。
珍しい夢
- 性的問題
- 食欲不振、便秘、下痢、吐き気または嘔吐、口渇
- 疲れている、疲れている、または過度に眠い
- 睡眠習慣の変化、睡眠障害
- あくび
- 振戦または震え
- めまい、かすみ目
- 発汗
- 不安、神経質、または神経質な感じ
- 頭痛
- 心拍数の増加
気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。
これらは、ベンラファキシン錠剤、USP の考えられるすべての副作用ではありません。
詳細については、医療提供者または薬剤師にお尋ねください。
副作用について医師に相談してください。 1-800-FDA-1088 で副作用を FDA に報告することができます。
ベンラファキシン錠 USP はどのように保管すればよいですか?
- 20° から 25°C (68° から 77°F) で保管 15° から 30°C (59° から 86°F) [ USP制御の室温 ]。
- ベラファキシン錠、USP は乾燥した場所に保管してください。
ベンラファキシン錠、USP、およびすべての医薬品は、子供の手の届かないところに保管してください。
venlafaxine 錠剤に関する一般情報、USP 医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態には、USP のベンラファキシン錠を使用しないでください。同じ状態であっても、ベンラファキシン錠 USP を他の人に与えないでください。それらに害を及ぼす可能性があります。
この医薬品ガイドは、ベンラファキシン錠、USP に関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療従事者向けに書かれた USP であるベンラファキシン錠に関する情報については、医療提供者または薬剤師にお尋ねください。
疑わしい有害反応を報告するには、Sun Pharmaceutical Industries, Inc. (1-800-818-4555) に連絡してください。
Venlafaxine Tablets、USPの成分は何ですか?
有効成分:(ベンラファキシン)
不活性成分:
- 錠剤:微結晶性セルロース、乳糖一水和物、α化デンプン、デンプングリコール酸ナトリウム、赤色酸化鉄、黄色酸化鉄、コロイド状二酸化ケイ素、ステアリン酸マグネシウム
この投薬ガイドは、すべての抗うつ薬について米国食品医薬品局によって承認されています。
適応症
大鬱病性障害
Effexor XR (塩酸ベンラファキシン) 徐放性カプセルは、大うつ病性障害 (MDD) の治療に適応されます。有効性は、3 つの短期 (4、8、および 12 週間) および 2 つの長期維持試験で確立されました。
全般性不安障害
Effexor XR は、全般性不安障害 (GAD) の治療に適応されます。有効性は、2 つの 8 週間および 2 つの 26 週間のプラセボ対照試験で確立されました。
社交不安障害
Effexor XR は、対人恐怖症としても知られる社交不安障害 (SAD) の治療に適応されます。有効性は、4 つの 12 週間および 1 つの 26 週間のプラセボ対照試験で確立されました。
パニック障害
Effexor XR は、広場恐怖症の有無にかかわらず、パニック障害 (PD) の治療に適応されます。有効性は、2 つの 12 週間のプラセボ対照試験で確立されました。
投薬と管理
Effexor 37.5mg XR は、毎日ほぼ同じ時間に、朝または夕方に食事と一緒に単回投与する必要があります [ 臨床薬理学 ]。各カプセルは液体で丸ごと飲み込み、分割したり、つぶしたり、噛んだり、水に入れたりしないでください。または、カプセルを慎重に開けて、内容物全体をスプーン一杯のアップルソースにまぶして投与することもできます。この薬物と食物の混合物は、噛まずにすぐに飲み込み、ペレット (スフェロイド) を完全に飲み込むためにコップ 1 杯の水を飲みます。
大鬱病性障害
ほとんどの患者にとって、Effexor 37.5mg XR の推奨開始用量は、1 日あたり 75mg であり、単回投与されます。一部の患者では、1 日 37.5 mg から開始して 4 ~ 7 日間、新しい患者が 1 日 75 mg に増量する前に薬に順応できるようにすることが望ましい場合があります。最初の 1 日あたり 75 mg の用量に反応しない患者は、1 日あたり最大 225 mg まで用量を増やすことで効果が得られる可能性があります。用量の増加は、必要に応じて 1 日あたり最大 75 mg の増分で行う必要があり、ベンラファキシンとその主要な代謝物の定常状態の血漿レベルが 4 日目までにほとんどの患者で達成されるため、4 日以上の間隔で行う必要があります。 [見る 臨床薬理学 ]。有効性が確認された臨床試験では、2 週間以上の間隔で漸増が許可されました。
中等度のうつ病の外来患者の最大推奨用量は Effexor (即効性) の 1 日あたり 225 mg ですが、その製品の開発プログラムの 1 つの研究では、より重度のうつ病の入院患者は平均 350 の用量で反応したことに注意してください。 mg/日 (1 日あたり 150 ~ 375 mg の範囲)。より重度のうつ病患者に高用量の Effexor 37.5mg XR が必要かどうかは不明です。ただし、1 日あたり 225 mg を超える Effexor 75 mg XR の使用経験は非常に限られています。
全般性不安障害
ほとんどの患者にとって、Effexor XR の推奨開始用量は 1 日 75 mg で、単回投与されます。一部の患者では、1 日 37.5 mg から開始して 4 ~ 7 日間、新しい患者が 1 日 75 mg に増量する前に薬に順応できるようにすることが望ましい場合があります。最初の 1 日あたり 75 mg の用量に反応しない患者は、1 日あたり最大 225 mg まで用量を増やすことで効果が得られる可能性があります。用量の増加は、必要に応じて 1 日あたり最大 75 mg の増分で行う必要があり、ベンラファキシンとその主要な代謝物の定常状態の血漿レベルが 4 日目までにほとんどの患者で達成されるため、4 日以上の間隔で行う必要があります。 [見る 臨床薬理学 ]。
社交不安障害(社会恐怖症)
推奨用量は 1 日 75 mg で、1 回の投与で投与されます。高用量が追加の利益をもたらすという証拠はありませんでした。
パニック障害
推奨される開始用量は、1 日あたり 37.5 mg の Effexor 75 mg XR を 7 日間服用することです。 1 日あたり 75 mg に反応しない患者は、1 日あたり最大約 225 mg まで用量を増やすことで効果が得られる可能性があります。用量の増加は、必要に応じて 1 日あたり 75 mg まで増量する必要があり、7 日以上の間隔で行う必要があります。
Effexor 37.5mg 錠から患者を切り替える
現在 Effexor (即時放出) による治療用量で治療されているうつ病患者は、最も近い等価用量 (mg/日) で Effexor 37.5mg XR に切り替えることができます。 1日1回。ただし、個々の投与量の調整が必要な場合があります。
特定の集団
肝障害のある患者
軽度 (Child-Pugh=5-6) から中等度 (Child-Pugh=7-9) の肝臓障害のある患者では、1 日総投与量を 50% 減らす必要があります。重度の肝機能障害 (Child-Pugh=10-15) または肝硬変の患者では、用量を 50% 以上減らす必要がある場合があります [ 特定の集団での使用 ]。
腎障害のある患者
軽度 (CLcr= 60-89 mL/min) または中等度 (CLcr= 30-59 mL/min) の腎障害のある患者では、1 日総投与量を 25% から 50% 減らす必要があります。血液透析を受けている患者または重度の腎障害(CLcr 特定の集団での使用 ]。
維持治療
MDD、GAD、SAD、またはPDの患者がEffexor 75mg XRでどのくらいの期間治療されるべきかを示す対照研究から入手できる証拠はありません.
MDD の急性エピソードには、急性エピソードへの反応を超えて、数か月以上の持続的な薬理学的治療が必要であることが一般的に認められています。 Effexor XR/Effexor は、最初の治療中に患者が反応したのと同じ用量で、最大 52 週間の臨床研究で反応の継続が実証されています [参照 臨床研究 ]。維持治療に必要な Effexor XR の投与量が、初期反応を達成するために必要な投与量と同じかどうかは不明です。患者は定期的に再評価され、維持治療の必要性とそのような治療の適切な用量を決定する必要があります。
GAD および SAD の患者では、Effexor 37.5mg XR が 6 か月の臨床試験で有効であることが示されています。 Effexor XR 治療で改善した GAD および SAD 患者の投薬継続の必要性は、定期的に再評価する必要があります。
PD の臨床研究では、治療の最初の 12 週間で反応したのと同じ用量で Effexor 75mg XR を継続した患者は、プラセボに無作為化された患者よりも統計的に有意に長い再発時間を経験しました [ 臨床研究 ]。 Effexor XR 治療で改善した PD 患者の投薬継続の必要性は、定期的に再評価する必要があります。
エフェクサーXRの販売中止
Effexor 37.5mg XR による治療を中止する場合は、急激に中止するのではなく、用量を徐々に減らすことが推奨されます。 Effexor 37.5mg XR を用いた臨床研究では、1 週間間隔で 1 日用量を 75mg 減らすことで漸減が達成されました。テーパリングの個別化が必要な場合があります[参照 警告と注意事項 ]。一部の患者では、数か月にわたって中止する必要がある場合があります。
精神障害の治療を目的としたモノアミンオキシダーゼ阻害剤(MAOI)への患者の切り替え
MAOI (精神障害の治療を目的とする) の中止と Effexor XR による治療の開始の間には、少なくとも 14 日間が必要です。さらに、精神障害の治療を目的とした MAOI を開始する前に、Effexor XR を中止してから少なくとも 7 日間の猶予を与える必要があります。 禁忌 、 警告と注意事項 、 と 薬物相互作用 ]。
Effexor XR とリネゾリドや静脈内メチレン ブルーなどの他の MAOI との併用
セロトニン症候群のリスクが高いため、リネゾリドまたは静脈内メチレンブルーで治療されている患者にEffexor 75mg XRを開始しないでください.精神疾患のより緊急の治療が必要な患者では、入院を含む他の介入を考慮する必要があります[参照 禁忌 ]。
場合によっては、すでに Effexor 37.5mg XR 療法を受けている患者は、リネゾリドまたは静脈内メチレン ブルーによる緊急治療が必要になる場合があります。リネゾリドまたはメチレンブルーの静脈内投与の許容可能な代替品が利用できず、リネゾリドまたはメチレンブルーの静脈内投与の潜在的な利点が特定の患者のセロトニン症候群のリスクを上回ると判断された場合は、Effexor XR を直ちに中止し、リネゾリドまたはメチレンブルーの静脈内投与を中止する必要があります。投与することができます。リネゾリドまたは静脈内メチレンブルーの最終投与後 7 日間または 24 時間までのいずれか早い方で、セロトニン症候群の症状がないか患者を監視します。 Effexor 75mg XR による治療は、リネゾリドまたは静脈内メチレン ブルーの最後の投与から 24 時間後に再開できます [ 警告と注意事項 ]。
非静脈経路 (経口錠剤や局所注射など) または 1 mg/kg よりはるかに低い静脈内投与でメチレン ブルーを Effexor XR と同時に投与するリスクは不明です。それにもかかわらず、臨床医は、そのような使用でセロトニン症候群の緊急症状が現れる可能性に注意する必要があります。 警告と注意事項 ]。
供給方法
剤形と強度
Effexor 37.5mg XR® (ベンラファキシン塩酸塩) 持続放出カプセルは、次の強度で利用できます。
- 37.5mgカプセル(グレーキャップ/ピーチボディ、キャップに「W」「エフェクサー75mg XR」、ボディに「37.5」)
- 75mgカプセル(キャップに「W」と「エフェクサー37.5mg XR」、ボディに「75」のピーチキャップとボディ)
- 150mgカプセル(キャップに「W」と「エフェクサー75mg XR」、ボディに「150」の濃いオレンジ色のキャップとボディ)
保管と取り扱い
Effexor XR® (ベンラファキシン塩酸塩) 持続放出カプセル 次のように使用できます。
NDC 0008-0837-20、使用単位パッケージの 15 カプセルのボトル。 NDC 0008-0837-21、使用単位パッケージの 30 カプセルのボトル。 NDC 0008-0837-22、使用単位パッケージの 90 カプセルのボトル。 NDC 0008-0837-03、それぞれ 10 カプセルの Redipak® ブリスター ストリップ 10 個のカートン。
NDC 0008-0833-20、使用単位パッケージの 15 カプセルのボトル。 NDC 0008-0833-21、使用単位パッケージの 30 カプセルのボトル。 NDC 0008-0833-22、使用単位パッケージの 90 カプセルのボトル。 NDC 0008-0833-03、それぞれ 10 カプセルの Redipak® ブリスター ストリップ 10 個のカートン。
NDC 0008-0836-20、使用単位パッケージの 15 カプセルのボトル。 NDC 0008-0836-21、使用単位パッケージの 30 カプセルのボトル。 NDC 0008-0836-22、使用単位パッケージの 90 カプセルのボトル。 NDC 0008-0836-03、それぞれ 10 カプセルの Redipak® ブリスター ストリップ 10 個のカートン。
- 37.5mg 、グレーキャップ/ピーチボディ、キャップに「W」と「Effexor XR」、ボディに「37.5」。
- 75mg 、ピーチ キャップとボディには、キャップに「W」と「エフェクサー 37.5mg XR」、ボディに「75」が付いています。
- 150mg 、ダークオレンジのキャップとボディには、キャップに「W」と「Effexor XR」、ボディに「150」があります。
制御された室温、20°~25°C (68°~77°F) で保管してください。
使用単位パッケージは、単位として分配されることを意図しています。
販売元: Wyeth Pharmaceuticals LLC, Pfizer Inc, Philadelpi, PA 19101 の子会社。改訂: 2021 年 11 月
副作用
以下の副作用については、ラベルの他のセクションで詳しく説明しています。
- 過敏症 [参照 禁忌 ]
- 小児、青年、および成人における自殺念慮および自殺行動 [参照 警告と注意事項 ]
- セロトニン症候群 [参照 警告と注意事項 ]
- 血圧の上昇 [参照 警告と注意事項 ]
- 異常出血 [参照 警告と注意事項 ]
- 閉塞隅角緑内障 [参照 警告と注意事項 ]
- 躁病/軽躁病の活性化 [参照] 警告と注意事項 ]
- 中断症候群 [参照 警告と注意事項 ]
- 発作[を参照してください 警告と注意事項 ]
- 低ナトリウム血症 [参照 警告と注意事項 ]
- 小児患者の体重と身長の変化 [参照 警告と注意事項 ]
- 小児患者の食欲の変化 [参照 警告と注意事項 ]
- 間質性肺疾患および好酸球性肺炎 [参照 警告と注意事項 ]
- 性機能障害 [参照 警告と注意事項 ]
臨床研究経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
最も一般的な有害反応
MDD、GAD、SAD、および PD の Effexor XR 治療を受けた患者の臨床研究データベースで最も一般的に観察された副作用 (発生率 5% 以上、プラセボの少なくとも 2 倍) は、吐き気 (30.0%)、傾眠 (15.3%) でした。 %)、口渇(14.8%)、発汗(11.4%)、異常射精(9.9%)、食欲不振(9.8%)、便秘(9.3%)、インポテンツ(5.3%)、性欲減退(5.1%).
治療中止の理由として報告された副作用
すべての適応症に対する短期のプラセボ対照の市販前研究を組み合わせると、Effexor XR (37.5-225 mg) を投与された 3,558 人の患者の 12% が有害な経験のために治療を中止したのに対し、2,197 人のプラセボ投与された患者では 4% でした。それらの研究で。短期間の研究 (最大 12 週間) で Effexor XR 治療を受けた患者の 1% 以上が中止に至った最も一般的な副作用を、適応症全体で表 7 に示します。
プラセボ対照研究における一般的な有害反応
承認された各適応症について、市販前評価中に Effexor XR の複数回投与を受けた患者の数を表 8 に示します。すべての開発プログラムにおけるベンラファキシンへの曝露の条件と期間は大きく異なり、(重複するカテゴリに)オープンおよびダブル盲検研究、非対照および対照研究、入院 (Effexor のみ) および外来研究、固定用量、および滴定研究。
Effexor XR 治療患者における一般的な副作用 (Effexor XR 治療患者の 2% 以上 [MDD 患者 357 人、GAD 患者 1,381 人、SAD 患者 819 人、PD 患者 1,001 人] で発生し、プラセボよりも頻繁に発生したもの) の発生率期間、プラセボ対照、固定用量および可変用量の臨床試験 (1 日あたり 37.5 ~ 225 mg の用量) を表 9 に示します。
有害反応プロファイルは、異なる患者集団間で実質的に異ならなかった.
臨床研究で観察されたその他の有害反応
ボディ全体: 光線過敏症、悪寒
心臓血管系: 体位性低血圧、失神、低血圧、頻脈
消化器系: 消化管出血[参照 警告と注意事項 ]、
歯ぎしりヘミック/リンパ系: 斑状出血 [参照 警告と注意事項 ]
代謝/栄養: 高コレステロール血症、体重増加 [参照 警告と注意事項 ]、減量[参照 警告と注意事項 ]
神経系: 発作 [参照 警告と注意事項 ]、躁反応[参照 警告と注意事項 ]、激越、混乱、アカシジア、幻覚、筋緊張亢進、ミオクローヌス、離人症、無関心
皮膚と付属物: 蕁麻疹、かゆみ、かぶれ、脱毛症
特別な感覚: 散瞳、調節異常、耳鳴り、味覚異常
泌尿生殖器系: 尿閉、排尿障害、尿失禁、頻尿、出血の増加または不規則な出血の増加を伴う月経障害(例、月経過多、子宮出血)
バイタルサインの変化
プラセボ対照の市販前研究では、平均血圧の上昇が見られました (表 10 を参照)。ほとんどの適応症で、エフェクサー 37.5mg XRs で治療された患者では、仰臥位の平均収縮期および拡張期血圧の用量に関連した増加が明らかでした。 MDD、GAD、SAD、および PD のすべての臨床研究で、Effexor XR 群の患者の 1.4% が 15 mm Hg 以上の SDBP の上昇と血圧 105 mm Hg 以上の増加を経験しました。プラセボ群。同様に、Effexor 37.5mg XR 群の患者の 1% は、プラセボ群の患者の 0.3% と比較して、血圧 ≥ 180 mmHg で ≥ 20 mmHg の SSBP の増加を経験しました。
Effexor 37.5mg XR 治療は、持続性高血圧と関連していた (治療に伴う仰臥位拡張期血圧 [SDBP] ≥ 90 mmHg および 3 回連続の治療中の通院でベースラインより ≥ 10 mm Hg 高いものとして定義される (表 11 を参照)。の患者が臨床研究で 1 日あたり 300 mg を超える Effexor XR の平均用量を投与され、これらのより高い用量での持続的な血圧上昇の発生率を完全に評価しました。
Effexor 37.5mg XR は、市販前のプラセボ対照試験において、プラセボと比較して脈拍数の平均増加と関連していました (表 12 を参照) [ 警告と注意事項 ]。
実験室の変更
血清コレステロール
Effexor XRは、市販前のMDD、GAD、SADおよびPD臨床試験において、プラセボの平均最終減少と比較して、血清コレステロール濃度の平均最終増加と関連していた(表13)。
Effexor 75mg XR (ベンラファキシン塩酸塩) 徐放性カプセルによる大うつ病性障害の市販前プラセボ対照試験での最大 12 週間の治療は、治療中の平均最終血清コレステロール濃度の約 1.5 mg/dL の増加と関連していました。プラセボの平均最終減少量は 7.4 mg/dL でした。市販前のプラセボ対照 GAD 試験における最大 8 週間および最大 6 か月の Effexor XR 治療は、プラセボ被験者が経験したのに対し、それぞれ約 1.0 mg/dL および 2.3 mg/dL の血清コレステロール濃度の平均最終治療増加と関連していたそれぞれ 4.9 mg/dL と 7.7 mg/dL の最終的な減少を意味します。市販前のプラセボ対照社交不安障害試験において、最大 12 週間および最大 6 か月の Effexor XR 治療は、血清コレステロール濃度の平均最終治療増加と比較して、それぞれ約 7.9 mg/dL および 5.6 mg/dL と関連していました。プラセボの平均最終減少量はそれぞれ 2.9 mg/dL と 4.2 mg/dL でした。市販前のプラセボ対照パニック障害試験における最大 12 週間の Effexor XR 治療は、プラセボの 3.7 mg/dL の平均最終低下と比較して、約 5.8 mg/dL の治療中の血清コレステロール濃度の平均最終上昇と関連していました。
プラセボ対照の 12 か月延長試験で少なくとも 3 か月間 Effexor (即時放出) で治療された患者は、プラセボ群では 7.1 mg/dL の減少と比較して、9.1 mg/dL の総コレステロールの平均最終治療増加を示しました。治療を受けた患者。この増加は、研究期間にわたって期間に依存し、より高い用量でより大きくなる傾向があった. -臨床的に関連する血清コレステロールの増加として定義されます。ベースラインからの 50 mg/dL から ≥261 mg/dL までの値は、ベンラファキシン治療患者の 5.3%、プラセボ治療患者の 0.0% で記録されました。
血清トリグリセリド
Effexor 75mg XR は、最大 12 週間 (プールされたデータ) および 6 か月の期間 (プールされたデータ) の SAD および PD の市販前臨床研究において、プラセボと比較して、空腹時血清トリグリセリドの平均最終治療増加と関連していました (表 14)。
小児患者
一般に、ベンラファキシン(プラセボ対照臨床試験)の小児および青年(6~17 歳)の有害反応プロファイルは、成人に見られるものと同様でした。成人と同様に、食欲減退、体重減少、血圧上昇、血清コレステロール上昇が観察された[参照 警告と注意事項 と 特定の集団での使用 ]。
小児科の臨床研究では、副作用である自殺念慮が観察されました。
特に小児患者では、腹痛、激越、消化不良、斑状出血、鼻出血、筋肉痛などの副作用が見られました。
承認後の使用中に確認された有害反応
Effexor XRの承認後の使用中に、次の副作用が確認されました。これらの反応は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
ボディ全体: アナフィラキシー、血管性浮腫
心臓血管系: QT延長、心室細動、心室頻拍(トルサード・ド・ポアントを含む)、たこつぼ型心筋症
消化器系: 膵炎
血液/リンパ系: 粘膜出血[参照 警告と注意事項 ]、血液疾患(無顆粒球症、再生不良性貧血、好中球減少症および汎血球減少症を含む)、出血時間の延長、血小板減少症
代謝/栄養: 低ナトリウム血症 [参照 警告と注意事項 ]、不適切な抗利尿ホルモン(SIADH)分泌症候群[参照 警告と注意事項 】、肝機能検査異常、肝炎、プロラクチン上昇
筋骨格: 横紋筋融解症
神経系: 神経弛緩性悪性症候群(NMS)[参照 警告と注意事項 ]、セロトニン作動性症候群[参照 警告と注意事項 ]、せん妄、錐体外路反応(ジストニアおよびジスキネジアを含む)、協調およびバランスの障害、遅発性ジスキネジア
呼吸器系: 呼吸困難、間質性肺疾患、肺好酸球増加症[参照 警告と注意事項 ]
皮膚と付属物: スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、多形紅斑
特別な感覚: 閉塞隅角緑内障 [参照 警告と注意事項 ]
薬物相互作用
中枢神経系(CNS)活性薬
ベンラファキシンを他の CNS 活性薬と組み合わせて使用するリスクは、体系的に評価されていません。したがって、Effexor XR を他の CNS 活性薬と併用する場合は注意が必要です。
モノアミンオキシダーゼ阻害剤
最近 MAOI を中止し、Effexor XR (SNRI または SSRI) と同様の薬理学的特性を持つ抗うつ薬を開始した患者、または以前に SNRI または SSRI 治療を中止した患者で副作用が報告されており、そのうちのいくつかは深刻なものでした。 MAOIの開始まで[参照 投薬と管理 、 禁忌 と 警告と注意事項 ]。
セロトニン薬
Effexor XR の作用機序とセロトニン症候群の可能性に基づいて、トリプタン、SSRI、他の SNRI、リネゾリド(可逆的な非選択的 MAOI)、リチウム、トラマドール、またはセントジョーンズワート。 Effexor XR とこれらの薬剤の併用治療が臨床的に正当化される場合、特に治療開始時と用量増加時には、患者を注意深く観察することをお勧めします。 Effexor 75mg XR とトリプトファン サプリメントの併用は推奨されません。 投薬と管理 、 禁忌 、 と 警告と注意事項 ]。
止血を妨げる薬(例、NSAID、アスピリン、ワルファリン)
血小板によるセロトニンの放出は、止血において重要な役割を果たします。セロトニンの再取り込みを妨げる向精神薬の使用は、上部消化管出血の発生と関連しており、NSAID またはアスピリンの同時使用は、この出血のリスクを増強する可能性があります [参照 警告と注意事項 ]。 SSRI と SNRI をワルファリンと併用すると、出血の増加を含む抗凝固効果の変化が報告されています。ワルファリン療法を受けている患者は、Effexor 37.5mg XR の開始時または中止時に注意深く監視する必要があります。
減量剤
フェンテルミンを含む減量剤と組み合わせたベンラファキシン療法の安全性と有効性は確立されていません。 Effexor XR と減量剤の併用は推奨されません。 Effexor XR は、単独での減量や他の製品との併用による減量には適応されていません。
エフェクサー XR に対する他の薬剤の影響
図 1: 相互作用する薬物がベンラファキシンと活性代謝物 O-デスメチルベンラファキシン (ODV) の薬物動態に及ぼす影響。
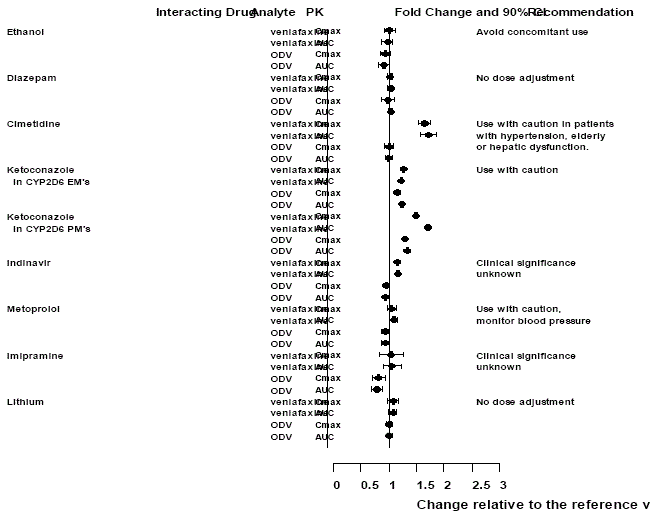
Effexor XR が他の薬剤に及ぼす影響
図 2: 相互作用する薬物とその活性代謝物に対するベンラファキシンの影響。
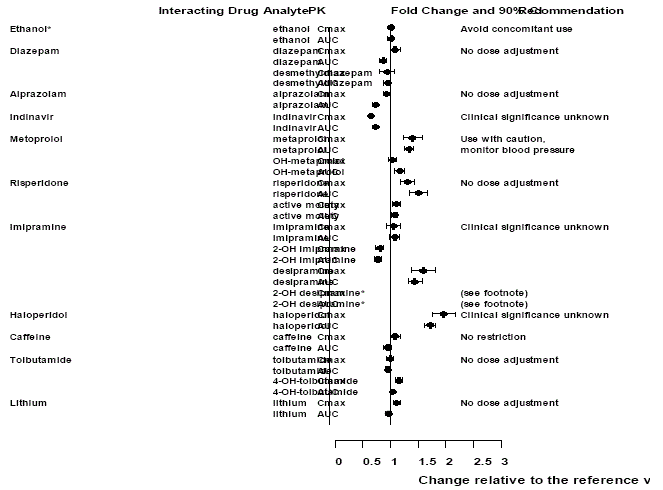
ノート
ベンラファキシンを投与されていない同じ対象者において、安定したレジメンでのベンラファキシンの投与は、エタノールによって誘発された精神運動効果および精神測定効果を誇張しませんでした。
薬物検査の相互作用
フェンシクリジン (PCP) とアンフェタミンの偽陽性の尿イムノアッセイ スクリーニング テストは、venlafaxine を服用している患者で報告されています。これは、スクリーニング検査の特異性の欠如によるものです。ベンラファキシン療法の中止後、数日間は偽陽性の検査結果が予想される場合があります。ガスクロマトグラフィー/質量分析などの確認テストにより、ベンラファキシンと PCP およびアンフェタミンが区別されます。
薬物乱用と依存
規制物質
Effexor 75mg XR は規制物質ではありません。
乱用
ベンラファキシンは乱用の可能性について臨床研究で体系的に研究されていませんが、臨床研究では薬物探索行動の兆候はありませんでした.しかし、市販前の経験に基づいて、中枢神経系活性薬が市販後にどの程度誤用、流用、および/または乱用されるかを予測することは不可能です。したがって、医師は患者の薬物乱用歴を注意深く評価し、そのような患者を綿密に追跡して、ベンラファキシンの誤用または乱用の兆候(例、耐性の発達、用量の増加、薬物探索行動)がないか観察する必要があります。
依存
In vitro 研究では、ベンラファキシンはアヘン剤、ベンゾジアゼピン、フェンシクリジン (PCP)、または N-メチル-D-アスパラギン酸 (NMDA) 受容体に対して実質的に親和性がないことが明らかになりました。
ベンラファキシンは、齧歯動物において有意な CNS 刺激活性を有することが判明していません。霊長類の薬物差別研究では、ベンラファキシンは覚醒剤または抑制剤の乱用傾向を示さなかった.
ベンラファキシンを投与されている患者では、中止効果が報告されている[参照 投薬と管理 ]。
警告
の一部として含まれています "予防" セクション
予防
小児、青年、若年成人の自殺念慮と行動
成人および小児の大うつ病性障害(MDD)の患者は、抗うつ薬を服用しているかどうかにかかわらず、うつ病の悪化および/または自殺念慮および自殺行動(自殺傾向)の出現、または行動の異常な変化を経験する可能性があります。リスクは、有意な寛解が起こるまで持続する可能性があります。自殺は、うつ病やその他の特定の精神障害の既知のリスクであり、これらの障害自体が自殺の最も強力な予測因子です。しかし、抗うつ薬が治療の初期段階で特定の患者のうつ病の悪化と自殺傾向の出現を誘発する役割を果たしている可能性があるという長年の懸念がありました.抗うつ薬 (SSRI など) の短期プラセボ対照試験のプール分析では、これらの薬が MDD を有する小児、青年、若年成人 (18 ~ 24 歳) の自殺念慮および自殺行動 (自殺傾向) のリスクを高めることが示されました。その他の精神障害。短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65 歳以上の成人では、プラセボと比較して抗うつ薬が減少しました。
MDD、強迫性障害(OCD)、またはその他の精神障害を患う小児および青年を対象としたプラセボ対照研究のプール分析には、4,400 人を超える患者を対象とした 9 種類の抗うつ薬の合計 24 の短期研究が含まれていました。 MDD またはその他の精神障害を有する成人を対象としたプラセボ対照研究のプール分析には、77,000 人を超える患者を対象とした 11 種類の抗うつ薬の合計 295 件の短期研究 (期間の中央値は 2 か月) が含まれていました。薬物間で自殺のリスクにかなりのばらつきがありましたが、研究されたほとんどすべての薬物で若い患者が増加する傾向がありました。さまざまな適応症で自殺の絶対リスクに違いがあり、MDD での発生率が最も高かった。ただし、リスクの違い (薬物とプラセボ) は、年齢層内および適応症全体で比較的安定していました。これらのリスクの違い (治療を受けた患者 1,000 人あたりの自殺傾向の症例数における薬物とプラセボの違い) を表 1 に示します。
いずれの小児科研究でも自殺は発生していません。成人の研究では自殺がありましたが、その数は自殺に対する薬物の影響について結論を出すには十分ではありませんでした。
自殺リスクが長期間の使用、つまり数ヶ月を超える使用に及ぶかどうかは不明です。しかし、うつ病の成人におけるプラセボ対照維持研究から、抗うつ薬の使用がうつ病の再発を遅らせることができるという実質的な証拠があります.
適応症を問わず抗うつ薬で治療されているすべての患者は、特に薬物療法のコースの最初の数か月間、または用量変更時に、臨床的悪化、自殺傾向、行動の異常な変化について適切に監視し、注意深く観察する必要があります。または減少します。
次の症状、不安、動揺、パニック発作、不眠症、過敏性、敵意、攻撃性、衝動性、アカシジア (精神運動の落ち着きのなさ)、軽躁病、および躁病が、MDD の抗うつ薬で治療されている成人および小児患者で報告されています。精神科および非精神科の両方の他の適応症について。そのような症状の出現と、うつ病の悪化および/または自殺衝動の出現との間の因果関係は確立されていませんが、そのような症状が自殺傾向の出現の前兆を表している可能性があるという懸念があります.
うつ病が持続的に悪化している患者、またはうつ病や自殺傾向の悪化の前兆である可能性のある緊急の自殺願望または症状を経験している患者では、場合によっては投薬を中止することを含め、治療計画の変更を検討する必要があります。特にこれらの症状が重度で突然の場合発症したか、患者の症状の一部ではありませんでした。
治療を中止する決定が下された場合、可能な限り急速に投薬を減らす必要がありますが、突然の中止は特定の症状に関連する可能性があることを認識してください[ 中断症候群 と 投薬と管理 ]。
MDD またはその他の適応症(精神科および非精神科の両方)で抗うつ薬による治療を受けている患者の家族および介護者は、動揺、過敏性、行動の異常な変化、および上記のその他の症状の出現について患者を監視する必要があることを警告する必要があります。自殺傾向の出現と同様に、そのような症状を医療提供者に直ちに報告すること。このようなモニタリングには、家族や介護者による毎日の観察が含まれる必要があります。 Effexor XR の処方は、過剰摂取のリスクを軽減するために、適切な患者管理と一致する最小量のカプセル用に作成する必要があります。
双極性障害の患者のスクリーニング
大うつ病エピソードは、双極性障害の最初の症状である可能性があります。このようなエピソードを抗うつ薬のみで治療すると、双極性障害のリスクがある患者に混合/躁病エピソードが発生する可能性が高くなる可能性があると一般的に考えられています (対照研究では確立されていません)。上記の症状のいずれかがそのような変換を表しているかどうかは不明です。ただし、抗うつ薬による治療を開始する前に、抑うつ症状のある患者を適切にスクリーニングして、双極性障害のリスクがあるかどうかを判断する必要があります。そのようなスクリーニングには、自殺、双極性障害、うつ病の家族歴など、詳細な精神病歴を含める必要があります。 Effexor XR は、双極性うつ病の治療に使用することは承認されていないことに注意してください。
セロトニン症候群
生命を脅かす可能性のあるセロトニン症候群の発症は、Effexor XR 単独を含むセロトニン-ノルエピネフリン再取り込み阻害薬 (SNRI) および SSRI で報告されていますが、特に他のセロトニン作動薬 (トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミン、およびセントジョンズワート) と、特にセロトニンの代謝を損なう薬、MAOIs (どちらも精神障害の治療を目的としたもの、およびリネゾリドや静脈内メチレンブルーなど) と一緒に使用されます)。
セロトニン症候群の症状には、精神状態の変化(例、激越、幻覚、せん妄、昏睡)、自律神経不安定性(例、頻脈、不安定な血圧、高体温、発汗、潮紅、およびめまい)、神経筋症状(例、振戦、硬直、ミオクローヌス)が含まれる場合があります。 、反射亢進、協調運動障害);発作および胃腸症状(例、吐き気、嘔吐、下痢)。セロトニン症候群の出現について患者を監視する必要があります。
Effexor XR と MAOI (精神障害の治療を目的とする) との併用は禁忌です。 Effexor XR は、リネゾリドや静脈内メチレン ブルーなどの MAOI で治療されている患者にも開始しないでください。投与経路に関する情報を提供するメチレンブルーに関するすべての報告は、1mg/kg~8mg/kgの用量範囲での静脈内投与を含んでいた。他の経路 (経口錠剤や局所組織注射など) または低用量でのメチレン ブルーの投与に関する報告はありません。 Effexor 37.5mg XR を服用している患者では、リネゾリドや静脈内メチレン ブルーなどの MAOI による治療を開始する必要がある場合があります。 Effexor XR は、MAOI による治療を開始する前に中止する必要があります [ 禁忌 、 投薬と管理 、 と 薬物相互作用 ]。
Effexor 37.5mg XR と他のセロトニン作動薬 (例、トリプタン、三環系抗うつ薬、ミルタザピン、フェンタニル、リチウム、トラマドール、ブスピロン、アンフェタミン、トリプトファン、またはセントジョーンズワート) との併用が臨床的に保証される場合は、注意深い観察特に治療の開始時と用量の増加時には、患者の 薬物相互作用 ]。患者は、セロトニン症候群の潜在的なリスクを認識する必要があります。上記の事象が発生した場合は、Effexor XR および併用するセロトニン作動薬による治療を直ちに中止し、支持対症療法を開始する必要があります。
血圧の上昇
対照試験では、収縮期および拡張期血圧の用量依存的な上昇、および持続性高血圧の症例が見られた[参照 有害反応 ]。
Effexor 37.5mg XR による治療を開始する前、および治療中は定期的に血圧を監視してください。 Effexor 75mg XR による治療を開始する前に、既存の高血圧をコントロールしてください。血圧の上昇によって損なわれる可能性のある既存の高血圧症または心血管または脳血管の状態を持つ患者の治療には注意してください。持続的な血圧上昇は、有害な転帰につながる可能性があります。 Effexor XR を使用した場合、直ちに治療が必要な血圧上昇の症例が報告されています。血圧の持続的な上昇を経験している患者には、用量の減量または治療の中止を検討してください。
Effexor 37.5mg を使用したすべての臨床研究で、Effexor XR 投与群の患者の 1.4% が仰臥位拡張期血圧 (SDBP) ≧ 15 mmHg の上昇を経験しましたが、プラセボ群の患者では 0.9% でした。同様に、Effexor 75mg XR 治療群の患者の 1% は、プラセボ群の患者の 0.3% と比較して、仰臥位収縮期血圧 (SSBP) が 180 mm Hg 以上で 20 mm Hg 以上の上昇を経験しました [表 10 を参照]の 有害反応 ]。 Effexor 75mg XR 治療は、持続性高血圧と関連していた (治療により出現した SDBP が 90 mm Hg 以上で、3 回連続して治療を受けているときのベースラインを 10 mm Hg 以上上回っていると定義される [表 11 を参照] 有害反応 ]。臨床研究で 1 日あたり 300 mg を超える Effexor 37.5 mg XR の平均用量を投与された患者の数は不十分であり、これらの高用量での持続的な血圧上昇の発生率を完全に評価することができませんでした。
異常出血
Effexor 37.5mg XR を含む SSRI および SNRI は、斑状出血、血腫、鼻出血、点状出血、消化管出血から生命を脅かす出血に至るまで、出血イベントのリスクを高める可能性があります。アスピリン、非ステロイド系抗炎症薬(NSAID)、ワルファリン、その他の抗凝固薬、または血小板機能に影響を与えることが知られているその他の薬を併用すると、このリスクが高まる可能性があります。症例報告と疫学的研究 (症例対照とコホート デザイン) は、セロトニンの再取り込みを妨げる薬物の使用と消化管出血の発生との関連を示しています。 Effexor 75mg XR と NSAIDs、アスピリン、または凝固に影響を与えるその他の薬剤の併用に伴う出血のリスクについて、患者に注意してください。
閉塞隅角緑内障
Effexor XR を含む多くの抗うつ薬の使用後に発生する瞳孔散大は、特許虹彩切除術を持っていない解剖学的に狭い隅角を持つ患者で隅角閉鎖発作を引き起こす可能性があります。
アクティベーション オブ マニア/ハイポマニア
MDD、SAD、および PD の市販前研究で、Effexor 37.5mg XR 治療患者で躁病または軽躁病が報告されました (表 2 を参照)。躁病/軽躁病は、MDD を治療するために他の市販薬で治療された気分障害患者のごく一部でも報告されています。 Effexor 37.5mg XR は、躁病または軽躁病の病歴のある患者には慎重に使用する必要があります。
中断症候群
中止症状は、GAD の臨床研究の前向き分析や MDD と SAD の研究の後ろ向き調査など、ベンラファキシンを服用している患者で体系的に評価されています。さまざまな用量でのベンラファキシンの突然の中止または減量は、新しい症状の出現と関連していることが判明しており、その頻度は、用量レベルの増加および治療期間の延長に伴い増加しました。報告された症状には、激越、食欲不振、不安、錯乱、協調とバランスの障害、下痢、めまい、口渇、不快気分、束縛、疲労、インフルエンザ様症状、頭痛、軽躁病、不眠症、吐き気、神経過敏、悪夢、感覚障害 (ショックのような電気的感覚を含む)、傾眠、発汗、震え、めまい、嘔吐。
長期にわたる重度の可能性がある深刻な中止症状の市販後の報告があります。中止中を含め、Effexor 75mg XR の減量中の患者では、完全な自殺、自殺念慮、攻撃性、および暴力的な行動が観察されています。市販後の他の報告では、Effexor XR の投与を中止または減量した後の視覚的な変化 (かすみ目や焦点の合わせづらさなど) と血圧の上昇が報告されています。
Effexor XR、他の SNRI、および SSRI のマーケティング中に、これらの薬物の中止時に、特に突然の場合に、過敏性、無気力、情緒不安定、耳鳴り、および発作などの他の有害事象が自発的に報告されています。
Effexor XR による治療を中止する場合は、これらの症状について患者を監視する必要があります。急激な中止ではなく、徐々に減量することをお勧めします。投与量の減少後または治療の中止後に耐え難い症状が発生した場合は、以前に処方された投与量の再開が考慮される場合があります。その後、医療提供者は線量を減らし続けるかもしれませんが、その速度はより緩やかになります。一部の患者では、数か月にわたって中止する必要がある場合があります [参照 投薬と管理 ]。
発作
発作は、ベンラファキシン療法で発生しました。 Effexor 75mg XR は、多くの抗うつ薬と同様に、発作の既往のある患者には慎重に使用し、発作を発症した患者には中止する必要があります。 [リスクを軽減する必要があります: 危険因子、発作閾値を下げる併用薬。]
低ナトリウム血症
低ナトリウム血症は、Effexor 37.5mg XR を含む SSRI および SNRI による治療の結果として発生する可能性があります。多くの場合、低ナトリウム血症は、不適切な抗利尿ホルモン (SIADH) 分泌症候群の結果であると思われます。血清ナトリウムが 110 mmol/L 未満の症例が報告されています。高齢患者は、SSRI および SNRI を使用すると低ナトリウム血症を発症するリスクが高くなる可能性があります [参照 特定の集団での使用 ]。また、利尿薬を服用している患者、またはその他の方法で体液量が枯渇している患者は、より大きなリスクにさらされる可能性があります.症候性低ナトリウム血症の患者では、Effexor 37.5mg XR の中止を検討し、適切な医療介入を開始してください。
低ナトリウム血症の兆候と症状には、頭痛、集中力の低下、記憶障害、錯乱、脱力感、ふらつきなどがあり、転倒につながる可能性があります。より重症および/または急性の症例に関連する徴候および症状には、幻覚、失神、発作、昏睡、呼吸停止、および死亡が含まれます。
小児患者の体重と身長の変化
体重の変化
MDD、GAD、および SAD におけるプラセボ対照小児研究における体重の平均変化および体重減少の発生率 (3.5% 以上を失った患者の割合) を表 3 および 4 に示します。
体重減少は、治療により発症した食欲不振の患者に限られたものではありませんでした[参照 小児患者の食欲の変化 ]。
Effexor 75mg XR の長期使用に伴うリスクは、最大 6 か月間 Effexor XR を投与された小児および青年を対象とした非盲検 MDD 研究で評価されました。研究に参加した子供と青年の体重増加は、年齢と性別が一致した仲間からのデータに基づくと、予想よりも少なかった.観察された体重増加と予想された体重増加の差は、青少年(12 歳以上)よりも子供(12 歳未満)の方が大きかった。
高さの変化
表 5 は、短期間のプラセボ対照 MDD、GAD、および SAD 研究における小児患者の平均身長増加を示しています。 GAD と MDD の研究における身長の伸びの違いは、12 歳未満の患者で最も顕著でした。
6 か月間の非盲検 MDD 研究では、年齢と性別を一致させた仲間のデータに基づくと、子供と青年の身長の伸びは予想を下回っていました。観察された成長率と期待された成長率の差は、青少年 (12 歳以上) よりも子供 (12 歳未満) の方が大きかった。
小児患者の食欲の変化
MDD、GAD、および SAD に対する Effexor XR の市販前評価では、食欲減退 (治療による食欲不振として報告) が、Effexor XR 治療患者とプラセボ治療患者でより一般的に観察されました (表 6 を参照)。
間質性肺疾患と好酸球性肺炎
ベンラファキシン療法に関連する間質性肺疾患および好酸球性肺炎はめったに報告されていません。これらの有害事象の可能性は、進行性の呼吸困難、咳、または胸の不快感を呈するベンラファキシン治療患者で考慮されるべきです.そのような患者は、速やかに医学的評価を受けるべきであり、ベンラファキシン療法の中止を考慮する必要があります。
性機能障害
Effexor XR を含む SNRI の使用は、性機能障害の症状を引き起こす可能性がある [参照 有害反応 ]。男性患者では、SNRI の使用により、射精の遅延または失敗、性欲減退、および勃起不全が生じる可能性があります。女性患者の場合、SNRI の使用により、性欲が低下し、オーガズムが遅延または消失する可能性があります。
処方者は、Effexor 37.5mg XR の開始前に性機能について質問し、治療中の性機能の変化について具体的に質問することが重要です。これは、性機能が自発的に報告されない可能性があるためです。性機能の変化を評価する際には、詳細な病歴(症状の発症時期を含む)を取得することが重要です。なぜなら、性的症状には、根底にある精神障害を含む他の原因がある可能性があるためです。患者が治療について情報に基づいた決定を下すのをサポートするための潜在的な管理戦略について話し合います。
患者相談情報
FDA承認を見る 患者情報 ( 投薬ガイド )。
処方者またはその他の医療専門家は、患者、その家族、および介護者に、Effexor 37.5mg XR による治療に関連する利点とリスクについて知らせ、適切な使用について助言する必要があります。 Effexor 75mg XR には、「抗うつ薬、うつ病およびその他の重篤な精神疾患、および自殺念慮または自殺行動」に関する患者の投薬ガイドが用意されています。処方者または医療専門家は、患者、その家族、および介護者に投薬ガイドを読むように指示し、その内容を理解できるように支援する必要があります。患者には、投薬ガイドの内容について話し合い、質問があれば回答を得る機会を与える必要があります。投薬ガイドの全文は、この文書の最後に転載されています。 Effexor XR の服用中に次の問題が発生した場合は、患者に次の問題について通知し、処方者に警告するよう依頼する必要があります。
自殺念慮と行動
患者、その家族、および介護者に、自殺傾向の出現、うつ病の悪化、およびその他の精神医学的症状 (不安、動揺、パニック発作、不眠症、過敏症、敵意、攻撃性、衝動性、アカシジア、精神運動の落ち着きのなさ、軽躁病、躁病、行動のその他の異常な変化)、特に治療中の初期および用量が上下に調整された場合。このような症状は、患者の処方者または医療専門家に報告する必要があります。特に、症状が深刻である場合、突然発症する場合、または患者の症状の一部ではない場合はそうです。このような症状は、自殺念慮や自殺行動のリスクの増加と関連している可能性があり、非常に綿密な監視が必要であることを示しています [参照 ボックス警告 と 警告と注意事項 ]。
併用薬
Effexor XR を服用している患者には、ベンラファキシンまたはデスベンラファキシンを含む他の製品を併用しないようにアドバイスしてください。医療従事者は、MAOI と一緒に、または MAOI を中止してから 14 日以内に Effexor XR を服用しないよう、また Effexor XR を中止してから 7 日後に MAOI を開始するよう患者に指示する必要があります。 禁忌 ]。
セロトニン症候群
患者は、Effexor 75mg XR とトリプタン、トラマドール、アンフェタミン、トリプトファン サプリメント、抗精神病薬またはその他のドーパミン拮抗薬、またはその他のセロトニン作動薬との併用によるセロトニン症候群のリスクについて注意する必要があります。 警告と注意事項 と 薬物相互作用 ]。
血圧上昇
Effexor XR を服用する際は、血圧を定期的にモニタリングする必要があることを患者にアドバイスします [ 警告と注意事項 ]。
異常出血
Effexor 75mg XR と NSAIDs、アスピリン、ワルファリン、またはセロトニンの再取り込みを妨げる向精神薬との併用は出血のリスク増加と関連しているため、アスピリン、ワルファリン、または凝固に影響を与える他の薬の併用について患者に注意する必要があります。 警告と注意事項 ]。
閉塞隅角緑内障
患者は、Effexor XR を服用すると軽度の瞳孔散大を引き起こす可能性があり、影響を受けやすい個人では、閉塞隅角緑内障のエピソードにつながる可能性があることを説明する必要があります。閉塞隅角緑内障と診断された場合、虹彩切除術で確実に治療できるため、既存の緑内障はほとんどの場合開放隅角緑内障です。開放隅角緑内障は、閉塞隅角緑内障の危険因子ではありません。患者は、隅角閉鎖の影響を受けやすいかどうかを判断するために検査を受け、影響を受けやすい場合は予防処置(例、虹彩切除術)を受けることを希望する場合があります。 警告と注意事項 ]。
アクティベーション オブ マニア/ハイポマニア
躁病/軽躁病の活性化の徴候を観察するように、患者、その家族、および介護者に助言する[参照 警告と注意事項 ]。
循環器・脳血管疾患
心血管、脳血管、または脂質代謝障害のある患者に Effexor XR を投与する際には注意が必要です。 有害反応 ]。
血清コレステロールとトリグリセリドの上昇
総コレステロール、LDL、およびトリグリセリドの上昇が起こる可能性があり、血清脂質の測定を考慮してもよいことを患者に助言する[参照 警告と注意事項 ]。
中断症候群
医療専門家に最初に相談せずに Effexor 75mg XR の服用を中止しないように患者に助言してください。患者は、Effexor XR を中止すると中止の影響が生じる可能性があることに注意する必要があります [参照 警告と注意事項 と 有害反応 ]。
性機能障害
Effexor XR の使用は、男性と女性の両方の患者に性機能障害の症状を引き起こす可能性があることを患者に助言してください。性機能の変化と潜在的な管理戦略について医療提供者と話し合う必要があることを患者に伝えます[ 警告と注意事項 ]。
認知機能および運動機能への干渉
Effexor 37.5mg XR 療法がそのような活動に従事する能力に悪影響を与えないことが合理的に確信できるまで、自動車を含む危険な機械の操作について患者に注意してください。
アルコール
Effexor 37.5mg XR を服用している間はアルコールを避けるように患者に助言する [ 薬物相互作用 ]。
アレルギー反応
発疹、蕁麻疹、腫れ、呼吸困難などのアレルギー現象が発生した場合は、医師に通知するよう患者にアドバイスしてください。
妊娠
治療中に妊娠した場合、または妊娠する予定がある場合は、医師に通知するよう患者に助言する[参照 特定の集団での使用 ]。
看護
乳児に授乳している場合は、医師に通知するよう患者に助言する [参照 特定の集団での使用 ]。
残留スフェロイド
Effexor XR にはスフェロイドが含まれており、消化管にゆっくりと薬物を放出します。これらのスフェロイドの不溶性部分は除去され、患者はスフェロイドが便中または人工肛門を介して通過することに気付く場合があります。患者がスフェロイドを見るまでに、有効な薬剤がすでに吸収されていることを患者に知らせる必要があります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
腫瘍は、マウスまたはラットのベンラファキシン治療によって増加しませんでした。ベンラファキシンは、1 日あたり最大 120 mg/kg の用量で 18 か月間、マウスに強制経口投与されました。これは、mg/m2 に基づく最大推奨用量の 1.7 倍でした。ベンラファキシンは、1 日あたり最大 120 mg/kg の用量で 24 か月間、強制経口投与によってラットにも投与されました。 120 mg/kg の用量を投与されたラットでは、剖検時のベンラファキシンの血漿濃度は、ヒトの最大推奨用量を投与された患者の血漿濃度の 1 倍 (雄ラット) および 6 倍 (雌ラット) でした。 O-デスメチル代謝物 (ODV) の血漿レベルは、最大推奨用量を投与された患者よりもラットの方が低かった。ベンラファキシンの主要なヒト代謝物である O-デスメチルベンラファキシン (ODV) をマウスおよびラットに 2 年間強制経口投与しても、いずれの研究でも腫瘍の発生率は増加しませんでした。マウスは 500/300 mg/kg/日までの用量で ODV を投与されました (投与の 45 週間後に用量を下げました)。 300 mg/kg/日の用量での曝露は、ヒトの用量である 225 mg/日の曝露の 9 倍です。ラットは 300 mg/kg/日 (オス) または 500 mg/kg/日 (メス) までの用量で ODV を投与されました。最高用量での暴露量は、人間の用量である 225 mg/日の約 8 (男性) または 11 (女性) 倍です。
突然変異誘発
ベンラファキシンおよび主要なヒト代謝物である ODV は、サルモネラ菌における Ames 復帰突然変異アッセイまたはチャイニーズハムスター卵巣/HGPRT 哺乳動物細胞前方遺伝子突然変異アッセイにおいて、変異原性を示さなかった。ベンラファキシンは、in vitro BALB/c-3T3 マウス細胞形質転換試験、培養チャイニーズハムスター卵巣細胞での姉妹染色分体交換試験、またはラット骨髄での in vivo 染色体異常試験でも、変異原性または染色体異常誘発性を示さなかった。 ODV は、in vitro チャイニーズハムスター卵巣細胞染色体異常試験またはラットの in vivo 染色体異常試験で染色体異常誘発性を示さなかった。
生殖能力の障害
ラットにおけるベンラファキシンの生殖および受胎能の研究では、mg/m2 ベースで 225 mg/日の最大推奨ヒト用量の 2 倍までの経口用量で、雄または雌の受精能に対するベンラファキシンの悪影響は示されませんでした。しかし、オスとメスのラットが、交尾および妊娠の前と最中に、ベンラファキシンの主要なヒト代謝産物であるO-デスメチルベンラファキシン(ODV)で処理された研究では、生殖能力の低下が観察されました.これは、225 mg/日のヒト ベンラファキシン用量に関連する ODV 曝露 (AUC) の約 2 ~ 3 倍で発生しました。
特定の集団での使用
妊娠
催奇形性効果
妊娠カテゴリーC
ベンラファキシンは、mg/m2 ベースでヒトの最大推奨 1 日用量の最大 2.5 倍 (ラット) または 4 倍 (ウサギ) の用量を与えられたラットまたはウサギの子孫に奇形を引き起こしませんでした。しかし、ラットでは、妊娠中に投与を開始して離乳まで継続した授乳期の最初の 5 日間に、仔の体重の減少、死産の仔の増加、および仔の死亡数の増加が見られました。これらの死因はわかっていません。これらの影響は、人間の 1 日最大用量の 2.5 倍 (mg/m2) で発生しました。ラットの仔の死亡率に対する影響のない用量は、mg/m2 ベースでヒト用量の 0.25 倍であった。ベンラファキシンの主要なヒト代謝物である O-デスメチルベンラファキシン (ODV) を用いたラットとウサギの生殖発達研究では、ラットで 13、ウサギで 0.3 の曝露マージンで催奇形性の証拠は観察されなかった。妊娠中の女性を対象とした、十分に管理された研究はありません。 Effexor XR は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用する必要があります。動物の繁殖研究は常に人間の反応を予測できるわけではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
非催奇形効果
妊娠第 3 期後半に Effexor 37.5mg XR、他の SNRI、または SSRI にさらされた新生児は、長期の入院、呼吸補助、および経管栄養を必要とする合併症を発症しました。このような合併症は、出産直後に発生する可能性があります。報告された臨床所見には、呼吸困難、チアノーゼ、無呼吸、発作、体温の不安定性、摂食困難、嘔吐、低血糖、筋緊張低下、筋緊張亢進、反射亢進、振戦、神経質、過敏症、絶え間ない泣き声が含まれます。これらの特徴は、SSRI と SNRI の直接的な毒性効果、またはおそらく薬物中止症候群のいずれかと一致しています。場合によっては、臨床像がセロトニン症候群と一致することに注意する必要があります。 警告と注意事項 と 薬物相互作用 ]。妊娠第 3 期に妊娠中の女性を Effexor XR で治療する場合、医師は治療の潜在的なリスクと利点を慎重に検討する必要があります。
労働と配達
ヒトの陣痛および分娩に対するベンラファキシンの影響は不明です。
授乳中の母親
ベンラファキシンと ODV は母乳中に排泄されることが報告されています。 Effexor XR による授乳中の乳児に深刻な副作用が生じる可能性があるため、母親にとっての薬剤の重要性を考慮して、授乳を中止するか薬剤を中止するかを決定する必要があります。
小児用
MDD の小児患者 766 人を対象とした 2 つのプラセボ対照試験と、GAD の小児患者 793 人を対象とした 2 つのプラセボ対照試験が Effexor XR で実施されましたが、データは小児患者への使用を主張するのに十分ではありませんでした。
小児または青年に Effexor XR の使用を検討している人は誰でも、潜在的なリスクと臨床上の必要性とのバランスを取らなければなりません [参照 ボックス警告 、 警告と注意事項 と 有害反応 ]。
エフェクサー 37.5mg XR が子供と青年の成長、発達、成熟に及ぼす影響を主に評価するために設計された研究はありませんが、実施された研究は、エフェクサー XR が体重と身長に悪影響を与える可能性があることを示唆しています [参照 警告と注意事項 ]。小児患者を Effexor XR で治療することを決定した場合、特に治療を長期間継続する場合は、治療中に体重と身長を定期的にモニタリングすることをお勧めします。 警告と注意事項 ]。小児患者に対する Effexor 75mg XR 治療の安全性は、期間が 6 か月を超える慢性治療について体系的に評価されていません。小児患者 (6 ~ 17 歳) で実施された研究では、小児患者で臨床的に関連すると考えられる血圧とコレステロールの増加の発生は、成人患者で観察されたものと同様でした。したがって、成人に対する注意事項は小児患者にも適用されます [参照 警告と注意事項 ]。
高齢者の使用
Effexor 37.5mg XR の MDD、GAD、SAD、および PD の臨床試験における 65 歳以上の患者の割合を表 15 に示します。
高齢患者と若年患者の間で有効性または安全性に全体的な違いは観察されず、他の報告された臨床経験では、一般的に高齢患者と若年患者の間の反応の違いは確認されていません。ただし、一部の高齢者の感度が高いことは否定できません。 Effexor XR を含む SSRI および SNRI は、高齢患者における臨床的に重大な低ナトリウム血症の症例と関連しており、この有害事象のリスクが高い可能性があります [参照 警告と注意事項 ]。
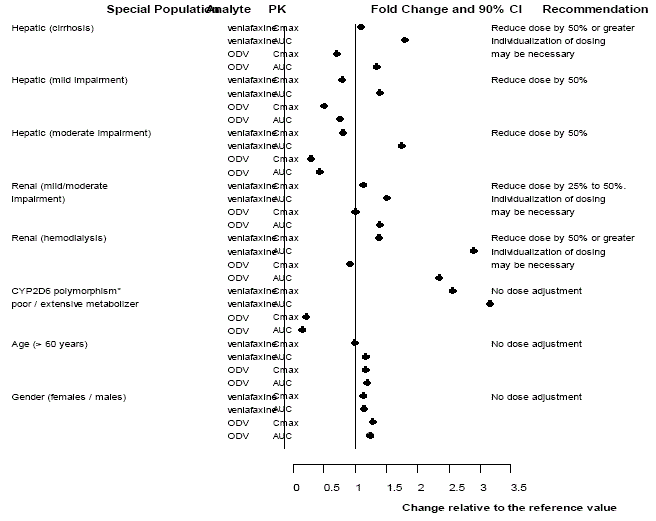
ベンラファキシンと ODV の薬物動態は、高齢者では実質的に変化していません [ 臨床薬理学 ] (図 3 を参照)。年齢だけに基づいて高齢者に用量調整を推奨することはできませんが、腎臓や肝臓の機能障害など、高齢者によく見られる他の臨床状況では、用量を減らす必要があるかもしれません [参照] 投薬と管理 ]。
年齢と性別
日 2 回と 1 日 3 回の両方のレジメンを含む 2 つの研究から得られた 404 人の Effexor 治療を受けた患者の母集団薬物動態分析では、ベンラファキシンまたは ODV のいずれかの用量で正規化されたトラフ血漿レベルが、年齢または性差によって変化しないことが示されました。患者の年齢または性別に基づく用量調整は、一般に必要ありません [参照 投薬と管理 (表 15 を参照)。
患者サブグループでの使用
図 3: 特別な集団におけるベンラファキシンとその代謝物 O-デスメチルベンラファキシン (ODV) の薬物動態。
過剰摂取
人間の経験
Effexor 75mg XR (MDD、GAD、SAD、および PD 用) および Effexor (MDD 用) の市販前評価中に、Effexor による急性過剰摂取の報告が 20 件ありました (Effexor XR および Effexor 75mg 患者でそれぞれ 6 件および 14 件の報告)。 、単独で、または他の薬物および/またはアルコールと組み合わせて。
傾眠は、最も一般的に報告された症状でした。他の報告された症状の中には、過量摂取から 5 日後に、四肢すべての感覚異常、中等度のめまい、吐き気、手足のしびれ、熱冷感があった.ほとんどの場合、過剰摂取に関連する徴候や症状はありませんでした。報告の大部分は、摂取されたベンラファキシンの総用量が通常の治療用量よりも数倍高くないと推定される摂取を含んでいた. 2.75 g のベンラファキシンを摂取した 1 人の患者は、ベースラインでの 405 ミリ秒と比較して、2 つの全身性けいれんと 500 ミリ秒への QTc の延長が観察されました。軽度の洞性頻脈は、他の 2 人の患者で報告されました。
過剰摂取を治療するために取られた行動には、治療なし、入院と対症療法、入院と活性炭による治療が含まれていました.すべての患者が回復しました。
市販後の経験では、ベンラファキシンの過剰摂取は、主にアルコールおよび/または他の薬物との組み合わせで発生しています.過剰摂取で最も一般的に報告されている事象には、頻脈、意識レベルの変化 (傾眠から昏睡までの範囲)、散瞳、発作、および嘔吐が含まれます。
心電図の変化(例、QT 間隔の延長、脚ブロック、QRS 延長)、心室頻拍、徐脈、低血圧、横紋筋融解症、めまい、肝壊死、セロトニン症候群、および死亡が報告されています。
発表されたレトロスペクティブ研究では、ベンラファキシンの過剰摂取は、SSRI 抗うつ薬製品で観察されたものと比較して、致命的な転帰のリスクの増加と関連している可能性があるが、三環系抗うつ薬よりも低いことが報告されています。疫学的研究は、ベンラファキシン治療を受けた患者は、SSRI 治療を受けた患者よりも自殺危険因子の既存の負荷が高いことを示しています。ベンラファキシン治療患者のいくつかの特徴とは対照的に、致死的転帰のリスク増加の所見が過剰摂取におけるベンラファキシンの毒性に起因する可能性がある程度は明らかではありません. Effexor 75mg XR の処方は、過剰摂取のリスクを軽減するために、適切な患者管理と一致する最小量のカプセル用に作成する必要があります。
過剰摂取の管理
最新のガイダンスとアドバイスについては、認定毒物管理センターに相談してください (1-800-222-1222 または www.poison.org)。過剰摂取の場合は、綿密な医学的監督と監視を含む支持療法を提供してください。治療は、薬物の過剰摂取の管理に採用されている一般的な手段で構成する必要があります。複数の薬物の過剰摂取の可能性を考慮してください。適切な気道、酸素化、および換気を確保します。心臓のリズムとバイタル サインを監視します。支持的および対症療法を提供します。
禁忌
過敏症
-塩酸ベンラファキシン、コハク酸デスベンラファキシンまたは製剤中の賦形剤に対する過敏症
モノアミンオキシダーゼ阻害剤(MAOI)との併用
Effexor 75mg XR と併用して、または Effexor XR による治療を中止してから 7 日以内に MAOI (精神障害の治療を目的とする) を使用することは、セロトニン症候群のリスクが高まるため禁忌です。 MAOI (精神障害の治療を目的とする) による治療を中止してから 14 日以内に Effexor 37.5mg XR を使用することも禁忌です [ 投薬と管理 、 警告と注意事項 、 と 薬物相互作用 ]。
セロトニン症候群のリスクが高まるため、リネゾリドや静脈内メチレンブルーなどのMAOIで治療されている患者にEffexor XRを開始することも禁忌です[ 投薬と管理 、 警告と注意事項 、 と 薬物相互作用 ]。
臨床薬理学
作用機序
ヒトにおけるベンラファキシンの抗うつ作用の正確なメカニズムは不明ですが、中枢神経系におけるセロトニンとノルエピネフリンの再取り込みの阻害による増強に関連していると考えられています。非臨床試験では、ベンラファキシンとその活性代謝物である ODV が、ニューロンのセロトニンとノルエピネフリンの再取り込みの強力かつ選択的な阻害剤であり、ドーパミンの再取り込みの弱い阻害剤であることが実証されています。
薬力学
ベンラファキシンと ODV は、インビトロでムスカリン-コリン作動性受容体、H1-ヒスタミン作動性受容体、または α1 アドレナリン作動性受容体に対して有意な親和性を示しません。これらの受容体での薬理学的活性は、他の向精神薬で見られるさまざまな抗コリン作用、鎮静作用、および心血管作用に関連していると仮定されています。ベンラファキシンと ODV は、モノアミンオキシダーゼ (MAO) 阻害活性を持ちません。
心臓電気生理学
QT 間隔に対するベンラファキシンの効果は、54 人の健康な成人被験者を対象に、無作為化、二重盲検、プラセボおよび陽性対照の 3 期間クロスオーバーによる QT 研究で評価されました。ベンラファキシン 450 mg の有意な QT 延長効果は検出されませんでした。
薬物動態
血漿中のベンラファキシンおよびODVの定常状態濃度は、経口反復投与療法の3日以内に達成される。 Venlafaxine と ODV は、1 日あたり 75 ~ 450 mg の用量範囲で直線的な動態を示しました。ベンラファキシンおよび ODV の平均±SD 定常状態血漿クリアランスは、それぞれ 1.3±0.6 および 0.4±0.2 L/h/kg です。みかけの消失半減期は、それぞれ 5±2 時間および 11±2 時間です。分布の見かけの (定常状態) 体積は、それぞれ 7.5±3.7 および 5.7±1.8 L/kg です。ベンラファキシンと ODV は、治療濃度で血漿タンパク質に最小限しか結合しません (それぞれ 27% と 30%)。
吸収と分配
ベンラファキシンはよく吸収され、肝臓で広範囲に代謝されます。 ODV は主要な活性代謝物です。物質収支研究に基づいて、ベンラファキシンの単回経口投与の少なくとも 92% が吸収されます。ベンラファキシンの絶対バイオアベイラビリティは約 45% です。
Effexor 37.5mg XR (150 mg 1 日 1 回) の投与は、一般に、1 日 2 回投与された Effexor (即時放出) よりも低い Cmax 値と遅い Tmax 値をもたらしました (表 16)。ベンラファキシンの 1 日当りの用量を即時放出錠剤または徐放性カプセルのいずれかで投与した場合、ベンラファキシンと ODV の両方への曝露は 2 つの治療で類似しており、血漿濃度の変動は Effexor 37.5mg の方がわずかに低かったXRカプセル。したがって、Effexor XR は吸収速度が遅くなりますが、即時放出錠剤と比較して吸収の程度は同じです。
食品は、ベンラファキシンまたはその活性代謝物である ODV の生物学的利用能に影響を与えませんでした。投与時間 (AM 対 PM) は、75 mg Effexor 75 mg XR カプセルからのベンラファキシンおよび ODV の薬物動態に影響しませんでした。
ベンラファキシンは、血漿タンパク質と強く結合していません。したがって、タンパク質結合性の高い別の薬を服用している患者に Effexor 37.5mg XR を投与しても、他の薬の遊離濃度が上昇することはありません。
代謝と排泄
吸収後、ベンラファキシンは、主に ODV へ、また N-デスメチルベンラファキシン、N,O-ジデスメチルベンラファキシン、およびその他の微量代謝物へと、肝臓で広範な全身前代謝を受けます。 in vitro 研究は、ODV の形成が CYP2D6 によって触媒されることを示しています。これは、CYP2D6レベルが低い(代謝が悪い)患者は、CYP2D6レベルが正常な(代謝が高い)患者と比較して、ベンラファキシンのレベルが高く、ODVのレベルが低いことを示す臨床研究で確認されています[ 特定の集団での使用 ]。
ベンラファキシン投与量の約 87% は、未変化のベンラファキシン (5%)、非抱合型 ODV (29%)、抱合型 ODV (26%)、またはその他のマイナーな不活性代謝物 (27%) として 48 時間以内に尿中に回収されます。したがって、ベンラファキシンとその代謝産物の腎排泄が主要な排泄経路です。
臨床研究
大鬱病性障害
大うつ病性障害 (MDD) の治療薬としての Effexor 75mg XR (塩酸ベンラファキシン) 徐放性カプセルの有効性は、2 つのプラセボ対照の短期 (試験 1 で 8 週間、試験 2 で 12 週間)、柔軟な試験で確立されました。 - MDD の DSM-III-R または DSM-IV 基準を満たす成人の外来患者を対象に、1 日あたり 75 mg から 225 mg までの用量での用量研究。中等度のうつ病の外来患者では、ベンラファキシンの初回投与量は 1 日 75 mg でした。両方の研究で、Effexor XR は、HAM-D-21 合計スコアのベースラインからエンドポイント訪問までの変化として定義される一次有効性測定値でプラセボよりも優れていることを示しました。また、Effexor XR は主要な二次有効性エンドポイントである臨床グローバル インプレッション (CGI) 病気の重症度スケール。調査対象集団の性別サブセットの調査では、性別に基づく反応性の違いは明らかになりませんでした。
Effexor 37.5 mg を 1 日 150 ~ 375 mg の範囲で (1 日 3 回のスケジュールで分割) 使用したメランコリーを伴う MDD の DSM-III-R 基準を満たす入院患者の 4 週間の研究では、 HAM-D-21 合計スコアに基づくプラセボ。完了者の平均用量は 1 日あたり 350 mg でした (研究 3)。
長期研究では、Effexor 37.5 mg XR (75、150、または 225 mg、1 日 1 回、毎朝) に関する 8 週間の非盲検試験で反応した MDD の成人外来患者が、同じ Effexor の継続に無作為に割り付けられました。 XR線量またはプラセボに対して、最大26週間の再発の観察。非盲検段階での反応は、56 日目の評価で CGI Severity of Illness 項目スコアが 3 以下、HAM-D-21 合計スコアが 10 以下であると定義されました。二重盲検段階での再発は次のように定義されました: (1) DSM-IV 基準で定義された大うつ病性障害の再発、および CGI の病気の重症度項目スコアが 4 以上 (中等度の病気)、(2) 2 回の連続した CGI -4以上の病気の重症度項目スコア、または(3)何らかの理由で研究を中止した患者の最終的なCGIの病気の重症度項目スコアが4以上。 Effexor 37.5mg XR 治療を継続した患者は、プラセボを投与した患者と比較して、その後 26 週間にわたって統計的に有意に低い再発率を経験しました (研究 4)。
回目の長期試験では、再発型 MDD の成人外来患者で、反応があり(56 日目の評価で HAM-D21 合計スコアが 12 以下)、改善が続いた [56 日目から 180 日目までに以下の基準が満たされていると定義される] : (1) HAM-D-21の合計スコア≧20; (2) HAM39 D-21 合計スコア > 10 が 2 つ以下、および (3) Effexor での最初の 26 週間の治療中 [100 ~ 200 mg あたり 100 ~ 200 mg日、1 日 2 回のスケジュールで] は、同じ Effexor 用量の継続またはプラセボに無作為に割り付けられました。患者の再発を観察するフォローアップ期間は、CGI の病気の重症度項目スコアが 4 以上であると定義され、最大 52 週間でした。 Effexor 治療を継続した患者は、プラセボを投与した患者と比較して、その後 52 週間にわたって統計的に有意に低い再発率を経験しました (研究 5)。
全般性不安障害
全般性不安障害 (GAD) の治療薬としての Effexor XR の有効性は、2 つの 8 週間、プラセボ対照、固定用量試験 (1 日あたり 75 ~ 225 mg)、1 つの 6 か月間、プラセボ対照、柔軟な試験で確立されました。 - GAD の DSM-IV 基準を満たす成人の外来患者を対象とした 6 か月間のプラセボ対照固定用量試験 (1 日あたり 37.5、75、および 150 mg)。
ある 8 週間の研究では、ハミルトン不安評価尺度 (HAM-A) の合計スコア、HAM-A の不安と緊張の両方によって測定される 1 日あたり 75、150、および 225 mg の用量で、Effexor XR がプラセボよりも優れていることが示されました。アイテム、Clinical Global Impressions (CGI) スケール。ただし、1 日あたり 75 および 150 mg の用量は、最高用量ほど一貫して効果的ではありませんでした (研究 1)。 1 日あたり 75 および 150 mg の用量とプラセボを評価する 2 番目の 8 週間の研究では、これらの同じ結果のいくつかにおいて、両方の用量がプラセボよりも効果的であることが示されました。ただし、1 日あたり 75 mg の用量は、1 日あたり 150 mg の用量よりも一貫して効果的でした (研究 2)。 GAD における有効性の用量反応関係は、研究された 1 日あたり 75 ~ 225 mg の用量範囲では明確に確立されませんでした。
つの 6 か月間の研究、1 日あたり 37.5、75、および 150 mg の Effexor 75mg XR 用量を評価するもの (研究 3) と、1 日あたり 75 ~ 225 mg の Effexor XR 用量を評価するもの (研究 4) は、 75 mg 以上は、HAM-A 全体、HAM-A の不安項目と緊張項目の両方、および 6 か月の治療中の CGI スケールにおいて、プラセボよりも効果的でした。 1 日 37.5 mg の用量でプラセボよりも優れているという証拠もありましたが、この用量はより高い用量ほど一貫して効果的ではありませんでした.
調査対象集団の性別サブセットの調査では、性別に基づく反応性の違いは明らかになりませんでした。
社交不安障害(社会恐怖症とも呼ばれます)
社交不安障害 (SAD) の治療薬としての Effexor 37.5mg XR の有効性は、4 つの二重盲検、並行群、12 週間、多施設、プラセボ対照、可変用量試験 (試験 1 ~ 4) で確立されました。 SAD の DSM-IV 基準を満たす成人外来患者を対象に、1 日あたり 75 ~ 225 mg の範囲の用量を含む、二重盲検、並行群、6 か月間、プラセボ対照、固定/可変用量試験 (試験 5 )。
これらの 5 つの研究では、Effexor 75mg XR は、Liebowitz Social Anxiety Scale (LSAS) 合計スコアのベースラインからエンドポイントまでの変化において、プラセボよりも統計的に有意に効果的でした。 6ヶ月の研究では、1日あたり75mgのグループと比較して、1日あたり150〜225mgのグループの有効性が高いという証拠はありませんでした.
研究された集団のサブセットの検査では、性別に基づく反応性の違いは明らかになりませんでした。これらの研究の結果に対する年齢または人種の影響を判断するには、情報が不十分でした。
パニック障害
パニック障害 (PD) の治療薬としての Effexor XR の有効性は、広場恐怖症の有無にかかわらず、PD の DSM-IV 基準を満たす成人外来患者を対象とした 2 つの二重盲検 12 週間多施設プラセボ対照試験で確立されました。患者は、1 つの研究 (研究 1) で 1 日あたり 75 または 150 mg、別の研究 (研究 2) で 1 日あたり 75 または 225 mg の固定用量を受け取りました。
有効性は、3 つの変数の結果に基づいて評価されました。 (2)パニック障害重症度スケール(PDSS)の合計スコアのベースラインからエンドポイントまでの平均変化。 (3)Clinical Global Impressions(CGI)改善スケールでレスポンダー(大幅に改善または非常に改善)と評価された患者の割合。これらの 2 つの研究では、Effexor XR は 3 つのエンドポイントすべてにおいてプラセボよりも (固定用量ごとに) 統計的に有意に効果的でしたが、用量反応関係は明確に確立されていませんでした。
研究された集団のサブセットの検査では、性別に基づく反応性の違いは明らかになりませんでした。これらの研究の結果に対する年齢または人種の影響を判断するには、情報が不十分でした。
長期研究 (研究 3) では、PD の DSM-IV 基準を満たす成人の外来患者で、12 週間のオープンフェーズ中に Effexor 75mg XR (1 日あたり 75 ~ 225 mg) で反応した患者が、同じ Effexor 75mg を継続するように無作為に割り当てられました。 XR用量(75、150、または225 mg)またはプラセボに切り替えて、二重盲検条件下での再発の観察。オープン フェーズ中の反応は、オープン フェーズの最後の 2 週間に 1 週間に 1 回以下の全症状のパニック発作があり、CGI 改善スコアが 1 (非常に改善) または 2 (非常に改善) であると定義されました。二重盲検段階での再発は、週に 2 回以上の完全な症状のパニック発作が 2 週間連続して発生するか、研究中に研究者によって決定された効果の喪失のために中止されたことと定義されました。無作為化された患者は、無作為化される前の平均 34 日間、反応状態にありました。 12 週間の非盲検期間に続く無作為化フェーズでは、Effexor 75mg XR を継続して投与された患者は、再発までの時間が統計的に有意に長くなりました。
小児患者
MDD の小児患者 766 人を対象とした 2 つのプラセボ対照研究と、GAD を患う 793 人の小児患者を対象とした 2 つのプラセボ対照研究が Effexor XR で実施されましたが、データは小児患者への使用を主張するのに十分ではありませんでした。
Effexor とは何ですか? また、どのように使用されますか?
Effexor は、うつ病、全般性不安障害、社会不安障害、パニック障害の症状を治療するために使用される処方薬です。 Effexor は、単独で使用することも、他の薬と併用することもできます。
Effexor は、抗うつ薬、選択的セロトニンおよびノルエピネフリン再取り込み阻害薬 (SNRI) と呼ばれる種類の薬に属しています。
Effexor 37.5mg の副作用の可能性は何ですか?
Effexor は、次のような重大な副作用を引き起こす可能性があります。
- ぼやけた視界、
- 視野狭窄、
- 目の痛みや腫れ、
- ハローの丸い光を見て、
- あざや出血しやすい(鼻血、歯ぐきの出血)、
- 尿や便に血が混じる、
- 喀血、
- 咳、
- 胸の圧迫感、
- 呼吸困難、
- 痙攣(発作)、
- 頭痛、
- 錯乱、
- ろれつが回らない、
- 重度の衰弱、
- 嘔吐、
- 調整の喪失、
- 気持ちが不安定になり、
- 非常に硬い(硬い)筋肉、
- 高熱、
- 発汗、
- 錯乱、
- 速いまたは不均一な心拍、
- 振戦、および
- 立ちくらみ
- 上記の症状がある場合は、すぐに医療機関を受診してください。
- Effexor の最も一般的な副作用は次のとおりです。
- めまい、
- 眠気、
- 不安、
- 緊張感、
- 睡眠障害(不眠症)、
- 視界の変化、
- 吐き気、
- 嘔吐、
- 下痢、
- 体重や食欲の変化、
- 口渇、
- あくび、
- 発汗の増加、
- 性欲減退、
- インポテンツ、
- 異常射精、そして
- オーガズムを持つのが難しい
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Effexor の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
自殺傾向と抗うつ薬
大うつ病性障害(MDD)およびその他の精神疾患の短期研究において、抗うつ薬は、プラセボと比較して、小児、青年、および若年成人の自殺願望および自殺行動(自殺傾向)のリスクを増加させました。ベンラファキシン錠剤、USP、またはその他の抗うつ薬を子供、青年、または若年成人に使用することを検討している人は誰でも、このリスクと臨床上の必要性とのバランスを取る必要があります.短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65歳以上の成人では、プラセボと比較して抗うつ薬のリスクが低下しました.うつ病やその他の特定の精神障害は、それ自体が自殺のリスクの増加と関連しています。抗うつ薬治療を開始したすべての年齢の患者は、臨床的悪化、自殺傾向、または行動の異常な変化について適切に監視し、注意深く観察する必要があります。家族や介護者は、処方者との綿密な観察とコミュニケーションの必要性を知らされるべきです。ベンラファキシン錠、USP は、小児患者への使用は承認されていません。 (見る 警告 : 臨床的悪化と自殺リスク 、 患者情報 、 と 予防 : 小児用 )。
説明
ベンラファキシン錠 USP は、経口投与用の構造的に新規な抗うつ薬です。 (R/S)-1-[2-(ジメチルアミノ)-1-(4-メトキシフェニル)エチル]シクロヘキサノール塩酸塩または(±)-1-[α-[(ジメチルアミノ)メチル]-p-メトキシベンジル]シクロヘキサノール塩酸塩であり、実験式はC17H27NO2 HClである。その分子量は 313.87 です。構造式を以下に示します。
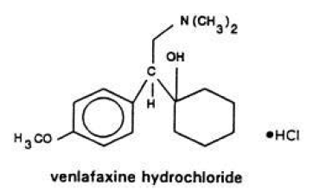
ベンラファキシン塩酸塩は、白色からオフホワイトの結晶性固体で、水への溶解度は 572 mg/mL です (塩化ナトリウムでイオン強度を 0.2 M に調整)。そのオクタノール:水 (0.2 M 塩化ナトリウム) 分配係数は 0.43 です。
圧縮錠剤には、塩酸ベンラファキシン、25 mg、37.5 mg、50 mg、75 mg、または 100 mg のベンラファキシン塩基に相当する USP と、次の不活性成分が含まれています。黄色酸化鉄、コロイド状二酸化ケイ素、ステアリン酸マグネシウム。
