Lexapro 10mg, 20mg, 5mg Escitalopram 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
レクサプロとは?
レクサプロは、大うつ病性障害および全般性不安障害の症状を治療するために使用される処方薬です。レクサプロは、単独で使用することも、他の薬と併用することもできます。
- Lexapro は、抗うつ薬、SSRI と呼ばれる種類の薬に属しています。
- レクサプロ 10mg が 12 歳未満の子供に安全で有効であるかどうかはわかっていません。
レクサプロの副作用は?
レクサプロは、次のような重大な副作用を引き起こす可能性があります。
- 腹痛、
- 不正出血、
- 異常な夢、
- アレルギー、
- ぼやけた視界、
- 視野狭窄、
- 胸痛、
- 集中力の低下、
- 止血、
- 目の痛みや腫れ、
- ライトの周りにハローが見える
- レーシング思考、
- 異常なリスクを取る行動、
- 極度の幸福感や悲しみ、
- 頭痛、
- 胸焼け、
- ほてり、
- 錯乱、
- ろれつが回らない、
- 重度の衰弱、
- 嘔吐、
- 調整の喪失、
- 気持ちが不安定になり、
- 非常に硬い(硬い)筋肉、
- 高熱、
- 発汗、
- 錯乱、
- 速いまたは不均一な心拍、
- 振戦、および
- 立ちくらみ
上記の症状がある場合は、すぐに医療機関を受診してください。
レクサプロの最も一般的な副作用は次のとおりです。
- めまい、
- 眠気、
- 弱点、
- 発汗、
- ふらついたり、不安になったり、
- 睡眠障害(不眠症)、
- 口渇、
- 食欲減少、
- 吐き気、
- 便秘、
- あくび、
- 体重の変化、
- 性欲減退、
- インポテンス、および
- オーガズムを持つのが難しい
警告
自殺傾向と抗うつ薬
抗うつ薬は、大うつ病性障害(MDD)およびその他の精神障害の短期研究において、小児、青年、および若年成人の自殺念慮および自殺行動(自殺傾向)のリスクをプラセボと比較して増加させました。レクサプロまたはその他の抗うつ薬を子供、青年、または若年成人に使用することを検討している人は、このリスクと臨床上の必要性とのバランスを取る必要があります。短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65歳以上の成人では、プラセボと比較して抗うつ薬のリスクが低下しました.うつ病やその他の特定の精神障害は、それ自体が自殺のリスクの増加と関連しています。抗うつ薬治療を開始したすべての年齢の患者は、臨床的悪化、自殺傾向、または行動の異常な変化について適切に監視し、注意深く観察する必要があります。家族や介護者は、処方者との綿密な観察とコミュニケーションの必要性を知らされるべきです。 Lexapro 5mg は、12 歳未満の小児患者への使用は承認されていません。 [見る 警告と注意事項 臨床的悪化と自殺リスク, 患者情報 、 と 特定の集団での使用 : 小児用]。
説明
Lexapro® (シュウ酸エスシタロプラム) は、経口投与される選択的セロトニン再取り込み阻害剤 (SSRI) です。エスシタロプラムは、ラセミ二環式フタラン誘導体シタロプラムの純粋なセナンチオマー (単一異性体) です。エスシタロプラム シュウ酸塩は、S-(+)-1-[3(ジメチル-アミノ)プロピル]-1-(p-フルオロフェニル)-5-フタランカルボニトリル シュウ酸塩と呼ばれ、次の構造式を持ちます。
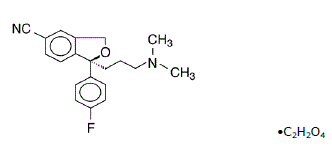
分子式は C20H21FN2O • C2H2O4 で、分子量は 414.40 です。
シュウ酸エスシタロプラムは、微細な白色からわずかに黄色の粉末として発生し、メタノールおよびジメチルスルホキシド (DMSO) に溶けやすく、等張食塩水に溶けやすく、水とエタノールに溶けにくく、酢酸エチルに溶けにくく、ヘプタンに溶けません。
レクサプロ(シュウ酸エスシタロプラム)は、錠剤または経口溶液として入手できます。
Lexapro 錠剤は、5 mg、10 mg、および 20 mg のエスシタロプラム塩基に相当する強度のシュウ酸エスシタロプラムを含むフィルムコーティングされた丸い錠剤です。 10 mg および 20 mg の錠剤にスコアが付けられます。錠剤には、次の不活性成分も含まれています: タルク、クロスカルメロース ナトリウム、微結晶性セルロース/コロイド状二酸化ケイ素、およびステアリン酸マグネシウム。フィルムコーティングには、ヒプロメロース、二酸化チタン、およびポリエチレングリコールが含まれています。
Lexapro 5mg 経口溶液には、1 mg/mL エスシタロプラム塩基に相当するシュウ酸エスシタロプラムが含まれています。また、次の不活性成分も含まれています: ソルビトール、精製水、クエン酸、クエン酸ナトリウム、リンゴ酸、グリセリン、プロピレングリコール、メチルパラベン、プロピルパラベン、天然ペパーミントフレーバー。
適応症
大鬱病性障害
レクサプロ(エスシタロプラム)は、成人および 12 歳から 17 歳の青年における大うつ病性障害の急性および維持治療に適応されます [参照 臨床研究 ]。
大うつ病エピソード (DSM-IV) は、顕著な、比較的持続的な (少なくとも 2 週間、ほぼ毎日) 抑うつ気分または不快気分を意味し、通常は日常生活に支障をきたし、次の 9 つの症状のうち少なくとも 5 つを含みます。通常の活動への関心の喪失、体重および/または食欲の著しい変化、不眠症または過眠症、精神運動の興奮または遅滞、疲労の増加、罪悪感または無価値感、思考の鈍化または集中力の低下、自殺未遂または自殺念慮。
全般性不安障害
レクサプロ 20mg は、成人の全般性不安障害 (GAD) の急性期治療に適応されています [参照 臨床研究 ]。
全般性不安障害 (DSM-IV) は、少なくとも 6 か月間持続する過度の不安と心配 (不安な期待) を特徴とし、それを制御することは困難です。次の症状のうち少なくとも 3 つに関連している必要があります: 落ち着きのなさ、緊張感、緊張感、疲れやすい、集中困難または頭が真っ白になる、過敏症、筋肉の緊張、睡眠障害。
投薬と管理
レクサプロ 5mg は、1 日 1 回、朝または夕方に、食事の有無にかかわらず投与する必要があります。
大鬱病性障害
初期治療
青少年
レクサプロの推奨用量は、1日1回10mgです。レクサプロの可変用量試験 (10 ~ 20 mg/日) では、レクサプロの有効性が実証されました [参照 臨床研究 ]。用量が 20 mg に増量された場合、これは最低 3 週間後に発生するはずです。
大人
レクサプロ 10mg の推奨用量は、1 日 1 回 10mg です。レクサプロの固定用量試験では、レクサプロ 5mg の 10 mg と 20 mg の両方の有効性が示されましたが、10 mg よりも 20 mg の方が優れた効果があることは示されませんでした [参照 臨床研究 ]。用量を 20 mg に増量する場合は、最低 1 週間後に行う必要があります。
維持治療
大うつ病性障害の急性エピソードには、急性エピソードへの反応を超えて、数か月以上の持続的な薬物療法が必要であることが一般的に認められています。 8週間の急性期治療期間中にレクサプロを服用中に反応した大うつ病性障害の成人患者におけるレクサプロ10mg/日または20mg/日の継続の体系的評価は、そのような維持治療の利点を実証した[参照 臨床研究 ]。それにもかかわらず、Lexapro 5mg を長期間使用することを選択した医師は、個々の患者に対する薬剤の長期的な有用性を定期的に再評価する必要があります。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります。
全般性不安障害
初期治療
大人
レクサプロの推奨開始用量は、1 日 1 回 10 mg です。用量を 20 mg に増量する場合は、最低 1 週間後に行う必要があります。
維持治療
全般性不安障害は慢性疾患として認識されています。 8 週間を超えた GAD の治療におけるレクサプロの有効性は、体系的に研究されていません。レクサプロを長期間使用することを選択した医師は、個々の患者に対する薬物の長期的な有用性を定期的に再評価する必要があります。
レクサプロ開始前の双極性障害のスクリーニング
Lexapro または他の抗うつ薬による治療を開始する前に、双極性障害、躁病、または軽躁病の個人的な家族歴について患者をスクリーニングします [参照 警告と注意事項 ]。
特別な集団
10 mg/日は、ほとんどの高齢患者および肝障害のある患者に推奨される用量です。
軽度または中等度の腎障害のある患者では、用量調整は必要ありません。レクサプロは、重度の腎障害のある患者には注意して使用する必要があります。
レクサプロによる治療の中止
Lexapro 5mg およびその他の SSRI および SNRI の中止に伴う症状が報告されています [ 警告と注意事項 ]。治療を中止するときは、これらの症状について患者を監視する必要があります。可能な限り、急激な中止ではなく、徐々に用量を減らすことをお勧めします。投与量の減少後または治療の中止後に耐え難い症状が発生した場合は、以前に処方された投与量の再開が考慮される場合があります。その後、医師は用量を減らし続けますが、より緩やかな速度で行います。
精神障害の治療を目的としたモノアミンオキシダーゼ阻害剤(MAOI)への患者の切り替え
精神障害の治療を目的とした MAOI の中止と Lexapro による治療の開始の間には、少なくとも 14 日が経過する必要があります。逆に、レクサプロ 20mg を中止した後、精神障害の治療を目的とした MAOI を開始する前に、少なくとも 14 日間の猶予を与える必要があります。 禁忌 ]。
リネゾリドやメチレン ブルーなどの他の MAOI と一緒にレクサプロを使用する
セロトニン症候群のリスクが高いため、リネゾリドまたは静脈内メチレンブルーで治療されている患者にレクサプロ5mgを開始しないでください.精神疾患のより緊急の治療が必要な患者では、入院を含む他の介入を考慮する必要があります[参照 禁忌 ]。
場合によっては、すでにレクサプロ 10mg 療法を受けている患者は、リネゾリドまたは静脈内メチレンブルーによる緊急治療が必要になる場合があります。リネゾリドまたはメチレンブルーの静脈内投与に代わる許容可能な治療法が利用できず、リネゾリドまたはメチレンブルーの静脈内投与の潜在的な利点が特定の患者のセロトニン症候群のリスクを上回ると判断された場合、レクサプロは直ちに中止し、リネゾリドまたはメチレンブルーの静脈内投与を中止する必要があります。投与することができます。患者は、セロトニン症候群の症状について、リネゾリドまたは静脈内メチレンブルーの最後の投与から 2 週間または 24 時間後までのいずれか早い方で監視する必要があります。レクサプロによる治療は、リネゾリドまたは静脈内メチレンブルーの最後の投与から 24 時間後に再開することができます [参照 警告と注意事項 ]。
非静脈経路 (経口錠剤や局所注射など) によるメチレン ブルーの投与、または Lexapro 10 mg で 1 mg/kg よりはるかに低い静脈内投与のリスクは不明です。それにもかかわらず、臨床医は、そのような使用でセロトニン症候群の緊急症状が現れる可能性に注意する必要があります。 警告と注意事項 ]。
供給方法
剤形と強度
錠剤
Lexapro 10mg 錠剤は、5mg、10mg、および 20mg のエスシタロプラム塩基に相当する強度のシュウ酸エスシタロプラムを含む、フィルムコーティングされた丸い錠剤です。 10 mg および 20 mg の錠剤にスコアが付けられます。片面に「FL」、もう片面にそれぞれの強さに応じて「5」「10」「20」のいずれかが刻印されています。
内服液
レクサプロ内用液には、エスシタロプラム基剤 1 mg/mL 相当のシュウ酸エスシタロプラムが含まれています(現在は販売されていません)。
保管と取り扱い
錠剤
5mg錠
100本入 - NDC # 0456-2005-01
白からオフホワイト、丸みを帯びた、無傷、フィルムコーティング。タブレットの片面に「FL」、反対面に「5」と刻印します。
10mg錠
100本入 - NDC 0456-2010-01 10 x 10 単位用量 - NDC # 0456-2010-63
白からオフホワイト、丸みを帯びた、スコアリングされた、フィルムコーティングされた。スコア面に左側に「F」、右側に「L」の刻印。得点のない面に「10」の刻印。
20mg錠
100本入 - NDC 0456-2020-01 10×10 単位用量 - NDC # 0456-2020-63
白からオフホワイト、丸みを帯びた、スコアリングされた、フィルムコーティングされた。スコア面に左側に「F」、右側に「L」の刻印。得点のない面に「20」の刻印。
内服液
5mg/5mL、ペパーミント味(240mL) - NDC # 0456-2101-08。経口液剤は現在販売されていません。
保管と取り扱い
20°C から 25°C (68°F から 77°F) で保管してください。 15 から 30°C (59° から 86°F) まで許容されるエクスカーション。
配布元: Allergan USA, Inc. Madison, NJ 07940. 改訂: 2021 年 9 月
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
臨床試験データソース
小児科(6~17歳)
有害事象は、二重盲検プラセボ対照試験において大うつ病性障害の小児患者 576 人 (286 人がレクサプロ 5mg、290 人がプラセボ) で収集されました。 12歳未満の小児患者におけるレクサプロ5mgの安全性と有効性は確立されていません。
大人
レクサプロ 5mg の有害事象情報は、エスシタロプラムにさらされた大うつ病性障害患者 715 人と、二重盲検プラセボ対照試験でプラセボにさらされた 592 人の患者から収集されました。大うつ病性障害の追加の 284 人の患者が、非盲検試験で新たにエスシタロプラムにさらされました。 GAD 患者におけるレクサプロの有害事象情報は、二重盲検プラセボ対照試験でエスシタロプラムに暴露された 429 人の患者とプラセボに暴露された 427 人の患者から収集されました。
曝露中の有害事象は、主に一般的な調査によって得られ、臨床研究者が独自に選択した用語を使用して記録されました。したがって、最初に同様のタイプのイベントをより少数の標準化されたイベントカテゴリにグループ化することなく、有害イベントを経験している個人の割合の有意義な推定値を提供することはできません.以下の表と表では、報告された有害事象を分類するために、標準的な世界保健機関 (WHO) の用語が使用されています。
記載されている有害反応の頻度は、記載されている種類の治療緊急有害事象を少なくとも 1 回経験した個人の割合を表しています。イベントが初めて発生した場合、またはベースライン評価後の治療中に悪化した場合、イベントは治療に起因すると見なされました。
治療中止に伴う有害事象
大鬱病性障害
小児科(6~17歳)
有害事象は、Lexapro を投与された 286 人の患者の 3.5%、およびプラセボを投与された 290 人の患者の 1% の中止に関連していました。中止に関連する最も一般的な有害事象(レクサプロ 10mg で少なくとも 1%、プラセボより多い発生率)は不眠症(レクサプロ 1%、プラセボ 0%)でした。
大人
プラセボ対照試験でレクサプロを投与された 715 人のうつ病患者のうち、6% が有害事象のために治療を中止しましたが、プラセボを投与された 592 人の患者では 2% でした。 2 つの固定用量試験では、1 日 10 mg のレクサプロ 20 mg を投与された患者における有害事象の中止率は、プラセボを投与された患者における有害事象の中止率と有意差はありませんでした。固定用量のレクサプロ 20 mg/日を割り当てられた患者における有害事象の中止率は 10% であり、10 mg/日のレクサプロ (4%) およびプラセボを投与された患者における有害事象の中止率とは有意に異なっていました。 (3%)。レクサプロ 5mg を投与された患者の少なくとも 1% の中止に関連し、その割合がプラセボの少なくとも 2 倍であった有害事象は、吐き気 (2%) と射精障害 (男性患者の 2%) でした。
全般性不安障害
大人
プラセボ対照試験でLexapro 10-20mg/日を投与された429人のGAD患者のうち、プラセボを投与された427人の患者の4%と比較して、8%が有害事象のために治療を中止しました.レクサプロ 20mg を投与された患者の少なくとも 1% の中止に関連し、その発生率がプラセボの発生率の少なくとも 2 倍であった有害事象は、吐き気 (2%)、不眠症 (1%)、および疲労 (1%) でした。 %)。
プラセボ対照臨床試験における有害反応の発生率
大鬱病性障害
小児科(6~17歳)
表 2 に示すように、小児患者における副作用の全体的なプロファイルは、成人の研究で見られたものとほぼ同様でした。 ) レクサプロで少なくとも 2% の発生率で、プラセボよりも高い発生率で報告されました: 背中の痛み、尿路感染症、嘔吐、および鼻づまり.
大人
Lexapro 10mg の患者で最も多く観察された副作用 (約 5% 以上の発生率で、プラセボ患者の約 2 倍の発生率) は、不眠症、射精障害 (主に射精遅延)、悪心、発汗の増加、疲労、および傾眠でした。
表 2 は、プラセボ対照試験で 10 ~ 20 mg/日の範囲の用量でレクサプロ 20 mg を投与された 715 人のうつ病患者に発生した治療に起因する有害事象の発生率を、最も近いパーセントに四捨五入して列挙しています。含まれるイベントは、レクサプロ 20 mg で治療された患者の 2% 以上で発生し、レクサプロ 10 mg で治療された患者の発生率がプラセボ治療患者での発生率よりも高かったものです。
表 2 大うつ病性障害の 2% 以上の頻度でプラセボよりも高い頻度で観察された治療に伴う有害反応
全般性不安障害
大人
Lexapro 患者で最も一般的に観察された副作用 (約 5% 以上の発生率で、プラセボ患者の約 2 倍の発生率) は、吐き気、射精障害 (主に射精遅延)、不眠症、疲労、性欲減退、および無オルガスムでした。
プラセボ対照試験でレクサプロ 10 ~ 20 mg/日を投与された 429 人の GAD 患者で発生した、治療に起因する有害事象の最も近いパーセントに丸められた発生率を列挙します。含まれるイベントは、レクサプロで治療された患者の 2% 以上に発生し、レクサプロで治療された患者の発生率がプラセボで治療された患者での発生率よりも高かったものです。
表 3 全般性不安障害の 2% 以上の頻度でプラセボよりも高い頻度で観察された治療に伴う有害反応
副作用の用量依存性
一般的な副作用の潜在的な用量依存性(レクサプロ 10 mg または 20 mg 群のいずれかで 5% 以上の発生率として定義)は、2 つの固定用量試験での副作用の合計発生率に基づいて調べられました。 10 mg のレクサプロを投与された患者 (66%) における有害事象の全体的な発生率は、プラセボを投与された患者 (61%) と同様でしたが、20 mg/日のレクサプロを投与された患者の発生率はより高かった (86 %)。表 4 に、レクサプロ 20 mg/日群で発生した一般的な副作用を示します。発生率は、レクサプロ 10 mg/日 10mg 群の約 2 倍、プラセボ群の約 2 倍でした。
表 4 大うつ病性障害患者における一般的な有害反応の発生率
SSRIによる男性と女性の性機能障害
性的欲求、性行為、および性的満足の変化は、精神障害の徴候としてしばしば発生しますが、薬理学的治療の結果である場合もあります。特に、いくつかの証拠は、SSRI がそのような不愉快な性的経験を引き起こす可能性があることを示唆しています。
しかし、患者と医師がそれらについて話し合うのをためらう可能性があるため、性的欲求、パフォーマンス、および満足を含む不快な経験の発生率と重症度の信頼できる推定値を取得することは困難です.したがって、製品ラベルに記載されている不快な性的経験とパフォーマンスの発生率の推定値は、実際の発生率を過小評価する可能性があります.
表 5 プラセボ対照臨床試験における性的副作用の発生率
エスシタロプラム治療による性機能障害を調べる適切に設計された研究はありません。
持続勃起症は、すべての SSRI で報告されています。
SSRI の使用に伴う性機能障害の正確なリスクを知ることは困難ですが、医師はそのような副作用の可能性について定期的に問い合わせる必要があります。
バイタルサインの変化
レクサプロ 5 mg 群とプラセボ群を、(1) バイタル サイン (脈拍、収縮期血圧、拡張期血圧) のベースラインからの平均変化、および (2) ベースラインから潜在的に臨床的に重要な変化の基準を満たす患者の発生率に関して比較しました。これらの変数。これらの分析では、Lexapro 20mg 治療に関連するバイタルサインの臨床的に重要な変化は明らかになりませんでした。さらに、Lexapro 20mg を投与された被験者の仰臥位と立位のバイタル サイン測定値の比較では、Lexapro 治療が起立性変化と関連していないことが示されました。
体重の変化
対照試験でLexaproで治療された患者は、体重の臨床的に重要な変化に関して、プラセボで治療された患者と差がありませんでした.
実験室の変更
レクサプロ 5 mg 群とプラセボ群は、(1) さまざまな血清化学、血液学、および尿検査変数のベースラインからの平均変化、および (2) これらの変数のベースラインからの潜在的に臨床的に重要な変化の基準を満たす患者の発生率に関して比較されました。これらの分析により、Lexapro 治療に関連する臨床検査パラメータに臨床的に重要な変化は見られませんでした。
心電図の変化
Lexapro (N=625) およびプラセボ (N=527) グループの心電図を、QTc 変化がベースラインから 60 ミリ秒を超える被験者または絶対値が投与後 500 ミリ秒を超える被験者として定義された外れ値に関して比較しました。 100 bpm を超えるか、ベースラインから 25% 変化して 50 bpm 未満に減少します (それぞれ、頻脈または徐脈の異常値)。プラセボ群の患者の 0.2% と比較して、Lexapro 20mg 群の患者のいずれも QTcF 間隔が 500 ミリ秒を超えていなかったり、延長が 60 ミリ秒を超えていませんでした。頻脈異常値の発生率は、Lexapro 5mg 群とプラセボ群で 0.2% でした。徐脈異常値の発生率は、レクサプロ 10mg 群で 0.5%、プラセボ群で 0.2% でした。
QTcF間隔は、無作為化、プラセボおよびアクティブ(モキシフロキサシン400 mg)制御クロスオーバーで評価され、113人の健康な被験者で複数回投与試験がエスカレートしました。プラセボ群との最大平均差 (95% 上限信頼限界) は、1 日 1 回投与されたエスシタロプラム 10 mg および超治療薬 30 mg で、それぞれ 4.5 (6.4) および 10.7 (12.7) ミリ秒でした。確立された暴露反応関係に基づいて、20 mg の用量の Cmax でのプラセボ群からの予測 QTcF 変化 (95% 信頼区間) は 6.6 (7.9) ミリ秒です。エスシタロプラム 30 mg を 1 日 1 回投与すると、定常状態での最大推奨治療用量 (20 mg) の平均 Cmax よりも 1.7 倍高い平均 Cmax が得られました。治療量を超える 30 mg の用量での曝露は、20 mg の治療用量の後に CYP2C19 低代謝者で予想される定常状態の濃度に類似しています。
レクサプロの市販前評価中に観察されたその他の反応
以下は、本書の序文で定義されている、治療に起因する有害事象のリストです。 有害反応 このセクションは、市販前評価中に二重盲検または非盲検臨床試験で最大1年間レクサプロで治療された1428人の患者によって報告されました。リストには、薬物の原因が遠く、プラセボよりも 1% 未満または低い率であったイベント、非常に一般的で情報が得られないイベント、一度しか報告されていないイベントに既にリストされているイベントは含まれません。急性の生命を脅かす可能性はほとんどありませんでした。イベントは、体のシステムによって分類されます。主要な臨床的重要性のイベントは、 警告と注意事項 セクション。
心臓血管 ・高血圧、動悸。
中枢神経系および末梢神経系の障害 - ふらつき感、片頭痛。
胃腸障害 ・腹痛、胸やけ、胃腸炎。
全般的 - アレルギー、胸の痛み、発熱、ほてり、手足の痛み。
代謝および栄養障害 -重量の増加。
筋骨格系疾患 - 関節痛、筋肉痛、あごのこわばり。
精神障害 食欲増進、集中力低下、イライラ。
生殖障害/女性 生理痛、生理不順。
呼吸器系疾患 - 気管支炎、咳、鼻づまり、副鼻腔のうっ血、副鼻腔の頭痛。
皮膚および付属器の疾患 -発疹。
特別な感覚 - かすみ目、耳鳴り。
泌尿器系疾患 -頻尿、尿路感染症。
市販後の経験
エスシタロプラムの販売後に報告された有害反応
レクサプロの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系の障害: 貧血、無顆粒球症、再生不良性貧血、溶血性貧血、特発性血小板減少性紫斑病、白血球減少症、血小板減少症。
心疾患: 心房細動、徐脈、心不全、心筋梗塞、頻脈、トルサード ド ポアント、心室性不整脈、心室性頻脈。
耳と迷路の障害: めまい
内分泌疾患: 真性糖尿病、高プロラクチン血症、SIADH。
目の病気: 閉塞隅角緑内障、複視、散瞳、視覚障害。
胃腸障害: 嚥下障害、消化管出血、胃食道逆流、膵炎、直腸出血。
一般的な障害および投与部位の状態: 歩行異常、無力症、浮腫、転倒、異常感、倦怠感。
肝胆道疾患: 劇症肝炎、肝不全、肝壊死、肝炎。
免疫系障害: アレルギー反応、アナフィラキシー。
調査: ビリルビン上昇、体重減少、心電図QT延長、肝酵素上昇、高コレステロール血症、INR上昇、プロトロンビン低下。
代謝および栄養障害: 高血糖、低血糖、低カリウム血症、低ナトリウム血症。
筋骨格および結合組織障害: 筋肉のけいれん、筋肉のこわばり、筋力低下、横紋筋融解症。
神経系障害: アカシジア、健忘症、運動失調症、舞踏病アテトーシス、脳血管発作、構音障害、ジスキネジア、ジストニア、錐体外路障害、大発作(または痙攣)、感覚鈍麻、ミオクローヌス、眼振、パーキンソニズム、むずむず脚、発作、失神、遅発性ジスキネジア、振戦。
妊娠、産褥および周産期の状態: 自然流産。
精神障害: 急性精神病、攻撃性、動揺、怒り、不安、無関心、自殺既遂、混乱、離人症、うつ病の悪化、せん妄、妄想、方向感覚の喪失、非現実感、幻覚(視覚と聴覚)、気分のむら、神経過敏、悪夢、パニック反応、パラノイア、落ち着きのなさ、自傷行為または自傷行為の考え、自殺未遂、自殺念慮、自殺傾向。
腎および尿路疾患: 急性腎不全、排尿障害、尿閉。
生殖器系および乳房疾患: 月経過多、持続勃起症。
呼吸器、胸部および縦隔の障害: 呼吸困難、鼻出血、肺塞栓症、新生児の肺高血圧症。皮膚および皮下組織障害:脱毛症、血管性浮腫、皮膚炎、斑状出血、多形紅斑、光線過敏症、スティーブンス・ジョンソン症候群、中毒性表皮壊死症、蕁麻疹。
血管障害: 深部静脈血栓症、紅潮、高血圧クリーゼ、低血圧、起立性低血圧、静脈炎、血栓症。
薬物相互作用
モノアミンオキシダーゼ阻害剤 (MAOI)
[見る 投薬と管理 と 、 禁忌 と 警告と注意事項 ]。
セロトニン薬
[見る 投薬と管理 と 、 禁忌 と 警告と注意事項 ]。
トリプタン
SSRIとトリプタンの使用によるセロトニン症候群のまれな市販後報告があります.レクサプロ 10mg とトリプタンの併用治療が臨床的に正当化される場合、特に治療開始時および用量増加中は、患者を注意深く観察することが推奨される [参照 警告と注意事項 ]。
中枢神経系の薬
エスシタロプラムの主な中枢神経系への影響を考えると、他の中枢作用薬と併用する場合は注意が必要です。
アルコール
レクサプロは、他の向精神薬と同様に、臨床試験でアルコールの認知および運動効果を増強しませんでしたが、レクサプロを服用している患者によるアルコールの使用は推奨されていません.
止血を妨げる薬(NSAID、アスピリン、ワルファリンなど)
血小板によるセロトニンの放出は、止血において重要な役割を果たします。セロトニンの再取り込みを妨げる向精神薬の使用と上部消化管出血の発生との関連性を実証したケースコントロールおよびコホートデザインの疫学的研究は、NSAIDまたはアスピリンの同時使用が出血のリスクを増強する可能性があることも示しています. SSRI と SNRI をワルファリンと併用すると、出血の増加を含む抗凝固効果の変化が報告されています。ワルファリン療法を受けている患者は、レクサプロの開始時または中止時に注意深く監視する必要があります。
シメチジン
ラセミ体のシタロプラム 40 mg/日を 21 日間投与された被験者では、シメチジン 400 mg を 1 日 2 回、8 日間併用投与すると、シタロプラムの AUC と Cmax がそれぞれ 43% と 39% 増加しました。これらの所見の臨床的意義は不明です。
ジゴキシン
40 mg/日のラセミ体シタロプラムを 21 日間投与された被験者では、シタロプラムとジゴキシンの併用投与 (1 mg の単回投与) は、シタロプラムまたはジゴキシンの薬物動態に有意な影響を与えませんでした。
リチウム
ラセミ体のシタロプラム (40 mg/日を 10 日間) とリチウム (30 mmol/日を 5 日間) の同時投与は、シタロプラムまたはリチウムの薬物動態に有意な影響を与えませんでした。それにもかかわらず、血漿リチウム濃度は、標準的な臨床診療に従ってリチウム用量を適切に調整して監視する必要があります。リチウムはエスシタロプラムのセロトニン作用を増強する可能性があるため、レクサプロ 5mg とリチウムを併用する場合は注意が必要です。
ピモジドとセレクサ
対照研究では、ラセミ体のシタロプラム 40 mg と併用してピモジド 2 mg を 1 日 1 回 11 日間単回投与すると、ピモジドを単独で投与した場合と比較して、約 10 ミリ秒の QTc 値の平均増加が見られました。ラセミ体のシタロプラムは、ピモジドの平均 AUC または Cmax を変化させませんでした。この薬力学的相互作用のメカニズムは知られていません。
スマトリプタン
SSRI とスマトリプタンの使用後に衰弱、反射亢進、および協調運動障害を患った患者を説明するまれな市販後の報告がありました。スマトリプタンと SSRI (例、フルオキセチン、フルボキサミン、パロキセチン、セルトラリン、シタロプラム、エスシタロプラム) による併用治療が臨床的に必要な場合は、患者の適切な観察が推奨されます。
テオフィリン
ラセミ体シタロプラム (40 mg/日を 21 日間) と CYP1A2 基質であるテオフィリン (300 mg の単回投与) の併用投与は、テオフィリンの薬物動態に影響を与えませんでした。シタロプラムの薬物動態に対するテオフィリンの効果は評価されなかった。
ワルファリン
40 mg/日のラセミ体シタロプラムを 21 日間投与しても、CYP3A4 基質であるワルファリンの薬物動態に影響はありませんでした。プロトロンビン時間は 5% 増加しましたが、その臨床的意義は不明です。
カルバマゼピン
ラセミ体シタロプラム (40 mg/日で 14 日間) とカルバマゼピン (400 mg/日で 35 日間) の併用投与は、CYP3A4 基質であるカルバマゼピンの薬物動態に有意な影響を与えませんでした。シタロプラムのトラフ血漿レベルは影響を受けませんでしたが、カルバマゼピンの酵素誘導特性を考えると、カルバマゼピンがエスシタロプラムのクリアランスを増加させる可能性は、2 つの薬剤が同時投与された場合に考慮されるべきです。
トリアゾラム
ラセミ体シタロプラム (40 mg/日で 28 日間漸増) と CYP3A4 基質トリアゾラム (0.25 mg の単回投与) の併用投与は、シタロプラムまたはトリアゾラムのいずれの薬物動態にも有意な影響を与えませんでした。
ケトコナゾール
ラセミ体のシタロプラム (40 mg) と強力な CYP3A4 阻害剤であるケトコナゾール (200 mg) の併用投与は、ケトコナゾールの Cmax と AUC をそれぞれ 21% と 10% 減少させ、シタロプラムの薬物動態に有意な影響を与えませんでした。
リトナビル
CYP3A4 基質であり CYP3A4 の強力な阻害剤であるリトナビル (600 mg) とエスシタロプラム (20 mg) の単回投与の併用投与は、リトナビルまたはエスシタロプラムのいずれの薬物動態にも影響しませんでした。
CYP3A4 および -2C19 阻害剤
In vitro 研究では、CYP3A4 と -2C19 がエスシタロプラムの代謝に関与する主要な酵素であることが示されました。しかし、エスシタロプラム (20 mg) と CYP3A4 の強力な阻害剤であるリトナビル (600 mg) の同時投与は、エスシタロプラムの薬物動態に有意な影響を与えませんでした。エスシタロプラムは複数の酵素系によって代謝されるため、単一の酵素を阻害しても、エスシタロプラムのクリアランスが目に見えて減少することはありません。
シトクロム P4502D6 によって代謝される薬物
in vitro 研究では、CYP2D6 に対するエスシタロプラムの阻害効果は明らかにされませんでした。さらに、ラセミ型シタロプラムの定常状態レベルは、シタロプラムの反復投与後の低代謝者と高代謝型 CYP2D6 代謝者で有意差はなく、CYP2D6 を阻害する薬剤のエスシタロプラムとの同時投与が臨床的に有意な影響を与える可能性は低いことを示唆しています。エスシタロプラム代謝。しかし、エスシタロプラムに対する適度な CYP2D6 阻害効果を示唆する in vivo データは限られています。つまり、エスシタロプラム (20 mg/日を 21 日間) と、CYP2D6 の基質である三環系抗うつ薬デシプラミン (50 mg の単回投与) を併用投与した結果です。デシプラミンの Cmax が 40% 増加し、AUC が 100% 増加しました。この所見の臨床的意義は不明です。ただし、エスシタロプラムと CYP2D6 が代謝する薬剤との併用には注意が必要です。
メトプロロール
健康なボランティアに 20 mg/日のレクサプロ 20 mg を 21 日間投与した結果、ベータアドレナリン遮断薬であるメトプロロール (100 mg の単回投与) の Cmax が 50% 増加し、AUC が 82% 増加しました。メトプロロール血漿レベルの上昇は、心選択性の低下と関連しています。レクサプロ 5mg とメトプロロールの同時投与は、血圧や心拍数に臨床的に有意な影響を与えませんでした。
電気けいれん療法(ECT)
ECT とエスシタロプラムの併用に関する臨床試験はありません。
薬物乱用と依存
虐待と依存
身体的および心理的依存
動物研究は、ラセミ体シタロプラムの乱用傾向が低いことを示唆しています。 Lexapro 10mg は、乱用、耐性、または身体的依存の可能性について、ヒトで体系的に研究されていません。 Lexapro の市販前の臨床経験では、薬物探索行動は明らかになりませんでした。しかし、これらの観察結果は系統だったものではなく、この限られた経験に基づいて、CNS 活性薬が一度市場に出された後、誤用、流用、および/または乱用される程度を予測することはできません。したがって、医師はレクサプロ患者の薬物乱用歴を注意深く評価し、そのような患者を綿密に追跡して、誤用または乱用の兆候(耐性の発達、用量の増加、薬物探索行動など)がないか観察する必要があります。
警告
の一部として含まれています "予防" セクション
予防
青少年と若年成人の自殺念慮と自殺行動
約 77,000 人の成人患者と 4,500 人の小児患者を含む抗うつ薬 (SSRI およびその他の抗うつ薬クラス) のプラセボ対照試験のプール分析では、24 歳以下の抗うつ薬治療患者における自殺念慮および自殺行動の発生率は、プラセボ治療患者で。薬物間で自殺念慮および自殺行動のリスクにかなりのばらつきがありましたが、研究されたほとんどの薬物について、若い患者で特定されたリスクの増加がありました。自殺念慮および自殺行動の絶対リスクには適応症ごとに違いがあり、MDD患者で最も高い発生率でした。治療を受けた患者 1,000 人あたりの自殺念慮および自殺行動の症例数における薬物とプラセボの差は、
小児、青年、および若年成人における自殺念慮および自殺行動のリスクが、長期使用、つまり 4 か月を超える使用に及ぶかどうかは不明です。しかし、抗うつ薬がうつ病の再発を遅らせ、うつ病自体が自殺念慮や自殺行動の危険因子であるという、MDDの成人におけるプラセボ対照維持試験からの実質的な証拠があります。
特に薬物療法の最初の数ヶ月間、および投薬量の変更時に、臨床的悪化および自殺念慮および自殺行動の出現の徴候について、抗うつ薬で治療されているすべての患者を監視します。行動の変化を監視し、医療提供者に警告するように、患者の家族または介護者に相談してください。うつ病が持続的に悪化している患者、または緊急の自殺念慮または行動を経験している患者では、レクサプロの中止を含め、治療レジメンの変更を検討してください。
セロトニン症候群
生命を脅かす可能性のあるセロトニン症候群の発症は、レクサプロを含む SNRI および SSRI 単独で報告されていますが、特に他のセロトニン作動薬 (トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミン、およびセントジョンズワート) およびセロトニンの代謝を損なう薬物 (特に、MAOI、精神障害の治療を目的としたものと、リネゾリドや静脈内メチレンブルーなどの他のもの) との併用。
セロトニン症候群の症状には、精神状態の変化(興奮、幻覚、せん妄、昏睡など)、自律神経不安定性(頻脈、血圧変動、めまい、発汗、紅潮、高体温など)、神経筋症状(振戦、硬直、ミオクローヌス、反射亢進、協調運動失調) 発作、および/または胃腸症状 (例えば、吐き気、嘔吐、下痢)。セロトニン症候群の出現について患者を監視する必要があります。
精神障害の治療を目的とした MAOI と Lexapro 10mg の併用は禁忌です。リネゾリドや静脈内メチレンブルーなどのMAOIで治療されている患者にも、レクサプロ5mgを開始しないでください。投与経路に関する情報を提供するメチレンブルーに関するすべての報告は、1mg/kg~8mg/kgの用量範囲での静脈内投与を含んでいた。他の経路 (経口錠剤や局所組織注射など) または低用量でのメチレン ブルーの投与に関する報告はありません。 Lexapro を服用している患者に、リネゾリドや静脈内メチレン ブルーなどの MAOI による治療を開始する必要がある場合があります。 MAOIによる治療を開始する前に、レクサプロを中止する必要があります[ 禁忌 と 投薬と管理 ]。
レクサプロ 5mg と、トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、ブスピロン、トリプトファン、アンフェタミン、セントジョーンズワートなどの他のセロトニン作動薬との併用が臨床的に正当化される場合、患者はセロトニン症候群のリスクが高まる可能性があることを認識しておく必要があります。 、特に治療開始時および用量増加中。
上記の事象が発生した場合は、レクサプロおよび併用するセロトニン作動薬による治療を直ちに中止し、対症療法を開始する必要があります。
レクサプロによる治療の中止
Lexapro およびその他の SSRI および SNRI (セロトニンおよびノルエピネフリン再取り込み阻害薬) のマーケティング中に、これらの薬物の中止時に、特に突然の場合に、次のような有害事象が自然発生的に報告されています。障害(例えば、電撃感覚などの感覚異常)、不安、錯乱、頭痛、無気力、情緒不安定、不眠症、および軽躁病。これらの事象は一般に自己制限的ですが、深刻な中止症状が報告されています.
Lexapro による治療を中止するときは、これらの症状について患者を監視する必要があります。可能な限り、急激な中止ではなく、徐々に用量を減らすことをお勧めします。投与量の減少後または治療の中止後に耐え難い症状が発生した場合は、以前に処方された投与量の再開が考慮される場合があります。その後、医師は用量を減らし続けますが、その速度はより緩やかになります [参照 投薬と管理 ]。
発作
ラセミ体シタロプラムの抗けいれん効果は動物実験で観察されていますが、レクサプロは発作性疾患の患者で体系的に評価されていません.これらの患者は、製品の市販前テスト中に臨床試験から除外されました。 Lexapro 5mg の臨床試験では、Lexapro 治療に関連して痙攣の症例が報告されています。大うつ病性障害の治療に有効な他の薬剤と同様に、レクサプロ 20mg は、発作性障害の病歴のある患者に慎重に導入する必要があります。
マニアまたは軽躁の活性化
双極性障害の患者では、うつ病エピソードをレクサプロまたは他の抗うつ薬で治療すると、混合/躁病エピソードを引き起こす可能性があります。大うつ病性障害におけるレクサプロ 20mg のプラセボ対照試験では、躁病/軽躁病の活性化が、レクサプロ 20mg で治療された 715 人の患者のうちの 1 人 (0.1%) で報告され、プラセボで治療された 592 人の患者では報告されませんでした。 Lexapro 10mgの治療に関連して、軽躁病の追加症例が1件報告されています。躁病/軽躁病の活性化は、大うつ病性障害の治療に有効なラセミ体シタロプラムおよびその他の市販薬で治療された大情動障害患者のごく一部で報告されています。 Lexapro による治療を開始する前に、双極性障害、躁病、または軽躁病の個人歴または家族歴について患者をスクリーニングします [参照 投薬と管理 ]。
低ナトリウム血症
低ナトリウム血症は、Lexapro を含む SSRI および SNRI による治療の結果として発生する可能性があります。多くの場合、この低ナトリウム血症は、不適切な抗利尿ホルモン分泌症候群 (SIADH) の結果であると考えられ、レクサプロ 20mg を中止すると元に戻りました。血清ナトリウムが 110 mmol/L 未満の症例が報告されています。高齢患者は、SSRI および SNRI で低ナトリウム血症を発症するリスクが高くなる可能性があります。また、利尿薬を服用している患者や、その他の方法で体液量が枯渇している患者は、リスクが高くなる可能性があります[参照 高齢者の使用 ]。症候性低ナトリウム血症の患者ではレクサプロの中止を検討し、適切な医療介入を開始する必要があります。
低ナトリウム血症の兆候と症状には、頭痛、集中力の低下、記憶障害、錯乱、脱力感、ふらつきなどがあり、転倒につながる可能性があります。より重症および/または急性の症例に関連する徴候および症状には、幻覚、失神、発作、昏睡、呼吸停止、および死亡が含まれます。
異常出血
Lexapro 20mg を含む SSRI および SNRI は、出血イベントのリスクを高める可能性があります。アスピリン、非ステロイド性抗炎症薬、ワルファリン、およびその他の抗凝固薬の併用は、リスクを高める可能性があります。症例報告と疫学的研究 (症例対照とコホート デザイン) は、セロトニンの再取り込みを妨げる薬物の使用と消化管出血の発生との関連を示しています。 SSRI および SNRI の使用に関連する出血事象は、斑状出血、血腫、鼻出血、および点状出血から、生命を脅かす出血にまで及びます。
Lexapro 20mg と NSAIDs、アスピリン、または凝固に影響を与えるその他の薬剤の併用に伴う出血のリスクについて、患者に注意する必要があります。
認知機能および運動機能への干渉
正常なボランティアを対象とした研究では、レクサプロ 10 mg/日は知的機能や精神運動能力の障害を引き起こしませんでした。ただし、向精神薬は判断力、思考力、または運動能力を損なう可能性があるため、レクサプロ療法がそのような活動に従事する能力に影響を与えないことが合理的に確信できるまで、患者は自動車を含む危険な機械の操作について注意する必要があります.
閉塞隅角緑内障
閉鎖隅角緑内障: Lexapro 20mg を含む多くの抗うつ薬の使用後に発生する瞳孔散大は、虹彩切除術を受けていない解剖学的に隅角が狭い患者で閉鎖隅角発作を引き起こす可能性があります。
合併症のある患者への使用
特定の全身疾患を併発している患者におけるレクサプロの臨床経験は限られています。代謝または血行動態反応の変化を引き起こす疾患または状態の患者にLexapro 5mgを使用する場合は注意が必要です.
レクサプロは、心筋梗塞または不安定心疾患の最近の病歴を持つ患者で体系的に評価されていません。これらの診断を受けた患者は、一般に、製品の市販前テスト中に臨床研究から除外されました.
肝機能障害のある被験者では、ラセミ体シタロプラムのクリアランスが減少し、血漿濃度が上昇しました。肝障害のある患者におけるレクサプロの推奨用量は 10 mg/日です [参照 投薬と管理 ]。
エスシタロプラムは広範囲に代謝されるため、尿中への未変化の薬物の排泄はマイナーな排泄経路です。ただし、Lexapro 20mg による慢性治療中の重度の腎機能障害患者の十分な数が評価されるまでは、そのような患者には注意して使用する必要があります [参照 投薬と管理 ]。
性機能障害
Lexapro を含む SSRI の使用は、性機能障害の症状を引き起こす可能性がある [参照 有害反応 ]。男性患者では、SSRI の使用により、射精の遅延または失敗、性欲減退、および勃起不全が生じる可能性があります。女性患者では、SSRI の使用により性欲が低下し、オーガズムが遅延または消失する可能性があります。
性機能は自発的に報告されない可能性があるため、処方者はレクサプロの開始前に性機能について質問し、治療中の性機能の変化について具体的に質問することが重要です。性機能の変化を評価する際には、詳細な病歴(症状の発症時期を含む)を取得することが重要です。なぜなら、性的症状には、根底にある精神障害を含む他の原因がある可能性があるためです。患者が治療について情報に基づいた決定を下すのをサポートするための潜在的な管理戦略について話し合います。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
自殺念慮と行動
患者、その家族、および介護者に、特に治療中および投与量を増減したときに、自殺念慮および自殺行動の出現を探すように助言し、そのような症状を医療提供者に報告するように指示する[参照 ボックス警告 と 警告と注意事項 ]。
セロトニン症候群
患者は、レクサプロを、トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミン、セントジョーンズワートなどの他のセロトニン作動薬、およびセロトニン(特に、MAOI、精神障害の治療を目的としたものと、リネゾリドなどの他のもの)[参照 警告と注意事項 ]。
マニアまたは軽躁の活性化
患者とその介護者に、躁病/軽躁病の活性化の兆候を観察するようにアドバイスし、そのような症状を医療提供者に報告するように指示します[参照 警告と注意事項 ]。
異常出血
セロトニンの再取り込みを妨げる向精神薬とこれらの薬剤の併用は出血リスクの増加と関連しているため、Lexapro 5mg と NSAIDs、アスピリン、ワルファリン、または凝固に影響を与えるその他の薬の併用について患者に注意する必要があります。 警告と注意事項 ]。
閉塞隅角緑内障
患者は、レクサプロ 5mg を服用すると軽度の瞳孔散大を引き起こす可能性があり、影響を受けやすい個人では、閉塞隅角緑内障のエピソードにつながる可能性があることをアドバイスする必要があります。閉塞隅角緑内障と診断された場合、虹彩切除術で確実に治療できるため、既存の緑内障はほとんどの場合開放隅角緑内障です。開放隅角緑内障は、閉塞隅角緑内障の危険因子ではありません。患者は、隅角閉鎖の影響を受けやすいかどうかを判断するために検査を受け、影響を受けやすい場合は予防処置(例、虹彩切除術)を受けることを希望する場合があります。 警告と注意事項 ]。
性機能障害
Lexapro の使用は、男性と女性の両方の患者で性機能障害の症状を引き起こす可能性があることを患者に助言してください。性機能の変化と潜在的な管理戦略について医療提供者と話し合う必要があることを患者に伝えます[ 警告と注意事項 ]。
併用薬
エスシタロプラムはラセミ体のシタロプラム (Celexa) の活性異性体であるため、2 つの薬剤を併用してはなりません。相互作用の可能性があるため、処方薬または市販薬を服用している、または服用する予定がある場合は、医師に知らせるように患者に助言する必要があります。
処方された治療の継続
患者はレクサプロ 10mg 療法で 1 ~ 4 週間で改善に気付くかもしれませんが、指示に従って治療を続けるようにアドバイスする必要があります。
精神運動パフォーマンスへの干渉
向精神薬は判断力、思考力、または運動能力を損なう可能性があるため、レクサプロ療法がそのような活動に従事する能力に影響を与えないことが合理的に確信できるまで、患者は自動車を含む危険な機械の操作について注意する必要があります.
アルコール
患者は、レクサプロ 5mg がアルコールによって引き起こされる精神的および運動能力障害を増加させることが正常な被験者を対象とした実験で示されていませんが、うつ病患者にレクサプロ 20mg とアルコールを併用することは勧められていないことを伝えておく必要があります。
妊娠
妊娠中の女性がLEXAPROによる治療中に妊娠した場合、または妊娠する予定がある場合は、医療提供者に通知するようにアドバイスしてください.妊娠後期に LEXAPRO 10mg を使用すると、長期入院、呼吸補助、経管栄養、および/または新生児の持続性肺高血圧症 (PPHN) を必要とする新生児合併症のリスクが増加する可能性があることを患者に助言する [参照 特定の集団での使用 ]。
妊娠中にLEXAPROに曝露した女性の妊娠転帰を監視する妊娠曝露登録があることを女性に助言する[参照 特定の集団での使用 ]。
授乳
LEXAPRO を使用している授乳中の女性は、過度の鎮静、落ち着きのなさ、激越、哺乳不良、体重増加不良について乳児を監視し、これらの兆候に気付いた場合は医療機関を受診するようアドバイスしてください [ 特定の集団での使用 ]。
包括的な治療プログラムの必要性
Lexapro 20mg は、この症候群の患者のための他の手段 (心理的、教育的、社会的) を含む MDD の総合治療プログラムの不可欠な部分として示されています。この症候群のすべての青年に薬物治療が適応されるわけではありません。 MDDにおけるLexapro 10mgの安全性と有効性は、12歳未満の小児患者では確立されていません。抗うつ薬は、環境要因および/またはその他の原発性精神障害に続発する症状を示す青年への使用を意図していません。適切な教育配置が不可欠であり、心理社会的介入が役立つことがよくあります。治療措置だけでは不十分な場合、抗うつ薬を処方する決定は、患者の症状の慢性性と重症度に関する医師の評価に依存します。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
ラセミ体のシタロプラムは、NMRI/BOM 系統のマウスと COBS WI 系統のラットに、それぞれ 18 か月と 24 か月間、食事で投与されました。最大 240 mg/kg/日を投与されたマウスでは、ラセミ シタロプラムの発がん性の証拠はありませんでした。 8 または 24 mg/kg/日のラセミ シタロプラムを投与されたラットでは、小腸癌の発生率が増加しました。この発見に対する無影響量は確立されていません。これらの発見と人間との関連性は不明です。
突然変異誘発
ラセミ体のシタロプラムは、in vitro 細菌復帰突然変異試験 (エイムズ試験) において、代謝活性化の非存在下で 5 つの細菌株 (サルモネラ TA98 および TA1537) のうち 2 つで変異原性を示しました。代謝活性化の存在下および非存在下での染色体異常の in vitro チャイニーズハムスター肺細胞アッセイで、染色体異常誘発性でした。ラセミ体のシタロプラムは、マウスリンパ腫細胞における in vitro 哺乳動物前方遺伝子突然変異試験 (HPRT) またはラット肝臓における結合 in vitro/in vivo 不定期 DNA 合成 (UDS) 試験において、変異原性を示さなかった。ヒトリンパ球の in vitro 染色体異常試験または 2 つの in vivo マウス小核試験で染色体異常誘発性は認められなかった。
生殖能力の障害
ラセミ体のシタロプラムを雄 16 匹、雌 24 匹のラットに、交配および妊娠前および妊娠中に 32、48、および 72 mg/kg/日の用量で経口投与した場合、すべての用量で交配が減少し、32 以上の用量で生殖能力が低下した。 mg/kg/日。妊娠期間は 48 mg/kg/日で増加しました。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中に抗うつ薬にさらされた女性の妊娠転帰を監視する妊娠曝露登録があります。医療提供者は、1-844-405-6185 の National Pregnancy Registry for Antidepressants に電話するか、オンラインで次の URL にアクセスして、患者を登録することをお勧めします。 https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
リスクの概要
発表された疫学的研究および市販後のレポートから入手可能なデータでは、重大な先天性欠損症または流産のリスク増加は確立されていません。新生児の持続性肺高血圧症(PPHN)のリスクがあります( データ )および新生児の適応不良(を参照) 臨床上の考慮事項 ) 妊娠中の LEXAPRO 5mg を含む選択的セロトニン再取り込み阻害薬 (SSRI) への暴露。妊娠中の未治療のうつ病に関連するリスクがあります( 臨床上の考慮事項 )。
動物の生殖研究では、エスシタロプラムとラセミ体シタロプラムの両方が、ヒトの治療用量よりも多い用量で投与された場合、胎児の構造異常を含む、胚/胎児および出生後の発達に悪影響を与えることが示されています ( データ )。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における重大な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
臨床上の考慮事項
病気に関連する母体のリスクおよび/または胚/胎児のリスク
抗うつ薬を中止した女性は、抗うつ薬を継続している女性よりも大うつ病の再発を経験する可能性が高くなります。この発見は、大うつ病の病歴があり、妊娠初期に胸腺機能が正常で抗うつ薬を服用していた 201 人の妊婦の前向き縦断研究から得られたものです。妊娠中および産後に抗うつ薬による治療を中止または変更する場合は、未治療のうつ病のリスクを考慮してください。
胎児/新生児の副作用
レクサプロ 5mg を含む SSRI または SNRI にさらされた新生児は、妊娠第 3 期後半に、長期の入院、呼吸補助、および経管栄養を必要とする合併症を発症しました。このような合併症は、出産直後に発生する可能性があります。報告された臨床所見には、呼吸困難、チアノーゼ、無呼吸、発作、体温の不安定性、摂食困難、嘔吐、低血糖、筋緊張低下、筋緊張亢進、反射亢進、振戦、神経質、過敏症、絶え間ない泣き声が含まれます。これらの特徴は、SSRI と SNRI の直接的な毒性効果、またはおそらく薬物中止症候群のいずれかと一致しています。場合によっては、臨床像がセロトニン症候群と一致することに注意する必要があります。 警告と注意事項 ]。
データ
ヒューマンデータ
特に妊娠後期に SSRI にさらされると、PPHN のリスクが高まる可能性があります。 PPHN は、一般集団の出生 1,000 人あたり 1 ~ 2 人で発生し、実質的な新生児の罹患率と死亡率に関連しています。
動物データ
ラットの胚/胎児発生研究では、器官形成期に妊娠中の動物にエスシタロプラム (56、112、または 150 mg/kg/日) を経口投与すると、胎児の体重が減少し、2 つの高用量で関連する骨化の遅延が生じました。 [mg/m2 ベースで 20 mg/日の最大推奨ヒト用量 (MRHD) の約 55 倍以上]。 56 mg/kg/日で軽度の母体毒性 (臨床徴候および体重増加と摂餌量の減少) が、すべての用量レベルで存在しました。 56 mg/kg/日の発生無影響用量は、mg/m2 ベースで 20 mg の MRHD の約 27 倍です。テストされたどの用量でも奇形は観察されませんでした (mg/m2 ベースで MRHD の 73 倍もの高さ)。
メスのラットが妊娠中および離乳期にエスシタロプラム (6、12、24、または 48 mg/kg/日) で処理された場合、48 mg/kg/日でわずかに増加した子孫の死亡率と成長遅延が認められました。 mg/m2 ベースで 20 mg の MRHD。この用量では、わずかな母体毒性(臨床症状、体重増加および摂餌量の減少)が見られました。 24mg/kg/日では、子孫死亡率のわずかな増加も見られた。無影響量は 12 mg/kg/日で、これは mg/m2 ベースで 20 mg の MRHD の約 6 倍です。
つのラット胚/胎児発生研究では、器官形成期に妊娠動物にラセミ シタロプラム (32、56、または 112 mg/kg/日) を経口投与すると、胚/胎児の成長と生存率が低下し、胎児の発生率が増加しました。これは、mg/m2 ベースで 60 mg/日の MRHD の約 18 倍です。この用量は、母体毒性 (臨床症状、体重増加の減少) とも関連していました。発生無影響用量は 56 mg/kg/日であり、mg/m2 ベースで MRHD の約 9 倍です。ウサギの研究では、ラセミ体のシタロプラムを最大 16 mg/kg/日、または mg/m2 ベースで MRHD の約 5 倍の用量で、胚/胎児の発育に悪影響は観察されませんでした。したがって、ラセミ体のシタロプラムの発生への影響は、ラットでは母体に毒性のある用量で観察され、ウサギでは観察されませんでした。
雌ラットを妊娠後期から離乳までラセミ体シタロプラム (4.8、12.8、または 32 mg/kg/日) で処理した場合、出生後最初の 4 日間の子孫の死亡率の増加と持続的な子孫の成長遅延が最高用量で観察されました。 mg/m2 ベースで 60 mg の MRHD の約 5 倍です。無影響用量は 12.8 mg/kg/日で、mg/m2 に基づいて MRHD の約 2 倍です。母動物が妊娠期間中および授乳期初期に 24 mg/kg/日以上の用量で処理された場合、子孫の死亡率と成長に同様の影響が見られました。これは、mg/m2 ベースで MRHD の約 4 倍です。その研究では、影響のない用量は決定されませんでした。
授乳
リスクの概要
公開された文献からのデータは、母乳中のエスシタロプラムとデスメチルエスシタロプラムの存在を報告しています ( データ )。母乳を通じてエスシタロプラムにさらされた乳児の過度の鎮静、落ち着きのなさ、動揺、摂食不良、および体重増加不良の報告があります。 臨床上の考慮事項 )、。乳生産に対するエスシタロプラムまたはその代謝物の影響に関するデータはありません。母乳育児の発達上および健康上の利点は、母親のLEXAPRO 5mgの臨床的必要性、およびLEXAPROまたは基礎となる母体の状態から母乳で育てられた子供への潜在的な悪影響とともに考慮されるべきです.
臨床上の考慮事項
LEXAPRO 20mg にさらされた乳児は、過度の鎮静、落ち着きのなさ、動揺、摂食不良、体重増加不良について監視する必要があります。
データ
エスシタロプラムを 1 日 10 ~ 20 mg/日の用量で服用している 8 人の授乳中の母親を対象とした研究では、完全に母乳で育てられた乳児は、エスシタロプラムの母親の体重調整用量の約 3.9% と母親の体重調整用量のデスメチルシタロプラムの 1.7% を摂取することが示されました。 .
小児用
Lexapro 10mg の安全性と有効性は、大うつ病性障害の治療のための青年期 (12 ~ 17 歳) で確立されています [ 臨床研究 ]。大うつ病性障害の思春期患者における維持の有効性は体系的に評価されていませんが、維持の有効性は、成人と思春期の患者におけるエスシタロプラムの薬物動態パラメータの比較とともに、成人のデータから外挿できます。
Lexapro の安全性と有効性は、大うつ病性障害の小児 (12 歳未満) 患者では確立されていません。大うつ病性障害の小児 118 人(7 歳から 11 歳)を対象とした 24 週間の非盲検安全性試験では、安全性の調査結果はレクサプロの既知の安全性および忍容性プロファイルと一致していました。
全般性不安障害の 18 歳未満の小児患者におけるレクサプロの安全性と有効性は確立されていません。
SSRIの使用に関連して、食欲減退および体重減少が観察されています。したがって、Lexapro などの SSRI で治療を受けている小児および青年では、体重と成長を定期的にモニタリングする必要があります。
高齢者の使用
大うつ病性障害およびGADにおけるLexapro 10mgの対照試験でエスシタロプラムを投与された1,144人の患者の約6%が60歳以上でした。これらの試験に参加した高齢患者は、10~20 mg のレクサプロを毎日投与されました。これらの試験における高齢患者の数は、年齢に基づく有効性と安全性の違いの可能性を適切に評価するには不十分でした。それにもかかわらず、一部の高齢者がレクサプロの効果に対してより敏感である可能性を排除することはできません.
Lexapro 5mg を含む SSRI および SNRI は、高齢患者における臨床的に重大な低ナトリウム血症の症例と関連しており、この有害事象のリスクがより高い可能性がある [参照 低ナトリウム血症 ]。
つの薬物動態研究では、エスシタロプラムの半減期は、若い被験者と比較して高齢の被験者で約 50% 増加し、Cmax は変化しませんでした [ 臨床薬理学 ]。 10 mg/日が高齢患者の推奨用量です [参照 投薬と管理 ]。
ラセミ体シタロプラムの臨床研究に参加した 4422 人の患者のうち、1357 人が 60 歳以上、1034 人が 65 歳以上、457 人が 75 歳以上でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていませんが、繰り返しになりますが、一部の高齢者の感度が高いことは除外できません.
過剰摂取
以下は、Lexapro タブレットの過剰摂取で報告されています。
- 遅れる可能性のある発作、および昏睡を含む精神状態の変化。
- QRS および QTc 間隔の延長、幅の広い複雑な頻脈性不整脈、トルサード ド ポワントなど、遅延する可能性のある心血管毒性。高血圧が最も一般的に見られますが、単独で、またはアルコールを含む共摂取物と一緒に低血圧が見られることはめったにありません。
- セロトニン症候群(他のプロセロトニン作動薬との多剤過剰摂取の患者は、リスクが高くなる可能性があります)。
不整脈のリスクがあるため、Lexapro を過剰摂取した場合は、長時間の心臓モニタリングが推奨されます。
レクサプロの過剰摂取後早期に発症した患者では、活性炭による胃腸の除染を検討する必要があります。
過剰摂取管理の推奨事項については、中毒センター (1-800-221-2222) または医療毒物学者に連絡することを検討してください。
禁忌
モノアミンオキシダーゼ阻害剤 (MAOI)
セロトニン症候群のリスクが高まるため、Lexapro による精神障害の治療、または Lexapro 5mg による治療中止から 14 日以内の MAOI の使用は禁忌です。精神障害の治療を目的とした MAOI を中止してから 14 日以内に Lexapro 20mg を使用することも禁忌です。 投薬と管理 、 と 警告と注意事項 ]。
リネゾリドまたは静脈内メチレンブルーなどのMAOIで治療されている患者にレクサプロ20mgを開始することも、セロトニン症候群のリスクが高まるため禁忌です[ 投薬と管理 、 と 警告と注意事項 ]。
ピモジド
ピモジドを服用している患者への併用は禁忌です。 薬物相互作用 ]。
エスシタロプラムまたはシタロプラムに対する過敏症
レクサプロ 20mg は、エスシタロプラム、シタロプラム、またはレクサプロの不活性成分に対する過敏症のある患者には禁忌です。
臨床薬理学
作用機序
ラセミ体シタロプラムの S-エナンチオマーであるエスシタロプラムの抗うつ作用の機序は、中枢神経系 (CNS) におけるセロトニン (5-HT) の再取り込みの阻害から生じる中枢神経系 (CNS) におけるセロトニン活性の増強に関連していると推定されています。
薬力学
動物での in vitro および in vivo 研究は、エスシタロプラムが、ノルエピネフリンおよびドーパミンのニューロン再取り込みに対する最小限の影響しか持たない高度に選択的なセロトニン再取り込み阻害剤 (SSRI) であることを示唆しています。エスシタロプラムは、5-HT 再取り込みの阻害および 5-HT ニューロン発火率の阻害に関して、R-エナンチオマーよりも少なくとも 100 倍強力です。ラットの抗うつ効果のモデルに対する耐性は、エスシタロプラムによる長期 (最大 5 週間) の治療では誘発されませんでした。エスシタロプラムは、セロトニン作動性 (5-HT1-7) またはアルファおよびベータアドレナリン、ドーパミン (D1-5)、ヒスタミン (H1-3)、ムスカリン (M1-5)、およびベンゾジアゼピンを含む他の受容体に対する親和性がないか、または非常に低い受容体。また、エスシタロプラムは、Na+、K+、Cl-、および Ca++ チャネルを含むさまざまなイオン チャネルに結合しないか、親和性が低くなります。ムスカリン受容体、ヒスタミン受容体、およびアドレナリン受容体の拮抗作用は、他の向精神薬のさまざまな抗コリン作用、鎮静作用、および心血管系の副作用に関連していると仮定されています。
薬物動態
エスシタロプラムの単回投与および複数回投与の薬物動態は、10 ~ 30 mg/日の用量範囲で直線的かつ用量比例的です。エスシタロプラムの生体内変化は主に肝臓で起こり、平均終末半減期は約 27 ~ 32 時間です。 1 日 1 回の投与で、約 1 週間以内に定常状態の血漿濃度が達成されます。定常状態では、若い健康な被験者の血漿中のエスシタロプラムの蓄積の程度は、単回投与後に観察された血漿濃度の 2.2 ~ 2.5 倍でした。シュウ酸エスシタロプラムの錠剤と経口溶液剤形は生物学的に同等です。
吸収と分配
エスシタロプラムの単回経口投与 (20 mg の錠剤または溶液) の後、血中濃度のピークは約 5 時間後に発生します。エスシタロプラムの吸収は食物の影響を受けません。
シタロプラムの絶対バイオアベイラビリティは、静脈内投与に対して約 80% であり、シタロプラムの分布容積は約 12 L/kg です。エスシタロプラムに固有のデータは入手できません。
エスシタロプラムのヒト血漿タンパク質への結合は、約 56% です。
代謝と排泄
エスシタロプラムの経口投与後、エスシタロプラムおよび S-デメチルシタロプラム (S-DCT) として尿中に回収される薬物の割合は、それぞれ約 8% および 10% です。エスシタロプラムの経口クリアランスは 600 mL/min で、その約 7% が腎クリアランスによるものです。
エスシタロプラムは、S-DCT と S-ジデメチルシタロプラム (S-DDCT) に代謝されます。ヒトでは、未変化のエスシタロプラムが血漿中の主要な化合物です。定常状態では、血漿中のエスシタロプラム代謝産物 S-DCT の濃度はエスシタロプラムの約 3 分の 1 です。 S-DDCT のレベルは、ほとんどの被験者で検出できませんでした。インビトロ研究は、エスシタロプラムがセロトニン再取り込みの阻害において、S-DCT および S-DDCT よりもそれぞれ少なくとも 7 倍および 27 倍強力であることを示しており、エスシタロプラムの代謝産物がエスシタロプラムの抗うつ作用に大きく寄与していないことを示唆しています。 S-DCT および SDDCT はまた、セロトニン作動性 (5-HT1-7) またはアルファおよびベータアドレナリン、ドーパミン (D1-5)、ヒスタミン (H1-3)、ムスカリン (M1- 5)、およびベンゾジアゼピン受容体。 S-DCT および S-DDCT は、Na+、K+、Cl-、および Ca++ チャネルを含むさまざまなイオン チャネルにも結合しません。
ヒト肝ミクロソームを使用した in vitro 研究では、CYP3A4 と CYP2C19 がエスシタロプラムの N-脱メチル化に関与する主要なアイソザイムであることが示されました。
人口サブグループ
年
青少年
エスシタロプラム 10 mg の単回投与試験では、エスシタロプラムの AUC は 19% 減少し、Cmax は成人と比較して健康な青年 (12 ~ 17 歳) で 26% 増加しました。 40 mg/日のシタロプラムを複数回投与した後、エスシタロプラム消失半減期、定常状態の Cmax および AUC は、成人患者と比較して MDD 患者 (12 ~ 17 歳) で類似していました。思春期の患者では投与量の調整は必要ありません。
お年寄り
65 歳以上の被験者におけるエスシタロプラムの薬物動態は、単回投与および複数回投与の研究で若い被験者と比較されました。エスシタロプラムの AUC と半減期は高齢者で約 50% 増加し、Cmax は変化しませんでした。 10 mg は、高齢患者の推奨用量です [参照 投薬と管理 ]。
性別
高齢者、若年成人、および青年におけるエスシタロプラムを測定する単回および複数回投与研究のデータに基づくと、性別に基づく投与量の調整は必要ありません。
肝機能の低下
シタロプラムの経口クリアランスは 37% 減少し、肝機能が低下した患者では、正常な被験者と比較して半減期が 2 倍になりました。ほとんどの肝障害患者に対するエスシタロプラムの推奨用量は 10 mg です。 投薬と管理 ]。
腎機能の低下
軽度から中等度の腎機能障害の患者では、シタロプラムの経口クリアランスは正常な被験者と比較して 17% 減少しました。そのような患者に対する投与量の調整は推奨されません。重度の腎機能低下 (クレアチニンクリアランス
薬物間相互作用
インビトロ酵素阻害データは、CYP3A4、-1A2、-2C9、-2C19、および-2E1 に対するエスシタロプラムの阻害効果を明らかにしませんでした。 in vitro データに基づくと、エスシタロプラムは、これらのシトクロムによって媒介される in vivo 代謝に対してほとんど阻害効果を持たないと予想されます。この問題に対処する in vivo データは限られていますが、薬物相互作用研究の結果は、20 mg の用量のエスシタロプラムには 3A4 阻害効果がなく、2D6 阻害効果はわずかであることを示唆しています。見る 薬物相互作用 入手可能な薬物相互作用データの詳細については、
動物毒物学および/または薬理学
ラットの網膜の変化
ラセミ体のシタロプラムを用いた 2 年間の発がん性試験で、アルビノラットの網膜に病理学的変化 (変性/萎縮) が観察されました。 80 mg/kg/日を投与された雄と雌の両方のラットで、網膜病変の発生率と重症度の両方が増加しました。 24 mg/kg/日のラセミ シタロプラムを 2 年間投与したラット、最大 240 mg/kg/日のラセミ シタロプラムを 18 か月間投与したマウス、または最大 20 mg/kg/日のラセミ シタロプラムを投与したイヌでは、同様の所見は見られませんでした。ラセミ体のシタロプラムを 1 年間服用します。
この病理のメカニズムを調査するための追加の研究は行われておらず、ヒトにおけるこの影響の潜在的な重要性は確立されていません。
犬の心血管の変化
年間の毒物学研究では、8 mg/kg/日の経口ラセミ体シタロプラムを投与されたビーグル犬 10 匹中 5 匹が、治療開始後 17 週から 31 週の間に突然死亡しました。ラセミ体のシタロプラムを 120 mg/kg/日まで投与したラットでは、突然死は観察されず、8 mg/kg/日でイヌで観察されたものと同様の、シタロプラムとその代謝物であるデメチルシタロプラムおよびジデメチルシタロプラム (DDCT) の血漿レベルが生成されました。その後の静脈内投与研究では、ビーグル犬で、ラセミ DDCT が QT 延長を引き起こすことが示されました。これは、犬で観察された結果の既知の危険因子です。
臨床研究
大鬱病性障害
青少年
青年期の大うつ病性障害の急性期治療としてのレクサプロの有効性は、12~17 歳の外来患者を対象にレクサプロ 10~20 mg/日をプラセボと比較した 8 週間の柔軟な用量のプラセボ対照試験で確立されました。大うつ病性障害の DSM-IV 基準を満たした包括的患者。主な結果は、子供のうつ病評価尺度 - 改訂版 (CDRS-R) のベースラインからエンドポイントへの変化でした。この研究では、Lexapro 5mg は CDRS-R でプラセボと比較して統計的に有意な平均改善を示しました。
青年期の大うつ病性障害の急性期治療におけるレクサプロの有効性は、部分的には、ラセミ体シタロプラム 20~40 mg/日を用いた 8 週間の柔軟な用量のプラセボ対照試験からの外挿に基づいて確立されました。大うつ病性障害の DSM-IV 基準を満たした 7 歳から 17 歳の小児および青年を対象としたこの外来研究では、シタロプラム治療はプラセボと比較してベースラインから統計的に有意な CDRS-R の平均改善を示しました。この試験の肯定的な結果は、主に思春期のサブグループから得られました。
追加の 2 つの柔軟な用量のプラセボ対照 MDD 研究 (1 つは 7 歳から 17 歳の患者を対象とした Lexapro 研究、もう 1 つは青少年を対象としたシタロプラム研究) では有効性が示されませんでした。
思春期の患者における維持の有効性は体系的に評価されていませんが、成人と青年の患者におけるエスシタロプラムの薬物動態パラメータの比較とともに、成人のデータから維持の有効性を推定することができます。
大人
大うつ病性障害の治療薬としてのレクサプロ 5mg の有効性は、大うつ病性障害の DSM-IV 基準を満たす 18 歳から 65 歳までの外来患者を対象に実施された 8 週間の 3 つのプラセボ対照試験で確立されました。 3 つの研究すべての主な結果は、モンゴメリー アズバーグうつ病評価尺度 (MADRS) のベースラインからエンドポイントまでの変化でした。
固定用量の研究では、10 mg/日のレクサプロと 20 mg/日のレクサプロを、プラセボと 40 mg/日のシタロプラムと比較しました。 10 mg/日および 20 mg/日のレクサプロ 5 mg 治療群は、MADRS でプラセボと比較して統計的に有意な平均改善を示しました。レクサプロ 10 mg と 20 mg のグループは、このアウトカム指標で類似していました。
10 mg/日のレクサプロとプラセボの 2 番目の固定用量研究では、10 mg/日のレクサプロ治療グループは、MADRS でプラセボと比較して統計的に有意な平均改善を示しました。
柔軟な用量の研究では、Lexapro 20mg (10 ~ 20 mg/日で滴定) とプラセボおよびシタロプラム (20 ~ 40 mg/日で滴定) を比較したところ、Lexapro 5mg 治療グループは、プラセボと比較して統計的に有意な平均改善を示しました。 MADRS。
治療結果と年齢、性別、および人種との関係の分析では、これらの患者の特徴に基づいた反応性の違いは示唆されませんでした。
長期試験では、Lexapro 10 または 20 mg/日による最初の 8 週間の非盲検治療段階で反応があった、大うつ病性障害の基準 (DSM-IV) を満たす 274 人の患者が無作為に割り付けられ、Lexapro の継続が行われました。同じ用量で、またはプラセボに対して、最大 36 週間の再発の観察。非盲検段階での反応は、MADRS 合計スコアが 12 以下に減少したことによって定義されました。二重盲検段階での再発は、MADRS 合計スコアが 22 以上に増加したこと、または不十分な臨床反応による中止と定義されました。 .レクサプロを継続して投与された患者は、プラセボを投与された患者と比較して、再発までの時間が統計的に有意に長くなりました。
全般性不安障害
全般性不安障害 (GAD) の急性期治療におけるレクサプロ 5 mg の有効性は、成人の外来患者を対象にレクサプロ 10 ~ 20 mg/日をプラセボと比較した 3 つの 8 週間多施設多施設柔軟用量プラセボ対照試験で実証されました。 GAD の DSM-IV 基準を満たした 18 歳および 80 歳。 3 つの研究すべてで、Lexapro はハミルトン不安尺度 (HAM-A) でプラセボと比較して統計的に有意な平均改善を示しました。
レクサプロがこれらのグループで異なる効果を持っているかどうかを適切に評価するには、異なる民族および年齢グループの患者が少なすぎました.男性と女性の間でレクサプロに対する反応に違いはありませんでした。
患者情報
レクサプロ® (レクサプロ) (エスシタロプラム) 錠剤・内服液
レクサプロの服用を開始する前、およびリフィルを入手するたびに、レクサプロに付属の投薬ガイドをお読みください。新しい情報があるかもしれません。この投薬ガイドは、あなたの病状や治療について医療提供者に相談する代わりにはなりません.わからないことやもっと知りたいことがある場合は、医療提供者に相談してください。
Lexapro 20mg について知っておくべき最も重要な情報は何ですか?
Lexapro 10mg およびその他の抗うつ薬は、次のような深刻な副作用を引き起こす可能性があります。
フォローアップの訪問はすべて医療提供者に任せ、症状が心配な場合は次の訪問まで電話してください。
以下の症状のいずれかがある場合は、すぐに医療提供者に連絡するか、緊急の場合、特に症状が新しい場合、悪化している場合、または心配している場合は、911 に電話してください。
以下の症状がある場合は、すぐに医療提供者に連絡するか、緊急の場合は 911 に電話してください。レクサプロは、次の深刻な副作用に関連している可能性があります。
男性の症状には次のようなものがあります。
女性の症状には次のようなものがあります。
性機能に何らかの変化が生じた場合、またはレクサプロによる治療中に性的問題について質問や懸念がある場合は、医療提供者に相談してください。あなたの医療提供者が提案できる治療法があるかもしれません。
- Lexapro 5mg およびその他の抗うつ薬は、自殺念慮または行動を増加させる可能性があります 一部の子供、10 代の若者、または若年成人では、 治療の最初の数ヶ月、または用量が変更されたとき。
- うつ病やその他の深刻な精神疾患は、自殺念慮や自殺行動の最も重要な原因です。
- これらの変化に注意し、次のことに気付いた場合はすぐに医療提供者に連絡してください。
- 特に重度の場合、気分、行動、行動、思考、または感情の新しいまたは突然の変化。
- レクサプロ 5mg の開始時や用量変更時の変化には特に注意してください。
- 自殺しようとする
- 危険な衝動で行動する
- 攻撃的または暴力的な行動
- 自殺や死についての考え
- 新しいまたは悪化したうつ病
- 新しいまたは悪化した不安またはパニック発作
- 動揺、落ち着きのなさ、怒り、または苛立ちを感じる
- 寝られない
- 活動の増加、または通常より多く話す
- 行動や気分のその他の異常な変化
- 興奮、幻覚、昏睡またはその他の精神状態の変化
- 調整の問題または筋肉のけいれん (過活動反射)
- レーシングハートビート、高血圧または低血圧
- 発汗または発熱
- 吐き気、嘔吐、または下痢
- 筋肉のこわばり
- 呼吸困難
- 顔、舌、目または口の腫れ
- 発疹、かゆみのあるみみずみ(蕁麻疹)または水ぶくれ、単独で、または発熱または関節痛を伴う
- わずかに増加したエネルギー
- 重度の睡眠障害
- レーシング思考
- 無謀な行動
- 異常に壮大なアイデア
- 過度の幸福または過敏症
- いつもより多くまたは速く話す
- 頭痛
- 脱力感または不安定感
- 混乱、集中または思考の問題、または記憶の問題
これらの問題の危険にさらされているのは、一部の人々だけです。目の検査を受けて、危険にさらされているかどうかを確認し、危険にさらされている場合は予防治療を受けることをお勧めします。
- 眼の痛み
- 視覚の変化
- 目の中または周りの腫れまたは赤み
- 射精が遅い、または射精できない
- 性欲の低下
- 勃起の獲得または維持の問題
- 性欲の低下
- オルガスムの遅延またはオルガスムを得ることができない
最初に医療提供者に相談せずにレクサプロを中止しないでください。 Lexapro 5mg をあまりにも早く中止すると、次のような深刻な症状を引き起こす可能性があります。
- 不安、いらいら、気分の高揚または低迷、落ち着きのなさ、または睡眠習慣の変化
- 頭痛、発汗、吐き気、めまい
- 電撃のような感覚、震え、錯乱
レクサプロとは?
レクサプロ 20mg は、うつ病の治療に使用される処方薬です。うつ病を治療するリスクと治療しないリスクについて、担当の医療提供者と話し合うことが重要です。すべての治療法の選択について、医療提供者と話し合う必要があります。レクサプロは以下の治療にも使用されます。
- 大うつ病性障害(MDD)
- 全般性不安障害(GAD)
Lexapro 治療で状態が改善していないと思われる場合は、医療提供者に相談してください。
レクサプロ 5mg を服用してはいけない人は?
次の場合は、レクサプロ 10mg を服用しないでください。
MAOIに近い時期にLexapro 20mgを服用した人は、深刻な、または生命を脅かす副作用さえあるかもしれません.次のような症状がある場合は、すぐに医療機関を受診してください。
- エスシタロプラムまたはシタロプラム、またはレクサプロの成分のいずれかにアレルギーがある. Lexapro の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
- モノアミンオキシダーゼ阻害剤(MAOI)を服用してください。リネゾリドを含む MAOI を服用しているかどうかわからない場合は、医療提供者または薬剤師に尋ねてください。
- 医師の指示がない限り、Lexapro 10mg を中止してから 2 週間以内に MAOI を服用しないでください。
- 過去 2 週間以内に MAOI の服用を中止した場合は、医師の指示がない限り、Lexapro 20mg を開始しないでください。
- 高熱
- 制御されていない筋肉のけいれん
- 筋肉のこわばり
- 心拍数または血圧の急激な変化
- 錯乱
- 意識を失う(失神する)
- Orap® (ピモジド) と一緒にレクサプロを服用しないでください。これら 2 つの薬剤を一緒に服用すると、深刻な心臓の問題を引き起こす可能性があります。
Lexapro 20mg を服用する前に、医療提供者に何を伝えるべきですか?わからない場合は質問してください。
Lexapro 20mg を開始する前に、次の場合は医療提供者に伝えてください。
- 次のような特定の薬を服用している:
- 片頭痛の治療に使用されるトリプタン
- 三環系薬剤、リチウム、SSRI、SNRI、アンフェタミン、または抗精神病薬を含む、気分、不安、精神病または思考障害の治療に使用される医薬品
- トラマドール
- トリプトファンやセントジョーンズワートなどの市販のサプリメント
- 肝臓に問題がある
- 腎臓に問題がある
- 心臓に問題がある
- 発作またはけいれんがある、またはあった
- 双極性障害または躁病がある
- 血液中のナトリウム濃度が低い
- 脳卒中の病歴がある
- 高血圧がある
- 出血の問題がある、またはあった
- 妊娠している、または妊娠する予定がある。妊娠後期にレクサプロを服用すると、新生児に特定の問題が発生するリスクが高くなる可能性があります。妊娠中のうつ病治療の利点とリスクについて、担当の医療提供者に相談してください。
- LEXAPRO の服用中に妊娠した場合は、かかりつけの医療提供者に、抗うつ薬の国立妊娠登録簿への登録について相談してください。 1-844-405-6185 に電話するか、https://womensmentalhealth.org/clinicaland-researchprograms/pregistry/antidepressants/ にアクセスして登録できます。
- 授乳中または授乳を計画している。レクサプロが母乳に移行する可能性があります。レクサプロを服用している場合は、赤ちゃんに与える最善の方法について医療提供者に相談してください.
あなたが服用しているすべての薬について医療提供者に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。 Lexapro 10mg と一部の薬は相互作用を起こしたり、効果がなかったり、深刻な副作用を引き起こす可能性があります。
医療提供者または薬剤師は、レクサプロ 20mg を他の医薬品と一緒に服用しても安全かどうかを教えてくれます。 Lexapro 10mgを服用している間は、最初に医療提供者に相談せずに薬を開始または中止しないでください.
Lexapro を服用する場合は、次のような escitalopram または citalopram を含む他の医薬品を服用しないでください。
レクサプロの服用方法は?
- 処方されたとおりにレクサプロを服用してください。担当の医療提供者は、Lexapro の用量があなたにとって適切な用量になるまで変更する必要がある場合があります。
- レクサプロ 5mg は食事の有無にかかわらず服用できます。
- レクサプロを飲み忘れた場合は、思い出したらすぐに飲み忘れた分を服用してください。次の服用時間が近い場合は、飲み忘れた分を飛ばして、次の通常の時間に服用してください。レクサプロを同時に 2 回服用しないでください。
- レクサプロを過剰に服用した場合は、すぐに医療提供者または毒物管理センターに連絡するか、緊急治療を受けてください.
レクサプロを服用している間は何を避けるべきですか?
Lexapro 5mg は、眠気を引き起こしたり、意思決定、明確な思考、迅速な反応に影響を与える可能性があります。レクサプロがどのように影響するかを理解するまで、運転、重機の操作、またはその他の危険な活動を行うべきではありません。レクサプロ使用中はアルコールを飲まないでください。
レクサプロ20mgの副作用は?
Lexapro 10mg は深刻な副作用を引き起こす可能性があります。 「レクサプロについて知っておくべき最も重要な情報は何ですか?」というタイトルのセクションで説明されているもののうち、
Lexapro 5mgを服用している人々に起こりうる一般的な副作用は次のとおりです。
- 吐き気
- 眠気
- 弱点
- めまい
- 不安な気持ち
- 寝られない
- 性的問題
- 発汗
- 揺れる
- 空腹感がない
- 口渇
- 便秘
- 感染
- あくび
小児および青年におけるその他の副作用には、次のものがあります。
- 喉の渇きの増加
- 筋肉の動きや動揺の異常な増加
- 鼻血
- 排尿困難
- 重い月経
- 成長速度が遅くなり、体重が変化する可能性があります。 Lexapro による治療中は、お子様の身長と体重を監視する必要があります。
気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。これらは、Lexapro の考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用について医師に相談してください。 1-800-FDA-1088 で副作用を FDA に報告することができます。
Lexapro 20mg の保管方法を教えてください。
- Lexapro は 68°F ~ 77°F (20°C ~ 25°C) で保管してください。 59°F から 86°F (15°C から 30°C) まで許容されるエクスカーション。
- Lexapro のボトルはしっかりと閉めておいてください。
Lexapro 10mg とすべての医薬品は、子供の手の届かないところに保管してください。
レクサプロに関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態でレクサプロを使用しないでください。同じ状態であっても、レクサプロ 10mg を他の人に与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、レクサプロに関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療従事者向けに書かれた Lexapro に関する情報については、医療提供者または薬剤師にお尋ねください。
レクサプロ 20mg コールの詳細については 1-800-678-1605 または www.Lexapro.com にアクセスしてください。
レクサプロ20mgの成分は?
有効成分:シュウ酸エスシタロプラム不活性成分:
- タルク、クロスカルメロースナトリウム、微結晶セルロース/コロイド状二酸化ケイ素、ステアリン酸マグネシウム。フィルムコーティングには、ヒプロメロース、二酸化チタン、およびポリエチレングリコールが含まれています。
- 口頭解決: ソルビトール、精製水、クエン酸、クエン酸Na、リンゴ酸、グリセリン、プロピレングリコール、メチルパラベン、プロピルパラベン、天然ペパーミント香料(内服液は現在販売しておりません)
この医薬品ガイドは、米国食品医薬品局によって承認されています。
