Remeron 15mg, 30mg Mirtazapine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
レメロンとは何ですか?
レメロンは、うつ病の症状を治療するために使用される処方薬です。レメロン 30mg は、単独で使用することも、他の薬と併用することもできます。
レメロンは、抗うつ薬、アルファ 2 拮抗薬と呼ばれる種類の薬に属しています。抗うつ薬、その他。
Remeron 30mgが子供に安全で効果的かどうかは不明です.
レメロン 30mg の副作用の可能性は何ですか?
Remeron は、次のような重大な副作用を引き起こす可能性があります。
- 落ち着かない気持ち、
- レーシング思考、
- 睡眠の必要性が減り、
- 異常なリスクを取る行動、
- 極度の幸福感や悲しみ、
- いつもよりおしゃべりで、
- ぼやけた視界、
- 視野狭窄、
- 目の痛みや腫れ、
- ライトの周りにハローが見える
- 立ちくらみ、
- 熱、
- 寒気、
- 喉の痛み、
- 口内炎、
- 体重や食欲の変化、
- 手のひらや足の裏にひどい発疹、水ぶくれ、はれ、
- 痙攣(発作)、
- 頭痛、
- 錯乱、
- ろれつが回らない、
- 重度の衰弱、
- 嘔吐、
- 調整の喪失、および
- 不安定な感じ
上記の症状がある場合は、すぐに医療機関を受診してください。
レメロンの最も一般的な副作用は次のとおりです。
- 眠気、
- めまい、
- 奇妙な夢、
- 口渇、
- 便秘、
- 食欲増進、そして
- 体重の増加
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Remeron の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
自殺傾向と抗うつ薬
抗うつ薬は、大うつ病性障害(MDD)およびその他の精神障害の短期研究において、小児、青年、および若年成人の自殺念慮および自殺行動(自殺傾向)のリスクをプラセボと比較して増加させました。 REMERON® (ミルタザピン) 錠またはその他の抗うつ薬を子供、青年、または若年成人に使用することを検討している人は、このリスクと臨床上の必要性とのバランスを取らなければなりません。短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65歳以上の成人では、プラセボと比較して抗うつ薬のリスクが低下しました.うつ病やその他の特定の精神障害は、それ自体が自殺のリスクの増加と関連しています。抗うつ薬治療を開始したすべての年齢の患者は、臨床的悪化、自殺傾向、または行動の異常な変化について適切に監視し、注意深く観察する必要があります。家族や介護者は、処方者との綿密な観察とコミュニケーションの必要性を知らされるべきです。レメロンは、小児患者への使用は承認されていません。 (警告: 臨床的悪化と自殺のリスク、患者情報、注意事項: 小児への使用を参照)
説明
レメロン®(ミルタザピン)錠は経口投与薬です。ミルタザピンは、四環式の化学構造を持ち、化合物のピペラジノ アゼピン グループに属します。これは、1,2,3,4,10,14b-ヘキサヒドロ-2-メチルピラジノ [2,1-a] ピリド [2,3-c] ベンザゼピンと呼ばれ、実験式 C17H19N3 を持っています。その分子量は 265.36 です。構造式は次のとおりで、ラセミ混合物です。
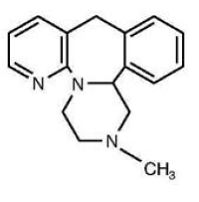
ミルタザピンは、水にわずかに溶ける白色からクリーム色の結晶性粉末です。
レメロンは、ミルタザピン 15 mg または 30 mg を含むスコア付きフィルムコーティング錠、およびミルタザピン 45 mg を含むスコアなしフィルムコーティング錠として経口投与用に供給されます。各錠剤には、コーンスターチ、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、コロイド状二酸化ケイ素、乳糖、およびその他の不活性成分も含まれています.
適応症
レメロン (ミルタザピン) 錠剤は、大うつ病性障害の治療に適応されます。
大うつ病性障害の治療におけるレメロンの有効性は、診断が精神障害の診断および統計マニュアル - 第 3 版 (DSM-III) 大うつ病性障害のカテゴリーに最も近い外来患者の 6 週間の対照試験で確立されました ( 臨床薬理学 )。
大うつ病エピソード (DSM-IV) は、顕著な、比較的持続的な (少なくとも 2 週間、ほぼ毎日) 抑うつ気分または不快気分を意味し、通常は日常生活に支障をきたし、次の 9 つの症状のうち少なくとも 5 つが含まれます。通常の活動への関心の喪失、体重および/または食欲の著しい変化、不眠症または過眠症、精神運動の興奮または遅滞、疲労の増加、罪悪感または無価値感、思考の鈍化または集中力の低下、自殺企図、または自殺念慮。
入院中のうつ病患者におけるレメロン 15mg の有効性は、十分に研究されていません。
レメロン 15mg の有効性は、大うつ病性障害患者において、最初の非盲検治療の 8 ~ 12 週間後、最大 40 週間にわたって反応を維持することが、プラセボ対照試験で実証されました。それにもかかわらず、レメロン 15mg を長期間使用することを選択した医師は、個々の患者に対する薬剤の長期的な有用性を定期的に再評価する必要があります ( 臨床薬理学 )。
投薬と管理
初期治療
レメロン(ミルタザピン)錠の推奨開始用量は 1 日 15 mg で、できれば就寝前の夕方に 1 回投与します。大うつ病性障害の治療におけるレメロンの有効性を確立する対照臨床試験では、有効用量範囲は一般に 15 ~ 45 mg/日でした。レメロン 15 mg の大うつ病性障害の治療における用量と満足のいく反応との関係は十分に調査されていませんが、最初の 15 mg の用量に反応しない患者は、最大 45 mg/日まで用量を増やすことで利益が得られる可能性があります。レメロンの消失半減期は約 20 ~ 40 時間です。したがって、所定の用量に対する治療反応を評価するための十分な時間を確保するために、1 ~ 2 週間未満の間隔で用量を変更するべきではありません。
高齢者および腎障害または肝障害のある患者
ミルタザピンのクリアランスは、高齢患者および中等度から重度の腎障害または肝障害のある患者では低下します。したがって、処方者は、これらの患者群では血漿ミルタザピン濃度が、腎障害または肝障害のない若年成人で観察される値と比較して上昇している可能性があることに注意する必要があります。 予防 と 臨床薬理学 )。
メンテナンス/延長治療
うつ病の急性エピソードには、急性エピソードへの反応を超えて、数か月以上の持続的な薬理学的治療が必要であることが一般的に認められています。レメロン (ミルタザピン) 錠の体系的な評価では、大うつ病性障害に対する有効性が、1 日 15 ~ 45 mg の用量で 8 ~ 12 週間の初期治療を行った後、最大 40 週間持続することが示されています ( 臨床薬理学 )。これらの限られたデータに基づくと、維持治療に必要なレメロン 30mg の投与量が初期反応を達成するために必要な投与量と同じであるかどうかは不明です。患者は定期的に再評価され、維持治療の必要性とそのような治療の適切な用量を決定する必要があります。
精神障害の治療を目的としたモノアミンオキシダーゼ阻害剤(MAOI)への患者の切り替え
精神障害の治療を目的とした MAOI の中止から、REMERON (ミルタザピン) 錠による治療の開始までには、少なくとも 14 日間が必要です。逆に言えば、REMERON 30mg を中止した後、精神障害の治療を目的とした MAOI を開始する前に、少なくとも 14 日間の猶予を与える必要があります。 禁忌 )。
リネゾリドやメチレン ブルーなどの他の MAOI と一緒に REMERON 15mg を使用する
セロトニン症候群のリスクが高いため、リネゾリドまたは静脈内メチレンブルーで治療されている患者では、レメロン 15mg を開始しないでください。精神疾患のより緊急の治療が必要な患者では、入院を含む他の介入を考慮する必要があります。 禁忌 )。
場合によっては、すでにレメロン 30mg による治療を受けている患者は、リネゾリドまたは静脈内メチレン ブルーによる緊急治療が必要になる場合があります。リネゾリドまたはメチレンブルーの静脈内投与に代わる許容できる治療法がなく、リネゾリドまたはメチレンブルーの静脈内投与の潜在的な利点が特定の患者のセロトニン症候群のリスクを上回ると判断された場合、レメロン 30mg は直ちに中止し、リネゾリドまたはメチレンブルーの静脈内投与を中止する必要があります。ブルーを投与することができます。患者は、セロトニン症候群の症状について、リネゾリドまたは静脈内メチレンブルーの最後の投与から 2 週間または 24 時間後までのいずれか早い方で監視する必要があります。レメロン 30mg による治療は、リネゾリドまたは静脈内メチレンブルーの最後の投与から 24 時間後に再開することができます。 警告 )。
非静脈経路 (経口錠剤や局所注射など) によるメチレン ブルーの投与、またはレメロンと一緒に 1 mg/kg よりはるかに低い静脈内投与のリスクは不明です。それにもかかわらず、臨床医は、そのような使用でセロトニン症候群の緊急症状が現れる可能性があることに注意する必要があります。 警告 )。
レメロン治療の中止
レメロン錠15mgの服用中止・減量に伴う症状が報告されています。治療を中止するときや減量中は、これらの症状やその他の症状について患者を監視する必要があります。可能であれば、突然中止するのではなく、数週間かけて徐々に用量を減らすことをお勧めします。用量の減少後または治療の中止時に耐え難い症状が発生した場合、患者の臨床反応に基づいて用量漸増を管理する必要があります。 予防 と 有害反応 )。
患者様向け情報
レメロンを服用すると軽度の瞳孔散大を引き起こす可能性があり、影響を受けやすい個人では、閉塞隅角緑内障のエピソードにつながる可能性があることを患者に通知する必要があります.既存の緑内障は、ほとんどの場合、開放隅角緑内障です。診断された場合、閉塞隅角緑内障は虹彩切除術で確実に治療できるからです。開放隅角緑内障は、閉塞隅角緑内障の危険因子ではありません。患者は、閉塞隅角の影響を受けやすいかどうかを判断するために検査を受け、影響を受けやすい場合は予防処置(虹彩切除術など)を受けることを希望する場合があります。
供給方法
レメロン(ミルタザピン)錠 次のように提供されます。
15mg錠 ― 楕円形、スコアリング、黄色、コーティング、片面に「オルガノン」、反対面に「T3Z」のデボス加工。
30本のボトル NDC 0052-0105-30
30mg錠 ― 楕円形、スコアリング、赤茶色、コーティング、片面に「オルガノン」、反対面に「T5Z」のデボス加工。
30本のボトル NDC 0052-0107-30
45mg錠 ― 楕円形、白、コーティング、片面に「Organon」の型押し、もう片面に「T7Z」の型押し。
30本のボトル NDC 0052-0109-30
保管所
20°C から 25°C (68°F から 77°F) で保管してください。 15°C から 30°C (59°F から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。光と湿気から保護してください。
製造元: Merck & Co., Inc., Whitehouse Station, NJ 08889, USA の子会社である Merck Sharp & Dohme Corp.。製造元: NV Organon、Oss、オランダ、Merck & Co., Inc.、Whitehouse Station、NJ 08889、USA の子会社。改訂: 2016 年 7 月
副作用
治療の中止に伴う
米国の 6 週間の対照臨床試験で REMERON (ミルタザピン) 錠を投与された 453 人の患者の約 16% が、これらの研究でプラセボを投与された 361 人の患者の 7% と比較して、有害な経験のために治療を中止しました。中止に関連し、薬物に関連すると考えられる最も一般的なイベント (1% 以上) (すなわち、プラセボの少なくとも 2 倍の割合でドロップアウトに関連するイベント) を表 2 に示します。
米国の対照臨床試験でよく観察される有害事象
レメロン(ミルタザピン)錠の使用に関連して最も一般的に観察され(5%以上の発生率)、プラセボ治療患者の間で同等の発生率では観察されない有害事象(少なくともプラセボの 2 倍のレメロン発生率)を表に示します。 3.
レメロン治療を受けた患者の1%以上の発生率で発生する有害事象
表 4 は、レメロン錠(ミルタザピン)錠で治療された米国の短期プラセボ対照試験に参加した患者のうち、1%以上の発生率で発生し、プラセボ群よりも頻繁に発生した有害事象を列挙しています。 5 から 60 mg/日の範囲で投与されます。この表は、治療中のある時点で少なくとも 1 つのイベントのエピソードがあった各グループの患者の割合を示しています。報告された有害事象は、標準的な COSTART ベースの辞書用語を使用して分類されました。
処方者は、患者の特性やその他の要因が臨床試験で一般的なものと異なる通常の医療行為の過程で、これらの数値を使用して副作用の発生率を予測することはできないことに注意する必要があります.同様に、引用された頻度は、異なる治療法、使用法、および研究者を含む他の調査から得られた数値と比較することはできません.しかし、引用された数値は、調査対象集団における副作用発生率に対する薬物因子と非薬物因子の相対的な寄与を推定するための根拠を処方医に提供します。
心電図の変化
レメロン(ミルタザピン)錠を投与された 338 人の患者と、6 週間のプラセボ対照試験でプラセボを投与された 261 人の患者の心電図が分析されました。ミルタザピン治療を受けた患者では、QTc ≥ 500 ミリ秒の延長は観察されませんでした。 QTc の平均変化は、ミルタザピンで +1.6 ミリ秒、プラセボで -3.1 ミリ秒でした。ミルタザピンは、プラセボの 0.8 bpm と比較して、3.4 bpm の心拍数の平均増加と関連していました。これらの変化の臨床的意義は不明です。
QTc 間隔に対する REMERON (ミルタザピン) の効果は、暴露反応分析を使用して、54 人の健康なボランティアを含む、プラセボと陽性 (モキシフロキサシン) コントロールによる臨床無作為化試験で評価されました。この試験では、ミルタザピン濃度と QTc 間隔の延長との間に正の関係が示されました。しかし、ミルタザピンの 45 mg (治療用) および 75 mg (治療以上) の用量で観察された QT 延長の程度は、一般に臨床的に意味があると考えられるレベルではありませんでした。
REMERON の市販前評価中に観察されたその他の有害事象
市販前評価中、複数回投与の REMERON (ミルタザピン) 錠が臨床研究で 2,796 人の患者に投与されました。ミルタザピンへの曝露の条件と期間は大きく異なり、(重複するカテゴリーに)オープンおよび二重盲検研究、非対照および対照研究、入院患者および外来患者の研究、固定用量および滴定研究が含まれていました.この曝露に関連する不都合な出来事は、臨床研究者が独自に選んだ用語を使用して記録されました。したがって、最初に同様のタイプの有害なイベントを少数の標準化されたイベントカテゴリにグループ化することなく、有害なイベントを経験している個人の割合の有意義な推定値を提供することはできません.
以下の表では、報告された有害事象は、標準的な COSTART ベースの辞書用語を使用して分類されています。したがって、提示された頻度は、レメロンの投与中に少なくとも 1 回引用されたタイプのイベントを経験したレメロンの複数回投与にさらされた 2796 人の患者の割合を表しています。報告されたすべてのイベントが含まれていますが、表 4 に既にリストされているもの、COSTART 用語に含まれる有害な経験で、過度に一般的または過度に具体的で情報が得られないもの、および薬物の原因が非常に遠いものであるイベントが含まれます。
報告された事象はレメロン 30mg による治療中に発生したが、必ずしもそれによって引き起こされたわけではないことを強調することが重要です。
事象はさらに身体系によって分類され、次の定義に従って頻度の高い順にリストされています。まれな有害事象は、1/100 から 1/1000 の患者に発生するものです。まれなイベントは、1/1000 未満の患者で発生するイベントです。このリストには、表 4 にまだリストされていないイベントのみが表示されます。主要な臨床的重要性のイベントは、警告および注意事項のセクションにも記載されています。
全身: 頻繁:倦怠感、腹痛、急性腹部症候群。まれ:悪寒、発熱、顔面浮腫、潰瘍、光線過敏反応、首のこわばり、首の痛み、腹部の拡大。まれ:蜂窩織炎、胸骨下の胸痛。
心臓血管系: 頻繁:高血圧、血管拡張;まれ:狭心症、心筋梗塞、徐脈、心室性期外収縮、失神、片頭痛、低血圧;まれ:心房性不整脈、双頭症、血管性頭痛、肺塞栓、脳虚血、心肥大、静脈炎、左心不全。
消化器系: 頻繁:嘔吐、食欲不振。まれ:おくび、舌炎、胆嚢炎、吐き気と嘔吐、歯肉出血、口内炎、大腸炎、肝機能検査異常。まれ:舌の変色、潰瘍性口内炎、唾液腺の肥大、唾液分泌の増加、腸閉塞、膵炎、アフタ性口内炎、肝硬変、胃炎、胃腸炎、口腔モニリア症、舌浮腫。
内分泌系: まれ:甲状腺腫、甲状腺機能低下症。
血液およびリンパ系: まれ:リンパ節腫脹、白血球減少症、点状出血、貧血、血小板減少症、リンパ球増加症、汎血球減少症。
代謝および栄養障害: 頻繁に: のどの渇き;まれ:脱水、体重減少。まれ:痛風、SGOT 増加、治癒異常、酸性ホスファターゼ増加、SGPT 増加、真性糖尿病、低ナトリウム血症。
筋骨格系: 頻繁:筋無力症、関節痛。まれ:関節炎、腱鞘炎;まれ:病的骨折、骨粗鬆症骨折、骨痛、筋炎、腱断裂、関節症、滑液包炎。
神経系: 頻繁:知覚過敏、無関心、うつ病、運動低下、めまい、けいれん、動揺、不安、記憶喪失、運動亢進、感覚異常。まれ:運動失調、せん妄、妄想、離人症、ジスキネジア、錐体外路症候群、性欲亢進、協調異常、構音障害、幻覚、躁反応、神経症、ジストニア、敵意、反射亢進、情緒不安定、多幸感、妄想反応。まれ:失語症、眼振、アカシジア(精神運動の落ち着きのなさ)、昏迷、認知症、複視、薬物依存、麻痺、大発作、筋緊張低下、ミオクローヌス、精神病性うつ病、離脱症候群、セロトニン症候群。
呼吸器系: 頻繁:咳の増加、副鼻腔炎;まれ:鼻出血、気管支炎、喘息、肺炎。まれ:窒息、喉頭炎、気胸、しゃっくり。
皮膚と付属物: 頻繁:かゆみ、発疹。まれ:にきび、剥脱性皮膚炎、乾燥肌、単純ヘルペス、脱毛症。まれ:蕁麻疹、帯状疱疹、皮膚肥大、脂漏症、皮膚潰瘍。
特別な感覚: まれ:眼痛、調節異常、結膜炎、難聴、角結膜炎、流涙障害、閉塞隅角緑内障、聴覚過敏、耳の痛み。まれ:眼瞼炎、部分的な一過性難聴、中耳炎、味覚障害、嗅覚異常。
泌尿生殖器系: 頻繁:尿路感染症。まれ:腎結石、膀胱炎、排尿障害、尿失禁、尿閉、膣炎、血尿、乳房痛、無月経、月経困難症、白血病、インポテンツ;まれ:多尿、尿道炎、子宮出血、月経過多、異常な射精、乳房の充血、乳房の肥大、尿意切迫。
レメロンの市販後評価中に観察されたその他の有害事象
市場導入以降に報告されたミルタザピン療法に一時的に関連する(ただし、必ずしも因果関係があるとは限らない)有害事象には、心室性不整脈トルサード ド ポアントの症例が含まれます。しかし、これらのケースの大部分では、併用薬が関与していました。スティーブンス・ジョンソン症候群、水疱性皮膚炎、多形紅斑、中毒性表皮壊死症などの重篤な皮膚反応の症例も報告されています。クレアチンキナーゼ血中濃度の上昇と横紋筋融解症も報告されています。
薬物乱用と依存
規制物質クラス
レメロン(ミルタザピン)錠は規制物質ではありません。
身体的および精神的依存
REMERON (ミルタザピン) 錠剤は、乱用、耐性、または身体的依存の可能性について、動物またはヒトで体系的に研究されていません。臨床試験では薬物探索行動の傾向は明らかになりませんでしたが、これらの観察結果は系統だったものではなく、この限られた経験に基づいて、CNS 活性薬物がどの程度誤用され、転用され、流用されるかを予測することはできません。 /または一度販売されると悪用されます。その結果、患者は薬物乱用の病歴について注意深く評価されるべきであり、そのような患者はレメロンの誤用または乱用の徴候(例えば、耐性の発達、用量の増加、薬物探索行動)について注意深く観察されるべきです.
薬物相互作用
他の薬物と同様に、さまざまな機序 (例えば、薬力学的、薬物動態の阻害または増強など) による相互作用の可能性があります (以下を参照)。 臨床薬理学 )。
モノアミンオキシダーゼ阻害剤
(見る 禁忌 、 警告 、 と 投薬と管理 .)
セロトニン薬
(見る 禁忌 と 警告 .)
肝代謝に影響を及ぼす薬剤
レメロン(ミルタザピン)錠の代謝および薬物動態は、薬物代謝酵素の誘導または阻害によって影響を受ける可能性があります。
チトクローム P450 酵素によって代謝および/または阻害される薬物
CYP酵素誘導剤
(これらの研究では、両方の薬物を定常状態で使用しました)
フェニトイン
健康な男性患者 (n=18) では、フェニトイン (1 日 200 mg) はミルタザピン (1 日 30 mg) のクリアランスを約 2 倍増加させ、平均血漿ミルタザピン濃度を 45% 低下させました。ミルタザピンは、フェニトインの薬物動態に有意な影響を与えませんでした。
カルバマゼピン
健康な男性患者 (n = 24) では、カルバマゼピン (400 mg 1 日 2 回) はミルタザピン (15 mg 1 日 2 回) クリアランスを約 2 倍増加させ、平均血漿ミルタザピン濃度を 60% 低下させました。
ミルタザピン療法にフェニトイン、カルバマゼピン、またはその他の肝代謝誘導物質(リファンピシンなど)を追加すると、ミルタザピンの投与量を増やす必要がある場合があります。そのような医薬品による治療を中止する場合、ミルタザピンの用量を減らす必要があるかもしれません。
CYP酵素阻害剤
シメチジン
健康な男性患者 (n=12) において、CYP1A2、CYP2D6、および CYP3A4 の弱い阻害剤であるシメチジンを定常状態で 800 mg 1 日 2 回投与すると、定常状態でミルタザピン (1 日 30 mg) と同時投与された場合、曲線下面積ミルタザピンの (AUC) は 50% 以上増加しました。ミルタザピンは、シメチジンの薬物動態に関連する変化を引き起こしませんでした。ミルタザピンの用量は、シメチジンによる併用治療を開始する場合は減量する必要があり、シメチジン治療を中止する場合は増量する必要があります。
ケトコナゾール
白人の健康な男性患者 (n=24) では、強力な CYP3A4 阻害剤であるケトコナゾール (200 mg 1 日 2 回、6.5 日間) の同時投与により、ミルタザピン 30 mg 単回投与のピーク血漿レベルと AUC が約 40% 増加し、それぞれ50%。
強力な CYP3A4 阻害剤、HIV プロテアーゼ阻害剤、アゾール系抗真菌剤、エリスロマイシン、またはネファゾドンとミルタザピンを併用投与する場合は注意が必要です。
パロキセチン
健康な CYP2D6 高代謝患者 (n=24) を対象とした in vivo 相互作用研究では、定常状態のミルタザピン (30 mg/日) は、定常状態のパロキセチン (40 mg/日) の薬物動態に関連する変化を引き起こしませんでした。 CYP2D6阻害剤。
その他の薬物間相互作用
アミトリプチリン
健康な CYP2D6 高代謝患者 (n=32) では、定常状態のアミトリプチリン (毎日 75 mg) は、定常状態のミルタザピン (毎日 30 mg) の薬物動態に関連する変化を引き起こしませんでした。ミルタザピンはまた、アミトリプチリンの薬物動態に関連する変化を引き起こしませんでした。
ワルファリン
健康な男性被験者 (n=16) では、定常状態のミルタザピン (1 日 30 mg) により、ワルファリンで治療された被験者の国際正規化比 (INR) がわずかに (0.2) 増加しましたが、統計的に有意な増加が見られました。ミルタザピンの高用量では、より顕著な効果を排除できないため、ミルタザピンとワルファリンの併用治療の場合はINRを監視することをお勧めします.
リチウム
健康な男性被験者において、定常状態で治療量以下のリチウム (1 日 600 mg を 10 日間) とミルタザピン 30 mg を 1 回投与した同時治療では、関連する臨床効果や薬物動態の有意な変化は観察されていません。ミルタザピンの薬物動態に対する高用量のリチウムの影響は不明です。
リスペリドン
インビボの非無作為化相互作用研究では、抗精神病薬および抗うつ薬による治療が必要な被験者 (n=6) は、定常状態のミルタザピン (1 日 30 mg) がリスペリドン (最大 3 mg) の薬物動態に影響を与えないことを示しました入札)。
アルコール
アルコール (60 g に相当) の同時投与は、6 人の健康な男性被験者のミルタザピン (15 mg) の血漿レベルに最小限の影響しか与えませんでした。ただし、REMERON によって引き起こされる認知および運動能力の障害は、アルコールによって引き起こされるものと相加的であることが示されました。したがって、レメロンを服用している間はアルコールを避けるよう患者に助言する必要があります。
ジアゼパム
ジアゼパム (15 mg) の同時投与は、12 人の健康な被験者のミルタザピン (15 mg) の血漿レベルに最小限の影響しか与えませんでした。しかし、レメロン 30mg によって引き起こされる運動能力の障害は、ジアゼパムによって引き起こされるものと相加的であることが示されています。したがって、レメロンを服用している間は、ジアゼパムや他の類似薬を避けるよう患者に助言する必要があります。
QTc延長薬
QT 延長および/または心室性不整脈 (例えば、Torsades de Pointes) のリスクは、QTc 間隔を延長する薬 (例えば、いくつかの抗精神病薬および抗生物質) の併用と、ミルタザピンの過剰摂取の場合に増加する可能性があります ( 有害反応 と 過剰摂取 セクション)。
警告
臨床的悪化と自殺リスク
成人および小児の大うつ病性障害(MDD)の患者は、抗うつ薬を服用しているかどうかにかかわらず、うつ病の悪化および/または自殺念慮および自殺行動(自殺傾向)の出現、または行動の異常な変化を経験する可能性があります。リスクは、有意な寛解が起こるまで持続する可能性があります。自殺は、うつ病やその他の特定の精神障害の既知のリスクであり、これらの障害自体が自殺の最も強力な予測因子です。しかし、抗うつ薬が治療の初期段階で特定の患者のうつ病の悪化と自殺傾向の出現を誘発する役割を果たしている可能性があるという長年の懸念がありました.抗うつ薬 (SSRI など) の短期プラセボ対照試験のプール分析では、これらの薬が大うつ病の子供、青年、若年成人 (18 ~ 24 歳) の自殺念慮および行動 (自殺傾向) のリスクを高めることが示されました。障害(MDD)およびその他の精神障害。短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65歳以上の成人では、プラセボと比較して抗うつ薬のリスクが低下しました.
MDD、強迫性障害(OCD)、またはその他の精神障害を有する小児および青年を対象としたプラセボ対照試験のプール分析には、4,400 人を超える患者を対象とした 9 種類の抗うつ薬の合計 24 の短期試験が含まれていました。 MDD またはその他の精神障害を有する成人を対象としたプラセボ対照試験のプール分析には、77,000 人を超える患者を対象とした 11 種類の抗うつ薬の合計 295 件の短期試験 (期間の中央値は 2 か月) が含まれていました。薬物間で自殺のリスクにかなりのばらつきがありましたが、研究されたほとんどすべての薬物で若い患者が増加する傾向がありました。さまざまな適応症で自殺の絶対リスクに差があり、MDD での発生率が最も高かった。ただし、リスクの違い (薬物とプラセボ) は、年齢層内および適応症全体で比較的安定していました。これらのリスクの違い (治療を受けた患者 1000 人あたりの自殺傾向の症例数における薬物とプラセボの違い) を表 1 に示します。
どの小児科試験でも自殺は発生していません。成人試験では自殺がありましたが、自殺に対する薬物の影響について結論を出すには十分な数ではありませんでした。
自殺リスクが長期間の使用、つまり数ヶ月以上の使用に及ぶかどうかは不明です。しかし、うつ病の成人におけるプラセボ対照維持試験から、抗うつ薬の使用がうつ病の再発を遅らせることができるという実質的な証拠があります.
適応症を問わず抗うつ薬で治療されているすべての患者は、特に薬物療法のコースの最初の数か月間、または用量変更時に、臨床的悪化、自殺傾向、行動の異常な変化について適切に監視し、注意深く観察する必要があります。または減少します。
大うつ病性障害で抗うつ薬を服用している成人および小児患者においても、不安、興奮、パニック発作、不眠症、易怒性、敵意、攻撃性、衝動性、アカシジア(精神運動の落ち着きのなさ)、軽躁病、躁病の症状が報告されています。他の適応症に関しては、精神医学的および非精神医学的の両方です。そのような症状の出現と、うつ病の悪化および/または自殺衝動の出現との間の因果関係は確立されていませんが、そのような症状が自殺傾向の出現の前兆を表している可能性があるという懸念があります.
うつ病が持続的に悪化している患者、またはうつ病や自殺傾向の悪化の前兆である可能性のある緊急の自殺願望または症状を経験している患者では、場合によっては投薬を中止することを含め、治療計画の変更を検討する必要があります。特にこれらの症状が重度で突然の場合発症したか、患者の症状の一部ではありませんでした。
大うつ病性障害またはその他の適応症(精神医学的および非精神医学的両方)の抗うつ薬で治療されている患者の家族および介護者は、動揺、過敏性、行動の異常な変化、および上記のその他の症状の出現について患者を監視する必要性について警告する必要があります。 、自殺傾向の出現と同様に、そのような症状を医療提供者に直ちに報告すること。このようなモニタリングには、家族や介護者による毎日の観察が含まれる必要があります。 REMERON (ミルタザピン) 錠剤の処方は、過剰摂取のリスクを軽減するために、適切な患者管理と一致する最小量の錠剤用に作成する必要があります。
双極性障害の患者のスクリーニング
大うつ病エピソードは、双極性障害の最初の症状である可能性があります。このようなエピソードを抗うつ薬のみで治療すると、双極性障害のリスクがある患者に混合/躁病エピソードが発生する可能性が高くなる可能性があると一般的に考えられています (対照試験では確立されていません)。上記の症状のいずれかがそのような変換を表しているかどうかは不明です。ただし、抗うつ薬による治療を開始する前に、抑うつ症状のある患者を適切にスクリーニングして、双極性障害のリスクがあるかどうかを判断する必要があります。そのようなスクリーニングには、自殺、双極性障害、うつ病の家族歴など、詳細な精神病歴を含める必要があります。 REMERON (ミルタザピン) 錠は、双極性うつ病の治療に使用することは承認されていないことに注意してください。
無顆粒球症
市販前の臨床試験では、レメロン (ミルタザピン) 錠で治療された 2796 人の患者のうち 2 人 (1 人はシェーグレン症候群) が無顆粒球症 [絶対好中球数 (ANC)
セロトニン症候群
生命を脅かす可能性のあるセロトニン症候群の発症は、レメロン 30mg を含む SNRI および SSRI 単独で報告されていますが、特に他のセロトニン作動薬 (トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、およびセントジョンズワート)、およびセロトニンの代謝を損なう薬物 (特に、MAOI、精神障害の治療を目的としたものと、リネゾリドや静脈内メチレンブルーなどの他のもの) との併用。
セロトニン症候群の症状には、精神状態の変化(興奮、幻覚、せん妄、昏睡など)、自律神経不安定性(頻脈、血圧変動、めまい、発汗、紅潮、高体温など)、神経筋症状(振戦、硬直、ミオクローヌス、反射亢進、協調運動失調)、発作、および/または胃腸症状 (例えば、吐き気、嘔吐、下痢)。セロトニン症候群の出現について患者を監視する必要があります。
精神障害の治療を目的とした MAOI との REMERON 15mg の併用は禁忌です。また、リネゾリドやメチレンブルーの静脈内投与などのMAOIで治療を受けている患者にも、REMERONを開始すべきではありません。投与経路に関する情報を提供するメチレンブルーに関するすべての報告は、1mg/kg~8mg/kgの用量範囲での静脈内投与を含んでいた。他の経路 (経口錠剤や局所組織注射など) または低用量でのメチレン ブルーの投与に関する報告はありません。 REMERON を服用している患者に、リネゾリドや静脈内メチレン ブルーなどの MAOI による治療を開始する必要がある場合があります。 REMERON 15mg は、MAOI による治療を開始する前に中止する必要があります (以下を参照)。 禁忌 と 投薬と管理 )。
トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、ブスピロン、トリプトファン、およびセントジョンズワートを含む他のセロトニン作動薬とのレメロン 30mg の併用が臨床的に正当化される場合は、特にセロトニン症候群のリスクが高まる可能性があることに注意してください。治療の開始と用量の増加。
上記の事象が発生した場合は、レメロン 30mg と併用するセロトニン作動薬による治療を直ちに中止し、対症療法を開始する必要があります。
閉塞隅角緑内障
レメロン 15 mg を含む多くの抗うつ薬の使用後に発生する瞳孔散大は、特許虹彩切除術を持っていない解剖学的に狭い隅角を持つ患者で閉鎖隅角発作を引き起こす可能性があります。
QT 延長と Torsades de Pointes
QTc 間隔に対する REMERON (ミルタザピン) の効果は、暴露反応分析を使用して、54 人の健康なボランティアを含む、プラセボと陽性 (モキシフロキサシン) コントロールによる臨床無作為化試験で評価されました。この試験では、ミルタザピン濃度と QTc 間隔の延長との間に正の関係が示されました。しかし、ミルタザピンの 45 mg (治療用) および 75 mg (治療以上) の用量で観察された QT 延長の程度は、一般に臨床的に意味があると考えられるレベルではありませんでした。ミルタザピンの市販後の使用中に、QT延長、Torsades de Pointes、心室頻拍、および突然死の症例が報告されています( 有害反応 )。報告の大部分は、過剰摂取に関連して、または QTc 延長薬の併用を含む、QT 延長の他の危険因子を持つ患者で発生しました ( 薬物相互作用 と 過剰摂取 セクション)。既知の心血管疾患または QT 延長の家族歴のある患者にレメロンを処方する場合、および QTc 間隔を延長すると考えられる他の医薬品と併用する場合は注意が必要です。
予防
全般的
中止の症状
レメロン錠(ミルタザピン)の服用を中止した際(特に急に服用した場合)、めまい、異常な夢、感覚障害(錯感覚や感電を含む)、動揺、不安、疲労、錯乱、頭痛、震え、吐き気、嘔吐、発汗、または臨床的に重要なその他の症状。報告された症例の大部分は軽症で、自己制限的です。これらは副作用として報告されていますが、これらの症状は基礎疾患に関連している可能性があることを認識する必要があります。
現在レメロンを服用している患者は、中止症状のリスクがあるため、突然治療を中止すべきではありません。レメロンによる治療を中止するという医学的決定がなされた時点で、突然中止するのではなく、用量を徐々に減らすことが推奨されます.
アカシジア/精神運動の落ち着きのなさ
抗うつ薬の使用はアカシジアの発症に関連してきました。アカシジアは、主観的に不快または苦痛な落ち着きのなさと動く必要性を特徴とし、しばしば座ったり立ったりすることができなくなります。これは、治療の最初の数週間以内に発生する可能性が最も高い.これらの症状を発症した患者では、用量を増やすと有害な場合があります。
低ナトリウム血症
低ナトリウム血症は、ミルタザピンの使用で非常にまれに報告されています.高齢患者や低ナトリウム血症を引き起こすことが知られている薬を併用している患者など、リスクのある患者には注意が必要です。
傾眠
米国の対照試験では、レメロン(ミルタザピン)錠で治療された患者の 54% で傾眠が報告されましたが、プラセボでは 18%、アミトリプチリンでは 60% でした。これらの研究では、レメロン治療を受けた患者の 10.4% が傾眠により治療を中止しましたが、プラセボでは 2.2% でした。レメロンの眠気に対する耐性が生じるかどうかは不明です。レメロン 30mg がパフォーマンスの障害に重大な影響を与える可能性があるため、患者は、自身の精神運動パフォーマンスに対する薬物の影響を評価できるようになるまで、覚醒を必要とする活動に従事することについて警告する必要があります。 患者情報 )。
めまい
米国の対照研究では、レメロンで治療された患者の 7% でめまいが報告されましたが、プラセボでは 3%、アミトリプチリンでは 14% でした。レメロンの使用に伴って観察されるめまいに対して耐性が生じるかどうかは不明です。
食欲増進・体重増加
米国の対照研究では、レメロン 30mg で治療された患者の 17% で食欲増進が報告されましたが、プラセボでは 2%、アミトリプチリンでは 6% でした。これらの同じ試験では、ミルタザピンで治療された患者の 7.5% で体重の 7% 以上の体重増加が報告されましたが、プラセボでは 0%、アミトリプチリンでは 5.9% でした。長期の非盲検治療の多くの患者を含む市販前の米国研究のプールでは、レメロン 30mg を投与された患者の 8% が体重増加のために中止しました。 15~45 mg/日の用量で8週間にわたる小児臨床試験では、プラセボ治療患者の5.7%と比較して、レメロン治療患者の49%が少なくとも7%の体重増加を示しました( 予防 : 小児用 )。
コレステロール/トリグリセリド
米国の対照試験では、レメロン 30mg で治療した患者の 15% で、非空腹時コレステロール値が正常上限の 20% 以上に上昇したことが観察されましたが、プラセボでは 7%、アミトリプチリンでは 8% でした。これらの同じ研究では、プラセボの 3%、アミトリプチリンの 3% と比較して、ミルタザピンで治療された患者の 6% で 500 mg/dL 以上の非絶食時トリグリセリドの増加が観察されました。
トランスアミナーゼ上昇
臨床的に有意な ALT (SGPT) 上昇 (正常範囲の上限の 3 倍以上) が、米国の短期対照試験のプールでレメロン 30mg に暴露された患者の 0.3% と比較して、2.0% (8/424) で観察されました。 (1/328) のプラセボ患者と 2.0% (3/181) のアミトリプチリン患者。 ALTが上昇したこれらの患者のほとんどは、肝機能の低下に関連する徴候や症状を発症しませんでした.一部の患者はALTの上昇のために中止されましたが、他のケースでは、REMERON治療を継続したにもかかわらず、酵素レベルが正常に戻りました.レメロンは、肝機能障害のある患者には慎重に使用する必要があります (以下を参照)。 臨床薬理学 と 投薬と管理 )。
アクティベーション オブ マニア/ハイポマニア
米国の研究では、レメロン治療を受けた患者の約 0.2% (3/1299 患者) で躁病/軽躁病が発生しました。ミルタザピンによる治療中の躁病/軽躁病の発生率は非常に低かったが、躁病/軽躁病の病歴のある患者には慎重に使用する必要がある.
発作
市販前の臨床試験では、レメロンで治療された米国および米国以外の患者 2,796 人のうち、発作は 1 回だけ報告されました。ただし、発作の既往歴のある患者を対象とした対照試験は実施されていません。したがって、これらの患者にミルタザピンを使用する場合は注意が必要です。
合併症のある患者への使用
全身疾患を併発している患者における REMERON の臨床経験は限られています。したがって、代謝または血行動態反応に影響を与える疾患または状態の患者にミルタザピンを処方する際には注意が必要です。
レメロンは、心筋梗塞やその他の重大な心臓病の最近の病歴を持つ患者に対して、体系的に評価されたり、かなりの範囲で使用されたりしていません。レメロンは、正常なボランティアを対象とした初期の臨床薬理試験で、有意な起立性低血圧と関連していました。うつ病患者を対象とした臨床試験では、起立性低血圧はめったに観察されませんでした。レメロン 15mg は、低血圧 (心筋梗塞、狭心症、または虚血性脳卒中の病歴) によって悪化する可能性のある既知の心血管疾患または脳血管疾患、および患者が低血圧になりやすい状態 (脱水、循環血液量減少、および降圧薬による治療) を有する患者には注意して使用する必要があります。投薬)。
ミルタザピンのクリアランスは、中等度 [糸球体濾過率 (GFR) = 11 - 39 mL/min/1.73 m²] および重度 [GFR 臨床薬理学 と 投薬と管理 )。
患者様向け情報
処方者またはその他の医療専門家は、患者、その家族、およびその介護者に、レメロン (ミルタザピン) 錠による治療に関連する利点とリスクについて知らせ、適切な使用について助言する必要があります。患者 投薬ガイド 「抗うつ薬、うつ病およびその他の重篤な精神疾患、および自殺念慮または自殺行動」については、REMERON で入手できます。処方者または医療専門家は、患者、その家族、および介護者に本書を読むように指示する必要があります。 投薬ガイド その内容を理解するのに役立つはずです。患者には、検査の内容について話し合う機会が与えられるべきです。 投薬ガイド そして、彼らが持つかもしれない質問への答えを得るために。の全文 投薬ガイド このドキュメントの最後に転載されています。
患者は、次の問題について知らされ、レメロンの服用中にこれらの問題が発生した場合は処方者に警告するよう求められる必要があります.
臨床的悪化と自殺リスク
患者、その家族、および介護者は、不安、動揺、パニック発作、不眠症、過敏性、敵意、攻撃性、衝動性、アカシジア(精神運動の落ち着きのなさ)、軽躁病、躁病、その他の行動の異常な変化の出現に注意するよう奨励されるべきである. 、うつ病の悪化、および自殺念慮、特に抗うつ薬治療中の初期および用量が上下に調整された場合。患者の家族や介護者は、変化が突然起こる可能性があるため、日常的にそのような症状の出現を探すようにアドバイスされるべきです.このような症状は、患者の処方者または医療専門家に報告する必要があります。特に、それらが重度である場合、突然発症する場合、または患者の症状の一部ではない場合はそうです。これらのような症状は、自殺念慮や行動のリスクの増加と関連している可能性があり、非常に綿密な監視と、場合によっては投薬の変更が必要であることを示しています.
無顆粒球症
レメロンの投与を受ける患者は、無顆粒球症を発症するリスクについて警告する必要があります。患者は、発熱、悪寒、喉の痛み、粘膜潰瘍、またはその他の感染の可能性のある徴候などの感染の徴候を経験した場合、医師に連絡するようにアドバイスされるべきです.インフルエンザのような症状や、感染を示唆するその他の症状には、特に注意を払う必要があります。
認知機能および運動機能への干渉
レメロン 15mg は、その顕著な鎮静効果のために、判断力、思考力、特に運動能力を損なう可能性があります。ミルタザピンの使用に伴う眠気は、運転、機械の使用、または注意力を必要とする作業を行う患者の能力を損なう可能性があります。したがって、患者は、REMERON 療法がそのような活動に従事する能力に悪影響を及ぼさないことが合理的に確信できるまで、危険な活動に従事することについて警告されるべきです.
治療コースの完了
患者はレメロン 15mg 治療で 1 ~ 4 週間で改善に気付くかもしれませんが、指示どおりに治療を続けるようにアドバイスする必要があります。
併用薬
レメロンが他の薬と相互作用する可能性があるため、処方薬または市販薬を服用している、または服用する予定がある場合は、医師に知らせるよう患者に助言する必要があります。
トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、ブスピロン、トリプトファン、およびセントジョンズワートを含む他のセロトニン作動薬とレメロン 15mg の併用が臨床的に保証されている場合、患者はセロトニン症候群の潜在的なリスク増加を認識する必要があります。特に治療開始時と用量増加中。
アルコール
レメロンによって引き起こされる認知および運動能力の障害は、アルコールによって引き起こされるものと相加的であることが示されています.したがって、患者はミルタザピンを服用している間はアルコールを避けるようにアドバイスされるべきです.
妊娠
レメロン治療中に妊娠した場合、または妊娠する予定がある場合は、医師に通知するよう患者に助言する必要があります。
看護
乳児に授乳している場合は、医師に知らせるように患者に助言する必要があります。
臨床検査
定期的な検査は推奨されていません。
発がん、突然変異誘発、生殖能力の障害
発がん
マウスに 2、20、および 200 mg/kg/日、ラットに 2、20、および 60 mg/kg/日のミルタザピンを混餌投与して、発がん性試験が実施されました。使用される最高用量は、マウスとラットでの mg/m² ベースで、それぞれ 45 mg/日の最大推奨ヒト用量 (MRHD) の約 20 倍と 12 倍です。高用量群の雄マウスで、肝細胞腺腫および肝細胞癌の発生率が増加した。ラットでは、中用量および高用量群の雌で肝細胞腺腫が増加し、高用量群の雄で肝細胞腫瘍、甲状腺濾胞腺腫/嚢胞腺腫および癌腫が増加した。データは、上記の影響が非遺伝毒性メカニズムによって媒介される可能性があることを示唆しており、そのヒトへの関連性は不明です。
マウスの研究で使用された用量は、REMERON (ミルタザピン) 錠の発がん性を完全に特徴付けるのに十分な量ではなかった可能性があります.
突然変異誘発
ミルタザピンは、変異原性または染色体異常誘発性ではなく、いくつかの遺伝毒性試験で決定されたように、一般的な DNA 損傷を誘発しませんでした: Ames 試験、チャイニーズハムスター V 79 細胞における in vitro 遺伝子突然変異試験、培養ウサギリンパ球における in vitro 姉妹染色分体交換試験、in vivo 骨髄ラットでの小核試験、および HeLa 細胞での不定期 DNA 合成アッセイ。
生殖能力の障害
ラットの受胎能研究では、ミルタザピンは最大 100 mg/kg の用量で投与されました [mg/m に基づく最大推奨用量 (MRHD) の 20 倍]。交配と受胎はこの薬物の影響を受けなかったが、MRHD の 3 倍以上の用量で発情周期が中断され、MRHD の 20 倍で着床前損失が発生した。
妊娠
催奇形性効果
妊娠カテゴリーC
妊娠中のラットとウサギをそれぞれ最大 100 mg/kg と 40 mg/kg の用量 [mg/m² に基づく最大推奨ヒト用量 (MRHD) のそれぞれ 20 倍と 17 倍] での生殖研究では、催奇形効果。しかし、ラットでは、ミルタザピンで治療した母動物の着床後の損失が増加しました。授乳の最初の 3 日間で子犬の死亡が増加し、子犬の出生時体重が減少しました。これらの死因はわかっていません。 mg/m²ベースで MRHD の 20 倍の用量で効果が発生しましたが、MRHD の 3 倍では効果がありませんでした。妊娠中の女性を対象とした、十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるわけではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
授乳中の母親
レメロンの一部が母乳中に排泄されることがあるため、授乳中の女性にレメロン(ミルタザピン)錠を投与する場合は注意が必要です。
小児用
小児集団における安全性と有効性は確立されていません ( 囲み警告 と 警告 : 臨床的悪化と自殺リスク )。 MDD の小児患者 258 人を対象に、REMERON (ミルタザピン) 錠を用いた 2 つのプラセボ対照試験が実施されましたが、データは小児患者への使用を主張するのに十分ではありませんでした。小児または青年に REMERON 30mg を使用することを検討している人は、潜在的なリスクと臨床上の必要性とのバランスを取る必要があります。
1日15~45mgの8週間にわたる小児臨床試験では、プラセボ投与患者の5.7%と比較して、レメロン投与患者の49%で少なくとも7%の体重増加が見られました。体重の平均増加は、レメロン治療患者では 4 kg (2 kg SD) であったのに対し、プラセボ治療患者では 1 kg (2 kg SD) でした ( 予防 : 食欲増進・体重増加 )。
高齢者の使用
約 190 人の高齢者 (65 歳以上) が、レメロン (ミルタザピン) 錠の臨床試験に参加しました。この薬は腎臓から実質的に排泄されることが知られており (75%)、この薬のクリアランスが低下するリスクは、腎機能が低下している患者で大きくなります。高齢者は腎機能が低下している可能性が高いため、用量選択には注意が必要です。鎮静剤は、高齢者に錯乱や過度の鎮静を引き起こす可能性があります。このグループでは、年齢に関連した異常な有害現象は確認されませんでした。薬物動態研究は、高齢者におけるクリアランスの減少を明らかにした。高齢患者へのレメロンの投与には注意が必要です( 臨床薬理学 と 投薬と管理 )。
過剰摂取
人間の経験
REMERON(ミルタザピン)錠の過剰摂取の経験は非常に限られています.市販前の臨床試験では、レメロン単独または他の薬理学的薬剤との組み合わせでの過剰摂取の報告が 8 件ありました。 REMERONの服用中に報告された唯一の薬物過剰摂取による死亡は、米国以外の臨床研究でのアミトリプチリンおよびクロルプロチキセンとの併用でした.血漿レベルに基づくと、レメロン 15 mg の服用量は 30 ~ 45 mg でしたが、アミトリプチリンとクロルプロチキセンの血漿レベルは毒性レベルであることがわかりました。その他の市販前の過剰摂取のケースはすべて、完全に回復しました。過剰摂取に関連して報告された兆候と症状には、見当識障害、眠気、記憶障害、頻脈が含まれます。レメロン単独での過剰摂取後の心電図異常、昏睡、または痙攣の報告はありませんでした。
しかし、市販後の報告に基づくと、治療用量よりもはるかに高い用量で、特に混合過剰摂取では、より深刻な結果 (死亡を含む) の可能性があります。これらのケースでは、QT 延長と Torsades de Pointes も報告されています ( 薬物相互作用 と 有害反応 セクション)。
過剰摂取管理
治療は、大うつ病性障害の治療に有効な薬物による過剰摂取の管理に採用されている一般的な手段で構成する必要があります。適切な気道、酸素化、および換気を確保します。 ECG パラメータ (心調律を含む) とバイタル サインを監視します。一般的な支持および対症療法も推奨されます。嘔吐の誘発は推奨されません。必要に応じて、適切な気道保護を備えた大口径の口腔胃管による胃洗浄が、摂取後すぐに実施される場合、または症状のある患者の場合に適応となる場合があります。活性炭を投与する必要があります。ミルタザピンの過剰摂取の治療において、強制利尿、透析、血液灌流、または交換輸血を使用した経験はありません。ミルタザピンに対する特異的な解毒剤は知られていません。
過剰摂取を管理する際には、複数の薬物が関与する可能性を考慮してください。医師は、過剰摂取の治療に関する追加情報について、毒物管理センターに連絡することを検討する必要があります。認定毒物管理センターの電話番号は、Physicians' Desk Reference (PDR) に記載されています。
禁忌
過敏症
REMERON (ミルタザピン) 錠剤は、ミルタザピンまたはいずれかの賦形剤に対して既知の過敏症のある患者には禁忌です。
モノアミンオキシダーゼ阻害剤
レメロン 15mg 錠による精神障害の治療を目的としたモノアミン酸化酵素阻害薬 (MAOI) の使用、またはレメロン 15mg による治療を中止してから 14 日以内の使用は、セロトニン症候群のリスクが高いため禁忌です。精神障害の治療を目的とした MAOI を中止してから 14 日以内に REMERON 15mg を使用することも禁忌です ( 警告 と 投薬と管理 )。
セロトニン症候群のリスクが高まるため、リネゾリドや静脈内メチレンブルーなどの MAOI で治療されている患者に REMERON を開始することも禁忌です。 警告 と 投薬と管理 )。
臨床薬理学
薬力学
レメロン(ミルタザピン)錠の作用機序は、大うつ病性障害の治療に有効な他の薬と同様に不明です。
前臨床研究で収集された証拠は、ミルタザピンが中枢性ノルアドレナリン作動性およびセロトニン作動性活性を増強することを示唆しています。これらの研究は、ミルタザピンが中枢性シナプス前α2-アドレナリン抑制自己受容体およびヘテロ受容体のアンタゴニストとして作用することを示しており、この作用は中枢性のノルアドレナリン作動性およびセロトニン作動性活性の増加をもたらすと仮定されています。
ミルタザピンは、5-HT2 および 5-HT3 受容体の強力な拮抗薬です。ミルタザピンには、5-HT1A および 5-HT1B 受容体に対する有意な親和性はありません。
ミルタザピンは、ヒスタミン (H1) 受容体の強力な拮抗薬であり、その顕著な鎮静効果を説明する可能性がある特性です。
ミルタザピンは中等度の末梢α-アドレナリン拮抗薬であり、その使用に関連して報告される時折の起立性低血圧を説明するかもしれない特性です.
ミルタザピンは、ムスカリン受容体の中等度の拮抗薬であり、その使用に伴う抗コリン作動性の副作用の発生率が比較的低いことを説明している可能性があります.
薬物動態
レメロン錠(ミルタザピン) 経口投与後、速やかに完全に吸収され、半減期は約20~40時間です。経口摂取後、約2時間以内に血漿中濃度がピークに達します。胃の中に食物が存在しても、吸収の速度と程度の両方に与える影響は最小限であり、投与量の調整は必要ありません。
ミルタザピンは、経口投与後に広範囲に代謝されます。生体内変化の主な経路は、脱メチル化とヒドロキシル化、それに続くグルクロニド抱合です。ヒト肝ミクロソームからの in vitro データは、シトクロム 2D6 および 1A2 がミルタザピンの 8-ヒドロキシ代謝産物の形成に関与しているのに対し、シトクロム 3A は N-デスメチルおよび N-オキシド代謝産物の形成に関与していると考えられていることを示しています。ミルタザピンの絶対バイオアベイラビリティは約 50% です。主に尿 (75%) から排泄され、15% が糞便に排泄されます。いくつかの非結合代謝物は薬理活性を持っていますが、血漿中には非常に低いレベルで存在しています。 (-) 鏡像異性体は、(+) 鏡像異性体の約 2 倍の排出半減期を持ち、したがって (+) 鏡像異性体の約 3 倍の血漿レベルを達成します。
血漿レベルは、15 ~ 80 mg の用量範囲で用量と直線的に関連しています。経口投与後のミルタザピンの平均排出半減期は、年齢と性別のサブグループ全体で約 20 時間から 40 時間の範囲であり、すべての年齢の女性は男性よりも有意に長い排出半減期を示しています (女性の平均半減期は 37 時間、女性は 26 時間です)。男性用)。ミルタザピンの定常状態の血漿レベルは、5 日以内に達成され、約 50% の蓄積があります (蓄積比 = 1.5)。
ミルタザピンは、0.01 ~ 10 mcg/mL の濃度範囲で約 85% が血漿タンパク質に結合します。
特別な集団
高齢者
レメロン (ミルタザピン) 錠 20 mg/日を 7 日間、さまざまな年齢 (25 ~ 74 歳の範囲) の被験者に経口投与した後、ミルタザピンの経口クリアランスは、若い被験者と比較して高齢者で減少しました。違いは男性で最も顕著で、年配の男性は若い男性に比べてクリアランスが 40% 低く、年配の女性のクリアランスは若い女性に比べてわずか 10% 低いだけでした。高齢患者へのレメロン 30mg の投与には注意が必要です( 予防 と 投薬と管理 )。
小児科
小児集団におけるミルタザピンの安全性と有効性は確立されていません。 予防 )。
性別
経口投与後のミルタザピンの平均排出半減期は、年齢と性別のサブグループ全体で約 20 ~ 40 時間の範囲であり、すべての年齢の女性が男性よりも有意に長い排出半減期を示しています (女性の平均半減期は 37 時間、男性の場合は26時間)(参照 薬物動態 )。
人種
レメロンの薬物動態に対する人種の影響を評価する臨床研究はありません。
腎不全
ミルタザピンの体内動態は、さまざまな程度の腎機能を持つ患者で研究されました。ミルタザピンの除去は、クレアチニンクリアランスと相関しています。ミルタザピンの全身クリアランスは、中等度 (Clcr=11 ~ 39 mL/min/1.73 m²) の患者では約 30% 減少し、重度 (Clcr= 予防 と 投薬と管理 )。
肝不全
レメロン 15 mg の単回経口投与後、ミルタザピンの経口クリアランスは、肝機能が正常な被験者と比較して、肝障害患者で約 30% 減少しました。肝機能が低下している患者にレメロンを投与する際には注意が必要です。 予防 と 投薬と管理 )。
有効性を示す臨床試験
大うつ病性障害の治療薬としてのレメロン(ミルタザピン)錠の有効性は、大うつ病性障害の DSM-III 基準を満たす成人外来患者を対象とした 4 つのプラセボ対照 6 週間試験で確立されました。患者はミルタザピンで 5 mg から 35 mg/日までの用量範囲で滴定されました。全体として、これらの研究では、ミルタザピンが次の 4 つの尺度のうち少なくとも 3 つにおいてプラセボよりも優れていることが示されました。 HDRS 抑うつ気分アイテム。 CGI 重大度スコア; Montgomery and Asberg Depression Rating Scale (MADRS)。プラセボに対するミルタザピンの優位性は、不安/身体化因子および睡眠障害因子を含む HDRS の特定の因子についても見出されました。これら 4 つの研究を完了した患者のミルタザピンの平均投与量は、21 ~ 32 mg/日の範囲でした。同様のデザインの 5 番目の研究では、1 日あたりより高い用量 (最大 50 mg) を使用し、有効性も示されました。
母集団の年齢と性別のサブセットを調べても、これらのサブグループに基づく反応の違いは明らかになりませんでした。
長期研究では、レメロン 30 mg による急性期治療の最初の 8 ~ 12 週間で効果があった、大うつ病性障害の基準 (DSM-IV) を満たす患者を、レメロン 15 mg またはプラセボを最大 40 週間継続する群に無作為に割り付けました。再発の観察。オープン フェーズ中の応答は、オープン ラベル フェーズの 8 ~ 12 週間のうちの 6 週目から始まる 2 回の連続した訪問で、HAM-D 17 合計スコアが 8 以下であり、CGI 改善スコアが 1 または 2 であると定義されました。研究の。二重盲検期間中の再発は、個々の研究者によって決定されました。レメロン 30mg を継続して投与された患者は、プラセボを投与された患者と比較して、その後 40 週間にわたって再発率が大幅に低下しました。このパターンは、男性患者と女性患者の両方で実証されました。
患者情報
レメロン® (rem' - e - ron) (ミルタザピン) 錠
REMERON® について知っておくべき最も重要な情報は何ですか?
REMERON 15mg およびその他の抗うつ薬は、次のような深刻な副作用を引き起こす可能性があります。
1. 自殺願望または行動 :
- REMERON 30mg およびその他の抗うつ薬は、治療の最初の数か月間または用量が変更されたときに、一部の子供、10 代の若者、または若年成人の自殺念慮または行動を増加させる可能性があります。
- うつ病やその他の深刻な精神疾患は、自殺念慮や自殺行動の最も重要な原因です。
- これらの変化に注意し、次のことに気付いた場合はすぐに医療提供者に連絡してください。
- 特に重度の場合、気分、行動、行動、思考、または感情の新しいまたは突然の変化。
- レメロンの投与開始時や用量変更時の変化には特に注意してください。
フォローアップの訪問はすべて医療提供者に任せ、症状が心配な場合は次の訪問まで電話してください。
以下の症状のいずれかがある場合は、すぐに医療提供者に連絡するか、緊急の場合、特に症状が新しい場合、悪化している場合、または心配している場合は、911 に電話してください。
- 自殺しようとする
- 危険な衝動で行動する
- 攻撃的または暴力的な行動
- 自殺や死についての考え
- 新しいまたは悪化したうつ病
- 新しいまたは悪化した不安またはパニック発作
- 動揺、落ち着きのなさ、怒り、または苛立ちを感じる
- 寝られない
- 活動の増加、または通常より多く話す
- 行動や気分のその他の異常な変化
以下の症状がある場合は、すぐに医療提供者に連絡するか、緊急の場合は 911 に電話してください。 REMERON は、次の重大な副作用に関連している可能性があります。
2. 躁病エピソード :
- 大幅に増加したエネルギー
- 無謀な行動
- いつもより多くまたは速く話す
- 重度の睡眠障害
- 異常に壮大なアイデア
- レーシング思考
- 過度の幸福または過敏症
3.白血球の減少 好中球と呼ばれ、感染と戦うために必要です。発熱、悪寒、喉の痛み、口や鼻の痛みなどの感染の徴候、特にインフルエンザのような症状がある場合は、医師に相談してください。
4.セロトニン症候群。この状態は生命を脅かす可能性があり、次のようなものがあります。
- 興奮、幻覚、昏睡またはその他の精神状態の変化
- レーシングハートビート、高血圧または低血圧
- 吐き気、嘔吐、または下痢
- 調整の問題または筋肉のけいれん (過活動反射)
- 発汗または発熱
- 筋肉のこわばり
5. 視覚的な問題
- 眼の痛み
- 視覚の変化
- 目の中または周りの腫れまたは赤み
これらの問題の危険にさらされているのは、一部の人々だけです。目の検査を受けて、危険にさらされているかどうかを確認し、危険にさらされている場合は予防治療を受けることをお勧めします。
6. 発作
7. 血中の塩分(ナトリウム)レベルが低い。
高齢者は、このリスクが高くなる可能性があります。症状には次のものがあります。
- 頭痛
- 混乱、集中または思考の問題、または記憶の問題
- 脱力感または不安定感
8.眠気。 取るのが一番 レメロン 就寝間近。
9. 重度の皮膚反応 : 次の症状のいずれかまたはすべてがある場合は、すぐに医師に連絡してください。
- 皮膚の腫れを伴う重度の発疹(手のひらや足の裏を含む)
- 体や口の中の皮膚、水ぶくれ、潰瘍の痛みを伴う発赤
10. 重度のアレルギー反応 : 呼吸困難、顔、舌、目、口の腫れ
- 発疹、かゆみのあるみみずみ(蕁麻疹)または水ぶくれ、単独で、または発熱または関節痛を伴う
11.食欲または体重の増加。 小児および青年は、治療中は身長と体重を監視する必要があります。
12.血中のコレステロールとトリグリセリドのレベルの上昇
担当の医療提供者に最初に相談せずに、REMERON 15mg を服用しないでください。 レメロン 15mg をあまりにも早く中止すると、次のような重篤な症状を引き起こす可能性があります。
- めまい
- 倦怠感
- チクチクする感覚
- 異常な夢
- 錯乱
- 吐き気、嘔吐
- 攪拌
- 頭痛
- 発汗
- 不安
- 揺れる
レメロン15mgとは?
レメロン 15mg は、うつ病の治療に使用される処方薬です。うつ病を治療するリスクと治療しないリスクについて、担当の医療提供者と話し合うことが重要です。すべての治療法の選択について、医療提供者と話し合う必要があります。
REMERON 治療で症状が改善していないと思われる場合は、医療提供者に相談してください。
レメロン15mgを服用してはいけない人は?
レメロンを服用しないでください:
- ミルタザピンまたはレメロンのいずれかの成分にアレルギーがある場合。 REMERON の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
- モノアミンオキシダーゼ阻害剤(MAOI)を服用している場合。抗生物質リネゾリドを含む MAOI を服用しているかどうかわからない場合は、医療提供者または薬剤師に尋ねてください。
- 医療提供者からの指示がない限り、REMERON を中止してから 2 週間以内に MAOI を服用しないでください。
- 過去 2 週間以内に MAOI の服用を中止した場合は、医療提供者の指示がない限り、REMERON を開始しないでください。
MAOI に近い時期に REMERON 15mg を服用した人は、深刻な、または生命を脅かす副作用さえある可能性があります。次のような症状がある場合は、すぐに医師の診察を受けてください。
- 高熱
- 心拍数または血圧の急激な変化
- 制御されていない筋肉のけいれん
- 錯乱
- 筋肉のこわばり
- 意識を失う(失神する)
レメロンを服用する前に、担当の医療提供者に何を伝えるべきですか?
REMERON を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 次のような特定の薬を服用しています。
- 片頭痛の治療に使用されるトリプタン
- 三環系薬、リチウム、SSRI、SNRI、または抗精神病薬を含む、気分障害、不安障害、精神障害または思考障害の治療に使用される医薬品
- 痛みの治療に使用されるトラマドール
- トリプトファンやセントジョーンズワートなどの市販のサプリメント
- フェニトイン、カルバマゼピン、またはリファンピシン (これらの薬は、レメロンの血中濃度を低下させる可能性があります)
- シメチジンまたはケトコナゾール (これらの薬は、レメロンの血中濃度を上昇させる可能性があります)
- 心臓のリズムに影響を与える可能性のある薬(特定の抗生物質や抗精神病薬など)
- 持っているか持っていた:
- 肝臓の問題
- 腎臓の問題
- 心臓のリズムを変える可能性のある心臓の問題または特定の状態
- 発作または痙攣
- 双極性障害または躁病
- めまいや失神する傾向
- 妊娠している、または妊娠する予定がある。レメロンが胎児に害を及ぼすかどうかは不明です。妊娠中のうつ病治療の利点とリスクについて、担当の医療提供者に相談してください。
- 授乳中または授乳を計画している。レメロンの一部が母乳に移行することがあります。レメロンを服用している間、赤ちゃんに食事を与える最善の方法について、かかりつけの医療提供者に相談してください。
あなたが服用しているすべての薬について医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。レメロンと一部の薬は相互作用を起こしたり、効果がなかったり、深刻な副作用を引き起こす可能性があります。
レメロン 15mg を他の医薬品と一緒に服用しても安全かどうかは、かかりつけの医療提供者または薬剤師が教えてくれます。レメロンを服用している間は、最初に医療提供者に相談することなく、薬を開始または中止しないでください.レメロン 30mg を服用している場合は、レメロン 30mgSolTab® を含むミルタザピンを含む他の薬を服用しないでください。
レメロンの服用方法は?
- レメロンを処方どおりに服用してください。あなたの医療提供者は、あなたにとって適切な用量になるまで、REMERON 15mgの用量を変更する必要があるかもしれません.
- レメロンは毎日同じ時間に、できれば就寝前の夕方に服用してください。
- レメロン 15mg を指示どおりに飲み込んでください。
- レメロンなどの抗うつ薬は、気分が良くなるまでに数週間かかるのが一般的です.すぐに結果を感じない場合は、レメロン 15mg の服用を中止しないでください。
- 気分が良くなったとしても、最初に医師に相談することなく、レメロン 15mg の服用を中止したり、用量を変更したりしないでください。
- レメロンは食事の有無にかかわらず服用できます。
- レメロン 30mg を飲み忘れた場合は、気がついた時点ですぐに服用してください。次の服用時間が近い場合は、飲み忘れた分を飛ばして、次の通常の時間に服用してください。レメロン15mgを2回同時に服用しないでください。
- レメロン15mgを飲みすぎると、 すぐに医療提供者または毒物管理センターに電話するか、緊急治療を受けてください。レメロンの過剰摂取の兆候 (他の薬やアルコールなし) には、次のようなものがあります。
- 錯乱、
- メモリの問題
- 眠気
- 心拍数の増加。
過剰摂取の可能性のある症状には、心臓のリズムの変化(速くて不規則な心拍)または失神が含まれる場合があります。これは、Torsades de Pointesとして知られる生命を脅かす状態の症状である可能性があります.
レメロン 15mg を服用している間、何を避けるべきですか?
- レメロンは眠気を引き起こしたり、意思決定、明確な思考、迅速な反応に影響を与える可能性があります。 REMERON がどのように影響するかを理解するまでは、運転、重機の操作、またはその他の危険な活動を行ってはなりません。
- レメロンを服用している間は、アルコールを飲んだり、ジアゼパム(不安、不眠症、発作などに使用される薬)または類似の薬を服用したりしないでください.特定の薬がレメロン 30mg で服用できるかどうか不明な場合は、医師に相談してください。
レメロンの副作用にはどのようなものがありますか?
レメロンは深刻な副作用を引き起こす可能性があります:
- 「REMERON について知っておくべき最も重要な情報は何ですか?」を参照してください。
レメロンの最も一般的な副作用は次のとおりです。
- 眠気
- 便秘
- 食欲増進
- めまい
- 体重の増加
- 口渇異常夢
これらは、REMERON の考えられるすべての副作用ではありません。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
レメロンはどのように保管すればよいですか?
- レメロン 15mg は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
- レメロン 15mg は光を避けて保管してください。
- レメロン 30mg のボトルはしっかりと閉めて保管してください。
レメロン 30mg とすべての薬は子供の手の届かないところに保管してください。
レメロンの安全で効果的な使用に関する一般情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。レメロン 15mg は、処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っていても、レメロンを他の人に与えないでください.それらに害を及ぼす可能性があります。医療従事者向けに書かれたレメロン 30mg に関する情報については、薬剤師または医療提供者にお尋ねください。
レメロン15mgの成分は?
有効成分: ミルタザピン
不活性成分 :
- 15mg錠: デンプン(トウモロコシ)、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、コロイド状二酸化ケイ素、ラクトース、ヒプロメロース、ポリエチレングリコール8000、二酸化チタン、酸化第二鉄(黄色)。
- 30mg錠: デンプン(トウモロコシ)、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、コロイド状二酸化ケイ素、乳糖、ヒプロメロース、ポリエチレングリコール8000、二酸化チタン、酸化第二鉄(黄色)、酸化第二鉄(赤色)。
- 45mg錠: デンプン(トウモロコシ)、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、コロイド状二酸化ケイ素、ラクトース、ヒプロメロース、ポリエチレングリコール8000、二酸化チタン。
