Geodon 40mg, 80mg, 20mg Ziprasidone 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ジオドンとは何ですか?
Geodon は、統合失調症、統合失調症による急性興奮、および双極 I 型障害の症状を治療するために使用される処方薬です。 Geodon は、単独で使用することも、他の薬と併用することもできます。
Geodon 20mg は、抗精神病薬と呼ばれる薬物のクラスに属します。
Geodon が子供に安全で有効であるかどうかは不明です。
ジオドンの副作用にはどのようなものがありますか?
Geodon 20mg は、次のような重大な副作用を引き起こす可能性があります。
- 心臓の鼓動が速くなったり、ドキドキしたり、
- 胸の中でときめき、
- 呼吸困難、
- 突然のめまい、
- 顔の制御されていない筋肉の動き (噛む、唇を叩く、顔をしかめる、舌の動き、まばたきまたは目の動き)、
- あらゆる皮膚発疹、
- 熱、
- 口内炎、
- 皮膚のただれ、
- 喉の痛み、
- 咳、
- 呼吸困難、
- 喉の渇きが増し、
- 排尿の増加
- 口渇、
- フルーティーな口臭、
- 非常に硬い筋肉、
- 高熱、
- 発汗、
- 攪拌、および
- 錯乱
上記の症状がある場合は、すぐに医療機関を受診してください。
Geodon 40mgの最も一般的な副作用は次のとおりです。
- めまい、
- 眠気、
- 弱点、
- 吐き気、
- 嘔吐、
- 嚥下障害、
- 落ち着かない気持ち、
- 震え、
- 視力の問題、
- 鼻水と、
- 新しい咳または悪化した咳
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、プロメトリウムの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
認知症関連精神病の高齢患者における死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。 GEODON は、認知症関連の精神病の治療には承認されていません [警告と注意事項を参照]。
説明
GEODON 40mg は、経口投与用のカプセル (ジプラシドン塩酸塩) として、および筋肉内使用のみの注射 (ジプラシドンメシル酸塩) として入手できます。ジプラシドンは、フェノチアジンまたはブチロフェノン系抗精神病薬とは化学的に無関係な向精神薬です。分子量は 412.94 (遊離塩基) で、化学名は 5-[2-[4-(1,2-ベンゾイソチアゾール-3-イル)-1-ピペラジニル]エチル]-6-クロロ-1 です。 ,3-ジヒドロ-2H-インドール-2-オン。 C21H21ClN4OS (ジプラシドンの遊離塩基) の実験式は、次の構造式を表します。
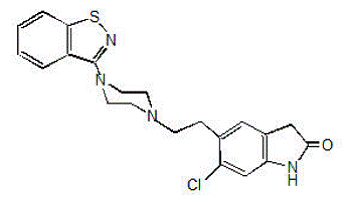
GEODON カプセルには、ジプラシドンの一塩酸塩、一水和物塩が含まれています。化学的には、塩酸ジプラシドン一水和物は、5-[2-[4-(1,2-ベンゾイソチアゾール-3-イル)-1-ピペラジニル]エチル]-6-クロロ-1,3-ジヒドロ-2H-インドール-2-オンです。 、一塩酸塩、一水和物。実験式は C21H21ClN4OS• HCl• H2O で、分子量は 467.42 です。ジプラシドン塩酸塩一水和物は、白色からわずかにピンク色の粉末です。
GEODON 20mg カプセルは、経口投与用に 20mg (青/白)、40mg (青/青)、60mg (白/白)、および 80mg (青/白) カプセルで提供されます。 GEODON 40mg カプセルには、塩酸ジプラシドン一水和物、乳糖、アルファ化デンプン、ステアリン酸マグネシウムが含まれています。
注射用GEODONには、メシル酸ジプラシドン三水和物の凍結乾燥形態が含まれています。化学的に、メシル酸ジプラシドン三水和物は、5-[2-[4-(1,2-ベンゾイソチアゾール-3-イル)-1-ピペラジニル]エチル]-6-クロロ-1,3-ジヒドロ-2H-インドール-2-オン、メタンスルホン酸塩、三水和物。実験式は C21H21ClN4OS・CH3SO3H・3H2O で、分子量は 563.09 です。
注射用 GEODON 40mg は、メシル酸ジプラシドンとして単回投与バイアルで入手できます (ラベルの指示に従って再構成した場合、ジプラシドン 20 mg/mL) [ 投薬と管理 ]。注射用メシル酸ジプラシドンの各 mL (再構成時) には、20 mg のジプラシドンと、294 mg のスルホブチルエーテル β-シクロデキストリン ナトリウム (SBECD) によって可溶化された 4.7 mg のメタンスルホン酸が含まれています。
適応症
GEODON は、統合失調症の治療、双極性躁病または混合エピソードの急性治療のための単剤療法、および双極性障害の維持治療のためのリチウムまたはバルプロ酸の補助として適応されます。 GEODON 筋肉内注射は、統合失調症患者の急性興奮に適応されます。治療を必要とする状態に対して利用可能な代替治療を決定する際、処方者は、他のいくつかの抗精神病薬と比較して、QT/QTc 間隔を延長するジプラシドンの能力が高いことを考慮する必要があります。 警告と注意事項 ]。 QTc 間隔の延長は、トルサード ド ポワント型不整脈、致死的となる可能性のある多形性心室頻拍、および突然死を引き起こす能力を持つ他のいくつかの薬物と関連しています。多くの場合、これは他の薬を最初に試す必要があるという結論につながります.ジプラシドンが torsade de pointes を引き起こしたり、突然死の割合を増加させたりするかどうかはまだわかっていません。 警告と注意事項 ]
統合失調症
- GEODON は、成人の統合失調症の治療に適応されます [ 臨床研究 ]。
双極 I 型障害 (急性の混合型または躁病エピソードおよびリチウムまたはバルプロ酸の補助としての維持療法)
- GEODON は、双極 I 型障害に関連する躁病エピソードまたは混合エピソードを有する成人の急性治療のための単剤療法として適応されます [参照 臨床研究 ]。
- GEODON 40mg は、成人の双極 I 型障害の維持治療のためのリチウムまたはバルプロ酸の補助として適応されます [参照 臨床研究 ]。
統合失調症における激越の急性治療
- GEODON 40mg の筋肉内投与は、ジプラシドンによる治療が適切であり、激越を迅速に制御するために抗精神病薬の筋肉内投与が必要な統合失調症成人患者の急性激越の治療に適応されます。 臨床研究 ]。
すでに経口ジプラシドンを服用している統合失調症患者にジプラシドンを筋肉内投与することの安全性に関する経験がないため、同時投与の実施は推奨されません。
投薬と管理
統合失調症
用量選択
GEODON 40mg カプセルは、1 日 20mg を 1 日 2 回、食事とともに服用してください。一部の患者では、その後、個々の臨床状態に基づいて 1 日 2 回 80 mg まで調整される場合があります。投与量の調整は、必要に応じて、通常は 2 日以上の間隔で行う必要があります。1 ~ 3 日以内に定常状態に達するためです。最低有効用量を確実に使用するために、患者は通常、用量の上方調整の前に数週間改善を観察する必要があります。
統合失調症における有効性は、短期間のプラセボ対照臨床試験で、1 日 2 回 20 mg から 100 mg の用量範囲で実証されました。 1 日 2 回 20 mg から 80 mg の範囲内で用量反応に向かう傾向がありましたが、結果には一貫性がありませんでした。一般に、1 日 2 回 80 mg を超える用量への増量は推奨されません。 1 日 2 回 100 mg を超える用量の安全性は、臨床試験で体系的に評価されていません [参照 臨床研究 ]。
維持治療
ジプラシドンで治療された患者がいつまでジプラシドンを服用し続けるべきかという疑問に答えるためのエビデンスはありませんが、症状が安定しており、ジプラシドンを継続するかプラセボに切り替えるように無作為化された患者の維持研究では、時間の遅れが示されましたGEODONを受けている患者の再発[を参照] 臨床研究 ]。 1 日 2 回 20 mg を超える用量では、追加の利点は示されませんでした。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります。
双極 I 型障害 (急性の混合型または躁病エピソードおよびリチウムまたはバルプロ酸の補助としての維持療法)
躁病または混合エピソードの急性治療
用量選択 - 経口ジプラシドンは、1 日 2 回 40 mg の初期用量を食事とともに投与する必要があります。その後、投与量は、治療の 2 日目に 60 mg または 80 mg の 1 日 2 回に増量され、その後、耐性と有効性に基づいて 40 mg ~ 80 mg の範囲内で 1 日 2 回調整されます。柔軟な用量の臨床試験では、投与された平均 1 日用量は約 120 mg でした [参照 臨床研究 ]。
維持療法(リチウムまたはバルプロ酸の補助として)
40 mg ~ 80 mg の範囲内で、患者が最初に安定したときと同じ用量で、1 日 2 回、食事とともに治療を続けます。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります[参照 臨床研究 ]。
統合失調症における激越の急性治療
筋肉内投与
推奨用量は 10 mg から 20 mg で、必要に応じて 1 日最大 40 mg まで投与されます。 2 時間ごとに 10 mg を投与できます。 4 時間ごとに 20 mg を 1 日最大 40 mg まで投与できます。ジプラシドンを 3 日以上連続して筋肉内投与する研究は行われていません。
長期治療が必要な場合は、できるだけ早く筋肉内投与を経口ジプラシドン塩酸塩カプセルに置き換える必要があります。
すでに経口ジプラシドンを服用している統合失調症患者にジプラシドンを筋肉内投与することの安全性に関する経験がないため、同時投与の実施は推奨されません。
ジプラシドン筋肉内注射は、筋肉内使用のみを目的としており、静脈内投与しないでください。
投与のための筋肉内製剤
注射用 GEODON (メシル酸ジプラシドン) は、筋肉内注射によってのみ投与されるべきであり、静脈内投与されるべきではありません。単回投与バイアルは、投与前に再構成する必要があります。
バイアルに 1.2 mL の注射用滅菌水を加え、すべての薬剤が溶解するまで激しく振ります。再構成された溶液の各 mL には、20 mg のジプラシドンが含まれています。 10 mg の用量を管理するには、再構成された溶液 0.5 mL を作成します。 20 mg の用量を管理するには、再構成された溶液 1.0 mL を作成します。未使用部分は廃棄する必要があります。この製品には防腐剤や静菌剤が含まれていないため、最終溶液の調製には無菌技術を使用する必要があります。この医薬品は、滅菌注射用水以外の他の医薬品または溶媒と混合してはなりません。非経口医薬品は、溶液と容器が許す限り、投与前に粒子状物質と変色がないか目視検査する必要があります。
供給方法
剤形と強度
ジオドンカプセル カプセルの色/サイズによって区別され、黒インクで「ファイザーと ZDX [投与量]」または「ファイザー」と固有の番号が刻印されています。 GEODON 40mg カプセルは、経口投与用に 20 mg (青/白)、40 mg (青/青)、60 mg (白/白)、および 80 mg (青/白) カプセルで提供されます。それらは、次の強度とパッケージ構成で提供されます。
注射用 GEODON は、メシル酸ジプラシドンとして単回投与バイアルで入手できます (ラベルの指示に従って再構成した場合、20 mg ジプラシドン/mL) [ 投薬と管理 ]。注射用ジプラシドン メシル酸塩 (再構成時) の各 mL は、20 mg のジプラシドンと 294 mg のスルホブチルエーテル β-シクロデキストリン ナトリウム (SBECD) によって可溶化されたメタンスルホン酸 4.7 mg を含む無色から淡いピンク色の溶液を提供します。
保管と取り扱い
ジオドンカプセル カプセルの色/サイズによって区別され、黒インクで「ファイザーおよび ZDX [用量強度]」または「ファイザー」と固有の番号が刻印されています。 GEODON 20mg カプセルは、経口投与用に 20mg (青/白)、40mg (青/青)、60mg (白/白)、および 80mg (青/白) カプセルで提供されます。それらは、次の強度とパッケージ構成で提供されます。
または
GEODON カプセルは 25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。
注射用 GEODON 80mg は、メシル酸ジプラシドンとして単回投与バイアルで入手できます (ラベルの指示に従って再構成した場合、ジプラシドン 20 mg/mL) [ 投薬と管理 ]。注射用ジプラシドン メシル酸塩 (再構成時) の各 mL は、20 mg のジプラシドンと 294 mg のスルホブチルエーテル β-シクロデキストリン ナトリウム (SBECD) によって可溶化されたメタンスルホン酸 4.7 mg を含む無色から淡いピンク色の溶液を提供します。
GEODON 注射用 40mg は 25°C (77°F) で保存する必要があります。 15°C から 30°C (59°F から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 乾燥した形で。光から保護します。再構成後、GEODON 注射用 40mg は、遮光した場合、15°C から 30°C (59°F から 86°F) で最大 24 時間、または冷蔵で最大 7 日間、2°C から 8 °C で保存できます。 °C (36°F から 46°F)。
配布元: Pfizer Inc. Roerig Division, NY, NY 10017. 改訂: 2020 年 10 月
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
経口ジプラシドンの臨床試験には、約 5700 人の患者および/またはジプラシドンの 1 回以上の投与にさらされた正常な被験者が含まれていました。これらの 5700 人のうち、4800 人以上が反復投与有効性試験に参加した患者であり、その経験は約 1831 患者年に相当します。これらの患者には次のものが含まれます。 (2) 双極性躁病試験に参加した 472 人の患者は、約 133 患者年の曝露に相当します。さらに 127 人の双極性障害患者が、約 74.7 患者年に及ぶジプラシドン曝露に相当する長期維持治療研究に参加しました。ジプラシドンによる治療の条件と期間には、非盲検試験と二重盲検試験、入院患者と外来患者の研究、および短期および長期の暴露が含まれていました。
筋肉内ジプラシドンの臨床試験には、ジプラシドンの 1 回以上の注射を受けた 570 人の患者および/または正常な被験者が含まれていました。これらの被験者のうち 325 人以上が、複数回投与を含む試験に参加しました。
曝露中の有害反応は、身体検査、バイタルサイン、体重、臨床検査、心電図、および眼科検査の結果だけでなく、自発的に報告された有害な経験を収集することによって得られました。
記載されている有害反応の頻度は、記載されている種類の治療に伴う有害反応を少なくとも 1 回経験した個人の割合を表しています。ベースライン評価後の治療中に反応が初めて発生した場合、または悪化した場合、反応は緊急治療と見なされました。
経口ジプラシドンによる短期のプラセボ対照試験で観察された有害な所見
以下の調査結果は、統合失調症 (2 つの 6 週間固定用量試験と 2 つの 4 週間固定用量試験のプール) および双極性躁病 (2 つの 3 週間可変用量試験のプール) に対する短期プラセボ対照市販前試験に基づいています。ジプラシドンが 10 ~ 200 mg/日の範囲の用量で投与された試験)。
短期プラセボ対照試験でよく観察される有害反応
次の有害反応は、ジプラシドンの使用に関連して最も一般的に観察された有害反応であり (5% 以上の発生率)、プラセボ治療を受けた患者と同等の発生率では観察されませんでした (ジプラシドンの発生率は少なくともプラセボの 2 倍でした)。
統合失調症の試験(表11を参照)
- 傾眠
- 気道感染症
双極性試験 (表 12 を参照)
- 傾眠
- 次の有害反応用語を含む錐体外路症状: 錐体外路症候群、筋緊張亢進、ジストニア、ジスキネジー、運動低下、振戦、麻痺およびけいれん。これらの有害反応はいずれも、双極性躁病試験で 10% を超える発生率で個別に発生することはありませんでした。
- 副作用用語のめまいと立ちくらみを含むめまい。
- アカシジア
- 異常な視力
- 無力症
- 嘔吐
統合失調症
経口ジプラシドンの短期プラセボ対照試験における治療中止に伴う有害反応
短期間のプラセボ対照試験でジプラシドン治療を受けた患者の約 4.1% (29/702) が、プラセボの約 2.2% (6/273) と比較して、有害反応のために治療を中止しました。ドロップアウトに関連する最も一般的な反応は発疹であり、プラセボを使用していない患者と比較して、ジプラシドン患者の発疹によるドロップアウトは 7 例 (1%) でした [ 警告と注意事項 ]。
短期、経口、プラセボ対照試験で、ジプラシドン治療を受けた患者で 2% 以上の発生率で発生した有害反応
表 11 は、主に統合失調症患者の急性治療中 (最大 6 週間) に発生した、最も近いパーセントに四捨五入された治療中に発生した有害反応の発生率を列挙しています。ジプラシドンで治療された患者の発生率は、プラセボで治療された患者の発生率よりも高かった.
短期、固定用量、プラセボ対照試験における有害反応の用量依存性
統合失調症の 4 試験プールにおける用量反応の分析により、以下の反応について用量に対する有害反応の明らかな関係が明らかになりました: 無力症、起立性低血圧、食欲不振、口渇、唾液分泌の増加、関節痛、不安、めまい、ジストニア、筋緊張亢進、傾眠、振戦、鼻炎、発疹、異常視力。
錐体外路症状 (EPS)
短期間のプラセボ対照統合失調症試験で、ジプラシドン治療を受けた患者で報告された EPS (錐体外路症候群、筋緊張亢進、ジストニア、ジスキネジー、運動低下、振戦、麻痺、痙攣などの有害反応用語を含む) の発生率は、14% 対 14% でした。プラセボで8%。 Simpson-Angus Rating Scale (EPS の場合) および Barnes Akathia Scale (アカシジアの場合) に関するこれらの試験から客観的に収集されたデータは、一般に、ジプラシドンとプラセボの違いを示しませんでした。
ジストニア
クラス効果: ジストニアの症状、筋群の長期にわたる異常な収縮が、治療の最初の数日間に影響を受けやすい個人に発生する可能性があります。ジストニアの症状には、首の筋肉のけいれん、時には喉の圧迫感、嚥下困難、呼吸困難、および/または舌の突出が含まれます.これらの症状は低用量でも発生する可能性がありますが、第 1 世代の抗精神病薬の用量が多いほど、より頻繁に発生し、重症度が高くなります。急性ジストニアのリスクの上昇は、男性および若い年齢層で観察されます。
バイタルサインの変化
ジプラシドンは起立性低血圧と関連している[参照 警告と注意事項 ]
心電図の変化
ジプラシドンは、QTc 間隔の増加と関連しています [参照 警告と注意事項 ]。統合失調症の試験では、ジプラシドンは、プラセボ患者では毎分0.2拍の減少と比較して、毎分1.4拍の心拍数の平均増加と関連していました.
経口ジプラシドンの市販前評価中に観察されたその他の有害反応
以下は、3834 人の患者のデータベース内で統合失調症試験において 4 mg/日を超える複数回投与でジプラシドンで治療された患者によって報告された、副作用セクションの導入部で定義されている、治療に起因する有害反応を反映する COSTART 用語のリストです。報告されたすべての反応は、表 11 またはその他のラベルに既に記載されているもの、一般的すぎて参考にならない反応用語、一度しか報告されておらず、急性の生命を脅かす可能性が実質的になかった反応、治療されている病気の一部であるか、バックグラウンド反応として一般的であり、薬物に関連する可能性は低いと考えられる反応.報告された反応はジプラシドンによる治療中に発生しましたが、必ずしもそれによって引き起こされたわけではないことを強調することが重要です.
有害反応は、身体システムによってさらに分類され、次の定義に従って頻度の低い順にリストされます。
頻繁 - 少なくとも 1/100 人の患者 (患者の 1.0% 以上) で発生する有害反応 (プラセボ対照試験の集計結果にまだ記載されていないもののみがこのリストに表示されます);
まれ - 1/100 から 1/1000 の患者に発生する副作用 (患者の 0.1-1.0%)
まれ - 1/1000 人未満の患者 (患者の 0.1% 未満) で発生する有害反応。
体全体
頻発する腹痛、インフルエンザ症候群、発熱、転倒、顔面浮腫、悪寒、光線過敏症、側腹部痛、低体温症、交通事故
心臓血管系
頻脈、高血圧、起立性低血圧
まれな徐脈、狭心症、心房細動
まれな第1度房室ブロック、脚ブロック、静脈炎、肺塞栓、心肥大、脳梗塞、脳血管障害、深部血栓性静脈炎、心筋炎、血栓性静脈炎
消化器系
頻繁な食欲不振、嘔吐
まれな直腸出血、嚥下障害、舌浮腫
稀な歯肉出血、黄疸、宿便、ガンマグルタミルトランスペプチダーゼ上昇、吐血、胆汁うっ滞性黄疸、肝炎、肝腫大、口内白板症、脂肪肝沈着、下血
内分泌
まれな甲状腺機能低下症、甲状腺機能亢進症、甲状腺炎
血液とリンパ系
まれな貧血、斑状出血、白血球増加症、白血球減少症、好酸球増加症、リンパ節腫脹
まれな血小板減少症、淡色性貧血、リンパ球増加症、単球症、好塩基球増加症、リンパ浮腫、赤血球増加症、血小板血症
代謝および栄養障害
まれな喉の渇き、トランスアミナーゼの増加、末梢性浮腫、高血糖、クレアチンホスホキナーゼの増加、アルカリホスファターゼの増加、高コレステロール血症、脱水、乳酸脱水素酵素の増加、アルブミン尿、低カリウム血症
レアBUN上昇、クレアチニン上昇、高脂血症、低コレステロール血症、高カリウム血症、低塩素血症、低血糖、低ナトリウム血症、低タンパク血症、耐糖能低下、痛風、高塩素血症、高尿酸血症、低カルシウム血症、低血糖、低マグネシウム血症、ケトーシス、呼吸性アルカローシス
筋骨格系
頻繁な筋肉痛
まれな腱鞘炎
まれなミオパチー
神経系
頻発、錐体外路症候群、振戦、ジストニア、筋緊張亢進、ジスキネジー、敵意、けいれん、感覚異常、錯乱、めまい、運動機能低下、運動亢進、異常歩行、眼科発作、感覚鈍麻、運動失調、記憶喪失、歯車硬直、せん妄、筋緊張低下、無動症、構音障害、離脱症候群、頬舌症候群、舞踏病アテトーゼ、複視、協調運動失調、神経障害
まれな麻痺
まれなミオクローヌス、眼振、斜頸、口周囲の感覚異常、後屈緊張、反射亢進、開口障害
呼吸器系
頻繁な呼吸困難
まれな肺炎、鼻出血
まれな喀血、喉頭
皮膚と付属物
まれな丘疹性発疹、蕁麻疹、脱毛症、湿疹、剥脱性皮膚炎、接触性皮膚炎、水疱性発疹
特別な感覚
頻繁な真菌性皮膚炎
まれな結膜炎、ドライアイ、耳鳴り、眼瞼炎、白内障、羞明
まれな眼の出血、視野欠損、角膜炎、角結膜炎
泌尿生殖器系
まれなインポテンス、異常な射精、無月経、血尿、月経過多、女性の授乳、多尿、尿閉の不正出血、男性の性機能障害、無オルガスミア、糖尿
まれな女性化乳房、膣出血、夜間頻尿、乏尿、女性性機能障害、子宮出血
双極性障害
躁病または混合エピソードの急性治療
短期間のプラセボ対照試験における治療中止に伴う有害反応
短期間のプラセボ対照試験でジプラシドン治療を受けた患者の約 6.5% (18/279) が、プラセボの約 3.7% (5/136) と比較して、有害反応のために治療を中止しました。ジプラシドン治療を受けた患者のドロップアウトに関連する最も一般的な反応は、アカシジア、不安、抑うつ、めまい、ジストニア、発疹、嘔吐であり、ジプラシドン患者ではこれらの反応のそれぞれで 2 つのドロップアウト (1%) であったのに対し、プラセボ患者はそれぞれ 1 人でした。ジストニアと発疹 (1%) と残りの有害反応のプラセボ患者。
短期、経口、プラセボ対照試験で、ジプラシドン治療を受けた患者で 2% 以上の発生率で発生した有害反応
表12は、双極性躁病患者の急性治療中(最大3週間)に発生した治療に伴う有害反応の発生率を、最も近いパーセントに四捨五入して列挙しています。ジプラシドンで治療された患者の発生率は、プラセボで治療された患者の発生率よりも高かった.
性別に基づく相互作用の調査では、この人口統計学的要因に基づく有害反応の発生に臨床的に意味のある違いは明らかになりませんでした。
筋肉内ジプラシドン
筋肉内ジプラシドンの短期試験におけるジプラシドン治療患者の1%以上の発生率で発生する有害反応
表 13 は、ジプラシドンの筋肉内投与による急性治療中に 1% 以上の患者で発生した治療に伴う有害反応の発生率を、最も近いパーセントに四捨五入して列挙しています。
これらの研究では、筋肉内ジプラシドンの使用に関連して最も一般的に観察された有害反応 (5% 以上の発生率) および筋肉内ジプラシドン (高用量グループ) で観察された割合は、最低筋肉内ジプラシドン グループの少なくとも 2 倍でした。頭痛 (13%)、吐き気 (12%)、傾眠 (20%) でした。
市販後の経験
GEODONの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
市場導入以降に受領された、上記に記載されていない副作用報告には、以下のまれな発生が含まれます。 警告と注意事項 ];消化器系の病気: 舌の腫れ;生殖器系および乳房障害:乳汁漏出症、持続勃起症。神経系障害:顔面下垂、神経弛緩性悪性症候群、セロトニン症候群(単独またはセロトニン作動薬との併用)、遅発性ジスキネジア。精神障害:不眠症、躁病/軽躁病。皮膚および皮下組織障害:アレルギー反応(アレルギー性皮膚炎、血管性浮腫、口腔顔面浮腫、蕁麻疹など)、発疹、好酸球増加症および全身症状を伴う薬物反応(DRESS)。泌尿生殖器系障害:夜尿症、尿失禁。血管障害:体位性低血圧、失神。
薬物相互作用
薬物間相互作用は、薬力学的 (複合的な薬理学的効果) または薬物動態 (血漿レベルの変化) である可能性があります。ジプラシドンを他の薬剤と組み合わせて使用するリスクは、以下のように評価されています。すべての相互作用研究は経口ジプラシドンで実施されています。ジプラシドンの薬力学的および薬物動態学的プロファイルに基づいて、相互作用の可能性が予想されます。
代謝経路
ジプラシドンの約 3 分の 2 は、グルタチオンによる化学的還元とアルデヒドオキシダーゼによる酵素的還元の組み合わせによって代謝されます。アルデヒドオキシダーゼの既知の臨床的に関連する阻害剤または誘導剤はありません。ジプラシドン代謝クリアランスの 3 分の 1 未満は、シトクロム P450 触媒酸化によって媒介されます。
インビトロ研究
ヒト肝ミクロソームを利用した in vitro 酵素阻害研究では、ジプラシドンは CYP1A2、CYP2C9、CYP2C19、CYP2D6、および CYP3A4 に対してほとんど阻害効果がなく、したがって、これらの酵素によって主に代謝される薬物の代謝を妨害しない可能性が高いことが示されました。置換によるジプラシドンとの薬物相互作用の可能性はほとんどありません。 臨床薬理学 ]。
薬力学的相互作用
Ziprasidone は、QT 間隔を延長する薬剤と一緒に使用すべきではありません。 禁忌 ]。
ジプラシドンの主な中枢神経系への影響を考えると、他の中枢作用薬と組み合わせて服用する場合は注意が必要です。
低血圧を誘発する可能性があるため、ジプラシドンは特定の降圧剤の効果を高める可能性があります。
ジプラシドンは、レボドパおよびドーパミン作動薬の効果に拮抗する可能性があります。
薬物動態学的相互作用
カルバマゼピン
カルバマゼピンは CYP3A4 のインデューサーです。 200 mg を 1 日 2 回、21 日間投与すると、ジプラシドンの AUC が約 35% 減少しました。より高用量のカルバマゼピンを投与すると、この効果が大きくなる可能性があります。
ケトコナゾール
CYP3A4 の強力な阻害剤であるケトコナゾールは、400 mg QD の用量で 5 日間、ジプラシドンの AUC および Cmax を約 35 ~ 40% 増加させました。 CYP3A4 の他の阻害剤にも同様の効果があると予想されます。
シメチジン
シメチジン 800 mg QD を 2 日間投与しても、ジプラシドンの薬物動態に影響はありませんでした。
制酸剤
30 mL の Maalox® とジプラシドンの同時投与は、ジプラシドンの薬物動態に影響を与えませんでした。
リチウム
ジプラシドン 40 mg を 1 日 2 回、リチウムを 450 mg を 1 日 2 回、7 日間併用投与しても、リチウムの定常状態レベルまたは腎クリアランスに影響はありませんでした。双極性障害患者の維持試験でリチウムに補助的に投与されたジプラシドンは、平均治療リチウムレベルに影響を与えませんでした。
経口避妊薬
in vivo 研究では、エストロゲンまたはプロゲステロン成分の薬物動態に対するジプラシドンの影響がないことが明らかになりました。 1 日 2 回 20 mg の用量のジプラシドンは、併用投与された経口避妊薬、エチニル エストラジオール (0.03 mg) およびレボノルゲストレル (0.15 mg) の薬物動態に影響を与えませんでした。
デキストロメトルファン
in vitro の結果と一致して、正常な健康なボランティアを対象とした研究では、ジプラシドンが CYP2D6 モデルの基質であるデキストロメトルファンの代謝を主要な代謝産物であるデキストロルファンに変化させないことが示されました。尿中のデキストロメトルファン/デキストロルファン比に統計的に有意な変化はありませんでした。
バルプロ酸
ジプラシドンとバルプロ酸の薬物動態学的相互作用は、2 つの薬剤に共通の代謝経路がないため、ありそうにありません。双極性患者の維持試験でバルプロ酸に補助的に投与されたジプラシドンは、平均治療バルプロ酸レベルに影響を与えませんでした。
その他の併用薬物療法
対照臨床試験に登録された統合失調症患者の母集団薬物動態分析では、ベンズトロピン、プロプラノロール、またはロラゼパムとの臨床的に重要な薬物動態相互作用の証拠は明らかにされていません。
食物相互作用
摂食条件下での 20 mg 用量の絶対バイオアベイラビリティは、約 60% です。ジプラシドンの吸収は、食物の存在下で 2 倍まで増加します [ 臨床薬理学 ]。
警告
の一部として含まれています "予防" セクション
予防
認知症関連精神病の高齢患者における死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。主に非定型抗精神病薬を服用している患者を対象とした 17 のプラセボ対照試験 (モーダル期間 10 週間) の分析により、薬物治療を受けた患者の死亡リスクは、プラセボ治療を受けた患者の死亡リスクの 1.6 ~ 1.7 倍であることが明らかになりました。典型的な 10 週間の対照試験の過程で、薬物治療を受けた患者の死亡率は約 4.5% であり、プラセボ群では約 2.6% でした。
死因はさまざまであるが、ほとんどの死因は心血管疾患(例、心不全、突然死)または感染症(例、肺炎)のいずれかであると思われた。 GEODON は、認知症関連の精神病患者の治療には承認されていません。 [見る ボックス警告 、 認知症関連精神病の高齢患者における脳卒中を含む脳血管有害反応 ]。
認知症関連精神病の高齢患者における脳卒中を含む脳血管有害反応
認知症の高齢者を対象としたプラセボ対照試験では、リスペリドン、アリピプラゾール、およびオランザピンに無作為に割り付けられた患者は、脳卒中および致命的な脳卒中を含む一過性脳虚血発作の発生率が高かった. GEODON は、認知症関連の精神病患者の治療には承認されていません。 ボックス警告 と 認知症関連精神病の高齢患者における死亡率の増加 ]。
QT延長と突然死のリスク
Ziprasidone の使用は、QTc 間隔を延長することが知られている他の薬剤との併用を避ける必要があります。 禁忌 と 薬物相互作用 ]。さらに、臨床医は、QTc間隔を延長することが一貫して観察されている他の薬物の特定に注意する必要があります.そのような薬はジプラシドンと一緒に処方されるべきではありません。ジプラシドンは、先天性 QT 延長症候群の患者および心不整脈の病歴のある患者でも避けるべきである [参照 禁忌 ]。
経口ジプラシドンの QT/QTc 延長効果を、統合失調症の治療に有効ないくつかの他の薬物と直接比較する研究が、ボランティア患者で実施されました。試験の第 1 段階では、薬物を単独で投与したときの最大血漿濃度の時点で ECG を取得しました。試験の第 2 段階では、薬物が薬物の CYP4503A4 代謝の阻害剤と同時投与されている間、最大血漿濃度の時点で ECG が取得されました。
研究の第 1 段階では、QT 間隔に対する心拍数の影響を除去するサンプルベースの補正を使用して、ベースラインからの QTc の平均変化を各薬剤について計算しました。ジプラシドンのベースラインからの QTc の平均増加は、4 つの比較薬 (リスペリドン、オランザピン、クエチアピン、およびハロペリドール) よりも約 9 ~ 14 ミリ秒大きかったが、チオリダジンで観察された延長よりも約 14 ミリ秒短かった。
研究の第 2 段階では、QTc の長さに対するジプラシドンの効果は、代謝阻害剤 (ケトコナゾール 200 mg を 1 日 2 回) の存在によって増強されませんでした。
プラセボ対照試験では、経口ジプラシドンは、1 日最高推奨用量 160 mg で、プラセボと比較して QTc 間隔を約 10 ミリ秒延長しました。経口ジプラシドンを用いた臨床試験では、GEODON 80mg を投与された 2988 人中 2 人 (0.06%) の患者とプラセボを投与された 1 人中 440 人 (0.23%) の患者の心電図で、500 ミリ秒の潜在的に臨床的に関連する閾値を超える QTc 間隔が明らかになりました。ジプラシドンで治療された患者では、どちらの場合もジプラシドンの役割を示唆していませんでした。 1 人の患者は QTc 延長の病歴があり、スクリーニング測定値は 489 ミリ秒でした。ジプラシドン治療中のQTcは503ミリ秒でした。他の患者は、ジプラシドンによる治療の終了時に 391 ミリ秒の QTc を有し、チオリダジンに切り替えると、518 および 593 ミリ秒の QTc 測定値を経験しました。
QT/QTc 間隔を延長するいくつかの薬は、トルサード ド ポワントの発生および原因不明の突然死に関連しています。 QT延長とtorsade de pointesの関係は、増加が大きい場合(20ミリ秒以上)に最も明確ですが、QT/QTc延長が小さい場合もリスクが増加するか、感受性のある個人でリスクが増加する可能性があります.トルサード ド ポワントは、市販前の研究でジプラシドンの使用に関連して観察されておらず、経験があまりにも限られており、リスクの増加を除外することはできませんが、まれに市販後の報告があります (複数の交絡因子の存在下で) [を参照してください。 有害反応 ]。
対照として筋肉内ハロペリドールを用いた、筋肉内ジプラシドンの QT/QTc 延長効果を評価する研究が患者志願者で実施されました。この試験では、4 時間間隔でジプラシドン (20 mg、次に 30 mg) またはハロペリドール (7.5 mg、次に 10 mg) を 2 回注射した後の最大血漿濃度の時点で ECG が得られました。筋肉内ジプラシドンの 30 mg の用量は、推奨される治療用量よりも 50% 高いことに注意してください。ベースラインからの QTc の平均変化は、QT 間隔に対する心拍数の影響を除去するサンプルベースの補正を使用して、各薬物について計算されました。ジプラシドンのベースラインからの QTc の平均増加は、1 回目の注射では 4.6 ミリ秒、2 回目の注射では 12.8 ミリ秒でした。ハロペリドールのベースラインからの QTc の平均増加は、1 回目の注射では 6.0 ミリ秒、2 回目の注射では 14.7 ミリ秒でした。この研究では、QTc 間隔が 500 ミリ秒を超える患者はいなかった。
他の抗精神病薬やプラセボと同様に、ジプラシドンを推奨用量で服用している患者で原因不明の突然死が報告されています.ジプラシドンの市販前の経験では、他の抗精神病薬やプラセボと比較して、ジプラシドンの過剰な死亡リスクは明らかになりませんでしたが、特に実薬対照やプラセボとして使用された薬剤では、暴露の程度は限定的でした。それにもかかわらず、他のいくつかの抗精神病薬と比較して、ジプラシドンのQTc長の延長が大きいことは、統合失調症を治療するために利用可能な他の薬よりも、ジプラシドンの方が突然死のリスクが高い可能性を高めます.この可能性は、代替医薬品を決定する際に考慮する必要があります[参照 適応症 ]。
特定の状況では、(1) 徐脈を含む QTc 間隔を延長する薬剤の使用に関連して、トルサード ド ポワントおよび/または突然死の発生リスクが高まる可能性があります。 (2) 低カリウム血症または低マグネシウム血症; (3)QTc間隔を延長する他の薬剤の併用。 (4)QT間隔の先天性延長の存在。
重大な電解質障害、特に低カリウム血症のリスクがあるジプラシドン治療を検討している患者は、ベースラインの血清カリウムおよびマグネシウム測定値を取得することをお勧めします。低カリウム血症 (および/または低マグネシウム血症) は、QT 延長および不整脈のリスクを高める可能性があります。低カリウム血症は、利尿薬療法、下痢、およびその他の原因によって生じることがあります。血清カリウムおよび/またはマグネシウムが低い患者は、治療を進める前にこれらの電解質を補充する必要があります.ジプラシドン治療中に利尿薬療法が導入された患者では、血清電解質を定期的に監視することが不可欠です。持続的に延長された QTc 間隔も、さらなる延長と不整脈のリスクを高める可能性がありますが、ルーチンのスクリーニング ECG 測定がそのような患者の検出に有効であるかどうかは明らかではありません。むしろ、QT延長、最近の急性心筋梗塞、非代償性心不全、または不整脈などの重大な心血管疾患の病歴を持つ患者では、ジプラシドンを避けるべきです。 QTc 測定値が 500 ミリ秒を超えて持続することが判明した患者では、ジプラシドンを中止する必要があります。
ジプラシドンを服用している患者で、めまい、動悸、失神などのトルサード ド ポワントの発生を示す可能性のある症状がある場合、処方者はさらなる評価を開始する必要があります。たとえば、ホルター モニタリングが役立つ場合があります。
悪性症候群(NMS)
抗精神病薬の投与に関連して、神経弛緩性悪性症候群 (NMS) と呼ばれることもある致命的な症状の複合体が報告されています。 NMS の臨床症状は、高熱、筋肉の硬直、精神状態の変化、および自律神経系の不安定性 (不規則な脈拍または血圧、頻脈、発汗、および不整脈) の証拠です。追加の徴候には、クレアチニンホスホキナーゼの上昇、ミオグロビン尿症 (横紋筋融解症)、および急性腎不全が含まれる場合があります。
この症候群の患者の診断評価は複雑です。診断を下す際には、臨床症状に深刻な医学的疾患(例、肺炎、全身感染症など)と未治療または不十分な治療を受けた錐体外路徴候および症状(EPS)の両方が含まれる症例を除外することが重要です。鑑別診断におけるその他の重要な考慮事項には、中枢性抗コリン作動性毒性、熱射病、薬物熱、および原発性中枢神経系 (CNS) の病理が含まれます。
NMS の管理には以下が含まれるべきです。 (2) 集中的な対症療法と医学的モニタリング。 (3) 特定の治療法が利用可能な付随する深刻な医学的問題の治療。 NMS の特定の薬理学的治療レジメンについては、一般的な合意はありません。
患者が NMS からの回復後に抗精神病薬治療を必要とする場合、薬物療法の再導入の可能性を慎重に検討する必要があります。 NMSの再発が報告されているため、患者を注意深く監視する必要があります。
重度の皮膚有害反応
好酸球増加症および全身症状を伴う薬物反応 (DRESS)
好酸球増加症および全身症状(DRESS)を伴う薬物反応は、ジプラシドン暴露で報告されています。 DRESS は、皮膚反応(発疹や剥脱性皮膚炎など)、好酸球増加症、発熱、リンパ節腫脹、および肝炎、腎炎、肺炎、心筋炎、心膜炎などの 1 つ以上の全身性合併症の 3 つ以上の組み合わせで構成されています。 DRESSは時々致命的です。 DRESSが疑われる場合は、ジプラシドンを中止してください。
その他の重度の皮膚有害反応
スティーブンス・ジョンソン症候群などの他の重度の皮膚副作用が、ジプラシドン曝露で報告されています。重篤な皮膚の有害反応は、時には致命的です。重度の皮膚副作用が疑われる場合は、ジプラシドンを中止してください。
遅発性ジスキネジア
抗精神病薬による治療を受けている患者では、潜在的に不可逆的で不随意の運動異常の症候群が発生する可能性があります。この症候群の有病率は高齢者、特に年配の女性の間で最も高いようですが、抗精神病薬治療の開始時に、どの患者がこの症候群を発症する可能性があるかを予測するために有病率の推定に頼ることは不可能です。抗精神病薬製品が遅発性ジスキネジアを引き起こす可能性が異なるかどうかは不明です。
遅発性ジスキネジアを発症するリスクとそれが不可逆的になる可能性は、治療期間と患者に投与される抗精神病薬の総累積用量が増加するにつれて増加すると考えられています。しかし、この症候群は、低用量での比較的短い治療期間の後に発生する可能性がありますが、それほど一般的ではありません.
遅発性ジスキネジアの確立された症例に対する既知の治療法はありませんが、抗精神病薬治療を中止すると、症候群は部分的または完全に寛解する可能性があります.しかし、抗精神病薬の治療自体が症候群の徴候や症状を抑制 (または部分的に抑制) する可能性があり、それによって根底にあるプロセスを覆い隠す可能性があります。症状の抑制が症候群の長期経過に及ぼす影響は不明です。
これらの考慮事項を考慮すると、遅発性ジスキネジアの発生を最小限に抑える可能性が最も高い方法でジプラシドンを処方する必要があります。慢性抗精神病治療は、一般に、(1) 抗精神病薬に反応することが知られている慢性疾患に苦しむ患者、および (2) 同等に効果的であるが潜在的に害の少ない代替治療が利用できない、または適切でない患者に限定されるべきです。慢性的な治療を必要とする患者では、満足のいく臨床反応をもたらす最小用量と最短の治療期間を追求する必要があります。継続的な治療の必要性は、定期的に再評価する必要があります。
ジプラシドンを服用している患者に遅発性ジスキネジアの徴候と症状が現れた場合は、薬剤の中止を検討する必要があります。ただし、一部の患者は、症候群の存在にもかかわらず、ジプラシドンによる治療が必要になる場合があります。
代謝変化
非定型抗精神病薬は、心血管/脳血管のリスクを高める可能性のある代謝変化と関連しています。これらの代謝変化には、高血糖症、脂質異常症、および体重増加が含まれます。このクラスのすべての薬が何らかの代謝変化を引き起こすことが示されていますが、各薬には独自のリスクプロファイルがあります.
高血糖と糖尿病
非定型抗精神病薬で治療された患者では、場合によっては極端でケトアシドーシスまたは高浸透圧性昏睡または死亡に関連する高血糖および真性糖尿病が報告されています。 GEODON で治療された患者における高血糖または糖尿病の報告はほとんどありません。 GEODON で治療された患者は少ないが、この限られた経験がそのような報告が少ない唯一の理由であるかどうかは不明である.非定型抗精神病薬の使用とグルコース異常との関係の評価は、統合失調症患者における真性糖尿病のバックグラウンドリスクの増加の可能性と、一般集団における真性糖尿病の発生率の増加の可能性によって複雑になっています。これらの交絡因子を考慮すると、非定型抗精神病薬の使用と高血糖関連の有害反応との関係は完全には理解されていません。非定型抗精神病薬で治療された患者における高血糖関連の有害反応の正確なリスク推定値は入手できません。
非定型抗精神病薬を開始した真性糖尿病の診断が確立された患者は、定期的に血糖コントロールの悪化を監視する必要があります。糖尿病の危険因子(例、肥満、糖尿病の家族歴)を持ち、非定型抗精神病薬による治療を開始する患者は、治療開始時と治療中定期的に空腹時血糖検査を受けるべきです。非定型抗精神病薬で治療された患者は、多飲、多尿、多食、衰弱などの高血糖の症状を監視する必要があります。非定型抗精神病薬による治療中に高血糖の症状を発症した患者は、空腹時血糖検査を受ける必要があります。場合によっては、非定型抗精神病薬を中止すると高血糖が解消されます。しかし、一部の患者は、疑わしい薬物の中止にもかかわらず、抗糖尿病治療の継続を必要としました。
統合失調症および双極性障害における短期のプラセボ対照試験から集められたデータを表 1 ~ 4 に示します。統合失調症と双極性障害の両方における柔軟な用量研究では、各被験者は、被験者のモーダル 1 日用量に基づいて、低用量 (20 ~ 40 mg BID) または高用量 (60 ~ 80 mg BID) のいずれかを受けたとして分類されることに注意してください。カテゴリ別の変化を示す表では、パーセンテージ (% 列) は 100x(n/N) として計算されます。

統合失調症における長期 (少なくとも 1 年間) のプラセボ対照の可変用量研究では、ジプラシドン 20-40 mg BID のベースラインからのランダムグルコースの平均変化は -3.4 mg/dL (N=122) でした。ジプラシドン 60 ~ 80 mg の場合、BID は +1.3 mg/dL でした (N=10)。プラセボでは+0.3 mg/dL (N=71)でした。
脂質異常症
非定型抗精神病薬で治療された患者では、脂質の望ましくない変化が観察されています。統合失調症および双極性障害における短期のプラセボ対照研究から集められたデータを表 5 ~ 8 に示します。
統合失調症における長期 (少なくとも 1 年間) のプラセボ対照の可変用量研究では、ジプラシドン 20-40 mg BID のランダムトリグリセリドのベースラインからの平均変化は +26.3 mg/dL (N=15) でした。ジプラシドン 60 ~ 80 mg の場合、BID は -39.3 mg/dL (N=10) でした。プラセボでは+12.9 mg/dL (N=9)でした。統合失調症における長期 (少なくとも 1 年間) のプラセボ対照の可変用量研究では、ジプラシドン 20-40 mg BID のランダム総コレステロールのベースラインからの平均変化は +2.5 mg/dL (N=14) でした。ジプラシドン 60 ~ 80 mg の場合、BID は -19.7 mg/dL (N=10) でした。プラセボでは-28.0 mg/dL (N=9)でした。
体重の増加
非定型抗精神病薬の使用により、体重増加が観察されています。体重のモニタリングをお勧めします。統合失調症および双極性障害における短期のプラセボ対照試験から集めたデータを表 9 ~ 10 に示します。
統合失調症における長期 (少なくとも 1 年間) のプラセボ対照の可変用量試験では、ジプラシドン 20-40 mg BID のベースライン体重からの平均変化は -2.3 kg (N=124) でした。ジプラシドン 60 ~ 80 mg の場合、BID は +2.5 kg (N=10) でした。プラセボでは-2.9kg(N=72)でした。同じ長期試験で、ジプラシドン 20~40 mg BID のベースラインから体重が 7% 以上増加した被験者の割合は 5.6% (N=124) でした。ジプラシドン 60-80 mg BID は 20.0% (N=10)、プラセボは 5.6% (N=72) でした。統合失調症における長期 (少なくとも 1 年間) のプラセボ対照固定用量研究では、ジプラシドン 20 mg BID のベースライン体重からの平均変化は -2.6 kg (N=72) でした。ジプラシドン 40 mg の場合、BID は -3.3 kg (N=69) でした。ジプラシドン 80 mg BID は -2.8 kg (N=70)、プラセボは -3.8 kg (N=70) でした。同じ長期固定用量統合失調症研究では、ジプラシドン 20 mg BID のベースラインから体重が 7% 以上増加した被験者の割合は 5.6% (N=72) でした。ジプラシドン 40 mg の BID は 2.9% (N=69) でした。ジプラシドン 80 mg BID は 5.7% (N=70)、プラセボは 2.9% (N=70) でした。
統合失調症
体重の 7% 以上の体重増加基準を満たす患者の割合が、4 週間および 6 週間のプラセボ対照統合失調症臨床試験のプールで比較され、ジプラシドン (10% ) プラセボ (4%) と比較して。プラセボ患者では体重変化の中央値がなかったのに対し、ジプラシドン患者では中央値で 0.5 kg の体重増加が観察されました。この一連の臨床試験では、ジプラシドン患者とプラセボ患者のそれぞれ 0.4% と 0.4% で体重増加が副作用として報告されました。ジプラシドンによる長期治療中、ボディマス指数(BMI)に基づいたベースラインでの患者の分類により、低体重の患者で最大の平均体重増加と臨床的に有意な体重増加(体重の> 7%)の発生率が最も高いことが明らかになりました。 BMI (27) と比較。ベースライン BMI が「低い」患者では平均 1.4 kg の体重増加、「正常」BMI の患者では平均変化なし、「高い」BMI でプログラムに参加した患者では平均 1.3 kg の体重減少がありました。 BMI。
双極性障害
リチウムまたはバルプロ酸の補助としてジプラシドンを使用した成人における 6 か月のプラセボ対照双極維持試験中、二重盲検期間中の臨床的に有意な体重増加 (体重の 7% 以上) の発生率は、両方のジプラシドンで 5.6% でした。再発の観察の6ヶ月を完了したプラセボ治療群。これらの調査結果の解釈は、ジプラシドンに十分に耐えられる患者のみが研究の二重盲検段階に入り、非盲検段階でかなりの脱落があったことを考慮に入れる必要があります。
発疹
ジプラシドンの市販前試験では、患者の約 5% が発疹および/または蕁麻疹を発症し、これらの症例の約 6 分の 1 で治療が中止されました。発疹の発生は、ジプラシドンの投与量に関連していましたが、この発見は、高用量の患者におけるより長い曝露時間によっても説明される可能性があります.発疹のある何人かの患者は、WBC の上昇など、関連する全身疾患の徴候と症状を示していました。ほとんどの患者は、抗ヒスタミン剤またはステロイドによる補助治療および/またはジプラシドンの中止により、速やかに改善し、これらの反応を経験したすべての患者は完全に回復したと報告されました。別の病因を特定できない発疹が現れたら、ジプラシドンを中止する必要があります。
起立性低血圧
ジプラシドンは、おそらくそのα1アドレナリン拮抗薬の特性を反映して、めまい、頻脈、および一部の患者では失神を伴う起立性低血圧を誘発する可能性があり、特に最初の用量漸増期間中に.ジプラシドンで治療された患者の 0.6% で失神が報告されました。
ジプラシドンは、既知の心血管疾患(心筋梗塞または虚血性心疾患の病歴、心不全または伝導異常)、脳血管疾患、または患者が低血圧になりやすい状態(脱水、循環血液量減少、および降圧薬による治療)のある患者には特に注意して使用する必要があります。薬)。
滝
抗精神病薬 (GEODON を含む) は、傾眠、起立性低血圧、運動および感覚の不安定を引き起こし、転倒につながる可能性があり、その結果、骨折やその他の怪我を引き起こす可能性があります。これらの影響を悪化させる可能性のある疾患、状態、または薬を服用している患者については、抗精神病治療を開始するときに転倒リスク評価を完了し、長期の抗精神病治療を受けている患者については繰り返します。
白血球減少症、好中球減少症、および無顆粒球症
臨床試験および市販後の経験では、抗精神病薬に一時的に関連する白血球減少症/好中球減少症のイベントが報告されています。無顆粒球症(致死例を含む)も報告されています。
白血球減少症/好中球減少症の可能性のある危険因子には、既存の低白血球数 (WBC) および薬物誘発性白血球減少症/好中球減少症の病歴が含まれます。既存の低 WBC または薬物誘発性白血球減少症/好中球減少症の病歴のある患者は、治療の最初の数か月間、頻繁に全血球計算 (CBC) を監視する必要があります。他の原因となる要因の。
好中球減少症の患者は、発熱やその他の症状や感染の徴候について注意深く監視し、そのような症状や徴候が発生した場合は速やかに治療する必要があります。重度の好中球減少症 (絶対好中球数
発作
臨床試験中、ジプラシドンで治療された患者の 0.4% で発作が発生しました。これらのケースの多くで、発作の発生に寄与した可能性のある交絡因子がありました。他の抗精神病薬と同様に、ジプラシドンは、発作の既往歴がある患者、またはアルツハイマー型認知症などの発作閾値を下げる可能性のある状態の患者には慎重に使用する必要があります。発作閾値を下げる条件は、65 歳以上の集団でより一般的である可能性があります。
嚥下障害
食道の運動障害と誤嚥は、抗精神病薬の使用に関連付けられています。誤嚥性肺炎は、高齢患者、特に進行したアルツハイマー型認知症患者の罹患率と死亡率の一般的な原因です。ジプラシドンおよび他の抗精神病薬は、誤嚥性肺炎のリスクがある患者では慎重に使用する必要があります[ ボックス警告 ]。
高プロラクチン血症
ドーパミン D2 受容体に拮抗する他の薬物と同様に、ジプラシドンはヒトのプロラクチン レベルを上昇させます。プロラクチンレベルの上昇は、この化合物を用いた動物実験でも観察され、マウスの乳腺腫瘍の増加と関連していました。同様の効果はラットでは観察されなかった[参照 非臨床毒性学 ]。組織培養実験では、ヒト乳癌の約 3 分の 1 が in vitro でプロラクチン依存性であることが示されています。これは、以前に乳癌が発見された患者でこれらの薬剤の処方が考えられる場合、潜在的に重要な要素です。これまでに実施された臨床研究も疫学研究も、このクラスの薬物の慢性投与とヒトの腫瘍形成との関連を示していません。入手可能な証拠は、現時点では決定的であるにはあまりにも限定的であると考えられています。
乳汁漏出、無月経、女性化乳房、インポテンスなどの障害がプロラクチン上昇化合物で報告されていますが、血清プロラクチン濃度の上昇の臨床的意義はほとんどの患者にとって不明です。性腺機能低下症を伴う長期にわたる高プロラクチン血症は、骨密度の低下につながる可能性があります。
認知障害および運動障害の可能性
傾眠は、ジプラシドンで治療された患者において一般的に報告された副作用でした。 4 週間および 6 週間のプラセボ対照試験では、プラセボ患者の 7% と比較して、ジプラシドンの患者の 14% で傾眠が報告されました。短期臨床試験では、0.3%の患者で傾眠により中止に至りました。ジプラシドンは判断力、思考力、または運動能力を損なう可能性があるため、患者は、ジプラシドン療法が無効であると合理的に確信できるまで、自動車 (自動車を含む) の運転や危険な機械の操作など、精神的覚醒を必要とする活動を行うことについて注意する必要があります。それらに悪影響を及ぼします。
持続勃起症
持続勃起症の 1 例が市販前データベースで報告されました。ジプラシドンの使用に対する反応の関係は確立されていませんが、アルファアドレナリン遮断効果を持つ他の薬が持続勃起症を誘発することが報告されており、ジプラシドンがこの能力を共有している可能性があります.重度の持続勃起症には、外科的介入が必要な場合があります。
体温調節
市販前試験ではジプラシドンについて報告されていませんが、深部体温を下げる体の能力の混乱は、抗精神病薬に起因しています。深部体温の上昇に寄与する可能性のある状態を経験する可能性のある患者にジプラシドンを処方するときは、適切な注意が必要です.
自殺
自殺未遂の可能性は、精神病や双極性障害に固有のものであり、リスクの高い患者の綿密な監視は、薬物療法に伴う必要があります。ジプラシドンの処方は、過剰摂取のリスクを軽減するために、適切な患者管理と一致する最小量のカプセル用に作成する必要があります。
合併症のある患者
特定の全身疾患を併発している患者におけるジプラシドンの臨床経験は限られている[参照 特定の集団での使用 ]。
Ziprasidone は、心筋梗塞または不安定な心臓病の最近の病歴を持つ患者で評価または使用されたことはありません。これらの診断を受けた患者は、市販前の臨床試験から除外されました。ジプラシドンによる QTc 延長および起立性低血圧のリスクがあるため、心臓病患者には注意が必要です。 [見る QT延長と突然死のリスク、起立性低血圧 ]。
臨床検査
重大な電解質障害のリスクがあるジプラシドン治療を検討している患者は、ベースラインの血清カリウムおよびマグネシウム測定値を持っている必要があります.低血清カリウムおよびマグネシウムは、治療に進む前に補充する必要があります。ジプラシドン療法中に利尿薬を開始した患者は、血清カリウムとマグネシウムを定期的に監視する必要があります。 QTc 測定値が 500 ミリ秒を超えて持続することが判明した患者では、ジプラシドンを中止する必要があります。 QT延長と突然死のリスク ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
カプセルの投与情報
GEODONカプセルを丸ごと服用するように患者にアドバイスしてください。カプセルを開けたり、つぶしたり、噛んだりしないでください。最適な吸収のために、GEODONカプセルを食事と一緒に服用するように患者に指示してください。ジプラシドンの吸収は、食物の存在下で 2 倍まで増加します [ 投薬と管理 、 薬物相互作用 、 と 臨床薬理学 ]。
QTc延長
医療提供者に次のことを知らせるように患者に助言する: QT 延長の病歴。最近の急性心筋梗塞;無代償性心不全; QT延長を示した他の薬の処方;重大な電解質異常のリスク;および心不整脈の病歴[参照 禁忌 と 警告と注意事項 ]。
重大な電解質障害、特に低カリウム血症の危険にさらされている状態の発症を報告するように患者に指示してください。さらに、めまい、動悸、失神などの症状を処方医に報告するように患者に指示する[参照 警告と注意事項 ]。
重度の皮膚有害反応
好酸球増多および全身症状を伴う薬物反応(DRESS)またはスティーブンス・ジョンソン症候群などの重度の皮膚有害反応に関連する可能性のある徴候または症状を、最も早い時期に医療提供者に報告するように患者に指示する[ 警告と注意事項 ]。
妊娠
GEODON による治療中に妊娠した場合、または妊娠する予定がある場合は、医療提供者に通知するよう妊娠中の女性にアドバイスしてください。 GEODON が新生児に錐体外路症状および/または禁断症状 (動揺、筋緊張亢進、筋緊張低下、振戦、傾眠、呼吸困難、および摂食障害) を引き起こす可能性があることを患者に助言してください。妊娠中に GEODON に曝露した女性の妊娠転帰を監視する妊娠曝露登録簿があることを患者に助言する [参照 特定の集団での使用 ]。
授乳
GEODON 20mg を使用している授乳中の女性は、乳児の過剰な鎮静、易刺激性、哺乳不良、錐体外路症状 (振戦、異常な筋肉運動) を監視し、これらの徴候に気付いた場合は医療機関を受診するようアドバイスしてください [参照]。 特定の集団での使用 ]。
不妊
GEODON 80mg が血清プロラクチンレベルの上昇により生殖能力を損なう可能性があることを生殖能力のある女性にアドバイスしてください。生殖能力への影響は可逆的です [ 警告と注意事項 と 特定の集団での使用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
Long Evans ラットおよび CD-1 マウスでジプラシドンの生涯発がん性試験が実施されました。ジプラシドンは、ラットに 2、6、または 12 mg/kg/日、マウスに 50、100、または 200 mg/kg/日の用量で 24 か月間、食事で投与されました ( mg/m2 の体表面積に基づいて、それぞれ 200 mg/日の人間の最大推奨用量 (MRHD)。ラットの研究では、コントロールと比較して腫瘍の発生率が増加したという証拠はありませんでした.オスのマウスでは、コントロールと比較して腫瘍の発生率の増加はありませんでした。メスのマウスでは、試験したすべての用量 (50 ~ 200 mg/kg/日または MRHD の 1 ~ 5 倍、mg/m2 体表面積)。げっ歯類の下垂体および乳腺の増殖性変化は、他の抗精神病薬の慢性投与後に観察されており、プロラクチン媒介性であると考えられています。血清プロラクチンの増加は、100 および 200 mg/kg/日 (または mg/m2 体表面積に基づく MRHD の 2.5 倍および 5 倍) で、メスのマウスでの 1 か月の食事研究で観察されましたが、オスでは観察されませんでした。ジプラシドンは、発がん性研究で使用された用量での5週間の食事研究で、ラットの血清プロラクチンに影響を与えませんでした.げっ歯類におけるプロラクチン介在性内分泌腫瘍の所見のヒトリスクとの関連性は不明である[参照 警告と注意事項 ]。
突然変異誘発
ジプラシドンは、Ames 細菌変異アッセイ、in vitro 哺乳動物細胞遺伝子変異マウス リンパ腫アッセイ、ヒトリンパ球における in vitro 染色体異常アッセイ、およびマウス骨髄における in vivo 染色体異常アッセイで試験されました。代謝活性化の非存在下で、S. typhimurium の 1 つの菌株で Ames アッセイで再現性のある変異原性応答がありました。哺乳類細胞の in vitro 遺伝子突然変異試験とヒトリンパ球の in vitro 染色体異常試験の両方で陽性の結果が得られました。
生殖能力の障害
ジプラシドンは、10 ~ 160 mg/kg/日の用量で、Sprague-Dawley ラットの交尾までの時間を増加させることが示されました。表面積)。受精率は 160 mg/kg/日で低下した (mg/m2 体表面積に基づく MRHD の 8 倍)。 40 mg/kg/日 (mg/m2 体表面積に基づく MRHD の 2 倍) では受胎能に影響はありませんでした。 160 mg/kg/日 (mg/m2 の体表面積に基づく MRHD の 8 倍) を投与された雄を未処理の雌と交配させた場合、受精能は損なわれなかったため、受精能への影響は雌にあるようでした。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中に GEODON 40mg を含む非定型抗精神病薬に曝露された女性の妊娠転帰を監視する妊娠曝露登録があります。医療提供者は、非定型抗精神病薬の国家妊娠登録に連絡して患者を登録することをお勧めします。 http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
リスクの概要
妊娠第 3 期に GEODON を含む抗精神病薬にさらされた新生児は、分娩後に錐体外路症状および/または禁断症状のリスクがあります (以下を参照)。 臨床上の考慮事項 )。ジプラシドンに暴露された妊婦の公表された疫学的研究から入手可能な全体的なデータは、主要な先天性欠損症、流産、または母体または胎児への有害転帰の薬物関連リスクを確立していません (以下を参照)。 データ )。未治療の統合失調症や双極 I 型障害、および妊娠中の GEODON などの抗精神病薬への曝露に関連する母親へのリスクがあります (以下を参照)。 臨床上の考慮事項 )。
動物実験では、器官形成期の妊娠中のラットおよびウサギへのジプラシドン投与は、ヒトの推奨用量と同様の用量で発生毒性を引き起こし、ヒトの最大推奨用量 (MRHD) の 3 倍でウサギに催奇形性を示しました。妊娠中および授乳中にジプラシドンに曝露されたラットは、ヒトの治療用量よりも少ないか同等の用量で、周産期の子犬の死亡率の増加と、子孫の神経行動および機能の発達の遅延を示しました( データ )。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
未治療の統合失調症または双極 I 型障害の母親には、再発、入院、および自殺のリスクの増加を含むリスクがあります。統合失調症および双極 I 型障害は、早産を含む周産期の有害転帰の増加と関連しています。これが病気の直接の結果なのか、他の併存因子によるものなのかは不明です。
胎児/新生児の副作用
興奮、筋緊張亢進、筋緊張低下、振戦、傾眠、呼吸困難、および摂食障害を含む錐体外路症状および/または禁断症状が、妊娠第 3 期に GEODON を含む抗精神病薬にさらされた新生児で報告されています。これらの症状の重症度はさまざまです。新生児の錐体外路および/または禁断症状を監視し、症状を適切に管理します。一部の新生児は、特別な治療を受けなくても数時間または数日で回復しました。他の人は長期の入院を必要としました。
データ
ヒューマンデータ
妊娠中の非定型抗精神病薬の使用に関する観察研究、出生登録、および症例報告から発表されたデータは、抗精神病薬および主要な先天異常との明確な関連を報告していません。妊娠中に抗精神病薬にさらされた 9,258 人の女性の Medicaid データベースからのレトロスペクティブ コホート研究では、主要な先天性欠損症の全体的なリスクの増加は示されませんでした。
動物データ
器官形成期の妊娠ウサギにジプラシドンを投与したところ、30 mg/kg/日 (MRHD mg/m2 の体表面積に基づいて 200 mg/日)。これらの発生への影響が母体毒性の二次的なものであることを示唆する証拠はありませんでした。発生無影響用量は 10 mg/kg/日(mg/m2 体表面積に基づく MRHD に相当)であった。ラットでは、10~160 mg/kg/日 (mg/m2 体表面積に基づく MRHD の 0.5~8 倍) の投与後に、器官形成中または妊娠期間を通じて胚胎児毒性 (胎児体重の減少、骨格骨化の遅延) が観察されたが、催奇形性の証拠はありませんでした。 40 および 160 mg/kg/日 (体表面積 mg/m2 に基づく MRHD の 2 倍および 8 倍) の用量は、母体毒性と関連していた。発生無影響量は 5 mg/kg/日 (mg/m2 体表面積に基づく MRHD の 0.2 倍) です。
妊娠中および授乳中に 10 mg/kg/日 (MRHD に基づく用量の 0.5 倍) の用量で処置された雌ラットの子孫では、授乳の最初の 4 日間を通じて、死亡して生まれた仔の数が増加し、出生後の生存率が低下した。 mg/m2 体表面積) 以上。 5 mg/kg/日 (mg/m2 体表面積に基づく MRHD の 0.2 倍) 以上の用量で、子孫の発育遅延 (子犬の体重の減少) および神経行動機能障害 (開眼時の空気の立ち上がり) が観察されました。これらの影響について無影響レベルは設定されていません。
授乳
リスクの概要
公開された症例報告からの限られたデータは、母乳中のジプラシドンの存在を示しています。母乳を介してジプラシドンに曝露された母乳育児の乳児に対する悪影響の報告はありませんが、乳房を介して他の非定型抗精神病薬に曝露された乳児では、過剰な鎮静、過敏性、摂食不良、および錐体外路症状 (振戦および異常な筋肉運動) の報告があります。ミルク(参照 臨床上の考慮事項 )。牛乳生産に対するジプラシドンの影響に関する情報はありません。母乳育児の発達上および健康上の利点は、GEODON に対する母親の臨床的必要性、および GEODON 20mg または母親の基礎疾患による授乳中の子供への潜在的な悪影響と併せて考慮する必要があります。
臨床上の考慮事項
GEODON にさらされた乳児は、過剰な鎮静、易刺激性、摂食不良、錐体外路症状 (振戦および異常な筋肉運動) について監視する必要があります。
生殖能力のある雌と雄
不妊
女性
ジプラシドンの薬理学的作用 (D2 拮抗作用) に基づいて、GEODON 40mg による治療は、血清プロラクチン レベルの上昇をもたらす可能性があり、生殖能力のある女性の生殖能力の可逆的な低下につながる可能性があります [参照 警告と注意事項 と 非臨床毒性学 ]。
小児用
小児患者におけるジプラシドンの安全性と有効性は確立されていません。
高齢者の使用
ジプラシドンの臨床試験の対象者総数のうち、2.4% が 65 歳以上でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.それにもかかわらず、ジプラシドンに対する薬力学的反応を増加させたり、耐性や起立性を低下させたりする可能性のある複数の要因の存在は、一部の高齢患者の初回投与期間中の開始用量を下げ、滴定を遅くし、慎重にモニタリングすることを考慮する必要があります。
ジプラシドン筋肉内注射は、高齢患者 (65 歳以上) では体系的に評価されていません。
腎障害
ジプラシドンは高度に代謝され、変化せずに排泄される薬物は 1% 未満であるため、腎障害のみがジプラシドンの薬物動態に大きな影響を与える可能性は低いです。 20 mg を 1 日 2 回 8 日間投与した後のジプラシドンの薬物動態は、さまざまな程度の腎障害のある被験者 (n=27) と正常な腎機能を持つ被験者の間で同様であり、腎障害の程度に基づく用量調整が必要ないことを示しています。 .ジプラシドンは血液透析では除去されません。
筋肉内ジプラシドンは、高齢患者または肝臓または腎臓障害のある患者で体系的に評価されていません。シクロデキストリン賦形剤は腎濾過によって除去されるため、ジプラシドンの筋肉内投与は、腎機能障害のある患者に注意して投与する必要があります[ 臨床薬理学 ]。
肝障害
ジプラシドンは肝臓によって実質的に除去されるため、肝機能障害の存在はジプラシドンの AUC を増加させると予想されます。臨床的に重要な (Childs-Pugh クラス A および B) 肝硬変の被験者 (n=13) を対象に、20 mg を 1 日 2 回、5 日間反復投与した研究では、AUC 0-12 が 13% 増加し、Childs-Pugh では 34% 増加したことが明らかになりました。 Pugh クラス A および B を、対応する対照群 (n=14) と比較しました。半減期は対照群の 4.8 時間に対し、肝硬変患者では 7.1 時間でした。
年齢と性別の影響
32 人の被験者を対象とした反復投与 (8 日間の治療) 研究では、男性と女性の間、または高齢者 (> 65 歳) と若者 (18 ~ 45 歳) の被験者間で、ジプラシドンの薬物動態に違いはありませんでした。さらに、対照試験における患者の集団薬物動態評価では、ジプラシドンの薬物動態における臨床的に有意な年齢または性別に関連する違いの証拠は明らかにされていません。したがって、年齢や性別による用量変更は推奨されません。
喫煙
ヒト肝酵素を利用した in vitro 研究に基づくと、ジプラシドンは CYP1A2 の基質ではありません。したがって、喫煙はジプラシドンの薬物動態に影響を与えるべきではありません。これらの in vitro の結果と一致して、母集団の薬物動態評価では、喫煙者と非喫煙者の間で有意な薬物動態の違いは明らかにされていません。
過剰摂取
人間の経験
5,400 人を超える患者および/または正常な被験者を対象とした市販前試験では、経口ジプラシドンの偶発的または意図的な過剰投与が 10 人の患者で報告されました。これらの患者は全員、後遺症なく生存しました。確認された最大量の 3,240 mg を服用した患者では、報告された唯一の症状は、最小限の鎮静、ろれつが回らない、一過性高血圧 (200/95) でした。
ジプラシドンの過剰摂取で報告された有害反応には、錐体外路症状、傾眠、振戦、および不安が含まれていました。 [見る 有害反応 ]
過剰摂取の管理
急性の過剰摂取の場合は、気道を確立して維持し、十分な酸素化と換気を確保してください。静脈内アクセスを確立し、胃洗浄 (患者が無意識の場合は挿管後) および下剤と一緒に活性炭の投与を考慮する必要があります。過剰摂取後の頭頸部の鈍化、発作、またはジストニー反応の可能性は、誘発された嘔吐を伴う誤嚥のリスクを生み出す可能性があります.
心血管モニタリングを直ちに開始し、不整脈の可能性を検出するために継続的な心電図モニタリングを含める必要があります。抗不整脈療法が行われる場合、ジソピラミド、プロカインアミド、およびキニジンは、ジプラシドンの効果に相加する可能性のある相加的な QT 延長効果の理論上の危険を伴います。
低血圧および循環虚脱は、静脈内輸液などの適切な手段で治療する必要があります。交感神経刺激薬が血管サポートに使用される場合、ジプラシドンに関連するα1拮抗作用と組み合わされたベータ刺激が低血圧を悪化させる可能性があるため、エピネフリンとドーパミンは使用しないでください.同様に、ブレチリウムのアルファアドレナリン遮断特性がジプラシドンの特性に相加的であり、問題のある低血圧をもたらす可能性があると予想するのは合理的です.
重度の錐体外路症状の場合、抗コリン薬を投与する必要があります。ジプラシドンに特異的な解毒剤はなく、透析もできません。複数の薬物の関与の可能性を考慮する必要があります。患者が回復するまで、綿密な医学的監督とモニタリングを継続する必要があります。
禁忌
QT延長
ジプラシドンの用量に関連した QT 間隔の延長、および致命的な不整脈と他のいくつかの薬剤による QT 延長との関連が知られているため、ジプラシドンは禁忌です。
- QT延長の既往歴のある患者(先天性QT延長症候群を含む)
- 最近の急性心筋梗塞患者
- 非代償性心不全患者
ジプラシドンと QT 間隔を延長する他の薬物との間の薬物動態/薬力学研究は実施されていません。 QT間隔を延長するジプラシドンおよび他の薬物の相加効果を排除することはできません。したがって、ジプラシドンは次の場合には投与しないでください。
- ドフェチリド、ソタロール、キニジン、その他のクラス Ia および III の抗不整脈薬、メソリダジン、チオリダジン、クロルプロマジン、ドロペリドール、ピモジド、スパルフロキサシン、ガチフロキサシン、モキシフロキサシン、ハロファントリン、メフロキン、ペンタミジン、三酸化ヒ素、酢酸レボメタジル、メシル酸ドラセトロン、プロブコールまたはタクロリムス。
- 薬力学的効果の 1 つとして QT 延長が実証されており、完全な処方情報でこの効果が禁忌または枠または太字の警告として記載されている他の薬剤 [参照 警告と注意事項 ]。
過敏症
ジプラシドンは、製品に対して既知の過敏症を持つ個人には禁忌です。
臨床薬理学
作用機序
リストされた適応症の治療におけるジプラシドンの作用機序は、ドーパミン 2 型 (D2) とセロトニン 2 型 (5HT2) 拮抗作用の組み合わせによって仲介される可能性があります。
薬力学
ジプラシドンは、ドーパミン D2 および D3、セロトニン 5HT2A、5HT2C、5HT1A、5HT1D、および α1 アドレナリン受容体に比較的高い親和性で結合します (Ki はそれぞれ 4.8、7.2、0.4、1.3、3.4、2、および 10 nM)。ヒスタミン H1 受容体に対する中程度の親和性 (Ki = 47 nM)。ジプラシドンは、D2、5HT2A、および 5HT1D 受容体のアンタゴニストであり、5HT1A 受容体のアゴニストです。ジプラシドンは、セロトニンとノルエピネフリンのシナプス再取り込みを阻害しました。コリン作動性ムスカリン受容体(IC50>1μM)を含む、試験した他の受容体/結合部位に対しては、顕著な親和性は示さなかった。
薬物動態
経口薬物動態
ジプラシドンの活性は、主に親薬によるものです。ジプラシドンの反復投与薬物動態は、提案された臨床用量範囲内で用量に比例し、ジプラシドンの蓄積は反復投与で予測可能です。ジプラシドンの消失は主に肝代謝によるものであり、提案された臨床用量範囲内で平均終末半減期は約 7 時間です。定常状態の濃度は、投与後 1 ~ 3 日以内に達成されます。見かけの全身クリアランスの平均値は 7.5 mL/min/kg です。ジプラシドンは、シトクロム P450 酵素によって代謝される薬物の代謝を妨害する可能性は低いです。
吸収
Ziprasidone は経口投与後によく吸収され、6 ~ 8 時間で最高血漿濃度に達します。摂食条件下での 20 mg 用量の絶対バイオアベイラビリティは、約 60% です。ジプラシドンの吸収は、食物の存在下で 2 倍まで増加します。
分布
ジプラシドンの平均見かけの分布容積は 1.5 L/kg です。 99%以上が血漿タンパク質に結合し、主にアルブミンとα1-酸性糖タンパク質に結合します。ジプラシドンの in vitro 血漿タンパク質結合は、ワルファリンまたはプロプラノロールという 2 つの高度にタンパク質結合した薬物によって変化せず、ジプラシドンはヒト血漿中のこれらの薬物の結合を変化させませんでした。したがって、置換によるジプラシドンとの薬物相互作用の可能性は最小限です。
代謝と排泄
ジプラシドンは、経口投与後に広範囲に代謝され、未変化の薬物として尿中 (
筋肉内薬物動態
全身バイオアベイラビリティ
筋肉内投与されたジプラシドンのバイオアベイラビリティは 100% です。単回投与の筋肉内投与後、ピーク血清濃度は通常、投与後約 60 分またはそれ以前に発生し、平均半減期 (T½) は 2 ~ 5 時間の範囲です。暴露量は用量依存的に増加し、3 日間の筋肉内投与後、蓄積はほとんど観察されません。
代謝と排泄
IMジプラシドンの代謝と排泄は体系的に評価されていませんが、筋肉内投与経路が代謝経路を変えるとは予想されません。
臨床研究
統合失調症
統合失調症の治療における経口ジプラシドンの有効性は、5 つのプラセボ対照試験、4 つの短期 (4 週間および 6 週間) 試験、および 1 つの維持試験で評価されました。すべての試験は成人の入院患者を対象としており、そのほとんどが統合失調症の DSM III-R 基準を満たしていました。各研究には、固定用量のジプラシドンとプラセボが 2 ~ 3 回含まれていました。 5 つの試験のうち 4 つが、ジプラシドンとプラセボを区別することができました。 1 つの短期研究ではそうではありませんでした。 3 つの短期試験の 1 つに比較治療として 1 つの固定用量ハロペリドール群が含まれていましたが、この 1 つの試験はジプラシドンとハロペリドールの信頼できる有効な比較を提供するには不十分でした。
これらの研究では、精神医学的徴候と症状を評価するためにいくつかの手段が使用されました。簡単な精神医学的評価尺度 (BPRS) と陽性および陰性症候群尺度 (PANSS) はどちらも、統合失調症における薬物治療の効果を評価するために通常使用される一般的な精神病理学の複数項目の目録です。 BPRS 精神病クラスター (概念の混乱、幻覚行動、疑わしさ、異常な思考内容) は、活発な精神病の統合失調症患者を評価するための特に有用なサブセットと見なされます。 2 番目に広く使用されている評価である Clinical Global Impression (CGI) は、患者の全体的な臨床状態について、統合失調症の症状に精通している熟練した観察者の印象を反映しています。さらに、負の症状を評価するためのスケール (SANS) が、1 つの試験で負の症状を評価するために採用されました。
統合失調症における経口ジプラシドン試験の結果
- 週間のプラセボ対照試験 (n=139) で、ジプラシドンの 2 つの固定用量 (20 mg および 60 mg を 1 日 2 回) とプラセボを比較したところ、60 mg の用量のみが BPRS の合計スコアと CGI の重症度においてプラセボよりも優れていました。スコア。この高用量グループは、BPRS 精神病クラスターまたは SANS でプラセボよりも優れていませんでした。
- 6 週間のプラセボ対照試験 (n=302) で、2 つの固定用量のジプラシドン (40 および 80 mg を 1 日 2 回) とプラセボを比較したところ、両方の用量群が BPRS 合計スコア、BPRS 精神病クラスターでプラセボよりも優れていました。 CGI 重症度スコアと PANSS 合計および負のサブスケール スコア。 80 mg を 1 日 2 回投与する方が 40 mg を 1 日 2 回投与するより数値的に大きな効果がありましたが、その差は統計的に有意ではありませんでした。
- つの固定用量のジプラシドン (20、60、および 100 mg を 1 日 2 回) とプラセボを比較した 6 週間のプラセボ対照試験 (n=419) では、3 つの用量群すべてが PANSS 合計スコアでプラセボよりも優れていました。 BPRS 合計スコア、BPRS 精神病クラスター、および CGI 重症度スコア。 100 mg を 1 日 2 回投与するグループのみが、PANSS ネガティブ サブスケール スコアでプラセボよりも優れていました。 20 mg を 1 日 2 回から 100 mg を 1 日 2 回の用量範囲内で、用量反応関係に関する明確な証拠はありませんでした。
- 4 週間のプラセボ対照試験 (n=200) で、ジプラシドンの 3 つの固定用量 (5、20、および 40 mg を 1 日 2 回) を比較したところ、いずれの用量群も関心のある結果においてプラセボよりも統計的に優れていませんでした。
- 研究は、2 か月以上入院した安定した慢性または亜慢性 (ベースラインで CGI-S ≤5) の統合失調症入院患者 (n=294) で実施されました。 3 日間の単盲検プラセボ慣らし運転の後、被験者は 3 つの固定用量のジプラシドン (20 mg、40 mg、または 80 mg を 1 日 2 回) またはプラセボのいずれかに無作為に割り付けられ、再発を観察しました。患者は、2日連続でPANSSの敵意または非協力性の項目で6以下のCGI改善スコア(はるかに悪いまたは非常に悪い)および/またはスコア6以下(中程度に重度)として定義される「切迫した精神病再発」について観察されました。 .ジプラシドンは、再発までの時間においてプラセボよりも有意に優れており、異なる用量群間で有意差はありませんでした.年齢と人種に基づいて人口サブセットを調べるにはデータが不十分でした。性別に基づく集団サブセットの検査では、反応性の違いは明らかになりませんでした。
双極 I 型障害 (急性の混合型または躁病エピソードおよびリチウムまたはバルプロ酸の補助としての維持療法)
双極Ⅰ型障害に関連する急性躁病と混合エピソード
ジプラシドンの有効性は、双極 I 型障害、躁病エピソード、または精神病的特徴の有無にかかわらず DSM-IV 基準を満たす患者を対象とした 2 つのプラセボ対照二重盲検 3 週間単剤療法試験で確立されました。これらの試験で躁病の症状を評価するために使用された主要な評価手段は次のとおりです。(1)躁病としてグループ化された項目を含む感情障害および統合失調症の変化版(SADS-CB)のスケジュールから導出された躁病評価尺度(MRS)サブスケール(気分の高揚、睡眠の必要性が少ない、過剰なエネルギー、過剰な活動、誇大性)、行動と観念のサブスケール(過敏性、運動多動、発話の加速、思考の競争、判断力の低下)、および洞察力の低下。 (2)Clinical Global Impression-Severity of Illness Scale(CGI-S)。これは、治療反応の臨床的意義を評価するために使用されました。
成人の双極 I 型障害、躁病/混合エピソードにおける経口ジプラシドン試験の結果は次のとおりです。試験期間中、40~80 mg を 1 日 2 回 (20 mg を 1 日 2 回ずつ) の範囲で滴定することが許可されました。 Ziprasidone は、MRS 合計スコアと CGI-S スコアの低下において、プラセボよりも有意に効果的でした。この研究におけるジプラシドンの平均 1 日量は 132 mg でした。 2 回目の 3 週間のプラセボ対照試験 (n=205) では、ジプラシドンの用量は 1 日目に 40 mg を 1 日 2 回投与しました。研究期間中(2日目から)。 Ziprasidone は、MRS 合計スコアと CGI-S スコアの低下において、プラセボよりも有意に効果的でした。この研究におけるジプラシドンの平均 1 日量は 112 mg でした。
維持療法
双極 I 障害の維持療法におけるリチウムまたはバルプロ酸の補助療法としてのジプラシドンの有効性は、双極 I 障害の DSM-IV 基準を満たす患者を対象としたプラセボ対照試験で確立されました。この試験には、最新のエピソードが躁病または混合型で、精神病的特徴の有無にかかわらず患者が含まれていました。非盲検段階では、無作為化するために、患者はジプラシドンとリチウムまたはバルプロ酸で少なくとも8週間安定する必要がありました。二重盲検無作為化フェーズでは、患者はリチウムまたはバルプロ酸による治療を継続し、ジプラシドン (1 日 2 回、1 日あたり合計 80 mg から 160 mg を投与) またはプラセボのいずれかを受けるように無作為に割り付けられました。一般に、維持期では、患者は安定化期に安定化したのと同じ用量を継続しました。この研究の主要エンドポイントは、介入を必要とする気分エピソード (躁病、混合性または抑うつエピソード) の再発までの時間であり、以下のいずれかとして定義されました: 気分エピソードによる中止、気分エピソードに対する臨床的介入 (例えば、投薬または入院の開始)、またはマニア評価尺度スコア≧18またはMADRSスコア≧18(10日以内の間隔で2回連続して評価)。合計 584 人の被験者が非盲検安定化期間に治療を受けました。二重盲検無作為化期間では、127 人の被験者がジプラシドンで治療され、112 人の被験者がプラセボで治療されました。ジプラシドンは、気分エピソードの再発までの時間を延長する点でプラセボよりも優れていました。観察された再発イベントのタイプには、うつ病、躁病、および混合エピソードが含まれていました。うつ病、躁病、および混合エピソードは、研究における再発イベントの総数のそれぞれ 53%、34%、および 13% を占めました。
統合失調症における激越の急性治療
興奮した統合失調症患者の管理における筋肉内ジプラシドンの有効性は、治験責任医師が「急性の興奮状態」であり、筋肉内抗精神病薬を必要としているとみなした統合失調症患者を対象とした 2 つの短期二重盲検試験で確立されました。さらに、患者は、PANSS の次の項目のうち少なくとも 3 つで 3 点以上のスコアを持つ必要がありました: 不安、緊張、敵意、興奮。有効性は、行動活動評価尺度 (BARS) の曲線下面積 (AUC) および臨床全体印象 (CGI) 重症度評価の分析によって評価されました。 BARS は、1 (困難または興奮できない) から 7 (暴力的、自制が必要) までのスコアを持つ 7 段階のスケールです。患者さん'ベースラインでのBARSのスコアはほとんど5であり(明白な活動[身体的または言語的]の兆候、指示で落ち着く)、研究者によって決定されたように、筋肉内療法を正当化する程度の動揺を示しました.最も深刻な興奮状態の患者は一般に市販前の臨床試験への参加についてインフォームド コンセントを提供できなかったため、BARS で 5 を超える評価の患者はほとんどいませんでした。
どちらの研究も、高用量の筋肉内ジプラシドンを 2 mg の対照用量と比較しました。ある研究では、より高い用量は 20 mg であり、研究の 24 時間で 4 回まで、4 時間以上の投与間隔で投与することができました。もう 1 つの研究では、より高い用量は 10 mg であり、2 時間以上の投与間隔で、研究の 24 時間に 4 回まで投与することができました。
筋肉内ジプラシドン試験の結果は次のとおりです
患者情報
ジオドン® カプセル(ジプラシドン)
GEODONを服用している患者さんとその介護者への情報
この概要には、GEODON に関する重要な情報が含まれています。医師の指示に代わるものではありません。 GEODON を服用する前に、この情報をよくお読みください。この情報を理解していない場合、またはGEODONについてもっと知りたい場合は、医師または薬剤師に相談してください.
ジオドン80mgとは?
ジオドンは向精神薬と呼ばれる処方薬の一種で、非定型抗精神病薬としても知られています。 GEODON は、統合失調症および双極性障害に関連する急性躁病または混合エピソードの症状の治療に使用できます。 GEODON 80mg は、リチウムまたはバルプロ酸との併用により、双極性障害の維持療法としても使用できます。
誰がGEODON 20mgを服用すべきですか?
GEODON があなたに適しているかどうかは、医師だけが知ることができます。統合失調症または双極性障害をお持ちの場合は、GEODON 20mg が処方されることがあります。
統合失調症の症状には次のようなものがあります。
- 声が聞こえる、物が見える、または存在しないものを感知する(幻覚)
- 真実ではない信念(妄想)
- 異常な疑い(パラノイア)
- 家族や友人から引きこもりになる
双極性障害の躁病エピソードまたは混合エピソードの症状には、次のようなものがあります。
- 非常に気分が高い、または過敏な気分
- エネルギー、活動、落ち着きのなさの増加
- 考えを巡らせたり、早口で話したりする
- 気が散りやすいです
- 睡眠の必要性がほとんどない
GEODON 40mgで反応が見られれば、症状が改善する可能性があります。 GEODON 40mg を服用し続けると、症状が再発する可能性が低くなります。気分が良くなっても、医師に相談せずにカプセルの服用を中止しないでください。
また、GEODON 40mg カプセルは食事と一緒に摂取する必要があることを覚えておくことも重要です。
GEODON 20mg について知っておくべき最も重要な安全性情報は何ですか?
GEODON は、認知症関連の精神病患者の治療には承認されていません。認知症に関連する精神病と診断され、抗精神病薬で治療された高齢患者は、プラセボ(砂糖の丸薬)で治療された患者と比較して、死亡リスクが高くなります。
GEODON は、統合失調症の症状や双極性障害の躁病または混合エピソードの治療に有効な薬です。ただし、潜在的な副作用の 1 つは、他の薬よりも心臓の電流の働きを変える可能性があることです。変化は小さく、これが有害かどうかはわかっていませんが、この種の変化を引き起こす他のいくつかの薬は、まれに危険な心拍リズムの異常を引き起こしました.このため、GEODON は、統合失調症または双極性躁病および混合エピソードの治療に利用できる他の医薬品のリスクと利点に対して、医師が GEODON のこのリスクを考慮した後にのみ使用する必要があります。
特定の他の薬を服用している場合や、すでに特定の心臓の状態に異常がある場合は、心拍リズムの危険な変化のリスクが高まる可能性があります。したがって、非処方薬、サプリメント、漢方薬など、服用している他の薬について医師に伝えることが重要です.また、あなたが持っている、または持っていた心臓の問題についても医師に伝えなければなりません。
GEODON 40mgを服用してはいけない人は?
認知症に関連する精神病と診断された高齢患者。 GEODON は、これらの患者の治療には承認されていません。
心拍リズム異常の可能性を高める可能性のあるものはすべて避ける必要があります。したがって、次の場合はGEODON 80mgを服用しないでください。
- QT延長症候群、最近の心臓発作、重度の心不全、特定の不整脈などの特定の心臓病がある(詳細については医師に相談してください)
- ドフェチリド、ソタロール、キニジン、その他のクラス Ia および III の抗不整脈薬、メソリダジン、チオリダジン、クロルプロマジン、ドロペリドール、ピモジド、スパルフロキサシン、ガチフロキサシン、モキシフロキサシン、ハロファントリンなど、ジプラシドンと併用してはならない薬を現在服用している、メフロキン、ペンタミジン、三酸化ヒ素、酢酸レボメタジル、メシル酸ドラセトロン、プロブコールまたはタクロリムス。
GEODONを始める前に医師に伝えるべきこと
GEODON があなたに適しているかどうかは、医師のみが判断できます。 GEODON を開始する前に、次の場合は必ず医師に相談してください。
- 心臓の鼓動や心臓に関連する病気や病気に問題があった
- 最近の心臓発作を含む心臓病の家族歴
- 失神やめまいに問題があった
- 処方薬を服用している、または最近服用した
- 自然療法や薬草療法など、処方箋なしで購入できる市販薬を服用している
- 肝臓に問題があった
- 妊娠している、妊娠している可能性がある、または妊娠する予定がある
- 母乳育児をしている、または母乳育児を計画している
- どんな薬にもアレルギーがある
- ジプラシドンまたはGEODON 20mgカプセルの他の成分に対してアレルギー反応を起こしたことはありません.これらの成分のリストについては、医師または薬剤師にお尋ねください
- 血液中のカリウムまたはマグネシウムのレベルが低い
あなたの医師は、GEODON 40mgがあなたにとって適切な治療法であるかどうかを確認するために、追加の臨床検査を受けることを望むかもしれません.
GEODONおよび他の薬
GEODON を服用しているときに使用するのが安全でない可能性のある薬がいくつかあります。 GEODON を服用している間は、自然療法やハーブ療法を含む新しい処方薬や市販薬を開始する前に、医師に確認してください。
ゲオドンの飲み方
- GEODON は、医師の指示に従ってのみ服用してください。
- GEODONカプセルを丸ごと飲み込んでください。カプセルを噛んだり、つぶしたり、開けたりしないでください。
- ジオドン40mgカプセルを食事と一緒にお召し上がりください。
- 毎日同じ時間にGEODON 80mgを服用するのが最善です.
- GEODON 80mg が効くまで数週間かかる場合があります。辛抱強くあることが重要です。
- 医師の承認なしに、用量を変更したり、薬の服用を中止したりしないでください。
- 気分が良くなっても、カプセルを服用し続けることを忘れないでください.
考えられる副作用
これらの問題は、心臓のリズムに異常があることを意味する可能性があるため、医師に相談してください すぐに もし、あんたが:
- 気絶または意識を失う
- 心臓の鼓動の変化を感じる(動悸)
GEODON の一般的な副作用には次のようなものがあります。
- 異常な疲労感や眠気
- 吐き気や胃のむかつき
- 便秘
- めまい
- 落ち着きのなさ
- 振戦、シャッフル、制御不能な不随意運動などの異常な筋肉の動き
- 下痢
- 発疹
- 咳・鼻水の増加
懸念される副作用が発生した場合は、医師に相談してください。下痢、嘔吐、または体液を失う原因となるその他の病気がある場合は、医師に相談することが特に重要です。あなたの医師は、そのような病気の後、あなたが適切な量の重要な塩分を持っていることを確認するためにあなたの血液をチェックしたいと思うかもしれません.
報告されているすべての副作用のリストについては、医師または薬剤師に GEODON Professional の添付文書をお尋ねください。
過剰摂取のために何をすべきか
過剰摂取の場合は、すぐに医師または毒物管理センターに連絡するか、最寄りの緊急治療室に行ってください。
その他の重要な安全情報
神経弛緩性悪性症候群 (NMS) と呼ばれる深刻な状態は、GEODON を含むすべての抗精神病薬で発生する可能性があります。 NMS の兆候には、高熱、筋肉のこわばり、震え、錯乱、発汗、心拍数や血圧の上昇などがあります。 NMS はまれですが、致命的な可能性がある深刻な副作用です。したがって、これらの兆候のいずれかが発生した場合は、医師に相談してください。
好酸球増加症および全身症状を伴う薬物反応(DRESS)と呼ばれる遅発性薬物反応がジプラシドンで発生する可能性があります。 DRESS の徴候には、発疹、発熱、リンパ節の腫れなどがあります。スティーブンス・ジョンソン症候群などの他の重度の皮膚有害反応 (SCAR) がジプラシドンで発生する可能性があります。スティーブンス・ジョンソン症候群の徴候には、口の潰瘍、皮膚の脱落、発熱、皮膚の標的のような斑点を含む可能性のある水疱を伴う発疹が含まれる場合があります. DRESS やその他の SCAR は致命的な場合があります。したがって、これらの兆候が見られた場合は、すぐに医師に相談してください。
非定型抗精神病薬で治療された患者では、高血糖(高血糖)に関連する有害反応が報告されており、重篤な場合もあります。 GEODON で治療された患者の高血糖または糖尿病の報告はほとんどなく、GEODON がこれらの反応と関連しているかどうかは不明です。非定型抗精神病薬で治療された患者は、高血糖の症状を監視する必要があります。
ジオドンは、特に服用開始時や増量時に血圧低下によるめまいが起こることがあります。このような場合は、急に立ち上がらないように注意し、医師に問題について相談してください。
GEODON を服用する前に、次のような場合は医師に相談してください。
- 妊娠している、または妊娠を計画している。
- GEODON 80mg の投与中に妊娠した場合は、非定型抗精神病薬の国家妊娠登録簿への登録について医療提供者に相談してください。 1-866-961-2388 に電話して登録するか、 http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- 授乳中または授乳を計画している。 GEODON 40mg は母乳に移行します。 GEODON を受け取った場合、赤ちゃんに与える最善の方法について、かかりつけの医療提供者に相談してください。
ゲオドン80mgは眠気を催すことがありますので、機械の操作や自動車の運転には十分注意してください。
ジオドンと同類の医薬品は、体の暑さへの順応を阻害することがありますので、高温多湿は避けたほうがよいでしょう。
GEODONを服用している間はアルコール飲料の摂取を避けるのが最善です.
医師に電話する すぐに 医師の処方量を超えてジオドンを服用した場合。
GEODON は、18 歳未満の子供および 10 代の若者の治療において安全または有効であることが示されていません。
GEODON 80mg とすべての薬は子供の手の届かないところに保管してください。
ジオドンの保管方法
GEODON 20mg カプセルは室温 (59°F ~ 86°F または 15°C ~ 30°C) で保管してください。
ジオドンについてもっと知りたい方へ
このシートは概要のみです。 GEODON 20mg は処方薬であり、医師のみがあなたに適しているかどうかを判断できます。ご不明な点がある場合、またはGEODONについてさらに詳しい情報が必要な場合は、医師または薬剤師にご相談ください. www.geodon.com にアクセスすることもできます。
この製品のラベルは更新されている可能性があります。最新の処方情報については、www.pfizer.com をご覧ください。
