Abilify 10mg, 15mg, 20mg Aripiprazole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。

エビリファイ20mgとは?
エビリファイは、統合失調症、双極Ⅰ型障害(躁うつ病)、大うつ病性障害の症状を治療するために使用される処方薬です。エビリファイ 10mg は、単独で使用することも、他の薬と併用することもできます。エビリファイは、抗精神病薬、抗躁薬です。
- エビリファイが 6 歳未満の子供に安全で効果があるかどうかはわかっていません。
エビリファイ15mgで起こりうる副作用は何ですか?
エビリファイ 15mg は、次のような重大な副作用を引き起こす可能性があります。
- 激しい動揺または苦痛、
- 落ち着かない気持ち、
- 目、唇、舌、顔、腕または脚のけいれんまたは制御不能な動き、
- 顔のマスクのような外観、
- 嚥下障害、
- スピーチの問題、
- 発作(けいれん)、
- 自殺や自傷行為の考え、
- 硬直した筋肉、
- 高熱、
- 発汗、
- 錯乱、
- 速いまたは不均一な心拍、
- 震え(揺れ)、
- 立ちくらみを感じ、
- 寒気、
- 喉の痛み、
- 口内炎、
- 皮膚のただれ、
- 咳、
- 呼吸困難、
- 喉の渇きが増し、
- 排尿の増加、
- ドライマウスと
- フルーティーな口臭
上記の症状がある場合は、すぐに医療機関を受診してください。
エビリファイ 20mg の最も一般的な副作用は次のとおりです。
- 制御されていない筋肉の動き、
- 不安、
- 落ち着かない気持ち、
- 体重の増加、
- 吐き気、
- 嘔吐、
- 便秘、
- 食欲増進、
- 頭痛、
- めまい、
- 眠気、
- 疲労感、
- 睡眠障害(不眠症)、
- 鼻づまりと、
- 喉の痛み
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Abilify の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
認知症関連の精神病および抗うつ薬による自殺念慮および行動を伴う高齢患者の死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。 ABILIFY 20mg は、認知症関連の精神病患者の治療には承認されていません [警告と注意事項を参照]。
抗うつ薬は、短期間の研究で、子供、青年、および若年成人の自殺念慮および自殺行動のリスクを増加させました。これらの研究では、24 歳以上の患者における抗うつ薬の使用による自殺念慮および自殺行動のリスクの増加は示されませんでした。 65歳以上の患者では、抗うつ薬の使用によりリスクが低下しました[警告と注意事項を参照]。
抗うつ薬治療を開始したすべての年齢の患者では、悪化の有無、および自殺念慮や自殺行動の出現を注意深く監視します。処方者との綿密な観察とコミュニケーションの必要性を家族と介護者に助言する[警告と注意事項を参照]。
説明
アリピプラゾールは向精神薬であり、ABILIFY® (アリピプラゾール) 錠、ABILIFY DISCMELT® (アリピプラゾール) 口腔内崩壊錠、ABILIFY® (アリピプラゾール) 経口溶液、および筋肉内注射用溶液である ABILIFY® (アリピプラゾール) 注射液として入手できます。アリピプラゾールは、7-[4-[4-(2,3ジクロロフェニル)-1-ピペラジニル]ブトキシ]-3,4-ジヒドロカルボスチリルです。実験式は C23H27Cl2N3O2 で、分子量は 448.38 です。化学構造は次のとおりです。
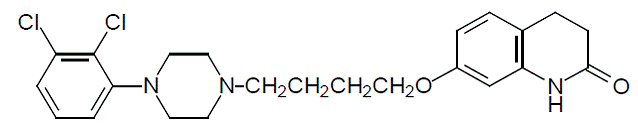
エビリファイ錠には、2 mg、5 mg、10 mg、15 mg、20 mg、および 30 mg の強度があります。不活性成分には、コーンスターチ、ヒドロキシプロピルセルロース、ラクトース一水和物、ステアリン酸マグネシウム、微結晶性セルロースが含まれます。着色剤には、酸化鉄 (黄色または赤色) と FD&C Blue No. 2 アルミニウム レーキが含まれます。
エビリファイ 20mg ディスクメルト口腔内崩壊錠には、10mg と 15mg の用量があります。不活性成分には、アセスルファムカリウム、アスパルテーム、ケイ酸カルシウム、クロスカルメロースナトリウム、クロスポビドン、クレームドバニラ(天然および人工香料)、ステアリン酸マグネシウム、微結晶性セルロース、二酸化ケイ素、酒石酸、およびキシリトールが含まれます.着色剤には、酸化鉄 (黄色または赤色) と FD&C Blue No. 2 アルミニウム レーキが含まれます。
ABILIFY Oral Solution は、無色透明から淡黄色の溶液で、濃度は 1 mg/mL です。この溶液の不活性成分には、エデト酸二ナトリウム、フルクトース、グリセリン、dl-乳酸、メチルパラベン、プロピレングリコール、プロピルパラベン、水酸化ナトリウム、スクロース、および精製水が含まれます。経口溶液は、天然オレンジ クリームと他の天然フレーバーで味付けされています。
ABILIFY 注射液は、単回投与用のバイアルで、すぐに使用できる 9.75 mg/1.3 mL (7.5 mg/mL) の透明、無色、無菌、筋肉内使用専用の水溶液として入手できます。この溶液の不活性成分には、199.5 mg のスルホブチルエーテル β-シクロデキストリン (SBECD)、10.4 mg の酒石酸、適量の pH 4.3 の水酸化ナトリウム、および 1.33 mL の注射用水が含まれます。
適応症
エビリファイ内服錠、口腔内崩壊錠、内服液は、以下の治療に適応されます。
- 統合失調症 [参照 臨床研究 ]
- 双極 I 型障害に関連する躁病エピソードおよび混合エピソードの急性治療 [参照 臨床研究 ]
- 大うつ病性障害の補助的治療 [参照 臨床研究 ]
- 自閉症に関連する過敏性 [参照 臨床研究 ]
- トゥレット障害の治療 [参照 臨床研究 ]
エビリファイ注射は、以下の治療に適応されます:
- 統合失調症または双極性躁病に伴う激越[参照 臨床研究 ]
投薬と管理
統合失調症
大人
ABILIFY の推奨される開始および目標用量は、食事に関係なく、1 日 1 回のスケジュールで 10 または 15 mg/日を投与することです。 ABILIFY は体系的に評価されており、錠剤として投与した場合、10 ~ 30 mg/日の用量範囲で有効であることが示されています。ただし、10 または 15 mg/日を超える用量は、10 または 15 mg/日より効果的ではありませんでした。増量は一般に、定常状態を達成するのに必要な時間である 2 週間前に行うべきではありません。 臨床研究 ]。
維持療法: 統合失調症における有効性の維持は、他の抗精神病薬で 3 か月以上症状が安定している統合失調症患者を対象とした試験で実証されました。これらの患者は、これらの投薬を中止し、ABILIFY 15 mg/日またはプラセボのいずれかに無作為に割り付けられ、再発を観察されました [参照 臨床研究 ]。患者は定期的に再評価され、維持治療の必要性を判断する必要があります。
青少年
ABILIFY の推奨目標用量は 10 mg/日です。アリピプラゾールは、13 歳から 17 歳の統合失調症の思春期患者を対象に、1 日 10 mg および 30 mg の用量で研究されました。これらの患者における錠剤製剤の開始日用量は 2 mg で、2 日後に 5 mg に、さらに 2 日後に目標用量の 10 mg に滴定されました。その後の用量の増加は、5 mg の増分で投与する必要があります。 30 mg/日の用量は、10 mg/日の用量よりも効果的であることが示されませんでした.エビリファイは食事に関係なく投与できます[参照 臨床研究 ]。維持療法の必要性を判断するために、患者を定期的に再評価する必要があります。
他の抗精神病薬からの切り替え
他の抗精神病薬から ABILIFY 20mg への切り替え、または他の抗精神病薬との併用投与に関する統合失調症患者に具体的に対処するための体系的に収集されたデータはありません。一部の統合失調症患者には、以前の抗精神病薬治療の即時中止が許容される場合がありますが、他の患者には、より段階的な中止が最も適切な場合があります。いずれの場合も、重複する抗精神病薬の投与期間は最小限に抑える必要があります。
双極Ⅰ型障害
躁病と混合エピソードの急性治療
大人
成人の推奨開始用量は、単独療法として 1 日 1 回 15 mg を投与し、リチウムまたはバルプロ酸による補助療法として 1 日 1 回 10 mg ~ 15 mg を投与することです。エビリファイ10mgは食事に関係なく服用できます。 ABILIFY の推奨目標用量は、単剤療法として、またはリチウムまたはバルプロ酸による補助療法として、15 mg/日です。用量は、臨床反応に基づいて 30 mg/日まで増量される場合があります。 30 mg/日を超える用量の安全性は、臨床試験で評価されていません。
小児科
単剤療法としての小児患者(10~17歳)の推奨開始用量は2mg/日で、2日後に5mg/日まで漸増し、さらに2日後に10mg/日を目標用量とします。リチウムまたはバルプロ酸の補助療法として推奨される用量は同じです。その後の増量は、必要に応じて 1 日 5 mg ずつ増量してください。 ABILIFY は食事に関係なく投与できます [参照 臨床研究 ]。
大うつ病性障害の補助療法
大人
すでに抗うつ薬を服用している患者の補助療法としてのABILIFYの推奨開始用量は、2~5mg/日です。推奨用量範囲は 2 ~ 15 mg/日です。 1日あたり最大5mgの用量調整は、1週間以上の間隔で徐々に行う必要があります[ 臨床研究 ]。患者は定期的に再評価され、維持治療の必要性を判断する必要があります。
自閉症に関連する過敏性
小児患者(6~17歳)
自閉性障害に関連する過敏症の小児患者の治療に推奨される用量範囲は、1 日あたり 5 ~ 15 mg です。
投与は 2 mg/日から開始する必要があります。用量は 5 mg/日に増量し、必要に応じて 10 または 15 mg/日に増量します。 1日5mgまでの用量調整は、1週間以上の間隔で徐々に行うべきです[ 臨床研究 ]。患者は定期的に再評価され、維持治療の必要性を判断する必要があります。
トゥレット症候群
小児患者(6~18歳)
トゥレット障害の推奨用量範囲は、1 日あたり 5 ~ 20 mg です。
体重が 50 kg 未満の患者の場合、投与は 2 mg/日から開始し、2 日後に目標用量を 5 mg/日にする必要があります。チックの最適なコントロールが得られない患者では、用量を 10 mg/日まで増量することができます。投与量の調整は、1 週間以上の間隔で徐々に行う必要があります。
体重が 50 kg 以上の患者の場合、投与は 2 mg/日で 2 日間開始し、その後 5 日間で 5 mg/日に増量し、8 日目には 10 mg/日を目標用量とします。チックを最適にコントロールできない患者には、1 日 20 mg まで増量します。投与量の調整は、1 週間以上の間隔で 5 mg/日ずつ徐々に行う必要があります。 [見る 臨床研究 ]。
患者は定期的に再評価され、維持治療の必要性を判断する必要があります。
統合失調症または双極性躁病に伴う動揺(筋肉内注射)
大人
これらの患者の推奨用量は 9.75 mg です。推奨用量範囲は 5.25 ~ 15 mg です。 9.75 mg と比較して、15 mg では追加の利点は示されませんでした。臨床的要因が必要な場合は、5.25 mg の低用量が考慮される場合があります。初回投与後も 2 回目の投与が必要な興奮が持続する場合は、合計 30 mg/日までの累積投与量を投与できます。しかし、興奮状態の患者におけるABILIFY 10mg注射の反復投与の有効性は、対照臨床試験で体系的に評価されていません. 30 mg を超える 1 日総投与量または 2 時間ごとよりも頻繁に投与される注射の安全性は、臨床試験で十分に評価されていません [ 臨床研究 ]。
進行中の ABILIFY 療法が臨床的に適応となる場合、10 ~ 30 mg/日の範囲の経口 ABILIFY をできるだけ早く ABILIFY 注射に置き換える必要があります [ 投薬と管理 ]。
エビリファイ注射の投与
エビリファイ 10mg 注射液を投与するには、表 1 に示すように注射器に必要な量の溶液を吸い上げます。未使用の部分は廃棄してください。
エビリファイ注射は、筋肉注射のみを目的としています。静脈内または皮下に投与しないでください。ゆっくりと筋肉の奥深くまで注入します。
非経口医薬品は、溶液と容器が許す限り、投与前に粒子状物質と変色がないか目視検査する必要があります。
シトクロム P450 の考慮事項の用量調整
CYP2D6 の代謝不良が知られている患者、および CYP3A4 阻害剤または CYP2D6 阻害剤または強力な CYP3A4 誘導剤を併用している患者では、用量調整が推奨されます (表 2 を参照)。同時投与された薬剤が併用療法から中止された場合、ABILIFY 10mgの投与量は元のレベルに調整されるべきです.併用投与された CYP3A4 インデューサーが中止された場合、ABILIFY の投与量は 1 ~ 2 週間かけて元のレベルまで減量する必要があります。 CYP3A4 および CYP2D6 の強力、中等度、および弱い阻害剤の組み合わせ (例えば、強力な CYP3A4 阻害剤と中程度の CYP2D6 阻害剤、または中等度の CYP3A4 阻害剤と中等度の CYP2D6 阻害剤) を投与されている可能性のある患者は、投与量を 1 回に減らすことができます。 - 最初は通常の用量の 4 分の 1 (25%) を投与し、その後、良好な臨床反応が得られるように調整します。
大うつ病性障害患者にエビリファイを補助的に投与する場合は、用法・用量(2.3)に規定する用量調整をせずに、エビリファイ10mgを投与すること。
経口溶液の投与
経口溶液は、最大 25 mg の用量レベルまで、mg/mg ベースで錠剤の代わりに使用できます。 30 mg の錠剤を服用している患者は、25 mg の溶液を服用する必要があります [参照 臨床薬理学 ]。
口腔内崩壊錠の服用について
エビリファイ口腔内崩壊錠10mgの用法・用量は内服錠と同じです。 上記のセクション ]。
供給方法
剤形と強度
ABILIFY® (アリピプラゾール) 錠剤は、表 3 に記載されているように入手できます。
ABILIFY DISCMELT® (アリピプラゾール) 口腔内崩壊錠は、表 4 に記載されているとおりに入手できます。
ABILIFY® (アリピプラゾール) 経口溶液 (1 mg/mL) は、無色から淡黄色の透明な溶液で、校正済みの経口投与用カップと一緒に、小児用の安全なボトルで提供されます。
ABILIFY® (アリピプラゾール) 筋肉内注射用注射剤は、無色透明の溶液で、すぐに使用できる 9.75 mg/1.3 mL (7.5 mg/mL) 溶液が透明なタイプ 1 ガラスバイアルに入っています。
保管と取り扱い
エビリファイ®(アリピプラゾール)錠 片面にマーキングがあり、表 32 に記載されている強度とパッケージで入手できます。
エビリファイ 15mg ディスクメルト®(アリピプラゾール)口腔内崩壊錠 両側に印が付いた丸い錠剤です。 ABILIFY 15mg DISCMELT は、表 33 に示す強度とパッケージで入手できます。
ABILIFY® (アリピプラゾール) 経口溶液 (1 mg/mL) は、キャリブレーションされた経口投与カップとともに、子供が安全なボトルで提供されます。エビリファイ 20mg 内用液は、次のように販売されています。
150mLボトル NDC 59148-013-15
筋肉注射用の ABILIFY® (アリピプラゾール) 注射剤は、次のように、すぐに使用できる 9.75 mg/1.3 mL (7.5 mg/mL) の透明なタイプ 1 ガラスバイアルの溶液として入手できます。
9.75 mg/1.3 mL 単回投与バイアル NDC 59148-016-65
保管所
錠剤
25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) の間で許容されるエクスカーション [参照 USP制御の室温 ]。
内服液
25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) の間で許容されるエクスカーション [参照 USP制御の室温 ]。 ABILIFY Oral Solution の開封済みボトルは、開封後 6 か月間使用できますが、ボトルの有効期限を超えて使用することはできません。ボトルとその内容物は、有効期限が切れたら廃棄する必要があります。
注入
25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) の間で許容されるエクスカーション [参照 USP制御の室温 ]。元の容器に保管して光から保護してください。使用時までカートンに保管してください。
Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA によって販売および販売されています。大塚アメリカ ファーマシューティカル, Inc. Rev 2019 年 8 月
副作用
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
次の副作用については、ラベルの他のセクションで詳しく説明しています。
- 認知症関連精神病の高齢患者における死亡率の増加 [参照 囲み警告 と 警告と注意事項 ]
- 脳卒中を含む脳血管有害事象 [参照 警告と注意事項 ]
- 小児、青年、および若年成人における自殺念慮および自殺行動 [参照 囲み警告 と 警告と注意事項 ]
- 神経弛緩性悪性症候群(NMS)[参照 警告と注意事項 ]
- 遅発性ジスキネジア [参照 警告と注意事項 ]
- 代謝変化 [参照 警告と注意事項 ]
- 病的賭博およびその他の強迫行為 [参照 警告と注意事項 ]
- 起立性低血圧 [参照 警告と注意事項 ]
- 滝 [参照 警告と注意事項 ]
- 白血球減少症、好中球減少症、および無顆粒球症 [参照 警告と注意事項 ]
- 発作/痙攣 [参照 警告と注意事項 ]
- 認知および運動障害の可能性 [参照 警告と注意事項 ]
- 体温調節 [参照 警告と注意事項 ]
- 自殺[見る 警告と注意事項 ]
- 嚥下障害 [参照 警告と注意事項 ]
臨床試験で成人患者に最もよく見られた副作用 (10%以上) は、吐き気、嘔吐、便秘、頭痛、めまい、アカシジア、不安、不眠、落ち着きのなさでした。
小児臨床試験で最も一般的な副作用(10%以上)は、傾眠、頭痛、嘔吐、錐体外路障害、疲労、食欲増進、不眠症、吐き気、鼻咽頭炎、体重増加でした。
ABILIFY は、統合失調症、双極性障害、大うつ病性障害、アルツハイマー型認知症、パーキンソン病、およびアルコール依存症の複数回投与の臨床試験に参加し、約 7,619 患者年を有する成人患者 13,543 人の安全性が評価されています。経口ABILIFY 10mgへの曝露とABILIFY注射への曝露のある749人の患者。合計 3,390 人の患者が少なくとも 180 日間経口 ABILIFY で治療され、経口 ABILIFY で治療された 1,933 人の患者は少なくとも 1 年間暴露されました。
ABILIFY 15mg は、統合失調症、双極性躁病、自閉症、またはトゥレット障害の複数回投与の臨床試験に参加し、約 1,342 患者年間経口 ABILIFY にさらされた 1,686 人の患者 (6 歳から 18 歳) で安全性が評価されています。 .合計 959 人の小児患者が少なくとも 180 日間、経口の ABILIFY で治療され、556 人の小児患者が経口の ABILIFY 10mg で治療され、少なくとも 1 年間の曝露がありました。
ABILIFY(抗うつ薬または気分安定薬による単剤療法および補助療法)の条件と治療期間には、二重盲検比較および非比較非盲検試験、入院患者および外来患者の試験、固定用量および可変用量試験、および短期および長期の曝露。
臨床試験の経験
統合失調症の成人患者
以下の調査結果は、ABILIFY 15 mg を 2 ~ 30 mg/日の範囲の用量で経口投与した 5 つのプラセボ対照試験 (4 週間が 4 つ、6 週間が 1 つ) のプールに基づいています。
一般的に観察される有害反応
統合失調症患者におけるABILIFY 20mgの使用に関連して一般的に観察された唯一の有害反応(発生率5%以上、ABILIFY発生率はプラセボの少なくとも2倍)はアカシジア(ABILIFY 8%; プラセボ 4%)でした。
双極性躁病の成人患者
単剤療法
以下の結果は、ABILIFY 15 mg を 1 日 15 または 30 mg 経口投与した 3 週間のプラセボ対照双極性躁病試験のプールに基づいています。
一般的に観察される有害反応
双極性躁病患者におけるABILIFYの使用に関連してよく観察される有害反応(5%以上の発生率およびプラセボの少なくとも2倍のABILIFY 15mgの発生率)を表16に示します。
成人ではあまり見られない有害反応
表 17 は、急性期治療中 (統合失調症で最大 6 週間、双極性躁病で最大 3 週間) に発生した有害反応のプールされた発生率を、最も近いパーセントに四捨五入して列挙しています。 ABILIFY で治療された患者 (用量 2 mg/日以上) であり、ABILIFY 20 mg で治療された患者の発生率が、組み合わせたデータセットでプラセボで治療された患者の発生率よりも高かった。
母集団のサブグループの調査では、年齢、性別、または人種に基づいて副作用の発生率が異なるという明確な証拠は明らかになりませんでした。
双極性躁病の補助療法を受けた成人患者
以下の所見は、リチウムまたはバルプロ酸による補助療法として、ABILIFY 15mg を 15 または 30mg/日の用量で投与した、双極性障害の成人患者のプラセボ対照試験に基づいています。
治療中止に伴う副作用
単剤療法としてリチウムまたはバルプロ酸のいずれかをすでに許容していた患者の研究では、有害反応による中止率は、補助的なプラセボで治療された患者の6%と比較して、補助的なABILIFYで治療された患者で12%でした.プラセボ治療を受けた患者と比較して、補助的なABILIFY治療を受けた患者の中止に関連する最も一般的な副作用は、アカシジア(それぞれ5%と1%)と振戦(それぞれ2%と1%)でした。
一般的に観察される有害反応
双極性躁病患者における補助的な ABILIFY およびリチウムまたはバルプロ酸に関連して一般的に観察された有害反応 (5% 以上の発生率および補助的なプラセボの少なくとも 2 倍の発生率) は、アカシジア、不眠症、および錐体外路障害でした。
双極性躁病の補助療法を受けた成人患者におけるあまり一般的でない有害反応
表 18 は、補助的な ABILIFY (15 または 30 の用量mg/日) とリチウムまたはバルプロ酸を併用しており、この組み合わせで治療された患者の発生率は、プラセボとリチウムまたはバルプロ酸で治療された患者の発生率よりも高かった。
統合失調症の小児患者(13~17歳)
以下の結果は、ABILIFY を 2 ~ 30 mg/日の範囲で経口投与した 6 週間のプラセボ対照試験に基づいています。
治療中止に伴う副作用
エビリファイ治療を受けた小児患者とプラセボ治療を受けた小児患者(13~17歳)の間の副作用による中止の発生率は、それぞれ5%と2%でした。
一般的に観察される有害反応
思春期の統合失調症患者(5%以上の発生率およびプラセボの少なくとも2倍のABILIFY発生率)の使用に関連してABILIFY 10mgの使用に関連して一般的に観察された副作用は、錐体外路障害、傾眠、および振戦でした.
双極性躁病の小児患者(10~17歳)
以下の結果は、ABILIFY を 1 日 10 または 30 mg の用量で経口投与した 4 週間のプラセボ対照試験に基づいています。
治療中止に伴う副作用
エビリファイ治療を受けた小児患者とプラセボ治療を受けた小児患者(10~17歳)の間の副作用による中止の発生率は、それぞれ7%と2%でした。
一般的に観察される有害反応
双極性躁病の小児患者における ABILIFY 20mg の使用に関連してよく観察される有害反応 (5% 以上の発生率およびプラセボの少なくとも 2 倍の ABILIFY 発生率) を表 19 に示します。
自閉症の小児患者 (6 ~ 17 歳)
以下の調査結果は、ABILIFY 20mg を 1 日 2 ~ 15mg の用量で経口投与した 2 つの 8 週間のプラセボ対照試験に基づいています。
治療中止に伴う副作用
エビリファイ治療を受けた小児患者とプラセボ治療を受けた小児患者(6歳から17歳)の間の副作用による中止の発生率は、それぞれ10%と8%でした。
一般的に観察される有害反応
自閉症の小児患者におけるABILIFYの使用に関連してよく観察される有害反応(5%以上の発生率およびプラセボの少なくとも2倍のABILIFY 10mgの発生率)を表20に示します。
トゥレット障害の小児患者(6~18歳)
以下の結果は、ABILIFY 15mg を 2 ~ 20mg/日の用量で経口投与した 8 週間および 10 週間のプラセボ対照試験 1 件に基づいています。
治療中止に伴う副作用
エビリファイ治療を受けた小児患者とプラセボ治療を受けた小児患者(6歳から18歳)の間の副作用による中止の発生率は、それぞれ7%と1%でした。
一般的に観察される有害反応
トゥレット障害の小児患者における ABILIFY の使用に関連してよく観察される有害反応 (5% 以上の発生率およびプラセボの少なくとも 2 倍の ABILIFY 10mg の発生率) を表 21 に示します。
統合失調症、双極性躁病、自閉症、トゥレット障害の小児患者(6~18歳)におけるあまり一般的でない有害反応
表 22 は、急性期治療中に発生した有害反応のプールされた発生率を、最も近いパーセントに四捨五入して列挙している (統合失調症で最大 6 週間、双極性躁病で最大 4 週間、自閉症で最大 8 週間、および最大 10 週間)。これには、ABILIFY で治療された小児患者の 2% 以上で発生し (用量 2 mg/日以上)、ABILIFY 10 mg で治療された患者の発生率が、プラセボ。
大うつ病性障害の補助療法としてエビリファイを投与されている成人患者
以下の調査結果は、継続的な抗うつ薬療法の補助療法として ABILIFY 20mg を 2 ~ 20mg の用量で投与した大うつ病性障害患者の 2 つのプラセボ対照試験のプールに基づいています。
治療中止に伴う副作用
副作用による中止の発生率は、補助的なABILIFY治療を受けた患者で6%、補助的なプラセボ治療を受けた患者で2%でした。
一般的に観察される有害反応
大うつ病性障害患者における補助的なエビリファイ 15mg の使用に関連して一般的に観察された副作用 (発生率 5% 以上、エビリファイ 15mg の発生率はプラセボの少なくとも 2 倍) は、アカシジア、落ち着きのなさ、不眠症、便秘、疲労、およびぼやけた視界。
大うつ病性障害の成人患者におけるあまり一般的でない有害反応
表 23 は、補助的な ABILIFY で治療された患者の 2% 以上で発生した有害反応のみを含む、急性治療中 (最大 6 週間) に発生した有害反応のプールされた発生率を最も近いパーセントに四捨五入して列挙している (用量 ≥2 mg/日) であり、組み合わせたデータセットにおいて、補助的な ABILIFY 10mg で治療された患者の発生率は、補助的なプラセボで治療された患者の発生率よりも高かった。
統合失調症または双極性躁病に関連する激越のある患者(筋肉内注射)
以下の調査結果は、統合失調症または双極性躁病に関連する激越を有する患者を対象に、ABILIFY 20mg 注射剤を 5.25mg から 15mg の用量で投与した 3 つのプラセボ対照試験のプールに基づいています。
一般的に観察される有害反応
統合失調症および双極性躁病に関連する動揺を伴う患者におけるABILIFY 10mg注射の使用に関連して、一般的に観察された副作用(吐き気)が1つありました(5%以上の発生率およびプラセボの少なくとも2倍のABILIFY 20mg発生率)。
統合失調症または双極性躁病に関連する激越患者におけるあまり一般的でない有害反応
表 24 は、ABILIFY 注射 (用量 ≥5.25 mg結合データセットでは、ABILIFY 15mg 注射で治療された患者の発生率がプラセボで治療された患者の発生率よりも高かった。
用量関連の有害反応
統合失調症
治療に起因する有害事象の発生率に対する用量反応関係は、統合失調症の成人患者を対象に、さまざまな固定用量 (2、5、10、15、20、および 30 mg/日) の経口 ABILIFY とプラセボを比較した 4 つの試験から評価されました。研究によって層別化されたこの分析は、用量反応関係の可能性があり、30 mg のみで最も顕著であった唯一の有害反応は傾眠 [鎮静を含む] であることを示しました。 (発生率はプラセボで7.1%、10mgで8.5%、15mgで8.7%、20mgで7.5%、30mgで12.6%)。
統合失調症の小児患者 (13 ~ 17 歳) の研究では、3 つの一般的な有害反応が用量反応関係の可能性があるように見えました。 %);傾眠(発生率はプラセボで6.0%、10mgで11.0%、30mgで21.6%)。振戦(発生率はプラセボで2.0%、10mgで2.0%、30mgで11.8%)。
バイポーラマニア
双極性躁病の小児患者 (10 歳から 17 歳) の研究では、4 週間で 4 つの一般的な副作用が用量反応関係の可能性がありました。錐体外路障害 (発生率はプラセボで 3.1%、10 mg で 12.2%、30 mg で 27.3%)。傾眠(発生率はプラセボで3.1%、10mgで19.4%、30mgで26.3%)。アカシジア (発生率はプラセボで 2.1%、10 mg で 8.2%、30 mg で 11.1%)。および唾液分泌過多 (発生率はプラセボで 0%、10 mg で 3.1%、30 mg で 8.1%)。
自閉症
自閉症の小児患者 (6 歳から 17 歳) を対象とした研究では、一般的な副作用の 1 つに用量反応関係がありました。 15 mg、18.5%)。
トゥレット障害
トゥレット障害の小児患者 (7 歳から 17 歳) を対象とした研究では、用量反応関係にある一般的な副作用はありませんでした。
錐体外路症状
統合失調症
成人の統合失調症を対象とした短期のプラセボ対照試験では、アカシジアに関連するイベントを除いて、ABILIFY 治療を受けた患者で報告された EPS 関連のイベントの発生率は 13% 対 プラセボでは 12% でした。また、ABILIFY 治療を受けた患者のアカシジア関連イベントの発生率は、8% 対プラセボの 4% でした。小児患者(13~17 歳)を対象とした統合失調症の短期プラセボ対照試験では、ABILIFY 治療患者で報告された EPS 関連イベント(アカシジア関連イベントを除く)の発生率は 25% であったのに対し、ABILIFY 治療患者では 7% でした。プラセボ;また、ABILIFY 治療を受けた患者のアカシジア関連イベントの発生率は、プラセボの 6% に対して 9% でした。
これらの試験から客観的に収集されたデータは、Simpson Angus Rating Scale (EPS の場合)、Barnes Akathisia Scale (アカシジアの場合)、および不随意運動評価尺度 (ジスキネジアの場合) で収集されました。成人の統合失調症試験では、客観的に収集されたデータは、バーンズ アカシジア スケール (ABILIFY 20mg、0.08; プラセボ、-0.05) を除いて、ABILIFY 10mg とプラセボの間に違いを示しませんでした。小児 (13 ~ 17 歳) の統合失調症試験では、シンプソン アンガス評価尺度 (ABILIFY 20mg、0.24; プラセボ、-0.29) を除いて、客観的に収集されたデータは ABILIFY 20mg とプラセボの間に違いを示しませんでした。
同様に、成人の統合失調症の長期 (26 週間) プラセボ対照試験では、シンプソン アンガス評価尺度 (EPS の場合)、バーンズ アカシジア スケール (アカシジアの場合)、および不随意の評価に関するデータを客観的に収集しました。 Movement Scales (ジスキネジア用) は、ABILIFY とプラセボの間に差を示しませんでした。
バイポーラマニア
成人の双極性躁病患者を対象とした短期のプラセボ対照試験では、アカシジアに関連するイベントを除いて、単剤療法のエビリファイ治療を受けた患者で報告された EPS 関連のイベントの発生率は 16% 対 プラセボでは 8% であり、単剤療法の ABILIFY 治療を受けた患者のアカシジア関連イベントは、プラセボの 4% に対して 13% でした。リチウムまたはバルプロ酸による補助療法の双極性躁病患者を対象とした 6 週間のプラセボ対照試験では、報告された EPS 関連のイベントの発生率は、補助的な ABILIFY 治療を受けた患者のアカシジアに関連するイベントを除いて、15% 対補助的なものでは 8% でした。プラセボおよび補助的なABILIFY治療を受けた患者のアカシジア関連イベントの発生率は、補助的なプラセボで19%対5%でした。双極性躁病の小児患者(10~17歳)を対象とした短期のプラセボ対照試験では、ABILIFY治療を受けた患者で報告されたEPS関連のイベント(アカシジア関連のイベントを除く)の発生率は26% vs. 5%でした。 ABILIFY 治療を受けた患者のアカシジア関連イベントの発生率は、プラセボの 2% に対して 10% でした。
ABILIFY 単剤療法による成人双極性躁病試験では、Simpson Angus Rating Scale と Barnes Akathia Scale は、ABILIFY 15mg とプラセボの間に有意差を示しました (ABILIFY、0.50; プラセボ、-0.01 および ABILIFY 10mg、0.21; プラセボ、-0.05)。不随意運動スケールの評価の変化は、ABILIFY 15mg 群とプラセボ群で同様でした。リチウムまたはバルプロ酸のいずれかによる補助療法として ABILIFY 20mg を用いた双極性躁病試験では、Simpson Angus Rating Scale および Barnes Akathisia Scale は、補助的な ABILIFY と補助的なプラセボとの間に有意差を示しました (ABILIFY 20mg、0.73; プラセボ、0.07 および ABILIFY 10mg、 0.30; プラセボ、0.11)。不随意運動スケールの評価の変化は、補助的なABILIFY 20mgと補助的なプラセボで同様でした。小児 (10 ~ 17 歳) の短期間の双極性躁病試験では、Simpson Angus Rating Scale は、ABILIFY 10mg とプラセボの間に有意差を示しました (ABILIFY 15mg、0.90; プラセボ、-0.05)。バーンズ アカシジア スケールおよび不随意運動スケールの評価の変化は、ABILIFY 20mg 群とプラセボ群で同様でした。
大鬱病性障害
大うつ病性障害における短期のプラセボ対照試験では、アカシジア関連のイベントを除く、報告された EPS 関連のイベントの発生率は、補助的な ABILIFY 治療を受けた患者では 8% 対、補助的なプラセボ治療を受けた患者では 5% でした。補助的なABILIFY治療を受けた患者のアカシジア関連イベントの発生率は、補助的なプラセボ治療を受けた患者の4%に対して25%でした。
大うつ病性障害試験では、シンプソン アンガス評価尺度とバーンズ アカシジア スケールは、補助的 ABILIFY と補助的プラセボの間に有意差を示しました (ABILIFY 10mg、0.31; プラセボ、0.03 および ABILIFY、0.22; プラセボ、0.02)。不随意運動スケールの評価の変化は、補助ABILIFYグループと補助プラセボグループで同様でした。
自閉症
小児患者(6歳から17歳)の自閉性障害を対象とした短期のプラセボ対照試験では、ABILIFY治療を受けた患者で報告されたEPS関連のイベント(アカシジア関連のイベントを除く)の発生率は18% vs. 2%でした。 ABILIFY 治療を受けた患者のアカシジア関連イベントの発生率は、プラセボで 3% 対 9% でした。
小児 (6 ~ 17 歳) の短期自閉症障害試験では、Simpson Angus 評価尺度は、ABILIFY とプラセボの間に有意差を示しました (ABILIFY 20mg、0.1; プラセボ、-0.4)。バーンズ アカシジア スケールおよび不随意運動スケールの評価の変化は、ABILIFY 10mg 群とプラセボ群で同様でした。
トゥレット障害
小児患者(6~18歳)のトゥレット障害における短期のプラセボ対照試験では、ABILIFY治療を受けた患者で報告されたEPS関連のイベント(アカシジア関連のイベントを除く)の発生率は7%対6%でした。 ABILIFY 治療を受けた患者のアカシジア関連イベントの発生率は、プラセボで 4% 対 6% でした。
小児 (6 ~ 18 歳) の短期トゥレット障害試験では、シンプソン アンガス評価尺度、バーンズ アカシジア スケール、および不随意運動評価尺度の変化は、ABILIFY 15mg とプラセボで臨床的に有意な差はありませんでした。
統合失調症または双極性躁病に伴う動揺
統合失調症または双極性躁病に関連する興奮を伴う患者を対象としたプラセボ対照試験では、ABILIFY 治療患者のアカシジアに関連するイベントを除いて報告された EPS 関連イベントの発生率は 2% 対 プラセボおよびアカシジアの発生率は 2% でした。 ABILIFY 治療を受けた患者の関連イベントは 2% であったのに対し、プラセボでは 0% でした。 Simpson Angus Rating Scale (EPS の場合) および Barnes Akathia Scale (アカシジアの場合) で客観的に収集されたすべての治療グループのデータでは、ABILIFY 10mg とプラセボの間に差は示されませんでした。
ジストニア
ジストニアの症状、筋肉群の長期にわたる異常な収縮は、治療の最初の数日間に影響を受けやすい個人に発生する可能性があります.ジストニアの症状には、首の筋肉のけいれん、時には喉の圧迫感、嚥下困難、呼吸困難、および/または舌の突出が含まれます.これらの症状は低用量でも発生する可能性がありますが、第 1 世代の抗精神病薬の用量が多いほど、より頻繁に発生し、重症度が高くなります。急性ジストニアのリスクの上昇は、男性および若い年齢層で観察されます。
臨床試験で観察された追加の知見
長期二重盲検プラセボ対照試験における有害反応
統合失調症患者を対象に、ABILIFY 10mg の経口投与とプラセボを比較した 26 週間の二重盲検試験で報告された副作用は、振戦の発生率が高いことを除けば、短期間のプラセボ対照試験で報告されたものと概ね一致していました [8 ABILIFY 20mg の % (12/153) 対プラセボの 2% (3/153)]。この研究では、振戦の症例の大部分は軽度であり (8/12 は軽度、4/12 は中等度)、治療の初期に発生し (9/12 ≤49 日)、限られた期間 (7/12 ≤ 10日間)。まれに振戦がABILIFYの中止につながった(
エビリファイの市販前評価中に観察されたその他の有害反応
次のリストには、反応は含まれていません: 1) 以前の表またはラベル付けの他の場所に既にリストされているもの、2) 薬物の原因が遠く離れているもの、3) 一般的すぎて情報が得られないもの、4) 重大な影響があるとは見なされなかったもの臨床的意義、または 5) プラセボと同等またはそれ以下の割合で発生した。
反応は、次の定義に従って身体システムによって分類されます。頻繁な副作用は、少なくとも 1/100 の患者で発生するものです。まれな有害反応は、1/100 から 1/1000 の患者に発生するものです。まれな反応とは、患者の 1/1000 未満で発生するものです。
成人 - 経口投与
血液およびリンパ系の障害: まれ - 血小板減少症
心疾患: まれ - 徐脈、動悸、まれ - 心房粗動、心肺停止、房室ブロック、心房細動、狭心症、心筋虚血、心筋梗塞、心肺不全
目の病気: まれ - 羞明;まれ - 複視
胃腸障害: まれ - 胃食道逆流症
一般的な障害および投与部位の状態: 頻繁 - 無力;まれ - 末梢浮腫、胸痛;まれ - 顔面浮腫
肝胆道疾患: まれ - 肝炎、黄疸
免疫系疾患 まれ - 過敏症
怪我、中毒、および手続き上の合併症: まれ - 落ちる;まれ - 熱射病
調査: 頻繁 - 体重減少、まれ - 肝臓酵素の増加、血糖値の増加、血中乳酸脱水素酵素の増加、ガンマグルタミルトランスフェラーゼの増加;まれ - 血中プロラクチンの増加、血中尿素の増加、血中クレアチニンの増加、血中ビリルビンの増加、心電図の QT 延長、糖化ヘモグロビンの増加
代謝および栄養障害: 頻繁 - 食欲不振;まれ - 低カリウム血症、低ナトリウム血症、低血糖症
筋骨格および結合組織障害: まれ - 筋力低下、筋緊張;まれ - 横紋筋融解症、可動性の低下
神経系障害: まれ - パーキンソニズム、記憶障害、歯車の硬直、運動機能低下症、運動緩慢;まれ - 無動症、ミオクローヌス、協調異常、言語障害、グランドマル痙攣。
精神障害: まれ - 攻撃性、性欲の喪失、せん妄;まれ - 性欲亢進、無オルガスム症、チック、殺人念慮、緊張病、睡眠歩行
腎および尿路疾患: まれ - 尿閉、夜間頻尿
生殖器系および乳房疾患: まれ - 勃起不全;まれ - 女性化乳房、月経不順、無月経、乳房痛、持続勃起症
呼吸器、胸部、および縦隔の障害: まれ - 鼻づまり、呼吸困難
皮膚および皮下組織の疾患: まれ - 発疹、多汗症、かゆみ、光過敏反応、脱毛症;まれ - 蕁麻疹
血管障害: まれ - 低血圧、高血圧
小児患者 - 経口投与
歳から 18 歳までの 1,686 人の小児患者のプールされたデータベースで観察されたほとんどの有害事象は、成人集団でも観察されました。小児集団で観察されたその他の副作用を以下に示します。
眼疾患 まれ - 眼科学的危機
胃腸障害: まれ - 舌の乾燥、舌のけいれん
調査: 頻繁 - 血中インスリンの増加
神経系障害: まれ - 寝言
腎および尿路疾患 頻繁 - 夜尿症
皮膚および皮下組織の疾患: まれ - 多毛症
成人 - 筋肉内注射
ABILIFY注射で治療された749人の成人患者のプールされたデータベースで観察されたほとんどの有害反応は、経口ABILIFYで治療された成人集団でも観察されました. ABILIFY 注射群で観察されたその他の副作用を以下に示します。
一般的な障害および投与部位の状態: ≥1/100 患者 - 注射部位反応; ≥1/1000 患者および
市販後の経験
エビリファイの承認後の使用において、以下の副作用が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、薬物曝露との因果関係を常に確立できるとは限りません: アレルギー反応 (アナフィラキシー反応、血管性浮腫、喉頭痙攣、掻痒/蕁麻疹、または口腔咽頭痙攣)、病理学的ギャンブルの発生、しゃっくりと血糖変動。
薬物相互作用
エビリファイと臨床上重要な相互作用を有する医薬品
エビリファイと臨床的に重要な相互作用を持たない医薬品
薬物動態研究に基づいて、ファモチジン、バルプロ酸、リチウム、ロラゼパムと併用投与する場合、ABILIFY の用量調整は必要ありません。
さらに、CYP2D6 (例、デキストロメトルファン、フルオキセチン、パロキセチン、またはベンラファキシン)、CYP2C9 (例、ワルファリン)、CYP2C19 (例、オメプラゾール、ワルファリン、エスシタロプラム)、または CYP3A4 (例、デキストロメトルファン) の基質については、用量調節は必要ありません。エビリファイと併用した場合。さらに、バルプロ酸、リチウム、ラモトリジン、ロラゼパム、またはセルトラリンを ABILIFY と併用する場合、投与量の調整は必要ありません。 臨床薬理学 ]。
薬物乱用と依存
規制物質
エビリファイは規制物質ではありません。
乱用
ABILIFY は、乱用、耐性、または身体的依存の可能性について、ヒトで体系的に研究されていません。したがって、患者は薬物乱用の病歴について慎重に評価されるべきであり、そのような患者は、ABILIFY 20mg の誤用または乱用の徴候 (例えば、耐性の発達、用量の増加、薬物探索行動) について注意深く観察されるべきです。
依存
サルの身体依存研究では、投与を突然中止すると禁断症状が観察されました。臨床試験では薬物探索行動の傾向は明らかになりませんでしたが、これらの観察結果は系統だったものではなく、この限られた経験に基づいて、CNS 活性薬物がどの程度誤用され、流用されるかを予測することはできません。および/または販売後に悪用される。
警告
の一部として含まれています 予防 セクション。
予防
認知症関連精神病の高齢患者における死亡率の増加
死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。 ABILIFY (アリピプラゾール) は、認知症関連精神病患者の治療には承認されていません [囲み警告を参照]。
アルツハイマー病に関連する精神病の高齢患者における安全性の経験
アルツハイマー病に関連する精神病の高齢患者 (n=938; 平均年齢: 82.4 歳; 範囲: 56-99 歳) における ABILIFY 10mg の 3 つの 10 週間のプラセボ対照試験では、 ≥3% の発生率で報告され、ABILIFY 15mg の発生率はプラセボの少なくとも 2 倍で、無気力 [プラセボ 2%、ABILIFY 5%]、傾眠 (鎮静を含む) [プラセボ 3%、ABILIFY 8%]、失禁 (主に、尿失禁)[プラセボ 1%、ABILIFY 5%]、過剰な唾液分泌 [プラセボ 0%、ABILIFY 4%]、および立ちくらみ [プラセボ 1%、ABILIFY 4%]。
認知症に伴う精神病患者の治療におけるABILIFY 15mgの安全性と有効性は確立されていません。処方者がそのような患者を ABILIFY 15mg で治療することを選択した場合、偶発的な損傷や誤嚥の素因となる可能性のある嚥下困難または過度の傾眠の出現を評価する [参照 囲み警告 ]。
脳卒中を含む脳血管有害事象
認知症関連精神病のプラセボ対照臨床試験(2つの変動用量試験および1つの固定用量試験)では、ABILIFY治療を受けた患者において、死亡を含む脳血管有害事象(例えば、脳卒中、一過性脳虚血発作)の発生率が増加しました(平均年齢: 84 歳、範囲: 78 ~ 88 歳)。固定用量試験では、ABILIFY で治療された患者の脳血管有害事象について、統計的に有意な用量反応関係がありました。 ABILIFY は、認知症関連の精神病患者の治療には承認されていない [参照 囲み警告 ]。
小児、青年、若年成人の自殺念慮と行動
成人および小児の大うつ病性障害(MDD)の患者は、抗うつ薬を服用しているかどうかにかかわらず、うつ病の悪化および/または自殺念慮および自殺行動(自殺傾向)の出現、または行動の異常な変化を経験する可能性があります。リスクは、有意な寛解が起こるまで持続する可能性があります。自殺は、うつ病やその他の特定の精神障害の既知のリスクであり、これらの障害自体が自殺の最も強力な予測因子です。しかし、抗うつ薬が治療の初期段階で特定の患者のうつ病の悪化と自殺傾向の出現を誘発する役割を果たしている可能性があるという長年の懸念がありました.抗うつ薬 (SSRI など) の短期のプラセボ対照試験のプール分析では、これらの薬が MDD の子供、青年、若年成人 (18 ~ 24 歳) の自殺念慮および自殺行動 (自殺傾向) のリスクを高めることが示されました。およびその他の精神障害。短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65 歳以上の成人では、プラセボと比較して抗うつ薬が減少しました。
MDD、強迫性障害(OCD)、またはその他の精神障害を有する小児および青年を対象としたプラセボ対照試験のプール分析には、4,400 人を超える患者を対象とした 9 種類の抗うつ薬の合計 24 の短期試験が含まれていました。 MDD またはその他の精神障害を有する成人を対象としたプラセボ対照試験のプール分析には、77,000 人を超える患者を対象とした 11 種類の抗うつ薬の合計 295 件の短期試験 (期間の中央値は 2 か月) が含まれていました。薬物間で自殺のリスクにかなりのばらつきがありましたが、研究されたほとんどすべての薬物で若い患者が増加する傾向がありました。さまざまな適応症で自殺の絶対リスクに違いがあり、MDD での発生率が最も高かった。ただし、リスクの違い (薬物とプラセボ) は、年齢層内および適応症全体で比較的安定していました。これらのリスクの違い (治療を受けた患者 1000 人あたりの自殺傾向の症例数における薬物とプラセボの違い) を表 5 に示します。
どの小児科試験でも自殺は発生していません。成人試験では自殺がありましたが、自殺に対する薬物の影響について結論を出すには十分な数ではありませんでした。
自殺リスクが長期間の使用、つまり数ヶ月以上の使用に及ぶかどうかは不明です。しかし、うつ病の成人におけるプラセボ対照維持試験から、抗うつ薬の使用がうつ病の再発を遅らせることができるという実質的な証拠があります.
適応症を問わず抗うつ薬で治療されているすべての患者は、特に薬物療法のコースの最初の数か月間、または用量変更時に、臨床的悪化、自殺傾向、行動の異常な変化について適切に監視し、注意深く観察する必要があります。または減少します。
次の症状、不安、動揺、パニック発作、不眠症、過敏性、敵意、攻撃性、衝動性、アカシジア (精神運動の落ち着きのなさ)、軽躁病、および躁病は、MDD および抗うつ薬で治療されている成人および小児患者で報告されています。他の適応症、精神科および非精神科の両方。そのような症状の出現と、うつ病の悪化および/または自殺衝動の出現との間の因果関係は確立されていませんが、そのような症状が自殺傾向の出現の前兆を表している可能性があるという懸念があります.
うつ病が持続的に悪化している患者、またはうつ病や自殺傾向の悪化の前兆である可能性のある緊急の自殺願望または症状を経験している患者では、場合によっては投薬を中止することを含め、治療計画の変更を検討する必要があります。特にこれらの症状が重度で突然の場合発症したか、患者の症状の一部ではありませんでした。
大うつ病性障害またはその他の適応症(精神医学的および非精神医学的両方)の抗うつ薬で治療されている患者の家族および介護者は、動揺、過敏性、行動の異常な変化、および上記のその他の症状の出現について患者を監視する必要性について警告する必要があります。 、および自殺傾向の出現、およびそのような症状を医療提供者に直ちに報告すること。このようなモニタリングには、家族や介護者による毎日の観察が含まれる必要があります。過剰摂取のリスクを軽減するために、ABILIFY の処方は、適切な患者管理と一致する最小量の錠剤用に作成する必要があります。
双極性障害の患者のスクリーニング
大うつ病エピソードは、双極性障害の最初の症状である可能性があります。このようなエピソードを抗うつ薬のみで治療すると、双極性障害のリスクがある患者に混合/躁病エピソードが発生する可能性が高くなる可能性があると一般的に考えられています (対照試験では確立されていません)。上記の症状のいずれかがそのような変換を表しているかどうかは不明です。ただし、抗うつ薬による治療を開始する前に、抑うつ症状のある患者を適切にスクリーニングして、双極性障害のリスクがあるかどうかを判断する必要があります。そのようなスクリーニングには、自殺、双極性障害、うつ病の家族歴など、詳細な精神病歴を含める必要があります。
ABILIFY 20mg は、小児集団のうつ病の治療に使用することは承認されていないことに注意してください。
悪性症候群(NMS)
ABILIFYを含む抗精神病薬の投与により、神経弛緩性悪性症候群(NMS)と呼ばれることもある致命的な症状の複合体が発生する可能性があります。世界的な臨床データベースでは、ABILIFY 15mg の治療中に NMS のまれな症例が発生しました。 NMS の臨床症状は、高熱、筋肉の硬直、精神状態の変化、および自律神経系の不安定性 (不規則な脈拍または血圧、頻脈、発汗、および不整脈) の証拠です。追加の徴候には、クレアチンホスホキナーゼの上昇、ミオグロビン尿症 (横紋筋融解症)、および急性腎不全が含まれる場合があります。
この症候群の患者の診断評価は複雑です。診断を下す際には、臨床症状に深刻な医学的疾患(肺炎、全身感染症など)と未治療または不十分な治療を受けた錐体外路徴候および症状(EPS)の両方が含まれる症例を除外することが重要です。鑑別診断におけるその他の重要な考慮事項には、中枢性抗コリン作動性毒性、熱射病、薬物熱、および原発性中枢神経系の病理が含まれます。
NMS の管理には次のことを含めるべきです。 2) 集中的な対症療法と医学的モニタリング。 3) 特定の治療法が利用可能な付随する深刻な医学的問題の治療。合併症のない NMS に対する特定の薬理学的治療レジメンについては、一般的な合意はありません。
患者が NMS からの回復後に抗精神病薬治療を必要とする場合、薬物療法の再導入の可能性を慎重に検討する必要があります。 NMSの再発が報告されているため、患者を注意深く監視する必要があります。
遅発性ジスキネジア
抗精神病薬で治療されている患者では、潜在的に不可逆的で不随意の運動障害の症候群が発生する可能性があります。この症候群の有病率は高齢者、特に年配の女性の間で最も高いようですが、抗精神病薬治療の開始時に、どの患者がこの症候群を発症する可能性があるかを予測するために有病率の推定に頼ることは不可能です。抗精神病薬製品が遅発性ジスキネジアを引き起こす可能性が異なるかどうかは不明です。
遅発性ジスキネジアを発症するリスクとそれが不可逆的になる可能性は、治療期間と患者に投与される抗精神病薬の総累積用量が増加するにつれて増加すると考えられています。しかし、この症候群は、低用量での比較的短い治療期間の後に発生する可能性がありますが、それほど一般的ではありません.
遅発性ジスキネジアは、抗精神病薬の治療を中止すると、部分的または完全に寛解することがあります。しかし、抗精神病薬の治療自体が、この症候群の徴候や症状を抑制 (または部分的に抑制) する可能性があり、それによって、根底にあるプロセスを覆い隠す可能性があります。症状の抑制が症候群の長期経過に及ぼす影響は不明です。
これらの考慮事項を考慮すると、遅発性ジスキネジアの発生を最小限に抑える可能性が最も高い方法で ABILIFY を処方する必要があります。慢性抗精神病薬治療は、一般に、(1) 抗精神病薬に反応することが知られている慢性疾患に苦しむ患者、および (2) 同等に効果的であるが潜在的に害の少ない代替治療法が利用できない、または適切でない患者に限定されるべきです。慢性的な治療を必要とする患者では、満足のいく臨床反応をもたらす最小用量と最短の治療期間を追求する必要があります。継続的な治療の必要性は、定期的に再評価する必要があります。
遅発性ジスキネジアの徴候と症状がABILIFYを服用している患者に現れた場合、投薬の中止を考慮する必要があります。ただし、一部の患者では、症候群の存在にもかかわらず、ABILIFY 15mg による治療が必要になる場合があります。
代謝変化
非定型抗精神病薬は、高血糖/真性糖尿病、脂質異常症、および体重増加を含む代謝変化と関連しています。このクラスのすべての薬物は何らかの代謝変化を引き起こすことが示されていますが、各薬物には固有のリスクプロファイルがあります.
高血糖/糖尿病
非定型抗精神病薬で治療された患者では、ケトアシドーシスまたは高浸透圧性昏睡または死亡を伴う極端な場合もある高血糖が報告されています。エビリファイで治療された患者における高血糖の報告がある[参照] 有害反応 ]。非定型抗精神病薬の使用とグルコース異常との関係の評価は、統合失調症患者における真性糖尿病のバックグラウンドリスクの増加の可能性と、一般集団における真性糖尿病の発生率の増加の可能性によって複雑になっています。これらの交絡因子を考慮すると、非定型抗精神病薬の使用と高血糖関連の有害事象との関係は完全には理解されていません。しかし、疫学的研究は、非定型抗精神病薬で治療された患者における高血糖関連の有害反応のリスクの増加を示唆しています。これらの研究が実施された時点では ABILIFY は販売されていなかったため、ABILIFY がこのリスクの増加と関連しているかどうかは不明です。非定型抗精神病薬で治療された患者における高血糖関連の有害反応の正確なリスク推定値は入手できません。
非定型抗精神病薬を開始した真性糖尿病の診断が確立された患者は、定期的に血糖コントロールの悪化を監視する必要があります。糖尿病の危険因子(例、肥満、糖尿病の家族歴)を持ち、非定型抗精神病薬による治療を開始する患者は、治療開始時と治療中定期的に空腹時血糖検査を受けるべきです。非定型抗精神病薬で治療された患者は、多飲、多尿、多食、衰弱などの高血糖の症状を監視する必要があります。非定型抗精神病薬による治療中に高血糖の症状を発症した患者は、空腹時血糖検査を受ける必要があります。場合によっては、非定型抗精神病薬を中止すると高血糖が解消されます。しかし、一部の患者は、疑わしい薬物の中止にもかかわらず、抗糖尿病治療の継続を必要としました。
大人
主に統合失調症または双極性障害の成人を対象とした 13 のプラセボ対照単剤療法試験の分析では、ABILIFY 治療を受けた患者の空腹時血糖の平均変化 (+4.4 mg/dL; 曝露の中央値 25 日; N=1057) は有意ではありませんでした。プラセボ治療を受けた患者とは異なります (+2.5 mg/dL; 曝露の中央値 22 日; N=799)。表 6 は、プラセボ治療患者 (暴露中央値 22 日) と比較して、ベースライン (暴露中央値 25 日) で正常および境界空腹時血糖を有する ABILIFY 治療患者の割合を示しています。
24 週の時点で、ABILIFY 投与患者の空腹時血糖の平均変化は、プラセボ投与患者と有意差はありませんでした [それぞれ、+2.2 mg/dL (n=42) および +9.6 mg/dL (n=28)]。 .
大うつ病性障害の補助的な ABILIFY 治療を受けた患者における空腹時血糖の平均変化 (+0.7 mg/dL; 曝露の中央値 42 日; N=241) は、プラセボ治療を受けた患者 (+0.8 mg/dL; 中央値) と有意な差はありませんでした。暴露 42 日;N=246)。表 7 は、大うつ病性障害患者を対象とした 2 つのプラセボ対照補助試験 (曝露の中央値 42 日) から空腹時血糖値が変化した成人患者の割合を示しています。
小児患者および青年
統合失調症の青年(13~17 歳)と双極性障害の小児患者(10~17 歳)を対象とした 2 つのプラセボ対照試験の分析では、ABILIFY 治療を受けた患者の空腹時血糖の平均変化(+4.8 mg/dL;暴露期間の中央値 43 日間; N=259) は、プラセボ治療を受けた患者 (+1.7 mg/dL; 暴露期間の中央値 42 日間; N=123) と有意な差はありませんでした。
自閉性障害に関連する易怒性を有する小児および青年期の患者 (6 歳から 17 歳) を対象とした 2 つのプラセボ対照試験の分析では、暴露期間の中央値が 56 日間であり、ABILIFY 治療を受けた患者の空腹時血糖の平均変化 (-0.2 mg) /dL; N = 83) は、プラセボ治療を受けた患者 (-0.6 mg/dL; N = 33) よりも有意差はありませんでした。
トゥレット障害の小児および青年患者 (6 歳から 18 歳) を対象とした 2 つのプラセボ対照試験の分析では、暴露期間の中央値が 57 日間であり、ABILIFY 治療を受けた患者の空腹時血糖の平均変化 (0.79 mg/dL; N = 90) は、プラセボ治療を受けた患者 (-1.66 mg/dL; N = 58) と有意な差はありませんでした。
表 8 は、プールされた思春期の統合失調症患者と小児双極性障害患者 (42 ~ 43 日間の曝露の中央値) の空腹時血糖値が変化した患者の割合を示しています。自閉性障害 (曝露の中央値 56 日) の 2 つのプラセボ対照試験、およびトゥレット障害 (曝露の中央値 57 日) の小児患者 (6 ~ 18 歳) による 2 つのプラセボ対照試験から。
プールされた思春期統合失調症および小児双極性障害試験の12週間で、ABILIFY治療患者の空腹時血糖の平均変化は、プラセボ治療患者[+2.4 mg / dL(n = 81)および+ 0.1 mg /dL(n=15)、それぞれ]。
脂質異常症
非定型抗精神病薬で治療された患者では、脂質の望ましくない変化が観察されています。
空腹時/非空腹時総コレステロール、空腹時トリグリセリド、空腹時LDL、および空腹時/非空腹時HDLの正常レベルから臨床的に有意なレベルへの変化の割合において、ABILIFY治療患者とプラセボ治療患者の間に有意差はありませんでした.少なくとも 12 週間または 24 週間の暴露を受けた患者の分析は、少数の患者によって制限されていました。
大人
表 9 は、主に統合失調症および双極性障害の単剤療法プラセボ対照試験からの成人患者の割合を示しており、総コレステロール (17 件の試験からプール; 曝露の中央値 21 ~ 25 日)、空腹時トリグリセリド (8 件の試験からプール; 中央値) の変化を示しています。空腹時 LDL コレステロール (8 つの試験からプール; 曝露の中央値 39 ~ 45 日、ベースラインの空腹時 LDL 測定値が正常で、治療曝露の中央値が 24 日のプラセボ治療患者を除く)、および HDL コレステロール (9 つの試験からプール)試験; 曝露の中央値は 40 ~ 42 日)。
成人を対象とした単剤療法試験では、12 週および 24 週で、総コレステロール(空腹時/非空腹時)、空腹時トリグリセリド、および空腹時 LDL コレステロールが正常から高値に変化した患者の割合は、ABILIFY 治療患者とプラセボ治療患者の間で類似していました。 12 週間、総コレステロール (空腹時/非空腹時)、1/71 (1.4%) vs. 3/74 (4.1%);空腹時トリグリセリド、8/62 (12.9%) 対 5/37 (13.5%);空腹時 LDL コレステロール、それぞれ 0/34 (0%) 対 1/25 (4.0%); 24 週間で、総コレステロール (絶食/非絶食)、1/42 (2.4%) 対 3/37 (8.1%)。空腹時トリグリセリド、5/34 (14.7%) 対 5/20 (25%);空腹時 LDL コレステロール、それぞれ 0/22 (0%) 対 1/18 (5.6%)。
表 10 は、大うつ病性障害の成人患者を対象とした 2 つのプラセボ対照補助試験から、総コレステロール (空腹時/非空腹時)、空腹時トリグリセリド、空腹時 LDL コレステロール、および HDL コレステロールに変化が見られた患者の割合を示しています (曝露の中央値は 42 日)。
小児患者および青年
表 11 は、統合失調症の青年 (13 ~ 17 歳) と双極性障害の小児患者 (10 ~ 17 歳) の割合を示しており、総コレステロールと HDL コレステロールの変化 (2 つのプラセボ対照試験からプール; 曝露の中央値は 42 ~ 43 日) ) および空腹時トリグリセリド (2 つのプラセボ対照試験からプール; 曝露の中央値は 42 ~ 44 日)。
統合失調症の思春期患者と双極性障害の小児患者を対象とした単剤療法試験では、12 週目と 24 週目の時点で、総コレステロール (空腹時/非空腹時)、空腹時トリグリセリド、空腹時 LDL コレステロールが正常から高値に変化した患者の割合は、ABILIFY と ABILIFY でほぼ同じでした。 - およびプラセボ治療を受けた患者: 12 週間で、総コレステロール (絶食/非絶食)、0/57 Â (0%) vs. 0/15 (0%);空腹時トリグリセリド、それぞれ 2/72 (2.8%) 対 1/14 (7.1%)。 24 週間で、総コレステロール (絶食/非絶食)、0/36 (0%) 対 0/12 (0%)。空腹時トリグリセリド、それぞれ 1/47 (2.1%) 対 1/10 (10.0%)。
表 12 は、小児患者 (6 ~ 17 歳) を対象とした 2 つのプラセボ対照試験から得られた、総コレステロール (空腹時/非空腹時) および空腹時トリグリセリド (曝露の中央値 56 日) および HDL コレステロール (曝露の中央値 55 ~ 56 日) が変化した患者の割合を示しています。年) 自閉性障害に関連する過敏症。
表 13 は、小児患者 (6 ~ 18 歳) を対象とした 2 つのプラセボ対照試験から、総コレステロール (空腹時/非空腹時) および空腹時トリグリセリド (曝露の中央値 57 日) および HDL コレステロール (曝露の中央値 57 日) が変化した患者の割合を示しています。トゥレット障害で。
体重の増加
非定型抗精神病薬の使用により、体重増加が観察されています。体重の臨床モニタリングが推奨されます。
大人
主にプールされた統合失調症と双極性障害からの 13 のプラセボ対照単剤療法試験の分析では、暴露期間の中央値が 21 ~ 25 日で、ABILIFY 治療を受けた患者の体重の平均変化は +0.3 kg (N=1673) でした。プラセボ対照患者では -0.1 kg (N=1100) まで。 24 週の時点で、ABILIFY 治療を受けた患者の体重のベースラインからの平均変化は -1.5 kg (n=73) であったのに対し、プラセボ治療を受けた患者では -0.2 kg (n=46) でした。
抗うつ薬に ABILIFY を追加する試験では、患者はまず 8 週間の抗うつ薬治療を受け、続いて 6 週間の補助的な ABILIFY 10mg またはプラセボを現在の抗うつ薬治療に加えて受けました。補助的な ABILIFY を投与された患者の体重の平均変化は +1.7 kg (N=347) であったのに対し、補助的なプラセボを投与された患者では +0.4 kg (N=330) でした。
表 14 は、体重増加が体重の 7%以上である成人患者の割合を適応症ごとに示しています。
小児患者および青年
統合失調症の青少年 (13 ~ 17 歳) と双極性障害の小児患者 (10 ~ 17 歳) を対象とした 2 つのプラセボ対照試験の分析では、暴露期間の中央値が 42 ~ 43 日で、ABILIFY 治療を受けた患者の平均体重変化はプラセボ治療患者の+0.3 kg (N=187) と比較して、患者は+1.6 kg (N=381) でした。 24 週での体重のベースラインからの平均変化は、
ABILIFY 治療を受けた患者は +5.8 kg (n=62) であったのに対し、プラセボ治療を受けた患者は +1.4 kg (n=13) でした。
自閉性障害に関連する過敏症患者(6~17歳)を対象とした2つの短期プラセボ対照試験で、暴露期間の中央値が56日で、ABILIFY治療を受けた患者の体重の平均変化は+1.6kg(n=209)でした。 ) プラセボ治療患者の +0.4 kg (n=98) と比較。
トゥレット障害患者(6歳から18歳)を対象とした2つの短期プラセボ対照試験で、暴露期間の中央値が57日で、ABILIFY治療を受けた患者の体重の平均変化は+1.5kg(n=105)でした。 ) プラセボ治療患者の +0.4 kg (n=66) と比較。
表 15 は、体重の 7% 以上の体重増加を示す小児および青年患者の割合を適応症ごとに示しています。
統合失調症の青少年 (13 ~ 17 歳) と双極性障害の小児患者 (10 ~ 17 歳) の 2 つのプラセボ対照試験から患者を登録した非盲検試験では、73.2% の患者 (238/325) が 26 を完了しました。エビリファイによる数週間の治療。 26 週間後、患者の 32.8% が体重の 7% 以上増加しましたが、通常の成長に合わせて調整されていません。正常な成長を調整するために、z スコアが導出されました (標準偏差 [SD] で測定)。これは、年齢および性別が一致した人口基準との比較により、小児患者および青年の自然な成長を正規化します。 z スコアの変化
つの短期プラセボ対照試験から患者を登録した非盲検試験では、自閉性障害に関連する過敏症の患者 (6 歳から 17 歳) と de novo 患者が参加し、60.3% (199/330) が 1 つを完了しました。エビリファイによる治療の年。 9 か月以上の治療を受けた患者の体重 z スコアの平均変化は 0.26 SD でした。
適応症で小児患者を治療する場合は、体重増加を監視し、正常な成長に期待される体重と比較して評価する必要があります。
病理学的ギャンブルおよびその他の強迫行為
市販後の症例報告によると、患者は、特にギャンブルに対する強い衝動を経験する可能性があり、アリピプラゾールを服用している間、これらの衝動を制御できないことが示唆されています。あまり頻繁に報告されていない他の強迫的な衝動には、性的衝動、買い物、食事またはむちゃ食い、およびその他の衝動的または強迫的な行動が含まれます。患者はこれらの行動を異常であると認識していない可能性があるため、処方者は患者またはその介護者に、治療中の新しいまたは激しいギャンブル衝動、強迫的な性的衝動、強迫的な買い物、むちゃ食いまたは強迫的な食事、またはその他の衝動の発生について具体的に尋ねることが重要です。アリピプラゾールで。衝動制御の症状は、基礎疾患に関連している可能性があることに注意する必要があります。すべてではありませんが、場合によっては、用量を減らしたり、投薬を中止したりすると、衝動が止んだと報告されています.強迫行為は、認識されない場合、患者や他の人に害を及ぼす可能性があります。患者がそのような衝動を起こした場合は、用量を減らすか、投薬を中止することを検討してください。
起立性低血圧
ABILIFY 20mg は起立性低血圧を引き起こす可能性があります。経口ABILIFY(n = 2467)の成人患者の短期間のプラセボ対照試験からの起立性低血圧関連イベントの発生率には、(ABILIFY 20mgの発生率、プラセボの発生率)起立性低血圧(1%、0.3%)、姿勢めまい( 0.5%、0.3%)、および失神 (0.5%、0.4%); ABILIFY の経口投与を受けている 6 歳から 18 歳の小児患者 (n=732) には、起立性低血圧 (0.5%、0%)、体位性めまい (0.4%、0%)、失神 (0.2%、0%) が含まれていました。また、ABILIFY 注射を受けた患者 (n=501) には、起立性低血圧 (0.6%、0%)、体位性めまい (0.2%、0.5%)、および失神 (0.4%、0%) が含まれていました [参照 有害反応 ]。
エビリファイの有意な起立性血圧変化(立位と仰臥位の値を比較した場合、25 bpm以上の心拍数の増加を伴う収縮期血圧の20 mmHg以上の低下として定義)の発生率は、プラセボと有意な差はありませんでした(ABILIFYの発生率、プラセボ発生率): 成人経口ABILIFY治療患者(4%、2%)、小児経口
6歳から18歳までのABILIFY治療患者(0.4%、1%)、またはABILIFY 15mg注射治療患者(3%、2%)。
ABILIFY 20mgは、既知の心血管疾患(心筋梗塞または虚血性心疾患の病歴、心不全または伝導異常)、脳血管疾患、または患者が低血圧になりやすい状態(脱水、血液量減少、および降圧薬による治療)のある患者には注意して使用する必要があります。薬)[参照 薬物相互作用 ]。
ABILIFY 注射治療に加えて非経口ベンゾジアゼピン療法が必要であると判断された場合、患者は過剰な鎮静と起立性低血圧を監視する必要があります。 薬物相互作用 ]。
滝
ABILIFY 10mgを含む抗精神病薬は、傾眠、起立性低血圧、運動および感覚の不安定性を引き起こし、転倒、ひいては骨折またはその他の怪我につながる可能性があります。これらの影響を悪化させる可能性のある疾患、状態、または薬を服用している患者については、抗精神病治療を開始するときに転倒リスク評価を完了し、長期の抗精神病治療を受けている患者については繰り返します。
白血球減少症、好中球減少症、および無顆粒球症
臨床試験および/または市販後の経験では、ABILIFY を含む抗精神病薬に一時的に関連する白血球減少症および好中球減少症のイベントが報告されています。無顆粒球症も報告されています。
白血球減少症/好中球減少症の可能性のある危険因子には、既存の低白血球数 (WBC)/絶対好中球数 (ANC) および薬剤性白血球減少症/好中球減少症の病歴が含まれます。臨床的に重大な低 WBC/ANC または薬剤性白血球減少症/好中球減少症の既往歴のある患者では、治療の最初の数か月間、頻繁に全血球計算 (CBC) を実行します。そのような患者では、他の原因となる要因がなく、臨床的に有意な白血球減少の最初の兆候が見られたら、ABILIFY の中止を検討してください。
臨床的に重大な好中球減少症の患者を発熱やその他の感染症の症状または徴候について監視し、そのような症状または徴候が発生した場合は速やかに治療してください。重度の好中球減少症 (絶対好中球数
発作/痙攣
短期間のプラセボ対照試験では、発作歴のある患者から除外された発作/けいれんは、経口アビリファイ 20mg で治療された未診断の成人患者の 0.1% (3/2467)、小児患者の 0.1% (1/732) で発生しました。 (6 歳から 18 歳)、成人の ABILIFY 15mg 注射治療患者の 0.2% (1/501)。
他の抗精神病薬と同様に、ABILIFY 15mg は、発作の既往歴がある患者や発作閾値を下げる症状のある患者には慎重に使用する必要があります。発作閾値を下げる条件は、65 歳以上の集団でより一般的である可能性があります。
認知障害および運動障害の可能性
ABILIFY は、他の抗精神病薬と同様に、判断力、思考力、または運動能力を損なう可能性があります。例えば、短期間のプラセボ対照試験では、眠気(鎮静を含む)は次のように報告されました(ABILIFYの発生率、プラセボの発生率):経口ABILIFYで治療された成人患者(n = 2467)(11%、6%)では、 6 歳から 17 歳の小児患者 (n=611) (24%, 6%)、および ABILIFY 注射を受けた成人患者 (n=501) (9%, 6%)。眠気(鎮静を含む)は、短期間のプラセボ対照試験で、経口ABILIFY 10mgの成人患者の0.3%(8/2467)および小児患者(6〜18歳)の3%(20/732)で中止につながりました。しかし、エビリファイ注の成人患者の中止には至りませんでした。
プラセボと比較してこれらの事象の発生率は比較的わずかに増加していますが、ABILIFY 15mg による治療が患者に悪影響を及ぼさないことが合理的に確信できるまで、患者は自動車を含む危険な機械の操作について注意する必要があります。
体温調節
深部体温を下げる体の機能の混乱は、抗精神病薬に起因しています。 ABILIFY 10mg を処方する際には、深部体温の上昇に寄与する可能性のある状態 (例えば、激しい運動、極度の暑さにさらされる、抗コリン作用のある薬を併用している、または脱水状態にあるなど) を経験している患者に適切な注意が必要です。 [見る 有害反応 ]。
自殺
自殺未遂の可能性は、精神病、双極性障害、および大うつ病性障害に固有のものであり、リスクの高い患者の綿密な監視は、薬物療法を伴う必要があります。 ABILIFY の処方は、過剰摂取のリスクを軽減するために、適切な患者管理に一致する最小量で作成する必要があります [参照 有害反応 ]。
嚥下障害
食道の運動障害および誤嚥は、ABILIFY を含む抗精神病薬の使用と関連しています。誤嚥性肺炎は、高齢患者、特に進行したアルツハイマー型認知症患者の罹患率と死亡率の一般的な原因です。 ABILIFY およびその他の抗精神病薬は、誤嚥性肺炎のリスクがある患者では慎重に使用する必要があります。 認知症関連精神病の高齢患者における死亡率の増加 Âと 有害反応 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
エビリファイを処方された患者と次の問題について話し合います。
うつ病と自殺リスクの臨床的悪化
患者、その家族、および介護者は、不安、動揺、パニック発作、不眠症、過敏性、敵意、攻撃性、衝動性、アカシジア(精神運動の落ち着きのなさ)、軽躁病、躁病、その他の行動の異常な変化の出現に注意するよう奨励されるべきである. 、うつ病の悪化、および自殺念慮、特に抗うつ薬治療中の初期および用量が上下に調整された場合。患者の家族や介護者は、変化が突然起こる可能性があるため、日常的にそのような症状の出現を探すようにアドバイスされるべきです.このような症状は、患者の処方者または医療専門家に報告する必要があります。特に、それらが重度である場合、突然発症した場合、または患者の症状の一部ではない場合はそうです。これらのような症状は、自殺念慮や行動のリスクの増加と関連している可能性があり、非常に綿密な監視と、場合によっては投薬の変更が必要であることを示しています[参照 警告と注意事項 ]。
処方者またはその他の医療専門家は、患者、その家族、およびその介護者に、ABILIFY による治療に関連する利点とリスクについて知らせ、適切な使用について助言する必要があります。 ABILIFY では、「抗うつ薬、うつ病およびその他の重篤な精神疾患、および自殺念慮または自殺行動」に関する情報を含む患者の投薬ガイドを利用できます。処方者または医療専門家は、患者、その家族、および介護者に投薬ガイドを読むように指示し、その内容を理解できるように支援する必要があります。患者には、投薬ガイドの内容について話し合い、質問があれば回答を得る機会を与える必要があります。 ABILIFY は、うつ病治療の単剤として承認されておらず、小児大うつ病性障害で評価されていないことに注意してください。
病理学的ギャンブルおよびその他の強迫行為
患者とその介護者に、アリピプラゾールを服用している間、買物への衝動、ギャンブルへの強い衝動、強迫的な性的衝動、むちゃ食い、および/またはその他の衝動、およびこれらの衝動を制御できない可能性があることを助言してください。すべてではありませんが、場合によっては、用量を減らすか中止すると、衝動が止んだと報告されています。 警告と注意事項 ]。
口腔内崩壊錠の使用
投与の準備が整うまで、ブリスターを開けないでください。単一の錠剤を取り出すには、パッケージを開き、ブリスターのホイルをはがして錠剤を露出させます。錠剤が損傷する可能性があるため、ホイルを通して錠剤を押し込まないでください。ブリスターを開けたらすぐに、乾いた手で錠剤を取り出し、エビリファイ ディスメルト口腔内崩壊錠全体を舌の上に置きます。錠剤の崩壊は唾液中で急速に起こります。 ABILIFY DISCMELT は液体なしで服用することをお勧めします。ただし、必要に応じて、液体で摂取することができます。錠剤を割ろうとしないでください。
認知機能および運動機能への干渉
ABILIFY は判断力、思考力、または運動能力を損なう可能性があるため、ABILIFY 療法が患者に悪影響を及ぼさないことを合理的に確信できるまで、患者は自動車を含む危険な機械の操作について注意する必要があります。 警告と注意事項 ]。
併用薬
患者は、相互作用の可能性があるため、処方薬または市販薬を服用している、または服用する予定がある場合は、医師に知らせるようにアドバイスする必要があります。 薬物相互作用 ]。
熱暴露と脱水
過熱や脱水を避けるための適切なケアについて、患者に助言する必要があります。 警告と注意事項 ]。
糖度
患者は、ABILIFY 10mg Oral Solution の各 mL に 400 mg のスクロースと 200 mg のフルクトースが含まれていることを説明する必要があります。
妊娠
ABILIFY による治療中に妊娠した場合、または妊娠する予定がある場合は、医療提供者に通知するよう患者に助言してください。 ABILIFY 20mg が新生児に錐体外路症状および/または禁断症状 (激越、筋緊張亢進、筋緊張低下、振戦、傾眠、呼吸困難、および摂食障害) を引き起こす可能性があることを患者に助言する.妊娠中にABILIFY 15mgに曝露した女性の妊娠転帰を監視する妊娠登録があることを患者に助言する[ 特定の集団での使用 ]。
フェニルケトン尿薬
フェニルアラニンはアスパルテームの成分です。各ABILIFY DISCMELT口腔内崩壊錠には、10mg、1.12mgのフェニルアラニンおよび15mg、1.68mgのフェニルアラニンが含まれています。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
生涯発がん性試験は、ICR マウス、F344 ラット、および Sprague-Dawley (SD) ラットで実施されました。アリピプラゾールは、ICR マウスに 1、3、10、および 30 mg/kg/日、F344 ラット (0.2、0.5、2、およびmg/m² の体表面積に基づいて、それぞれ 30 mg/日の MRHD の 5 倍および 0.3、1 および 3 倍)。さらに、SD ラットに 10、20、40、および 60 mg/kg/日を 2 年間経口投与しました。これは、mg/m² 体表面積に基づく MRHD の 3、6、13、および 19 倍です。アリピプラゾールは、雄マウスまたは雄ラットに腫瘍を誘発しなかった。メスのマウスでは、下垂体腺腫、乳腺腺癌および腺棘腫の発生率は、3~30 mg/kg/日 (MRHD の 0.5 ~ 5 倍) の食事量で増加しました。雌ラットでは、乳腺線維腺腫の発生率が 10 mg/kg/日 (MRHD の 3 倍) の食事量で増加しました。副腎皮質癌および複合副腎皮質腺腫/癌の発生率は、60mg/kg/日(MRHDの19倍)の経口用量で増加した。
他の抗精神病薬の慢性投与後のげっ歯類では、乳腺、下垂体、および内分泌膵臓の新生物の増加が見られ、長期にわたるドーパミン D2 受容体拮抗作用および高プロラクチン血症によって媒介されると考えられています。血清プロラクチンは、アリピプラゾールの発がん性試験では測定されませんでした。しかし、乳腺および下垂体腫瘍に関連する用量での 13 週間の食事研究で、メスのマウスで血清プロラクチンレベルの上昇が観察されました。血清プロラクチンは、乳腺腫瘍に関連する用量での 4 週間および 13 週間の混餌試験で、メスのラットで増加しませんでした。げっ歯類におけるプロラクチン媒介性内分泌腫瘍の所見のヒトリスクとの関連性は不明である。
突然変異誘発
アリピプラゾールの変異原性の可能性は、in vitro 細菌復帰突然変異試験、in vitro 細菌 DNA 修復試験、マウスリンパ腫細胞における in vitro 前方遺伝子突然変異試験、チャイニーズハムスター肺 (CHL) における in vitro 染色体異常試験で試験されました。細胞、マウスでの in vivo 小核アッセイ、およびラットでの不定期 DNA 合成アッセイ。アリピプラゾールと代謝産物 (2,3-DCPP) は、代謝活性化の有無にかかわらず、CHL 細胞の in vitro 染色体異常アッセイで染色体異常誘発性でした。代謝物 2,3DCPP は、代謝活性化の非存在下で CHL 細胞の in vitro アッセイで数値異常を増加させました。マウスの in vivo 小核試験で陽性反応が得られました。しかし、その反応は、人間には関係ないと考えられているメカニズムによるものでした。
生殖能力の障害
雌ラットは、交配の 2 週間前から妊娠 7 日までアリピプラゾールを 2、6、および 20 mg/kg/日の用量で経口投与されました。 mg/m² 体表面積。発情周期の不規則性と黄体の増加がすべての用量で見られましたが、生殖能力の障害は見られませんでした。着床前損失の増加は MRHD の 2 倍および 6 倍で見られ、胎児体重の減少は MRHD の 6 倍で見られました。
オスのラットは、交配の 9 週間前から交配までアリピプラゾールを 20、40、および 60 mg/kg/日の用量で経口投与されました。これは、mg/ m²の体表面積。精子形成の障害は MRHD の 19 倍で見られ、前立腺萎縮は MRHD の 13 倍と 19 倍で見られ、生殖能力の障害はありませんでした。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中に ABILIFY を含む非定型抗精神病薬に曝露された女性の妊娠転帰を監視する妊娠曝露登録があります。医療提供者は、1-866-961-2388 で非定型抗精神病薬の国家妊娠登録に連絡するか、http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/ にアクセスして、患者を登録することをお勧めします。
リスクの概要
妊娠第 3 期に ABILIFY 20mg を含む抗精神病薬にさらされた新生児は、分娩後に錐体外路症状および/または禁断症状のリスクがあります (以下を参照)。 臨床上の考慮事項 )。アリピプラゾールに曝露された妊婦の公表された疫学研究から入手可能な全体的なデータは、主要な先天性欠損症、流産、または母体または胎児への有害転帰の薬物関連リスクを確立していません( データ )。未治療の統合失調症、双極 I 型障害、または大うつ病性障害、および妊娠中の ABILIFY を含む抗精神病薬への曝露に関連する母親へのリスクがあります ( 臨床上の考慮事項 )。
動物生殖研究では、器官形成期のアリピプラゾールをラットおよび/またはウサギにそれぞれ 10 倍および 19 倍の用量で経口および静脈内投与し、mg/m² の体表面積に基づいて 30 mg/日の最大推奨用量 (MRHD) を生成しました。胎児死亡、胎児体重の減少、停留睾丸、骨格骨化の遅延、骨格異常、および横隔膜ヘルニア。 mg/m² 体表面積に基づく MRHD の 10 倍の用量で、出生前および出生後の期間にアリピプラゾールをラットに経口および静脈内投与すると、妊娠期間の延長、死産、児の体重の減少、および児の生存率の低下がもたらされました ( データ )。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
未治療の統合失調症または双極 I 型障害の母親には、再発、入院、および自殺のリスクの増加を含むリスクがあります。統合失調症および双極 I 型障害は、早産を含む周産期の有害転帰の増加と関連しています。これが病気の直接の結果なのか、他の併存因子によるものなのかは不明です。
前向き縦断研究では、大うつ病性障害の病歴があり、妊娠初期に胸腺機能が正常で抗うつ薬を服用していた 201 人の妊婦を追跡しました。妊娠中に抗うつ薬を中止した女性は、抗うつ薬を継続した女性よりも大うつ病の再発を経験する可能性が高かった.妊娠中および産後に抗うつ薬による治療を中止または変更する場合は、未治療のうつ病のリスクを考慮してください。
胎児/新生児の有害反応
興奮、筋緊張亢進、筋緊張低下、振戦、傾眠、呼吸困難、および摂食障害を含む錐体外路症状および/または禁断症状が、妊娠第 3 期に抗精神病薬 (ABILIFY を含む) にさらされた新生児で報告されています。これらの症状の重症度はさまざまです。新生児の錐体外路および/または禁断症状を監視し、症状を適切に管理します。一部の新生児は、特別な治療を受けなくても数時間または数日で回復しました。他の人は長期の入院を必要としました。
データ
ヒューマンデータ
妊娠中の非定型抗精神病薬の使用に関する観察研究、出生登録、および症例報告から発表されたデータは、抗精神病薬および主要な先天異常との明確な関連を報告していません。妊娠中に抗精神病薬にさらされた 9,258 人の女性のメディケイド データベースからのレトロスペクティブ研究では、主要な先天性欠損症の全体的なリスクの増加は示されませんでした。
動物データ
動物実験では、アリピプラゾールは、ラットおよびウサギにおける催奇形性の影響の可能性を含む発生毒性を示しました。
器官形成中にアリピプラゾールを 3、10、および 30 mg/kg/日の用量で経口投与した妊娠ラットでは、体表面積 mg/m² に基づいて MRHD の 30 mg/日の約 1、3、および 10 倍である。妊娠のわずかな延長と胎児の発育の遅延は、胎児の体重の減少と停留精巣によって証明されるように、MRHDの10倍で観察されました。遅延骨格骨化は MRHD の 3 倍と 10 倍で観察されました。分娩児では、肝横隔膜結節の発生率が増加し、横隔膜ヘルニアが MRHD の 10 倍で観察された (これらの所見について他の用量群は検査されなかった)。生後、MRHD の 3 倍および 10 倍で膣開口の遅延が見られました。生殖能力の障害(生殖能力の低下、黄体、着床、生きた胎児、および着床後の損失の増加、おそらく雌の子孫への影響を介して)がMRHDの10倍で観察されました。しかし、これらの発生への影響が母体毒性の二次的なものであることを示唆する証拠はありませんでした。
器官形成中にアリピプラゾールを 3、9、および 27 mg/kg/日の用量で静脈内注射した妊娠ラットでは、体表面積 mg/m² に基づく MRHD の 30 mg/日の 1、3、および 9 倍であり、減少した。 MRHDの9倍で胎児の体重と骨格骨化の遅延が観察されました。この用量は母体毒性も引き起こした。
器官形成中にアリピプラゾールを 10、30、および 100 mg/kg/日の用量で経口投与した妊娠ウサギでは、体表面積 mg/m² に基づく MRHD の 30 mg/日の 6、19、および 65 倍であるMHRD の 65 倍で、食物消費量の増加、流産の増加、胎児死亡率の増加が観察されました。 MRHD の 19 倍と 65 倍で、胎児体重の減少と胸骨癒合の発生率の増加が観察された。
器官形成中にアリピプラゾールを 3、10、および 30 mg/kg/日の用量で静脈内注射された妊娠ウサギでは、体表面積 mg/m² に基づく MRHD の 30 mg/日の 2、6、および 19 倍であり、減少した。 MRHDの19倍で、胎児の体重、胎児の異常(主に骨格)の増加、および胎児の骨格骨化の減少が観察されました。この用量は母体毒性も引き起こした。胎児の無影響量は 10 mg/kg/日で、これは MRHD の 6 倍です。
アリピプラゾールを妊娠17日目から産後21日目まで、MRHDの30mg/日の1、3、および10倍である3、10、および30mg/kg/日の用量で、出生前および出生後に経口投与したラットにおいてmg/m² の体表面積に基づくと、MHRD の 10 倍でわずかな母体毒性とわずかな妊娠期間の延長が観察されました。この用量では、死産の増加、子犬の体重の減少 (成人期まで持続) および生存率も見られました。
アリピプラゾールを妊娠 6 日から授乳 20 日まで 3、8、および 20 mg/kg/日の用量で静脈内注射されたラットにおいて、これらは mg/m² に基づく 30 mg/日の MRHD の 1、3、および 6 倍です。体表面積、MRHDの3倍と6倍で死産の増加が観察されました。出生後初期の子犬の体重と生存率の減少は、MRHDの6倍で観察されました。これらの用量は、母体毒性も引き起こしました。出生後の行動および生殖発達への影響はありませんでした。
授乳
リスクの概要
公表された文献からの限られたデータは、母体の体重調整用量の 0.7% から 8.3% の範囲の乳児の相対用量で、ヒトの母乳中にアリピプラゾールが存在することを報告しています。アリピプラゾールに暴露された母乳で育てられた乳児の体重増加が乏しいという報告と、アリピプラゾールを服用している授乳中の女性の母乳の供給が不十分であるという報告があります。
母乳育児の発達と健康上の利点は、母親のエビリファイに対する臨床的必要性、およびエビリファイまたは母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
小児用
統合失調症または双極性躁病に関連する大うつ病性障害または激越の小児患者における安全性と有効性は確立されていません。
10 歳から 17 歳の小児患者におけるアリピプラゾールとデヒドロアリピプラゾールの薬物動態は、体重の違いを補正した後の成人と同様でした [参照 臨床薬理学 ]。
統合失調症
統合失調症の小児患者における安全性と有効性は、13 ~ 17 歳の小児患者 202 人を対象とした 6 週間のプラセボ対照臨床試験で確立されました [参照 投薬と管理 、 有害反応 、 と 臨床研究 ]。小児患者における維持の有効性は体系的に評価されていませんが、維持の有効性は、成人患者と小児患者におけるアリピプラゾールの薬物動態パラメータの比較とともに、成人データから外挿できます。
双極Ⅰ型障害
双極性躁病の小児患者における安全性と有効性は、10 ~ 17 歳の小児患者 197 人を対象とした 4 週間のプラセボ対照臨床試験で確立されました [参照 投薬と管理 、 有害反応 、 と 臨床研究 ]。小児患者における維持の有効性は体系的に評価されていませんが、維持の有効性は、成人患者と小児患者におけるアリピプラゾールの薬物動態パラメータの比較とともに、成人データから外挿できます。
小児患者の躁病エピソードまたは混合エピソードの治療における補助的な ABILIFY 10mg とリチウムまたはバルプロ酸の併用の有効性は、体系的に評価されていません。しかし、アリピプラゾールとリチウムまたはバルプロ酸との間のそのような有効性および薬物動態学的相互作用の欠如は、成人および小児患者におけるアリピプラゾール薬物動態パラメーターの比較とともに、成人データから外挿することができます。
自閉症に関連する過敏性
自閉性障害に関連する過敏性を示す小児患者における安全性と有効性は、6 歳から 17 歳の小児患者 212 人を対象とした 2 つの 8 週間のプラセボ対照臨床試験で確立された [参照 適応症と使用法 、 投薬と管理 、 有害反応 、 と 臨床研究 ]。自閉症に関連した過敏症の小児患者(6歳から17歳)を対象に、維持試験が実施されました。この試験の第 1 フェーズは、非盲検の柔軟な投与 (アリピプラゾール 2 ~ 15 mg/日) フェーズで、患者は安定しました (ABC-I サブスケールで > 25% の改善と定義され、CGI-I 評価はABILIFY で 12 週間連続で「かなり改善」または「非常に改善」)。全体として、85 人の患者が安定し、第 2 の 16 週間の二重盲検フェーズに入り、ABILIFY 治療を継続するか、プラセボに切り替えるかのいずれかに無作為に割り付けられました。この試験では、自閉症に伴う過敏症の維持治療に対するエビリファイの有効性は確立されていません。
トゥレット症候群
トゥレット症候群の小児患者におけるアリピプラゾールの安全性と有効性は、194 人の小児患者を対象とした 1 回の 8 週間試験 (7 歳から 17 歳) および 1 回の 10 週間試験 (6 歳から 18 歳) で確立された [参照 投薬と管理 、 有害反応 、 と 臨床研究 ]。小児患者における維持の有効性は、体系的に評価されていません。
若年動物研究
幼若ラットのアリピプラゾールは、離乳 (21 日齢) から成熟 (80 日齢) まで 10、20、40 mg/kg/日の経口用量で投与した場合、死亡率、CNS 臨床徴候、記憶と学習の障害、および性成熟の遅延を引き起こしました。 . 40 mg/kg/日で、死亡率、活動の低下、後肢の広がり、猫背の姿勢、運動失調、振戦、およびその他の中枢神経系の徴候が男女ともに観察されました。さらに、男性では性成熟の遅延が観察されました。すべての用量で用量依存的に、記憶と学習の障害、運動活動の増加、および下垂体 (萎縮)、副腎 (副腎皮質肥大)、乳腺 (過形成および分泌の増加)、および女性の生殖器官 (膣粘液化、子宮内膜萎縮、卵巣黄体の減少)が観察された。女性の生殖器官の変化は、プロラクチン血清レベルの上昇に続発すると考えられました。無毒性量 (NOAEL) を決定することはできず、試験された最低用量の 10 mg/kg/日では、アリピプラゾールまたはその主要な活性代謝物の全身暴露 (AUC0-24) に対する安全域はありません。 15 mg/日の最大推奨小児用量で青少年に。すべての薬物関連の効果は、2 か月の回復期間後に可逆的であり、以前に実施された研究から、幼若ラットの薬物効果のほとんどは成体ラットでも観察されました。
アリピプラゾールを幼犬 (生後 2 か月) に 3、10、30 mg/kg/日で 6 か月間経口投与した場合、振戦、活動低下、運動失調、横臥、および後肢の使用制限という CNS 臨床徴候を引き起こした。対照値と比較して、すべての薬物群の女性で、平均体重と体重増加が最大 18% 減少しました。 NOAEL を決定することはできず、3 mg/kg/日の最低試験用量では、アリピプラゾールまたは思春期の主要な活性代謝物に対する全身暴露 (AUC0-24) に対する安全域はありません。 15mg/日の用量。すべての薬物関連の影響は、2 か月の回復期間の後、元に戻すことができました。
高齢者の使用
高齢患者には投与量の調整は推奨されない[参照 囲み警告 、 警告と注意事項 、 と 臨床薬理学 ]。
臨床試験で経口ABILIFY 15mgで治療された13,543人の患者のうち、1073人(8%)が65歳以上、799人(6%)が75歳以上でした。統合失調症、双極性躁病、または大うつ病性障害における経口ABILIFY 10mgのプラセボ対照研究では、65歳以上の被験者が若い被験者と異なる反応を示すかどうかを判断するのに十分な数が含まれていませんでした.
臨床試験で ABILIFY 注射で治療された 749 人の患者のうち、99 人 (13%) が 65 歳以上、78 人 (10%) が 75 歳以上でした。統合失調症または双極性躁病に関連する激越患者におけるABILIFY注射のプラセボ対照研究には、65歳以上の被験者が十分に含まれておらず、若い被験者と反応が異なるかどうかを判断できませんでした.
ABILIFY 15mg は、アルツハイマー病に伴う精神病患者の治療には承認されていません。 囲み警告 と 警告と注意事項 ]。
CYP2D6 代謝不良者
アリピプラゾール濃度が高いため、既知の CYP2D6 代謝不良者には用量調整が推奨されます。白人の約 8% と黒人/アフリカ系アメリカ人の 3 ~ 8% は CYP2D6 基質を代謝できず、代謝不良者 (PM) に分類されます [参照 投薬と管理 と 臨床薬理学 ]。
肝臓と腎臓の障害
患者の肝機能(軽度から重度の肝障害、Child-Pughスコア5~15)または腎機能(軽度~重度の腎障害、糸球体濾過率15~15)に基づいてABILIFYの用量を調整する必要はありません。および 90 mL/分) [参照 臨床薬理学 ]。
その他の特定の集団
患者の性別、人種、または喫煙状況に基づいて ABILIFY の投与量を調整する必要はありません。 臨床薬理学 ]。
過剰摂取
MedDRA の用語は、副作用の分類に使用されています。
人間の経験
臨床試験および市販後の経験では、ABILIFY の経口摂取による意図的または偶発的な過剰摂取による副作用が世界中で報告されています。これらには、経口ABILIFY 20mg単独および他の物質との組み合わせによる過剰摂取が含まれます. ABILIFY単独での死亡は報告されていません。既知の転帰を伴う既知の最大用量は、完全に回復した患者による 1260 mg の経口 ABILIFY (最大推奨 1 日用量の 42 倍) の急性摂取でした。意図的または偶発的な過剰摂取は、子供(12 歳以下)でも報告されており、ABILIFY 10mg を 195mg まで経口摂取し、死亡はありませんでした。
経口ABILIFYの過剰摂取(単独または他の物質との併用)で報告された一般的な副作用(すべての過剰摂取症例の少なくとも5%で報告されています)には、嘔吐、傾眠、および振戦が含まれます. ABILIFY の過剰摂取 (単独または他の物質との併用) を行った 1 人以上の患者に見られるその他の臨床的に重要な徴候および症状には、アシドーシス、攻撃性、アスパラギン酸アミノトランスフェラーゼの増加、心房細動、徐脈、昏睡、錯乱状態、痙攣、血中クレアチンホスホキナーゼの増加、レベルの低下が含まれます。意識障害、高血圧、低カリウム血症、低血圧、無気力、意識消失、QRS 群延長、QT 延長、誤嚥性肺炎、呼吸停止、てんかん重積、頻脈。
過剰摂取の管理
エビリファイによる過剰摂取の治療に関する具体的な情報はありません。過剰投与の場合は心電図を取得し、QT 間隔の延長が存在する場合は、心臓モニタリングを開始する必要があります。それ以外の場合、過剰摂取の管理は、支持療法、適切な気道の維持、酸素化と換気、および症状の管理に集中する必要があります。患者が回復するまで、綿密な医学的監督とモニタリングを継続する必要があります。
木炭
ABILIFY 10mg を過剰摂取した場合、アリピプラゾールの吸収を部分的に防止するために、早期のチャコール投与が役立つ場合があります。 ABILIFY 15 mg の単回経口投与の 1 時間後に 50 g の活性炭を投与すると、アリピプラゾールの平均 AUC および Cmax が 50% 減少しました。
血液透析
ABILIFY による過剰摂取の治療における血液透析の効果に関する情報はありませんが、アリピプラゾールは血漿タンパク質と強く結合するため、血液透析が過剰摂取の管理に役立つ可能性は低いです。
禁忌
ABILIFY 15mg は、アリピプラゾールに対する過敏反応の既往歴のある患者には禁忌です。反応は、そう痒症/蕁麻疹からアナフィラキシーにまで及びます[を参照してください。 有害反応 ]。
臨床薬理学
作用機序
統合失調症または双極性躁病におけるアリピプラゾールの作用機序は不明です。しかし、列挙された適応症におけるアリピプラゾールの有効性は、D2 および 5-HT1A 受容体での部分アゴニスト活性と 5-HT2A 受容体でのアンタゴニスト活性の組み合わせによって媒介される可能性があります。
薬力学
アリピプラゾールは、ドーパミン D2 および D3、セロトニン 5-HT1A および 5-HT2A 受容体に対して高い親和性を示し (Ki 値はそれぞれ 0.34 nM、0.8 nM、1.7 nM、および 3.4 nM)、ドーパミン D4、セロトニン 5-HT2C および5-HT7、アルファ 1 アドレナリンおよびヒスタミン H1 受容体 (それぞれ 44 nM、15 nM、39 nM、57 nM、および 61 nM の Ki 値)、およびセロトニン再取り込み部位に対する中程度の親和性 (Ki = 98 nM)。アリピプラゾールは、コリン作動性ムスカリン受容体に対して明確な親和性を持たない (IC50 > 1000 nM)。
薬物動態
ABILIFY 活性は、おそらく主に親薬であるアリピプラゾールによるものであり、その主要な代謝物であるデヒドロアリピプラゾールは、親薬と同様の D2 受容体に対する親和性を持ち、親薬の 40% を占めることが示されています。血漿中の薬物曝露。アリピプラゾールとデヒドロアリピプラゾールの平均消失半減期は、それぞれ約 75 時間と 94 時間です。定常状態の濃度は、両方の活性部分の投与から 14 日以内に達成されます。アリピプラゾールの蓄積は、単回投与の薬物動態から予測可能です。定常状態では、アリピプラゾールの薬物動態は用量に比例します。アリピプラゾールの排出は、主に 2 つの P450 アイソザイム、CYP2D6 および CYP3A4 が関与する肝代謝によって行われます。 CYP2D6 代謝不良者の場合、アリピプラゾールの平均消失半減期は約 146 時間です。
薬物動態研究により、エビリファイ 10mg ディスクメルト口腔内崩壊錠は、エビリファイ 15mg 錠と生物学的に同等であることが示されました。
経口投与
吸収
錠剤: アリピプラゾールは錠剤の投与後によく吸収され、血漿中濃度のピークは 3 時間から 5 時間以内に発生します。錠剤製剤の絶対的な経口バイオアベイラビリティは 87% です。 ABILIFY 10mg は食事の有無にかかわらず投与できます。エビリファイ錠 15 mg を標準的な高脂肪食とともに投与しても、アリピプラゾールまたはその活性代謝物であるデヒドロアリピプラゾールの Cmax または AUC に有意な影響はありませんでしたが、Tmax はアリピプラゾールで 3 時間、デヒドロアリピプラゾールで 12 時間遅延しました。
内服液:アリピプラゾールは、溶液として経口投与するとよく吸収されます。同等の用量で、溶液からのアリピプラゾールの血漿濃度は、錠剤製剤からの血漿濃度よりも高かった。健康な被験者を対象に経口溶液としてのアリピプラゾール 30 mg とアリピプラゾール 30 mg 錠剤の薬物動態を比較した相対的バイオアベイラビリティ研究では、幾何平均 Cmax 値と AUC 値の錠剤に対する溶液の比率は、それぞれ 122% と 114% でした [ 投薬と管理 ]。アリピプラゾールの単回投与の薬物動態は、5 mg から 30 mg の投与量の間で線形であり、用量に比例していました。
分布
静脈内投与後のアリピプラゾールの定常状態での分布量は高く (404 L または 4.9 L/kg)、広範な血管外分布を示しています。治療濃度では、アリピプラゾールとその主要な代謝産物は、99% 以上が血清タンパク質、主にアルブミンに結合しています。 0.5 から 30 mg/日のアリピプラゾールを 14 日間投与された健康なヒトボランティアでは、アリピプラゾールがヒトの脳に浸透したことを示す用量依存的な D2 受容体占有率がありました。
代謝と排泄
アリピプラゾールは主に、脱水素、ヒドロキシル化、および N-脱アルキル化の 3 つの生体内変化経路によって代謝されます。 in vitro 研究に基づくと、CYP3A4 および CYP2D6 酵素はアリピプラゾールの脱水素化およびヒドロキシル化に関与しており、N-脱アルキル化は CYP3A4 によって触媒されます。アリピプラゾールは、全身循環における主要な薬物部分です。定常状態では、活性代謝物であるデヒドロアリピプラゾールは、血漿中のアリピプラゾール AUC の約 40% を占めます。
[14C]標識アリピプラゾールの単回経口投与後、投与された放射能の約 25% および 55% がそれぞれ尿および糞中に回収された。未変化体のアリピプラゾールは 1%未満が尿中に排泄され、経口投与量の約 18%が未変化体として糞便中に回収されました。
薬物相互作用研究
アリピプラゾールとデヒドロアリピプラゾールの曝露に対する他の薬剤の影響を、それぞれ図 1 と図 2 にまとめています。シミュレーションに基づくと、強力な CYP2D6 阻害剤と CYP3A4 阻害剤の両方とともに CYP2D6 の広範な代謝物質を投与すると、定常状態での平均 Cmax および AUC 値が 4.5 倍増加すると予想されます。強力な CYP3A4 阻害剤を投与された CYP2D6 の低代謝者では、定常状態での平均 Cmax および AUC 値の 3 倍の増加が予想されます。
図 1: アリピプラゾールの薬物動態に対する他の薬剤の効果 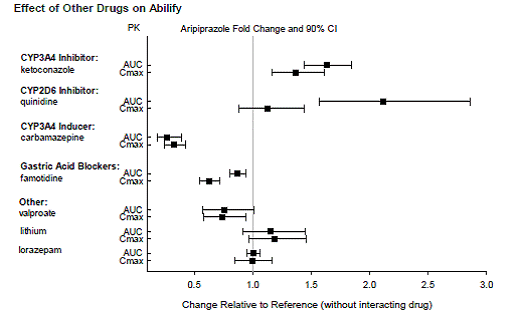
図 2: デヒドロアリピプラゾールの薬物動態に対する他の薬剤の効果 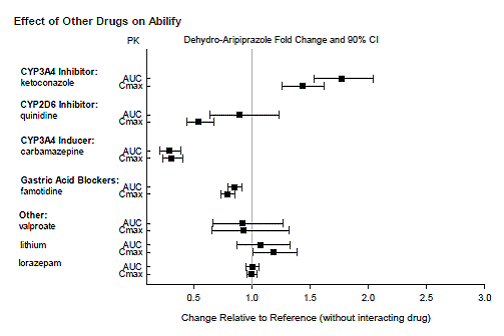
ABILIFY 15mg が他の薬剤への曝露に及ぼす影響を図 3 にまとめました。大うつ病性障害患者の集団 PK 分析では、フルオキセチン (20 または 40 mg/日)、パロキセチン CR (37.5 または50 mg/日)、またはセルトラリン (100 または 150 mg/日) を定常状態に投与します。フルオキセチンとノルフルオキセチンの定常状態の血漿濃度は、それぞれ約 18% と 36% 増加し、パロキセチンの濃度は約 27% 減少しました。セルトラリンとデスメチルセルトラリンの定常状態の血漿濃度は、これらの抗うつ療法がアリピプラゾールと同時投与された場合、実質的に変化しませんでした。
図 3: エビリファイ 15mg が他の薬物の薬物動態に及ぼす影響 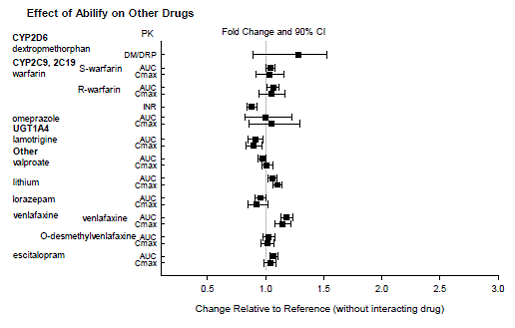
特定の集団における研究
特定の集団におけるアリピプラゾールとデヒドロアリピプラゾールの曝露を、それぞれ図 4 と図 5 にまとめます。さらに、ABILIFY(20mg~30mg)を投与された小児患者(10~17歳)では、体重補正アリピプラゾールクリアランスは成人と同様でした。
図 4: アリピプラゾールの薬物動態に対する内因性因子の影響 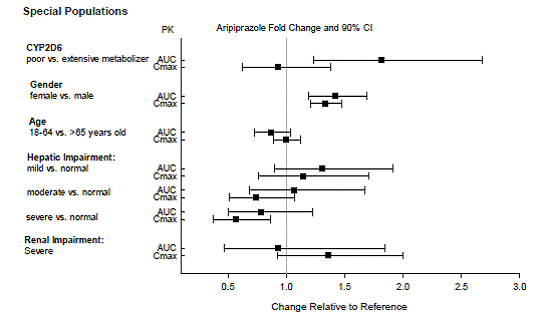
図 5: デヒドロアリピプラゾールの薬物動態に対する内因性因子の影響 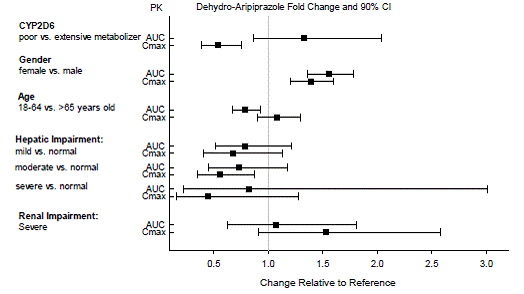
筋肉内投与
健康な被験者に筋肉内投与されたアリピプラゾール注射の 2 つの薬物動態研究では、ピーク血漿濃度までの時間の中央値は 1 時間と 3 時間でした。アリピプラゾール 5 mg の筋肉内注射では、100% の絶対バイオアベイラビリティが得られました。筋肉内投与後に達成された幾何平均最大濃度は、経口錠剤の Cmax よりも平均で 19% 高かった。 24 時間にわたる全身暴露は、アリピプラゾールの筋肉内注射と経口錠剤投与後とでほぼ同様でしたが、筋肉内注射後の最初の 2 時間のアリピプラゾール AUC は、錠剤と同じ用量の後の AUC よりも 90% 大きくなりました。統合失調症または統合失調感情障害の安定した患者では、筋肉内投与後のアリピプラゾールの薬物動態は、1 mg から 45 mg の用量範囲で直線的でした。アリピプラゾール注射の代謝は体系的に評価されていませんが、筋肉内投与経路が代謝経路を変えるとは予想されませんでした。
動物毒物学および/または薬理学
アリピプラゾールは、60 mg/kg/日の用量での 26 週間の慢性毒性試験および 40 および 60 mg/kg/日の用量での 2 年間の発がん性試験で、アルビノ ラットに網膜変性を引き起こしました。 mg/m² 体表面積に基づく 30 mg/日の MRHD。アルビノ マウスおよびサルの網膜の評価では、網膜変性の証拠は明らかにされませんでした。メカニズムをさらに評価するための追加の研究は行われていません。この発見と人間のリスクとの関連性は不明です。
臨床研究
エビリファイ(アリピプラゾール)の経口製剤の有効性は、以下の適切かつ十分に管理された試験で確立されました。
- 統合失調症の成人患者を対象とした 4 つの短期試験と 1 つの維持試験、および青年期 (13 ~ 17 歳) を対象とした 1 つの短期試験 [参照 臨床研究 ]
- 成人患者における 4 つの短期単剤療法試験および 1 つの 6 週間の補助的試験、および躁病エピソードまたは混合エピソードを有する小児患者 (1017 歳) における 1 つの短期単剤療法試験 [参照 臨床研究 ]
- 双極 I 型障害の成人患者における 1 つの維持単剤療法試験および 1 つの維持補助試験 臨床研究 ]
- 現在のエピソード中に抗うつ薬治療に不十分な反応を示した MDD の成人患者における 2 つの短期試験 [ 臨床研究 ]
- 自閉性障害に関連する過敏症の治療のための小児患者 (6 ~ 17 歳) における 2 つの短期試験 [ 臨床研究 ]
- トゥレット障害の小児患者(6~18 歳)を対象とした 2 つの短期試験 [参照 臨床研究 ]
ABILIFY(アリピプラゾール)の注射製剤の有効性は、以下の適切かつ十分に管理された試験で確立されました。
- [ 臨床研究 ]
統合失調症
大人
統合失調症の治療における ABILIFY 15mg の有効性は、主に統合失調症の DSM-III/IV 基準を満たした急性再発入院患者の 5 つの短期 (4 週間および 6 週間) プラセボ対照試験で評価されました。 5 つの試験のうち 4 つが ABILIFY とプラセボを区別できましたが、最小の 1 つの試験では区別できませんでした。これらの研究のうち 3 件には、リスペリドン(1 件の試験)またはハロペリドール(2 件の試験)のいずれかで構成される実薬対照群も含まれていましたが、ABILIFY 20mg と実薬対照群を比較できるようには設計されていませんでした。
ABILIFY 10mg の 4 つの肯定的な試験では、精神医学的徴候と症状を評価するために 4 つの主要な尺度が使用されました。有効性は、ポジティブおよびネガティブ シンドローム スケール (PANSS) の合計スコアを使用して評価されました。 PANSS は、統合失調症の陽性症状 (7 項目)、統合失調症の陰性症状 (7 項目)、および一般的な精神病理学 (16 項目) を測定する 30 項目の尺度であり、それぞれ 1 (なし) から 7 (極端) の尺度で評価されます。 ; PANSS スコアの合計は 30 から 210 の範囲です。Clinical Global Impression (CGI) 評価は、患者の全体的な臨床状態について、統合失調症の症状に精通している熟練した観察者の印象を反映しています。
ABILIFY の 2 つの固定用量 (15 または 30 mg/日) をプラセボと比較した 4 週間の試験 (n=414) では、ABILIFY 10 mg の両方の用量が PANSS 合計スコアでプラセボよりも優れていました (表 26 の試験 1)。 PANSS 正サブスケール、および CGI 重症度スコア。さらに、15 mg の用量は、PANSS 陰性サブスケールでプラセボよりも優れていました。
ABILIFY の 2 つの固定用量 (20 または 30 mg/日) をプラセボと比較した 4 週間の試験 (n=404) では、ABILIFY の両方の用量が PANSS 合計スコアでプラセボよりも優れていました (表 26 の試験 2)、PANSS正のサブスケール、PANSS の負のサブスケール、および CGI 重症度スコア。
ABILIFY の 3 つの固定用量 (10、15、または 20 mg/日) をプラセボと比較した 6 週間の試験 (n=420) では、ABILIFY の 3 つの用量すべてが PANSS 合計スコアでプラセボよりも優れていました (表の試験 3)。 26)、PANSS 正サブスケール、および PANSS 負サブスケール。
ABILIFY の 3 つの固定用量 (2、5、または 10 mg/日) をプラセボと比較した 6 週間の試験 (n=367) では、ABILIFY の 10 mg 用量は PANSS 合計スコアでプラセボよりも優れていました (研究 4表 26)、研究の主要アウトカム指標。 2 mg および 5 mg の投与量は、主要評価項目でプラセボより優れていることを示しませんでした。
したがって、10、15、20、および 30 mg の 1 日用量の有効性は、各用量の 2 つの研究で確立されました。これらの用量の中で、高用量グループがこれらの研究の最低用量グループよりも有利であるという証拠はありませんでした.
母集団のサブグループを調べても、年齢、性別、または人種に基づく反応性の違いを示す明確な証拠は明らかになりませんでした。
より長期の試験では、統合失調症の DSM-IV 基準を満たす 310 人の入院患者または外来患者が登録されました。病歴により、他の抗精神病薬で 3 か月以上症状が安定していました。これらの患者は、抗精神病薬の投与を中止し、ABILIFY 15 mg/日またはプラセボに無作為に割り付けられ、最大 26 週間の再発の観察が行われました。二重盲検段階での再発は、CGI 改善スコアが 5 以上(最小限に悪化)、PANSS の敵意または非協力性の項目でスコアが 5 以上(中程度に重度)、または PANSS 合計スコアが 20% 以上増加した場合と定義されました。 ABILIFY 15 mg/日を投与された患者は、プラセボを投与された患者と比較して、その後の 26 週間で再発までの時間が有意に長くなりました (図 6 の試験 5)。
小児患者
小児患者(13 ~ 17 歳)の統合失調症治療における ABILIFY(アリピプラゾール)の有効性は、統合失調症の DSM-IV 基準を満たし、PANSS スコアを持つ外来患者を対象とした 6 週間のプラセボ対照試験で評価されました。ベースラインで70以上。この試験 (n=302) では、ABILIFY の 2 つの固定用量 (10 または 30 mg/日) をプラセボと比較し、ABILIFY 15 mg は 2 mg/日から開始し、10 mg/日の治療群で 5 日間で目標用量まで滴定されました。 30 mg/日の治療群では 11 日。 ABILIFY の両方の用量は、PANSS 合計スコア (表 26 の試験 6) でプラセボよりも優れていました。 30 mg/日の投与量は、10 mg/日の投与量よりも効果的であることが示されませんでした.小児患者における維持の有効性は体系的に評価されていませんが、維持の有効性は、成人患者と小児患者におけるアリピプラゾールの薬物動態パラメータの比較とともに、成人データから外挿できます。
図 6:再発患者の累積割合のカプラン・マイヤー推定(統合失調症研究 5) 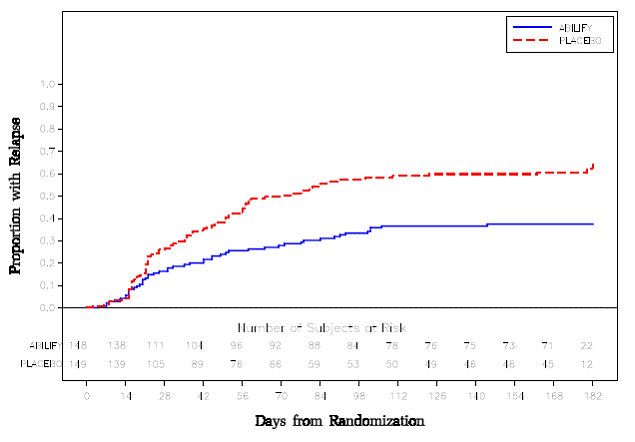
双極性障害
躁病と混合エピソードの急性治療
大人
単剤療法
躁病エピソードの急性治療における単剤療法としてのABILIFY 10mgの有効性は、躁病エピソードまたは混合エピソードを伴うバイポーラI障害のDSM-IV基準を満たす入院患者を対象とした4つの3週間のプラセボ対照試験で確立されました。これらの研究には、精神病的特徴の有無にかかわらず患者が含まれ、そのうちの2つの研究には、急速なサイクリングコースの有無にかかわらず患者も含まれていました.
躁病の症状を評価するために使用される主要な手段は、0 (躁病の特徴がない) から 60 (最高得点)。主要な二次的手段には、Clinical Global Impression-Bipolar (CGI-BP) スケールが含まれていました。
つの肯定的な 3 週間のプラセボ対照試験 (n=268; n=248; n=480; n=485) では、ABILIFY を 15 mg から 30 mg の範囲で 1 日 1 回 (開始用量で) 評価しました。 2 つの研究で 30 mg/日、2 つの研究で 15 mg/日)、ABILIFY 20 mg は、Y-MRS 合計スコア (表 27 の研究 1 ~ 4) および CGI-BP 病気の重症度スコアの低下において、プラセボよりも優れていました。 (マニア)。開始用量が 15 mg/日である 2 つの研究では、患者の 48% と 44% がエンドポイントで 15 mg/日を服用していました。 30 mg/日の開始用量の 2 つの研究では、患者の 86% と 85% がエンドポイントで 30 mg/日を服用していました。
補助療法
躁病エピソードまたは混合エピソードの治療におけるリチウムまたはバルプロ酸の併用による ABILIFY 補助療法の有効性は、成人患者を対象とした 2 週間のリードイン気分安定剤単剤療法フェーズを含む 6 週間のプラセボ対照試験 (n=384) で確立されました。双極 I 型障害の DSM-IV 基準を満たした人。この研究には、躁病エピソードまたは混合エピソードを持ち、精神病的特徴の有無にかかわらず患者が含まれていました。
患者は、非盲検リチウム (0.6 ~ 1.0 mEq/L) またはバルプロ酸 (50 ~ 125 μg/mL) を治療血清レベルで開始し、2 週間安定した用量を維持しました。 2 週間の終わりに、リチウムまたはバルプロ酸に対する効果が不十分な患者 (YMRS 合計スコアが 16 以上で、Y-MRS 合計スコアの 25% 以下の改善) を無作為に割り付けて、ABILIFY (15 mg/日または 30 への増量) のいずれかを投与しました。早ければ 7 日目に mg/日)、または非盲検リチウムまたはバルプロ酸による補助療法としてのプラセボ。 6 週間のプラセボ対照相では、補助的な ABILIFY を 1 日 15 mg から開始し、リチウムまたはバルプロ酸 (それぞれ 0.6 ~ 1.0 mEq/L または 50 ~ 125 μg/mL の治療範囲) を併用すると、リチウムよりも優れていました。または、YMRS 合計スコア (表 27 の研究 5) および CGI-BP 病気の重症度スコア (マニア) の減少において補助的なプラセボとバルプロエート。バルプロ酸を併用投与した患者の 71% とリチウムを併用投与した患者の 62% は、6 週間のエンドポイントで 15 mg/日を服用していました。
小児患者
小児患者(10~17 歳)の双極 I 型障害の治療における ABILIFY 15mg の有効性は、双極の DSM-IV 基準を満たす外来患者を対象とした 4 週間のプラセボ対照試験(n=296)で評価されました。私は、精神病の特徴を伴うまたは伴わない躁病エピソードまたは混合エピソードを障害しており、ベースラインで Y-MRS スコアが 20 以上でした。この二重盲検プラセボ対照試験では、ABILIFY の 2 つの固定用量 (10 または 30 mg/日) をプラセボと比較しました。 ABILIFY 20mg は 2mg/日から開始し、2 日後に 5mg/日、10mg/日群では 5 日で、30mg/日群では 13 日で目標用量に漸増しました。デイトリートメントアーム。 ABILIFY 10mg の両方の用量は、ベースラインから 4 週目までの Y-MRS 合計スコアの変化においてプラセボよりも優れていました (表 27 の試験 6)。
双極Ⅰ型障害の維持療法
単剤療法 維持療法
維持試験は、オープンラベルのABILIFY 20mgで安定し、少なくとも6週間臨床反応を維持していた、最近躁病または混合エピソードを有する双極I型障害のDSM-IV基準を満たす成人患者で実施されました。この試験の第 1 段階は、入院患者と外来患者が臨床的に安定した後、非盲検 ABILIFY (15 または 30 mg/日、開始用量 30 mg/日) を少なくとも6週連続。次に、161 人の外来患者を二重盲検法で無作為に割り付け、安定化および維持期間の終了時に使用していたのと同じ用量の ABILIFY またはプラセボのいずれかに割り付け、躁病またはうつ病の再発を監視しました。無作為化フェーズでは、ABILIFY は、この研究の主要評価項目である情動再発 (躁病と抑うつ) の合計数に対して、時間通りにプラセボよりも優れていました (図 7 の研究 7)。二重盲検治療期間中に合計 55 の気分イベントが観察されました。 19 人がエビリファイ群、36 人がプラセボ群でした。エビリファイ 15mg 群で観察された躁病エピソードの数 (6) は、プラセボ群 (19) よりも少なく、一方、エビリファイ群での抑うつエピソードの数 (9) は、プラセボ群 (11) と同程度でした。 .
人口サブグループの調査では、年齢と性別に基づく反応性の違いの明確な証拠は明らかになりませんでした。しかし、グループ間の違いを適切に評価するには、各民族グループの患者数が不十分でした。
図7:再発患者の累積割合のKaplan-Meier推定(双極研究7) 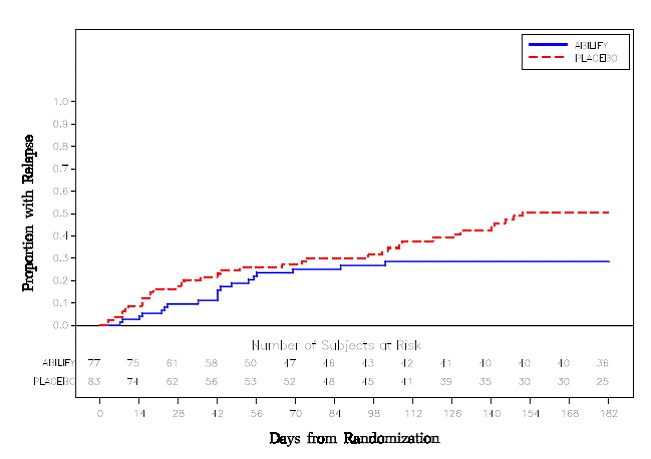
補助維持療法
最近の躁病エピソードまたは混合エピソードを有するバイポーラ I 障害の DSMIV 基準を満たす成人患者を対象に、補助維持試験が実施されました。患者は、非盲検リチウム (0.6 ~ 1.0 mEq/L) またはバルプロ酸 (50 ~ 125 μg/mL) を治療血清レベルで開始し、2 週間安定した用量を維持しました。 2 週間の終わりに、リチウムまたはバルプロ酸に対して不適切な反応 (Y-MRS 合計スコアが 16 以上で、Y-MRS 合計スコアの 35% 以下の改善) を示す患者は、オプションで 15 mg/日の開始用量で ABILIFY を受けました。非盲検リチウムまたはバルプロ酸による補助療法として、早ければ 4 日目に 30 mg に増量または 10 mg に減量します。無作為化の前に、単盲検の ABILIFY とリチウムまたはバルプロ酸の併用療法を受けている患者は、12 週間連続して安定性を維持する必要がありました (Y-MRS と MADRS の合計スコアが 12 以下)。次に、337 人の患者を二重盲検法で無作為に割り付け、安定化期間の終了時に使用していたのと同じ用量の ABILIFY 20mg、またはプラセボとリチウムまたはバルプロ酸のいずれかに割り付け、躁病、混合型、または最大 52 週間のうつ病の再発。 ABILIFY 15mg は、無作為化から任意の気分イベントへの再発までの主要エンドポイントでプラセボよりも優れていました (図 8 の試験 8)。気分イベントは、躁病、混合性、または抑うつエピソードによる入院、Y-MRSスコア>16および/またはMADRS>16を伴う有効性の欠如による研究中止、またはY-MRSスコアを伴う疾患悪化のSAEとして定義されました。 MRS スコアが 16 を超えている、および/または MADRS が 16 を超えている。二重盲検治療期間中に合計 68 の気分イベントが観察されました。 25 人が ABILIFY 20mg 群から、43 人がプラセボ群からでした。エビリファイ 15mg 群で観察された躁病エピソードの数 (7) は、プラセボ群 (19) よりも少なく、一方、エビリファイ群で観察されたうつ病エピソードの数 (14) は、プラセボ群 (18) と同程度でした。 . ABILIFY 10 mg 群とプラセボ群の 52 週間の二重盲検治療段階における無作為化から気分イベントの再発までの時間の Kaplan-Meier 曲線を図 8 に示します。
図 8: 気分イベントが再発した患者の累積割合のカプラン・マイヤー推定 (双極研究 8) 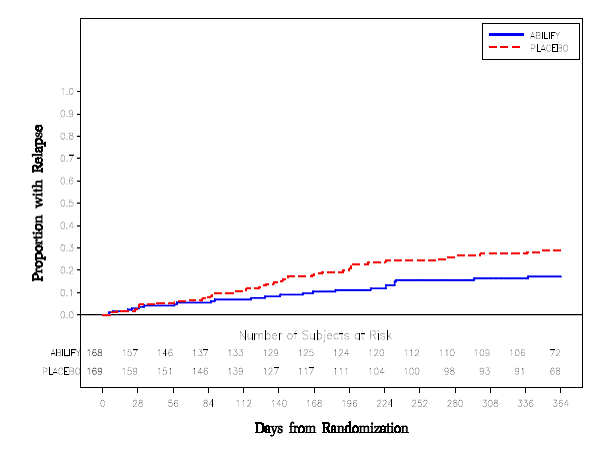
人口サブグループの調査では、年齢と性別に基づく反応性の違いの明確な証拠は明らかになりませんでした。しかし、グループ間の違いを適切に評価するには、各民族グループの患者数が不十分でした。
大うつ病性障害の補助療法
大人
大うつ病性障害 (MDD) の補助療法における ABILIFY 15mg の有効性は、MDD の DSM-IV 基準を満たす成人患者を対象とした 2 つの短期 (6 週間) プラセボ対照試験で実証されました。現在のエピソードでの以前の抗うつ薬療法(1〜3コース)であり、8週間の抗うつ薬療法(パロキセチン制御放出、ベンラファキシン徐放、フルオキセチン、エスシタロプラム、またはセルトラリン)に対して不十分な反応を示した.前向き治療に対する不十分な反応は、ハミルトンうつ病評価尺度 (HAMD17) の 17 項目バージョンで 50% 未満の改善、最小 HAMD17 スコア 14、および最小改善以下の臨床全体印象改善評価として定義されました。以前の治療に対する不十分な反応は、最小有効用量以上で最低 6 週間の抗うつ薬治療後に患者が認識した改善が 50% 未満であると定義されました。
抑うつ症状を評価するために使用される主要な手段は、抑うつ症状の程度を評価するために使用される 10 項目の臨床医評価尺度である Montgomery-Asberg Depression Rating Scale (MADRS) でした。主要な二次的手段は、Sheehan Disability Scale (SDS) でした。これは、機能の 3 つの領域に対するうつ病の影響を評価するために使用される 3 項目の自己評価尺度であり、各項目は 0 (まったくない) から 10 (極度) までスコア付けされます。
2 つの試験 (n=381、n=362) では、ABILIFY 15mg は平均 MADRS 合計スコアの低下においてプラセボよりも優れていました (表 28 の試験 1、2)。ある研究では、ABILIFY は平均 SDS スコアの低下においてもプラセボよりも優れていました。
どちらの試験でも、患者は抗うつ薬の補助として ABILIFY 15mg を 1 日 5 mg の用量で投与されました。忍容性と有効性に基づいて、用量は 1 週間間隔で 5 mg ずつ調整できます。許容用量は、2、5、10、15 mg/日であり、強力な CYP2D6 阻害剤であるフルオキセチンおよびパロキセチンを服用していない患者では、20 mg/日でした。 2 つの試験のエンドポイントでの平均最終用量は、10.7 および 11.4 mg/日でした。
人口サブグループの調査では、年齢、抗うつ薬候補の選択、または人種に基づいた異なる反応の証拠は明らかにされませんでした。性別に関しては、女性よりも男性の方がMADRS合計スコアの平均低下が小さかった。
自閉症に関連する過敏性
小児患者
自閉性障害に関連する過敏症の治療における ABILIFY (アリピプラゾール) の有効性は、自閉性障害の DSM-IV 基準を満たし、かつかんしゃく、攻撃性、自傷行為、またはこれらの問題の組み合わせなどの行動を示しました。これらの被験者の 75% 以上が 13 歳未満でした。
有効性は、Aberrant Behavior Checklist (ABC) および Clinical Global Impression-Improvement (CGI-I) スケールの 2 つの評価スケールを使用して評価されました。両方の試験の主要アウトカム指標は、ABC の過敏性サブスケール (ABC-I) のベースラインからエンドポイントまでの変化でした。 ABC-I サブスケールは、自閉性障害における過敏症の症状を測定しました。
これらの試行の結果は次のとおりです。
週間のプラセボ対照試験の 1 つでは、6 歳から 17 歳までの自閉症障害の小児および青年 (n=98) が、1 日 2 から 15 mg のプラセボまたは ABILIFY の投与を受けました。 ABILIFY は、2 mg/日から開始し、臨床反応に基づいて最大 15 mg/日まで増量が可能であり、プラセボと比較して ABC-I サブスケールおよび CGI-I スケールのスコアを大幅に改善しました。 8週間の治療終了時のABILIFY 10mgの1日平均投与量は8.6mg/日でした(表29の試験1)。
6歳から17歳までの自閉症児および青年(n=218)を対象とした別の8週間のプラセボ対照試験では、ABILIFYの固定用量(5mg/日、10mg/日、または15mg/日)が3回投与されました。日) をプラセボと比較しました。 ABILIFY の投与量は 2 mg/日から開始し、1 週間後に 5 mg/日に増量しました。 2 週間後、10 および 15 mg 投与群の患者では 10 mg/日に増量され、3 週間後には 15 mg/日治療群で 15 mg/日に増量されました (研究 2表 29)。 ABILIFY の 3 回の投与はすべて、プラセボと比較して ABC-I サブスケールのスコアを有意に改善しました。
トゥレット症候群
小児患者
トゥレット障害の治療における ABILIFY (アリピプラゾール) の有効性は、8 週間 (7 歳から 17 歳) および 10 週間 (6 歳から 18 歳) の 1 つのプラセボ対照試験で確立されました。トゥレット障害のDSM-IV基準を満たし、Yale Global Tic Severity Scale(YGTSS)で合計チックスコア(TTS)が20~22以上の小児患者(6~18歳)。 YGTSS は、現在のチックの重症度を測定するために設計された完全に検証済みのスケールです。有効性は 2 つの評価スケールを使用して評価されました: 1) YGTSS の合計ティック スコア (TTS) および 2) トゥレット症候群の臨床的総合印象尺度 (CGI-TS)。利用可能なすべての患者情報。これらの患者の 65% 以上が 13 歳未満でした。
両方の試験の主要なアウトカム指標は、YGTSS の TTS のベースラインからエンドポイントへの変化でした。 TTS の評価は、運動チックと音声チックのそれぞれについて、0 から 5 のスケールで 5 つの異なる次元に沿って行われます。これら 10 のスコアの合計が TTS (つまり、0 ~ 50) になります。
これらの試行の結果は次のとおりです。
週間のプラセボ対照固定用量試験では、7 歳から 17 歳までのトゥレット症候群の小児および青年 (n=133) が、低用量の ABILIFY と高用量の ABILIFY に 1:1:1 の割合で無作為化されました。 ABILIFY 15mg、またはプラセボ。低用量および高用量のABILIFY 10mgグループの目標用量は、体重に基づいていました。低用量 ABILIFY グループの 50 kg 未満の患者は、2 日後に 1 日 5 mg の目標用量で 1 日 2 mg から開始しました。低用量 ABILIFY グループの 50 kg 以上の患者は、1 日 2 mg で開始し、2 日後に 1 日 5 mg に増加し、その後 7 日目に 1 日 10 mg の目標用量に増加しました。高用量 ABILIFY グループは 1 日 2 mg で開始し、2 日後に 1 日 5 mg に増加し、その後 7 日目に 1 日 10 mg の目標用量に増加しました。高用量 ABILIFY グループの ≥ 50 kg の患者は、 1 日 2 mg は 2 日後に 1 日 5 mg に増加し、その後 7 日目に 1 日 10 mg の用量に増加し、1 日 1 日 20 mg の目標用量まで 1 日 5 mg の増加を毎週許可されました。 21. ABILIFY (高用量群と低用量群の両方) は、プラセボと比較して、YGTSS TTS (表 30 の研究 1) および CGI-TS スケールで統計的に有意に改善されたスコアを示しました。調査の過程での YGTSS TTS の推定改善を図 9 に示します。
図 9: 週ごとの YGTSS TTS のベースラインからの変化の最小二乗平均 (トゥレット障害研究 1) 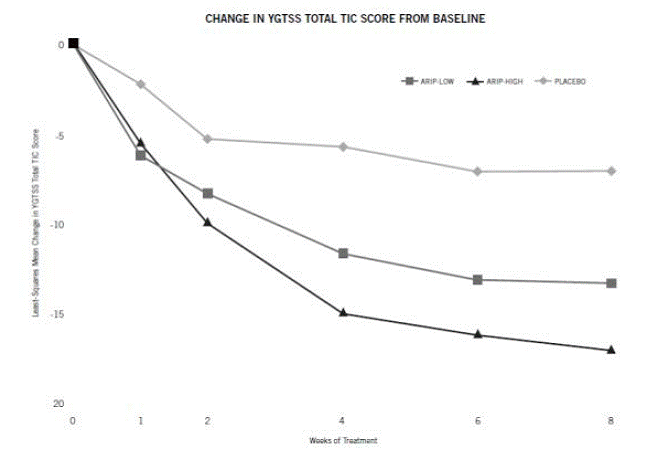
6歳から18歳までのトゥレット症候群の小児および青年(n=61)を対象とした10週間のプラセボ対照の可変用量試験では、患者はプラセボまたはABILIFYの毎日の投与量を2mg/日から開始しました。臨床反応に基づいて、最大 20 mg/日まで増量が許可されます。 ABILIFY は、プラセボと比較して YGTSS TTS スケールで統計的に有意に改善されたスコアを示しました (表 30 の研究 2)。 10週間の治療終了時のABILIFYの平均1日量は6.54mg/日でした。
統合失調症または双極性躁病に伴う動揺
激越の治療のための筋肉注射用 ABILIFY の有効性は、統合失調症および双極 I 型障害 (躁病または混合エピソード、または精神病の特徴なし)。各試験には、ハロペリドール注射(統合失調症研究)またはロラゼパム注射(双極性躁病研究)のいずれかの単一のアクティブな比較治療群が含まれていました。患者は、24 時間の治療期間中に最大 3 回の注射を受けることができました。ただし、患者は、最初の 2 時間後に最初の有効性測定値が評価されるまで、2 回目の注射を受けることができませんでした。試験に登録された患者は、(1) 臨床研究者によって臨床的に動揺しており、筋肉内投薬による治療に臨床的に適切な候補であると判断され、(2) 15 以上の閾値スコア以上の動揺のレベルを示す必要がありました。ポジティブおよびネガティブ シンドローム スケール (PANSS) 興奮コンポーネント (すなわち、衝動制御不良、緊張、敵意、非協力性、および興奮の項目) を構成する 5 つの項目で、1 ~ 7 の採点システム (1 ~ 7 の採点システム) を使用して、少なくとも 2 つの個別の項目のスコアが 4 以上である (1 = なし、4 = 中程度、7 = 極度)。研究では、ベースラインの PANSS Excited Component スコアの平均は 19 で、スコアは 15 から 34 の範囲 (最大スコア 35 のうち) であり、一部の患者は軽度または重度の興奮を経験しており、主に中程度のレベルの興奮を示唆しています。これらの試験で動揺の徴候と症状を評価するために使用された主要な有効性指標は、注射後 2 時間の PANSS 励起成分のベースラインからの変化でした。主要な二次測定は、改善の臨床全体印象 (CGI-I) スケールでした。試行の結果は次のとおりです。
主に統合失調症の DSM-IV 基準を満たす動揺した入院患者 (n=350) を対象としたプラセボ対照試験では、1 mg、5.25 mg、9.75 mg、および 15 mg の 4 つの固定 ABILIFY 20 mg 注射用量が評価されました。注射後 2 時間で、5.25 mg、9.75 mg、および 15 mg の用量は、PANSS 興奮成分 (表 31 の研究 1) および CGII スケールでプラセボよりも統計的に優れていました。
主に統合失調症の DSM-IV 基準を満たす動揺した入院患者 (n=445) を対象とした 2 回目のプラセボ対照試験では、9.75 mg の ABILIFY 15 mg 固定注射用量が 1 回評価されました。注射後 2 時間で、注射用の ABILIFY は、PANSS 興奮成分 (表 31 の研究 2) および CGI-I スケールで統計的にプラセボよりも優れていました。
双極 I 型障害(躁病または混合型)の DSMIV 基準を満たす興奮状態の入院患者(n=291)を対象としたプラセボ対照試験では、9.75 mg および 15 mg の 2 つの固定 ABILIFY 10 mg 注射用量が評価されました。注射後 2 時間で、両方の用量が PANSS 興奮成分でプラセボよりも統計的に優れていました (表 31 の研究 3)。
母集団のサブセット (年齢、人種、および性別) の検査では、これらのサブグループに基づいて異なる応答性は明らかになりませんでした。
患者情報
エビリファイ® (アリピプラゾール)錠
エビリファイ ディスクメルト® (アリピプラゾール) 口腔内崩壊錠
エビリファイ® (アリピプラゾール)内服液
エビリファイ® (アリピプラゾール) 筋肉内使用のみの注射
ABILIFY 20mg について知っておくべき最も重要な情報は何ですか?
(その他の副作用については「エビリファイで起こりうる副作用は?」も参照)
エビリファイを服用すると、次のような深刻な副作用が発生する可能性があります。
- 認知症関連精神病の高齢患者における死亡リスクの増加: ABILIFY 10mg のような医薬品は、混乱や記憶喪失 (認知症) により現実との接触を失った高齢者 (精神病) の死亡リスクを高める可能性があります。 ABILIFY は、認知症関連の精神病患者の治療には承認されていません。
- 自殺念慮または行動のリスク: 抗うつ薬、うつ病やその他の重篤な精神疾患、自殺願望や行動:
1. 抗うつ薬は、治療の最初の数か月以内に、一部の子供、10 代の若者、および若年成人で自殺念慮または自殺行動を増加させる可能性があります。
2. うつ病やその他の深刻な精神疾患は、自殺念慮や自殺行動の最も重要な原因です。一部の人々は、自殺念慮または行動を起こすリスクが特に高い可能性があります。 これらには、双極性障害(躁うつ病とも呼ばれる)または自殺念慮または行動を起こしている(またはその家族歴がある)人が含まれます。
3. 自分や家族の自殺念慮や自殺行為を監視し、防止するにはどうすればよいですか?
- 気分、行動、思考、または感情の変化、特に突然の変化に細心の注意を払ってください。これは、抗うつ薬の服用を開始するとき、または用量を変更するときに非常に重要です。
- すぐに医療提供者に電話して、気分、行動、思考、または感情の新しい変化または突然の変化を報告してください。
- 医療提供者とのすべてのフォローアップ訪問は、予定どおりに行ってください。特に症状について懸念がある場合は、必要に応じて訪問の合間に医療提供者に電話してください。
あなたまたはあなたの家族に次のような症状がある場合、特に新しい症状、悪化した症状、心配な症状がある場合は、すぐに医療提供者に連絡してください。
- 自殺や死についての考え
- 自殺しようとする
- 新しいまたは悪化したうつ病
- 新しいまたは悪化した不安
- 非常に動揺している、または落ち着きがない
- パニック発作
- 寝つきが悪い(不眠症)
- 新しいまたは悪化した過敏症
- 攻撃的、怒っている、または暴力的である
- 危険な衝動で行動する
- 活動と会話の極端な増加 (躁病)
- 行動や気分のその他の異常な変化
抗うつ薬について他に何を知る必要がありますか?
- 最初に医療提供者に相談することなく、抗うつ薬を中止しないでください。 抗うつ薬を突然中止すると、他の症状を引き起こす可能性があります。
- 抗うつ薬は、うつ病やその他の病気の治療に使用される薬です。 うつ病を治療するリスクと、治療しないリスクについて話し合うことが重要です。患者とその家族、または他の介護者は、抗うつ薬の使用だけでなく、すべての治療法について医療提供者と話し合う必要があります。
- 抗うつ薬には他の副作用があります。 あなたまたはあなたの家族に処方された薬の副作用について、医療提供者に相談してください。
- 抗うつ薬は他の薬と相互作用することがあります。 あなたやあなたの家族が服用しているすべての薬を知っておいてください。医療提供者に見せるために、すべての薬のリストを保管してください。最初に医療提供者に確認することなく、新しい薬を開始しないでください。
- 子供に処方されるすべての抗うつ薬が、子供への使用が FDA に承認されているわけではありません。 詳細については、お子様の医療提供者にご相談ください。
エビリファイとは?
- エビリファイ 20mg 内服錠、口腔内崩壊錠、内服液は、以下の治療に使用される処方薬です。
- 統合失調症
- 双極Ⅰ型障害で起こる躁病または混合エピソード
- ABILIFY 20mgを抗うつ薬と併用した場合の大うつ病性障害(MDD)
- 自閉症に関連するイライラ
- トゥレット障害
- エビリファイ注射は、以下の治療に使用される処方薬です。
- 統合失調症または双極性躁病に伴う激越
ABILIFY 10mgが子供に安全か効果的かは不明です:
- 統合失調症の13歳未満
- 双極Ⅰ型障害の10歳未満
- 自閉性障害に関連する過敏症の6歳未満
- 6歳未満のトゥレット障害
次の人はエビリファイ20mgを服用しないでください。 アリピプラゾールまたはエビリファイのいずれかの成分にアレルギーがある。 ABILIFY の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
ABILIFY 15mg を服用する前に、次のような病状があるかどうかなど、すべての病状について医療提供者に伝えてください。
- あなたまたはあなたの家族の糖尿病または高血糖;医療提供者は、ABILIFY 10mg を開始する前と治療中に血糖値をチェックする必要があります。
- 発作(けいれん)。
- 低血圧または高血圧。
- 心臓の問題や脳卒中。
- 妊娠中または妊娠予定の方。 ABILIFY が胎児に害を及ぼすかどうかは不明です。
- ABILIFY 10mg の投与中に妊娠した場合は、非定型抗精神病薬の国家妊娠登録簿への登録について医療提供者に相談してください。 1-866-961-2388 に電話するか、http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/ にアクセスして登録できます。
- 授乳中または授乳予定。エビリファイは母乳に移行します。 ABILIFY を受け取った場合、赤ちゃんに与える最善の方法について、かかりつけの医療提供者に相談してください。
- 白血球数が少ない。
- フェニルケトン尿症。エビリファイ ディスクメルト口腔内崩壊錠には、フェニルアラニンが含まれています。
あなたが服用しているすべての薬について医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
エビリファイと他の薬は互いに影響し合い、深刻な副作用を引き起こす可能性があります。エビリファイは他の薬の働きに影響を与える可能性があり、他の薬はエビリファイの働きに影響を与える可能性があります。
医療提供者は、ABILIFY を他の薬と一緒に服用しても安全かどうかを教えてくれます。 ABILIFY を服用している間は、最初に医療提供者に相談することなく、薬を開始または中止しないでください。服用している薬を知る。薬のリストを保管して、新しい薬を入手したときに医療提供者や薬剤師に見せてください。
エビリファイ20mgの服用方法は?
- ABILIFY 10mg は、医療提供者の指示に従って正確に服用してください。用量を変更したり、ABILIFY の使用を中止したりしないでください。
- ABILIFY 20mg は食事の有無にかかわらず服用できます。
- エビリファイ錠は丸ごと飲み込んでください。
- エビリファイ 20mg を飲み忘れた場合は、気がついた時点ですぐに服用してください。次の服用時間が近い場合は、忘れた分は飛ばして、通常の時間に次の分を服用してください。エビリファイ10mgを同時に2回服用しないでください。
- エビリファイ ディスクメルトを処方された場合は、次のように服用してください。
- ディスメルト錠を服用する準備が整うまで、ブリスターを開けないでください。
- DISCMELT タブレットを 1 つ取り出すには、パッケージを開き、ブリスターのホイルをはがしてタブレットを露出させます。
- 錠剤が損傷する可能性があるため、ホイルを通して錠剤を押し込まないでください。
- ブリスターを開けたらすぐに、乾いた手で錠剤を取り出し、エビリファイ ディスメルト口腔内崩壊錠全体を舌の上に置きます。
- 錠剤の崩壊は唾液中で急速に起こります。エビリファイ 10mg ディスクメルトは水なしで服用することをお勧めします。ただし、必要に応じて、液体で摂取することができます。
- DISCMELT タブレットを分割しようとしないでください。
- ABILIFY を過剰に服用した場合は、すぐに医療提供者または毒物管理センター (1-800-222-1222) に電話するか、最寄りの病院の緊急治療室に行ってください。
ABILIFY 10mgを服用している間、何を避けるべきですか?
- ABILIFY 10mgがあなたにどのように影響するかを理解するまで、運転、重機の操作、またはその他の危険な活動をしないでください. ABILIFY 20mg を服用すると、眠くなることがあります。
- 過熱や脱水は避けてください。
- 過度に運動しないでください。
- 暑いときは、なるべく涼しいところに置いてください。
- 太陽を避けてください。厚着や厚着をしないでください。
- たくさん水を飲む。
エビリファイの副作用は?
ABILIFY 10mg は、次のような重大な副作用を引き起こす可能性があります。
- 「エビリファイ 10mg について知っておくべき最も重要な情報は何ですか?」を参照してください。
- 死に至る可能性がある高齢者の脳卒中(脳血管障害)
- 悪性症候群 (NMS)。 高熱、筋肉のこわばり、錯乱、発汗、脈拍、心拍数、血圧の変化の一部またはすべてがある場合は、すぐに医療機関に連絡してください。これらは、死に至る可能性のあるまれで深刻な状態の症状である可能性があります。これらの症状がある場合は、すぐに医療提供者に連絡してください。
- 制御不能な身体の動き (遅発性ジスキネジー)。 ABILIFY は、顔、舌、その他の体の部分に制御できない動きを引き起こす可能性があります。遅発性ジスキネジアは、ABILIFY の投与を中止しても治らない場合があります。遅発性ジスキネジアは、ABILIFY の投与を中止した後に始まる場合もあります。
- 次のような代謝の問題:
- 高血糖(高血糖)と糖尿病。 エビリファイを服用している一部の人では、血糖値の上昇が起こる可能性があります。極端に高い血糖値は、昏睡または死に至る可能性があります。糖尿病または糖尿病の危険因子 (太りすぎや糖尿病の家族歴など) がある場合、医療提供者は、ABILIFY を開始する前と治療中に血糖値をチェックする必要があります。
ABILIFY の投与中に以下のような高血糖の症状がある場合は、医療提供者に連絡してください。
- 非常にのどが渇く
- いつもより多く排尿する必要がある
- とてもお腹がすいた
- 脱力感や疲れを感じる
- 胃が痛い
- 混乱したり、息がフルーティーなにおいがしたりします
- 血液中の脂肪レベル(コレステロールとトリグリセリド)の増加。
- 体重の増加。 あなたとあなたの医療提供者は、定期的に体重をチェックする必要があります。
- 異常な衝動。 ABILIFY 15mg を服用している一部の人々は、ギャンブル、むちゃ食い、制御不能な食事 (強迫性)、強迫的な買い物、性的衝動などの異常な衝動を経験しています。あなたやあなたの家族が、異常な衝動や行動に気づいたら、かかりつけの医療提供者に相談してください。
- 起立性低血圧(血圧の低下)。 座位または横臥位から急に立ち上がると、立ちくらみや失神が起こることがあります。
- 滝。 ABILIFY は、眠気やめまいを引き起こしたり、姿勢を変えると血圧が低下したり、思考や運動能力が低下し、骨折やその他の怪我を引き起こす可能性のある転倒につながる可能性があります。
- 白血球数が少ない
- 発作(けいれん)
- 特に運動量が多い場合や非常に暑い場所にいる場合は、体温のコントロールに問題があります。脱水症状にならないように水を飲むことが重要です。 「ABILIFY 15mgの服用中に避けるべきことは何ですか?」を参照してください。
- 食べ物や液体が肺に入る原因となる嚥下困難。
成人におけるABILIFY 10mgの最も一般的な副作用は次のとおりです。
- 吐き気
- めまい
- 嘔吐
- 不安
- 便秘
- 不眠症
- 頭痛
- 落ち着きのなさ
- ぼやけた視界
- 上気道疾患
- 内なる落ち着きのなさ/動く必要性 (アカシジア)
小児におけるABILIFYの最も一般的な副作用は次のとおりです。
- 眠い
- 不眠症
- 頭痛
- 吐き気
- 嘔吐
- 鼻づまり
- 倦怠感
- 体重の増加
- 食欲の増加または減少
- 落ち着きのなさ、震えなどの制御不能な動き
- 唾液の増加またはよだれ
- 筋肉のこわばり
これらは、ABILIFY の考えられるすべての副作用ではありません。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
エビリファイの保存方法は?
- ABILIFY 15mg は室温、68°F ~ 77°F (20°C ~ 25°C) で保管してください。
- ABILIFY 10mg Oral Solution の開封済みボトルは、開封後 6 か月間使用できますが、ボトルの有効期限を超えて使用することはできません。
エビリファイとすべての医薬品は、子供の手の届かないところに保管してください。
エビリファイの安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 ABILIFY 20mg は、処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、エビリファイ 20mg を与えないでください。それらに害を及ぼす可能性があります。医療従事者向けに書かれた ABILIFY 10mg に関する情報については、医療提供者または薬剤師にお尋ねください。
エビリファイの成分は?
有効成分: アリピプラゾール
不活性成分:
コーンスターチ、ヒドロキシプロピルセルロース、ラクトース一水和物、ステアリン酸マグネシウム、微結晶性セルロース。着色剤には、酸化鉄 (黄色または赤色) と FD&C Blue No. 2 アルミニウム レーキが含まれます。
エビリファイ 10mg ディスクメルト口腔内崩壊錠: アセスルファム カリウム、アスパルテーム (フェニルアラニンを含む)、ケイ酸カルシウム、クロスカルメロース ナトリウム、クロスポビドン、クレーム ド バニラ (天然および人工香料)、ステアリン酸マグネシウム、微結晶性セルロース、二酸化ケイ素、酒石酸、およびキシリトール。着色剤には、酸化鉄 (黄色または赤色) と FD&C Blue No. 2 アルミニウム レーキが含まれます。
エビリファイ オーラル ソリューション: エデト酸ナトリウム、フルクトース (200 mg/mL)、グリセリン、dl-乳酸、メチルパラベン、プロピレングリコール、プロピルパラベン、水酸化ナトリウム、スクロース (400 mg/mL)、精製水。口腔液は、天然オレンジクリームと他の天然フレーバーで味付けされています
ABILIFY の詳細については、www.abilify.com にアクセスするか、1-800-438-6055 までお電話ください。
この投薬ガイドは、米国食品医薬品局によって承認されています
