Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
サインバルタとは?
サインバルタは、大うつ病性障害、糖尿病性末梢神経因性疼痛、全般性不安障害、線維筋痛症、および慢性筋肉痛の症状を治療するために使用される処方薬です。サインバルタは、単独で使用することも、他の薬と併用することもできます。
- サインバルタは、抗うつ薬、SNRI、線維筋痛薬と呼ばれる種類の薬に属しています。
- Cymbalta が 7 歳未満の子供に安全で有効であるかどうかはわかっていません。
サインバルタ 20mg の副作用の可能性は何ですか?
サインバルタは、次のような重大な副作用を引き起こす可能性があります。
- ドキドキしたり、胸がドキドキしたり、
- 立ちくらみ、
- あざができやすい、
- 不正出血、
- 視界の変化、
- 痛みや排尿困難、
- インポテンツ、
- 性的問題、
- 右上腹部の痛み、
- かゆみ、
- 暗い尿、
- 皮膚や目の黄変(黄疸)、
- 頭痛、
- 錯乱、
- ろれつが回らない、
- 重度の衰弱、
- 嘔吐、
- 調整の喪失、
- 気持ちが不安定になり、
- レーシング思考、
- エネルギーの増加、
- 無謀な行動、
- 極度の幸福感や苛立ちを感じ、
- いつも以上にしゃべり、
- 深刻な睡眠障害
上記の症状がある場合は、すぐに医療機関を受診してください。
サインバルタの最も一般的な副作用は次のとおりです。
- 眠気、
- 吐き気、
- 便秘、
- 食欲減少、
- ドライマウスと
- 発汗の増加
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、サインバルタの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
自殺念慮と行動
抗うつ薬は、短期間の研究で、子供、青年、および若年成人の自殺念慮および自殺行動のリスクを増加させました。これらの研究では、24 歳以上の患者における抗うつ薬の使用による自殺念慮および自殺行動のリスクの増加は示されませんでした。 65歳以上の患者では、抗うつ薬の使用によりリスクが低下しました[参照 警告と注意事項 ]。
抗うつ薬治療を開始したすべての年齢の患者では、悪化の有無、および自殺念慮や自殺行動の出現を注意深く監視します。家族や介護者に、処方者との綿密な観察とコミュニケーションの必要性を助言する[参照 警告と注意事項 ]。
説明
CYMBALTA® (デュロキセチン遅延放出カプセル) は、経口投与用の選択的セロトニンおよびノルエピネフリン再取り込み阻害剤 (SSNRI) です。その化学名は、(+)-(S)-N-メチル-γ-(1-ナフチルオキシ)-2-チオフェンプロピルアミン塩酸塩です。実験式は C18H19NOS•HCl で、分子量 333.88 に相当します。構造式は次のとおりです。
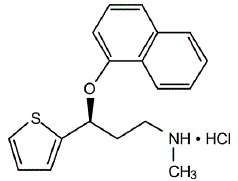
デュロキセチン塩酸塩は、白色からわずかに茶色がかった白色の固体で、水にわずかに溶けます。
各カプセルには、それぞれ 20、30、または 60 mg のデュロキセチンに相当する 22.4、33.7、または 67.3 mg のデュロキセチン塩酸塩の腸溶コーティング ペレットが含まれています。これらの腸溶コーティングされたペレットは、胃の酸性環境での薬物の分解を防ぐように設計されています。不活性成分には、FD&C ブルー No. 2、ゼラチン、ヒプロメロース、ヒドロキシプロピル メチルセルロース アセテート サクシネート、ラウリル硫酸ナトリウム、スクロース、糖球、タルク、二酸化チタン、およびクエン酸トリエチルが含まれます。 20 mg および 60 mg のカプセルには酸化鉄イエローも含まれています。
適応症
CYMBALTA® は、以下の治療に適応されます。
- 成人の大うつ病性障害
- 成人および7歳以上の小児患者における全般性不安障害
- 成人における糖尿病性末梢神経因性疼痛
- 成人および13歳以上の小児患者における線維筋痛症
- 成人の慢性筋骨格痛
投薬と管理
重要な管理手順
CYMBALTA を経口投与 (食事の有無にかかわらず) し、丸ごと飲み込んでください。腸溶性コーティングに影響を与える可能性があるため、噛んだりつぶしたり、遅延放出カプセルを開けたり、内容物を食品にふりかけたり、液体と混ぜたりしないでください。シンバルタ 20mg を飲み忘れた場合は、気がついたらすぐに服用してください。次の服用時間が近い場合は、飲み忘れた分は飛ばして、次の通常の時間に服用してください。シンバルタ60mgを同時に2回服用しないでください。
成人における大うつ病性障害の治療のための投与量
MDD の成人の推奨開始用量は、40 mg/日 (20 mg を 1 日 2 回投与) から 60 mg/日 (1 日 1 回または 30 mg を 1 日 2 回投与) です。一部の患者では、1 日 1 回 60 mg に増量する前に患者が CYMBALTA 30 mg に適応できるように、30 mg を 1 日 1 回 1 週間投与することが望ましい場合があります。 120 mg/日の用量で効果があることが示されていますが、60 mg/日を超える用量で追加の利点が得られるという証拠はありません.定期的に再評価して、維持治療の必要性とそのような治療の適切な投与量を決定します。
全般性不安障害の治療のための投与量
65歳未満の成人の推奨用量
65 歳未満の GAD のほとんどの成人には、CYMBALTA 60 mg を 1 日 1 回から開始します。一部の患者では、1 日 1 回 60 mg に増量する前に患者が CYMBALTA 40 mg に適応できるように、30 mg を 1 日 1 回 1 週間投与することが望ましい場合があります。 1 日 120 mg の用量で効果があることが示されていますが、1 日 60 mg を超える用量で追加の効果が得られるという証拠はありません。ただし、1 日 1 回 60 mg を超えて増量する場合は、1 日 1 回 30 mg ずつ増量してください。定期的に再評価して、継続的な維持治療の必要性と、そのような治療のための適切な投与量を決定してください。
高齢患者における推奨用量
GAD の高齢患者では、CYMBALTA を 30 mg の用量で 1 日 1 回 2 週間投与してから、目標用量の 60 mg/日への増量を検討してください。その後、患者は 1 日 1 回 60 mg 以上の用量で効果が得られる可能性があります。 1 日 1 回 60 mg を超えて用量を増やす決定がなされた場合は、1 日 1 回 30 mg ずつ用量を増やしてください。研究された最大用量は 1 日あたり 120 mg でした。
7歳から17歳の小児患者における推奨用量
歳から 17 歳の GAD の小児患者に CYMBALTA 30mg を 1 日 1 回 30mg の用量で 2 週間開始してから、1 日 1 回 60mg に増量することを検討してください。推奨用量範囲は、1 日 1 回 30 ~ 60 mg です。一部の患者は、1 日 1 回 60 mg を超える用量で効果が得られる場合があります。 1 日 1 回 60 mg を超えて増量する場合は、1 日 1 回 30 mg ずつ増量してください。研究された最大用量は 1 日あたり 120 mg でした。
成人における糖尿病性末梢神経因性疼痛の治療のための投与量
糖尿病性末梢神経因性疼痛のある成人には、1 日 1 回 60 mg を投与します。 1 日 1 回 60 mg を超える用量で追加の有意な効果が得られるという証拠はなく、より高い用量では明らかに忍容性が低くなります。忍容性が懸念される患者には、より低い開始用量が考慮される場合があります。
糖尿病は腎疾患を合併することが多いため、腎障害のある患者では開始用量を低くし、徐々に用量を増やすことを検討してください。 肝障害または重度の腎障害のある患者における投与量 と 特定の集団での使用 ]。
線維筋痛症の治療のための投与量
成人の推奨用量
線維筋痛症の成人では、CYMBALTA の推奨用量は 1 日 1 回 60mg です。患者が CYMBALTA 20mg に適応できるように、1 日 1 回 60mg に増量する前に、1 週間 30mg で治療を開始してください。一部の患者は、開始用量に反応する場合があります。 60 mg/日の投与量に反応しない患者であっても、60 mg/日を超える投与量が追加の利益をもたらすという証拠はなく、より高い投与量はより高い副作用率と関連していました.
13歳から17歳の小児患者における推奨用量
13 ~ 17 歳の線維筋痛症の小児患者に推奨される CYMBALTA 60mg の開始用量は、1 日 1 回 30mg です。投与量は、反応と忍容性に基づいて 1 日 1 回 60 mg に増量される場合があります。
成人の慢性筋骨格痛の治療のための投与量
推奨されるCYMBALTAの投与量は、慢性筋骨格痛のある成人では1日1回60mgです。患者が CYMBALTA に順応できるように、1 日 1 回 30 mg で 1 週間治療を開始してから、1 日 1 回 60 mg に増量してください。 1 日 1 回の 60 mg の投与に反応しない患者であっても、より高い投与量が追加の利益をもたらすという証拠はなく、より高い投与量は有害反応のより高い率と関連している [参照]。 臨床研究 ]。
肝障害または重度の腎障害のある患者における投与量
慢性肝疾患または肝硬変の患者への使用は避けてください。 警告と注意事項 と 特定の集団での使用 ]。
重度の腎機能障害、GFR 警告と注意事項 と 特定の集団での使用 ]。
シンバルタの販売中止
CYMBALTA の中止後、突然または徐々に中止した後の副作用には、めまい、頭痛、吐き気、下痢、感覚異常、過敏症、嘔吐、不眠症、不安、多汗症、および疲労が含まれます。可能な限り、急激な中止ではなく、徐々に投与量を減らすことが推奨されます。 警告と注意事項 ]。
精神障害の治療を目的としたモノアミンオキシダーゼ阻害剤 (MAOI) への、またはその逆の患者の切り替え
精神障害の治療を目的とした MAOI を中止してから CYMBALTA による治療を開始するまでには、少なくとも 14 日間の間隔を空ける必要があります。逆に、CYMBALTA 60mg を中止した後、精神障害の治療を目的とした MAOI を開始する前に、少なくとも 5 日間の猶予を与える必要があります。 禁忌 ]。
リネゾリドやメチレン ブルーなどの他の MAOI との CYMBALTA の使用
セロトニン症候群のリスクが高まるため、リネゾリドまたはメチレンブルーの静脈内投与を受けている患者にCYMBALTAの投与を開始しないでください。精神疾患のより緊急の治療が必要な患者では、入院を含む他の介入を考慮する必要があります[参照 禁忌 ]。
場合によっては、すでにシンバルタ療法を受けている患者は、リネゾリドまたは静脈内メチレンブルーによる緊急治療が必要になる場合があります。リネゾリドまたはメチレンブルーの静脈内投与に代わる許容できる治療法がなく、リネゾリドまたはメチレンブルーの静脈内投与の潜在的な利益が特定の患者のセロトニン症候群のリスクを上回ると判断された場合、CYMBALTA は直ちに中止し、リネゾリドまたはメチレンブルーの静脈内投与を中止する必要があります。投与することができます。患者は、セロトニン症候群の症状について、リネゾリドまたは静脈内メチレンブルーの最後の投与後 5 日間または 24 時間までのいずれか早い方で監視する必要があります。 CYMBALTA による治療は、リネゾリドまたは静脈内メチレン ブルーの最後の投与から 24 時間後に再開することができます。 警告と注意事項 ]。
非静脈経路 (経口錠剤や局所注射など) によるメチレン ブルーの投与、または CYMBALTA と一緒に 1 mg/kg をはるかに下回る静脈内投与のリスクは不明です。それにもかかわらず、臨床医は、そのような使用でセロトニン症候群の緊急症状が現れる可能性に注意する必要があります。 警告と注意事項 ]。
供給方法
剤形と強度
CYMBALTA は、遅延放出カプセルとして入手できます。
- 「Lilly 3235 20mg」と刻印された20mgの不透明な緑色のカプセル
- 「Lilly 3240 30mg」と刻印された30mgの不透明な白と青のカプセル
- 「Lilly 3270 60mg」と刻印された60mgの不透明な緑と青のカプセル
CYMBALTA(デュロキセチン遅延放出カプセル) は、次の強度、色、インプリント、およびプレゼンテーションで利用できます。
保管と取り扱い
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) [USP 制御室温を参照してください] まで許容されます。
販売元: Lilly USA, LLC インディアナポリス、IN 46285、米国。改訂: 2021 年 7 月
副作用
次の重篤な副作用は、以下およびラベルの他の場所に記載されています。
- 小児、青年、および若年成人における自殺念慮および自殺行動 [参照 ボックス警告 と 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- 起立性低血圧、転倒および失神 [参照 警告と注意事項 ]
- セロトニン症候群 [参照 警告と注意事項 ]
- 出血のリスクの増加 [参照 警告と注意事項 ]
- 重度の皮膚反応 [参照 警告と注意事項 ]
- 中断症候群 [参照 警告と注意事項 ]
- 躁病/軽躁病の活性化 [参照] 警告と注意事項 ]
- 閉塞隅角緑内障 [参照 警告と注意事項 ]
- 発作 [参照 警告と注意事項 ]
- 血圧の上昇 [参照 警告と注意事項 ]
- 臨床的に重要な薬物相互作用 [参照 警告と注意事項 ]
- 低ナトリウム血症 [参照 警告と注意事項 ]
- 尿ためらいおよび尿閉 [参照 警告と注意事項 ]
- 性機能障害 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
記載されている副作用の頻度は、少なくとも 1 回、記載されている種類の治療に起因する副作用を経験した患者の割合を表しています。ベースライン評価に続いて治療を受けている間に反応が初めて発生した場合、または悪化した場合、反応は治療下にあると見なされました。
成人における有害反応
成人臨床試験データベース
下記のデータは、MDD (N=3779)、GAD (N=1018)、OA (N=503)、CLBP (N=600)、DPNP (N=906)、およびFM(N = 1294)。このプールされた人口の年齢範囲は 17 ~ 89 歳でした。このプールされた集団では、成人患者の 66%、61%、61%、43%、および 94% が女性でした。成人患者の 82%、73%、85%、74%、および 86% は、それぞれ MDD、GAD、OA および CLBP、DPNP、および FM 集団の白人でした。ほとんどの患者は、1 日あたり合計 60 ~ 120 mg のシンバルタ投与量を受けました [参照 臨床研究 ]。以下のデータには、65 歳以上の患者の GAD に対する CYMBALTA 30mg の有効性を評価した試験(GAD-5 試験)の結果は含まれていません。 臨床研究 ];しかし、この高齢者集団で観察された有害反応は、一般的に成人集団全体の有害反応と同様でした。
成人プラセボ対照試験における治療中止につながる有害反応
大鬱病性障害
MDD のプラセボ対照成人試験で、CYMBALTA 治療を受けた患者の約 8.4% (319/3779) が、プラセボ治療を受けた患者の 4.6% (117/2536) と比較して、副作用のために治療を中止しました。吐き気(CYMBALTA 1.1%、プラセボ 0.4%)は、中止の理由として報告された唯一の副作用であり、薬物関連であると考えられました(つまり、CYMBALTA 治療を受けた患者の少なくとも 1% で、少なくともプラセボ治療患者の 2 倍)。
全般性不安障害
プラセボ投与患者の 5% (38/767) と比較して、GAD のプラセボ対照成人試験では、CYMBALTA 投与患者の約 13.7% (139/1018) が副作用のために治療を中止しました。中止の理由として報告され、薬物関連 (上記で定義) と考えられる一般的な副作用には、吐き気 (シンバルタ 3.3%、プラセボ 0.4%)、およびめまい (シンバルタ 1.3%、プラセボ 0.4%) が含まれていました。
糖尿病性末梢神経因性疼痛
プラセボ投与患者の 5.1% (23/448) と比較して、DPNP のプラセボ対照成人試験では、CYMBALTA 投与患者の約 12.9% (117/906) が副作用のために治療を中止しました。中止の理由として報告され、薬物関連 (上記で定義) と考えられる一般的な副作用には、吐き気 (シンバルタ 3.5%、プラセボ 0.7%)、めまい (シンバルタ 1.2%、プラセボ 0.4%)、傾眠 (シンバルタ 1.1%) が含まれます。 、プラセボ 0%)。
線維筋痛症
プラセボ治療患者の 10.1% (96/955) と比較して、FM の 3 ~ 6 か月のプラセボ対照成人試験で、CYMBALTA 治療患者の約 17.5% (227/1294) が治療を中止しました。 .中止の理由として報告され、薬物関連(上記で定義)と考えられる副作用には、吐き気(シンバルタ 2.0%、プラセボ 0.5%)、頭痛(シンバルタ 1.2%、プラセボ 0.3%)、傾眠(シンバルタ 1.1%、プラセボ)が含まれます。 0%)、疲労 (CYMBALTA 1.1%、プラセボ 0.1%)。
変形性関節症による慢性的な痛み
13 週間の OA による慢性疼痛に対するプラセボ対照成人試験で、CYMBALTA 治療を受けた患者の約 15.7% (79/503) が、プラセボの 7.3% (37/508) と比較して、治療を中止しました。治療を受けた患者。中止の理由として報告され、薬物関連(上記で定義)と考えられる副作用には、吐き気が含まれていました(シンバルタ 2.2%、プラセボ 1%)。
慢性腰痛
CLBP の 13 週間のプラセボ対照成人試験において、CYMBALTA で治療された患者の約 16.5% (99/600) が、プラセボで治療された患者の 6.3% (28/441) と比較して、副作用のために治療を中止しました。中止の理由として報告され、薬物関連(上記で定義)と考えられる副作用には、吐き気(シンバルタ 3%、プラセボ 0.7%)、傾眠(シンバルタ 1%、プラセボ 0%)が含まれていました。
成人試験における最も一般的な有害反応
CYMBALTA 治療を受けた患者(上記で定義)で最も一般的に観察された副作用は次のとおりです。
- 糖尿病性末梢神経因性疼痛: 吐き気、傾眠、食欲減退、便秘、多汗症、口渇。
- 線維筋痛症: 吐き気、口渇、便秘、傾眠、食欲減退、多汗症、興奮。
- 変形性関節症による慢性痛: 吐き気、疲労、便秘、口渇、不眠症、傾眠、めまい。
- 慢性腰痛: 吐き気、口渇、不眠症、傾眠、便秘、めまい、疲労。
プールされたすべての成人集団(すなわち、MDD、GAD、DPNP、FM、OA、および CLBP)の CYMBALTA 治療を受けた患者で最も一般的に観察された副作用(少なくとも 5% の発生率で、プラセボ治療の発生率の少なくとも 2 倍)患者) は、吐き気、口渇、傾眠、便秘、食欲減退、および多汗症でした。
表 2 は、承認された成人集団 (すなわち、MDD、GAD、DPNP、FM、OA、および CLBP) を対象としたプラセボ対照試験における副作用の発生率を示しています。プラセボ治療患者よりも。
成人のプールされた MDD および GAD 試験における有害反応
表 3 は、MDD および GAD プラセボ対照成人試験における有害反応の発生率を示しています。副作用は、CYMBALTA 投与患者の 2% 以上で発生し、発生率はプラセボ投与患者よりも高かったです。
DPNP、FM、OA、および CLBP 成人試験における有害反応
表 4 は、DPNP、FM、OA、および CLBP プラセボ対照成人試験の市販前急性期において、CYMBALTA 治療を受けた患者の 2% 以上 (丸め前に決定) で発生した副作用の発生率を示しています。プラセボ治療患者よりも。
MDDの成人における男性と女性の性機能への影響
性欲、性的パフォーマンス、および性的満足度の変化は、精神障害または糖尿病の症状としてしばしば発生しますが、薬理学的治療の結果である場合もあります。性的有害反応は自発的に過少報告されると推定されるため、性的有害反応を特定するために設計された検証済みの尺度であるアリゾナ性的経験尺度 (ASEX) が、4 つの MDD プラセボ対照成人試験 (研究 MDD-1、MDD-2) で前向きに使用されました。 、MDD-3、および MDD-4) [参照 臨床研究 ]。 ASEX スケールには、性機能の次の側面に関する 5 つの質問が含まれています。 5) オーガズムの満足感。正の数値は、性機能がベースラインから悪化していることを示します。負の数は、うつ病患者に一般的に見られる機能障害のベースライン レベルからの改善を意味します。
これらの試験では、CYMBALTA で治療された男性患者は、プラセボで治療された男性患者よりも、ASEX の合計スコアとオーガズムに到達する能力によって測定されるように、有意に多くの性機能障害を経験しました (参考文献を参照)。 CYMBALTA で治療された女性患者は、ASEX 合計スコアで測定した場合、プラセボで治療された女性患者よりも多くの性機能障害を経験しませんでした。医療提供者は、CYMBALTA 治療を受けた患者に起こりうる性的な副作用について定期的に問い合わせる必要があります。
大人のバイタルサインの変化
ベースラインからエンドポイントまでの変化について承認された成人集団を対象としたプラセボ対照臨床試験では、CYMBALTA 治療を受けた患者は、収縮期血圧 (SBP) が平均 0.23 mmHg、拡張期血圧 (DBP) が平均 0.73 mm Hg 上昇し、平均下降と比較されました。プラセボ治療患者の SBP で 1.09 mm Hg、DBP で 0.55 mm Hg。持続的な(3回連続の来院)血圧上昇の頻度に有意差はありませんでした。 警告と注意事項 ]。
承認された成人集団を対象としたプラセボ対照試験で最大 26 週間の CYMBALTA 20mg 治療は、典型的には、ベースラインからエンドポイントまでの変化に対して、プラセボと比較して最大 1.37 拍/分 (1.20 拍/分の増加) の心拍数のわずかな増加を引き起こしました。 CYMBALTA 投与患者では、プラセボ投与患者では毎分 0.17 拍の減少)。
成人における実験室の変化
承認された成人集団を対象としたプラセボ対照臨床試験における CYMBALTA 治療は、ALT、AST、CPK、およびアルカリホスファターゼのベースラインからエンドポイントまでのわずかな平均増加と関連していました。プラセボで治療された患者と比較した場合、CYMBALTA で治療された患者では、これらの分析対象物について、まれに、適度な、一過性の、異常な値が観察されました [参照 警告と注意事項 ]。高重炭酸塩、コレステロール、および異常な(高または低)カリウムは、プラセボ治療患者と比較してCYMBALTA治療患者でより頻繁に観察されました.
成人におけるCYMBALTAの臨床試験評価中に観察されたその他の有害反応
以下は、成人臨床試験でCYMBALTA 40mgを投与された患者から報告された副作用のリストです。承認されたすべての成人集団を対象とした臨床試験で、34,756 人の患者が CYMBALTA で治療されました。このうち、27% (9337) が CYMBALTA 60mg を 6 か月以上服用し、12% (4317) が CYMBALTA を 1 年以上服用しました。次のリストは、(1) すでに前の表またはラベル付けの他の場所にリストされている反応、(2) 薬物の原因が遠隔であった反応、(3) 非常に一般的で参考にならない反応、(4) (5) プラセボと同等またはそれ以下の割合で発生した。
反応は、次の定義に従って身体システムによって分類されます。頻繁な副作用は、少なくとも 1/100 の患者で発生するものです。まれな有害反応は、1/100 から 1/1000 の患者に発生するものです。まれな反応とは、患者の 1/1000 未満で発生する反応です。
- 心疾患 - 頻繁: 動悸;まれ:心筋梗塞、頻脈、たこつぼ心筋症。
- 耳と迷路の障害 - 頻繁: めまい;まれ:耳の痛みと耳鳴り。
- 内分泌疾患 - まれ: 甲状腺機能低下症。
- 眼疾患 - 頻繁: 視界がぼやけます。まれ: 複視、ドライアイ、視覚障害。
- 胃腸障害 - 頻繁: 鼓腸;まれ:嚥下障害、おくび、胃炎、胃腸出血、口臭、口内炎。まれ:胃潰瘍。
- 一般的な疾患と投与部位の状態 - 頻繁: 悪寒/悪寒;まれ:転倒、異常な感覚、暑さおよび/または寒さ、倦怠感、喉の渇き。まれ:歩行障害。
- 感染症と蔓延 - まれ: 胃腸炎および喉頭炎。
- 調査 頻繁: 体重増加、体重減少;まれ: 血中コレステロールが増加しました。
- 代謝と栄養障害 - まれ: 脱水症および高脂血症;まれ:脂質異常症。
- 筋骨格疾患および結合組織疾患 - 頻繁: 筋骨格痛;まれ:筋肉のこわばりと筋肉のけいれん。
- 神経系疾患 - 頻繁: 味覚異常、無気力、感覚異常/感覚鈍麻;まれ:注意力の乱れ、ジスキネジー、ミオクローヌス、質の悪い睡眠。まれ:構音障害。
- 精神障害 - 頻繁: 異常な夢と睡眠障害;まれ:無関心、歯ぎしり、見当識障害/混乱状態、過敏症、気分変動、および自殺未遂。レア:自殺完了。
- 腎および尿路疾患 - 頻繁: 頻尿;まれ:排尿困難、排尿切迫、夜間頻尿、多尿、尿臭異常。
- 生殖器系と乳房の病気 - 頻繁: 無オルガスム/オーガズム異常;まれ:更年期症状、性機能障害、精巣痛。まれ:月経障害。
- 呼吸器、胸部および縦隔の障害 頻繁: あくび、口腔咽頭の痛み;まれ:喉の圧迫感。
- 皮膚および皮下組織の疾患 - 頻繁: かゆみ;まれ:冷汗、接触皮膚炎、紅斑、打撲傾向の増加、寝汗、光線過敏反応。まれ:斑状出血。
- 血管障害 頻繁: ホットフラッシュ;まれ:顔面紅潮、起立性低血圧、および末梢の冷え。
小児患者のプラセボ対照臨床試験で観察された有害反応
小児臨床試験データベース
下記のデータは、MDD 患者(N=341)を対象とした 2 つの 10 週間のプラセボ対照試験(MDD-6 試験および MDD- 7)、GAD における 10 週間のプラセボ対照試験 (N=135) (GAD-6 試験)、および線維筋痛症における 13 週間の試験 (N=91)。 CYMBALTA 60mg は、小児患者の MDD の治療には承認されていません [参照 特定の集団での使用 ]。これらの試験でCYMBALTA治療を受けた患者のうち、36%が7~11歳(64%は12~18歳)、55%が女性、69%が白人でした。患者は、プラセボ対照の急性治療研究中に 1 日あたり 30 ~ 120 mg の CYMBALTA を投与されました。小児 MDD、GAD、および線維筋痛症の 40 週間までの試験では、7 歳から 17 歳までの 988 人の CYMBALTA 治療を受けた小児患者が参加しました (ほとんどの患者は 1 日あたり 30 から 120 mg を投与されました) - 35% は 7 歳から 11 歳でした年齢 (65% が 12 歳から 17 歳) で、56% が女性でした。
小児科の治験における最も一般的な有害反応
プールされたすべての小児集団(MDD、GAD、および線維筋痛症)における最も一般的な副作用(CYMBALTA 治療患者で 5% 以上、プラセボ治療患者の発生率の少なくとも 2 倍)は、体重減少、食欲減退、吐き気、嘔吐、倦怠感、下痢。
MDDおよびGADを有する7~17歳の小児患者における有害反応
MDD および GAD を有する 7 歳から 18 歳の小児患者の臨床試験で観察された有害反応プロファイルは、成人の臨床試験で観察された有害反応プロファイルと一致していました。これらの小児臨床試験で観察された最も一般的な (5% 以上でプラセボの 2 倍) 副作用には、吐き気、下痢、体重減少、めまいが含まれます。
表 6 は、MDD および GAD の小児用プラセボ対照試験で、CYMBALTA で治療された患者の 2% 以上で発生し、プラセボで治療された患者よりも発生率が高い有害反応の発生率を示しています。 CYMBALTA は、小児患者の MDD の治療には承認されていません [参照 特定の集団での使用 ]。
小児 MDD および GAD 臨床試験で 2% 未満の発生率で発生し、プラセボ治療患者よりも多くの CYMBALTA 治療患者で報告されたその他の副作用には、異常な夢 (悪夢を含む)、不安、顔面紅潮 (のぼせを含む) が含まれます。 )、多汗症、動悸、脈拍増加、および振戦(CYMBALTA 20mgは、MDDの小児患者の治療には承認されていません)。
小児MDDおよびGADの臨床試験でCYMBALTA 30mgの中止後に最もよく報告された症状には、頭痛、めまい、不眠症、および腹痛が含まれていました[参照 警告と注意事項 ]。
GADおよびMDDを伴う7〜17歳の小児患者の成長(身長と体重)
SSRI と SNRI の使用に関連して、食欲減退と体重減少が観察されています。臨床試験でCYMBALTA治療を受けた小児患者は、プラセボ治療を受けた小児患者の約0.9kgの平均体重増加と比較して、10週間で平均0.1kgの体重減少を経験しました。臨床的に有意な体重減少(3.5%以上)を経験した患者の割合は、プラセボ群よりもCYMBALTA群の方が高かった(それぞれ16%と6%)。その後、4 ~ 6 か月の制御されていない延長期間にわたって、CYMBALTA 治療を受けた患者は平均して、年齢と性別が一致した同業者からの母集団データに基づいて、予想されるベースラインの体重パーセンタイルまで回復する傾向にありました。
最長 9 か月の研究では、CYMBALTA 治療を受けた小児患者の身長が平均 1.7 cm 増加しました (7 歳から 11 歳の患者では 2.2 cm、12 歳から 17 歳の患者では 1.3 cm の増加)。これらの研究中に身長の増加が観察された一方で、身長パーセンタイルの平均1%の減少が観察されました(7〜11歳の患者で2%の減少、12〜17歳の患者で0.3%の増加)。 CYMBALTA による治療を受けている小児患者では、体重と身長を定期的にモニタリングする必要があります。 特定の集団での使用 ]。
13~17歳の線維筋痛症の小児患者における有害反応
表 7 は、小児線維筋痛症のプラセボ対照試験(FM-4 試験)において、CYMBALTA 30mg で治療された患者の 5%以上で発生し、プラセボで治療された患者よりも高い発生率で発生した有害反応の発生率を示しています。 臨床研究 ]。
市販後の経験
CYMBALTAの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
CYMBALTA 40mg療法に一時的に関連し、他のラベルには記載されていない市場導入以降に報告された副作用には、急性膵炎、アナフィラキシー反応、攻撃性および怒り(特に治療初期または治療中止後)、血管神経性浮腫、閉塞隅角緑内障、大腸炎(顕微鏡的または詳細不明)、皮膚血管炎(全身の関与を伴うこともある)、錐体外路障害、乳汁漏出、婦人科出血、幻覚、高血糖、高プロラクチン血症、過敏症、高血圧クリーゼ、筋肉痙攣、発疹、むずむず脚症候群、治療中止時の発作、上室性不整脈、耳鳴り(治療中止時)、開口障害、蕁麻疹。
薬物相互作用
CYP1A2 と CYP2D6 の両方がデュロキセチンの代謝に関与しています。
CYP1A2の阻害剤
CYMBALTA 60 mg と強力な CYP1A2 阻害剤であるフルボキサミン 100 mg を男性被験者 (n=14) に併用投与した場合、デュロキセチンの AUC は約 6 倍、Cmax は約 2.5 倍、デュロキセチン t1/2 は約3倍に増加。 CYP1A2 代謝を阻害する他の薬剤には、シプロフロキサシンやエノキサシンなどのシメチジンおよびキノロン系抗菌薬が含まれます [ 警告と注意事項 ]。
CYP2D6の阻害剤
CYMBALTA (40 mg 1 日 1 回) とパロキセチン (20 mg 1 日 1 回) の併用により、デュロキセチン AUC の濃度が約 60% 増加し、パロキセチンの用量が多いほど阻害の程度が大きくなると予想されます。他の強力な CYP2D6 阻害剤(例、フルオキセチン、キニジン)でも同様の効果が期待できます。 警告と注意事項 ]。
CYP1A2 と CYP2D6 の二重阻害
CYP2D6 代謝不良の被験者(n=14)に、強力な CYP1A2 阻害剤であるフルボキサミン 100 mg とともに CYMBALTA 40 mg を 1 日 2 回投与すると、デュロキセチンの AUC と Cmax が 6 倍に増加しました。
止血を妨げる薬(NSAID、アスピリン、ワーファリンなど)
血小板によるセロトニンの放出は、止血において重要な役割を果たします。セロトニンの再取り込みを妨げる向精神薬の使用と上部消化管出血の発生との関連性を実証したケースコントロールおよびコホートデザインの疫学的研究は、NSAIDまたはアスピリンの同時使用がこの出血のリスクを増強する可能性があることも示しています. SSRIまたはSNRIをワルファリンと併用すると、出血の増加を含む抗凝固効果の変化が報告されています。健康な被験者 (n=15) に CYMBALTA 60 または 120 mg を 1 日 1 回、最大 14 日間、定常状態でワルファリン (2 ~ 9 mg、1 日 1 回) を併用投与しても、INR はベースラインから有意に変化しませんでした (平均 INR 変化の範囲は0.05 ~ +0.07)。 R-ワルファリンおよびS-ワルファリンの両方についての総ワルファリン(タンパク質結合プラス遊離薬物)薬物動態(AUCτ,ss、Cmax,ssまたはtmax,ss)は、デュロキセチンによって変化しなかった。血小板に対するデュロキセチンの影響の可能性があるため、ワルファリン療法を受けている患者は、CYMBALTA の開始時または中止時に注意深く監視する必要があります [参照 警告と注意事項 ]。
ロラゼパム
CYMBALTA (60 mg Q 12 時間) およびロラゼパム (2 mg Q 12 時間) の定常状態では、デュロキセチンの薬物動態は併用投与による影響を受けませんでした。
テマゼパム
CYMBALTA (20 mg qhs) およびテマゼパム (30 mg qhs) の定常状態では、デュロキセチンの薬物動態は併用投与による影響を受けませんでした。
胃酸に影響を与える薬
CYMBALTA には、pH が 5.5 を超える胃腸管の部分に到達するまで溶解に抵抗する腸溶性コーティングがあります。極度の酸性条件では、腸溶性コーティングによって保護されていないシンバルタ 20mg は加水分解を受けてナフトールを形成する可能性があります。胃内容排出を遅らせる可能性のある状態の患者(一部の糖尿病患者など)にCYMBALTA 30mgを使用する場合は注意が必要です。胃腸のpHを上げる薬は、デュロキセチンの早期放出につながる可能性があります.しかし、アルミニウムおよびマグネシウム含有制酸剤 (51 mEq) と CYMBALTA 60mg の同時投与、または CYMBALTA とファモチジンの同時投与は、40mg 経口投与後のデュロキセチン吸収の速度または程度に有意な影響を与えませんでした。
CYP1A2によって代謝される薬物
インビトロ薬物相互作用研究は、デュロキセチンが CYP1A2 活性を誘導しないことを示しています。したがって、誘導の臨床試験は実施されていませんが、誘導による CYP1A2 基質 (テオフィリン、カフェインなど) の代謝の増加は予想されません。デュロキセチンは、in vitro 研究で CYP1A2 アイソフォームの阻害剤であり、2 つの臨床研究で、テオフィリン AUC の平均 (90% 信頼区間) の増加は 7% (1%-15%) および 20% (13%-27%) でした。 CYMBALTA (60 mg 1 日 2 回) と併用した場合。
CYP2D6 によって代謝される薬物
デュロキセチンは CYP2D6 の中程度の阻害剤です。 CYMBALTA を CYP2D6 基質であるデシプラミン 50 mg の単回投与と併用して (60 mg を 1 日 2 回) 投与した場合、デシプラミンの AUC は 3 倍に増加しました [ 警告と注意事項 ]。
CYP2C9によって代謝される薬物
インビトロ研究の結果は、デュロキセチンが活性を阻害しないことを示しています。ある臨床研究では、CYP2C9 基質である S-ワルファリンの薬物動態は、デュロキセチンによって有意な影響を受けませんでした [ 止血を妨げる薬(例、NSAID、アスピリン、ワルファリン) ]。
CYP3Aによって代謝される薬物
in vitro 研究の結果は、デュロキセチンが CYP3A 活性を阻害または誘導しないことを示しています。したがって、臨床研究は実施されていませんが、誘導または阻害による CYP3A 基質 (例えば、経口避妊薬および他のステロイド剤) の代謝の増加または減少は予想されません。
CYP2C19によって代謝される薬物
in vitro 研究の結果は、デュロキセチンが治療濃度で CYP2C19 活性を阻害しないことを示しています。したがって、臨床研究は実施されていませんが、CYP2C19 基質の代謝の阻害は予想されません。
モノアミンオキシダーゼ阻害剤 (MAOI)
[見る 投薬と管理 、 禁忌 、 と 警告と注意事項 ]。
セロトニン薬
[見る 投薬と管理 、 禁忌 、 と 警告と注意事項 ]。
アルコール
シンバルタ 40mg とエタノールをそれぞれのピーク濃度が一致するように数時間間隔をあけて投与した場合、シンバルタはアルコールによる精神および運動能力の障害を増加させませんでした。
CYMBALTA の臨床試験データベースでは、CYMBALTA で治療を受けた 3 人の患者が、ALT および総ビリルビンの上昇によって明らかになるように、肝障害の証拠を伴う肝障害を有していました。これらのケースのそれぞれにかなりの同時エタノール使用が存在し、これが観察された異常に寄与した可能性があります[ 警告と注意事項 ]。
中枢神経系の薬
[見る 警告と注意事項 ]。
血漿タンパク質に高度に結合する薬物
デュロキセチンは血漿タンパクとの結合性が高いため、タンパク結合性の高い他の薬剤を服用している患者にシンバルタ 30mg を投与すると、他の薬剤の遊離濃度が上昇し、副作用が生じる可能性があります。しかし、CYMBALTA (60 または 120 mg) とワルファリン (2 ~ 9 mg) を併用した場合、INR および総 S- または総 R- のいずれの薬物動態にも有意な変化は見られませんでした。ワルファリン(タンパク質結合プラス遊離薬物)[参照 止血を妨げる薬(例、NSAID、アスピリン、ワルファリン) ]。
薬物乱用と依存
乱用
動物実験では、デュロキセチンはバルビツレート様(抑制剤)乱用の可能性を示しませんでした.
CYMBALTA は、乱用の可能性についてヒトで体系的に研究されていませんが、臨床試験では薬物探索行動の兆候はありませんでした.しかし、市販前の経験に基づいて、中枢神経系活性薬が市販後にどの程度誤用、流用、および/または乱用されるかを予測することは不可能です。したがって、医師は患者の薬物乱用歴を慎重に評価し、そのような患者を綿密に追跡し、CYMBALTA の誤用または乱用の徴候(耐性の発現、用量の増加、薬物探索行動など)がないか観察する必要があります。
依存
薬物依存研究では、デュロキセチンはラットで依存を引き起こす可能性を示しませんでした。
警告
の一部として含まれています "予防" セクション
予防
小児、青年、若年成人の自殺念慮と行動
成人および小児の大うつ病性障害(MDD)の患者は、抗うつ薬を服用しているかどうかにかかわらず、うつ病の悪化および/または自殺念慮および自殺行動(自殺傾向)の出現、または行動の異常な変化を経験する可能性があります。リスクは、有意な寛解が起こるまで持続する可能性があります。自殺は、うつ病やその他の特定の精神障害の既知のリスクであり、これらの障害自体が自殺の最も強力な予測因子です。しかし、抗うつ薬が治療の初期段階で特定の患者のうつ病の悪化と自殺傾向の出現を誘発する役割を果たしている可能性があるという長年の懸念がありました.
抗うつ薬 (SSRI など) の短期プラセボ対照試験のプール分析では、これらの薬が大うつ病性障害 (1824 歳) の子供、青年、若年成人 ( MDD) およびその他の精神障害。短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65 歳以上の成人では、プラセボと比較して抗うつ薬が減少しました。
MDD、強迫性障害(OCD)、またはその他の精神障害を有する小児および青年を対象としたプラセボ対照試験のプール分析には、4,400 人を超える患者を対象とした 9 種類の抗うつ薬の合計 24 の短期試験が含まれていました。 MDD またはその他の精神障害を有する成人を対象としたプラセボ対照試験のプール分析には、77,000 人を超える患者を対象とした 11 種類の抗うつ薬の合計 295 件の短期試験 (期間の中央値は 2 か月) が含まれていました。薬物間で自殺のリスクにかなりのばらつきがありましたが、研究されたほとんどすべての薬物で若い患者が増加する傾向がありました。さまざまな適応症で自殺の絶対リスクに違いがあり、MDD での発生率が最も高かった。しかし、差異のリスク (薬物 vs プラセボ) は、年齢層内および適応症全体で比較的安定していました。これらのリスクの違い (治療を受けた患者 1000 人あたりの自殺傾向の症例数における薬物とプラセボの違い) を表 1 に示します。
小児の CYMBALTA 試験のいずれにおいても、自殺は発生しませんでした。成人のCYMBALTA 20mg試験で自殺がありましたが、その数は自殺に対するCYMBALTAの効果について結論を出すのに十分ではありませんでした.
自殺リスクが長期間の使用、つまり数ヶ月以上の使用に及ぶかどうかは不明です。しかし、うつ病の成人におけるプラセボ対照維持試験から、抗うつ薬の使用がうつ病の再発を遅らせることができるという実質的な証拠があります.
適応症を問わず抗うつ薬で治療されているすべての患者は、特に薬物療法のコースの最初の数か月間、または用量変更時に、臨床的悪化、自殺傾向、行動の異常な変化について適切に監視し、注意深く観察する必要があります。または減少します。
大うつ病性障害で抗うつ薬を服用している成人および小児患者においても、不安、興奮、パニック発作、不眠症、易怒性、敵意、攻撃性、衝動性、アカシジア(精神運動の落ち着きのなさ)、軽躁病、躁病の症状が報告されています。他の適応症に関しては、精神医学的および非精神医学的の両方です。そのような症状の出現と、うつ病の悪化および/または自殺衝動の出現との間の因果関係は確立されていませんが、そのような症状が自殺傾向の出現の前兆を表している可能性があるという懸念があります.
うつ病が持続的に悪化している患者、またはうつ病や自殺傾向の悪化の前兆である可能性のある緊急の自殺願望または症状を経験している患者では、場合によっては投薬を中止することを含め、治療計画の変更を検討する必要があります。特にこれらの症状が重度で突然の場合発症したか、患者の症状の一部ではありませんでした。
治療を中止する決定が下された場合、中止が特定の症状に関連する可能性があることを認識して、可能な限り迅速に投薬を減らす必要があります[ 投薬と管理 と 中断症候群 ] CYMBALTAの中止のリスクの説明について。
大うつ病性障害またはその他の適応症(精神医学的および非精神医学的両方)の抗うつ薬で治療されている患者の家族および介護者は、動揺、過敏性、行動の異常な変化、および上記のその他の症状の出現について患者を監視する必要性について警告する必要があります。 、自殺傾向の出現と同様に、そのような症状を医療提供者に直ちに報告すること。このようなモニタリングには、家族や介護者による毎日の観察が含まれる必要があります。 CYMBALTA の処方は、過剰摂取のリスクを軽減するために、適切な患者管理と一致する最小量のカプセル用に作成する必要があります。
双極性障害の患者のスクリーニング
大うつ病エピソードは、双極性障害の最初の症状である可能性があります。このようなエピソードを抗うつ薬のみで治療すると、双極性障害のリスクがある患者に混合/躁病エピソードが発生する可能性が高くなる可能性があると一般的に考えられています (対照試験では確立されていません)。上記の症状のいずれかがそのような変換を表しているかどうかは不明です。ただし、抗うつ薬による治療を開始する前に、抑うつ症状のある患者を適切にスクリーニングして、双極性障害のリスクがあるかどうかを判断する必要があります。そのようなスクリーニングには、自殺、双極性障害、うつ病の家族歴など、詳細な精神病歴を含める必要があります。 CYMBALTA は、双極性うつ病の治療での使用は承認されていないことに注意してください。
肝毒性
CYMBALTA で治療された患者において、時には致命的な肝不全の報告があります。これらの症例は、腹痛、肝腫大、および黄疸を伴うまたは伴わないトランスアミナーゼレベルの正常上限(ULN)の20倍以上への上昇を伴う肝炎として提示され、肝障害の混合または肝細胞パターンを反映しています。 CYMBALTA 30mg は、黄疸または臨床的に重大な肝機能障害の他の徴候を発症した患者では中止し、別の原因が確立されない限り再開すべきではありません。
トランスアミナーゼレベルの上昇が最小限である胆汁うっ滞性黄疸の症例も報告されています。他の市販後の報告では、慢性肝疾患または肝硬変の患者でトランスアミナーゼ、ビリルビン、およびアルカリホスファターゼの上昇が起こっていることが示されています。
CYMBALTA は、開発プログラムの臨床試験において、血清トランスアミナーゼ値が上昇するリスクを高めました。肝トランスアミナーゼの上昇により、CYMBALTA 治療を受けた患者の 0.3% (92/34,756) が中止されました。ほとんどの患者で、トランスアミナーゼの上昇が検出されるまでの時間の中央値は約 2 か月でした。成人のプラセボ対照試験では、ベースラインの ALT 値が正常および異常な患者について、ULN の 3 倍を超える ALT の上昇が、プラセボの 0.45% (39/8716) と比較して、CYMBALTA 投与患者の 1.25% (11,496 人中 144 人) で発生しました。 -治療を受けた患者。固定用量デザインを用いた成人のプラセボ対照研究では、ALT および AST 上昇に対する CYMBALTA の用量反応関係がそれぞれ ULN の 3 倍以上および ULN の 5 倍以上であるという証拠がありました。
CYMBALTA とアルコールが相互作用して肝障害を引き起こす可能性や、CYMBALTA 20mg が既存の肝疾患を悪化させる可能性があるため、かなりの量のアルコールを使用している患者や慢性肝疾患の証拠がある患者には CYMBALTA を処方しないでください。
起立性低血圧、転倒、失神
起立性低血圧、転倒、および失神が、CYMBALTA の推奨用量で治療された患者で報告されています。失神および起立性低血圧は、治療の最初の 1 週間以内に発生する傾向がありますが、CYMBALTA 治療中のいつでも、特に用量増加後に発生する可能性があります。転倒のリスクは、起立性血圧 (BP) の低下の程度や、転倒の潜在的なリスクを高める可能性のあるその他の要因に関連しているようです。
すべてのプラセボ対照試験の患者の分析では、CYMBALTA 20mg で治療された患者は、プラセボで治療された患者と比較して、より高い転倒率を報告しました。リスクは、起立性血圧の低下の存在に関連しているようです。血圧低下のリスクは、起立性低血圧を誘発する併用薬(降圧薬など)または強力な CYP1A2 阻害薬を服用している患者でより大きくなる可能性があります。 警告と注意事項 と 臨床的に重要な薬物相互作用 および CYMBALTA 20mg を 1 日 60mg を超える用量で服用している患者。 CYMBALTA 40mg の投与中に症候性起立性低血圧、転倒および/または失神を経験した患者では、CYMBALTA の減量または中止を考慮する必要があります。
転倒のリスクはまた、患者の潜在的な転倒リスクに比例しているように見え、年齢とともに着実に増加しているように見えました.高齢患者は、複数の薬の使用、併存疾患、歩行障害などのリスク要因の有病率が高いため、転倒の潜在的なリスクが高くなる傾向があるため、加齢自体の影響は不明です。骨折や入院を含む重大な結果を伴う転倒が、CYMBALTA 30mg の使用で報告されています [参照 有害反応 ]。
セロトニン症候群
生命を脅かす可能性のあるセロトニン症候群の発症は、シンバルタ 60mg を含む SNRI および SSRI 単独で報告されていますが、特に他のセロトニン作動薬 (トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミンなど) の併用で報告されています。 、およびセントジョンズワート) およびセロトニンの代謝を損なう薬物 (特に、MAOI、精神障害の治療を目的としたものと、リネゾリドや静脈内メチレンブルーなどの他のもの) との併用。
セロトニン症候群の症状には、精神状態の変化(興奮、幻覚、せん妄、昏睡など)、自律神経不安定性(頻脈、血圧変動、めまい、発汗、紅潮、高体温など)、神経筋症状(振戦、硬直、ミオクローヌス、反射亢進、協調運動失調)、発作、および/または胃腸症状 (例えば、吐き気、嘔吐、下痢)。セロトニン症候群の出現について患者を監視する必要があります。
CYMBALTA 30mg と MAOI 系抗うつ薬の併用は禁忌です。また、リネゾリドやメチレンブルーの静脈内投与などのMAOIで治療を受けている患者にもCYMBALTA 60mgを開始すべきではありません。投与経路に関する情報を提供するメチレンブルーに関するすべての報告は、1mg/kg~8mg/kgの用量範囲での静脈内投与を含んでいた。他の経路 (経口錠剤や局所組織注射など) または低用量でのメチレン ブルーの投与に関する報告はありません。 CYMBALTA を服用している患者に、リネゾリドや静脈内メチレンブルーなどの MAOI による治療を開始する必要がある場合があります。 MAOI による治療を開始する前に、CYMBALTA を中止する必要があります。 投薬と管理 と 禁忌 ]。
トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、ブスピロン、トリプトファン、アンフェタミン、およびセントジョーンズワートを含む他のセロトニン作動薬とシンバルタ 20mg の併用が臨床的に正当化される場合、患者はセロトニン症候群のリスクが増加する可能性があることを認識する必要があります。 、特に治療開始時および用量増加中。上記の事象が発生した場合は、CYMBALTA 60mg および併用するセロトニン作動薬による治療を直ちに中止し、対症療法を開始する必要があります。
出血のリスクの増加
CYMBALTA などのセロトニン再取り込み阻害を阻害する薬剤は、出血イベントのリスクを高める可能性があります。症例報告と疫学的研究 (症例対照とコホート デザイン) は、セロトニンの再取り込みを妨げる薬物の使用と消化管出血の発生との関連を示しています。市販後の研究では、シンバルタを服用している母親の分娩後出血の発生率が高いことが示されました。 SSRI および SNRI の使用に関連するその他の出血イベントは、斑状出血、血腫、鼻出血、および点状出血から生命を脅かす出血にまで及びます。アスピリン、非ステロイド性抗炎症薬(NSAID)、ワルファリン、およびその他の抗凝固薬の併用は、このリスクを高める可能性があります。
CYMBALTA と NSAIDs、アスピリン、または凝固に影響を与えるその他の薬剤の併用に伴う出血のリスクについて、患者に知らせてください。 薬物相互作用 ]。
重度の皮膚反応
多形紅斑やスティーブンス・ジョンソン症候群(SJS)などの重度の皮膚反応がシンバルタで発生する可能性があります。 CYMBALTA の使用に関連する SJS の報告率は、この重篤な皮膚反応の一般集団のバックグラウンド発生率 (100 万人年あたり 1 ~ 2 例) を上回っています。報告率は、過少報告による過小評価であることが一般に認められています。
水疱、剥離性発疹、粘膜びらん、またはその他の過敏症の徴候が最初に現れた時点で、他の原因が特定できない場合は、CYMBALTA の使用を中止する必要があります。
中断症候群
CYMBALTA を服用している患者の中止症状は、体系的に評価されています。成人のプラセボ対照臨床試験で突然または徐々に中止した後、次の症状が 1% 以上発生し、プラセボを中止した患者と比較して CYMBALTA 治療患者で有意に高い割合で発生しました: めまい、頭痛、吐き気、下痢、感覚異常、過敏症、嘔吐、不眠症、不安、多汗症、疲労。
他の SSRI および SNRI (セロトニンおよびノルエピネフリン再取り込み阻害薬) のマーケティング中に、これらの薬物の中止時に、特に突然の場合に、次のような有害事象が自然発生的に報告されています。例えば、電気ショック感覚などの感覚異常)、不安、混乱、頭痛、無気力、情緒不安定、不眠症、軽躁病、耳鳴り、および発作。これらのイベントは一般に自己制限的ですが、一部は深刻であると報告されています.
CYMBALTA による治療を中止する場合は、これらの症状について患者を監視する必要があります。可能な限り、急激な中止ではなく、徐々に用量を減らすことをお勧めします。投与量の減少後または治療の中止後に耐え難い症状が発生した場合は、以前に処方された投与量の再開が考慮される場合があります。その後、医療提供者は線量を減らし続けるかもしれませんが、より緩やかな速度で [ 投薬と管理 ]。
アクティベーション オブ マニア/ハイポマニア
MDD 患者を対象とした成人のプラセボ対照試験では、CYMBALTA 治療患者の 0.1% (4/3779) およびプラセボ治療患者の 0.04% (1/2536) で躁病または軽躁病の活性化が報告されました。 DPNP、GAD、線維筋痛症、または慢性筋骨格痛のプラセボ対照試験では、躁病または軽躁病の活性化は報告されていません。躁病または軽躁病の活性化は、大うつ病性障害の治療に有効な他の市販薬で治療された気分障害患者のごく一部で報告されています。これらの他の薬剤と同様に、躁病の病歴のある患者には、CYMBALTA 60mg を慎重に使用する必要があります。
閉塞隅角緑内障
CYMBALTA を含む多くの抗うつ薬の使用後に発生する瞳孔散大は、開存性虹彩切除術を受けていない解剖学的に狭い隅角の患者で隅角閉鎖発作を引き起こす可能性があります。
発作
CYMBALTA は発作性疾患の患者で体系的に評価されておらず、そのような患者は臨床試験から除外されました。成人のプラセボ対照臨床試験では、発作/けいれんは、CYMBALTA 60mg で治療された患者の 0.02% (3/12,722) およびプラセボで治療された患者の 0.01% (1/9513) で発生しました。発作性疾患の既往歴のある患者には、CYMBALTA を慎重に処方する必要があります。
血圧の上昇
承認された成人集団を対象としたベースラインからエンドポイントまでの成人プラセボ対照臨床試験では、CYMBALTA 治療により、収縮期血圧が平均 0.5 mmHg、拡張期血圧が 0.8 mmHg 上昇したのに対し、収縮期血圧が平均 0.6 mm Hg 低下し、プラセボ治療患者の拡張期血圧は 0.3 mm Hg。持続的(3回連続の訪問)の血圧上昇の頻度に有意差はありませんでした。シンバルタ 60mg のさまざまなパラメーターに対する効果を評価するために設計された臨床薬理学研究では、加速用量漸増を伴う治療以上の用量での血圧を含む、200mg までの用量で 1 日 2 回 (約 3.3 回最大推奨用量)。最高 200 mg を 1 日 2 回投与した場合、投与後 12 時間までの平均脈拍数の増加は 5.0 ~ 6.8 回、平均血圧の増加は 4.7 ~ 6.8 mm Hg (収縮期) および 4.5 ~ 7 mm Hg (拡張期) でした。 .
治療を開始する前に血圧を測定し、治療中は定期的に血圧を測定する必要があります。 有害反応 ]。
臨床的に重要な薬物相互作用
CYP1A2 と CYP2D6 の両方が CYMBALTA 代謝に関与しています。
他の薬剤がCYMBALTAに影響を与える可能性
CYP1A2阻害剤
CYMBALTA 40mg と強力な CYP1A2 阻害剤との併用は避ける必要があります [ 薬物相互作用 ]。
CYP2D6阻害剤
CYP2D6 は CYMBALTA の代謝に関与しているため、CYP2D6 の強力な阻害剤と CYMBALTA を併用すると、CYMBALTA の濃度が高くなることが予想されます (平均 60%)。 薬物相互作用 ]。
CYMBALTA 30mg が他の薬剤に影響を与える可能性
CYP2D6によって代謝される薬物
特定の抗うつ薬(ノルトリプチリン、アミトリプチリン、イミプラミンなどの三環系抗うつ薬[TCA])、フェノチアジン、1C型抗不整脈薬(例、プロパフェノン、フレカイニド)、注意してアプローチする必要があります。 TCA を CYMBALTA と併用投与する場合は、血漿 TCA 濃度をモニタリングする必要があり、TCA の用量を減らす必要があるかもしれません。重篤な心室性不整脈およびチオリダジンの血漿中濃度の上昇に潜在的に関連する突然死のリスクがあるため、CYMBALTA 30mg とチオリダジンは併用すべきではありません。 薬物相互作用 ]。
その他の臨床的に重要な薬物相互作用
アルコール
CYMBALTA 40mg を多量のアルコール摂取と併用すると、重度の肝障害を引き起こす可能性があります。このため、相当量のアルコールを摂取している患者には、CYMBALTA 60mg を処方すべきではありません。 肝毒性と薬物相互作用 ]。
中枢神経系作用薬
CYMBALTA の主な中枢神経系への影響を考えると、同様の作用機序を持つものを含む他の中枢作用薬と組み合わせて使用する場合、または代替薬として使用する場合は注意して使用する必要があります。 臨床的に重要な薬物相互作用 と 薬物相互作用 ]。
低ナトリウム血症
低ナトリウム血症は、シンバルタを含む SSRI および SNRI による治療の結果として発生する可能性があります。多くの場合、この低ナトリウム血症は、不適切な抗利尿ホルモン分泌症候群 (SIADH) の結果であると思われます。血清ナトリウム値が 110 mmol/L 未満の症例が CYMBALTA 40mg の使用で報告されており、CYMBALTA を中止すると元に戻るように見えました。高齢患者は、SSRI および SNRI を使用すると低ナトリウム血症を発症するリスクが高くなる可能性があります。また、利尿薬を服用している患者や、その他の方法で体液量が枯渇している患者は、リスクが高くなる可能性があります[参照 特定の集団での使用 ]。症候性低ナトリウム血症の患者では、CYMBALTA の中止を考慮し、適切な医療介入を開始する必要があります。
低ナトリウム血症の兆候と症状には、頭痛、集中力の低下、記憶障害、錯乱、脱力感、ふらつきなどがあり、転倒につながる可能性があります。より重症および/または急性の症例は、幻覚、失神、発作、昏睡、呼吸停止、および死亡に関連しています。
合併症のある患者への使用
全身疾患を併発している患者におけるCYMBALTAの臨床経験は限られています。胃の運動性の変化が CYMBALTA の腸溶性コーティングの安定性に及ぼす影響に関する情報はありません。極度の酸性条件では、腸溶性コーティングによって保護されていないシンバルタは加水分解を受けてナフトールを形成する可能性があります。胃内容排出を遅らせる可能性のある状態の患者(一部の糖尿病患者など)に CYMBALTA を使用する場合は注意が必要です。
CYMBALTA 30mg は、心筋梗塞または不安定冠動脈疾患の最近の病歴を持つ患者で体系的に評価されていません。これらの診断を受けた患者は、一般に、製品の市販前テスト中に臨床研究から除外されました.
肝障害
慢性肝疾患または肝硬変の患者への使用は避けてください。 投薬と管理 、 肝毒性 、 と 特定の集団での使用 ]。
重度の腎障害
重度の腎機能障害、GFR 投薬と管理 と 特定の集団での使用 ]。
糖尿病患者の血糖コントロール
DPNP 試験で観察されたように、CYMBALTA 30mg 治療は一部の糖尿病患者の血糖コントロールを悪化させました。糖尿病性末梢神経障害に伴う神経因性疼痛の管理を目的とした CYMBALTA の 3 つの臨床試験 [参照 臨床研究 ]、糖尿病の平均期間は約 12 年、平均ベースライン空腹時血糖は 176 mg/dL、平均ベースライン ヘモグロビン A1c (HbA1c) は 7.8% でした。これらの研究の 12 週間の急性期治療段階では、CYMBALTA はプラセボと比較して平均空腹時血糖のわずかな増加と関連していました。 52 週間まで続いたこれらの研究の延長段階では、平均空腹時血糖値が CYMBALTA 40mg 群で 12mg/dL 増加し、通常治療群で 11.5mg/dL 減少しました。 HbA1cは、シンバルタ40mg群で0.5%、日常ケア群で0.2%上昇しました。
尿ためらいと尿閉
CYMBALTA 60mg は、尿道抵抗に影響を与えることが知られている薬剤のクラスに属しています。 CYMBALTA 20mg の投与中に尿ためらいの症状が発現した場合は、薬物関連の可能性を考慮する必要があります。
市販後の経験では、尿閉の症例が観察されています。 CYMBALTA 60mg の使用に伴う尿閉のいくつかの例では、入院および/またはカテーテル挿入が必要でした。
性機能障害
CYMBALTA 60mg を含む SNRI の使用は、性機能障害の症状を引き起こす可能性があります [ 有害反応 ]。男性患者では、SNRI の使用により、射精の遅延または失敗、性欲減退、および勃起不全が生じる可能性があります。女性患者の場合、SNRI の使用により、性欲が低下し、オーガズムが遅延または消失する可能性があります。
性機能は自然に報告されない可能性があるため、処方者は、CYMBALTA 40mg の開始前に性機能について質問し、治療中の性機能の変化について具体的に質問することが重要です。性機能の変化を評価する際には、詳細な病歴(症状の発症時期を含む)を取得することが重要です。なぜなら、性的症状には、根底にある精神障害を含む他の原因がある可能性があるためです。患者が治療について情報に基づいた決定を下すのをサポートするための潜在的な管理戦略について話し合います。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
自殺念慮と行動
患者、その家族、およびその介護者に、特に治療中および投与量を増減したときに、自殺念慮および行動の出現を探すように助言し、そのような症状を医療提供者に報告するように指示する[参照 ボックス警告 と 警告と注意事項 ]。
管理
患者には、CYMBALTA 20mg を丸ごと飲み込み、カプセルを噛んだり、つぶしたり、開けたりしないようにアドバイスしてください (内容物を食品にまき散らしたり、液体と混ぜたりしないでください)。
肝毒性
CYMBALTA で治療された患者で、時には致命的な重度の肝障害が報告されていることを患者に知らせてください。 CYMBALTA の服用中にかゆみ、右上腹部の痛み、尿の色が濃い、または皮膚や目が黄色くなった場合は、肝臓の問題の徴候である可能性があるため、医療提供者に相談するよう患者に指示してください。患者に、アルコール摂取について医療提供者に相談するように指示します。大量のアルコールを摂取しながらCYMBALTAを使用すると、重度の肝障害を引き起こす可能性があります[参照 警告と注意事項 ]。
アルコール
CYMBALTA は、アルコールによって引き起こされる精神および運動能力の障害を増加させませんが、CYMBALTA を大量のアルコール摂取と併用すると、重度の肝障害を引き起こす可能性があります。 警告と注意事項 と 薬物相互作用 ]。
起立性低血圧、転倒、失神
起立性低血圧、転倒、失神のリスクについて、特に初回使用時とその後の用量漸増の期間中、およびシンバルタの起立性効果を増強する可能性のある併用薬の使用に関連して、患者に助言する[参照 警告と注意事項 ]。
セロトニン症候群
シンバルタ 30mg と、トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、ブスピロン、トリプトファン、アンフェタミン、およびセントジョーンズワートを含む他のセロトニン作動薬の併用によるセロトニン症候群のリスクについて、患者に注意してください。 禁忌 、 警告と注意事項 、 と 薬物相互作用 ]。セロトニン症候群に関連する徴候や症状について患者に助言する神経筋の変化 (例えば、振戦、硬直、ミオクローヌス、反射亢進、協調運動障害)、発作、および/または胃腸症状 (例えば、吐き気、嘔吐、下痢)。これらの症状が見られた場合は、直ちに医療機関を受診するよう患者に注意してください。
出血のリスクの増加
セロトニンの再取り込みを妨げる向精神薬との併用は出血リスクの増加と関連しているため、シンバルタ 30mg と NSAIDs、アスピリン、ワルファリン、またはその他の凝固に影響を与える薬との併用について患者に注意してください。 警告と注意事項 と 特定の集団での使用 ]。
重度の皮膚反応
シンバルタが重篤な皮膚反応を引き起こす可能性があることに注意してください。これは病院で治療する必要があり、生命を脅かす可能性があります。患者に、皮膚の水ぶくれ、剥がれた発疹、口内のただれ、蕁麻疹、またはその他のアレルギー反応がある場合は、すぐに医師に連絡するか、緊急の助けを求めるように助言します。 警告と注意事項 ]。
治療の中止
CYMBALTA 30mg の中止は、めまい、頭痛、吐き気、下痢、感覚異常、易刺激性、嘔吐、不眠症、不安、多汗症、疲労などの症状を伴う可能性があるため、投与計画を変更したり中止したりしないように患者に指示する必要があります。医療提供者に相談せずにCYMBALTAを服用する[参照 警告と注意事項 ]。
マニアまたは軽躁の活性化
CYMBALTAによる治療を開始する前に、双極性障害のリスク(自殺、双極性障害、およびうつ病の家族歴など)について、抑うつ症状のある患者を適切にスクリーニングしてください。エネルギーの大幅な増加、重度の睡眠障害、考え事を巡る、無謀な行動、いつもより多くまたは速く話す、異常に壮大な考え、過度の幸福感または過敏症などの躁病反応の徴候または症状を報告するように患者に助言する[参照 警告と注意事項 ]。
閉塞隅角緑内障
CYMBALTA 40mg を服用すると軽度の瞳孔散大を引き起こす可能性があり、影響を受けやすい個人では、閉塞隅角緑内障のエピソードにつながる可能性があることを患者に助言してください。既存の緑内障は、ほとんどの場合、開放隅角緑内障です。診断された場合、閉塞隅角緑内障は虹彩切除術で確実に治療できるからです。開放隅角緑内障は、閉塞隅角緑内障の危険因子ではありません。患者は、閉塞隅角の影響を受けやすいかどうかを判断するために検査を受け、影響を受けやすい場合は予防処置(虹彩切除術など)を受けることを希望する場合があります。 警告と注意事項 ]。
発作
発作性疾患の病歴がある場合は、医療提供者に知らせるように患者に助言する[参照 警告と注意事項 ]。
血圧への影響
患者は、シンバルタ 60mg が血圧上昇を引き起こす可能性があることに注意してください。 警告と注意事項 ]。
併用薬
相互作用の可能性があるため、患者が処方薬または市販薬を服用している、または服用する予定がある場合は、医療提供者に知らせるよう患者に助言する[参照 投薬と管理 、 禁忌 、 警告と注意事項 、 と 薬物相互作用 ]。
低ナトリウム血症
CYMBALTA を含む SNRI および SSRI による治療の結果として低ナトリウム血症が報告されていることを患者に助言する。低ナトリウム血症の徴候と症状について患者に助言する[参照 警告と注意事項 ]。

付随する病気
医療提供者に自分のすべての病状について知らせるよう患者に助言する [参照 警告と注意事項 ]。
尿ためらいと尿閉
CYMBALTA は、排尿に影響を与える可能性のある医薬品のクラスに属しています。尿の流れに問題が生じた場合は、医療提供者に相談するように患者に指示します [参照 警告と注意事項 ]。
性機能障害
CYMBALTA 40mg の使用は、男性と女性の両方の患者で性機能障害の症状を引き起こす可能性があることを患者に助言してください。性機能の変化と潜在的な管理戦略について医療提供者と話し合う必要があることを患者に伝えます[ 警告と注意事項 ]。
妊娠
- CYMBALTA による治療中に妊娠した場合、または妊娠する予定がある場合は、医療提供者に通知するよう女性に助言してください。
- 妊娠中の女性または妊娠を希望する患者には、分娩前の月にシンバルタ 40mg を使用すると、分娩後出血のリスクが高まる可能性があり、長期の入院、呼吸補助、および経管栄養を必要とする新生児合併症のリスクが高まる可能性があることをアドバイスしてください。
- 妊娠中の女性には、抗うつ薬の中止による再発のリスクがあることをアドバイスしてください。
- 妊娠中にデュロキセチンに曝露した女性の妊娠転帰を監視する妊娠曝露登録簿があることを患者に助言する[参照 特定の集団での使用 ]。
授乳
シンバルタ 30mg を使用している授乳中の女性は、乳児の鎮静、哺乳不良、体重増加不良を監視し、これらの徴候に気付いた場合は医療機関を受診するようアドバイスしてください。 特定の集団での使用 ]。
精神運動パフォーマンスへの干渉
CYMBALTA 30mg は、鎮静とめまいを伴う可能性があります。したがって、CYMBALTA 療法がそのような活動に従事する能力に影響を及ぼさないことが合理的に確信できるまで、自動車を含む危険な機械の操作について患者に注意してください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
デュロキセチンは、マウスとラットに 2 年間混餌投与されました。
デュロキセチンを 140 mg/kg/日 (mg/m2 に基づいて子供に与えられる 120 mg/日の最大推奨ヒト用量 (MRHD) の 3 倍) 投与された雌マウスでは、肝細胞腺腫および肝細胞癌の発生率が増加しました。無効果量は 50 mg/kg/日 (子供に与えられた MRHD の 1 倍) でした。デュロキセチンを 100 mg/kg/日 (小児に投与した MRHD の 2 倍) まで投与した雄マウスでは、腫瘍発生率は増加しませんでした。
ラットでは、雌で最大 27 mg/kg/日 (子供に投与された MRHD の 1 倍)、雄で最大 36 mg/kg/日 (子供に投与された MRHD の 1.4 倍) のデュロキセチンの食事量は、腫瘍の発生率。
突然変異誘発
デュロキセチンは、in vitro 細菌復帰突然変異試験 (Ames 試験) で変異原性を示さず、マウス骨髄細胞を用いた in vivo 染色体異常試験で染色体異常誘発性を示さなかった。さらに、デュロキセチンは、マウスリンパ腫細胞を用いた in vitro 哺乳動物前方遺伝子変異アッセイまたは初代ラット肝細胞を用いた in vitro 不定期 DNA 合成 (UDS) アッセイで遺伝毒性を示さず、in vivo でチャイニーズハムスター骨髄の姉妹染色分体交換を誘発しませんでした。 .
生殖能力の障害
デュロキセチンをオスまたはメスのいずれかのラットに交配前および交配中に経口投与したところ、45 mg/kg/日 (mg/m2 に基づいて青少年に投与された MRHD の 3 倍) までの用量で交配または受胎能に変化はありませんでした。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中にCYMBALTAに曝露した女性の妊娠転帰を監視する妊娠曝露登録があります。登録するには、1-866-814-6975 または www.cymbalta 20mgpregnancyregistry.com で CYMBALTA Pregnancy Registry に連絡してください。
リスクの概要
市販後レトロスペクティブ コホート研究のデータは、出産前の月にデュロキセチンを使用すると、分娩後出血のリスクが増加する可能性があることを示しています。出版された文献および市販後レトロスペクティブ コホート研究からのデータは、主要な先天性欠損症またはその他の有害な発達転帰の明確な薬物関連リスクを特定していません (以下を参照)。 データ )。妊娠中の未治療のうつ病や線維筋痛症、および妊娠中のシンバルタを含む SNRI や SSRI への曝露に関連するリスクがあります( 臨床上の考慮事項 )。
器官形成期にデュロキセチンを投与されたラットとウサギでは、胎児の体重が減少しましたが、最大推奨用量 (MRHD) の 120 mg/日を投与した場合、それぞれ最大 3 倍と 6 倍の用量で発生への影響の証拠はありませんでした。 mg/m2 ベースで青少年に。デュロキセチンを妊娠中のラットに妊娠中および授乳中に経口投与した場合、出生時の仔の体重と分娩後 1 日までの仔の生存率は、mg/m2 ベースで青少年に投与された MRHD の 2 倍の用量で減少しました。この用量では、騒音に対する驚愕反応の増加や自発運動の慣れの減少など、反応性の増加と一致する子犬の行動が観察されました。離乳後の成長に悪影響はありませんでした。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中に抗うつ薬を中止した女性は、抗うつ薬を継続している女性よりも大うつ病の再発を経験する可能性が高くなります。この発見は、大うつ病性障害の病歴があり、妊娠初期に胸腺機能が正常で抗うつ薬を服用していた 201 人の妊婦を追跡した前向き縦断研究から得られたものです。妊娠中および産後に抗うつ薬による治療を中止または変更する場合は、未治療のうつ病のリスクを考慮してください。
線維筋痛症の妊婦は、早期破水、早産、在胎週数の割に小さい、子宮内発育制限、胎盤崩壊、静脈血栓症など、母体および乳児に有害な結果をもたらすリスクが高くなります。これらの母体および胎児への悪影響が、線維筋痛症またはその他の併存因子の直接の結果であるかどうかは不明です。
母体の有害反応
分娩前の月にデュロキセチンを使用すると、分娩後出血のリスクが高くなる可能性があります。 警告と注意事項 ]。
胎児/新生児の有害反応
CYMBALTA および他の SNRI または SSRI にさらされた妊娠第 3 期後半の新生児は、長期の入院、呼吸補助、および経管栄養を必要とする合併症を発症しました。このような合併症は、出産直後に発生する可能性があります。報告された臨床所見には、呼吸困難、チアノーゼ、無呼吸、発作、体温の不安定性、摂食困難、嘔吐、低血糖、筋緊張低下、筋緊張亢進、反射亢進、振戦、神経質、過敏症、絶え間ない泣き声が含まれます。これらの調査結果は、SNRI または SSRI の直接的な毒性効果、またはおそらく薬物中止症候群のいずれかと一致しています。場合によっては、臨床像がセロトニン症候群と一致することに注意する必要があります。 警告と注意事項 ]。
データ
ヒューマンデータ
市販後遡及請求ベースのコホート研究からのデータは、妊娠の最後の月にデュロキセチンに曝露された 955 人の妊婦の間で、曝露されていない 4,128,460 人の妊婦と比較して、分娩後出血のリスクが高いことを発見しました (調整相対リスク: 1.53; 95% CI: 1.08-2.18 )。同じ研究では、妊娠初期にデュロキセチンに暴露した 2,532 人の女性と、いくつかの交絡因子を調整した後、暴露していない 1,284,827 人の女性を比較したところ、重大な先天異常のリスクに臨床的に意味のある増加は見られませんでした。方法論的な限界には、交絡の可能性、曝露と転帰の誤分類、疾患の重症度を直接測定する方法の欠如、アルコール使用、栄養、市販薬への曝露に関する情報の欠如が含まれます。
動物データ
動物の繁殖研究では、デュロキセチンは胚/胎児および生後の発達に悪影響を与えることが示されています.
器官形成期にデュロキセチンを妊娠中のラットとウサギに経口投与した場合、45 mg/kg/日までの用量で奇形や発達上の変化の証拠はありませんでした [それぞれ、120 mg/日の MRHD の 3 倍と 6 倍]。 mg/m2 に基づいて青少年に与えられる]。しかし、胎児の体重はこの用量で減少し、10 mg/kg/日の無影響用量でした (ラットの MRHD にほぼ等しく、ウサギの MRHD の 2 倍)。
デュロキセチンを妊娠中のラットに妊娠中および授乳中に経口投与した場合、分娩後 1 日までの仔の生存率および出生時および授乳期の仔の体重は、30 mg/kg/日の用量で減少しました (与えられた MRHD の 2 倍)。 mg/m2 ベースで青少年に);無影響量は 10 mg/kg/日でした。さらに、騒音に対する驚愕反応の増加や自発運動の慣れの減少など、反応性の増加と一致する行動が、30 mg/kg/日の母体暴露後の子犬で観察されました。子孫の離乳後の成長と生殖能力は、母親のデュロキセチン治療によって悪影響を受けませんでした。
授乳
リスクの概要
公開された文献のデータは、母乳中のデュロキセチンの存在を報告しています ( データ )。母乳を通じてデュロキセチンにさらされた乳児の鎮静、摂食不良、および体重増加不良の報告があります( 臨床上の考慮事項 )。牛乳生産に対するデュロキセチンの効果に関するデータはありません。
母乳育児の発達上および健康上の利点は、母親のシンバルタに対する臨床的必要性、およびシンバルタまたは母体の基礎疾患による母乳育児中の子供への潜在的な悪影響と併せて考慮する必要があります。
臨床上の考慮事項
CYMBALTA にさらされた乳児は、鎮静状態、哺乳不良、体重増加不良について監視する必要があります。
データ
CYMBALTA 60mg の体内動態は、産後 12 週以上で離乳を選択した 6 人の授乳中の女性で研究されました。女性は CYMBALTA 60mg 40mg を 1 日 2 回、3.5 日間投与されました。母乳中で測定されたピーク濃度は、投与後 3 時間の中央値で発生しました。母乳中のシンバルタの量は、その用量で約 7 mcg/日でした。推定 1 日乳児用量は約 2 mcg/kg/日であり、これは母親の用量の 1% 未満です。母乳中のシンバルタ 40mg 代謝物の存在は調査されていません。
小児用
CYMBALTA 60mg の安全性と有効性は、7 歳から 17 歳の患者の全般性不安障害 (GAD) の治療および 13 歳から 17 歳の患者の若年性線維筋痛症候群の治療で確立されています。 CYMBALTA 20mg の安全性と有効性は、大うつ病性障害 (MDD)、糖尿病性末梢神経因性疼痛、または慢性筋骨格痛の小児患者では確立されていません。
抗うつ薬は、小児患者の自殺念慮と自殺行動のリスクを高めました。抗うつ薬で治療されているすべての小児患者を、特に治療の最初の数か月間、または投与量の変更時に、臨床的悪化および自殺念慮および自殺行動の出現について監視する[参照 警告と注意事項 ]。 CYMBALTA による治療を受けた小児患者の体重と成長を定期的にモニタリングする [参照 有害反応 ]。
全般性不安障害
歳から 17 歳の患者の GAD の治療における CYMBALTA の使用は、1 つの 10 週間のプラセボ対照試験 (GAD-6) によって支持されています。この研究には、GAD の 272 人の小児患者が含まれ、そのうち 47% が 7 歳から 11 歳でした (53% は 12 歳から 17 歳でした)。 CYMBALTA は、GAD 重症度スコアの小児不安評価尺度(PARS)の大幅な改善によって測定されるように、プラセボよりも優れていることを示しました [参照 臨床研究 ]。
7歳未満の小児患者のGAD治療におけるCYMBALTA 20mgの安全性と有効性は確立されていません。
線維筋痛症
13 歳から 17 歳の患者の線維筋痛症の治療における CYMBALTA の使用は、184 人の若年性線維筋痛症症候群の患者を対象とした 13 週間のプラセボ対照試験によって支持されています (Study FM-4)。 CYMBALTA は、主要評価項目、Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version のベースラインから治療終了までの変化でプラセボよりも改善を示しました。24 時間平均疼痛重症度評価 [参照 臨床研究 ]。
13 歳未満の患者の線維筋痛症の治療における CYMBALTA の安全性と有効性は確立されていません。
大鬱病性障害
CYMBALTA の安全性と有効性は、MDD の治療のために小児患者で確立されていません。
CYMBALTA の有効性は、MDD (MDD-6 および MDD-7) の 7 歳から 17 歳までの 800 人の小児患者を対象とした 2 つの 10 週間のプラセボ対照試験で実証されませんでした。 CYMBALTA も実薬対照(小児 MDD の治療薬として承認済み)もプラセボより優れていませんでした。
MDD の小児臨床試験で最も頻繁に観察された副作用には、吐き気、頭痛、体重減少、腹痛などがあります。 SSRI と SNRI の使用に関連して、食欲減退と体重減少が観察されています。
若年動物毒性データ
生後 21 日目 (離乳) から生後 90 日目 (成体) までの若いラットへのデュロキセチン投与は、成体期まで持続する体重減少をもたらしましたが、薬物治療を中止すると回復しました。生殖能力に影響を与えずに、女性の性的成熟がわずかに遅れる(〜1.5日)。成人期における複雑な作業の学習の遅れは、薬物治療が中止された後は観察されませんでした。これらの効果は、45mg/kg/日の高用量で観察された(子供の場合、MRHDの2倍)。無影響レベルは 20 mg/kg/日 (子供の場合、MRHD の約 1 倍) でした。
高齢者の使用
CYMBALTA の市販前臨床試験における高齢者曝露
- MDD 試験の 2,418 人の患者のうち、6% (143 人) が 65 歳以上でした。
- CLBP 試験に参加した 1041 人の患者のうち、21% (221 人) が 65 歳以上でした。
- OA 試験の 487 人の患者のうち、41% (197 人) が 65 歳以上でした。
- DPNP 試験の 1,074 人の患者のうち、33% (357 人) が 65 歳以上でした。
- FM 試験の 1,761 人の患者のうち、8% (140 人) が 65 歳以上でした。
MDD、GAD、DPNP、FM、OA、および CLBP の研究では、一般に、これらの患者と若年成人患者との間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、これらの高齢者と若年者の間の反応の違いは確認されていません。成人患者の場合もあるが、一部の高齢患者の感度が高いことは除外できない。
CYMBALTA を含む SSRI および SNRI は、高齢患者において臨床的に重大な低ナトリウム血症と関連しており、この有害反応のリスクが高い可能性があります [参照 警告と注意事項 ]。
すべてのプラセボ対照試験のデータを分析したところ、CYMBALTA 治療を受けた患者は、プラセボ治療を受けた患者よりも高い転倒率が報告されました。リスクの増加は、患者の潜在的な転倒リスクに比例しているようです。根底にあるリスクは、年齢とともに着実に増加しているようです。高齢患者は、投薬、併存疾患、歩行障害などの転倒の危険因子の有病率が高い傾向があるため、CYMBALTA 30mg 治療中の転倒に対する年齢の増加自体の影響は不明です。 CYMBALTAの使用により、骨折や入院などの重大な結果を伴う転倒が報告されています[参照 警告と注意事項 と 有害反応 ]。
健康な高齢女性(65~77歳)と健康な中年女性(32~50歳)を対象に、デュロキセチン40mg単回投与後の薬物動態を比較しました。 Cmax に差はありませんでしたが、デュロキセチンの AUC は幾分 (約 25%) 高く、半減期は年配の女性で約 4 時間長くなりました。母集団の薬物動態分析では、クリアランスの典型的な値は、25 歳から 75 歳の間で年齢ごとに約 1% 減少することが示唆されています。しかし、予測因子としての年齢は、患者間のばらつきのわずかな割合しか占めていません。成人患者の年齢に基づく用量調節は必要ありません。
性別
デュロキセチンの半減期は、男性と女性で似ています。性別による用量調節は必要ありません。
喫煙状況
デュロキセチンのバイオアベイラビリティ (AUC) は、喫煙者では約 3 分の 1 減少するようです。投与量の変更は、喫煙者にはお勧めできません。
人種
人種の影響を調査するための特定の薬物動態研究は実施されていません。
肝障害
臨床的に明らかな肝障害のある患者は、デュロキセチンの代謝と排泄が減少しています。 CYMBALTA 20mg の 20mg 単回投与後、中等度の肝機能障害 (Child-Pugh クラス B) の 6 人の肝硬変患者は、年齢および性別が一致した健康な被験者の約 15% の平均血漿デュロキセチン クリアランスを示し、5 倍増加しました。平均露出(AUC)で。肝硬変患者の Cmax は正常値と同様でしたが、半減期は約 3 倍長かった [参照 投薬と管理 と 警告と注意事項 ]。
重度の腎障害
末期腎不全(ESRD)患者におけるCYMBALTA 40mgの効果に関するデータは限られています。 CYMBALTA 20mg の 60mg 単回投与後、Cmax および AUC 値は、慢性間欠的血液透析を受けている ESRD 患者で、腎機能が正常な被験者よりも約 100% 大きくなりました。しかし、排出半減期は両方のグループで類似していました。主な循環代謝物である 4-ヒドロキシ デュロキセチン グルクロニドおよび 5-ヒドロキシ, 6 メトキシ デュロキセチン硫酸塩の AUC は、大部分が尿中に排泄され、約 7 倍から 9 倍高く、複数回投与でさらに増加すると予想されます。集団 PK 分析は、軽度から中等度の腎障害 (推定 CrCl 30-80 mL/min) がデュロキセチンの見かけのクリアランスに有意な影響を及ぼさないことを示唆している [ 投薬と管理 と 警告と注意事項 ]。
過剰摂取
徴候と症状
市販後の経験では、主に混合過剰摂取による急性のシンバルタ 60mg 過剰摂取で致命的な結果が報告されていますが、シンバルタ 1000 mg を含む 20mg のみでも報告されています (最大推奨用量の約 8.3 倍)。過剰摂取(CYMBALTA単独または混合薬)の徴候と症状には、傾眠、昏睡、セロトニン症候群、発作、失神、頻脈、低血圧、高血圧、および嘔吐が含まれていました.
過剰摂取の管理
CYMBALTA 60mg の過剰摂取に対する特定の解毒剤はありませんが、セロトニン症候群が続いた場合は、特定の治療法(シプロヘプタジンや体温調節など)が考慮されることがあります。
CYMBALTA 30mg の急性過剰摂取の場合、適切な気道、酸素化、換気を確保し、心調律とバイタルサインを監視するなど、過剰摂取の管理に採用されている一般的な対策を講じて治療を行う必要があります。必要に応じて、適切な気道保護を備えた大口径の口腔胃管による胃洗浄が、摂取直後または症状のある患者で実施される場合に適応となる場合があります。嘔吐の誘発は推奨されません。
活性炭は、消化管からのデュロキセチンの吸収を制限するのに役立つ場合があります。活性炭の投与により、デュロキセチンの AUC と Cmax が平均で 3 分の 1 減少することが示されていますが、一部の患者では活性炭の効果が限定的でした。デュロキセチンの分布量が多いため、強制利尿、透析、血液灌流、および交換輸血が有益であるとは考えにくい.
過剰摂取を管理する際には、複数の薬物の関与の可能性を考慮する必要があります。特に、シンバルタ 60mg および三環系抗うつ薬を過剰摂取している患者には注意が必要です。このような場合、親の三環系および/またはその活性代謝物のクリアランスの減少は、臨床的に重大な後遺症の可能性を高め、綿密な医学的観察に必要な時間を延長する可能性があります[参照 警告と注意事項 と 薬物相互作用 ]。
過剰摂取の治療に関する追加情報については、毒物管理センター (1-800-222-1222 または www.poison.org) に連絡することを検討してください。
禁忌
セロトニン症候群のリスクが高まるため、CYMBALTA 40mg または CYMBALTA による治療を中止してから 5 日以内に精神障害を治療することを目的とした MAOI の使用は禁忌です。精神障害の治療を目的とした MAOI を中止してから 14 日以内の CYMBALTA の使用は禁忌です。 投薬と管理 と 警告と注意事項 ]。
セロトニン症候群のリスクが高まるため、リネゾリドやメチレンブルーの静脈内投与などのMAOIで治療されている患者にCYMBALTA 30mgを開始することも禁忌です[ 投薬と管理 と 警告と注意事項 ]。
臨床薬理学
作用機序
ヒトにおけるデュロキセチンの抗うつ作用、中枢性疼痛抑制作用、および抗不安作用の正確なメカニズムは不明ですが、これらの作用は、CNS におけるセロトニン作動性およびノルアドレナリン作動性活性の増強に関連していると考えられています。
薬力学
前臨床研究では、デュロキセチンがニューロンのセロトニンとノルエピネフリンの再取り込みの強力な阻害剤であり、ドーパミンの再取り込みの強力な阻害剤ではないことが示されています。デュロキセチンは、ドーパミン作動性、アドレナリン作動性、コリン作動性、ヒスタミン作動性、オピオイド、グルタミン酸、および GABA 受容体に対して in vitro で有意な親和性を示しません。デュロキセチンはモノアミンオキシダーゼ (MAO) を阻害しません。
CYMBALTA は、尿道抵抗に影響を与えることが知られている薬剤のクラスに属しています [参照 警告と注意事項 ]。
心臓電気生理学
CYMBALTA 160 mg および 200 mg を 1 日 2 回 (それぞれ最大推奨用量の 2.7 倍および 3.3 倍) 投与した場合の定常状態への影響は、117 人の健康な成人女性被験者を対象とした無作為化二重盲検双方向クロスオーバー試験で評価されました。 QT 間隔の延長は検出されませんでした。 CYMBALTA 40mg は、濃度依存性であるが臨床的に意味のある QT 短縮と関連していないようです。
薬物動態
デュロキセチンの排出半減期は約 12 時間 (範囲 8 ~ 17 時間) であり、その薬物動態は治療範囲にわたって用量に比例します。定常状態の血漿濃度は、通常、3 日間の投与後に達成されます。デュロキセチンの排出は、主に 2 つの P450 アイソザイム、CYP1A2 および CYP2D6 が関与する肝代謝によって行われます。
吸収
シンバルタ30mgの経口投与後、デュロキセチン塩酸塩はよく吸収されます。吸収が始まるまでの中央値 2 時間の遅延 (Tlag) があり、デュロキセチンの最大血漿濃度 (Cmax) は投与後 6 時間で発生します。吸収が 3 時間遅れ、朝の投与と比較して、夕方の投与後にデュロキセチンの見かけのクリアランスが 3 分の 1 増加します。
食事の影響
食事はデュロキセチンの Cmax に影響を与えませんが、ピーク濃度に達する時間を 6 時間から 10 時間遅らせ、吸収の程度 (AUC) を約 10% わずかに減少させます。
分布
分布の見かけの体積は、平均約 1640 L です。デュロキセチンは、ヒト血漿中のタンパク質に高度に結合 (>90%) し、主にアルブミンおよびα1-酸性糖タンパク質に結合します。デュロキセチンと他の高タンパク結合薬との相互作用は十分に評価されていません。デュロキセチンの血漿タンパク質結合は、腎臓または肝臓の障害による影響を受けません。
排除
代謝
ヒトにおけるデュロキセチンの生体内変化および体内動態は、14C 標識デュロキセチンの経口投与後に測定されています。デュロキセチンは、血漿中の総放射性標識物質の約 3% を占めており、多数の代謝物への広範な代謝を受けることを示しています。デュロキセチンの主な生体内変化経路には、ナフチル環の酸化、それに続く抱合、さらに酸化が含まれます。 CYP1A2 と CYP2D6 の両方が in vitro でナフチル環の酸化を触媒します。血漿中に見られる代謝物には、4-ヒドロキシ デュロキセチン グルクロニドおよび 5 ヒドロキシ, 6-メトキシ デュロキセチン硫酸塩が含まれます。
排泄
他にも多くの代謝物が尿中に確認されており、一部はマイナーな排泄経路にすぎません。微量 (投与量の 1% 未満) の未変化デュロキセチンが尿中に存在します。デュロキセチン用量の大部分 (約 70%) は、デュロキセチンの代謝物として尿中に現れます。約 20% が糞便中に排泄されます。デュロキセチンは広範な代謝を受けますが、主要な循環代謝物がデュロキセチンの薬理活性に大きく寄与することは示されていません。
特定の集団
小児患者
デュロキセチンの定常状態の血漿濃度は、7 ~ 17 歳の小児患者と成人患者で同等でした。平均定常デュロキセチン濃度は、成人患者と比較して、この小児集団で約 30% 低かった。モデルで予測された 7 ~ 17 歳の小児患者におけるデュロキセチンの定常状態血漿濃度は、ほとんどが成人患者で観察された濃度範囲内にあり、成人の濃度範囲を超えませんでした。
臨床研究
臨床試験の概要
CYMBALTA 60mg の有効性は、適切かつ十分に管理された試験において、以下の集団で確立されています。
大うつ病性障害(MDD)
成人における4つの短期(MDD-1、MDD-2、MDD-3、およびMDD-4試験)および1つの維持試験(MDD-5試験)[参照 成人の大うつ病性障害 ]。
全般性不安障害(GAD)
成人短期試験3件(GAD-1、GAD-2、GAD-3試験)、成人維持試験1件(GAD-4試験)、高齢者短期試験1件(GAD-5試験)、および 7 歳から 17 歳の小児患者を対象とした 1 つの短期試験(GAD-6 試験)[参照 全般性不安障害 ]。
糖尿病性末梢神経障害性疼痛 (DPNP)
成人を対象とした 2 つの 12 週間試験(DPNP-1 および DPNP-2 試験)[参照 成人における糖尿病性末梢神経因性疼痛 ]。
線維筋痛症(FM)
成人を対象とした 2 つの試験(3 か月間および 6 か月間のうちの 1 つ)(FM-1 および FM-2 試験)および 13 歳から 17 歳の小児患者を対象とした 13 週間の試験(FM-4 試験)[参照 線維筋痛症 ]。
慢性筋骨格痛
慢性腰痛(CLBP)の成人患者を対象とした12~13週間の試験2件(CLBP-1およびCLBP-3試験)および変形性関節症(OA)による慢性疼痛を有する成人患者を対象とした13週間の試験1件(OA試験) -1) [参照 成人の慢性筋骨格痛 ]。
さらに、有効性を示さなかった次の試験の概要を以下に示します: FM-3 試験 (線維筋痛症の成人患者を対象とした 16 週間の試験)、CLBP-2 試験 (CLBP の成人患者を対象とした 13 週間の試験)、および研究 OA-2 (OA による慢性疼痛の成人患者における 13 週間の試験)。
成人の大うつ病性障害
成人の MDD の治療としての CYMBALTA の有効性は、MDD の DSM-IV 基準を満たす成人の外来患者 (18 ~ 83 歳) を対象とした 4 つのランダム化二重盲検プラセボ対照固定用量試験で確立されました。
- 研究 MDD-1 および MDD-2 では、患者は 1 日 1 回の CYMBALTA 60 mg (それぞれ N=123 および N=128) またはプラセボ (それぞれ N=122 および N=139) に 9 週間無作為に割り付けられました。
- MDD-3 試験では、8 週間にわたって CYMBALTA 20 mg または 40 mg を 1 日 2 回 (それぞれ N=86 および N=91) またはプラセボ (N=89) に無作為に割り付けられました。
- MDD-4 試験では、8 週間にわたり CYMBALTA 40 または 60 mg を 1 日 2 回 (それぞれ N=95 および N=93) またはプラセボ (N=93) に無作為に割り付けました。
4つの試験すべてにおいて、CYMBALTA 40mgは、17項目のハミルトンうつ病評価尺度(HAMD-17)の合計スコアの改善によって測定されるように、プラセボよりも優れていることが示されました( を参照)。 1 日 60 mg を超える用量で追加の効果が得られるという証拠はありません。
これらの臨床試験のすべてにおいて、治療結果と年齢、性別、および人種との関係の分析は、これらの患者の特性に基づいた差別的な反応を示唆していませんでした.
MDD-1 試験 CYMBALTA (60mg/日)b プラセボ 21.5 (4.10) 21.1 (3.71) -10.9 (0.70) -6.1 (0.69) -4.9 (-6.8, -2.9) --
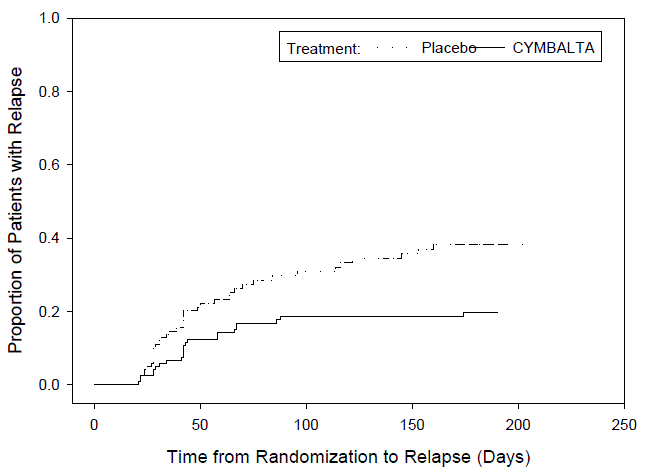
MDD-5 試験では、MDD の DSM-IV 基準を満たす 533 人の成人患者が、最初の 12 週間の非盲検治療段階で 1 日 1 回 CYMBALTA 60mg を投与されました。非盲検治療に反応した 278 人の患者 [10 週目と 12 週目で以下の基準を満たすと定義: HAMD-17 合計スコア ≤9、重症度の臨床全体印象 (CGI-S) ≤2、および[MDD の DSM-IV 基準を満たす] は、同じ用量で CYMBALTA を継続する群 (N=136) またはプラセボ (N=142) に無作為に割り付けられました。
MDD-5 試験では、CYMBALTA を投与された患者は、プラセボを投与された患者よりも統計的に有意に長いうつ病再発期間を経験しました( 図1 )。再発は、12 週目に得られた値と比較して CGI-S スコアが 2 ポイント以上増加し、少なくとも 2 週間間隔で 2 回連続して通院し、MDD の DSM-IV 基準を満たすこととして定義されました。一時的な基準は、2回目の訪問でのみ満たされなければなりませんでした。
図1:MDD再発成人患者の累積割合(MDD-5試験)
全般性不安障害
成人(高齢患者を含む)におけるGAD試験
全般性不安障害(GAD)の治療におけるCYMBALTA 20mgの有効性は、成人の外来患者を対象とした1件の固定用量無作為化二重盲検プラセボ対照試験および2件の可変用量無作為化二重盲検プラセボ対照試験で確立されました。 GADのDSM-IV基準を満たす18歳から83歳の間(それぞれGAD-1、GAD-2、およびGAD-3の研究)。
研究 GAD-1 および GAD-2 では、開始用量は 1 日 1 回 60 mg でした (忍容性の理由から、1 日 1 回 30 mg への減量が許可されました。用量は 1 日 1 回 60 mg に増やすことができました)。患者の 15% がダウン タイトレーションされました。研究 GAD-3 は、1 日 1 回 60 mg に増加する前に、1 週間 1 日 1 回 30 mg の開始用量がありました。
GAD-2 および GAD-3 の研究では、CYMBALTA の用量を 1 日 1 回 60 mg から 1 日 1 回 120 mg まで (N=168 および N=162)、プラセボ (N=159 および N=161) と 10 年間にわたって比較しました。週の治療期間。これらの試験のエンドポイントでの完了者の平均投与量は 104.8 mg/日でした。 GAD-1 試験では、9 週間の治療期間にわたって CYMBALTA 60mg を 1 日 1 回 60 mg (N=168) および 120 mg を 1 日 1 回 (N=170) 投与し、プラセボ (N=175) と比較して評価しました。 120 mg/日の用量で効果があることが示されていますが、60 mg/日を超える用量で追加の利益が得られるという証拠はありません.
つの試験すべてで、CYMBALTA は、ハミルトン不安尺度 (HAM-A) の合計スコアの大幅な改善 (参照) およびシーハン障害尺度 (SDS) の全体的な機能障害スコアによって測定されるように、プラセボに対する優位性を示しました。 SDS は、仕事/学校、社会生活/余暇活動、および家庭生活/家庭での責任という 3 つの生活領域で、情緒的症状が患者の機能を混乱させる程度を総合的に測定したものです。
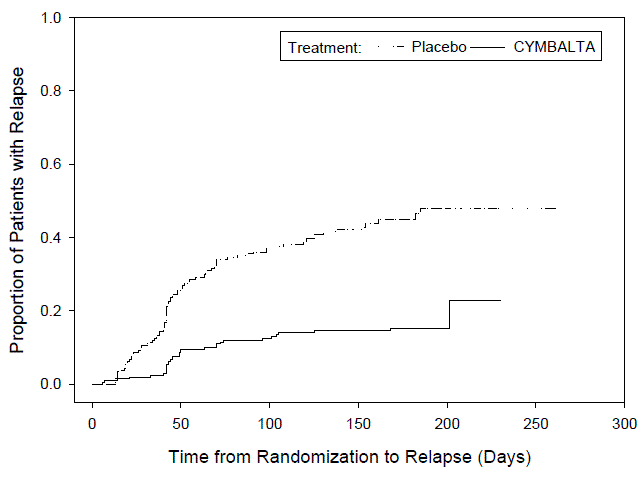
試験 GAD-4 では、GAD の DSM-IV-TR 基準を満たす 887 人の患者が、最初の 26 週間の非盲検治療段階で 1 日 1 回、CYMBALTA 60 mg から 120 mg を投与されました。非盲検治療に反応した 429 人の患者 [24 週目と 26 週目で次の基準を満たすと定義: ベースラインの HAM-A 合計スコアから少なくとも 50% 減少し、スコアが 11 以下になり、かつ改善の臨床全体印象(CGI改善)スコア1または2]は、同じ用量でCYMBALTA 30mgの継続(N = 216)またはプラセボ(N = 213)に無作為に割り当てられ、再発が観察されました。無作為化された患者の 73% は、少なくとも 10 週間レスポンダー状態でした。再発は、CGI-Severity スコアが少なくとも 2 ポイント増加してスコアが 4 以上になり、MINI (Mini-International Neuropsychiatric Interview) で GAD と診断された場合 (期間を除く)、または有効性の欠如による中止と定義されました。 CYMBALTA を服用している患者は、プラセボを服用している患者よりも、GAD の再発までの時間が統計的に有意に長くなりました。 図 2 )。
サブグループ分析では、年齢や性別による治療結果の違いは示されませんでした。
高齢患者におけるGAD試験
65 歳以上の GAD 患者の治療における CYMBALTA の有効性は、DSM-IV 基準を満たす 65 歳以上の成人を対象とした 10 週間の柔軟な用量、無作為化、二重盲検、プラセボ対照試験で確立されました。 GADの場合(GAD-5の研究)。試験 GAD-5 では、開始用量は 30 mg を 1 日 1 回 2 週間投与し、治療の 2、4、7 週目に 30 mg ずつ増量し、1 日 1 回 120 mg まで追加投与することが許可されました。忍容性。 10 週間の急性期治療を完了した患者の平均投与量は 51 mg でした。 CYMBALTA で治療された患者 (N=151) は、HAM-A 合計スコアで測定されるベースラインからエンドポイントまでの平均変化において、プラセボ (N=140) と比較して有意に大きな改善を示しました ( を参照)。
7歳から17歳の小児患者におけるGAD試験
歳から 17 歳の GAD の小児患者の治療における CYMBALTA の有効性は、GAD の小児科外来患者を対象とした 1 件の柔軟な用量のランダム化二重盲検プラセボ対照試験で確立されました (DSM-IV 基準に基づく) (研究GAD-6)。
試験 GAD-6 では、開始用量は 30 mg を 1 日 1 回 2 週間投与しました。臨床反応と忍容性の研究者の判断に基づいて、1 日 1 回 120 mg まで 30 mg 単位でさらに増量することが許可されました。 10 週間の治療段階を完了した患者の平均投与量は 57.6 mg/日でした。この研究では、CYMBALTA (N=135) は、ベースラインからエンドポイントまでプラセボ (N=137) よりも優れていることが示されました。
図 2:GAD 再発成人患者の累積割合(GAD-4 試験)
成人における糖尿病性末梢神経因性疼痛
成人の糖尿病性末梢神経障害に伴う神経障害性疼痛の管理に対するシンバルタ 30mg の有効性は、糖尿病性末梢神経障害性疼痛 (DPNP ) 少なくとも 6 か月間 (DPNP-1 試験および DPNP-2 試験)。これらの試験には合計 791 人の患者が登録され、そのうち 592 人 (75%) が試験を完了しました。登録された患者は、痛みを伴う遠位対称性感覚運動性多発ニューロパシーの診断が少なくとも 6 か月間ある I 型または II 型糖尿病を患っていました。患者は、0 (痛みなし) から 10 (考えられる最悪の痛み) の範囲の 11 点尺度でベースラインの痛みスコアが 4 以上でした。患者は、CYMBALTA に加えて、疼痛の必要に応じて、1 日あたり最大 4 グラムのアセトアミノフェンの摂取が許可されました。患者は毎日の痛みを日記に記録しました。
どちらの試験も、CYMBALTA 60 mg 1 日 1 回または 60 mg 1 日 2 回をプラセボと比較しました。 DPNP-1 試験ではさらに、CYMBALTA 20 mg とプラセボを比較しました。合計 457 人の患者(シンバルタ 342 人、プラセボ 115 人)が DPNP-1 試験に登録され、合計 334 人の患者(シンバルタ 226 人、プラセボ 108 人)が試験 DPNP-2 に登録されました。
CYMBALTA 60 mg を 1 日 1 ~ 2 回投与することで、エンドポイントの平均疼痛スコアがベースラインから統計的に有意に改善され、疼痛スコアがベースラインから少なくとも 50% 減少した患者の割合が増加しました。ベースラインから研究のエンドポイントまでのさまざまな程度の痛みの改善について、図 3 と 4 はそれぞれ研究 DPNP-1 と研究 DPNP-2 でその程度の改善を達成した患者の割合を示しています。数値は累積的であるため、ベースラインからの変化が 50% である患者も、50% 未満のすべての改善レベルに含まれます。試験を完了しなかった患者には、0% の改善が割り当てられました。何人かの患者は、早くも 1 週目に痛みの軽減を経験し、それは治験を通じて持続しました。
図 3: 24 時間平均疼痛強度で測定した、さまざまなレベルの疼痛緩和を達成した DPNP 成人患者の割合 (研究 DPNP-1)
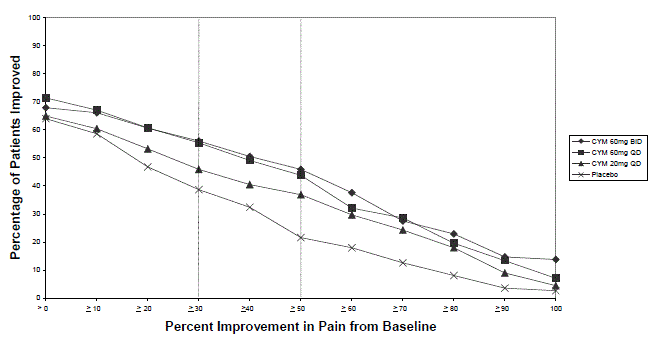
図 4: 24 時間平均疼痛強度で測定した、さまざまなレベルの疼痛緩和を達成した DPNP 成人患者の割合 (研究 DPNP-2)
線維筋痛症
線維筋痛症の成人試験
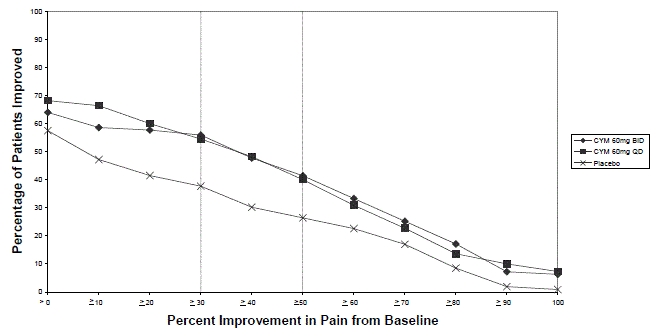
成人の線維筋痛症の管理に対する CYMBALTA の有効性は、米国リウマチ学会の線維筋痛症基準を満たす成人患者を対象とした 2 つのランダム化二重盲検プラセボ対照固定用量試験で確立されました、および18の特定の圧痛部位のうち11以上に存在する痛み)。研究 FM-1 は期間が 3 か月で、女性患者のみが登録されました。研究 FM-2 は 6 か月間行われ、男性と女性の患者が登録されました。参加者の約 25% が MDD の併存診断を受けていました。研究 FM1 および FM-2 には合計 874 人の患者が登録され、そのうち 541 人 (62%) が試験を完了しました。合計 354 人の患者(234 人のシンバルタ 40mg、120 人のプラセボ)が FM-1 試験に登録され、合計 520 人の患者(376 人のシンバルタ、144 人のプラセボ)が FM-2 試験に登録されました(男性 5%、女性 95%)。患者は、0 (痛みなし) から 10 (痛みが悪化する可能性がある) の範囲の 11 点尺度で 6.5 のベースライン痛みスコアを持っていました。
FM-1 試験と FM-2 試験では、CYMBALTA 60 mg を 1 日 1 回または 1 日 120 mg を投与した場合 (FM-1 試験では分割投与、FM-2 試験では 1 日 1 回投与) とプラセボを比較しました。 FM-2 試験では、さらに 6 か月の試験の最初の 3 か月間で CYMBALTA 20 mg とプラセボを比較しました。
CYMBALTA 60 mg または 120 mg による毎日の治療は、エンドポイントの平均疼痛スコアをベースラインから統計的に有意に改善し、疼痛スコアがベースラインから少なくとも 50% 減少した患者の割合を増加させました。 MDDを併発している患者と伴わない患者の両方で、疼痛の軽減が観察されました。ただし、MDD を併発している患者では、痛みの軽減の程度が大きくなる可能性があります。ベースラインから研究のエンドポイントまでのさまざまな程度の痛みの改善について、図 5 と 6 は、それぞれ研究 FM-1 と研究 FM-2 でその程度の改善を達成した患者の割合を示しています。ベースラインからの変化が例えば 50% である患者も 50% 未満のすべての改善レベルに含まれるように、数値は累積されます。試験を完了しなかった患者には、0% の改善が割り当てられました。何人かの患者は、早くも 1 週目に痛みの軽減を経験し、それは治験を通じて持続しました。改善は、機能の測定値 (線維筋痛影響アンケート) および患者の全体的な変化の印象 (PGI) にも示されました。どちらの試験も、60 mg と比較して 120 mg の利点を示しておらず、より高い用量は、より多くの有害反応と早期の治療中止と関連していました.
図 5: 24 時間平均疼痛重症度で測定した、研究エンドポイントでさまざまなレベルの疼痛緩和を達成した成人線維筋痛症患者の割合 (研究 FM-1)
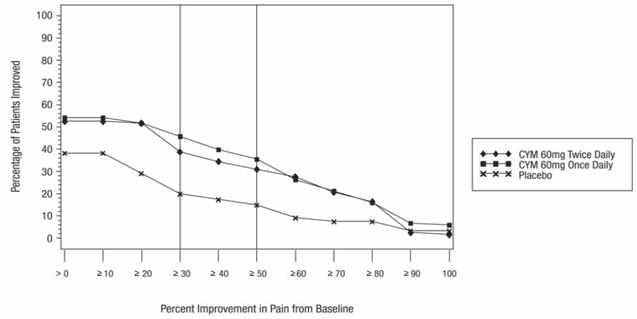
図 6: 24 時間平均疼痛重症度で測定した、研究エンドポイントでさまざまなレベルの疼痛緩和を達成した成人線維筋痛症患者の割合 (研究 FM-2)
さらに、CYMBALTA 60 mg/日での非反応者におけるアップタイトレーションの利点は、別の試験(FM-3 試験)で評価されました。成人患者は、非盲検で CYMBALTA 60 mg を 1 日 1 回 8 週間投与されました。その後、このフェーズの完了者は、CYMBALTA 60 mg 1 日 1 回または 120 mg 1 日 1 回の二重盲検治療に無作為に割り付けられました。レスポンダーは、8 週間の治療終了時にベースラインから少なくとも 30% の疼痛スコアの減少が見られた患者と定義されました。 8 週間で非応答者であった患者は、盲目的に CYMBALTA 60 mg を継続した患者と比較して、盲目的に CYMBALTA 120 mg に漸増した場合、治療の 60 週間の終わりに応答基準を満たす可能性は高くありませんでした。
線維筋痛症の小児試験
CYMBALTA は、13 週間のプラセボ対照試験 (Study FM-4) で、13 歳から 17 歳の若年性線維筋痛症候群の小児患者 184 人を対象に研究されました。 FM-4 試験では、149 例 (81%) の患者が試験を完了しました。 CYMBALTA (N=91) は、30 mg を 1 日 1 回 1 週間投与することから開始し、1 日 1 回 60 mg を 12 週間投与し、忍容性を確認しました。 12 週間の治療段階を完了した患者の平均投与量は 49 mg/日でした。 CYMBALTA は、主要評価項目 [Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24 時間平均疼痛重症度評価におけるベースラインから治療終了までの変化] でプラセボよりも 0.052 の p 値で改善を示しました。事前に指定された一次分析、およびさまざまな理由で試験を完了しなかった一部の患者の欠落した評価にベースライン値を割り当てた感度分析からの 0.011 ~ 0.020 の範囲の p 値。患者のベースライン BPI は 5.7 でした。ベースラインから研究のエンドポイントまでのさまざまな程度の痛みの改善について、図 7 は、研究 FM-4 でその程度の改善を達成した患者の割合を示しています。
図 7: 13 歳から 17 歳の若年性線維筋痛症症候群の小児患者の割合で、12 週目にさまざまなレベルの疼痛緩和を達成した (FM-4 試験)a
成人の慢性筋骨格痛
CYMBALTA は、成人の慢性筋骨格痛の治療を適応としています。これは、慢性腰痛および変形性関節症による慢性疼痛の成人患者を対象とした試験で確立されています。
成人の慢性腰痛の試験
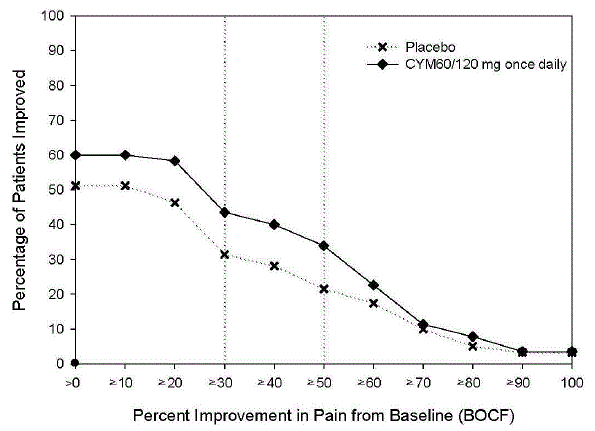
成人の慢性腰痛(CLBP)に対するシンバルタ 60mg の有効性は、13 週間の 2 つの二重盲検プラセボ対照ランダム化臨床試験(CLBP-1 および CLBP-2 試験)、および 12 試験のうちの 1 試験で評価されました。 - 週の期間 (CLBP-3)。 CLBP-1 および CLBP-3 試験では、CLBP の治療における CYMBALTA の有効性が実証されました。すべての試験の患者には、神経根障害または脊柱管狭窄症の兆候はありませんでした。
CLBP-1試験
236 人の成人患者 (CYMBALTA 40mg の N=115、プラセボの N=121) が登録され、182 人 (77%) が 13 週間の治療段階を完了しました。 7 週間の治療後、シンバルタ治療を受けた患者で、1 日あたりの平均疼痛の減少が 30% 未満で、1 日 1 回 60 mg に耐えることができた患者は、二重盲検法で 1 日 1 回 120 mg に増量された。トライアルの残り。患者は、0 (痛みなし) から 10 (考えられる最悪の痛み) までの範囲の数値評価スケールで 6 の平均ベースライン痛み評価を持っていました。 13 週間の治療後、CYMBALTA 60-120 mg を毎日服用している患者は、プラセボを服用している患者と比較して有意に大きな痛みの軽減を示しました。無作為化は、患者のベースライン NSAID 使用状況によって層別化されました。サブグループ分析では、NSAID の使用の関数として治療結果に違いがあることは示されませんでした。
CLBP-2試験
404 人の患者が無作為に割り付けられ、1 日あたり固定用量の CYMBALTA 60mg または対応するプラセボが投与されました (N=59 は CYMBALTA 20mg、N=116 は CYMBALTA 60mg、N=112 は CYMBALTA 120mg、N=117 はプラセボ) 267 人 (66%) が 13 週間の試験全体を完了しました。 13 週間の治療後、シンバルタ 30mg の 3 つの投与量のいずれも、プラセボと比較して統計的に有意な疼痛軽減の差を示しませんでした。
CLBP-3試験
401 人の患者が CYMBALTA 60 mg の固定用量を毎日またはプラセボを投与されるよう無作為に割り付けられ (N=198 は CYMBALTA 20mg で、N=203 はプラセボで)、303 人 (76%) が試験を完了しました。患者は、0 (痛みなし) から 10 (考えられる最悪の痛み) までの範囲の数値評価スケールで 6 の平均ベースライン痛み評価を持っていました。 12 週間の治療後、シンバルタ 60 mg を毎日服用している患者は、プラセボを服用している患者と比較して、有意に大きな痛みの軽減を示しました。
ベースラインから研究のエンドポイントまでのさまざまな程度の痛みの改善について、図 8 と 9 はそれぞれ、研究 CLBP-1 と CLBP-3 でその程度の改善を達成した患者の割合を示しています。数値は累積的であるため、ベースラインからの変化が 50% である患者も、50% 未満のすべての改善レベルに含まれます。試験を完了しなかった患者には、0% 改善の値が割り当てられました。
図 8: 24 時間平均疼痛強度で測定した、さまざまなレベルの疼痛緩和を達成した CLBP の成人患者の割合 (研究 CLBP-1)
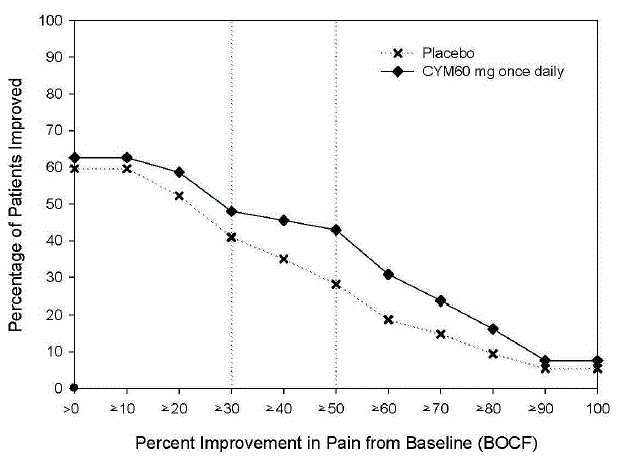
図 9: 24 時間平均疼痛強度で測定した、さまざまなレベルの疼痛緩和を達成した CLBP の成人患者の割合 (研究 CLBP-3)
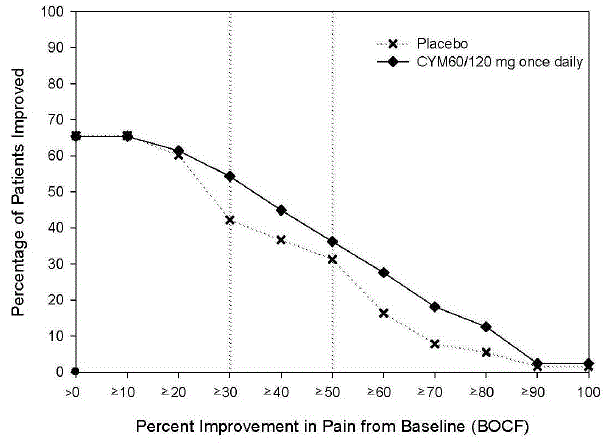
成人の変形性関節症による慢性疼痛の試験
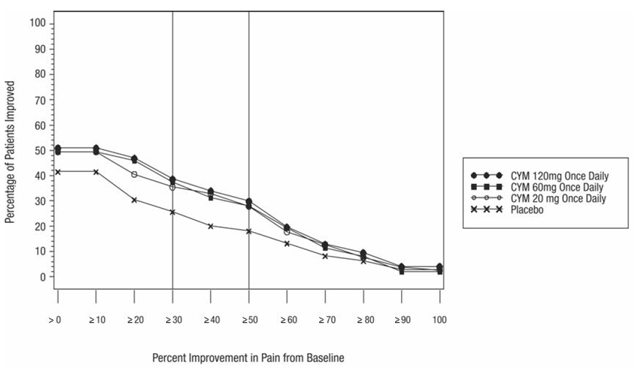
成人の変形性関節症(OA)による慢性疼痛に対するシンバルタの有効性は、13 週間にわたる 2 つの二重盲検プラセボ対照ランダム化臨床試験(OA-1 試験および OA-2 試験)で評価されました。両方の試験のすべての患者は、膝の特発性 OA の分類に関する ACR の臨床的基準および X 線検査基準を満たしていました。無作為化は、患者のベースライン NSAID 使用状況によって層別化されました。
CYMBALTA に割り当てられた患者は、両方の試験で 1 日 1 回 1 週間、30 mg の用量で治療を開始しました。最初の 1 週間後、CYMBALTA の用量は 1 日 1 回 60 mg に増量されました。 CYMBALTA 60 mg の 1 日 1 回投与による 7 週間の治療後、OA-1 試験では、治療に対する反応が最適ではなく (
研究OA-1
256 人の患者 (CYMBALTA 30mg の N=128、プラセボの N=128) が登録され、204 人 (80%) が試験を完了しました。患者は、0 (痛みなし) から 10 (考えられる最悪の痛み) までの範囲の数値評価スケールで 6 の平均ベースライン痛み評価を持っていました。 13週間の治療後、CYMBALTA 20mgを服用した患者は、プラセボを服用した患者よりも大幅に痛みが軽減されました.サブグループ分析では、NSAID の使用の関数として治療結果に違いがあることは示されませんでした。
研究OA-2
231 人の患者 (CYMBALTA 30mg の N=111、プラセボの N=120) が登録され、173 人 (75%) が試験を完了しました。患者は、0 (痛みなし) から 10 (考えられる最悪の痛み) までの範囲の数値評価スケールで 6 の平均ベースライン痛みを持っていました。 13週間の治療後、CYMBALTA 20mgを服用した患者は、プラセボを服用した患者よりも有意に大きな痛みの軽減を示しませんでした.
研究 OA-1 では、ベースラインから研究のエンドポイントまでのさまざまな程度の痛みの改善について、その程度の改善を達成した患者の割合を図 10 に示します。この数値は累積的であるため、たとえばベースラインからの変化が 50% である患者も、50% 未満の改善レベルごとに含まれます。試験を完了しなかった患者には、0% 改善の値が割り当てられました。
図 10: 24 時間平均疼痛強度で測定した、さまざまなレベルの疼痛緩和を達成した OA の成人患者の割合 (研究 OA-1)
患者情報
サインバルタ® [sim-BALL-tah] (デュロキセチン遅延放出カプセル)
Cymbalta® の服用を開始する前、および補充を受けるたびに、この投薬ガイドをお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
以下について医療提供者に相談してください。
- 抗うつ薬による治療のすべてのリスクと利点
- うつ病やその他の深刻な精神疾患に対するすべての治療法の選択肢
抗うつ薬、うつ病、その他の深刻な精神疾患、および自殺念慮や自殺行動について知っておくべき最も重要な情報は何ですか?
- 気分、行動、行動、思考、または感情の変化、特に突然の変化に細心の注意を払ってください。これは、抗うつ薬の服用を開始するとき、または用量を変更するときに非常に重要です。
- すぐに医療提供者に電話して、気分、行動、思考、または感情の新しい変化または突然の変化を報告してください。
- 医療提供者とのすべてのフォローアップ訪問は、予定どおりに行ってください。特に症状について懸念がある場合は、必要に応じて訪問の合間に医療提供者に電話してください。
以下の症状や気分がある場合、特にそれらが新しい、悪化している、または心配している場合は、すぐに医療提供者に連絡してください。緊急の場合は、911 に電話してください。
- 自殺しようとする
- 危険な衝動で行動する
- 攻撃的、怒っている、または暴力的である
- 自殺や死についての考え
- 新しいまたは悪化したうつ病
- 新しいまたは悪化した不安
- パニック発作
- 非常に動揺している、または落ち着きがない
- 新しいまたは悪化した過敏症
- 寝られない
- 活動や会話の極端な増加 (躁病)
- 行動や気分のその他の異常な変化
抗うつ薬について他に何を知る必要がありますか?
- 最初に医療提供者に相談することなく、抗うつ薬を中止しないでください。抗うつ薬を突然中止すると、他の症状を引き起こす可能性があります。
- 抗うつ薬は、うつ病やその他の病気の治療に使用される薬です。うつ病を治療するリスクと、治療しないリスクについて話し合うことが重要です。患者は、抗うつ薬の使用だけでなく、すべての治療法について医療提供者と話し合う必要があります。
- 抗うつ薬には他の副作用があります。あなたやあなたの家族のために処方された薬の副作用について、かかりつけの医療提供者に相談してください。
- 抗うつ薬は他の薬と相互作用することがあります。あなたやあなたの家族が服用しているすべての薬を知っておいてください。すべての医薬品のリストを保管して、医療提供者に提示してください。最初に医療提供者に確認することなく、新しい薬を開始しないでください。
サインバルタ60mgとは?
サインバルタは、大うつ病性障害 (MDD) と呼ばれる特定の種類のうつ病の治療に使用される処方薬です。サインバルタ 20mg は、SNRI (オルセロトニン-ノルエピネフリン再取り込み阻害薬) として知られる医薬品のクラスに属します。
サインバルタ 60mg は、以下の治療または管理にも使用されます。
- 全般性不安障害(GAD)
- 糖尿病性末梢神経障害性疼痛 (DPNP)
- 線維筋痛症(FM)
- 慢性筋骨格痛
サインバルタを服用してはいけない人
次の場合は、サインバルタ 20mg を服用しないでください。
- モノアミンオキシダーゼ阻害剤(MAOI)を服用してください。 抗生物質リネゾリドまたは静脈内メチレンブルーを含むMAOIを服用しているかどうかがわからない場合は、医療提供者または薬剤師に相談してください.
- 医療提供者からの指示がない限り、サインバルタを中止してから 5 日以内に MAOI を服用しないでください。
- 過去 14 日間に MAOI の服用を中止した場合は、医療提供者の指示がない限り、サインバルタを開始しないでください。
サインバルタ 60mg を MAOI に近い時期に服用する人は、セロトニン症候群と呼ばれる深刻な問題を抱えている可能性があります (「サインバルタ 60mg の副作用の可能性は?」を参照)。
サインバルタを服用する前に、医療提供者に何を伝えるべきですか?
Cymbalta を開始する前に、次の場合は医療提供者に伝えてください。
- 心臓の問題や高血圧がある
- 糖尿病を患っている(Cymbalta 40mgの治療により、糖尿病患者の血糖コントロールが難しくなります)
- 肝臓に問題がある
- 腎臓に問題がある
- 緑内障がある
- 発作またはけいれんがある、またはあった
- 双極性障害または躁病がある
- 血液中のナトリウム濃度が低い
- 胃が空になるのが遅れている
- 出血の問題がある、またはあった
- 妊娠している、または妊娠する予定がある。サインバルタは胎児に害を及ぼす可能性があります。妊娠中にサインバルタを服用した場合の胎児へのリスクについて、医療提供者に相談してください。
- サインバルタによる治療中に妊娠した場合、または妊娠していると思われる場合は、すぐに医療提供者に伝えてください。
- サインバルタ 30mg を服用中に妊娠した場合は、サインバルタ妊娠登録簿への登録について医療提供者に相談してください。 1-866-8146975 に電話するか、www.cymbalta 40mgpregnancyregistry.com にアクセスして登録できます。このレジストリの目的は、妊娠中の任意の時点でサインバルタによる治療を受けた女性の妊娠転帰を監視することです。
- 授乳中または授乳を計画している。サインバルタは母乳に移行し、赤ちゃんに害を及ぼす可能性があります。サインバルタを服用している間、赤ちゃんに食事を与える最善の方法については、かかりつけの医療提供者に相談してください。
あなたが服用しているすべての薬について医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。サインバルタと一部の医薬品は、相互作用を起こしたり、効果がなかったり、深刻な副作用を引き起こす可能性があります。
特に以下を服用している場合は、医療提供者に伝えてください。
- 片頭痛の治療に使用されるトリプタン
- 三環系薬剤、リチウム、ブスピロン、SSRI、SNRI または MAOI を含む、気分、不安、精神病または思考障害の治療に使用される医薬品
- トラマドールとフェンタニル
- アンフェタミン
- シメチジン
- 抗生物質シプロフロキサシン、エノキサシン
- 不規則な心拍数を治療するための薬(プロパフェノン、フレカイニド、キニジンなど)
- テオフィリン
- 抗凝血剤ワルファリン(Coumadin、Jantoven)
- 非ステロイド性抗炎症薬 (NSAID) (イブプロフェン、ナプロキセン、アスピリンなど)。
- トリプトファンやセントジョーンズワートなどの市販のサプリメント
- チオリダジン(メラリル)。メラリルをサインバルタと一緒に使用すると、深刻な心拍リズムの問題や突然死を引き起こす可能性があります.
よくわからない場合は、医療提供者にこれらの医薬品のリストを依頼してください。
デュロキセチンを含む他の薬と一緒に Cymbalta を服用しないでください。
サインバルタ 60mg の服用方法は?
- サインバルタは、担当の医療提供者が指示した通りに服用してください。あなたの医療提供者は、あなたにとって適切な用量になるまで、Cymbalta 20mgの用量を変更する必要があるかもしれません.
- サインバルタを丸ごと飲み込む。サインバルタを噛んだりつぶしたりしないでください。
- カプセルを開けて食品にかけたり、液体と混ぜたりしないでください。カプセルを開けると、サインバルタの効能に影響を与える可能性があります。
- サインバルタは食事の有無にかかわらず服用できます。
- サインバルタ 30mg を飲み忘れた場合は、気がついたらすぐに服用してください。次の服用時間が迫っている場合は、飲み忘れた分を飛ばして、次の通常の時間に服用してください。サインバルタ 30mg を同時に 2 回服用しないでください。
- サインバルタを過剰に服用した場合は、すぐに医療提供者または毒物管理センター (1800-222-1222) に電話するか、緊急治療を受けてください。
- 別の抗うつ薬からサインバルタに切り替える場合、医療提供者は、副作用を潜在的に回避するために、最初の抗うつ薬の用量を最初に減らすことを希望する場合があります.
サインバルタを服用している間、何を避けるべきですか?
- サインバルタは眠気を引き起こしたり、意思決定、明晰な思考、素早い反応に影響を与える可能性があります。サインバルタがどのように影響するかを知るまでは、運転したり、重機を操作したり、その他の危険な活動を行ったりしないでください.
- 大量のアルコール摂取を伴うサインバルタの使用は、重度の肝臓損傷に関連している可能性があります。サインバルタを服用している間は、大量のアルコールの使用を避けてください。
サインバルタの副作用の可能性は?
サインバルタ 30mg は、次のような重大な副作用を引き起こす可能性があります。「サインバルタについて知っておくべき最も重要な情報は何ですか?」を参照してください。
サインバルタ 20mg を服用している人々に起こりうる一般的な副作用は次のとおりです。
男性の症状には次のようなものがあります。
女性の症状には次のようなものがあります。
性機能に何らかの変化が生じた場合、または CYMBALTA による治療中に性的問題について質問や懸念がある場合は、医療提供者に相談してください。医療提供者が提案できる治療法があるかもしれません。
- かゆみ
- 右上腹部の痛み
- 暗い尿
- 黄色い肌や目
- 肥大した肝臓
- 肝臓酵素の増加
- 血圧を上げる。
- 立っていると血圧が下がり、めまいや失神を引き起こします。これは主に、サインバルタを最初に開始するとき、または用量を増やすときに発生します。
- 特に高齢者では、転倒のリスクが高まります。
- 興奮、幻覚、昏睡またはその他の精神状態の変化
- 調整の問題または筋肉のけいれん (過活動反射)
- レーシングハートビート、高血圧または低血圧
- 発汗または発熱
- 吐き気、嘔吐、または下痢
- 筋肉のこわばり
- めまい
- フラッシング
- 身震い
- 発作
- 不安
- 過敏性
- 疲労感や睡眠障害
- 頭痛
- 発汗
- めまい
- 電撃のような感覚
- 嘔吐または吐き気
- 下痢
- 大幅に増加したエネルギー
- 重度の睡眠障害
- レーシング思考
- 無謀な行動
- 異常に壮大なアイデア
- 過度の幸福または過敏症
- いつもより多くまたは速く話す
これらの問題の危険にさらされているのは、一部の人々だけです。目の検査を受けて、危険にさらされているかどうかを確認し、危険にさらされている場合は予防治療を受けることをお勧めします。
- 眼の痛み
- 視覚の変化
- 目の中または周りの腫れまたは赤み
- 頭痛
- 脱力感または不安定感
- 混乱、集中または思考の問題、または記憶の問題
- 尿の流れの減少
- 尿を渡すことができない
- 射精が遅い、または射精できない
- 性欲減退
- 勃起の獲得または維持の問題
- 性欲減退
- オーガズムの遅延またはオーガズムを持てない
サインバルタ 20mg の最も一般的な副作用は次のとおりです。
- 吐き気
- 口渇
- 眠気
- 倦怠感
- 便秘
- 食欲減少
- 発汗の増加
- めまい
サインバルタ 20mg を服用している小児および青年によく見られる副作用には、次のようなものがあります。
- 吐き気
- 減量
- めまい
大人の副作用は、サインバルタを服用している子供や青年にも発生する可能性があります.小児および青年は、治療中は身長と体重を監視する必要があります。
気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。
これらは、サインバルタの考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。副作用は 1800-FDA-1088 に報告できます。
サインバルタ 40mg の保管方法を教えてください。
Cymbalta は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
サインバルタとすべての医薬品は、子供の手の届かないところに保管してください。
サインバルタの安全で効果的な使用に関する一般的な情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態でサインバルタを使用しないでください。他の人があなたと同じ症状を持っていても、サインバルタ 20mg を与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、サインバルタに関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療従事者向けに書かれた Cymbalta に関する情報については、医療提供者または薬剤師に尋ねることができます。
詳細については、1-800-545-5979 までお電話ください。
サインバルタ30mgの成分は?
有効成分:デュロキセチン塩酸塩
不活性成分:
FD&C ブルー No. 2、ゼラチン、ヒプロメロース、ヒドロキシプロピル メチルセルロース アセテート サクシネート、ラウリル硫酸ナトリウム、スクロース、砂糖球、タルク、二酸化チタン、およびクエン酸トリエチル。 20mg と 60mg のカプセルには酸化鉄イエローも含まれています。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
