Paxil 10mg, 20mg, 30mg, 40mg Paroxetine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
パキシルとは何ですか?
パキシル 20mg は、うつ病、強迫性障害 (OCD)、パニック障害、社会恐怖症、全般性不安障害、心的外傷後ストレス障害 (PTSD)、および月経前不快気分障害 (PMDD) の症状を治療するために使用される処方薬です。パキシルは、単独で使用することも、他の薬と併用することもできます。
- パキシル 40 mg は、抗うつ薬、SSRI と呼ばれる種類の薬に属します。
- パキシルが子供に安全で効果があるかどうかはわかっていません。
パキシル30mgの副作用は?
パキシル 10mg は、次のような重大な副作用を引き起こす可能性があります。
- レーシング思考、
- 睡眠の必要性が減り、
- 異常なリスクを取る行動、
- 極度の幸福感や悲しみ、
- いつもよりおしゃべりで、
- ぼやけた視界、
- 視野狭窄、
- 目の痛みや腫れ、
- ライトの周りにハローが見える
- 異常な骨の痛みや圧痛、腫れやあざ、
- 体重の変化、
- 食欲の変化、
- あざができやすい、
- 鼻、口、膣、または直腸からの異常な出血、
- 喀血、
- 非常に硬直した、または硬直した筋肉、
- 高熱、
- 発汗、
- 錯乱、
- 速いまたは不均一な心拍、
- 震え、
- 失神、
- 頭痛、
- 錯乱、
- ろれつが回らない、
- 重度の衰弱、
- 調整の喪失、および
- 不安定な感じ
上記の症状がある場合は、すぐに医療機関を受診してください。
パキシル 30mg の最も一般的な副作用は次のとおりです。
- 視界の変化、
- 弱点、
- 眠気、
- めまい、
- 疲れ、
- 発汗、
- 不安、
- 揺れ、
- 睡眠障害(不眠症)、
- 食欲減少、
- 吐き気、
- 嘔吐、
- 下痢、
- 便秘、
- 口渇、
- 感染、
- 頭痛、
- 性欲減退、
- インポテンツ、
- 異常射精、そして
- オーガズムを持つのが難しい
自殺傾向と抗うつ薬
抗うつ薬は、大うつ病性障害(MDD)およびその他の精神障害の短期研究において、小児、青年、および若年成人の自殺念慮および自殺行動(自殺傾向)のリスクをプラセボと比較して増加させました。子供、青年、若年成人にPAXIL 40mgまたはその他の抗うつ薬の使用を検討している人は、このリスクと臨床上の必要性とのバランスを取る必要があります.短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65歳以上の成人では、プラセボと比較して抗うつ薬のリスクが低下しました.うつ病やその他の特定の精神障害は、それ自体が自殺のリスクの増加と関連しています。抗うつ薬治療を開始したすべての年齢の患者は、臨床的悪化、自殺傾向、または行動の異常な変化について適切に監視し、注意深く観察する必要があります。家族や介護者は、処方者との綿密な観察とコミュニケーションの必要性を知らされるべきです。 PAXIL 30mg は、小児患者への使用は承認されていません。 (警告: 臨床的悪化と自殺のリスク、患者情報、および注意事項: 小児への使用を参照してください。)
説明
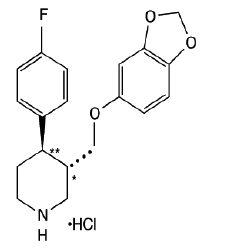
PAXIL(パロキセチン塩酸塩)は経口投与の向精神薬です。これは、(-)-トランス-4R-(4'フルオロフェニル)-3S-[(3',4'-メチレンジオキシフェノキシ)メチル]ピペリジン塩酸塩半水和物として化学的に識別されるフェニルピペリジン化合物の塩酸塩であり、 C19H20FNO3•HCl•½H2O の実験式を持っています。分子量は 374.8 (遊離塩基として 329.4) です。パロキセチン塩酸塩の構造式は次のとおりです。
パロキセチン塩酸塩は無臭のオフホワイトの粉末で、融点範囲は 120° ~ 138°C、水への溶解度は 5.4 mg/mL です。
各フィルムコーティング錠には、次のようにパロキセチンと同等のパロキセチン塩酸塩が含まれています。 20 mg-ピンク (スコア); 30mg-青、40mg-緑。不活性成分は、二塩基性リン酸カルシウム二水和物、ヒプロメロース、ステアリン酸マグネシウム、ポリエチレングリコール、ポリソルベート 80、デンプングリコール酸ナトリウム、二酸化チタン、および次の 1 つ以上で構成されます: D&C レッド No. 30 アルミニウムレーキ、D&C イエロー No. 10 アルミニウムレーキ、FD&C ブルー No. 2 アルミレーキ、FD&C イエロー No. 6 アルミレーキ。
経口投与用懸濁液
オレンジ色のオレンジ風味の液体5mLあたり、パロキセチンに相当するパロキセチン塩酸塩が10mg含まれています。不活性成分は、ポラクリリン カリウム、微晶質セルロース、プロピレン グリコール、グリセリン、ソルビトール、メチルパラベン、プロピルパラベン、クエン酸ナトリウム二水和物、無水クエン酸、サッカリン ナトリウム、香料、FD&C イエロー No. 6 アルミニウム レーキ、シメチコン エマルジョン、USP で構成されています。
適応症
PAXIL 20mg は、以下の治療のために成人に適応されます。
- 大うつ病性障害(MDD)
- 強迫性障害(OCD)
- パニック障害(PD)
- 社交不安障害(SAD)
- 全般性不安障害(GAD)
- 心的外傷後ストレス障害 (PTSD)
投薬と管理
管理情報
食事の有無にかかわらず、朝に 1 日 1 回の用量でパキシルを投与します。
投与前に経口懸濁液をよく振ってください。
MDD、OCD、PD、および PTSD の推奨用量
MDD、OCD、PD、およびPTSDの患者におけるPAXIL 20mgの推奨開始用量と最大用量を表1に示します。
反応が不十分な患者では、忍容性に応じて、少なくとも 1 週間の間隔で 1 日あたり 10 mg ずつ増量してください。
SADおよびGADの推奨用量
悲しい
SAD患者の開始および推奨用量は、1日20mgです。臨床試験では、PAXIL 30 mg の有効性が、1 日 20 mg から 60 mg の範囲で投与された患者で実証されました。 PAXIL の安全性は、SAD 患者で 1 日最大 60 mg の用量で評価されていますが、入手可能な情報では、1 日 20 mg を超える用量で追加の利点は示唆されていません [ 臨床研究 ]。
ガッド
GAD患者の開始および推奨用量は、1日20mgです。臨床試験では、GADにおけるPAXIL 10mgの有効性が、毎日20mgから50mgの範囲で投与された患者で実証されました. 1 日 20 mg を超える用量でより大きな利益が得られることを示唆する十分な証拠はありません [ 臨床研究 ]。
反応が不十分な患者では、忍容性に応じて、少なくとも 1 週間の間隔で 1 日あたり 10 mg ずつ増量してください。
PAXIL 開始前の双極性障害のスクリーニング
PAXIL 10mgまたは他の抗うつ薬による治療を開始する前に、双極性障害、躁病、または軽躁病の個人歴または家族歴について患者をスクリーニングします[ 警告と注意事項 ]。
高齢患者、重度の腎障害のある患者、および重度の肝障害のある患者の推奨用量
高齢者、重度の腎障害のある患者、重度の肝障害のある患者では、1 日 10 mg から開始することをお勧めします。投与量は 40 mg/日を超えてはなりません。
モノアミンオキシダーゼ阻害剤 (MAOI) への、またはその逆の患者の切り替え
モノアミンオキシダーゼ阻害剤(MAOI)の中止から PAXIL の開始までの間に少なくとも 14 日が経過している必要があります。 禁忌 、 警告と注意事項 ]。
パキシルによる治療の中止
PAXIL の中止時に有害反応が起こることがある [参照 警告と注意事項 ]。可能であれば、PAXIL を突然中止するのではなく、徐々に投与量を減らしてください。
供給方法
剤形と強度
パキシル錠 次のように利用できます。
- 10 mg の黄色の錠剤で、表に「PAXIL」、裏に「10」と刻印されています。
- 20 mg ピンク色、表に「PAXIL」、裏に「20」と刻印されたスコア付き錠剤。
- 30mgの青色の錠剤で、表に「PAXIL」、裏に「30」と刻印されています。
- 40mgの緑色の錠剤で、表に「PAXIL」、裏に「40」と刻印されています。
パキシル20mg経口懸濁剤 次のように使用できます。
- 10 mg/5 mL のオレンジ色のオレンジ色の懸濁液で、250 mL のボトルに入っています。
保管と取り扱い
パキシル(パロキセチン)錠 楕円形の錠剤は、次のように提供されます。
錠剤は 15° ~ 30°C (59° ~ 86°F) で保管してください。
パキシル(パロキセチン)経口懸濁液 次のように提供されます。
懸濁液は 25°C (77°F) 以下で保管してください
製造元: Apotex Inc.、トロント、オンタリオ、カナダ M9L 1T9。改訂: 2021 年 2 月
副作用
以下の副作用については、処方情報の他のセクションに詳しく記載されています。
- パロキセチンに対する過敏反応 [参照 禁忌 ]
- 自殺念慮および自殺行動 [参照 警告と注意事項 ]
- セロトニン症候群 [参照 警告と注意事項 ]
- 胎児および新生児毒性 [参照 警告と注意事項 ]
- 出血のリスクの増加 [参照 警告と注意事項 ]
- 躁病/軽躁病の活性化 [参照] 警告と注意事項 ]
- 中断症候群 [参照 警告と注意事項 ]
- 発作 [参照 警告と注意事項 ]
- 閉塞隅角緑内障 [参照 警告と注意事項 ]
- 低ナトリウム血症 [参照 警告と注意事項 ]
- 骨折 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
PAXIL の安全性データは次のとおりです。
- パキシル 20 mg から 50 mg を 1 日 1 回投与された MDD 患者を対象とした 6 週間の臨床試験
- パキシル 20 mg から 60 mg を 1 日 1 回投与された OCD 患者を対象とした 12 週間の臨床試験
- PAXIL 10 mg ~ 60 mg を 1 日 1 回投与された PD 患者を対象とした 10 ~ 12 週間の臨床試験
- PAXIL 20 mg から 50 mg を 1 日 1 回投与された SAD 患者を対象とした 12 週間の臨床試験
- PAXIL 10 mg から 50 mg を 1 日 1 回投与された GAD 患者を対象とした 8 週間の臨床試験
- PAXIL 20 mg から 50 mg を 1 日 1 回投与された PTSD 患者を対象とした 12 週間の臨床試験
中止につながる有害反応
MDD の臨床試験で PAXIL で治療された患者の 20% (1,199/6,145)、および 16.1% (84/522)、11.8% (64/542)、9.4% (44/469)、10.7% (79/735)、 SAD、OCD、PD、GAD、およびPTSDの臨床試験でPAXILで治療された患者のそれぞれ11.7%(79/676)が、副作用のために治療を中止しました。中止に関連する最も一般的な副作用 (≥1%) (すなわち、プラセボと比較して、PAXIL 10mg で約 2 倍以上の割合でドロップアウトに関連する有害反応) を表 3 に示します。
最も一般的な有害反応
PAXIL の使用に関連して最も一般的に観察された副作用 (発生率 5% 以上、少なくともプラセボの 2 倍) は次のとおりです。
MDD
無力症、発汗、吐き気、食欲減退、傾眠、めまい、不眠症、振戦、神経過敏、射精障害、その他の男性生殖器障害。
OCD
吐き気、口渇、食欲減退、便秘、めまい、傾眠、振戦、発汗、インポテンツ、異常射精。
PD
無力症、発汗、食欲減退、性欲減退、振戦、異常射精、女性性器障害、インポテンス
悲しい
発汗、吐き気、口渇、便秘、食欲不振、傾眠、振戦、性欲減退、あくび、異常射精、女性生殖器障害、インポテンス
ガッド
無力症、感染症、便秘、食欲減退、口渇、吐き気、性欲減退、傾眠、振戦、発汗、異常射精。
PTSD
無力症、発汗、吐き気、口渇、下痢、食欲減退、傾眠、性欲減退、異常射精、女性性器障害、インポテンス
MDD患者の有害反応
表 4 は、PAXIL で治療された MDD 患者の臨床試験において、プラセボよりも高い 1% 以上の発生率で発生した有害反応を示しています。
OCD、PD、および SAD 患者の有害反応
表 5 は、OCD、PD、および SAD 患者の臨床試験で 2% 以上の頻度で発生した副作用を示しています。
GAD および PTSD 患者における有害反応
表 6 は、GAD および PTSD 患者の臨床試験で 2% 以上の頻度で発生した副作用を示しています。
用量依存性の有害反応
MDD
表 7 に示すように、MDD の治療において PAXIL10 mg、20 mg、30 mg、および 40 mg を 1 日 1 回プラセボと比較した固定用量研究における副作用率の比較により、用量依存性の副作用が明らかになりました。
OCD
OCD の治療においてプラセボと PAXIL 20 mg、40 mg、および 60 mg を比較した固定用量の研究では、副作用と患者が割り当てられた PAXIL 30 mg の用量との間に明確な関係はありませんでした。
PD
PD の治療において、プラセボと PAXIL 10 mg、20 mg、および 40 mg を比較した固定用量の研究では、次の有害反応が用量依存的であることが示されました。異常射精。
悲しい
SAD の治療においてプラセボと PAXIL 20 mg、40 mg、および 60 mg を比較した固定用量の研究では、ほとんどの副作用について、副作用と患者が割り当てられた PAXIL 10 mg の用量との間に明確な関係はありませんでした。 .
ガッド
GAD の治療においてプラセボと PAXIL 20 mg および 40 mg を比較した固定用量の研究では、以下の有害反応が用量依存的であることが示されました: 無力症、便秘、および異常な射精。
PTSD
PTSD の治療においてプラセボと PAXIL 20 mg および 40 mg を比較した固定用量の研究では、以下の有害反応が用量依存的であることが示されました: インポテンスおよび異常射精。
男性と女性の性機能障害
性的欲求、性的パフォーマンス、および性的満足の変化は、精神障害の徴候としてしばしば発生しますが、SSRI 治療の結果である可能性もあります。しかし、性的欲求、パフォーマンス、および満足を含む不快な経験の発生率と重症度の信頼できる推定値を取得することは困難です。したがって、ラベリングで引用された不快な性的経験とパフォーマンスの発生率の推定値は、実際の発生率を過小評価する可能性があります。
MDD、OCD、PD、SAD、GAD、および PTSD を有する男性および女性の性機能障害の症状を報告している患者の割合を表 8 に示します。
PAXIL 20mg 治療は、持続勃起症のいくつかの症例と関連しています。転帰がわかっている場合、患者は後遺症なく回復しました。
幻覚
PAXILのプールされた臨床試験では、プラセボを受けた患者の0.1%と比較して、PAXIL治療を受けた患者の0.2%で幻覚が観察されました.
あまり一般的でない有害反応
以下の副作用は、PAXIL の臨床試験中に発生したものであり、ラベルには含まれていません。
有害反応は身体のシステムによって分類され、次の定義に従って頻度の高い順にリストされています。まれな有害反応は、1/100 から 1/1,000 の患者に発生するものです。まれな副作用とは、患者の 1/1,000 未満で発生するものです。
体全体
まれ:アレルギー反応、悪寒、顔面浮腫、倦怠感、首の痛み。まれ:アドレナリン症候群、蜂窩織炎、モニリア症、頸部硬直、骨盤痛、腹膜炎、敗血症、潰瘍。
心臓血管系
頻繁:高血圧、頻脈。まれ:徐脈、血腫、低血圧、片頭痛、姿勢性低血圧、失神。まれ:狭心症、結節性不整脈、心房細動、脚ブロック、脳虚血、脳血管障害、うっ血性心不全、心ブロック、低心拍出量、心筋梗塞、心筋虚血、蒼白、静脈炎、肺塞栓症、上室性期外収縮、血栓性静脈炎、血栓症、静脈瘤、血管性頭痛、心室性期外収縮。
消化器系
まれ:歯ぎしり、大腸炎、嚥下障害、おくび、胃炎、胃腸炎、歯肉炎、舌炎、唾液分泌の増加、異常な肝機能検査、直腸出血、潰瘍性口内炎。まれ:アフタ性口内炎、血性下痢、過食症、心痙攣、胆石症、十二指腸炎、腸炎、食道炎、宿便、便失禁、歯茎出血、吐血、肝炎、回腸炎、イレウス、腸閉塞、黄疸、下血、口内潰瘍、消化性潰瘍、唾液腺肥大、唾液腺炎、胃潰瘍、口内炎、舌の変色、舌浮腫、虫歯。
内分泌系
まれ:真性糖尿病、甲状腺腫、甲状腺機能亢進症、甲状腺機能低下症、甲状腺炎。
血液とリンパ系
まれ: 貧血、白血球減少症、リンパ節腫脹、紫斑;まれ:異常な赤血球、好塩基球増加症、出血時間の増加、好酸球増加症、低色素性貧血、鉄欠乏性貧血、白血球増加症、リンパ浮腫、異常なリンパ球、リンパ球増加症、小球性貧血、単球症、正球性貧血、血小板血症、血小板減少症。
代謝と栄養
頻繁: 体重増加;まれ:浮腫、末梢性浮腫、SGOTの増加、SGPTの増加、喉の渇き、体重減少。まれ:アルカリホスファターゼ増加、ビリルビン血症、BUN増加、クレアチニンホスホキナーゼ増加、脱水、ガンマグロブリン増加、痛風、高カルシウム血症、高コレステロール血症、高血糖、高カリウム血症、高リン血症、低カルシウム血症、低血糖、低カリウム血症、低ナトリウム血症、ケトーシス、乳酸脱水素酵素増加、非タンパク窒素(NPN)が増加しました。
筋骨格系
頻繁: 関節痛;まれ: 関節炎、関節症;稀:滑液包炎、筋炎、骨粗鬆症、全身痙攣、腱鞘炎、テタニー。
神経系
頻繁:情緒不安定、めまい。まれ:異常な思考、アルコール乱用、運動失調、ジストニア、ジスキネジア、多幸感、敵意、筋緊張亢進、感覚鈍麻、運動機能低下、協調運動失調、感情の欠如、リビドーの増加、躁反応、神経症、麻痺、妄想反応。まれ:異常歩行、無動症、反社会的反応、失語症、舞踏病アテトーシス、口周囲の感覚異常、痙攣、せん妄、妄想、複視、薬物依存、構音障害、錐体外路症候群、筋束性痙攣、大発作、痛覚過敏、ヒステリー、躁うつ病反応、髄膜炎、脊髄炎、神経痛、神経障害、眼振、末梢神経炎、精神病性うつ病、精神病、反射低下、反射亢進、昏迷、斜頸、開口障害、離脱症候群。
呼吸器系
まれ:喘息、気管支炎、呼吸困難、鼻出血、過換気、肺炎、呼吸器インフルエンザ。まれ:肺気腫、喀血、しゃっくり、肺線維症、肺水腫、痰の増加、喘鳴、声の変化。
皮膚と付属物
頻繁: そう痒;まれ:にきび、脱毛症、接触性皮膚炎、乾燥肌、斑状出血、湿疹、単純ヘルペス、光線過敏症、蕁麻疹。まれ:血管性浮腫、結節性紅斑、多形紅斑、剥脱性皮膚炎、真菌性皮膚炎、フルンクローシス。帯状疱疹、多毛症、斑状丘疹発疹、脂漏症、皮膚変色、皮膚肥大、皮膚潰瘍、発汗減少、水疱性発疹。
特別な感覚
頻繁: 耳鳴り;まれ:調節の異常、結膜炎、耳の痛み、目の痛み、角結膜炎、散瞳、中耳炎;まれ:弱視、不同視、眼瞼炎、白内障、結膜浮腫、角膜潰瘍、難聴、眼球突出、眼内出血、緑内障、聴覚過敏、夜盲症、外耳炎、知覚異常、羞明、眼瞼下垂、網膜出血、味覚喪失、視野欠損。
泌尿生殖器系
まれ:無月経、乳房痛、膀胱炎、排尿障害、血尿、月経過多、夜間頻尿、多尿、膿尿、尿失禁、尿閉、尿意切迫、膣炎。まれ:流産、乳房萎縮、乳房肥大、子宮内膜症、精巣上体炎、女性の授乳、乳房線維嚢胞、腎臓結石、腎臓痛、白帯下、乳腺炎、子宮出血、腎炎、乏尿、卵管炎、尿道炎、尿円柱、子宮けいれん、尿石、膣出血、膣モニリア症。
市販後の経験
以下の反応は、PAXIL の承認後の使用中に確認されています。これらの反応は未知の規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
急性膵炎、肝機能検査値の上昇(最も深刻なケースは、肝壊死による死亡、および重度の肝機能障害に関連するトランスアミナーゼの大幅な上昇)、ギラン・バレー症候群、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、不適切なADH分泌症候群、プロラクチン血症および乳汁漏出症;アカシジア、運動緩慢、歯車の硬直、ピモジドの併用に関連する眼科学的危機を含む錐体外路症状;てんかん重積症、急性腎不全、肺高血圧症、アレルギー性肺胞炎、アナフィラキシー、子癇、喉頭炎、視神経炎、ポルフィリン症、むずむず脚症候群(RLS)、心室細動、心室頻拍(トルサード・ド・ポアントを含む)、溶血性貧血、障害に関連する事象造血(再生不良性貧血、汎血球減少症、骨髄形成不全、無顆粒球症を含む)、血管炎症候群(ヘノッホ・シェーンライン紫斑病など)、および妊婦の早産。パキシル 20mg を慢性的なメトプロロール治療に追加した場合、重度の低血圧の症例報告がありました。
薬物相互作用
表 9 は、PAXIL との臨床的に重要な薬物相互作用を示しています。
警告
の一部として含まれています "予防" セクション
予防
青少年と若年成人の自殺念慮と自殺行動
約 77,000 人の成人患者と 4,500 人の小児患者を含む抗うつ薬 (SSRI およびその他の抗うつ薬クラス) のプラセボ対照試験のプール分析では、24 歳以下の抗うつ薬治療患者における自殺念慮および行動の発生率は、プラセボ治療を受けた患者。薬物間で自殺念慮および自殺行動のリスクにかなりのばらつきがありましたが、研究されたほとんどの薬物について、若い患者で特定されたリスクの増加がありました。自殺念慮および自殺行動の絶対リスクには適応症ごとに違いがあり、MDD患者で最も高い発生率でした。治療を受けた患者 1000 人あたりの自殺念慮および自殺行動の症例数における薬物とプラセボの差を表 2 に示します。
PAXIL 30mg は、小児患者への使用は承認されていません。
小児、青年、および若年成人における自殺念慮および自殺行動のリスクが、長期使用、つまり 4 か月を超える使用に及ぶかどうかは不明です。しかし、抗うつ薬がうつ病の再発を遅らせ、うつ病自体が自殺念慮や自殺行動の危険因子であるという、MDDの成人におけるプラセボ対照維持試験からの実質的な証拠があります。
特に薬物療法の最初の数ヶ月間、および投薬量の変更時に、臨床的悪化および自殺念慮および自殺行動の出現の徴候について、抗うつ薬で治療されているすべての患者を監視します。行動の変化を監視し、医療提供者に警告するように、患者の家族または介護者に相談してください。うつ病が持続的に悪化している患者、または緊急の自殺念慮または行動を経験している患者では、場合によっては PAXIL の中止を含め、治療レジメンの変更を検討してください。
セロトニン症候群
PAXIL を含む SSRI は、生命を脅かす可能性のある状態であるセロトニン症候群を引き起こす可能性があります。リスクは、他のセロトニン作動薬(トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミン、セントジョンズワートなど)や、セロトニンの代謝を損なう薬、すなわち MAOI との併用によって増加します。 禁忌 、 薬物相互作用 ]。セロトニン症候群は、これらの薬を単独で使用した場合にも発生する可能性があります。
セロトニン症候群の症状には、精神状態の変化(興奮、幻覚、せん妄、昏睡など)、自律神経不安定性(頻脈、血圧変動、めまい、発汗、紅潮、高体温など)、神経筋症状(振戦、硬直、ミオクローヌス、反射亢進、協調運動失調)、発作、および/または胃腸症状 (例えば、吐き気、嘔吐、下痢)。
PAXIL と MAOI の併用は禁忌です。さらに、リネゾリドまたは静脈内メチレン ブルーなどの MAOI で治療されている患者に PAXIL 30mg を開始しないでください。他の経路 (経口錠剤や局所組織注射など) または低用量でのメチレン ブルーの投与に関する報告はありません。 PAXIL 10mg を服用している患者にリネゾリドや静脈内メチレン ブルーなどの MAOI による治療を開始する必要がある場合は、MAOI による治療を開始する前に PAXIL 40mg を中止してください。 禁忌 、 薬物相互作用 ]。
セロトニン症候群の出現について、PAXIL 20mgを服用しているすべての患者を監視してください。上記の症状が発生した場合は、PAXIL 20mg および併用するセロトニン作動薬による治療を直ちに中止し、支持対症療法を開始してください。 PAXIL と他のセロトニン作動薬との併用が臨床的に正当化される場合は、セロトニン症候群のリスクが高いことを患者に知らせ、症状を監視してください。
QT延長につながる薬物相互作用
パロキセチンの CYP2D6 阻害特性は、チオリダジンとピモジドの血漿レベルを上昇させる可能性があります。チオリダジンとピモジドを単独で投与すると QTc 間隔が延長され、重篤な心室性不整脈のリスクが高まるため、PAXIL 40mg をチオリダジンとピモジドと組み合わせて使用することは禁忌です。 禁忌 、 薬物相互作用 、 臨床薬理学 ]。
胚胎児および新生児毒性
パキシルを妊婦に投与すると、胎児に害を及ぼす可能性があります。疫学的研究は、妊娠の最初の三半期にパロキセチンにさらされた乳児が心血管奇形のリスクが高いことを示しています.妊娠後期にパロキセチンに曝露すると、新生児の持続性肺高血圧症(PPNH)および/または長期入院、呼吸補助、および経管栄養を必要とする新生児合併症のリスクが増加する可能性があります。
妊娠中に PAXIL 20mg を使用する場合、または患者が PAXIL 30mg を服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきである [参照 特定の集団での使用 ]。
出血のリスクの増加
パキシル 40mg などのセロトニン再取り込み阻害を阻害する薬剤は、出血イベントのリスクを高めます。アスピリン、非ステロイド性抗炎症薬 (NSAIDS)、その他の抗血小板薬、ワルファリン、およびその他の抗凝固薬の併用は、このリスクを高める可能性があります。症例報告と疫学的研究 (症例対照とコホート デザイン) は、セロトニンの再取り込みを妨げる薬物の使用と消化管出血の発生との関連を示しています。セロトニンの再取り込みを妨げる薬物に関連する出血イベントは、斑状出血、血腫、鼻出血、および点状出血から生命を脅かす出血にまで及びます。
PAXIL 20mg と抗血小板薬または抗凝固薬の併用に伴う出血リスクの増加について、患者に知らせてください。ワルファリンを服用している患者については、国際正規化比を注意深く監視してください。
マニアまたは軽躁の活性化
双極性障害の患者では、パキシル 30mg または別の抗うつ薬で抑うつエピソードを治療すると、混合/躁病エピソードが引き起こされる可能性があります。 PAXILの対照臨床試験中、軽躁病または躁病は、アクティブコントロールの1.1%およびプラセボ治療の単極性患者の0.3%と比較して、PAXIL治療の単極性患者の約1%で発生しました。 PAXIL 20mg による治療を開始する前に、双極性障害、躁病、または軽躁病の個人歴または家族歴について患者をスクリーニングします。
中断症候群
セロトニン作動性抗うつ薬の中止後、特に突然の中止後の有害反応には、吐き気、発汗、不快気分、過敏性、動揺、めまい、感覚障害(例:感電などの感覚異常)、振戦、不安、錯乱、頭痛、無気力、情緒不安定、不眠症、軽躁病、耳鳴り、発作。可能な限り、急激な中止ではなく、徐々に投与量を減らすことが推奨されます。 投薬と管理 ]。
GAD および PTSD の臨床試験では、治療を中止する前に、1 日あたり 10 mg/日を 1 週間間隔で徐々に減らし、その後 20 mg/日を 1 週間使用しました。以下の有害反応は、PAXIL 20mg で 2% 以上の発生率で報告されており、プラセボで報告された場合の少なくとも 2 倍でした。小児患者における PAXIL の安全性と有効性は確立されていません [ 囲み警告 、 青少年と若年成人の自殺念慮と自殺行動 、 特定の集団での使用 ]。
発作
PAXIL 10mg 錠剤および経口懸濁液は、発作性疾患の患者で体系的に評価されていません。発作の既往のある患者は、臨床研究から除外されました。臨床研究中、PAXIL で治療された患者の 0.1% で発作が発生しました。 PAXIL は、発作性疾患の患者には慎重に処方する必要があります。発作を起こした患者では、PAXIL 30mg を中止してください。
閉塞隅角緑内障
PAXIL を含む多くの抗うつ薬の使用後に発生する瞳孔散大は、開存虹彩切除術を持たない解剖学的に狭い隅角を持つ患者で隅角閉鎖発作を引き起こす可能性があります。 PAXIL 40mgの使用に伴う閉塞隅角緑内障の症例が報告されています。未治療の解剖学的に狭角の患者では、PAXIL を含む抗うつ薬の使用を避けてください。
低ナトリウム血症
低ナトリウム血症は、PAXIL を含む SSRI による治療の結果として発生する可能性があります。血清ナトリウムが 110 mmol/L 未満の症例が報告されています。低ナトリウム血症の兆候と症状には、頭痛、集中力の低下、記憶障害、錯乱、脱力感、ふらつきなどがあり、転倒につながる可能性があります。より重症および/または急性の症例に関連する徴候および症状には、幻覚、失神、発作、昏睡、呼吸停止、および死亡が含まれます。多くの場合、この低ナトリウム血症は、不適切な抗利尿ホルモン分泌症候群 (SIADH) の結果であると思われます。
症候性低ナトリウム血症の患者では、PAXIL を中止し、適切な医療介入を開始してください。高齢患者、利尿薬を服用している患者、および体液量が枯渇している患者は、SSRI で低ナトリウム血症を発症するリスクが高くなる可能性があります [参照 特定の集団での使用 ]。
タモキシフェンの有効性の低下
パロキセチンによる CYP2D6 の不可逆的な阻害とタモキシフェンの血中濃度の低下の結果として、乳癌の再発/死亡のリスクによって測定されるタモキシフェンの有効性は、PAXIL の併用によって低下する可能性があることがいくつかの研究で示されています [ 薬物相互作用 ]。ある研究では、併用期間が長くなるとリスクが高まる可能性があることが示唆されています。しかし、他の研究ではそのようなリスクを証明できていません。乳がんの治療または予防にタモキシフェンを使用する場合、処方者は CYP2D6 阻害がほとんどまたはまったくない代替抗うつ薬の使用を検討する必要があります。
骨折
SSRI を含むいくつかの抗うつ薬への暴露中の骨折リスクに関する疫学的研究では、抗うつ薬治療と骨折との関連が報告されています。この観察結果には複数の原因が考えられますが、SSRI 治療に直接起因する骨折のリスクがどの程度かは不明です。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
自殺念慮と行動
患者と介護者に、特に治療中の初期および投与量を増減したときに自殺傾向の出現を探すように助言し、そのような症状を医療提供者に報告するように指示する[参照 囲み警告 と 警告と注意事項 ]。
セロトニン症候群
特にトリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミン、セントジョーンズワートなどの他のセロトニン作動薬、およびセロトニン(特にMAOI、精神障害の治療を目的としたものと、リネゾリドなどの他のもの)。セロトニン症候群の徴候または症状を経験した場合は、医療提供者に連絡するか、緊急治療室に報告するように患者に指示します[参照 警告と注意事項 、 薬物相互作用 ]。
併用薬
薬物相互作用の可能性があるため、処方薬または市販薬を服用している、または服用する予定がある場合は、医師に知らせるよう患者に助言する[参照 警告と注意事項 、 薬物相互作用 ]。
出血のリスクの増加
パキシルとアスピリン、NSAID、その他の抗血小板薬、ワルファリン、またはその他の抗凝固薬との併用について患者に知らせる。出血のリスクを高める処方薬または市販薬を服用している、または服用する予定がある場合は、医療提供者に知らせるよう患者に助言する[参照 警告と注意事項 ]。
アクティベーション オブ マニア/ハイポマニア
患者とその介護者に、躁病/軽躁病の活性化の兆候を観察するようにアドバイスし、そのような症状を医療提供者に報告するように指示します[参照 警告と注意事項 ]。
中断症候群
PAXIL 40mg を突然中止しないように患者に助言し、漸減レジメンについては医療提供者と話し合うようにしてください。 PAXIL の使用を中止すると副作用が発生する可能性があることを患者に知らせる [ 警告と注意事項 ]。
経口懸濁液の投与情報
投与前に経口懸濁液をよく振るように患者に指示する[参照 投薬と管理 ]。
アレルギー反応
発疹、蕁麻疹、腫れ、または呼吸困難などのアレルギー反応を発症した場合は、医療提供者に通知するよう患者に助言します[参照 有害反応 ]。
胚・胎児毒性
胎児への潜在的なリスクについて女性に助言する [参照 警告と注意事項 、 特定の集団での使用 ]。胎児へのリスクがあるため、治療中に妊娠した場合、または妊娠する予定がある場合は、医療提供者に通知するよう患者に助言してください。
看護
乳児に母乳を与えている場合は、医療提供者に通知するよう女性にアドバイスします [参照 特定の集団での使用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
パロキセチンを 1、5、および 25 mg/kg/日 (マウス) および 1、5、および 20 mg/kg/日 (ラット) で与えられたげっ歯類で、2 年間の発がん性試験が実施されました。これらの用量は、mg/m2 ベースで 75 mg の MRHD の最大 2.0 (マウス) および 3.2 (ラット) 倍です。高用量群では、網状細胞肉腫を有する雄ラットの数が有意に多かった(対照群、低用量群、中用量群、および高用量群では、1/100、0/50、0/50、および 4/50)。 、それぞれ)および雄ラットにおけるリンパ網状腫瘍の発生について、用量群全体で有意に増加した線形傾向。雌ラットは影響を受けなかった。マウスの腫瘍数には用量に関連した増加がありましたが、腫瘍を有するマウスの数に薬剤に関連した増加はありませんでした。これらの発見と人間との関連性は不明です。

突然変異誘発
パロキセチンは、以下を含む 5 つの in vitro および 2 つの in vivo アッセイのバッテリーで遺伝毒性影響を生じませんでした: 細菌突然変異アッセイ、マウスリンパ腫突然変異アッセイ、不定期 DNA 合成アッセイ、および in vivo でのマウス骨髄および in vitro での細胞遺伝学的異常に関する試験ヒトリンパ球およびラットの優性致死試験で。
生殖能力の障害
いくつかの臨床研究では、SSRI(パロキセチンを含む)がSSRI治療中に精子の質に影響を与える可能性があり、一部の男性の生殖能力に影響を与える可能性があることが示されています.
妊娠率の低下は、15 mg/kg/日のパロキセチンの用量でのラットの生殖研究で発見されました。これは、mg/m2 ベースで 75 mg の MRHD の 2.4 倍です。毒性試験で 2~52 週間投与した後、雄ラットの生殖管に不可逆的な病変が生じた。これらの病変は、50 mg/kg/日での精巣上体尿細管上皮の空胞化、および 25 mg/kg/日での精子形成の停止を伴う精巣の精細管の萎縮変化から成っていた (1 mg/kg で 75 mg の MRHD の 8.2 倍および 4.1 倍)。 m2ベース)。
特定の集団での使用
妊娠
妊娠カテゴリーD [参照 警告と注意事項 ]
疫学研究では、妊娠初期にパロキセチンにさらされた乳児は、先天性奇形、特に心血管奇形のリスクが高いことが示されています。妊娠中にパロキセチンを使用する場合、または患者がパロキセチンを服用中に妊娠した場合は、胎児への潜在的な危険性について患者に助言してください。
臨床上の考慮事項
母親に対するパロキセチンの利点が治療の継続を正当化する場合を除き、パロキセチン療法を中止するか、別の抗うつ薬に切り替えることを検討する必要があります。 警告と注意事項 ]。為に
- スウェーデンの国家登録データに基づく研究では、妊娠中にパロキセチンにさらされた乳児 (n = 815) は、登録母集団全体 (1% のリスク) と比較して、心血管奇形のリスクが高い (パロキセチンにさらされた乳児では 2% のリスク) ことが示されました。オッズ比 (OR) 1.8 (95% 信頼区間 1.1 ~ 2.8)。パロキセチンにさらされた乳児では、全体的な先天性奇形のリスクの増加は見られませんでした。パロキセチンに暴露された乳児の心奇形は、主に心室中隔欠損症 (VSD) と心房中隔欠損症 (ASD) でした。中隔欠損症の重症度は、自然に解消するものから手術が必要なものまでさまざまです。
- 米国からの別のレトロスペクティブ コホート研究 (United Healthcare データ) では、妊娠初期に抗うつ薬を投与された母親から生まれた 5,956 人の乳児が評価されました (パロキセチンについては n = 815)。この研究では、OR 1.5 (95% 信頼区間 0.8 ~ 2.9) で、他の抗うつ薬 (リスク 1%) と比較して、パロキセチン (リスク 1.5%) の心血管奇形のリスクが増加する傾向が示されました。パロキセチンにさらされた心血管奇形のある乳児12人のうち、9人がVSDを持っていました。この研究では、他の抗うつ薬 (リスク 2%) と比較して、パロキセチン (リスク 4%) の場合、心血管障害を含む全体的な主要な先天性奇形のリスクが高いことも示唆されました (OR 1.8; 95% 信頼区間 1.2 ~ 2.8)。
- 個別のデータベースを使用した 2 つの大規模な症例対照研究では、それぞれ 9,000 人を超える先天異常症例と 4,000 人を超える対照が含まれており、妊娠初期に母体がパロキセチンを使用すると、右心室流出のリスクが 2 倍から 3 倍増加することがわかりました。道の障害。ある研究では、OR は 2.5 (95% 信頼区間、1.0 ~ 6.0、曝露した乳児 7 人) で、別の研究では、OR は 3.3 (95% 信頼区間、1.3 ~ 8.8、曝露した乳児 6 人) でした。
他の研究では、全体的、心血管系、または特定の先天性奇形のリスクが増加したかどうかについて、さまざまな結果が見つかりました。妊娠および先天性奇形における妊娠初期のパロキセチンの使用に関する 16 年間 (1992 年から 2008 年) にわたる疫学的データのメタ分析には、他の研究に加えて上記の研究が含まれていた (全体的な奇形を含む n = 17 の研究および n =心血管奇形を含む 14 の研究; n = 20 の別個の研究)。制限はありますが、このメタアナリシスは、パロキセチンによる心血管奇形 (有病率オッズ比 [POR] 1.5; 95% 信頼区間 1.2 ~ 1.9) および全体的な奇形 (POR 1.2; 95% 信頼区間 1.1 ~ 1.4) の発生の増加を示唆しました。最初の学期中に使用します。このメタアナリシスでは、観察された心血管奇形の有病率が全体的な奇形の有病率にどの程度寄与したかを判断することはできませんでした。また、特定のタイプの心血管奇形が観察された有病率に寄与したかどうかを判断することもできませんでしたすべての心血管奇形の。
母親に対するパロキセチンの利点が治療の継続を正当化する場合を除き、パロキセチン療法を中止するか、別の抗うつ薬に切り替えることを検討する必要があります。 警告と注意事項 ]。妊娠を希望している女性、または妊娠の最初の三半期にある女性の場合、パロキセチンは、他の利用可能な治療オプションを考慮した後にのみ開始する必要があります[を参照してください。 警告と注意事項 ]。
妊娠後期における妊婦の治療
SSRIまたはパキシル40mgを含むセロトニンおよびノルエピネフリン再取り込み阻害薬(SNRI)にさらされた新生児は、妊娠第3期後半に、長期の入院、呼吸補助、および経管栄養を必要とする合併症を発症しました。このような合併症は、出産直後に発生する可能性があります。報告された臨床所見には、呼吸困難、チアノーゼ、無呼吸、発作、体温の不安定性、摂食困難、嘔吐、低血糖、筋緊張低下、筋緊張亢進、反射亢進、振戦、神経質、過敏症、絶え間ない泣き声が含まれます。これらの特徴は、SSRI と SNRI の直接的な毒性効果、またはおそらく薬物中止症候群のいずれかと一致しています。場合によっては、臨床像がセロトニン症候群と一致することに注意する必要があります。 警告と注意事項 ]。
妊娠後期に SSRI にさらされると、新生児の持続性肺高血圧症 (PPHN) のリスクが高くなる可能性があります。 PPHN は、一般人口の出生 1,000 人あたり 1 ~ 2 人で発生し、実質的な新生児の罹患率と死亡率に関連しています。乳児がPPHNで生まれた377人の女性と乳児が健康に生まれた836人の女性を対象としたレトロスペクティブな症例対照研究では、PPHNを発症するリスクは、妊娠20週以降にSSRIにさらされた乳児の場合、乳児と比較して約6倍高かった妊娠中に抗うつ薬にさらされていなかった人。
パロキセチンまたは他の SSRI にさらされた妊婦の早産の市販後の報告もあります。
妊娠後期に妊娠中の女性をパロキセチンで治療する場合、医師は治療の潜在的なリスクと利点の両方を慎重に検討する必要があります。大うつ病の病歴があり、妊娠初期には胸腺が正常だった 201 人の女性の前向き縦断研究。妊娠中に抗うつ薬を中止した女性は、抗うつ薬を服用し続けた女性よりも大うつ病の再発を経験する可能性が高かった.
動物の所見
生殖研究は、ラットでは 50 mg/kg/日まで、ウサギでは器官形成中に投与された 6 mg/kg/日までの用量で実施された。これらの用量は、mg/m2 ベースでヒトの最大推奨用量 (MRHD – 75 mg) の約 6 倍 (ラット) および 2 倍未満 (ウサギ) です。これらの研究は、発達への影響の証拠を明らかにしていません。しかし、ラットでは、妊娠の最後の三半期に投与が行われ、授乳期間中継続された場合、授乳の最初の 4 日間で子犬の死亡が増加しました。この効果は、mg/m2 に基づく MRHD よりも多い 1 mg/kg/日の用量で発生しました。仔ラットの死亡率に対する無影響用量は決定されなかった。これらの死因はわかっていません。
授乳中の母親
他の多くの薬物と同様に、パロキセチンは母乳に分泌されます。授乳中の乳児にパキシル 20mg が重篤な副作用を引き起こす可能性があるため、母親にとっての薬剤の重要性を考慮して、授乳中の乳児を中止するか、薬剤を中止するかを決定する必要があります。
小児用
小児患者における PAXIL の安全性と有効性は確立されていません [ ボックス警告 ]。 PAXIL 治療を受けた MDD の小児患者 752 人を対象とした 3 つのプラセボ対照試験では、有効性は示されませんでした。
抗うつ薬は、小児患者の自殺念慮および自殺行動のリスクを高める [参照 囲み警告 、 警告と注意事項 ]。 SSRIの使用に関連して、食欲減退および体重減少が観察されています。
小児患者を対象に実施されたプラセボ対照臨床試験では、以下の副作用が PAXIL で治療された小児患者の少なくとも 2% で報告され、プラセボを受けた小児患者の 2 倍以上の割合で発生しました。 、自殺念慮、自殺未遂、泣く、気分の変動など)、敵意、食欲減退、振戦、発汗、多動症、興奮。
患者の少なくとも 2% でプラセボの少なくとも 2 倍の割合で発生した漸減期レジメンを含む小児臨床試験で PAXIL による治療を中止した際の有害反応は、次のとおりでした。試み、気分の変化、涙)、神経過敏、めまい、吐き気、腹痛などがあります。
高齢者の使用
PAXIL 10mg の市販前臨床試験では、PAXIL で治療された患者の 17% (約 700 人) が 65 歳以上でした。薬物動態研究では、高齢者におけるクリアランスの減少が明らかになり、より低い開始用量が推奨されました;しかし、高齢者と若年患者の間で安全性または有効性の全体的な違いは観察されませんでした[参照 投薬と管理 、 臨床薬理学 ]。
PAXIL を含む SSRI は、高齢患者における臨床的に重大な低ナトリウム血症の症例と関連しており、この有害反応のリスクがより高い可能性がある [参照 警告と注意事項 ]。
腎および肝障害
パロキセチンの血漿濃度の上昇は、腎障害および肝障害のある患者で発生します。重度の腎機能障害のある患者および重度の肝機能障害のある患者では、PAXIL の初回投与量を減らす必要があります。 投薬と管理 、 臨床薬理学 ]。
過剰摂取
人間の経験
米国でPAXIL 30mgが導入されて以来、パロキセチン治療中の意図的または偶発的な過剰摂取の自発的な症例が世界中で報告されています.これらには、パロキセチン単独および他の物質との組み合わせによる過剰摂取が含まれます。パロキセチン単独での死亡例が報告されています。
パロキセチンの過剰摂取に関連してよく報告されている副作用には、傾眠、昏睡、吐き気、振戦、頻脈、錯乱、嘔吐、めまいなどがあります。パロキセチン(単独または他の物質と一緒に)を含む過剰摂取で観察されるその他の注目すべき徴候および症状には、散瞳、痙攣(てんかん重積症を含む)、心室律動障害(トルサード・ド・ポワントを含む)、高血圧、攻撃的反応、失神、低血圧、昏迷、徐脈、ジストニアが含まれる、横紋筋融解症、肝機能障害の症状(肝不全、肝壊死、黄疸、肝炎、脂肪肝を含む)、セロトニン症候群、躁反応、ミオクローヌス、急性腎不全、尿閉。
過剰摂取管理
PAXIL に対する特定の解毒剤は知られていません。過剰摂取が発生した場合は、毒物管理センター (1-800-222-1222) に電話して、最新の推奨事項を確認してください。
禁忌
パキシルは以下の患者には禁忌です:
- セロトニン症候群のリスクが高まるため、MAOI(MAOIであるリネゾリドおよび静脈内メチレンブルーを含む)を服用中、または中止してから14日以内[ 警告と注意事項 、 薬物相互作用 ]。
- QT延長のリスクがあるためチオリダジンを服用する[参照 警告と注意事項 と 薬物相互作用 ]
- QT延長のリスクがあるためピモジドを服用する[参照 警告と注意事項 、 薬物相互作用 ]。
- パロキセチンまたはPAXILのいずれかの不活性成分に対する既知の過敏症(例、アナフィラキシー、血管性浮腫、スティーブンス・ジョンソン症候群)を有する[ 有害反応 ]。
臨床薬理学
作用機序
MDD、SAD、OCD\、PD、GAD、および PTSD の治療における PAXIL の作用機序は不明ですが、セロトニンのニューロン再取り込みの阻害に起因する中枢神経系のセロトニン活性の増強に関連していると推定されています。 (5-ヒドロキシトリプタミン、5-HT)。
薬力学
ヒトにおける臨床的に適切な用量での研究は、パロキセチンがセロトニンのヒト血小板への取り込みをブロックすることを実証しました。動物での in vitro 研究はまた、パロキセチンがニューロンのセロトニン再取り込み (SSRI) の強力で高度に選択的な阻害剤であり、ノルエピネフリンとドーパミンのニューロンの再取り込みには非常に弱い影響しか与えないことを示唆しています。
薬物動態
PAXILの用量が増加するにつれて、薬物動態の非線形性が観察されます。
20 mg/日から 40 mg/日までの複数回投与後に健康なボランティアで行われた 4 つの研究からのパロキセチンのメタ分析では、男性は女性よりも有意に低い Cmax または AUC を示さなかった.
吸収
パロキセチン塩酸塩は、塩酸塩溶液の経口投与後に完全に吸収されます。正常な男性被験者 (n = 15) が毎日 30 mg の錠剤を 30 日間投与された研究では、ほとんどの被験者で約 10 日で定常状態のパロキセチン濃度が達成されましたが、まれな患者ではかなり長くかかる場合があります。定常状態では、Cmax、Tmax、Cmin、および T½ の平均値は 61.7 ng/mL (CV 45%)、5.2 時間でした。 (CV 10%)、30.7 ng/mL (CV 67%)、および 21.0 時間 (CV 32%)、それぞれ。定常状態の Cmax 値と Cmin 値は、単回投与試験から予測される値の約 6 倍と 14 倍でした。 AUC0-24 に基づく定常状態の薬物曝露は、これらの被験者の単回投与データから予測されるよりも約 8 倍大きかった。過剰な蓄積は、パロキセチンを代謝する酵素の 1 つが容易に飽和するという事実の結果です。
パロキセチンは、経口懸濁液と錠剤から等しく生物学的に利用可能です。
食事の影響
パロキセチンのバイオアベイラビリティに対する食物の影響は、食物の有無にかかわらず単回投与された被験者で研究されました。薬物を食事とともに投与した場合、AUC はわずかに (6%) しか増加しませんでしたが、Cmax は 29% 大きくなり、ピーク血漿濃度に達するまでの時間は投与後 6.4 時間から 4.9 時間に短縮されました。
分布
パロキセチンは CNS を含む全身に分布し、血漿中には 1% しか残りません。
パロキセチンの約 95% および 93% は、それぞれ 100 ng/mL および 400 ng/mL で血漿タンパク質に結合します。臨床条件下では、パロキセチン濃度は通常 400 ng/mL 未満です。パロキセチンは、フェニトインまたはワルファリンの in vitro タンパク質結合を変化させません。
排除
代謝
平均消失半減期は、30 日間の PAXIL の 30 mg 錠剤の毎日の経口投与後、約 21 時間 (CV 32%) です。
高齢者と非高齢者の患者を対象とした定常状態の用量比例研究では、高齢者には 1 日 20 mg から 40 mg、非高齢者には 1 日 20 mg から 50 mg の用量で、両方の集団である程度の非線形性が観察され、これも飽和代謝経路を反映しています。 . 1 日 20 mg の Cmin 値と比較して、1 日 40 mg の Cmin 値は、2 倍の約 2 ~ 3 倍に過ぎませんでした。
パロキセチンは、経口投与後に広範囲に代謝されます。主な代謝物は、酸化とメチル化の極性生成物と共役生成物であり、容易に除去されます。グルクロン酸および硫酸塩との結合体が優勢であり、主要な代謝物が分離および同定されています。データは、代謝物がセロトニン取り込みの阻害において親化合物の効力の 1/50 以下であることを示しています。パロキセチンの代謝は、CYP2D6 によって部分的に達成されます。臨床用量でのこの酵素の飽和は、用量の増加と治療期間の延長に伴うパロキセチン動態の非線形性を説明しているようです。パロキセチン代謝におけるこの酵素の役割は、薬物間相互作用の可能性も示唆している[参照 薬物相互作用 ]。パロキセチンの薬物動態学的挙動は、CYP2D6 が欠損している被験者 (代謝不良者) では評価されていません。
排泄
パロキセチンの 30 mg 経口溶液投与量の約 64% が尿中に排泄され、2% が親化合物として、62% が代謝物として 10 日間の投与後期間にわたって排泄されました。約 36% が (おそらく胆汁を介して) 糞便中に排泄され、ほとんどが代謝物として排泄され、親化合物として 10 日間の投与後期間で 1% 未満が排泄されました。
薬物相互作用研究
パロキセチンと他の薬物との間には、臨床的に重要な既知の薬物相互作用があります [参照 薬物相互作用 ]。
図 1. 同時投与された薬物の薬物動態に対するパロキセチンの影響 (ログ スケール)
図 2. パロキセチンの薬物動態に対する同時投与薬物の影響
テオフィリン
PAXIL 治療に関連するテオフィリン レベルの上昇の報告が報告されています。この相互作用は正式に研究されていませんが、これらの薬物を同時に投与する場合は、テオフィリン レベルを監視することをお勧めします。
シトクロム CYP3A4 によって代謝される薬物
パロキセチンと CYP3A4 の基質であるテルフェナジンの定常状態での同時投与を含む in vivo 相互作用研究では、テルフェナジンの薬物動態に対するパロキセチンの影響がないことが明らかになりました。さらに、in vitro 研究では、CYP3A4 活性の強力な阻害剤であるケトコナゾールが、テルフェナジン、アステミゾール、シサプリド、トリアゾラム、およびシクロスポリン。パロキセチンによる CYP3A4 活性の阻害の程度は、臨床的に重要であるとは予想されません。
特定の集団
パロキセチンの薬物動態に対する特定の集団の影響を図 3 に示します。
高齢患者、重度の腎障害のある患者、および重度の肝障害のある患者では、PAXIL の推奨される開始用量および最大用量が減量されます。 投薬と管理 ]。
図 3. パロキセチンの薬物動態に対する特定の集団の影響 (ログ スケール)
臨床研究
大鬱病性障害
大うつ病性障害 (MDD) の治療薬としての PAXIL の有効性は、MDD 患者 (18 歳から 73 歳) を対象とした 6 つのプラセボ対照試験で確立されています。これらの研究では、PAXIL は、MDD の治療において、ハミルトンうつ病評価尺度 (HDRS)、ハミルトン抑うつ気分項目、および臨床全体印象 (CGI) の少なくとも 2 つによって、プラセボよりも統計的に有意に有効であることが示されました。病気の重症度。 PAXIL は、抑うつ気分項目、睡眠障害因子、および不安因子を含む HDRS 副因子スコアの改善において、統計的にプラセボよりも有意に優れていました。
外来患者の MDD の治療に対する PAXIL 10mg の長期有効性は、無作為化離脱試験で実証されました。最初の 8 週間の非盲検治療段階で PAXIL (HDRS 合計スコア
強迫性障害
強迫性障害 (OCD) の治療における PAXIL の有効性は、成人の外来患者を対象とした 2 つの 12 週間の多施設プラセボ対照研究 (研究 1 および 2) で実証されました。患者は、中等度から重度の OCD (DSM-IIIR) を有し、Yale Brown Obsessive Compulsive Scale (YBOCS) 合計スコアの平均ベースライン評価は 23 から 26 の範囲でした。研究 1 の用量範囲発見研究では、患者は固定された 1 日量のパキシル 20 mg、40 mg、または 60 mg。研究 1 では、1 日用量の PAXIL 40 mg および 60 mg が OCD の治療に有効であることが示されました。 PAXIL 40 mg および 60 mg の投与を受けた患者は、YBOCS 合計スコアでそれぞれ平均約 6 ポイントおよび 7 ポイントの低下を経験しました。プラセボ治療を受けた患者。研究 2 は、毎日 PAXIL 20 mg から 60 mg を毎日 25 mg から 250 mg のクロミプラミンまたはプラセボと比較する柔軟な用量の研究でした)。この研究では、PAXIL を投与された患者は、YBOCS の合計スコアで平均約 7 ポイントの低下を経験しました。
次の表は、研究 1 の Clinical Global Impression (CGI) スケールの全体的な改善項目に関する治療グループ別の結果の分類を示しています。
サブグループ分析では、年齢や性別による治療結果の違いは示されませんでした。
OCD の治療に対する PAXIL の長期有効性は、スタディ 1 の長期延長で確立されました。 mg から 60 mg を 1 日あたり 6 か月の二重盲検再発予防フェーズで、PAXIL 10 mg またはプラセボのいずれかに無作為に割り付けました。 PAXILに無作為に割り付けられた患者は、プラセボ治療を受けた患者よりも統計的に有意に再発する可能性が低かった.
パニック障害
パニック障害 (PD) の治療における PAXIL 20mg の有効性は、成人の外来患者を対象とした 10 ~ 12 週間の 3 つの多施設共同プラセボ対照研究 (研究 1、2、および 3) で実証されました。患者は、広場恐怖症の有無にかかわらず、PD (DSM-IIIR) を持っていました。これらの研究では、PAXIL は、PD の治療において、パニック発作頻度の 3 つの測定値のうち少なくとも 2 つと、Clinical Global Impression Severity of Illness スコアにおいて、プラセボよりも統計的に有意に有効であることが示されました。
研究 1 は 10 週間の用量範囲調査でした。患者は固定用量の PAXIL 10 mg、20 mg、または 40 mg を毎日、またはプラセボを投与されました。プラセボとの統計的に有意な差は、PAXIL 40 mg の毎日のグループでのみ観察されました。エンドポイントでは、毎日パキシル 40 mg を投与された患者の 76% がパニック発作を起こしていませんでしたが、プラセボを投与された患者では 44% でした。
研究 2 は、1 日 10 mg から 60 mg の PAXIL とプラセボを比較する 12 週間の可変用量研究でした。エンドポイントで、PAXIL 治療を受けた患者の 51% は、プラセボ治療を受けた患者の 32% と比較して、パニック発作を起こしませんでした。
研究 3 は、標準化された認知行動療法を同時に受けている患者を対象に、毎日 PAXIL 10 mg から 60 mg をプラセボと比較する 12 週間の可変用量研究でした。エンドポイントで、PAXIL 治療を受けた患者の 33% が、プラセボ治療を受けた患者の 14% と比較して、0 または 1 回のパニック発作の減少を示しました。
研究 2 および 3 では、エンドポイントでの完了者の平均 PAXIL 用量は、1 日あたり約 40 mg でした。
PD における PAXIL 10mg の長期有効性は、研究 1 の延長で実証されました。 mg、20 mg、または 40 mg を 1 日 1 回、またはプラセボを 3 か月の二重盲検再発予防段階で投与します。 PAXIL 20mgに無作為に割り付けられた患者は、プラセボで治療された患者よりも再発する可能性が統計的に有意に低かった.
サブグループ分析では、年齢や性別による治療結果の違いは示されませんでした。
社交不安障害
社交不安障害 (SAD) の治療における PAXIL の有効性は、SAD の成人外来患者 (DSM-IV) を対象とした 3 つの 12 週間の多施設共同プラセボ対照研究 (研究 1、2、および 3) で実証されました。これらの研究では、プラセボと比較した PAXIL 30mg の有効性は、(1) 臨床全体印象 (CGI) 改善スコア 1 (非常に改善) または 2 (非常に改善) によって定義されるレスポンダーの割合に基づいて評価されました。 )、および (2) Liebowitz Social Anxiety Scale (LSAS) のベースラインからの変化。
研究 1 と 2 は、1 日 20 mg から 50 mg の PAXIL とプラセボを比較する変動用量研究でした。 PAXIL は、CGI 改善応答者基準と Liebowitz Social Anxiety Scale (LSAS) の両方でプラセボよりも統計的に有意な優位性を示しました。スタディ 1 では、12 週まで完了した患者について、プラセボ治療患者の 29% と比較して、PAXIL 治療患者の 69% が CGI 改善応答者でした。スタディ 2 では、CGI 改善応答者は、PAXIL およびプラセボで治療された患者でそれぞれ 77% および 42% でした。
研究 3 は、固定用量の PAXIL 20 mg、40 mg、または 60 mg を毎日、プラセボと比較する 12 週間の研究でした。 PAXIL 20 mg は、LSAS 合計スコアと CGI 改善応答者基準の両方でプラセボよりも統計的に有意に優れていました。 PAXIL 40 mg および 60 mg の 1 日用量グループでは、プラセボよりも優れている傾向がありました。この研究では、1 日 20 mg を超える用量で追加の利益が得られるという兆候はありませんでした。
サブグループ分析では、一般に、年齢、人種、または性別の関数としての治療結果の違いは示されませんでした。
全般性不安障害
全般性不安障害 (GAD) の治療における PAXIL の有効性は、GAD の成人外来患者 (DSM-IV) の 2 つの 8 週間多施設プラセボ対照研究 (研究 1 および 2) で実証されました。
研究 1 は、1 日 20 mg または 40 mg の固定用量の PAXIL をプラセボと比較する 8 週間の研究でした。 PAXIL 20 mg または 40 mg の用量は両方とも、不安神経症のハミルトン評価尺度 (HAM-A) の合計スコアでプラセボよりも統計的に有意に優れていることが実証されました。
この研究では、PAXIL 40 mg の 1 日用量が 20 mg の 1 日用量よりも大きな利益をもたらすことを示唆する十分な証拠はありませんでした。
研究 2 は、1 日 20 mg から 50 mg の PAXIL とプラセボを比較する変動用量研究でした。 PAXIL は、ハミルトン不安評価尺度 (HAM-A) の合計スコアにおいて、プラセボよりも統計的に有意な優位性を示しました。
つ目の研究である 1 日 20 mg から 50 mg の PAXIL をプラセボと比較した柔軟な用量の研究では、主な結果であるハミルトン不安評価尺度 (HAM-A) の合計スコアにおいて、PAXIL がプラセボよりも統計的に有意に優れていることは示されませんでした。
サブグループ分析では、人種や性別による治療結果の違いは示されませんでした。年齢に基づいてサブグループ分析を行うには、高齢患者が不十分でした。
長期試験では、GAD の DSM-IV 基準を満たす 566 人の患者が、単盲検の 8 週間の急性期治療段階で PAXIL 20 mg から 50 mg を毎日服用し、無作為に PAXIL 30 mg を継続するように割り付けられました。 24 週間までの再発の観察には、同じ用量またはプラセボを投与します。単盲検段階での反応は、CGI-病気の重症度スケールでベースラインと比較して 2 ポイント以上低下し、スコアが 3 以下になることによって定義されました。二重盲検段階での再発は、CGI-病気の重症度スケールでベースラインと比較して 2 ポイント以上増加してスコアが 4 以上になった場合、または有効性がないために離脱した場合と定義されました。 PAXIL 40mg を継続して投与された患者は、プラセボを投与された患者と比較して、その後 24 週間にわたって統計的に有意に低い再発率を経験しました。
心的外傷後ストレス障害
心的外傷後ストレス障害 (PTSD) の治療における PAXIL 20mg の有効性は、PTSD の DSM-IV 基準を満たす成人の外来患者を対象とした 2 つの 12 週間多施設プラセボ対照研究 (研究 1 および 2) で実証されました。 2 つの研究を合わせた PTSD 症状の平均期間は 13 年 (0.1 年から 57 年) でした。 2 つの研究を組み合わせた二次性 MDD または非 PTSD 不安障害患者の割合は、それぞれ 41% (858 人中 356 人) および 40% (858 人中 345 人) でした。試験結果は、(1) 臨床医が管理する PTSD スケール パート 2 (CAPS-2) スコア、および (2) 臨床全体印象 - 全体改善尺度 (CGI-I) によって評価されました。 CAPS-2 は、PTSD の 3 つの側面 (再体験/侵入、回避/麻痺、過覚醒) を測定する複数項目の測定器です。各試験の 2 つの主要アウトカムは、(1) ベースラインからエンドポイントまでの CAPS-2 合計スコア (17 項目) の変化、および (2) CGI-I でのレスポンダーの割合でした。 1 (非常に改善された) または 2 (非常に改善された)。
研究 1 は、固定用量の PAXIL 20 mg または 40 mg を毎日、プラセボと比較する 12 週間の研究でした。 PAXIL 20 mg および 40 mg の用量は、CAPS-2 合計スコアのベースラインからの変化および CGI-I のレスポンダーの割合において、プラセボよりも統計的に有意に優れていることが実証されました。この研究では、1 日 20 mg の投与量と比較して 40 mg の 1 日投与量の利点が大きいことを示唆する十分な証拠はありませんでした。
研究 2 は、1 日 20 mg から 50 mg の PAXIL とプラセボを比較する 12 週間の可変用量研究でした。 PAXIL 40mg は、CAPS-2 合計スコアのベースラインからの変化、および CGI-I のレスポンダーの割合において、プラセボよりも有意に優れていることが実証されました。
PAXIL 20 mg から 50 mg を毎日プラセボと比較した 3 番目の研究では、PAXIL 20 mg は、CAPS-2 の合計スコアのベースラインからの変化に関してプラセボよりも統計的に有意に優れていることが示されましたが、CGI のレスポンダーの割合についてはそうではありませんでした。 -私。
これらの試験の患者の大部分は女性でした (研究 1 では 68% の女性: 551 人の被験者のうち 377 人、研究 2 では 66% の女性: 303 人の被験者のうち 202 人)。サブグループ分析では、性別による治療結果の違いは示されませんでした。それぞれ年齢または人種に基づいてサブグループ分析を行うには、65 歳以上または白人以外の患者の数が不十分でした。
患者情報
パキシル® (PAX-il)(パロキセチン) 錠剤 & 経口懸濁液
PAXIL について知っておくべき最も重要な情報は何ですか?
PAXIL は、次のような重大な副作用を引き起こす可能性があります。
- 自殺念慮または自殺行動のリスクの増加。 パキシル 10mg およびその他の抗うつ薬は、特に 24 歳以下の一部の人々の自殺念慮および自殺行動を増加させる可能性があります。 治療の最初の数ヶ月、または用量が変更されたとき。パキシルは小児には使用できません。
- うつ病やその他の精神疾患は、自殺念慮や自殺行動の最も重要な原因です。
どうすれば自殺念慮や自殺行為を監視し、防止することができますか?
- あらゆる変化、特に気分、行動、思考や感情の突然の変化、または自殺念慮や行動を起こした場合は、細心の注意を払ってください。これは、抗うつ薬を開始するとき、または用量を変更するときに非常に重要です。
- すぐに医療提供者に電話して、気分、行動、思考または感情の新しい変化または突然の変化、または自殺念慮または行動を起こした場合に報告してください。
- 医療提供者とのすべてのフォローアップ訪問は、予定どおりに行ってください。特に症状について懸念がある場合は、必要に応じて訪問の合間に医療提供者に電話してください。
次のような症状がある場合、特に新しい症状、悪化している症状、心配な症状がある場合は、すぐに医療提供者に連絡するか、緊急医療の助けを受けてください。
- 自殺しようとする
- 攻撃的または暴力的な行動
- 新しいまたは悪化したうつ病
- 動揺、落ち着きのなさ、怒り、または苛立ちを感じる
- 活動が活発になり、通常より多く話す
- 危険な衝動で行動する
- 自殺や死についての考え
- 新しいまたは悪化した不安またはパニック発作
- 寝られない
- 行動や気分のその他の異常な変化
パキシルとは?
PAXIL 30mg は、成人が以下の治療に使用する処方薬です。
- 大うつ病性障害(MDD)と呼ばれる特定のタイプのうつ病
- 強迫性障害(OCD)
- パニック障害(PD)
- 社交不安障害(SAD)
- 全般性不安障害(GAD)
- 心的外傷後ストレス障害 (PTSD)
次の場合は、パキシルを服用しないでください。
- モノアミンオキシダーゼ阻害剤(MAOI)を服用する
- 過去14日間でMAOIの服用をやめた
- 抗生物質リネゾリドまたは静脈内メチレンブルーで治療されています
- ピモジドを服用している
- チオリダジンを服用しています
- パロキセチンまたはパキシルのいずれかの成分にアレルギーがある。 PAXIL の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
MAOI を服用しているかどうか、または抗生物質リネゾリドや静脈内メチレンブルーを含むこれらの薬のいずれかを服用しているかどうかがわからない場合は、医療提供者または薬剤師に尋ねてください。
PAXIL による治療を中止してから少なくとも 14 日間は、MAOI の服用を開始しないでください。
PAXIL を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 心臓に問題がある
- 出血の問題がある、またはあった
- 双極性障害、躁病または軽躁病を患っている、またはその家族歴がある
- 発作またはけいれんがある、またはあった
- 緑内障がある(眼圧が高い)
- 血液中のナトリウム濃度が低い
- 骨に問題がある
- 腎臓または肝臓に問題がある
- 妊娠している、または妊娠する予定がある。 PAXIL 40mg は胎児に害を及ぼす可能性があります。妊娠中にパキシルを服用した場合の胎児へのリスクについて、かかりつけの医療提供者に相談してください。 PAXIL による治療中に妊娠した場合、または妊娠していると思われる場合は、すぐに医療提供者に伝えてください。
- 授乳中または授乳を計画している。パキシルは母乳に移行します。 PAXIL による治療中の赤ちゃんへの最良の授乳方法については、かかりつけの医療提供者に相談してください。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
PAXIL と他のいくつかの薬は互いに影響し合い、深刻な副作用を引き起こす可能性があります。 PAXIL 30mg は他の薬の作用に影響を与える可能性があり、他の薬は PAXIL の作用に影響を与える可能性があります。
特に以下を服用している場合は、医療提供者に伝えてください。
- トリプタンと呼ばれる片頭痛の治療に使用される薬
- 三環系抗うつ薬
- フェンタニル
- リチウム
- トラマドール
- トリプトファン
- ブスピロン
- アンフェタミン
- セントジョーンズワート
- アスピリン、非ステロイド系抗炎症薬(NSAID)、ワルファリンなどの血液凝固に影響を与える可能性のある薬
- 利尿剤
- タモキシフェン
- 選択的セロントニン再取り込み (SSRI) およびセロトニン ノルエピネフリン再取り込み阻害剤 (SNRI) を含む、気分、不安、精神病、または思考障害の治療に使用される医薬品
これらの薬を服用しているかどうかわからない場合は、医療提供者に尋ねてください。他の医薬品と一緒に PAXIL 10mg を服用しても安全かどうかは、かかりつけの医療提供者が教えてくれます。
最初に医療提供者に相談することなく、PAXILによる治療中に他の薬を開始または停止しないでください. PAXIL を突然中止すると、重大な副作用が発生する可能性があります。見る、 「パキシル 20mg の副作用の可能性は何ですか?」
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医療従事者や薬剤師に見せてください。
パキシルはどのように服用すればよいですか?
- パキシルは処方された通りに服用してください。あなたの医療提供者は、あなたにとって適切な用量になるまで、PAXIL 30mgの用量を変更する必要があるかもしれません.
- 1日1回、朝にパキシルを服用してください。
- PAXIL 30mg は食事の有無にかかわらず服用できます。
- パキシル経口懸濁液を服用している場合は、懸濁液をよく振ってから服用してください。
- PAXIL を過剰に服用した場合は、毒物管理センター (1-800-222-1222) に電話するか、すぐに最寄りの病院の緊急治療室に行ってください。
PAXIL 10mg の副作用にはどのようなものがありますか?
PAXIL 40mg は、次のような重大な副作用を引き起こす可能性があります。
- 見る、 「PAXIL について知っておくべき最も重要な情報は何ですか?」
- セロトニン症候群。 セロトニン症候群と呼ばれる生命を脅かす可能性のある問題は、PAXIL 20mgを他の特定の薬と一緒に服用すると発生する可能性があります. 「PAXIL を服用してはいけない人は?」を参照してください。 医療提供者に電話するか、すぐに最寄りの病院の緊急治療室に行きます 次のようなセロトニン症候群の徴候や症状がある場合:
- 攪拌
- 現実ではないものを見たり聞いたりする(幻覚)
- 錯乱
- 昏睡
- 速い心拍
- 血圧の変化
- めまい
- 発汗
- フラッシング
- 高体温(高熱)
- 震え(震え)、筋肉のこわばり、または筋肉のけいれん
- 協調性の喪失
- 発作
- 吐き気、嘔吐、下痢
- 目の問題 (閉塞隅角緑内障)。 PAXIL 10mg は、他の特定の眼の状態を持つ人々に、閉塞隅角緑内障と呼ばれるタイプの眼の問題を引き起こす可能性があります。目の検査を受けて、危険にさらされているかどうかを確認し、危険にさらされている場合は予防治療を受けることをお勧めします。目の痛み、視力の変化、目の中や周りの腫れや赤みがある場合は、医療提供者に連絡してください。
- 薬の相互作用。 PAXIL 20mgをチオリダジンやピモジドなどの他の特定の薬と一緒に服用すると、QT延長と呼ばれる深刻な心臓の問題を発症するリスクが高まる可能性があります.
- 発作(けいれん)。
- 躁病エピソード。 躁病エピソードは、PAXIL を服用している双極性障害の人に起こることがあります。症状には次のものがあります。
- 大幅に増加したエネルギー
- レーシング思考
- 異常に壮大なアイデア
- いつもより多くまたは速く話す
- 重度の睡眠障害
- 無謀な行動
- 過度の幸福または過敏症
- 中断症候群。 PAXIL 20mg を突然中止すると、深刻な副作用が生じることがあります。あなたの医療提供者は、あなたの線量をゆっくりと減らしたいと思うかもしれません。症状には次のものがあります。
- 吐き気
- 発汗
- 気分の変化
- 過敏性と動揺
- めまい
- 電撃感(感覚異常)
- 身震い
- 不安
- 錯乱
- 頭痛
- 疲れ
- 睡眠の問題
- 軽躁病
- 耳鳴り(耳鳴り)
- 発作
- 血中のナトリウム濃度が低い(低ナトリウム血症)。 深刻で死に至る可能性がある血液中の低ナトリウムレベルは、PAXIL による治療中に発生する可能性があります。高齢者や特定の薬を服用している人は、血中のナトリウム濃度が低下するリスクが高くなる可能性があります.兆候と症状には次のものがあります。
- 頭痛
- 集中困難
- 記憶の変化
- 錯乱
- 転倒につながる可能性のある足の脱力感と不安定さ
より深刻な、またはより突然のケースでは、兆候と症状には次のようなものがあります。
- 現実ではないものを見たり聞いたりする(幻覚)
- 失神
- 発作
- 昏睡
- 呼吸が止まる(呼吸停止)
- 不正出血。 アスピリン、NSAIDs、抗凝血剤と一緒に PAXIL を服用すると、このリスクが高まる可能性があります。異常な出血やあざがあれば、医療提供者に伝えてください。
- 骨折。
PAXIL 10mgの最も一般的な副作用は次のとおりです。
- 男性と女性の性機能の問題
- 便秘
- 下痢
- 口渇
- 睡眠の問題
- 緊張感
- 発汗
- あくび
- 衰弱(無力症)
- 食欲減退
- めまい
- 感染
- 吐き気
- 眠気
- 震え(震え)
これらは、PAXIL の考えられるすべての副作用ではありません。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
パキシルはどのように保管すればよいですか?
- パキシル錠は 59°F ~ 86°F (15°C ~ 30°C) で保管してください。
- PAXIL 10mg 経口懸濁液は 77°F (25°C) 以下で保管してください。
PAXIL およびすべての医薬品は、子供の手の届かないところに保管してください。
PAXIL の安全で効果的な使用に関する一般的な情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態でパキシルを服用しないでください。他の人があなたと同じ症状を持っている場合でも、PAXIL を与えないでください。それらに害を及ぼす可能性があります。医療従事者向けに書かれた PAXIL に関する情報については、医療提供者または薬剤師にお尋ねください。
パキシル30mgの成分は?
有効成分: パロキセチン塩酸塩
不活性成分:
二塩基性リン酸カルシウム二水和物、ヒプロメロース、ステアリン酸マグネシウム、ポリエチレングリコール、ポリソルベート 80、デンプングリコール酸ナトリウム、二酸化チタン、および次の 1 つまたは複数: D&C Red No. 30 アルミニウムレーキ、D&C Yellow No. 10 アルミニウムレーキ、FD&C Blue No. . 2アルミレーキ、FD&Cイエロー6号アルミレーキ
経口懸濁液: クエン酸(無水)、FD&C黄色6号、香料、グリセリン、メチルパラベン、微結晶セルロースおよびカルボキシメチルセルロースナトリウム、ポラクリリンカリウム、プロピレングリコール、プロピルパラベン、精製水、サッカリンナトリウム、シメチコンエマルジョン、クエン酸ナトリウム(二水和物)
この医薬品ガイドは、米国食品医薬品局によって承認されています。
