抗うつ薬治療: Celexa 10mg, 20mg Citalopram 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Celexa とは何ですか? どのように使用されますか?
Celexa は、うつ病の症状を治療するために使用される処方薬です。 Celexa は、単独で使用することも、他の薬と併用することもできます。
セレクサ 20mg は、抗うつ薬、SSRI と呼ばれる種類の薬に属します。
Celexa の可能な副作用は何ですか?
Celexa は、次のような重大な副作用を引き起こす可能性があります。
- 立ちくらみ、
- ぼやけた視界、
- 視野狭窄、
- 目の痛みや腫れ、
- ライトの周りにハローが見える
- 胸の痛みと激しいめまいを伴う頭痛、
- 失神、
- 心臓の鼓動が速くなったり、ドキドキしたり、
- 非常に硬い(硬い)筋肉、
- 発熱や高熱、
- 発汗、
- 錯乱、
- 震え、
- 攪拌、
- 幻覚、
- 過剰反応、
- 吐き気、
- 嘔吐、
- 下痢、
- 調整の喪失、
- 頭痛、
- ろれつが回らない、
- 重度の衰弱、および
- 不安定な感じ
上記の症状がある場合は、すぐに医療機関を受診してください。
Celexa 20mgの最も一般的な副作用は次のとおりです。
- メモリの問題、
- 集中困難、
- 頭痛、
- 眠気、
- 口渇、
- 発汗を増やし、
- しびれやうずき、
- 食欲増進、
- 吐き気、
- 下痢、
- ガス、
- 速い心拍、
- 揺れる感じ、
- 睡眠障害(不眠症)、
- 疲労感、
- かぜの諸症状(鼻づまり、くしゃみ、のどの痛み)、
- 体重の変化と、
- オーガズムを持つのが難しい
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらはセレクサの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
自殺傾向と抗うつ薬
抗うつ薬は、大うつ病性障害(MDD)およびその他の精神障害の短期研究において、小児、青年、および若年成人の自殺念慮および自殺行動(自殺傾向)のリスクをプラセボと比較して増加させました。子供、青年、若年成人にセレクサまたはその他の抗うつ薬の使用を検討している人は、このリスクと臨床上の必要性とのバランスを取る必要があります。短期間の研究では、24 歳を超える成人のプラセボと比較して、抗うつ薬による自殺のリスクの増加は示されませんでした。 65歳以上の成人では、プラセボと比較して抗うつ薬のリスクが低下しました.うつ病やその他の特定の精神障害は、それ自体が自殺のリスクの増加と関連しています。抗うつ薬治療を開始したすべての年齢の患者は、臨床的悪化、自殺傾向、または行動の異常な変化について適切に監視し、注意深く観察する必要があります。家族や介護者は、プレスクライバーとの綿密な観察とコミュニケーションの必要性を知らされるべきです. Celexa 10mg は、小児患者への使用は承認されていません。 (警告: 臨床的悪化と自殺のリスク、患者情報、および注意事項: 小児への使用を参照してください。)
説明
Celexa® (シタロプラム HBr) は、経口投与される選択的セロトニン再取り込み阻害剤 (SSRI) であり、化学構造は他の SSRI や三環系、四環系、またはその他の利用可能な抗うつ薬とは無関係です。シタロプラム HBr は、(±)-1-(3- ジメチルアミノプロピル)-1-(4-フルオロフェニル)-1,3-ジヒドロイソベンゾフラン-5-カルボニトリル、HBr と呼ばれるラセミ二環式フタラン誘導体で、次の構造式を持ちます。
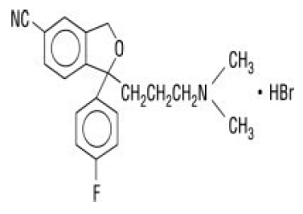
分子式は C20H22BrFN2O で、分子量は 405.35 です。
シタロプラム HBr は、白色からオフホワイトの細かい粉末です。シタロプラム HBr は水にやや溶けにくく、エタノールに溶けます。
Celexa (citalopram Hydrobromide) は、錠剤の剤形でのみ入手できます。
Celexa 10 mg は、シタロプラム塩基 10 mg に相当する強度のシタロプラム HBr を含む、フィルムコーティングされた楕円形の錠剤です。 Celexa 20 mg および 40 mg は、シタロプラム塩基 20 mg または 40 mg に相当する強度のシタロプラム HBr を含む、フィルムコーティングされた楕円形の割線のある錠剤です。錠剤には、コポリビドン、コーンスターチ、クロスカルメロース ナトリウム、グリセリン、ラクトース一水和物、ステアリン酸マグネシウム、ヒプロメロース、微結晶性セルロース、ポリエチレングリコール、および二酸化チタンの不活性成分も含まれています。ベージュ色(10mg)とピンク色(20mg)の錠剤には酸化鉄が着色料として使われています。
適応症
CELEXA 20mgは、成人の大うつ病性障害(MDD)の治療に適応されています[参照 臨床研究 ]。
投薬と管理
推奨用量
食事の有無にかかわらず、CELEXA を 1 日 1 回、1 日 1 回 20 mg の初期用量で投与し、1 週間以上の間隔で 1 日 1 回の最大用量 40 mg まで増量します。
QT 延長のリスクがあるため、1 日 1 回 40 mg を超える用量は推奨されません。 警告と注意事項 ]。
CELEXA開始前の双極性障害のスクリーニング
CELEXA 20mgまたは他の抗うつ薬による治療を開始する前に、双極性障害、躁病、または軽躁病の個人歴または家族歴について患者をスクリーニングします[ 警告と注意事項 ]。
特定の集団に対する推奨用量
60 歳以上の患者、肝機能障害のある患者、および CYP2C19 代謝不良の患者に対するセレクサ 10mg の最大推奨用量は、1 日 1 回 20mg です。 警告と注意事項 、 臨床薬理学 ]。
CYP2C19阻害剤の併用による用量変更
CYP2C19阻害剤と併用する場合のCELEXA 20mgの最大推奨用量は、1日1回20mgです[ 警告と注意事項 、 薬物相互作用 ]。
モノアミンオキシダーゼ阻害薬抗うつ薬への、または患者からの切り替え
モノアミンオキシダーゼ阻害剤(MAOI)抗うつ薬の中止からCELEXAによる治療の開始までに、少なくとも14日が経過する必要があります。逆に、MAOI 抗うつ薬を開始する前に、CELEXA を中止してから少なくとも 14 日間経過する必要があります。 禁忌 と 警告と注意事項 ]。
CELEXAによる治療の中止
CELEXA の中止時に有害反応が起こることがある [参照 警告と注意事項 ]。可能であれば、CELEXA を突然中止するのではなく、徐々に投与量を減らしてください。
供給方法
剤形と強度
CELEXA 10mg 錠剤は、次のように入手できます。
- 10 mg: ベージュ、楕円形、片面に「FP」、もう片面に「10 mg」と刻印
- 20 mg: ピンク色、楕円形、スコア ラインの左側に「F」、スコア ラインの右側に「P」、スコア ラインのない側に「20 mg」の刻印
- 40 mg: 白色、楕円形、スコア ラインの左側に「F」が刻印され、スコア ラインの右側に「P」が刻印され、スコア ラインのない側に「40 mg」が刻印されています。
セレクサ (シタロプラム) 錠剤は次のように供給されます。
保管と取り扱い
CELEXA 10mg 錠剤は 20 ~ 25°C (68 ~ 77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) の間で許容されるエクスカーション [参照 USP制御の室温 ]。
販売元: Allergan USA, Inc. 改訂: 2022 年 2 月
副作用
次の副作用については、ラベルの他のセクションで詳しく説明しています。
- 過敏反応 [参照 禁忌 ]
- 青年および若年成人における自殺念慮および自殺行動[参照 警告と注意事項 ]
- QT延長とトルサード・ド・ポアント[参照 警告と注意事項 ]
- セロトニン症候群 [参照 警告と注意事項 ]
- 出血のリスクの増加 [参照 警告と注意事項 ]
- 躁病または軽躁病の活性化 [参照 警告と注意事項 ]
- 中断症候群 [参照 警告と注意事項 ]
- 発作 [参照 警告と注意事項 ]
- 閉塞隅角緑内障 [参照 警告と注意事項 ]
- 低ナトリウム血症 [参照 警告と注意事項 ]
- 性機能障害 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、臨床現場で観察された発生率を反映していない可能性があります。
CELEXA 20mgの安全性には、3つの異なる研究グループからの患者および/または健康な被験者のシタロプラム曝露が含まれていました。対照および非対照の臨床試験における患者からの 4,422 回の曝露は、約 1,370 年の患者曝露年に相当します。さらに、ほとんどが非盲検のヨーロッパの市販後研究から、19,000 を超える暴露がありました。 CELEXA 10mgによる治療の条件と期間は大きく異なり、(重複するカテゴリーに)非盲検および二重盲検研究、入院患者および外来患者の研究、固定用量および用量滴定研究、短期および長期暴露が含まれていました. .
治療中止に伴う副作用
最長6週間のプラセボ対照試験で1日1回10mgから80mgの用量でCELEXA 10mgを投与されたMDD患者1,063人のうち、16%が副作用のために治療を中止しましたが、446人の患者では8%でした。プラセボを受け取っています。中止に伴う有害反応(すなわち、少なくとも 1% の CELEXA 治療患者で、プラセボの少なくとも 2 倍の割合で中止に伴う副作用)を表 2 に示します。
表3は、最大6週間のプラセボ対照試験において、セレクサ20mgを1日1回10mgから80mgの用量で投与された1,063人のMDD患者に発生した副作用の発生率を列挙しています。
CELEXA治療を受けた患者で発生した最も一般的な副作用は、発生率が5%以上で、プラセボ患者の発生率の少なくとも2倍で、男性患者の射精障害(主に射精遅延)でした(表3を参照)。
用量依存性の有害反応
CELEXA 10mgの投与量と副作用の発生率との潜在的な関係は、プラセボまたはCELEXA 10mg、20mg、40mg、または60mg(最大推奨用量の1.5倍)を投与されたMDD患者の固定用量研究で調べられました。 .次の副作用について、正の用量反応 (p
SSRIによる男性と女性の性機能障害
性的欲求、性的パフォーマンス、および性的満足の変化は、精神障害の徴候としてしばしば発生しますが、SSRI 治療の結果である可能性もあります。しかし、患者と医療提供者がそれらについて話し合うのをためらう可能性があるため、性的欲求、パフォーマンス、および満足を含む不快な経験の発生率と重症度の信頼できる推定値を取得することは困難です.したがって、ラベリングで引用された不快な性的経験とパフォーマンスの発生率の推定値は、実際の発生率を過小評価する可能性があります。
表4は、うつ病患者のプラセボ対照臨床試験のプールでCELEXA 20mgを服用している男性患者の少なくとも2%によって報告された性的有害反応の発生率を示しています.
セレクサ 20mg を投与された女性のうつ病患者において、性欲減退と無オルガスムの発生率は、それぞれ 1.3% (n=638 女性) と 1.1% (n=252 女性) でした。
体重の変化
対照試験でCELEXAで治療された患者は、プラセボ患者では変化がなかったのと比較して、約0.5kgの体重減少を経験しました.
心電図の変化
徹底した QT 研究では、CELEXA は QTc 間隔の用量依存的な増加と関連していることがわかりました。
CELEXA (N=802) およびプラセボ (N=241) グループの心電図を、QTc 変化がベースラインから 60 ミリ秒を超える被験者または絶対値が投与後 500 ミリ秒を超える被験者、および心拍数が100 bpm を超えるか、ベースラインから 25% 変化して 50 bpm 未満に減少します (それぞれ、頻脈または徐脈の異常値)。 CELEXAグループでは、プラセボグループの患者の1.2%と比較して、患者の1.9%がQTcFのベースラインから60ミリ秒以上の変化を示しました。 CELEXA 10mg群の患者の0.5%と比較して、プラセボ群の患者はいずれも投与後のQTcFが500ミリ秒を超えていませんでした。頻脈異常値の発生率は、CELEXA群で0.5%、プラセボ群で0.4%でした。徐脈異常値の発生率は、CELEXA 10mg群で0.9%、プラセボ群で0.4%でした。
セレクサの市販前評価中に観察されたその他の有害反応
次の副作用のリストには、次のような反応は含まれていません: 1) 表 3 またはラベル表示の他の場所に含まれているもの、2) 薬物の原因が遠く離れているもの、3) 一般的であるために情報が得られないもの、および一人の患者。
有害反応は身体システムによって分類され、次の定義に従って頻度の高い順にリストされています。まれな副作用とは、患者の 1/100 未満から 1/1000 の患者に発生するものです。まれな副作用とは、1/1000 人未満の患者で発生するものです。
心臓血管 - 頻繁:頻脈、姿勢性低血圧、低血圧。まれ:高血圧、徐脈、浮腫(四肢)、狭心症、期外収縮、心不全、紅潮、心筋梗塞、脳血管障害、心筋虚血。まれ:一過性脳虚血発作、静脈炎、心房細動、心停止、脚ブロック。
中枢神経系および末梢神経系の障害 - 頻繁: 感覚異常、片頭痛。まれ:運動亢進、めまい、筋緊張亢進、錐体外路障害、脚のけいれん、不随意筋収縮、運動低下、神経痛、ジストニア、異常歩行、感覚鈍麻、運動失調。まれ:異常な協調、知覚過敏、眼瞼下垂、昏迷。
内分泌疾患 -まれ: 甲状腺機能低下症、甲状腺腫、女性化乳房。
胃腸障害 -頻繁: 唾液の増加、鼓腸。まれ:胃炎、胃腸炎、口内炎、おくび、痔、嚥下障害、歯ぎしり、歯肉炎、食道炎。まれ:大腸炎、胃潰瘍、胆嚢炎、胆石症、十二指腸潰瘍、胃食道逆流、舌炎、黄疸、憩室炎、直腸出血、しゃっくり。
一般 - まれ :のぼせ、のぼせ、アルコール不耐症、失神、インフルエンザ様症状まれ:花粉症。
血行障害およびリンパ障害 -まれ: 紫斑、貧血、鼻出血、白血球増加症、白血球減少症、リンパ節腫脹。まれ:肺塞栓症、顆粒球減少症、リンパ球増加症、リンパ球減少症、低色素性貧血、凝固障害、歯肉出血。
代謝および栄養障害 -頻繁: 体重減少、体重増加。まれ:肝臓酵素の増加、喉の渇き、ドライアイ、アルカリホスファターゼの増加、異常な耐糖能。まれ:ビリルビン血症、低カリウム血症、肥満、低血糖、肝炎、脱水。
筋骨格系疾患 -まれ: 関節炎、筋力低下、骨格痛。まれ:滑液包炎、骨粗鬆症。
精神障害 -頻繁:集中力の低下、記憶喪失、無関心、うつ病、食欲増進、うつ病の悪化、自殺未遂、混乱。まれ:性欲増進、攻撃的反応、パロニリア、薬物依存、離人症、幻覚、多幸感、精神病性うつ病、妄想、妄想反応、情緒不安定、パニック反応、精神病。まれ:緊張病反応、メランコリー。
生殖障害/女性* -頻繁:無月経。まれ:乳汁漏出、乳房痛、乳房肥大、膣出血。 (*女性被験者のみに基づく%: 2955)
呼吸器系疾患 -頻繁: 咳。まれ:気管支炎、呼吸困難、肺炎。まれ:喘息、喉頭炎、気管支痙攣、肺炎、痰の増加。
皮膚および付属器の障害 - 頻繁:発疹、かゆみ。まれ:光線過敏症、蕁麻疹、にきび、皮膚の変色、湿疹、脱毛症、皮膚炎、皮膚の乾燥、乾癬。まれ:多毛症、発汗の減少、黒色症、角膜炎、蜂窩織炎、肛門そう痒症。
特別な感覚 - よくある:異常な順応、味の倒錯。まれ:耳鳴り、結膜炎、目の痛み。まれ:散瞳、羞明、複視、異常な流涙、白内障、味覚喪失。
泌尿器系疾患 - 頻繁:多尿。まれ:排尿頻度、尿失禁、尿閉、排尿障害。まれ:顔面浮腫、血尿、乏尿、腎盂腎炎、腎結石、腎痛。
市販後の経験
ラセミ体であるシタロプラム、またはシタロプラムの S-エナンチオマーであるエスシタロプラムの承認後の使用中に、次の有害反応が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系の障害: 溶血性貧血、血小板減少症、プロトロンビン減少
心疾患: トルサード ド ポアント、心室性不整脈、QT延長
内分泌疾患: 高プロラクチン血症
目の病気: 閉塞隅角緑内障
胃腸障害: 消化管出血、膵炎
一般的な障害と管理サイトの状態: 離脱症候群
肝胆道疾患: 肝壊死
免疫系障害: アナフィラキシー、アレルギー反応
筋骨格および結合組織障害: 横紋筋融解症
神経系障害: 大発作、ミオクローヌス、舞踏病アテトーゼ、ジスキネジー、アカシジア、眼振
妊娠、産褥および周産期の状態: 自然流産
精神障害: せん妄
腎および尿路疾患: 急性腎不全
生殖器系および乳房疾患: 持続勃起症
皮膚および皮下組織の疾患: スティーブンス・ジョンソン症候群、表皮壊死融解症、血管性浮腫、多形紅斑、斑状出血
血管障害: 血栓症
薬物相互作用
表 5 は、CELEXA との臨床的に重要な薬物相互作用を示しています。
薬物乱用と依存
規制物質
CELEXA (シタロプラム HBr) は規制物質ではありません。
乱用
動物研究は、CELEXA 20mg の乱用傾向が低いことを示唆しています。 CELEXA は、乱用、耐性、または身体的依存の可能性について、ヒトで体系的に研究されていません。 CELEXAの市販前の臨床経験では、薬物探索行動は明らかになりませんでした。しかし、これらの観察結果は系統だったものではなく、この限られた経験に基づいて、CNS 活性薬が市場に出された後、どの程度誤用、流用、および/または乱用されるかを予測することはできません。したがって、医療提供者は、CELEXA 20mg患者の薬物乱用歴を慎重に評価し、そのような患者を綿密に追跡し、誤用または乱用の兆候(耐性の発達、用量の増加、薬物探索行動など)がないか観察する必要があります.
警告
の一部として含まれています 予防 セクション。
予防
青少年と若年成人の自殺念慮と自殺行動
約 77,000 人の成人患者と 4,500 人の小児患者を含む抗うつ薬 (SSRI およびその他の抗うつ薬クラス) のプラセボ対照試験のプール分析では、24 歳以下の抗うつ薬治療患者における自殺念慮および自殺行動の発生率は、プラセボ治療患者で。薬物間で自殺念慮および自殺行動のリスクにかなりのばらつきがありましたが、研究されたほとんどの薬物について、若い患者で特定されたリスクの増加がありました。自殺念慮および自殺行動の絶対リスクには適応症ごとに違いがあり、MDD患者で最も高い発生率でした。治療を受けた患者 1000 人あたりの自殺念慮および自殺行動の症例数における薬物とプラセボの差を表 1 に示します。
小児、青年、および若年成人における自殺念慮および自殺行動のリスクが、長期使用、つまり 4 か月を超える使用に及ぶかどうかは不明です。しかし、抗うつ薬がうつ病の再発を遅らせ、うつ病自体が自殺念慮や自殺行動の危険因子であるという、MDDの成人におけるプラセボ対照維持試験からの実質的な証拠があります。
特に薬物療法の最初の数ヶ月間および投与量の変更時に、臨床的悪化および自殺念慮および行動の出現について、抗うつ薬で治療されているすべての患者を監視します。行動の変化を監視し、医療提供者に警告するように、患者の家族または介護者に相談してください。うつ病が持続的に悪化している患者、または緊急の自殺念慮または行動を経験している患者では、CELEXAの中止を含め、治療レジメンの変更を検討してください。
QT延長とトルサード・ド・ポアント
CELEXA は、用量依存的な QTc 延長、トルサード ド ポアンツ (TdP)、心室頻拍、および突然死に関連する ECG 異常を引き起こします。これらはすべて、シタロプラムの市販後の報告で観察されています。 有害反応 ]。
CELEXA 20mg の高用量で QTc 延長のリスクがあるため、CELEXA を 1 日 1 回 40mg を超える用量で投与しないことをお勧めします。 投薬と管理 、 臨床薬理学 ]。
先天性 QT 延長症候群、徐脈、低カリウム血症または低マグネシウム血症、最近の急性心筋梗塞、または非代償性心不全の患者では、ベネフィットが特定の患者のリスクを上回らない限り、CELEXA を避けるべきです。 QTc間隔を延長する他の薬を服用している患者でもCELEXAは避けるべきです[ 薬物相互作用 ]。このような薬物には、クラス 1A (例、キニジン、プロカインアミド) またはクラス III (例、アミオダロン、ソタロール) の抗不整脈薬、抗精神病薬 (例、クロルプロマジン、チオリダジン)、抗生物質 (例、ガチフロキサシン、モキシフロキサシン)、または任意の他のクラスの薬が含まれます。 QTc間隔を延長することが知られている(例、ペンタミジン、酢酸レボメタジル、メタドン)。
シタロプラムの用量は、特定の集団では制限する必要があります。 CYP2C19 代謝不良の患者、またはシメチジンまたは別の CYP2C19 阻害剤を併用している患者では、より高いシタロプラムへの曝露が予想されるため、最大用量は 1 日 1 回 20 mg に制限する必要があります。また、肝機能障害のある患者および 60 歳以上の患者では、より高い曝露が予想されるため、最大用量は 1 日 1 回 20 mg に制限する必要があります。 投薬と管理 、 薬物相互作用 、 特定の集団での使用 、 臨床薬理学 ]。
特定の状況では、電解質および/または心電図モニタリングが推奨されます。重大な電解質障害のリスクがあるCELEXA 20mgによる治療を検討している患者は、定期的なモニタリングによりベースラインの血清カリウムおよびマグネシウムを測定する必要があります.低カリウム血症 (および/または低マグネシウム血症) は、QTc 延長および不整脈のリスクを高める可能性があるため、治療開始前に是正し、定期的に監視する必要があります。ベネフィットが特定の患者のリスクを明らかに上回らない限り、CELEXA 10mgの使用が推奨されない患者には、心電図モニタリングが推奨されます。 その上 )。これらには、上記の心臓病の患者、およびQTc間隔を延長する可能性のある他の薬を服用している患者が含まれます.
QTc 測定値が 500 ミリ秒を超えることが判明した患者では、CELEXA 10mg の投与を中止してください。 CELEXAを服用している患者が、めまい、動悸、または失神などの不整脈の発生を示す可能性のある症状を経験した場合、処方者は心臓モニタリングを含むさらなる評価を開始する必要があります.
セロトニン症候群
CELEXA 20mgを含むSSRIは、生命を脅かす可能性のある状態であるセロトニン症候群を引き起こす可能性があります.リスクは、他のセロトニン作動薬(トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミン、セントジョーンズワートなど)や、セロトニンの代謝を損なう薬、すなわち、 MAOI [参照 禁忌 、 薬物相互作用 ]。セロトニン症候群は、これらの薬を単独で使用した場合にも発生する可能性があります。セロトニン症候群の症状は、市販前の臨床試験でCELEXA 20mgで治療されたMDD患者の0.1%で認められました。
セロトニン症候群の徴候および症状には、精神状態の変化(興奮、幻覚、せん妄、および昏睡など)、自律神経不安定性(頻脈、不安定な血圧、めまい、発汗、紅潮、高体温など)、神経筋症状(振戦、硬直、ミオクローヌス、反射亢進、協調運動障害)、発作、および胃腸症状 (例、吐き気、嘔吐、下痢)。
CELEXAとMAOIの併用は禁忌です。さらに、リネゾリドまたは静脈内メチレンブルーなどのMAOIで治療されている患者にCELEXA 20mgを開始しないでください.他の経路 (経口錠剤や局所組織注射など) によるメチレン ブルーの投与に関する報告はありません。 CELEXA 10mgを服用している患者にリネゾリドまたは静脈内メチレンブルーなどのMAOIによる治療を開始する必要がある場合は、MAOIによる治療を開始する前にCELEXA 20mgを中止してください[ 禁忌 、 薬物相互作用 ]。
セロトニン症候群の出現について、CELEXA 20mgを服用しているすべての患者を監視してください。上記の症状が発生した場合は、CELEXA および併用するセロトニン作動薬による治療を直ちに中止し、支持対症療法を開始してください。 CELEXA と他のセロトニン作動薬との併用が臨床的に正当化される場合は、セロトニン症候群のリスクが高いことを患者に知らせ、症状を監視してください。
出血のリスクの増加
セレクサ 20mg など、セロトニン再取り込み阻害を阻害する薬剤は、出血イベントのリスクを高めます。アスピリン、非ステロイド性抗炎症薬 (NSAIDS)、その他の抗血小板薬、ワルファリン、およびその他の抗凝固薬の併用は、このリスクを高める可能性があります。症例報告と疫学的研究 (症例対照とコホート デザイン) は、セロトニンの再取り込みを妨げる薬物の使用と消化管出血の発生との関連を示しています。セロトニンの再取り込みを妨げる薬物に関連する出血イベントは、斑状出血、血腫、鼻出血、および点状出血から生命を脅かす出血にまで及びます。
CELEXA 20mgと抗血小板薬または抗凝固薬の併用に伴う出血リスクの増加について患者に知らせてください。ワルファリンを服用している患者については、国際正規化比を注意深く監視してください [ 薬物相互作用 ]。
マニアまたは軽躁の活性化
双極性障害の患者では、CELEXA または他の抗うつ薬で抑うつエピソードを治療すると、混合/躁病エピソードを引き起こす可能性があります。対照臨床試験では、双極性障害の患者は除外されました。しかし、躁病または軽躁病の症状は、CELEXA で治療された未診断患者の 0.1% で報告されました。 CELEXA 10mgによる治療を開始する前に、双極性障害、躁病、または軽躁病の個人歴または家族歴について患者をスクリーニングします[ 投薬と管理 ]。
中断症候群
セロトニン作動性抗うつ薬の中止後、特に突然の中止後の有害反応には、吐き気、発汗、不快気分、過敏性、動揺、めまい、感覚障害(例:感電などの感覚異常)、振戦、不安、錯乱、頭痛、無気力、情緒不安定、不眠症、軽躁病、耳鳴り、発作。可能な限り、急激な中止ではなく、徐々に投与量を減らすことが推奨されます。 投薬と管理 ]。
発作
CELEXA 20mg は、発作性疾患の患者で体系的に評価されていません。発作の既往歴のある患者は、臨床研究から除外されました。 CELEXA 20mgの臨床試験では、CELEXAで治療された患者の0.3%(98年間の曝露につき1人の患者の割合)およびプラセボで治療された患者の0.5%(50年間の曝露につき1人の患者の割合)で発作が発生しました.セレクサ 10mg は、発作性疾患のある患者には慎重に処方する必要があります。
閉塞隅角緑内障
CELEXA を含む多くの抗うつ薬の使用後に起こる瞳孔散大は、開存虹彩切除術を持っていない解剖学的に狭い隅角を持つ患者で隅角閉鎖発作を引き起こす可能性があります。未治療の解剖学的に狭角の患者には、CELEXA を含む抗うつ薬の使用を避けてください。
低ナトリウム血症
低ナトリウム血症は、CELEXA を含む SSRI による治療の結果として発生する可能性があります。血清ナトリウムが 110 mmol/L 未満の症例が報告されています。低ナトリウム血症の兆候と症状には、頭痛、集中力の低下、記憶障害、錯乱、脱力感、ふらつきなどがあり、転倒につながる可能性があります。より重症および/または急性の症例に関連する徴候および症状には、幻覚、失神、発作、昏睡、呼吸停止、および死亡が含まれます。多くの場合、この低ナトリウム血症は、不適切な抗利尿ホルモン分泌症候群 (SIADH) の結果であると思われます。
症候性低ナトリウム血症の患者では、CELEXA を中止し、適切な医療介入を開始してください。高齢患者、利尿薬を服用している患者、および体液量が枯渇している患者は、SSRI で低ナトリウム血症を発症するリスクが高くなる可能性があります [参照 特定の集団での使用 ]。
性機能障害
セレクサを含むSSRIの使用は、性機能障害の症状を引き起こす可能性があります[参照 有害反応 ]。男性患者では、SSRI の使用により、射精の遅延または失敗、性欲減退、および勃起不全が生じる可能性があります。女性患者では、SSRI の使用により性欲が低下し、オーガズムが遅延または消失する可能性があります。
性機能は自然に報告されない可能性があるため、処方者はCELEXAの開始前に性機能について質問し、治療中の性機能の変化について具体的に質問することが重要です.性機能の変化を評価する際には、詳細な病歴(症状の発症時期を含む)を取得することが重要です。なぜなら、性的症状には、根底にある精神障害を含む他の原因がある可能性があるためです。患者が治療について情報に基づいた決定を下すのをサポートするための潜在的な管理戦略について話し合います。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
自殺念慮と行動
患者と介護者に、特に治療中の初期および投与量を増減したときに自殺傾向の出現を探すように助言し、そのような症状を医療提供者に報告するように指示する[参照 囲み警告 、 警告と注意事項 ]。
QT延長とトルサード・ド・ポアント
失神、意識喪失、または動悸を感じた場合は、すぐに医療提供者に相談するよう患者に助言してください。新しい薬を服用する前に、CELEXAを服用していることを医療提供者に知らせるように患者に指示します[ 警告と注意事項 、 薬物相互作用 ]。
セロトニン症候群
特にトリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドール、トリプトファン、ブスピロン、アンフェタミン、セントジョーンズワート、およびセロトニンの代謝を損なう薬物(特に、MAOI、精神障害の治療を目的としたものと、リネゾリドなどの他の薬物の両方)。セロトニン症候群の徴候または症状を経験した場合は、医療提供者に連絡するか、緊急治療室に報告するように患者に指示します[参照 警告と注意事項 、 薬物相互作用 ]。
出血のリスクの増加
アスピリン、NSAID、その他の抗血小板薬、ワルファリン、またはその他の抗凝固薬とセレクサ 10mg の併用について患者に知らせる。出血のリスクを高める処方薬または市販薬を服用している、または服用する予定がある場合は、医療提供者に知らせるよう患者に助言する[参照 警告と注意事項 ]。
マニアまたは軽躁の活性化
患者とその介護者に、躁病/軽躁病の活性化の兆候を観察するようにアドバイスし、そのような症状を医療提供者に報告するように指示します[参照 警告と注意事項 ]。
中断症候群
急にCELEXAを中止せず、漸減レジメンについて医療提供者と話し合うように患者に助言してください。 CELEXA 20mgを中止すると副作用が起こる可能性があることを患者に知らせる[ 警告と注意事項 ]。
性機能障害
CELEXA の使用は、男性患者と女性患者の両方に性機能障害の症状を引き起こす可能性があることを患者に助言してください。性機能の変化と潜在的な管理戦略について医療提供者と話し合う必要があることを患者に伝えます[ 警告と注意事項 ]。
妊娠
- CELEXAによる治療中に妊娠した場合、または妊娠する予定がある場合は、医療提供者に通知するよう患者に助言してください[ 特定の集団での使用 ]。
- 妊娠後期にCELEXAを使用すると、長期の入院、呼吸補助、経管栄養、および/または新生児の持続性肺高血圧症(PPHN)を必要とする新生児合併症のリスクが高まる可能性があることを患者に助言してください[ 特定の集団での使用 ]。
- 妊娠中にシタロプラムに暴露した女性の妊娠転帰を監視する妊娠暴露登録があることを女性に助言する [参照 特定の集団での使用 ]。
授乳
授乳中の女性には、過度の鎮静、落ち着きのなさ、動揺、哺乳不良、体重増加不良について乳児を監視し、これらの兆候に気付いた場合は医療機関を受診するようアドバイスする[参照 特定の集団での使用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
シタロプラムは、8 および 24 mg/kg/日の用量で 24 か月間投与されたラットの小腸癌の発生率を増加させました。これは、それぞれ 40 mg の最大推奨ヒト用量 (MRHD) の約 2 倍および 6 倍です。 mg/m² 体表面積に基づく。この所見の無影響量 (NOEL) は確立されていません。
シタロプラムは、最大 240 mg/kg/日の用量で 18 か月間投与されたマウスの腫瘍の発生率を増加させませんでした。これは、mg/m² 体表面積に基づく 40 mg の MRDH の約 30 倍です。
突然変異誘発
シタロプラムは、代謝活性化の非存在下で、5 つの細菌株 (サルモネラ TA98 および TA1537) のうちの 2 つの in vitro 細菌復帰突然変異アッセイ (エイムズ試験) で変異原性がありました。代謝活性化の存在下および非存在下での染色体異常の in vitro チャイニーズハムスター肺細胞アッセイで、染色体異常誘発性でした。シタロプラムは、マウスリンパ腫細胞の in vitro 哺乳類前方遺伝子突然変異試験 (HPRT) またはラット肝臓の in vitro/in vivo 不定期 DNA 合成 (UDS) 試験で変異原性を示さなかった。ヒトリンパ球の in vitro 染色体異常試験または 2 つの in vivo マウス小核試験で染色体異常誘発性は認められなかった。
生殖能力の障害
シタロプラムは、雌および雄のラットに 32、48、および 72 mg/kg/日の用量で、交配前および交配中および妊娠継続中に経口投与されました。これらの用量は、mg/m² 体表面積に基づいて、40 mg の MRHD の約 8、12、および 17 倍です。交配と受胎能は、MRHD の約 8 倍である 32 mg/kg/日以上の用量で減少しました。
妊娠期間は 48 mg/kg/日で増加し、これは MRHD の約 12 倍です。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中に抗うつ薬にさらされた女性の妊娠転帰を監視する妊娠曝露登録があります。医療提供者は、1-844-405-6185 で抗うつ剤の国立妊娠登録に電話するか、オンラインで https://womensmentalhealth.org/research/pregnancyregistry/antidepressants にアクセスして、患者を登録することをお勧めします。
リスクの概要
妊娠中のシタロプラムの使用に関する発表された疫学研究および市販後の報告から入手可能なデータでは、主要な先天性欠損症または流産のリスクの増加は確立されていません。発表された研究は、臍帯血と羊水の両方のシタロプラムレベルが母体血清で観察されたものと類似していることを示しました.新生児の持続性肺高血圧症(PPHN)のリスクがあります( データ )および/または妊娠中のCELEXAを含む選択的セロトニン再取り込み阻害薬(SSRI)への曝露による新生児適応不良。妊娠中の未治療のうつ病に関連するリスクもあります( 臨床上の考慮事項 )。
動物の繁殖研究では、シタロプラムは、母体毒性を引き起こす用量で胚/胎児への悪影響を引き起こしました( データ )。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中に抗うつ薬を中止した女性は、抗うつ薬を継続している女性よりも大うつ病の再発を経験する可能性が高くなります。この発見は、大うつ病性障害の病歴があり、妊娠初期に胸腺機能が正常で抗うつ薬を服用していた 201 人の妊婦の前向き縦断研究から得られたものです。妊娠中および産後に抗うつ薬による治療を中止または変更する場合は、未治療のうつ病のリスクを考慮してください。
胎児/新生児の有害反応
妊娠第三期後期にCELEXAや他のSSRIにさらされた新生児は、長期の入院、呼吸補助、および経管栄養を必要とする合併症を発症しました。このような合併症は、出産直後に発生する可能性があります。報告された臨床所見には、呼吸困難、チアノーゼ、無呼吸、発作、体温の不安定性、摂食困難、嘔吐、低血糖、筋緊張低下、筋緊張亢進、反射亢進、振戦、神経質、過敏症、絶え間ない泣き声が含まれます。これらの調査結果は、SSRI の直接的な毒性効果、またはおそらく薬物中止症候群のいずれかと一致しています。場合によっては、臨床像がセロトニン症候群と一致することに注意する必要があります。 警告と注意事項 ]。
データ
ヒューマンデータ
妊娠後期に SSRI にさらされると、新生児の持続性肺高血圧症 (PPHN) のリスクが高くなる可能性があります。 PPHN は、一般人口の出生 1,000 人あたり 1 ~ 2 人で発生し、実質的な新生児の罹患率と死亡率に関連しています。
動物データ
シタロプラムは、器官形成期に妊娠ラットに 32、56、および 112 mg/kg/日の用量で経口投与されました。 mg/m²の体表面積について。シタロプラムは、中枢神経系の臨床徴候の母体毒性を引き起こし、MRHD の 27 倍である 112 mg/kg/日で体重増加を減少させました。この母体毒性用量では、シタロプラムは胚/胎児の成長と生存を減少させ、胎児の異常 (心血管および骨格の欠陥を含む) を増加させました。母体および胎児毒性の無毒性量 (NOAEL) は 56 mg/kg/日で、これは MRHD の約 14 倍です。
シタロプラムは器官形成期の妊娠中のウサギに 16 mg/kg/日までの用量で経口投与されました。母体または胎児への毒性は観察されませんでした。母体および胎児毒性の NOAEL は 16 mg/kg/日で、これは MRHD の約 8 倍です。
シタロプラムは、妊娠後期および授乳期の妊娠ラットに 4.8、12.8、および 32 mg/kg/日の用量で経口投与されました。これは、体の mg/m² に基づいて、40 mg の MRHD の約 1、3、および 8 倍です。表面積。シタロプラムは、出生後最初の 4 日間の子孫の死亡率を増加させ、MRHD の約 8 倍である 32 mg/kg/日で子孫の成長を低下させました。発生毒性の NOAEL は 12.8 mg/kg/日で、MRHD の約 3 倍です。別の研究では、母親が妊娠中および授乳期初期に MRHD の約 6 倍である 24 mg/kg/日以上の用量で治療された場合、子孫の死亡率と成長に同様の影響が見られました。その研究では NOAEL は決定されなかった。
授乳
リスクの概要
公開された文献からのデータは、母乳中のシタロプラムの存在を、母親の体重調整用量の 0.7 ~ 9.4% の範囲の相対乳児用量で、乳/血漿比が 0.78 ~ 4.3 の範囲であると報告しています。シタロプラムにさらされた母乳で育てられた乳児が、過敏症、落ち着きのなさ、過度の傾眠、摂食の減少、および体重減少を経験したという報告があります。 臨床上の考慮事項 )。牛乳生産に対するシタロプラムの影響に関する情報はありません。
母乳育児の発達上および健康上の利点は、セレクサ 20 mg に対する母親の臨床的必要性、およびセレクサ 20 mg または基礎となる母体の状態から母乳で育てられた子供への潜在的な悪影響とともに考慮されるべきです。
臨床上の考慮事項
授乳中の乳児に、いらいら、落ち着きのなさ、過度の傾眠、哺乳量の減少、体重減少などの副作用がないか監視します。
小児用
小児患者におけるCELEXAの安全性と有効性は確立されていません。 MDD の小児患者 407 人を対象に CELEXA 20mg を用いた 2 つのプラセボ対照試験が実施されましたが、データは小児患者での使用を支持するには不十分でした。
抗うつ薬は、小児患者の自殺念慮および自殺行動のリスクを高める [参照 囲み警告 、 警告と注意事項 ]。小児患者におけるSSRIの使用に関連して、食欲減退および体重減少が観察されています。
高齢者の使用
セレクサ20mgの臨床試験に参加した4422人の患者のうち、1357人が60歳以上、1034人が65歳以上、457人が75歳以上でした。 2 つの薬物動態研究では、シタロプラムの AUC は、若い被験者と比較して 60 歳以上の被験者でそれぞれ 23% および 30% 増加し、その半減期はそれぞれ 30% および 50% 増加しました [参照 臨床薬理学 ]。したがって、60 歳以上の患者の最大推奨用量は、若い患者よりも低くなります [参照 投薬と管理 、 警告と注意事項 ]。
CELEXA を含む SSRI は、高齢患者における臨床的に重大な低ナトリウム血症の症例と関連しており、この有害反応のリスクが高い可能性があります [参照 警告と注意事項 ]。
肝障害
肝機能障害のある患者では、シタロプラムへの曝露が増加します。 CELEXA 10mgの最大推奨用量は、肝障害のある患者では低くなります[参照 投薬と管理 、 臨床薬理学 ]。
過剰摂取
セレクサ錠の過剰摂取で次のことが報告されています。
- 遅れる可能性のある発作、および昏睡を含む精神状態の変化。
- QRS および QTc 間隔の延長、幅の広い複雑な頻脈性不整脈、トルサード ド ポワントなど、遅延する可能性のある心血管毒性。高血圧が最も一般的に見られますが、単独で、またはアルコールを含む共摂取物と一緒に低血圧が見られることはめったにありません。
- セロトニン症候群(他のプロセロトニン作動薬との多剤過剰摂取の患者は、リスクが高くなる可能性があります)。
不整脈のリスクがあるため、セレクサを過剰摂取した場合は、長時間の心臓モニタリングが推奨されます。 Celexa 10mgの過剰摂取後早期に発症した患者では、活性炭による胃腸の除染を検討する必要があります。追加の過剰摂取管理の推奨事項については、中毒センター (1-800-221-2222) または医療毒物学者に連絡することを検討してください。
禁忌
CELEXA は以下の患者には禁忌です:
- セロトニン症候群のリスクが高いため、MAOI(リネゾリドや静脈内メチレンブルーなどのMAOIを含む)を服用中、または中止してから14日以内[ 警告と注意事項 、 薬物相互作用 ]。
- QT延長のリスクがあるためピモジドを服用する[参照 薬物相互作用 ]。
- シタロプラムまたはCELEXAの不活性成分に対する既知の過敏症を有する。反応には、血管性浮腫およびアナフィラキシーが含まれている[参照 有害反応 ]。
臨床薬理学
作用機序
シタロプラムの作用機序は不明ですが、中枢神経系 (CNS) におけるセロトニン (5-HT) の再取り込みを阻害することにより、中枢神経系 (CNS) におけるセロトニン活性の増強に関連していると推定されています。
薬力学
動物での in vitro および in vivo 研究は、シタロプラムが選択的セロトニン再取り込み阻害剤 (SSRI) であり、ノルエピネフリン (NE) およびドーパミン (DA) ニューロン再取り込みに対する影響が最小限であることを示唆しています。
シタロプラムは、5-HT1A、5-HT2A、ドーパミン D1 および D2、α1-、α2-、および β-アドレナリン受容体、ヒスタミン H1、ガンマアミノ酪酸 (GABA)、ムスカリン性コリン作動性受容体、およびベンゾジアゼピン受容体に対して親和性がないか、非常に低いです。
心臓電気生理学
個別に修正された QTc (QTcNi) 間隔は、無作為化、プラセボおよびアクティブ (モキシフロキサシン 400 mg) 制御クロスオーバーで評価され、119 人の健康な被験者を対象にエスカレートする複数回投与試験が実施されました。プラセボとの最大平均 (95% 片側信頼区間の上限) の差は、20 mg および 60 mg (最大推奨用量の 1.5 倍) のシタロプラムで、それぞれ 8.5 (10.8) および 18.5 (21.0) ミリ秒でした。確立された暴露反応関係に基づいて、40 mg の用量の Cmax でのプラセボからの予測 QTcNi 変化 (95% 片側信頼区間の上限) は 12.6 (14.3) ミリ秒です [参照 警告と注意事項 ]。
薬物動態
シタロプラムの単回投与および複数回投与の薬物動態は、10 ~ 40 mg/日の用量範囲で直線的かつ用量比例的です。シタロプラムの生体内変化は主に肝臓で起こり、平均終末半減期は約 35 時間です。 1 日 1 回の投与で、約 1 週間以内に定常状態の血漿濃度が達成されます。定常状態では、半減期に基づく血漿中のシタロプラムの蓄積の程度は、単回投与後に観察される血漿濃度の 2.5 倍であると予想されます。
吸収
シタロプラムの単回経口投与 (40 mg 錠剤) に続いて、血中濃度のピークは約 4 時間で発生します。シタロプラムの絶対的なバイオアベイラビリティは、静脈内投与と比較して約 80% であり、吸収は食物の影響を受けません。
分布
シタロプラムの分布量は約 12 L/kg であり、シタロプラム (CT)、デメチルシタロプラム (DCT)、およびジデメチルシタロプラム (DDCT) のヒト血漿タンパク質への結合は約 80% です。
排除
代謝
シタロプラムは、デメチルシタロプラム (DCT)、ジデメチルシタロプラム (DDCT)、シタロプラム-N-オキシド、および脱アミノ化プロピオン酸誘導体に代謝されます。ヒトでは、未変化のシタロプラムが血漿中の主要な化合物です。定常状態では、血漿中のシタロプラムの代謝産物である DCT と DDCT の濃度は、親薬の濃度のそれぞれ約 2 分の 1 と 10 分の 1 です。インビトロ研究は、シタロプラムがセロトニン再取り込みの阻害においてその代謝産物よりも少なくとも8倍強力であることを示しており、評価された代謝産物がシタロプラムの抗うつ作用に有意に寄与しない可能性が高いことを示唆しています.
ヒト肝ミクロソームを使用した in vitro 研究では、CYP3A4 と CYP2C19 がシタロプラムの N-脱メチル化に関与する主要なアイソザイムであることが示されました。
排泄
シタロプラムの静脈内投与後、シタロプラムおよび DCT として尿中に回収された薬物の割合は、それぞれ約 10% および 5% でした。シタロプラムの全身クリアランスは 330 mL/min で、その約 20% が腎クリアランスによるものでした。
特定の集団
高齢患者
60 歳以上の被験者におけるシタロプラムの薬物動態は、2 つの通常のボランティア研究で若い被験者と比較されました。単回投与研究では、シタロプラムの AUC と半減期は、60 歳以上の被験者でそれぞれ 30% と 50% 増加しましたが、複数回投与研究では、それぞれ 23% と 30% 増加しました[見る 投薬と管理 、 警告と注意事項 、 特定の集団での使用 ]。
男性と女性の患者
つの薬物動態研究 (合計 N = 32) では、女性のシタロプラム AUC は男性の 1.5 倍から 2 倍でした。この違いは、他の 5 つの薬物動態研究 (合計 N = 114) では観察されませんでした。臨床研究では、男性 (N=237) と女性 (N=388) の間で、定常状態の血清シタロプラム レベルに違いは見られませんでした。 DCT と DDCT の薬物動態に性差はありませんでした。
肝障害のある患者
シタロプラムの経口クリアランスは 37% 減少し、肝機能が低下した患者では、正常な被験者と比較して半減期が 2 倍になりました [参照 投薬と管理 、 警告と注意事項 、 特定の集団での使用 ]。
腎障害のある患者
軽度から中等度の腎障害のある患者では、シタロプラムの経口クリアランスは正常な被験者と比較して 17% 減少しました。そのような患者に対する投与量の調整は推奨されません。重度の腎機能障害 (クレアチニンクリアランス
CYP2C19 代謝不良者
CYP2C19 代謝不良者では、シタロプラムの定常状態の Cmax と AUC がそれぞれ 68% と 107% 増加しました [参照 投薬と管理 、 警告と注意事項 ]。
CYP2D6 代謝不良者
シタロプラムの定常状態レベルは、CYP2D6 の低代謝者と高代謝者で有意差はありませんでした。
薬物相互作用研究
in vitro 酵素阻害データは、CYP3A4、-2C9、または -2E1 に対するシタロプラムの阻害効果を明らかにしませんでしたが、CYP1A2、-2D6、および -2C19 の弱い阻害剤であることを示唆しました。シタロプラムは、これらの酵素によって媒介される in vivo 代謝に対してほとんど阻害効果を持たないと予想されます。ただし、この問題に対処する in vivo データは限られています。
CYP3A4 および CYP2C19 阻害剤
CYP3A4 と CYP2C19 はシタロプラムの代謝に関与する主要な酵素であるため、CYP3A4 の強力な阻害剤 (ケトコナゾール、イトラコナゾール、マクロライド系抗生物質など) や CYP2C19 の阻害剤 (オメプラゾール、シメチジンなど) は、シタロプラムのクリアランスを減少させる可能性があると予想されます。シタロプラム。ただし、シタロプラムと強力な CYP3A4 阻害剤であるケトコナゾールの同時投与は、シタロプラムの薬物動態に有意な影響を与えませんでした。 QT 延長のリスクがあるため、シメチジンまたは別の CYP2C19 阻害剤を併用している患者では、1 日 20 mg がシタロプラムの最大推奨用量です。 投薬と管理 、 警告と注意事項 ]。
シメチジン
セレクサ 10mg 40mg/日を 21 日間投与された被験者では、シメチジン 400mg を 1 日 2 回、8 日間併用投与すると、シタロプラムの AUC と Cmax がそれぞれ 43% と 39% 増加しました [参照 投薬と管理 、 警告と注意事項 、 薬物相互作用 ]。
CYP2D6阻害剤
CYP2D6 を阻害する薬剤とシタロプラムの同時投与は、CYP2D6 の低代謝者における研究結果に基づいて、シタロプラムの代謝に臨床的に重大な影響を与える可能性は低いです。
ジゴキシン
40mg/日のセレクサ20mgを21日間投与された被験者では、セレクサとジゴキシンの併用投与(1mgの単回投与)は、シタロプラムまたはジゴキシンの薬物動態に有意な影響を与えませんでした。
リチウム
CELEXA (40 mg/日を 10 日間) とリチウム (30 mmol/日を 5 日間) の同時投与は、シタロプラムまたはリチウムの薬物動態に有意な影響を与えませんでした。
ピモジド
対照研究では、ピモジド 2 mg とシタロプラム 40 mg を 1 日 1 回 11 日間併用投与すると、ピモジド単独投与と比較して約 10 ミリ秒の QTc 値の平均増加が見られました。シタロプラムは、ピモジドの平均 AUC または Cmax を変化させませんでした。この薬力学的相互作用のメカニズムは知られていない [ 禁忌 、 警告と注意事項 ]。
テオフィリン
CELEXA (40 mg/日を 21 日間) と CYP1A2 基質であるテオフィリン (300 mg の単回投与) の併用投与は、テオフィリンの薬物動態に影響を与えませんでした。シタロプラムの薬物動態に対するテオフィリンの効果は評価されなかった。
ワルファリン
40 mg/日のセレクサを 21 日間投与しても、CYP3A4 基質であるワルファリンの薬物動態に影響はありませんでした。プロトロンビン時間は 5% 増加しましたが、その臨床的意義は不明です。
カルバマゼピン
CELEXA (40 mg/日で 14 日間) とカルバマゼピン (400 mg/日で 35 日間) の併用投与は、CYP3A4 基質であるカルバマゼピンの薬物動態に有意な影響を与えませんでした。シタロプラムのトラフ血漿レベルは影響を受けませんでしたが、カルバマゼピンの酵素誘導特性を考えると、2 つの薬剤を併用する場合、カルバマゼピンがシタロプラムのクリアランスを増加させる可能性を考慮する必要があります。
トリアゾラム
CELEXA (40 mg/日で 28 日間漸増) と CYP3A4 基質であるトリアゾラム (0.25 mg の単回投与) の併用投与は、シタロプラムまたはトリアゾラムのいずれの薬物動態にも有意な影響を与えませんでした。
ケトコナゾール
セレクサ(40 mg)とケトコナゾール(200 mg)の併用投与は、ケトコナゾールの Cmax と AUC をそれぞれ 21% と 10% 減少させ、シタロプラムの薬物動態に有意な影響を与えませんでした。
メトプロロール
40 mg/日のセレクサ 20 mg を 22 日間投与すると、ベータアドレナリン遮断薬であるメトプロロールの血漿レベルが 2 倍に増加しました。メトプロロール血漿レベルの上昇は、心選択性の低下と関連しています。 CELEXA 10mgとメトプロロールの同時投与は、血圧や心拍数に臨床的に有意な影響を与えませんでした.
イミプラミンおよびその他の三環系抗うつ薬 (TCA)
インビトロ研究は、シタロプラムが CYP2D6 の比較的弱い阻害剤であることを示唆しています。 CYP2D6 の基質である TCA イミプラミン (100 mg の単回投与) とセレクサ (40 mg/日を 10 日間) の同時投与は、イミプラミンまたはシタロプラムの血漿濃度に有意な影響を与えませんでした。しかし、イミプラミン代謝産物であるデシプラミンの濃度は約 50% 増加しました。デシプラミンの変化の臨床的意義は不明です。
動物毒物学および/または薬理学
ラットの網膜の変化
シタロプラムを用いた 2 年間の発がん性試験で、アルビノラットの網膜に病理学的変化 (変性/萎縮) が観察されました。 80 mg/kg/日を投与された雄と雌の両方のラットで、網膜病変の発生率と重症度の両方が増加しました。これは、mg/m² の体表面積に基づいて、40 mg の MRHD の約 19 倍です。同様の所見は、24 mg/kg/日の用量で 2 年間投与されたラット、240 mg/kg/日までの用量で 18 か月間投与されたマウス、または 240 mg/kg/日までの用量で 1 年間投与されたイヌには見られなかった。 20 mg/kg/日、これは mg/m² の体表面積に基づいて、それぞれ MRHD の約 6、29、および 17 倍です。
この病理のメカニズムを調査するための追加の研究は行われておらず、ヒトにおけるこの影響の潜在的な重要性は確立されていません。
臨床研究
大うつ病性障害の治療薬としてのセレクサの有効性は、大うつ病のDSM-IIIまたはDSM-III-R基準を満たす成人外来患者(18~66歳)を対象とした2つのプラセボ対照試験(4~6週間)で確立されました。障害(MDD)(研究1および2)。
患者が毎日10mg、20mg、40mg、および60mgの一定用量のCELEXA 10mgを投与された6週間の試験である研究1は、CELEXA 40を毎日および60mgを毎日(最大推奨1日用量の1.5倍)投与したことを示しました。ハミルトンうつ病評価尺度(HAMD)の合計スコア、主要な有効性エンドポイントによって測定される有効性。 HAMD-17 は、抑うつ症状の重症度を評価するために使用される 17 項目の臨床医評価尺度です。 HAMD-17 のスコアは 0 ~ 52 の範囲で、スコアが高いほどうつ病が深刻であることを示します。この研究では、10 mg および 20 mg の 1 日用量の明らかな効果は示されず、1 日 60 mg の用量は 40 mg の 1 日用量より効果的ではありませんでした。 QTc 延長および心室性不整脈のリスクがあるため、CELEXA 10mg の最大推奨用量は 1 日 1 回 40mg です。
MDD 患者を対象とした 4 週間のプラセボ対照試験である研究 2 では、初回用量は 1 日 20 mg で、その後、最大耐用量または 1 日最大用量 80 mg (最大推奨 1 日用量の 2 倍) まで漸増しました。 )。 CELEXA 20mgで治療された患者は、主要な有効性評価項目であるHAMD合計スコアにおいて、プラセボ患者よりも統計的に有意に大きな改善を示しました. MDD 患者を対象とした 3 つの追加のプラセボ対照試験では、CELEXA を投与された患者とプラセボを投与された患者の間の治療に対する反応の差は統計的に有意ではありませんでした。
2つの長期研究では、急性期治療の最初の6週間または8週間でCELEXA 10mgに反応したMDD患者が、CELEXA 10mgまたはプラセボの継続に無作為に割り付けられました。 1 つの研究では、患者は毎日固定用量のセレクサ 20 mg または 40 mg を投与され、2 つ目の研究では、患者は毎日 20 mg から 60 mg までの可変用量のセレクサ (最大推奨 1 日用量の 1.5 倍) を投与されました。どちらの研究でも、CELEXA 治療を継続した患者は、プラセボを投与した患者と比較して、その後 6 か月間の再発率が統計的に有意に低かった.固定用量試験では、1日20mgまたは40mgのCELEXAを投与された患者で、うつ病再発率の低下は同程度でした。 QTc 延長および心室性不整脈のリスクがあるため、CELEXA 20mg の最大推奨用量は 1 日 1 回 40mg です。
治療結果と年齢、性別、および人種との関係の分析では、これらの患者の特徴に基づいた反応性の違いは示唆されませんでした。
患者情報
セレクサ® (Suh-leks-uh) (シタロプラム) 錠剤、経口用
CELEXAについて知っておくべき最も重要な情報は何ですか?
CELEXA 20mg は、次のような重大な副作用を引き起こす可能性があります。
- 自殺念慮や自殺行動のリスクの増加。 CELEXA 10mgおよび他の抗うつ薬は、一部の子供、青年、および若年成人の自殺念慮および行動を増加させる可能性があります 特に治療の最初の数ヶ月間または用量が変更されたとき。セレクサは小児には使用できません。
- うつ病やその他の精神疾患は、自殺念慮や自殺行動の最も重要な原因です。
自分や家族の自殺念慮や自殺行為を監視し、防止するにはどうすればよいですか?
- あらゆる変化、特に気分、行動、思考、感情の突然の変化、または自殺念慮や行動に発展した場合は、細心の注意を払ってください。これは、抗うつ薬の服用を開始するとき、または用量を変更するときに非常に重要です。
- すぐに医療提供者に電話して、気分、行動、思考、または感情の新しい変化または突然の変化を報告してください。
- 医療提供者とのすべてのフォローアップ訪問は、予定どおりに行ってください。特に症状について懸念がある場合は、必要に応じて訪問の合間に医療提供者に電話してください。
あなたまたはあなたの家族に次のような症状がある場合、特に新しい症状、悪化している症状、または心配している症状がある場合は、すぐに医療提供者に連絡するか、緊急医療の助けを受けてください。
- 自殺や死についての考え
- 新しいまたは悪化したうつ病
- 非常に動揺している、または落ち着きがない
- 寝つきが悪い(不眠症)
- 攻撃的、怒っている、または暴力的である
- 活動や会話の極端な増加 (躁病)
- 自殺しようとする
- 新しいまたは悪化した不安
- 危険な衝動で行動する
- パニック発作
- 新しいまたは悪化した過敏症
- 行動や気分のその他の異常な変化
セレクサとは?
CELEXA 10mg は、成人の大うつ病性障害 (MDD) と呼ばれる特定のタイプのうつ病の治療に使用される処方薬です。
CELEXA 10mgが子供に安全で効果的であるかどうかは不明です.
セレクサを服用してはいけない人は?
次の場合はセレクサを服用しないでください。
- モノアミンオキシダーゼ阻害剤(MAOI)を服用する
- 過去14日間でMAOIの服用をやめた
- 抗生物質リネゾリドまたは静脈内メチレンブルーで治療されている
- ピモジドを服用する
- シタロプラムまたはCELEXAのいずれかの成分にアレルギーがある. CELEXA の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
リネゾリドや静脈内メチレン ブルーなどの MAOI を含む MAOI を服用しているかどうかがわからない場合は、医療提供者または薬剤師に尋ねてください。
CELEXAによる治療を中止した後、少なくとも14日間はMAOIの服用を開始しないでください.
CELEXA を服用する前に、以下の場合を含め、すべての病状について医療提供者に伝えてください。
- 自殺、うつ病、双極性障害、躁病または軽躁病の家族歴がある、または家族歴がある
- QT延長と呼ばれる不整脈がある
- 心臓発作、心不全、不整脈、QT延長症候群などの心臓の問題がある、またはあった
- 血液中のカリウム、マグネシウム、またはナトリウムのレベルが低い
- 出血の問題がある、またはあった
- 発作(けいれん)がある、またはあった
- 眼圧が高い(緑内障)
- 腎臓または肝臓に問題がある、またはあった
- 妊娠している、または妊娠する予定がある。 CELEXA 20mg は胎児に害を及ぼす可能性があります。妊娠後期にCELEXAを服用すると、新生児に特定の問題が発生するリスクが高まる可能性があります.妊娠中にうつ病を治療することのリスクと利点について、担当の医療提供者に相談してください。
- CELEXAの治療中に妊娠した場合、または妊娠の可能性があると思われる場合は、すぐに医療提供者に伝えてください.
- 妊娠中にCELEXAにさらされた女性のための妊娠登録があります.レジストリの目的は、CELEXA にさらされた女性とその赤ちゃんの健康に関する情報を収集することです。 CELEXA 10mgによる治療中に妊娠した場合は、抗うつ薬の国家妊娠登録簿への登録について医療提供者に相談してください. 1-844-405-6185 に電話するか、オンラインで https://womensmentalhealth.org/research/pregnancyregistry/antidepressants にアクセスして登録できます。
- 授乳中または授乳を計画している。 CELEXA が母乳に移行するかどうかは不明です。 CELEXA による治療中の赤ちゃんへの最良の授乳方法については、かかりつけの医療提供者にご相談ください。
- CELEXA 20mgの治療中に母乳育児をしている場合、赤ちゃんが眠気やむずかしさを感じたり、授乳や体重の増加がうまくいかなかったりした場合は、すぐに医療提供者に連絡してください.
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
CELEXA 10mgと他の薬は互いに影響し合い、深刻な副作用を引き起こす可能性があります. CELEXA は他の医薬品の作用に影響を与える可能性があり、他の医薬品は CELEXA の作用に影響を与える可能性があります。
特に以下を服用している場合は、医療提供者に伝えてください。
- トリプタンとして知られる片頭痛の治療に使用される薬
- 三環系抗うつ薬
- フェンタニル
- リチウム
- トラマドール
- トリプトファン
- ブスピロン
- アンフェタミン
- セントジョーンズワート
- アスピリン、非ステロイド性抗炎症薬(NSAID)、ワルファリンなどの血液凝固に影響を与える可能性のある薬
- 利尿剤
- メタドン
- ガチフロキサシンまたはモキシフロキサシン
- 心拍数またはリズムを制御するために使用される薬(抗不整脈薬)
- 選択的セロトニン再取り込み阻害剤(SSRI)およびセロトニン・ノルエピネフリン再取り込み阻害剤(SNRI)を含む、気分、不安、精神病または思考障害の治療に使用される医薬品
これらの薬を服用しているかどうかわからない場合は、医療提供者に尋ねてください。他の医薬品と一緒にCELEXA 10mgを服用しても安全かどうかは、かかりつけの医療提供者が教えてくれます。
最初に医療提供者に相談することなく、CELEXAによる治療中に他の薬を開始または停止しないでください.セレクサを急に中止すると、重篤な副作用が生じることがあります。見る、 「CELEXA の副作用にはどのようなものがありますか?」
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医療従事者や薬剤師に見せてください。
セレクサ10mgはどのように服用すればよいですか?
- 担当の医療提供者が指示したとおりに、CELEXA 20mg を服用してください。最初に医療提供者に相談せずに、用量を変更したり、CELEXA の服用を中止したりしないでください。
- 担当の医療提供者は、CELEXA の用量があなたにとって適切な用量になるまで変更する必要がある場合があります。
- 食事の有無にかかわらず、CELEXA を 1 日 1 回服用してください。
- CELEXA 20mg の服用量が多すぎる場合は、医療提供者または毒物管理センター (1-800-222-1222) に電話するか、すぐに最寄りの病院の緊急治療室に行ってください。
CELEXA 20mgの副作用の可能性は?
CELEXA は、次のような重大な副作用を引き起こす可能性があります。
- 見る、 「CELEXAについて知っておくべき最も重要な情報は何ですか?」
- 心臓のリズムの問題。 CELEXA は、心臓の鼓動に重大な変化 (速いまたは不規則な鼓動) を引き起こし、死に至る可能性があります。気絶したり気絶したり、心拍に変化があった場合は、すぐに医療提供者に伝えてください。
- セロトニン症候群。 CELEXAを服用すると、セロトニン症候群と呼ばれる生命を脅かす可能性のある問題を引き起こす可能性があります.セロトニン症候群を発症するリスクは、CELEXA 20mg を特定の他の医薬品と一緒に服用すると増加します。見る、 「セレクサを服用してはいけない人は?」医療提供者に電話するか、すぐに最寄りの病院の緊急治療室に行きます 次のようなセロトニン症候群の徴候や症状がある場合:
- 攪拌
- 現実ではないものを見たり聞いたりする(幻覚)
- 錯乱
- 昏睡
- 速い心拍
- 血圧の変化
- めまい
- 発汗
- フラッシング
- 高体温(高熱)
- 震え、筋肉のこわばり、または筋肉のけいれん
- 協調性の喪失
- 発作
- 吐き気、嘔吐、下痢
- 出血のリスクが高まります。 アスピリン、非ステロイド系抗炎症薬(NSAID)、ワルファリン、または血液希釈剤と一緒にCELEXA 20mgを服用すると、このリスクが高まる可能性があります.異常な出血やあざがあれば、すぐに医療提供者に伝えてください。
- 躁病エピソード。 躁病エピソードは、CELEXA を服用している双極性障害の人に発生する可能性があります。症状には次のものがあります。
- 大幅に増加したエネルギー
- 重度の睡眠障害
- レーシング思考
- 無謀な行動
- 異常に壮大なアイデア
- 過度の幸福または過敏症
- いつもより多くまたは速く話す
- 中断症候群。 セレクサ 20mg を突然中止すると、深刻な副作用が発生する可能性があります。あなたの医療提供者は、あなたの線量をゆっくりと減らしたいと思うかもしれません。症状には次のものがあります。
- 吐き気
- 発汗
- 気分の変化
- 頭痛
- 過敏性と動揺
- 疲れ
- めまい
- 睡眠の問題
- 電撃感覚(感覚異常)
- 軽躁病
- 不安
- 耳鳴り(耳鳴り)
- 錯乱
- 発作
- 発作(けいれん)。
- 目の問題 (閉塞隅角緑内障)。 CELEXAを含む多くの抗うつ薬は、閉塞隅角緑内障と呼ばれる特定のタイプの眼の問題を引き起こす可能性があります.視力の変化や目の痛みがある場合は、医療提供者に連絡してください。
- 血中のナトリウム濃度が低い(低ナトリウム血症)。 血中のナトリウム濃度が低いと深刻な場合があり、死に至る場合があります。高齢者は、このリスクが高くなる可能性があります。 CELEXAによる治療中に血液中のナトリウム濃度が低い兆候や症状が現れた場合は、すぐに医療提供者に伝えてください.血液中のナトリウム濃度が低い場合の徴候や症状には、次のようなものがあります。
- 頭痛
- 集中困難
- 記憶の変化
- 錯乱
- 転倒につながる可能性のある足の脱力感と不安定さ
重症またはより突然の症例では、徴候と症状には次のようなものがあります。
-
- 幻覚(現実ではないものを見たり聞いたりする)
- 失神
- 発作
- 昏睡
- 息が止まる
- 死
- 性的問題 (機能不全)。 セレクサを含む選択的セロトニン再取り込み阻害薬(SSRI)を服用すると、性的問題を引き起こす可能性があります。
男性の症状には次のようなものがあります。
- 射精が遅い、または射精できない
- 性欲の低下
- 勃起の獲得または維持の問題
女性の症状には次のようなものがあります。
- 性欲の低下
- オルガスムの遅延またはオルガスムを得ることができない
性機能に何らかの変化が生じた場合、または DRIZALMA SPRINKLE による治療中に性的問題について質問や懸念がある場合は、医療提供者に相談してください。あなたの医療提供者が提案できる治療法があるかもしれません。
セレクサの最も一般的な副作用は射精遅延です。
これらはCELEXAの考えられるすべての副作用ではありません.
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
セレクサの保管方法は?
- CELEXA は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
- セレクサ 20mg とすべての薬は子供の手の届かないところに保管してください。
CELEXAの安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態でCELEXA 20mgを使用しないでください。他の人があなたと同じ症状を持っていても、CELEXA を他の人に与えないでください。それらに害を及ぼす可能性があります。医療従事者向けに書かれたCELEXAに関する情報については、担当の医療提供者または薬剤師にお尋ねください。
セレクサの成分は?
有効成分: シタロプラム臭化水素酸塩
不活性成分: コポリビドン、コーンスターチ、クロスカルメロースナトリウム、グリセリン、ラクトース一水和物、ステアリン酸マグネシウム、ヒプロメロース、微結晶セルロース、ポリエチレングリコール、二酸化チタン、着色用二酸化鉄。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
