Provera 5mg, 10mg Medroxyprogesterone 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
プロベラとは何ですか?
Provera 10mg は、多量の月経出血、無月経または不規則な月経出血、および避妊の症状を治療するために使用される処方薬です。 Provera 10mg は、単独で使用することも、他の薬と併用することもできます。
Provera 5mg は、抗腫瘍薬、ホルモン、プロゲスチンと呼ばれる種類の薬に属しています。
プロベラが子供に安全で効果があるかどうかはわかっていません。
プロベラ 10mg の副作用の可能性は何ですか?
プロベラ 5mg は、次のような重大な副作用を引き起こす可能性があります。
- 性器出血(すでに閉経している場合)、
- 立ちくらみ、
- 乳房のしこり、
- うつ、
- 睡眠障害(不眠症)、
- めまい、
- 気分の変化、
- 頭痛、
- 熱、
- 皮膚や目の黄変(黄疸)、
- 手、足首、足のむくみ、
- 胸の痛みや圧迫感、
- あごや肩に広がる痛み
- 吐き気、
- 発汗、
- 突然のしびれや衰弱、
- 突然の激しい頭痛、
- ろれつが回らない、
- 視力の問題、
- バランスの問題、
- 突然の咳、
- 喘鳴、
- 速い呼吸、
- 喀血、そして
- 腫れ、熱感、発赤を伴う脚 (または両方) の痛み
上記の症状がある場合は、すぐに医療機関を受診してください。
プロベラ 10mg の最も一般的な副作用は次のとおりです。
- 点状出血または破綻出血、
- 月経周期の変化、
- 膣のかゆみや分泌物、
- 乳房の圧痛または分泌物、
- 頭痛、
- めまい、
- 緊張したり、落ち込んだり、
- 静脈のあざや腫れ、
- 膨満感、
- 体液貯留、
- 気分の変化、
- 睡眠障害(不眠症)、
- かゆみ、
- 発疹、
- にきび、
- 髪の伸び、
- 頭髪の喪失、
- 胃の不快感、
- 膨満感、
- 吐き気、
- 体重増加、および
- 視力の変化またはコンタクトレンズの装用困難
警告
エストロゲンとプロゲスチンによる心血管障害、乳がん、認知症の可能性
心血管疾患と認知症の可能性
エストロゲンとプロゲスチンの併用療法は、心血管疾患や認知症の予防には使用しないでください。 (見る 臨床研究 と 警告 、 心血管疾患と認知症の可能性 .)
Women's Health Initiative (WHI) のエストロゲンとプロゲスチンに関するサブスタディでは、閉経後の女性 (50 歳から 79 歳まで) における深部静脈血栓症 (DVT)、肺塞栓症 (PE)、脳卒中、心筋梗塞 (MI) のリスク増加が報告されています。 ) 5.6 年間の毎日の経口抱合型エストロゲン (CE) [0.625 mg] と酢酸メドロキシプロゲステロン (MPA) [2.5 mg] の併用による治療で、プラセボと比較。 (見る 臨床研究 と 警告 、 心血管疾患 .)
WHI メモリー研究 (WHIMS) のエストロゲンとプロゲスチンの補助的研究では、65 歳以上の閉経後女性において、4 年間の毎日の CE (0.625 mg) と MPA (2.5 mg) の組み合わせによる治療中に認知症を発症するリスクが増加したことが報告されました。プラシーボに。この所見が閉経後の若い女性に当てはまるかどうかは不明です。 (見る 臨床研究 と 警告 、 認知症の可能性 と 予防 、 高齢者の使用 .)
乳がん
WHI エストロゲンとプロゲスチンのサブスタディでは、浸潤性乳がんのリスクが増加することが示されました。 (見る 臨床研究 と 警告 、 悪性新生物 、 乳がん .)
比較可能なデータがない場合、これらのリスクは、CE と MPA の他の用量、およびエストロゲンとプロゲスチンの他の組み合わせと剤形についても同様であると想定する必要があります。
エストロゲンを含むプロゲスチンは、個々の女性の治療目標とリスクに一致する最小の有効用量と最短の期間で処方されるべきです.
説明
プロベラ®錠には、プロゲステロンの誘導体である酢酸メドロキシプロゲステロンが含まれています。白色からオフホワイトの無臭の結晶性粉末で、空気中で安定で、200 ~ 210°C で融解します。クロロホルムに溶けやすく、アセトンまたはジオキサンに溶けにくく、アルコールまたはメタノールにやや溶けにくく、エーテルに溶けにくく、水に溶けにくい。
酢酸メドロキシプロゲステロンの化学名は、プレグン-4-エン-3、20-ジオン、17-(アセチルオキシ)-6-メチル-、(6α)-です。構造式は次のとおりです。
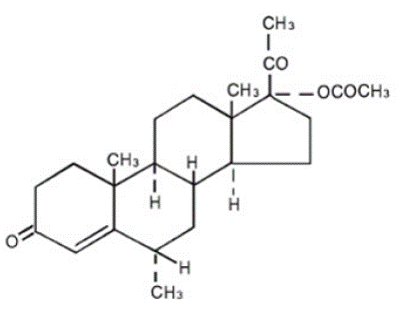
経口投与用の各プロベラ 5 mg 錠剤には、2.5 mg、5 mg、または 10 mg の酢酸メドロキシプロゲステロンと、次の不活性成分が含まれています: ステアリン酸カルシウム、コーンスターチ、ラクトース、ミネラルオイル、ソルビン酸、スクロース、およびタルク。 2.5mg錠にはFD&C黄色6号が含まれています。
適応症
プロベラ 5mg 錠剤は、子宮筋腫や子宮がんなどの器質的病変がなく、ホルモンの不均衡による二次性無月経および異常な子宮出血の治療に適応されます。それらは、共役型エストロゲン 0.625 mg 錠剤を毎日経口投与されている子宮摘出術を受けていない閉経後女性の子宮内膜過形成の予防にも使用されます。
投薬と管理
続発性無月経
プロベラ 10mg 錠剤は、1 日 5 または 10 mg を 5 ~ 10 日間服用できます。内因性または外因性のエストロゲンのいずれかで適切にプライミングされた子宮内膜の最適な分泌変換を誘導するための用量は、10日間、毎日10mgのプロベラ10mgです。続発性無月経の場合、治療はいつでも開始できます。プロゲスチン離脱出血は、通常、プロベラ 10mg 治療を中止してから 3 ~ 7 日以内に発生します。
器質的病理がない場合のホルモンの不均衡による異常な子宮出血
月経周期の計算された 16 日目または 21 日目から始めて、プロベラ 10mg の 5 または 10 mg を 5 ~ 10 日間毎日投与することができます。内因性または外因性のエストロゲンで適切にプライミングされた子宮内膜の最適な分泌変換を生成するには、周期の 16 日目から 10 日間、毎日 10 mg のプロベラ 10 mg を摂取することをお勧めします。プロゲスチン離脱出血は、通常、プロベラによる治療を中止してから 3 ~ 7 日以内に発生します。異常な子宮出血の再発エピソードの過去の病歴を持つ患者は、PROVERA を使用した計画的な月経周期から恩恵を受ける可能性があります。
毎日 0.625 mg の抱合型エストロゲンを投与されている閉経後の女性における子宮内膜増殖症の減少
子宮のある閉経後の女性にエストロゲンが処方される場合、子宮内膜がんのリスクを軽減するためにプロゲスチンも開始する必要があります。子宮のない女性にはプロゲスチンは必要ありません。エストロゲンを単独で、またはプロゲスチンと組み合わせて使用する場合は、個々の女性の治療目標とリスクに合わせて、最小の有効用量と最短の期間で使用する必要があります.患者は、治療がまだ必要かどうかを判断するために、臨床的に適切である限り定期的に (例えば、3 ~ 6 か月間隔で) 再評価する必要があります (以下を参照)。 警告 )。子宮を有する女性の場合、子宮内膜サンプリングなどの適切な診断手段を講じて、診断されていない持続性または再発性膣出血の場合に悪性を除外する必要があります。
PROVERA 錠は、周期の 1 日目または周期の 16 日目に開始して、毎日 0.625 mg の抱合型エストロゲンを摂取している閉経後の女性に、月に 12 ~ 14 日間連続して 5 mg または 10 mg の用量で投与することができます。
患者は最低用量で開始する必要があります。
プロベラの最低有効用量は決定されていません。
供給方法
プロベラ錠10mg 次の強度とパッケージ サイズで利用できます。
2.5mg (スコアリング、ラウンド、オレンジ)
30本のボトル NDC 0009-0064-06 100本入 NDC 0009-0064-04
5mg (スコア、六角、白)
100本のボトル NDC 0009-0286-03
10mg (スコアリング、ラウンド、ホワイト)
100本のボトル NDC 0009-0050-02 500本入 NDC 0009-0050-11
20° ~ 25°C (68° ~ 77°F) に制御された室温で保管してください [参照 USP ]。
"小児の手の届かない場所に保管"
販売元: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. 改訂: 2015 年 8 月
副作用
見る 囲み警告 、 警告 、 と 予防 .
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
エストロゲン治療を併用せずに、プロベラ 10mg 錠を服用している女性では、次の副作用が報告されています。
泌尿生殖器系
異常な子宮出血(不規則、増加、減少)、月経量の変化、破綻出血、斑点、無月経、子宮頸部びらんおよび頸部分泌物の変化。
胸
乳房の圧痛、乳房痛、または乳汁漏出症が報告されています。
心臓血管
血栓性静脈炎や肺塞栓症などの血栓塞栓症が報告されています。
胃腸
吐き気、胆汁うっ滞性黄疸。
肌
蕁麻疹、かゆみ、浮腫、および全身性の発疹からなる過敏反応が発生しています。にきび、蕁麻疹、かゆみ、浮腫、および全身性の発疹からなる過敏反応が発生しました。にきび、脱毛症、多毛症が報告されています。
目
網膜血栓症や視神経炎などの神経眼病変。
中枢神経系
精神の落ち込み、不眠症、傾眠、めまい、頭痛、神経過敏。
その他
過敏症反応(例えば、アナフィラキシーおよびアナフィラキシー様反応、血管性浮腫)、かゆみを伴うまたは伴わない発疹(アレルギー性)、体重の変化(増加または減少)、発熱、浮腫/体液貯留、疲労、耐糖能の低下。
エストロゲン+プロゲスチン療法では、以下の副作用が報告されています。
泌尿生殖器系
異常な子宮出血/斑点、または流れ;破過出血;スポッティング;月経困難症/骨盤痛;子宮平滑筋腫のサイズの増加;膣カンジダ症を含む膣炎;子宮頸管分泌量の変化;子宮頸部外反の変化;卵巣がん;子宮内膜増殖症;子宮内膜癌。
胸
優しさ、肥大、痛み、乳頭分泌物、乳汁漏出;線維嚢胞性乳房の変化;乳がん。
心臓血管
深部および表在静脈血栓症;肺塞栓症;血栓性静脈炎;心筋梗塞;脳卒中;血圧の上昇。
胃腸
吐き気、嘔吐;腹部のけいれん、膨満感;胆汁うっ滞性黄疸;胆嚢疾患の発生率の増加;膵炎;肝血管腫の拡大。
肌
薬物を中止しても持続する可能性のある肝斑または黒皮症;多形紅斑;結節性紅斑;出血性発疹;頭皮の毛の喪失;多毛症;かゆみ、かぶれ。
目
網膜血管血栓症、コンタクトレンズ不耐性。
中枢神経系
頭痛;片頭痛;めまい;精神的うつ病;舞踏病;緊張感;気分障害;過敏性;てんかん、認知症の悪化。
その他
体重の増減;炭水化物耐性の低下;ポルフィリン症の悪化;浮腫;関節痛;足のけいれん;性欲の変化;蕁麻疹、血管性浮腫、アナフィラキシー/アナフィラキシー反応;低カルシウム血症;喘息の悪化;トリグリセリドの増加。
薬物相互作用
薬物検査の相互作用
以下の臨床検査結果は、エストロゲンとプロゲスチン療法の使用によって変化する可能性があります。
警告
の一部として含まれています 予防 セクション。
見る 囲み警告 .
心血管疾患
エストロゲンとプロゲスチンの併用療法では、PE、DVT、脳卒中、心筋梗塞のリスクが高まることが報告されています。これらのイベントのいずれかが発生したり、疑われる場合は、エストロゲンとプロゲスチンの併用療法を直ちに中止する必要があります。
動脈血管疾患(高血圧、糖尿病、喫煙、高コレステロール血症、肥満など)および/または静脈血栓塞栓症(VTE)(VTEの既往歴または家族歴、肥満、全身性エリテマトーデスなど)の危険因子適切に管理する必要があります。
脳卒中
WHI エストロゲンとプロゲスチンのサブスタディでは、CE (0.625 mg) と MPA (2.5 mg) を投与された 50 ~ 79 歳の女性で、プラセボ (33 対10,000 女性年当たり 25)。 (見る 臨床研究 .) リスクの増加は、最初の 1 年後に実証され、持続しました。脳卒中が発生した場合、またはその疑いがある場合は、エストロゲンとプロゲスチンの併用療法を直ちに中止する必要があります。
冠状動脈性心臓病
WHI エストロゲンとプロゲスチンのサブスタディでは、CE (0.625 mg) と MPA (2.5 mg) を毎日投与した女性では、プラセボを投与した女性と比較して、CHD イベントのリスクが統計的に有意ではないが増加したことが報告されました (女性年 10,000 人あたり 41 対 34)。 )。相対リスクの増加は 1 年目に示され、相対リスクの減少傾向は 2 年目から 5 年目に報告されました。
記録された心疾患のある閉経後の女性 (n = 2,763、平均年齢 66.7 歳) において、心血管疾患の二次予防の対照臨床試験 (心臓およびエストロゲン/プロゲスチン補充研究 [HERS]) では、毎日の CE (0.625 mg) による治療) と MPA (2.5mg) は、心血管系の利点を示しませんでした。平均 4.1 年間の追跡期間中、CE と MPA による治療は、冠状動脈性心疾患が確定した閉経後の女性の CHD イベントの全体的な発生率を低下させませんでした。 CE と MPA を併用したグループでは、1 年目にプラセボ グループよりも多くの CHD イベントが発生しましたが、その後の数年間はそうではありませんでした。最初の HERS 試験からの 2,321 人の女性が、HERS の非盲検拡大である HERS II に参加することに同意しました。 HERS II の平均追跡期間はさらに 2.7 年で、全体で合計 6.8 年でした。 CHD イベントの発生率は、CE と MPA を併用したグループとプラセボ グループの女性の間で、HERS、HERS II、および全体で同等でした。
静脈血栓塞栓症
WHI エストロゲンとプロゲスチンのサブスタディでは、毎日 CE (0.625 mg) と MPA (2.5 mg) を投与された女性では、プラセボを投与された女性と比較して、統計的に有意な 2 倍の VTE (DVT および PE) 発生率が報告されました (35 対 17/回)。 10,000 女性年)。 DVT(10,000女性年あたり26対13)とPE(10,000女性年あたり18対8)の両方のリスクの統計的に有意な増加も示されました. VTE リスクの増加は、最初の 1 年の間に実証され、持続しました。 (見る 臨床研究 .) VTE が発生した場合、または疑われる場合は、エストロゲンとプロゲスチンの併用療法を直ちに中止する必要があります。
可能であれば、エストロゲンとプロゲスチンの併用は、血栓塞栓症のリスクが高いタイプの手術の少なくとも 4 ~ 6 週間前、または長時間の固定期間中は中止する必要があります。
悪性新生物
乳がん
エストロゲンとプロゲスチンの使用者に乳癌に関する情報を提供する最も重要なランダム化臨床試験は、毎日の CE (0.625 mg) と MPA (2.5 mg) の WHI サブスタディです。平均 5.6 年の追跡調査の後、エストロゲンとプロゲスチンのサブスタディでは、CE と MPA を毎日服用した女性で浸潤性乳がんのリスクが増加したことが報告されました。
このサブスタディでは、エストロゲン単独またはエストロゲンとプロゲスチン療法の以前の使用が女性の 26% によって報告されました。浸潤性乳がんの相対リスクは 1.24 であり、絶対リスクは 41 対女性年 10,000 人あたり 33 例であり、CE と MPA をプラセボと比較した.ホルモン療法の以前の使用を報告した女性の間で、侵襲性乳がんの相対リスクは 1.86 であり、プラセボと比較した CE と MPA の絶対リスクは、女性年 10,000 人あたり 25 件に対して 46 件でした。以前にホルモン療法を使用したことがないと報告した女性の間で、侵襲性乳がんの相対リスクは 1.09 であり、CE と MPA を併用した場合の絶対リスクは、10,000 女性年当たり 40 対 36 であり、プラセボと比較した.同じサブスタディでは、プラセボ群と比較して、CE (0.625 mg) と MPA (2.5 mg) を併用したグループでは浸潤性乳がんが大きく、リンパ節陽性である可能性が高く、より進行した段階で診断されました。転移性疾患はまれであり、2 つのグループ間に明らかな違いはありませんでした。組織学的サブタイプ、グレード、およびホルモン受容体の状態などの他の予後因子は、グループ間で差がありませんでした。 (見る 臨床研究 .)
WHI 臨床試験と一致して、観察研究でも、エストロゲンとプロゲスチンの併用療法では乳がんのリスクが増加し、エストロゲン単独療法ではリスクが低下することが数年間の使用後に報告されています。リスクは使用期間とともに増加し、治療中止後約 5 年でベースラインに戻るように見えました (中止後のリスクに関する十分なデータがあるのは観察研究のみです)。観察研究はまた、エストロゲンのみの治療と比較して、エストロゲンとプロゲスチンの治療を併用した場合、乳癌のリスクが高く、早期に明らかになることを示唆しています。しかし、これらの研究では、エストロゲンとプロゲスチンの組み合わせや投与経路が異なると、乳がんのリスクに有意な差は見られませんでした。
エストロゲンとプロゲスチンの併用は、さらなる評価を必要とする異常なマンモグラムの増加をもたらすと報告されています。すべての女性は、医療提供者による毎年の乳房検査を受け、毎月の乳房自己検査を実施する必要があります。さらに、マンモグラフィー検査は、患者の年齢、危険因子、および過去のマンモグラフィー結果に基づいてスケジュールする必要があります。
子宮内膜癌
子宮のある女性に非拮抗エストロゲン療法を使用すると、子宮内膜がんのリスクが高まることが報告されています。反対されていないエストロゲン使用者の間で報告されている子宮内膜がんのリスクは、非使用者の約 2 倍から 12 倍高く、治療期間とエストロゲンの投与量に依存しているようです。ほとんどの研究では、1 年未満のエストロゲンの使用に関連するリスクの有意な増加は示されていません。最大のリスクは長期使用に関連しているようであり、5 年から 10 年以上にわたってリスクが 15 倍から 24 倍に増加します。このリスクは、エストロゲン療法が中止された後、少なくとも 8 ~ 15 年間持続することが示されています。
エストロゲンとプロゲスチン療法を使用しているすべての女性の臨床的監視が重要です。適応があれば子宮内膜サンプリングを含む適切な診断手段を講じて、未診断の持続性または再発性の性器出血のすべてのケースで悪性を除外する必要があります。天然エストロゲンの使用が、同等のエストロゲン用量の合成エストロゲンとは異なる子宮内膜リスクプロファイルをもたらすという証拠はありません.エストロゲン療法にプロゲスチンを追加すると、子宮内膜がんの前兆となる子宮内膜増殖症のリスクが低下することが示されています。
卵巣がん
WHI エストロゲンとプロゲスチンのサブスタディでは、統計的に有意ではない卵巣がんのリスク増加が報告されました。平均 5.6 年の追跡調査の後、CE と MPA を併用した場合とプラセボを併用した場合の卵巣がんの相対リスクは 1.58 (95% CI、0.77–3.24) でした。 CE と MPA の絶対リスクは、女性年 10,000 人当たり 4 対 3 でした。いくつかの疫学的研究では、エストロゲンとプロゲスチン、およびエストロゲンのみの製品を特に 5 年以上使用すると、卵巣がんのリスクが増加することが示されています。ただし、リスクの増加に関連する曝露期間は、すべての疫学研究で一貫しておらず、関連性がないと報告されているものもあります。
認知症の可能性
WHI の WHIMS エストロゲン + プロゲスチン補助研究では、65 ~ 79 歳の 4,532 人の閉経後女性の集団が、毎日の CE (0.625 mg) + MPA (2.5 mg) またはプラセボに無作為に割り付けられました。平均 4 年間の追跡調査の後、CE と MPA のグループの 40 人の女性とプラセボ グループの 21 人の女性が認知症の可能性があると診断されました。 CE と MPA を併用した場合とプラセボを併用した場合の推定認知症の相対リスクは 2.05 (95% CI、1.21–3.48) でした。 CE と MPA を併用した場合とプラセボを併用した場合の推定認知症の絶対リスクは、10,000 女性年あたり 45 対 22 でした。これらの所見が閉経後の若い女性に当てはまるかどうかは不明です。 (見る 臨床研究 と 予防 、 高齢者の使用 .)
視覚異常
突然の部分的または完全な視力喪失、または眼球突出、複視または片頭痛の突然の発症がある場合は、検査が保留されるまでエストロゲンとプロゲスチンの併用療法を中止してください。検査で乳頭浮腫または網膜血管病変が明らかになった場合は、エストロゲンとプロゲスチンの併用療法を永久に中止する必要があります。
予防
全般的
女性が子宮摘出術を受けていない場合のプロゲスチンの追加
エストロゲン投与のサイクルの 10 日以上、または連続レジメンでエストロゲンと一緒に毎日プロゲスチンを追加する研究では、エストロゲン治療単独で誘発されるよりも子宮内膜過形成の発生率が低いことが報告されています。子宮内膜増殖症は、子宮内膜がんの前兆である可能性があります。
ただし、エストロゲンのみのレジメンと比較して、エストロゲンとプロゲスチンの使用に関連する可能性のあるリスクがあります。これらには、乳がんのリスクの増加が含まれます。
予期しない異常な膣出血
予想外の異常な膣出血の場合、適切な診断手段が示されます。
血圧上昇
エストロゲンとプロゲスチンの併用療法では、定期的に血圧を監視する必要があります。
高トリグリセリド血症
既存の高トリグリセリド血症の女性では、エストロゲンとプロゲスチン療法は、膵炎につながる血漿トリグリセリドの上昇と関連している可能性があります.膵炎が発生した場合は、治療の中止を検討してください。
肝障害および/または胆汁うっ滞性黄疸の既往歴
エストロゲンとプロゲスチンは、肝機能障害のある女性では代謝が不十分な場合があります。過去のエストロゲン使用や妊娠に伴う胆汁うっ滞性黄疸の既往歴のある女性は注意が必要で、再発した場合は投薬を中止する必要があります。
体液貯留
プロゲスチンは、ある程度の体液貯留を引き起こす可能性があります。心臓や腎臓の機能障害など、この要因の影響を受ける可能性のある状態にある女性は、エストロゲンとプロゲスチンが処方されたときに注意深い観察が必要です.
低カルシウム血症
エストロゲン誘発性低カルシウム血症が起こる可能性があるため、副甲状腺機能低下症の女性では、エストロゲンとプロゲスチン療法を慎重に使用する必要があります。
他の状態の悪化
エストロゲンとプロゲスチンの併用療法は、喘息、真性糖尿病、てんかん、片頭痛、ポルフィリン症、全身性エリテマトーデス、および肝血管腫の悪化を引き起こす可能性があり、これらの状態の女性には注意して使用する必要があります。
患者情報
医師は、以下について話し合うことをお勧めします。 患者情報 プロベラを処方する女性のリーフレット。
母親が妊娠の最初の三半期にプロゲスチンにさらされている子供では、軽度の先天性欠損症のリスクが高くなる可能性があります.男性の赤ちゃんに起こりうるリスクは、尿道下裂です。これは、陰茎の開口部が陰茎の先端ではなく下側にある状態です。この状態は、男性の出生 1000 人あたり約 5 ~ 8 人で自然に発生します。プロベラにさらされるとリスクが高まる可能性があります。クリトリスの肥大と陰唇の融合は、女性の赤ちゃんに発生する可能性があります。しかし、プロベラの使用による尿道下裂、陰核肥大、陰唇癒合との明確な関連性は確立されていません。
妊娠初期にプロベラ 5mg に暴露したことを報告することの重要性を患者に知らせてください。
発がん、突然変異誘発、生殖能力の障害
発がん性
酢酸メドロキシプロゲステロンの長期筋肉内投与は、ビーグル犬に乳腺腫瘍を引き起こすことが示されています。ラットおよびマウスへの酢酸メドロキシプロゲステロンの経口投与に関連する発がん作用の証拠はありませんでした。
エストロゲンとプロゲスチン療法の長期継続投与は、乳がんと卵巣がんのリスクの増加を示しています。 (見る 警告 と 予防 .)
遺伝毒性
酢酸メドロキシプロゲステロンは一連の in vitro または in vivo 遺伝毒性試験で変異原性を示さなかった。
受胎能力
高用量の酢酸メドロキシプロゲステロンは避妊薬であり、高用量は治療を中止するまで生殖能力を損なうと予想されます.
妊娠
妊娠カテゴリーX
妊娠中はプロベラを使用しないでください。 (見る 禁忌 .)
妊娠初期にプロベラ 10mg を摂取した母親の子供は、尿道下裂、陰核肥大、陰唇癒合のリスクが高くなる可能性があります。しかし、これらの症状とプロベラの使用との明確な関連は確立されていません。
授乳中の母親
プロベラは授乳中は使用しないでください。プロゲスチンを摂取している授乳中の母親の母乳には、検出可能な量のプロゲスチンが含まれていることが確認されています。
小児用
プロベラ 10mg 錠は小児には適応されません。小児集団を対象とした臨床研究は実施されていません。
高齢者の使用
プロベラのみを使用した臨床試験に参加した老年女性の数は十分ではなく、65 歳以上の女性とプロベラのみの反応が若い被験者と異なるかどうかを判断することができませんでした。
女性の健康イニシアチブ研究
WHIエストロゲンとプロゲスチンのサブスタディ(毎日CE [0.625 mg] + MPA [2.5 mg] vs プラセボ)では、65歳以上の女性で非致死性脳卒中と浸潤性乳がんの相対リスクが高かった. (見る 臨床研究 .)
女性の健康イニシアチブ記憶研究
65 歳から 79 歳の閉経後の女性を対象とした WHIMS 補助研究では、エストロゲン単独またはエストロゲンとプロゲスチンを投与された女性では、プラセボと比較して認知症を発症するリスクが増加しました。 (見る 警告 、 認知症の可能性 .)
どちらの補助研究も 65 歳から 79 歳の女性を対象に実施されたため、これらの調査結果が閉経後の若い女性に適用されるかどうかは不明です。 (見る 警告 、 認知症の可能性 .)
過剰摂取
エストロゲンとプロゲスチン療法の過剰摂取は、吐き気と嘔吐、乳房の圧痛、めまい、腹痛、眠気/疲労、消退出血を女性に引き起こす可能性があります.過剰摂取の治療は、CE と MPA の中止と、適切な対症療法の開始で構成されます。
禁忌
プロベラ 10mg は、次のいずれかの状態の女性には禁忌です。
臨床薬理学
適切な内因性エストロゲンを持つ女性に推奨用量で経口または非経口投与された酢酸メドロキシプロゲステロン (MPA) は、増殖性子宮内膜を分泌性子宮内膜に変換します。アンドロゲンおよびアナボリック効果が注目されていますが、この薬には明らかに有意なエストロゲン活性がありません.非経口投与されたMPAはゴナドトロピン産生を阻害し、卵胞の成熟と排卵を防ぎますが、入手可能なデータは、通常推奨される経口投与量が1日1回投与された場合には発生しないことを示しています.
薬物動態
MPA の薬物動態は、20 人の閉経後の女性を対象に、プロベラ 2.5 mg 錠 8 錠の単回投与またはプロベラ 10 mg 錠 2 錠の単回投与を絶食状態で行った後に測定されました。別の研究では、閉経後の女性 30 人を対象に、プロベラ 10 mg 錠剤を 1 錠 7 日間毎日服用した後、絶食条件下で MPA の定常状態の薬物動態が測定されました。両方の研究で、検証済みのガスクロマトグラフィー質量分析 (GC-MS) メソッドを使用して血清中の MPA を定量化しました。プロベラ錠の単回および複数回投与後の MPA の薬物動態パラメーターの推定値は、非常に変動が大きく、表 1 にまとめられています。
吸収
ヒトにおける MPA の絶対的なバイオアベイラビリティに関する特定の調査は実施されていません。 MPA は消化管から急速に吸収され、経口投与後 2 ~ 4 時間で最大 MPA 濃度に達します。
プロベラを食事とともに投与すると、MPA のバイオアベイラビリティが向上します。プロベラ 10mg の 10mg を食事の直前または直後に服用すると、MPA Cmax (50 ~ 70%) および AUC (18 ~ 33%) が増加しました。 MPA の半減期は食物によって変化しませんでした。
分布
MPA の約 90% は、主にアルブミンに結合したタンパク質です。性ホルモン結合グロブリンでは MPA 結合は起こりません。
代謝
経口投与後、MPA はヒドロキシル化を介して肝臓で広範に代謝され、その後の抱合と尿中への排出が行われます。
排泄
ほとんどの MPA 代謝産物はグルクロニド抱合体として尿中に排泄され、硫酸塩として排泄されるのはごくわずかです。
特定の集団
肝不全
MPA は、ほとんどが肝代謝によって排除されます。進行した肝疾患を持つ 14 人の患者では、MPA の配置が大幅に変更されました (除去の減少)。脂肪肝の患者では、10 mg または 100 mg の投与後に 24 時間尿中に無傷の MPA として排泄される平均投与量は、それぞれ 7.3% および 6.4% でした。
腎不全
プロベラ 5mg の薬物動態に対する腎障害の影響は研究されていません。
薬物相互作用
酢酸メドロキシプロゲステロン (MPA) は、主に CYP3A4 を介したヒドロキシル化によってインビトロで代謝されます。 MPA に対する CYP3A4 誘導剤または阻害剤の臨床効果を評価する特定の薬物間相互作用研究は実施されていません。 CYP3A4 の誘導剤および/または阻害剤は、MPA の代謝に影響を与える可能性があります。
臨床研究
子宮内膜への影響
45 歳から 64 歳までの子宮摘出術を受けていない閉経後の女性 356 人を対象とした 3 年間の二重盲検プラセボ対照試験では、無作為にプラセボ (n=119)、抱合型エストロゲン 0.625 mg のみ (n=119)、または 0.625 を投与されました。 mg 抱合型エストロゲンと環状プロベラ (n=118) の結果は、0.625 mg 抱合型エストロゲンのみを受けた群と比較して、10 mg プロベラ 5mg と 0.625 mg 抱合型エストロゲンを受けた治療群で子宮内膜過形成のリスクが減少したことを示しました。表 2 を参照してください。
つ目の 1 年間の研究では、45 歳から 65 歳までの 832 人の閉経後の女性が、1 日 0.625 mg の抱合型エストロゲン (1 ~ 28 日目) と、5 mg の環状プロベラまたは 10 mg の環状プロベラ (15 ~ 28 日目) のいずれかで治療されました。または毎日 0.625 mg 抱合型エストロゲンのみ。 5 または 10 mg のサイクリック プロベラ (15 ~ 28 日目) と抱合型エストロゲンを毎日投与した治療群は、抱合型エストロゲンのみの群と比較して、有意に低い過形成率を示しました。表 3 を参照してください。
女性の健康イニシアチブ研究
WHI は約 27,000 人の主に健康な閉経後の女性を 2 つのサブスタディに登録し、特定の慢性疾患の予防における毎日の経口 CE (0.625 mg) 単独または MPA (2.5 mg) との組み合わせのリスクと利点を、プラセボと比較して評価しました。主要エンドポイントは冠状動脈性心疾患(CHD)(非致死性心筋梗塞、無症候性心筋梗塞および心疾患による死亡と定義)の発生率で、浸潤性乳がんが主な有害転帰でした。 「グローバル インデックス」には、CHD、浸潤性乳癌、脳卒中、PE、子宮内膜癌 (CE と MPA サブスタディのみ)、結腸直腸癌、股関節骨折、またはその他の原因による死亡の早期発生が含まれていました。これらのサブスタディでは、更年期症状に対する CE 単独または CE と MPA の効果は評価されていません。
WHI エストロゲン プラス プロゲスチン サブスタディ
WHI エストロゲンとプロゲスチンのサブスタディは早期に中止されました。事前に定義された中止規則によると、平均 5.6 年間の治療追跡調査の後、浸潤性乳がんと心血管イベントのリスク増加は、「グローバル インデックス」に含まれる特定の利益を上回りました。 「グローバルインデックス」に含まれるイベントの絶対過剰リスクは、10,000 女性年あたり 19 でした。
5.6 年の追跡調査後に統計的有意性に達した WHI の「グローバル インデックス」に含まれる転帰について、CE と MPA で治療されたグループの 10,000 女性年あたりの絶対過剰リスクは、CHD イベントが 7 件、脳卒中が 8 件、 PE が 10 件、浸潤性乳がんが 8 件増加し、女性年 10,000 人あたりの絶対リスク減少は、結腸直腸がんが 6 件、股関節骨折が 5 件減少しました。
16,608 人の女性 (平均 63 歳、範囲 50 ~ 79、白人 83.9%、黒人 6.8%、ヒスパニック系 5.4%、その他 3.9%) を対象とした CE プラス MPA サブスタディの結果を表 4 に示します。平均5.6年のフォローアップ後の裁定データ。
閉経の開始と比較したエストロゲンとプロゲスチン療法の開始のタイミングは、全体的なリスクベネフィットプロファイルに影響を与える可能性があります。年齢で層別化された WHI エストロゲンとプロゲスチンのサブスタディでは、50 歳から 59 歳の女性で、全死亡率のリスクが減少するという有意ではない傾向が示されました [ハザード比 (HR) 0.69 (95% CI、0.44–1.07)]。
女性の健康イニシアチブ記憶研究
WHI の WHIMS エストロゲンとプロゲスチン補助研究では、65 歳以上の主に健康な閉経後の女性 4,532 人が登録されました (47% が 65 ~ 69 歳、35% が 70 ~ 74 歳、18% が 75 歳)。プラセボと比較して、推定認知症の発生率(主要転帰)に対する毎日のCE(0.625 mg)とMPA(2.5 mg)の効果を評価する。
平均 4 年間の追跡調査後、CE と MPA を併用した場合とプラセボを併用した場合の推定認知症の相対リスクは 2.05 (95% CI、1.21–3.48) でした。 CE と MPA を併用した場合とプラセボを併用した場合の推定認知症の絶対リスクは、女性年 10,000 人あたり 45 対 33 でした。この研究で定義された推定認知症には、アルツハイマー病 (AD)、血管性認知症 (VaD)、混合型 (AD と VaD の両方の特徴を持つ) が含まれます。治療群とプラセボ群における認知症の可能性の最も一般的な分類はADでした。補助研究は 65 歳から 79 歳の女性で実施されたため、これらの調査結果がより若い閉経後の女性に適用されるかどうかは不明です。 (見る 警告 、 認知症の可能性 と 予防 、 高齢者の使用 )。
患者情報
プロベラ (pro-VE-rah) (酢酸メドロキシプロゲステロン) 錠剤、USP
プロベラの服用を開始する前にこの患者情報を読み、プロベラの処方箋を補充するたびに何が得られるかを読んでください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
プロベラ(プロゲスチンホルモン)について知っておくべき最も重要な情報は何ですか?
- 心臓病、心臓発作、脳卒中、または認知症 (脳機能の低下) を予防するために、エストロゲンとプロゲスチンを併用しないでください。
- プロゲスチンと一緒にエストロゲンを使用すると、心臓発作、脳卒中、乳がん、血栓が発生する可能性が高くなります.
- エストロゲンとプロゲスチンを併用すると、65 歳以上の女性を対象とした研究に基づいて、認知症になる可能性が高くなる可能性があります。
- あなたとあなたの医療提供者は、プロベラによる治療が必要かどうかについて定期的に話し合う必要があります。
プロベラ10mgとは?
プロベラは、プロゲスチンホルモンである酢酸メドロキシプロゲステロンを含有するお薬です。
プロベラ5mgは何に使うの?
プロベラは次の目的で使用されます。
- 止まった月経を治療したり、異常な子宮出血を治療したりします。妊娠していない子宮を持つ女性、定期的な月経が止まった女性、または月経不順が始まった女性では、プロゲステロン値が低下する可能性があります。プロベラ 10mg があなたに適しているかどうかについては、かかりつけの医療提供者に相談してください。
- 子宮(子宮)のがんになる可能性を減らします。エストロゲンを使用する子宮を持つ閉経後の女性では、エストロゲンと組み合わせてプロゲスチンを服用すると、子宮(子宮)のがんになる可能性が減少します.
プロベラを服用してはいけない人
次の場合は、プロベラの服用を開始しないでください。
- 異常な性器出血がある
- 現在、特定のがんを患っている、または患ったことがある エストロゲンとプロゲスチンは、乳がんを含む特定の種類のがんにかかる可能性を高める可能性があります.がんにかかっている、またはがんにかかったことがある場合は、プロベラを使用すべきかどうかについて医療提供者に相談してください.
- 脳卒中または心臓発作を起こした
- 現在、血栓がある、またはあった
- 現在肝臓に問題がある、または持っていた
- プロベラ10mgまたはその成分にアレルギーのある方 このリーフレットの最後にあるプロベラの成分リストをご覧ください。
- あなたが妊娠しているかもしれないと思う プロベラは妊婦用ではありません。妊娠している可能性がある場合は、妊娠検査を受けて結果を知る必要があります。検査結果が陽性の場合は、プロベラを使用せず、医療提供者に相談してください。母親が妊娠の最初の 4 か月間にプロベラを服用している子供は、軽度の先天性欠損症のリスクが高くなる可能性があります。プロベラは妊娠検査薬として使用しないでください。
プロベラ 10mg を服用する前に、医療提供者に何を伝えるべきですか?プロベラ 5mg を服用する前に、次の場合は医療提供者に伝えてください。
- その他の医学的問題がある 喘息(喘鳴)、てんかん(発作)、糖尿病、片頭痛、子宮内膜症(重度の骨盤痛)、狼瘡、または心臓、肝臓、甲状腺、腎臓、または血液中のカルシウムが高い。
- 手術を受けるか、安静にします プロベラの服用を中止する必要がある場合は、担当の医療提供者がお知らせします。
- 授乳中です プロベラのホルモンは母乳に移行します。
あなたが服用しているすべての薬について、医療提供者に伝えてください 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。一部の医薬品は、プロベラの働きに影響を与える可能性があります。プロベラは、他の医薬品の働きにも影響を与える可能性があります。
プロベラ 10mg の服用方法は?
最低用量から始めて、その用量がどれだけ効果的かについて医療提供者に相談してください.プロベラの最低有効用量は決定されていません。あなたとあなたの医療提供者は、あなたが服用している用量と、まだプロベラによる治療が必要かどうかについて定期的に(3〜6か月ごとに)話し合う必要があります.
プロベラの副作用は?
プロベラ 10mg を単独で使用した場合、次のような副作用が報告されています。
- 乳房の圧痛
- 母乳の分泌
- 破綻出血
- スポッティング(少量の膣出血)
- 不規則な期間
- 無月経(月経がない)
- 膣分泌物
- 頭痛
- 緊張感
- めまい
- うつ
- 不眠、眠気、倦怠感
- 月経前症候群のような症状
- 血栓性静脈炎(炎症を起こした静脈)
- 血餅
- かゆみ、じんましん、かぶれ
- にきび
- 脱毛、育毛
- 腹部不快感
- 吐き気
- 膨満感
- 熱
- 体重増加
- 腫れ
- 視力とコンタクトレンズに対する感度の変化
蕁麻疹、呼吸困難、顔、口、舌、首の腫れがある場合は、すぐに医療提供者に連絡してください
プロベラ 5mg をエストロゲンと一緒に使用した場合、次のような副作用が報告されています。
副作用は、その深刻度と治療時に発生する頻度によって分類されます。
深刻ではあるがあまり一般的ではない副作用には次のものがあります。
- 心臓発作
- 脳卒中
- 血の塊
- 認知症
- 乳がん
- 子宮がん
- 卵巣がん
- 高血圧
- 高血糖
- 胆嚢疾患
- 肝臓の問題
- 甲状腺ホルモンレベルの変化
- 良性腫瘍(「筋腫」)の拡大
以下の警告サインのいずれか、またはその他の異常な症状が見られた場合は、すぐに医療提供者に連絡してください。
- 新しい乳房のしこり
- 異常な性器出血
- 視覚と発話の変化
- 突然の新しい激しい頭痛
- 息切れ、衰弱、疲労を伴う、または伴わない胸や脚の激しい痛み
- 記憶喪失または混乱
それほど深刻ではありませんが、一般的な副作用には次のものがあります。
- 頭痛
- 胸の痛み
- 不規則な膣出血または斑点
- 胃や腹部のけいれん、膨満感
- 吐き気と嘔吐
- 脱毛
- 体液貯留
- 膣内イースト菌感染症
これらは、エストロゲンの有無にかかわらず、プロベラのすべての可能な副作用ではありません.詳細については、医療提供者または薬剤師に副作用に関するアドバイスを求めてください。気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。副作用については、ファイザー (1-800-438-1985) または FDA (1-800-FDA-1088) に報告できます。
プロベラ 10mg の深刻な副作用の可能性を下げるにはどうすればよいですか?
- プロベラの服用を継続すべきかどうか、定期的に医療提供者と相談してください。プロゲスチンの追加は、子宮(子宮)のがんになる可能性を減らすために、子宮を持つ女性に一般的に推奨されます.
- プロベラの服用中に膣から出血した場合は、すぐに医療提供者に相談してください。
- 医療提供者から特に指示がない限り、毎年内診、乳房検査、マンモグラム (乳房 X 線) を受けてください。あなたの家族のメンバーが乳がんにかかったことがある場合、または乳房のしこりや異常なマンモグラムを経験したことがある場合は、より頻繁に乳房検査を受ける必要があるかもしれません.
- 高血圧、高コレステロール(血中脂肪)、糖尿病、太りすぎ、またはタバコを使用している場合は、心臓病になる可能性が高くなります.心臓病になる可能性を下げる方法については、医療提供者に尋ねてください。
プロベラの安全で効果的な使用に関する一般情報
- 医薬品は、患者情報リーフレットに記載されていない状態に対して処方されることがあります。
- 処方されていない状態でプロベラを服用しないでください。
- 他の人があなたと同じ症状であっても、プロベラを与えないでください。それらに害を及ぼす可能性があります。
プロベラ10mgは子供の手の届かないところに保管してください。
このリーフレットは、プロベラに関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医療提供者または薬剤師に相談してください。医療専門家向けに書かれたプロベラ 10mg に関する情報を求めることができます。詳細については、フリーダイヤル 1-800-438-1985 までお問い合わせください。
プロベラの成分は?
経口投与用の各プロベラ 5 mg 錠剤には、酢酸メドロキシプロゲステロンが 2.5 mg、5 mg、または 10 mg 含まれています。
不活性成分:ステアリン酸カルシウム、コーンスターチ、ラクトース、ミネラルオイル、ソルビン酸、スクロース、タルク。 2.5mg錠にはFD&C黄色6号が含まれています。
この商品のラベルは更新されている可能性があります。現在の完全な処方情報については、www.pfizer.com をご覧ください。
