Fosamax 35mg, 70mg Alendronate 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Fosamax 70mg とは何ですか?
Fosamax 35mg は、成人の特定の種類の骨量減少 (骨粗鬆症) を予防および治療するために使用される処方薬です。 Fosamax 70mg は、単独で使用することも、他の薬と併用することもできます。
Fosamax は、カルシウム代謝調整剤、ビスフォスフォネート誘導体です。
Fosamax が子供に安全で有効であるかどうかはわかっていません。
Fosamax の副作用の可能性は何ですか?
Fosamax は、次のような重大な副作用を引き起こす可能性があります。
- 胸痛
- 胸やけの新規または悪化
- 肋骨の下または背中の痛みまたは灼熱感
- 重度の胸やけ
- 胃の上部の焼けるような痛み、または喀血
- 太ももや股関節の新しいまたは異常な痛み
- あごの痛み
- しびれ
- 腫れ
- 重度の関節痛、骨痛または筋肉痛
- 筋肉のけいれんまたはけいれん
- 口の周りや手足のしびれやヒリヒリ感
上記の症状がある場合は、すぐに医療機関を受診してください。
Fosamax の最も一般的な副作用は次のとおりです。
- 胸焼け
- 胃のむかつき
- 胃痛
- 吐き気
- 下痢
- 便秘
- 骨の痛み
- 筋肉痛
- 関節痛
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Fosamax の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
FOSAMAX (アレンドロン酸ナトリウム) は、破骨細胞を介した骨吸収の特異的阻害剤として作用するビスフォスフォネートです。ビスフォスフォネートは、骨に見られるヒドロキシアパタイトに結合するピロリン酸の合成類似体です。
アレンドロン酸ナトリウムは、化学的に (4-アミノ-1-ヒドロキシブチリデン) ビスホスホン酸一ナトリウム塩三水和物と表されます。
アレンドロン酸ナトリウムの実験式は C4H12NNaO7P2・3H2O であり、式量は 325.12 である。構造式は次のとおりです。
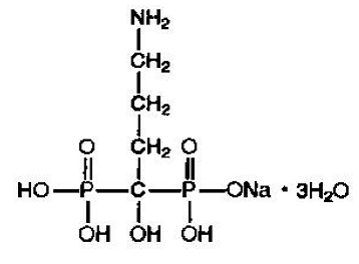
アレンドロン酸ナトリウムは、白色の結晶性の非吸湿性の粉末です。水に溶け、アルコールに極めて溶けにくく、クロロホルムにほとんど溶けない。
経口投与用の FOSAMAX 70mg 錠剤には、70mg の遊離酸とモル当量である 91.37mg のアレンドロネート一ナトリウム塩三水和物と、微結晶セルロース、無水乳糖、クロスカルメロース ナトリウム、およびステアリン酸マグネシウムが含まれています。
適応症
閉経後の女性における骨粗鬆症の治療®
FOSAMAX は、閉経後の女性の骨粗鬆症の治療に適応されます。閉経後の女性では、FOSAMAX 70mg は骨量を増加させ、股関節や脊椎の骨折 (脊椎圧迫骨折) を含む骨折の発生率を低下させます。 [見る 臨床研究 ]
閉経後の女性における骨粗鬆症の予防
FOSAMAX 70mg は、閉経後の骨粗鬆症の予防に適応されます [参照 臨床研究 ]。
骨粗鬆症の男性の骨量を増加させる治療
FOSAMAX は、骨粗鬆症の男性の骨量を増加させるための治療に適応されます [参照 臨床研究 ]。
グルココルチコイド誘発性骨粗鬆症の治療
FOSAMAX は、プレドニゾン 7.5 mg 以上に相当する 1 日量のグルココルチコイドを投与され、骨ミネラル密度が低い男性および女性におけるグルココルチコイド誘発性骨粗鬆症の治療に適応されます。 臨床研究 ]。
骨パジェット病の治療
FOSAMAX 35mg は、男性および女性の骨パジェット病の治療に適応されます。治療は、アルカリホスファターゼが正常上限の少なくとも 2 倍の骨ページェット病患者、または症状のある患者、または疾患による将来の合併症のリスクがある患者に適応されます。 [見る 臨床研究 ]
使用上の重要な制限
最適な使用期間は決定されていません。骨粗鬆症の治療における FOSAMAX の安全性と有効性は、4 年間の臨床データに基づいています。ビスフォスフォネート療法を受けているすべての患者は、定期的に再評価される継続的な治療の必要性を持っている必要があります.骨折のリスクが低い患者は、3 ~ 5 年の使用後に薬剤の中止を検討する必要があります。治療を中止した患者は、骨折のリスクを定期的に再評価する必要があります。
投薬と管理
アレンドロネート錠 5 mg、10 mg、35 mg、および 40 mg は市場で入手できますが、FOSAMAX 35 mg は、5 mg、10 mg、35 mg、および 40 mg の強度で販売されなくなりました。
アレンドロネートの経口溶液は市場で入手できる可能性がありますが、FOSAMAX 35mg 経口溶液はもはや販売されていません。
閉経後の女性における骨粗鬆症の治療
推奨用量は次のとおりです。
- 70 mg の錠剤 1 錠を週 1 回または
- 週に 1 回 70 mg の経口溶液のボトル 1 本または
- 1日1回10mgの錠剤1錠
閉経後の女性における骨粗鬆症の予防
推奨用量は次のとおりです。
- 35 mg の錠剤 1 錠を週 1 回または
- 日 1 回 5 mg の錠剤 1 つ
骨粗鬆症の男性の骨量を増加させる治療
推奨用量は次のとおりです。
- 70 mg の錠剤 1 錠を週 1 回または
- 週に 1 回 70 mg の経口溶液のボトル 1 本または
- 1日1回10mgの錠剤1錠
グルココルチコイド誘発性骨粗鬆症の治療
推奨用量は、エストロゲンを投与されていない閉経後の女性を除いて、1 日 1 回 10 mg 錠剤 1 錠です。
骨パジェット病の治療
推奨される治療法は、40 mg を 1 日 1 回、6 か月間服用することです。
パジェット病の再治療
FOSAMAX 35mg による再治療は、定期的に測定する必要がある血清アルカリホスファターゼの増加に基づいて、再発した患者の治療後 6 か月の評価期間後に考慮することができます。血清アルカリホスファターゼを正常化できなかった人には、再治療を考慮することもできます。
重要な管理手順
患者に次のことを指示します。
- FOSAMAX は、その日の最初の食べ物、飲み物、または薬の少なくとも 30 時間前に、普通の水のみで服用してください [ 患者相談情報 ]。他の飲料(ミネラルウォーターを含む)、食品、および一部の医薬品は、FOSAMAX の吸収を低下させる可能性があります [参照 薬物相互作用 ]。 30 分以内に待機するか、FOSAMAX 70mg を食べ物、飲み物 (普通の水以外)、または他の薬と一緒に服用すると、FOSAMAX 70mg の体内への吸収が減少し、FOSAMAX 70mg の効果が減少します。
- その日の起床時にFOSAMAXを服用してください。胃への送達を促進し、食道への刺激の可能性を減らすために、FOSAMAX 35mg 錠剤はコップ一杯の水 (6 ~ 8 オンス) と一緒に飲み込む必要があります。胃内容物排出を容易にするために、FOSAMAX 70mg 経口溶液の後に、少なくとも 2 オンス (カップの 4 分の 1) の水を摂取する必要があります。患者は少なくとも 30 分間は横にならないようにし、その日の最初の食事を終えるまで横にならないようにします。 FOSAMAX は、就寝時または起床前に服用しないでください。これらの指示に従わないと、食道に有害な経験をするリスクが高まる可能性があります [参照 警告と注意事項 と 患者相談情報 ]。
カルシウムとビタミン D の補給に関する推奨事項
食事からの摂取が不十分な場合は、カルシウムを補給するよう患者に指示する[参照 警告と注意事項 ]。ビタミン D 不足のリスクが高い患者 (例、70 歳以上、老人ホームに通院している、または慢性疾患) は、ビタミン D 補給が必要な場合があります。消化管吸収不良症候群の患者は、高用量のビタミン D 補給が必要な場合があり、25-ヒドロキシビタミン D の測定を検討する必要があります。
グルココルチコイドで治療された患者は、十分な量のカルシウムとビタミン D を摂取する必要があります。
飲み忘れ時の投与指示
週 1 回の FOSAMAX の服用を忘れた場合は、思い出した朝に 1 回服用するよう患者に指示してください。同じ日に 2 回服用するべきではありませんが、選択した日に当初予定されていたように、週 1 回の服用に戻す必要があります。
供給方法
剤形と強度
- 70 mg 錠剤は白色の楕円形のコーティングされていない錠剤で、片面にコード 31、もう片面に骨の輪郭が描かれています。
保管と取り扱い
No. 3814 - FOSAMAX 錠 70 mg は白色の楕円形のコーティングされていない錠剤で、片面にコード 31、もう片面に骨の輪郭が描かれています。
NDC 0006-0031-44 4個入りブリスターパッケージ。
保管所
FOSAMAX錠
密閉容器に入れ、室温、15 ~ 30°C (59 ~ 86°F) で保管してください。
販売元: MERCK & CO., INC., Whitehouse Station, NJ 08889, USA の子会社である Merck Sharp & Dohme Corp.。改訂: 2019 年 8 月
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
閉経後の女性における骨粗鬆症の治療
毎日の投薬
閉経後骨粗鬆症の治療における FOSAMAX 35mg の安全性は、44 ~ 84 歳の女性 7,453 人を登録した 4 つの臨床試験で評価されました。研究 1 と研究 2 は、同じように設計された、3 年間のプラセボ対照二重盲検多施設研究でした (米国および多国籍 n=994)。研究 3 は、骨折介入試験 [FIT] の 3 年間の脊椎骨折コホート (n=2027) であり、研究 4 は FIT の 4 年間の臨床骨折コホート (n=4432) でした。全体で、3620 人の患者がプラセボにさらされ、3432 人の患者が FOSAMAX にさらされました。これらの臨床試験には、既存の胃腸疾患と非ステロイド性抗炎症薬の併用患者が含まれていました。研究 1 と研究 2 では、すべての女性が 500 mg の元素カルシウムを炭酸塩として摂取しました。研究 3 と研究 4 では、1 日あたりのカルシウム摂取量が 1000 mg 未満のすべての女性が、1 日あたり 500 mg のカルシウムと 250 国際単位のビタミン D を摂取しました。
スタディ 1 とスタディ 2 でアレンドロネート 10 mg またはプラセボで治療された患者、およびスタディ 3 とスタディ 4 のすべての患者の全死因死亡率は、プラセボ群で 1.8%、FOSAMAX 35mg 群で 1.8% でした。重篤な有害事象の発生率は、プラセボ群で 30.7%、FOSAMAX 群で 30.9% でした。何らかの臨床的有害事象のために試験を中止した患者の割合は、プラセボ群で 9.5%、FOSAMAX 70mg 群で 8.9% でした。 FOSAMAX 35mgまたはプラセボのいずれかで治療された患者の1%以上で、研究者がおそらく、おそらく、または確実に薬物関連であると考えたこれらの研究からの有害反応を表1に示します.
発疹と紅斑が発生しました。
胃腸の有害反応
消化性潰瘍疾患と胃切除術の病歴があり、併用アスピリンを服用していたFOSAMAX(10 mg /日)で治療された1人の患者は、軽度の出血を伴う吻合部潰瘍を発症しましたが、これは薬物関連と考えられていました.アスピリンと FOSAMAX は中止され、患者は回復しました。スタディ 1 とスタディ 2 の集団では、49 ~ 54% がベースラインで胃腸障害の病歴があり、54 ~ 89% が非ステロイド性抗炎症薬またはアスピリンを研究中のある時点で使用していました。 [見る 警告と注意事項 ]
臨床検査結果
二重盲検多施設対照研究では、血清カルシウムとリン酸塩の無症候性、軽度、および一時的な減少が、FOSAMAX を服用している患者のそれぞれ約 18% と 10% で観察されたのに対し、プラセボを服用している患者の約 12% と 3% で観察されました。しかし、血清カルシウムが 8.0 mg/dL (2.0 mM) 未満に減少し、血清リン酸塩が 2.0 mg/dL (0.65 mM) 以下に減少する発生率は、両方の治療群で同様でした。
毎週の投薬
閉経後骨粗鬆症の治療における FOSAMAX 70 mg 週 1 回投与の安全性は、FOSAMAX 70 mg 週 1 回投与と FOSAMAX 10 mg 1 日投与を比較する 1 年間の二重盲検多施設試験で評価されました。週 1 回の FOSAMAX 70 mg と FOSAMAX 10 mg の毎日の全体的な安全性と忍容性プロファイルは類似していました。いずれかの治療群の患者の 1% 以上で、治験責任医師がおそらく、おそらく、または確実に薬物関連であると考えた有害反応を表 2 に示します。
閉経後の女性における骨粗鬆症の予防
毎日の投薬
40 ~ 60 歳の閉経後の女性における FOSAMAX 5 mg/日の安全性は、2 年または 3 年のいずれかで FOSAMAX を受けるように無作為に割り付けられた 1,400 人以上の患者を含む 3 つの二重盲検プラセボ対照試験で評価されています。これらの研究では、FOSAMAX 5 mg/日とプラセボの全体的な安全性プロファイルは類似していました。何らかの臨床的有害事象による治療の中止は、FOSAMAX 5 mg/日で治療された 642 人の患者の 7.5%、プラセボで治療された 648 人の患者の 5.7% で発生しました。
毎週の投薬
FOSAMAX 35 mg を週 1 回投与する場合の安全性と、FOSAMAX 5 mg を毎日投与する場合の安全性は、723 人の患者を対象とした 1 年間の二重盲検多施設試験で評価されました。 FOSAMAX 35 mg を週 1 回投与する場合と FOSAMAX 5 mg を毎日投与する場合の全体的な安全性と忍容性のプロファイルは類似していました。
週1回のFOSAMAX 35 mg、FOSAMAX 5 mg/日、またはプラセボのいずれかで治療された患者の1%以上で、研究者が可能性、おそらく、または確実に薬物関連であると考えたこれらの研究からの有害反応を表3に示します。 .
エストロゲン/ホルモン補充療法との併用
閉経後の骨粗鬆症の女性 (合計: n=853) を対象とした 2 つの研究 (1 年間と 2 年間) では、1 日 1 回の FOSAMAX 10 mg とエストロゲン±プロゲスチン (n=354) の併用療法の安全性と忍容性プロファイルが示されました。個々の治療法と一致しています。
男性の骨粗しょう症
男性を対象とした 2 つのプラセボ対照二重盲検多施設研究 (1 日 10 mg の FOSAMAX の 2 年間の研究と 70 mg の週 1 回の 1 年間の研究) では、何らかの臨床的有害事象による治療の中止率イベントは、FOSAMAX 10 mg/日で 2.7%、プラセボで 10.5%、週 1 回の FOSAMAX 70 mg で 6.4%、プラセボで 8.6% でした。研究者が FOSAMAX 70mg またはプラセボのいずれかで治療された患者の 2% 以上で、おそらく、おそらく、または確実に薬物関連であると見なした副作用を表 4 に示します。
グルココルチコイド誘発性骨粗鬆症
グルココルチコイド治療を受けている患者を対象とした 2 つの 1 年間のプラセボ対照二重盲検多施設研究では、FOSAMAX 5 および 10 mg/日の全体的な安全性と忍容性のプロファイルは、一般にプラセボと同様でした。 FOSAMAX 5 または 10 mg/日またはプラセボのいずれかで治療された患者の 1% 以上で、研究者が可能性がある、おそらく、または確実に薬物関連であると考えた副作用を表 5 に示します。
研究の 2 年目 (FOSAMAX: n=147) の治療を継続したグルココルチコイド誘発性骨粗鬆症集団における全体的な安全性と忍容性のプロファイルは、最初の年に観察されたプロファイルと一致していました。
骨パジェット病
臨床研究 (骨粗鬆症およびパジェット病) では、FOSAMAX 40 mg/日を 3 ~ 12 か月間服用した 175 人の患者で報告された有害事象は、FOSAMAX 10 mg/日で治療された閉経後の女性と同様でした。しかし、FOSAMAX 40 mg/日を服用している患者では、明らかに上部消化管の有害反応の発生率が増加していました (17.7% FOSAMAX 対 10.2% プラセボ)。食道炎 1 例、胃炎 2 例で治療中止となった。
さらに、筋骨格系(骨、筋肉、または関節)の痛みは、他のビスフォスフォネートで治療されたパジェット病患者で報告されており、約 6% の患者でおそらく、おそらく、または確実に薬物に関連していると研究者は考えていました。 FOSAMAX 40 mg/日で治療された患者とプラセボで治療された患者の約 1% で治療されましたが、治療が中止されることはめったにありませんでした。何らかの臨床的有害事象による治療の中止は、FOSAMAX 40 mg/日で治療されたパジェット病患者の 6.4%、プラセボで治療された患者の 2.4% で発生しました。
市販後の経験
FOSAMAXの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
全身: 蕁麻疹や血管性浮腫などの過敏反応。筋痛、倦怠感、無力症、および発熱の一過性の症状が FOSAMAX で報告されており、通常は治療の開始に関連しています。一般に素因となる状態に関連して、症候性低カルシウム血症が発生しています。末梢浮腫。
胃腸: 食道炎、食道びらん、食道潰瘍、食道狭窄または穿孔、および中咽頭潰瘍。重篤で合併症を伴う胃潰瘍または十二指腸潰瘍も報告されている[参照 投薬と管理 ; 警告と注意事項 ]。
一般に抜歯および/または治癒の遅延を伴う局所感染に関連する顎の限局性骨壊死が報告されている[参照 警告と注意事項 ]。
筋骨格: 骨、関節、および/または筋肉の痛み。 警告と注意事項 ];関節の腫れ;低エネルギー大腿骨幹および転子下骨折[参照 警告と注意事項 ]。
神経系: めまいとめまい。
肺: 喘息の急性増悪。
肌: 発疹(光過敏症を伴うこともあります)、かゆみ、脱毛症、スティーブンス・ジョンソン症候群および中毒性表皮壊死融解症を含む重度の皮膚反応。
特別な感覚: ブドウ膜炎、強膜炎または上強膜炎。外耳道の真珠腫(限局性骨壊死)。
薬物相互作用
カルシウムサプリメント/制酸剤
FOSAMAX とカルシウム、制酸剤、または多価陽イオンを含む経口薬を併用すると、FOSAMAX の吸収が妨げられます。したがって、他の経口薬を服用する前に、FOSAMAX 35mg を服用した後、少なくとも 30 時間待つように患者に指示してください。
アスピリン
臨床研究では、10mgを超えるFOSAMAX 35mgとアスピリン含有製品の併用療法を受けている患者で、上部消化管の有害事象の発生率が増加しました。
非ステロイド性抗炎症薬
FOSAMAX 35mg は、非ステロイド性抗炎症薬 (NSAID) を服用している患者に投与することができます。大多数の患者が NSAID を併用した 3 年間の対照臨床研究 (n=2027) では、上部消化管の有害事象の発生率は、FOSAMAX 5 または 10 mg/日を服用している患者とプラセボを服用している患者で同程度でした。ただし、NSAID の使用は胃腸の刺激に関連しているため、FOSAMAX との併用には注意が必要です。
警告
の一部として含まれています 予防 セクション。
予防
上部消化管の有害反応
FOSAMAX 35mg は、経口投与される他のビスフォスフォネートと同様に、上部消化管粘膜の局所刺激を引き起こす可能性があります。これらの刺激作用の可能性と基礎疾患の悪化の可能性があるため、FOSAMAX が活発な上部消化管の問題 (既知のバレット食道、嚥下障害、その他の食道疾患、胃炎、十二指腸炎、または潰瘍)。
食道炎、食道潰瘍、食道びらんなどの食道の有害な経験は、時には出血を伴い、食道狭窄または穿孔が続くことはめったになく、FOSAMAX を含む経口ビスフォスフォネートによる治療を受けている患者で報告されています。場合によっては、重症で入院が必要な場合もあります。したがって、医師は、食道反応の可能性を示す徴候や症状に注意する必要があり、患者は、嚥下障害、嚥下痛、胸骨後部の痛み、または胸焼けの新規または悪化を発症した場合は、FOSAMAX 70mg の使用を中止し、医師の診察を受けるように指示する必要があります。
重度の食道有害事象のリスクは、FOSAMAX 70mg を含む経口ビスフォスフォネートを服用した後に横になっている患者、および/または FOSAMAX 35mg を含む経口ビスフォスフォネートを推奨されるコップ 1 杯 (6 ~ 8 オンス) の水と一緒に飲み込めない患者でより大きくなるようです。 /または食道刺激を示唆する症状が現れた後、FOSAMAX 70mg を含む経口ビスフォスフォネートを服用し続けている人。したがって、完全な投与指示が患者に提供され、理解されることが非常に重要です[参照 投薬と管理 ]。精神障害のために投薬指示を遵守できない患者では、FOSAMAX による治療は適切な監督下で使用する必要があります。
ビスフォスフォネートの経口使用による胃潰瘍および十二指腸潰瘍の市販後報告があり、一部は重篤で合併症を伴うものもあるが、対照臨床試験ではリスクの増加は観察されなかった[参照 有害反応 ]。
ミネラル代謝
FOSAMAX による治療を開始する前に、低カルシウム血症を是正する必要があります。 禁忌 ]。ミネラル代謝に影響を与えるその他の障害 (ビタミン D 欠乏症など) も効果的に治療する必要があります。これらの状態の患者では、FOSAMAX による治療中に血清カルシウムと低カルシウム血症の症状を監視する必要があります。
おそらく、骨ミネラルの増加に対する FOSAMAX の効果により、特に治療前の骨代謝回転率が大幅に上昇している可能性があるパジェット病の患者では、血清カルシウムとリン酸塩の小さな無症候性の減少が起こる可能性があります。カルシウム吸収が低下する可能性があるグルココルチコイドを投与されている患者。
十分なカルシウムとビタミン D の摂取を確保することは、骨パジェット病の患者やグルココルチコイドを投与されている患者にとって特に重要です。
筋骨格痛
市販後の経験では、骨粗鬆症の予防と治療に承認されているビスフォスフォネートを服用している患者で、骨、関節、および/または筋肉の重度の、時には行動不能になるような痛みが報告されています。 有害反応 ]。このカテゴリーの薬には、FOSAMAX (アレンドロネート) が含まれます。患者のほとんどは閉経後の女性でした。症状の発現までの時間は、薬を開始してから 1 日から数か月までさまざまでした。症状がひどい場合は使用を中止してください。ほとんどの患者は、中止後に症状が緩和されました。同じ薬剤または別のビスフォスフォネートを再投与すると、一部の患者で症状が再発しました。
FOSAMAX のプラセボ対照臨床研究では、これらの症状を持つ患者の割合は、FOSAMAX 35mg とプラセボ群で同様でした。
あごの骨壊死
顎骨壊死 (ONJ) は、自然に発生する可能性があり、一般に抜歯および/または治癒の遅延を伴う局所感染に関連しており、FOSAMAX を含むビスフォスフォネートを服用している患者で報告されています。顎の骨壊死の既知の危険因子には、侵襲的な歯科処置(例、抜歯、歯科インプラント、骨形成術)、がんの診断、併用療法(例、化学療法、コルチコステロイド、血管新生阻害剤)、口腔衛生不良、併存症が含まれます。障害(例えば、歯周病および/または他の既存の歯科疾患、貧血、凝固障害、感染症、不適合な義歯)。 ONJ のリスクは、ビスフォスフォネートへの曝露期間とともに増加する可能性があります。
侵襲的な歯科処置を必要とする患者の場合、ビスフォスフォネート治療を中止すると、ONJ のリスクが低下する可能性があります。担当医および/または口腔外科医の臨床的判断は、個々の利益/リスク評価に基づいて各患者の管理計画を導く必要があります。
ビスフォスフォネート治療中に顎の骨壊死を発症した患者は、口腔外科医による治療を受けるべきです。これらの患者では、ONJ を治療するための大規模な歯科手術が状態を悪化させる可能性があります。個々のベネフィット/リスク評価に基づいて、ビスフォスフォネート療法の中止を検討する必要があります。
非定型転子下および骨幹大腿骨骨折
ビスフォスフォネート治療を受けた患者では、大腿骨幹の非定型、低エネルギー、または低外傷骨折が報告されています。これらの骨折は、小転子のすぐ下から顆上フレアの上までの大腿骨幹のどこにでも発生する可能性があり、粉砕の形跡がなく、横方向または短い斜め方向です。これらの骨折は、ビスフォスフォネートで治療されていない骨粗鬆症患者にも発生するため、因果関係は確立されていません。
非定型大腿骨骨折は、ほとんどの場合、患部への外傷が最小限またはまったくない状態で発生します。それらは両側性である可能性があり、多くの患者は、完全な骨折が発生する数週間から数か月前に、通常、鈍くうずく太ももの痛みとして現れる、患部の前駆痛を報告します.多くの報告は、患者が骨折時にグルココルチコイド(プレドニゾンなど)による治療も受けていたことを指摘しています。
大腿部または鼠径部の痛みを呈するビスフォスフォネート曝露歴のある患者は、非定型骨折を疑い、不完全な大腿骨骨折を除外するために評価する必要があります。非定型骨折を呈している患者は、対側肢の骨折の症状と徴候についても評価する必要があります。ビスフォスフォネート療法の中断は、リスク/ベネフィットの評価が保留されている間、個別に検討する必要があります。
腎障害
FOSAMAX 35mg は、クレアチニンクリアランスが 35 mL/min 未満の患者には推奨されません。
グルココルチコイド誘発性骨粗鬆症
グルココルチコイドの 1 日投与量が 7.5 mg 未満のプレドニゾンまたは同等量である場合の FOSAMAX のリスク対ベネフィットは確立されていません。 適応症と使用法 ]。治療を開始する前に、男性と女性の性腺ホルモンの状態を確認し、適切な代替品を検討する必要があります。
骨ミネラル密度の測定は、治療開始時に行い、FOSAMAX とグルココルチコイドの併用治療の 6 ~ 12 か月後に再度測定する必要があります。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
FOSAMAX による治療を開始する前に投薬ガイドを読み、処方が更新されるたびに読み直すように患者に指示してください。
カルシウムとビタミンDの補給を含む骨粗鬆症の推奨事項
毎日の食事摂取量が不十分な場合は、カルシウムとビタミン D を補給するように患者に指示します。これらの要因が存在する場合は、喫煙や過度のアルコール摂取などの特定の行動要因の修正とともに、体重負荷運動を考慮する必要があります。
投与指示
FOSAMAX 70mg の期待される利点は、その日の最初の飲食物、または薬の少なくとも 30 分前に起床して最初に普通の水で服用した場合にのみ得られることを患者に指示してください.オレンジ ジュースやコーヒーと一緒に服用しても、FOSAMAX の吸収が著しく減少することが示されています。 臨床薬理学 ]。
口腔咽頭潰瘍の可能性があるため、錠剤を噛んだり吸ったりしないように患者に指示してください。
FOSAMAX の各錠剤を一杯の水 (6 ~ 8 オンス) と一緒に飲み込んで、胃への送達を促進し、食道への刺激の可能性を減らすように患者に指示してください。 FOSAMAX 70mg 経口溶液を服用した後、胃内容物を排出しやすくするために、少なくとも 2 オンス (カップの 4 分の 1) の水を飲むように患者に指示してください。
少なくとも 30 分間は横にならないように患者に指示し、その日の最初の食事を終えるまでは注意してください。
就寝時またはその日の起床前に FOSAMAX を服用しないように患者に指示してください。これらの指示に従わないと、食道の問題のリスクが高まる可能性があることを患者に知らせる必要があります。
食道疾患の症状(嚥下困難または嚥下時の痛み、胸骨後部の痛み、胸やけの新規または悪化など)が発生した場合は、FOSAMAX の服用を中止し、医師に相談するよう患者に指示してください。
週 1 回の FOSAMAX 70mg の服用を患者が忘れた場合は、思い出した朝に 1 回服用するよう患者に指示します。同じ日に 2 回服用するべきではありませんが、選択した日に当初予定されていたように、週 1 回の服用に戻す必要があります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
ハーダー腺 (ヒトには存在しない後眼窩腺) 腺腫は、1、3、および 10 mg/kg/ の用量のアレンドロネートでの 92 週間の経口発がん性試験で、高用量の雌マウスで増加しました (p=0.003)。日 (男性) または 1、2、および 5 mg/kg/日 (女性)。これらの用量は、表面積に基づいて 40 mg の最高推奨臨床日用量の約 0.1 ~ 1 倍、mg/m² に相当します。この発見と人間との関連性は不明です。
傍濾胞細胞 (甲状腺) 腺腫は、1 および 3.75 mg/kg 体重の用量での 2 年間の経口発がん性試験で、高用量の雄ラットで増加しました (p=0.003)。これらの投与量は、表面積 mg/m² に基づく 40 mg の臨床 1 日投与量の約 0.3 倍と 1 倍に相当します。人間に対するこの知見の関連性は不明です。
アレンドロネートは、代謝活性化の有無にかかわらず in vitro 微生物突然変異誘発試験、in vitro 哺乳動物細胞突然変異誘発試験、ラット肝細胞を用いた in vitro アルカリ溶出試験、およびマウスを用いた in vivo 染色体異常試験において遺伝毒性を示さなかった。しかし、チャイニーズハムスターの卵巣細胞を用いた in vitro 染色体異常試験では、アレンドロネートはあいまいな結果を示しました。
アレンドロネートは、5 mg/kg/日 (表面積に基づく臨床的 1 日用量 40 mg の約 1 倍、mg/m²) までの経口投与では、ラットの生殖能力 (オスまたはメス) に影響を与えませんでした。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性における FOSAMAX の使用に関する入手可能なデータは、母体または胎児への有害転帰の薬物関連リスクを知らせるには不十分です。妊娠が認められた場合は、FOSAMAX 35mg を中止してください。
動物の繁殖研究では、交尾前から妊娠または授乳の終わりまでのラットへのアレンドロネートの毎日の経口投与は、推奨される最高の40 mgの臨床的1日用量の半分未満に相当する用量から開始して、着床後の生存率の低下と子犬の体重増加の減少を示しました(体表面積に基づく、mg/m²)。器官形成中のラットへのアレンドロネートの経口投与は、40mgの臨床日用量の3倍の用量で開始して、胎児骨化の減少をもたらした.同様の胎児への影響は、妊娠中のウサギに器官形成期に経口投与され、1 日臨床用量 40 mg の約 10 倍に相当する用量で観察されなかった。
母体の低カルシウム血症による子孫の出産の遅延または失敗、分娩の遅延、妊娠後期の母体および胎児の死亡が、40 mg の臨床 1 日用量の 10 分の 1 という低用量のラットで発生しました ( データ )。
ビスフォスフォネートは骨基質に取り込まれ、そこから何年にもわたって徐々に放出されます。成体の骨に取り込まれ、全身循環への放出に利用できるビスフォスフォネートの量は、ビスフォスフォネートの使用量と使用期間に直接関係しています。その結果、ビスフォスフォネートの作用機序に基づいて、女性がビスフォスフォネート療法のコースを完了した後に妊娠した場合、胎児、主に骨格に害を及ぼす潜在的なリスクがあります。ビスフォスフォネート療法の中止から受胎までの時間、使用される特定のビスフォスフォネート、および投与経路 (静脈内または経口) などの変数がリスクに及ぼす影響は研究されていません。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天異常、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
データ
動物データ
交配前から妊娠または授乳の終わりまで経口投与されたラットの生殖研究では、2 mg/kg/日から始まる着床後の生存率の低下と、1 mg/kg/日から始まる体重増加の減少が示されました。体表面積に基づく mg 臨床 1 日量、mg/m²。脊椎、頭蓋骨、および胸骨の骨における不完全な胎児骨化の発生率は、10 mg/kg/日 (40 mg の臨床 1 日用量の約 3 倍) から始まる器官形成期に経口投与されたラットで増加しました。同様の胎児への影響は、器官形成期に 35 mg/kg/日まで経口投与された妊娠ウサギでは観察されませんでした (40 mg の臨床 1 日用量の約 10 倍に相当)。
15 mg/kg/日のアレンドロネートを経口投与された妊娠ラットでは、総カルシウムとイオン化カルシウムの両方が減少し (40 mg の臨床 1 日用量の約 4 倍)、分娩の遅延と失敗が生じました。母体の低カルシウム血症による分娩の遅延は、ラットが交配前から妊娠期間まで 0.5 mg/kg/日 (40 mg の臨床 1 日用量の約 10 分の 1) から投与された場合に観察されました。妊娠期間を変えて 15 mg/kg/日 (1 日臨床用量 40 mg の約 4 倍) を経口投与した雌ラットでも、母体毒性 (妊娠後期の死亡) が発生した。これらの妊産婦死亡は減少しましたが、治療の中止によってゼロにはなりませんでした。 15 mg/kg/日のアレンドロネートを経口投与したラットに飲料水または皮下ミニポンプでカルシウムを補給しても、低カルシウム血症を改善することはできず、難産に関連する母体および新生児の死亡を防ぐこともできませんでした。しかし、静脈内カルシウム補給は母体の死亡を防いだが、新生児の死亡は防げなかった。
授乳
リスクの概要
アレンドロネートがヒトの母乳に存在するのか、母乳の生産に影響を与えるのか、母乳で育てられた乳児に影響を与えるのかは不明です.母乳育児の発達上および健康上の利点は、母親の FOSAMAX 70mg の臨床的必要性、および FOSAMAX または基礎となる母体の状態による母乳育児の子供への潜在的な悪影響とともに考慮されるべきです。
小児用
FOSAMAX 70mg は、小児患者には使用できません。
FOSAMAX の安全性と有効性は、4 ~ 18 歳の重度の骨形成不全症 (OI) の小児患者 139 人を対象とした無作為二重盲検プラセボ対照 2 年間試験で調べられました。 109 人の患者が毎日 5 mg FOSAMAX 35mg (体重 40 kg 未満) または 1 日 10 mg FOSAMAX 70 mg (体重 40 kg 以上) に無作為に割り付けられ、30 人の患者がプラセボに割り付けられました。患者の平均ベースライン腰椎 BMD Z スコアは -4.5 でした。ベースラインから 24 か月までの腰椎 BMD Z スコアの平均変化は、FOSAMAX 35mg 投与患者で 1.3、プラセボ投与患者で 0.1 でした。 FOSAMAX 35mg による治療では、骨折のリスクは減少しませんでした。研究の 12 か月目までに X 線検査で骨折が確認された FOSAMAX 患者の 16% は、プラセボ治療を受けた患者の 9% と比較して、24 か月目に X 線写真で評価した場合、骨折治癒 (仮骨リモデリング) または骨折の非癒合が遅れていました。 FOSAMAX 治療を受けた患者では、24 か月目に得られた骨組織形態計測データから、骨代謝回転の減少と石灰化時間の遅延が示されました。ただし、鉱化作用の欠陥はありませんでした。骨痛の軽減において、FOSAMAX 35mg 群とプラセボ群の間に統計的に有意な差はありませんでした。小児の経口バイオアベイラビリティは、成人で観察されたものと同様でした。
最長 24 か月間治療を受けた骨形成不全患者における FOSAMAX の全体的な安全性プロファイルは、FOSAMAX で治療された骨粗鬆症の成人とほぼ同様でした。しかし、FOSAMAX で治療した骨形成不全患者では、プラセボと比較して嘔吐の発生が増加しました。 24か月の治療期間中、FOSAMAX 70mgで治療された患者109人中32人(29.4%)とプラセボで治療された患者30人中3人(10%)で嘔吐が観察されました。
薬物動態研究では、FOSAMAX 35 または 70 mg の単回経口投与を受けた 24 人の小児骨形成不全患者のうち 6 人が、投与後 24 ~ 48 時間以内に発熱、インフルエンザ様症状、および/または軽度のリンパ球減少症を発症しました。これらのイベントは、2 ~ 3 日しか持続せず、アセトアミノフェンに反応するものであり、FOSAMAX を含むビスフォスフォネートを投与されている患者で報告されている急性期の反応と一致しています。 [見る 有害反応 ]
高齢者の使用
Fracture Intervention Trial (FIT) で FOSAMAX を投与された患者のうち、71% (n=2302) が 65 歳以上、17% (n=550) が 75 歳以上でした。米国で FOSAMAX 70mg を投与されている患者と、女性の多国籍骨粗鬆症治療研究、男性の骨粗鬆症研究、グルココルチコイド誘発骨粗鬆症研究、およびパジェット病研究[参照 臨床研究 ]、それぞれ 45%、54%、37%、および 70% が 65 歳以上でした。これらの患者と若い患者の間で有効性または安全性に全体的な違いは観察されませんでしたが、一部の高齢者の感度が高いことは除外できません。
腎障害
FOSAMAX 70mg は、クレアチニンクリアランスが 35 mL/min 未満の患者には推奨されません。クレアチニンクリアランス値が 35 ~ 60 mL/min の患者では、投与量の調整は必要ありません。 臨床薬理学 ]。
肝障害
アレンドロネートが胆汁で代謝または排泄されないという証拠があるため、肝障害のある患者での研究は行われませんでした.投与量の調整は必要ありません [参照 臨床薬理学 ]。
過剰摂取
単回経口投与後の有意な致死率は、552 mg/kg (3256 mg/m²) および 966 mg/kg (2898 mg/m²) の雌ラットおよびマウスでそれぞれ見られました。男性では、これらの値はわずかに高く、それぞれ 626 および 1280 mg/kg でした。 200 mg/kg (4000 mg/m²) までの経口投与では、犬に致死率はありませんでした。
FOSAMAX による過剰摂取の治療に関する具体的な情報はありません。低カルシウム血症、低リン血症、および胃のむかつき、胸やけ、食道炎、胃炎、または潰瘍などの上部消化管の有害事象は、経口の過剰摂取に起因する可能性があります。アレンドロネートを結合させるために牛乳または制酸剤を投与する必要があります。食道刺激のリスクがあるため、嘔吐を誘発してはならず、患者は完全に直立したままにしておく必要があります。
透析は有益ではありません。
禁忌
FOSAMAX 35mg は、以下の状態の患者には禁忌です。
- 狭窄やアカラシアなど、食道が空になるのを遅らせる食道の異常[参照 警告と注意事項 ]
- 少なくとも 30 分間直立または直立座位できない [参照 投薬と管理 ; 警告と注意事項 ]
- 誤嚥のリスクが高い患者には、FOSAMAX 35mg 経口溶液を投与しないでください。
- 低カルシウム血症 [参照 警告と注意事項 ]
- この製品の成分に対する過敏症。蕁麻疹や血管性浮腫などの過敏反応が報告されている[参照 有害反応 ]。
臨床薬理学
作用機序
動物実験では、次の作用機序が示されています。細胞レベルでは、アレンドロネートは骨吸収部位、特に破骨細胞の下に優先的に局在します。破骨細胞は骨の表面に正常に付着しますが、活発な吸収を示す波状の境界がありません。アレンドロネートは破骨細胞の動員や付着を妨げませんが、破骨細胞の活動を阻害します。骨における放射性[3H]アレンドロネートの局在に関するマウスの研究では、骨芽細胞表面よりも破骨細胞表面に約10倍高い取り込みが示されました。 [3H]アレンドロネートをラットに投与してから 6 日後、マウスに投与してから 49 日後に骨を調べたところ、マトリックスの内部に取り込まれたアレンドロネートの上に正常な骨が形成されていることがわかりました。アレンドロネートは骨基質に組み込まれていますが、薬理活性はありません。したがって、新しく形成された吸収面で破骨細胞を抑制するには、アレンドロネートを継続的に投与する必要があります。ヒヒおよびラットにおける組織形態計測は、アレンドロネート処置が骨代謝回転(すなわち、骨が再構築される部位の数)を減少させることを示した。さらに、これらのリモデリング部位では骨形成が骨吸収を上回り、骨量が徐々に増加します。

薬力学
アレンドロネートは、骨ヒドロキシアパタイトに結合し、骨吸収細胞である破骨細胞の活性を特異的に阻害するビスフォスフォネートです。アレンドロネートは、骨形成に直接影響を与えずに骨吸収を減少させますが、骨代謝回転中に骨吸収と形成が連動するため、後者のプロセスは最終的に減少します。
閉経後の女性における骨粗鬆症
骨粗しょう症は、骨折のリスクを高める低骨量を特徴としています。診断は、低骨量、X 線での骨折の証拠、骨粗鬆症性骨折の病歴、または脊椎(脊椎)骨折を示す身長の減少または脊柱後弯症の所見によって確認できます。骨粗鬆症は男性と女性の両方で発生しますが、骨代謝回転が増加し、骨吸収率が骨形成率を超える閉経後の女性に最も一般的です。これらの変化は、進行性の骨量減少をもたらし、50 歳以上の女性のかなりの割合で骨粗鬆症を引き起こします。通常、脊椎、股関節、および手首の骨折が一般的な結果です。 50 歳から 90 歳までの間に、白人女性の股関節骨折のリスクは 50 倍、脊椎骨折のリスクは 15 倍から 30 倍に増加します。 50 歳の女性の約 40% が、骨粗しょう症に関連して脊椎、股関節、または手首の骨折を残りの生涯で 1 回以上受けると推定されています。特に、股関節骨折は、実質的な罹患率、障害、および死亡率と関連しています。
閉経後の女性にアレンドロネートを毎日経口投与すると (5、20、40 mg を 6 週間)、尿中カルシウムや骨コラーゲン分解の尿中マーカー (デオキシピリジノリンやクロスタイプ I コラーゲンの結合した N-テロペプチド)。これらの生化学的変化は、アレンドロネートによる治療の中止後、早くも 3 週間後にベースライン値に戻る傾向があり、7 か月後にはプラセボと差がありませんでした。
FOSAMAX 10 mg/日による骨粗鬆症の長期治療 (最大 5 年間) は、骨吸収のマーカーであるデオキシピリジノリンおよび I 型コラーゲンの架橋 N-テロペプチドの尿中排泄を、それぞれ約 50% および 70% 減少させました。 、健康な閉経前の女性に見られるレベルと同様のレベルに到達します。同様の減少は、FOSAMAX 5 mg/日を投与された骨粗鬆症予防研究の患者でも見られました。これらのマーカーによって示される骨吸収速度の低下は、早ければ 1 か月で明らかであり、3 ~ 6 か月でプラトーに達し、FOSAMAX による治療の全期間にわたって維持されました。骨粗鬆症治療研究では、FOSAMAX 10mg/日は、骨形成のマーカー、オステオカルシンおよび骨特異的アルカリホスファターゼを約50%減少させ、総血清アルカリホスファターゼを約25~30%減少させ、6~12ヶ月後にプラトーに達した.骨粗鬆症予防研究では、FOSAMAX 5mg/日はオステオカルシンと総血清アルカリホスファターゼをそれぞれ約40%と15%減少させました。骨粗鬆症の治療のために週 1 回 FOSAMAX 70 mg を週 1 回、骨粗鬆症の予防のために週 1 回 FOSAMAX 35 mg を 1 年間投与した研究で、閉経後の女性で同様の骨代謝回転速度の低下が観察されました。これらのデータは、骨内に沈着するアレンドロネートの総量が徐々に増加しているにもかかわらず、骨代謝回転率が新しい定常状態に達したことを示しています。
骨吸収の阻害の結果として、FOSAMAX による治療後、血清カルシウムおよびリン酸塩濃度の無症候性の低下も観察されました。長期試験では、FOSAMAX 10 mg の開始後最初の 1 か月で、血清カルシウム (約 2%) とリン酸塩 (約 4 ~ 6%) のベースラインからの減少が明らかでした。 5年間の治療期間中、血清カルシウムのさらなる減少は観察されませんでした。しかし、血清リン酸塩は、3 年から 5 年の間に研究前のレベルに戻りました。 FOSAMAX 5 mg/日でも同様の減少が観察されました。 FOSAMAX 35 および 70 mg を週 1 回投与する 1 年間の研究では、6 か月および 12 か月で同様の減少が観察されました。血清リン酸塩の減少は、FOSAMAX 70mg による骨ミネラルバランスの改善だけでなく、腎臓でのリン酸塩再吸収の減少も反映している可能性があります。
男性の骨粗しょう症
骨粗鬆症の男性をFOSAMAX 10 mg/日で2年間治療すると、I型コラーゲンの架橋N-テロペプチドの尿中排泄が約60%減少し、骨特異的アルカリホスファターゼが約40%減少しました。同様の減少が、骨粗鬆症の男性を対象に週 1 回 FOSAMAX 70 mg を 1 年間投与した 1 年間の研究でも観察されました。
グルココルチコイド誘発性骨粗鬆症
グルココルチコイドの継続的な使用は、一般に骨粗鬆症の発症とそれに伴う骨折 (特に脊椎、股関節、および肋骨) に関連しています。それは、すべての年齢の男性と女性の両方に発生します。骨粗鬆症は、骨形成の阻害と骨吸収の増加の結果として発生し、その結果、正味の骨量が減少します。アレンドロネートは、骨形成を直接阻害することなく、骨吸収を減少させます。
最長 2 年間の臨床研究で'期間、FOSAMAX 5 および 10 mg/日は、I 型コラーゲンの架橋 N-テロペプチド (骨吸収のマーカー) を約 60% 減少させ、骨特異的アルカリホスファターゼおよび総血清アルカリホスファターゼ (骨形成のマーカー) を減少させました。それぞれ約 15 ~ 30% および 8 ~ 18% です。骨吸収の阻害の結果として、FOSAMAX 5 および 10 mg/日は、血清カルシウム (約 1 ~ 2%) および血清リン酸塩 (約 1 ~ 8%) の無症候性の減少を誘発しました。
骨のパジェット病
骨のパジェット病は、大幅に増加した無秩序な骨リモデリングを特徴とする、慢性の限局性骨格障害です。過剰な破骨細胞の骨吸収に続いて造骨細胞の新しい骨が形成され、正常な骨構造が、組織化されず、肥大し、弱体化した骨構造に置き換わります。
パジェット病の臨床症状は、無症状から、骨の痛み、骨の変形、病的骨折、神経学的およびその他の合併症による重度の罹患率にまで及びます。最も頻繁に使用される疾患活動性の生化学的指標である血清アルカリホスファターゼは、疾患の重症度と治療への反応の客観的な尺度を提供します。
FOSAMAX 70mg は、骨吸収率を直接低下させ、骨形成を間接的に低下させます。臨床試験では、FOSAMAX 40 mg を 1 日 1 回 6 か月間投与すると、血清アルカリホスファターゼと骨コラーゲン分解の尿中マーカーが大幅に減少しました。骨吸収の阻害の結果として、FOSAMAX は一般に、血清カルシウムとリン酸塩の軽度、一過性、および無症候性の減少を引き起こしました。
薬物動態
吸収
静脈内参照用量と比較して、女性におけるアレンドロネートの平均経口バイオアベイラビリティは、一晩の絶食後と標準化された朝食の2時間前に投与された場合、5〜70 mgの範囲の用量で0.64%でした.男性における 10 mg 錠剤の経口バイオアベイラビリティ (0.59%) は、一晩絶食した後、朝食の 2 時間前に投与した場合の女性と同様でした。
FOSAMAX 70 mg 経口溶液と FOSAMAX 70 mg 錠剤は、生物学的に同等に利用可能です。
アレンドロネートのバイオアベイラビリティに対する食事のタイミングの影響を調べる研究が、49 人の閉経後の女性で行われました。アレンドロネート 10 mg を標準化された朝食の 0.5 時間前または 1 時間前に投与すると、食事の 2 時間前に投与した場合と比較して、バイオアベイラビリティが低下しました (約 40%)。骨粗鬆症の治療と予防に関する研究では、アレンドロネートは朝食の少なくとも30分前に投与すると効果的でした.
バイオアベイラビリティは、アレンドロネートが標準化された朝食と一緒に投与された場合でも、標準化された朝食の2時間後まで投与された場合でも、ごくわずかでした.アレンドロネートとコーヒーまたはオレンジ ジュースの併用投与により、バイオアベイラビリティが約 60% 低下しました。
分布
前臨床試験 (雄ラット) では、アレンドロネートが 1 mg/kg の静脈内投与後に一時的に軟部組織に分布するが、その後急速に骨に再分布するか、尿中に排泄されることが示されています。骨を除いた分布の平均定常状態体積は、ヒトでは少なくとも 28 L です。治療用経口投与後の血漿中の薬物濃度は、分析検出するには低すぎます (5 ng/mL 未満)。ヒト血漿中のタンパク質結合は約 78% です。
代謝
アレンドロネートが動物またはヒトで代謝されるという証拠はありません。
排泄
[14C]アレンドロネートの単回静脈内投与後、放射能の約 50% が 72 時間以内に尿中に排泄され、糞便中には放射能がほとんどまたはまったく回収されませんでした。 10 mg の単回静脈内投与後、アレンドロネートの腎クリアランスは 71 mL/分 (64、78; 90% 信頼区間 [CI]) であり、全身クリアランスは 200 mL/分を超えませんでした。血漿濃度は、静脈内投与後 6 時間以内に 95% 以上低下しました。ヒトの最終半減期は 10 年を超えると推定されており、これはおそらく骨格からのアレンドロネートの放出を反映している.上記に基づいて、FOSAMAX (1 日 10 mg) による 10 年間の経口治療後、骨格から毎日放出されるアレンドロネートの量は、消化管から吸収される量の約 25% であると推定されます。
特定の集団
性別
バイオアベイラビリティと尿中に排泄される静脈内投与量の割合は、男性と女性で類似していました。
高齢者
バイオアベイラビリティと体質(尿中排泄)は、高齢患者と若年患者で同様でした。高齢患者では用量調整は必要ありません。
人種
人種による薬物動態の違いは研究されていません。
腎障害
前臨床試験では、腎不全のラットでは、血漿、腎臓、脾臓、および脛骨に存在する薬物の量が増加していることが示されています。健常者では、骨に沈着していない薬物は尿中に急速に排泄されます。若い雄ラットに 35 mg/kg の累積静脈内投与を 3 週間行った後、骨取り込みの飽和の証拠は見られませんでした。正式な腎機能障害の薬物動態研究は患者で実施されていませんが、動物と同様に、腎機能障害のある患者では腎臓を介したアレンドロネートの排泄が減少する可能性があります。したがって、腎機能障害のある患者では、骨へのアレンドロネートの蓄積がいくぶん大きくなることが予想されます。
クレアチニンクリアランスが 35 ~ 60 mL/min の患者では、用量調整は必要ありません。 FOSAMAX 35mg は、腎不全でアレンドロネートを使用した経験がないため、クレアチニンクリアランスが 35 mL/min 未満の患者には推奨されません。
肝障害
アレンドロネートが胆汁で代謝または排泄されないという証拠があるため、肝障害のある患者での研究は行われませんでした.投与量の調整は必要ありません。
薬物相互作用
ラニチジンの静脈内投与は、経口アレンドロネートのバイオアベイラビリティを 2 倍にすることが示されました。この増加したバイオアベイラビリティの臨床的意義、および H2 拮抗薬を経口投与された患者で同様の増加が起こるかどうかは不明です。
健康な被験者では、経口プレドニゾン (20 mg を 1 日 3 回、5 日間) は、アレンドロネートの経口バイオアベイラビリティーに臨床的に意味のある変化をもたらしませんでした (20 から 44% の範囲の平均増加)。
カルシウムやその他の多価陽イオンを含む製品は、アレンドロネートの吸収を妨げる可能性があります。
動物毒物学および/または薬理学
アレンドロネートとエチドロネートの骨吸収とミネラル化に対する相対的な阻害活性は、成長中のラットの骨端の組織学的検査に基づくシェンクアッセイで比較されました。このアッセイでは、骨の石灰化を妨害した (骨軟化症を引き起こす) アレンドロネートの最低用量は、抗吸収用量の 6000 倍でした。エチドロネートの対応する比率は 1 対 1 でした。これらのデータは、治療用量で投与されたアレンドロネートが骨軟化症を誘発する可能性が非常に低いことを示唆しています。
臨床研究
閉経後の女性における骨粗鬆症の治療
毎日の投薬
日 10 mg の FOSAMAX の有効性は、4 つの臨床試験で評価されました。スタディ 1 は、3 年間の多施設共同二重盲検プラセボ対照米国臨床試験で、BMD T スコアがマイナス 2.5 以下の 478 人の患者を登録し、以前の椎骨骨折の有無を問わなかった。スタディ 2 は、3 年間の多施設共同二重盲検プラセボ対照多国籍臨床試験で、BMD T スコアがマイナス 2.5 以下の 516 人の患者を登録し、以前の椎骨骨折の有無を問わなかった。スタディ 3、骨折介入試験 (FIT) の 3 年間のスタディは、ベースラインで少なくとも 1 つの椎体骨折を有する 2027 人の閉経後患者を登録したスタディです。研究 4、FIT の 4 年間の研究: 骨量は少ないがベースラインの椎体骨折のない 4,432 人の閉経後患者を登録した研究。
骨折発生率への影響
脊椎骨折の発生率に対する FOSAMAX の効果を評価するために (デジタル化された X 線撮影によって検出され、これらの約 3 分の 1 は臨床的に症候性でした)、米国および多国籍の研究が組み合わされて、プラセボと FOSAMAX のプールされた投与量グループを比較する分析が行われました (5または 10 mg を 3 年間、または 20 mg を 2 年間、その後 5 mg を 1 年間)。プラセボで治療された患者と比較して、FOSAMAX 70mg で治療された患者の割合が統計的に有意に減少しました (3.2% 対 6.2%; 相対リスクの減少 48%)。新たな脊椎骨折の総数の減少も観察されました (患者 100 人あたり 4.2 対 11.3)。プールされた分析では、FOSAMAX を投与された患者の身長の減少は、プラセボを投与された患者よりも統計的に有意に低かった (-3.0 mm 対 -4.6 mm)。
Fracture Intervention Trial (FIT) は、閉経後の女性を対象とした 2 つの研究で構成されていました。ベースラインで少なくとも 1 つの X 線撮影による脊椎骨折があった患者の 3 年間の研究と、骨量が少ないがベースラインの脊椎骨折のない患者の 4 年間の研究です。 FIT の両方の研究で、無作為化された患者の 96% が研究を完了しました (すなわち、研究の予定された終了時にクローズアウトの訪問を受けました)。患者の約 80% は、完了時にまだ治験薬を服用していました。
Fracture Intervention Trial: 3 年間の研究 (少なくとも 1 つのベースライン X 線撮影による脊椎骨折のある患者)
この無作為化二重盲検プラセボ対照 2027 患者試験 (FOSAMAX 70mg、n=1022; プラセボ、n=1005) は、表 6 に示すように、FOSAMAX による治療が 3 年後の骨折発生率の統計的に有意な減少をもたらすことを実証しました。 .
さらに、このベースライン椎体骨折患者集団では、FOSAMAX による治療により入院の発生率が大幅に減少しました (25.0% 対 30.7%)。
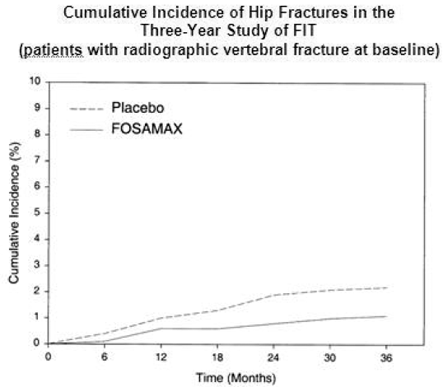
FIT の 3 年間の研究では、プラセボ群の 1005 人の患者のうち 22 人 (2.2%)、FOSAMAX の 1022 人の患者のうち 11 人 (1.1%) で股関節の骨折が発生しました (p=0.047)。図 1 は、この研究における股関節骨折の累積発生率を示しています。
図 1: FIT の 3 年間の研究における股関節骨折の累積発生率 (ベースラインで X 線撮影による椎体骨折のある患者)
骨折介入試験: 4 年間の研究 (骨量は少ないがベースラインのレントゲン写真による脊椎骨折のない患者)
このランダム化、二重盲検、プラセボ対照、4432 人の患者の研究 (FOSAMAX 70mg、n=2214; プラセボ、n=2218) は、FOSAMAX による骨折発生率の減少をさらに調査しました。この研究の目的は、ベースラインの大腿骨頸部 BMD が若年成人女性の平均値より少なくとも 2 標準偏差低いと定義される骨粗鬆症の女性を募集することでした。ただし、その後の大腿骨頸部 BMD の基準値の改訂により、患者の 31% がこの登録基準を満たしていないことが判明したため、この研究には骨粗鬆症の女性と非骨粗鬆症の女性の両方が含まれていました。骨粗鬆症患者の結果を表7に示す。
スタディ全体の骨折結果
FIT の 3 年間の研究では、FOSAMAX 35mg により、少なくとも 1 回の X 線撮影による新たな脊椎骨折を経験した女性の割合が 15.0% から 7.9% に減少しました (47% の相対リスク減少、p
FOSAMAX は、複数の (2 つ以上の) 新たな脊椎骨折を経験している女性の割合を、米国/多国籍共同研究で 4.2% から 0.6% (87% 相対リスク減少、p
このように、FOSAMAX 35mg は、骨粗鬆症の女性の X 線検査による脊椎骨折の発生率を、以前に X 線検査による脊椎骨折があったかどうかにかかわらず減少させました。
骨密度への影響
骨粗鬆症(閉経前の平均よりも少なくとも標準偏差の 2 倍低い腰椎の骨ミネラル密度 [BMD])を有する 44 ~ 84 歳の閉経後の女性における FOSAMAX 10 mg の 1 日 1 回の骨ミネラル密度の有効性は、4 つのダブル2、3 年間の盲検プラセボ対照臨床試験'間隔。
図 2 は、これらの各研究の 3 年間でのプラセボ治療患者と比較した、FOSAMAX 10 mg/日を投与された患者の腰椎、大腿骨頸部、および転子の BMD の平均増加を示しています。
図 2: 閉経後の女性における骨粗鬆症治療研究 3 年間で FOSAMAX 10mg/日で BMD が増加
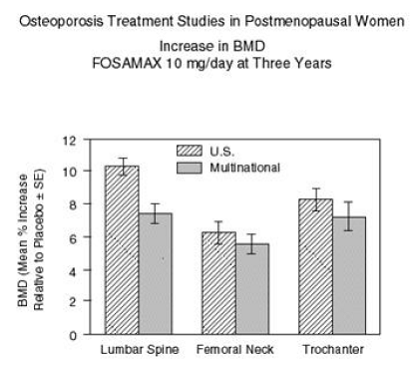
FOSAMAX 10mg/日を投与された患者の各研究の各測定部位で、ベースラインとプラセボの両方と比較して、3年でBMDの有意な増加が見られました.全身BMDも各研究で有意に増加し、脊椎と股関節の骨量の増加が他の骨格部位を犠牲にして発生したのではないことを示唆しています. BMD の増加は、早ければ 3 か月で明らかであり、3 年間の治療を通じて継続しました。 (腰椎の結果については、図 3 を参照してください。)これらの研究の 2 年間の延長では、147 人の患者を FOSAMAX 10 mg/日で治療すると、腰椎と転子の BMD が継続的に増加しました (3 年目から5: 腰椎、0.94%; 転子、0.88%)。大腿骨頸部、前腕、および全身の骨密度は維持されました。 FOSAMAX は、年齢、人種、ベースラインの骨代謝回転率、ベースラインの BMD に関係なく、調査した範囲 (閉経前の平均よりも少なくとも 2 標準偏差) にかかわらず、同様に効果的でした。
図 3: 閉経後の女性における骨粗鬆症治療研究 FOSAMAX 10mg/日とプラセボの効果の経時変化: ベースラインからの腰椎 BMD 変化率
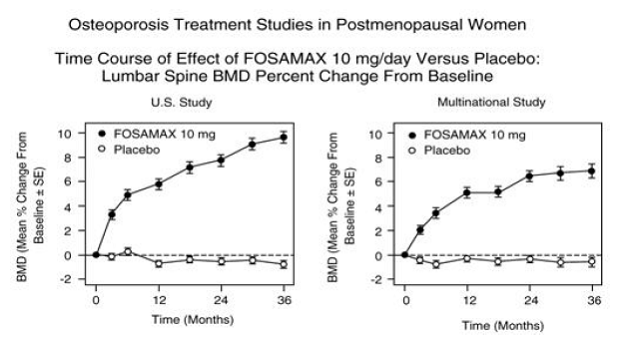
FOSAMAX 10 mg/日で 1 ~ 2 年間治療された閉経後骨粗鬆症患者において、治療中止の影響が評価されました。中止後、骨量のさらなる増加は見られず、骨量減少率はプラセボ群と同程度でした.
骨組織学
骨粗鬆症の閉経後患者 270 人を対象に、FOSAMAX を 1 ~ 20 mg/日の用量で 1、2、または 3 年間投与したところ、正常な石灰化と構造が明らかになり、プラセボと比較して予想される骨代謝回転の減少が見られました。これらのデータは、長期のアレンドロネート治療にさらされたラットとヒヒで観察された正常な骨組織学と骨強度の増加とともに、FOSAMAX 35mg による治療中に形成された骨が正常な品質であるという結論を支持します。
高さへの影響
FOSAMAX は、3 年または 4 年の期間にわたって、ベースラインのレントゲン写真による椎体骨折の有無にかかわらず、プラセボと比較して統計的に有意な身長減少の減少と関連していました。 FIT 研究の終了時、治療群間の差は 3 年研究で 3.2 mm、4 年研究で 1.3 mm でした。
毎週の投薬
週 1 回の FOSAMAX 70 mg (n=519) と 1 日 10 mg の FOSAMAX 10 mg (n=370) の治療上の同等性は、骨粗鬆症の閉経後の女性を対象とした 1 年間の二重盲検多施設試験で実証されました。完了者の一次分析では、1 年での腰椎 BMD のベースラインからの平均増加は、70mg 週 1 回投与群 (n=440) で 5.1% (4.8、5.4%; 95% CI)、5.4% ( 5.0、5.8%; 95% CI) 10 mg の毎日のグループ (n = 330)。 2 つの治療群は、他の骨格部位での BMD の増加に関しても同様でした。治療意図分析の結果は、完了者の一次分析と一致していました。
エストロゲン/ホルモン補充療法 (HRT) との併用
日 1 回の FOSAMAX 10 mg と抱合型エストロゲン (0.625 mg/日) の単独または併用による BMD への影響は、子宮摘出された閉経後の骨粗鬆症の女性 (n= 425)。 2 年後、ベースラインからの腰椎 BMD の増加は、エストロゲン単独または FOSAMAX 単独の場合 (どちらも 6.0%) よりも、組み合わせた場合 (8.3%) の方が有意に大きかった。
HRT(エストロゲン±プロゲスチン)の一定用量(少なくとも1年間)にFOSAMAX 35mgを追加した場合のBMDへの影響は、閉経後の骨粗鬆症の女性(n = 428)を対象とした1年間の二重盲検プラセボ対照試験で評価されました. HRT に FOSAMAX 10 mg を 1 日 1 回追加すると、1 年後に、HRT 単独 (1.1%) に比べて腰椎 BMD (3.7%) が大幅に増加しました。
これらの研究では、HRT 単独と比較して併用療法の BMD の有意な増加または好ましい傾向が、股関節全体、大腿骨頸部、および転子で見られました。全身の BMD に有意な影響は見られませんでした。
92 人の被験者における経腸骨生検の組織形態計測研究では、正常な骨構造が示されました。プラセボと比較して、FOSAMAX 35mg と HRT を併用した 18 か月の併用治療では、骨代謝回転が 98% 抑制されました (表面のミネラル化によって評価)。FOSAMAX 35mg 単独では 94%、HRT 単独では 78% でした。 FOSAMAX 35mg と HRT の併用による骨折の発生と治癒に対する長期的な影響は研究されていません。
閉経後の女性における骨粗鬆症の予防
毎日の投薬
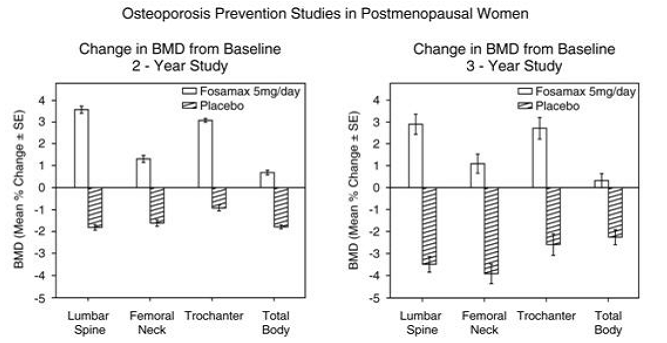
40~60 歳の閉経後の女性を対象とした 2 つの二重盲検プラセボ対照試験で、骨量減少の予防が実証されました。少なくとも閉経後 6 か月の 1,609 人の患者 (FOSAMAX 5 mg/日; n=498) が、ベースラインの BMD に関係なく 2 年間の研究に参加しました。もう 1 つの研究では、閉経後 6 か月から 3 年の 447 人の患者 (FOSAMAX 5 mg/日、n=88) が最長 3 年間治療を受けました。プラセボ治療を受けた患者では、年間約 1% の BMD 損失が、脊椎、股関節 (大腿骨頸部および転子) および全身で見られました。対照的に、FOSAMAX 5 mg/日は、大多数の患者で骨量減少を防ぎ、これらの各部位の平均骨量を有意に増加させました (図 4 を参照)。さらに、FOSAMAX 5 mg/日は、前腕の骨量減少率をプラセボと比較して約半分に減少させました。 FOSAMAX 5 mg/日は、年齢、閉経からの経過時間、人種、骨代謝回転のベースライン速度に関係なく、この集団で同様に効果的でした.
図4:閉経後の女性における骨粗鬆症予防研究
骨組織学
FOSAMAX を最大 10 mg/日の用量で投与された 3 年の終わりに生検を行った 28 人の患者の骨の組織像は正常でした。
毎週の投薬
週 1 回の FOSAMAX 35 mg (n=362) と FOSAMAX 5 mg の毎日 (n=361) の治療上の同等性は、骨粗鬆症のない閉経後の女性を対象とした 1 年間の二重盲検多施設試験で実証されました。完了者の一次分析では、1 年での腰椎 BMD のベースラインからの平均増加は、35 mg 週 1 回投与群 (n=307) で 2.9% (2.6、3.2%; 95% CI)、3.2% ( 2.9、3.5%; 95% CI) 5 mg の毎日のグループ (n = 298)。 2 つの治療群は、他の骨格部位での BMD の増加に関しても同様でした。治療意図分析の結果は、完了者の一次分析と一致していました。
骨粗鬆症の男性の骨量を増加させる治療
性腺機能低下症または特発性骨粗鬆症の男性における FOSAMAX 35mg の有効性は、2 つの臨床研究で実証されています。
毎日の投薬
FOSAMAX 10 mg を 1 日 1 回投与する 2 年間の二重盲検プラセボ対照多施設研究では、31 歳から 87 歳までの合計 241 人の男性 (平均 63 歳) が登録されました。試験に参加したすべての患者は、大腿骨頸部の BMD T スコアが -2 以下で腰椎の BMD T スコアが -1 以下であるか、ベースラインの骨粗鬆症性骨折で BMD T スコアが大腿骨頸部で -1 に等しい。 2 年後、FOSAMAX 10 mg/日を投与された男性の BMD のプラセボと比較した平均増加は、以下の部位で顕著でした。大腿骨頸部、2.6%。転子、3.1%。そして全身、1.6%。 FOSAMAX 70mg による治療でも、身長の減少が減少しました (FOSAMAX、-0.6 mm vs. プラセボ、-2.4 mm)。
毎週の投薬
FOSAMAX 70 mg を週 1 回投与する 1 年間の二重盲検プラセボ対照多施設研究では、38 歳から 91 歳までの合計 167 人の男性 (平均 66 歳) が登録されました。この研究の患者は、大腿骨頸部で-2以下、腰椎で-1以下のBMD Tスコア、または大腿骨頸部で-2以下のBMD Tスコアのいずれかでした。腰椎および大腿骨頸部で-1以下、またはベースラインの骨粗鬆症性骨折および大腿骨頸部でのBMD Tスコアが-1以下。 1 年後、週 1 回 FOSAMAX 70 mg を投与された男性の BMD のプラセボと比較した平均増加は、以下の部位で顕著でした。大腿骨頸部、1.9%。転子、2.0%;そして全身、1.2%。これらの BMD の増加は、10 mg を 1 日 1 回投与する研究で 1 年間に見られたものと同様でした。
両方の研究で、年齢 (65 歳以上 vs. 65 歳未満)、性腺機能 (ベースライン テストステロン 9 ng/dL 未満 vs. 9 ng/dL 以上) に関係なく、BMD 反応は同様でした。 、またはベースライン BMD (大腿骨頚部および腰椎の T スコアが -2.5 以下 vs. -2.5 より大きい)。
グルココルチコイド誘発性骨粗鬆症の治療
グルココルチコイド(少なくとも 7.5 mg/日または同等のプレドニゾン)を服用している男女における FOSAMAX 5 および 10 mg の 1 日 1 回の有効性は、2 つの 1 年間の二重盲検無作為化プラセボ対照多施設試験で実証されました。 1 つは米国で実施され、もう 1 つは 15 の異なる国で実施された (多国籍 [これには FOSAMAX 2.5 mg/日も含まれる])。これらの研究には、17 歳から 83 歳までのさまざまなグルココルチコイドを必要とする疾患を持つ 232 人および 328 人の患者が登録されました。患者はカルシウムとビタミン D の補給を受けました。図 5 は、各研究で FOSAMAX 5 mg/日を投与された患者の腰椎、大腿骨頸部、および転子の BMD のプラセボと比較した平均増加を示しています。
図 5: グルココルチコイド治療を受けた患者の研究では、1 年で FOSAMAX 5 mg/日で BMD が増加
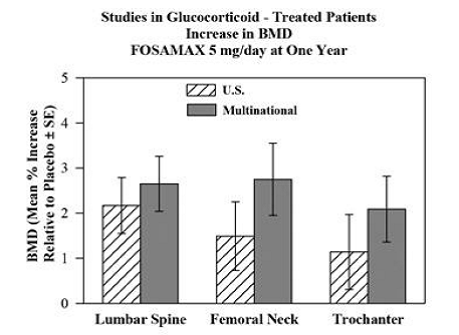
1年後、FOSAMAX 5mg/日を投与された患者のこれらの部位のそれぞれでの複合試験で、BMDのプラセボと比較して有意な増加が見られました.プラセボで治療された患者では、BMD の有意な減少が大腿骨頸部で発生し (-1.2%)、腰椎と転子でより小さな減少が見られました。全身のBMDは、FOSAMAX 5 mg/日で維持されました。 FOSAMAX 10 mg/日による BMD の増加は、エストロゲン療法を受けていない閉経後の女性を除くすべての患者で、FOSAMAX 5 mg/日の場合と同様でした。これらの女性では、FOSAMAX 10 mg/日の増加 (プラセボとの比較) は、FOSAMAX 5 mg/日の場合よりも腰椎 (4.1% 対 1.6%) および転子 (2.8% 対 1.7%) で大きかった。しかし、他のサイトではありません。 FOSAMAX 35mg は、グルココルチコイドの使用量や使用期間に関係なく効果的でした。さらに、FOSAMAX は、年齢 (65 歳未満対 65 歳以上)、人種 (白人対その他の人種)、性別、基礎疾患、ベースライン BMD、ベースライン骨代謝回転、およびさまざまな一般的な薬。
年の終わりに 10 mg/日までの用量で FOSAMAX を投与された 49 人の患者の生検では、骨の組織像は正常でした。
これらの研究の最初の 560 人の患者のうち、少なくとも 7.5 mg/日または同等のプレドニゾンを服用し続けた 208 人の患者は、1 年間の二重盲検延長を続けました。 2 年間の治療後、脊椎の BMD は、FOSAMAX 5 および 10 mg/日のプラセボと比較して、それぞれ 3.7% および 5.0% 増加しました。 BMD の有意な増加 (プラセボと比較して) も、大腿骨頸部、転子、および全身で観察されました。
1 年後、FOSAMAX 5 または 10 mg/日 (プール) で治療された患者の 2.3% に対して、プラセボで治療された患者の 3.7% が新たな椎体骨折を経験しました (有意ではありません)。しかし、2 年間研究された集団では、FOSAMAX による治療 (プールされた用量群: 5 または 10 mg を 2 年間、または 2.5 mg を 1 年間、続いて 10 mg を 1 年間) は、新たな椎体骨折患者の発生率を有意に減少させました。 (FOSAMAX 0.7% 対 プラセボ 6.8%)。
骨パジェット病の治療
FOSAMAX 40 mg を 1 日 1 回 6 か月間投与した場合の有効性は、中等度から重度のパジェット病 (アルカリホスファターゼが正常上限の少なくとも 2 倍) の男女患者を対象とした 2 つの二重盲検臨床試験で実証されました。エチドロン酸二ナトリウム 400 mg/日を用いた多国籍共同研究および米国比較研究。図 6 は、6 か月までの無作為化治療における血清アルカリホスファターゼのベースラインからの平均変化率を示しています。
図 6 : FOSAMAX 40mg/日とプラセボまたはエチドロネート 400mg/日の血清アルカリホスファターゼに対する骨効果のパジェット病の研究
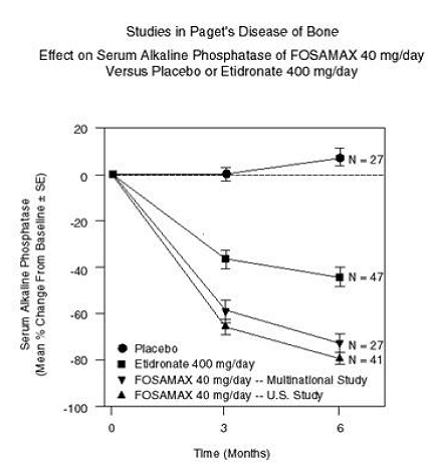
か月で、FOSAMAX で治療された患者のアルカリホスファターゼの抑制は、エチドロネートで達成されたものよりも有意に大きく、プラセボで治療された患者での反応の完全な欠如とは対照的でした.応答 (血清アルカリホスファターゼの正常化またはベースラインからの 60% 以上の減少と定義) は、組み合わせた研究で FOSAMAX で治療された患者の約 85% で発生したのに対し、エチドロネート群では 30%、プラセボでは 0% でした。グループ。 FOSAMAX 70mg は、年齢、性別、人種、他のビスフォスフォネートの使用歴、ベースラインのアルカリホスファターゼが調査範囲内 (少なくとも正常上限の 2 倍) にかかわらず、同様に効果的でした。
FOSAMAX 40 mg/日で 6 か月間治療された Paget's 病患者 33 例の骨組織像が評価されました。骨粗鬆症の治療を受けている患者と同様に[参照 臨床研究 ]、FOSAMAX は石灰化を損なわず、予想通りの骨代謝回転速度の低下が観察されました。 FOSAMAX による治療中には、既存の骨が織り込まれ、組織化されていない場合でも、正常な層状骨が生成されました。全体として、骨組織学データは、FOSAMAX 35mg による治療中に形成された骨が正常な品質であるという結論を支持しています。
患者情報
FOSAMAX® (FOSS-ah-max)(アレンドロン酸ナトリウム)錠
FOSAMAX 70mg の服用を開始する前、およびリフィルを入手するたびに、FOSAMAX 70mg に付属の投薬ガイドをお読みください。新しい情報があるかもしれません。この投薬ガイドは、あなたの病状または治療について医師と話すことに代わるものではありません. FOSAMAX について質問がある場合は、医師に相談してください。
FOSAMAX 70mg について知っておくべき最も重要な情報は何ですか?
FOSAMAX 70mg は、次のような重大な副作用を引き起こす可能性があります。
1.食道の問題。
FOSAMAX 35mg を服用している人の中には、食道 (口と胃をつなぐ管) に問題が発生する可能性があります。
これらの問題には、食道の刺激、炎症、または潰瘍が含まれ、出血することもあります。
- FOSAMAX 70mg を処方どおりに服用し、食道の問題が発生する可能性を下げることが重要です。 (「FOSAMAX の服用方法」セクションを参照)
- FOSAMAX の服用を中止し、胸の痛み、胸やけの再発または悪化、飲み込むときに問題や痛みがある場合は、すぐに医師に連絡してください。
2. 血液中のカルシウム濃度が低い(低カルシウム血症)。
FOSAMAX は血中のカルシウム濃度を低下させる可能性があります。 FOSAMAX の服用を開始する前に血中カルシウムが低い場合は、治療中に悪化する可能性があります。 FOSAMAX を服用する前に、低血中カルシウムを治療する必要があります。血中カルシウム濃度が低い人のほとんどは症状がありませんが、一部の人には症状が出ることがあります。次のような低血中カルシウムの症状がある場合は、すぐに医師に連絡してください。
- 筋肉のけいれん、けいれん、けいれん
- 指、足の指、または口の周りのしびれやうずき
医師は、FOSAMAX を服用している間、血液中のカルシウム濃度が低下するのを防ぐために、カルシウムとビタミン D を処方することがあります。医師の指示に従って、カルシウムとビタミン D を摂取してください。
3. 骨、関節、または筋肉の痛み。
FOSAMAX を服用している人の中には、重度の骨、関節、または筋肉の痛みを発症する人もいます。
4. 重度の顎骨の問題 (骨壊死)。
FOSAMAX を服用すると、深刻な顎の骨の問題が発生する可能性があります。 FOSAMAX を開始する前に、医師が口内を検査する必要があります。医師は、FOSAMAX を開始する前に歯科医に相談するように指示する場合があります。 FOSAMAX による治療中は、適切な口腔ケアを実践することが重要です。
5. 異常な大腿骨骨折。
太ももの骨に異常な骨折が発生した人もいます。骨折の症状には、股関節、鼠蹊部、または太ももの新しいまたは異常な痛みが含まれる場合があります。
これらの副作用がある場合は、すぐに医師に連絡してください。
FOSAMAX 70mgとは?
- FOSAMAX 70mg は、以下に使用される処方薬です。
- 閉経後の女性の骨粗鬆症の治療または予防。股関節や脊椎の骨折 (骨折) の可能性を減らすのに役立ちます。
- 骨粗しょう症の男性の骨量を増やします。
- コルチコステロイド薬を服用している男性または女性の骨粗鬆症を治療します。
骨のパジェット病を患っている特定の男性と女性を治療します。
FOSAMAX 70mg が骨粗鬆症の治療と予防にどのくらい効果があるかはわかっていません。 FOSAMAX 70mg がまだあなたに適しているかどうかを判断するには、定期的に医師の診察を受ける必要があります。
FOSAMAX は子供には使用できません。
FOSAMAX 70mgを服用してはいけない人は?
次の場合は、FOSAMAX を服用しないでください。
- 口と胃をつなぐ管である食道に特定の問題がある
- 少なくとも 30 分間は立ったり座ったりできない
- 血液中のカルシウム濃度が低い
- FOSAMAX 70mgまたはその成分にアレルギーがある。このリーフレットの最後に成分表があります。
FOSAMAX 35mg を服用する前に医師に何を伝えるべきですか?
FOSAMAX を開始する前に、次の場合は必ず医師に相談してください。
- 飲み込みに問題がある
- 胃や消化器系の問題がある
- 血中カルシウムが少ない
- 歯科手術または抜歯の計画
- 腎臓に問題がある
- 胃や腸でのミネラルの吸収に問題があると言われたことがある(吸収不良症候群)
- 妊娠している、妊娠しようとしている、または妊娠している疑いがある。 FOSAMAX の服用中に妊娠した場合は、服用を中止し、医師に相談してください。 FOSAMAX が胎児に害を及ぼすかどうかはわかっていません。
- 授乳中または授乳を計画している。 FOSAMAX が母乳に移行し、赤ちゃんに害を及ぼす可能性があるかどうかはわかっていません。
特に次の場合は医師に相談してください。
- 制酸剤
- アスピリン
- 非ステロイド性抗炎症(NSAID)薬
服用しているすべての薬について医師に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。特定の医薬品は、FOSAMAX 70mg の作用に影響を与える可能性があります。
服用している薬を知る。それらのリストを保管し、新しい薬を入手するたびに医師と薬剤師に見せてください.
FOSAMAX 35mg の服用方法は?
- FOSAMAX 35mg を医師の指示どおりに服用してください。
- FOSAMAX は、空腹時に服用した場合にのみ機能します。
- 一日の起床後、最初の食べ物、飲み物、または他の薬を飲む前に、FOSAMAX 35mg を服用してください。
- FOSAMAX は座った状態または立った状態で服用してください。
- FOSAMAX の錠剤を噛んだり、吸ったりしないでください。
- FOSAMAX タブレットは、グラス一杯 (6 ~ 8 オンス) の水だけで飲み込んでください。
- しない FOSAMAX をミネラルウォーター、コーヒー、紅茶、ソーダ、またはジュースと一緒に服用してください。
- アレンドロネートを毎日服用する場合:
- アレンドロネート 1 錠を 1 日 1 回、毎日起床後、最初の食べ物、飲み物、または他の薬を服用する前に服用してください。
- FOSAMAX を週 1 回服用する場合:
- スケジュールに最適な曜日を選択してください。
- 毎週、起床後、最初の食べ物、飲み物、または他の薬を服用する前に、選択した日に 1 回分の FOSAMAX を服用してください。
- アレンドロネートを毎日服用する場合:
FOSAMAX 35mg 錠剤を飲み込んだ後、少なくとも 30 分間待ちます。
- 横になる前に。座ったり、立ったり、歩いたり、読書などの通常の活動を行うことができます。
- 普通の水以外の最初の食べ物や飲み物を飲む前。
- 制酸剤、カルシウム、その他のサプリメントやビタミンを含む他の薬を服用する前に.
FOSAMAX を服用した後、およびその日の最初の食品を食べた後、少なくとも 30 分間は横にならないでください。
FOSAMAX 70mg を飲み忘れた場合は、その日の後半に服用しないでください。気がついた翌朝、飲み忘れた分を服用してから、通常のスケジュールに戻ります。同じ日に2回服用しないでください。
FOSAMAX 70mg を過剰に摂取した場合は、医師に連絡してください。吐こうとしないでください。横にならないでください。
FOSAMAX 70mg の副作用の可能性は何ですか?
FOSAMAX は深刻な副作用を引き起こす可能性があります。
- 「FOSAMAX について知っておくべき最も重要な情報は何ですか?」を参照してください。
FOSAMAX 70mg の最も一般的な副作用は次のとおりです。
- 胃部(腹部)の痛み
- 胸焼け
- 便秘
- 下痢
- 胃のむかつき
- 骨、関節、または筋肉の痛み
- 吐き気
蕁麻疹や顔、唇、舌、喉の腫れなどのアレルギー反応を起こすことがあります。
喘息の悪化が報告されています。
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは FOSAMAX の副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
FOSAMAXの保管方法を教えてください。
- FOSAMAX 35mg を室温、59°F から 86°F (15°C から 30°C) で保管してください。
- FOSAMAX は密閉容器に保管してください。
FOSAMAX およびすべての医薬品は、子供の手の届かないところに保管してください。
FOSAMAX の安全で効果的な使用に関する一般的な情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 FOSAMAX 35mg は、処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っていても、FOSAMAX 35mg を与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、FOSAMAX に関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた FOSAMAX に関する情報については、医師または薬剤師にお尋ねください。詳細については、www.FOSAMAX.com にアクセスするか、1-800-622-4477 (フリーダイヤル) までお電話ください。
FOSAMAXの成分は?
有効成分:アレンドロン酸ナトリウム
不活性成分:微結晶性セルロース、無水ラクトース、クロスカルメロースナトリウム、ステアリン酸マグネシウム。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
