Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ジフルカンとは何ですか?
ジフルカンは、真菌感染症の症状を治療するために使用される処方薬です。ジフルカン 50mg は、単独で使用することも、他の薬と併用することもできます。
ジフルカン 100mg は、抗真菌薬と呼ばれる薬のクラスに属します。
Diflucan 150mgの副作用は何ですか?
ジフルカン 100mg は、次のような重大な副作用を引き起こす可能性があります。
- 心臓の鼓動が速くなったり、ドキドキしたり、
- 胸をときめかせ、
- 呼吸困難、
- 突然のめまい、
- 熱、
- 寒気、
- 体の痛み、
- インフルエンザの症状、
- あざや出血しやすい、
- 異常な弱さ、
- 発作(けいれん)、
- 皮膚の発疹または病変、
- 食欲減少、
- 上腹部の痛み、
- 暗い尿、
- 粘土色の便、および
- 目や皮膚が黄色くなる(黄疸)
上記の症状がある場合は、すぐに医療機関を受診してください。
ジフルカンの最も一般的な副作用は次のとおりです。
- 吐き気、
- 胃痛、
- 下痢、
- 胃のむかつき、
- 頭痛、
- めまい、および
- 味覚の変化
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ジフルカンの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
DIFLUCAN® (フルコナゾール) は、合成トリアゾール抗真菌剤の新しいサブクラスの最初のものであり、経口投与用の錠剤として、経口懸濁液用の粉末として入手できます。
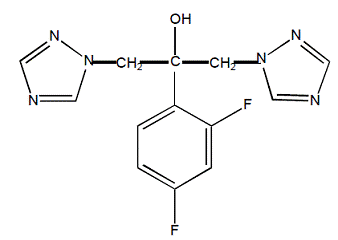
フルコナゾールは化学的に 2,4-ジフルオロ-α,α1-ビス(1H-1,2,4-トリアゾール-1-イルメチル) ベンジル アルコールと呼ばれ、実験式は C13H12F2N6O、分子量は 306.3 です。構造式は次のとおりです。
フルコナゾールは白色の結晶性固体で、水と生理食塩水にわずかに溶けます。
DIFLUCAN タブレットには、50、100、150、または 200 mg のフルコナゾールと次の不活性成分が含まれています。
DIFLUCAN for Oral Suspension には、350 mg または 1400 mg のフルコナゾールと、次の不活性成分が含まれています: スクロース、クエン酸ナトリウム二水和物、無水クエン酸、安息香酸ナトリウム、二酸化チタン、コロイド状二酸化ケイ素、キサンタンガム、天然オレンジフレーバー。 24 mL の蒸留水または精製水 (USP) で再構成した後、再構成された懸濁液の各 mL には、10 mg または 40 mg のフルコナゾールが含まれます。
適応症
ジフルカン(フルコナゾール)は、以下の治療に適応されます:
- 膣カンジダ症(カンジダによる膣内イースト菌感染症)。
- 中咽頭および食道カンジダ症。比較的少数の患者を対象とした公開非比較研究では、DIFLUCAN はカンジダ尿路感染症、腹膜炎、およびカンジダ血症、播種性カンジダ症、肺炎を含む全身性カンジダ感染症の治療にも有効でした。
- クリプトコッカス髄膜炎。クリプトコッカス髄膜炎のエイズ患者に DIFLUCAN (フルコナゾール) を処方する前に、 臨床研究 セクション。非 HIV 感染患者における DIFLUCAN 150mg とアムホテリシン B を比較した研究は実施されていません。
予防
DIFLUCAN はまた、骨髄移植を受け、細胞傷害性化学療法および/または放射線療法を受ける患者のカンジダ症の発生率を低下させることが示されています。
真菌培養およびその他の関連する実験室研究 (血清学、組織病理学) のための標本は、原因生物を分離および特定するために、治療の前に入手する必要があります。治療は、培養やその他の実験室での研究の結果が判明する前に開始される場合があります。ただし、これらの結果が利用可能になったら、それに応じて抗感染療法を調整する必要があります。
投薬と管理
成人における用法・用量
単回投与
膣カンジダ症
膣カンジダ症に対するディフルカンの推奨投与量は、1 回の経口投与として 150 mg です。
複数回投与
経口吸収は急速でほぼ完全であるため、ジフルカン (フルコナゾール) の 1 日用量は、経口 (錠剤および懸濁液) と静脈内投与で同じです。一般に、治療の 2 日目までに血漿濃度を定常状態に近づけるために、治療の 1 日目に 1 日量の 2 倍の負荷量を推奨します。
膣カンジダ症以外の感染症の治療のための DIFLUCAN 100mg の 1 日量は、感染生物と治療に対する患者の反応に基づいて決定する必要があります。治療は、臨床パラメータまたは臨床検査で活動性の真菌感染が治まったことが示されるまで継続する必要があります。不適切な治療期間は、活動性感染症の再発につながる可能性があります。 AIDS およびクリプトコッカス髄膜炎または再発性口腔咽頭カンジダ症の患者は通常、再発を防ぐために維持療法が必要です。
中咽頭カンジダ症
口腔咽頭カンジダ症に対する DIFLUCAN の推奨用量は、初日に 200 mg、その後 1 日 1 回 100 mg です。口腔咽頭カンジダ症の臨床的証拠は、一般に数日以内に解決しますが、再発の可能性を減らすために、少なくとも 2 週間は治療を継続する必要があります。
食道カンジダ症
食道カンジダ症に対するディフルカン 200mg の推奨投与量は、初日に 200mg、その後 1 日 1 回 100mg です。治療に対する患者の反応の医学的判断に基づいて、400 mg/日までの用量を使用することができます。食道カンジダ症の患者は、最低 3 週間、症状が改善してから少なくとも 2 週間は治療を受ける必要があります。
全身性カンジダ感染症
カンジダ血症、播種性カンジダ症、肺炎などの全身性カンジダ感染症の場合、最適な治療用量と治療期間は確立されていません。少数の患者を対象としたオープンな非比較研究では、1 日最大 400 mg の用量が使用されています。
尿路感染症と腹膜炎
カンジダ尿路感染症および腹膜炎の治療のために、50~200 mg の 1 日用量が、少数の患者を対象としたオープンな非比較試験で使用されています。
クリプトコッカス髄膜炎
急性クリプトコッカス髄膜炎の治療に推奨される投与量は、初日に 400 mg、その後 1 日 1 回 200 mg です。治療に対する患者の反応の医学的判断に基づいて、1 日 1 回 400 mg の用量を使用することができます。クリプトコッカス髄膜炎の初期治療に推奨される治療期間は、脳脊髄液が培養陰性になってから 10 ~ 12 週間です。エイズ患者のクリプトコッカス髄膜炎の再発を抑制するためのディフルカン 150mg の推奨投与量は、1 日 1 回 200mg です。
骨髄移植を受ける患者の予防
骨髄移植を受ける患者のカンジダ症を予防するための推奨される DIFLUCAN の 1 日量は、1 日 1 回 400 mg です。重度の顆粒球減少症(500個/mm³未満の好中球細胞)が予想される患者は、好中球減少症の発症が予想される数日前にDIFLUCAN予防を開始し、好中球数が1000個/mm³を超えてから7日間継続する必要があります.
小児における用法・用量
以下の線量等価スキームは、一般に、小児患者と成人患者で同等の曝露を提供する必要があります。
新生児における DIFLUCAN の使用経験は、未熟児の薬物動態研究に限られています。 (見る 臨床薬理学 .) 未熟児 (妊娠 26 ~ 29 週) に見られる半減期の延長に基づいて、生後 2 週間のこれらの子供は、年長の子供と同じ用量 (mg/kg) を投与する必要がありますが、 72時間ごと。最初の 2 週間以降は、これらの子供には 1 日 1 回投与する必要があります。満期産児における DIFLUCAN の薬物動態に関する情報はありません。
中咽頭カンジダ症
小児の口腔咽頭カンジダ症に対する DIFLUCAN 150mg の推奨用量は、初日に 6 mg/kg、その後 1 日 1 回 3 mg/kg です。再発の可能性を減らすために、少なくとも 2 週間は治療を行う必要があります。
食道カンジダ症
食道カンジダ症の治療では、子供のディフルカンの推奨投与量は、初日に 6 mg/kg、その後 1 日 1 回 3 mg/kg です。治療に対する患者の反応の医学的判断に基づいて、12 mg/kg/日までの用量を使用することができます。食道カンジダ症の患者は、最低 3 週間、症状が治まってから少なくとも 2 週間は治療を受けるべきです。
全身性カンジダ感染症
カンジダ血症および播種性カンジダ感染症の治療には、少数の子供を対象としたオープンな非比較研究で、1 日 6 ~ 12 mg/kg/日の用量が使用されています。
クリプトコッカス髄膜炎
急性クリプトコッカス髄膜炎の治療の推奨用量は、初日に 12 mg/kg、その後 1 日 1 回 6 mg/kg です。治療に対する患者の反応の医学的判断に基づいて、1 日 1 回 12 mg/kg の用量を使用することができます。クリプトコッカス髄膜炎の初期治療に推奨される治療期間は、脳脊髄液が培養陰性になってから 10 ~ 12 週間です。エイズ患者のクリプトコッカス性髄膜炎の再発を抑制するためのディフルカンの推奨用量は、1 日 1 回 6 mg/kg です。
腎機能障害のある患者における投与量
フルコナゾールは、未変化の薬物として主に腎排泄によって除去されます。腎機能障害のため、膣カンジダ症の単回投与療法を調整する必要はありません。 DIFLUCAN の複数回投与を受ける腎機能障害のある患者では、50 mg から 400 mg の初回負荷量を投与する必要があります。負荷用量の後、1 日用量 (適応症による) は、次の表に基づく必要があります。
血液透析を受けている患者は、各血液透析後に推奨用量の 100% を投与する必要があります。透析を受けていない日は、クレアチニンクリアランスに応じて用量を減らす必要があります。
これらは、複数回投与後の薬物動態に基づいて推奨される用量調整です。臨床状態によっては、さらに調整が必要になる場合があります。
血清クレアチニンが利用可能な唯一の腎機能の尺度である場合、次の式(患者の性別、体重、および年齢に基づく)を使用して、成人のクレアチニンクリアランスを推定する必要があります。
男性: 体重 (kg) × (140 – 年齢)/72 × 血清クレアチニン (mg/100 mL)
女性: 0.85 × 上の値
フルコナゾールの薬物動態は腎不全の子供で研究されていませんが、腎不全の子供の減量は成人に推奨される減量と並行する必要があります.次の式は、子供のクレアチニンクリアランスを推定するために使用できます。
× 直線の長さまたは高さ (cm)/血清クレアチニン (mg/100 mL)
(ここで、K=1 歳以上の子供の場合は 0.55、幼児の場合は 0.45 です。)
管理
DIFLUCAN 100mg は経口投与されます。 DIFLUCAN は食事の有無にかかわらず服用できます。
経口懸濁液を混合するための指示
次のように分注時に懸濁液を調製します。すべての粉末が自由に流れるまでボトルをたたきます。再構成するには、24 mL の蒸留水または精製水 (USP) をフルコナゾール ボトルに加え、激しく振って粉末を懸濁します。各ボトルは 35 mL の懸濁液を提供します。再構成された懸濁液の濃度は次のとおりです。
注: 使用前に経口懸濁液をよく振ってください。再構成された懸濁液は 86°F (30°C) ~ 41°F (5°C) で保管し、未使用部分は 2 週間後に廃棄してください。凍結から保護してください。
供給方法
ジフルカン100mg錠 50、100、または 200 mg のフルコナゾールを含むピンク色の台形錠剤は、ボトルまたは単位用量のブリスターに包装されています。フルコナゾール 150 mg の錠剤は、ピンク色の楕円形で、1 回量単位のブリスターに包装されています。
DIFLUCAN タブレットは次のように供給されます。
ジフルカン50mg錠 :表に「DIFLUCAN」と「50」、裏に「ROERIG」の刻印。
NDC 0049-3410-30 30本入
ジフルカン100mg錠 :表に「DIFLUCAN」と「100」、裏に「ROERIG」の刻印。
NDC 0049-3420-30 30本入 NDC 0049-3420-41 100 単位用量パッケージ
ジフルカン150mg錠 :表に「DIFLUCAN」と「150」、裏に「ROERIG」の刻印。
NDC 0049-3500-79 1 単位用量パッケージ
ジフルカン200mg錠 :表に「DIFLUCAN」と「200」、裏に「ROERIG」の刻印。
NDC 0049-3430-30 30本入 NDC 0049-3430-41 100 単位用量パッケージ
保管所
錠剤は 86°F (30°C) 以下で保管してください。
経口懸濁液用ジフルカン100mg : DIFLUCAN for Oral Suspension は、以下のように 1 ボトルあたり 35 mL を提供するために、オレンジ風味の粉末として提供されます。
NDC 0049-3440-19 フルコナゾール 350 mg/ボトル NDC 0049-3450-19 フルコナゾール 1400 mg/ボトル
保管所
乾燥粉末は 86°F (30°C) 以下で保管してください。再構成された懸濁液は 86°F (30°C) ~ 41°F (5°C) で保管し、未使用部分は 2 週間後に廃棄してください。凍結から保護してください。
配布元: Roerig Division of Pfizer Inc., NY, NY 10017. 改訂: 2021 年 10 月
副作用
DIFLUCAN は一般に忍容性が良好です。
一部の患者、特にエイズや癌などの重篤な基礎疾患を有する患者では、フルコナゾールおよび比較薬による治療中に、腎機能および血液機能の検査結果の変化および肝異常が観察されていますが、臨床的意義および治療との関係は不明です。
膣カンジダ症の単回投与を受ける患者
米国で実施された比較臨床研究では、448 人の膣カンジダ症患者が DIFLUCAN 150 mg の単回投与で治療されました。 DIFLUCAN に関連すると考えられる副作用の全体的な発生率は 26% でした。有効な比較薬を投与された 422 人の患者では、発生率は 16% でした。膣炎のためにフルコナゾール 150 mg を単回投与した患者で報告された最も一般的な治療関連の有害事象は、頭痛 (13%)、吐き気 (7%)、および腹痛 (6%) でした。 1%以上の発生率で報告されたその他の副作用には、下痢 (3%)、消化不良 (1%)、めまい (1%)、味覚異常 (1%) が含まれます。報告された副作用のほとんどは、重症度が軽度から中等度でした。まれに、血管浮腫およびアナフィラキシー反応がマーケティングの経験で報告されています。
他の感染症で複数回投与を受けている患者
7日以上の臨床試験でDIFLUCAN(フルコナゾール)で治療された4000人以上の患者の16%が有害事象を経験しました. 1.5%の患者で有害臨床事象により治療が中止され、1.3%の患者で検査異常が原因で治療が中止されました。
臨床的有害事象は、非 HIV 感染患者 (13%) よりも HIV 感染患者 (21%) でより頻繁に報告されました。ただし、HIV 感染患者と非 HIV 感染患者のパターンは似ていました。臨床的有害事象のために治療を中止した患者の割合は、2 つのグループで同程度でした (1.5%)。
次の治療関連の臨床的有害事象は、臨床試験で DIFLUCAN 50mg を 7 日以上投与された 4,048 人の患者で 1% 以上の発生率で発生しました: 吐き気 3.7%、頭痛 1.9%、皮膚発疹 1.8%、嘔吐 1.7%、腹部痛み 1.7%、下痢 1.5%。
肝胆道
臨床試験とマーケティングの経験を組み合わせた結果、DIFLUCAN による治療中に重篤な肝反応がまれに発生しました。 (見る 警告 .) これらの肝反応の範囲は、トランスアミナーゼの軽度の一過性上昇から、臨床的肝炎、胆汁うっ滞、および死亡を含む劇症肝不全にまで及びます。致命的な肝反応の例は、主に重篤な基礎疾患 (主に AIDS または悪性腫瘍) を持つ患者で、多くの場合、複数の併用薬を服用しているときに発生することが指摘されています。肝炎や黄疸を含む一過性の肝反応は、他に特定可能な危険因子を持たない患者の間で発生しています。これらのケースのそれぞれにおいて、肝機能は DIFLUCAN の中止でベースラインに戻りました。
クリプトコッカス髄膜炎の再発抑制に対する DIFLUCAN の有効性を評価する 2 つの比較試験では、統計的に有意な AST (SGOT) レベルの中央値の上昇が、1 つの試験でベースライン値の 30 IU/L から 41 IU/L に、34 の試験で観察されました。もう一方は IU/L から 66 IU/L です。臨床試験でフルコナゾール治療を受けた患者では、正常上限の 8 倍を超える血清トランスアミナーゼ上昇の全体的な割合は約 1% でした。これらの上昇は、重度の基礎疾患、主にエイズまたは悪性腫瘍を有する患者で発生し、そのほとんどは肝毒性であることが知られているものを含む複数の併用薬を受けていました.異常に上昇した血清トランスアミナーゼの発生率は、リファンピン、フェニトイン、イソニアジド、バルプロ酸、または経口スルホニル尿素系血糖降下薬の 1 つ以上と併用して DIFLUCAN を服用している患者でより高かった.
市販後の経験
また、市販後の経験において、以下の有害事象が発生しています。
免疫学的: まれに、アナフィラキシー(血管性浮腫、顔面浮腫、かゆみを含む)が報告されています。
全身: 無力症、疲労、発熱、倦怠感。
心臓血管: QT 延長、torsade de pointes。 (見る 予防 .)
中枢神経系: 発作、めまい。
造血およびリンパ: 好中球減少症および無顆粒球症、血小板減少症を含む白血球減少症。
代謝: 高コレステロール血症、高トリグリセリド血症、低カリウム血症。
胃腸: 胆汁うっ滞、口渇、肝細胞損傷、消化不良、嘔吐。
その他の感覚: 味の倒錯。
筋骨格系: 筋肉痛。
神経系: 不眠症、感覚異常、傾眠、振戦、めまい。
皮膚と付属物: 急性汎発性発疹性膿疱症、固定薬疹を含む薬疹、発汗の増加、スティーブンス・ジョンソン症候群および中毒性表皮壊死融解症を含む剥脱性皮膚障害、好酸球増加症および全身症状を伴う薬物反応(DRESS)( 警告 )、脱毛症。
子供の有害反応
小児臨床試験中に記録された有害事象および検査異常のパターンと発生率は、成人で見られるものと同等です。
米国とヨーロッパで実施された第 II/III 相臨床試験では、生後 1 日から 17 歳の 577 人の小児患者が、最大 15 mg/kg/日の用量で最大 1,616 日間、DIFLUCAN で治療されました。小児の 13% が治療関連の有害事象を経験しました。最も一般的に報告されたイベントは、嘔吐 (5%)、腹痛 (3%)、吐き気 (2%)、および下痢 (2%) でした。 2.3%の患者で有害臨床事象により治療が中止され、1.4%の患者で臨床検査の異常が原因で治療が中止されました。治療に関連した臨床検査値異常の大部分は、トランスアミナーゼまたはアルカリホスファターゼの上昇でした。
治療に関連した副作用のある患者の割合
薬物相互作用
(見る 禁忌 .) フルコナゾールは中等度の CYP2C9 および CYP3A4 阻害剤です。フルコナゾールは、CYP2C19 の強力な阻害剤でもあります。 CYP2C9 および CYP3A4 を介して代謝される治療域が狭い薬物を併用している DIFLUCAN で治療されている患者は、併用投与された薬物に関連する副作用について監視する必要があります。以下で観察された/文書化された相互作用に加えて、フルコナゾールと同時投与された CYP2C9、CYP2C19、および CYP3A4 によって代謝される他の化合物の血漿濃度が増加するリスクがあります。したがって、これらの組み合わせを使用する場合は注意が必要であり、患者を注意深く監視する必要があります。フルコナゾールの酵素阻害効果は、フルコナゾールの半減期が長いため、フルコナゾール治療の中止後 4 ~ 5 日持続します。 DIFLUCAN 200mg と以下の薬剤/クラスとの間の臨床的または潜在的に重要な薬物相互作用が観察されており、以下でより詳細に説明されています。
アルフェンタニル
ある研究では、フルコナゾールによる併用治療後のアルフェンタニルのクリアランスと分布量の減少、およびt½の延長が観察されました。考えられる作用機序は、フルコナゾールによる CYP3A4 の阻害です。アルフェンタニルの用量調整が必要な場合があります。
アミオダロン
アミオダロンとフルコナゾールの併用投与は、QT延長を増加させる可能性があります。フルコナゾールとアミオダロンの併用が必要な場合、特に高用量のフルコナゾール (800 mg) を併用する場合は注意が必要です。
アミトリプチリン、ノルトリプチリン
フルコナゾールは、アミトリプチリンとノルトリプチリンの効果を高めます。 5-ノルトリプチリンおよび/またはS-アミトリプチリンは、併用療法の開始時および1週間後に測定することができます。必要に応じて、アミトリプチリン/ノルトリプチリンの投与量を調整する必要があります。
アムホテリシン B
感染した正常マウスおよび免疫抑制マウスにフルコナゾールとアムホテリシン B を同時に投与すると、次の結果が示されました。カンジダ アルビカンスによる全身感染では小さな相加的抗真菌効果、クリプトコッカス ネオフォルマンスによる頭蓋内感染では相互作用はなく、A による全身感染では 2 つの薬剤の拮抗作用があります。 . fumigatus。これらの研究で得られた結果の臨床的意義は不明です。
アジスロマイシン
18人の健康な被験者を対象とした非盲検無作為化三元クロスオーバー試験では、フルコナゾール800mg単回経口投与の薬物動態に対するアジスロマイシン1200mg単回経口投与の効果と、薬物動態に対するフルコナゾールの効果が評価されました。アジスロマイシンの。フルコナゾールとアジスロマイシンの間に有意な薬物動態学的相互作用はありませんでした。
カルシウムチャネル遮断薬
特定のカルシウム チャネル拮抗薬 (ニフェジピン、イスラジピン、アムロジピン、ベラパミル、およびフェロジピン) は CYP3A4 によって代謝されます。フルコナゾールは、カルシウム チャネル拮抗薬の全身曝露を増加させる可能性があります。有害事象を頻繁に監視することをお勧めします。
カルバマゼピン
フルコナゾールはカルバマゼピンの代謝を阻害し、血清カルバマゼピンの 30% の増加が観察されています。カルバマゼピン毒性を発症するリスクがあります。カルバマゼピンの投与量の調整は、濃度測定/効果に応じて必要になる場合があります。
セレコキシブ
フルコナゾール (1 日 200 mg) とセレコキシブ (200 mg) による併用治療中、セレコキシブの Cmax と AUC はそれぞれ 68% と 134% 増加しました。フルコナゾールと併用する場合、セレコキシブの用量の半分が必要になる場合があります。
クマリン系抗凝固剤
DIFLUCAN 150mg とクマリン系抗凝固薬を併用している患者では、プロトロンビン時間が増加する可能性があります。市販後の経験では、他のアゾール系抗真菌薬と同様に、ワルファリンと同時にフルコナゾールを投与されている患者のプロトロンビン時間の増加に関連して、出血イベント (あざ、鼻出血、消化管出血、血尿、およびメレナ) が報告されています。 DIFLUCAN 50mg とクマリン系抗凝固薬を投与されている患者では、プロトロンビン時間を注意深く監視することが推奨されます。ワーファリンの用量調整が必要な場合があります。 (見る 臨床薬理学 : 薬物相互作用研究 .)
シクロホスファミド
シクロホスファミドとフルコナゾールの併用療法は、血清ビリルビンと血清クレアチニンの増加をもたらします。この組み合わせは、血清ビリルビンおよび血清クレアチニンの上昇のリスクを考慮して使用することができます。
シクロスポリン
DIFLUCAN 100mg は、腎障害の有無にかかわらず、腎移植患者のシクロスポリンレベルを有意に上昇させます。 DIFLUCAN とシクロスポリンを投与されている患者では、シクロスポリン濃度と血清クレアチニンを注意深くモニタリングすることをお勧めします。 (見る 臨床薬理学 : 薬物相互作用研究 .) この組み合わせは、シクロスポリン濃度に応じてシクロスポリンの投与量を減らして使用することができます。
フェンタニル
フェンタニルとフルコナゾールの相互作用の可能性のある致死例が 1 例報告されました。著者は、患者はフェンタニル中毒による死亡と判断した。さらに、12人の健康なボランティアを対象とした無作為化クロスオーバー研究では、フルコナゾールがフェンタニルの排泄を大幅に遅らせることが示されました.フェンタニル濃度の上昇は、呼吸抑制を引き起こす可能性があります。
HMG-CoAレダクターゼ阻害剤
フルコナゾールを、アトルバスタチンやシンバスタチンなどの CYP3A4、またはフルバスタチンなどの CYP2C9 を介して代謝される HMG-CoA レダクターゼ阻害剤と併用すると、ミオパシーおよび横紋筋融解症のリスクが高まります。併用療法が必要な場合は、ミオパシーおよび横紋筋融解症の症状について患者を観察し、クレアチニンキナーゼを監視する必要があります。クレアチニンキナーゼの著しい増加が観察された場合、またはミオパシー/横紋筋融解症が診断または疑われる場合は、HMG-CoAレダクターゼ阻害剤を中止する必要があります.
ヒドロクロロチアジド
薬物動態学的相互作用研究では、フルコナゾールを投与されている健康なボランティアに複数回投与のヒドロクロロチアジドを同時投与すると、フルコナゾールの血漿濃度が 40% 増加しました。この大きさの効果は、併用利尿剤を受けている被験者のフルコナゾール投与計画の変更を必要とすべきではありません.
イブルチニブ
フルコナゾールなどのCYP3A4の中程度の阻害剤は、血漿イブルチニブ濃度を上昇させ、イブルチニブに関連する副作用のリスクを高める可能性があります。イブルチニブとフルコナゾールを併用する場合は、イブルチニブの処方情報で指示されているようにイブルチニブの用量を減らし、イブルチニブに関連する副作用について患者を頻繁に監視する必要があります。
レンボレキサント
フルコナゾールの併用により、レンボレキサントの Cmax および AUC がそれぞれ約 1.6 倍および 4.2 倍増加し、傾眠などの副作用のリスクが高まると予想されます。 DIFLUCAN とレンボレキサントの併用は避けてください。
ロサルタン
フルコナゾールは、ロサルタンによる治療中に発生するアンギオテンシンII受容体拮抗作用のほとんどに関与する活性代謝物(E-31 74)へのロサルタンの代謝を阻害します。患者は血圧を継続的に監視する必要があります。
メタドン
フルコナゾールは、メタドンの血清濃度を高める可能性があります。メタドンの投与量調整が必要な場合があります。
非ステロイド性抗炎症薬
フルルビプロフェンの Cmax と AUC は、フルコナゾールと同時投与した場合、フルルビプロフェン単独の投与と比較して、それぞれ 23% と 81% 増加しました。同様に、フルコナゾールをラセミ体のイブプロフェン (400 mg) と併用投与した場合、ラセミ体のイブプロフェンを単独で投与した場合と比較して、薬理学的に活性な異性体 [S-(+)-イブプロフェン] の Cmax と AUC がそれぞれ 15% と 82% 増加しました。
特に研究されていませんが、フルコナゾールは、CYP2C9 によって代謝される他の非ステロイド性抗炎症薬 (NSAID) (ナプロキセン、ロルノキシカム、メロキシカム、ジクロフェナクなど) の全身曝露を増加させる可能性があります。 NSAID に関連する有害事象と毒性を頻繁に監視することが推奨されます。 NSAIDの投与量の調整が必要になる場合があります。
オラパリブ
フルコナゾールなどのCYP3A4の中程度の阻害剤は、オラパリブの血漿濃度を上昇させます。併用はお勧めしません。併用が避けられない場合は、LYNPARZA®(オラパリブ)処方情報で指示されているように、オラパリブの用量を減らしてください。
経口避妊薬
フルコナゾールの複数回投与を使用して、経口避妊薬を組み合わせた2つの薬物動態研究が実施されました。フルコナゾール 50 mg の研究では、ホルモンレベルに関連する影響はありませんでしたが、毎日 200 mg では、エチニルエストラジオールとレボノルゲストレルの AUC がそれぞれ 40% と 24% 増加しました。したがって、これらの用量でフルコナゾールを複数回使用しても、組み合わせた経口避妊薬の有効性に影響を与える可能性は低い.
経口血糖降下薬
DIFLUCAN と経口血糖降下薬を併用すると、臨床的に重大な低血糖が引き起こされる可能性があります。 DIFLUCAN 150mg とグリブリドの併用に関連した低血糖により、1 人の死亡例が報告されています。ジフルカンは、トルブタミド、グリブリド、グリピジドの代謝を低下させ、これらの薬剤の血漿濃度を上昇させます。 DIFLUCAN 100mg をこれらまたは他のスルホニル尿素経口血糖降下薬と併用する場合、血糖値を注意深く監視し、必要に応じてスルホニル尿素の用量を調整する必要があります。 (見る 臨床薬理学 : 薬物相互作用研究 .)
フェニトイン
DIFLUCAN は、フェニトインの血漿濃度を増加させます。 DIFLUCAN 50mg とフェニトインを投与されている患者のフェニトイン濃度を注意深くモニタリングすることをお勧めします。 (見る 臨床薬理学 : 薬物相互作用研究 .)
ピモジド
インビトロまたはインビボで研究されていませんが、フルコナゾールとピモジドの併用投与により、ピモジド代謝が阻害される可能性があります。ピモジド血漿濃度の上昇は、QT 延長およびトルサード ド ポワントのまれな発生につながる可能性があります。フルコナゾールとピモジドの併用は禁忌です。
プレドニゾン
プレドニゾンで治療された肝臓移植患者が、フルコナゾールによる3か月の治療を中止したときに急性副腎皮質機能不全を発症したという症例報告がありました.フルコナゾールの中止により、CYP3A4 活性が増強され、プレドニゾンの代謝が増加したと考えられます。フルコナゾールとプレドニゾンによる長期治療を受けている患者は、フルコナゾールを中止する際に副腎皮質の機能不全について注意深く監視する必要があります。
キニジン
インビトロまたはインビボで研究されていませんが、フルコナゾールとキニジンを併用すると、キニジン代謝が阻害される可能性があります。キニジンの使用は、QT 延長とトルサード ド ポワントのまれな発生に関連付けられています。フルコナゾールとキニジンの併用は禁忌です。 (見る 禁忌 .)
リファブチン
フルコナゾールがリファブチンと同時に投与されると相互作用が存在し、リファブチンの血清レベルが最大80%増加するという報告があります.フルコナゾールとリファブチンを併用した患者にブドウ膜炎が報告されています。リファブチンとフルコナゾールを併用している患者は注意深く監視する必要があります。 (見る 臨床薬理学 : 薬物相互作用研究 .)
リファンピン
リファンピンは、同時投与されたジフルカンの代謝を高めます。臨床状況に応じて、リファンピンと併用する場合、DIFLUCAN 200mg の用量を増やすことを考慮する必要があります。 (見る 臨床薬理学 : 薬物相互作用研究 .)
サキナビル
フルコナゾールは、CYP3A4 によるサキナビルの肝臓代謝の阻害と P 糖タンパク質の阻害により、サキナビルの AUC を約 50%、Cmax を約 55% 増加させ、サキナビルのクリアランスを約 50% 減少させます。サキナビルの用量調整が必要な場合があります。
短時間作用型ベンゾジアゼピン
ミダゾラムの経口投与後、フルコナゾールはミダゾラム濃度と精神運動効果の大幅な増加をもたらしました。ミダゾラムに対するこの効果は、フルコナゾールを静脈内投与した場合よりも、フルコナゾールを経口投与した場合の方が顕著であると思われます。チトクローム P450 系で代謝される短時間作用型ベンゾジアゼピンをフルコナゾールと併用投与する場合は、ベンゾジアゼピンの減量を考慮し、患者を適切に監視する必要があります。 (見る 臨床薬理学 : 薬物相互作用研究 .)
シロリムス
フルコナゾールは、おそらく CYP3A4 および P 糖タンパク質を介したシロリムスの代謝を阻害することにより、シロリムスの血漿中濃度を上昇させます。この組み合わせは、効果/濃度の測定値に応じて、シロリムスの投与量を調整して使用できます。
タクロリムス
フルコナゾールは、腸内の CYP3A4 を介したタクロリムス代謝の阻害により、経口投与されたタクロリムスの血清濃度を最大 5 倍増加させる可能性があります。タクロリムスを静脈内投与した場合、有意な薬物動態の変化は観察されていません。タクロリムス濃度の上昇は、腎毒性と関連しています。経口タクロリムスの投与量は、タクロリムスの濃度に応じて減量する必要があります。 (見る 臨床薬理学 : 薬物相互作用研究 .)
テオフィリン
DIFLUCAN 50mg は、テオフィリンの血清濃度を上昇させます。 DIFLUCAN 100mg とテオフィリンを投与されている患者の血清テオフィリン濃度を注意深くモニタリングすることをお勧めします。 (見る 臨床薬理学 : 薬物相互作用研究 .)
トファシチニブ
トファシチニブをフルコナゾールと併用すると、トファシチニブへの全身曝露が増加します。フルコナゾールと同時に投与する場合は、トファシチニブの用量を減らします(つまり、ゼルヤンツ [トファシチニブ] のラベルに記載されているように、1 日 2 回 5 mg から 1 日 1 回 5 mg に)。 (見る 臨床薬理学 : 薬物相互作用研究 .)
トルバプタン
トルバプタンへの血漿曝露は、CYP3A4 基質であるトルバプタンを中等度の CYP3A4 阻害剤であるフルコナゾールと同時投与すると、有意に増加します (AUC で 200%、Cmax で 80%)。この相互作用により、トルバプタンに関連する有害反応、特に著しい利尿、脱水、および急性腎不全が著しく増加するリスクが生じる可能性があります。トルバプタンとフルコナゾールを併用する場合は、トルバプタンの処方情報に記載されているようにトルバプタンの用量を減らし、トルバプタンに関連する副作用がないか患者を頻繁に監視する必要があります。
トリアゾラム
フルコナゾールは、トリアゾラムの代謝の阻害により、トリアゾラムの AUC (単回投与) を約 50% 増加させ、Cmax を 20% から 32% 増加させ、t½ を 25% から 50% 増加させます。トリアゾラムの用量調整が必要な場合があります。
ビンカアルカロイド
研究はされていませんが、フルコナゾールはビンカ アルカロイド (ビンクリスチンやビンブラスチンなど) の血漿中濃度を上昇させ、おそらく CYP3A4 に対する阻害効果による神経毒性を引き起こす可能性があります。
ビタミンA
オールトランスレチノイド酸 (ビタミン A の酸形態) とフルコナゾールの併用療法を受けている 1 人の患者の症例報告に基づいて、中枢神経系 (CNS) 関連の望ましくない影響が偽大脳腫瘍の形で発生しました。フルコナゾール治療の中止。この組み合わせは使用できますが、CNS 関連の望ましくない影響の発生率に注意する必要があります。
ボリコナゾール
ボリコナゾールとフルコナゾールの併用は避けてください。ボリコナゾールに関連する有害事象および毒性のモニタリングが推奨されます。特に、フルコナゾールの最後の投与後 24 時間以内にボリコナゾールを開始した場合。 (見る 臨床薬理学 : 薬物相互作用研究 .)
ジドブジン
フルコナゾールは、ジドブジンの経口クリアランスが約 45% 減少するため、ジドブジンの Cmax と AUC をそれぞれ 84% と 74% 増加させます。同様に、ジドブジンの半減期は、フルコナゾールとの併用療法後、約 128% 延長されました。この併用療法を受けている患者は、ジドブジン関連の有害反応の発生について監視する必要があります。ジドブジンの減量を考慮してもよい。

医師は、臨床薬理学のセクションに記載されている以外の医薬品との相互作用研究は実施されていませんが、そのような相互作用が発生する可能性があることに注意する必要があります。
警告
予防
全般的
フルコナゾールを含む一部のアゾールは、心電図の QT 間隔の延長と関連しています。フルコナゾールは、整流カリウム チャネル電流 (Ikr) の阻害を介して QT 延長を引き起こします。他の医薬品 (アミオダロンなど) によって引き起こされる QT 延長は、シトクロム P450 (CYP) 3A4 の阻害によって増幅される可能性があります。 (見る 予防 : 薬物相互作用 .) 市販後の調査中に、フルコナゾールを服用している患者に QT 延長およびトルサード ド ポワントのまれなケースがありました。これらの報告のほとんどは、構造的心疾患、電解質異常、および寄与している可能性のある併用薬など、複数の交絡危険因子を持つ重病患者に関するものでした。低カリウム血症および進行性心不全の患者は、生命を脅かす心室性不整脈およびトルサード ド ポワントの発生リスクが高くなります。
フルコナゾールは、これらの潜在的な催不整脈状態の患者には注意して投与する必要があります。
フルコナゾールとエリスロマイシンの併用は、心毒性(QT間隔の延長、トルサード・ド・ポワント)のリスクを高め、結果として心臓突然死のリスクを高める可能性があります。この組み合わせは避けるべきです。
腎機能障害のある患者には、フルコナゾールを慎重に投与する必要があります。
フルコナゾールを含むアゾールを投与されている患者では、副腎機能不全が報告されています。フルコナゾールを投与された患者では、副腎機能不全の可逆的な症例が報告されています。
経口懸濁液用の DIFLUCAN 100mg 粉末にはスクロースが含まれており、遺伝性フルクトース、グルコース/ガラクトース吸収不良、およびスクラーゼ - イソマルターゼ欠乏症の患者には使用しないでください。
車を運転したり、機械を操作したりするときは、めまいやけいれんが起こることがありますので注意してください。
単回投与
膣内イースト菌感染症の治療のためのフルコナゾール経口錠剤レジメンの単回投与の利便性と有効性は、米国ではジフルカン (26%) と膣内薬剤 (16%) のほうが薬物関連の有害事象の発生率が高いことの許容範囲と比較検討する必要があります。比較臨床研究。 (見る 有害反応 と 臨床研究 .)
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
フルコナゾールは、2.5 mg/kg/日、5 mg/kg/日、または 10 mg/kg/日 (ヒトの推奨用量の約 2 ~ 7 倍) の用量で 24 か月間経口投与されたマウスおよびラットで、発がん性の証拠を示さなかった)。 5 mg/kg/日および 10 mg/kg/日で処理された雄ラットでは、肝細胞腺腫の発生率が増加しました。
フルコナゾールは、代謝活性化の有無にかかわらず、S. typhimurium の 4 株およびマウスリンパ腫 L5178Y システムでの変異原性試験で陰性でした。 in vivo (マウス骨髄細胞、フルコナゾールの経口投与後) および in vitro (1000 mcg/mL でフルコナゾールに暴露されたヒトリンパ球) の細胞遺伝学的研究では、染色体変異の証拠は示されませんでした。
フルコナゾールは、5 mg/kg、10 mg/kg、または 20 mg/kg の経口投与、または 5 mg/kg、25 mg/kg、または 75 mg の非経口投与を受けた雄または雌のラットの生殖能力に影響を与えませんでした。 /kg、分娩の開始は 20 mg/kg PO でわずかに遅れました。 5 mg/kg、20 mg/kg、および 40 mg/kg でのラットの静脈内周産期試験では、難産および分娩の延長が 20 mg/kg (ヒトの推奨用量の約 5 ~ 15 倍) で数匹の母動物に観察されました。 ) および 40 mg/kg ではありませんが、5 mg/kg ではありません。分娩障害は、これらの用量レベルでの死産仔数のわずかな増加と新生児生存率の低下に反映された。ラットの分娩に対する影響は、高用量のフルコナゾールによって生じる種特異的なエストロゲン低下特性と一致しています。このようなホルモンの変化は、フルコナゾールで治療された女性では観察されていません. (見る 臨床薬理学 .)
妊娠
催奇形性効果
胎児への害の可能性
予想される利益が胎児へのリスクの可能性を上回る場合にフルコナゾールを使用する可能性がある重度または潜在的に生命を脅かす可能性のある真菌感染症の患者を除いて、妊娠中の使用は避けるべきです.いくつかの公表された症例報告では、妊娠初期のほとんどまたはすべての時期に母親が高用量のフルコナゾール (1 日 400 ~ 800 mg) に子宮内で曝露した乳児の明確な先天性異常のパターンについて説明しています。これらの報告された異常は、動物実験で見られるものと似ています。 DIFLUCAN 400 ~ 800 mg/日で治療を受けている妊娠可能な女性では、効果的な避妊手段を検討する必要があり、治療期間中および最終投与後約 1 週間 (半減期の 5 ~ 6 倍) は継続する必要があります。妊娠中に DIFLUCAN を使用する場合、または患者が薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきです。自然流産と先天異常は、レトロスペクティブな疫学的研究に基づいて、妊娠の最初の三半期に単回または反復投与としてフルコナゾール 150 mg に関連する潜在的なリスクとして示唆されています。妊娠中の女性を対象とした DIFLUCAN 150mg の十分に管理された研究はありません。 (見る 警告 : 胎児への害の可能性 .)
ヒューマンデータ
事例報告では、母親が妊娠初期のほとんどまたはすべての時期に高用量 (400 ~ 800 mg/日) のフルコナゾールを投与された乳児に見られる、特徴的でまれなパターンの先天異常について説明しています。これらの乳児に見られる特徴には、短頭症、異常な顔貌、異常な頭蓋冠の発達、口蓋裂、大腿骨の湾曲、細い肋骨と長骨、関節拘縮、および先天性心疾患が含まれます。これらの効果は、動物実験で見られるものと似ています。
疫学的研究は、妊娠初期にフルコナゾール 150 mg を単回または反復投与した母親の乳児に自然流産および先天異常の潜在的なリスクがあることを示唆していますが、これらの疫学的研究には限界があり、これらの所見は対照臨床で確認されていません。試練。
動物データ
フルコナゾールは、器官形成期の妊娠中のウサギに 2 つの研究で経口投与され、それぞれ 5 mg/kg、10 mg/kg、20 mg/kg、および 5 mg/kg、25 mg/kg、75 mg/kg の用量で投与されました。母体の体重増加はすべての用量レベルで損なわれ(体表面積[BSA]比較に基づく臨床用量 400 mg の約 0.25 から 4 倍)、75 mg/kg で流産が発生した(臨床用量 400 mg の約 4 倍)。 BSA);胎児への悪影響は観察されませんでした。
妊娠中のラットが器官形成中にフルコナゾールを経口投与されたいくつかの研究では、母体の体重増加が損なわれ、胎盤重量が25 mg / kgで増加しました. 5 mg/kg または 10 mg/kg では胎児への影響はありませんでした。 25 mg/kg および 50 mg/kg およびそれ以上の用量で、胎児の解剖学的変異 (過剰肋骨、腎盂拡張) の増加および骨化の遅延が観察された。 80 から 320 mg/kg (BSA に基づく臨床用量 400 mg の約 2 倍から 8 倍) の範囲の用量で、ラットの胚致死率が増加し、胎児の異常には肋骨の波状、口蓋裂、および異常な頭蓋顔面骨化が含まれた。これらの効果は、ラットにおけるエストロゲン合成の阻害と一致しており、妊娠、器官形成、分娩に対するエストロゲン低下の既知の効果の結果である可能性があります。
授乳中の母親
フルコナゾールは、産後 5 日から 19 か月の間に一時的または永久的に母乳育児を中止した 10 人の授乳中の女性を対象とした研究のデータに基づいて、150 mg を 1 回投与した後の母乳中に低レベルで存在していました。授乳後 5.2 時間の平均ピーク乳濃度 (2.61 mcg/mL [範囲: 1.57 ~ 3.65 mcg/mL]) に基づく、母乳からのフルコナゾールの推定 1 日乳児用量 (平均乳消費量を 150 mL/kg/日と仮定)。用量) は 0.39 mg/kg/日であり、これは口腔咽頭カンジダ症の推奨小児用量の約 13% です。 (表示されている小児用量は、初日に 6 mg/kg/日、続いて 3 mg/kg/日である。乳児の推定用量は、3 mg/kg/日の維持用量の 13% である)。繰り返し使用した後、または高用量のフルコナゾールを使用した後の牛乳中のフルコナゾールレベルに関するデータはありません.母乳育児に関連した乳房のカンジダに対して隔日でフルコナゾール 150 mg (平均 7.3 カプセル [範囲 1 ~ 29 カプセル]) を投与された 96 人の授乳中の女性の公表された調査では、乳児に深刻な副作用は報告されていません。 DIFLUCAN を授乳中の女性に投与する場合は注意が必要です。
小児用
非盲検無作為対照試験では、DIFLUCAN 100mg が生後 6 か月から 13 歳までの小児の口腔咽頭カンジダ症の治療に有効であることが示されました。 (見る 臨床研究 .)
クリプトコッカス髄膜炎、カンジダ食道炎、または全身性カンジダ感染症の小児における DIFLUCAN 200mg の使用は、成人におけるこれらの適応症に対して示された有効性と、いくつかの小規模な非比較小児臨床試験の結果によって裏付けられています。さらに、小児における薬物動態研究( 臨床薬理学 ) は、子供と大人の間の線量比例を確立しました。 (見る 投薬と管理 .)
ほとんどがカンジダ血症である深刻な全身性真菌感染症の子供の非比較研究では、DIFLUCANの有効性は、成人のカンジダ血症の治療について報告されたものと同様でした.培養で確認されたカンジダ血症の 17 人の被験者のうち、ベースラインの症状 (3 人は無症候性) の 14 人中 11 人 (79%) が臨床治癒しました。評価可能な患者の 13/15 (87%) は、治療終了時に菌学的治癒を示しましたが、これらの患者のうち 2 人は、治療の中止後、それぞれ 10 日目と 18 日目に再発しました。
クリプトコッカス髄膜炎の抑制に対する DIFLUCAN の有効性は、生命を脅かすまたは重篤な真菌症の治療のためのフルコナゾールの人道的使用研究で治療された 5 人の子供のうち 4 人で成功しました。小児のクリプトコッカス髄膜炎の一次治療に対するフルコナゾールの有効性に関する情報はありません。
小児における DIFLUCAN 200mg の安全性プロファイルは、1 ~ 15 mg/kg/日の範囲の用量を 1 ~ 1,616 日間投与された 1 日~17 歳の 577 人の小児で研究されています。 (見る 有害反応 .)
DIFLUCAN の有効性は、生後 6 か月未満の乳児では確立されていません。 (見る 臨床薬理学 .) 生後 1 日から 6 か月の少数の患者 (29 人) が DIFLUCAN で安全に治療されています。
高齢者の使用
AIDS 以外の患者では、フルコナゾール治療に関連すると思われる副作用は、65 歳以上の患者 (9%、n = 339) では若い患者 (14%、n = 2240) よりも少なかったと報告されています。しかし、個々の副作用に関しては、年配の患者と若い患者の間に一貫した違いはありませんでした。最も頻繁に報告された (> 1%) 副作用のうち、発疹、嘔吐、および下痢は、より高齢の患者でより多く発生しました。高齢患者 (2.4%) と若年患者 (1.5%) の同程度の割合が、副作用のためにフルコナゾール療法を中止しました。市販後の経験では、貧血および急性腎不全の自発的報告は、12~65 歳の患者よりも 65 歳以上の患者でより頻繁に報告されました。しかし、報告の自発的な性質と、高齢者における貧血および腎不全の発生率の自然な増加のため、薬物曝露との因果関係を確立することは不可能です.
フルコナゾールの対照臨床試験には、65 歳以上の患者が、各適応症で若い患者と異なる反応を示すかどうかを評価するのに十分な数が含まれていませんでした。他の報告された臨床経験では、年配の患者と若い患者の間の反応の違いは確認されていません。
フルコナゾールは、主に未変化の薬物として腎排泄によって除去されます。高齢者は腎機能が低下している可能性が高いため、クレアチニンクリアランスに基づいて用量を調整するように注意する必要があります。腎機能のモニタリングに役立つ場合があります。 (見る 臨床薬理学 と 投薬と管理 .)
過剰摂取
幻覚と妄想行動を伴うフルコナゾールの過剰摂取の報告があります。
過剰摂取の場合は、対症療法(臨床的に必要な場合は支持療法と胃洗浄による)を開始する必要があります。
フルコナゾールの大部分は尿中に排泄されます。 3 時間の血液透析セッションでは、血漿レベルが約 50% 低下します。
非常に高用量のフルコナゾールを投与されたマウスとラットでは、両方の種の臨床効果には、運動性と呼吸の低下、眼瞼下垂、流涙、唾液分泌、尿失禁、立ち直り反射の喪失、およびチアノーゼが含まれていました。間代性痙攣が死に至ることもあった。
禁忌
ジフルカン(フルコナゾール)は、フルコナゾールまたはその賦形剤に対して過敏症を示した患者には禁忌です。フルコナゾールと他のアゾール系抗真菌薬との交差過敏症に関する情報はありません。他のアゾールに対する過敏症の患者に DIFLUCAN を処方する際には注意が必要です。 QT間隔を延長することが知られており、エリスロマイシン、ピモジド、キニジンなどの酵素CYP3A4を介して代謝される他の薬物の同時投与は、フルコナゾールを投与されている患者には禁忌です. (見る 臨床薬理学 : 薬物相互作用研究 と 予防 .)
臨床薬理学
薬物動態と代謝
フルコナゾールの薬物動態特性は、静脈内または経口経路による投与後も同様です。正常なボランティアでは、経口投与されたフルコナゾールのバイオアベイラビリティは、静脈内投与と比較して 90% 以上です。 100 mg 錠剤と 200 mg 単回投与時の両方の懸濁液強度との間で生物学的同等性が確立されました。
絶食した正常なボランティアのピーク血漿濃度 (Cmax) は、経口投与後約 30 時間 (範囲: 20 から 50 時間) の最終血漿排出半減期で 1 時間から 2 時間の間に発生します。
絶食状態の正常なボランティアでは、DIFLUCAN (フルコナゾール) の 400 mg の単回経口投与により、平均 Cmax が 6.72 mcg/mL (範囲: 4.12 ~ 8.08 mcg/mL) になり、50 ~ 400 mg の単回経口投与後、フルコナゾール血漿濃度と血漿濃度-時間曲線下面積 (AUC) は用量に比例します。
DIFLUCAN (フルコナゾール) 錠剤を絶食状態で高脂肪の食事と一緒に健康なボランティアに投与することを含む食事効果研究からの Cmax および AUC データは、薬物への曝露が食物の影響を受けないことを示しました。したがって、ディフルカンは食事に関係なく服用できます。 (見る 投薬と管理 .)
50~400 mgを1日1回経口投与すると、5~10日以内に定常状態の濃度に達します。通常の 1 日量の 2 倍の負荷量を (1 日目に) 投与すると、2 日目までに血漿濃度が定常状態に近くなります。フルコナゾールの分布の見かけの体積は、全身の水分に近似しています。血漿タンパク質結合は低い(11~12%)。最大 14 日間の単回または複数回の経口投与後、フルコナゾールは研究対象のすべての体液に浸透します ( 下の表 )。正常なボランティアでは、フルコナゾールの唾液濃度は、投与量、経路、または投与期間に関係なく、血漿濃度と同じかわずかに高かった.気管支拡張症の患者では、フルコナゾール 150 mg を 1 回経口投与した後の喀痰濃度は、投与後 4 時間と 24 時間の両方で血漿濃度と同等でした。真菌性髄膜炎の患者では、脳脊髄液 (CSF) 中のフルコナゾール濃度は、対応する血漿濃度の約 80% です。
27 人の患者に投与されたフルコナゾール 150 mg の単回経口投与は、膣組織に浸透し、投与後最初の 48 時間で 0.94 から 1.14 の範囲の組織: 血漿比が得られました。
14 人の患者に投与されたフルコナゾール 150 mg の単回経口投与は、膣液に浸透し、投与後最初の 72 時間で 0.36 から 0.71 の範囲の体液: 血漿比が得られました。
正常なボランティアでは、フルコナゾールは主に腎排泄によって除去され、投与量の約 80% が未変化の薬物として尿中に現れます。投与量の約 11% が代謝物として尿中に排泄されます。
フルコナゾールの薬物動態は、腎機能の低下によって著しく影響を受けます。排泄半減期とクレアチニンクリアランスの間には反比例の関係があります。腎機能障害のある患者では、DIFLUCAN の用量を減らす必要がある場合があります。 (見る 投薬と管理 .) 3 時間の血液透析セッションでは、血漿濃度が約 50% 低下します。
正常なボランティアでは、DIFLUCAN 投与 (200 mg から 400 mg の範囲の用量を 1 日 1 回、最大 14 日間) は、テストステロン濃度、内因性コルチコステロイド濃度、および副腎皮質刺激ホルモン (ACTH) 刺激によるコルチゾール反応に対して、わずかで一貫性のない効果と関連していました。
小児における薬物動態
小児では、以下の薬物動態データ {Mean (%cv)} が報告されています。
これらの研究では、体重で補正されたクリアランスは年齢の影響を受けませんでした。成人の平均体内クリアランスは 0.23 (17%) mL/min/kg と報告されています。
未熟児 (妊娠期間 26 ~ 29 週) では、生後 36 時間以内の平均 (%cv) クリアランスは 0.180 (35%、N=7) mL/min/kg で、時間とともに平均 0.218 ( 31%、N=9) mL/min/kg 6 日後、0.333 (56%, N=4) mL/min/kg 12 日後。同様に、半減期は 73.6 時間で、6 日後に平均 53.2 時間、12 日後に平均 46.6 時間まで時間とともに減少しました。
高齢者における薬物動態
フルコナゾール 50 mg を単回経口投与した 65 歳以上の 22 人の被験者を対象に、薬物動態研究が実施されました。これらの患者のうち 10 人は利尿薬を併用していました。 Cmax は 1.54 mcg/mL で、投与後 1.3 時間で発生しました。平均 AUC は 76.4 ± 20.3 mcg·h/mL であり、平均終末半減期は 46.2 時間でした。これらの薬物動態パラメータ値は、正常な若い男性ボランティアについて報告された類似の値よりも高くなっています。利尿薬の同時投与は、AUC または Cmax を大幅に変更しませんでした。さらに、高齢者のクレアチニンクリアランス (74 mL/分)、尿中に変化せずに回収された薬物の割合 (0 ~ 24 時間、22%)、およびフルコナゾールの腎クリアランス推定値 (0.124 mL/分/kg) は一般的に低かった。若いボランティアよりも。したがって、高齢者におけるフルコナゾールの性質の変化は、このグループに特徴的な腎機能の低下に関連しているようです。各被験者の最終排出半減期とクレアチニン クリアランスの関係を、正常な被験者とさまざまな程度の腎不全の被験者から得られた予測半減期 - クレアチニン クリアランス曲線と比較したプロットは、被験者 22 人中 21 人が範囲内に収まったことを示しました。予測された半減期クレアチニンクリアランス曲線の 95% 信頼限界。これらの結果は、正常な若い男性の志願者と比較して高齢の被験者で観察された薬物動態パラメータの値が高いのは、高齢者で予想される腎機能の低下によるものであるという仮説と一致しています。
薬物相互作用研究
(見る 薬物相互作用 )
経口避妊薬
健康な女性 10 人を対象に、ジフルカン 50 mg を 1 日 1 回、10 日間経口投与する前後に、経口避妊薬を単回投与しました。 DIFLUCAN 50 mg 投与後のエチニルエストラジオールまたはレボノルゲストレルの AUC に有意差はありませんでした。エチニル エストラジオール AUC の平均増加は 6% (範囲: -47 から 108%) で、レボノルゲストレル AUC は 17% 増加しました (範囲: -33 から 141%)。
番目の研究では、25 人の正常な女性が 200 mg の DIFLUCAN 150 mg 錠剤またはプラセボの両方を 10 日間の 2 日間毎日投与されました。治療サイクルは 1 か月間隔で行われ、すべての被験者は 1 つのサイクルで DIFLUCAN を投与され、もう 1 つのサイクルでプラセボが投与されました。研究治療の順序はランダムでした。レボノルゲストレルとエチニルエストラジオールを含む経口避妊薬錠剤の単回投与は、両方のサイクルの最終治療日 (10 日目) に投与されました。 DIFLUCAN 200 mg の投与後、プラセボと比較したレボノルゲストレルの AUC の平均増加率は 25% (範囲: -12 ~ 82%) であり、プラセボと比較したエチニル エストラジオールの平均増加率は 38% (範囲: –11 ~ 101%)。これらの増加は両方とも、プラセボとは統計的に有意に異なっていました.
つ目の研究では、エチニル エストラジオールとノルエチンドロンを含む経口避妊薬を服用している 21 人の正常な女性に週 1 回フルコナゾール 300 mg を投与した場合の潜在的な相互作用が評価されました。 3 サイクルの経口避妊薬治療で実施されたこのプラセボ対照、二重盲検、無作為化、双方向クロスオーバー研究では、フルコナゾール投与により、同様のプラセボ投与と比較して、エチニル エストラジオールとノルエチンドロンの平均 AUC がわずかに増加しました。エチニルエストラジオールおよびノルエチンドロンの平均 AUC は、プラセボと比較して、それぞれ 24% (95% CI 範囲: 18 ~ 31%) および 13% (95% CI 範囲: 8 ~ 18%) 増加しました。フルコナゾール治療は、プラセボ投与と比較して、この研究の個々の被験者のエチニルエストラジオールAUCの減少を引き起こしませんでした.ノルエチンドロンの個々の AUC 値は、フルコナゾール治療後に 21 人の被験者のうち 3 人でわずかに減少しました (
シメチジン
ジフルカン 100 mg を 6 人の健康な男性ボランティアに単独で経口投与し、シメチジン 400 mg を単回投与してから 2 時間後に投与しました。シメチジンの投与後、フルコナゾールの AUC と Cmax が有意に減少しました。フルコナゾールの AUC は平均 ± SD で 13% ± 11% (範囲: -3.4 ~ -31%) 減少し、Cmax は 19% ± 14% (範囲: -5 ~ -40%) 減少しました。 %)。しかし、シメチジン 600 mg から 900 mg を 4 時間にわたって静脈内投与した場合 (DIFLUCAN 200 mg の単回経口投与の 1 時間前から 3 時間後まで)、24 人の健康な男性ボランティアのフルコナゾールの生物学的利用能または薬物動態に影響はありませんでした。 .
制酸剤
DIFLUCAN 100 mg の単回投与の直前に、正常な男性ボランティア 14 人に Maalox® (20 mL) を投与しても、フルコナゾールの吸収または排泄に影響はありませんでした。
ヒドロクロロチアジド
13 人の正常なボランティアに 100 mg の DIFLUCAN と 50 mg のヒドロクロロチアジドを 10 日間同時に経口投与すると、DIFLUCAN を単独で投与した場合と比較して、フルコナゾールの AUC と Cmax が有意に増加しました。フルコナゾールの AUC と Cmax は、平均 ± SD でそれぞれ 45% ± 31% (範囲: 19 ~ 114%) および 43% ± 31% (範囲: 19 ~ 122%) 増加しました。これらの変化は、腎クリアランスが 30% ± 12% (範囲: -10 から -50%) 減少したことによるものです。
リファンピン
人の健康な男性ボランティアに毎日 600 mg としてリファンピンを 15 日間投与した後、200 mg の DIFLUCAN 200 mg を単回経口投与すると、フルコナゾール AUC が大幅に減少し、フルコナゾールの見かけの経口クリアランスが大幅に増加しました。フルコナゾール AUC の平均 ± SD 減少は 23% ± 9% (範囲: -13 ~ -42%) でした。フルコナゾールの見かけの経口クリアランスは 32% ± 17% (範囲: 16 ~ 72%) 増加しました。フルコナゾールの半減期は、33.4 ± 4.4 時間から 26.8 ± 3.9 時間に減少しました。 (見る 予防 .)
ワルファリン
13 人の正常な男性ボランティアにワルファリン (15 mg) を単回投与した後、14 日間毎日経口ディフルカン 200 mg を投与した後、プロトロンビン時間応答 (プロトロンビン時間-時間曲線の下の領域) が有意に増加しました。ワーファリンのみ。 7% ± 4% (範囲: -2 から 13%) のプロトロンビン時間応答 (プロトロンビン時間-時間曲線の下の領域) の平均 ± SD 増加がありました。 (見る 予防 .) 平均値は 12 人の被験者からのデータに基づいています。13 人の被験者のうちの 1 人がプロトロンビン時間応答の 2 倍の増加を経験したからです。
フェニトイン
フェニトインの AUC は、10 人の正常な男性に、フルコナゾール (経口 DIFLUCAN 200 mg を 1 日 16 日間) を投与した場合としない場合の両方で、4 日間のフェニトイン投与 (1 日 200 mg、3 日間経口、続いて 250 mg の静脈内投与) 後に測定されました。ボランティア。フェニトイン AUC の有意な増加がありました。フェニトイン AUC の平均 ± SD 増加は 88% ± 68% (範囲: 16 ~ 247%) でした。この相互作用の絶対的な大きさは、フェニトインの本質的に非線形な性質のために不明です。 (見る 予防 .)
シクロスポリン
シクロスポリン AUC および Cmax は、少なくとも 6 か月間シクロスポリン療法を受け、少なくとも 6 週間安定したシクロスポリン用量で投与された 8 人の腎移植患者において、フルコナゾール 200 mg を毎日 14 日間投与する前と後に測定されました。フルコナゾールの投与後、シクロスポリンの AUC、Cmax、Cmin (24 時間濃度) が大幅に増加し、見かけの経口クリアランスが大幅に減少しました。 AUC の平均 ± SD 増加は 92% ± 43% (範囲: 18 ~ 147%) でした。 Cmax は 60% ± 48% 増加しました (範囲: -5 から 133%)。 C は 157% ± 96% 増加しました (範囲: 33 ~ 360%)。見かけの口腔クリアランスは 45% ± 15% 減少しました (範囲: -15 から -60%)。 (見る 予防 .)
ジドブジン
血漿ジドブジン濃度は、少なくとも 2 週間安定したジドブジン投与を受けていた AIDS または ARC の 13 人のボランティアで 2 回 (15 日間、フルコナゾール 200 mg を毎日 200 mg 投与する前後) 測定されました。フルコナゾールの投与後、ジドブジン AUC が有意に増加しました。 AUC の平均 ± SD 増加は 20% ± 32% (範囲: -27 から 104%) でした。代謝物である GZDV と親薬物の比率は、フルコナゾールの投与後に 7.6 ± 3.6 から 5.7 ± 2.2 に大幅に減少しました。
テオフィリン
テオフィリンの薬物動態は、フルコナゾール 200 mg を毎日 14 日間、16 人の正常な男性ボランティアに経口投与する前後に、アミノフィリン (6 mg/kg) を 1 回静脈内投与して測定しました。テオフィリンの AUC、Cmax、および半減期が大幅に増加し、対応するクリアランスが減少しました。平均 ± SD テオフィリン AUC は 21% ± 16% 増加しました (範囲: -5 から 48%)。 Cmax は 13% ± 17% 増加しました (範囲: -13 から 40%)。テオフィリン クリアランスは 16% ± 11% 減少しました (範囲: -32 ~ 5%)。テオフィリンの半減期は 6.6 ± 1.7 時間から 7.9 ± 1.5 時間に増加しました。 (見る 予防 .)
キニジン
インビトロまたはインビボで研究されていませんが、フルコナゾールとキニジンを併用すると、キニジン代謝が阻害される可能性があります。キニジンの使用は、QT 延長とトルサード ド ポワントのまれな発生に関連付けられています。フルコナゾールとキニジンの併用は禁忌です。 (見る 禁忌 と 予防 .)
経口血糖降下薬
スルホニル尿素経口血糖降下薬であるトルブタミド、グリピジド、およびグリブリドの薬物動態に対するフルコナゾールの効果は、正常なボランティアを対象とした 3 つのプラセボ対照研究で評価されました。すべての被験者は、スルホニル尿素を単回投与として単独で投与され、DIFLUCAN 100 mg を毎日 7 日間投与した後、単回投与として再度投与されました。これらの 3 つの研究では、DIFLUCAN 治療患者の 22/46 (47.8%) とプラセボ治療患者の 9/22 (40.1%) が低血糖と一致する症状を経験しました。 (見る 予防 .)
トルブタミド
13 人の正常な男性ボランティアでは、フルコナゾールの投与後にトルブタミド (500 mg の単回投与) の AUC と Cmax が有意に増加しました。トルブタミド AUC の平均 ± SD 増加は 26% ± 9% (範囲: 12 ~ 39%) でした。トルブタミド Cmax は 11% ± 9% 増加しました (範囲: -6 から 27%)。 (見る 予防 .)
グリピジド
グリピジド (2.5 mg 単回投与) の AUC および Cmax は、13 人の正常な男性ボランティアにフルコナゾールを投与した後、有意に増加しました。 49% ± 13% (範囲: 27 ~ 73%) の AUC の平均 ± SD 増加と 19% ± 23% (範囲: -11 ~ 79%) の Cmax の増加がありました。 (見る 予防 .)
グリブリド
グリブリド(5 mg 単回投与)の AUC および Cmax は、20 人の正常な男性ボランティアにフルコナゾールを投与した後、有意に増加しました。 44% ± 29% (範囲: -13 から 115%) の AUC の平均 ± SD 増加があり、Cmax は 19% ± 19% 増加しました (範囲: -23 から 62%)。フルコナゾール投与の7日後にグリブリドを摂取した後、5人の被験者が経口ブドウ糖を必要とした. (見る 予防 .)
リファブチン
フルコナゾールをリファブチンと同時に投与すると相互作用が存在し、リファブチンの血清レベルが上昇するという報告が発表されています。 (見る 予防 .)
タクロリムス
フルコナゾールをタクロリムスと同時に投与すると相互作用が存在し、タクロリムスの血清レベルが上昇するという報告が発表されています。 (見る 予防 .)
ミダゾラム
ミダゾラムの薬物動態と薬力学に対するフルコナゾールの効果は、12人のボランティアを対象とした無作為クロスオーバー研究で調べられました。この研究では、被験者は 1 日目にプラセボまたは 400 mg のフルコナゾールを摂取し、その後 2 日目から 6 日目まで毎日 200 mg を摂取しました。さらに、ミダゾラムの 7.5 mg 用量を初日に経口摂取し、0.05 mg/kg を静脈内投与しました。 4 日目に 7.5 mg を経口投与した。フルコナゾールは、IV ミダゾラムのクリアランスを 51% 減少させました。投与の初日に、フルコナゾールはミダゾラムの AUC と C をそれぞれ 259% と 150% 増加させました。投与の 6 日目に、フルコナゾールはミダゾラムの AUC と C をそれぞれ 259% と 74% 増加させました。ミダゾラムの精神運動効果は、ミダゾラムの経口投与後に有意に増加しましたが、ミダゾラムの静脈内投与後は有意な影響を受けませんでした。
フルコナゾールとミダゾラムの間の相互作用に対するフルコナゾールの投与経路の影響を決定するために、3段階での2番目の無作為化、ダブルダミー、プラセボ対照、クロスオーバー試験が実施されました。各フェーズで、被験者は経口フルコナゾール 400 mg と静脈内生理食塩水を投与されました。経口プラセボおよび静脈内フルコナゾール 400 mg。経口プラセボと IV 生理食塩水。フルコナゾール/プラセボの後に7.5mgのミダゾラムを経口摂取しました。ミダゾラムの AUC と Cmax は、フルコナゾールの IV 投与よりも経口投与後に有意に高かった。経口フルコナゾールは、ミダゾラムの AUC と Cmax をそれぞれ 272% と 129% 増加させました。 IV フルコナゾールは、ミダゾラムの AUC と Cmax をそれぞれ 244% と 79% 増加させました。経口フルコナゾールと静脈内フルコナゾールの両方が、ミダゾラムの薬力学的効果を増加させました。 (見る 予防 .)
アジスロマイシン
18人の健康な被験者を対象とした非盲検無作為化三元クロスオーバー試験では、フルコナゾール800mg単回経口投与がアジスロマイシン1200mg単回経口投与の薬物動態に及ぼす影響、および薬物動態に対するアジスロマイシンの効果を評価しました。フルコナゾールの。フルコナゾールとアジスロマイシンの間に有意な薬物動態学的相互作用はありませんでした。
ボリコナゾール
ボリコナゾールは、CYP2C9 および CYP3A4 アイソザイムの両方の基質です。経口ボリコナゾール (400 mg Q12h を 1 日、その後 200 mg Q12h を 2.5 日間) と経口フルコナゾール (1 日目に 400 mg、その後 200 mg Q24h を 4 日間) を 6 人の健康な男性被験者に同時投与すると、Cmax が上昇しました。およびボリコナゾールの AUCτ は、それぞれ平均 57% (90% CI: 20% ~ 107%) および 79% (90% CI: 40% ~ 128%) でした。 8人の健康な男性被験者を対象としたその後の臨床研究では、ボリコナゾールとフルコナゾールの投与量および/または頻度を減らしても、この効果が排除または減少することはありませんでした.ボリコナゾールとフルコナゾールの同時投与は、どの用量でも推奨されません。ボリコナゾールをフルコナゾールの後に連続して使用する場合、特にフルコナゾールの最終投与から 24 時間以内に、ボリコナゾールに関連する有害事象を綿密に監視することをお勧めします。 (見る 予防 .)
トファシチニブ
健康な被験者にフルコナゾール (1 日目に 400 mg、200 mg を 1 日 1 回 6 日間 [2 日目~7 日目]) とトファシチニブ (5 日目に 30 mg 単回投与) を同時投与すると、トファシチニブの平均 AUC と Cmax 値は約トファシチニブ単独投与と比較して、それぞれ 79% (90% CI: 64% ~ 96%) および 27% (90% CI: 12% ~ 44%)。 (見る 予防 .)
微生物学
作用機序
フルコナゾールは、真菌シトクロム P450 依存酵素ラノステロール 14-α-デメチラーゼの高度に選択的な阻害剤です。この酵素は、ラノステロールをエルゴステロールに変換する働きをします。その後の正常なステロールの喪失は、真菌における14-α-メチルステロールの蓄積と相関しており、フルコナゾールの静真菌活性の原因である可能性があります.哺乳動物細胞の脱メチル化は、フルコナゾール阻害の影響をはるかに受けません。
抵抗
フルコナゾールに対する耐性が発生する可能性はよく知られています。他のアゾールに対する感受性の低下を示す真菌分離株は、フルコナゾールに対する感受性の低下も示す可能性があります。本剤の適応となる各種菌類の薬剤耐性発現頻度は不明である。
フルコナゾール耐性は、標的酵素 (ラノステロール 14-α-デメチラーゼ) の質または量の変更、薬物標的へのアクセスの減少、またはこれらのメカニズムのいくつかの組み合わせから生じる可能性があります。
標的酵素をコードする遺伝子 (ERG11) の点変異により、アゾールに対する親和性が低下した標的が変化します。 ERG11 の過剰発現は、高濃度の標的酵素の産生をもたらし、細胞内のすべての酵素分子を阻害するために、より高い細胞内薬物濃度が必要になります。
薬剤耐性の 2 番目の主要なメカニズムには、2 種類の多剤排出トランスポーターの活性化による細胞外へのフルコナゾールの積極的な排出が含まれます。主要なファシリテーター (MDR 遺伝子によってコードされる) と ATP 結合カセット スーパーファミリー (CDR 遺伝子によってコードされる) のもの。 MDR 遺伝子のアップレギュレーションはフルコナゾール耐性につながりますが、CDR 遺伝子のアップレギュレーションは複数のアゾールに対する耐性につながる可能性があります。
Candida glabrata の耐性には通常、CDR 遺伝子のアップレギュレーションが含まれ、複数のアゾールに対する耐性が生じます。最小発育阻止濃度 (MIC) が中程度 (16 ~ 32 mcg/mL) に分類される分離株では、フルコナゾールの最高用量が推奨されます。
カンジダ・クルセイはフルコナゾールに耐性があると考えるべきです。 C. クルセイの耐性は、薬剤による阻害に対する標的酵素の感受性の低下によって媒介されるようです。
C. albicans 以外のカンジダ種との重複感染の症例が報告されており、C. albicans は本質的に DIFLUCAN に感受性がないことが多い (例: カンジダ クルセイ)。そのような場合は、代替の抗真菌療法が必要になる場合があります。
抗菌活性
フルコナゾールは、以下の微生物のほとんどの分離株に対して活性があることが示されています インビトロと臨床感染の両方で。
カンジダ・アルビカンス カンジダ・グラブラタ (多くの分離株は中程度の感受性があります) カンジダ・パラプシロシス カンジダ・トロピカリス クリプトコッカス・ネオフォルマンス
以下の in vitro データが利用可能です。 しかし、それらの臨床的意義は不明です。 以下の菌類の少なくとも 90% は、同様の属または生物群の分離株に対して、フルコナゾールの感受性ブレークポイント (https://www.fda.gov/STIC) と同等またはそれ以下の in vitro MIC を示します。しかし、これらの真菌による臨床感染症の治療におけるフルコナゾールの有効性は、十分に管理された適切な臨床試験では確立されていません.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
カンジダ・クルセイはフルコナゾールに耐性があると考えるべきです。 C. クルセイの耐性は、薬剤による阻害に対する標的酵素の感受性の低下によって媒介されるようです。
C. albicans 以外のカンジダ種との重複感染の症例が報告されており、C. albicans は本質的に DIFLUCAN に感受性がないことが多い (例: カンジダ クルセイ)。そのような場合は、代替の抗真菌療法が必要になる場合があります。
感受性試験
感受性試験の解釈基準、関連する試験方法、およびこの薬剤について FDA によって認められた品質管理基準に関する具体的な情報については、https://www.fda.gov/STIC を参照してください。
臨床研究
クリプトコッカス髄膜炎
AIDS 患者のクリプトコッカス髄膜炎の治療について、DIFLUCAN (200 mg/日) とアムホテリシン B (0.3 mg/kg/日) を比較した多施設研究では、多変量解析により、治療過程での死亡を予測する 3 つの治療前因子が明らかになりました。精神状態、脳脊髄液のクリプトコッカス抗原力価が 1:1024 を超え、脳脊髄液の白血球数が 20 細胞/mm³ 未満。高リスク患者の死亡率は、アムホテリシン B 患者と DIFLUCAN 患者でそれぞれ 33% と 40% (p=0.58) で、全死亡率は 2 つのアームで 14% (被験者 63 人中 9 人) と 18% (被験者 131 人中 24 人) でした。研究(p = 0.48)。急性クリプトコッカス髄膜炎患者および治療失敗のリスクが高い患者に対する最適な用量とレジメンはまだ決定されていません。 (Saag, et al. N Engl J Med 1992; 326:83-9.)
膣カンジダ症
150 mg の錠剤を使用して、2 つの適切で十分に管理された研究が米国で実施されました。どちらの場合も、フルコナゾールレジメンの結果は、治療後 1 か月の評価で、臨床的にも統計的にも対照レジメン (クロトリマゾールまたはミコナゾールを 7 日間膣内投与) と同等でした。
膣カンジダ症の徴候と症状の完全な解消 (臨床的治癒) と定義される治療的治癒率は、KOH 検査とカンジダの陰性培養 (微生物学的根絶) とともに、フルコナゾール群と膣製品の両方で 55% でした。グループ。
登録された患者の約 4 分の 3 が急性膣炎 (4 エピソード/12 か月未満) を患っており、経口投与された 150 mg の DIFLUCAN 錠剤で治療された場合、80% の臨床治癒、67% の真菌根絶、および 59% の治療治癒を達成しました。これらの割合は、対照製品と同等でした。登録された患者の残りの 4 分の 1 は、再発性膣炎 (4 エピソード/12 か月以上) を有し、57% の臨床的治癒、47% の真菌根絶、および 40% の治療的治癒を達成しました。数が少なすぎて、再発性膣炎患者の治療において膣用製品との意味のある臨床的または統計的比較を行うことができません。
フルコナゾール群では、膣製品群と比較して、実質的に多くの胃腸イベントが報告されました.ほとんどのイベントは軽度から中等度でした。フルコナゾールは単回投与されたため、中止はありませんでした。
小児科研究
中咽頭カンジダ症
口咽頭カンジダ症の免疫不全の子供を対象に、ジフルカン(2~3mg/kg/日)と経口ナイスタチン(400,000IUを1日4回)の有効性と安全性に関する非盲検比較試験が実施されました。フルコナゾールで治療された小児では、臨床的および菌学的奏功率が高かった。
治療終了時の臨床治癒は、ナイスタチン治療患者の 46% と比較して、フルコナゾール治療患者の 86% で報告されました。菌学的には、フルコナゾールで治療された患者の 76% が、ナイスタチンで治療された患者の 11% と比較して、感染生物が根絶されました。
治療終了から 2 週間後の臨床的再発患者の割合は、DIFLUCAN を投与された被験者で 14%、ナイスタチンを投与された被験者で 16% でした。治療終了後 4 週間で、臨床的再発患者の割合は、DIFLUCAN 150mg で 22%、ナイスタチンで 23% でした。
患者情報
ジフルカン® (染料FLEW館)(フルコナゾール)錠
このリーフレットには、DIFLUCAN に関する重要な情報が含まれています。医療提供者の指示に代わるものではありません。 DIFLUCAN を服用する前に、この情報をよくお読みください。この情報を理解していない場合、または DIFLUCAN について詳しく知りたい場合は、医療提供者に尋ねてください。
ジフルカン100mgとは?
DIFLUCAN は、カンジダと呼ばれる酵母によって引き起こされる膣のイースト菌感染症を治療するために使用される処方薬です。 DIFLUCAN 150mg は、膣内で過剰なイースト菌が増殖するのを防ぎ、イースト菌感染症を解消します。
DIFLUCAN 150mg は、口から服用する錠剤であるため、膣内イースト菌感染症の他の治療法とは異なります。 DIFLUCAN は他の条件にも使用されます。ただし、このリーフレットは、膣内イースト菌感染症に対する DIFLUCAN 50mg の使用についてのみ説明しています。その他の理由での DIFLUCAN 200mg の使用に関する情報については、医療提供者にお尋ねください。膣内イースト菌感染症に関する情報については、このリーフレットのセクションを参照してください。
膣内イースト菌感染症とは何ですか?
膣内に一定量の酵母菌が存在するのは正常です。膣内でイースト菌が過剰に増殖し始めると、イースト菌感染症を引き起こすことがあります。膣のイースト菌感染症は一般的です。成人女性の約 4 人に 3 人が、一生のうちに少なくとも 1 回は膣内イースト菌感染症にかかります。
一部の薬や病状は、イースト菌感染症にかかる可能性を高める可能性があります.妊娠している、糖尿病を患っている、避妊薬を使用している、または抗生物質を服用している場合は、他の女性よりも頻繁にイースト菌感染症にかかる可能性があります.個人の衛生状態と特定の種類の衣服は、イースト菌感染症にかかる可能性を高める可能性があります.膣内イースト菌感染症を予防するためにできることについて、医療提供者にアドバイスを求めてください。膣内イースト菌感染症にかかると、次のいずれかの症状が現れることがあります。
- かゆみ
- 排尿時の灼熱感
- 発赤
- 痛み
- カッテージチーズのように見える濃い白いおりもの
次の場合は DIFLUCAN を服用しないでください。
- 次の薬を服用してください。
- キニジン
- エリスロマイシン
- ピモジド
- DIFLUCAN 50mgの有効成分であるフルコナゾール、またはDIFLUCANの成分のいずれかにアレルギーがある. DIFLUCAN の成分の完全なリストについては、この患者情報リーフレットの最後を参照してください。
次の場合は、DIFLUCAN を服用する前に、すべての病状について医療提供者に伝えてください。
- 肝臓に問題がある
- 腎臓に問題がある
- 心臓の不整脈を含む心臓の問題がある
- 低カリウム血症(低カリウム)がある
- 妊娠している、または妊娠する予定がある。 DIFLUCAN の服用中に妊娠した場合は、すぐに医療提供者に伝えてください。 DIFLUCAN 100mgがあなたに適しているかどうかは、あなたとあなたの医療提供者が決定します.妊娠する可能性がある場合は、DIFLUCAN の服用中および最終服用後 1 週間は、避妊(避妊)方法を使用する必要があります。
- 授乳中または授乳を計画している。 DIFLUCAN は母乳に移行する可能性があります。 DIFLUCAN を服用している間、赤ちゃんに与える最善の方法について、かかりつけの医療提供者に相談してください。
DIFLUCAN の服用を開始する前に、服用しているすべての薬について医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。特に以下を服用している場合は、医療提供者に伝えてください。
- グリブリド、トルブタミド、グリピジドなどの糖尿病薬
- ヒドロクロロチアジド、ロサルタン、アムロジピン、ベラパミル、ニフェジピン、フェロジピンなどの血圧薬
- ワーファリンなどの血液希釈剤
- シクロスポリン、タクロリムスまたはシロリムス (臓器移植の拒絶反応を防ぐために使用)
- 結核に対するリファンピンまたはリファブチン
- 発作を制御するためのフェニトインまたはカルバマゼピン
- 喘息をコントロールするテオフィリン
- キニジン(心拍リズムの乱れを修正するために使用)
- アミオダロン(不整脈「不整脈」の治療に使用)
- うつ病にはアミトリプチリンまたはノルトリプチリン
- 精神疾患に対するピモジド
- 真菌感染症に対するアムホテリシン B またはボリコナゾール
- 細菌感染に対するエリスロマイシン
- 癌の治療のためのオラパリブ、シクロホスファミド、またはビンクリスチンやビンブラスチンなどのビンカアルカロイド
- 慢性疼痛に対するフェンタニル、アルフェンタニルまたはメタドン
- 血液がんの治療に使用されるイブルチニブ
- 不眠症の治療に使用されるレンボレキサント
- アトルバスタチン、シンバスタチン、フルバスタチンなどの脂質低下薬
- セレコキシブ、イブプロフェン、ナプロキセンなどの非ステロイド性抗炎症薬
- プレドニゾン、皮膚、胃腸、血液または呼吸器疾患の治療に使用されるステロイド
- サキナビルやジドブジンのような HIV の治療に使用される抗ウイルス薬
- 関節リウマチに対するトファシチニブ
- ビタミンAの栄養補助食品
- 低ナトリウム血症(血液中のナトリウム濃度が低い状態)の治療や、腎機能の低下を遅らせるために使用されるトルバプタン
これらの薬には多くのブランド名があるため、質問がある場合は、医療提供者または薬剤師に確認してください.
どのようにディフルカンを服用すればよいですか?
- あなたの医療提供者があなたに指示するように、DIFLUCANを正確に服用してください。
- DIFLUCAN 100mg は食事の有無にかかわらず口から摂取してください。
- DIFLUCAN 50mg の服用量が多すぎる場合は、すぐに医療提供者に連絡するか、最寄りの緊急治療室に行ってください。
DIFLUCAN 150mgを服用している間、何を避けるべきですか?
DIFLUCAN は、めまいや発作を引き起こす可能性があります。 DIFLUCAN がどのように影響するかを理解するまでは、車を運転したり、機械を操作したりしないでください。
DIFLUCAN 150mg の副作用の可能性は何ですか?
DIFLUCAN 50mg は、次のような重大な副作用を引き起こす可能性があります。
- 深刻な肝臓の問題。 深刻な医学的問題を抱えている人の中には、DIFLUCAN を服用している間に生命を脅かす、または死に至る深刻な肝臓の問題を発症した人もいます。 DIFLUCANの服用を中止すると、これらの肝臓の問題が元に戻ることがあります.次のような深刻な肝臓の問題の症状がある場合は、すぐに医療提供者に伝えてください。
- 濃い色の尿
- 激しい皮膚のかゆみ
- 皮膚や目が黄色くなる(黄疸)
- 明るい色の便
- 疲れ
- 嘔吐
- 食欲減少
- 深刻なアレルギー反応: まれに、DIFLUCAN の服用中に深刻なアレルギー反応(アナフィラキシー)が発生しました。次のようなアレルギー反応の徴候や症状が現れた場合は、DIFLUCAN 50mg の服用を中止し、医療提供者に連絡するか、最寄りの病院の緊急治療室にすぐに行ってください。
- 呼吸困難
- 熱
- まぶたの腫れ
- 咳
- 皮膚の発疹、蕁麻疹、水ぶくれ、または皮膚の剥離
- 顔、口、首、または体の他の部分
- 喘鳴
- 心臓または耳のドキドキ
- 寒気
- 深刻な皮膚の問題。 深刻な医学的問題を抱えている人の中には、DIFLUCAN を服用中に死に至る深刻な皮膚の問題が発生した人もいます。 DIFLUCAN の服用中に発疹が現れた場合は、すぐに医療提供者に伝えてください。
DIFLUCAN 200mg の最も一般的な副作用は次のとおりです。
- 頭痛
- めまい
- 下痢
- 胃痛
- 吐き気や胃のむかつき
- 食べ物の味の変化
その他の副作用は次のとおりです。
- 副腎不全: DIFLUCAN を服用した一部の人々は、可逆的な副腎機能不全を発症しました。次のような副腎不全の症状がある場合は、すぐに医療提供者に伝えてください。
- 長期にわたる疲労
- 筋力低下
- 食欲減少
- 減量
- 胃痛
- めまい
- 吐き気
- 嘔吐
- めまいや発作。
これらは、DIFLUCAN の考えられるすべての副作用ではありません。
副作用に関する医学的アドバイスについては、医療提供者に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
DIFLUCANの保管方法は?
DIFLUCAN タブレットは 86°F (30°C) 以下で保管してください。
DIFLUCAN 50mg とすべての薬は子供の手の届かないところに保管してください。
DIFLUCAN の安全で効果的な使用に関する一般情報。
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。 DIFLUCAN 50mg を処方されていない状態に使用しないでください。他の人があなたと同じ症状を持っている場合でも、DIFLUCAN を与えないでください。それらに害を及ぼす可能性があります。医療専門家向けに書かれた DIFLUCAN 200mg に関する情報については、医療提供者にお問い合わせください。
DIFLUCAN 150mgの成分は何ですか?
有効成分: フルコナゾール
不活性成分: 微結晶性セルロース、無水二塩基性リン酸カルシウム、ポビドン、クロスカルメロース ナトリウム、FD&C Red No. 40 アルミニウム レーキ染料、およびステアリン酸マグネシウム。
この患者情報は、米国食品医薬品局によって承認されています
