Parlodel 2.5mg Bromocriptine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
パーロデルとは何ですか? どのように使用されますか?
パーロデル 2.5mg は、高プロラクチン血症関連機能障害、パーキンソン病、先端巨大症の症状を治療するために使用される処方薬です。パーロデル 2.5mg は、単独で使用することも、他の薬と併用することもできます。
パーロデル 2.5mg は、抗パーキンソン剤、ドーパミン アゴニストと呼ばれる薬物のクラスに属します。高プロラクチン血症;代謝および内分泌、その他。
パーロデル 2.5mg が 10 歳未満の子供に安全で有効であるかどうかはわかっていません。
パーロデルの副作用にはどのようなものがありますか?
Parlodel は、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 視力の問題、
- 鼻水が止まらず、
- 胸痛、
- 息をするときの痛み、
- 速い心拍数、
- 速い呼吸、
- 呼吸困難、
- 背中の痛み、
- 足首や足のむくみ、
- 排尿が少ない、またはまったくない、
- 錯乱、
- 幻覚、
- 立ちくらみ、
- 頭痛、
- 飢え、
- 弱点、
- 発汗、
- 震え、
- 過敏症、
- 集中するのが苦手、
- 不随意の筋肉の動き、
- バランスや調整の喪失、
- 血便またはタール便
- 喀血、
- コーヒーかすのような嘔吐物、
- 激しい頭痛、
- ぼやけた視界、
- 耳元でブンブン、
- 不安、
- 錯乱、
- 胸痛、
- 呼吸困難、
- 不規則な心拍、および
- 発作
上記の症状がある場合は、すぐに医療機関を受診してください。
パーロデル 2.5mg の最も一般的な副作用は次のとおりです。
- めまい、
- 回転する感覚、
- 軽い眠気、
- 疲れ、
- 軽い頭痛、
- 憂鬱な気分、
- 睡眠障害(不眠症)、
- 口渇、
- 鼻づまり、
- 胃のむかつき、
- 吐き気、
- 嘔吐、
- 胃痛、
- 食欲減少、
- 下痢、
- 便秘、および
- 指の冷感またはしびれ
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Parlodel の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
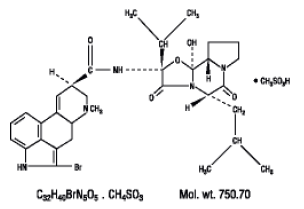
Parlodel® (メシル酸ブロモクリプチン) は、強力なドーパミン受容体アゴニスト活性を持つ麦角誘導体です。経口投与用の各 Parlodel® (メシル酸ブロモクリプチン) SnapTabs® 錠剤には 2.5 mg が含まれ、各カプセルには (メシル酸としての) ブロモクリプチンが 5 mg 含まれています。ブロモクリプチンメシル酸塩は、化学的にエルゴタマン-3',6',18-トリオン、2-ブロモ-12'-ヒドロキシ-2'-(1-メチルエチル)-5'-( 2-メチルプロピル)-, (5'α)-モノメタンスルホナート (塩)。
構造式は次のとおりです。
2½ mg SnapTabs®
有効成分: ブロモクリプチンメシル酸塩、USP
不活性成分: コロイド状二酸化ケイ素、乳糖、ステアリン酸マグネシウム、ポビドン、デンプン、その他の成分
5mgカプセル
有効成分: ブロモクリプチンメシル酸塩、USP
不活性成分: コロイド状二酸化ケイ素、ゼラチン、乳糖、ステアリン酸マグネシウム、ベンガラ、二酸化ケイ素、ラウリル硫酸ナトリウム、デンプン、二酸化チタン、黄酸化鉄、その他の成分
適応症
高プロラクチン血症関連機能障害
パーロデル(メシル酸ブロモクリプチン)は、以下に関連する機能障害の治療に適応されます。 高プロラクチン血症 含む 無月経 有無 乳汁漏出症、不妊症または性腺機能低下症 .パーロデル 2.5mg 治療は、以下の患者に適応されます。 プロラクチン分泌腺腫 これは、上記の臨床症状に寄与する基本的な根底にある内分泌障害である可能性があります。 割引 の 腫瘍の大きさ マクロアデノーマの男性と女性の両方の患者で実証されています。腺切除術が選択された場合、パーロデル 2.5mg 療法のコースを使用して、手術前に腫瘍量を減らすことができます。
先端巨大症
パーロデル 2.5mg 療法は、先端巨大症の治療に適応されます。パーロデル療法は、単独で、または下垂体照射または手術による補助療法として、治療を受けた患者の約 2 分の 1 で血清成長ホルモンを 50% 以上減少させますが、通常は正常レベルにはなりません。
下垂体外照射の影響は数年間最大にならない可能性があるため、パーロデル 2.5mg による補助療法は、照射の影響が現れる前に潜在的な利益をもたらします。
パーキンソン病
Parlodel 2.5mg SnapTab またはカプセルは、特発性または脳炎後パーキンソン病の徴候および症状の治療に適応されます。レボドパ(単独または末梢脱炭酸酵素阻害剤と併用)の補助療法として、パーロデル療法は、現在レボドパの最適用量を維持している患者、レボドパ療法に対して悪化し始めている(耐性を発現している)患者、およびレボドパ療法で「服用の失敗」を経験している人。パーロデル 2.5mg 療法は、レボドパの維持量を減らすことを可能にする可能性があり、したがって、異常な不随意運動 (例えば、ジスキネジー) や筋肉の著しい揺れなど、長期のレボドパ療法に伴う副作用の発生および/または重症度を改善する可能性があります。運動機能(「オンオフ」現象)。 2年以上の治療中のパーロデル2.5mg療法の継続的な有効性は確立されていません.
新たに診断されたパーキンソン病をパーロデルで治療することによる潜在的な利益を評価するには、データが不十分です。しかし、研究によると、レボドパ/カルビドパで治療された患者よりもパーロデルで治療された患者の方が有意に多くの有害反応 (特に吐き気、幻覚、錯乱、低血圧) が見られます。レボドパに反応しない患者は、パーロデル療法の候補にはなりません。
投薬と管理
全般的
パーロデル(メシル酸ブロモクリプチン)は食事と一緒に摂取することをお勧めします。用量漸増中は患者を頻繁に評価して、治療効果が得られる最低用量を決定する必要があります。
高プロラクチン血症の適応症
成人におけるパーロデル スナップタブの初期投与量は、1 日 1 ½ ~ 1 錠 2½ mg です。最適な治療反応が得られるまで、2~7 日ごとに 2.5 mg の錠剤を追加することができます。臨床的に研究された成人の治療用量は、毎日2.5〜15 mgの範囲でした。
11 歳から 15 歳の子供の限られたデータに基づいて、 小児用 ) 最初の用量は、1 日 1 ½ から 1 錠の 2½ mg スコア錠です。治療効果が得られるまでは、許容量に応じて用量を増やす必要がある場合があります。プロラクチン分泌性下垂体腺腫の小児では、治療用量は 1 日 2.5 ~ 10 mg の範囲でした。
予期せぬ妊娠が発生した場合に、パーロデルへの長期暴露の可能性を減らすために、通常の排卵月経周期が回復するまで、機械的避妊薬をパーロデル 2.5mg 療法と組み合わせて使用する必要があります。その後、妊娠を希望する患者は避妊を中止することができます。
その後、予定日から 3 日以内に月経が起こらない場合は、パーロデル 2.5mg の治療を中止し、妊娠検査を実施する必要があります。
先端巨大症
事実上、パーロデル 2.5mg の治療効果を享受している先端巨大症患者のほぼすべてが、成長ホルモンの循環レベルを低下させています。したがって、成長ホルモンの循環レベルの定期的な評価は、ほとんどの場合、パーロデルの治療可能性を決定する際のガイドとして役立ちます.パーロデル療法を短期間試した後、成長ホルモンレベルの有意な低下が見られない場合は、疾患の臨床的特徴を注意深く評価する必要があり、変化が見られない場合は、投与量の調整または治療の中止を検討する必要があります。 .
最初の推奨投与量は、3 日間の引退時に 1/2 から 1 つの 2½ mg パーロデル SnapTabs タブレットです (食事と一緒に)。患者が最適な治療効果を得るまで、3 日から 7 日ごとに 1/2 から 1 個の SnapTabs タブレットを追加する必要があります。患者は毎月再評価し、成長ホルモンの減少または臨床反応に基づいて投与量を調整する必要があります。パーロデルの通常の最適な治療用量範囲は、ほとんどの患者で 20 ~ 30mg/日です。最大投与量は 100 mg/日を超えてはなりません。
下垂体照射で治療された患者は、パーロデル療法の効果だけでなく、疾患プロセスに対する放射線の臨床効果の両方を評価するために、毎年パーロデル 2.5mg 療法を中止する必要があります。通常、この目的には 4 ~ 8 週間の離脱期間が適切です。徴候/症状の再発または成長ホルモンの増加は、疾患プロセスがまだ活発であることを示しており、パーロデルのさらなるコースを検討する必要があります.
パーキンソン病
パーロデル 2.5mg 療法の基本原則は、低用量で治療を開始し、個々に、最大の治療効果が得られるまで、1 日あたりの用量をゆっくりと増加させることです。可能であれば、この導入期間中のレボドパの投与量を維持する必要があります。パーロデル 2.5mg の初期用量は、2.5mg の SnapTabs タブレットの 1/2 を 1 日 2 回、食事と一緒に摂取することです。最適な治療効果が得られる最低用量を超えないように、用量調整中に 2 週間間隔で評価することをお勧めします。必要に応じて、14 ~ 28 日ごとに 1 日 2.5 mg ずつ食事とともに増量されます。副作用のためにレボドパの投与量を減らすことが賢明である場合、Parlodel の 1 日投与量を増やす場合は、少量 (2.5 mg) ずつ徐々に増量する必要があります。
パーロデルの安全性は、1 日 100 mg を超える投与量では証明されていません。
供給方法
パーロデル (ブロモクリプチン メシル酸塩) SnapTabs
2.5mg
パーロデル 2.5 mg の 30 錠と 100 錠が入ったボトルで入手でき、各ボトルには乾燥剤が含まれています。
丸みを帯びたオフホワイトのエッジが面取りされた SnapTab で、それぞれ 2½ mg のブロモクリプチン (メシル酸塩として) を含んでいます。片面に「PARLODEL 2½」、スコア面に「017」の刻印。 USP溶出試験1に準拠。
30 個入りパッケージ - NDC 30698-202-30 100 個入りパッケージ - NDC 30698-202-01
パーロデル(メシル酸ブロモクリプチン)カプセル
5mg
キャラメルとホワイトのカプセルで、それぞれ 5 mg のブロモクリプチン (メシラートとして) を含んでいます。赤インクで「PARLODEL 5mg」、半面に「102」を刻印。
30 個入りパッケージ - NDC 30698-201-30 100 個入りパッケージ - NDC 30698-201-01
保管および分配
68° ~ 77°F (20° ~ 25°C) で保管してください。 59° から 86°F (15° から 30°C) [USP 制御室温を参照] まで許容されます。
遮光性の密閉容器に分注してください。
製造および販売元: Validus Pharmaceuticals LLC Parsippany, NJ 07054. 改訂: 2021 年 7 月
副作用
臨床試験からの有害反応
高プロラクチン血症の適応症
副作用の発生率は非常に高い (69%) が、一般的に軽度から中等度である.副作用のため、患者の約 5% で治療が中止されました。頻度の高い順に、吐き気 (49%)、頭痛 (19%)、めまい (17%)、疲労 (7%)、立ちくらみ (5%)、嘔吐 (5%)、腹部痙攣 (4%) です。 、鼻づまり(3%)、便秘(3%)、下痢(3%)、眠気(3%)。
パーロデル(メシル酸ブロモクリプチン)の治療には、軽度の降圧効果が伴う場合があります。 1 日 2 ~ 3 回、SnapTabs タブレットの 1/2 に一時的に用量を減らすと、副作用の発生が軽減される場合があります。大規模なプロラクチノーマの治療のためにパーロデル 2.5mg を投与された患者で、脳脊髄液性鼻漏の数例が報告されています。これはめったに発生せず、通常は以前に経蝶形骨手術、下垂体放射線療法、またはその両方を受け、腫瘍再発のためにパーロデル 2.5mg を投与されていた患者にのみ発生します。また、腫瘍が蝶形骨洞に達している未治療の患者にも発生する可能性があります。
先端巨大症
パーロデル 2.5mg で治療された先端巨大症患者で最も頻繁に見られた副作用は、吐き気 (18%)、便秘 (14%)、姿勢/起立性低血圧 (6%)、食欲不振 (4%)、口渇/鼻づまり (4%) でした。 %)、消化不良/消化不良 (4%)、デジタル血管痙攣 (3%)、眠気/疲労感 (3%)、嘔吐 (2%)。
頻度の低い副作用 (2% 未満) は、胃腸出血、めまい、レイノー症候群の悪化、頭痛、および失神でした。まれに(1%未満)、脱毛、アルコール増強、失神、立ちくらみ、不整脈、心室頻拍、睡眠要件の低下、幻視、倦怠感、息切れ、徐脈、めまい、感覚異常、反応の鈍さ、血管迷走神経発作、妄想性精神病、パラノイア、不眠症、頭重、寒さへの耐性の低下、耳のうずき、顔面蒼白、筋肉のけいれんなどが報告されています。
パーキンソン病
パーロデル 2.5mg を投与し、同時にレボドパ/カルビドパの用量を減らした臨床試験では、最も一般的に新たに出現した副作用は、吐き気、異常な不随意運動、幻覚、錯乱、「オンオフ」現象、めまい、眠気、失神・失神、嘔吐、無力症、腹部不快感、視覚障害、運動失調、不眠症、うつ病、低血圧、息切れ、便秘、めまい。
あまり一般的ではない副作用としては、食欲不振、不安、眼瞼けいれん、口渇、嚥下障害、足と足首の浮腫、紅斑痛、てんかん様発作、疲労、頭痛、無気力、皮膚のまだら、鼻づまり、神経過敏、悪夢、感覚異常、皮膚の発疹、頻尿、尿失禁、尿閉、まれに、指のうずき、冷たい足、しびれ、足と脚の筋肉のけいれん、またはレイノー症候群の悪化などの交渉の徴候と症状。
臨床検査の異常には、血中尿素窒素、SGOT、SGPT、GGPT、CPK、アルカリホスファターゼ、および尿酸の上昇が含まれる場合がありますが、これらは通常一過性であり、臨床的に重要ではありません。
市販後の経験からの有害反応
パーロデル(全適応症合算)の承認後の使用中に、以下の副作用が報告されています。自発報告による副作用は、不確実な規模の母集団から自発的に報告されるため、一般に、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることはできません。
精神障害: 混乱、精神運動の興奮/興奮、幻覚、精神病性障害、不眠症、性欲亢進、衝動制御/強迫行為 (ギャンブル、浪費、その他の強い衝動を含む)。
神経系障害: 頭痛、眠気、めまい、運動障害、傾眠、感覚異常、日中の過度の傾眠、突然の入眠。
眼疾患: 視覚障害、かすみ目。
耳と迷路の障害: 耳鳴り。
心疾患: 心膜液貯留、収縮性心膜炎、頻脈、徐脈、不整脈、心臓弁線維症。
血管障害: 低血圧、起立性低血圧(失神につながることはほとんどありません)、寒さによって引き起こされる手足の可逆的な蒼白(特にレイノー現象の病歴のある患者)。
呼吸器、胸部および縦隔の障害: 鼻づまり、胸水、胸膜線維症、胸膜炎、肺線維症、呼吸困難。
胃腸障害: 吐き気、便秘、嘔吐、口渇、下痢、腹痛、後腹膜線維症、消化管潰瘍、消化管出血。
皮膚および皮下組織の障害: アレルギー性皮膚反応、脱毛。
筋骨格および結合組織障害: 脚のけいれん。
一般的な障害および投与部位の状態: 疲労、末梢性浮腫、パーロデルの突然の離脱による神経弛緩性悪性症候群に似た症候群、漸減または中止後の離脱症状(無関心、不安、抑うつ、疲労、不眠症、発汗、および痛みを含む)(参照) 予防 )。
その他の条件で観察された有害事象
産後の患者(上記参照) 警告 )
パーロデル 2.5mg を使用した産後の研究では、治療を受けた産後の患者の 23% に少なくとも 1 つの副作用がありましたが、一般的に軽度から中等度でした.約 3% の患者で治療が中止されました。最も頻繁に発生した副作用は、頭痛 (10%)、めまい (8%)、吐き気 (7%)、嘔吐 (3%)、疲労 (1.0%)、失神 (0.7%)、下痢 (0.4%)、けいれん(0.4%)。血圧の低下(収縮期 20 mmHg 以上および拡張期 10 mm Hg 以上)は、産後最初の 3 日間に少なくとも 1 回、患者の 28% で発生しました。これらは通常、一時的なものでした。産褥期の失神の報告は、この影響に関連している可能性があります。米国での市販後の経験では、重篤な副作用として、発作72例(てんかん重積症4例を含む)、脳卒中30例、産後患者の心筋梗塞9例が報告されています。発作症例は、必ずしも高血圧の発症を伴うものではありませんでした。時には視覚障害を伴う絶え間ない、しばしば次第に重度の頭痛であり、発作および/または脳卒中の多くの症例が数時間から数日先行することがよくあります。ほとんどの患者は、子癇、子癇前症、または妊娠誘発性高血圧を含む、妊娠による高血圧障害の証拠を示していませんでした。脳卒中の 1 例は矢状静脈洞血栓症に関連し、別の 1 例は脳および小脳血管炎に関連していた。心筋梗塞の 1 例は原因不明の播種性血管内凝固に関連しており、2 番目の例は別の麦角アルカロイドの使用に関連して発生しました。これらの副作用とパーロデル投与との関係は確立されていません。
まれに、高血圧、心筋梗塞、発作、脳卒中、または精神障害を含む深刻な有害事象が、パーロデルで治療された産後の女性で報告されています.一部の患者では、発作または脳卒中の発症に先立って、重度の頭痛および/または一時的な視覚障害が発生しました。これらの事象と薬剤との因果関係は不明ですが、パーロデルを服用している産後の女性には、血圧を定期的にモニタリングすることをお勧めします。高血圧、重度、進行性、または絶え間ない頭痛 (視覚障害の有無にかかわらず)、または CNS 毒性の証拠が発生した場合、パーロデル 2.5mg の投与を中止し、患者を速やかに評価する必要があります。
交感神経刺激薬などの血管収縮薬や、エルゴメトリンやメチルエルゴメトリンなどの麦角アルカロイドなど、血圧を変化させる可能性のある薬を最近治療または併用療法を受けている患者には特に注意が必要であり、産褥期にこれらを併用することは推奨されません。
疑わしい有害反応を報告するには、Validus Pharmaceuticals LLC (1-866-982-5438) または FDA (1-800-FDA-1088) に連絡するか、 www.fda.gov/medwatch.
薬物相互作用
パーロデルを他の薬と組み合わせて使用するリスクは体系的に評価されていませんが、アルコールはパーロデルの副作用を増強する可能性があります.パーロデル 2.5mg は、ドーパミン拮抗薬、ブチロフェノン、および特定の他の薬剤と相互作用する可能性があります。フェノチアジン、ハロペリドール、メトクロプラミド、ピモジドなどのカテゴリーの化合物は、パーロデルの有効性を低下させます。ブロモクリプチンは CYP3A4 の基質です。したがって、この酵素の強力な阻害剤 (アゾール抗真菌剤、HIV プロテアーゼ阻害剤など) である薬物を同時投与する場合は注意が必要です。エリスロマイシンなどのマクロライド系抗生物質を併用すると、ブロモクリプチンの血漿中濃度が上昇することが示されました (平均 AUC および Cmax 値は、それぞれ 3.7 倍および 4.6 倍に上昇しました)。 (ブロモクリプチンの AUC は約 38% 増加しました)。4 パーロデルと他の麦角アルカロイドとの併用は推奨されません。高用量のブロモクリプチンが使用されている場合(パーキンソン病の適応症など)には、用量調節が必要になる場合があります。
警告
無月経/乳汁漏出および不妊症を伴う高プロラクチン血症が下垂体腫瘍の患者に見られるため、Parlodel (メシル酸ブロモクリプチン) による治療の前に、下垂体の完全な評価が必要です。
パーロデル投与中に妊娠が発生した場合は、これらの患者の注意深い観察が必須です。プロラクチン分泌腺腫が拡大し、視神経または他の脳神経が圧迫される可能性があり、緊急の下垂体手術が必要になります。ほとんどの場合、圧縮は配信後に解決されます。パーロデル 2.5mg の治療を再開すると、妊娠中に神経圧迫が発生した患者の視野が改善されることが報告されています。妊娠中のパーロデル 2.5mg 治療の母親と胎児への安全性は確立されていません。
パーロデル 2.5mg は、特にパーキンソン病患者において、眠気や突然の入眠のエピソードと関連しています。場合によっては、意識や警告の兆候なしに、日常活動中に突然の睡眠が始まることが報告されています。患者はこのことを知らされ、ブロモクリプチンによる治療中は車を運転したり、機械を操作したりしないように助言されなければなりません。傾眠および/または突然の入眠のエピソードを経験した患者は、機械を運転または操作してはなりません。さらに、投与量の減量または治療の中止が考慮される場合があります。
症候性低血圧は、あらゆる適応症でパーロデルで治療された患者に発生する可能性があります。パーロデルを使用した分娩後の研究では、仰臥位の収縮期圧と拡張期圧のそれぞれ 20 mm Hg と 10 mm Hg を超える減少が、パーロデルを投与された患者のほぼ 30% で観察されました。場合によっては、仰臥位の収縮期血圧が 50 ~ 59 mm Hg も低下することがありました。
特に治療の最初の数日間は、時折低血圧反応が起こり、注意力が低下する可能性があるため、車両の運転や機械の操作には特に注意する必要があります。
一部の患者では、パーロデル 2.5mg による治療開始時に低血圧が発生しますが、まれに、授乳の抑制のためにパーロデル 2.5mg で治療された産後の女性で、高血圧、心筋梗塞、発作、脳卒中などの深刻な有害事象が報告されています。高血圧が報告されており、治療の開始時に高血圧が発生することもありますが、治療の 2 週目に発症することがよくあります。高血圧の発症の有無にかかわらず、発作も報告されています。脳卒中は主に、出生前および産科の経過が複雑でなかった産後の患者で報告されています。発作(てんかん重積症の症例を含む)および/または脳卒中を経験しているこれらの患者の多くは、急性イベントの数時間から数日前に、一定の、しばしば次第に激しい頭痛を発症したと報告しました.脳卒中や発作の一部の症例では、視覚障害 (かすみ目、一過性の皮質失明) が先行していました。急性心筋梗塞の症例も報告されています。
パーロデル投与と産後の女性の高血圧、発作、脳卒中、心筋梗塞との因果関係は確立されていませんが、生理的授乳の予防、または高血圧がコントロールされていない患者への使用は推奨されません。高プロラクチン血症の治療を受けている患者では、妊娠が診断されたときにパーロデル 2.5mg を中止する必要があります ( 予防 、 高プロラクチン血症状態 )。パーロデル 2.5mg が急速に拡大するマクロアデノーマを制御するために再処方された場合 ( 予防 、 高プロラクチン血症状態 )および患者が妊娠高血圧障害を経験している場合、パーロデルを継続することの利点は、妊娠高血圧障害中に使用する可能性のあるリスクと比較検討する必要があります.パーロデルが、その後妊娠した患者の先端巨大症またはパーキンソン病の治療に使用されている場合、治療が医学的に必要であり続けるか、中止できるかを決定する必要があります。継続する場合、パーロデルの中止が医学的に禁忌であるとみなされない限り、妊娠高血圧症(子癇、子癇前症、または妊娠誘発性高血圧を含む)を経験する可能性のある人は、この薬を中止する必要があります。パーロデルと他の麦角アルカロイドとの相互作用の可能性があるため、これらの薬剤の併用は推奨されません。特に治療の最初の数週間は、血圧を定期的にモニタリングすることが賢明です。高血圧、重度、進行性、または絶え間ない頭痛 (視覚障害の有無にかかわらず)、または CNS 毒性の証拠が発生した場合は、薬物療法を中止し、患者を速やかに評価する必要があります。最近治療を受けている患者、または血圧を変化させる可能性のある薬剤による併用療法を受けている患者には、特に注意を払う必要があります。産褥での併用は推奨されません。
パーロデル、特に長期および高用量治療の患者の間で、胸水および心嚢液、ならびに胸膜および肺線維症および収縮性心膜炎が報告されています。原因不明の胸膜肺疾患の患者は、徹底的に検査し、パーロデル 2.5mg 療法の中止を検討する必要があります。パーロデル 2.5mg の治療を中止した例では、変化はゆっくりと正常に戻りました。
パーロデル、特に長期および高用量治療の少数の患者では、後腹膜線維症が報告されています。初期の可逆的段階で後腹膜線維症を確実に認識するために、このカテゴリーの患者では、その症状 (例えば、背中の痛み、下肢の浮腫、腎機能障害) を観察することが推奨されます。後腹膜の線維性変化が診断または疑われる場合は、パーロデルの投薬を中止する必要があります。
予防
全般的
パーロデル 2.5mg を含む 1 つまたは複数の薬を服用しているときに、ギャンブルへの強い衝動、性的衝動の増加、抑えきれないほどお金を使う強い衝動、および/またはその他の強い衝動を経験している患者、およびこれらの衝動を制御できないという報告があります。 、それは中枢性ドーパミン作動性緊張を高めます。すべてではありませんが、いくつかのケースでは、これらの衝動は、用量を減らしたり、投薬を中止したりしたときに止まったと報告されています.患者はこれらの行動が異常であると認識していない可能性があるため、処方者はパーキンソン病のパーロデル 2.5mg による治療中に、ギャンブルへの衝動、性的衝動、制御不能な支出、またはその他の衝動の新たな発生または増加について、患者またはその介護者に具体的に尋ねることが重要です。または高プロラクチン血症に関連する機能障害。医師は、パーロデルの服用中に患者がそのような衝動を起こした場合、用量を減らすか、投薬を中止することを検討する必要があります.
パーロデル(メシル酸ブロモクリプチン)の安全性と有効性は、腎疾患または肝疾患の患者では確立されていません。パーロデル療法を血圧を下げることが知られている他の薬と併用する場合は注意が必要です。
精神病や心血管疾患の既往歴のある患者には、この薬を慎重に使用する必要があります。先端巨大症患者またはプロラクチノーマまたはパーキンソン病の患者が妊娠中にパーロデル 2.5mg で治療されている場合、特に心血管疾患の病歴がある場合は、産後の期間中は慎重に観察する必要があります。
ガラクトース不耐症、重度のラクターゼ欠乏症、またはグルコース - ガラクトース吸収不良のまれな遺伝的問題のある患者は、この薬を服用しないでください.
高プロラクチン血症状態
視野障害は、マクロプロラクチノーマの既知の合併症です。パーロデル 2.5mg による効果的な治療により、高プロラクチン血症が減少し、多くの場合、視覚障害が解消されます。しかし、一部の患者では、正常化されたプロラクチンレベルと腫瘍の縮小にもかかわらず、視野の二次的な悪化が続いて発生する可能性があります。これらの場合、ブロモクリプチンの投与量を減らすと視野欠損が改善する可能性がありますが、プロラクチンの上昇と腫瘍の再拡大があります。したがって、マクロプロラクチノーマ患者の視野のモニタリングは、視交叉ヘルニアによる二次視野損失の早期認識と薬物投与量の適応のために推奨されます。
視野の保存におけるパーロデルと手術の相対的有効性は不明です。視野欠損が急速に進行する患者は、最も適切な治療法を決定するために、脳神経外科医による評価を受ける必要があります。
無月経/乳汁漏出症および性腺機能低下症(不妊症)を呈する多くの高プロラクチン血症患者では、妊娠が治療の目的であることが多いため、プロラクチン分泌腺腫の存在を検出するには、下垂体の注意深い評価が不可欠です。妊娠を望んでいない患者、または大きな腺腫を抱えている患者は、パーロデルによる治療中、経口避妊薬以外の避妊手段を使用するようにアドバイスする必要があります。妊娠は月経の再開前に発生する可能性があるため、無月経期間中は少なくとも 4 週間ごとに妊娠検査を行うことをお勧めします。パーロデル スナップタブまたはカプセルによる治療は、妊娠が確定したらすぐに中止する必要があります。以前に検出されなかった、または既存のプロラクチン分泌腫瘍の拡大を示す可能性のある徴候や症状について、妊娠中は患者を綿密に監視する必要があります。マクロアデノーマが知られている患者でのパーロデル治療の中止は、ほとんどの場合、腫瘍の急速な再成長と血清プロラクチンの増加に関連しています。
脳脊髄液性鼻漏は、パーロデルで治療されたプロラクチン分泌腺腫の一部の患者で観察されています。
先端巨大症
寒さに敏感な指の血管痙攣は、パーロデルで治療された一部の先端巨大症患者で観察されています。反応が起こった場合は、パーロデル 2.5mg の投与量を減らすことで元に戻すことができ、指を温めておくことで防ぐことができます。消化性潰瘍からの重度の消化管出血の症例が報告されており、一部は致命的です。パーロデル 2.5mg が先端巨大症患者の消化性潰瘍の発生率を増加させるという証拠はありませんが、消化性潰瘍を示唆する症状を徹底的に調査し、適切に治療する必要があります。消化性潰瘍または消化管出血の病歴のある患者は、パーロデルによる治療中に注意深く観察する必要があります。
パーロデル療法を受けている間に腫瘍が拡大する可能性が、少数の患者で報告されています。成長ホルモン分泌腫瘍の自然史は不明であるため、すべての患者を注意深く監視し、腫瘍拡大の証拠が現れた場合は、治療の中止と代替処置を検討する必要があります。
パーキンソン病
パーキンソニズムに必要な用量で 2 年以上の長期使用における安全性は確立されていません。
あらゆる慢性治療と同様に、肝臓、造血、心血管、および腎機能の定期的な評価が推奨されます。症候性低血圧が発生する可能性があるため、降圧薬を服用している患者の治療には注意が必要です。
パーロデル 2.5mg の高用量は、混乱や精神障害に関連している可能性があります。パーキンソン病患者は軽度の認知症を呈することがあるため、そのような患者の治療には注意が必要です。
単独で、またはレボドパと併用して投与されたパーロデルは、幻覚(視覚または聴覚)を引き起こす可能性があります。幻覚は通常、用量を減らすことで解決します。場合によっては、パーロデル 2.5mg の中止が必要になります。まれに、高用量の摂取後、Parlodel の中止後数週間にわたって幻覚が持続することがあります。
レボドパと同様に、心房、結節、または心室性不整脈が残存している心筋梗塞の既往歴のある患者にパーロデルを投与する場合は注意が必要です。
後腹膜線維症は、パーロデル 2.5mg を 1 日 30~140mg の用量で長期(2~10 年)投与している少数の患者で報告されています。
疫学的研究は、パーキンソン病患者が黒色腫を発症するリスクが一般集団よりも高い (2 約 6 倍高い) ことを示しています。観察されたリスクの増加がパーキンソン病によるものなのか、それともパーキンソン病の治療に使用される薬剤などの他の要因によるものなのかは不明です.上記の理由により、パーロデルを適応症に使用する場合、患者と医療提供者はメラノーマを頻繁かつ定期的に監視することをお勧めします。理想的には、適切な資格を持つ個人(皮膚科医など)が定期的な皮膚検査を実施する必要があります。
患者がレボドパを継続する場合でも、パーロデルの中止は可能な限り徐々に行う必要があります。抗パーキンソン病治療の急速な減量、中止、または変更に関連して、神経弛緩性悪性症候群 (体温の上昇、筋肉の硬直、意識の変化、および自律神経の不安定性を特徴とする) に似た複雑な症状が報告されています。
無関心、不安、抑うつ、疲労、不眠症、発汗、痛みなどの症状が、パーロデルを含むドーパミン アゴニストの漸減中または中止後に報告されています。これらの症状は通常、レボドパに反応しません。パーロデルの中止前に、患者は潜在的な禁断症状について知らされ、パーロデルの中止中および中止後に注意深く監視されるべきです。重度の禁断症状の場合、最低有効用量でのドーパミン作動薬の再投与が考慮される場合があります。
発がん、突然変異誘発、生殖能力の障害
10 および 50 mg/kg/日の経口用量に相当するメシル酸ブロモクリプチンの食餌レベルを使用して、74 週間の研究がマウスで実施されました。 1.7、9.8、および 44 mg/kg/日の経口用量に相当する食事レベルを使用して、ラットで 100 週間の研究が実施されました。マウスとラットでテストされた最高用量は、体表面積に基づいて、対照臨床試験で投与された最大ヒト用量(100 mg /日)の約2.5倍と4.4倍でした.悪性子宮腫瘍、子宮内膜および子宮筋層は、次のようにラットで発見されました: 0/50 の対照雌、毎日 1.7 mg/kg を投与された 2/50 の雌、毎日 9.8 mg/kg を投与された 7/49 の雌、および 9/50 の雌が 44 を投与されたmg/kg 毎日。これらの新生物の発生はおそらく、メシル酸ブロモクリプチンのプロラクチン阻害作用の結果としてラットで発生する高いエストロゲン/プロゲステロン比に起因します。ラットに関与すると考えられている内分泌メカニズムは、ヒトには存在しません。ブロモクリプチンで治療されたラットに発生する子宮悪性腫瘍とヒトのリスクとの間には、既知の相関関係はありません。ラットでの所見とは対照的に、74週間の治療後に殺されたマウスの子宮は、薬物関連の変化の証拠を示さなかった.
メシル酸ブロモクリプチンは、Ames 細菌変異アッセイ、V79 チャイニーズハムスター線維芽細胞に対する in vitro での変異原活性、in vivo 処理後のチャイニーズハムスター骨髄細胞の細胞遺伝学的分析、および変異原性に関する in vivo 小核試験を含む、一連の試験で変異原性について評価されました。マウスの可能性。
これらの試験のいずれにおいても、変異原性の影響は得られませんでした。
メスのラットの繁殖能力と繁殖能力は、授乳の抑制による子の体重の予測された減少を超えて、ブロモクリプチンによる治療によって悪影響を受けませんでした。この薬の 50 mg/kg で処理された雄では、交尾と生殖能力は正常範囲内でした。最高用量(50mg/kg)で処理された雄と交配した後、分娩後21日目(pp)に屠殺された母動物のサブグループで、周産期損失の増加が生じた。
妊娠
カテゴリーB
交尾後 (pc) 6 ~ 15 日目に 2 系統のラットに 10 ~ 30 mg/kg のブロモクリプチンを投与し、pc 5 日目に 10 mg/kg を単回投与すると、着内が妨げられました。 6 から 15 日目に投与された 3 mg/kg は着床に影響を与えず、異常も生じませんでした。 pc8日目から15日目、すなわち着床後、処置された動物において、30mg/kgは、胚吸収の発生率の増加という形で、出生前死亡率の増加をもたらした。 30 mg/kg のブロモクリプチンで処理された母動物に由来する 262 の胎児のグループに、1 つの異常である脊椎および肋骨の形成不全が見られました。出生前または出生後の期間に処理された母動物の子孫には、胎児毒性の影響は見られませんでした。
着床を妨害する可能性を判断するために、ウサギ (2 系統) で 2 つの研究が行われました。 1日目から6日目までの100または300mg/kg/日の用量レベルは、着床に悪影響を及ぼさなかった。高用量は、体表面積に基づいて、対照臨床試験で投与された最大ヒト用量(100 mg /日)の約63倍でした.ニュージーランド白ウサギでは、300 mg/kg で胚の死亡率がいくらか発生しましたが、これは明白な母体毒性を反映したものでした。 6 日目から 18 日目まで pc に 3、10、30、100、および 300 mg/kg の用量レベルでブロモクリプチンを投与した場合の催奇形性の可能性を調べるために、2 つの系統のウサギで 3 つの研究が実施されました。 、口蓋裂は、それぞれ 100 および 300 mg/kg の母体毒性用量で 3 および 2 胎児に見られた。 1 つの対照胎児もこの異常を示した。同じプロトコルを使用してニュージーランド白ウサギで実施された 3 番目の研究では、口蓋裂は生成されませんでした。
ブロモクリプチンの催奇形性または胚毒性効果は、2 mg/kg の用量レベルで 6 匹のサルの 6 匹の子孫のいずれにも生じませんでした。
パーロデルを服用している女性の 1276 人の妊娠に関する情報が収集されました。大多数の場合、パーロデルは妊娠 8 週以内 (平均 28.7 日) に中止されましたが、8 人の患者は妊娠中ずっと薬を服用していました。すべての患者の平均 1 日用量は 5.8 mg (範囲 1 ~ 40 mg) でした。
これらの 1276 件の妊娠のうち、1088 件が満期分娩 (4 件が死産)、145 件が自然流産 (11.4%)、28 件が人工流産 (2.2%) でした。さらに、12 の子宮外妊娠と 3 の胞状奇胎 (同じ患者で 2 回) が妊娠の早期終了を引き起こしました。これらのデータは、クエン酸クロミフェン、更年期性ゴナドトロピン、および絨毛性ゴナドトロピンによって誘発された妊娠について引用された流産率 (11% ~ 25%) に匹敵します。
特に妊娠 20 週以前の自然流産は報告されないことが多いが、その頻度は 15% と推定されている。
集団における先天性欠損症の発生率は、2% ~ 4.5% です。ブロモクリプチンを投与された患者からの 1,109 人の出生における発生率は 3.3% です。
パーロデル 2.5mg が、このグループの乳児の先天異常のタイプまたは発生率に寄与したという示唆はありません。
授乳中の母親
パーロデル 2.5mg は、産後の女性の授乳中は使用しないでください。
小児用
プロラクチン分泌性下垂体腺腫の治療におけるブロモクリプチンの安全性と有効性は、16 歳から成人までの患者で確立されています。 8 歳未満の小児患者におけるブロモクリプチンの使用に関するデータはありません。プロラクチン分泌下垂体マクロアデノーマに対してブロモクリプチンで治療された1人の8歳の患者は、治療反応なしで報告されています。
11 歳から 16 歳未満の小児患者におけるプロラクチン分泌腺腫の治療にブロモクリプチンを使用することは、成人を対象とした十分に管理された試験から得られた証拠によって裏付けられており、限られた数 (n=14) の小児における追加データがあります。ブロモクリプチンで治療された、プロラクチン分泌性下垂体マクロ腺腫およびミクロ腺腫を有する11~15歳の青年。報告された 14 人の患者のうち、9 人は転帰が良好で、3 人は部分奏効、2 人はブロモクリプチン治療に反応しませんでした。慢性下垂体機能低下症は、ブロモクリプチンを単独で投与された患者と、ブロモクリプチンを外科的治療および/または下垂体照射と組み合わせて投与された患者の両方で、5人のレスポンダーでマクロアデノーマ治療を複雑にしました。
小児患者におけるブロモクリプチンの安全性と有効性は、適応症と使用法のセクションに記載されている他の適応症については確立されていません。
高齢者の使用
パーロデル 2.5mg の臨床試験には、65 歳以上の十分な数の被験者が含まれていなかったため、高齢者が若い被験者と異なる反応を示すかどうかを判断できませんでした。しかし、有害事象の市販後報告を含む他の報告された臨床経験では、高齢患者と若年患者の反応または忍容性の違いは確認されていません。パーロデル 2.5mg を服用している高齢患者の有効性や有害反応プロファイルに変化は見られませんが、一部の高齢者の感受性が高いことを断固として除外することはできません。一般に、高齢患者の用量選択は慎重に行う必要があり、この集団では肝機能、腎機能、心機能の低下、および付随する疾患や他の薬物療法の頻度が高いことを反映して、用量範囲の下限から始めます。
過剰摂取
パーロデル(メシル酸ブロモクリプチン)の急性過剰摂取に関連する最も一般的に報告されている徴候と症状は、吐き気、嘔吐、便秘、発汗、めまい、蒼白、重度の低血圧、倦怠感、錯乱、無気力、眠気、妄想、幻覚、あくびの繰り返しです。致死量は確立されておらず、この薬には非常に広い安全域があります。しかし、パーロデル 2.5mg とクロロキンの量が不明なため、自殺した患者が 1 人死亡しました。
過剰摂取の治療は、嘔吐(意識がある場合)、胃洗浄、活性炭、または生理食塩水カタルシスによる薬物の除去で構成されます。液体の摂取と排出を注意深く監視し、記録することが不可欠です。低血圧は、患者をトレンデレンブルグ体位にし、静脈内輸液を投与して治療する必要があります。上記の手段を最大限に使用しても十分な低血圧の軽減が得られない場合は、昇圧剤を考慮する必要があります。
パーロデルを誤って摂取した子供の報告がいくつかあります.嘔吐、傾眠、発熱が有害事象として報告されました。患者は、数時間以内に自然に回復するか、適切な管理を行った後に回復しました。
禁忌
ブロモクリプチンまたはパーロデル(メシル酸ブロモクリプチン)の賦形剤のいずれかに対する過敏症、制御されていない高血圧、麦角アルカロイドに対する過敏症。高プロラクチン血症の治療を受けている患者では、妊娠が診断されたときにパーロデル 2.5mg を中止する必要があります ( 予防 、 高プロラクチン血症状態 )。急速に拡大するマクロアデノーマを制御するためにパーロデル 2.5mg が再投与された場合 予防 、 高プロラクチン血症状態 )および患者が妊娠高血圧障害を経験している場合、パーロデルを継続することの利点は、妊娠高血圧障害中に使用する可能性のあるリスクと比較検討する必要があります.パーロデルが、その後妊娠した患者の先端巨大症、プロラクチノーマ、またはパーキンソン病の治療に使用されている場合、その治療が医学的に必要であり続けるか、中止できるかを決定する必要があります。継続する場合、パーロデルの中止が医学的に禁忌であるとみなされない限り、妊娠高血圧症(子癇、子癇前症、または妊娠誘発性高血圧を含む)を経験する可能性のある人は、この薬を中止する必要があります。
離脱が医学的に禁忌であるとみなされない限り、冠動脈疾患やその他の重度の心血管疾患の病歴を持つ女性では、分娩後にこの薬を使用しないでください。分娩後に薬を使用する場合は、患者を注意深く観察する必要があります。
臨床薬理学
パーロデル(メシル酸ブロモクリプチン)は、シナプス後ドーパミン受容体を活性化するドーパミン受容体アゴニストです。結節漏斗突起のドーパミン作動性ニューロンは、プロラクチン抑制因子 (ドーパミンと考えられている) を分泌することにより、下垂体前葉からのプロラクチンの分泌を調節します。線条体では、ドーパミン作動性ニューロンが運動機能の制御に関与しています。臨床的には、パーロデル 2.5mg は、生理学的にプロラクチンが上昇した患者および高プロラクチン血症の患者のプロラクチンの血漿レベルを大幅に低下させます。下垂体前葉からの他の栄養ホルモンの分泌に影響を及ぼさない用量レベルで、病理学的高プロラクチン血症状態における生理学的授乳ならびに乳汁漏出の阻害が得られる。実験は、ブロモクリプチンが齧歯類において長期にわたる常同行動を誘発し、黒質に片側性病変を有するラットにおいて回転行動を誘発することを実証した。ドーパミンによって生成されるこれらの作用の特徴は、ドーパミン拮抗薬によって阻害され、線条体ドーパミン受容体に対するブロモクリプチンの直接作用を示唆しています。
メシル酸ブロモクリプチンは、ヒトのプロラクチンの分泌を阻害する非ホルモン性の非エストロゲン作用剤であり、他の下垂体ホルモンにはほとんどまたはまったく影響を与えません。
メシル酸ブロモクリプチンは、線条体のドーパミン受容体を直接刺激することにより、黒質におけるドーパミン合成の進行性欠乏を特徴とする臨床症状であるパーキンソン病の治療に治療効果をもたらします。対照的に、レボドパは、この患者集団で数値的に減少することが知られている黒質のニューロンによるドーパミンへの変換後にのみ、その治療効果を発揮します。
薬物動態
吸収
パーロデル 2.5mg 錠剤、2 x 2.5 mg を絶食状態で 5 人の健康なボランティアに単回投与した後、ブロモクリプチンの平均ピーク血漿レベル、ピーク血漿濃度に到達するまでの時間、および排泄半減期は 465 pg/mL ± 226, 2.5 でした。 1 パーロデル 2.5 mg の単回投与と、1 ~ 7.5 mg の用量範囲で Cmax および AUC との間に線形関係が見られました.2 ブロモクリプチン代謝物の薬物動態は報告されていません。
パーロデル錠 2.5 mg の投与後、食事はブロモクリプチンの全身暴露に有意な影響を与えませんでした.3 絶食条件下でブロモクリプチンを服用すると嘔吐する被験者の割合が高いため、パーロデル 2.5 mg を食事と一緒に服用することをお勧めします.
パーロデル 5 mg を 1 日 2 回 14 日間投与した後、定常状態でのブロモクリプチンの Cmax と AUC は、それぞれ 628 ± 375 pg/mL と 2377 ± 1186 pg*hr/mL でした.4
分布
インビトロ実験は、ブロモクリプチンが血清アルブミンに90%~96%結合していることを示した。
代謝
ブロモクリプチンは、複雑な代謝産物プロファイルと、尿と糞便中に親薬物がほぼ完全に存在しないことによって反映される、広範な初回通過生体内変化を受けます。
ヒト肝ミクロソームを使用した in vitro 研究では、ブロモクリプチンが CYP3A に対して高い親和性を持ち、シクロペプチド部分のプロリン環でのヒドロキシル化が主要な代謝経路を構成することが示されました.レベルアップへ。 (見る 予防 、 薬物相互作用 セクション)。ブロモクリプチンの代謝に対する 2D6、2C8、および 2C19 などの他の主要な CYP 酵素の関与は評価されていません。ブロモクリプチンは、計算された IC50 値が 1.69 μM の CYP3A4 の阻害剤でもあります。予想された。ブロモクリプチンとその代謝産物が CYP 酵素のインデューサーとして作用する可能性は報告されていません。
排泄
経口投与された放射線量の約 82% と 5.6% が、それぞれ糞便と尿中に回収されました。ブロモリゼルグ酸とブロモイソリゼルグ酸は、尿中の放射能の半分を占めていました.5
特定の集団
腎障害の影響
ブロモクリプチンの薬物動態に対する腎機能の影響は評価されていません。
親薬物と代謝物は代謝によってほぼ完全に排泄され、腎臓からは 6% しか排出されないため、腎機能障害はブロモクリプチンとその代謝物の PK に大きな影響を与えない可能性があります ( 予防 、 全般的 )。
肝障害の影響
パーロデルとその代謝物の PK に対する肝臓障害の影響は評価されていません。パーロデルは主に代謝によって消失するため、肝機能障害によりブロモクリプチンの血漿中濃度が上昇する可能性があるため、注意が必要な場合があります ( 予防 、 全般的 )。
ブロモクリプチンとその代謝物の薬物動態に対する年齢、人種、性別の影響は評価されていません。
臨床研究
無月経および乳汁漏出の約 75% の症例で、Parlodel 2.5mg 療法は乳汁漏出を完全またはほぼ完全に抑制し、正常な排卵性月経周期を再開します。
月経は通常、乳汁漏出が完全に抑制される前に再開されます。これにかかる時間は平均で 6 ~ 8 週間です。ただし、数日以内に反応する患者もいれば、最長で 8 か月かかる患者もいます。
乳汁漏出症は、治療前の乳房組織の刺激の程度によっては、制御に時間がかかる場合があります。分泌の少なくとも75%の減少は、通常、8〜12週間後に観察されます.一部の患者は、12 か月の治療後でも反応しない場合があります。
多くの先端巨大症患者において、パーロデル 2.5mg は血清成長ホルモンの循環レベルを迅速かつ持続的に低下させます。
1 ネルソン、M。アル。 (1990)。ブロモクリプチンと共に投与されたエリスロマイシンおよびカフェインの薬物動態評価。 Clin Pharmacol Ther; 47(6):694-7。
Schran, HF, Bhuta, SI, Schwartz, et al. (1980)。ヒトにおけるブロモクリプチンの薬物動態。 In: Golstein, M. Calne, DB, et.アル(エド)。麦角化合物と脳機能: 神経内分泌と神経精神医学的側面、pp. 125-139、ニューヨーク、レイブ プレス。
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic,J. (1991)。ブロモクリプチンの薬物動態と副作用に対する食物とメトクロプラミドの影響。 Eur J Drug Metab Pharmacokinet; 16(3):177-81
4 Flogstad、AK、Halse、J.、Grass、P.、Abisch、E.、Djoseland、O.、Kutz、K.、Bodd、E.、およびJervell、J.(1994)。先端巨大症におけるオクトレオチド、ブロモクリプチン、または両薬剤の併用の比較。 Journal of Clinical Endocrinology & Metabolism;第79巻、461-465
5 Peyronneau MA、Delaforge M、Riviere R ら。 1994. CYP P450 3A に対するエルゴペプチドの高親和性。 P450認識およびブロモクリプチンのヒドロキシル化に対するペプチド部分の重要性。 Eur J Biochem 223:947-56。
ウィナルダ、マサチューセッツ州、ウィエンカーズ、LC (1997)。シンプルな in vitro 阻害スクリーニングを使用した、ドーパミン受容体アゴニストとさまざまなヒトチトクローム P450 酵素との間の潜在的な相互作用の評価。薬物代謝ディスポ; 25:1211-14。
患者情報
臨床試験中、パーロデル 2.5mg 療法の初期段階で、めまい、眠気、気絶、失神、失神が報告されています。市販後の報告によると、パーロデルは、特にパーキンソン病患者において、傾眠や突然の入眠に関連しています。場合によっては、意識や警告の兆候なしに、日常活動中に突然の睡眠が始まることはほとんど報告されていません.パーロデルを服用しているすべての患者は、自動車の運転や機械の操作など、迅速かつ正確な対応が必要な活動に従事する際に注意する必要があります。パーロデル 2.5mg による治療を受けている患者で、傾眠および/または突然の睡眠エピソードを呈している患者は、注意力の低下によって自分自身または他の人が重傷または死亡の危険にさらされる可能性がある活動 (機械の操作など) を運転したり、それに従事したりしないようにアドバイスする必要があります。
マクロアデノーマに関連する高プロラクチン血症状態でパーロデル 2.5mg を投与されている患者、または以前に経蝶形骨手術を受けた患者は、持続的な水様鼻汁があれば主治医に報告するように指示されるべきです。マクロアデノーマの治療のためにパーロデル 2.5mg を服用している患者は、薬剤の中止が腫瘍の急速な再成長と元の症状の再発に関連している可能性があることを伝えなければなりません。
患者とその介護者は、パーロデルを服用している間、患者が制御不能にお金を使うという強い衝動、ギャンブルに対する強い衝動、性的衝動の増加、その他の強い衝動、およびこれらの衝動を制御できない可能性があることに注意する必要があります。患者とその介護者に、Parlodel による治療中に制御不能な支出、ギャンブルへの衝動、性的衝動、またはその他の衝動が新たに発生した場合、または増加した場合は、医療提供者に知らせるようにアドバイスします [参照 予防 ]。
特に治療の最初の数日間、低血圧反応が時折発生し、注意力が低下することがあります。車両の運転や機械の操作には特に注意が必要です。
パーロデルを中止するか、パーロデルの用量を減らしたい場合は、医療提供者に連絡するよう患者にアドバイスしてください。低用量を処方された患者、または薬を中止した患者に、発熱、筋肉のこわばり、意識の変化、無関心、不安、抑うつ、疲労、不眠症、発汗、または痛み(参照 予防 )。
