Arimidex 1mg Anastrozole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
アリミデックスとは何ですか?
アリミデックス 1mg は、閉経後の女性の乳がんの症状を治療するために使用される処方薬です。アリミデックスは、単独で使用することも、他の薬と併用することもできます。
アリミデックスは、抗腫瘍剤、アロマターゼ阻害剤と呼ばれる薬のクラスに属しています。
アリミデックスが子供に安全で効果があるかどうかはわかっていません。
アリミデックスの副作用は?
アリミデックスは、次のような重大な副作用を引き起こす可能性があります。
- 呼吸困難、
- 骨折、
- 腫れた腺、
- 吐き気、
- 上腹部の痛み、
- かゆみ、
- 疲れ、
- 食欲減少、
- 暗い尿、
- 粘土色の便、
- 皮膚や目の黄変(黄疸)、
- 突然のしびれや衰弱(特に体の片側)、
- 突然の激しい頭痛、
- ろれつが回らない、
- 視力やバランスの問題、
- 熱、
- 喉の痛み、
- 顔や舌の腫れ、
- あなたの目に燃える、
- 皮膚の痛みと
- 赤または紫の発疹が(特に顔や上半身に)水ぶくれや剥がれを伴って広がる
上記の症状がある場合は、すぐに医療機関を受診してください。
アリミデックスの最も一般的な副作用は次のとおりです。
- 弱点、
- ほてり、
- 肌のしびれやヒリヒリ感、
- 足首や足のむくみ、
- 関節の痛みやこわばり、
- 握っている時の指の問題、
- 喉の痛み、
- 頭痛、
- 背中の痛み、
- 骨の痛み、
- うつ、
- 気分の変化、
- 睡眠障害(不眠症)、
- 高血圧、
- 激しい頭痛、
- ぼやけた視界、
- 首や耳がドキドキする
- 吐き気、
- 嘔吐、および
- 軽度の発疹
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、アリミデックスの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
経口投与用のアリミデックス (アナストロゾール) 錠剤には、非ステロイド性アロマターゼ阻害剤であるアナストロゾールが 1 mg 含まれています。化学的には、1,3-ベンゼンジアセトニトリル、a,a,a',a'-テトラメチル-5-(1H-1,2,4-トリアゾール-1-イルメチル)と記載されています。その分子式は C17H19N5 であり、その構造式は次のとおりです。
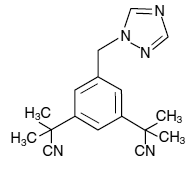
アナストロゾールは、分子量 293.4 のオフホワイトの粉末です。アナストロゾールの水溶性は中程度です (25°C で 0.5 mg/mL)。溶解度は、生理学的範囲の pH とは無関係です。アナストロゾールは、メタノール、アセトン、エタノール、テトラヒドロフランに溶けやすく、アセトニトリルによく溶けます。
各錠剤には、ラクトース、ステアリン酸マグネシウム、ヒドロキシプロピルメチルセルロース、ポリエチレングリコール、ポビドン、デンプングリコール酸ナトリウム、二酸化チタンなどの不活性成分が含まれています。
適応症
アジュバント治療
アリミデックスは、ホルモン受容体陽性の早期乳がんの閉経後女性の補助療法に適応されます。
一次治療
アリミデックス 1mg は、ホルモン受容体陽性またはホルモン受容体不明の局所進行性または転移性乳癌の閉経後女性の第一選択治療に適応されます。
二次治療
アリミデックス 1mg は、タモキシフェン療法後に疾患が進行した閉経後女性の進行性乳がんの治療に適応されます。 ER陰性疾患の患者および以前のタモキシフェン療法に反応しなかった患者は、アリミデックスにほとんど反応しませんでした。
投薬と管理
推奨用量
アリミデックスの服用量は、1日1回1mg錠1錠です。進行乳癌患者の場合、アリミデックス 1mg は腫瘍が進行するまで継続する必要があります。アリミデックスは食事の有無にかかわらず服用できます。
閉経後の女性における早期乳がんの補助療法について、最適な治療期間は不明です。 ATAC 試験では、アリミデックス 1mg が 5 年間投与された [参照 臨床研究 ]。
腎障害のある患者や高齢の患者では、用量調節は必要ありません[参照 特定の集団での使用 ]。
肝障害のある患者
軽度から中等度の肝障害のある患者には、用量の変更は推奨されません。アリミデックスは、重度の肝障害のある患者では研究されていません[参照 特定の集団での使用 ]。
供給方法
剤形と強度
錠剤は白色、両凸、フィルムコーティングされており、1 mg のアナストロゾールが含まれています。錠剤には、片面に文字「A」(大文字)からなるロゴが刻印されており、「A」の伸ばした右足の付け根に矢じりが付いており、裏面には錠剤の強度を示す「Adx 1」が刻印されています。 」。
保管と取り扱い
これらの錠剤は、30 錠入りのボトルで提供されます ( NDC 0310-0201-30)。
保管所
制御された室温、20 ~ 25°C (68 ~ 77°F) で保管してください [ USP ]。
販売元: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. 改訂: 2014 年 5 月
副作用
10,000 人に 1 人未満の患者に発生するアリミデックスの重篤な副作用は次のとおりです。1) 病変、潰瘍、または水疱などの皮膚反応。 2) 顔、唇、舌、喉の腫れを伴うアレルギー反応。これにより、飲み込みや呼吸が困難になる場合があります。 3) 肝機能の血液検査の変化。黄疸、肝臓の痛み、肝臓の腫れの有無にかかわらず、体調がよくないという一般的な症状を伴う肝臓の炎症が含まれます。
アリミデックス 1mg を服用している女性によく見られる副作用 (発生率 10% 以上) には、ほてり、無力症、関節炎、痛み、関節痛、高血圧、うつ病、吐き気と嘔吐、発疹、骨粗鬆症、骨折、背中の痛み、不眠症、頭痛、骨の痛み、末梢浮腫、咳の増加、呼吸困難、咽頭炎、リンパ浮腫。
ATAC 試験では、両治療群の治療中止につながる最も一般的に報告された副作用 ( > 0.1%) はのぼせでしたが、アリミデックス 1mg 群ではのぼせのために治療を中止した患者は少なかったです。
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
臨床試験の経験
補助療法
補助療法の副作用データは、ATAC 試験に基づいています [参照 臨床研究 ]。安全性評価のための補助療法期間の中央値は、アリミデックス 1 mg およびタモキシフェン 20 mg を投与された患者で、それぞれ 59.8 か月および 59.6 か月でした。
治療中または治療終了後 14 日以内にいずれかの治療群で少なくとも 5% の発生率で発生した有害反応を表 1 に示します。
特定の有害反応および有害反応の組み合わせは、2 つの薬剤の既知の薬理学的特性および副作用プロファイルに基づいて、分析のために前向きに特定されました (表 2 を参照)。
虚血性心血管イベント
6,186 人の患者の全体集団の治療群間で、虚血性心血管イベントに統計的な差はありませんでした (4% アリミデックス vs. 3% タモキシフェン)。
全体集団では、狭心症は、アリミデックス 1 mg 群の 71/3092 (2.3%) の患者とタモキシフェン群の 51/3094 (1.6%) の患者で報告されました。心筋梗塞は、アリミデックス 1 mg 群の 37/3092 (1.2%) 患者とタモキシフェン群の 34/3094 (1.1%) 患者で報告されました。
既存の虚血性心疾患 465/6186 (7.5%) の女性では、虚血性心血管イベントの発生率は、アリミデックスの患者で 17%、タモキシフェンの患者で 10% でした。この患者集団では、アリミデックスを投与された 216 人中 25 人 (11.6%) の患者とタモキシフェンを投与された 249 人中 13 人 (5.2%) の患者で狭心症が報告されました。心筋梗塞は、アリミデックスを投与された 2/216 (0.9%) の患者とタモキシフェンを投与された 8/249 (3.2%) の患者で報告されました。
骨密度の所見
12 か月および 24 か月での ATAC 試験骨サブスタディの結果は、アリミデックス 1mg を投与された患者は、ベースラインと比較して、腰椎と総股関節骨密度 (BMD) の両方が平均的に減少したことを示しました。タモキシフェンを投与された患者は、ベースラインと比較して、腰椎と総股関節骨密度の両方が平均的に増加しました。
アリミデックスは循環エストロゲンレベルを低下させるため、骨密度の低下を引き起こす可能性があります.
市販後試験では、ホルモン受容体陽性早期乳癌の閉経後女性の BMD のベースラインからの変化、および骨吸収と骨形成のマーカーに対するアリミデックス 1mg とビスフォスフォネート リセドロネートの併用効果が評価されました。すべての患者は、カルシウムとビタミン D の補給を受けました。 12 か月の時点で、ビスフォスフォネートを投与されていない患者では、腰椎の骨塩量のわずかな減少が見られました。ビスフォスフォネート治療は、骨折のリスクがあるほとんどの患者で骨密度を維持しました。
アリミデックス1mgによる治療が予定されている早期乳がんの閉経後女性は、脆弱性骨折の同様のリスクがある閉経後女性のためにすでに利用可能な治療ガイドラインに従って、骨の状態を管理する必要があります。
コレステロール
ATAC 試験中、アリミデックス 1mg を投与された患者は、タモキシフェンを投与された患者と比較して、より多くの血清コレステロールが上昇したことが報告されました (それぞれ 9% 対 3.5%)。
市販後の試験では、脂質プロファイルに対するアリミデックスの潜在的な影響も評価されました。脂質の一次分析母集団(アリミデックス 1mg 単独)では、ベースラインから 12 か月までの LDL-C およびベースラインから 12 か月までの HDL-C に臨床的に有意な変化はありませんでした。
脂質の二次母集団(アリミデックス+リセドロネート)でも、ベースラインから 12 か月まで、LDL-C および HDL-C に臨床的に有意な変化はありませんでした。
脂質の両方の集団で、ベースラインと比較して、12 か月の総コレステロール (TC) または血清トリグリセリド (TG) に臨床的に有意な差はありませんでした。
この試験では、アリミデックス 1mg 単独での 12 か月間の治療は、脂質プロファイルにニュートラルな効果をもたらしました。アリミデックスとリセドロネートの併用療法も、脂質プロファイルに中立的な影響を及ぼしました。
この試験は、アリミデックス 1mg による治療が予定されている早期乳がんの閉経後女性は、LDL 上昇を伴う個々の患者の心血管リスクに基づく管理に関する現在の全米コレステロール教育プログラムのガイドラインを使用して管理されるべきであるという証拠を提供します。
その他の有害反応
アリミデックスを投与された患者は、タモキシフェンを投与された患者と比較して、関節障害(関節炎、関節症、関節痛を含む)が増加しました。アリミデックスを投与された患者は、タモキシフェンを投与された患者 [209 (7%)] と比較して、すべての骨折 (具体的には脊椎、股関節、および手首の骨折) [315 (10%)] の発生率が増加しました。
アリミデックス 1mg を投与された患者は、タモキシフェンを投与された患者 [22 (0.7%)] と比較して、手根管症候群 [78 (2.5%)] の発生率が高かった。
膣出血は、タモキシフェン治療患者とアリミデックス治療患者でより頻繁に発生し、それぞれ 317 (10%) 対 167 (5%) でした。
アリミデックスを投与された患者は、タモキシフェンを投与された患者と比較して、ほてり、膣出血、膣分泌物、子宮内膜がん、静脈血栓塞栓症および虚血性脳血管イベントの発生率が低かった.
ATAC 試験からの 10 年間の中央値追跡安全性結果
結果は以前の分析と一致しています。
重篤な副作用は、アリミデックス(50%)とタモキシフェン(51%)で同様でした。
- 心血管イベントは、アリミデックスとタモキシフェンの既知の安全性プロファイルと一致していました。
- すべての最初の骨折(治療中または治療後に発生する重篤および非重篤の両方)の累積発生率は、タモキシフェン群(11%)と比較してアリミデックス群(15%)で高かった。この治療中の最初の骨折率の増加は、治療後のフォローアップ期間には続きませんでした。
- 新しい原発性がんの累積発生率は、タモキシフェン群(13.9%)と比較して、アリミデックス 1mg 群(13.7%)で同様でした。以前の分析と一致して、子宮内膜がんはアリミデックス群 (0.2%) と比較してタモキシフェン群 (0.8%) で高かった。
- 総死亡数(治験中または治験外)は、治療群間で同程度でした。タモキシフェン群では、アリミデックス 1mg 治療群よりも乳がんに関連する死亡が多かった.
一次治療
試験 0030 および 0027 のいずれかの治療群で、治療中または治療終了後 2 週間以内に少なくとも 5% の発生率で発生した有害反応を表 3 に示します。
試験 0030 または試験 0027 のいずれかでアリミデックス 1mg/mg を投与された患者で報告された頻度の低い有害事象は、二次治療で報告されたものと同様でした。
二次治療の結果とタモキシフェンの確立された安全性プロファイルに基づいて、薬理作用により治療の一方または両方に因果関係がある可能性がある、事前に指定された 9 つの有害事象カテゴリーの発生率が統計的に分析されました。治療グループ間で有意差は見られませんでした。
二次治療
アリミデックス 1mg は 2 つの対照臨床試験 (試験 0004 および 0005) で耐容性があり、アリミデックス治療患者の 3.3% 未満、酢酸メゲストロール治療患者の 4.0% が副作用のために中止しました。
酢酸メゲストロールよりもアリミデックスでより一般的な主な副作用は下痢でした。因果関係に関係なく、これら 2 つの対照臨床試験のいずれかの治療群の患者の 5% 以上で報告された有害反応を以下に示します。
全身: インフルエンザ症候群;熱;首の痛み;沈滞;偶発的な怪我;感染
心臓血管: 高血圧;血栓性静脈炎
肝臓: ガンマ GT が増加しました。 SGOTが増加しました。 SGPT 増加 血液学的:貧血。白血球減少症
代謝と栄養: アルカリホスファターゼが増加しました。減量
アリミデックスを投与された患者では、平均血清総コレステロール値が 0.5 mmol/L 上昇しました。 LDL コレステロールの増加は、これらの変化に寄与することが示されています。
筋骨格: 筋肉痛;関節痛;病的骨折
緊張: 傾眠;錯乱;不眠症;不安;緊張感
呼吸器: 副鼻腔炎;気管支炎;鼻炎
皮膚と付属物: 薄毛 (脱毛症);かゆみ
泌尿生殖器: 尿路感染;胸の痛み
薬理作用からいずれかまたは両方の治療に因果関係がある可能性のある次の副作用群の発生率を統計的に分析しました:体重増加、浮腫、血栓塞栓症、胃腸障害、のぼせ、および膣の乾燥。これらの 6 つのグループ、およびグループでキャプチャされた有害反応は、前向きに定義されました。結果を下の表に示します。
市販後の経験
これらの有害反応は、不確実な規模の集団から自発的に報告されています。したがって、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません。以下は、アリミデックスの承認後の使用で報告されています。
- アルカリホスファターゼ、アラニンアミノトランスフェラーゼ、アスパラギン酸アミノトランスフェラーゼ、ガンマ-GT、およびビリルビンの増加を含む肝胆道イベント;肝炎
- 多形紅斑やスティーブンス・ジョンソン症候群などの皮膚粘膜疾患を含む発疹
- 血管性浮腫、蕁麻疹、アナフィラキシーなどのアレルギー反応の症例[参照 禁忌 ]
- 筋肉痛、人差し指、高カルシウム血症 (副甲状腺ホルモンの増加を伴うまたは伴わない)
薬物相互作用
タモキシフェン
乳がん患者にアナストロゾールとタモキシフェンを併用投与すると、アナストロゾールの血漿濃度が 27% 減少しました。しかし、アナストロゾールとタモキシフェンの同時投与は、タモキシフェンまたは N-デスメチルタモキシフェンの薬物動態に影響を与えませんでした。追跡期間の中央値 33 か月で、アリミデックスとタモキシフェンの併用は、すべての患者およびホルモン受容体陽性の部分集団において、タモキシフェンと比較して有効性の利点を示しませんでした。この治療群は試験から中止された[参照 臨床研究 ]。 ATAC 試験の臨床的および薬物動態学的結果に基づいて、タモキシフェンはアナストロゾールと一緒に投与すべきではありません。
エストロゲン
エストロゲン含有療法は、アリミデックス 1mg と一緒に使用しないでください。アリミデックスの薬理作用が低下する可能性があります。
ワルファリン
16 人の男性ボランティアで実施された研究では、アナストロゾールは R- と S- の両方の曝露 (C max と AUC で測定) と抗凝固活性 (プロトロンビン時間、活性化部分トロンボプラスチン時間、およびトロンビン時間で測定) を変化させませんでした。ワルファリン。
シトクロム P450 in vitro および in vivo の結果に基づくと、アリミデックス 1 mg の同時投与がシトクロム P450 の阻害の結果として他の薬剤に影響を与える可能性は低い [参照 臨床薬理学 ]。
警告
の一部として含まれています 予防 セクション。
予防
虚血性心血管イベント
既存の虚血性心疾患を持つ女性では、ATAC 試験でアリミデックスを使用した場合、虚血性心血管イベントの発生率の増加が観察されました (アリミデックス 1 mg の患者の 17%、タモキシフェンの患者の 10%)。虚血性心疾患の既往がある患者におけるアリミデックス療法のリスクとベネフィットを考慮する [参照 有害反応 ]
骨の効果
12 か月目と 24 か月目の ATAC 試験骨サブスタディの結果は、アリミデックスを投与された患者は、ベースラインと比較して腰椎と総股関節骨密度 (BMD) の両方が平均的に減少したことを示しました。タモキシフェンを投与された患者は、ベースラインと比較して、腰椎と総股関節骨密度の両方が平均的に増加しました。アリミデックスで治療された患者では、骨密度のモニタリングを考慮してください [ 有害反応 ]。
コレステロール
ATAC 試験中、アリミデックス 1 mg を投与された患者は、タモキシフェンを投与された患者と比較して、より多くの血清コレステロールが上昇したことが報告されました (それぞれ 9% 対 3.5%) [参照 有害反応 ]。
患者相談情報
見る FDA 承認の患者表示 (PATIENT INFORMATION)。
妊娠
アリミデックス 1mg が胎児に害を及ぼす可能性があることを患者に説明する必要があります。また、ARIMIDEX 1mg は閉経前の女性には使用できないことも伝えておく必要があります。したがって、妊娠した場合は、アリミデックスの使用を中止し、すぐに医師に連絡する必要があります。
アレルギー(過敏症)反応
患者は、顔、唇、舌および/または喉の腫れ(血管性浮腫)を伴う深刻なアレルギー反応の可能性について知らされ、飲み込みおよび/または呼吸が困難になる可能性があり、直ちに医師の診察を受ける必要があります.
虚血性心血管イベント
既存の虚血性心疾患を有する患者は、タモキシフェンの使用と比較して、アリミデックス 1 mg の使用で心血管イベントの発生率の増加が観察されていることを通知する必要があります。胸痛や息切れが新たに発生したり悪化した場合は、直ちに医師の診察を受けてください。
骨の効果
アリミデックスがエストロゲンのレベルを低下させることを患者に知らせる必要があります。これにより、骨のミネラル含有量が失われ、骨の強度が低下する可能性があります。骨のミネラル含有量が減少すると、骨折のリスクが高まる可能性があります。
コレステロール
アリミデックスの投与中にコレステロール値の上昇が見られる可能性があることを患者に知らせる必要があります。
くすぐり、うずき、またはしびれ
くすぐり、うずき、またはしびれを経験した場合は、医療提供者に通知する必要があることを患者に通知する必要があります。
タモキシフェン
アリミデックスをタモキシフェンと一緒に服用しないように患者に助言する必要があります。
飲み忘れ
飲み忘れた場合は、気がついたらすぐに服用するよう患者に伝えてください。次の服用時間が近い場合は、飲み忘れた分を飛ばして、次の定期服用分を服用してください。患者は同時に 2 回服用しないでください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
1.0 ~ 25 mg/kg/日 (mg/m² ベースでヒトの 1 日最大推奨用量の約 10 ~ 243 倍) の用量を最大 2 年間強制経口投与したラットの従来の発がん研究では、高用量群では、肝細胞腺腫および肝細胞癌、ならびに雌での子宮間質ポリープおよび雄での甲状腺腺腫の発生率。雌の卵巣および子宮過形成の発生率に用量依存的な増加が観察された。 25 mg/kg/日で、ラットの血漿 AUC0-24 hr レベルは、推奨用量で閉経後のボランティアで示されたレベルよりも 110 から 125 倍高かった。別の発がん性試験では、5 ~ 50 mg/kg/日 (mg/m² ベースで人間の 1 日最大推奨用量の約 24 ~ 243 倍) を最大 2 年間経口投与したマウスで、良性の発生率が増加しました。すべての用量レベルで卵巣間質、上皮および顆粒膜細胞腫瘍。卵巣過形成の発生率の用量依存的な増加も雌マウスで観察された。これらの卵巣の変化は、げっ歯類特有のアロマターゼ阻害効果であると考えられており、ヒトにとって重要性は疑わしいものです。高用量群の雌雄でリンパ肉腫の発生率が増加した。 50 mg/kg/日で、マウスの血漿 AUC レベルは、推奨用量で閉経後のボランティアで示されたレベルよりも 35 ~ 40 倍高かった。
アリミデックス 1mg は、in vitro 試験 (Ames および E. coli 細菌試験、CHO-K1 遺伝子突然変異試験) で変異原性を示すことも、in vitro (ヒトリンパ球の染色体異常) または in vivo (ラットの小核試験) で染色体異常誘発性を示すことも示されていません。 .
雌ラットへのアナストロゾールの経口投与 (交配の 2 週間前から妊娠 7 日まで) は、1 mg/kg/日 (mg/m² ベースでヒトの推奨用量の約 10 倍) で不妊症の有意な発生率と実行可能な妊娠数の減少をもたらしました推奨用量で閉経後のボランティアに見られる AUC0-24 時間よりも 9 倍高い)。卵子または胎児の着床前喪失は、0.02 mg/kg/日以上の用量で増加しました (mg/m² ベースで推奨されるヒト用量の約 5 分の 1)。受胎能の回復は、3 週間の投薬に続く 5 週間の非投薬期間後に観察されました。メスのラットで観察されたこれらの影響が、ヒトの生殖能力の障害を示しているかどうかは不明です。
アナストロゾールを 1 mg/kg/日以上の用量で 6 か月間投与したラットでの複数回投与試験 (血漿アナストロゾール Cssmax および AUC 0-24 hr は、閉経後に見られるそれぞれの値よりも 19 倍および 9 倍高かった)推奨用量のボランティア)は、卵巣の肥大と卵胞嚢胞の存在をもたらしました。さらに、1 mg/kg/日以上の用量を投与されたメスのイヌにおける 6 か月間の研究で、過形成子宮が観察されました (血漿アナストロゾール Cssmax および AUC0-24 hr は、それぞれの 22 倍および 16 倍高かった)。推奨用量で閉経後の女性に見られる値)。動物の生殖器官へのこれらの影響が、閉経前の女性の生殖能力の障害と関連しているかどうかはわかっていません。
特定の集団での使用
妊娠
妊娠カテゴリーX [見る 禁忌 ]
アリミデックスは、妊娠中の女性に投与すると胎児に害を及ぼす可能性があり、乳癌の閉経前の女性には臨床的利益をもたらしません。アリミデックスは、妊娠中または妊娠の可能性がある女性には禁忌です。動物実験では、アナストロゾールは妊娠の失敗、流産の増加、および胎児発育の遅延の兆候を引き起こしました。妊娠中の女性におけるアリミデックス 1mg の使用に関する研究はありません。アリミデックス 1mg を妊娠中に使用する場合、または患者がこの薬剤の投与中に妊娠した場合、患者は胎児への潜在的な危険性と流産の潜在的なリスクについて知らされるべきです。
動物の繁殖研究では、妊娠中のラットとウサギは器官形成中にアナストロゾールを mg/m² ベースでヒトの推奨用量の 1 (ラット) および 1/3 (ウサギ) 以上の用量で投与されました。両方の種で、アナストロゾールは胎盤を通過し、妊娠喪失が増加しました (着床前および/または着床後の喪失の増加、吸収の増加、生存胎児数の減少)。ラットでは、これらの影響は用量に関連しており、胎盤重量が有意に増加しました。胎児発育の遅延(すなわち、不完全な骨化および胎児体重の低下)を含む胎児毒性は、アナストロゾール用量でラットに発生し、治療用量でのヒトの血清レベルよりも19倍高いピーク血漿レベルを生成しました(AUC 0-24hr 9倍高い) .うさぎでは、アナストロゾールは、mg/m² ベースでヒトの推奨用量の 16 倍以上の用量で不妊症を引き起こしました [ 動物毒物学および/または薬理学 ]。
授乳中の母親
アナストロゾールが母乳中に排泄されるかどうかは不明です。多くの薬物が母乳中に排泄されること、および動物実験でアナストロゾールに示された腫瘍原性、または授乳中の乳児における深刻な副作用の可能性のために、授乳を中止するか、または薬を中止するかを決定する必要があります。母親にとっての薬の重要性。
小児用
小児患者を対象とした臨床試験には、女性化乳房を有する思春期の思春期の男子を対象としたプラセボ対照試験と、マッキューン・オルブライト症候群および進行性思春期早発症を有する女子を対象とした単群試験が含まれていました。思春期男子の思春期女性化乳房の治療およびマッキューン・オルブライト症候群の女子の思春期早発症の治療におけるアリミデックス 1mg の有効性は実証されていません。
女性化乳房研究
無作為化、二重盲検、プラセボ対照、多施設研究では、11 歳から 18 歳の思春期女性化乳房の 80 人の少年が登録されました。患者は、アリミデックス 1 mg またはプラセボのいずれかの毎日のレジメンに無作為に割り付けられました。 6 か月の治療後、女性化乳房が 50% 以上減少した患者の割合に統計的に有意な差はありませんでした (一次有効性分析)。二次有効性分析(乳房容積の絶対変化、計算された女性化乳房の容積が減少した患者の割合、乳房の痛みの解消)は、一次有効性分析と一致していました。治療6か月目の血清エストラジオール濃度は、アリミデックス群で15.4%、プラセボ群で4.5%減少しました。
治験責任医師が治療に関連すると評価した有害反応は、アリミデックス治療患者の 16.3% とプラセボ治療患者の 8.1% で発生し、最も頻度が高かったのはニキビ (7% アリミデックスと 2.7% プラセボ) と頭痛 (7%) でした。 % アリミデックス 1mg および 0% プラセボ);他のすべての有害反応は、治療グループ間でわずかな違いを示しました。アリミデックス 1mg で治療された 1 人の患者は、精巣肥大のために試験を中止しました。 6 か月の治療後の睾丸容積のベースラインを差し引いた平均変化は、アリミデックス治療を受けた患者で +6.6 ± 7.9 cm³、プラセボ群で +5.2 ± 8.0 cm³ でした。
マッキューン・オルブライト症候群研究
マッキューン・オルブライト症候群および進行性思春期早発症の 2 歳から 10 歳未満の 28 人の女児を対象に、多施設、単群、非盲検試験が実施されました。すべての患者は、1 日 1 mg のアリミデックスを投与されました。試用期間は 12 か月でした。患者は、典型的(27/28)または非典型的(1/27)マッキューン・オルブライト症候群、思春期早発症、膣出血の病歴、および/または高度な骨年齢の診断に基づいて登録されました。患者のベースライン特性には次のものが含まれていました:平均実年齢 5.9 ± 2.0 歳、平均骨年齢 8.6 ± 2.6 歳、平均成長率 7.9 ± 2.9 cm/年、乳房の平均タナー段階 2.7 ± 0.81 .治療前のデータと比較して、治療中の膣出血の頻度、または骨年齢の増加率(暦年齢の変化に対する骨年齢の変化の比率として定義される)の統計的に有意な減少はありませんでした。 .タナー病期分類、平均卵巣容積、平均子宮容積、平均予測成人身長に臨床的に有意な変化はありませんでした。 7.9 ± 2.9 cm/年から 6.5 ± 2.8 cm/年への小さいながらも統計的に有意な成長率の減少が観察されましたが、対照群が存在しないため、この効果が治療または内因性エストロゲンの変動などの他の交絡因子に起因するとは考えられません。 McCune-Albright 症候群の患者に一般的に見られるレベル。
人の患者 (18%) が、アリミデックスに関連すると考えられる副作用を経験しました。これらは、吐き気、にきび、四肢の痛み、アラニントランスアミナーゼとアスパラギン酸トランスアミナーゼの増加、およびアレルギー性皮膚炎でした.
小児患者における薬物動態
小児患者に 1 mg を 1 日 1 回複数回投与した後、最大アナストロゾール濃度に達するまでの平均時間は 1 時間でした。小児患者におけるアナストロゾールの平均 (範囲) 体内動態パラメーターは、CL/F 1.54 L/h (0.77-4.53 L/h) および V/F 98.4 L (50.7-330.0 L) で表されました。最終排出半減期は 46.8 時間で、これは乳癌のアナストロゾールで治療された閉経後の女性で観察されたものと同様でした。集団薬物動態分析に基づくと、アナストロゾールの薬物動態は、思春期女性化乳房の男児とマッキューン・オルブライト症候群の女児で同様でした。
高齢者の使用
研究 0030 および 0027 では、患者の約 50% が 65 歳以上でした。 65 歳以上の患者は、無作為化治療に関係なく、65 歳未満の患者よりも腫瘍反応と腫瘍進行までの時間が中程度に良好でした。研究 0004 および 0005 では、患者の 50% が 65 歳以上でした。奏効率と進行までの時間は、65 歳以上の患者と同様でした。
ATAC 研究では、患者の 45% が 65 歳以上でした。 65 歳以上の患者におけるタモキシフェンと比較したアリミデックス 1mg の有効性 (アリミデックスの場合は N=1413、タモキシフェンの場合は N=1410、無病生存率のハザード比は 0.93 [95% CI: 0.80、1.08]) でした。 65 歳未満の患者で観察された有効性よりも低かった (アリミデックスで N=1712、タモキシフェンで N=1706、無病生存率のハザード比は 0.79 [95% CI: 0.67, 0.94])。
アナストロゾールの薬物動態は、年齢の影響を受けません。
腎障害
約 10% のアナストロゾールのみが未変化のまま尿中に排泄されるため、腎機能障害は全身クリアランスに影響しません。腎障害のある患者の用量調整は必要ありません[を参照してください 投薬と管理 と 臨床薬理学 ]。
肝障害
肝硬変の被験者の血漿アナストロゾール濃度は、すべての臨床試験で正常な被験者に見られる濃度の範囲内でした。したがって、安定性肝硬変の患者でも用量調節は必要ありません。アリミデックスは、重度の肝障害のある患者では研究されていません[参照 投薬と管理 と 臨床薬理学 ]。
過剰摂取
アリミデックスを用いた臨床試験が実施されており、健康な男性ボランティアには 1 回の投与で最大 60 mg、進行性乳癌の閉経後の女性には毎日最大 10 mg が投与されています。これらの投与量は許容されました。生命を脅かす症状をもたらすアリミデックス 1mg の単回投与量は確立されていません。過剰摂取に対する特定の解毒剤はなく、治療は対症療法でなければなりません。過剰摂取の管理では、複数の薬剤が服用された可能性があることを考慮してください.患者が覚醒している場合、嘔吐が誘発されることがあります。アリミデックスはタンパク質結合性が高くないため、透析が役立つ場合があります。バイタルサインの頻繁なモニタリングと患者の綿密な観察を含む一般的な支持療法が必要です。
禁忌
妊娠中および閉経前の女性
アリミデックス 1mg は、妊娠中の女性に投与すると胎児に害を及ぼす可能性があり、乳癌の閉経前の女性には臨床的利益をもたらしません。アリミデックス 1mg は、妊娠中または妊娠の可能性がある女性には禁忌です。アリミデックスを使用した妊娠中の女性を対象とした適切で十分に管理された研究はありません。アリミデックス 1mg を妊娠中に使用する場合、または患者がこの薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性または流産の潜在的な危険性について知らされるべきである [参照 特定の集団での使用 ]。
過敏症
アリミデックス 1mg は、薬剤または賦形剤に対して過敏症反応を示した患者には禁忌です。観察された反応には、アナフィラキシー、血管性浮腫、蕁麻疹などがあります。 有害反応 ]
臨床薬理学
作用機序
多くの乳癌の増殖は、エストロゲンによって刺激または維持されます。
閉経後の女性では、エストロゲンは主に、副腎アンドロゲン(主にアンドロステンジオンとテストステロン)をエストロンとエストラジオールに変換するアロマターゼ酵素の作用に由来します。したがって、アロマターゼ酵素を特異的に阻害することによって、末梢組織および癌組織自体におけるエストロゲン生合成の抑制を達成することができる。
アナストロゾールは選択的非ステロイド性アロマターゼ阻害剤です。血清エストラジオール濃度を大幅に低下させ、副腎コルチコステロイドまたはアルドステロンの形成に検出可能な影響はありません.
薬力学
エストラジオールへの影響
エストラジオールの平均血清濃度は、進行乳癌の閉経後の女性を対象に、0.5、1、3、5、および 10 mg のアリミデックスを毎日複数回投与する試験で評価されました。すべての投与量で血清エストラジオールの臨床的に有意な抑制が見られました。 1 mg 以上の用量では、エストラジオールの平均血清濃度が検出下限 (3.7 pmol/L) まで抑制されました。推奨される 1 日用量のアリミデックス 1 mg は、エストラジオールを 24 時間以内に約 70% 減少させ、14 日間の毎日の投薬後に約 80% 減少させました。血清エストラジオールの抑制は、アリミデックス 1 mg の毎日の投与を中止した後、最大 6 日間維持されました。
早期または進行乳がんの閉経前女性におけるアリミデックス 1mg の効果は研究されていません。副腎アンドロゲンの芳香族化は、閉経前の女性のエストラジオールの重要な供給源ではないため、アリミデックスは閉経前の女性のエストラジオールレベルを低下させるとは予想されません.
コルチコステロイドへの影響
3、5、および 10 mg の複数の毎日の投与試験では、アナストロゾールの選択性は、コルチコステロイド合成への影響を調べることによって評価されました。すべての用量で、アナストロゾールは、ベースライン時または ACTH に反応したコルチゾールまたはアルドステロンの分泌に影響を与えませんでした。アナストロゾールでは、グルココルチコイドまたはミネラルコルチコイド補充療法は必要ありません。
その他の内分泌への影響
mg と 10 mg を毎日複数回投与する試験で、甲状腺刺激ホルモン (TSH) が測定されました。アリミデックスの投与中にTSHの増加はありませんでした。アリミデックスは、動物において直接的なプロゲストゲン、アンドロゲン、またはエストロゲン活性を持っていませんが、プロゲステロン、アンドロゲン、およびエストロゲンの循環レベルを混乱させます.
薬物動態
吸収
アロマターゼ活性の阻害は、主に親薬であるアナストロゾールによるものです。アナストロゾールの吸収は急速であり、最大の血漿濃度は通常、絶食条件下で投与後 2 時間以内に発生します。放射性標識された薬物を用いた研究は、経口投与されたアナストロゾールが体循環によく吸収されることを実証しました.食物はアナストロゾールの吸収率を低下させますが、全体的な程度は低下させません。アナストロゾールの平均 C max は 16% 減少し、アナストロゾールが食後 30 分に投与された場合、T max の中央値は 2 時間から 5 時間遅れました。アナストロゾールの薬物動態は、1 ~ 20 mg の用量範囲で直線的であり、反復投与によって変化しません。アナストロゾールの薬物動態は、患者と健康なボランティアで同様でした。
分布
定常状態の血漿レベルは、アリミデックスの単回投与後に観察されるレベルよりも約 3 ~ 4 倍高くなります。血漿濃度は、1 日 1 回の投与の約 7 日間で定常状態レベルに近づきます。アナストロゾールは、治療範囲の血漿タンパク質に 40% 結合しています。
代謝
アナストロゾールの代謝は、N-脱アルキル化、ヒドロキシル化、およびグルクロン酸抱合によって起こります。アナストロゾールの 3 つの代謝産物 (トリアゾール、ヒドロキシ アナストロゾールのグルクロニド抱合体、およびアナストロゾール自体のグルクロニド抱合体) が、ヒトの血漿および尿で確認されています。アナストロゾールの主要な循環代謝物であるトリアゾールには、薬理活性がありません。
アナストロゾールは、シトクロム P450 1A2、2C8/9、および 3A4 によって触媒される反応をインビトロで阻害し、Ki 値は、1 mg の毎日の投与後に観察される平均定常状態 Cmax 値よりも約 30 倍高かった。アナストロゾールは、in vitro でシトクロム P450 2A6 または 2D6 によって触媒される反応に対して阻害効果がありませんでした。健康な被験者への単回 30 mg/kg または複数回の 10 mg/kg 用量のアナストロゾールの投与は、アンチピリンのクリアランスまたはアンチピリン代謝物の尿中回復に影響を与えませんでした。
排泄
放射性標識されたアナストロゾールの 85% が糞便と尿から回収されました。肝代謝は、アナストロゾール排泄の約 85% を占めます。腎排泄は総クリアランスの約 10% を占めます。アナストロゾールの平均消失半減期は 50 時間です。
性別と年齢の影響
アナストロゾールの薬物動態は、閉経後の女性ボランティアと乳癌患者で調査されています。年齢に関連した影響は、50 歳未満から 80 歳を超える範囲では見られませんでした。
人種の影響
エストラジオールとエストロン硫酸塩の血清レベルは、1 mg のアナストロゾールを毎日 16 日間投与された日本人と白人の閉経後女性の間で類似していました。白人および日本人の閉経後女性におけるアナストロゾールの平均定常状態最小血漿濃度は、それぞれ 25.7 および 30.4 ng/mL でした。
腎障害の影響
アナストロゾールの薬物動態は、腎障害のある被験者で調査されています。アナストロゾールの腎クリアランスは、クレアチニン クリアランスに比例して減少し、重度の腎機能障害 (クレアチニン クリアランス 投薬と管理 と 特定の集団での使用 ]。
肝障害の影響
アナストロゾールの薬物動態は、アルコール乱用に関連する肝硬変の被験者で調査されています。アナストロゾールの見かけの経口クリアランス (CL/F) は、肝機能が正常な対照被験者よりも、安定した肝硬変の被験者で約 30% 低かった。しかし、これらの血漿中濃度は、正常な被験者で観察される値の範囲にとどまりました。重度の肝障害の影響は研究されていません。安定した肝硬変には用量調整は必要ありません。 投薬と管理 と 特定の集団での使用 ]。
動物毒物学および/または薬理学
生殖毒性学
アナストロゾールは、ラットおよびウサギに 0.1 mg/kg を経口投与した後、胎盤を通過することがわかっています (mg/m² ベースで、それぞれ、ヒトの推奨用量の約 1 倍および 1.9 倍)。ラットとウサギの両方で、それぞれ 0.1 および 0.02 mg/kg/日以上の用量 (mg/m² ベースでそれぞれ約 1 および 1/3、ヒトの推奨用量) を次の期間に投与した研究。器官形成は、アナストロゾールが妊娠喪失を増加させることを示した(着床前および/または着床後の喪失の増加、吸収の増加、および生きている胎児の数の減少)。影響は、ラットでは用量に関連していた。 0.1 mg/kg/日以上の用量でラットの胎盤重量が有意に増加した。
胎児発育の遅延(すなわち、不完全な骨化および胎児体重の低下)を含む胎児毒性の証拠が、1mg/kg/日の用量を投与されたラットで観察された(血漿アナストロゾールCssmaxおよびAUC 0-24hrは19倍であり、推奨用量で閉経後のボランティアに見られるそれぞれの値よりも 9 倍高い)。 1.0 mg/kg/日までの用量を投与されたラットに催奇形性の証拠はありませんでした。ウサギでは、アナストロゾールは 1.0 mg/kg/日以上の用量で不妊症を引き起こしました (mg/m² ベースでヒトの推奨用量の約 16 倍)。ウサギに 0.2 mg/kg/日 (mg/m² ベースでヒトの推奨用量の約 3 倍) を投与した場合、催奇形性の証拠はありませんでした。
臨床研究
閉経後の女性における乳がんの補助療法
多施設二重盲検試験 (ATAC) では、手術可能な乳癌の閉経後女性 9,366 人を、アリミデックス 1 日 1 mg、タモキシフェン 1 日 20 mg、または 2 つの治療の組み合わせによる補助療法に 5 年間または疾患が再発するまで無作為に割り付けました。
この試験の主要評価項目は、無病生存率(すなわち、遠隔再発または局所再発、対側乳がんまたはあらゆる原因による死亡までの時間)でした。この試験の副次的評価項目には、遠隔無病生存率、対側乳癌の発生率、および全生存率が含まれていました。追跡期間の中央値 33 か月で、アリミデックスとタモキシフェンの併用は、すべての患者およびホルモン受容体陽性の部分母集団において、タモキシフェンと比較して有効性の利点を示しませんでした。この治療群は試験から中止されました。 ATAC 試験の臨床的および薬物動態学的結果に基づいて、タモキシフェンはアナストロゾールと一緒に投与すべきではありません。 薬物相互作用 ]。
人口統計学的およびその他のベースライン特性は、3 つの治療群間で類似していました (表 7 を参照)。
ATAC 試験の 2 つの単剤療法群の患者は、中央値で 60 か月 (5 年) 治療を受け、中央値で 68 か月追跡されました。治療目的集団における無病生存率は、タモキシフェン群と比較してアリミデックス群で統計的に有意に改善されました [ハザード比 (HR) = 0.87、95% CI: 0.78、0.97、p=0.0127]。試験患者の約 84% を占めるホルモン受容体陽性の部分集団では、アリミデックス 1 mg 投与群では無病生存率も統計的に有意に改善されました (HR = 0.83、95% CI: 0.73、0.94、p=0.0049)。タモキシフェンアーム。
図 1: ATAC 試験でアリミデックス 1 mg またはタモキシフェン単剤療法に無作為化されたすべての患者の無病生存カプラン マイヤー生存曲線 (Intent-to-Treat) 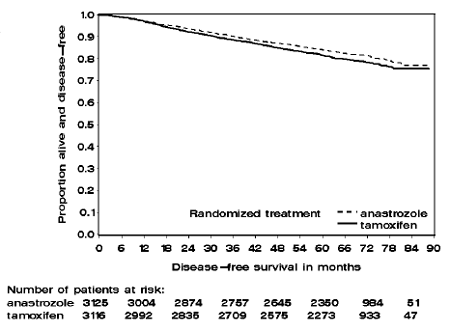
図 2: ATAC 試験でアリミデックスまたはタモキシフェン単剤療法に無作為に割り付けられた患者のホルモン受容体陽性部分集団の無病生存率 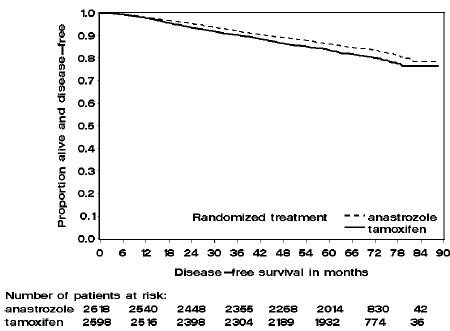
68 か月の追跡調査による生存データを表 9 に示します。
以前に補助化学療法を受けた患者群 (アリミデックス 1 mg の場合は N=698、タモキシフェンの場合は N=647) では、無病生存のハザード比はアリミデックス群で 0.91 (95% CI: 0.73 ~ 1.13) でした。タモキシフェンアーム。
治療意図集団およびホルモン受容体陽性亜集団における個々の事象の頻度を表8に記載する。
試験の有効性結果の要約を表 9 に示します。
10 年間の中央値追跡調査 ATAC 試験の有効性結果
その後の ATAC 試験の分析では、2 つの単剤療法群の患者を中央値で 120 か月 (10 年) 追跡しました。患者は、中央値で 60 か月 (5 年) にわたって研究治療を受けました (表 10 を参照)。
図 3:ATAC 試験でアリミデックスまたはタモキシフェン単剤療法にランダム化されたすべての患者の無病生存カプラン マイヤー生存曲線 (Intent-to-Treat)a 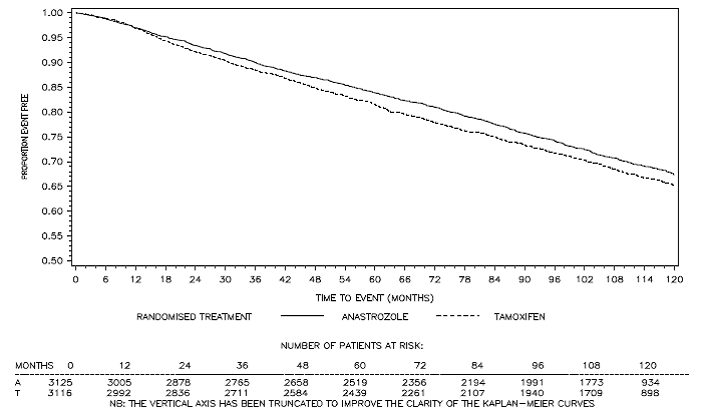
a 120 か月の追跡調査を受けた患者の割合は 29.4% でした。
図 4:ATAC 試験でアリミデックス 1 mg またはタモキシフェン単剤療法にランダム化された患者のホルモン受容体陽性部分集団の無病生存 b 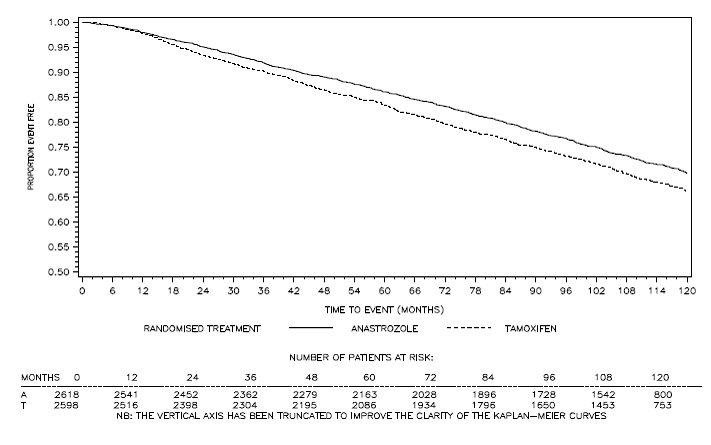
b 120 か月の追跡調査を受けた患者の割合は 29.8% でした。
進行性乳がんの閉経後女性における一次治療
ホルモン受容体陽性またはホルモン受容体に対する一次治療として、タモキシフェンと比較したアリミデックス 1mg の有効性を評価するために、同様のデザインの 2 つの二重盲検対照臨床試験 (0030 は北米の研究、0027 は主にヨーロッパの研究) が実施されました。閉経後の女性における未知の局所進行性または転移性乳がん。 30 歳から 92 歳までの合計 1021 人の患者が無作為に割り付けられ、試験治療を受けました。患者は、アリミデックス 1 mg 1 mg を 1 日 1 回投与する群またはタモキシフェン 20 mg を 1 日 1 回投与する群に無作為に割り付けられました。両試験の主要評価項目は、腫瘍進行までの時間、客観的な腫瘍奏効率、および安全性でした。
測定可能な疾患を有する患者と測定不可能な疾患を有する患者、以前にアジュバント療法を受けた患者、転移性疾患の部位および民族的起源を含む人口統計およびその他のベースライン特性は、両方の試験の2つの治療群で類似していました。次の表は、試験 0030 および 0027 の無作為化されたすべての患者の登録時のホルモン受容体の状態をまとめたものです。
主要評価項目について、試験 0030 は、アリミデックスがタモキシフェンよりも統計的に有意な優位性を持っていることを示しました (p=0.006)。アリミデックス 1mg とタモキシフェンの客観的腫瘍奏効率は同程度でした。試験 0027 では、アリミデックス 1mg とタモキシフェンの客観的腫瘍奏効率と腫瘍進行までの時間が同様であることが示されました (表 12、図 5 および 6 を参照)。
以下の表 12 は、主要な有効性エンドポイントに関する試験 0030 および試験 0027 の結果をまとめたものです。
図 5 : 試験 0030 における無作為化されたすべての患者 (治療意図) の疾患進行までの時間のカプラン・マイヤー確率 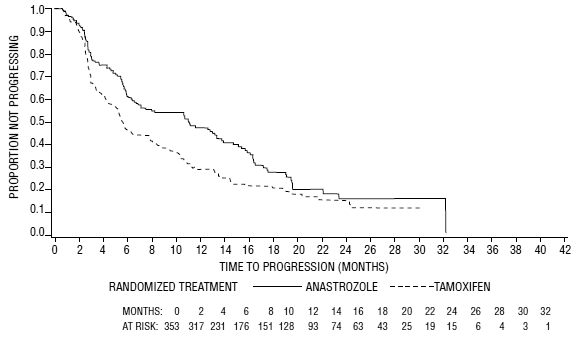
図 6 : 試験 0027 における無作為化されたすべての患者 (治療意図) の無増悪期間の Kaplan-Meier 確率 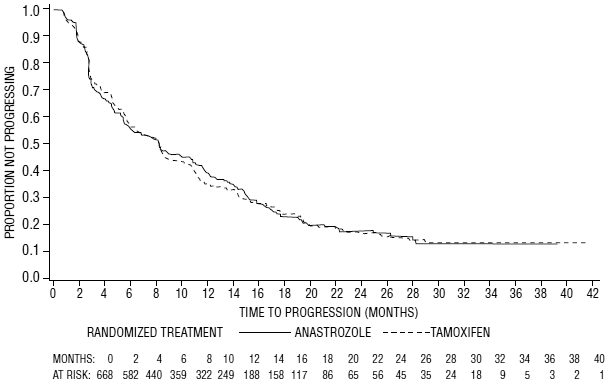
副次評価項目の結果は、有効性の主要評価項目の結果を支持するものでした。両方の試験の治療群全体で発生した死亡は少なすぎて、全生存期間の差について結論を出すことができませんでした。
タモキシフェン療法後に疾患が進行した閉経後の進行性乳がん女性におけるセカンドライン療法
アナストロゾールは、進行乳がんまたは早期乳がんのタモキシフェン療法後に疾患が進行した閉経後の進行乳がんの女性を対象とした 2 つの対照臨床試験 (0004 は北米の研究、0005 は主にヨーロッパの研究) で研究されました。一部の患者は、以前に細胞毒性治療を受けていました。ほとんどの患者はER陽性でした。より少ない割合はER不明またはER陰性でした。 ER 陰性の患者は、タモキシフェンに対して陽性反応を示した場合にのみ適格でした。測定可能な疾患および測定不可能な疾患を有する適格な患者は、アリミデックス 1 mg または 10 mg を 1 日 1 回投与するか、酢酸メゲストロール 40 mg を 1 日 4 回投与するよう無作為に割り付けられました。研究は、アリミデックスに関して二重盲検で行われました。進行までの時間と客観的奏効(測定可能な疾患を有する患者のみが部分奏功者と見なすことができた)率が、主要な有効性変数でした。客観的奏効率は、Union Internationale Contre le Cancer (UICC) 基準に基づいて計算されました。長期 (24 週間以上) の安定した疾患の割合、進行率、および生存率も計算されました。
どちらの試験にも 375 人以上の患者が含まれていました。人口統計およびその他のベースライン特性は、各試験の 3 つの治療群で類似していました。 0005 試験の患者は、以前のタモキシフェン治療によりよく反応していました。進行性疾患に対して以前にタモキシフェン療法を受けた患者(試験 0004 で 58%、試験 0005 で 57%)のうち、これらの患者の 18% が試験 0004 で、42% が試験 0005 で、主治医から反応があったと報告されました。試験 0004 では、患者の 81% が ER 陽性、13% が ER 不明、6% が ER 陰性でした。試験 0005 では、患者の 58% が ER 陽性、37% が ER 不明、5% が ER 陰性でした。試験 0004 では、患者の 62% が測定可能な疾患を有していたのに対し、試験 0005 では 79% でした。転移性疾患の部位は、各試験の治療群間で類似していました。平均して、患者の 40% に軟部組織転移がありました。 60% に骨転移がありました。 40%が内臓(15%が肝臓)に転移していた。
表13に示されるように、2つの研究からの有効性結果は類似していた。両方の研究において、以下の表に列挙された有効性パラメータのいずれに関しても治療群間に有意差はなかった。
2 つの対照試験のデータをプールすると、アリミデックス 1 mg と酢酸メゲストロールに無作為に割り付けられた患者の客観的奏効率と進行および死亡までの期間の中央値は類似していました。このデータでは、アリミデックス 10 mg がアリミデックス 1 mg よりも優れているという兆候はありません。
患者情報
アリミデックス® 経口投与用A-rim-eh-dex(アナストロゾール)錠
アリミデックスについて知っておくべき最も重要な情報は何ですか?
アリミデックスは、次のような重大な副作用を引き起こす可能性があります。
- 心臓病。 心臓動脈の閉塞(虚血性心疾患)の病歴があり、アリミデックス1mgを服用している早期乳がんの女性は、タモキシフェンを服用している同様の女性と比較して、心臓への血流減少の症状が増加する可能性があります.
アリミデックスの治療中に胸痛や息切れが新たに発生したり悪化したりした場合は、すぐに医療機関を受診してください。
アリミデックスとは?
アリミデックス 1mg は、閉経(「人生の変化」)後の女性に使用される処方薬です。
- 早期乳がんの治療
- 手術後
- 乳がんがホルモン受容体陽性の女性
- 乳がんがホルモン受容体陽性であるか、またはホルモン受容体が不明である女性における、近くの組織またはリンパ節に拡がった(局所的に進行した)または体の他の部分に拡がった(転移性)乳がんの最初の治療
- タモキシフェン療法後に癌が増殖した場合、または疾患が広がった場合の進行乳癌の治療
アリミデックス 1mg は、閉経していない乳がんの女性(閉経前の女性)には効果がありません。
アリミデックスを服用してはいけない人は?
次の場合は、アリミデックス 1mg を服用しないでください。
- 妊娠している、または妊娠する可能性がある。アリミデックスは胎児に害を及ぼす可能性があります。アリミデックスの服用中に妊娠した場合は、すぐに医師に相談してください。
- 閉経していない(閉経前)
- アナストロゾールまたはアリミデックスのいずれかの成分に対して重度のアレルギー反応を起こしたことがある.アリミデックスの全成分リストについては、このリーフレットの最後をご覧ください。アリミデックスに対する重度のアレルギー反応の症状には、顔、唇、舌、または喉の腫れ、呼吸または嚥下障害、蕁麻疹およびかゆみが含まれます。
アリミデックス 1mg を服用する前に医師に何を伝えるべきですか?
アリミデックスを服用する前に、次の場合は医師に相談してください。
- 閉経していません。よくわからない場合は、医師に相談してください。
- 心臓に問題がある、またはあった
- 骨が薄くなったり弱くなったりしている(骨粗鬆症)と言われたことがある
- コレステロールが高い
- 他の病状がある
- 妊娠している、または妊娠する予定がある。アリミデックスは胎児に害を及ぼす可能性があります。 「アリミデックスを服用してはいけない人は?」を参照してください。
- 授乳中または授乳を計画している。アリミデックスが母乳に移行するかどうかは不明です。アリミデックス 1mg を服用するか、母乳で育てるかは、あなたと主治医が決定する必要があります。両方を行うべきではありません。
服用しているすべての薬について医師に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。特に次の場合は医師に相談してください。
- タモキシフェン。 服用してはいけません アリミデックス タモキシフェンを服用している場合。アリミデックス 1mg をタモキシフェンと一緒に服用すると、血液中のアリミデックス 1mg の量が減少し、アリミデックス 1mg がうまく機能しなくなる可能性があります。
- エストロゲンを含む薬。 アリミデックス 1mg は、次の薬と一緒に服用すると効果がない場合があります。
- ホルモン補充療法
- 避妊薬
- エストロゲンクリーム
- 膣リング
- 膣座薬
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医師や薬剤師に見せてください。
アリミデックスの服用方法は?
- アリミデックスは、医師の指示どおりに服用してください。
- 医師から中止の指示があるまで、アリミデックスの服用を続けてください。
- アリミデックス 1mg は食事の有無にかかわらず服用できます。
- 飲み忘れた場合は、気がついたらすぐに服用してください。次の服用時間が近い場合は、飲み忘れた分は飛ばしてください。次回の定期服用量を服用してください。同時に2回服用しないでください。
アリミデックス 1mg を服用しすぎた場合は、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
アリミデックスの副作用は?
アリミデックスは、次のような重大な副作用を引き起こす可能性があります。
- 見る 「アリミデックスについて知っておくべき最も重要な情報は何ですか?」
- 骨が薄くなったり弱くなったりする(骨粗鬆症)。 アリミデックス 1mg は体内のエストロゲンを低下させ、骨が薄く弱くなる可能性があります。これにより、特に背骨、股関節、手首の骨折のリスクが高まる可能性があります。医師は骨密度検査を注文することがあります
- アリミデックスによる治療を開始する前と治療中に、骨の変化をチェックします。
- 血中コレステロール(血中脂肪)の増加。 アリミデックスを服用している間、医師はコレステロールをチェックするために血液検査を行うことがあります。
- 皮膚反応。 アリミデックス 1mg の服用を中止し、皮膚病変、潰瘍、または水ぶくれが発生した場合は、すぐに医師に連絡してください。
- 重度のアレルギー反応。 次のような場合は、すぐに医師の診察を受けてください。
- 顔、唇、舌、喉の腫れ
- 飲み込みや呼吸の困難
- 肝臓の問題。 アリミデックス 1mg は、肝臓の炎症や肝機能の血液検査の変化を引き起こす可能性があります。あなたの医者はこれについてあなたをチェックするかもしれません。 アリミデックス1mgの服用を中止し、すぐに医師に連絡してください 肝臓の問題のこれらの徴候または症状のいずれかがある場合:
- 気分が良くないという一般的な感覚
- 皮膚や白目が黄色くなる
- お腹の右側(腹部)の痛み
アリミデックス 1mg を服用している女性の一般的な副作用には、次のようなものがあります。
- ほてり
- 弱点
- 関節痛
- 関節の痛み、こわばりまたは腫れ(関節炎)
- 痛み
- 喉の痛み
- 高血圧
- うつ
- 吐き気と嘔吐
- 発疹
- 背中の痛み
- 睡眠の問題
- 骨の痛み
- 頭痛
- 足、足首、足のむくみ
- 咳の増加
- 呼吸困難
- 影響を受けた腕の組織にリンパ液が蓄積する (リンパ浮腫)
アリミデックスはまた、皮膚のくすぐり、うずき、またはしびれを引き起こす可能性があります。
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、アリミデックスの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
アリミデックス 1mg の保存方法を教えてください。
- アリミデックス 1mg を 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
アリミデックスとすべての医薬品は子供の手の届かないところに保管してください。
アリミデックスの安全で効果的な使用に関する一般情報。
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。処方されていない状態でアリミデックス 1mg を服用しないでください。他の人があなたと同じ症状を持っていても、アリミデックスを与えないでください。それらに害を及ぼす可能性があります。
さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた ARIMIDEX に関する情報については、薬剤師または医師にお尋ねください。詳細については、1-866-992-9276 までお電話いただくか、www.ARIMIDEX.com をご覧ください。
アリミデックスの成分は?
有効成分: アナストロゾール
不活性成分: ラクトース、ステアリン酸マグネシウム、ヒドロキシプロピルメチルセルロース、ポリエチレングリコール、ポビドン、デンプングリコール酸ナトリウム、および二酸化チタン。
