Prometrium 100mg, 200mg Progesterone 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
プロメトリウム 100mg とは何ですか?
プロメトリウム 200mg は、子宮内膜増殖症の症状および二次性無月経 (月経の欠如または月経) の症状の治療を予防するために使用される処方薬です。プロメトリウムは、単独で使用することも、他の薬と併用することもできます。
プロメトリウムは、プロゲスチンと呼ばれる種類の薬に属しています。
プロメトリウム 200mg が子供に安全で効果的かどうかはわかっていません。
プロメトリウムの副作用にはどのようなものがありますか?
プロメトリウムは、次のような重大な副作用を引き起こす可能性があります。
- 異常な膣出血、
- 排尿時の痛みや灼熱感、
- 乳房のしこり、
- 突然の視力障害、
- 激しい頭痛、
- 目の奥の痛み、
- うつ、
- 睡眠の問題、
- 弱点、
- 気分の変化、
- 重度のめまい、
- 眠気、
- 回転する感覚、
- 錯乱、
- 呼吸困難、
- 胸の痛みや圧迫感、
- 顎や肩に広がる痛み、
- 吐き気、
- 発汗、
- 上腹部の痛み、
- かゆみ、
- 疲れ、
- 食欲減少、
- 濃い色の尿、
- 粘土色の便、
- 皮膚や目の黄変(黄疸)、
- 突然のしびれや衰弱、
- 突然の激しい頭痛、
- ろれつが回らない ,
- 話すことやバランスを取ることの難しさ、
- 突然の咳、
- 喘鳴、
- 速い呼吸、
- 喀血、
- 下肢痛、
- 足のむくみ、そして
- 片足または両足の熱感または発赤
上記の症状がある場合は、すぐに医療機関を受診してください。
プロメトリウム 100mg の最も一般的な副作用は次のとおりです。
- 眠気、
- めまい、
- 胸の痛み、
- 気分の変化、
- 頭痛、
- 便秘、
- 下痢、
- 胸焼け、
- 膨満感、
- 手や足のむくみ、
- 関節痛、
- のぼせ、そして
- おりもの
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、プロメトリウムの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
エストロゲンとプロゲスチンによる心血管疾患、乳がん、認知症の可能性
心血管疾患と認知症の可能性
エストロゲンとプロゲスチンの併用療法は、心血管疾患や認知症の予防には使用しないでください。 (見る 臨床研究 と 警告 、 心血管障害および認知症の可能性。 )
Women's Health Initiative (WHI) のエストロゲンとプロゲスチンのサブスタディでは、閉経後の女性 (50 歳から 79 歳) の 5.6 年間の毎日の経口共役薬による治療中に、深部静脈血栓症、肺塞栓症、脳卒中、心筋梗塞のリスクが増加したことが報告されました。プラセボと比較して、エストロゲン (CE) [0.625 mg] と酢酸メドロキシプロゲステロン (MPA) [2.5 mg] の組み合わせ。 (見る 臨床研究 と 警告 、 心血管障害。 )
WHI 記憶研究 (WHIMS) のエストロゲンとプロゲスチンの WHI 補助研究では、4 年間の毎日の CE (0.625 mg) と MPA (2.5 mg) の組み合わせによる治療中に、65 歳以上の閉経後女性で認知症を発症するリスクが増加したことが報告されました。 )、プラセボと比較して。この所見が閉経後の若い女性に当てはまるかどうかは不明です。 (見る 臨床研究 と 警告 、おそらく認知症および 予防 、 高齢者の使用 .)
乳がん
WHI エストロゲンとプロゲスチンのサブスタディでも、浸潤性乳がんのリスクが増加することが示されました。 (見る 臨床研究 と 警告 、 悪性新生物、乳がん .)
比較可能なデータがない場合、これらのリスクは、CE と MPA の他の用量、およびエストロゲンとプロゲスチンの他の組み合わせと剤形についても同様であると想定する必要があります。
エストロゲンを含むプロゲスチンは、個々の女性の治療目標とリスクに一致する最小の有効用量と最短の期間で処方されるべきです.
説明
PROMETRIUM (プロゲステロン、USP) カプセルには、経口投与用の微粉化プロゲステロンが含まれています。プロゲステロンの分子量は 314.47 で、分子式は C21H30O2 です。プロゲステロン (pregn-4-ene-3, 20-dione) は白色またはクリーム色の無臭の結晶性粉末で、実質的に水に溶けず、アルコール、アセトン、ジオキサンに溶け、植物油にやや溶けにくく、空気中で安定し、 126°と131°C。構造式は次のとおりです。
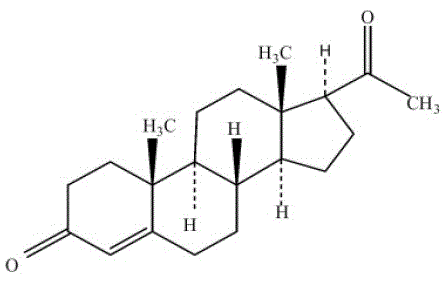
プロゲステロンは、植物源の出発物質から合成され、ヒト卵巣由来のプロゲステロンと化学的に同一です。 PROMETRIUM カプセルは、最適な管理のための投与量の柔軟性を提供するために、複数の強度で利用できます。プロメトリウム カプセルには、微粉化されたプロゲステロンが 100 mg または 200 mg 含まれています。
プロメトリアム カプセル 100 mg の不活性成分には、ピーナッツ油 NF、ゼラチン NF、グリセリン USP、レシチン NF、二酸化チタン USP、FD&C 赤色 40 号、および D&C 黄色 10 号が含まれます。 :ピーナッツ油NF、ゼラチンNF、グリセリンUSP、レシチンNF、二酸化チタンUSP、D&Cイエロー10号、FD&Cイエロー6号
適応症
PROMETRIUM 200mg カプセルは、抱合型エストロゲン錠剤を服用している、子宮摘出されていない閉経後の女性における子宮内膜過形成の予防に使用することが示されています。それらは、続発性無月経にも使用することが示されています。
投薬と管理
子宮内膜増殖症の予防
PROMETRIUM 100mg カプセルは、就寝時に 1 日 1 回、抱合型エストロゲンの錠剤を毎日服用している子宮のある閉経後の女性に、28 日サイクルごとに 200mg を 12 日間経口投与する必要があります。
続発性無月経の治療
PROMETRIUM 100mg カプセルは、就寝前に 400mg を 1 日 1 回、10 日間服用することができます。
一部の女性は、プロメトリウム カプセルを飲み込むのが困難になる場合があります。これらの女性の場合、プロメトリウム カプセルは立った状態でグラス 1 杯の水で服用してください。
供給方法
プロメトリウム (プロゲステロン、USP) カプセル 100 mg 丸い桃色のカプセルで、黒いインプリント「SV」がブランド化されています。
NDC 0032-1708-01(100本入)
プロメトリウム (プロゲステロン、USP) カプセル 200 mg 楕円形の淡い黄色のカプセルで、黒いインプリント「SV2」がブランド化されています。
NDC 0032-1711-01(100本入)
25°C (77°F) で保管してください。 15° から 30°C (59° から 86°F) [USP 制御室温を参照] まで許容される逸脱。
過度の湿気から保護してください。
USP/NF で定義されている密閉型の耐光性容器に入れ、患者挿入物を添付してください。
小児の手の届かない場所に保管。
製造元: Catalent Pharma Solutions, St. Petersburg, FL 33716. 改訂: 2013 年 9 月
副作用
見る ボックス警告 、 警告 と 予防 .
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
多施設、無作為化、二重盲検、プラセボ対照の臨床試験で、合計 875 人の閉経後の女性で、子宮内膜に対する PROMETRIUM 100mg カプセルの効果が研究されました。表 6 は、0.625 mg のコンジュゲート エストロゲンまたはプラセボと一緒に周期的な PROMETRIUM カプセル 200 mg を毎日 (1 暦月のサイクルあたり 12 日) 服用した女性の 2% 以上の有害反応を示しています。
表 6. 閉経後の女性を対象とした 3 年間にわたる 875 人の患者によるプラセボ対照試験で報告された有害反応 (≥ 2%) [報告した患者の割合 (%)]
続発性無月経への影響
多施設無作為化二重盲検プラセボ対照臨床試験では、エストロゲンでプライミングされた閉経後女性 49 人を対象に、二次性無月経に対する PROMETRIUM カプセルの効果が研究されました。表 7 は、PROMETRIUM 100mg カプセルまたはプラセボを投与された女性の 5% 以上の有害反応を示しています。
表 7. エストロゲンでプライミングされた閉経後女性のプラセボ対照試験で 400 mg/日を使用した患者で報告された有害反応 (≥ 5%)
つの連続した 28 日間の治療サイクルからなる多施設、並行群、非盲検の市販後投与研究では、続発性無月経の 220 人の閉経前女性が毎日の抱合型エストロゲン療法 (抱合型エストロゲン 0.625 mg) と PROMETRIUM 100mg カプセル、300 mg を受けるように無作為に割り付けられました。 1 日あたり (n=113) または PROMETRIUM カプセル、1 日あたり 400 mg (n=107)、各治療サイクルの 10 日間。全体として、最も頻繁に報告された治療に伴う副作用は、被験者の 5% 以上で報告され、吐き気、疲労、膣真菌症、鼻咽頭炎、上気道感染症、頭痛、めまい、乳房の圧痛、腹部膨満、ざ瘡でした。 、月経困難症、気分変動、および尿路感染症。
市販後の経験
プロメトリウム 200mg カプセルについて、以下の副作用が報告されています。これらの反応は、不確実な規模の集団から自発的に報告されるため、頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
泌尿生殖器系
子宮内膜癌、尿道下裂、子宮内死、月経過多、月経障害、子宮出血、卵巣嚢腫、自然流産。
心臓血管
循環虚脱、先天性心疾患(心室中隔欠損および動脈管開存を含む)、高血圧、低血圧、頻脈。
胃腸
急性膵炎、胆汁うっ滞、胆汁うっ滞性肝炎、嚥下障害、肝不全、肝壊死、肝炎、肝機能検査値の上昇(アラニンアミノトランスフェラーゼ上昇、アスパラギン酸アミノトランスフェラーゼ上昇、ガンマグルタミルトランスフェラーゼ上昇を含む)、黄疸、舌の腫れ。
肌
脱毛症、かゆみ、蕁麻疹。
目
かすみ目、複視、視覚障害。
中枢神経系
攻撃性、痙攣、離人、意識の低下、見当識障害、構音障害、意識喪失、感覚異常、鎮静、昏迷、失神(低血圧の有無にかかわらず)、一過性虚血発作、自殺念慮。
最初の治療中に、極度のめまいおよび/または眠気、かすみ目、ろれつが回らない、歩行困難、意識喪失、めまい、錯乱、見当識障害、酩酊感、および呼吸困難。
その他
異常歩行、アナフィラキシー反応、関節痛、血糖値上昇、窒息、口唇裂、口蓋裂、歩行困難、呼吸困難、顔面浮腫、異常感、酩酊感、過敏症、ぜんそく、筋肉のけいれん、のどのつっぱさ、耳鳴り、めまい、体重減少、重量が増加しました。
薬物相互作用
薬物検査の相互作用
以下の臨床検査結果は、エストロゲンとプロゲスチン療法の使用によって変化する可能性があります。
- スルホブロモフタレイン保持の増加およびその他の肝機能検査。
- 凝固検査:プロトロンビン因子VII、VIII、IX、およびXの増加。
- プレグナンジオール測定。
- 甲状腺機能: PBI の増加、およびブタノール抽出タンパク質結合ヨウ素と T3 の減少 値を取り込みます。
警告
見る ボックス警告 .
心血管疾患
エストロゲンとプロゲスチンの併用療法では、肺塞栓症、深部静脈血栓症(DVT)、脳卒中、心筋梗塞のリスクが高まることが報告されています。これらのいずれかが発生したり、疑われる場合は、エストロゲンとプロゲスチン療法を直ちに中止する必要があります.
動脈血管疾患(高血圧、糖尿病、喫煙、高コレステロール血症、肥満など)および/または静脈血栓塞栓症(静脈血栓塞栓症[VTE]、肥満、全身性エリテマトーデスの既往歴または家族歴など)の危険因子)を適切に管理する必要があります。
脳卒中
Women's Health Initiative (WHI) のエストロゲンとプロゲスチンのサブスタディでは、CE (0.625 mg) と MPA (2.5 mg) を毎日摂取している 50 歳から 79 歳の女性で、同年齢の女性と比較して統計的に有意な脳卒中リスクの増加が報告されました。プラセボを投与されたグループ (10,000 女性年あたり 33 対 25)。リスクの増加は、最初の 1 年後に実証され、持続しました。 (見る 臨床研究 .) 脳卒中が発生した場合、またはその疑いがある場合は、エストロゲンとプロゲスチンの併用療法を直ちに中止する必要があります。
冠状動脈性心臓病
WHI エストロゲンとプロゲスチンのサブスタディでは、冠動脈心疾患 (CHD) イベント (致命的でない心筋梗塞 [MI]、サイレント MI、または CHD による死亡と定義) のリスクが統計的に有意ではないが、毎日 CE を受けている女性で報告された (0.625 mg) + MPA (2.5 mg) をプラセボを投与された女性と比較した (10,000 女性年あたり 41 対 34)。 1 年目に相対リスクの増加が示され、2 年目から 5 年目には相対リスクが減少する傾向が報告されました。 臨床研究 .)
記録された心疾患のある閉経後の女性 (n = 2,763、平均年齢 66.7 歳) において、心血管疾患の二次予防の対照臨床試験 (心臓およびエストロゲン/プロゲスチン補充研究 [HERS]) で、毎日の CE (0.625 mg) による治療プラス MPA (2.5 mg) は、心血管系の利点を示しませんでした。平均 4.1 年間の追跡期間中、CE と MPA による治療は、冠状動脈性心疾患が確定した閉経後の女性の CHD イベントの全体的な発生率を低下させませんでした。 CE と MPA を併用したグループでは、1 年目にプラセボ グループよりも多くの CHD イベントが発生しましたが、その後の数年間はそうではありませんでした。最初の HERS 試験からの 2,321 人の女性が、HERS の非盲検拡大である HERS II に参加することに同意しました。 HERS II の平均追跡期間はさらに 2.7 年で、全体で合計 6.8 年でした。 CHD イベントの発生率は、CE と MPA を併用したグループとプラセボ グループの女性の間で、HERS、HERS II、および全体で同等でした。
静脈血栓塞栓症
WHIエストロゲンとプロゲスチンのサブスタディでは、毎日CE(0.625mg)とMPA(2.5mg)を投与された女性では、プラセボを投与された女性と比較して、統計的に有意な2倍のVTE(DVTおよび肺塞栓症[PE])の発生率が報告されました( 10,000 女性年あたり 35 対 17)。 DVT(10,000女性年あたり26対13)とPE(10,000女性年あたり18対8)の両方のリスクの統計的に有意な増加も示されました. VTE リスクの増加は、最初の 1 年の間に実証され、持続しました。 (見る 臨床研究 .) VTE が発生した場合、または疑われる場合は、エストロゲンとプロゲスチンの併用療法を直ちに中止する必要があります。
可能であれば、プロゲスチンを含むエストロゲンは、血栓塞栓症のリスクが高いタイプの手術の少なくとも 4 ~ 6 週間前、または長時間の固定期間中に中止する必要があります。
悪性新生物
乳がん
エストロゲンとプロゲスチンの使用者に乳癌に関する情報を提供する最も重要なランダム化臨床試験は、毎日の CE (0.625 mg) と MPA (2.5 mg) の女性の健康イニシアチブ (WHI) サブスタディです。平均 5.6 年の追跡調査の後、エストロゲンとプロゲスチンのサブスタディでは、CE と MPA を毎日服用した女性で浸潤性乳がんのリスクが増加したことが報告されました。このサブスタディでは、エストロゲン単独またはエストロゲンとプロゲスチン療法の以前の使用が女性の 26% によって報告されました。浸潤性乳がんの相対リスクは 1.24 (95% nCI、1.01-1.54) であり、絶対リスクは 41 対 33 症例/10,000 女性年であり、CE と MPA をプラセボと比較した.ホルモン療法の以前の使用を報告した女性の間で、浸潤性乳がんの相対リスクは 1.86 であり、プラセボと比較したエストロゲンとプロゲスチンの場合、女性年 10,000 人あたりの絶対リスクは 46 対 25 でした。ホルモン療法を以前に使用したことがないと報告した女性では、侵襲性乳がんの相対リスクは 1.09 であり、絶対リスクはプラセボと比較した CE と MPA の女性年 10,000 人あたり 36 件に対して 40 件でした。同じサブスタディでは、プラセボ群と比較して、CE (0.625 mg) と MPA (2.5 mg) を併用したグループでは浸潤性乳がんが大きく、リンパ節陽性である可能性が高く、より進行した段階で診断されました。転移性疾患はまれであり、2 つのグループ間に明らかな違いはありませんでした。組織学的サブタイプ、グレード、ホルモン受容体の状態などの他の予後因子は、グループ間で差がありませんでした。 (見る 臨床研究 .)
WHI の臨床試験と一致して、観察研究でも、エストロゲンとプロゲスチンの併用療法では乳がんのリスクが増加し、エストロゲン単独療法では数年間の使用後にリスクがわずかに増加することが報告されています。リスクは使用期間とともに増加し、治療中止後約 5 年でベースラインに戻るように見えました (中止後のリスクに関する十分なデータがあるのは観察研究のみです)。観察研究はまた、エストロゲンのみの治療と比較して、エストロゲンとプロゲスチンの治療を併用した場合、乳癌のリスクが高く、早期に明らかになることを示唆しています。しかし、これらの研究では一般的に、異なるエストロゲンとプロゲスチンの組み合わせ、用量、または投与経路の間で乳がんのリスクに有意な差があることはわかっていません.
エストロゲンとプロゲスチンの併用は、さらなる評価を必要とする異常なマンモグラムの増加をもたらすと報告されています。すべての女性は、医療提供者による毎年の乳房検査を受け、毎月の乳房自己検査を実施する必要があります。さらに、マンモグラフィー検査は、患者の年齢、危険因子、および過去のマンモグラフィー結果に基づいてスケジュールする必要があります。
子宮内膜癌
子宮のある女性に拮抗されていないエストロゲン療法を使用すると、子宮内膜がんのリスクが高まることが報告されています。反対されていないエストロゲン使用者の間で報告されている子宮内膜がんのリスクは、非使用者の約 2 倍から 12 倍高く、治療期間とエストロゲンの投与量に依存しているようです。ほとんどの研究では、1 年未満のエストロゲンの使用に関連するリスクの有意な増加は示されていません。最大のリスクは長期間の使用に関連しているようであり、5 年から 10 年以上にわたってリスクが 15 倍から 24 倍に増加し、このリスクはエストロゲン療法が中止された後、少なくとも 8 から 15 年間持続することが示されています。
エストロゲンとプロゲスチン療法を使用しているすべての女性の臨床的監視が重要です。診断されていない持続性または再発性の異常性器出血のすべてのケースで悪性を除外するために、必要に応じて指示されたまたは無作為の子宮内膜サンプリングを含む適切な診断手段を実施する必要があります。天然エストロゲンの使用が、同等のエストロゲン用量の合成エストロゲンとは異なる子宮内膜リスクプロファイルをもたらすという証拠はありません.閉経後の女性のエストロゲン療法にプロゲスチンを追加すると、子宮内膜がんの前兆である可能性がある子宮内膜増殖症のリスクが低下することが示されています。
卵巣がん
WHI エストロゲンとプロゲスチンのサブスタディでは、統計的に有意ではない卵巣がんのリスク増加が報告されました。平均 5.6 年の追跡調査の後、CE と MPA を併用した場合とプラセボを併用した場合の卵巣がんの相対リスクは 1.58 (95% nCI、0.77 – 3.24) でした。 CE と MPA を併用した場合とプラセボを併用した場合の絶対リスクは、女性年 10,000 人あたり 4 対 3 でした。いくつかの疫学研究では、エストロゲンとプロゲスチン、およびエストロゲンのみの製品を特に 5 年以上使用すると、卵巣がんのリスクが増加することが示されています。ただし、リスクの増加に関連する曝露期間は、すべての疫学研究で一貫しておらず、関連性がないと報告されているものもあります。
認知症の可能性
エストロゲンとプロゲスチンの女性の健康イニシアチブの記憶研究 (WHIMS) では、WHI の補助研究である 65 ~ 79 歳の 4,532 人の閉経後の女性の集団が、毎日の CE (0.625 mg) と MPA (2.5 mg) またはプラセボに無作為に割り付けられました。
WHIMS エストロゲンとプロゲスチンの補助研究では、平均 4 年間の追跡調査の後、CE と MPA のグループの 40 人の女性とプラセボのグループの 21 人の女性が認知症の可能性があると診断されました。エストロゲンとプロゲスチンを併用した場合とプラセボを併用した場合の推定認知症の相対リスクは 2.05 (95% CI、1.21-3.48) でした。 CE と MPA を併用した場合とプラセボを併用した場合の推定認知症の絶対リスクは、10,000 女性年あたり 45 対 22 でした。これらの所見が閉経後の若い女性に当てはまるかどうかは不明です。 (見る 臨床研究 と 予防 、 高齢者の使用 .)
視力異常
エストロゲンを投与されている患者では、網膜血管血栓症が報告されています。突然の部分的または完全な視力喪失、または眼球突出、複視、または片頭痛の突然の発症がある場合は、検査が保留されているエストロゲンとプロゲスチンの併用療法を中止してください。検査で乳頭浮腫または網膜血管病変が明らかになった場合は、エストロゲンとプロゲスチンの併用療法を永久に中止する必要があります。
予防
全般的
女性が子宮摘出術を受けていない場合のプロゲスチンの追加
エストロゲン投与のサイクルの 10 日以上、または連続レジメンでエストロゲンと一緒に毎日プロゲスチンを追加する研究では、エストロゲン治療単独で誘発されるよりも子宮内膜過形成の発生率が低いことが報告されています。子宮内膜増殖症は、子宮内膜がんの前兆である可能性があります。
ただし、エストロゲンのみのレジメンと比較して、エストロゲンとプロゲスチンの使用に関連する可能性のあるリスクがあります。これらには、乳がんのリスクの増加が含まれます。
体液貯留
プロゲステロンは、ある程度の体液貯留を引き起こす可能性があります。心機能障害や腎機能障害など、この要因の影響を受ける可能性のある状態の女性は、注意深い観察が必要です。
めまいと眠気
プロメトリウム カプセルは、一時的なめまいや眠気を引き起こす可能性があるため、自動車の運転中や機械の操作中は注意して使用する必要があります。プロメトリウム カプセルは就寝前に 1 日 1 回服用してください。
患者情報
全般的
この製品にはピーナッツ油が含まれており、ピーナッツにアレルギーがある場合は使用しないでください。
医師は、PROMETRIUM 100mg カプセルを処方する患者と患者情報リーフレットの内容について話し合うことをお勧めします。
発がん、突然変異誘発、生殖能力の障害
プロゲステロンは、経口投与による動物の発がん性について試験されていません。プロゲステロンをメスのマウスに移植すると、乳癌、卵巣顆粒膜細胞腫瘍、子宮内膜間質肉腫が発生した。イヌでは、長期の筋肉内注射により、結節性過形成および良性および悪性の乳腺腫瘍が生じました。プロゲステロンの皮下または筋肉内注射は潜伏期間を短縮し、以前に化学発がん物質で治療したラットの乳腺腫瘍の発生率を増加させました.
プロゲステロンは、点突然変異または染色体損傷に関する in vitro 研究で遺伝毒性の証拠を示さなかった.染色体損傷の in vivo 研究では、マウスに 1000 mg/kg および 2000 mg/kg の経口投与で肯定的な結果が得られました。外部から投与されたプロゲステロンは、多くの種で排卵を阻害することが示されており、長期間にわたって投与された高用量は、治療が中止されるまで生殖能力を損なうと予想されます.
妊娠
プロメトリウム カプセルは、妊娠中は使用しないでください。 (見る 禁忌 )。
妊娠カテゴリーB
マウスではヒトの経口用量の 9 倍までの用量で、ラットではヒトの経口用量の 44 倍までの用量で、ウサギでは移植されたデバイスによって子宮内に局所的に送達される 10 mcg/日の用量で生殖研究が行われています。 、モルモットではヒトの経口用量の約半分の用量で、アカゲザルではヒトの用量のほぼ半分の用量で、すべて体表面積に基づいており、生殖能力の障害または胎児への害の証拠はほとんどまたはまったく明らかにされていません。プロゲステロン。
看護婦
プロゲスチンを摂取している授乳中の女性の母乳中に、検出可能な量のプロゲスチンが確認されています。プロメトリウム 100mg カプセルを授乳中の女性に投与する場合は注意が必要です。
小児用
プロメトリウム カプセルは小児には適応されません。小児集団を対象とした臨床研究は実施されていません。
高齢者の使用
プロメトリウム カプセルを利用した臨床試験に参加した老年女性の数は十分ではなく、プロメトリウム 200mg カプセルに対する反応が 65 歳以上の女性と若い被験者とで異なるかどうかを判断できませんでした。
女性の健康イニシアチブ研究
Women's Health Initiative (WHI) エストロゲンとプロゲスチンのサブスタディ (毎日の CE [0.625 mg] と MPA [2.5 mg] 対 プラセボ) では、65 歳以上の女性で非致死性脳卒中と浸潤性乳がんの相対リスクが高かった. (見る 臨床研究 と 警告 、 心血管障害 と 悪性新生物。 )
女性の健康イニシアチブ記憶研究
65 歳から 79 歳の閉経後の女性を対象とした Women's Health Initiative Memory Study (WHIMS) では、プラセボと比較した場合、エストロゲンとプロゲスチンの補助研究で認知症を発症するリスクが増加しました。 (見る 臨床研究 と 警告 、 認知症の可能性あり。 )
過剰摂取
人間での過剰摂取に関する研究は行われていません。過剰摂取の場合は、プロメトリアム カプセルを中止し、対症療法を行う必要があります。
禁忌
プロメトリウム カプセルは、次のいずれかの状態の女性には使用しないでください。
臨床薬理学
プロメトリウム 200mg カプセルは、卵巣由来のプロゲステロンと化学的に同一の微粉化プロゲステロンの経口剤形です。プロゲステロンの経口バイオアベイラビリティは、微粉化によって増加します。
薬物動態
吸収
プロゲステロンを微粉化ソフトゼラチンカプセル製剤として経口投与した後、3時間以内に最大血清濃度に達しました。微粉化されたプロゲステロンの絶対的なバイオアベイラビリティは知られていません。表 1 は、マイクロナイズド ソフト ゼラチン カプセル製剤としてプロメトリアム カプセル 100 mg を 1 日 5 回経口投与した後の閉経後女性の平均薬物動態パラメーターをまとめたものです。
表 1. PROMETRIUM 200mg カプセルの薬物動態パラメータ
血清プロゲステロン濃度は、閉経後の女性において、1 日あたり 100 mg から 300 mg までの用量範囲にわたって、PROMETRIUM 200 mg カプセル 100 mg を複数回投与した後、直線的かつ用量に比例するように見えました。女性では 1 日 300 mg を超える用量は研究されていませんが、男性ボランティアの研究からの血清濃度は、1 日あたり 100 mg と 400 mg の間で直線的で用量に比例しているように見えました。男性志願者の薬物動態パラメーターは、閉経後の女性に見られるものと概ね一致していました。
分布
プロゲステロンは、血清タンパク質、主に血清アルブミン (50 ~ 54%) およびトランスコルチン (43 ~ 48%) に約 96% ~ 99% 結合しています。
代謝
プロゲステロンは主に肝臓で代謝され、主にプレグナンジオールとプレグナノロンになります。プレグナンジオールとプレグナノロンは、肝臓でグルクロニドと硫酸塩の代謝物に抱合されます。胆汁中に排泄されるプロゲステロン代謝物は脱抱合され、還元、脱ヒドロキシル化、およびエピマー化を介して腸内でさらに代謝される可能性があります。
排泄
プレグナンジオールとプレグナノロンのグルクロニドと硫酸抱合体は、胆汁と尿に排泄されます。プロゲステロン代謝物は、主に腎臓によって排出されます。胆汁に排泄されるプロゲステロン代謝産物は、腸肝循環を受けるか、糞便に排泄される可能性があります。
特別な集団
PROMETRIUM Capsules の薬物動態は、低体重または肥満の患者では評価されていません。
肝不全
PROMETRIUM 100mgカプセルの薬物動態に対する肝障害の影響は研究されていません。
腎不全
PROMETRIUM Capsules の薬物動態に対する腎障害の影響は研究されていません。
食物と薬物の相互作用
閉経後の女性に 200 mg の用量で投与した場合、同時の食物摂取により、絶食状態と比較して PROMETRIUM 100 mg カプセルのバイオアベイラビリティが増加しました。
薬物相互作用
ヒト肝ミクロソームによるプロゲステロンの代謝は、ケトコナゾールによって阻害された (IC50
共役型エストロゲンとプロメトリウム 200mg カプセルを 29 人の閉経後女性に 12 日間にわたって同時投与すると、総エストロン濃度 (Cmax 3.68 ng/mL から 4.93 ng/mL) および総エクイリン濃度 (Cmax 2.27 ng/mL から 3.22 ng/mL) が増加しました。 ng/mL) および循環 17β エストラジオール濃度の減少 (Cmax 0.037 ng/mL から 0.030 ng/mL)。共役エストロゲンの半減期は、PROMETRIUM カプセルの同時投与と同様でした。表 2 に薬物動態パラメーターをまとめます。
表 2. 閉経後の女性に抱合型エストロゲン 0.625 mg とプロメトリアム カプセル 200 mg を 12 日間同時投与した後のエストラジオール、エストロン、エクイリンの平均 (± SD) 薬物動態パラメータ
臨床研究
子宮内膜への影響
無作為化二重盲検臨床試験では、358 人の閉経後女性で、それぞれ子宮が無傷で、最長 36 か月間治療を受けました。治療グループは次のとおりです。1 日あたり 200 mg の用量の PROMETRIUM カプセルを、1 日あたり 0.625 mg のコンジュゲート型エストロゲンと組み合わせて、28 日サイクルあたり 12 日間投与 (n=120)。結合型エストロゲン 0.625 mg/日のみ (n=119);またはプラセボ(n = 119)。 3 つの治療グループすべての被験者は、主に白人女性でした (各グループの 87% 以上)。最長 3 年間の治療を受けた女性における子宮内膜過形成の発生率の結果を表 3 に示します。PROMETRIUM カプセルと抱合型エストロゲンを併用した治療群と抱合型エストロゲンのみの治療群を比較すると、過形成率が有意に低いことが示されました (6%)。プロメトリアム カプセルと抱合型エストロゲンを併用した治療グループで、36 か月の治療を通じて
表 3. 3 年間の治療を受けた女性における子宮内膜増殖症の発生率
36 か月間の治療における子宮内膜増殖症の診断までの期間を図 1 に示します。この図は、共役型エストロゲンとプロメトリアム カプセルの併用群と比較して、共役型エストロゲン群の過形成患者の割合が有意に高かったことをグラフで示しています (64%)。 (6パーセント)。
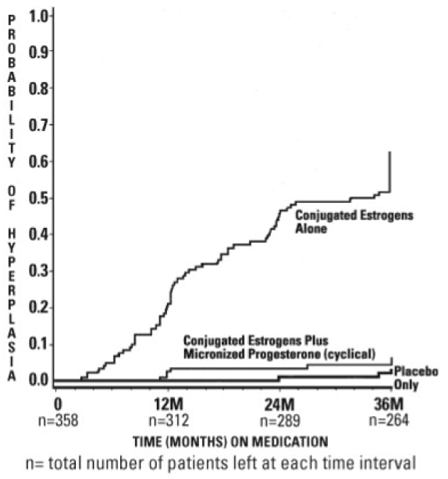
図 1. 最大 36 か月の治療を受けた女性の過形成までの時間
36 か月の治療期間中の過形成による中止率を表 4 に示します。過形成の程度にかかわらず、抱合型エストロゲンとプロメトリウム 100mg カプセルを投与された患者の中止率は、プラセボのみの群と同様でしたが、抱合型エストロゲンのみを投与された患者の中止率は有意に高かった。過形成のために永久に治療を中止した女性は、人口統計学的に全体の研究集団と同様でした。
表 4. 36 か月の治療における過形成による中止率
続発性無月経への影響
少なくとも 90 日間続発性無月経の閉経前女性を対象とした単一施設の無作為化二重盲検臨床試験では、プロメトリウム 200mg カプセル療法を 10 日間投与した結果、女性の 80% が最後の無月経から 7 日以内に消退出血を経験しました。プロメトリウム 100mg カプセルの 1 日あたり 300mg の用量 (n=20) と、プラセボ群 (n=21) で消退出血を経験した女性の 10% を比較しました。
少なくとも 90 日間続発性無月経の閉経前女性を対象とした多施設並行群間非盲検市販後投与試験では、28 日間の 2 回の治療サイクル中に 10 日間の PROMETRIUM 100mg カプセルを投与し、1 日あたり 300mg (n= .
分泌転換率は、エストロゲンでプライミングされた閉経後の女性を対象とした多施設無作為化二重盲検臨床試験で評価されました。 PROMETRIUM 100mg カプセルを 1 日 400 mg で 10 日間経口投与した場合 (n=22)、プラセボ群 (n=23) では 0% であったのに対し、45% の女性で子宮内膜の完全な分泌変化が誘発されました。
続発性無月経の閉経前女性を 90 日間以上対象とした 2 回目の多施設並行群間非盲検市販後投与試験でも、分泌変化の速度が評価されました。すべての被験者は、3 つの連続した 28 日間の治療サイクルにわたって毎日経口抱合型エストロゲンと、各治療サイクルの 10 日間、1 日あたり 300 mg (n=107) または 1 日あたり 400 mg (n=99) の PROMETRIUM カプセルを受け取りました。完全な分泌変換の割合は、それぞれ 21.5% と 28.3% でした。
女性の健康イニシアチブ研究
Women's Health Initiative (WHI) は、約 27,000 人の主に健康な閉経後の女性を 2 つのサブスタディに登録し、毎日の経口共役エストロゲン (CE) [0.625 mg] 単独または酢酸メドロキシプロゲステロン (MPA) [2.5 mg] との組み合わせのリスクと利点を評価しました。特定の慢性疾患の予防におけるプラセボとの比較。主要エンドポイントは冠状動脈性心疾患 [(CHD) は非致死性心筋梗塞 (MI)、サイレント MI および CHD 死亡として定義される] の発生率であり、浸潤性乳がんが主要な有害アウトカムでした。 「グローバル インデックス」には、CHD、浸潤性乳がん、脳卒中、肺塞栓症 (PE)、子宮内膜がん (CE と MPA サブスタディのみ)、結腸直腸がん、股関節骨折、またはその他の原因による死亡の早期発生が含まれていました。これらのサブスタディでは、更年期症状に対する CE 単独または CE と MPA の効果は評価されていません。
WHI エストロゲン プラス プロゲスチン サブスタディ
WHI エストロゲンとプロゲスチンのサブスタディは早期に中止されました。事前定義された中止規則によると、平均5.6年間の治療追跡調査の後、乳がんと心血管イベントのリスクの増加は、「グローバルインデックス」に含まれる特定の利点を上回りました. 「グローバルインデックス」におけるイベントの絶対過剰リスクは、10,000 女性年あたり 19 でした。
5.6 年の追跡調査後に統計的有意性に達した WHI の「グローバル インデックス」に含まれる転帰について、CE と MPA で治療されたグループの 10,000 女性年あたりの絶対過剰リスクは、CHD イベントが 7 件、脳卒中が 8 件、 PE が 10 件、浸潤性乳がんが 8 件増加し、女性年 10,000 人あたりの絶対リスク減少は、結腸直腸がんが 6 件、股関節骨折が 5 件減少しました。
16,608 人の女性 (平均 63 歳、範囲 50 ~ 79、白人 83.9%、黒人 6.8%、ヒスパニック系 5.4%、その他 3.9%) を対象としたエストロゲンとプロゲスチンのサブスタディの結果を表 5 に示します。平均5.6年のフォローアップ後の裁定データ。
表 5. 平均 5.6 年の WHI のエストロゲンとプロゲスチンのサブスタディで見られる相対リスクと絶対リスク a、b
閉経の開始と比較したエストロゲンとプロゲスチン療法の開始のタイミングは、全体的なリスクベネフィットプロファイルに影響を与える可能性があります。年齢で層別化された WHI エストロゲンとプロゲスチンのサブスタディでは、50 歳から 59 歳の女性で、全死亡率のリスクを減少させる有意ではない傾向が示されました [ハザード比 (HR) 0.69 (95% CI、0.44-1.07)]。
女性の健康イニシアチブ記憶研究
WHI の補助研究であるエストロゲンとプロゲスチンの女性の健康イニシアチブ記憶研究 (WHIMS) は、4,532 人の主に健康な閉経後の 65 歳以上の女性 (47% は 65 歳から 69 歳、35% は 70 歳から 74 歳) を登録しました。年齢; 18% は 75 歳以上であった) は、毎日の CE (0.625 mg) と MPA (2.5 mg) の効果をプラセボと比較して認知症の可能性 (一次結果) に評価した。
平均 4 年間の追跡調査後、CE と MPA を併用した場合とプラセボを併用した場合の認知症の可能性の相対リスクは 2.05 (95% CI、1.21 – 3.48) でした。 CE と MPA を併用した場合とプラセボを併用した場合の推定認知症の絶対リスクは、女性年 10,000 人あたり 45 対 22 でした。この研究で定義された推定認知症には、アルツハイマー病 (AD)、血管性認知症 (VaD)、混合型 (AD と VaD の両方の特徴を持つ) が含まれます。治療群とプラセボ群における認知症の可能性の最も一般的な分類はADでした。補助研究は 65 歳から 79 歳の女性で実施されたため、これらの調査結果がより若い閉経後の女性に適用されるかどうかは不明です。 (見る 警告 、 認知症の可能性 と 予防 、 高齢者の使用 .)
患者情報
プロメトリウム® (プロゲステロン、USP) カプセル 100 mg & 200 mg
PROMETRIUM 200mg カプセルの服用を開始する前に、この患者情報をお読みください。また、PROMETRIUM 100mg カプセルの処方箋を補充するたびに得られる内容をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
プロメトリウム 100mg カプセル (プロゲステロン ホルモン) について知っておくべき最も重要な情報は何ですか?
- エストロゲンを含むプロゲスチンは、心臓病、心臓発作、脳卒中、または認知症を予防するために使用しないでください.
- エストロゲンと一緒にプロゲスチンを使用すると、心臓発作、脳卒中、乳がん、および血栓が発生する可能性が高くなる可能性があります.
- 65 歳以上の女性を対象とした研究によると、エストロゲンと一緒にプロゲスチンを使用すると、認知症になる可能性が高くなる可能性があります。
- PROMETRIUM 100mg カプセルによる治療が必要かどうかについて、あなたと担当の医療提供者と定期的に話し合う必要があります。
この製品にはピーナッツ油が含まれており、ピーナッツにアレルギーのある方は使用しないでください。
プロメトリウム200mgカプセルとは?
プロメトリウム 100mg カプセルには、プロゲステロンと呼ばれる女性ホルモンが含まれています。
プロメトリウム 100mg カプセルは何に使用されますか?
月経不順の治療
プロメトリウム 200mg カプセルは、プロゲステロンの減少による続発性無月経 (以前に月経があった女性の月経の欠如) の治療に使用されます。プロゲステロンが不足すると月経不順になります。あなたの体がそれ自体で十分なプロゲステロンを生成しないと医療提供者が判断した場合、必要なプロゲステロンを提供するために PROMETRIUM 200mg カプセルが処方されることがあります。
子宮内膜の保護(子宮内膜)
プロメトリウム 200mg カプセルは、子宮 (子宮) を持つ閉経後の女性にエストロゲン含有薬と組み合わせて使用されます。エストロゲンを単独で服用すると、子宮内膜(子宮)の癌につながる可能性がある子宮内膜増殖症と呼ばれる状態を発症する可能性が高くなります.プロゲスチンの追加は、一般に、子宮(子宮)のがんになる可能性を減らすために、子宮を持つ女性に推奨されます.
プロメトリウム カプセルを服用してはいけない人は?
次の場合は、プロメトリアム カプセルの服用を開始しないでください。
- ピーナッツにアレルギーがある
- 異常な性器出血がある
- 現在、特定のがんを患っている、または患ったことがある エストロゲンとプロゲスチンによる治療は、乳がんや子宮がんなど、特定の種類のがんにかかる可能性を高める可能性があります。がんにかかっている、またはがんにかかったことがある場合は、プロメトリウム カプセルを服用すべきかどうかについて医療提供者に相談してください。
- 脳卒中や心臓発作を起こした
- 現在、血栓がある、またはあったことがある
- 現在、肝臓に問題がある、またはあったことがある
- プロメトリウムカプセルまたはその成分にアレルギーがある このリーフレットの最後にあるプロメトリウム 200mg カプセルの成分リストを参照してください。
- 妊娠しているかもしれないと思う
医療提供者に次のように伝えます。
- 授乳中の場合。 プロメトリウム 100mg カプセルのホルモンは、母乳に移行する可能性があります。
- あなたのすべての医学的問題について。 喘息(喘鳴)、てんかん(発作)、糖尿病、片頭痛、子宮内膜症、狼瘡、心臓、肝臓、甲状腺、腎臓に問題がある場合、または血中のカルシウム濃度が高い。
- 服用しているすべての薬について。 これには、処方薬と非処方薬、ビタミン、ハーブのサプリメントが含まれます。一部の医薬品は、プロメトリウム 100mg カプセルの作用に影響を与える可能性があります。プロメトリウム カプセルは、他の医薬品の作用にも影響を与える可能性があります。
プロメトリウム 200mg カプセルの服用方法は?
プロメトリウム カプセルの副作用にはどのようなものがありますか?
副作用は、その深刻度と治療を受けたときに発生する頻度によって分類されます。
深刻ではあるがあまり一般的ではない副作用には次のものがあります。
- 胎児へのリスク: 口蓋裂、口唇裂、尿道下裂、心室中隔欠損症、動脈管開存症、その他の先天性心疾患の症例。
- 異常な血液凝固: 脳卒中、心臓発作、肺塞栓、視覚障害または失明。
深刻な副作用の兆候には次のようなものがあります。
- 視覚または発話の変化
- 突然の新しい激しい頭痛
- 息切れ、衰弱、疲労を伴う、または伴わない胸や脚の激しい痛み
- めまいと失神
- 嘔吐
これらの警告サインのいずれか、またはその他の異常な症状が発生した場合は、すぐに医療提供者に連絡してください。
それほど深刻ではありませんが、一般的な副作用には次のものがあります。
- 頭痛
- 胸の痛み
- 不規則な膣出血または斑点
- 胃や腹部のけいれん、膨満感
- 吐き気と嘔吐
- 脱毛
- 体液貯留
- 膣内イースト菌感染症
これらは、PROMETRIUM 200mg カプセルの考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師に副作用に関するアドバイスを求めてください。副作用については、AbbVie Inc. (1-800-633-9110) または FDA (1-800-FDA-1088) に報告できます。
プロメトリウム 100mg カプセルで深刻な副作用が起こる可能性を下げるにはどうすればよいですか?
- PROMETRIUM 100mg カプセルの服用を継続すべきかどうか、定期的に医療提供者と相談してください。
- プロメトリウム カプセルの服用中に異常な性器出血が発生した場合は、すぐに医療提供者に相談してください。
- 医療提供者から特に指示がない限り、毎年内診、乳房検査、マンモグラム (乳房 X 線) を受けてください。あなたの家族のメンバーが乳がんにかかったことがある場合、または乳房のしこりや異常なマンモグラムを経験したことがある場合は、より頻繁に乳房検査を受ける必要があるかもしれません.
- 高血圧、高コレステロール(血中脂肪)、糖尿病、太りすぎ、またはタバコを使用している場合は、心臓病になる可能性が高くなります.心臓病になる可能性を下げる方法については、医療提供者に尋ねてください。
PROMETRIUMカプセルの安全で効果的な使用に関する一般情報
- 医薬品は、患者情報リーフレットに記載されていない状態に対して処方されることがあります。処方されていない状態でプロメトリウム カプセルを服用しないでください。
- あなたの医療提供者は、あなたとあなただけのためにこの薬を処方しました。他の人があなたと同じ症状を持っている場合でも、プロメトリアム カプセルを他の人に与えないでください。それらに害を及ぼす可能性があります。
- プロメトリウム 200mg カプセルは、就寝前に 1 日 1 回服用してください。一部の女性は、最初の治療中に極度のめまいや眠気を経験することがあります.まれに、かすみ目、会話困難、歩行困難、異常感などの症状が現れることがあります。これらの症状が発生した場合は、すぐに医療提供者に相談してください。
- めまいや眠気が起こることがありますので、自動車の運転や機械の操作には十分注意してください。
プロメトリウム カプセルは子供の手の届かないところに保管してください。
このリーフレットは、PROMETRIUM 100mg カプセルに関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医療提供者または薬剤師に相談してください。医療専門家向けに書かれた PROMETRIUM 100mg カプセルに関する情報を求めることができます。詳細については、フリーダイヤル 1-800-633-9110 までお問い合わせください。
プロメトリウム カプセルの成分は何ですか?
有効成分: 100 mg または 200 mg の微粉化プロゲステロン
プロメトリアム カプセル 100 mg の不活性成分には、ピーナッツ油 NF、ゼラチン NF、グリセリン USP、レシチン NF、二酸化チタン USP、FD&C 赤色 40 号、D&C 黄色 10 号が含まれます。
プロメトリアム カプセル 200 mg の不活性成分には、ピーナッツ油 NF、ゼラチン NF、グリセリン USP、レシチン NF、二酸化チタン USP、D&C 黄色 10 号、および FD&C 黄色 6 号が含まれます。
供給方法
プロメトリウム 200mg カプセル 100mg は、丸いピーチ色のカプセルで、黒いインプリント「SV」が刻印されています。
プロメトリウム 100mg カプセル 200mg は、楕円形の淡黄色のカプセルで、「SV2」という黒い刻印が入っています。
25°C (77°F) で保管してください。 15° から 30°C (59° から 86°F) [USP 制御室温を参照] まで許容される逸脱。
