Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Neurontin とは何ですか?どのように使用されますか?
Neurontin 400mg は、神経痛や発作の症状を治療するために使用される処方薬です。 Neurontin は、単独で使用することも、他の薬と併用することもできます。
Neurontin は GABA アナログ、抗てんかん薬です。
Neurontin が 3 歳未満の子供に安全で有効であるかどうかはわかっていません。
Neurontin 400mg の副作用の可能性は何ですか?
ニューロンチンは、次のような重大な副作用を引き起こす可能性があります。
- 発作の増加
- 重度の衰弱または疲労
- バランスまたは筋肉の動きの問題
- 胃の上部の痛み
- 胸痛
- 発熱を伴う新しい咳または悪化する咳
- 呼吸困難
- 重度のうずきまたはしびれ
- 急速眼球運動
- 排尿がほとんどまたはまったくない
- 痛みや排尿困難
- 足や足首の腫れ
上記の症状がある場合は、すぐに医療機関を受診してください。
Neurontin の最も一般的な副作用は次のとおりです。
- 頭痛
- めまい
- 眠気
- 疲れ
- 手や足のむくみ
- あなたの目の問題
- 調整の問題
- 小児における Neurontin 600mg の最も一般的な副作用は次のとおりです。
- 熱
- 吐き気
- 嘔吐
- 行動の変化
- メモリの問題
- 集中できない
- 落ち着きのない、敵対的または攻撃的な行動
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Neurontin の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
NEURONTIN カプセル、錠剤、経口液剤の有効成分はガバペンチンで、化学名は 1-(アミノメチル)シクロヘキサン酢酸です。
ガバペンチンの分子式は C9H17NO2 で、分子量は 171.24 です。ガバペンチンの構造式は次のとおりです。
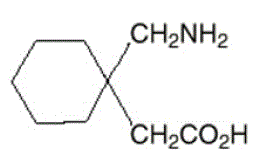
ガバペンチンは白色からオフホワイトの結晶性固体で、pKa1 は 3.7、pKa2 は 10.7 です。水および塩基性および酸性水溶液の両方に自由に溶けます。 pH 7.4 での分配係数 (ノクタノール/0.05M リン酸緩衝液) の対数は –1.25 です。
各 Neurontin 100mg カプセルには、100mg、300mg、または 400mg のガバペンチンと次の不活性成分が含まれています: ラクトース、コーンスターチ、タルク、ゼラチン、二酸化チタン、FD&C Blue No. 2、黄酸化鉄 (300 mg および 400 mg のみ) 、および赤酸化鉄 (400 mg のみ)。
各 Neurontin タブレットには、600 mg または 800 mg のガバペンチンと次の不活性成分が含まれています: ポロキサマー 407、コポビドン、コーンスターチ、ステアリン酸マグネシウム、ヒドロキシプロピルセルロース、タルク、カンデリラワックス
Neurontin 経口溶液には、5 mL あたり 250 mg のガバペンチン (1 mL あたり 50 mg) と次の不活性成分が含まれています: グリセリン、キシリトール、精製水、および人工の冷たいストロベリー アニス フレーバー。
適応症
NEURONTIN® は次のように適応されます。
- 成人の帯状疱疹後神経痛の管理
- てんかんを有する成人および3歳以上の小児患者における、二次性全般化を伴うまたは伴わない部分発作の治療における補助療法
投薬と管理
帯状疱疹後神経痛の投与量
帯状疱疹後神経痛の成人では、NEURONTIN は 1 日目に 300 mg を 1 回、2 日目に 600 mg/日 (300 mg を 1 日 2 回)、3 日目に 900 mg/日 (300 mg を 3 回) から開始することができます。 1日に1回)。その後、必要に応じて、1800 mg/日 (600 mg 1 日 3 回) の用量まで、痛みを軽減するために用量を漸増することができます。臨床研究では、1800 mg/日から 3600 mg/日の用量範囲で有効性が実証され、用量範囲全体で同等の効果が見られました。ただし、これらの臨床研究では、1800 mg/日を超える用量を使用することによる追加の利点は実証されていません。
部分発作を伴うてんかんの投与量
12歳以上の患者
開始用量は1日3回300mgです。 NEURONTIN の推奨維持用量は、1 日 3 回 300 mg から 600 mg です。 2400 mg/日までの投与量は、長期の臨床研究で十分に許容されています. 3600 mg/日の用量も少数の患者に比較的短期間投与されており、忍容性は良好です。 300 mg または 400 mg のカプセル、または 600 mg または 800 mg の錠剤を使用して、NEURONTIN を 1 日 3 回投与します。投与間の最大時間は 12 時間を超えてはなりません。
3歳から11歳の小児患者
開始用量範囲は 10 mg/kg/日から 15 mg/kg/日であり、3 回に分けて投与され、約 3 日間かけて漸増することで推奨される維持用量に到達します。 3 歳から 4 歳の患者における NEURONTIN の推奨維持量は 40 mg/kg/日で、3 回に分けて投与されます。 5~11歳の患者におけるNEURONTIN 100mgの推奨維持用量は、25mg/kg/日~35mg/kg/日で、3回に分けて投与されます。 NEURONTIN 300mg は、経口溶液、カプセル、または錠剤として、またはこれらの製剤の組み合わせを使用して投与することができます。 50 mg/kg/日までの投与量は、長期の臨床研究で十分に許容されています.投与間の最大時間間隔は 12 時間を超えてはなりません。
腎障害患者における用量調節
12 歳以上の腎障害のある患者または血液透析を受けている患者では、次のように用量調整が推奨されます(各適応症の有効用量については、上記の推奨用量を参照してください)。
表 1: 腎機能に基づく NEURONTIN 投与量
クレアチニンクリアランス (CLCr) は、外来患者で測定することは困難です。腎機能が安定している患者では、Cockcroft と Gault の式を使用して、クレアチニン クリアランスを適切に推定できます。
腎機能が低下した 12 歳未満の患者における NEURONTIN の使用は研究されていません。
高齢者の投与量
高齢患者は腎機能が低下している可能性が高いため、用量選択には注意が必要であり、これらの患者のクレアチニンクリアランス値に基づいて用量を調整する必要があります。
管理情報
NEURONTIN は食事の有無にかかわらず経口投与してください。
NEURONTIN 100mg カプセルは、水で丸ごと飲み込んでください。
半分の錠剤を投与するためにスコアリングされた 600 mg または 800 mg のニューロンチン錠を分割する必要がある場合は、未使用の半分の錠剤を次の用量として服用する必要があることを患者に伝えます。スコアリングされた錠剤を分割してから 28 日以内に使用されなかった半錠は廃棄する必要があります。
NEURONTIN の投与量を減らしたり、中止したり、別の薬に置き換えたりする場合は、少なくとも 1 週間かけて徐々に行う必要があります (処方者の裁量により、より長い期間が必要になる場合があります)。
供給方法
剤形と強度
カプセル
- 100mg:本体に「PD」、キャップに「Neurontin/100mg」と印字した白色ハードゼラチンカプセル
- 300mg:本体に「PD」、キャップに「Neurontin/300mg」と印字した黄色のハードゼラチンカプセル
- 400mg:本体に「PD」、キャップに「Neurontin/400mg」と印字したオレンジ色のハードゼラチンカプセル
錠剤
- 600mg:片面に「NT」「16」を刻印した白色楕円フィルムコーティング割線錠
- 800mg:片面に「NT」「26」を刻印した白色楕円形フィルムコーティング割線錠
内服液
- 250 mg/5 mL (50 mg/mL) 無色透明~微黄色溶液
保管と取り扱い
NEURONTIN(ガバペンチン) カプセル、錠剤、および経口溶液は、次のように供給されます。
100mgカプセル
ボディに「PD」、キャップに「Neurontin/100mg」と印刷された白いハードゼラチンカプセル。で利用可能:
100本のボトル: NDC 0071-0803-24
300mgカプセル
本体に「PD」、キャップに「Neurontin/300mg」と印刷された黄色のハードゼラチンカプセル。で利用可能:
100本のボトル: NDC 0071-0805-24 単位用量 50 代: NDC 0071-0805-40
400mgカプセル
オレンジ色のハードゼラチンカプセルで、本体に「PD」、キャップに「Neurontin/400mg」と印字。で利用可能:
100本のボトル: NDC 0071-0806-24 単位用量 50 代: NDC 0071-0806-40
600mg錠
片面に「NT」と「16」と刻印された白い楕円形のフィルムコーティングされた割線錠。で利用可能:
100本のボトル: NDC 0071-0513-24
800mg錠
片面に「NT」と「26」と刻印された白い楕円形のフィルムコーティングされた割線錠。で利用可能:
100本のボトル: NDC 0071-0401-24
内服液5mLあたり250mg
無色透明からわずかに黄色の溶液。各経口溶液 5 mL には 250 mg のガバペンチンが含まれています。で利用可能:
470 mL 入りガラスびん: NDC 0071-2012-23 470 mL 入りボトル: NDC 0071-2012-44
NEURONTIN 400mg の錠剤とカプセルは 25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) の間で許容されるエクスカーション [参照 USP制御の室温 ]。
NEURONTIN Oral Solution は 2°C ~ 8°C (36°F ~ 46°F) で冷蔵保存してください。
配布元: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. 改訂: 2020 年 12 月
副作用
次の重篤な副作用については、別のセクションで詳しく説明します。
- 好酸球増多症および全身症状(DRESS)/多臓器過敏症を伴う薬物反応 [参照 警告と注意事項 ]
- アナフィラキシーおよび血管性浮腫 [参照 警告と注意事項 ]
- 傾眠/鎮静およびめまい [参照 警告と注意事項 ]
- 禁断症状 急発性発作、てんかん重積症 [参照 警告と注意事項 ]
- 自殺行動と観念 [参照 警告と注意事項 ]
- 呼吸抑制 [参照 警告と注意事項 ]
- 神経精神医学的有害反応(3~12歳の小児患者)[参照 警告と注意事項 ]
- てんかん患者における原因不明の突然死 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
帯状疱疹後神経痛
NEURONTIN の成人での使用に関連する最も一般的な副作用は、プラセボ治療を受けた患者では同等の頻度では見られませんでしたが、めまい、傾眠、および末梢性浮腫でした。
帯状疱疹後神経痛の 2 つの対照試験では、NEURONTIN を投与された 336 人の患者の 16%、プラセボを投与された 227 人の患者の 9% が、副作用のために治療を中止しました。 NEURONTIN 治療を受けた患者の離脱に最も頻繁につながった副作用は、めまい、傾眠、吐き気でした。
表 3 は、NEURONTIN で治療された、プラセボ対照試験に参加した帯状疱疹後神経痛患者の少なくとも 1% で発生し、プラセボ群よりも NEURONTIN 群で数値的により頻繁に発生した有害反応を示しています。
表 3: 帯状疱疹後神経痛におけるプールされたプラセボ対照試験における有害反応
患者の 1% 以上にみられたが、プラセボ群で同様またはそれ以上に頻繁に見られたその他の反応には、疼痛、振戦、神経痛、背部痛、消化不良、呼吸困難、およびインフルエンザ症候群が含まれていました。
副作用の種類と発生率について、男女間で臨床的に重要な差はありませんでした。人種が白人以外であると報告された患者はほとんどいなかったため、人種による副作用の分布に関する声明を裏付けるデータは不十分です。
部分発作を伴うてんかん(補助療法)
NEURONTIN 300mg を他の抗てんかん薬と併用した 12 歳以上の患者における最も一般的な副作用は、眠気、めまい、運動失調、疲労、眼振でした。
3 歳から 12 歳の小児患者における他の抗てんかん薬と組み合わせた NEURONTIN の最も一般的な副作用は、ウイルス感染、発熱、悪心および/または嘔吐、傾眠、および敵意[参照 警告と注意事項 ]。
市販前の臨床試験でニューロンチンを投与された 12 歳以上の 2,074 人の患者の約 7%、および 3 ~ 12 歳の 449 人の小児患者の約 7% が、副作用のために治療を中止しました。 12 歳以上の患者の離脱に関連する最も一般的な有害反応は、傾眠 (1.2%)、運動失調 (0.8%)、疲労 (0.6%)、悪心および/または嘔吐 (0.6%)、およびめまい (0.6%) でした。 .小児患者の離脱に最も一般的に関連する有害反応は、情緒不安定 (1.6%)、敵意 (1.3%)、運動亢進 (1.1%) でした。
表 4 は、プラセボ対照試験に参加した 12 歳以上の NEURONTIN 治療患者の少なくとも 1% で発生した有害反応を示しており、数値的には NEURONTIN グループでより一般的でした。これらの研究では、NEURONTIN 300mg またはプラセボのいずれかが、患者の現在の抗てんかん薬療法に追加されました。
表 4:12 歳以上のてんかん患者を対象としたプールされたプラセボ対照追加試験における有害反応
NEURONTIN 治療を受けた患者で少なくとも 10% の発生率で発生する有害反応の中で、傾眠と運動失調は正の用量反応関係を示すように見えました。
有害反応の全体的な発生率と見られた有害反応の種類は、NEURONTIN で治療された男性と女性の間で類似していました。 NEURONTINまたはプラセボのいずれかで治療された患者では、年齢が上がるにつれて副作用の発生率がわずかに増加しました。プラセボ対照研究で患者の 3% (28/921) だけが非白人 (黒人またはその他) であると特定されたため、人種による副作用の分布に関する声明を裏付けるデータは不十分です。
表 5 は、プラセボ対照試験に参加している 3 歳から 12 歳までの NEURONTIN 治療を受けた患者の少なくとも 2% で発生した有害反応を示しています。
表 5: 3 歳から 12 歳の小児てんかん患者を対象としたプラセボ対照追加試験における有害反応
歳から 12 歳の小児患者の 2% 以上に見られた、プラセボ群と同等以上の頻度でみられたその他の反応には、咽頭炎、上気道感染症、頭痛、鼻炎、痙攣、下痢、食欲不振、咳、および中耳炎が含まれていました。
市販後の経験
NEURONTIN の市販後の使用中に、以下の副作用が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
肝胆道障害: 黄疸
調査: クレアチンキナーゼの上昇、肝機能検査の上昇
代謝および栄養障害: 低ナトリウム血症
筋骨格および結合組織障害: 横紋筋融解症
神経系障害: 運動障害
精神障害: 攪拌
生殖器系および乳房障害: 豊胸、性欲の変化、射精障害、無オルガスム
皮膚および皮下組織の障害: 血管性浮腫 [参照 警告と注意事項 ]、水疱性類天疱瘡、多形紅斑、スティーブンス・ジョンソン症候群。
NEURONTIN をオピオイドまたは他の CNS 抑制剤と一緒に服用している患者、または潜在的な呼吸障害の状況で、生命を脅かすまたは致命的な呼吸抑制の市販後の報告があります [参照 警告と注意事項 ]。
ガバペンチンの突然の中止後の副作用も報告されています。最も頻繁に報告された反応は、不安、不眠、吐き気、痛み、発汗でした。
薬物相互作用
オピオイド
ガバペンチンとオピオイド(例、モルヒネ、ヒドロコドン、オキシコドン、ブプレノルフィン)の同時投与後に、呼吸抑制と鎮静が起こり、時には死に至ることが報告されている[参照 警告と注意事項 ]。
ヒドロコドン
NEURONTIN 300mg とヒドロコドンの同時投与により、ヒドロコドンへの曝露が減少します [参照 臨床薬理学 ]。ヒドロコドンを服用している患者で NEURONTIN 100mg を開始または中止する場合は、ヒドロコドンの曝露と効果が変化する可能性を考慮する必要があります。
モルヒネ
ガバペンチンをモルヒネと一緒に投与する場合、傾眠、鎮静、呼吸抑制などの中枢神経系抑制の徴候について患者を観察する必要があります。 臨床薬理学 ]。
その他の抗てんかん薬
ガバペンチンは目に見えて代謝されず、一般的に同時投与される抗てんかん薬の代謝を妨げません。 臨床薬理学 ]。
マーロックス®(水酸化アルミニウム、水酸化マグネシウム)
ガバペンチンの平均バイオアベイラビリティーは、水酸化マグネシウムと水酸化アルミニウムを含む制酸剤 (マーロックス) の併用で約 20% 減少しました。ガバペンチンは、マーロックス投与後少なくとも 2 時間は服用することをお勧めします。 臨床薬理学 ]。
薬物/実験室試験の相互作用
ガバペンチンが他の抗てんかん薬に追加された場合、Ames N-Multistix SG ディップスティック テストで尿タンパクの偽陽性の測定値が報告されたため、尿タンパクの存在を判断するには、より特異的なスルホサリチル酸沈殿手順が推奨されます。
薬物乱用と依存
規制物質
ガバペンチンは予定薬ではありません。
乱用
乱用とは、望ましい心理的または生理学的効果を目的として、たとえ 1 回であっても、薬物を意図的かつ非治療的に使用することです。誤用とは、医療従事者が処方した以外の方法で、または処方されていない人が治療目的で薬物を意図的に使用することです。
ガバペンチンは、ベンゾジアゼピン、オピオイド (ミュー、デルタ、カッパ)、またはカンナビノイド 1 受容体部位に対して親和性を示しません。ガバペンチンの誤用および乱用は、市販後の設定および出版された文献で報告されています.これらのレポートに記載されている個人のほとんどは、多剤乱用の履歴がありました。これらの個人の何人かは、承認されていない使用のためにガバペンチンの推奨用量よりも多く服用していました. NEURONTIN を処方するときは、患者の薬物乱用歴を慎重に評価し、ガバペンチンの誤用または乱用の徴候や症状 (例えば、自己用量の増加や薬物探索行動) を観察します。ガバペンチンの乱用の可能性は、人間の研究では評価されていません。
依存
身体依存は、薬物の反復使用に応じた生理学的適応の結果として発生する状態であり、薬物の突然の中止または大幅な減量後の禁断症状や禁断症状として現れます。薬が承認されていない病気の治療に使用されるガバペンチンの推奨用量よりも高い用量を中止した直後に離脱症状を経験した個人のまれな市販後報告があります.このような症状には、ガバペンチンを突然中止した後の動揺、見当識障害、混乱が含まれ、ガバペンチンを再開すると解消しました。ガバペンチンの依存の可能性は、人間の研究では評価されていません。
警告
の一部として含まれています 予防 セクション。
予防
好酸球増加症および全身症状(DRESS)/多臓器過敏症との薬物反応
多臓器過敏症としても知られる好酸球増加症および全身症状(DRESS)を伴う薬物反応が、NEURONTIN で発生しています。これらの反応のいくつかは、致命的または生命を脅かすものです。 DRESS は、典型的には、発熱、発疹、および/またはリンパ節腫脹を呈し、肝炎、腎炎、血液学的異常、心筋炎、または急性ウイルス感染に似ていることもある筋炎などの他の臓器系の関与に関連しています。好酸球増加症がしばしば存在します。この障害はその発現が多様であり、ここに記載されていない他の臓器系が関与している可能性があります。
発疹が明らかでない場合でも、発熱やリンパ節腫脹などの過敏症の初期症状が存在する可能性があることに注意することが重要です。そのような徴候または症状が存在する場合は、患者を直ちに評価する必要があります。徴候または症状の別の病因が確立できない場合は、NEURONTIN を中止する必要があります。
アナフィラキシーと血管性浮腫
NEURONTIN は、初回投与後または治療中のいつでも、アナフィラキシーおよび血管性浮腫を引き起こす可能性があります。報告された症例の兆候と症状には、呼吸困難、唇、喉、舌の腫れ、緊急治療を必要とする低血圧が含まれます.アナフィラキシーまたは血管性浮腫の徴候または症状を経験した場合は、NEURONTIN 300mg の使用を中止し、直ちに医療機関を受診するよう患者に指示する必要があります。
重機の運転と操作への影響
NEURONTINを服用している患者は、NEURONTIN 100mgが運転能力を損なうかどうかを評価するのに十分な経験を積むまで運転しないでください.ガバペンチンのプロドラッグ(ガバペンチン エナカルビル タブレット、徐放性)を用いて実施された運転能力研究では、ガバペンチンが重大な運転障害を引き起こす可能性があることが示されています。処方者と患者は、患者が「自分の運転能力を評価する能力、および NEURONTIN によって引き起こされる傾眠の程度を評価する能力は不完全な場合があります。 NEURONTIN 300mg による治療を開始した後の運転障害の期間は不明です。障害が傾眠に関連しているかどうか[参照 警告と注意事項 または NEURONTIN の他の効果は不明です。
また、NEURONTIN 300mgは傾眠やめまいを引き起こすため[参照 警告と注意事項 ]、患者は、NEURONTIN 300mgがそのようなタスクを実行する能力を損なうかどうかを評価するためにNEURONTINで十分な経験を積むまで、複雑な機械を操作しないようにアドバイスされるべきです.
傾眠/鎮静とめまい
NEURONTIN 100mg を 1 日 1800 mg まで投与された 12 歳以上の患者を対象とした対照てんかん試験では、NEURONTIN を投与された患者では、プラセボと比較して傾眠、めまい、運動失調がより高い割合で報告されました。対して眠気はプラセボで 9%、めまいは薬物で 17%、プラセボは 7%、運動失調は薬物で 13%、プラセボで 6% でした。これらの試験では、眠気、運動失調、および疲労が、12 歳以上の患者における NEURONTIN の中止につながる一般的な副作用であり、これらのイベントでそれぞれ 1.2%、0.8%、および 0.6% が中止されました。
帯状疱疹後神経痛、傾眠、めまいの患者を対象とした対照試験では、1 日あたり最大 3600 mg の用量で NEURONTIN を投与された患者では、プラセボと比較して高い割合で報告されました。眠気についてはプラセボ治療患者の%、めまいについてはプラセボ治療患者の8%に対して、NEURONTIN治療患者では28%でした。めまいと傾眠は、NEURONTINの中止につながる最も一般的な副作用の1つでした.
NEURONTIN 400mgを鎮静作用のある他の薬剤と併用する場合、潜在的な相乗効果のために、眠気や鎮静などの中枢神経系(CNS)抑制の徴候について患者を注意深く観察する必要があります。さらに、モルヒネによる併用治療が必要な患者は、ガバペンチン濃度の上昇を経験する可能性があり、用量調整が必要になる場合があります[参照 薬物相互作用 ]。
禁断症状 急発性けいれん、てんかん重積症
発作の頻度が増える可能性があるため、抗てんかん薬を突然中止すべきではありません。
12 歳以上の患者を対象としたプラセボ対照てんかん研究では、NEURONTIN を投与された患者におけるてんかん重積症の発生率は 0.6% (3/543) であったのに対し、プラセボを投与された患者では 0.5% (2/378) でした。すべてのてんかん研究 (制御および非制御) で NEURONTIN 300mg で治療された 12 歳以上の 2074 人の患者のうち、31 人 (1.5%) がてんかん重積状態でした。これらのうち、14人の患者は、治療前または他の投薬中にてんかん重積症の既往歴がありませんでした.十分な過去のデータが入手できないため、NEURONTIN による治療が、NEURONTIN で治療されていない同様の集団で発生すると予想されるよりも高いまたは低いてんかん重積率と関連しているかどうかを言うことは不可能です.
自殺行動と観念
NEURONTIN 100mgを含む抗てんかん薬(AED)は、これらの薬を服用している患者の自殺念慮または行動のリスクを高めます.適応症を問わず AED で治療された患者は、うつ病、自殺念慮または行動の出現または悪化、および/または気分や行動の異常な変化について監視する必要があります。
11 の異なる AED の 199 のプラセボ対照臨床試験 (単剤療法および補助療法) のプール分析では、AED の 1 つに無作為に割り付けられた患者は、自殺のリスクが約 2 倍 (調整相対リスク 1.8、95% CI: 1.2、2.7) あることが示されました。プラセボにランダム化された患者と比較した思考または行動。治療期間の中央値が 12 週間であったこれらの試験では、27,863 人の AED 治療患者の自殺行動または自殺念慮の推定発生率は 0.43% であったのに対し、16,029 人のプラセボ治療患者では 0.24% であり、約 1 の増加を示しています。治療を受けた 530 人の患者ごとに、自殺念慮または行動のケース。試験で薬物治療を受けた患者では 4 人の自殺があり、プラセボ治療を受けた患者では自殺はありませんでしたが、自殺に対する薬物の影響について結論を出すには数が少なすぎます。
AED による自殺念慮または自殺行動のリスクの増加は、AED による薬物治療を開始してから 1 週間後に観察され、評価された治療期間中持続しました。分析に含まれるほとんどの試験は 24 週間を超えないため、24 週間を超える自殺念慮または自殺行動のリスクは評価できませんでした。
分析されたデータでは、自殺念慮または自殺行動のリスクは一般的に薬物間で一貫していました。さまざまな作用機序の AED でリスクが増加するという発見は、あらゆる適応症に使用されるすべての AED にリスクが適用されることを示唆しています。分析された臨床試験では、リスクは年齢 (5 ~ 100 歳) によって大幅に変化しませんでした。表 2 は、評価されたすべての AED の適応症別の絶対リスクと相対リスクを示しています。
表 2 : プール分析における抗てんかん薬の適応症別のリスク
自殺念慮または自殺行動の相対リスクは、てんかんの臨床試験の方が精神医学的または他の状態の臨床試験よりも高かったが、絶対リスクの差はてんかんと精神医学的適応症で類似していた.
NEURONTIN 100mgまたはその他のAEDの処方を検討している人は、自殺念慮または行動のリスクと未治療の病気のリスクとのバランスを取る必要があります. AED が処方されるてんかんやその他の多くの病気は、それ自体が罹患率と死亡率、および自殺念慮と自殺行動のリスクの増加に関連しています。治療中に自殺念慮や自殺行動が現れた場合、処方者は、特定の患者におけるこれらの症状の出現が治療中の病気に関連している可能性があるかどうかを考慮する必要があります.
患者、その介護者、および家族は、AED が自殺念慮および自殺行動のリスクを高めることを知らされるべきであり、うつ病の徴候および症状の出現または悪化、気分または行動の異常な変化に注意する必要があることを知らされるべきである、または自殺念慮、行動、または自傷行為についての考えの出現。懸念される行動は、直ちに医療提供者に報告する必要があります。
呼吸抑制
オピオイドを含む中枢神経系抑制薬と併用した場合、または潜在的な呼吸障害の状況でガバペンチンを重篤な、生命を脅かす、または致命的な呼吸抑制と関連付ける症例報告、ヒト研究、および動物研究からの証拠があります。 NEURONTIN 100mg を別の中枢神経系抑制薬、特にオピオイドと併用処方するか、NEURONTIN 100mg を基礎に呼吸障害のある患者に処方する決定が下された場合、呼吸抑制と鎮静の症状について患者を監視し、低用量での NEURONTIN の開始を検討する.呼吸抑制の管理には、綿密な観察、支持療法、および中枢神経系抑制薬 (NEURONTIN を含む) の減量または中止が含まれる場合があります。
神経精神医学的副作用(3~12歳の小児患者)
歳から 12 歳のてんかんの小児患者におけるガバペンチンの使用は、CNS 関連の有害反応の発生と関連しています。これらの中で最も重大なものは、次のカテゴリーに分類できます: 1) 情緒不安定 (主に行動上の問題)、2) 攻撃的な行動を含む敵意、3) 集中力の問題および学校の成績の変化を含む思考障害、および 4) 多動症 (主に落ち着きのなさと多動性)。ガバペンチンで治療された患者では、ほとんどの反応は軽度から中等度でした。
歳から 12 歳の小児患者を対象とした対照臨床てんかん試験では、これらの有害反応の発生率は次のとおりでした。敵意 5.2% 対 1.3%。多動症 4.7% 対 2.9%。思考障害は 1.7% 対 0% でした。これらの反応の 1 つである敵意の報告は、深刻であると見なされました。ガバペンチン治療の中止は、情緒不安定と多動症を報告している患者の 1.3% と、敵意と思考障害を報告しているガバペンチン治療患者の 0.9% で発生しました。プラセボ治療を受けた 1 人の患者 (0.4%) は、情緒不安定のために離脱しました。
腫瘍原性の可能性
経口発がん性研究では、ガバペンチンはラットの膵臓腺房細胞腫瘍の発生率を増加させた[参照 非臨床毒性学 ]。この所見の臨床的意義は不明です。ガバペンチンの市販前開発中の臨床経験は、ヒトに腫瘍を誘発する可能性を評価するための直接的な手段を提供していません.
12 歳以上の患者における 2,085 患者年曝露からなるてんかんの補助療法の臨床研究では、10 人の患者で新しい腫瘍が報告されました (2 人の乳房、3 人の脳、2 つの肺、1 つの副腎、1 つの非ホジキン' NEURONTIN の中止中または中止後 2 年以内に 11 人の患者 (脳 9 人、乳房 1 人、前立腺 1 人) で既存の腫瘍が悪化した。 NEURONTIN 100mgで治療されていない同様の集団における背景の発生率と再発の知識がなければ、このコホートで見られる発生率が治療の影響を受けているかどうかを知ることは不可能です.
てんかん患者における原因不明の突然死
NEURONTIN 400mg の市販前開発の過程で、NEURONTIN で治療された 2203 人のてんかん患者のコホート (2103 患者年暴露) で 8 人の突然の原因不明の死亡が記録されました。
これらのいくつかは、例えば夜間に発作が観察されなかった発作関連の死亡を表している可能性があります。これは、患者年あたり 0.0038 人の死亡率を表しています。この割合は、年齢と性別が一致した健康な集団で予想される割合を超えていますが、NEURONTIN を投与されていないてんかん患者の原因不明の突然死の推定発生率の範囲内です (一般集団のてんかん患者の 0.0005 から 0.003 の範囲)。 NEURONTIN プログラムと同様の臨床試験集団を、難治性てんかん患者の 0.005 まで)。したがって、これらの数値が安心できるものか、それともさらなる懸念を引き起こすかは、NEURONTIN コホートに報告された集団の比較可能性と、提供された推定値の正確さに依存します。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
管理情報
NEURONTIN は食事の有無にかかわらず経口摂取することを患者に知らせてください。半分の錠剤を投与するためにスコアリングされた 600 mg または 800 mg の錠剤を分割する場合は、未使用の半分の錠剤を次の用量として服用する必要があることを患者に伝えます。スコアリングされた錠剤を分割してから 28 日以内に使用されなかった半錠を廃棄するように患者に助言します。
好酸球増加症および全身症状(DRESS)/多臓器過敏症との薬物反応
NEURONTIN による治療を開始する前に、発疹またはその他の過敏症の徴候または症状 (発熱やリンパ節腫脹など) が深刻な医学的事象の前兆である可能性があること、および患者がそのような事態が発生した場合は直ちに医師に報告する必要があることを患者に指示してください [ 警告と注意事項 ]。
アナフィラキシーと血管性浮腫
アナフィラキシーまたは血管性浮腫の徴候または症状が現れた場合は、NEURONTIN 300mg の使用を中止し、医療機関を受診するよう患者に助言してください。 警告と注意事項 ]。
めまいと眠気、重機の運転と操作への影響
NEURONTIN 100mg がめまい、傾眠、およびその他の症状や中枢神経系抑制の徴候を引き起こす可能性があることを患者に助言してください。鎮静作用のある他の薬は、これらの症状を悪化させる可能性があります。したがって、患者の障害のレベルを判断する能力は信頼できない可能性があるため、NEURONTIN が精神的および/または運動能力に悪影響を与えるかどうかを判断するのに十分な経験を積むまで、車を運転したり、他の複雑な機械を操作したりしないようにアドバイスしてください。この効果がどのくらい持続するかは不明であることを患者に伝えます[ 警告と注意事項 と 警告と注意事項 ]。
自殺思考と行動
NEURONTIN を含む AED が自殺念慮や自殺行動のリスクを高める可能性があることを、患者、その介護者、および家族に相談してください。うつ病の症状の出現または悪化、気分や行動の異常な変化、自殺念慮、行動、または自傷行為についての考えの出現に注意する必要があることを患者に助言します。気になる行動をすぐに医療提供者に報告するように患者に指示する [参照 警告と注意事項 ]。
呼吸抑制
呼吸抑制のリスクについて患者に知らせます。中枢神経系抑制薬(オピオイド鎮痛薬など)を併用している場合や、基礎に呼吸障害がある場合にリスクが最大になるという情報を含めてください。患者に呼吸抑制を認識する方法を教え、それが発生した場合はすぐに医師の診察を受けるようにアドバイスします[参照 警告と注意事項 ]。
妊娠中の使用
治療中に妊娠した場合、または妊娠する予定がある場合は医師に通知し、治療中に授乳中または授乳する予定がある場合は医師に通知するように患者に指示します[参照 特定の集団での使用 ]。
患者が妊娠した場合は、NAAED 妊娠登録に登録するよう患者に勧めます。このレジストリは、妊娠中の抗てんかん薬の安全性に関する情報を収集しています。登録するには、患者はフリーダイヤル 1-888-233-2334 に電話することができます [参照 特定の集団での使用 ]。
この製品のラベルは更新されている可能性があります。最新の処方情報については、www.pfizer.com をご覧ください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
ガバペンチンは、2 年間の発がん性試験でマウスとラットに経口投与されました。 2000 mg/kg/日までの用量で投与されたマウスでは、薬物に関連した発がん性の証拠は観察されませんでした。 2000 mg/kg では、マウスの血漿ガバペンチン暴露 (AUC) は、3600 mg/日の MRHD でのヒトの約 2 倍でした。ラットでは、最高用量 (2000 mg/kg) を投与した雄ラットで膵腺房細胞腺腫および癌の発生率の増加が認められたが、250 または 1000 mg/kg/日の用量では認められなかった。 1000 mg/kg で、ラットの血漿ガバペンチン暴露 (AUC) は、MRHD でのヒトの約 5 倍でした。
ラットにおけるガバペンチン誘発性膵臓発がんのメカニズムを調査するために設計された研究は、ガバペンチンが in vitro でラット膵臓腺房細胞の DNA 合成を刺激し、したがって、マイトジェン活性を増強することによって腫瘍プロモーターとして作用している可能性があることを示しています。ガバペンチンが他の細胞タイプまたはヒトを含む他の種の細胞増殖を増加させる能力を持っているかどうかは不明です.
突然変異誘発
ガバペンチンは、in vitro (エイムズ試験、チャイニーズハムスター肺細胞における HGPRT 前方突然変異試験) および in vivo (チャイニーズハムスター骨髄における染色体異常および小核試験、マウス小核、ラット肝細胞における不定期 DNA 合成) で、変異原性または遺伝毒性の可能性を示さなかった。アッセイ。
生殖能力の障害
2000 mg/kg までの用量のラットでは、受胎能または生殖に対する悪影響は観察されませんでした。 2000 mg/kg で、ラットの血漿ガバペンチン暴露 (AUC) は、MRHD でのヒトの約 8 倍です。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中に NEURONTIN 300mg などの抗てんかん薬 (AED) に暴露された女性の妊娠転帰を監視する妊娠暴露登録があります。妊娠中に NEURONTIN を服用している女性は、フリーダイヤル 1-888-233-2334 に電話するか、http://www.aedpregnancyregistry.org/ にアクセスして、北米抗てんかん薬 (NAAED) 妊娠登録に登録することをお勧めします。
リスクの概要
妊娠中の女性における NEURONTIN の使用に関連する発達上のリスクに関する適切なデータはありません。マウス、ラット、およびウサギを対象とした非臨床試験では、ガバペンチンは、臨床的に使用されている用量と同等またはそれよりも低い用量で妊娠動物に投与した場合、発生毒性を示しました (胎児の骨格および内臓の異常が増加し、胚胎児死亡率が増加しました)。 データ ]。
米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。示された集団の重大な先天性欠損症および流産の背景リスクは不明です。
データ
動物データ
器官形成期に妊娠マウスにガバペンチン (500、1000、または 3000 mg/kg/日) を経口投与した場合、胎児毒性 (骨格変化の発生率の増加) が 2 つの最高用量で観察されました。マウスにおける胚胎児発生毒性の無影響用量 (500 mg/kg/日) は、体表面積 (mg/m²) に基づくヒトの最大推奨用量 (MRHD) である 3600 mg よりも少ない。
妊娠中にラットにガバペンチン (500 ~ 2000 mg/kg/日) を経口投与した研究では、すべての用量で子孫の発育に対する悪影響 (水尿管および/または水腎症の発生率の増加) が観察されました。テストされた最低用量は、mg/m² ベースで MRHD に似ています。
妊娠中のウサギを器官形成期にガバペンチンで処理すると、試験したすべての用量 (60、300、または 1500 mg/kg) で胚胎児死亡率の増加が観察されました。テストされた最低用量は、mg/m² ベースで MRHD 未満です。
発表された研究では、ガバペンチン (400 mg/kg/日) が、げっ歯類におけるシナプス形成の期間 (ヒトの妊娠の最後の三半期に相当) である生後最初の週に、新生児マウスに腹腔内注射によって投与されました。ガバペンチンは、無傷のマウスの脳における神経シナプス形成の著しい減少と、シナプス修復のマウスモデルにおける異常な神経シナプス形成を引き起こしました。ガバペンチンは、ニューロンのシナプス形成に関与する受容体である電位活性化カルシウム チャネルの α2δ サブユニットの活性を阻害することが in vitro で示されています。これらの所見の臨床的意義は不明です。
授乳
リスクの概要
ガバペンチンは、経口投与後に母乳中に分泌されます。母乳で育てられた乳児および乳生産への影響は不明です。母乳育児の発達上および健康上の利点は、NEURONTIN に対する母親の臨床的必要性、および NEURONTIN または母体の基礎疾患による母乳育児への潜在的な悪影響とともに考慮されるべきです。
小児用
小児患者の帯状疱疹後神経痛の管理における NEURONTIN 600mg の安全性と有効性は確立されていません。
3歳未満の小児患者の部分発作の治療における補助療法としての安全性と有効性は確立されていません[ 臨床研究 ]。
高齢者の使用
帯状疱疹後神経痛患者の対照臨床試験で NEURONTIN で治療された患者の総数は 336 人で、そのうち 102 人 (30%) は 65 歳から 74 歳で、168 人 (50%) は 75 歳以上でした。同じ投与量を受けた若い患者と比較して、75 歳以上の患者ではより大きな治療効果がありました。ガバペンチンはほとんど腎排泄によって排除されるため、75 歳以上の患者で観察されたより大きな治療効果は、加齢に伴う腎機能の低下に起因する所定の用量でのガバペンチン曝露の増加の結果である可能性があります。ただし、他の要因を排除することはできません。副作用の種類および発現率は、年齢とともに増加する傾向にあった末梢性浮腫および運動失調を除いて、年齢層全体で同様でした。
てんかんにおける NEURONTIN の臨床研究には、65 歳以上の被験者が十分に含まれておらず、若い被験者と異なる反応を示すかどうかを判断できませんでした。他の報告された臨床経験では、年配の患者と若い患者の間の反応の違いは確認されていません。一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
この薬は腎臓から実質的に排泄されることが知られており、腎機能が低下している患者では、この薬に対する毒性反応のリスクが高くなる可能性があります。高齢患者は腎機能が低下している可能性が高いため、用量選択には注意が必要であり、これらの患者のクレアチニンクリアランス値に基づいて用量を調整する必要があります[参照 投薬と管理 、 有害反応 、 と 臨床薬理学 ]。
腎障害
腎機能が低下している成人患者では用量調節が必要である[参照 投薬と管理 と 臨床薬理学 ]。腎不全の小児患者は研究されていません。
血液透析を受けている患者では投与量の調整が必要です。 投薬と管理 と 臨床薬理学 ]。
過剰摂取
動物における急性毒性の兆候には、運動失調、呼吸困難、眼瞼下垂、鎮静、活動低下、または興奮が含まれます。
NEURONTIN 300mg の急性経口過剰摂取が報告されています。症状には、複視、振戦、ろれつが回らない、眠気、精神状態の変化、めまい、無気力、下痢などがあります。 NEURONTIN 400mgを単独で、または他のCNS抑制剤と組み合わせて過剰摂取した場合、致命的な呼吸抑制が報告されています.
ガバペンチンは血液透析で除去できます。
過度の暴露が発生した場合は、毒物管理センター (1-800-222-1222) に電話してください。
禁忌
NEURONTIN は、薬物またはその成分に対して過敏症を示した患者には禁忌です。
臨床薬理学
作用機序
ガバペンチンが鎮痛作用と抗てんかん作用を生み出す正確なメカニズムは不明です。ガバペンチンは構造的に神経伝達物質のガンマアミノ酪酸 (GABA) に関連していますが、GABA の結合、取り込み、または分解には影響しません。 in vitro 研究では、ガバペンチンが電位活性化カルシウム チャネルの α2δ サブユニットに高い親和性で結合することが示されています。しかし、この結合とガバペンチンの治療効果との関係は不明です。
薬物動態
ガバペンチン投与後のすべての薬理学的作用は、親化合物の活性によるものです。ガバペンチンはヒトではほとんど代謝されません。
経口バイオアベイラビリティ
ガバペンチンのバイオアベイラビリティは用量に比例しません。すなわち、用量が増加するにつれて、バイオアベイラビリティが減少します。ガバペンチンのバイオアベイラビリティは、900、1200、2400、3600、および 4800 mg/日を 3 回に分けて投与した後、それぞれ約 60%、47%、34%、33%、および 27% です。食事は、ガバペンチンの吸収率と吸収範囲にわずかな影響しか与えません (AUC と Cmax が 14% 増加)。
分布
ガバペンチンの 3% 未満が血漿タンパク質に結合して循環します。 150 mg の静脈内投与後のガバペンチンの見かけの分布体積は 58±6 L (平均 ± SD) です。てんかん患者では、脳脊髄液中のガバペンチンの定常状態投与前 (Cmin) 濃度は、対応する血漿濃度の約 20% でした。
排除
ガバペンチンは、未変化の薬物として腎排泄により全身循環から排除されます。ガバペンチンはヒトではほとんど代謝されません。
ガバペンチン排泄半減期は 5 ~ 7 時間であり、用量または複数回の投薬によって変化することはありません。ガバペンチン排出速度定数、血漿クリアランス、および腎クリアランスは、クレアチニンクリアランスに正比例します。高齢患者や腎機能障害のある患者では、ガバペンチンの血漿クリアランスが低下します。ガバペンチンは、血液透析によって血漿から除去できます。
特定の集団
年
年齢の影響は、20 ~ 80 歳の被験者で調査されました。ガバペンチンの見かけの経口クリアランス (CL/F) は年齢が上がるにつれて減少し、30 歳未満の約 225 mL/min から 70 歳以上の約 125 mL/min に減少しました。体表面積で調整された腎クリアランス(CLr)とCLrも年齢とともに低下しました。しかし、年齢に伴うガバペンチンの腎クリアランスの低下は、主に腎機能の低下によって説明できます。 [見る 投薬と管理 と 特定の集団での使用 ]。
性別
男性と女性におけるガバペンチンの薬物動態を比較するための正式な研究は実施されていませんが、男性と女性の薬物動態パラメーターは類似しており、大きな性差はないようです。
人種
人種による薬物動態の違いは研究されていません。ガバペンチンは主に腎臓から排泄され、クレアチニンクリアランスに重要な人種差がないため、人種による薬物動態の違いは予想されません。
小児科
ガバペンチンの薬物動態は、約 10 mg/kg の用量で生後 1 か月から 12 歳までの 48 人の小児被験者で測定されました。ピーク血漿濃度は全年齢層で類似しており、投与後 2 ~ 3 時間で発生しました。一般に、生後 1 か月から 5 歳未満の小児対象者は、5 歳以上の対象者よりも約 30% 低い曝露 (AUC) を達成しました。したがって、体重あたりの正規化された口腔クリアランスは、年少の子供の方が高かった。ガバペンチンの見かけの経口クリアランスは、クレアチニンクリアランスに正比例していました。ガバペンチン排出半減期は平均 4.7 時間で、調査対象の年齢層全体で同様でした。
生後 1 か月から 13 歳までの 253 人の小児被験者で集団薬物動態分析を実施しました。患者は 10 ~ 65 mg/kg/日を 1 日 3 回投与されました。見かけの経口クリアランス (CL/F) はクレアチニン クリアランスに正比例し、この関係は単回投与後も定常状態でも同様でした。体重あたりで正規化すると、5 歳以上の子供で観察されたものと比較して、5 歳未満の子供でより高い口腔クリアランス値が観察されました。クリアランスは、1 歳未満の乳児では非常にばらつきがありました。 5 歳以上の小児患者で観察された正規化された CL/F 値は、単回投与後に成人で観察された値と一致していました。体重あたりの正規化された分布の口腔容積は、年齢範囲全体で一定でした。
これらの薬物動態データは、3 歳および 4 歳のてんかんの小児患者における有効な 1 日用量は、ガバペンチン 30 mg/kg を投与された 5 歳以上の患者で達成される平均血漿濃度と同様の平均血漿濃度を達成するために 40 mg/kg/日であるべきであることを示しています。 kg/日 [参照 投薬と管理 ]。
腎障害のある成人患者
腎機能障害 (平均クレアチニンクリアランス範囲 13 ~ 114 mL/min) の被験者 (N=60) に、400 mg のガバペンチンを単回経口投与しました。ガバペンチンの平均半減期は、約 6.5 時間 (クレアチニン クリアランスが 60 mL/分を超える患者) から 52 時間 (クレアチニン クリアランスが 30 mL/分未満) の範囲で、ガバペンチンの腎クリアランスは約 90 mL/分 (> 60 mL/分) でした。グループ) を約 10 mL/min ( 投薬と管理 と 特定の集団での使用 ]。腎不全の小児患者は研究されていません。
血液透析
無尿の成人被験者 (N=11) を対象とした研究では、非透析日のガバペンチンの明らかな消失半減期は約 132 時間でした。透析中、ガバペンチンの見かけの半減期は 3.8 時間に短縮されました。このように、血液透析は、無尿患者のガバペンチン排泄に有意な影響を与える [参照 投薬と管理 と 特定の集団での使用 ]。
肝疾患
ガバペンチンは代謝されないため、肝障害のある患者を対象とした試験は実施されていません。
薬物相互作用
インビトロ研究
アイソフォーム選択マーカー基質およびヒト肝ミクロソーム調製物を使用して、ガバペンチンが薬物および生体異物代謝を媒介する主要なシトクロム P450 酵素 (CYP1A2、CYP2A6、CYP2C9、CYP2C19、CYP2D6、CYP2E1、および CYP3A4) を阻害する可能性を調査するために、in vitro 研究が実施されました。 .試験した最高濃度 (171 mcg/mL; 1 mM) でのみ、アイソフォーム CYP2A6 のわずかな阻害度 (14% から 30%) が観察されました。観察されたアイソフォーム CYP2A6 の最大 171 mcg/mL (3600 mg/日で C の約 15 倍) までのガバペンチン濃度で、試験した他のアイソフォームのいずれの阻害も観察されませんでした。 171 mcg/mL (3600 mg/日での Cmax の約 15 倍) までのガバペンチン濃度では、試験した他のアイソフォームの阻害は観察されませんでした。
インビボ研究
このセクションで説明する薬物相互作用のデータは、健康な成人およびてんかんの成人患者を対象とした研究から得られたものです。
フェニトイン
少なくとも 2 か月間フェニトイン単剤療法を維持したてんかん患者 (N=8) における NEURONTIN 400mg の単回 (400 mg) および複数回投与 (400 mg を 1 日 3 回) の研究では、ガバペンチンは定常状態のトラフに影響を与えませんでした。フェニトインとフェニトインの血漿濃度は、ガバペンチンの薬物動態に影響を与えませんでした。
カルバマゼピン
定常状態のトラフ血漿カルバマゼピンおよびカルバマゼピン 10, 11 エポキシド濃度は、同時のガバペンチン (400 mg 1 日 3 回; N=12) 投与の影響を受けませんでした。同様に、ガバペンチンの薬物動態は、カルバマゼピン投与によって変化しなかった。
バルプロ酸
ガバペンチン投与前および同時投与中の平均定常状態トラフ血清バルプロ酸濃度 (400 mg 1 日 3 回、N = 17) に差はなく、ガバペンチンの薬物動態パラメーターもバルプロ酸の影響を受けませんでした。
フェノバルビタール
フェノバルビタールまたはガバペンチン (300 mg を 1 日 3 回、N = 12) の定常状態の薬物動態パラメーターの推定値は、薬物を単独で投与しても一緒に投与しても同じです。
ナプロキセン
ナプロキセン ナトリウム カプセル (250 mg) と NEURONTIN (125 mg) の同時投与 (N=18) は、ガバペンチンの吸収量を 12% から 15% 増加させるようです。ガバペンチンは、ナプロキセンの薬物動態パラメーターに影響を与えませんでした。これらの用量は、両方の薬剤の治療用量よりも低くなっています。どちらの薬剤も推奨用量範囲内での相互作用の大きさは不明です。
ヒドロコドン
NEURONTIN (125 ~ 500 mg; N=48) の同時投与は、ヒドロコドン (10 mg; N=50) の Cmax および AUC 値を、ヒドロコドン単独の投与と比較して用量依存的に減少させます。 CmaxおよびAUC値は、ニューロンチン125mgの投与後にそれぞれ3%から4%低くなり、ニューロンチン500mgの投与後にそれぞれ21%から22%低くなる。この相互作用のメカニズムは不明です。ヒドロコドンは、ガバペンチンの AUC 値を 14% 増加させます。他の用量での相互作用の大きさは不明です。
モルヒネ
ある文献記事では、600 mg の NEURONTIN カプセルの 2 時間前に 60 mg の制御放出モルヒネ カプセルを投与した場合 (N = 12)、平均ガバペンチン AUC が、モルヒネなしで投与されたガバペンチンと比較して 44% 増加したことが報告されています。モルヒネの薬物動態パラメーター値は、モルヒネの 2 時間後に NEURONTIN を投与しても影響を受けませんでした。他の用量での相互作用の大きさは不明です。
シメチジン
シメチジン 300 mg を 1 日 4 回 (N=12) 存在させると、ガバペンチンの見かけの平均経口クリアランスは 14% 低下し、クレアチニンクリアランスは 10% 低下しました。したがって、シメチジンは、腎機能の内因性マーカーであるガバペンチンとクレアチニンの両方の腎排泄を変化させるように見えました。シメチジンによるガバペンチンの排泄のこのわずかな減少は、臨床的に重要であるとは予想されていません。シメチジンに対するガバペンチンの効果は評価されなかった。
経口避妊薬
AUC と半減期に基づくと、酢酸ノルエチンドロン 2.5 mg とエチニル エストラジオール 50 mcg を含む錠剤を投与した後のノルエチンドロンとエチニル エストラジオールの反復投与薬物動態プロファイルは、ガバペンチン (400 mg 1 日 3 回; N=13)。ガバペンチンと併用した場合、ノルエチンドロンの Cmax は 13% 高かった。この相互作用は、臨床的に重要であるとは考えられていません。
制酸剤(マーロックス®)(水酸化アルミニウム、水酸化マグネシウム)
水酸化マグネシウムと水酸化アルミニウムを含む制酸剤 (Maalox®) は、ガバペンチン (N=16) の平均バイオアベイラビリティーを約 20% 低下させました。このバイオアベイラビリティの低下は、マーロックスの 2 時間後にガバペンチンを投与した場合、約 10% でした。
プロベネシド
プロベネシドは尿細管分泌の遮断薬です。プロベネシドの有無にかかわらず、ガバペンチンの薬物動態パラメーターは同等でした。これは、ガバペンチンがプロベネシドによってブロックされた経路によって尿細管分泌を受けないことを示しています。
臨床研究
帯状疱疹後神経痛
NEURONTIN は、帯状疱疹後神経痛 (PHN) の管理について、2 つの無作為二重盲検プラセボ対照多施設研究で評価されました。治療意図 (ITT) 集団は、帯状ヘルペス皮膚発疹の治癒後 3 か月以上痛みを伴う合計 563 人の患者で構成されていました (表 6)。
表 6. 対照 PHN 研究: 期間、投与量、および患者数
各研究には、7 週間または 8 週間の二重盲検期 (3 週間または 4 週間の滴定と 4 週間の固定用量) が含まれていました。患者は治療を開始し、ガバペンチンを 3 日間で最大 900 mg/日まで漸増しました。その後、3~4 週間かけて 600~1200 mg/日ずつ 3~7 日間隔で目標用量まで用量を滴定しました。患者は、0 (痛みなし) から 10 (考えられる最悪の痛み) までの 11 点の数値による痛みの評価スケールを使用して、毎日の日記に痛みを記録しました。無作為化には、ベースライン中の平均疼痛スコアが少なくとも 4 である必要がありました。分析は、ITT集団(試験薬を少なくとも1回投与された無作為化されたすべての患者)を使用して実施された。
両方の研究は、テストされたすべての用量でプラセボと比較して有効性を示しました。
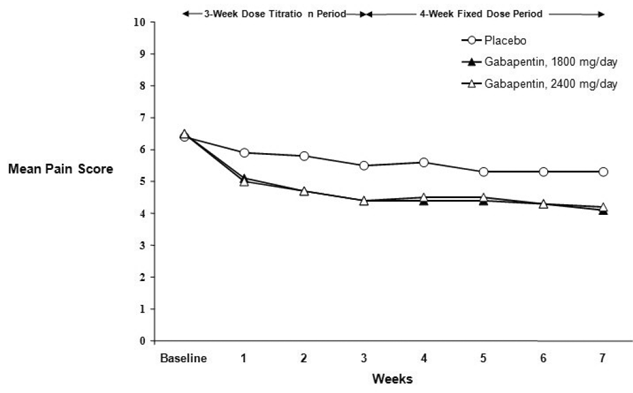
週平均疼痛スコアの減少は、両方の研究で 1 週目までに見られ、治療終了まで維持されました。同等の治療効果が、すべての実薬治療群で観察されました。薬物動態/薬力学モデリングにより、すべての用量にわたる有効性の確証が得られました。図 1 と 2 は、研究 1 と 2 の経時的な痛み強度スコアを示しています。
図 1. 週平均疼痛スコア (ITT 集団で観察された症例): 研究 1
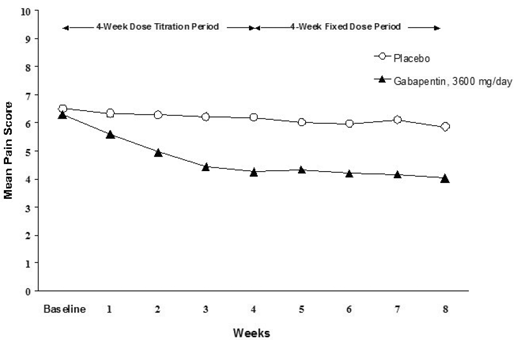
図 2. 週平均疼痛スコア (ITT 集団で観察された症例): 研究 2
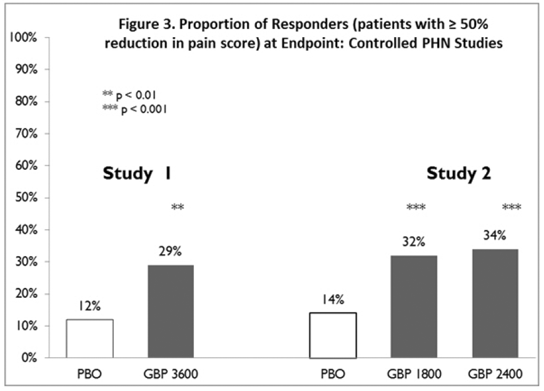
レスポンダー (ベースラインと比較してエンドポイントの疼痛スコアが少なくとも 50% 改善したと報告した患者) の割合を、各研究について計算しました (図 3)。
図 3. エンドポイントでのレスポンダー (疼痛スコアが 50% 以上減少した患者) の割合: コントロール PHN 研究
部分発作に対するてんかん(補助療法)
NEURONTIN 400mg の補助療法 (他の抗てんかん薬に追加) としての有効性は、難治性部分発作を有する成人および小児患者 (3 歳以上) を対象とした多施設プラセボ対照二重盲検並行群臨床試験で確立されました。
705 人の患者 (12 歳以上) で実施された 3 つの試験と 247 人の小児患者 (3 歳から 12 歳まで) で実施された 1 つの試験で、有効性の証拠が得られました。登録された患者は、治療レベルの抗てんかん薬を 1 つ以上服用しているにもかかわらず、1 か月に少なくとも 4 回の部分発作の病歴があり、12 週間のベースライン期間 (小児科の研究では 6 週間) の間、確立された抗てんかん薬レジメンで観察されました。忍耐)。 1 か月に少なくとも 2 回 (一部の研究では 4 回) の発作が継続している患者では、12 週間の治療期間中に NEURONTIN 300mg またはプラセボが既存の治療に追加されました。有効性は主に、ベースラインから治療までに発作頻度が 50% 以上減少した患者の割合 (「レスポンダー率」) と、応答率と呼ばれる派生測定値 (T - B)/(T + B)、ここで、B は患者のベースライン発作頻度、T は治療中の患者の発作頻度です。応答率は、-1 から +1 の範囲に分布しています。 0 の値は変化がないことを示し、発作が完全になくなると値は -1 になります。発作率の増加は正の値を与えるでしょう。 -0.33 の反応率は、発作頻度の 50% の減少に相当します。以下に示す結果は、別段の指示がない限り、各研究における治療目的の集団(何らかの用量の治療を受けたすべての患者)のすべての部分発作に関するものです。
つの研究では、NEURONTIN 1200 mg/日を 3 回に分けてプラセボと比較しました。レスポンダー率は、NEURONTIN 600mg グループで 23% (14/61)、プラセボ グループで 9% (6/66) でした。グループ間の差は統計的に有意でした。応答率も、プラセボ群 (-0.044) よりも NEURONTIN 群 (-0.199) の方が優れており、この差は統計的有意性も達成しました。
つ目の研究では、主に NEURONTIN 1200 mg/日を 3 回に分けて (N=101)、プラセボ (N=98) と比較しました。さらなる少量のニューロンチン 300 mg 投与群 (600 mg/日、N=53; 1800 mg/日、N=54) も、用量反応に関する情報を得るために研究されました。 NEURONTIN 1200 mg/日群 (16%) のレスポンダー率は、プラセボ群 (8%) より高かったが、その差は統計的に有意ではなかった. 600 mg でのレスポンダー率 (17%) もプラセボよりも有意に高くはありませんでしたが、1800 mg グループでのレスポンダー率 (26%) はプラセボ率よりも統計的に有意に優れていました。応答率は、NEURONTIN 1200 mg/日群 (-0.103) の方がプラセボ群 (-0.022) よりも優れていました。しかし、この差も統計的に有意ではありませんでした (p = 0.224)。 NEURONTIN 600 mg/日グループ (-0.105) および 1800 mg/日グループ (-0.222) では、1200 mg/日グループよりも良好な反応が見られ、1800 mg/日グループはプラセボと比較して統計的有意性を達成しました。グループ。
つ目の研究では、NEURONTIN 900 mg/日を 3 回に分けて投与した場合 (N=111) とプラセボ (N=109) を比較しました。追加の NEURONTIN 1200 mg/日投与群 (N=52) は、用量反応データを提供しました。 NEURONTIN 900 mg/日投与群 (22%) では、プラセボ投与群 (10%) と比較して、レスポンダー率に統計的に有意な差が見られました。 NEURONTIN 900 mg/日投与群 (-0.119) は、プラセボ投与群 (-0.027) よりも反応率が統計的に有意に優れていました。
二次的な全般性強直間代発作の予防に対する NEURONTIN 300mg の効果を調べるために、各研究でも分析が行われました。 3 つのプラセボ対照研究すべてで、ベースラインまたは治療期間のいずれかで、二次的な全般性強直間代発作を経験した患者がこれらの分析に含まれました。 NEURONTIN がプラセボと比較して統計的に有意な優位性を示し、ほぼすべての比較で好ましい傾向を示したいくつかの応答比の比較がありました。
3 つすべての研究とすべての用量 (N=162、NEURONTIN; N=89、プラセボ) からの結合データを使用したレスポンダー率の分析でも、二次的全般性強直間代発作の頻度を減らす点で、プラセボよりも NEURONTIN の方が有意な利点があることが示されました。
つの対照試験のうち 2 つで、NEURONTIN が複数回投与されました。各研究内で、結果は用量に対する反応の一貫した増加を示しませんでした。しかし、研究全体を見ると、用量の増加に伴い有効性が増加する傾向が明らかです (図 4 を参照)。
図 4. NEURONTIN 600mg を投与された患者のレスポンダー率は、用量および研究ごとにプラセボとの差として表されます。部分発作を伴う 12 歳以上の患者における補助療法研究
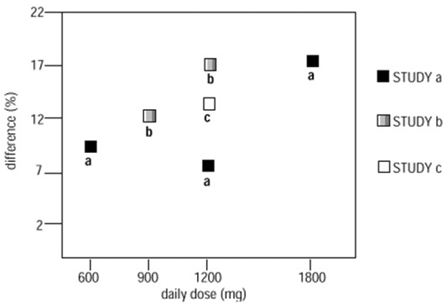
図では、ベースラインからの発作頻度の 50% 以上の減少を達成するガバペンチンとプラセボに割り当てられた患者の割合の差に関して Y 軸で測定された治療効果の大きさが、投与されたガバペンチンの 1 日用量に対してプロットされています。 (X 軸)。
性別による正式な分析は行われていませんが、臨床試験 (男性 398 人、女性 307 人) から得られた反応 (反応率) の推定値は、重要な性差が存在しないことを示しています。年齢が NEURONTIN に対する反応に影響を与えることを示す一貫したパターンはありませんでした。白人以外の人種の患者数は不十分であり、人種グループ間で有効性を比較することはできませんでした。
3 歳から 12 歳までの小児患者を対象とした 4 番目の研究では、25 ~ 35 mg/kg/日の NEURONTIN (N=118) とプラセボ (N=127) が比較されました。治療意図集団におけるすべての部分発作について、応答率はプラセボ群 (-0.079) よりも NEURONTIN 群 (-0.146) の方が統計的に有意に優れていました。同じ集団で、NEURONTIN の応答率 (21%) はプラセボ (18%) と有意な差はありませんでした。
生後 1 か月から 3 歳の小児患者を対象とした研究では、少なくとも 1 つの市販の抗てんかん薬を服用しており、治療中に少なくとも 1 回部分発作を起こした患者において、40 mg/kg/日 NEURONTIN (N=38) とプラセボ (N=38) を比較しました。スクリーニング期間(ベースライン前の2週間以内)。患者は、最大 48 時間のベースラインと最大 72 時間の二重盲検ビデオ EEG モニタリングを受けて、発作の発生を記録およびカウントしました。応答率または応答者率のいずれにおいても、治療間で統計的に有意な差はありませんでした。
患者情報
ニューロンチン (Neu ron' tin) (ガバペンチン) カプセル、錠剤、内服液
NEURONTIN について知っておくべき最も重要な情報は何ですか?
最初に医療提供者に相談せずに NEURONTIN 300mg の服用を中止しないでください。
NEURONTIN を突然停止すると、重大な問題が発生する可能性があります。
NEURONTIN 400mg は、次のような重大な副作用を引き起こす可能性があります。
1.自殺願望。他の抗てんかん薬と同様に、NEURONTIN 100mg は、500 人に 1 人という非常に少数の人々に自殺念慮または自殺行動を引き起こす可能性があります。
これらの症状のいずれかがある場合、特にそれらが新しい場合、悪化している場合、または心配している場合は、すぐに医療提供者に連絡してください。
- 自殺や死についての考え
- 自殺しようとする
- 新しいまたは悪化したうつ病
- 新しいまたは悪化した不安
- 動揺または落ち着きがない
- パニック発作
- 寝つきが悪い(不眠症)
- 新しいまたは悪化した過敏症
- 攻撃的、怒っている、または暴力的である
- 危険な衝動で行動する
- 活動と会話の極端な増加 (躁病)
- 行動や気分のその他の異常な変化
自殺念慮や自殺行動の初期症状を観察するにはどうすればよいですか?
- 気分、行動、思考、または感情の変化、特に突然の変化に注意してください。
- 医療提供者とのすべてのフォローアップ訪問は、予定どおりに行ってください。
特に症状が心配な場合は、必要に応じて訪問の合間に医療提供者に電話してください。
最初に医療提供者に相談することなく、NEURONTIN の服用を中止しないでください。
- NEURONTIN 100mg を突然中止すると、深刻な問題が発生する可能性があります。てんかんを患っている患者が発作薬を突然中止すると、発作が止まらないことがあります(てんかん重積症)。
- 自殺念慮や自殺行動は、薬以外のものが原因である可能性があります。自殺の考えや行動がある場合、医療提供者は他の原因をチェックすることがあります。
2. 行動と考え方の変化 - 3 歳から 12 歳の子供に NEURONTIN 100mg を使用すると、感情の変化、攻撃的な行動、集中力の問題、落ち着きのなさ、学業成績の変化、多動を引き起こす可能性があります。
3. NEURONTIN は深刻な、または生命を脅かすアレルギー反応を引き起こす可能性があります 皮膚や、肝臓や血液細胞などの体の他の部分に影響を与える可能性があります。これにより、入院したり、NEURONTIN を中止したりする可能性があります。 NEURONTIN によって引き起こされるアレルギー反応を伴う発疹がある場合とない場合があります。次のいずれかの症状がある場合は、すぐに医療提供者に連絡してください。
- 皮膚発疹
- 蕁麻疹
- 呼吸困難
- 熱
- 消えない腫れた腺
- 顔、唇、のど、または舌の腫れ
- 皮膚または白目の黄変
- 異常なあざまたは出血
- 重度の疲労または衰弱
- 予想外の筋肉痛
- 頻繁な感染
これらの症状は、深刻な反応の最初の兆候である可能性があります。医療提供者は、NEURONTIN の服用を継続すべきかどうかを判断するために、あなたを診察する必要があります。
4. 深刻な呼吸の問題。 NEURONTIN を重度の眠気や意識の低下を引き起こす可能性のある他の薬と併用した場合、またはすでに呼吸障害のある人が NEURONTIN を服用した場合、深刻な呼吸障害が発生する可能性があります。 NEURONTIN 300mgの開始時または用量の増加時に、眠気の増加または呼吸の減少に注意してください.呼吸の問題が発生した場合は、すぐに助けを求めてください。
ニューロンチン400mgとは?
NEURONTIN 400mg は、以下の治療に使用される処方薬です。
- 成人の帯状疱疹(帯状疱疹感染後に生じる痛みを伴う発疹)の治癒に続く、損傷した神経による痛み(帯状疱疹後痛)。
- 成人および発作のある 3 歳以上の子供の他の薬と一緒に服用した場合の部分発作。
ニューロンチンを服用してはいけない人
ガバペンチンまたは NEURONTIN の他の成分にアレルギーがある場合は、NEURONTIN を服用しないでください。 NEURONTIN の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
NEURONTIN 300mg を服用する前に医療提供者に何を伝えるべきですか?
NEURONTIN 400mg を服用する前に、次の場合は医療提供者に伝えてください。
- 腎臓に問題がある、またはあったことがある、または血液透析を受けている
- うつ病、気分の問題、または自殺念慮または行動を持っている、または持っていた
- 糖尿病を持っている
- 呼吸に問題がある
- 妊娠している、または妊娠する予定がある。 NEURONTIN が胎児に害を及ぼすかどうかはわかっていません。 NEURONTIN の服用中に妊娠した場合は、すぐに医療提供者に伝えてください。妊娠中に NEURONTIN 100mg を服用するかどうかは、あなたと担当の医療提供者が決定します。 妊娠登録: NEURONTIN の服用中に妊娠した場合は、北米抗てんかん薬 (NAAED) 妊娠登録簿への登録について医療提供者に相談してください。このレジストリの目的は、妊娠中の抗てんかん薬の安全性に関する情報を収集することです。このレジストリに登録するには、1-888-233-2334 に電話してください。
- 授乳中または授乳を計画している。 NEURONTIN は母乳に移行する可能性があります。 NEURONTIN を服用している間、赤ちゃんにどのように食事を与えるかは、あなたとかかりつけの医療従事者が決定する必要があります。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。特に、オピオイド鎮痛薬(オキシコドンなど)、不安症(ロラゼパムなど)または不眠症(ゾルピデムなど)の薬、または眠くなる薬を服用している場合は、医療提供者に伝えてください.
これらの薬を NEURONTIN と一緒に服用すると、めまい、眠気、または呼吸障害の可能性が高くなる可能性があります。
NEURONTIN 100mg を特定の他の薬と一緒に服用すると、副作用を引き起こしたり、薬の効果に影響を与えたりする可能性があります。医療提供者に相談せずに、他の薬を開始または停止しないでください。
服用している薬を知る。それらのリストを保管し、新しい薬を入手するときに医療提供者や薬剤師に見せてください.
NEURONTIN 400mg の服用方法は?
- NEURONTIN を処方どおりに服用してください。 NEURONTIN 600mg の摂取量は、かかりつけの医療提供者が教えてくれます。
- 医療提供者に相談せずに NEURONTIN の用量を変更しないでください。
- NEURONTIN 錠剤を服用し、錠剤を半分に割った場合は、未使用の半分の錠剤を次回の予定用量で服用する必要があります。壊れてから 28 日以内に使用されなかった半分の錠剤は廃棄する必要があります。
- NEURONTINカプセルを水で服用してください。
- NEURONTIN 錠剤は、食事の有無にかかわらず服用できます。 Maalox®、Mylanta®、Gelusil®、Gaviscon®、または Di-Gel® などのアルミニウムとマグネシウムを含む制酸剤を服用している場合は、次の NEURONTIN の服用まで少なくとも 2 時間待つ必要があります。 NEURONTIN 600mg の服用量が多すぎる場合は、すぐに医療提供者または地域の毒物管理センター (1-800-222-1222) に電話してください。
NEURONTINを服用している間、何を避けるべきですか?
- NEURONTINを服用している間は、最初に医療提供者に相談することなく、アルコールを飲んだり、眠気やめまいを起こす他の薬を服用したりしないでください. NEURONTIN 600mgをアルコールや眠気やめまいを引き起こす薬と一緒に服用すると、眠気やめまいが悪化することがあります.
- NEURONTIN 100mg がどのように影響するかを理解するまでは、運転したり、重機を操作したり、その他の危険な活動を行ったりしないでください。 NEURONTIN 600mg は、思考と運動能力を低下させる可能性があります。
NEURONTIN 300mg の副作用の可能性は何ですか?
NEURONTIN 100mg は、次のような重大な副作用を引き起こす可能性があります。
見る 「NEURONTIN について知っておくべき最も重要な情報は何ですか?」
- NEURONTIN 使用中の運転の問題。 「Neurontin 600mg を服用中に避けるべきことは何ですか?」を参照してください。
- 眠気やめまい、転倒などの偶発的な怪我の発生を増加させる可能性があります
- NEURONTIN 100mg の最も一般的な副作用は次のとおりです。
- 協調性の欠如
- ウイルス感染
- 眠気
- 吐き気と嘔吐
- 話すことの難しさ
- 身震い
- 腫れ、通常は脚と足
- 疲労感
- 熱
- ぎくしゃくした動き
- 調整の難しさ
- 複視
- 異常な眼球運動
気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。
これらは、NEURONTIN の考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
NEURONTINの保管方法は?
- NEURONTIN 400mg カプセルおよび錠剤は、68°F ~ 77°F (20°C ~ 25°C) で保管してください。
- NEURONTIN 400mg Oral Solution は、36°F ~ 46°F (2°C ~ 8°C) の冷蔵庫に保管してください。
NEURONTIN 600mg とすべての医薬品は子供の手の届かないところに保管してください。
NEURONTIN の安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 NEURONTIN 300mg を処方されていない状態に使用しないでください。他の人があなたと同じ症状を持っていても、NEURONTIN を他の人に与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、NEURONTIN に関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療従事者向けに書かれた NEURONTIN 100mg に関する情報については、医療提供者または薬剤師にお尋ねください。
詳細については、http://www.pfizer.com にアクセスするか、1-800-438-1985 までお電話ください。
ニューロンチン400mgの成分は?
有効成分: ガバペンチン
カプセル中の不活性成分: ラクトース、コーンスターチ、タルク、ゼラチン、二酸化チタン、FD&C ブルー No. 2。
300 mg のカプセル シェルには、次の成分も含まれています。
400 mg のカプセル シェルには、赤色酸化鉄と黄色酸化鉄も含まれています。
錠剤中の不活性成分: ポロキサマー407、コポビドン、コーンスターチ、ステアリン酸マグネシウム、ヒドロキシプロピルセルロース、タルク、キャンデリラワックス
経口溶液中の不活性成分: グリセリン、キシリトール、精製水、人工香料。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
