Imitrex 100mg, 25mg, 50mg Sumatriptan 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
イミトレックス 25mg とは何ですか?
イミトレックス 100mg は、片頭痛および群発頭痛の症状を治療するために使用される処方薬です。イミトレックスは、単独で使用することも、他の薬と併用することもできます。
イミトレックス 50mg は、抗片頭痛薬、セロトニン 5-HT 受容体アゴニストです。
Imitrex 50mg が 18 歳未満の子供に安全で有効であるかどうかは不明であり、高齢患者には使用をお勧めしません。
イミトレックス 50mg の副作用の可能性は何ですか?
イミトレックス 25mg は、次のような重大な副作用を引き起こす可能性があります。
- 突然の激しい腹痛、
- 血液の有無にかかわらず下痢、
- 激しい胸痛、
- 顎や肩の痛み、
- 呼吸困難、
- 不規則な心拍、
- 発作(けいれん)、
- 足のけいれん、
- 足や足のしびれやうずき、
- あなたの足や足の灼熱の痛み、
- 足や足の冷え、
- 足や足の色の変化、
- 腰の痛み、
- 吐き気、
- 嘔吐、
- 汗をかいたり、震えたり、
- 攪拌、
- 幻覚、
- 熱、
- 筋肉の硬直、
- 調整の喪失、
- 体の片側の突然のしびれや衰弱、
- ろれつが回らない、
- 見づらさ、
- バランスが悪い、そして
- 突然の激しい頭痛
上記の症状がある場合は、すぐに医療機関を受診してください。
イミトレックスの最も一般的な副作用は次のとおりです。
- 胸、のど、あごの痛みや圧迫感、
- 体のあらゆる部分に圧力がかかり、
- しびれやうずき、
- 暑かったり寒かったり、
- めまい、
- 眠気、
- 弱点、
- 鼻薬を使用した後の不快な味、
- 鼻薬を使用した後の鼻や喉の痛み、灼熱感、しびれ、うずき、および
- 鼻薬を使用した後の鼻水または鼻づまり
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらはイミトレックスの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
イミトレックス 50mg 注射液には、選択的 5-HT1B/1D 受容体アゴニストであるコハク酸スマトリプタンが含まれています。スマトリプタン コハク酸エステルは、化学的に 3-[2-(ジメチルアミノ)エチル]-N-メチル-インドール 5-メタンスルホンアミド コハク酸エステル (1:1) と呼ばれ、次の構造を持っています。
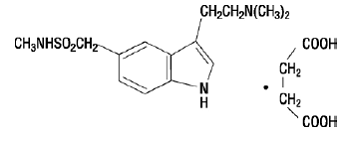
実験式は C14H21N3O2S•C4H6O4 で、分子量は 413.5 です。スマトリプタン コハク酸塩は、水や生理食塩水に容易に溶ける白色からオフホワイトの粉末です。
IMITREX 注射液は、透明、無色から淡黄色、無菌、非発熱性の皮下注射用溶液です。各 0.5 mL のイミトレックス注射用 8 mg/mL 溶液には、コハク酸塩として 4 mg のスマトリプタン (塩基) と 3.8 mg の塩化ナトリウム (USP 注射用水 (USP) 中) が含まれています。各 0.5 mL のイミトレックス注射用 12 mg/mL 溶液には、コハク酸塩として 6 mg のスマトリプタン (塩基) と 3.5 mg の塩化ナトリウム (USP 注射用水 (USP) 中) が含まれています。両方の溶液の pH 範囲は約 4.2 ~ 5.3 です。両方の注射の浸透圧は 291 mOsmol です。
適応症
IMITREX® 注射剤は、(1) 前兆の有無にかかわらず片頭痛の急性治療、および (2) 群発頭痛の急性治療のために成人に適応されます。
使用制限
- 片頭痛または群発頭痛の明確な診断が確立されている場合にのみ使用してください。患者がイミトレックス 50mg 注射で治療された最初の片頭痛または群発頭痛の発作に反応しない場合は、その後の発作を治療するためにイミトレックス注射を投与する前に診断を再考してください。
- イミトレックス注射は、片頭痛または群発頭痛発作の予防には適応されていません。
投薬と管理
投与情報
片頭痛または群発頭痛の急性治療のためのイミトレックス注射 25mg の成人の推奨最大単回投与量は、皮下注射で 6mg です。片頭痛の治療では、副作用によって用量が制限される場合は、より低い用量(1 mg から 5 mg)を使用することができます [参照 臨床研究 ]。群発頭痛の治療では、低用量での有効性は確立されていません。
24 時間に投与できる最大累積投与量は 12 mg で、6 mg を 2 回、少なくとも 1 時間間隔で注射します。 2 回目の 6 mg の投与は、最初の注射に対して何らかの反応が観察された場合にのみ考慮する必要があります。
IMITREX STATdose Pen® を使用した管理
自動注射装置 (IMITREX 25mg STATdose Pen) は、4 mg および 6 mg のプレフィルド シリンジ カートリッジで使用できます。この装置では、針は約 1/4 インチ (5 ~ 6 mm) 貫通します。注射は皮下投与を意図しており、筋肉内または血管内への投与は避ける必要があります。患者に IMITREX 100mg STATdose Pen の適切な使用方法を指導し、注射針の長さに対応できる十分な皮膚と皮下の厚さの注射部位を使用するように指導してください。
4 または 6 mg 以外の IMITREX の用量の投与
mg または 6 mg 以外の用量を投与されている患者では、6 mg の単回投与バイアルを使用してください。 IMITREX 50mg STATdose Pen は使用しないでください。投与前に粒子状物質や変色がないかバイアルを目視検査してください。粒子や変色が認められる場合は使用しないでください。
供給方法
剤形と強度
- 注射: IMITREX STATdose ペンで使用するための 4 mg および 6 mg の単回投与用プレフィルド シリンジ カートリッジ。
- 注射: 6 mg 単回投与バイアル。
保管と取り扱い
イミトレックス100mg注射 コハク酸塩としてスマトリプタン (塩基) を含み、無色透明から淡黄色の無菌の非発熱性溶液として次のように供給されます。
プレフィルドシリンジおよび/またはオートインジェクターペン
各パックには、患者情報と患者への使用説明書が含まれています。
イミトレックス 100mg STATdose System®、4mg 、1 IMITREX 25mg STATdoseペン、2つのプレフィルド単回投与シリンジカートリッジ、および1つのキャリングケースを含みます ( NDC 0173-0739-00)。
イミトレックス 100mg STATdose システム、6mg 、 1 つの IMITREX STATdose ペン、2 つのプレフィルド単回投与シリンジ カートリッジ、および 1 つのキャリング ケース ( NDC 0173-0479-00)。
4 mg 単回投与プレフィルド シリンジ 2 本 IMITREX STATdose システムで使用するためのカートリッジ ( NDC 0173-0739-02)。
2 つの 6 mg 単回投与プレフィルド シリンジ IMITREX 25mg STATdose システムで使用するカートリッジ ( NDC 0173-0478-00)。
単回投与バイアル
イミトレックス 25mg 注射用単回投与バイアル (6 mg/0.5 mL) 5 バイアルを含むカートン ( NDC 01730449-02)。
2° ~ 30°C (36° ~ 86°F) で保管してください。光から保護します。
グラクソスミスクライン、リサーチ トライアングル パーク、NC 27709
副作用
次の重篤な副作用は、以下およびラベルの他の場所に記載されています。
- 心筋虚血、心筋梗塞、およびプリンツメタル狭心症 [参照 警告と注意事項 ]
- 不整脈 [参照 警告と注意事項 ]
- 胸部、のど、首、および/または顎の痛み/圧迫感/圧迫感[参照 警告と注意事項 ]
- 脳血管イベント [参照 警告と注意事項 ]
- その他の血管痙攣反応 [参照 警告と注意事項 ]
- 薬の乱用による頭痛 [参照 警告と注意事項 ]
- セロトニン症候群 [参照 警告と注意事項 ]
- 血圧の上昇 [参照 警告と注意事項 ]
- 過敏反応 [参照 禁忌 、 警告と注意事項 ]
- 発作 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
片頭痛
表 1 は、片頭痛患者を対象とした 2 つの米国プラセボ対照臨床試験 (試験 2 および 3) で、イミトレックス 100mg 注射の 6 mg 単回投与またはプラセボ後に発生した副作用を示しています。表 1 には、イミトレックス注射 6 mg で治療されたグループで 2% 以上の頻度で発生し、プラセボ グループよりも高い頻度で発生した反応のみが含まれています。
対照臨床試験における副作用の発生率は、患者の性別や年齢の影響を受けませんでした。有害反応の発生率に対する人種の影響を評価するには、データが不十分でした。
群発頭痛
群発頭痛の治療薬としてのイミトレックス 50mg 注射剤の有効性を評価する対照臨床試験(試験 4 および 5)では、片頭痛患者におけるイミトレックス 100mg の試験でまだ確認されていない新たな重大な副作用は検出されませんでした。
全体として、群発頭痛の試験で報告された有害反応の頻度は、片頭痛の試験よりも概して低かった。例外として、感覚異常 (5% IMITREX、0% プラセボ)、吐き気と嘔吐 (4% IMITREX、0% プラセボ)、および気管支痙攣 (1% IMITREX 50mg、0% プラセボ) の報告が含まれます。
市販後の経験
イミトレックス錠 50mg、イミトレックス点鼻スプレー、イミトレックス 50mg 注射剤の承認取得後の使用において、以下の副作用が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
心臓血管
低血圧、動悸。
神経学
ジストニア、振戦。
薬物相互作用
麦角含有薬
麦角を含む薬は、長期にわたる血管痙攣反応を引き起こすことが報告されています。これらの効果は相加的である可能性があるため、エルゴタミン含有または麦角型の薬剤 (ジヒドロエルゴタミンまたはメチセルジドなど) とイミトレックス 25mg 注射を 24 時間以内に使用することは禁忌です。
モノアミンオキシダーゼ-A阻害剤
MAO-A阻害剤は、全身曝露を2倍増加させます。したがって、MAO-A阻害剤を投与されている患者へのイミトレックス注射の使用は禁忌です。 臨床薬理学 ]。
その他の 5-HT1 アゴニスト
それらの血管痙攣効果は相加的である可能性があるため、イミトレックス注射と他の 5-HT1 アゴニスト (例えば、トリプタン) を互いに 24 時間以内に同時投与することは禁忌です。
選択的セロトニン再取り込み阻害剤/セロトニン・ノルエピネフリン再取り込み阻害剤およびセロトニン症候群
セロトニン症候群の症例は、トリプタンと SSRI、SNRI、TCA、および MAO 阻害剤の同時投与中に報告されています [ 警告と注意事項 ]。
警告
の一部として含まれています 予防 セクション。
予防
心筋虚血、心筋梗塞、プリンツメタル狭心症
IMITREX 注射の使用は、虚血性または血管痙攣性 CAD の患者には禁忌です。イミトレックス注射液の投与後数時間以内に、急性心筋梗塞を含む重篤な心臓の副作用がまれに発生したという報告があります。これらの反応のいくつかは、既知の CAD のない患者で発生しました。 IMITREX 100mg 注射は、CAD の既往歴のない患者でも、冠動脈血管攣縮 (プリンツメタル狭心症) を引き起こす可能性があります。
IMITREX 注射を受ける前に、複数の心血管危険因子 (例えば、加齢、糖尿病、高血圧、喫煙、肥満、CAD の強い家族歴) を有するトリプタン未使用患者の心血管評価を実施してください。 CADまたは冠動脈血管痙攣の証拠がある場合、イミトレックス100mg注射は禁忌です。複数の心血管危険因子を持ち、心血管系の評価が陰性である患者の場合、医学的に管理された環境でイミトレックス注射の初回投与を行い、イミトレックス注射の投与直後に心電図 (ECG) を実施することを検討してください。このような患者に対しては、イミトレックス 100mg 注射剤を断続的に長期間使用する場合は、定期的な心血管評価を検討してください。
不整脈
5-HT1アゴニストの投与後数時間以内に、心室頻拍や心室細動などの生命を脅かす心調律障害が死亡に至ることが報告されています。これらの障害が発生した場合は、イミトレックス注射を中止してください。イミトレックス注射は、ウォルフ・パーキンソン・ホワイト症候群または他の心臓副伝導経路障害に関連する不整脈の患者には禁忌です。
胸、のど、首、および/または顎の痛み/緊張/圧力
前胸部、喉、首、および顎の圧迫感、痛み、圧迫感、および重さの感覚は、一般的に IMITREX 注射による治療後に発生し、通常は心臓以外の原因によるものです。ただし、これらの患者が心臓のリスクが高い場合は、心臓の評価を行います。 IMITREX 注射の使用は、CAD 患者およびプリンツメタル変異型狭心症患者には禁忌です。
脳血管イベント
脳出血、くも膜下出血、および脳卒中は、5-HT1 アゴニストで治療された患者で発生し、一部は死亡に至りました。多くの場合、脳血管イベントは一次的なものである可能性があり、5-HT1 アゴニストは、経験した症状が片頭痛の結果ではないのに片頭痛の結果であるという誤った信念で投与された.また、片頭痛の患者は、特定の脳血管イベント(脳卒中、出血、TIAなど)のリスクが高くなる可能性があります。脳血管イベントが発生した場合は、イミトレックス注射を中止してください。
以前に片頭痛または群発頭痛と診断されていない患者、または非典型的な症状を呈している患者の頭痛を治療する前に、他の潜在的に深刻な神経学的状態を除外してください。イミトレックス注射は、脳卒中またはTIAの既往歴のある患者には禁忌です。
その他の血管痙攣反応
IMITREX 25mg注射は、末梢血管虚血、胃腸血管虚血および梗塞(腹痛および血性下痢を伴う)、脾臓梗塞、およびレイノー症候群などの非冠動脈痙攣反応を引き起こす可能性があります。 5-HT1 アゴニストの使用後に非冠動脈痙攣反応を示唆する症状または徴候を経験した患者では、追加の IMITREX 注射を受ける前に血管痙攣反応を除外してください。
5-HT1 アゴニストの使用により、一時的および永久的な失明、および重大な部分的視力喪失の報告が報告されています。視覚障害は片頭痛発作の一部である可能性があるため、これらのイベントと 5-HT1 アゴニストの使用との因果関係は明確に確立されていません。
薬の乱用による頭痛
急性片頭痛薬(例、エルゴタミン、トリプタン、オピオイド、またはこれらの薬の組み合わせを月に10日以上)を過剰に使用すると、頭痛が悪化することがあります(薬物乱用頭痛)。薬物乱用頭痛は、片頭痛のような毎日の頭痛、または片頭痛発作の頻度の著しい増加として現れることがあります。過剰に使用された薬物の中止を含む患者の解毒、および離脱症状の治療(頭痛の一時的な悪化を含むことが多い)が必要になる場合があります。
セロトニン症候群
セロトニン症候群は、特に選択的セロトニン再取り込み阻害剤(SSRI)、セロトニン・ノルエピネフリン再取り込み阻害剤(SNRI)、三環系抗うつ剤(TCA)、およびMAO阻害剤との同時投与中に、IMITREX注射で発生する可能性があります[参照 薬物相互作用 ]。セロトニン症候群の症状には、精神状態の変化(興奮、幻覚、昏睡など)、自律神経不安定性(頻脈、不安定な血圧、高体温など)、神経筋異常(反射亢進、協調運動障害など)、および/または胃腸症状(吐き気、嘔吐、下痢)。症状の発症は、通常、セロトニン作動薬の新しい用量またはより多くの用量を受け取ってから数分から数時間以内に発生します.セロトニン症候群が疑われる場合は、イミトレックス注射を中止してください。
血圧の上昇
高血圧の病歴のない患者を含む、5-HT1アゴニストで治療された患者では、臓器系の急性障害を伴う高血圧クリーゼを含む血圧の有意な上昇がまれに報告されています。 IMITREX で治療された患者の血圧を監視します。 IMITREX 注射は、高血圧がコントロールされていない患者には禁忌です。
アナフィラキシー/アナフィラキシー様反応
アナフィラキシー/アナフィラクトイド反応は、IMITREX を投与された患者で発生しています。このような反応は、生命を脅かすものや致命的なものになる可能性があります。一般に、薬物に対するアナフィラキシー反応は、複数のアレルゲンに対する過敏症の病歴を持つ個人で発生する可能性が高くなります.イミトレックス 50mg 注射は、イミトレックスに対する過敏反応の既往歴のある患者には禁忌です。
発作
IMITREXの投与後に発作が報告されています。一部は、発作の既往歴があるか、発作の素因となる状態が併発している患者に発生しています。そのような素因が明らかでない患者の報告もあります。イミトレックス注射は、てんかんの病歴または発作閾値の低下に関連する状態の患者には注意して使用する必要があります。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報と使用説明書 )。
心筋虚血および/または心筋梗塞、プリンツメタル狭心症、その他の血管痙攣関連イベント、不整脈、および脳血管イベントのリスク
イミトレックス 50mg 注射は、心筋梗塞や脳卒中などの深刻な心血管系の副作用を引き起こす可能性があることを患者に知らせてください。重大な心血管イベントは警告症状なしに発生する可能性がありますが、患者は、胸痛、息切れ、不整脈、血圧の大幅な上昇、衰弱、ろれつが回らないなどの徴候や症状に注意する必要があります。徴候または症状が観察されます。このフォローアップの重要性を患者に知らせる [参照 警告と注意事項 ]。
アナフィラキシー/アナフィラキシー様反応
IMITREX 100mg注射を受けた患者にアナフィラキシー/アナフィラキシー反応が発生したことを患者に知らせてください。このような反応は、生命を脅かすものや致命的なものになる可能性があります。一般に、薬物に対するアナフィラキシー反応は、複数のアレルゲンに対する過敏症の病歴を持つ個人で発生する可能性が高くなります。 禁忌 、 警告と注意事項 ]。
他のトリプタンまたは麦角薬との併用
別のトリプタンまたは麦角型の薬(ジヒドロエルゴタミンまたはメチセルギドを含む)の24時間以内にイミトレックス50mg注射を使用することは禁忌であることを患者に知らせる[ 禁忌 、 薬物相互作用 ]。
セロトニン症候群
特にSSRI、SNRI、TCA、およびMAO阻害剤との併用中は、イミトレックス注射または他のトリプタンの使用によるセロトニン症候群のリスクについて患者に注意してください[ 警告と注意事項 、 薬物相互作用 ]。
薬の乱用による頭痛
急性片頭痛薬を月に10日以上使用すると頭痛が悪化する可能性があることを患者に伝え、患者に頭痛の頻度と薬物使用を記録するように勧める(例、頭痛日記をつける)[ 警告と注意事項 ]。
妊娠
潜在的な利益が胎児への潜在的なリスクを正当化しない限り、妊娠中にイミトレックス 25mg 注射剤を使用すべきではないことを患者に知らせる[ 特定の集団での使用 ]。
授乳中の母親
授乳中または授乳を計画している場合は、医療提供者に通知するように患者に助言する [参照 特定の集団での使用 ]。
複雑なタスクを実行する能力
IMITREX 25mg注射による治療は、傾眠やめまいを引き起こす可能性があります。イミトレックス 25mg 注射剤の投与後、複雑なタスクを実行する能力を評価するように患者に指示します。
イミトレックス100mg注射の使い方
患者が医学的に監督されていない状況で IMITREX 50mg 注射剤を自己投与できる場合は、IMITREX 100mg 注射剤の適切な使用について患者に指導してください。
IMITREX STATdose Pen の針が約 1/4 インチ (5 ~ 6 mm) 貫通することを患者に伝えます。注射は皮下に行うことを意図しており、筋肉内または血管内への注入は避けるべきであることを患者に伝えてください。針の長さに対応するために、十分な皮膚と皮下の厚さの注射部位を使用するように患者に指示します。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
マウスとラットの発がん性試験では、スマトリプタンがそれぞれ 78 週間と 104 週間経口投与され、最大用量は 160 mg/kg/日でした (ラットの最高用量は 21 週の間に 360 mg/kg/日から減量されました)。 )。マウスおよびラットへの最高用量は、mg/m² に基づいて皮下投与された 6 mg の単回 MRHD の約 130 倍および 260 倍でした。いずれの種においても、スマトリプタン投与に関連する腫瘍の増加の証拠はありませんでした。
突然変異誘発
スマトリプタンは、in vitro (細菌の復帰突然変異 [Ames]、チャイニーズハムスター V79/HGPRT の遺伝子細胞突然変異、ヒトリンパ球の染色体異常) および in vivo (ラット小核) アッセイで陰性でした。
受胎能障害
スマトリプタンを交配前および交配期間中、雄および雌のラットに皮下注射で投与した場合、最大 60 mg/kg/日またはヒトの単回用量 6 mg の約 100 倍の用量で受精能障害の証拠はありませんでした。 mg/㎡ベース。スマトリプタン (5、50、500 mg/kg/日) を交配期間の前および交配期間を通して雌雄ラットに経口投与した場合、用量で処置した動物の交配の減少に続いて、処置に関連した受胎能の低下が見られました。 5mg/kg/日以上。この発見が男性または女性、またはその両方への影響によるものかどうかは明らかではありません.
特定の集団での使用
妊娠
妊娠カテゴリーC
妊娠中の女性におけるイミトレックス 50mg 注射の適切で十分に管理された試験はありません。ラットとウサギの発生毒性研究では、妊娠中の動物へのスマトリプタンの経口投与は、胎児の致死率、胎児の異常、および子犬の死亡率と関連していました。妊娠中のウサギに静脈内投与すると、スマトリプタンは胚致死的でした。イミトレックス 100mg 注射は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用する必要があります。
器官形成期の妊娠ラットにスマトリプタンを経口投与すると、胎児血管(頸胸部および臍帯)の異常の発生率が増加した。胚胎児発生毒性の無影響量の最高用量は 60 mg/kg/日であり、1 回の最大推奨用量 (MRHD) である 6 mg の皮下投与 (mg/m² ベース) の約 100 倍でした。器官形成期に妊娠したウサギにスマトリプタンを経口投与すると、胚致死率および胎児の頸胸部血管および骨格異常の発生率が増加した。器官形成期の妊娠ウサギへのスマトリプタンの静脈内投与は、胚致死率の増加をもたらした。ウサギの発生毒性に対する経口および静脈内無影響量の最高用量は、15 および 0.75 mg/kg/日、または mg/m² ベースで皮下投与された 6 mg の単回 MRHD のそれぞれ約 50 および 2 倍でした。
妊娠前および妊娠中のラットへのスマトリプタンの経口投与は、胎児毒性(体重の減少、骨化の減少、骨格異常の発生率の増加)をもたらしました。無効果の最高用量は 50 mg/kg/日であり、1 mg/m² ベースで皮下投与された 6 mg の単一 MRHD の約 80 倍です。器官形成中にスマトリプタンを経口投与された妊娠ラットの子孫では、仔の生存率が低下した。この効果に対する無効果の最高用量は 60 mg/kg/日であり、これは 6 mg を皮下投与した単回 MRHD の約 100 倍であり、mg/m² ベースで計算されます。妊娠後期および授乳中の妊娠ラットにスマトリプタンを経口投与すると、仔の生存率が低下した。この所見に対する無効果の最高用量は 100 mg/kg/日であり、1 mg/m² ベースで皮下投与された 6 mg の単一 MRHD の約 160 倍です。
授乳中の母親
スマトリプタンは、皮下投与後に母乳中に排泄されます。スマトリプタンへの乳児の曝露は、イミトレックス 50mg 注射による治療後 12 時間は授乳を避けることで最小限に抑えることができます。
小児用
小児患者における安全性と有効性は確立されていません。イミトレックス 100mg 注射は、18 歳未満の患者への使用は推奨されません。
2 つの対照臨床試験では、1 回の発作を治療した 12 歳から 17 歳の小児片頭痛患者 1,248 人を対象に、イミトレックス鼻スプレー (5 から 20 mg) を評価しました。この試験では、小児患者の片頭痛の治療において、プラセボと比較した IMITREX 点鼻薬の有効性は確立されませんでした。これらの臨床試験で観察された副作用は、成人の臨床試験で報告されたものと本質的に類似していました。
12 歳から 17 歳の小児患者における経口 IMITREX (25 から 100 mg) を評価する 5 つの対照臨床試験 (2 つの単一攻撃試験、3 つの複数攻撃試験) では、合計 701 人の小児片頭痛患者が登録されました。これらの試験では、小児患者の片頭痛の治療において、プラセボと比較した経口 IMITREX 25mg の有効性は確立されませんでした。これらの臨床試験で観察された副作用は、成人の臨床試験で報告されたものと本質的に類似していました。これらの患者におけるすべての有害反応の頻度は、用量と年齢の両方に依存しているようであり、年長の小児患者よりも若い患者がより一般的に反応を報告しています。
市販後の経験によると、皮下、経口、および/または鼻腔内の IMITREX の使用後に小児集団で深刻な副作用が発生したことが記録されています。これらの報告には、脳卒中、視覚障害、死亡など、成人でめったに報告されないものと本質的に類似した反応が含まれています。経口イミトレックスの使用後、14 歳の男性で心筋梗塞が報告されています。臨床徴候は、薬物投与の 1 日以内に発生しました。 IMITREX を皮下、経口、または鼻腔内に投与された可能性のある小児患者における重篤な副作用の頻度を判断するための臨床データは、現在入手できません。
高齢者の使用
イミトレックス 100mg 注射の臨床試験には、65 歳以上の十分な数の患者が含まれておらず、若い患者と異なる反応を示すかどうかを判断できませんでした。他の報告された臨床経験では、年配の患者と若い患者の間の反応の違いは確認されていません。一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
IMITREX 注射を受ける前に、他の心血管危険因子 (例、糖尿病、高血圧、喫煙、肥満、CAD の強い家族歴) を有する高齢患者には、心血管評価が推奨される [参照 警告と注意事項 ]。
過剰摂取
イミトレックス 50mg 注射液の静脈内投与後、冠血管痙攣が認められた[参照 禁忌 ]。動物のデータ (0.1 g/kg のイヌ、2 g/kg のラット) から予想される過剰摂取は、痙攣、振戦、運動不足、四肢の紅斑、呼吸数の減少、チアノーゼ、運動失調、散瞳、注射部位反応 (落屑、脱毛、かさぶたの形成)、および麻痺。
スマトリプタンの半減期は約 2 時間です。 臨床薬理学 ];したがって、イミトレックス注射による過剰摂取後の患者のモニタリングは、少なくとも 10 時間、または症状または徴候が持続する間継続する必要があります。
血液透析または腹膜透析がスマトリプタンの血清濃度にどのような影響を与えるかは不明です。
禁忌
イミトレックス注射は以下の患者には禁忌です:
- -虚血性冠動脈疾患(CAD)(狭心症、心筋梗塞の病歴、または記録された無症候性虚血)またはプリンツメタル狭心症を含む冠動脈血管痙攣[参照 警告と注意事項 ]。
- Wolff-Parkinson-White 症候群またはその他の心臓副伝導経路障害に関連する不整脈 [参照 警告と注意事項 ]。
- 脳卒中または一過性脳虚血発作(TIA)の病歴、または片麻痺または脳底片頭痛の病歴。これらの患者は脳卒中のリスクが高いため[参照 警告と注意事項 ]。
- 末梢血管疾患 [参照 警告と注意事項 ]。
- 虚血性腸疾患 [参照 警告と注意事項 ]。
- コントロールされていない高血圧 [参照 警告と注意事項 ]。
- エルゴタミン含有薬、麦角型薬(ジヒドロエルゴタミンやメチセルジドなど)、または別の5-ヒドロキシトリプタミン1(5-HT1)アゴニストの最近(すなわち、24時間以内)の使用[ 薬物相互作用 ]。
- -モノアミンオキシダーゼ(MAO)-A阻害剤の同時投与、または最近(2週間以内)のMAO-A阻害剤の使用[参照 薬物相互作用 、 臨床薬理学 ]。
- IMITREXに対する過敏症(血管性浮腫およびアナフィラキシーが見られる)[参照 警告と注意事項 ]。
- 重度の肝障害[参照 臨床薬理学 ]。
臨床薬理学
作用機序
スマトリプタンは、クローン化されたヒト 5-HT1B/1D 受容体に高い親和性で結合します。スマトリプタンはおそらく、頭蓋内血管および三叉神経系の感覚神経上の 5-HT1B/1D 受容体でのアゴニスト効果を通じて、片頭痛および群発頭痛の治療に治療効果を発揮し、頭蓋血管の収縮および炎症誘発性神経ペプチドの阻害をもたらします。リリース。
薬力学
血圧
高血圧クリーゼを含む血圧の有意な上昇は、高血圧の病歴のある患者とない患者で報告されている[参照 警告と注意事項 ]。
末梢(小)動脈
健康なボランティア (N = 18) において、スマトリプタンが末梢 (小血管) の動脈反応性に及ぼす影響を評価した試験では、末梢抵抗の臨床的に有意な増加を検出できませんでした。
心拍数
片頭痛の治療薬としてのスマトリプタンの開発中に実施された臨床試験で一部の患者に観察された血圧の一時的な上昇は、心拍数の臨床的に有意な変化を伴わなかった.
薬物動態
吸収とバイオアベイラビリティ
18 人の健康な男性被験者への皮下注射によるスマトリプタンのバイオアベイラビリティは、静脈内注射後に得られたバイオアベイラビリティの 97% ± 16% でした。
18 人の健康な男性 (年齢: 24 ± 6 歳、体重: 70 kg) の腕の三角筋領域に 6 mg を単回皮下手動注射した後、スマトリプタンの最大血清濃度 (Cmax) は (平均 ± 標準偏差) でした。 74 ± 15 ng/mL であり、濃度がピークになるまでの時間 (Tmax) は注入後 12 分でした (範囲: 5 ~ 20 分)。この試験では、大腿部に皮下注射された同じ用量の Cmax は、手動注射では 61 ± 15 ng/mL であったのに対し、自動注射技術では 52 ± 15 ng/mL でした。 Tmaxまたは吸収量は、注射の部位または技術のいずれによっても有意に変化しなかった。
分布
10 ~ 1,000 ng/mL の濃度範囲で平衡透析によって測定されるタンパク質結合は低く、約 14% ~ 21% です。他の薬剤のタンパク質結合に対するスマトリプタンの効果は評価されていません。
人の男性 (平均年齢: 33 歳、平均体重: 77 kg) の腕の三角筋領域への 6 mg 皮下注射後、スマトリプタンの分布中央コンパートメントの容積は 50 ± 8 リットルであり、分布半減期は15±2分。
代謝
ヒトミクロソームを用いた in vitro 研究は、スマトリプタンが MAO、主に A アイソザイムによって代謝されることを示唆しています。尿中に排泄されたスマトリプタンの放射性標識用量のほとんどは、主要な代謝産物であるインドール酢酸 (IAA) または IAA グルクロニドであり、どちらも不活性です。
排除
6 mg の単回皮下投与後、22% ± 4% が未変化のスマトリプタンとして尿中に排泄され、38% ± 7% が IAA 代謝物として排泄されました。
腕の三角筋領域への 6 mg の皮下注射後、スマトリプタンの全身クリアランスは 1,194 ± 149 mL/分であり、最終半減期は 115 ± 19 分でした。
特定の集団
年
高齢者(平均年齢:72 歳、男性 2 名、女性 4 名)および片頭痛患者(平均年齢:38 歳、男性 25 名、女性 155 名)におけるスマトリプタンの薬物動態は、健康な男性被験者(平均年齢: 30年)。
肝障害
皮下投与されたスマトリプタンの薬物動態に対する軽度から中等度の肝疾患の影響が評価されています。健康な対照と比較して、中等度の肝障害のある被験者における皮下投与されたスマトリプタンの薬物動態に有意差はありませんでした。重度の肝障害を持つ患者におけるスマトリプタンの皮下投与の薬物動態は研究されていません。この集団でのイミトレックス注射の使用は禁忌です[ 禁忌 ]。
人種
皮下スマトリプタンの全身クリアランスと Cmax は、黒人 (n = 34) と白人 (n = 38) の健康な男性被験者で類似していました。
薬物相互作用研究
モノアミンオキシダーゼ-A阻害剤
14 人の健康な女性を対象とした試験では、MAO-A 阻害剤による前処理により皮下スマトリプタンのクリアランスが減少し、その結果、スマトリプタンの血漿濃度-時間曲線 (AUC) の下の面積が 2 倍に増加し、40% の増加に相当します。排泄半減期で。
動物毒物学および/または薬理学
角膜混濁
スマトリプタンを経口投与された犬は、角膜混濁と角膜上皮の欠損を発症しました。角膜混濁は、試験した最低用量である 2 mg/kg/日で見られ、1 か月の治療後に存在しました。角膜上皮の欠陥は、60 週間の研究で指摘されました。これらの毒性に関する以前の試験は実施されておらず、無影響用量は確立されていません。ただし、テストされた最低用量での相対的な血漿暴露は、6 mg の皮下投与後のヒトの暴露の約 3 倍でした。
臨床研究
片頭痛
中等度または重度の痛みと、表 3 に列挙された 1 つ以上の症状を経験している片頭痛発作中の 1,000 人以上の患者を登録した対照臨床試験では、6 mg のイミトレックス 50 mg 注射後、早ければ 10 分後に緩和が始まりました。低用量のイミトレックス 100mg 注射剤も効果的であることが証明される可能性がありますが、十分な緩和を得られる患者の割合は減少し、その緩和までの待ち時間は低用量で大きくなります。
研究 1 では、イミトレックス 100mg 注射の 6 つの異なる用量 (各群 n = 30) がプラセボ (n = 62) と比較されました。表 2。
中等度または重度の片頭痛患者 1,104 人を対象とした IMITREX 25mg 注射 6mg の 2 つの無作為化プラセボ対照臨床試験 (研究 2 および 3) では、緩和の開始は 10 分未満でした。重度または中程度の重度から軽度または頭痛のない頭痛への痛みの軽減によって定義される頭痛の軽減は、イミトレックス注射の 6 mg 単回皮下投与の 1 時間以内に患者の 70% で達成されました。 IMITREX 6 mg で治療された患者の約 82% と 65% は、それぞれ 2 時間以内に頭痛が軽減し、痛みがなくなりました。
表 3 は、試験 2 および試験 3 におけるイミトレックス注 6 mg の 1 時間および 2 時間の有効性結果を示しています。
イミトレックス 100mg 注射は、片頭痛発作に伴う光恐怖症、音恐怖症 (音過敏症)、吐き気、嘔吐も緩和しました。患者が IMITREX 100mg STATdose ペンを使用して IMITREX 50mg 注射を自己投与した場合、同様の有効性が見られました。
イミトレックス注射の有効性は、片頭痛が前兆、発作の持続時間、患者の性別または年齢、または一般的な片頭痛予防薬(ベータ遮断薬など)の併用と関連しているかどうかに影響されませんでした。
群発頭痛
群発頭痛の急性治療における IMITREX 注射の有効性は、2 つのランダム化二重盲検プラセボ対照 2 期間クロスオーバー試験で実証されました (試験 4 および 5)。 21 歳から 65 歳の患者が登録され、発症から 10 分以内に中等度から非常に重度の頭痛を治療するように指示されました。頭痛の軽減は、頭痛の重症度が軽度または無痛に軽減することと定義されました。どちらの試験でも、プラセボを投与された患者と比較して、6 mg のイミトレックス注射を投与された患者では、10 分または 15 分で緩和を得た個人の割合が有意に高かった(表 4 を参照)。
イミトレックス 25mg 注射またはプラセボのいずれかで治療された後、群発頭痛患者が軽減する累積確率の推定値を図 1 に示します。
図 1: 注射時から群発頭痛が軽減するまでの時間a 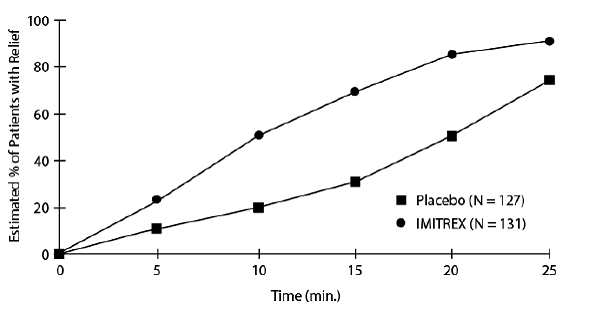
a図はKaplan-Meier(積極限)Survivorship Plotを使用。レスキュー薬を服用している患者は、15 分で打ち切られました。
プロットは、治療後 2 時間以内に緩和を経験したか、またはレスキュー薬を必要としなかった (要求した) 患者からのデータを使用して作成されました。結果として、プロットのデータは、治療された 258 の頭痛のサブセットのみから得られたものです (127 のプラセボ治療頭痛のうち 52 で、イミトレックス 50mg 注射で治療された 131 の頭痛のうち 18 でレスキュー薬が必要でした)。
他のデータは、イミトレックス 25mg 注射による治療は、頭痛の早期再発の増加とは関係がなく、後に発生する頭痛 (すなわち、2 時間後、しかし 18 時間または 24 時間前に発生するもの) の発生率にほとんど影響を与えないことを示唆しています。
患者情報
イミトレックス® (IM-i-trex) (コハク酸スマトリプタン) 注射
イミトレックスの服用を開始する前、および補充を受けるたびに、この患者情報をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
IMITREX について知っておくべき最も重要な情報は何ですか?
IMITREX は、次のような重大な副作用を引き起こす可能性があります。
心臓発作およびその他の心臓の問題。心臓の問題は死に至る可能性があります。
次のような心臓発作の症状がある場合は、イミトレックス 25mg の服用を中止し、直ちに緊急医療処置を受けてください。
- 数分以上続く、または消えて戻ってくる胸の中心の不快感
- 胸、喉、首、または顎の重度の圧迫感、痛み、圧迫感、または重さ
- 腕、背中、首、顎、または胃の痛みまたは不快感
- 胸の不快感を伴うまたは伴わない息切れ
- 冷や汗をかく
- 吐き気または嘔吐
- めまいがする
イミトレックスは、心臓検査が行われて問題が示されない限り、心臓病の危険因子を持つ人には適していません.次の場合、心臓病のリスクが高くなります。
- 高血圧がある
- コレステロール値が高い
- 煙
- 太りすぎです
- 糖尿病を持っている
- 心臓病の家族歴がある
イミトレックスとは?
イミトレックス注射は、片頭痛または群発頭痛と診断された成人の前兆のあるまたはない急性片頭痛および急性群発頭痛の治療に使用される処方薬です。
IMITREX 50mg は、片麻痺 (体の片側を動かすことができなくなる) や脳底 (前兆のあるまれな形態の片頭痛) 片頭痛など、他のタイプの頭痛の治療には使用されません。
イミトレックス 100mg は、片頭痛または群発頭痛の予防または数の減少には使用されません。
イミトレックス 100mg が 18 歳未満の子供に安全で効果的であるかどうかはわかっていません。
イミトレックス 100mg を服用してはいけない人は?
次の場合は、イミトレックス 50mg を服用しないでください。
- 心臓の問題または心臓の問題の病歴
- 足、腕、胃、または腎臓への血管の狭窄(末梢血管疾患)
- コントロールされていない高血圧
- 深刻な肝臓の問題
- 片麻痺性片頭痛または脳底片頭痛。これらのタイプの片頭痛があるかどうかわからない場合は、医療提供者に尋ねてください。
- 脳卒中、一過性脳虚血発作 (TIA)、または血液循環の問題があった
- 過去 24 時間以内に次のいずれかの薬を服用した:
- アルモトリプタン(AXERT®)
- エレトリプタン(RELPAX®)
- フロバトリプタン(FROVA®)
- ナラトリプタン(AMERGE®)
- リザトリプタン(MAXALT®、MAXALT-MLT®)
- スマトリプタンとナプロキセン (TREXIMET®)
- エルゴタミン(CAFERGOT®、ERGOMAR®、MIGERGOT®)
- ジヒドロエルゴタミン (DHE 45®、MIGRANAL®) 使用している薬が上記に記載されているかどうか不明な場合は、医療提供者にお尋ねください。
- スマトリプタンまたはイミトレックスのいずれかの成分に対するアレルギー。イミトレックスの全成分リストについては、このリーフレットの最後をご覧ください。
IMITREX を服用する前に、医療提供者に何を伝えるべきですか?
IMITREX を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 高血圧がある
- コレステロールが高い
- 糖尿病を持っている
- 煙
- 太りすぎです
- 心臓病または心臓病または脳卒中の家族歴がある
- 腎臓に問題がある
- 肝臓に問題がある
- てんかんまたは発作を起こしたことがある
- 効果的な避妊を使用していない
- イミトレックス服用中に妊娠
- 授乳中または授乳を計画している。イミトレックス 25mg は母乳に移行し、赤ちゃんに害を及ぼす可能性があります。イミトレックスを服用している場合は、赤ちゃんに与える最善の方法について医療提供者に相談してください。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。
イミトレックスと特定の他の薬は互いに影響し合い、深刻な副作用を引き起こす可能性があります。
特に次の場合は医療提供者に伝えてください。 あなたは次のような抗うつ薬を服用しています:
- 選択的セロトニン再取り込み阻害薬(SSRI)
- セロトニン・ノルエピネフリン再取り込み阻害薬(SNRI)
- 三環系抗うつ薬(TCA)
- モノアミンオキシダーゼ阻害剤 (MAOI)
よくわからない場合は、医療提供者または薬剤師にこれらの薬のリストを尋ねてください。
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医療提供者または薬剤師に見せてください。
イミトレックス 100mg はどのように服用すればよいですか?
- 特定の人々は、ヘルスケア提供者のオフィスまたは別の医療環境で、イミトレックス 25mg の最初の用量を服用する必要があります。医療現場で初めて服用する必要があるかどうかは、かかりつけの医療提供者に相談してください。
- IMITREX 50mg は、医療提供者が使用するように指示したとおりに使用してください。
- 担当の医療提供者が用量を変更する場合があります。最初に医療提供者に相談せずに用量を変更しないでください。
- 通常、成人は1回皮下に1回注射します。
- 頭痛の症状が現れたらすぐに注射する必要がありますが、片頭痛や群発頭痛の発作中はいつでも注射することができます.
- 1 回目の注射で効果が得られなかった場合は、医療提供者に相談せずに 2 回目の注射を行わないでください。
- 頭痛が再発したり、最初の注射後に少ししか緩和されない場合は、最初の注射の 1 時間後に 2 回目の注射を行うことができますが、それより早くはできません。
- 24 時間以内に 12 mg を超えて服用しないでください。
- イミトレックス 25mg を使いすぎた場合は、すぐに医療提供者に連絡するか、最寄りの病院の緊急治療室に行ってください。
- いつ頭痛がしたか、いつイミトレックスを服用したかを書き留めて、イミトレックス 25mg がどのように作用するかについて医療提供者に相談できるようにしてください。
イミトレックスを服用している間、何を避けるべきですか?
イミトレックスは、めまい、衰弱、または眠気を引き起こす可能性があります。これらの症状がある場合は、車を運転したり、機械を使用したり、注意が必要な場所で何かをしたりしないでください.
イミトレックス 25mg で起こりうる副作用は何ですか?
イミトレックスは深刻な副作用を引き起こす可能性があります。 「IMITREX について知っておくべき最も重要な情報は何ですか?」を参照してください。
これらの深刻な副作用には次のものがあります。
- 手足の色や感覚の変化 (レイノー症候群)
- 胃および腸の問題(胃腸および結腸の虚血性事象)。胃腸および結腸の虚血性イベントの症状には、以下が含まれます。
- 突然または激しい胃の痛み
- 食後の胃痛
- 減量
- 吐き気または嘔吐
- 便秘または下痢
- 血まみれの下痢
- 熱
- 足への血液循環の問題(末梢血管虚血)。末梢血管虚血の症状は次のとおりです。
- 足や腰のけいれんや痛み
- 脚の筋肉の重さまたは緊張感
- 安静時の足やつま先の灼熱感やうずくような痛み
- 足のしびれ、うずき、または衰弱
- 片足または両足の冷感または色の変化
- 蕁麻疹(かゆみのある隆起);舌、口、または喉の腫れ
- 薬の乱用による頭痛。イミトレックス 100mg の注射を多用すると、頭痛が悪化することがあります (薬物乱用頭痛)。頭痛が悪化した場合、医療提供者は IMITREX による治療を中止することを決定する場合があります。
- セロトニン症候群。セロトニン症候群は、特に IMITREX 50mg が SSRI または SNRI と呼ばれる抗うつ薬と併用されている場合に、IMITREX を使用している人々に発生する可能性があるまれではあるが深刻な問題です。次のようなセロトニン症候群の症状がある場合は、すぐに医療提供者に連絡してください。
- 存在しないものが見える(幻覚)、動揺、昏睡などの精神的変化
- 速い心拍
- 血圧の変化
- 高体温
- タイトな筋肉
- 歩行困難
- 発作。以前に発作を起こしたことがない人でも、イミトレックスを服用している人に発作が起こりました。 IMITREX の服用中に発作を起こす可能性について、担当の医療提供者に相談してください。
イミトレックス 50mg 注射の最も一般的な副作用は次のとおりです。
- 注射部位の痛みまたは発赤
- 指やつま先のうずきやしびれ
- めまい
- あなたの顔に暖かい、熱い、灼熱感(紅潮)
- 首の不快感やこわばり
- 脱力感、眠気、または疲労感
気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。
これらは、IMITREX の考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
イミトレックス注の保存方法は?
- IMITREX は 36°F ~ 86°F (2°C ~ 30°C) で保管してください。
- 薬は光を避けて保管してください。
- 薬は付属のパッケージまたはキャリングケースに入れて保管してください。
イミトレックスとすべての医薬品は子供の手の届かないところに保管してください。
イミトレックスの安全で効果的な使用に関する一般情報
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。処方されていない状態にイミトレックスを使用しないでください。他の人があなたと同じ症状を持っていても、イミトレックス 25mg を与えないでください。それらに害を及ぼす可能性があります。
この患者情報リーフレットには、IMITREX に関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療専門家向けに書かれた IMITREX に関する情報については、医療提供者または薬剤師にお尋ねください。
詳細については、www.gsk.com にアクセスするか、1-888-825-5249 までお電話ください。
イミトレックス注射の成分は?
有効成分:コハク酸スマトリプタン
不活性成分:塩化ナトリウム、注射用水
この患者情報および使用説明書は、米国食品医薬品局によって承認されています。
患者への使用説明書
イミトレックススタットドーズシステム
IMITREX STATdose システムの使用を開始する前に、この患者用取扱説明書をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.あなたとあなたの医療提供者は、イミトレックス 25mg 注射の服用開始時と定期健診時に話し合う必要があります。
IMITREX STATdose システムは子供の手の届かないところに保管してください。
IMITREX STATdose システムを使用する前に
IMITREX 25mg STATdose システムの箱を最初に開けると、カートリッジ パックと IMITREX STATdose Pen® がすでにキャリング ケースに入っているので便利です。
グレーとブルー キャリングケース 取り外したペンとカートリッジパックを未使用時に保管するために使用します。
の カートリッジパック 個別に密封された2つを保持 シリンジカートリッジ .各シリンジカートリッジには、イミトレックス® (コハク酸スマトリプタン) 注射剤が 1 回分入っています。この薬の 4 mg 強度のカートリッジ パックは黄色、6 mg 強度のカートリッジ パックは青色です (図のように)。詰め替えカートリッジパックが利用可能です。
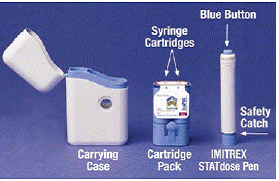
グレーとブルー ペン シリンジカートリッジから1回分の薬を自動的に注入するために使用されます。に触れないでください。 青いボタン ペンを皮膚に押し付けて用量を与えるまで。それ以外のときに押すと、服用量を失う可能性があります。の 安全キャッチ 準備が整うまで、ペンが誤って発砲するのを防ぎます。ペンは、バレルの灰色の部分を青色の部分にスライドさせた場合にのみ機能します。新しいシリンジ カートリッジをロードする前に、白いプライミング ロッドがペンの端から突き出ていないことを必ず確認してください (図 B を参照)。はみ出していると、その線量が失われます。
IMITREX STATdose ペンの装填方法
自分で注射する準備ができるまで、ペンを装填しないでください。ペンをロードしている間は、ペンの上部にある青いボタン (図 A を参照) に触れないでください。
図A 
図 B 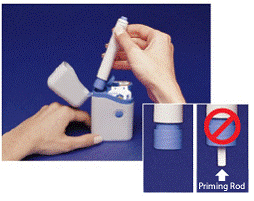
1. キャリングケースのふたを開けます。 2 つのシリンジカートリッジの不正開封防止シールには、「A」と「B」のラベルが付けられています ( 図 A 挿入図 )。
投与量を追跡するのに役立つように、「B」とマークされたシリンジカートリッジの前に、常に「A」とマークされたシリンジカートリッジを使用してください。 キャリング ケースを最初に開いたときに、いずれかのシールが壊れているか紛失している場合は使用しないでください。
2. 不正開封防止シールの 1 つをはがします ( 図A )。封印を捨てる。シリンジカートリッジの蓋を開けます。
3. ペンの上部の隆起部分を持ちます。ペンをキャリング ケースから取り出します ( 図 B )。
白いプライミング ロッドがペンの下端から突き出ていないことを確認します ( 図 B 挿入図 )。はみ出している場合は、ペンをキャリング ケースに戻し、カチッと音がするまでしっかりと押し込みます。ペンをキャリング ケースから取り出します。
図 C 
4. ペンをカートリッジ パックに入れます。それ以上回らなくなるまで右(時計回り)に回します(約半回転)。 図 C )。
5. ロードされたペンの隆起部分を持ち、まっすぐ引き抜きます (参照)。 図 D )。ペンを強く引っ張る必要があるかもしれませんが、これは正常です。青いボタンはまだ押さないでください。
図 D 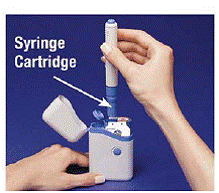
ペンを使用する準備が整いました。 しない ロードしたペンをキャリング ケースに戻してください。針が損傷する可能性があります。
IMITREX STAT 線量ペンを使用して薬を服用する方法
薬を注射する前に、脂肪組織層のある領域を選択してください (図 E または図 F を参照)。薬をどこに注射するかについて質問がある場合は、医療提供者に尋ねてください。
イミトレックスを注射する皮膚の領域を準備するために、注射部位をアルコール綿棒で拭きます。注射を行う前に、この領域に再び触れないでください。
図 E または図 F 図 G 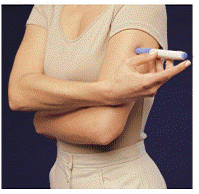
6. 青色のボタンを押さずに、装填したペンを肌にしっかりと押し付けて、灰色のバレルがシリンジ カートリッジを保持する青色のセクションに向かって滑り落ちるようにします ( 図 D )。 (これにより、準備が整うまでペンが誤って発射されないようにする安全キャッチが解除されます。)
7. 青いボタンを押します。ペンをしばらく保持します。 5秒以上 .ペンを皮膚から離すのが早すぎると、すべての薬が出てくるわけではありません。
8 5秒後 、慎重にペンを肌から離してください。針が表示されます (参照 図G )。 針に触れないでください。
薬を服用した後、イミトレックススタットドーズペンを取り出す方法
ペンで服用した直後に、使用済みのシリンジカートリッジをカートリッジパックに戻す必要があります。
図 H 図 I および図 J 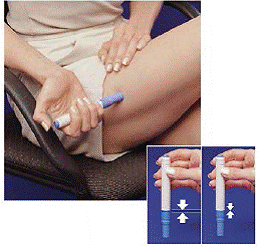
9. ペンをカートリッジ パックの空の側に奥まで押し込みます ( 図 H )。
10. ペンがシリンジ カートリッジから外れるまで、ペンを左 (反時計回り) に約半回転します ( 図Ⅰ )。
11. 空のペンをカートリッジ パックから引き出します ( 図J )。
ペンは使用済みなので、白いプライミング ロッドがペンの下端から突き出ています ( 図J )。
12. 使用済みのシリンジ カートリッジの上にあるカートリッジ パックの蓋を閉じます。使用済みのシリンジ カートリッジが正しく挿入されている場合、カートリッジ パックは使い捨ての保護ケースであり、針刺しを防ぎ、シリンジを正しく使用するのに役立ちます。
13. ペンをキャリング ケースに戻し、カチッと音がするまでしっかりと押し込みます。キャリング ケースのふたを閉じます。これにより、ペンが次の使用に備えます。
ふたが閉まらない場合は、カチッと音がするまでペンを押し下げてください。その後、ふたを閉めます。
使用済みカートリッジパックの取り出し方
両方のシリンジ カートリッジを使用したら、キャリング ケースからカートリッジ パックを取り出します。 シリンジカートリッジを再利用またはリサイクルしないでください。
図 K 図 L 
14. キャリング ケースのふたを開きます。
15. キャリング ケースを片手で持ち、キャリング ケースの両側にある 2 つのボタンを押します ( 図K )。
16. もう一方の手でカートリッジ パックをゆっくりと引き出します ( 図L )。
17. カートリッジ パックを廃棄するか、医療提供者の指示に従って廃棄してください。使用済みの注射針や注射器の廃棄については、州および地域の特別な法律がある場合があります。常に子供の手の届かないところに保管してください。
新しいカートリッジパックの挿入方法
図 M 図 N および図 O 
18. 新しいカートリッジ パックを箱から取り出します。 不正開封防止シールを剥がさないでください (図 M を参照)。
19. カートリッジ パックをキャリング ケースに入れます。スムーズにスライドさせます( 図N )。
20. キャリング ケースの穴から 2 つのボタンが見えると、カートリッジ パックが所定の位置にカチッとはまります。 図 O )。ふたを閉めます。
この患者情報および使用説明書は、米国食品医薬品局によって承認されています。
