Maxalt 5mg, 10mg Rizatriptan 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
マクサルトとは何ですか?
マクサルトは、片頭痛の症状を治療するために使用される処方薬です。 Maxalt 10mg は、単独で使用することも、他の薬と併用することもできます。
マクサルトは、セロトニン 5-HT 受容体アゴニストと呼ばれる種類の薬に属しています。抗片頭痛剤。
マクサルト 5mg が 6 歳未満の子供に安全で有効であるかどうかはわかっていません。
マクサルトの副作用は?
マクサルトは、次のような重大な副作用を引き起こす可能性があります。
- 突然の激しい腹痛、
- 血便、
- 冷感、
- 手足のしびれ、
- 激しい頭痛、
- ぼやけた視界、
- 首や耳がドキドキする
- 胸の痛みや圧迫感、
- あごや肩に広がる痛み
- 吐き気、
- 発汗、
- 攪拌、
- 幻覚、
- 熱、
- 震え、
- 速い心拍数、
- 筋肉の硬直、
- けいれん、
- 調整の喪失、
- 吐き気、
- 調整の喪失、
- 嘔吐、
- 下痢、
- 突然のしびれや衰弱(特に体の片側)、
- 突然の激しい頭痛、
- ろれつが回らない、そして
- 視覚またはバランスの問題
上記の症状がある場合は、すぐに医療機関を受診してください。
マクサルトの最も一般的な副作用は次のとおりです。
- めまい、
- 眠気、
- 疲労感と
- のどや胸の痛みや圧迫感
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、マクサルトの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
MAXALT 10mg には、選択的 5-ヒドロキシトリプタミン 1B/1D (5-HT1B/1D) 受容体アゴニストである安息香酸リザトリプタンが含まれています。
リザトリプタン安息香酸塩は、化学的に次のように記述されています。
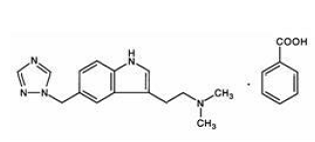
その実験式は C15H19N5•C7H6O2 で、遊離塩基の分子量は 269.4 です。リザトリプタン安息香酸塩は、白色からオフホワイトの結晶性固体で、25°C で 1 mL あたり約 42 mg (遊離塩基として表される) で水に溶解します。
MAXALT 5mg 錠剤および MAXALT-MLT 口腔内崩壊錠は、5 および 10 mg の濃度で経口投与できます (それぞれ安息香酸塩 7.265 mg または 14.53 mg に相当)。各圧縮錠剤には、次の不活性成分が含まれています: ラクトース一水和物、微結晶性セルロース、アルファ化デンプン、酸化第二鉄 (赤)、およびステアリン酸マグネシウム。各凍結乾燥口腔内崩壊錠には、ゼラチン、マンニトール、グリシン、アスパルテーム、ペパーミントフレーバーの不活性成分が含まれています。
適応症
MAXALT(登録商標)およびMAXALT-MLT(登録商標)は、成人および6~17歳の小児患者における、前兆のあるまたはない片頭痛の急性治療に適応される。
使用制限
- MAXALT は、片頭痛の明確な診断が確立されている場合にのみ使用してください。患者が MAXALT 10mg で治療された最初の片頭痛発作に対して反応がない場合、その後の発作を治療するために MAXALT 5mg を投与する前に、片頭痛の診断を再考する必要があります。
- MAXALT 10mg は、片麻痺または脳底片頭痛の管理に使用することは適応されていません。 禁忌 ]。
- MAXALT 10mg は、片頭痛発作の予防には適応されません。
- 群発頭痛に対するMAXALT 5mgの安全性と有効性は確立されていません。
投薬と管理
成人における投与情報
成人の片頭痛の急性治療の場合、MAXALT の推奨開始用量は 5 mg または 10 mg です。 10 mg の用量は 5 mg の用量よりも大きな効果をもたらす可能性がありますが、副作用のリスクが高くなる可能性があります [ 臨床研究 ]。
大人の再投与
2回目以降の投与の有効性はプラセボ対照試験で確立されていませんが、片頭痛が再発した場合は、最初の投与の2時間後に2回目の投与を行うことができます. 1 日最大用量は、24 時間で 30 mg を超えてはなりません。平均して、30 日間に 4 つ以上の頭痛を治療することの安全性は確立されていません。
小児患者(6~17歳)の投与情報
小児患者への投与量は、患者の体重に基づいています。 MAXALT 10mg の推奨用量は、体重が 40 kg (88 ポンド) 未満の患者では 5 mg、体重が 40 kg (88 ポンド) 以上の患者では 10 mg です。
6 歳から 17 歳の小児患者における 24 時間以内に複数回の MAXALT 投与による治療の有効性と安全性は確立されていません。
MAXALT-MLT口腔内崩壊錠の投与
MAXALT-MLT口腔内崩壊錠は、液体での投与は不要です。口腔内崩壊錠は、外側のアルミニウム パウチ内のブリスターに包装されており、患者は投与直前まで外側のパウチからブリスターを取り出さないでください。その後、ブリスターパックを乾いた手で剥がし、口腔内崩壊錠を舌の上に置き、舌で溶かして唾液と一緒に飲み込みます。
プロプラノロールを服用している患者の用量調整
成人患者
プロプラノロールを服用している成人患者では、MAXALT 5 mg の 5 mg 用量のみが推奨され、24 時間に最大 3 回の用量 (15 mg) までが推奨されます [ 薬物相互作用 と 臨床薬理学 ]。
小児患者
体重が 40 kg (88 lb) 以上の小児患者で、プロプラノロールを服用している場合は、MAXALT の 5 mg の単回投与のみが推奨されます (24 時間での最大投与量は 5 mg)。 MAXALT は、体重が 40 kg (88 ポンド) 未満のプロプラノロール治療を受けている小児患者には処方されるべきではありません [参照 薬物相互作用 と 臨床薬理学 ]。
供給方法
剤形と強度
マクサルト錠
- mg 錠剤は、淡いピンク色のカプセル型の圧縮錠剤で、片面に MRK、もう片面に 266 とコード化されています。
- 10 mg 錠剤は、淡いピンク色のカプセル型の圧縮錠剤で、片側に MAXALT 5 mg、反対側に MRK 267 とコード化されています。
MAXALT-MLT口腔内崩壊錠
- mg 口腔内崩壊錠は、白からオフホワイトの丸い凍結乾燥錠で、片面に修正された三角形がデボス加工されています。
- 10 mg 口腔内崩壊錠は、白色からオフホワイトの丸い凍結乾燥錠で、片面に修正された四角形の型押し加工が施されています。
保管と取り扱い
No. 3732 - マクサルト錠 5mg 、淡いピンク色のカプセル型の圧縮された錠剤で、コード化されています
一方がMRK、もう一方が266:
NDC 0006-0266-18、18 錠入りカートン。
No. 3733 - マクサルト 5mg 錠、10mg 、淡いピンク色のカプセル型の圧縮錠剤で、片面に MAXALT 10mg、もう片面に MRK 267 とコード化されています。
NDC 0006-0267-18、18 錠入りカートン。
No. 3800 - MAXALT-MLT 口腔内崩壊錠、5 mg 、白色からオフホワイトの円形の凍結乾燥口腔内崩壊錠で、片面に修正された三角形がデボス加工されており、サイズは 10.0 ~ 11.5 mm (左右) で、ペパーミントの風味があります。口腔内崩壊錠は、アルミパウチ(サシェ)にブリスター包装されています。それらは次のように提供されます。
NDC 0006-3800-18 口腔内崩壊錠3錠(計18錠)の携帯用ケース×6個。
No. 3801 - MAXALT-MLT 口腔内崩壊錠、10 mg は、白からオフホワイトの丸い凍結乾燥口腔内崩壊錠で、片面に修正された正方形がデボス加工されており、サイズは 12.0 ~ 13.8 mm (左右) で、ペパーミントの風味があります。口腔内崩壊錠は、アルミパウチ(サシェ)にブリスター包装されています。それらは次のように提供されます。
NDC 0006-3801-18 口腔内崩壊錠3錠(計18錠)の携帯用ケース×6個。
保管所
MAXALT 5mg 錠剤は室温、15°C~30°C (59°F~86°F) で保管してください。
MAXALT-MLT 口腔内崩壊錠は室温、15°C~30°C (59°F~86°F) で保管してください。
販売元: MERCK & CO.,INC.,Whitehouse Station, NJ 08889, USA の子会社である Merck Sharp & Dohme Corp.。改訂: 2019 年 10 月
副作用
次の副作用については、ラベルの他のセクションで詳しく説明しています。
- 心筋虚血、心筋梗塞、およびプリンツメタル狭心症 [参照 警告と注意事項 ]。
- 不整脈 [参照 警告と注意事項 ]。
- 胸部、のど、首および/または顎の痛み/圧迫感/圧力 [参照 警告と注意事項 ]。
- 脳血管イベント [参照 警告と注意事項 ]。
- その他の血管痙攣反応 [参照 警告と注意事項 ]。
- 薬物乱用頭痛 [参照 警告と注意事項 ]。
- セロトニン症候群 [参照 警告と注意事項 ]。
- 血圧の上昇 [参照 警告と注意事項 ]。
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
大人
対照臨床試験における発生率
MAXALT に対する副作用は、MAXALT 錠の単回投与または複数回投与を受けた 3,700 人以上の成人患者を含む対照臨床試験で評価されました。 MAXALT による治療中の最も一般的な副作用 (いずれかの治療群で 5% 以上、プラセボよりも多かった) は、無力症/疲労、傾眠、痛み/圧迫感、およびめまいでした。これらの有害反応は、用量に関連しているように見えました。
表 1 に、成人における MAXALT 5mg の単回投与後の有害反応 (発生率が 2% 以上でプラセボよりも高い) を示します。
臨床試験での副作用の頻度は、24 時間以内に 3 回まで服用しても増加しませんでした。副作用の頻度は、片頭痛の予防に一般的に使用される薬(プロプラノロールを含む)、経口避妊薬、または鎮痛薬の併用によっても変化しませんでした。副作用の発生率は、年齢や性別による影響を受けませんでした。有害反応の発生率に対する人種の影響を評価するには、データが不十分でした。
成人における MAXALT の投与に関連して観察されたその他の事象
次のセクションでは、ラベリングの他のセクションでは報告されていない、あまり報告されていない有害事象の頻度が示されています。報告には公開研究で観察された事象が含まれているため、それらの因果関係におけるMAXALT 5mgの役割を確実に決定することはできません.さらに、有害事象の報告に関連する変動性 (有害事象を説明するために使用される用語) は、提供される定量的な頻度推定値の値を制限します。イベント頻度は、MAXALT を使用してイベントを報告した患者数を MAXALT にさらされた患者の総数で割った値として計算されます (N=3716)。報告されたすべてのイベントは、1%以上の発生率で発生したか、薬物の使用に合理的に関連していると考えられています。イベントは、身体システムのカテゴリ内でさらに分類され、次の定義を使用して頻度の低い順に列挙されます。まれな有害な経験は、1/100 から 1/1000 の患者に発生するものです。まれな有害事象は、1/1000 人未満の患者で発生するものです。
全般的: まれに顔面浮腫があった。まれに、失神および浮腫/腫れがありました。
非定型感覚: 頻繁に暖かい感覚がありました。
心臓血管: 動悸が頻繁でした。まれに、頻脈、四肢の冷え、徐脈がありました。
消化器: 下痢と嘔吐が頻繁にありました。まれに、消化不良、舌浮腫、腹部膨満がみられました。
筋骨格: まれに、筋肉の衰弱、こわばり、筋肉痛、筋肉のけいれん/けいれんが見られました。
神経学/精神医学: 感覚鈍麻、多幸感、震えが頻繁に見られました。まれに、めまい、不眠症、混乱/見当識障害、歩行異常、記憶障害、興奮がありました。
呼吸器: 呼吸困難が多かった。咽頭浮腫はまれでした。
特別な感覚: まれに、かすみ目と耳鳴りがありました。まれに目の腫れがありました。
皮膚と皮膚付属物: 頻繁にフラッシングがありました。発汗、かゆみ、発疹、蕁麻疹はまれでした。紅斑、のぼせはまれでした。
MAXALT-MLT 口腔内崩壊錠で見られた副作用プロファイルは、MAXALT 10mg 錠で見られたものと同様でした。
6歳から17歳の小児患者
小児患者の対照臨床試験における発生率
MAXALT-MLT に対する副作用は、6 歳から 17 歳の合計 1382 人の小児患者を含む、片頭痛の急性治療における対照臨床試験 (研究 7) で評価され、そのうち 977 人 (72%) が少なくとも 1 回の投与を受けました。試験治療(MAXALT-MLTおよび/またはプラセボ)の[参照 臨床研究 ]。急性臨床試験で小児患者について報告された有害反応の発生率は、MAXALT を投与された患者とプラセボを投与された患者で同程度でした。小児患者の副作用パターンは、成人と同様であると予想されます。
小児患者における MAXALT-MLT の投与に関連して観察されたその他の事象
次のセクションでは、あまり報告されていない有害事象の頻度を示します。レポートには公開研究で観察されたイベントが含まれているため、因果関係における MAXALT-MLT の役割を確実に決定することはできません。さらに、有害事象の報告に関連する変動性 (有害事象を説明するために使用される用語) は、提供される定量的な頻度推定値の値を制限します。
イベント頻度は、MAXALT-MLT を使用してイベントを報告した 6 ~ 17 歳の小児患者の数を、MAXALT-MLT にさらされた患者の総数で割った値として計算されます (N = 1068)。報告されたすべてのイベントは、1%以上の発生率で発生したか、薬物の使用に合理的に関連していると考えられています。イベントは、システム臓器クラス内でさらに分類され、次の定義を使用して頻度の低い順に列挙されます。まれな有害事象は、小児患者の 1/100 から 1/1000 に発生するものです。まれな有害事象は、1/1000 人未満の患者で発生するものです。
全般的: 頻繁に疲労がありました。
耳と迷路の障害: まれに聴力低下がありました。
胃腸障害: 頻繁に腹部不快感がありました。
神経系障害: まれに、協調異常、注意障害、失神前症がみられました。
精神障害: まれに幻覚が見られました。
市販後の経験
次のセクションでは、臨床現場で発生し、さまざまな監視システムに自発的に報告された潜在的に重要な有害事象を列挙します。列挙されたイベントには、ラベルの他のセクションに既にリストされているもの、または一般的すぎて参考にならないものを除くすべてが含まれます。報告書は世界中の市販後の経験から自発的に報告された事象を引用しているため、事象の頻度とその因果関係における MAXALT 5mg の役割を確実に決定することはできません。
神経学/精神医学: 発作。
全般的: アナフィラキシー/アナフィラキシー様反応、血管性浮腫、喘鳴、中毒性表皮壊死融解症などのアレルギー状態 [参照 禁忌 ]。
特別な感覚: 味覚異常。
薬物相互作用
プロプラノロール
プロプラノロールはリザトリプタンの血漿AUCを70%増加させることが示されているため、プロプラノロールで治療された患者ではMAXALT 5mgの用量を調整する必要があります[ 投薬と管理 と 臨床薬理学 ]。
麦角含有薬
麦角を含む薬は、長期にわたる血管痙攣反応を引き起こすことが報告されています。これらの効果は相加的である可能性があるため、エルゴタミン含有または麦角型の薬剤 (ジヒドロエルゴタミンまたはメチセルジドなど) および MAXALT 5mg を 24 時間以内に使用することは禁忌です [ 禁忌 ]。
その他の 5-HT1 アゴニスト
それらの血管痙攣効果は相加的である可能性があるため、相互に 24 時間以内に MAXALT 10mg と他の 5-HT1 アゴニストを同時投与することは禁忌です。 禁忌 ]。
SSRI/SNRIとセロトニン症候群
セロトニン症候群の症例は、トリプタンと選択的セロトニン再取り込み阻害剤(SSRI)またはセロトニン・ノルエピネフリン再取り込み阻害剤(SNRI)の同時投与中に報告されています[ 警告と注意事項 ]。
モノアミンオキシダーゼ阻害剤
MAXALT は、MAO-A 阻害剤および非選択的 MAO 阻害剤を服用している患者には禁忌です。特定の MAO-A 阻害剤は、リザトリプタンとその代謝産物の全身曝露を増加させた [参照 禁忌 と 臨床薬理学 ]。
警告
の一部として含まれています "予防" セクション
予防
心筋虚血、心筋梗塞、プリンツメタル狭心症
MAXALT は、虚血性または血管痙攣性冠動脈疾患の患者には投与しないでください。 MAXALTの投与後数時間以内に、急性心筋梗塞を含む重篤な心臓の副作用が発生したというまれな報告があります。これらの反応の一部は、既知の冠動脈疾患 (CAD) のない患者で発生しました。 MAXALT 5mg を含む 5-HT1 アゴニストは、CAD の病歴のない患者でも、冠動脈血管攣縮 (プリンツメタル狭心症) を引き起こす可能性があります。
複数の心血管危険因子(例:加齢、糖尿病、高血圧、喫煙、肥満、重度のCADの家族歴)を有するトリプタン未使用患者は、MAXALTを受ける前に心血管評価を受ける必要があります。 CAD または冠動脈血管攣縮の証拠がある場合、MAXALT は投与すべきではありません [ 禁忌 ]。心血管系の評価が陰性の患者については、医学的に監督された環境で最初の MAXALT 用量を投与し、MAXALT 10mg 投与直後に心電図 (ECG) を実施することを考慮する必要があります。心血管系の危険因子を有する MAXALT の断続的な長期使用者では、定期的な心血管系の評価を考慮する必要があります。
不整脈
5-HT1アゴニストの投与後数時間以内に、心室頻拍や心室細動などの生命を脅かす心調律障害が死亡に至ることが報告されています。これらの障害が発生した場合は、MAXALT 10mg を中止してください。
胸、のど、首、および/または顎の痛み/緊張/圧力
他の 5-HT1 アゴニストと同様に、前胸部、喉、首、および顎の圧迫感、痛み、圧迫感、および重さの感覚は、MAXALT 5mg による治療後に一般的に発生し、通常は心臓に起因するものではありません。ただし、心臓起源が疑われる場合は、患者を評価する必要があります。 CAD が示されている患者および Prinzmetal のバリアント狭心症の患者は、5-HT1 アゴニストを受けるべきではありません。
脳血管イベント
脳出血、くも膜下出血、および脳卒中は、5-HT1 アゴニストで治療された患者で発生し、一部は死亡に至りました。多くの場合、脳血管イベントは一次的なものである可能性があり、5-HT1 アゴニストは、経験した症状が片頭痛の結果であるという誤った考えで投与されましたが、そうではありませんでした.また、片頭痛の患者は、特定の脳血管イベント(脳卒中、出血、一過性脳虚血発作など)のリスクが高くなる可能性があります。脳血管イベントが発生した場合は、MAXALT を中止してください。
他の急性片頭痛治療と同様に、以前に片頭痛と診断されていない患者、および非定型症状を呈する片頭痛患者の頭痛を治療する前に、他の潜在的に深刻な神経学的状態を除外するように注意する必要があります. MAXALT は、脳卒中または一過性脳虚血発作の既往のある患者には投与しないでください [ 禁忌 ]。
その他の血管痙攣反応
MAXALT を含む 5-HT1 アゴニストは、末梢血管虚血、胃腸血管虚血および梗塞 (腹痛および血性下痢を伴う)、脾臓梗塞、およびレイノー症候群などの非冠動脈痙攣反応を引き起こす可能性があります。 5-HT1 アゴニストの使用後に非冠動脈痙攣反応を示唆する症状または徴候を経験した患者では、MAXALT 10mg の追加投与を受ける前に、血管痙攣反応の疑いを除外する必要があります。
5-HT1 アゴニストの使用により、一時的および永久的な失明、および重大な部分的視力喪失の報告が報告されています。視覚障害は片頭痛発作の一部である可能性があるため、これらのイベントと 5-HT1 アゴニストの使用との因果関係は明確に確立されていません。
薬の乱用による頭痛
急性片頭痛薬(例えば、エルゴタミン、トリプタン、オピオイド、または複数の薬の組み合わせを月に10日以上)を過剰に使用すると、頭痛が悪化することがあります(薬物乱用頭痛)。薬物乱用頭痛は、片頭痛のような毎日の頭痛、または片頭痛発作の頻度の著しい増加として現れることがあります。過剰に使用された薬物の中止を含む患者の解毒、および離脱症状の治療(頭痛の一時的な悪化を含むことが多い)が必要になる場合があります。
セロトニン症候群
セロトニン症候群は、特に選択的セロトニン再取り込み阻害剤(SSRI)、セロトニンノルエピネフリン再取り込み阻害剤(SNRI)、三環系抗うつ剤(TCA)、およびMAO阻害剤との同時投与中に、MAXALT 10mgを含むトリプタンで発生する可能性があります[参照 薬物相互作用 ]。セロトニン症候群の症状には、精神状態の変化(興奮、幻覚、昏睡など)、自律神経不安定性(頻脈、不安定な血圧、高体温など)、神経筋異常(反射亢進、協調運動障害など)、および/または胃腸症状(吐き気など)が含まれる場合があります。 、嘔吐、下痢)。症状の発症は、セロトニン作動薬の新しい用量またはより多くの用量を受け取ってから数分から数時間以内に発生する可能性があります.セロトニン症候群が疑われる場合は、MAXALT 治療を中止する必要があります。 薬物相互作用 と 患者情報 ]。
血圧の上昇
MAXALT を含む 5-HT1 アゴニストを投与された高血圧の病歴の有無にかかわらず、臓器系の急性障害を伴う高血圧クリーゼを含む血圧の有意な上昇がまれに報告されています。 MAXALT の最大用量 (2 時間ごとに 10 mg、3 回の用量) を投与された健康な若年成人男性および女性患者では、血圧のわずかな上昇 (約 2 ~ 3 mmHg) が観察されました。 MAXALT は、高血圧がコントロールされていない患者には禁忌である [参照 禁忌 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
心筋虚血および/または心筋梗塞、プリンツメタル狭心症、その他の血管痙攣関連イベント、および脳血管イベントのリスク
MAXALT が心筋梗塞や脳卒中などの重篤な心血管系副作用を引き起こす可能性があることを患者に知らせてください。重大な心血管イベントは前兆なしに発生する可能性がありますが、患者は胸痛、息切れ、衰弱、ろれつが回らないなどの徴候や症状に注意する必要があり、徴候や症状が観察された場合は医師に相談する必要があります。患者は、このフォローアップの重要性を知らされるべきです [ 警告と注意事項 ]。
セロトニン症候群
患者は、特に選択的セロトニン再取り込み阻害剤(SSRI)またはセロトニンノルエピネフリン再取り込み阻害剤(SNRI)との併用時に、MAXALT 10mgまたは他のトリプタンの使用に伴うセロトニン症候群のリスクについて注意する必要があります[参照. 警告と注意事項 、 薬物相互作用 、 と 臨床薬理学 ]。
妊娠
潜在的な利益が胎児への潜在的なリスクを正当化する場合を除き、妊娠中に MAXALT を使用してはならないことを患者に知らせる [ 特定の集団での使用 ]。
授乳
授乳中または授乳を計画している場合は、医療提供者に通知するように患者に助言する [参照 特定の集団での使用 ]。
複雑なタスクを実行する能力
片頭痛または MAXALT 10mg による治療は眠気やめまいを引き起こす可能性があるため、片頭痛発作中および MAXALT の投与後に複雑なタスクを実行する能力を評価するように患者に指示してください。
薬の乱用による頭痛
急性片頭痛薬を月に10日以上使用すると頭痛が悪化する可能性があることを患者に伝え、頭痛の頻度と薬物使用を記録するよう患者に勧める(例、頭痛日記をつける)[ 警告と注意事項 ]。
口腔内崩壊錠の包装の取扱いについて
内側の口腔内崩壊錠を使用する準備が整うまで、外側のアルミニウム パウチからブリスターを取り出さないように患者に指示する [ 投薬と管理 ]。
フェニルケトン尿症の患者
フェニルケトン尿症患者には、MAXALT-MLT 口腔内崩壊錠にフェニルアラニン (アスパルテームの成分) が含まれていることを伝えてください。各 5 mg 口腔内崩壊錠には 1.1 mg のフェニルアラニンが含まれ、各 10 mg 口腔内崩壊錠には 2.1 mg のフェニルアラニンが含まれています。 特定の集団での使用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
リザトリプタンの経口発がん性試験は、マウス (100 週間) およびラット (106 週間) で最大 125 mg/kg/日の用量で実施されました。いずれの種においても、リザトリプタンに関連する腫瘍発生率の増加の証拠はありませんでした。試験された最高用量での血漿暴露 (AUC) は、30 mg/日の最大推奨ヒト用量 (MRHD) でのヒトの約 150 (マウス) および 240 倍 (ラット) でした。
突然変異誘発
リザトリプタンは、一連の in vitro および in vivo 遺伝毒性試験で変異原性も染色体異常誘発性もありませんでした。これには、微生物変異誘発 (Ames) アッセイ、in vitro 哺乳動物細胞変異誘発および染色体異常アッセイ、およびマウスでの in vivo 染色体異常アッセイが含まれます。
生殖能力の障害
リザトリプタン (0、2、10、または 100 mg/kg/日) を交配前および交配中に雌ラットに経口投与し、妊娠期間および授乳期間を通じて継続した場合、生殖能力に影響はありませんでした。しかし、発情周期の変化と交配までの時間の遅延が、試験された最高用量で観察されました。生殖毒性に対する影響のない用量 (10 mg/kg/日) での血漿曝露は、MRHD でのヒトの曝露の約 15 倍でした。
リザトリプタン (0、5、35、または 250 mg/kg/日) を交配前および交配中に雄ラットに経口投与したところ、受胎能または生殖能力に障害はありませんでした。テストされた最高用量での血漿曝露(AUC)は、MRHDでのヒトの約550倍でした。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性における MAXALT の使用に関する利用可能なヒトのデータは、主要な先天性欠損症および流産の薬物関連リスクについて結論を出すのに十分ではありません。
動物実験では、リザトリプタンの妊娠中 (ラットの胎児体重の減少) または妊娠中および授乳中 (ラットの子孫の死亡率の増加、体重の減少、および神経行動障害) にリザトリプタンを経口投与した後、それよりも多くの母親の血漿曝露で発生毒性が観察されました。ヒトの治療用量で期待される[参照 動物データ ]。
米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% から 4% および 15% から 20% です。片頭痛のある女性の分娩における主要な先天性欠損症の報告率は 2.2% から 2.9% で、報告された流産率は 17% で、片頭痛のない女性で報告された率と同様です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
片頭痛の女性では、子癇前症や妊娠高血圧症など、母親の周産期に有害な結果が生じるリスクが高くなります。
データ
ヒューマンデータ
MAXALT の妊娠登録では、1998 年から 2018 年にかけて、先天異常やその他の有害な出生結果のパターンは特定されませんでした。は低く、MAXALT の使用に関連する個々の先天性欠損症のリスクの増加を検出するのに十分な検出力を提供しませんでした。さらに、将来の妊娠報告のフォローアップに重大な損失があり、MAXALT と先天異常またはその他の有害な出生結果のパターンとの関連のこの評価をさらに複雑にしました。
スウェーデン医療出生登録簿のデータを使用した研究では、妊娠中にトリプタンまたは麦角を使用したと報告した女性の出生率を、使用しなかった女性の出生率と比較しました。妊娠初期にリザトリプタンにさらされた 157 人の出生のうち、7 人の乳児が奇形を持って生まれました (相対リスク 1.01 [95% CI: 0.40 ~ 2.08])。ノルウェーの医療出生登録からノルウェーの処方箋データベースにリンクされたデータを使用した研究では、妊娠中にトリプタンの処方箋を引き換えた女性と、妊娠前にのみトリプタンの処方箋を引き換えた片頭痛疾患比較グループの妊娠転帰を比較しました。人口統制グループ。妊娠初期にリザトリプタンの処方箋を引き換えた 310 人の女性のうち、10 人は重大な先天性奇形 (OR 1.03 [95% CI: 0.55 to 1.93]) の乳児を持っていましたが、以前にリザトリプタンの処方箋を引き換えた 271 人の女性は、リザトリプタンの処方箋を引き換えませんでした。 、妊娠中、12 人に重大な先天性奇形の乳児がいた (OR 1.48 [95% CI: 0.83 ~ 2.64])。それぞれが集団比較グループと比較された。
動物データ
リザトリプタン (0、2、10、または 100 mg/kg/日) を妊娠中のラットに器官形成を通じて経口投与した場合、試験した最高用量で胎児体重の減少が観察されました。中用量 (10 mg/kg/日) では、胚胎児の発育への悪影響に対する無影響用量であり、血漿曝露 (AUC) は、30 の最大推奨ヒト用量 (MRHD) でのヒトの約 15 倍でした。 mg/日。リザトリプタン (0、5、10、または 50 mg/kg/日) を妊娠中のウサギに経口投与した場合、器官形成の間、胎児への悪影響は観察されませんでした。テストされた最高用量での血漿曝露(AUC)は、MRHDでのヒトの115倍でした。胎児への薬物の胎盤移行は、両方の種で実証されました。
リザトリプタン (0、2、10、または 100 mg/kg/日) を交配前および交配中に雌ラットに経口投与し、妊娠期間および授乳期を通じて継続して投与すると、出生時および授乳期を通じて、最低体重を除いて、子の体重が減少しました。テストされた用量 (2 mg/kg/日)。出生後の発育に対する悪影響に対する影響のない用量 (2 mg/kg/日) での血漿曝露 (AUC) は、MRHD でのヒトの曝露と同様でした。
リザトリプタンの経口投与 (0、5、100、または 250 mg/kg/日) は、器官形成および授乳期間を通じて、新生児の死亡率、体重の減少 (成人期まで持続)、および子孫の神経行動機能の障害をもたらしましたが、最低用量を除きます。テスト済み。出生後の発育に対する悪影響に対する無影響用量(5 mg/kg/日)での血漿曝露(AUC)は、MRHD でのヒトの約 8 倍でした。
授乳
リスクの概要
母乳中のリザトリプタンまたは活性代謝物の存在、または母乳で育てられた乳児または乳生産に対するリザトリプタンの影響に関するデータはありません。
リザトリプタンはラットの乳汁中に排泄され、乳汁中のレベルは母体血漿中の約 6 倍でした。
母乳育児の発達上および健康上の利点は、MAXALT または MAXALT-MLT に対する母親の臨床的必要性、および MAXALT または MAXALT-MLT または母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
データ
授乳中のラットに 100 mg/kg/日の用量でリザトリプタンを経口投与した後、乳サンプル中のリザトリプタンの薬物濃度は母体の血漿薬物濃度を約 6 倍超えました。
小児用
歳未満の小児患者における安全性と有効性は確立されていません。 6 歳から 17 歳の患者の片頭痛の急性治療における MAXALT 5mg の有効性と安全性は、十分に管理された適切な研究で確立されています [ 臨床研究 ]。
急性臨床試験で小児患者について報告された有害反応の発生率は、MAXALT 5mg を投与された患者とプラセボを投与された患者で同程度でした。小児患者の副作用パターンは、成人と同様であると予想されます。
高齢者の使用
MAXALT 5mg の臨床試験には、65 歳以上の対象者が若い対象者と異なる反応を示すかどうかを判断するのに十分な数の対象者が含まれていませんでした。他の報告された臨床経験では、年配の患者と若い患者の間の反応の違いは確認されていません。
リザトリプタンの薬物動態は、高齢者 (65 歳以上) と若年成人 (n=17) で類似していましたが、一般に、高齢患者の用量選択は、用量範囲の下限から始めて慎重に行う必要があります。これは、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
他の心血管危険因子(例、糖尿病、高血圧、喫煙、肥満、冠動脈疾患の強い家族歴)を有する高齢患者は、MAXALTを受ける前に心血管評価を受ける必要があります。 警告と注意事項 ]。
フェニルケトン尿症の患者
口腔内崩壊錠には、フェニルアラニン(アスパルテームの成分)が含まれています。 5 mg および 10 mg の口腔内崩壊錠には、それぞれ 1.1 mg および 2.1 mg のフェニルアラニンが含まれています。
過剰摂取
成人を対象とした臨床試験では、MAXALT の過剰摂取は報告されていません。
40 mg の MAXALT 5 mg を 1 回または 2 時間間隔で 2 回投与した一部の成人患者は、めまいと眠気を感じました。
12 人の成人被験者が MAXALT 5mg を合計累積投与量 80mg (4 時間以内に投与) で投与された臨床薬理学研究では、被験者のうち 2 人が失神、めまい、第 3 度房室ブロックを含む徐脈、嘔吐、および/または失禁を経験しました。 .
治療を受けた12~17歳の小児片頭痛患者606人(うち432人が少なくとも12か月間治療を受けた)を対象とした長期非盲検試験では、151人の患者(25%)が10mgのMAXALT-MLTを2回服用しました24時間以内。これらの患者のうち 3 人の有害反応には、腹部不快感、疲労、および呼吸困難が含まれていました。
また、MAXALT 10mg の薬理作用から、過剰摂取により高血圧や心筋虚血が起こる可能性があります。 MAXALT の過剰摂取が疑われる患者では、胃腸の除染 (すなわち、胃洗浄とそれに続く活性炭) を考慮する必要があります。臨床症状が観察されない場合でも、臨床および心電図モニタリングを少なくとも 12 時間継続する必要があります。
リザトリプタンの血清濃度に対する血液透析または腹膜透析の影響は不明です。
禁忌
MAXALT 5mg は、以下の患者には禁忌です。
- -虚血性冠動脈疾患(狭心症、心筋梗塞の病歴、または記録された無症候性虚血)、またはその他の重要な基礎となる心血管疾患[参照 警告と注意事項 ]。
- プリンツメタル狭心症を含む冠動脈血管痙攣 [参照 警告と注意事項 ]。
- 脳卒中または一過性脳虚血発作(TIA)の病歴[参照 警告と注意事項 ]。
- 末梢血管疾患 (PVD) [参照 警告と注意事項 ]。
- 虚血性腸疾患 [参照 警告と注意事項 ]。
- コントロールされていない高血圧 [参照 警告と注意事項 ]。
- 別の 5-HT1 アゴニスト、エルゴタミン含有薬、または麦角型薬(ジヒドロエルゴタミンやメチセルギドなど)の最近の使用(つまり、24 時間以内)[参照 薬物相互作用 ]。
- 片麻痺または脳底片頭痛[参照 適応症 ]。
- -MAO-A阻害剤の同時投与または最近の中止(すなわち、2週間以内)[参照 薬物相互作用 と 臨床薬理学 ]。
- リザトリプタンまたはいずれかの賦形剤に対する過敏症(血管性浮腫およびアナフィラキシーが見られる)[参照 有害反応 ]。
臨床薬理学
作用機序
リザトリプタンは、クローン化されたヒト 5-HT1B/1D 受容体に高い親和性で結合します。 MAXALT 10mg は、頭蓋内血管および三叉神経系の感覚神経に位置する 5-HT1B/1D 受容体に結合することにより、片頭痛の治療に治療効果を発揮すると考えられています。
薬物動態
吸収
リザトリプタンは経口投与後、完全に吸収されます。 MAXALT 10mg 錠剤の平均経口絶対バイオアベイラビリティは約 45% で、平均ピーク血漿濃度 (Cmax) は約 1 ~ 1.5 時間 (Tmax) で到達します。片頭痛の存在は、リザトリプタンの吸収または薬物動態に影響を与えるようには見えませんでした。食物はリザトリプタンのバイオアベイラビリティに大きな影響を与えませんが、ピーク濃度に達する時間を 1 時間遅らせます。臨床試験では、食品に関係なく MAXALT 10mg が投与されました。
リザトリプタンのバイオアベイラビリティと Cmax は、MAXALT 錠と MAXALT-MLT 口腔内崩壊錠の投与後に類似していましたが、吸収速度は MAXALT-MLT の方がやや遅く、Tmax は最大 0.7 時間遅れました。リザトリプタンの AUC は、男性よりも女性で約 30% 高い。複数回の投与で蓄積は発生しませんでした。
分布
平均分布量は、男性被験者で約 140 リットル、女性被験者で約 110 リットルです。リザトリプタンの血漿タンパク質への結合は最小限 (14%) です。
代謝
リザトリプタン代謝の主な経路は、モノアミンオキシダーゼ-A (MAO-A) による酸化的脱アミノ化を介して、5-HT1B/1D 受容体で活性ではないインドール酢酸代謝物になります。 5-HT1B/1D 受容体で親化合物と同様の活性を持つ代謝産物である N-モノデスメチル-リザトリプタンがわずかに形成されます。 N-モノデスメチル-リザトリプタンの血漿中濃度は、親化合物の約 14% であり、同様の速度で排出されます。他の微量代謝産物、N-オキシド、6-ヒドロキシ化合物、および 6-ヒドロキシ代謝産物の硫酸抱合体は、5-HT1B/1D 受容体で活性ではありません。
排除
14C-リザトリプタン 10 mg を 1 回経口投与した後の 120 時間にわたって尿中および糞中に回収された投与量の総放射能は、それぞれ 82%および 12%であった。 14C-リザトリプタンの経口投与後、リザトリプタンは循環血漿放射能の約 17% を占めた。経口投与量の約 14% が未変化のリザトリプタンとして尿中に排泄され、51% がインドール酢酸代謝物として排泄され、実質的な初回通過代謝が示されます。
男性および女性におけるリザトリプタンの血漿半減期は、平均 2 ~ 3 時間です。
シトクロム P450 アイソフォーム
リザトリプタンは、ヒト肝シトクロム P450 アイソフォーム 3A4/5、1A2、2C9、2C19、または 2E1 の活性の阻害剤ではありません。リザトリプタンはシトクロム P450 2D6 の競合的阻害剤 (Ki = 1400 nM) ですが、臨床的に無関係な高濃度でのみ作用します。
特別な集団
高齢者
健康な高齢者の非片頭痛患者ボランティア (65 ~ 77 歳) におけるリザトリプタンの薬物動態は、若い非片頭痛患者ボランティア (18 ~ 45 歳) の場合と同様でした。
小児科
リザトリプタンの薬物動態は、6 ~ 17 歳の小児片頭痛患者で測定されました。体重 20 ~ 39 kg (44 ~ 87 ポンド) の小児患者に MAXALT-MLT 5 mg を単回投与した場合、または体重 40 kg (88 ポンド) 以上の小児患者に MAXALT-MLT 10 mg を単回投与した場合の曝露は、単回投与後に観察された曝露と同様でした。成人への 10 mg MAXALT-MLT の投与。
性別
リザトリプタン(経口 10 mg)の平均 AUC0-∞ と Cmax は、男性と比較して女性でそれぞれ約 30% と 11% 高く、Tmax はほぼ同じ時間に発生しました。
肝障害
軽度から中等度のアルコール性肝硬変による肝機能障害患者への経口投与後、リザトリプタンの血漿中濃度は、肝機能が正常な被験者の対照群と比較して、軽度の肝不全患者で類似していました。リザトリプタンの血漿中濃度は、中程度の肝不全患者で約 30% 高かった。
腎障害
腎機能障害患者(クレアチニンクリアランス 10-60 mL/min/1.73 m2)では、リザトリプタンの AUC0-∞ は腎機能が正常な被験者と有意な差はありませんでした。しかし、血液透析患者 (クレアチニンクリアランス
人種
薬物動態データは、アフリカ系アメリカ人と白人の被験者の間に有意差がないことを明らかにしました。
薬物相互作用
[こちらもご覧ください 薬物相互作用 ]
モノアミンオキシダーゼ阻害剤
リザトリプタンは、主にモノアミン酸化酵素「A」サブタイプ (MAO-A) を介して代謝されます。リザトリプタンの血漿中濃度は、選択的 MAO-A 阻害剤 (例、モクロベミド) または非選択的 MAO 阻害剤 [タイプ A および B] (例、イソカルボキサジド、フェネルジン、トラニルシプロミン、およびパルギリン) である薬物によって増加する可能性があります。薬物相互作用研究では、MAXALT 10 mg を選択的で可逆的な MAO-A 阻害剤であるモクロベミド 150 mg tid との併用療法を受けている被験者 (n=12) に投与した場合、リザトリプタンの AUC と Cmax が平均 119% 増加し、それぞれ 41%。リザトリプタンの活性 N-モノデスメチル代謝物の AUC は 400% 以上増加しました。相互作用は、不可逆的な MAO 阻害剤でより大きくなると予想されます。選択的 MAO-B 阻害剤を投与されている患者では、薬物動態学的相互作用は予想されません。 禁忌 と 薬物相互作用 ]。
プロプラノロール
プロプラノロール 240 mg/日とリザトリプタン 10 mg 単回投与を健康成人 (n=11) に同時投与した研究では、プロプラノロール投与中にリザトリプタンの平均血漿 AUC が 70% 増加し、4 倍増加しました。 1 科目で観察された。リザトリプタンの活性 N-モノデスメチル代謝産物の AUC は、プロプラノロールの影響を受けませんでした [参照 投薬と管理 と 薬物相互作用 ]。
ナドロール/メトプロロール
薬物相互作用研究では、健康な被験者 (n=12) を対象に、リザトリプタン 10 mg の単回投与の薬物動態に対するナドロール 80 mg またはメトプロロール 100 mg の 12 時間ごとの複数回投与の効果が評価されました。薬物動態学的相互作用は観察されませんでした。
パロキセチン
選択的セロトニン再取り込み阻害薬 (SSRI) のパロキセチン 20 mg/日を 2 週間投与し、MAXALT 10 mg を単回投与した被験者 (n=12) との相互作用に関する研究では、リザトリプタンの血漿中濃度もその安全性プロファイルもパロキセチンの影響を受けた[参照 警告と注意事項 、 薬物相互作用 、 と 患者情報 ]。
経口避妊薬
健康な女性ボランティア (n=18) における MAXALT (10-30 mg/日) の 6 日間の投与中の経口避妊薬の同時投与の研究では、リザトリプタンはエチニルエストラジオールまたはノルエチンドロンの血漿濃度に影響を与えませんでした。
臨床研究
大人
MAXALT 5mg 錠の有効性は、4 つの多施設無作為化プラセボ対照試験で確立されました。これらの研究に登録された患者は、主に女性 (84%) と白人 (88%) で、平均年齢は 40 歳 (範囲は 18 ~ 71 歳) でした。患者は、中等度から重度の頭痛を治療するように指示されました。中等度または重度の頭痛から無痛または軽度の頭痛への軽減と定義される頭痛反応は、投与後最大 2 時間 (研究 1) または最大 4 時間 (研究 2、3、および 4) 評価されました。吐き気、羞明、音恐怖症の関連症状と、投与後 24 時間までの反応の維持を評価しました。 MAXALT 10mg 錠の 2 回目の投与は、研究 1 および 2 で反復性頭痛の治療のために投与後 2 時間から 24 時間で許可されました。追加の鎮痛薬および/または制吐薬は、4 つの研究すべてでレスキューのために最初の治療の 2 時間後に許可されました。
すべての研究で、プラセボを投与された患者と比較して、MAXALT 5 または 10 mg を投与された患者では、治療の 2 時間後に頭痛反応を達成した患者の割合が有意に高かった.別の研究では、2.5 mg の用量はプラセボと差がありませんでした。 10 mgを超える用量は、副作用の発生率の増加と関連していました. 4 つの対照試験の結果を表 2 にまとめます。
異なる臨床試験で得られた結果に基づく薬物性能の比較は、信頼できない場合があります。研究は、異なる時期に、異なる患者サンプルを用いて、異なる研究者によって、異なる基準および/または同じ基準の異なる解釈を採用し、異なる条件(用量、投与レジメンなど)の下で実施されるため、治療反応の定量的推定および応答のタイミングは、研究ごとにかなり異なると予想される場合があります。
プールされた研究 1、2、3、および 4 で治療後 2 時間以内に最初の頭痛反応を達成する推定確率を図 1 に示します。
図 1: 統合された研究 1、2、3、および 4 で 2 時間までに頭痛の初期反応を達成する確率の推定値* 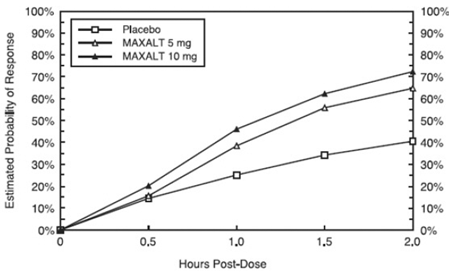
ベースラインで片頭痛に関連する光恐怖症、音恐怖症、および吐き気のある患者では、プラセボと比較して、MAXALT の投与後にこれらの症状の発生率が低下しました。
研究治療の最初の投与から2~24時間後、患者は、研究治療または他の薬物の2回目の投与の形で、疼痛反応のための追加治療を使用することが許可されました。患者が試験治療の初回投与後 24 時間にわたって片頭痛の 2 回目の投与または他の薬を服用する確率の推定値を図 2 にまとめます。
図 2: プールされた研究 1、2、3、および 4* における、研究治療の初回投与後 24 時間にわたって MAXALT 10mg 錠剤または他の片頭痛薬の 2 回目の投与を受ける患者の推定確率* 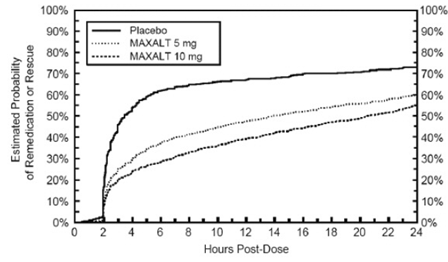
有効性はオーラの存在によって影響を受けませんでした。患者の性別または年齢による。または、一般的な片頭痛予防薬(ベータ遮断薬、カルシウムチャネル遮断薬、三環系抗うつ薬など)または経口避妊薬の併用による。追加の 2 つの同様の研究では、有効性は月経との関係による影響を受けませんでした。有効性に対する人種の影響を評価するにはデータが不十分でした。
MAXALT-MLT口腔内崩壊錠
MAXALT-MLT の有効性は、MAXALT 錠の試験とデザインが類似した 2 つの多施設ランダム化プラセボ対照試験で確立されました (試験 5 および 6)。患者は、中等度から重度の頭痛を治療するように指示されました。これらの研究で治療を受けた患者は、主に女性 (88%) と白人 (95%) で、平均年齢は 42 歳 (範囲 18-72) でした。
どちらの研究でも、プラセボを投与された患者と比較して、MAXALT-MLT 5 または 10 mg を投与された患者では、治療の 2 時間後に頭痛反応を達成した患者の割合が有意に高かった.研究 5 および 6 の結果を表 3 にまとめます。
プールされた研究 5 および 6 で、MAXALT-MLT による治療後 2 時間までに最初の頭痛反応を達成する推定確率を図 3 に示します。
図 3: プールされた研究 5 および 6* で MAXALT-MLT を使用して 2 時間までに頭痛の初期反応を達成する推定確率 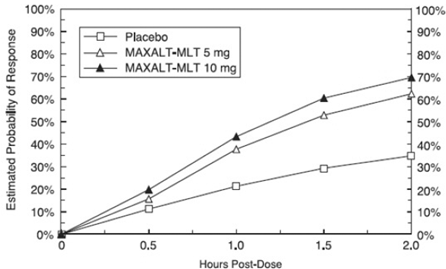
ベースラインで片頭痛に関連する光恐怖症および音恐怖症を有する患者では、プラセボと比較して、MAXALT-MLT の投与後にこれらの症状の発生率が減少しました。
研究治療の最初の投与から2~24時間後、患者は、研究治療または他の薬物の2回目の投与の形で、疼痛反応のための追加治療を使用することが許可されました。患者が試験治療の初回投与後 24 時間に 2 回目の投与または片頭痛の他の薬を服用する確率の推定値を図 4 にまとめます。
図 4: 併合研究 5 および 6* における、研究治療の初回投与後 24 時間に 2 回目の MAXALT-MLT または片頭痛薬を服用している患者の推定確率 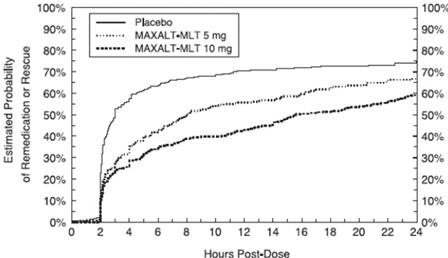
6歳から17歳の小児患者
~ 17 歳の小児患者における MAXALT-MLT の有効性は、多施設、無作為化、二重盲検、プラセボ対照、並行群間臨床試験 (研究 7) で評価されました。患者は、片頭痛発作(前兆の有無にかかわらず)が通常 3 時間以上続く(未治療の場合)、少なくとも 6 か月の病歴が必要でした。患者集団は歴史的に、NSAIDs とアセトアミノフェン療法に反応しませんでした。
患者は、中程度から重度の頭痛の痛みを伴う単一の片頭痛発作を治療するように指示されました.研究の治療段階には 2 つの段階がありました。ステージ 1 は、プラセボの非応答者を特定するために使用され、患者はステージ 2 に入り、患者は MAXALT-MLT またはプラセボに無作為に割り付けられました。体重に基づく投与戦略を使用して、20 kg から
調査対象の患者集団の平均年齢は 13 歳でした。患者の 61% が白人で、患者の 56% が女性でした。プラセボを投与された患者と比較して、MAXALT-MLT を投与された患者では、治療の 2 時間後に頭痛の痛みがないという主要な有効性エンドポイントを達成した患者の割合が有意に高かった (33% 対 24%)。試験 7 の結果を表 4 にまとめます。
MAXALT-MLT による最初の治療後 2 時間以内に頭痛の痛みがなくなった小児患者の割合を図 5 に示します。
図 5: 研究 7 で投与後 2 時間までに頭痛がないと報告した患者の観察されたパーセンテージ 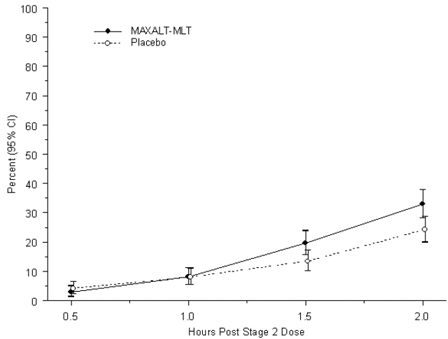
服用後 2 時間での片頭痛関連症状 (悪心、羞明、および音恐怖症) の欠如の探索的エンドポイントの有病率は、MAXALT-MLT を投与された患者とプラセボを投与された患者の間で統計的に有意な差はありませんでした。
患者情報
マクサルト® (max-awlt)
MAXALT-MLT® (安息香酸リザトリプタン)錠・口腔内崩壊錠
MAXALT®の服用を開始する前、および補充を受けるたびに、この患者情報をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医師に相談する代わりにはなりません。
特に明記しない限り、この患者情報リーフレットの情報は、MAXALT 10mg 錠と MAXALT-MLT® 口腔内崩壊錠の両方に適用されます。
マックスアルトとは?
MAXALT は、トリプタンと呼ばれるクラスの医薬品に属する処方薬です。 MAXALT は、従来の錠剤 (MAXALT) と口腔内崩壊錠 (MAXALT-MLT) として入手できます。
MAXALT 5mg と MAXALT-MLT は、成人および 6 ~ 17 歳の子供の前兆の有無にかかわらず、片頭痛発作の治療に使用されます。
MAXALT 5mg は、片頭痛発作の予防には使用できません。
MAXALT は、片麻痺または脳底片頭痛の治療用ではありません。
MAXALT が群発頭痛の治療に安全かつ有効であるかどうかはわかっていません。
6 歳から 17 歳の子供に 24 時間以内に 1 回以上の MAXALT を服用することが安全で効果的であるかどうかはわかっていません。
MAXALT が 6 歳未満の子供に安全で有効であるかどうかはわかっていません。
MAXALTを服用してはいけない人は?
次の場合は MAXALT を服用しないでください。
- 心臓に問題がある、または持っていた
- 脳卒中または一過性脳虚血発作(TIA)を患っている、または患ったことがある
- 虚血性腸疾患を含む血管の問題がある、またはあった
- コントロールされていない高血圧がある
- 過去 24 時間以内に他のトリプタン薬を服用したことがある
- 過去24時間以内に麦角を含む薬を服用した
- 片麻痺または脳底片頭痛がある
- -モノアミンオキシダーゼ(MAO)阻害剤を服用しているか、過去2週間以内にMAO阻害剤を服用した
- リザトリプタン安息香酸塩または MAXALT のいずれかの成分にアレルギーのある方。 MAXALT の全成分リストについては、このリーフレットの最後を参照してください。
上記の状態のいずれかがある場合、またはこれらの薬を服用しているかどうかわからない場合は、この薬を服用する前に医師に相談してください.
MAXALT を服用する前に医師に何を伝えるべきですか?
MAXALTを服用する前に、 次の場合は医師に相談してください。
- 心臓の問題、高血圧、胸の痛み、または息切れを持っている、または持っていた
- 次のような心臓の問題や血管の問題の危険因子があります。
- 高血圧
- 高コレステロール
- 喫煙
- 肥満
- 糖尿病
- 心臓病の家族歴
- あなたは閉経後です
- あなたは40歳以上の男性です
- フェニルケトン尿症(PKU)があります。 MAXALT-MLT 口腔内崩壊錠には、フェニルアラニンが含まれています。
- 腎臓または肝臓に問題がある
- 他の病状がある
- 妊娠している、または妊娠する予定がある。 MAXALT が胎児に害を及ぼすかどうかは不明です。 MAXALT 5mg の服用中に妊娠した場合は、医療提供者に相談してください。
- 授乳中または授乳を計画している。 MAXALT 10mg が母乳に移行するかどうかは不明です。 MAXALT を服用する場合は、赤ちゃんに与える最善の方法について医師に相談してください。
服用しているすべての薬について医師に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。
MAXALT 10mgと他の薬が影響し合い、副作用を引き起こす可能性があります。 MAXALT は他の薬の作用に影響を与える可能性があり、他の薬は MAXALT 5mg の作用に影響を与える可能性があります。
特に次の場合は医師に相談してください。
- インデラル®、インデラル® LA、イノプラン® XL などのプロプラノロール含有医薬品
- 選択的セロトニン再取り込み阻害剤 (SSRI) やセロトニン ノルエピネフリン再取り込み阻害剤 (SNRI) など、気分障害の治療に使用される医薬品。
よくわからない場合は、医師または薬剤師にこれらの薬のリストを尋ねてください。
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医師や薬剤師に見せてください。
MAXALTはどのように服用すればよいですか?
- MAXALT は、医師の指示どおりに服用してください。
- MAXALT 5mg の服用量と服用時期については、医師が説明します。
- MAXALT-MLT を服用するには:
- MAXALT-MLT 口腔内崩壊錠は、服用するまでパッケージに入れたままにしておいてください。服用する準備ができたら:
- ホイルポーチからブリスターを取り出します。 MAXALT-MLT 口腔内崩壊錠をブリスターから押し出さないでください。
- 乾いた手でブリスターパックをはがし、MAXALT-MLT口腔内崩壊錠を舌の上に置きます。錠剤は唾液と一緒に溶けて飲み込みます。口腔内崩壊錠の服用に液体は必要ありません。
- MAXALT-MLT 口腔内崩壊錠は、服用するまでパッケージに入れたままにしておいてください。服用する準備ができたら:
- 最初の MAXALT 10mg の服用後に頭痛が再発した場合:
- 成人:1回目の服用から2時間後に2回目を服用してください。 24 時間に 30 mg 以上の MAXALT を服用しないでください (たとえば、24 時間に 3 個以上の 10 mg 錠剤を服用しないでください)。
- 歳から 17 歳の子供の場合: MAXALT 5mg を 24 時間に 1 回以上服用することが安全で効果的かどうかは不明です。頭痛が治まらない、または再発する場合の対処法について、医師に相談してください。
- MAXALT 5mg を服用しすぎた場合は、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
MAXALTを服用している間、何を避けるべきですか?
MAXALT 5mg は、めまい、脱力感、または失神を引き起こす可能性があります。これらの症状がある場合は、車を運転したり、機械を使用したり、注意が必要なことをしたりしないでください.
MAXALT 5mg の副作用の可能性は何ですか?
MAXALT 5mg は深刻な副作用を引き起こす可能性があります。 次のような MAXALT の重大な副作用があると思われる場合は、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
- 心臓発作。 心臓発作の症状には次のようなものがあります。
- 胸部中央の不快感が数分以上続くか、消えて戻ってくる
- 不快な圧迫感、圧迫感、膨満感、または痛みのような胸の不快感
- 腕、背中、首、顎、または胃の痛みまたは不快感
- 胸の不快感を伴うまたは伴わない息切れ
- 冷や汗をかく
- 吐き気または嘔吐
- めまいがする
- 脳卒中。 脳卒中の症状には、次の突然の症状が含まれる場合があります。
- 顔、腕、または脚のしびれまたは衰弱、特に体の片側
- 混乱、会話や理解の問題
- 片方または両方の目で見る問題
- 歩行障害、めまい、バランスまたは協調の喪失
- 原因不明の激しい頭痛
- 血管の問題。 血管の問題の症状には次のようなものがあります。
- 胃痛
- 血まみれの下痢
- 視力の問題
- 手足の冷えやしびれ
- セロトニン症候群。 セロトニン症候群と呼ばれる状態は、MAXALT などのトリプタン薬を他の特定の薬と一緒に服用すると発生する可能性があります。セロトニン症候群の症状には次のようなものがあります。
- 攪拌
- 幻覚
- 昏睡
- 速い心拍
- 血圧の急激な変化
- 体温上昇
- 筋けいれん
- 協調性の喪失
- 吐き気、嘔吐または下痢
- 血圧上昇。
成人におけるMAXALTの最も一般的な副作用は次のとおりです。
- 眠気や疲労感
- 胸や喉の痛みや圧迫感
- めまい
気になる副作用や治らない副作用がある場合は、医師に相談してください。
MAXALT 10mgを頻繁に服用すると、慢性的な頭痛を引き起こす可能性があります.このような場合は、MAXALT の服用を中止しなければならない可能性があるため、医師に相談してください。
これらは、MAXALT の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA1088 で副作用を FDA に報告できます。
MAXALTの保管方法は?
- MAXALT は 59°F ~ 86°F (15°C ~ 30°C) の室温で保管してください。
- 期限切れまたは不要になった薬を安全に廃棄します。
MAXALT 10mg とすべての医薬品は、子供の手の届かないところに保管してください。
MAXALT の安全で効果的な使用に関する一般情報。
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。 MAXALT が処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っていても、MAXALT を与えないでください。それらに害を及ぼす可能性があります。
この患者情報リーフレットには、MAXALT に関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた MAXALT に関する情報については、薬剤師または医師にお尋ねください。
詳細については、 www.maxalt.com。
MAXALTの成分は?
MAXALT 10mgおよびMAXALT-MLT口腔内崩壊錠の有効成分:
リザトリプタン安息香酸塩。
MAXALTの不活性成分: ラクトース一水和物、微結晶性セルロース、アルファ化デンプン、酸化第二鉄(赤)、ステアリン酸マグネシウム。
MAXALT-MLT口腔内崩壊錠の不活性成分: ゼラチン、マンニトール、グリシン、アスパルテーム、ペパーミントフレーバー。
MAXALT-MLT 口腔内崩壊錠には、フェニルアラニンの供給源であるアスパルテームが含まれています。
フェニルケトン尿薬:
MAXALT-MLT口腔内崩壊錠5mgにはフェニルアラニンが1.1mg含まれています。 MAXALT-MLT口腔内崩壊錠10mgはフェニルアラニンを2.1mg含有しています。
この患者情報は、米国食品医薬品局によって承認されています。
