Imuran 50mg, 25mg Azathioprine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
イムランとは?
イムラン 25mg は、関節リウマチの症状を治療し、移植拒絶反応を予防するために使用される処方薬です。イムランは、単独で使用することも、他の薬と併用することもできます。
イムラン 25mg は、DMARDs、Immunomodulators と呼ばれる薬物のクラスに属します。免疫抑制剤。
イムランの副作用は?
イムラン 25mg は、次のような重大な副作用を引き起こす可能性があります。
- 熱、
- 腫れた腺、
- 体の痛み、
- 寝汗、
- 気分が優れない、
- 薄い肌、
- 発疹、
- あざや出血しやすい、
- 手足の冷え、
- 立ちくらみ、
- 呼吸困難、
- 肩に広がる可能性のある上腹部の痛み、
- 少量食べただけで満腹感が得られ、
- 減量、
- 感染の徴候(発熱、悪寒、脱力感、インフルエンザの症状、喉の痛み、咳、排尿時の痛みまたは灼熱感)、
- 激しい吐き気、
- 嘔吐、
- 下痢、
- 急速な心拍、
- 暗い尿、および
- 皮膚や目の黄変(黄疸)
上記の症状がある場合は、すぐに医療機関を受診してください。
イムラン 50mg の最も一般的な副作用は次のとおりです。
- 吐き気、
- 下痢、
- 胃痛、
- 脱毛、そして
- 皮膚発疹
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、イムランの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
悪性腫瘍
プリン代謝拮抗剤である IMURAN による慢性的な免疫抑制は、ヒトの悪性腫瘍のリスクを高めます。悪性腫瘍の報告には、炎症性腸疾患患者における移植後リンパ腫および肝脾 T 細胞リンパ腫 (HSTCL) が含まれます。この薬を使用する医師は、このリスクと、男性と女性の両方に対する変異原性の可能性、および血液毒性の可能性に精通している必要があります。医師は、イムランによる悪性腫瘍のリスクを患者に知らせる必要があります。見る 警告 .
説明
免疫抑制性代謝拮抗剤であるイムラン(アザチオプリン)は、経口投与用の錠剤の形で入手できます。スコア付きの各錠剤には、50 mg のアザチオプリンと、不活性成分であるラクトース、ステアリン酸マグネシウム、ポテト スターチ、ポビドン、およびステアリン酸が含まれています。
アザチオプリンは、化学的には 6-[(1-メチル-4-ニトロ-1H-イミダゾール-5-イル)チオ]-1H-プリンです。アザチオプリンの構造式は次のとおりです。
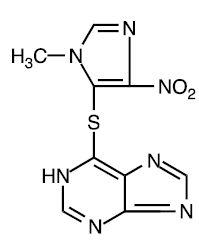
これは 6-メルカプトプリンのイミダゾリル誘導体であり、その生物学的効果の多くは親化合物と類似しています。
アザチオプリンは水に溶けませんが、1モル当量のアルカリを加えると溶けます。アザチオプリンは、中性または酸性 pH の溶液中で安定していますが、過剰の水酸化ナトリウム (0.1N) では、特に加温時にメルカプトプリンへの加水分解が起こります。メルカプトプリンへの変換は、システイン、グルタチオン、硫化水素などのスルフヒドリル化合物の存在下でも起こります。
適応症
IMURAN は、同種腎移植における拒絶反応防止の補助剤として適応されます。また、徴候や症状を軽減するために活動性関節リウマチの管理にも適応されます。
腎臓ホモ移植
IMURAN は、同種腎移植における拒絶反応防止の補助剤として適応されます。 16,000 件を超える移植の経験から、患者の 5 年生存率は 35% から 55% であることが示されていますが、これはドナー、HLA 抗原の一致、抗ドナーまたは抗 B 細胞アロ抗原抗体、およびその他の変数に依存します。これらの変数に対する IMURAN の効果は、対照試験ではテストされていません。
関節リウマチ
IMURAN は、活動性関節リウマチ (RA) の徴候や症状を軽減する治療に適応しています。イムランによる治療中は、アスピリン、非ステロイド性抗炎症薬、および/または低用量グルココルチコイドを継続することができます。 IMURAN 25mg と疾患修飾性抗リウマチ薬 (DMARDs) との併用は、追加の利点または予期しない副作用について研究されていません。これらのエージェントでイムランを使用することはお勧めできません。
投薬と管理
TPMT 検査は、IMURAN を投与されている患者の完全血球計算 (CBC) モニタリングの代わりにはなりません。 TPMT ジェノタイピングまたはフェノタイピングを使用して、TPMT 活性が欠如または低下している患者を特定できます。 TPMT 活性が低い、またはない患者は、従来の用量が投与された場合、IMURAN による重度の生命を脅かす骨髄毒性を発症するリスクが高くなります。医師は、TPMT 活性が低いか、または欠如している患者 (非機能的対立遺伝子のホモ接合体) に対して代替療法を検討する場合があります。 IMURAN 25mg は、1 つの非機能的対立遺伝子 (ヘテロ接合性) を有する患者に注意して投与する必要があります。これらの患者は、従来の用量を投与すると毒性を引き起こす可能性がある TPMT 活性の低下のリスクがあります。 TPMT 活性が低下している患者では、減量が推奨されます。血算結果に異常があり、減量に反応しない患者では、早期の投薬中止を考慮してもよい。
腎臓ホモ移植
拒絶反応を防ぎ、毒性を最小限に抑えるために必要なイムラン 50mg の投与量は、個々の患者によって異なります。これには慎重な管理が必要です。通常、初回投与量は移植時から 1 日 3 ~ 5 mg/kg です。イムランは通常、移植当日に 1 日 1 回投与されますが、まれに移植の 1 ~ 3 日前に投与されます。通常、1 日 1 ~ 3 mg/kg の維持レベルまでの減量が可能です。拒絶反応の恐れがあるため、イムラン 50mg の投与量を毒性レベルまで増やさないでください。同種移植片の拒絶が薬物中止の結果である可能性がある場合でも、重度の血液毒性またはその他の毒性のために中止が必要になる場合があります。
関節リウマチ
イムラン 50mg は、通常、毎日投与されます。初期用量は、1 回または 1 日 2 回のスケジュールで、約 1.0 mg/kg (50 ~ 100 mg) を投与する必要があります。重篤な毒性がなく、初期反応が不十分な場合は、6 ~ 8 週から開始し、その後 4 週間隔で段階的に用量を増やすことができます。用量の増分は、1 日あたり 0.5 mg/kg とし、1 日あたりの最大用量は 2.5 mg/kg です。治療反応は、治療の数週間後、通常は 6 ~ 8 週間後に発生します。適切な試験は、最低 12 週間行う必要があります。 12 週間後に改善しない患者は、難治性と見なすことができます。イムラン 50mg は、臨床反応が得られた患者では長期的に継続することができますが、患者を注意深く監視し、毒性のリスクを減らすために段階的な減量を試みる必要があります。
維持療法は最低有効用量で行う必要があり、他の治療を一定に保ちながら、4 週間ごとに 1 日あたり 0.5 mg/kg または約 25 mg の変化で投与量を段階的に減らすことができます。イムラン 50mg の最適な維持期間は決定されていません。イムランは突然中止することができますが、効果が遅れる可能性があります。
腎機能障害での使用
比較的乏尿患者、特に死体移植直後の尿細管壊死患者は、IMURAN またはその代謝産物のクリアランスが遅れている可能性があり、この薬剤に特に敏感である可能性があり、通常は低用量が投与されます。
この免疫抑制性代謝拮抗薬の適切な取り扱いと廃棄の手順を考慮する必要があります。この主題に関するいくつかのガイドラインが公開されています.25-31 ガイドラインで推奨されているすべての手順が必要または適切であるという一般的な合意はありません。
供給方法
50mg 重なり合った黄色からオフホワイトの円形の錠剤で、各錠剤に「IMURAN」と「50」が刻印されています。 100本入り( NDC 65483-590-10)。
15° ~ 25°C (59° ~ 77°F) の乾燥した場所に保管し、光を避けてください。
参考文献
25. 非経口抗腫瘍薬の安全な取り扱いに関する推奨事項。ワシントン DC: 安全部門。国立衛生研究所の臨床センター薬局部門およびがん看護サービス。 1992. 米国保健社会福祉省。公衆衛生局発行 NIH 92-2621。
26.科学問題に関するAMA評議会。非経口抗腫瘍薬の取り扱いに関するガイドライン。ジャム。 1985; 253:15901592。
27. 細胞毒性暴露に関する国家研究委員会。細胞毒性剤の取り扱いに関する推奨事項。 1987 年。ルイス P. ジェフリー、委員長、細胞毒性暴露に関する全国研究委員会から入手可能。 Massachusetts College of Pharmacy and Allied Health Sciences、179 Longwood Avenue、Boston、MA 02115。
28. オーストラリア臨床腫瘍学会。抗腫瘍薬の安全な取り扱いに関するガイドラインと推奨事項。 Med J Aust. 1983; 1:426-428。
29. ジョーンズ RB、フランク R、マス T. 化学療法剤の安全な取り扱い: マウント サイナイ医療センターからの報告。臨床医のための CA Cancer J。 1983; 33:258-263。
30. 米国病院薬剤師協会。細胞傷害性薬物および有害薬物の取り扱いに関する ASHP 技術支援速報。アム J ホスプ ファームです。 1990; 47:1033-1049。
31. Yodaiken RE、Bennett D. OSHA Work-Practice Guidelines for スタッフが細胞毒性 (抗腫瘍性) 薬を扱う。 Am J Hosp Pharm、1996 年。 43:1193-1204。
Prometheus Laboratories Inc. San Diego, CA 92121 のために Pharmaceutics International, Inc. Hunt Valley, MD 21031 によって製造されました。改訂: 2014 年 2 月
副作用
IMURAN の主な潜在的な深刻な毒性作用は、血液および胃腸です。二次感染および悪性腫瘍のリスクも重大です ( 警告 )。副作用の頻度と重症度は、IMURAN の投与量と期間、および患者の基礎疾患や併用療法によって異なります。腎同種移植レシピエントのグループで遭遇する血液毒性および腫瘍形成の発生率は、関節リウマチに IMURAN 25mg を使用した研究よりも有意に高くなっています。臨床研究における相対発生率を以下に要約します。
血液学
白血球減少症および/または血小板減少症は用量依存性であり、IMURAN による治療過程の後期に発生する可能性があります。減量または一時的な中止により、これらの毒性が回復する可能性があります。骨髄抑制または白血球減少症の二次症状として感染が起こることがありますが、同種腎移植における感染の発生率は、関節リウマチの 30 ~ 60 倍です。大球性貧血を含む貧血、および/または出血が報告されています。
TPMT ジェノタイピングまたはフェノタイピングは、IMURAN による重度の生命を脅かす骨髄抑制のリスクが高い、TPMT 活性が低いかまたは欠如している患者 (機能しない対立遺伝子のホモ接合体) を特定するのに役立ちます。見る 臨床薬理学 、 警告 と 予防 : 臨床検査 .汎血球減少症に関連する死亡は、アザチオプリンを投与されている TPMT 活性のない患者で報告されています.6,20
胃腸
吐き気と嘔吐は、イムラン 50mg による治療の最初の数か月以内に発生する可能性があり、676 人の関節リウマチ患者の約 12% で発生しました。胃の障害の頻度は、分割用量でのおよび/または食後の薬物の投与によってしばしば減少させることができる.しかし、一部の患者では、吐き気と嘔吐が重度で、下痢、発熱、倦怠感、筋肉痛などの症状を伴うことがあります( 予防 )。過敏性膵炎ではまれに腹痛を伴う嘔吐が起こることがあります。血清アルカリホスファターゼ、ビリルビン、および/または血清トランスアミナーゼの上昇による肝毒性のマニフェストは、主に同種移植レシピエントで、アザチオプリンの使用後に発生することが知られています。関節リウマチ患者では、肝毒性はまれです (1% 未満)。移植後の肝毒性は、ほとんどの場合、移植後 6 か月以内に発生し、通常は IMURAN の中断後に元に戻ります。アザチオプリンの慢性投与に関連する、まれではあるが生命を脅かす肝静脈閉塞性疾患が、移植患者および汎ぶどう膜炎のためにイムランを投与された 1 人の患者で報告されています。肝毒性の早期発見に適応。肝静脈閉塞性疾患が臨床的に疑われる場合、IMURAN は永久に中止する必要があります。
その他
低周波の追加の副作用が報告されています。これらには、皮膚発疹、脱毛症、発熱、関節痛、下痢、脂肪便、負の窒素バランス、可逆性間質性肺炎、肝脾T細胞リンパ腫が含まれます( 警告 – 悪性 )、およびスウィート症候群(急性熱性好中球性皮膚症)。
薬物相互作用
アロプリノールと併用
アザチオプリンの不活性化経路の 1 つは、アロプリノールによって阻害されます。イムラン 50mg とアロプリノールを併用している患者は、イムラン 50mg の用量を通常の約 1/3 から 1/4 に減らす必要があります。 TPMT と XO の両方の不活化経路が影響を受けるため、IMURAN 50mg とアロプリノールを投与されている TPMT 活性が低い、または存在しない患者には、さらなる減量または代替療法を検討することをお勧めします。見る 臨床薬理学 、 警告 、 予防 : 臨床検査 と 有害反応 セクション。
アミノサリチル酸との併用
アミノサリチル酸誘導体 (例えば、スルファサラジン、メサラジン、またはオルサラジン) が TPMT 酵素を阻害するという in vitro の証拠があります。これらの薬剤とイムラン 50mg の併用には注意が必要です。
骨髄造血に影響を与える他の薬剤との併用
コトリモキサゾールを含む白血球産生に影響を与える可能性のある薬剤は、特に腎移植レシピエントにおいて、誇張された白血球減少症につながる可能性があります。
アンジオテンシン変換酵素阻害剤との併用
アザチオプリンを服用している患者の高血圧を制御するためのアンギオテンシン変換酵素阻害剤の使用は、貧血および重度の白血球減少症を誘発することが報告されています。
ワルファリンと併用
イムランはワルファリンの抗凝固作用を阻害する可能性があります。
リバビリンとの併用
アザチオプリンを投与されている患者のC型肝炎に対するリバビリンの使用は、重度の汎血球減少症を誘発することが報告されており、アザチオプリン関連の骨髄毒性のリスクを高める可能性があります。イノシン一リン酸デヒドロゲナーゼ (IMDH) は、アザチオプリンの代謝経路の 1 つに必要です。リバビリンは IMDH を阻害することが知られているため、骨髄毒性 (好中球減少症、血小板減少症、および貧血) に関連するアザチオプリン代謝産物である 6-メチルチオイオノシン一リン酸 (6MTITP) の蓄積を引き起こします。リバビリンと一緒にアザチオプリンを投与されている患者は、血小板数を含む完全な血球計算を、治療の最初の 1 か月間は毎週、2 か月目と 3 か月目は 1 か月に 2 回、その後は 1 か月に 1 回、または投与量や他の治療法の変更が必要な場合はそれ以上の頻度で監視する必要があります。
参考文献
6. ファイル上のデータ、Prometheus Laboratories Inc.
20. Schutz E、Gummert J、Mohr F、Oellerich M. チオプリンメチルトランスフェラーゼ欠損心臓移植患者におけるアザチオプリン誘発性骨髄抑制。ランセット。 1993; 341:436。
21. AE、Wiesner RH、LaBrecque DR などを読んでください。腎移植およびアザチオプリン療法に関連する肝静脈閉塞性疾患。アンインターン医。 1986; 104:651-655。
22. Katzka DA、Saul SH、Jorkasky D、他。腎移植患者におけるアザチオプリンと肝静脈閉塞性疾患。消化器科。 1986; 90:446-454。
23. Weitz H、Gokel JM、Loeshke K、他。免疫抑制療法を受けている患者における肝臓の静脈閉塞性疾患。 Virchows Arch A Pathol Anat Histol. 1982; 395:245-256。
警告
悪性
IMURAN 50mg を含む免疫抑制剤を投与されている患者は、特に皮膚のリンパ腫やその他の悪性腫瘍を発症するリスクが高くなります。医師は、イムランによる悪性腫瘍のリスクを患者に知らせる必要があります。皮膚がんのリスクが高い患者の場合と同様に、保護服を着用し、保護係数の高い日焼け止めを使用して、日光と紫外線への曝露を制限する必要があります。
移植後
腎移植患者は悪性腫瘍、主に皮膚がん、細網細胞またはリンパ腫のリスクが高いことが知られています。移植後リンパ腫のリスクは、IMURAN などの免疫抑制薬による積極的な治療を受けている患者で増加する可能性があります。したがって、免疫抑制剤による治療は、有効な最低レベルに維持する必要があります。
関節リウマチ
関節リウマチにおける IMURAN 50mg の使用による悪性腫瘍のリスクに関する情報が入手可能です ( 有害反応 )。 IMURAN による悪性腫瘍の正確なリスクを定義することはできませんでした。このデータは、関節リウマチ患者ではリスクが高くなる可能性があることを示唆していますが、腎移植患者よりは低い.しかし、IMURAN を投与された関節リウマチ患者では、固形腫瘍と同様に急性骨髄性白血病が報告されています。
炎症性腸疾患
まれなタイプの T 細胞リンパ腫である肝脾 T 細胞リンパ腫 (HSTCL) の市販後症例が、IMURAN で治療された患者で報告されています。これらの症例は非常に攻撃的な疾患経過をたどり、致命的でした。報告された症例の大部分は、クローン病または潰瘍性大腸炎の患者で発生しており、大部分は思春期および若年成人男性でした。一部の患者は単独療法として IMURAN で治療され、一部は診断時または診断前に TNFα 遮断薬による併用治療を受けていました。クローン病および潰瘍性大腸炎の治療におけるイムラン 25mg の安全性と有効性は確立されていません。
血球減少症
重度の白血球減少症、血小板減少症、大球性貧血を含む貧血、および/または汎血球減少症が、イムランで治療されている患者に発生する可能性があります。重度の骨髄抑制も発生する可能性があります。中程度のチオプリン S-メチル トランスフェラーゼ (TPMT) 活性を有する患者は、従来の用量の IMURAN を投与された場合、骨髄毒性のリスクが高くなる可能性があります。 TPMT 活性が低い、または欠如している患者は、IMURAN の従来の用量を投与された場合、生命を脅かす重度の骨髄毒性を発症するリスクが高くなります。 TPMTジェノタイピングまたはフェノタイピングは、IMURAN 50mgの毒性を発症するリスクが高い患者を特定するのに役立ちます.2-9 ( 予防 : 臨床検査 )。血液毒性は用量依存性であり、同種移植片が拒絶反応を起こしている腎移植患者ではより深刻になる可能性があります。 IMURAN を服用している患者は、最初の 1 か月間は毎週、治療の 2 か月目と 3 か月目は月 2 回、その後は月 1 回、または投与量の変更やその他の治療法の変更が必要な場合はそれ以上の頻度で、血小板数を含む完全な血球計算を行うことをお勧めします。遅発性血液抑制が起こることがある。白血球数が急速に減少したり、持続的に低い場合、または骨髄抑制の他の証拠がある場合は、投薬量の迅速な減少または薬物の一時的な中止が必要になる場合があります。白血球減少症は治療効果と相関しません。したがって、白血球数を下げるために意図的に用量を増やすべきではありません。
重篤な感染症
イムラン25mgを含む免疫抑制剤を投与されている患者は、潜在感染の再活性化を含む、細菌、ウイルス、真菌、原虫、および日和見感染のリスクが高くなります。これらの感染症は、致命的な結果を含む深刻な結果につながる可能性があります。
進行性多巣性白質脳症
イムランを含む免疫抑制剤で治療された患者で、JC ウイルス関連感染症が進行性多発性白質脳症 (PML) を引き起こし、時には致命的となるケースが報告されています。 PML の危険因子には、免疫抑制療法による治療と免疫機能の障害が含まれます。新たに発症した神経症状を呈する患者では PML の診断を検討し、臨床的に必要な場合は神経科医との相談を検討してください。 PML を発症した患者では、免疫抑制の量を減らすことを検討してください。移植患者では、免疫抑制の低下が移植片に与えるリスクを考慮してください。
動物の精子への影響
IMURAN は、人間の治療用量の 10 倍の用量でマウスの精子形成を一時的に抑制し、精子の生存率と精子数を減少させることが報告されています。
妊娠
妊娠カテゴリーD
イムランを妊婦に投与すると、胎児に害を及ぼす可能性があります。イムラン 50mg は、リスクとベネフィットを慎重に比較検討することなく、妊娠中に投与すべきではありません。可能な限り、妊娠中の患者へのイムランの使用は避けるべきです。この薬は、妊娠中の女性の関節リウマチの治療には使用しないでください.12
IMURAN は、ウサギとマウスにおいて、ヒトと同等の用量 (1 日 5 mg/kg) を投与した場合、催奇形性を示します。異常には、骨格の奇形と内臓の異常が含まれていました.11
IMURAN の腎臓同種移植レシピエントから生まれた少数の乳児に、限定的な免疫学的異常およびその他の異常が発生しています。詳細な症例報告 13 では、妊娠中毎日 150 mg のアザチオプリンと 30 mg のプレドニゾンを投与されている母親から生まれた乳児で、リンパ球減少症、IgG および IgM レベルの低下、CMV 感染、および胸腺陰影の減少が認められました。 10 週間で、ほとんどの機能が正常化されました。 DeWitte らは、母親が毎日 125 mg のアザチオプリンと 12.5 mg のプレドニゾンを投与された早産児の汎血球減少症と重度の免疫不全を報告しました. Williamson と Karp は、母親が妊娠中に毎日 200 mg のアザチオプリンと 20 mg のプレドニゾンを 1 日おきに投与された、軸前多指症で生まれた乳児について説明しました。タリペス・エクイノヴァラス。父親は長期のアザチオプリン療法を受けていた.16
生殖能力のある患者にイムランを使用する前に、利益とリスクを慎重に検討する必要があります。妊娠中の女性を対象とした、十分に管理された研究はありません。妊娠中にこの薬を使用する場合、またはこの薬を服用中に患者が妊娠した場合は、胎児への潜在的な危険性について患者に通知する必要があります。妊娠可能年齢の女性は、妊娠を避けるように助言されるべきです。
予防
全般的
重度の吐き気と嘔吐を特徴とする胃腸過敏反応が報告されています。これらの症状には、下痢、発疹、発熱、倦怠感、筋肉痛、肝酵素の上昇、そして時折低血圧が伴うこともあります。胃腸毒性の症状は、IMURAN 25mg による治療の最初の数週間以内に最も頻繁に発生し、薬物の中止により元に戻ります。この反応は、IMURAN の単回投与による再攻撃後、数時間以内に再発する可能性があります。
臨床検査
完全血球計算 (CBC) モニタリング
IMURAN 25mg を服用している患者は、血小板数を含む完全な血球計算を、治療の最初の 1 か月間は毎週、2 か月目と 3 か月目は月 2 回、その後は月 1 回、または投与量の変更やその他の治療の変更が必要な場合はそれ以上の頻度で行う必要があります。
TPMTテスト
TPMT については、遺伝子型または表現型のいずれかの患者を考慮することをお勧めします。フェノタイピングおよびジェノタイピングの方法は市販されています。 TPMT 活性レベルの低下に関連する最も一般的な非機能的対立遺伝子は、TPMT*2、TPMT*3A、および TPMT*3C です。 2 つの非機能的対立遺伝子 (ホモ接合体) を持つ患者は TPMT 活性が低いか、または欠如しており、1 つの非機能的対立遺伝子 (ヘテロ接合体) を持つ患者は中間の活性を持っています。最近輸血を受けた患者では、正確な表現型検査 (赤血球 TPMT 活性) の結果を得ることができません。 TPMT 検査は、CBC の結果が異常で減量に反応しない患者にも考慮される場合があります。これらの患者では、早期の投薬中止が推奨されます。 TPMT 検査は、IMURAN を投与されている患者の完全血球計算 (CBC) モニタリングの代わりにはなりません。見る 臨床薬理学 、 警告 、 有害反応 と 投薬と管理 セクション。
発がん、突然変異誘発、生殖能力の障害
見る 警告 セクション。
妊娠
催奇形性効果
妊娠カテゴリーD. 見る 警告 セクション。
授乳中の母親
授乳中の母親へのイムラン 25mg の使用は推奨されません。アザチオプリンまたはその代謝産物は、経胎盤および母乳の両方で低レベルで移行されます.母親にとっての薬の重要性。
小児用
小児患者におけるアザチオプリンの安全性と有効性は確立されていません。
参考文献
2. Weinshilboum R. Thiopurine pharmacogenetics: チオプリン メチルトランスフェラーゼの臨床および分子研究。薬物代謝ディスポ。 2001;29:601-605。
3. McLeod HL、Siva C. チオプリン S-メチルトランスフェラーゼ遺伝子座 -- 臨床薬理ゲノミクスへの影響。ファーマコゲノミクス。 2002;3:89-98。
4. Anstey A、Lennard L、Mayou SC、他。アザチオプリンに関連する汎血球減少症 – 一般的な遺伝子多型によって引き起こされる酵素欠損症: レビュー. JR医学会1992; 85:752-756。
5. Stolk JN、Beorbooms AM、de Abreu RA 他関節リウマチ患者におけるアザチオプリン治療のチオプリンメチルトランスフェラーゼ活性の低下および副作用の発生。関節炎リューム。 1998年; 41:18581866.
6. ファイル上のデータ、Prometheus Laboratories Inc.
7. Yates CR、Krynetski EY、Loennechen T、他。チオプリン S-メチルトランスフェラーゼ欠損症の分子診断:アザチオプリンおよびメルカプトプリン不耐症の遺伝的基盤。アンインターン医。 1997; 126:608-614。
8. Black AJ、McLeod HL、Capell HA 他チオプリンメチルトランスフェラーゼ遺伝子型は、アザチオプリンからの治療を制限する重度の毒性を予測します。アンインターン医。 1998年; 129:716-718。
9. Clunie GP、Lennard L. アザチオプリンを受けているリウマチ患者におけるチオプリンメチルトランスフェラーゼ状態の関連性。リウマチ学。 2004; 43:13-18。
10.クラークJM。マウス、キイロショウジョウバエ、ニューロスポラ クラッサにおけるアザチオプリンの変異原性。 Mutat Res. 1975; 28:87-99。
11. ファイル上のデータ、Prometheus Laboratories Inc.
12. タガッツ GE、シモンズ RL。腎移植後の妊娠。アンインターン医。 1975; 82:113-114。編集上の注意。
13.コートCJ、ミューウィッセンHJ、ピカリングRJ。妊娠中に母親に投与されたプレドニゾンとアザチオプリンの新生児への影響。 J Pediatr。 1974; 85:324-328。
14. DeWitte DB、Buick MK、Cyran SE、その他。アザチオプリンとプレドニゾンの出生前投与に関連する新生児汎血球減少症と重度の複合免疫不全。 J Pediatr。 1984; 105:625-628。
15.ウィリアムソンRA、カープLE。アザチオプリンの催奇形性:文献と症例報告のレビュー。 Obstet Gynecol。 1981; 58:247-250。
16. タレント MB、シモンズ RL、ナジャリアン JS。腎臓移植の男性レシピエントの子供の先天異常。ジャム。 1970; 211: 1854-1855。
17. ファイル上のデータ、Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. 妊娠中の免疫抑制: アザチオプリンとその代謝産物の母親から胎児への伝達。 J Obstet Gynecol です。 1973年; 115:1100-1106。
19. Coulam CB、Moyer TP、Jiang NSなど。腎移植後の授乳。移植手続き1982; 14: 605-609。
過剰摂取
マウスおよびラットにおける IMURAN 50 mg の単回投与の経口 LD50 は、それぞれ 2500 mg/kg および 400 mg/kg です。この代謝拮抗物質を非常に大量に投与すると、骨髄形成不全、出血、感染、および死に至る可能性があります。 IMURAN の約 30% は血清タンパク質に結合していますが、約 45% は 8 時間の血液透析中に除去されます.即時の毒性反応は、吐き気、嘔吐、下痢であり、軽度の白血球減少症と肝機能の軽度の異常が続きました。白血球数、SGOT、およびビリルビンは、過剰摂取から 6 日後に正常に戻りました。
禁忌
イムラン 25mg は、この薬に対して過敏症を示している患者には投与しないでください。イムランは妊婦の関節リウマチの治療には使用しないでください。以前にアルキル化剤(シクロホスファミド、クロラムブシル、メルファランなど)で治療された関節リウマチ患者は、IMURAN で治療した場合、悪性腫瘍のリスクが非常に高くなる可能性があります。
参考文献
24. Schusziarra V、Ziekursch V、Schlamp R、他。血液透析下のアザチオプリンの薬物動態。 Int J Clin Pharmacol Biopharm。 1976年; 14:298-302。
臨床薬理学
アザチオプリンは、経口投与後によく吸収されます。最大の血清放射能は、35S-アザチオプリンの経口投与後 1 ~ 2 時間で発生し、5 時間の半減期で減衰します。これは、アザチオプリン自体の半減期の推定ではなく、薬物のすべての 35S 含有代謝物の減衰率です。広範な代謝のため、放射能の一部のみがアザチオプリンとして存在します。通常の用量では、アザチオプリンとそれに由来するメルカプトプリンの血中濃度が低くなります ( 過剰摂取 .
アザチオプリンは、6-メルカプトプリン (6-MP) に代謝されます。どちらの化合物も血液から急速に排出され、赤血球と肝臓で酸化またはメチル化されます。 8 時間後の尿中にアザチオプリンまたはメルカプトプリンは検出されません。 6-メルカプトプリンの活性化は、ヒポキサンチン-グアニン ホスホリボシルトランスフェラーゼ (HGPRT) と、主要な代謝産物として 6-チオグアニン ヌクレオチド (6-TGN) を形成するキナーゼが関与する一連の多酵素プロセスを介して発生します ( 図 1 の代謝スキーム )。アザチオプリンの細胞毒性は、部分的には、DNA への 6-TGN の取り込みによるものです。
6-MP は 2 つの主要な不活化経路を経ます (図 1)。 1 つはチオールのメチル化で、これは酵素チオプリン S-メチルトランスフェラーゼ (TPMT) によって触媒され、不活性な代謝産物であるメチル-6-MP (6-MeMP) を形成します。 TPMT 活性は遺伝子多型によって制御されます.1,2,3 白人とアフリカ系アメリカ人では、人口の約 10% が 1 つの非機能的 TPMT 対立遺伝子 (ヘテロ接合体) を継承し、中間の TPMT 活性を付与し、0.3% が 2 つの非機能的 TPMT 対立遺伝子を継承します。 TPMT 活性が低いか存在しない場合の対立遺伝子 (ホモ接合性)。非機能的対立遺伝子は、アジア人ではあまり一般的ではありません。 TPMT 活性は、赤血球およびおそらく他の造血組織の 6-TGN レベルと逆相関します。これは、これらの細胞のキサンチンオキシダーゼ (他の不活性化経路に関与する) 活性がごくわずかであり、TPMT メチル化が唯一の不活性化経路であるためです。中等度の TPMT 活性を有する患者は、従来の用量の IMURAN を投与された場合、骨髄毒性のリスクが高くなる可能性があります。 TPMT 活性が低い、または欠如している患者は、IMURAN の従来の用量を投与された場合、重度の生命を脅かす骨髄毒性を発症するリスクが高くなります。 2,3,7,8,9 最近輸血を受けた患者では、正確な表現型検査(赤血球 TPMT 活性)の結果を得ることができません。見る 警告 、 予防 : 薬物相互作用 、 予防 : 臨床検査 と 有害反応 セクション。
図1 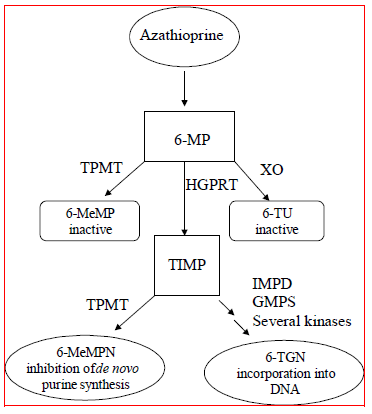 図 1. アザチオプリンの代謝経路: 競合する経路は、TPMT または XO による不活性化、または DNA への細胞毒性ヌクレオチドの取り込みをもたらします。
図 1. アザチオプリンの代謝経路: 競合する経路は、TPMT または XO による不活性化、または DNA への細胞毒性ヌクレオチドの取り込みをもたらします。
GMPS: グアノシン一リン酸合成酵素。 HGPRT: ヒポキサンチン-グアニン-ホスホリボシル-トランスフェラーゼ。 IMPD:イノシン一リン酸デヒドロゲナーゼ。 MeMP: メチルメルカプトプリン; MeMPN: メチルメルカプトプリンヌクレオチド。 TGN:チオグアニンヌクレオチド。 TIMP: チオイノシン一リン酸。 TPMT: チオプリン S-メチルトランスフェラーゼ。 TU チオウ酸; XO: キサンチンオキシダーゼ (Pharmacogenomics 2002; 3:89-98; and Cancer Res 2001; 61:5810-5816 より転載)
別の不活性化経路は酸化であり、これはキサンチンオキシダーゼ (XO) によって触媒されて 6-チオウリン酸を形成します。アロプリノール (ZYLOPRIM®) を投与されている患者におけるキサンチンオキシダーゼの阻害は、これらの患者に必要なアザチオプリンの減量の根拠となっています ( 予防 : 薬物相互作用 )。代謝産物の割合は個々の患者で異なり、これはおそらく、薬の効果の大きさと持続時間がさまざまであることを説明しています。腎臓のクリアランスは、生物学的有効性または毒性を予測する上でおそらく重要ではありませんが、腎機能が低下している患者では減量が行われます。
ホモグラフトサバイバル
腎同種移植片拒絶の阻害のためのアザチオプリンの使用は十分に確立されているが、この作用のメカニズムはいくぶんあいまいである.この薬は、細胞媒介型の過敏症を抑制し、抗体産生にさまざまな変化を引き起こします。 T細胞抑制の除去を含むT細胞効果の抑制は、抗原刺激または生着との時間的関係に依存しています。この薬剤は、確立された移植片拒絶反応または二次反応にはほとんど影響を与えません。
移植レシピエントにおける特定の免疫応答または免疫機能の変化を、アザチオプリンによる免疫抑制と具体的に関連付けるのは困難です。これらの患者は、ワクチンに対する反応が正常以下であり、T 細胞数が少なく、末梢血細胞による食作用が異常ですが、分裂促進反応、血清免疫グロブリン、および二次抗体反応は通常正常です。
免疫炎症反応
アザチオプリンは、自己免疫疾患の動物モデルにおいて、疾患の発現と基礎となる病理を抑制します。例えば、補助関節炎の重症度は、アザチオプリンによって軽減されます。
アザチオプリンが自己免疫疾患に影響を与えるメカニズムは知られていません。アザチオプリンは、抗体応答よりも大幅に抑制される免疫抑制性、遅発性過敏症および細胞毒性試験です。アジュバント関節炎のラットモデルでは、アザチオプリンは、疾患の徴候の発症に先行するリンパ節過形成を阻害することが示されています。動物モデルにおける免疫抑制効果と治療効果の両方は、用量に関連しています。アザチオプリンは遅効性薬と考えられており、薬を中止した後も効果が持続する可能性があります.
参考文献
1. レナード L. 6-メルカプトプリンの臨床薬理学。 Eur J Clin Pharmacol。 1992;43:329-339。
2. Weinshilboum R. Thiopurine pharmacogenetics: チオプリン メチルトランスフェラーゼの臨床および分子研究。薬物代謝ディスポ。 2001;29:601-605。
3. McLeod HL、Siva C. チオプリン S-メチルトランスフェラーゼ遺伝子座 -- 臨床薬理ゲノミクスへの影響。ファーマコゲノミクス。 2002;3:89-98。
4. Anstey A、Lennard L、Mayou SC、他。アザチオプリンに関連する汎血球減少症 – 一般的な遺伝子多型によって引き起こされる酵素欠損症: レビュー. JR医学会1992; 85:752-756。
5. Stolk JN、Beorbooms AM、de Abreu RA 他関節リウマチ患者におけるアザチオプリン治療のチオプリンメチルトランスフェラーゼ活性の低下および副作用の発生。関節炎リューム。 1998年; 41:18581866.
6. ファイル上のデータ、Prometheus Laboratories Inc.
7. Yates CR、Krynetski EY、Loennechen T、他。チオプリン S-メチルトランスフェラーゼ欠損症の分子診断:アザチオプリンおよびメルカプトプリン不耐症の遺伝的基盤。アンインターン医。 1997; 126:608-614。
8. Black AJ、McLeod HL、Capell HA 他チオプリンメチルトランスフェラーゼ遺伝子型は、アザチオプリンからの治療を制限する重度の毒性を予測します。アンインターン医。 1998年; 129:716-718。
9. Clunie GP、Lennard L. アザチオプリンを受けているリウマチ患者におけるチオプリンメチルトランスフェラーゼ状態の関連性。リウマチ学。 2004; 43:13-18。
患者情報
イムランの服用を開始する患者には、薬を服用している間は定期的な血球計算の必要性を知らせ、異常な出血やあざがあれば医師に報告するよう奨励する必要があります。患者はイムランの投与中に感染の危険性を知らされ、感染の徴候と症状を医師に報告するよう求められるべきです。特に、IMURAN が腎機能障害の存在下で、またはアロプリノールと同時に投与されている場合は、慎重な投与量指示を患者に与える必要があります (以下を参照)。 薬物相互作用 サブセクションと 投薬と管理 )。患者は、妊娠中および授乳期間中にイムラン 50mg を使用することの潜在的なリスクについて説明する必要があります。 IMURAN による治療後の悪性腫瘍のリスクの増加について、患者に説明する必要があります。
