Celebrex 100mg, 200mg Celecoxib 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Celebrex 100mg とは何ですか? どのように使用されますか?
セレブレックス 200mg は、急性の痛みや炎症の症状を治療するために使用される処方薬です。セレブレックスは、単独で使用することも、他の薬と併用することもできます。
セレブレックス 100mg は、非ステロイド系抗炎症薬 (NSAID) と呼ばれる種類の薬に属しています。
Celebrex が 2 歳未満の子供に安全で有効であるかどうかはわかっていません。
セレブレックス 100mg の副作用の可能性は何ですか?
Celebrex 200mg は、次のような重大な副作用を引き起こす可能性があります。
- 腫れ、
- 急激な体重増加、
- 呼吸困難、
- 血便またはタール便
- コーヒーかすのような吐血や吐血、
- 吐き気、
- 右上腹部の痛み.
- かゆみ、
- 疲れ、
- 暗い尿、
- 皮膚や目の黄変(黄疸)、
- 排尿がほとんどまたはまったくない、
- 足や足首のむくみ、
- 疲労感、
- 薄い肌、
- 立ちくらみ、および
- 手足が冷える
上記の症状がある場合は、すぐに医療機関を受診してください。
セレブレックスの最も一般的な副作用は次のとおりです。
- 胃痛、
- 胸焼け、
- ガス、
- 下痢、
- 便秘、
- 吐き気、
- 嘔吐、
- 手や足のむくみ、
- めまい、
- d
- かぜの諸症状(鼻づまり、くしゃみ、のどの痛み)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらはセレブレックスの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
重篤な心血管および胃腸イベントのリスク
心血管血栓性イベント
- 非ステロイド性抗炎症薬 (NSAID) は、心筋梗塞や脳卒中などの重篤な心血管血栓性イベントのリスクを高め、致命的になる可能性があります。このリスクは、治療の初期に発生する可能性があり、使用期間とともに増加する可能性があります。 [警告と注意事項を参照]
- セレブレックスは、冠動脈バイパス移植 (CABG) 手術の設定では禁忌です。 [禁忌、警告、注意事項を参照]
消化管出血、潰瘍、および穿孔
- NSAIDs は、胃や腸の出血、潰瘍、穿孔などの重篤な胃腸 (GI) 有害事象のリスクを高め、致命的な場合があります。これらのイベントは、使用中にいつでも発生する可能性があり、警告の症状はありません。高齢患者および消化性潰瘍疾患および/または消化管出血の既往歴のある患者は、重篤な(GI)イベントのリスクが高くなります。 [警告と注意事項を参照]
説明
セレブレックス (セレコキシブ) カプセルは非ステロイド性抗炎症薬で、経口投与用に 50 mg、100 mg、200 mg、および 400 mg のセレコキシブを含むカプセルとして入手できます。化学名は 4-[5-(4-メチルフェニル)-3-(トリフルオロメチル)-1H-ピラゾール-1-イル] ベンゼンスルホンアミドで、ジアリール置換ピラゾールです。分子量は381.38です。その分子式は C17H14F3N3O2S で、次の化学構造を持っています。
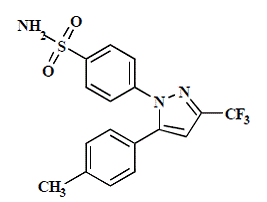
セレコキシブは白色からオフホワイトの粉末で、pKa は 11.1 (スルホンアミド部分) です。セレコキシブは疎水性 (log P は 3.5) であり、生理的 pH 範囲で水性媒体に実質的に不溶です。
セレブレックス 200mg の不活性成分には、クロスカルメロース ナトリウム、食用インク、ゼラチン、乳糖一水和物、ステアリン酸マグネシウム、ポビドン、ラウリル硫酸ナトリウムが含まれます。
適応症
セレブレックスと表記されています
変形性関節症(OA)
OA の徴候と症状の管理 [参照 臨床研究 ]。
関節リウマチ(RA)
RA の徴候と症状の管理 [参照 臨床研究 ]。
若年性関節リウマチ(JRA)
2 歳以上の患者における JRA の徴候および症状の管理 [参照 臨床研究 ]。
強直性脊椎炎(AS)
AS の徴候と症状の管理 [参照 臨床研究 ]。
急性痛
成人の急性疼痛の管理 [参照 臨床研究 ]。
原発性月経困難症
原発性月経困難症の管理 [参照 臨床研究 ]。
投薬と管理
一般的な投与指示
セレブレックスの使用を決定する前に、セレブレックスおよびその他の治療オプションの潜在的な利点とリスクを慎重に検討してください。個々の患者の治療目標に一致する最短の期間で最低の有効用量を使用する [参照 警告と注意事項 ]。
これらの用量は、食事のタイミングに関係なく投与できます。
変形性関節症
OA の場合、投与量は 1 日 200 mg を 1 回または 100 mg を 1 日 2 回投与します。
関節リウマチ
RAの場合、投与量は100mgから200mgを1日2回です。
若年性関節リウマチ
JRAの場合、小児(2歳以上)は体重による。 10 kg 以上から 25 kg 以下の患者の推奨用量は、1 日 2 回 50 mg です。 25 kg を超える患者の場合、推奨用量は 100 mg を 1 日 2 回です。
カプセルを飲み込むのが困難な患者には、セレブレックス カプセルの内容物をアップルソースに加えることができます。カプセルの内容物全体を小さじ1杯の冷たいまたは室温のアップルソースに慎重に注ぎ、すぐに水で摂取します.アップルソースにふりかけたカプセルの内容物は、冷蔵状態 (2°C ~ 8°C/35°F ~ 45°F) で最大 6 時間安定です。
強直性脊椎炎
AS の場合、セレブレックスの投与量は、1 日 200 mg を 1 回 (1 日 1 回) または分割 (1 日 2 回) します。 6 週間後に効果が観察されない場合は、1 日 400 mg を試す価値があるかもしれません。 1 日 400 mg を 6 週間服用しても効果が見られない場合は、反応が見られない可能性があり、別の治療オプションを検討する必要があります。
急性疼痛の管理と原発性月経困難症の治療
急性疼痛の管理および原発性月経困難症の治療の場合、最初の投与量は 400 mg で、必要に応じて初日に 200 mg を追加します。それ以降の日の推奨用量は、必要に応じて 1 日 2 回 200 mg です。
特別な集団
肝障害
中等度の肝機能障害 (Child-Pugh クラス B) の患者では、用量を 50% 減らします。重度の肝障害のある患者にセレブレックス 100mg を使用することは推奨されません。 警告と注意事項 、 特定の集団での使用 、 と 臨床薬理学 ]。
CYP2C9 基質の代謝不良者
遺伝子型または他の CYP2C9 基質 (ワルファリン、フェニトインなど) の使用歴/経験に基づいて CYP2C9 代謝不良であることが知られている、または疑われる成人患者では、最低推奨用量の半分で治療を開始します。
CYP2C9 の低代謝であることが知られている、または疑われる JRA 患者では、代替治療の使用を検討してください [ 特定の集団での使用 と 臨床薬理学 ]。
供給方法
剤形と強度
セレブレックス(セレコキシブ)カプセル:
50 mg ホワイト、本体とキャップの赤いバンドに逆印刷された白、キャップに 7767、本体に 50 のマーキング。
100 mg ホワイト、本体とキャップの青色のバンドに反転印刷された白色で、キャップに 7767、本体に 100 のマーキングがあります。
200 mg ホワイト、キャップに 7767、ボディに 200 のマーキングが付いたゴールド バンドにホワイトが逆印刷されています。
400 mg ホワイト、キャップに 7767、ボディに 400 のマークが付いたグリーン バンドにホワイトが逆に印刷されています。
保管と取り扱い
セレブレックス(セレコキシブ)50mg カプセルは白で、本体とキャップの赤の帯に白が反転印刷され、キャップに 7767、本体に 50 のマーキングがあり、次のように供給されます。
セレブレックス(セレコキシブ)100mg カプセルは白色で、本体とキャップの青色の帯に白色が逆に印刷され、キャップに 7767、本体に 100 のマーキングがあり、次のように供給されます。
セレブレックス(セレコキシブ) 200mg カプセルは白で、キャップに 7767、本体に 200 のマーキングが施された金色のバンドに白の逆印刷が施されています。次のように供給されます。
セレブレックス(セレコキシブ) 400mg カプセルは白で、裏面に緑の帯に白が印刷されており、theca に 7767、本体に 400 のマーキングがあり、次のように供給されます。
保管所
室温 20°C ~ 25°C (68°F ~ 77°F) で保管してください。 15°C から 30°C (59°F から 86°F) の間で許容されるエクスカーション [参照 USP制御の室温 ]。
配布元: GD Searle LLC, Division of Pfizer Inc, NY, NY 10017. 改訂: 2021 年 4 月
副作用
次の副作用については、ラベルの他のセクションで詳しく説明しています。
- 心血管血栓性イベント [参照 警告と注意事項 ]
- 消化管出血、潰瘍および穿孔 [参照 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- 高血圧 [参照 警告と注意事項 ]
- 心不全および浮腫 [参照 警告と注意事項 ]
- 腎毒性および高カリウム血症 [参照 警告と注意事項 ]
- アナフィラキシー反応 [参照 警告と注意事項 ]
- 深刻な皮膚反応 [参照 警告と注意事項 ]
- 血液毒性 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。しかし、臨床試験からの有害反応情報は、薬物使用に関連すると思われる有害事象を特定し、発生率を概算するための基礎を提供します。
市販前対照臨床試験でセレブレックス治療を受けた患者のうち、約 4,250 人が OA 患者、約 2,100 人が RA 患者、約 1,050 人が術後疼痛患者でした。 8,500 人以上の患者が 200 mg (100 mg を 1 日 2 回、または 200 mg を 1 日 1 回) またはそれ以上のセレブレックス 200 mg を 1 日 2 回投与され、そのうち 400 人以上が 800 mg (400 mg を 1 日 2 回) を投与されました。約 3,900 人の患者がこれらの用量のセレブレックスを 6 か月以上投与されました。そのうち約 2,300 人が 1 年以上、124 人が 2 年以上受けています。
市販前管理関節炎試験
表 1 は、プラセボおよび/または陽性対照群を含む OA または RA 患者を対象に実施された 12 の対照研究から、セレブレックス 100mg を投与された患者の 2% 以上に発生した、因果関係に関係なくすべての有害事象を示しています。これらの 12 の試験は期間が異なり、試験に参加した患者は同じ期間暴露されていない可能性があるため、これらのパーセンテージは累積発生率を捉えていません。
プラセボまたは実薬対照臨床試験では、有害事象による中止率は、セレブレックスを投与された患者で 7.1%、プラセボを投与された患者で 6.1% でした。セレブレックス治療群における有害事象による中止の最も一般的な理由には、消化不良と腹痛がありました (セレブレックス患者の中止の理由として、それぞれ 0.8% と 0.7% が挙げられています)。プラセボを投与された患者のうち、0.6% が消化不良のために中止し、0.6% が腹痛のために中止しました。
セレブレックス(100mg~200mgを1日2回、または200mgを1日1回)で治療した患者の0.1%~1.9%で、以下の有害反応が発生しました。
胃腸: 便秘、憩室炎、嚥下障害、おくび、食道炎、胃炎、胃腸炎、胃食道逆流症、痔核、裂孔ヘルニア、下血、口渇、口内炎、しぶり、嘔吐
心臓血管: 高血圧の悪化、狭心症、冠動脈疾患、心筋梗塞
全般的: 過敏症、アレルギー反応、胸痛、嚢胞NOS、全身浮腫、顔面浮腫、疲労感、発熱、のぼせ、インフルエンザ様症状、疼痛、末梢痛
中枢、末梢神経系: 脚のけいれん、筋緊張亢進、知覚鈍麻、片頭痛、感覚異常、めまい
聴覚と前庭: 難聴、耳鳴り
心拍数とリズム: 動悸、頻脈
肝臓と胆道: 肝酵素上昇(含むSGOT上昇、SGPT上昇)
代謝と栄養: 血中尿素窒素 (BUN) 増加、クレアチンホスホキナーゼ (CPK) 増加、高コレステロール血症、高血糖、低カリウム血症、NPN 増加、クレアチニン増加、アルカリホスファターゼ増加、体重増加
筋骨格: 関節痛、関節症、筋肉痛、滑膜炎、腱炎
血小板(出血または凝固): 斑状出血、鼻出血、血小板血症、
精神的: 食欲不振、不安、食欲増進、うつ、神経過敏、傾眠
ヘミック: 貧血
呼吸器: 気管支炎、気管支痙攣、気管支痙攣悪化、咳、呼吸困難、喉頭炎、肺炎
皮膚と付属物: 脱毛症、皮膚炎、光線過敏症、かゆみ、紅斑性発疹、斑状丘疹性発疹、皮膚障害、皮膚乾燥、発汗亢進、蕁麻疹
適用部位障害: 蜂窩織炎、接触皮膚炎
尿: 蛋白尿、膀胱炎、排尿困難、血尿、排尿回数、腎結石
以下の重篤な有害事象 (因果関係は評価されていません) が患者の 0.1% 未満で発生しました:
心臓血管: 失神、うっ血性心不全、心室細動、肺塞栓症、脳血管障害、末梢壊疽、血栓性静脈炎
胃腸: 腸閉塞、腸穿孔、消化管出血、出血性大腸炎、食道穿孔、膵炎、イレウス
全般的: 敗血症、突然死
肝臓と胆道: 胆石症
ヘムおよびリンパ: 血小板減少症
緊張: 運動失調、自殺[参照] 薬物相互作用 ]
腎臓: 急性腎不全
セレコキシブ長期関節炎安全性研究
[見る 臨床研究 ]
血液学的事象: ヘモグロビンの臨床的に有意な減少 (>2 g/dL) の発生率は、ジクロフェナク 75 mg を 1 日 2 回 (1.3%) またはイブプロフェン 800 mg を 1 日 3 回投与された患者と比較して、セレブレックス 400 mg を 1 日 2 回 (0.5%) 投与された患者の方が低かった 1.9 %。アスピリンの使用の有無にかかわらず、セレブレックスによるイベントの発生率の低下は維持されました[参照 臨床薬理学 ]。
撤退/深刻な有害事象: セレブレックス 100mg、ジクロフェナク、イブプロフェンの有害事象による中止の 9 か月時点でのカプラン・マイヤー累積率は、それぞれ 24%、29%、26% でした。因果関係に関係なく、重篤な有害事象(すなわち、入院を引き起こしたり、生命を脅かしたり、医学的に重要であると感じたりする)の発生率は、治療群間で差はありませんでした(それぞれ8%、7%、8%).
若年性関節リウマチ研究
12 週間の二重盲検の実薬対照試験では、2 歳から 17 歳までの 242 人の JRA 患者がセレコキシブまたはナプロキセンで治療されました。 77 人の JRA 患者がセレコキシブ 3 mg/kg を 1 日 2 回投与され、82 人の患者がセレコキシブ 6 mg/kg を 1 日 2 回投与され、83 人の患者がナプロキセン 7.5 mg/kg を 1 日 2 回投与されました。セレコキシブ治療を受けた患者で最も一般的に (5% 以上) 発生した有害事象は、頭痛、発熱 (発熱)、上腹部痛、咳、鼻咽頭炎、腹痛、吐き気、関節痛、下痢、および嘔吐でした。ナプロキセン治療を受けた患者で最も一般的に発生した (5% 以上) 有害事象は、頭痛、吐き気、嘔吐、発熱、上腹部痛、下痢、咳、腹痛、およびめまいでした (表 2)。ナプロキセンと比較して、1 日 2 回 3 および 6 mg/kg の用量のセレコキシブは、12 週間の二重盲検試験の過程で、成長と発達に目に見える有害な影響を与えませんでした。ブドウ膜炎の臨床的増悪の数またはJRAの全身的特徴に、治療群間で実質的な差はなかった。
上記の二重盲検試験の 12 週間の非盲検延長試験では、202 人の JRA 患者が 1 日 2 回、セレコキシブ 6mg/kg で治療されました。有害事象の発生率は、二重盲検試験中に観察されたものと同様でした。臨床的に重要な予期しない有害事象は発生しませんでした。
その他の承認前試験
強直性脊椎炎研究からの有害事象
合計 378 人の患者が、プラセボおよび実薬対照 AS 研究でセレブレックス 200mg で治療されました。 1 日 1 回 400 mg までの用量が研究されました。 AS研究で報告された有害事象のタイプは、OA/RA研究で報告されたものと同様でした。
鎮痛および月経困難症研究からの有害事象
約 1,700 人の患者が、鎮痛および月経困難症の研究においてセレブレックス 200mg で治療されました。口腔外科手術後の疼痛研究のすべての患者は、研究薬の単回投与を受けました。セレブレックス 200mg の 600mg/日までの投与量が、原発性月経困難症および整形外科手術後の疼痛研究で研究されました。鎮痛および月経困難症研究における有害事象のタイプは、関節炎研究で報告されたものと同様でした。報告された唯一の追加の有害事象は、口腔外科手術後の疼痛研究における抜歯後の歯槽骨炎(ドライソケット)でした。
APC および PreSAP トライアル
長期のプラセボ対照ポリープ予防研究からの有害反応
APC および PreSAP 試験でのセレブレックスへの暴露は、最大 3 年間、毎日 400 mg から 800 mg でした [参照 臨床研究 ]。
一部の有害反応は、関節炎の市販前試験よりも高い割合の患者で発生しました (治療期間は最大 12 週間です。上記の CELEBREX 200mg の市販前対照関節炎試験による有害事象を参照してください)。関節炎の市販前試験と比較して、セレブレックスで治療された患者でこれらの違いが大きかった副作用は次のとおりです。
以下の追加の有害反応は、セレブレックス 100mg を服用している患者の 0.1% 以上および 1% 未満で発生し、長期ポリープ予防試験においてプラセボよりも高い発生率であり、管理された関節炎の市販前試験中に報告されなかったか、または発生しました。長期のプラセボ対照ポリープ予防研究でより高い頻度で:
神経系障害: 脳梗塞
眼疾患: 硝子体浮遊物、結膜出血
耳と迷路: 迷路炎
心疾患: 不安定狭心症、大動脈弁閉鎖不全症、冠動脈アテローム性動脈硬化症、洞性徐脈、心室肥大
血管障害: 深部静脈血栓症
生殖器系および乳房障害: 卵巣嚢腫
調査: 血中カリウム上昇、血中ナトリウム上昇、血中テストステロン低下
怪我、中毒、および手続き上の合併症: 上顆炎、腱断裂
市販後の経験
セレブレックスの承認後の使用中に、以下の有害反応が確認されています。これらの反応は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません
心臓血管: 血管炎、深部静脈血栓症
全般的: アナフィラキシー様反応、血管性浮腫
肝臓と胆道: 肝壊死、肝炎、黄疸、肝不全
ヘムおよびリンパ: 無顆粒球症、再生不良性貧血、汎血球減少症、白血球減少症
代謝: 低血糖、低ナトリウム血症
緊張: 無菌性髄膜炎、老化、無嗅覚症、致命的な頭蓋内出血
腎臓: 間質性腎炎
薬物相互作用
セレコキシブとの臨床的に重要な薬物相互作用については、表 3 を参照してください。
警告
の一部として含まれています 予防 セクション。
予防
心血管血栓性イベント
いくつかのシクロオキシゲナーゼ-2 (COX-2) 選択的および非選択的 NSAID の最大 3 年間の臨床試験では、心筋梗塞 (MI) や脳卒中など、致命的な可能性がある重篤な心血管 (CV) 血栓症のリスクが増加することが示されています。利用可能なデータに基づくと、CV 血栓イベントのリスクがすべての NSAID で同様であることは明らかではありません。 NSAID の使用によってもたらされるベースラインを超える重篤な心血管血栓性イベントの相対的な増加は、既知の心血管疾患または心血管疾患の危険因子がある場合とない場合で同様であるように思われます。しかし、既知の心血管疾患または危険因子を持つ患者は、ベースライン率が高いため、過剰な重篤な心血管血栓イベントの絶対発生率が高くなりました。いくつかの観察研究では、深刻な CV 血栓症のリスクの増加は、治療の最初の数週間で始まったことがわかりました。 CV 血栓リスクの増加は、高用量で最も一貫して観察されています。
APC (セレコキシブによる腺腫予防) 試験では、プラセボと比較して、セレブレックス 400 mg を 1 日 2 回投与した群とセレブレックス 200 mg を 1 日 2 回投与した群で、心血管死、MI、または脳卒中の複合エンドポイントのリスクが約 3 倍増加しました。セレコキシブ投与群とプラセボ治療群の両方での増加は、主に心筋梗塞の発生率の増加によるものでした [参照 臨床研究 ]。
非選択的 NSAID であるナプロキセンおよびイブプロフェンと比較して、COX-2 阻害剤であるセレコキシブの相対的な心血管血栓リスクを評価するために、Celecoxib Integrated Safety vs. Ibuprofen Or Naproxen の Prospective Randomized Evaluation (PRECISION) と題するランダム化比較試験が実施されました。セレコキシブ 100 mg 1 日 2 回投与は、ナプロキセン 375 から 500 mg 1 日 2 回投与、イブプロフェン 600 から 800 mg 1 日 3 回投与に比べて、抗血小板試験の複合エンドポイントで非劣性でした'心血管死(出血死を含む)、非致死性心筋梗塞、非致死性脳卒中からなるコラボレーション(APTC) 臨床研究 ]。
NSAID 治療を受けている患者の有害な CV イベントの潜在的なリスクを最小限に抑えるために、可能な限り短い期間で最小の有効用量を使用してください。医師と患者は、以前の心血管症状がなくても、治療過程全体を通して、そのような事象の発生に注意を払う必要があります。重篤な心血管イベントの症状と、発生した場合の対処法について、患者に説明する必要があります。
アスピリンの同時使用が、NSAID の使用に関連する重篤な CV 血栓イベントのリスク増加を軽減するという一貫した証拠はありません。アスピリンとセレコキシブなどの NSAID の同時使用は、重篤な胃腸(GI)イベントのリスクを高めます。 警告と注意事項 ]。
冠動脈バイパス移植(CABG)手術後の状態
CABG 手術後の最初の 10 ~ 14 日間の痛みの治療のための COX-2 選択的 NSAID の 2 つの大規模な対照臨床試験では、心筋梗塞と脳卒中の発生率の増加が見られました。 NSAIDs は、CABG の状況では禁忌です [参照 禁忌 ]。
MI後の患者
デンマーク国民登録簿で実施された観察研究では、MI 後の期間に NSAID で治療された患者は、治療の最初の週から、再梗塞、心血管関連死、および全死因死亡のリスクが高いことが示されました。この同じコホートでは、MI 後 1 年間の死亡率は、非 NSAID 曝露患者では 100 人年あたり 12 であるのに対し、NSAID 治療患者では 100 人年あたり 20 でした。絶対死亡率は MI 後 1 年目から幾分低下したが、NSAID 使用者の死亡の相対リスクの増加は、少なくともその後 4 年間の追跡調査で持続した。
最近心筋梗塞を発症した患者には、心血管血栓性イベントの再発のリスクを上回る効果が見込めない限り、セレブレックス 100mg の使用を避けてください。心筋梗塞を最近起こした患者にセレブレックスを使用する場合は、心虚血の徴候がないか患者を監視してください。
消化管出血、潰瘍、および穿孔
セレコキシブを含む NSAIDs は、食道、胃、小腸、または大腸の炎症、出血、潰瘍、穿孔などの重篤な胃腸 (GI) 有害事象を引き起こし、致命的な場合があります。これらの重篤な有害事象は、警告症状の有無にかかわらず、セレブレックスで治療された患者にいつでも発生する可能性があります。 NSAID 療法で重篤な上部消化管の有害事象を発症した患者の 5 人に 1 人のみが症状を示します。 NSAID による上部消化管潰瘍、肉眼的出血、または穿孔は、3 ~ 6 か月間治療を受けた患者の約 1%、1 年間治療を受けた患者の約 2% ~ 4% で発生しました。ただし、短期間の NSAID 治療でもリスクがないわけではありません。
消化管出血、潰瘍、および穿孔の危険因子
消化性潰瘍疾患および/または消化管出血の既往歴があり、NSAID を使用した患者は、これらの危険因子のない患者と比較して、消化管出血を発症するリスクが 10 倍以上高くなりました。 NSAID で治療された患者の消化管出血のリスクを高めるその他の要因には、NSAID 治療の長期化が含まれます。経口コルチコステロイド、抗血小板薬(アスピリンなど)、抗凝固薬の併用;または選択的セロトニン再取り込み阻害剤(SSRI);喫煙;アルコールの使用;高齢;および一般的な健康状態が悪い。致命的な消化管イベントに関する市販後の報告のほとんどは、高齢者または衰弱した患者で発生しています。さらに、進行した肝疾患および/または凝固障害のある患者は、消化管出血のリスクが高くなります。
複雑で症候性の潰瘍の発生率は、CLASS 試験の全患者で 9 か月時点で 0.78%、低用量 ASA のサブグループで 2.19% でした。 65 歳以上の患者では、9 か月で 1.40% の発生率があり、ASA を併用した場合は 3.06% でした [ 臨床研究 ]。
NSAID 治療患者の消化管リスクを最小限に抑えるための戦略
- 可能な限り短い期間で最低の有効量を使用してください。
- 一度に複数の NSAID を投与することは避けてください。
- 利点が出血のリスクの増加を上回ると予想される場合を除き、リスクの高い患者への使用は避けてください。そのような患者、および活動性消化管出血のある患者については、NSAIDs 以外の代替療法を検討してください。
- NSAID 治療中は、消化管潰瘍や出血の徴候や症状に注意してください。
- 重篤な胃腸の有害事象が疑われる場合は、直ちに評価と治療を開始し、重大な胃腸の有害事象が除外されるまでセレブレックス 200mg を中止してください。
- 心臓予防のために低用量アスピリンを併用している状況では、消化管出血の証拠について患者をより綿密に監視する[参照 薬物相互作用 ]。
肝毒性
ALT または AST の上昇 (正常 [ULN] の上限の 3 倍以上) が、臨床試験で NSAID 治療を受けた患者の約 1% で報告されています。さらに、劇症肝炎、肝壊死、肝不全などのまれな、時には致命的な重度の肝障害の症例が報告されています。
ALT または AST の上昇 (ULN の 3 倍未満) は、セレコキシブを含む NSAID で治療された患者の最大 15% で発生する可能性があります。
セレブレックス 200mg の対照臨床試験では、肝臓関連酵素のボーダーライン上昇 (正常上限の 1.2 倍以上 3 倍未満) の発生率は、セレブレックスで 6%、プラセボで 5%、約 0.2% でした。セレブレックスを服用している患者の%とプラセボを服用している患者の0.3%で、ALTとASTが著しく上昇しました。
肝毒性の徴候と症状(吐き気、疲労、無気力、下痢、かゆみ、黄疸、右上腹部圧痛、「インフルエンザ様」症状など)について患者に知らせる。肝疾患に一致する臨床徴候や症状が現れた場合、または全身症状(好酸球増加、発疹など)が発生した場合は、セレブレックスを直ちに中止し、患者の臨床評価を行ってください。
高血圧症
セレブレックス 200mg を含む NSAID は、高血圧の新たな発症または既存の高血圧の悪化につながる可能性があり、いずれも CV イベントの発生率の増加に寄与する可能性があります。アンギオテンシン変換酵素 (ACE) 阻害剤、サイアザイド利尿薬またはループ利尿薬を服用している患者は、NSAID を服用している場合、これらの治療に対する反応が損なわれる可能性があります [参照 薬物相互作用 ]。
見る 臨床研究 セレブレックスの追加の血圧データについては。
NSAID 治療の開始時および治療中は、血圧 (BP) を監視します。
心不全と浮腫
Coxib と伝統的な NSAID Trialists'無作為対照試験の共同メタアナリシスでは、COX-2 選択的治療を受けた患者と非選択的 NSAID 治療を受けた患者の心不全による入院が、プラセボ治療を受けた患者と比較して約 2 倍増加したことが示されました。心不全患者を対象としたデンマーク国立登録簿の研究では、NSAID の使用により心筋梗塞、心不全による入院、および死亡のリスクが増加しました。
さらに、体液貯留と浮腫は、NSAID で治療された一部の患者で観察されています。セレコキシブの使用は、これらの病状の治療に使用されるいくつかの治療薬(利尿薬、ACE阻害薬、またはアンギオテンシン受容体遮断薬[ARB]など)のCV効果を鈍らせる可能性があります[ 薬物相互作用 ]。
CLASS研究では[参照 臨床研究 ]、セレブレックス 400 mg を 1 日 2 回 (OA と RA の推奨用量のそれぞれ 4 倍と 2 倍)、イブプロフェン 800 mg を 1 日 3 回、ジクロフェナク 75 mg を 1 日 2 回投与した 9 か月間の末梢性浮腫患者のカプラン・マイヤー累積率それぞれ 4.5%、6.9%、4.7% でした。
重度の心不全患者へのセレブレックス 200mg の使用は、心不全の悪化のリスクを上回ると予想される場合を除き、避けてください。重度の心不全患者にセレブレックス 100mg を使用する場合は、心不全の悪化の徴候がないか患者を監視してください。
腎毒性と高カリウム血症
腎毒性
NSAIDs の長期投与は、腎乳頭壊死およびその他の腎損傷をもたらしました。
腎毒性は、腎プロスタグランジンが腎灌流の維持において代償的役割を果たしている患者にも見られます。これらの患者では、NSAID の投与により、プロスタグランジン情報が用量依存的に減少し、二次的に腎血流が減少し、明らかな腎代償不全が引き起こされる可能性があります。この反応のリスクが最も高い患者は、腎機能障害、脱水、循環血液量減少、心不全、肝機能障害、利尿薬、ACE阻害薬またはARBを服用している患者、および高齢者です。通常、NSAID 療法を中止すると、治療前の状態に戻ります。
進行した腎疾患患者におけるセレブレックス 100mg の使用に関する対照臨床研究からの情報は入手できません。セレブレックスの腎臓への影響は、既存の腎疾患を持つ患者の腎機能障害の進行を早める可能性があります。
セレブレックスを開始する前に、脱水症または血液量減少症の患者の体液量を修正してください。セレブレックスの使用中に、腎障害または肝障害、心不全、脱水症、または血液量減少症の患者の腎機能を監視する[参照 薬物相互作用 ]。腎機能が悪化するリスクを上回ると予想される場合を除き、腎疾患が進行した患者へのセレブレックス 200mg の使用は避けてください。進行した腎疾患の患者にセレブレックス 200mg を使用する場合は、腎機能の悪化の徴候がないか患者を監視してください。
高カリウム血症
高カリウム血症を含む血清カリウム濃度の上昇は、腎機能障害のない一部の患者でさえ、NSAID の使用で報告されています。腎機能が正常な患者では、これらの影響は低アルドステロン症の状態に起因するとされています。
アナフィラキシー反応
セレコキシブは、セレコキシブに対する既知の過敏症の有無にかかわらず、アスピリン感受性喘息患者のアナフィラキシー反応と関連しています。 Celebrex 200mg はスルホンアミドであり、NSAID とスルホンアミドの両方が、アレルギー反応を引き起こし、特定の感受性のある人々において、アナフィラキシー症状や生命を脅かす、または軽度の喘息発作を引き起こす可能性があります。 禁忌 と 警告と注意事項 ]。
アナフィラキシー反応が発生した場合は、緊急の助けを求めてください。
アスピリン感受性に関連する喘息の増悪
喘息患者の亜集団は、鼻ポリープを合併した慢性副鼻腔炎を含む可能性があるアスピリン感受性喘息を有する可能性があります。重度の致命的な気管支痙攣;および/またはアスピリンやその他の NSAID に対する不耐性。アスピリンと他の NSAIDs との交差反応性がアスピリン感受性患者で報告されているため、セレブレックスは、この形態のアスピリン感受性患者には禁忌です [参照 禁忌 ]。既存の喘息患者(アスピリン感受性がない)にセレブレックスを使用する場合は、喘息の徴候や症状の変化について患者を監視してください。
深刻な皮膚反応
多形紅斑、剥離性皮膚炎、スティーブンス・ジョンソン症候群(SJS)、中毒性表皮壊死融解症(TEN)、好酸球増加症および全身症状を伴う薬物反応(DRESS)、および急性全身性発疹性膿疱症( AGEP)。これらの重大なイベントは警告なしに発生する可能性があり、致命的になる可能性があります。
深刻な皮膚反応の兆候と症状について患者に知らせ、皮膚発疹または過敏症の他の兆候が最初に現れた場合は、セレブレックス 100mg の使用を中止してください。セレブレックス 200mg は、以前に NSAIDs に対して重篤な皮膚反応を起こしたことがある患者には禁忌です。 禁忌 ]。
好酸球増加症および全身症状を伴う薬物反応 (DRESS)
セレブレックスなどのNSAIDを服用している患者では、好酸球増加症および全身症状(DRESS)との薬物反応が報告されています。これらのイベントのいくつかは、致命的または生命を脅かすものです。 DRESS は通常、発熱、発疹、リンパ節腫脹、および/または顔面の腫れを示しますが、これに限定されません。他の臨床症状には、肝炎、腎炎、血液学的異常、心筋炎、または筋炎が含まれる場合があります。 DRESS の症状は、急性のウイルス感染に似ている場合があります。好酸球増加症がしばしば存在します。この障害は症状がさまざまであるため、ここに記載されていない他の臓器系が関与している可能性があります。発疹が明らかでない場合でも、発熱やリンパ節腫脹などの過敏症の初期症状が存在する可能性があることに注意することが重要です。そのような徴候や症状がある場合は、セレブレックス 200mg の使用を中止し、直ちに患者を評価してください。
胎児毒性
胎児動脈管の早期閉鎖
妊娠約 30 週以降の妊婦には、セレブレックス 100mg を含む NSAID の使用を避けてください。セレブレックスを含む NSAID は、ほぼこの在胎期間で胎児の動脈管の早期閉鎖のリスクを高めます。
羊水過少症/新生児腎障害
セレブレックスを含むNSAIDを妊娠約20週以降に使用すると、羊水過少症や場合によっては新生児の腎機能障害につながる胎児の腎機能障害を引き起こす可能性があります。これらの有害な転帰は、平均して数日から数週間の治療後に見られますが、NSAID開始後48時間で羊水過少症が報告されることはめったにありません.羊水過少症は、常にではありませんが、多くの場合、治療を中止すれば元に戻ります。長期にわたる羊水過少症の合併症には、例えば、四肢拘縮および肺成熟の遅延が含まれる場合があります。市販後の新生児腎機能障害の一部の症例では、交換輸血や透析などの侵襲的処置が必要でした。
妊娠約20週から30週の間にNSAID治療が必要な場合は、セレブレックスの使用を可能な限り最小の有効用量と最短の期間に制限してください.セレブレックス治療が 48 時間を超える場合は、羊水の超音波モニタリングを検討してください。羊水過少症が発生した場合はセレブレックスを中止し、臨床診療に従ってフォローアップする[参照 特定の集団での使用 ]。
血液毒性
NSAID治療を受けた患者に貧血が発生しました。これは、潜在的または総失血、体液貯留、または不完全に記述された赤血球生成への影響が原因である可能性があります。セレブレックスで治療を受けた患者に貧血の徴候や症状がある場合は、ヘモグロビンまたはヘマトクリットを監視してください。
対照臨床試験では、貧血の発生率は、セレブレックスで 0.6%、プラセボで 0.4% でした。セレブレックス 200mg による長期治療を受けている患者は、ヘモグロビンまたはヘマトクリットをチェックして、貧血または失血の徴候または症状を示す場合に備えてください。
セレブレックス 100mg を含む NSAID は、出血イベントのリスクを高める可能性があります。凝固障害やワルファリン、他の抗凝固薬、抗血小板薬(アスピリンなど)、SSRI、セロトニン・ノルエピネフリン再取り込み阻害薬(SNRI)の併用などの併存疾患は、このリスクを高める可能性があります。これらの患者の出血の徴候を監視します [参照 薬物相互作用 ]。
炎症と発熱のマスキング
セレブレックス 100mg の炎症および場合によっては発熱を軽減する薬理学的活性は、感染を検出する際の診断的徴候の有用性を低下させる可能性があります。
ラボモニタリング
深刻な消化管出血、肝毒性、および腎障害は、警告の症状や徴候なしに発生する可能性があるため、長期の NSAID 治療を受けている患者を定期的に CBC および化学的プロファイルでモニタリングすることを検討してください。 警告と注意事項 ]。
対照臨床試験では、患者の息子プラセボと比較して、CELEBREXを投与された患者でBUNの上昇がより頻繁に発生しました。この臨床検査値の異常は、これらの研究で比較 NSAID を受けた患者にも見られました。この異常の臨床的意義は確立されていません。
播種性血管内凝固症候群 (DIC)
全身性JRAの小児患者にセレブレックス200mgを使用すると、播種性血管内凝固症候群のリスクがあるため、異常な凝固または出血の徴候と症状について患者を監視し、患者とその介護者に症状をできるだけ早く報告するよう通知してください。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド ) 調剤される各処方箋に添付されます。セレブレックスによる治療を開始する前、および治療中は定期的に、患者、家族、またはその介護者に次の情報を知らせてください。
心血管血栓性イベント
胸痛、息切れ、脱力感、ろれつが回らないなどの心血管血栓性イベントの症状に注意し、これらの症状があればすぐに医療提供者に報告するように患者に助言する[参照 警告と注意事項 ]。
消化管出血、潰瘍、および穿孔
みぞおちの痛み、消化不良、下血、吐血などの潰瘍や出血の症状を医療提供者に報告するように患者に助言します。心臓予防のために低用量アスピリンを併用する状況では、患者に消化管出血のリスクの増加とその徴候と症状を知らせる[参照 警告と注意事項 ]。
肝毒性
肝毒性の徴候と症状(吐き気、疲労、無気力、かゆみ、下痢、黄疸、右上腹部の圧痛、「インフルエンザ様」症状など)について患者に知らせます。これらが発生した場合は、セレブレックス 200mg を中止し、直ちに治療を受けるように患者に指示してください [ 警告と注意事項 、 特定の集団での使用 ]。
心不全と浮腫
息切れ、原因不明の体重増加、または浮腫などのうっ血性心不全の症状に注意し、そのような症状が発生した場合は医療提供者に連絡するよう患者に助言する[参照 警告と注意事項 ]。
アナフィラキシー反応
アナフィラキシー反応の徴候(例、呼吸困難、顔や喉の腫れ)を患者に知らせてください。これらが発生した場合は、直ちに緊急の助けを求めるように患者に指示します[参照 禁忌 と 警告と注意事項 ]。
DRESSを含む深刻な皮膚反応
何らかの発疹や発熱が生じた場合は、セレブレックス 100mg の服用を直ちに中止し、できるだけ早く医療提供者に連絡するよう患者にアドバイスしてください。 警告と注意事項 ]。
女性の生殖能力
セレブレックス 200mg を含む NSAID が排卵の遅延に関連している可能性があることを、妊娠を希望している生殖能力のある女性にアドバイスします。 特定の集団での使用 ]。
胎児毒性
妊婦には、胎児の動脈管が早期に閉鎖するリスクがあるため、妊娠 30 週以降はセレブレックスやその他の NSAID の使用を避けるように伝えてください。妊娠約 20 ~ 30 週の妊婦にセレブレックス 200mg による治療が必要な場合は、治療が 48 時間以上続く場合は、羊水過少症のモニタリングが必要になる可能性があることを伝えてください。 警告と注意事項 と 特定の集団での使用 ]。
NSAIDの併用を避ける
セレブレックスと他のNSAIDまたはサリチル酸塩(ジフルニサル、サルサレートなど)との併用は、胃腸毒性のリスクが高く、有効性がほとんどまたはまったく増加しないため、推奨されないことを患者に伝えます[ 警告と注意事項 と 薬物相互作用 ]。風邪、発熱、または不眠症の治療のための「市販薬」に NSAID が含まれている可能性があることを患者に警告します。
NSAID と低用量アスピリンの使用
医療提供者に相談するまで、セレブレックス 200mg と併用して低用量アスピリンを使用しないように患者に伝えます [ 薬物相互作用 ]。
この製品のラベルは更新されている可能性があります。最新の処方情報については、www.pfizer.com をご覧ください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
セレコキシブは、Sprague-Dawley ラットに雄で最大 200 mg/kg、雌で最大 10 mg/kg を経口投与した場合、発がん性はありませんでした (200 mg を 1 日 2 回投与した場合の AUC0-24 で測定した場合、ヒトの曝露量の約 2 倍から 4 倍)。 )またはマウスに、オスで最大 25 mg/kg、メスで最大 50 mg/kg を 2 年間(200 mg を 1 日 2 回、AUC0-24 で測定したヒトの曝露量にほぼ等しい)経口投与した。
突然変異誘発
セレコキシブはチャイニーズハムスター卵巣 (CHO) 細胞でのエームス試験および突然変異試験で変異原性を示さず、CHO 細胞での染色体異常試験およびラット骨髄での in vivo 小核試験で染色体異常誘発性も示さなかった。
生殖能力の障害
セレコキシブは、1 日 2 回 200 mg で 200 mg を 1 日 2 回投与する場合の約 11 倍の経口投与量で、ラットの雄または雌の受胎能または雄の生殖機能に影響を与えませんでした。 ≥50 mg/kg/日 (1 日 2 回 200 mg の AUC0-24 に基づくヒトの曝露量の約 6 倍) では、着床前損失が増加しました。
特定の集団での使用
妊娠
リスクの概要
セレブレックス 200mg を含む NSAID の使用は、胎児の動脈管の早期閉鎖および胎児の腎機能障害を引き起こし、羊水過少症や、場合によっては新生児の腎機能障害を引き起こす可能性があります。これらのリスクがあるため、セレブレックス 200mg の使用量と使用期間は、妊娠約 20 ~ 30 週に制限し、妊娠約 30 週以降のセレブレックスの使用は避けてください。 臨床的考察、データ )。
胎児動脈管の早期閉鎖
セレブレックスを含むNSAIDを妊娠約30週以降に使用すると、胎児の動脈管が早期に閉鎖するリスクが高まります。
羊水過少症/新生児腎障害
妊娠約 20 週以降の妊娠での NSAID の使用は、羊水過少症につながる胎児の腎機能障害の症例と関連しており、場合によっては新生児の腎機能障害と関連しています。
妊娠第 1 期または第 2 期の女性における NSAID 使用の他の潜在的な胚胎児リスクに関する観察研究のデータは決定的ではありません。動物の繁殖研究では、器官形成期に、人間の最大推奨用量 (MRHD) である 200 mg の 1 日 2 回の約 6 倍の経口用量で毎日セレコキシブを投与されたラットで、胚胎児の死亡と横隔膜ヘルニアの増加が観察されました。さらに、MRHD の約 2 倍の器官形成期にセレコキシブを毎日経口投与されたウサギでは、構造的異常 (例えば、中隔欠損、肋骨融合、胸骨融合、胸骨奇形) が観察された ( データ )。動物データに基づいて、プロスタグランジンは子宮内膜の血管透過性、胚盤胞着床、および脱落膜化において重要な役割を果たしていることが示されています。動物実験では、セレコキシブなどのプロスタグランジン合成阻害剤の投与により、着床前および着床後の損失が増加しました。プロスタグランジンは、胎児の腎臓の発達にも重要な役割を果たしていることが示されています。公表された動物研究では、プロスタグランジン合成阻害剤は、臨床的に適切な用量で投与された場合、腎臓の発達を損なうことが報告されています。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
胎児/新生児の有害反応
胎児動脈管の早期閉鎖
セレブレックス 200mg を含む NSAID は胎児の動脈管の早期閉鎖を引き起こす可能性があるため、妊娠約 30 週以降の女性への NSAID の使用は避けてください。 データ )。
羊水過少症/新生児腎障害:
妊娠約 20 週以降に NSAID が必要な場合は、使用を最小限の有効量と可能な限り短い期間に制限してください。セレブレックス治療が 48 時間を超える場合は、羊水過少症を超音波で監視することを検討してください。羊水過少症が発生した場合は、セレブレックスを中止し、臨床診療に従ってフォローアップします( データ )。
労働または配達
分娩中のセレブレックスの効果に関する研究はありません。動物実験では、セレコキシブを含む NSAID はプロスタグランジンの合成を阻害し、分娩を遅らせ、死産の発生率を高めます。
データ
ヒューマンデータ
入手可能なデータは、セレブレックスの使用に関連する発生毒性の有無を立証していません。
胎児動脈管の早期閉鎖
出版された文献によると、妊娠約 30 週以降に NSAID を使用すると、胎児の動脈管が早期に閉鎖する可能性があります。
羊水過少症/新生児腎障害
発表された研究および市販後のレポートでは、妊娠約 20 週以降の母親の NSAID 使用が、羊水過少症、場合によっては新生児の腎障害につながる胎児の腎機能障害に関連していると記載されています。これらの有害な転帰は、平均して数日から数週間の治療後に見られますが、NSAID開始後48時間で羊水過少症が報告されることはめったにありません.すべてではありませんが、多くの場合、羊水の減少は一過性であり、薬物の中止により元に戻りました。母体の NSAID 使用および羊水過少症を伴わない新生児の腎機能障害の限られた数の症例報告があり、そのうちのいくつかは不可逆的でした。新生児腎機能障害の一部の症例では、交換輸血や透析などの侵襲的処置による治療が必要でした。
これらの市販後調査およびレポートの方法論的限界には、対照群の欠如が含まれます。薬物曝露の用量、期間、およびタイミングに関する限られた情報。および他の薬の併用。これらの制限により、母体の NSAID 使用による胎児および新生児の有害転帰のリスクの信頼できる推定値を確立することができなくなります。新生児転帰に関する公表された安全性データは主に早産児に関係しているため、母親の使用を通じてNSAIDに曝露された満期産児に対する特定の報告されたリスクの一般化可能性は不明です.
動物データ
150 mg/kg/日以上の経口用量のセレコキシブ (AUC0-24 で測定すると、200 mg の 1 日 2 回のヒト曝露の約 2 倍) は、心室中隔欠損症の発生率の増加、まれなイベント、および胎児の変化などを引き起こしました。ウサギが器官形成全体にわたって処理されたとき、肋骨が融合し、胸骨が融合し、胸骨が奇形になりました。器官形成全体を通して、ラットに 30 mg/kg/日以上の経口用量でセレコキシブを投与した場合 (RA に対して 200 mg を 1 日 2 回投与した場合の AUC 0-24 に基づくと、ヒトの曝露量の約 6 倍)、用量依存的な横隔膜ヘルニアの増加が観察されました。ラットでは、初期胚発生時のセレコキシブへの曝露により、経口用量 ≥50 mg/kg/日で着床前および着床後の損失が生じました (200 mg を 1 日 2 回投与した場合の AUC 0-24 に基づくと、ヒトの曝露の約 6 倍)。 RA)。
セレコキシブは、ラットに最大 100 mg/kg の経口投与で遅延分娩または分娩の証拠を生成しませんでした (1 日 2 回 200 mg で AUC 0-24 によって測定される約 7 倍のヒト曝露)。妊娠中の女性の陣痛および分娩に対するセレブレックスの影響は不明です。
授乳
リスクの概要
合計 12 人の授乳中の女性を含む 3 つの公開されたレポートからの限られたデータは、母乳中のセレブレックスのレベルが低いことを示しました。計算された乳児の 1 日平均投与量は 10 ~ 40 mcg/kg/日で、2 歳児の体重ベースの治療投与量の 1% 未満でした。授乳中の 17 か月と 22 か月の 2 人の乳児の報告では、有害事象は見られませんでした。セレブレックス 100mg を授乳中の女性に投与する場合は注意が必要です。母乳育児の発達上および健康上の利点は、セレブレックスに対する母親の臨床的必要性、およびセレブレックス 200mg または母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
生殖能力のある雌と雄
不妊
女性
作用機序に基づいて、CELEBREX を含むプロスタグランジン媒介 NSAID の使用は、一部の女性の可逆的不妊症に関連している卵胞の破裂を遅らせるか、または防止する可能性があります。発表された動物研究は、プロスタグランジン合成阻害剤の投与が、排卵に必要なプロスタグランジン介在卵胞破裂を妨害する可能性があることを示しています。 NSAIDs で治療された女性を対象とした小規模な研究でも、可逆的な排卵遅延が示されています。妊娠困難な女性や不妊症の調査を受けている女性では、セレブレックス 200mg を含む NSAID の中止を検討してください。
小児用
セレブレックス 200mg は、2 歳以上の患者の若年性関節リウマチの徴候と症状の緩和に承認されています。安全性と有効性は、子供の 6 か月を超えて研究されていません。セレブレックス 100mg にさらされた小児における長期の心血管毒性は評価されておらず、セレブレックスまたは他の COX-2 選択的および非選択的 NSAID にさらされた成人に見られるリスクと同様の長期的リスクがあるかどうかは不明です。 囲み警告 、 警告と注意事項 、 と 臨床研究 ]。
歳から 17 歳までの少関節多関節型 JRA 患者または全身型 JRA 患者におけるセレコキシブの使用について、12 週間の二重盲検実薬対照薬物動態試験、安全性および有効性試験が実施されました。 12 週間の非盲検延長。セレコキシブは、2 歳未満の患者、体重が 10 kg (22 ポンド) 未満の患者、および活動的な全身機能を有する患者では研究されていません。全身性発症のJRA(全身性機能のない)患者は、臨床検査で凝固異常が発生するリスクがあるようです。一部の全身性JRA患者では、セレコキシブとナプロキセンの両方が、活性化部分トロンボプラスチン時間(APTT)の軽度の延長に関連していましたが、プロトロンビン時間(PT)には関連していませんでした。全身性JRA患者にセレコキシブを含むNSAIDを使用する場合は、播種性血管内凝固症候群のリスクがあるため、異常な凝固や出血の兆候や症状がないか患者を監視してください。全身性JRAの患者は、異常な凝固検査の発生について監視する必要があります[を参照してください。 投薬と管理 、 警告と注意事項 、 有害反応 、 動物毒物学 、 臨床研究 ]。
CYP2C9 の代謝不良が確認された小児患者では、JRA の代替療法を検討する必要があります。 CYP2C9基質の代謝不良者 ]。
高齢者の使用
高齢の患者は、若い患者と比較して、NSAID に関連する重篤な心血管、胃腸、および/または腎臓の副作用のリスクが高くなります。高齢患者にとって予想される利益がこれらの潜在的なリスクを上回る場合は、投与範囲の下限から投与を開始し、副作用について患者を監視します[参照 警告と注意事項 ]。
承認前の臨床試験でセレブレックス 100mg を投与された患者の総数のうち、3,300 人以上が 65 ~ 74 歳で、さらに約 1,300 人の患者が 75 歳以上でした。これらの対象者と若い対象者の間で有効性に実質的な差は観察されませんでした。 GFR、BUN、およびクレアチニンによって測定される腎機能と、出血時間および血小板凝集によって測定される血小板機能を比較する臨床研究では、高齢者と若いボランティアの間で結果に違いはありませんでした。しかし、COX-2 を選択的に阻害するものを含む他の NSAID と同様に、若年患者よりも高齢者において、致死的な消化管イベントおよび急性腎不全の市販後の自発的な報告が多い [ 警告と注意事項 ]。
肝障害
中等度の肝障害(Child-Pugh クラス B)の患者におけるセレブレックス カプセルの 1 日あたりの推奨用量は、50% 減量する必要があります。重度の肝障害のある患者にセレブレックスを使用することは推奨されません。 投薬と管理 と 臨床薬理学 ]。
腎障害
セレブレックスは、重度の腎機能障害のある患者には推奨されません。 警告と注意事項 と 臨床薬理学 ]。
CYP2C9 基質の代謝不良者
遺伝子型または他のCYP2C9基質(ワルファリン、フェニトインなど)の過去の病歴/経験に基づいて、CYP2C9代謝不良であることが知られている、または疑われる患者(すなわち、CYP2C9*3/*3)では、セレブレックス200mgを最低値の半分から投与します。推奨用量。 CYP2C9 の代謝不良が確認された JRA 患者では、代替管理を検討する必要があります [参照 投薬と管理 と 臨床薬理学 ]。
過剰摂取
急性 NSAID 過剰摂取後の症状は通常、無気力、眠気、吐き気、嘔吐、みぞおちの痛みに限定されており、支持療法で一般的に回復可能です。消化管出血が発生しました。高血圧、急性腎不全、呼吸抑制、および昏睡が発生しましたが、まれでした [ 警告と注意事項 ]。
臨床試験中にセレブレックス 200mg の過剰摂取は報告されていません。 12 人の患者で 10 日間まで 2400 mg/日までの投与量では、深刻な毒性は発生しませんでした。血液透析によるセレコキシブの除去に関する情報は入手できませんが、その高度な血漿タンパク質結合 (>97%) に基づいて、透析が過剰摂取に役立つ可能性は低いです。
NSAID の過剰摂取後は、対症療法と支持療法で患者を管理します。特定の解毒剤はありません。嘔吐および/または活性炭 (成人では 60 ~ 100 グラム、小児患者では体重 1 kg あたり 1 ~ 2 グラム) および/または摂取後 4 時間以内に見られる症状のある患者または大量の過剰摂取 (推奨用量の5~10倍)。強制利尿、尿のアルカリ化、血液透析、または血液灌流は、タンパク質結合が高いため役に立たない場合があります。
過剰摂取の治療に関する追加情報については、毒物管理センター (1-800-222-1222) にお問い合わせください。
禁忌
セレブレックスは、次の患者には禁忌です。
- -セレコキシブ、製剤の成分に対する既知の過敏症(例、アナフィラキシー反応および重篤な皮膚反応)[参照 警告と注意事項 ]。
- -アスピリンまたは他のNSAIDを服用した後の喘息、蕁麻疹、またはその他のアレルギー型反応の病歴。そのような患者では、NSAIDs に対する重度の、時には致命的なアナフィラキシー反応が報告されています。 警告と注意事項 ]。
- CABG 手術の設定では [参照 警告と注意事項 ]。
- スルホンアミドに対するアレルギー反応を示した患者[参照 警告と注意事項 ]。
臨床薬理学
作用機序
セレコキシブには、鎮痛、抗炎症、および解熱特性があります。
セレブレックス 100mg の作用機序は、主に COX-2 の阻害によるプロスタグランジン合成の阻害によるものと考えられています。
セレコキシブは、インビトロでのプロスタグランジン合成の強力な阻害剤です。治療中に到達したセレコキシブ濃度は、in vivo 効果を生み出しました。プロスタグランジンは求心性神経を敏感にし、動物モデルで痛みを誘発するブラジキニンの作用を増強します。プロスタグランジンは炎症のメディエーターです。セレコキシブはプロスタグランジン合成の阻害剤であるため、その作用機序は末梢組織におけるプロスタグランジンの減少による可能性があります。
薬力学
血小板
正常なボランティアを使用した臨床試験では、最大 800 mg の単回投与と 600 mg の複数回投与を 1 日 2 回、最大 7 日間 (推奨される治療用量よりも高い) 投与したセレブレックスは、血小板凝集の減少や出血時間の増加に影響を与えませんでした。血小板への影響がないため、セレブレックス 100mg は心血管予防のためのアスピリンの代わりにはなりません。セレブレックスの使用に関連する重篤な心血管血栓性有害事象のリスク増加に寄与する可能性がある、血小板に対するセレブレックスの影響があるかどうかは不明です。
体液貯留
PGE2合成の阻害は、ヘンレの腎髄質の厚い上行ループおよびおそらく遠位ネフロンの他のセグメントでの再吸収の増加を介して、ナトリウムと水分の保持につながる可能性があります。集合管では、PGE2 は抗利尿ホルモンの作用に対抗することにより水の再吸収を阻害するようです。
薬物動態
セレコキシブは、1 日 2 回 200 mg までの経口投与後、用量に比例して曝露量が増加し、より高い用量では比例的な増加よりも少なくなります。分布が広く、タンパク質との結合性が高い。主に CYP2C9 によって代謝され、半減期は約 11 時間です。
吸収
セレコキシブの血漿レベルのピークは、経口投与の約 3 時間後に発生します。絶食条件下では、ピーク血漿レベル (Cmax) と曲線下面積 (AUC) の両方が、1 日 2 回 200 mg までほぼ用量比例します。より高い用量では、Cmax と AUC の比例した増加よりも少ない (参照 食事の影響 )。絶対的なバイオアベイラビリティ研究は実施されていません。複数回の投与により、5日目またはそれ以前に定常状態に達します。健康な被験者のグループにおけるセレコキシブの薬物動態パラメーターを表4に示します。
食事の影響
セレブレックス 200mg カプセルを高脂肪食と一緒に摂取した場合、総吸収量 (AUC) が 10% から 20% 増加し、血漿レベルのピークが約 1 時間から 2 時間遅れました。絶食条件下では、200 mg を超える用量で、Cmax と AUC の比例増加は少なくなります。これは、水性媒体への薬物の溶解度が低いためと考えられています。
セレブレックスをアルミニウムおよびマグネシウム含有制酸剤と併用すると、血漿セレコキシブ濃度が低下し、Cmax が 37%、AUC が 10% 減少しました。セレブレックスは、1 日 2 回 200 mg までの用量で、食事のタイミングに関係なく投与できます。吸収を改善するために、高用量 (1 日 2 回 400 mg) を食物と一緒に投与する必要があります。
健康な成人ボランティアでは、セレコキシブを無傷のカプセルとして、またはカプセルの内容物をアップルソースにまぶして投与した場合、セレコキシブの全体的な全身暴露 (AUC) は同等でした。アップルソースにカプセル内容物を投与した後、Cmax、Tmax、または t½ に有意な変化はありませんでした [参照 投薬と管理 ]。
分布
健康な被験者では、セレコキシブは臨床用量範囲内で高度にタンパク質結合 (~97%) します。インビトロ研究は、セレコキシブが主にアルブミンに結合し、程度は低いがα酸糖タンパク質に結合することを示しています。定常状態での分布の見かけの体積 (V/F) は約 400 L であり、組織への広範な分布を示唆しています。セレコキシブは赤血球に優先的に結合しません。
排除
代謝
セレコキシブの代謝は、主に CYP2C9 を介して媒介されます。 3 つの代謝産物、第一級アルコール、対応するカルボン酸、およびそのグルクロニド抱合体が、ヒト血漿で同定されています。これらの代謝産物は、COX-1 または COX-2 阻害剤として不活性です。
排泄
セレコキシブは主に肝代謝によって排泄され、尿や糞便中に未変化の薬物はほとんど (
特定の集団
高齢者
定常状態では、年配の被験者 (65 歳以上) は、若い被験者と比較して Cmax が 40% 高く、AUC が 50% 高かった。高齢の女性では、セレコキシブの Cmax と AUC が高齢の男性よりも高いが、これらの増加は主に高齢の女性の体重が低いためである。高齢者の用量調整は一般的に必要ありません。ただし、体重が 50 kg 未満の患者の場合は、最低推奨用量から治療を開始してください [参照 特定の集団での使用 ]。
小児科
治験用経口懸濁液として投与されたセレコキシブの定常状態の薬物動態が、2歳から17歳までの体重10kg以上の152人のJRA患者で、少関節または多関節JRAおよび全身発症JRA患者で評価された。母集団薬物動態分析では、セレコキシブの経口クリアランス (体重調整なし) は、体重の増加に比例して増加しないことが示され、10 kg および 25 kg の患者は、70 kg の成人 RA と比較して、それぞれ 40% および 24% 低いクリアランスを有すると予測されました。忍耐強い。
体重が 12 kg 以上から 25 kg 以下の JRA 患者に 50 mg カプセルを 1 日 2 回投与し、体重が 25 kg を超える JRA 患者に 100 mg カプセルを 1 日 2 回投与すると、セレコキシブの非劣性が実証された臨床試験で観察された値と同様の血漿濃度が得られるはずです。ナプロキセン 7.5 mg/kg を 1 日 2 回 [ を参照 投薬と管理 ]。セレコキシブは、2 歳未満の JRA 患者、体重が 10 kg (22 ポンド) 未満の患者、または 24 週を超えた患者では研究されていません。
人種
薬物動態研究のメタアナリシスは、白人と比較して黒人のセレコキシブの AUC が約 40% 高いことを示唆しています。この所見の原因と臨床的意義は不明です。
肝障害
軽度 (Child-Pugh クラス A) および中等度 (Child-Pugh クラス B) の肝障害を持つ被験者の薬物動態研究では、定常状態のセレコキシブ AUC が、健康な対照で見られるよりもそれぞれ約 40% および 180% 増加することが示されています。科目。したがって、中等度 (Child-Pugh クラス B) の肝障害のある患者では、セレブレックス カプセルの 1 日あたりの推奨用量を約 50% 減らす必要があります。重度の肝機能障害 (Child-Pugh クラス C) の患者は研究されていません。重度の肝障害のある患者へのセレブレックスの使用は推奨されません[ 投薬と管理 と 特定の集団での使用 ]。
腎障害
クロススタディの比較では、セレコキシブの AUC は、慢性腎不全患者 (GFR35-60 mL/min) では、腎機能が正常な被験者よりも約 40% 低くなりました。 GFRとセレコキシブのクリアランスの間に有意な関係は見つかりませんでした。重度の腎不全の患者は研究されていません。他のNSAIDと同様に、セレブレックス200mgは重度の腎不全患者には推奨されません[参照 警告と注意事項 ]。
薬物相互作用研究
in vitro 研究では、セレコキシブはシトクロム P450 2C9、2C19、または 3A4 の阻害剤ではないことが示されています。
In vivo 研究では、次のことが示されています。
アスピリン
NSAID をアスピリンと一緒に投与すると、NSAID のタンパク質結合は減少しましたが、遊離 NSAID のクリアランスは変化しませんでした。この相互作用の臨床的意義は不明です。 NSAIDs とアスピリンとの臨床的に重要な薬物相互作用については、表 3 を参照してください。 薬物相互作用 ]。
リチウム
健康な被験者を対象に実施された研究では、リチウム 450 mg を 1 日 2 回投与し、セレブレックス 200 mg を 1 日 2 回投与した被験者では、リチウムのみを投与した被験者と比較して、平均定常状態のリチウム血漿レベルが約 17% 増加しました[参照 薬物相互作用 ]。
フルコナゾール
フルコナゾール 200 mg を 1 日 1 回併用投与すると、セレコキシブの血漿濃度が 2 倍に増加しました。この増加は、フルコナゾールによる P450 2C9 を介したセレコキシブ代謝の阻害によるものです [ 薬物相互作用 ]。
その他の薬
グリブリド、ケトコナゾールの薬物動態および/または薬力学に対するセレコキシブの効果[ 薬物相互作用 ]、フェニトイン、およびトルブタミドは in vivo で研究されており、臨床的に重要な相互作用は発見されていません。
ファーマコゲノミクス
CYP2C9 * 2およびCYP2C9 * 3多型のホモ接合体など、酵素活性の低下につながる遺伝子多型を持つ個人では、CYP2C9活性が低下します。ホモ接合型 CYP2C9*3/*3 遺伝子型を持つ合計 8 人の被験者を含む 4 つの公開されたレポートからの限られたデータは、CYP2C9*1/*1 または * を持つ被験者と比較して、これらの被験者のセレコキシブ全身レベルが 3 ~ 7 倍高いことを示しました。 I/*3 遺伝子型。セレコキシブの薬物動態は、*2、*5、*6、*9、*11 などの他の CYP2C9 多型を持つ被験者では評価されていません。 *3/*3 遺伝子型のホモ接合体の頻度は、さまざまな民族グループで 0.3% から 1.0% であると推定されています [参照 投薬と管理 、 特定の集団での使用 ]。
動物毒物学
精巣上体後精巣症や精細管の最小限からわずかな拡張などの二次的変化の有無にかかわらず、精巣瘤の背景所見の発生率の増加が、若年ラットで見られました。これらの生殖所見は明らかに治療に関連しているが、用量に伴って発生率や重症度が増加することはなく、自然状態の悪化を示している可能性がある。同様の生殖所見は、幼若犬または成犬の研究、またはセレコキシブで治療された成体ラットの研究では観察されませんでした。この所見の臨床的意義は不明です。
臨床研究
変形性関節症
セレブレックス 200mg は、プラセボと比較して関節痛の大幅な軽減を示しました。セレブレックスは、最大 12 週間のプラセボおよび実薬対照臨床試験で、膝および股関節の OA の徴候および症状の治療について評価されました。 OA 患者では、セレブレックス 100 mg を 1 日 2 回、または 200 mg を 1 日 1 回投与することで、WOMAC (Western Ontario and McMaster Universities) の変形性関節症指数が改善されました。 OAフレアに伴う痛みに関する12週間の3つの研究では、セレブレックス100mgを1日2回100mgと200mgを1日2回投与すると、投与開始から24時間から48時間以内に痛みが大幅に軽減されました。 100 mg を 1 日 2 回または 200 mg を 1 日 2 回投与した場合、セレブレックス 200 mg の有効性は、ナプロキセン 500 mg を 1 日 2 回投与した場合と同様であることが示されました。 200 mg を 1 日 2 回投与しても、100 mg を 1 日 2 回投与した場合に見られる以上の効果は得られませんでした。 1 日 200 mg の総投与量は、100 mg を 1 日 2 回投与しても、200 mg を 1 日 1 回投与しても、同等の効果があることが示されています。
関節リウマチ
セレブレックスは、プラセボと比較して、関節の圧痛/痛みおよび関節の腫れの有意な減少を示しました。セレブレックス 100mg は、最大 24 週間のプラセボおよび実薬対照臨床試験で RA の徴候および症状の治療について評価されました。セレブレックスは、これらの研究でプラセボよりも優れていることが示され、ACR20レスポンダー指数、RAの臨床、検査、および機能測定の複合体を使用しています。セレブレックス 100 mg 1 日 2 回投与と 200 mg 1 日 2 回投与の有効性は類似しており、どちらもナプロキセン 500 mg 1 日 2 回投与に匹敵しました。
セレブレックス 100 mg を 1 日 2 回と 200 mg を 1 日 2 回投与しても全体的な有効性は同様でしたが、一部の患者は 200 mg を 1 日 2 回投与することでさらに効果が得られました。 400 mg を 1 日 2 回服用しても、100 mg から 200 mg を 1 日 2 回服用した場合に見られる効果以上の効果は得られませんでした。
若年性関節リウマチ(NCT00652925)
12 週間の無作為化、二重盲検、実薬対照、並行群間、多施設共同、非劣性試験では、2 歳から 17 歳までの少数関節、多関節コースの JRA または全身性発症の JRA (現在不活発な全身機能を伴う) の患者)、次のいずれかの治療を受けた: セレコキシブ 3 mg/kg (最大 150 mg) を 1 日 2 回。セレコキシブ 6mg/kg (最大 300mg) を 1 日 2 回。またはナプロキセン 7.5 mg/kg (最大 500 mg) を 1 日 2 回。回答率は、JRA の臨床的、検査的、および機能的測定の複合体である 30% 以上の改善の定義 (JRA DOI 30) 基準に基づいています。 12 週目の JRA DOI 30 反応率は、セレコキシブ 3 mg/kg 1 日 2 回、セレコキシブ 6 mg/kg 1 日 2 回、ナプロキセン 7.5 mg/kg 1 日 2 回の治療群で、それぞれ 69%、80%、67% でした。
JRA に対するセレブレックス 100mg の有効性と安全性は、6 か月を超えて研究されていません。セレブレックス 200mg にさらされた子供の長期的な心血管毒性は評価されておらず、長期的なリスクがセレブレックス 100mg や他の COX-2 選択的および非選択的 NSAID にさらされた成人に見られるリスクと同様であるかどうかは不明です [見る 囲み警告 、 警告と注意事項 ]。
強直性脊椎炎
セレブレックスは、6 週間および 12 週間の 2 つのプラセボおよび実薬対照臨床試験で AS 患者を対象に評価されました。セレブレックス 100 mg を 1 日 2 回、200 mg を 1 日 1 回、400 mg を 1 日 1 回の用量で投与した場合、これらの研究では、全体的な痛みの強さ (ビジュアル アナログ スケール)、全体的な疾患活動性を評価する 3 つの主要な有効性指標すべてについて、統計的にプラセボよりも優れていることが示されました。 (Visual Analogue Scale) および機能障害 (Bath Ankylosing Spondylitis Functional Index)。 12 週間の研究では、ベースラインからの平均変化の比較において、200 mg と 400 mg のセレブレックス 200 mg の投与量の間で改善の程度に違いはありませんでしたが、セレブレックス 400 mg に反応した患者のパーセンテージはより高かった53。 %、強直性脊椎炎応答基準 (ASAS20) の評価を使用して、セレブレックス 200 mg、44% より。 ASAS 20 では、次の 4 つのドメインのうち少なくとも 3 つにおいて、0 mm から 100 mm のスケールで、ベースラインから少なくとも 20% の改善と少なくとも 10 mm の絶対的な改善としてレスポンダーを定義しています: 患者の全体的な痛み、バス強直性脊椎炎機能指数、および炎症。レスポンダー分析では、6 週間を超えてもレスポンダー率に変化がないことも示されました。
原発性月経困難症を含む鎮痛
口腔外科手術後の疼痛、整形外科手術後の疼痛、および原発性月経困難症の急性鎮痛モデルにおいて、セレブレックス 100mg は、患者によって中等度から重度と評価された疼痛を緩和しました。単回投与 [参照 投薬と管理 のセレブレックス 200mg は、60 分以内に痛みを軽減しました。
心血管転帰試験:セレコキシブ統合安全性とイブプロフェンまたはナプロキセンの前向き無作為化評価(PRECISION; NCT00346216)
デザイン
PRECISION 試験は、セレコキシブとナプロキセンおよびイブプロフェンを比較した、心血管疾患を有する、またはそのリスクが高い OA および RA 患者の心血管安全性に関する二重盲検無作為対照試験でした。患者は、セレコキシブ 100 mg 1 日 2 回、イブプロフェン 600 mg 1 日 3 回、またはナプロキセン 375 mg 1 日 2 回の開始用量に無作為に割り付けられ、疼痛管理の必要に応じて用量を段階的に増やすことができました。表示された用量に基づいて、セレコキシブに無作為に割り付けられた OA 患者は、用量を増やすことができませんでした。
主要評価項目である抗血小板試験参加者'コラボレーション (APTC) コンポジットは、心血管死 (出血死を含む)、非致死性心筋梗塞、および非劣性を評価する 80% の検出力を持つ非致死性脳卒中の独立して判定されたコンポジットでした。すべての患者は、胃の保護のために非盲検のエソメプラゾール (20-40 mg) を処方されました。治療の無作為化は、ベースラインの低用量アスピリンの使用によって層別化されました。
さらに、外来モニタリングによって測定された血圧に対する 3 つの薬剤の効果を評価する 4 か月のサブスタディがありました。
結果
OA患者の中で、わずか0.2% (17/7259) がセレコキシブを200 mg 1日2回に増量し、54.7% (3946/7208) がイブプロフェンを800 mg 1日3回に増量し、54.8% (3937/7178) がナプロキセンを増量した1日2回500mgまで。 RAの被験者のうち、55.7% (453/813) がセレコキシブを200 mg 1日2回に増やし、56.5% (470/832) がイブプロフェンを800 mg 1日3回に増やし、54.6% (432/791) がナプロキセンを1日3回に増やした。 500 mg を 1 日 2 回投与。ただし、RA 集団は試験集団の 10% に過ぎませんでした。
セレコキシブ患者全体で比較的少数 (5.8% [470/8072]) が 200 mg 1 日 2 回に用量漸増したため、PRECISION 試験の結果は、イブプロフェンおよび服用量のナプロキセン。
一次エンドポイント
この試験には、事前に指定された 2 つの分析母集団がありました。
- Intent-to-treat集団(ITT):無作為化されたすべての被験者で構成され、最大30か月間追跡されました
- 修正された治療目的集団(mITT):治験薬の少なくとも1回の投与を受け、少なくとも1回のベースライン後の訪問が、治療中止と30日または43か月のいずれか早い方まで続いたすべての無作為化された被験者で構成されています
セレコキシブ 100 mg を 1 日 2 回投与した場合、ナプロキセンまたはイブプロフェンを服用した場合と比較して、事前に指定された 4 つの非劣性基準をすべて満たしました (両方の比較で非劣性について p
ITT と mITT の主要な分析結果を表 5 に示します。
30 か月までの ITT 分析集団では、全死因死亡率はセレコキシブ群で 1.6%、イブプロフェン群で 1.8%、ナプロキセン群で 2.0% でした。
外来血圧モニタリング (ABPM) サブスタディ
PRECISION-ABPM サブスタディでは、4 か月目に分析可能な合計 444 人の患者のうち、セレコキシブ 100 mg を 1 日 2 回投与すると平均 24 時間収縮期血圧 (SBP) が 0.3 mmHg 低下しましたが、摂取した用量のイブプロフェンとナプロキセンは上昇しました。それぞれ 3.7 と 1.6 mmHg で 24 時間 SBP を意味します。これらの変化により、セレコキシブとイブプロフェンの間で統計的に有意かつ臨床的に意味のある差が 3.9 mmHg (p=0.0009)、セレコキシブとナプロキセンの間で統計的に有意でない差が 1.8 (p=0.119) mmHg になりました。
特別研究
腺腫性ポリープ予防研究 (NCT00005094 および NCT00141193)
心血管の安全性は、セレブレックスで治療された散発性腺腫性ポリープ患者を対象とした 2 つの無作為化二重盲検プラセボ対照 3 年間試験で評価されました。 . APC 試験では、3 年間の治療で、プラセボと比較して、セレコキシブによる心血管死、心筋梗塞、または脳卒中の複合エンドポイント (判定済み) が用量依存的に増加しました。 PreSAP 試験では、同じ複合エンドポイントで統計的に有意なリスク増加は示されませんでした (判定済み):
- APC 試験では、心血管死、心筋梗塞、または脳卒中の複合エンドポイント (判定済み) のプラセボと比較したハザード比は、3.4 (95% CI 1.4 – 8.5) であり、セレコキシブ 400 mg を 1 日 2 回投与し、2.8 (95% CI CI 1.1 – 7.2) セレコキシブ 200 mg を 1 日 2 回。 3 年間にわたるこの複合エンドポイントの累積率は、プラセボ治療の 0.9% (6/679 被験者) と比較して、それぞれ 3.0% (20/671 被験者) および 2.5% (17/685 被験者) でした。セレコキシブ投与群とプラセボ治療群の両方での増加は、主に心筋梗塞の発生率の増加によるものでした。
- PreSAP 試験では、プラセボと比較して、セレコキシブ 400 mg を 1 日 1 回投与した場合の同じ複合エンドポイント (判定済み) のハザード比は 1.2 (95% CI 0.6 – 2.4) でした。 3 年間にわたるこの複合エンドポイントの累積率は、それぞれ 2.3% (21/933 被験者) および 1.9% (12/628 被験者) でした。
他の COX-2 選択的および非選択的 NSAID の最大 3 年間の臨床試験では、致命的な可能性がある重篤な心血管血栓性イベント、心筋梗塞、および脳卒中のリスクが増加することが示されています。その結果、すべての NSAID がこのリスクに関連している可能性があると見なされます。
セレコキシブ長期関節炎安全性試験(CLASS)
これは、約 5,800 人の OA 患者と 2,200 人の RA 患者を対象に、市販後に実施された前向きの長期的な安全性結果研究でした。患者は、セレブレックス 400 mg を 1 日 2 回 (推奨される OA および RA 用量のそれぞれ 4 倍および 2 倍)、イブプロフェン 800 mg を 1 日 3 回、またはジクロフェナク 75 mg を 1 日 2 回 (一般的な治療用量) 投与されました。セレブレックス (n = 3,987) とジクロフェナク (n = 1,996) の曝露の中央値は 9 か月で、イブプロフェン (n = 1,985) は 6 か月でした。この転帰研究の主要評価項目は、複雑な潰瘍 (消化管出血、穿孔、または閉塞) の発生率でした。患者は、心血管予防のために低用量(325 mg/日以下)のアスピリン(ASA)を併用することが許可されました(ASA サブグループ:セレブレックス、n = 882、ジクロフェナク、n = 445、イブプロフェン、n = 412)。セレブレックス 200mg とイブプロフェンとジクロフェナクの併用群との間の複雑性潰瘍の発生率の差は、統計的に有意ではありませんでした。
セレブレックスと低用量の ASA を併用している患者 (N=882) は、ASA を使用していない患者 (N=3,105) と比較して、4 倍高い複雑性潰瘍の発生率を経験しました。 9 か月時点での複雑な潰瘍の Kaplan-Meier 率は、低用量の ASA を投与された潰瘍と ASA を投与されていない潰瘍の 0.32% に対して、それぞれ 1.12% でした [参照 警告と注意事項 ]。
表 7 は、セレブレックス 400mg を 1 日 2 回投与された患者の 9 か月間の合併症および症候性潰瘍の推定累積率を示しています。セレブレックス 200mg 単独とセレブレックス 100mg と ASA グループとの間の率の違いは、ASA 使用者の胃腸イベントのリスクが高いためである可能性があります。
潰瘍疾患の既往歴のある少数の患者では、セレブレックス 100mg 単独またはセレブレックス 100mg と ASA を服用している患者の複雑性および症候性潰瘍の発生率は、それぞれ 2.56% (n=243) および 6.85% (n=91) でした。 48週。これらの結果は、潰瘍疾患の既往歴のある患者で期待されます[参照 警告と注意事項 と 有害反応 ]。
CLASS試験では、心血管安全性の結果も評価されました。治験責任医師が報告した重篤な心血管血栓塞栓性有害事象(心筋梗塞、肺塞栓症、深部静脈血栓症、不安定狭心症、一過性脳虚血発作、虚血性脳血管障害を含む)のカプラン・マイヤー累積率は、セレブレックス 200mg、ジクロフェナク、またはイブプロフェン治療の間で差がないことを示しました。グループ。セレブレックス、ジクロフェナク、イブプロフェンの 9 か月時点での全患者の累積率は、それぞれ 1.2%、1.4%、1.1% でした。 3 つの治療グループのそれぞれで 9 か月の非 ASA ユーザーの累積率は 1% 未満でした。 3 つの治療群のそれぞれで、非 ASA ユーザーの 9 か月時点での心筋梗塞の累積率は 0.2% 未満でした。 CLASS 試験にはプラセボ群がなかったため、試験した 3 種類の薬剤で心血管イベントのリスクが増加しなかったのか、それともリスクが同程度まで増加したのかを判断する能力が制限されました。 CLASS 試験では、セレブレックス 400 mg を 1 日 2 回 (推奨される OA および RA 用量のそれぞれ 4 倍および 2 倍)、イブプロフェン 800 mg を 1 日 3 回、およびジクロフェナク 75 mg を 1 日 2 回投与した場合、それぞれ 4.5%、6.9%、4.7% でした。セレブレックス、イブプロフェン、およびジクロフェナクで治療された患者における CLASS 試験からの高血圧の割合は、それぞれ 2.4%、4.2%、および 2.5% でした。
内視鏡研究
セレブレックスを使用した短期内視鏡研究の所見と、長期使用による臨床的に重大な重篤な上部消化管イベントの相対的発生率との相関関係は確立されていません。対照試験および非盲検試験で、CELEBREX 100mgを投与された患者で、臨床的に重大な重篤な上部消化管出血が観察されています[参照 警告と注意事項 と 臨床研究 ]。
430 人の RA 患者を対象に無作為化二重盲検試験を実施し、生後 6 か月で内視鏡検査を実施しました。セレブレックス 200 mg を 1 日 2 回服用している患者の内視鏡的潰瘍の発生率は、ジクロフェナク SR 75 mg を 1 日 2 回服用している患者の 15% に対して 4% でした。しかし、CLASS 試験における臨床的に関連する消化管アウトカムについては、CELEBREX はジクロフェナクと統計的に差がありませんでした [参照 臨床研究 ]。
内視鏡的潰瘍の発生率は、ベースラインの内視鏡検査で潰瘍が認められなかった 2,157 人の OA および RA 患者を対象とした 2 つの 12 週間のプラセボ対照試験で研究されました。胃十二指腸潰瘍の発生率とセレブレックスの用量(1 日 2 回 50mg から 400mg)との間に用量関係はありませんでした。ナプロキセン 500 mg を 1 日 2 回投与した場合の発生率は 2 つの研究で 16.2% と 17.6% で、プラセボの場合は 2.0% と 2.3% で、セレブレックスのすべての用量で発生率は 2.7% ~ 5.9% の範囲でした。臨床的に関連する消化管転帰をセレブレックスおよびナプロキセンと比較する大規模な臨床転帰研究はありません。
内視鏡研究では、患者の約 11% がアスピリン (≤ 325 mg/日) を服用していました。セレブレックス群では、内視鏡による潰瘍発生率は、非使用者よりもアスピリン使用者の方が高かったようです。しかし、これらのアスピリン使用者の潰瘍発生率の増加は、アスピリンの有無にかかわらず、実際の対照群で観察された内視鏡による潰瘍発生率よりも低かった。
患者情報
非ステロイド性抗炎症薬(NSAID)の投薬ガイド
非ステロイド性抗炎症薬 (NSAIDs) と呼ばれる薬について知っておくべき最も重要な情報は何ですか?
NSAID は、次のような重大な副作用を引き起こす可能性があります。
- 死に至る可能性のある心臓発作や脳卒中のリスクが高まります。 このリスクは治療の初期に発生する可能性があり、次のように増加する可能性があります。
- NSAIDsの増量に伴い
- NSAIDの長期使用
「冠動脈バイパス移植(CABG)」と呼ばれる心臓手術の直前または直後に NSAID を服用しないでください。最近心臓発作を起こした後は、医療提供者が指示しない限り、NSAID の服用を避けてください。最近の心臓発作の後にNSAIDを服用すると、別の心臓発作のリスクが高くなる可能性があります.
- 食道(口から胃につながる管)、胃、腸の出血、潰瘍、裂傷(穿孔)のリスクの増加:
- 使用中いつでも
- 警告症状なし
- 死に至る可能性があるもの
- 潰瘍または出血のリスクは、次の場合に増加します。
- 胃潰瘍、またはNSAIDの使用による胃または腸の出血の過去の病歴
- 「コルチコステロイド」、「抗血小板薬」、「抗凝固薬」、「SSRI」または「SNRI」と呼ばれる薬の服用
- NSAIDの増量
- NSAIDの長期使用
- 喫煙
- アルコールを飲む
- 高齢
- 病弱
- 進行した肝疾患
- 出血の問題
- NSAID は次の場合にのみ使用してください。
- 規定どおり
- あなたの治療のために可能な限り低い用量で
- 必要最小限の時間で
NSAIDとは何ですか?
NSAID は、さまざまな種類の関節炎、月経痛、およびその他の種類の短期的な痛みなどの病状による痛みや発赤、腫れ、および熱 (炎症) を治療するために使用されます。
NSAIDsを服用してはいけない人は?
NSAID を服用しないでください。
- 喘息発作、蕁麻疹、またはアスピリンやその他の NSAID によるその他のアレルギー反応を起こしたことがある場合。
- 心臓バイパス手術の直前または直後。
NSAIDS を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 肝臓または腎臓に問題がある
- 高血圧がある
- 喘息がある
- 妊娠している、または妊娠する予定がある。妊娠約 20 週以降に NSAID を服用すると、胎児に害を及ぼす可能性があります。妊娠 20 ~ 30 週の間に NSAID を 2 日以上服用する必要がある場合、医療提供者は赤ちゃんの周りの子宮内の液体の量を監視する必要がある場合があります。 妊娠約30週以降はNSAIDを服用しないでください
- 授乳中または授乳を計画している。
処方薬や市販薬、ビタミン、ハーブのサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。 NSAIDs と他のいくつかの薬は相互に作用し、深刻な副作用を引き起こす可能性があります。 最初に医療提供者に相談せずに、新しい薬の服用を開始しないでください。
NSAIDsの考えられる副作用は何ですか?
NSAID は、次のような重大な副作用を引き起こす可能性があります。
「非ステロイド性抗炎症薬 (NSAID) と呼ばれる薬について知っておくべき最も重要な情報は何ですか?」を参照してください。
- 新しいまたは悪化した高血圧
- 心不全
- 肝不全を含む肝臓の問題
- 腎不全を含む腎臓の問題
- 低赤血球(貧血)
- 生命を脅かす皮膚反応
- 生命を脅かすアレルギー反応
NSAID のその他の副作用には次のようなものがあります。 胃痛、便秘、下痢、ガス、胸やけ、吐き気、嘔吐、めまい。
次のいずれかの症状が現れた場合は、すぐに緊急援助を受けてください。
- 息切れまたは呼吸困難
- 胸痛
- 体の一部または側面の脱力
- ろれつが回らない
- 顔や喉の腫れ
次のいずれかの症状が現れた場合は、NSAID の使用を中止し、すぐに医療提供者に連絡してください。
- 吐き気
- いつもより疲れている、または弱っている
- 下痢
- かゆみ
- 肌や目が黄色く見える
- 消化不良または胃痛
- 風邪のような症状
- 血を吐く
- 便に血が混じっている、またはタールのように黒くてねばねばしている
- 異常な体重増加
- 発熱を伴う皮膚発疹または水ぶくれ
- 腕、脚、手、足のむくみ
NSAID の服用量が多すぎる場合は、すぐに医療提供者に連絡するか、医師の診察を受けてください。
これらは、NSAIDs の考えられるすべての副作用ではありません。詳細については、NSAID について医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
NSAID に関するその他の情報
- アスピリンは NSAID ですが、心臓発作の可能性を高めることはありません。アスピリンは、脳、胃、腸で出血を引き起こす可能性があります。アスピリンは、胃や腸に潰瘍を引き起こすこともあります。
- 一部の NSAID は、処方箋なしで低用量で販売されています (店頭)。市販の NSAID を 10 日以上使用する前に、医療提供者に相談してください。
NSAID の安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態に NSAID を使用しないでください。他の人があなたと同じ症状を持っていても、NSAID を他の人に与えないでください。それらに害を及ぼす可能性があります。
NSAID についてさらに詳しい情報が必要な場合は、医療提供者に相談してください。医療専門家向けに書かれた NSAID に関する情報については、薬剤師または医療提供者に尋ねることができます。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
