痛みの治療: Lioresal 10mg, 25mg Baclofen 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Lioresal 10mg Intrathecal とは何ですか? どのように使用されますか?
Lioresal Intrathecal は、痙縮の症状を治療するために使用される処方薬です。 Lioresal Intrathecal は、単独で使用することも、他の薬剤と併用することもできます。
Lioresal Intrathecal は、骨格筋弛緩剤と呼ばれる薬物のクラスに属します。
Lioresal Intrathecal が 12 歳未満の子供に安全で有効であるかどうかはわかっていません。
Lioresal 25mg Intrathecal の副作用の可能性は何ですか?
Lioresal 10mg Intrathecal は、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 重度の眠気、
- 弱いまたは浅い呼吸、
- 錯乱、
- 幻覚、
- 手、腕、足、または脚のかゆみ、うずき、またはけいれん、
- 発熱、および
- 発作
上記の症状がある場合は、すぐに医療機関を受診してください。
Lioresal 25mg Intrathecal の最も一般的な副作用は次のとおりです。
- 眠気、
- めまい、
- 弱点、
- 疲れ、
- 頭痛、
- 睡眠障害(不眠症)、
- 吐き気、
- 便秘、および
- いつもより頻繁に排尿する
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Lioresal Intrathecal の副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
原因に関係なく、髄腔内バクロフェンの突然の中止は、高熱、精神状態の変化、誇張されたリバウンド痙縮、および筋硬直を含む後遺症をもたらし、まれに横紋筋融解症、多臓器不全および死に進行した.
髄腔内バクロフェンの突然の中止を防ぐには、注入システムのプログラミングとモニタリング、補充のスケジュールと手順、およびポンプアラームに細心の注意を払う必要があります。患者と介護者は、予定された補充訪問を維持することの重要性を知らされるべきであり、バクロフェン離脱の初期症状について教育されるべきです.明らかなリスクのある患者には特別な注意を払う必要があります (例: T-6 以上での脊髄損傷、コミュニケーション障害、バクロフェンの経口または髄腔内投与による離脱症状の既往)。植込み後の臨床医および患者に関する追加情報については、植込み型輸液システムの技術マニュアルを参照してください ( 警告 )。
説明
LIORESAL INTRATHECAL (バクロフェン注射) は、筋弛緩剤および鎮痙剤です。その化学名は 4-アミノ-3-(4-クロロフェニル) ブタン酸で、その構造式は次のとおりです。
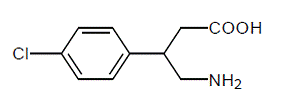
バクロフェンは、分子量が 213.66 の白色からオフホワイトの、無臭または実質的に無臭の結晶性粉末です。水に溶けにくく、メタノールに極めて溶けにくく、クロロホルムに溶けにくい。
LIORESAL INTRATHECAL は、無菌、パイロジェンフリー、等張液であり、抗酸化物質、防腐剤、その他の神経毒性の可能性がある添加物を含まず、髄腔内投与のみを目的としています。この薬物は、37°C で溶液中で安定しており、CSF と適合します。 LIORESAL INTRATHECAL の各ミリリットルには、バクロフェン USP 50 mcg、500 mcg、または 2000 mcg と塩化ナトリウム 9 mg が注射用水に含まれています。 pH 範囲は 5.0 ~ 7.0 です。各アンプルは 1 回の使用のみを目的としています。未使用部分は廃棄してください。オートクレーブしないでください。
適応症
LIORESAL 10mg INTRATHECAL (バクロフェン注射) は、重度の痙縮の管理に使用することが示されています。患者は、埋め込み型ポンプを介した長期注入を検討する前に、まずバクロフェンの髄腔内投与のスクリーニング用量に反応する必要があります。脊髄起源の痙性については、埋め込み型ポンプを介した LIORESAL INTRATHECAL の慢性注入は、経口バクロフェン療法に反応しない患者、または有効量で耐え難い CNS 副作用を経験した患者のために予約する必要があります。外傷性脳損傷による痙性の患者は、長期の髄腔内バクロフェン療法を検討する前に、損傷後少なくとも 1 年間待つ必要があります。 LIORESAL INTRATHECAL は、髄腔内への LIORESAL INTRATHECAL の投与用に特別に FDA によって承認された埋め込み型ポンプでのみ、単回ボーラス試験用量 (脊髄カテーテルまたは腰椎穿刺を介して) の髄腔内経路で使用することを目的としています。
脊髄起源の痙性
LIORESAL INTRATHECAL の有効性を裏付ける証拠は、脊髄外傷または複数の原因による重度の痙縮およびけいれんを有する患者における LIORESAL INTRATHECAL の単回髄腔内投与または 3 日間の髄腔内注入の効果をプラセボと比較した無作為化対照試験で得られました。硬化症。 LIORESAL 10mg INTRATHECAL は、採用された主なアウトカム指標の両方でプラセボよりも優れていました: アシュワース評価の痙縮および痙攣の頻度のベースラインからの変化。
大脳由来の痙性
LIORESAL INTRATHECAL の有効性は、3 つの対照臨床試験で調査されました。 2 名は脳性麻痺患者、1 名は以前の脳損傷による痙縮患者であった。最初の研究は、脳性麻痺患者 51 人を対象とした無作為化対照交差試験であり、強力で統計的に有意な結果が得られました。 LIORESAL INTRATHECAL は、アッシュワース スケールで測定した痙縮の軽減において、プラセボよりも優れていました。 2 番目のクロス オーバー研究は、脳損傷に起因する痙縮患者 11 人で実施されました。サンプルサイズが小さいにもかかわらず、この研究ではほぼ有意な検定統計量 (p= 0.066) が得られ、方向的に好ましい結果が得られました。ただし、最後の研究では、信頼できる分析が可能なデータは提供されませんでした。
LIORESAL 10mg INTRATHECAL 療法は、破壊的な脳神経外科手術の代替と見なされる場合があります。 LIORESAL 10mg INTRATHECAL の慢性髄腔内注入用のデバイスを埋め込む前に、患者はスクリーニング試験で LIORESAL 10mg INTRATHECAL に対する反応を示さなければなりません (以下を参照)。 投薬と管理 )。
投薬と管理
ポンプのプログラミングおよび/またはリザーバーの補充に関する具体的な手順と注意事項については、髄腔内注入用に承認された埋め込み型ポンプの製造元のマニュアルを参照してください。さまざまなリザーバー容量を持つさまざまなポンプがあり、さまざまな詰め替えキットが利用可能です。使用中の特定のポンプに適した詰め替えキットを選択するには、これらすべての製品に精通していることが重要です。
スクリーニングフェーズ
ポンプ移植および LIORESAL INTRATHECAL の慢性注入 (バクロフェン注射) の開始前に、患者はスクリーニング試験で髄腔内投与された LIORESAL INTRATHECAL ボーラス用量に対して肯定的な臨床反応を示さなければなりません。スクリーニング試験では、50 mcg/mL の濃度で LIORESAL INTRATHECAL を採用しています。スクリーニング試験では、1 mL アンプル (50 mcg/mL) を使用できます。審査の流れは以下の通りです。 1 ミリリットルの容量に 50 マイクログラムを含む初期ボーラスを、バーボタージュによって 1 分以上にわたって髄腔内に投与します。患者は、その後 4 ~ 8 時間にわたって観察されます。肯定的な反応は、筋緊張および/またはけいれんの頻度および/または重症度の有意な減少からなる。最初の反応が期待どおりでない場合は、最初のボーラス注射の 24 時間後に 2 回目のボーラス注射を行うことができます。 2 番目のスクリーニング ボーラス投与量は、1.5 ミリリットル中 75 マイクログラムで構成されます。繰り返しますが、患者は 4 ~ 8 時間の間隔で観察する必要があります。それでも反応が不十分な場合は、2 ミリリットル中 100 マイクログラムの最終ボーラス スクリーニング用量を 24 時間後に投与することができます。
小児患者
小児患者のスクリーニング開始用量は、成人患者と同じ 50 mcg です。ただし、非常に体格の小さい患者の場合は、最初に 25 mcg のスクリーニング用量を試すことができます。 100 mcg の髄腔内ボーラスに反応しない患者は、長期注入用の埋め込み型ポンプの候補と見なされるべきではありません。
移植後の用量滴定期間
植込み後の LIORESAL INTRATHECAL の最初の 1 日総投与量を決定するには、ボーラス投与の有効性が 8 時間以上維持されない限り、肯定的な効果を示したスクリーニング投与量を 2 倍にして 24 時間投与する必要があります。この場合、1 日あたりの開始用量は、24 時間にわたって送達されるスクリーニング用量でなければなりません。最初の 24 時間 (すなわち、定常状態が達成されるまで) は増量してはなりません。
脊髄起源の痙性を有する成人患者
最初の 24 時間後、成人患者の場合、望ましい臨床効果が得られるまで、24 時間ごとに 1 回だけ、1 日量を 10 ~ 30% ずつゆっくりと増やしてください。
脳起源の痙性を有する成人患者
最初の 24 時間以降は、望ましい臨床効果が得られるまで、24 時間ごとに 1 回だけ、1 日量を 5 ~ 15% ずつゆっくりと増やしてください。
小児患者
最初の 24 時間以降は、望ましい臨床効果が得られるまで、24 時間ごとに 1 回だけ、1 日量を 5 ~ 15% ずつゆっくりと増やしてください。 1 日あたりの投与量を増やしても実質的な臨床反応がない場合は、適切なポンプ機能とカテーテルの開存性を確認してください。患者は、インプラント直後のスクリーニング段階および用量調整期間中、設備が整ったスタッフが配置された環境で綿密に監視する必要があります。蘇生機器は、生命を脅かす、または耐え難い副作用が発生した場合に備えて、すぐに使用できるようにする必要があります。
維持療法
脊髄由来患者の痙性
臨床目標は、耐え難い副作用を誘発することなく、筋肉の緊張をできるだけ正常に近づけ、けいれんの頻度と重症度を可能な限り最小限に抑えることです.非常に多くの場合、治療の最初の数か月間は、患者が痙縮の緩和によるライフスタイルの変化に順応するまでの間、維持用量を調整する必要があります。ポンプの定期的な補充中は、適切な症状のコントロールを維持するために、1 日量を 10 ~ 40% 増加させることができますが、40% を超えないようにしてください。患者が副作用を経験した場合は、1 日量を 10 ~ 20% 減らすことができます。ほとんどの患者は、慢性治療中に最適な反応を維持するために、時間をかけて徐々に用量を増やす必要があります。用量漸増に対する突然の大きな要求は、カテーテルの合併症(すなわち、カテーテルのキンクまたは脱落)を示唆している。
LIORESAL 10mg INTRATHECAL (バクロフェン注射) の長期持続注入の維持投与量は、12 mcg/日から 2003 mcg/日の範囲であり、ほとんどの患者は 1 日あたり 300 マイクログラムから 800 マイクログラムで適切に維持されています。 1000 mcg/日を超える 1 日用量の経験は限られています。最適な LIORESAL INTRATHECAL 投与量の決定には、個別の滴定が必要です。最適な反応が得られる最低用量を使用する必要があります。
脳由来患者の痙性
臨床目標は、耐え難い副作用を誘発することなく、筋緊張を可能な限り正常に近づけ、けいれんの頻度と重症度を可能な限り最小限に抑えること、または最適な機能のために望ましい程度の筋緊張まで用量を滴定することです.非常に多くの場合、治療の最初の数か月間は、患者が痙縮の緩和によるライフスタイルの変化に適応するまでの間、維持量を調整する必要があります。ポンプの定期的な補充中は、適切な症状のコントロールを維持するために、1 日あたりの投与量を 5 ~ 20% 増加させることができますが、20% を超えないようにしてください。患者が副作用を経験した場合は、1 日量を 10 ~ 20% 減らすことができます。多くの患者は、慢性治療中に最適な反応を維持するために、時間をかけて徐々に用量を増やす必要があります。用量漸増に対する突然の大きな要求は、カテーテルの合併症(すなわち、カテーテルのキンクまたは脱落)を示唆している。
LIORESAL 25mg INTRATHECAL (バクロフェン注射) の長期持続注入の維持用量は、22 mcg/日から 1400 mcg/日の範囲であり、ほとんどの患者は 90 マイクログラムから 703 マイクログラム/日で適切に維持されています。臨床試験では、150 人の患者のうち 3 人だけが、1 日あたり 1000 mcg を超える用量を必要としていました。
小児患者
脳起源の痙縮を有する患者には、同じ推奨用量を使用してください。 12 歳未満の小児患者は、臨床試験でより低い 1 日用量を必要とするように思われました。 12 歳未満の患者の 1 日あたりの平均投与量は 274 mcg/日で、範囲は 24 ~ 1199 mcg/日でした。 12 歳以上の小児患者の投与量は、成人患者と変わらないようです。最適な LIORESAL INTRATHECAL 投与量の決定には、個別の滴定が必要です。最適な反応が得られる最低用量を使用する必要があります。
慢性使用における用量調整の潜在的な必要性
長期治療中、患者の約 5% (28/627) が用量の増加に反応しなくなります。耐性治療について確固たる推奨をするのに十分な経験はありません。しかし、この「耐性」は、病院で 2 ~ 4 週間かけて LIORESAL 25mg INTRATHECAL を徐々に減らし、別の痙性管理方法に切り替える「休薬期間」によって治療されることがあります。 「休薬期間」の後、LIORESAL INTRATHECAL は最初の連続注入量で再開することができます。
安定
非経口医薬品は、溶液と容器が許す限り、投与前に粒子状物質と変色がないか検査する必要があります。
納入仕様書
使用すべき特定の濃度は、必要な 1 日総投与量とポンプの送達速度によって異なります。 LIORESAL 10mg INTRATHECAL は、特定の埋め込み型ポンプで使用する場合、希釈が必要になる場合があります。具体的な推奨事項については、製造元のマニュアルを参照してください。
準備指導
ふるい分け
くも膜下腔へのボーラス注射には、1 mL スクリーニング アンプル (50 mcg/mL) のみを使用してください。 50 mcg ボーラス投与の場合は、スクリーニング アンプル 1 mL を使用します。 75 mcg ボーラス用量の 50 mcg/mL バクロフェン注射の 1.5 mL を使用します。 100 mcg の最大スクリーニング用量の場合は、2 mL の 50 mcg/mL バクロフェン注射液 (スクリーニング アンプル 2 個) を使用します。
メンテナンス
500 mcg/mL または 2000 mcg/mL 以外の濃度が必要な患者には、LIORESAL INTRATHECAL 希釈する必要があります .
リオレサール 10mg 髄腔内 希釈する必要があります 無菌防腐剤を含まない注射用塩化ナトリウム、USP
配達体制
LIORESAL 10mg INTRATHECAL は、ほとんどの場合、移植直後に持続注入モードで投与されます。プログラム可能なポンプを移植され、持続注入を比較的満足のいくように制御できた患者の場合、LIORESAL INTRATHECAL 送達のより複雑なスケジュールを使用することで、さらなる利点が得られる可能性があります。たとえば、夜間にけいれんが増加した患者は、1 時間あたりの注入速度を 20% 増加させる必要がある場合があります。流量の変更は、望ましい臨床効果が得られる時間の 2 時間前に開始するようにプログラムする必要があります。
供給方法
LIORESAL INTRATHECAL(バクロフェン注射) 0.05 mg/1 mL (50 mcg/mL)、10 mg/20 mL (500 mcg/mL)、10 mg/5 mL (2000 mcg/mL)、または 40 mg/20 mL ( 2000 mcg/mL) は次のように供給されます。
スクリーニング用量 (モデル 8563s): 0.05 mg/1 mL (50 mcg/mL) を含む 5 つのアンプル ( NDC 70257-562-55)。
LIORESAL INTRATHECAL(バクロフェン注射)詰め替えキット .各詰め替えキットには、示されている量の LIORESAL INTRATHECAL、調剤キット、Medtronic SynchroMed® Infusion Systems と互換性のあるアクセサリを備えたポンプ詰め替えキット、および関連する説明書が含まれています。
モデル 8561 :10mg/20mL(500mcg/mL)入りアンプル1本( NDC 70257-560-01)。
モデル 8562 : 2つのアンプル、それぞれ10 mg/5 mL (2000 mcg/mL)を含みます ( NDC 70257-561-02)。
モデル 8564 :40mg/20mL(2000mcg/mL)入りアンプル1本( NDC 70257-563-01)。
モデル 8565 :アンプル2本、各10mg/20mL(500mcg/mL)( NDC 70257-560-02)。
モデル 8566 : 2 つのアンプル、それぞれ 40 mg/20 mL (2000 mcg/mL) を含みます ( NDC 70257-563-02)。
保管所
冷蔵は必要ありません。
86° F (30° C) 以上で保管しないでください。
凍結しないでください。
加熱殺菌しないでください。
販売元: Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. 改訂: 2019 年 1 月
副作用
脊髄起源の痙性 - 臨床研究
脊椎起源の痙縮患者によくみられる
市販前および市販後の臨床試験で、LIORESAL 25mg INTRATHECAL (バクロフェン注射) の使用に関連して最も一般的に観察された有害事象は、プラセボ治療を受けた患者の間で同等の発生率では見られなかった: 傾眠、めまい、吐き気、低血圧、頭痛、痙攣および筋緊張低下。
治療の中止に伴う
米国での市販前および市販後の臨床試験で、LIORESAL 25mg INTRATHECAL の長期注入を受けた脊髄起源の痙縮患者 8/474 が、有害事象のために治療を中止しました。これらには、ポンプポケット感染(3)、髄膜炎(2)、創傷裂開(1)、婦人科筋腫(1)、ポンプ過圧(1)が含まれますが、後遺症は不明です。過剰摂取により昏睡状態になった 11 人の患者は一時的に治療を中止されましたが、その後全員が再開されたため、真の中止とは見なされませんでした。
死亡者数
見る 警告 .
対照試験における発生率
LIORESAL INTRATHECAL (バクロフェン注射) を並行して行ったプラセボ対照無作為試験で得られた経験は、有害事象の発生率を推定するための限られた根拠しか提供しません。合計63人の患者。 2 つの無作為化プラセボ対照試験で LIORESAL INTRATHECAL (バクロフェン注射) を投与された 31 人の患者で、次の事象が発生しました: 低血圧 (2)、めまい (2)、頭痛 (2)、呼吸困難 (1)。これらの研究でプラセボを投与された 32 人の患者の間で有害事象は報告されませんでした。
LIORESAL INTRATHECAL の市販前および市販後の評価中に観察された事象
LIORESAL 25mg INTRATHECAL の使用に関連する有害事象は、米国で前向きに追跡された 576 人の患者で得られた経験を反映しています。彼らは、1 日 (スクリーニング) (N = 576) から 8 年以上 (維持) (N = 10) の期間、LIORESAL INTRATHECAL を受けました。これらの研究におけるポンプ移植前に投与される通常のスクリーニングボーラス投与量は、典型的には50mcgであった。維持用量は、1 日あたり 12 mcg から 2003 mcg の範囲でした。オープンで制御されていない経験の性質のため、観察された事象と LIORESAL INTRATHECAL の投与との間の因果関係は、多くの場合、確実に評価することができず、報告された有害事象の多くは、治療中の基礎疾患に関連して発生することが知られています。それにもかかわらず、筋緊張低下、傾眠、めまい、感覚異常、吐き気/嘔吐、頭痛など、より一般的に報告されている反応の多くは、明らかに薬物に関連しているようです.
すべての米国の研究 (対照および非対照の両方) で報告された有害な経験を次の表に示します。埋め込み型ポンプを介して慢性注入を受けた 474 人の患者のうち 8 人は、市販前および市販後の研究で長期治療の中止につながった有害な経験をしました。
前向きに監視された臨床試験における脊髄起源の痙性を有する患者における最も頻度の高い (≥1%) 有害事象の発生率
市販前および市販後の研究で前向きに追跡された 576 人の国内患者で報告された、より一般的な (1% 以上の) 有害事象に加えて、海外の研究から LIORESAL 25mg INTRATHECAL (バクロフェン注射) にさらされた追加の 194 人の患者からの経験は、報告されています。表には記載されておらず、頻度の高い順に並べられ、身体システムによって分類された次の有害事象が報告されました。
神経系: 歩行異常、思考異常、振戦、記憶喪失、けいれん、血管拡張、脳血管障害、眼振、人格障害、精神病性うつ病、脳虚血、情緒不安定、多幸感、筋緊張亢進、イレウス、薬物依存、協調運動障害、妄想反応、眼瞼下垂。
消化器系: 鼓腸、嚥下障害、消化不良および胃腸炎。
心臓血管: 体位性低血圧、徐脈、動悸、失神、心室性不整脈、深部血栓性静脈炎、蒼白および頻脈。
呼吸器: 呼吸器障害、誤嚥性肺炎、過換気、肺塞栓症、鼻炎。
泌尿生殖器: 血尿と腎不全。
皮膚と付属物: 脱毛症と発汗。
代謝および栄養障害: 体重減少、蛋白尿、脱水、高血糖。
特別な感覚: 視力異常、調節異常、羞明、味覚障害、耳鳴り。
全身: 自殺、薬効の欠如、腹痛、低体温症、首のこわばり、胸痛、悪寒、顔面浮腫、インフルエンザ症候群、過剰摂取。
血液およびリンパ系: 貧血。
脳起源の痙性 - 臨床研究
一般的に観察される
市販前の臨床試験で、LIORESAL 25mg INTRATHECAL (バクロフェン注射) の使用に関連して最も一般的に観察された有害事象は、プラセボ治療を受けた患者の間で同等の発生率では見られなかった: 動揺、便秘、傾眠、白血球増多、悪寒、尿保持と筋緊張低下。
治療の中止に伴う
米国での市販前臨床試験で LIORESAL INTRATHECAL を投与された 211 人の患者のうち 9 人が、髄腔内療法に関連する有害事象のために長期投与を中止しました。
中止に至った 9 つの有害事象は、感染 (3)、CSF 漏出 (2)、髄膜炎 (2)、ドレナージ (1)、管理不能な体幹コントロール (1) でした。
死亡者数
LIORESAL 10mg INTRATHECAL に起因するものではなかった 3 人の死亡が、脳起源の痙縮患者を含む臨床試験の患者で報告されました。見る 脊椎痙縮患者で報告されたその他の死亡に関する警告 .
対照試験における発生率
LIORESAL INTRATHECAL (バクロフェン注射) の経験は、プラセボ対照の無作為化試験と並行して得られたものであり、有害事象の発生率を推定するための限られた根拠しか提供していません。脳性麻痺患者と頭部外傷患者を対象とした 2 つの無作為化プラセボ対照試験で、LIORESAL 10mg INTRATHECAL を投与された 62 人の患者で、興奮、便秘、傾眠、白血球増加症、吐き気、嘔吐、眼振、悪寒、尿閉、および筋緊張低下。
LIORESAL 25mg INTRATHECAL の市販前評価中に観察された事象
LIORESAL INTRATHECAL の使用に関連する有害事象は、脳起源の痙縮を有する合計 211 人の米国患者で得られた経験を反映しており、そのうち 112 人は小児患者 (登録時 16 歳未満) でした。彼らは、1 日 (スクリーニング) (N= 211) から 84 か月 (維持) (N= 1) の期間、LIORESAL INTRATHECAL を受けました。これらの研究におけるポンプ移植前に投与される通常のスクリーニングボーラス用量は、50~75mcgであった。維持用量は、1 日あたり 22 mcg から 1400 mcg の範囲でした。長期注入のためにこの患者集団に使用される用量は、一般に、脊髄起源の痙性を有する患者に必要な用量よりも低い.
オープンで制御されていない経験のため、多くの場合、観察された事象と LIORESAL INTRATHECAL の投与との間の因果関係を確実に評価することはできません。それにもかかわらず、より一般的に報告されている反応(傾眠、めまい、頭痛、吐き気、低血圧、筋緊張低下、昏睡)の多くは、明らかに薬物に関連しているようです.
すべての臨床試験で報告された最も頻繁な (1% 以上) 有害事象を次の表に示します。 9 人の患者は、有害事象のために長期治療を中止しました。
前向きにモニタリングされた臨床試験における、大脳起源の痙性患者における最も頻度の高い(1%以上)有害事象の発生率
LIORESAL 25mg INTRATHECAL (バクロフェン注射) に暴露された 211 人の前向き追跡患者で報告された、より一般的な (1% 以上の) 有害事象が報告されています。コホート全体で、表には記載されていない次の有害事象が報告されました。
神経系: アカシジア、運動失調、錯乱、抑うつ、アピストトノス、記憶喪失、不安、幻覚、ヒステリー、不眠症、眼振、人格障害、反射神経の低下、血管拡張。
消化器系: 嚥下障害、便失禁、消化管出血、舌障害。
心臓血管: 徐脈。
呼吸器: 無呼吸、呼吸困難、過換気。
泌尿生殖器: 異常な射精、腎結石、乏尿および膣炎。
皮膚と付属物: 発疹、発汗、脱毛症、接触性皮膚炎、皮膚潰瘍。
特別な感覚: 宿泊施設の異常。
全身: 死亡、発熱、腹痛、がん、倦怠感、低体温。
血液およびリンパ系: 白血球増加症および点状出血。
市販後の経験
LIORESAL INTRATHECAL の承認後の使用中に、以下の有害事象が報告されています。これらのイベントは、不確実な規模の母集団から自発的に報告されるため、その頻度を確実に推定することはできません。
筋骨格
脊柱側弯症の発症または既存の脊柱側弯症の悪化が報告されています。
泌尿生殖器
性欲減退やオルガスム機能障害など、男女の性機能障害が報告されています。男性の勃起不全も報告されています。バクロフェン離脱後に持続勃起症が報告されています。
薬物相互作用
特定の薬物間相互作用を予測するために LIORESAL INTRATHECAL を他の薬剤と組み合わせて使用する体系的な経験は不十分です。 LIORESAL INTRATHECAL と硬膜外モルヒネの併用による相互作用には、低血圧や呼吸困難などがあります。
警告
LIORESAL INTRATHECAL は、シングル ボーラス髄腔内注射 (腰椎髄腔内に配置されたカテーテルまたは腰椎穿刺による注射を介して) および特にバクロフェンの髄腔内投与のために FDA によって承認された埋め込み型ポンプで使用するためのものです。生命を脅かす可能性のある CNS 抑制、心血管虚脱、および/または呼吸不全の可能性があるため、医師は慢性髄腔内注入療法について十分な訓練を受け、教育を受けなければなりません。
ポンプ システムは、ボーラス LIORESAL 10mg INTRATHECAL 注射に対する患者の反応が十分に評価されるまで、移植しないでください。評価 (スクリーニング手順で構成される: を参照) 投薬と管理 )は、LIORESAL 25mg INTRATHECAL をカテーテルまたは腰椎穿刺を介して髄腔内に投与する必要があります。スクリーニング手順とポンプ埋め込み後の投与量の調整に関連するリスクのため、これらの段階は、投与量と投与のセクションで概説されている指示に従って、医学的に監督され、適切に装備された環境で実施する必要があります。
蘇生器具が利用可能であるべきである。
ポンプの外科的移植後、特にポンプ使用の初期段階では、注入に対する患者の反応が許容可能であり、合理的に安定していることが確実になるまで、患者を綿密に監視する必要があります。
ポンプの投与速度および/またはリザーバー内の LIORESAL INTRATHECAL (バクロフェン注射) の濃度を調整するたびに、注入に対する患者の反応が許容可能であり、合理的に安定していることが確実になるまで、綿密な医学的監視が必要です。
患者、すべての患者介護者、および患者を担当する医師は、この治療モードのリスクに関する適切な情報を受け取ることが義務付けられています。すべての医療関係者および介護者は、1) 過剰摂取の徴候と症状、2) 過剰摂取の場合に従うべき手順、および 3) ポンプおよび挿入部位の適切な在宅ケアについて指導を受ける必要があります。
過剰摂取
過剰摂取の兆候は、突然または知らずに現れることがあります。急性の大規模な過剰摂取は、昏睡として現れることがあります。突然ではなく、重度でもない形態の過剰摂取は、眠気、立ちくらみ、めまい、傾眠、呼吸抑制、発作、吻側の筋緊張低下の進行、昏睡に至る意識消失の徴候を示すことがあります。過剰摂取の可能性が高いと思われる場合は、患者をすぐに病院に連れて行って評価し、ポンプのリザーバーを空にする必要があります。これまでに報告されたケースでは、過剰摂取は一般的にポンプの誤動作、不注意による皮下注射、または投薬ミスに関連しています。 (見る 薬物過剰摂取の症状と治療 .)
FDA 承認の埋め込み型ポンプに充填する場合は、細心の注意を払う必要があります。このようなポンプは、リザーバー補充セプタムを通してのみ補充する必要があります。リザーバー補充セプタムに適切にアクセスしないと、皮下組織への不注意な注入が発生する可能性があります。一部のポンプには、髄腔内カテーテルへの直接アクセスを可能にするカテーテルアクセスポートも装備されています。このカテーテル アクセス ポートへの直接注入または皮下組織への不注意による注入は、生命を脅かす過量投与の原因となる可能性があります。
出金
原因に関係なく、髄腔内バクロフェンの突然の中止は、高熱、精神状態の変化、誇張されたリバウンド痙縮および筋硬直を含む後遺症をもたらし、まれに横紋筋融解症、多臓器不全、および死に進行した.市販後最初の 9 年間の経験では、一時的にバクロフェン療法の中止に関連した 27 例の離脱が報告されました。 6人の患者が死亡した。ほとんどの場合、離脱症状は、バクロフェン療法の中断後、数時間から数日以内に現れました。髄腔内バクロフェン療法の突然の中断の一般的な理由には、カテーテルの誤動作 (特に切断)、ポンプ リザーバーの容量不足、およびポンプのバッテリー寿命の終了が含まれます。場合によっては、人為的ミスが原因または寄与する役割を果たした可能性があります。移植されたカテーテルの先端の髄腔内腫瘤が離脱症状につながる症例も報告されています。 予防 )。
髄腔内バクロフェンの突然の中止を防ぐには、注入システムのプログラミングとモニタリング、補充のスケジュールと手順、およびポンプアラームに細心の注意を払う必要があります。患者と介護者は、予定された補充訪問を維持することの重要性を知らされるべきであり、バクロフェン離脱の初期症状について教育されるべきです.
髄腔内バクロフェン療法を受けているすべての患者は、潜在的に離脱のリスクがあります。バクロフェン離脱の初期症状には、ベースラインの痙縮、掻痒、低血圧、感覚異常の回復が含まれる場合があります。髄腔内バクロフェンによる治療が中断されると、持続勃起症が発症または再発する可能性があります。高度な髄腔内バクロフェン離脱症候群の臨床的特徴のいくつかは、自律神経反射異常、感染症(敗血症)、悪性高体温、神経弛緩性悪性症候群、または代謝亢進状態または広範な横紋筋融解症に関連する他の状態に似ている場合があります。
生命を脅かす可能性のある中枢神経系および髄腔内バクロフェン離脱による全身への影響を防ぐためには、緊急治療室または集中治療室での迅速で正確な診断と治療が重要です。髄腔内バクロフェン離脱の推奨される治療法は、治療が中断される前と同じ用量またはほぼ同じ用量で髄腔内バクロフェンを回復することです。ただし、髄腔内送達の回復が遅れる場合は、経口または経腸バクロフェンなどの GABA 作動薬による治療、または経口、経腸、または静脈内ベンゾジアゼピンによる治療により、潜在的に致命的な後遺症を防ぐことができます。バクロフェンの髄腔内離脱の進行を止めるために、経口または経腸バクロフェンだけに頼るべきではありません。
発作は、LIORESAL 25mg INTRATHECAL の過剰摂取時および離脱時に、また LIORESAL INTRATHECAL の治療用量を維持している患者で報告されています。
死亡者数
脊髄起源の痙性
1992 年 12 月の時点で評価された市販前および市販後の研究で、LIORESAL 10mg INTRATHECAL (バクロフェン注射) で治療された 576 人の米国患者のうち、16 人の死亡が報告されました。もしあれば、LIORESAL INTRATHECAL が彼らの死に果たした役割。
グループとして、死亡した患者は比較的若かった (平均年齢は 47 歳、範囲は 25 歳から 63 歳) が、大多数は長年にわたる重度の痙縮に苦しみ、歩行不能であり、肺炎、尿路などのさまざまな医学的合併症を持っていました。感染症、褥瘡、および/または複数の併用薬を受けていた。死亡した 16 人の患者の臨床経過のケースバイケースのレビューでは、LIORESAL INTRATHECAL による治療が彼らの死を引き起こしたことを示唆するような独特の徴候、症状、または検査結果を明らかにすることはできませんでした。しかし、2 人の患者はポンプ移植後 2 週間以内に予期せぬ突然死に見舞われ、1 人の患者はスクリーニング後に予期せず死亡しました。
MS の 44 歳の男性患者 1 人は、ポンプ移植後 2 日目に病院で死亡しました。剖検により、冠状動脈伝導系の重度の線維症が示された。 2 番目の患者、MS と下壁心筋梗塞の病歴を持つ 52 歳の女性は、ポンプ移植の 12 日後、正常なバイタル サインを記録してから 2 時間後に、ベッドで死亡しているのが発見されました。剖検により、肺うっ血と両側胸水が明らかになりました。 LIORESAL INTRATHECAL がこれらの死亡に寄与したかどうかを判断することは不可能です。 3 番目の患者は、3 つのバクロフェン スクリーニング試験を受けました。彼の病歴には、SCI、誤嚥性肺炎、敗血症性ショック、播種性血管内凝固障害、重度の代謝性アシドーシス、肝毒性、およびてんかん重積症が含まれていました。スクリーニングの 12 日後 (彼は移植されていませんでした)、彼は再びてんかん重積状態を経験し、その後の重大な神経学的悪化を伴いました。事前の指示に基づいて、特別な蘇生措置は追求されず、患者は死亡しました。
大脳由来の痙性
1996 年 3 月現在、販売前の研究で LIORESAL INTRATHECAL で治療された 211 人の患者のうち 3 人が死亡しました。これらの死亡は治療に起因するものではありませんでした。
過剰注入
プログラムされた速度よりも多くの薬物量を送達すると (過剰注入)、予期しない過剰摂取や、ポンプ リザーバーが早期に空になることによる離脱が発生する可能性があります。リザーバーの補充については、製造元のポンプのマニュアルと説明書を参照してください。
予防
子供は、慢性注入用の埋め込み型ポンプを収容するのに十分な体重でなければなりません。具体的な推奨事項については、ポンプの製造元のマニュアルを参照してください。
4 歳未満の小児患者における安全性と有効性は確立されていません。
ふるい分け
全身感染症の存在は、ボーラス LIORESAL 10mg INTRATHECAL に対する患者の反応の評価を妨げる可能性があるため、LIORESAL INTRATHECAL (バクロフェン注射) によるスクリーニング試験の前に、患者は感染していない必要があります。
ポンプ注入
感染の存在は外科的合併症のリスクを高める可能性があるため、患者はポンプ移植前に感染していない必要があります。さらに、全身感染症は投与を複雑にする可能性があります。
ポンプ投与量の調整と滴定
ほとんどの患者では、有効性を維持するために時間をかけて徐々に用量を増やす必要があります。大幅な用量増加が突然必要になった場合は、通常、カテーテルの合併症 (すなわち、カテーテルのキンクまたは脱落) を示します。
リザーバーの補充は、十分な訓練を受けた資格のある担当者が、ポンプの製造元の指示に従って行う必要があります。リザーバー補充セプタムに適切にアクセスしないと、皮下組織への不注意な注入が発生する可能性があります。皮下注射は、全身の過剰摂取またはリザーバーの早期枯渇の症状を引き起こす可能性があります。リザーバーの枯渇を防ぐために、補充間隔を慎重に計算する必要があります。これにより、重度の痙縮が再発し、離脱症状が現れる可能性があります。
細菌汚染や深刻な感染を避けるために、充填には厳格な無菌技術が必要です。臨床状況に適した観察期間は、薬物リザーバーの補充または操作のたびに行う必要があります。
髄腔内カテーテルへの直接アクセスを可能にする注入ポートを備えた FDA 承認の埋め込み型ポンプに充填するときは、細心の注意を払う必要があります。カテーテル アクセス ポートからカテーテルに直接注入すると、生命を脅かす過剰摂取を引き起こす可能性があります。
用量調整に関するその他の考慮事項
ある程度の筋肉の緊張を維持し、時折のけいれんを可能にするために、用量を滴定することが重要である可能性があります。 .
過剰摂取に関連する緊急事態を除いて、LIORESAL 25mg INTRATHECAL の投与量は、何らかの理由で薬が中止された場合、通常はゆっくりと減らす必要があります。
過剰摂取や有害な薬物相互作用の可能性を避けるために、スクリーニングの前、または植込みと慢性的なLIORESAL INTRATHECAL注入の開始後に、併用する経口鎮痙薬を中止するよう試みるべきです。経口抗けいれん薬の減量と中止は、ゆっくりと、医師の注意深い監視の下で行う必要があります。併用する鎮痙薬の急激な減量または中止は避けるべきです。
眠気
LIORESAL INTRATHECAL を服用している患者で眠気が報告されています。患者は、自動車やその他の危険な機械の操作、および注意力の低下によって危険となる活動について注意する必要があります。患者は、LIORESAL INTRATHECAL (バクロフェン注射) の中枢神経系抑制効果が、アルコールや他の中枢神経系抑制剤の影響に相加する可能性があることにも注意する必要があります。
髄腔内腫瘤
埋め込まれたカテーテルの先端の髄腔内腫瘤の症例が報告されており、それらのほとんどは薬局で調合された鎮痛剤の混合物に関係しています。髄腔内腫瘤に関連する最も頻繁な症状は、1) 治療反応の低下 (痙縮の悪化、以前は十分に制御されていた場合の痙縮の再発、禁断症状、漸増用量に対する反応不良、または頻繁または大量の用量増加)、2) 痛み、3)神経障害/機能不全。臨床医は、新たな神経学的徴候や症状がないか、脊髄内治療を受けている患者を注意深く監視する必要があります。髄腔内腫瘤を示唆する新たな神経学的徴候または症状がある患者では、脳神経外科の診察を検討してください。炎症性腫瘤の症状の多くは、疾患による重度の痙縮を伴う患者が経験する症状と似ているからです。場合によっては、髄腔内腫瘤の診断を確認または除外するために、画像検査の実施が適切な場合があります。
特別な患者集団における予防措置
LIORESAL 10mg INTRATHECAL の慎重な用量設定は、直立した姿勢と移動のバランスを維持するために痙性が必要な場合、または痙性が最適な機能とケアを得るために使用される場合に必要です。
精神病性障害、統合失調症、または錯乱状態に苦しむ患者は、経口投与でこれらの状態の悪化が観察されているため、LIORESAL INTRATHECAL で慎重に治療し、注意深い監視下に置く必要があります。
LIORESAL INTRATHECAL は、自律神経失調症の病歴のある患者には注意して使用する必要があります。侵害刺激の存在または LIORESAL 10mg INTRATHECAL (バクロフェン注射) の突然の中止は、自律神経反射異常のエピソードを引き起こす可能性があります。
リオレサールは主に腎臓から未変化のまま排泄されるため、腎機能障害のある患者には慎重に投与する必要があり、投与量を減らす必要がある場合があります。
臨床検査
LIORESAL INTRATHECAL を使用している患者の管理に必須と見なされる特定の臨床検査はありません。
発がん、突然変異誘発、および生殖能力の障害
バクロフェンを 2 年間経口投与したラットでは、腫瘍の増加は見られませんでした。バクロフェンの適切な遺伝毒性試験は実施されていない。
妊娠
妊娠中の女性を対象とした、十分に管理された研究はありません。動物実験では、妊娠中のラットに経口投与すると、バクロフェンは胎児の発育に悪影響を及ぼしました。 LIORESAL 25mg INTRATHECAL は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用する必要があります。
経口投与されたバクロフェンは、ラットの胎児の構造異常(臍帯ヘルニア)の発生率を増加させました。母動物では摂餌量の減少と体重増加が観察されました。マウスやウサギでは胎児の構造異常は認められなかった
授乳中の母親
治療用量の経口 LIORESAL (バクロフェン USP) で治療された母親では、活性物質が母乳に移行します。 LIORESAL 25mg INTRATHECAL を投与された授乳中の母親の母乳に検出可能なレベルの薬物が存在するかどうかは不明です。原則として、潜在的な利益が乳児への潜在的なリスクを正当化する場合にのみ、患者が LIORESAL 25mg INTRATHECAL を投与されている間、授乳を行う必要があります。
小児用
子供は、慢性注入用の埋め込み型ポンプを収容するのに十分な体重でなければなりません。具体的な推奨事項については、ポンプの製造元のマニュアルを参照してください。
4 歳未満の小児患者における安全性と有効性は確立されていません。
経口 LIORESAL (バクロフェン USP) の経験に基づく考察
経口 LIORESAL を慢性的に投与した雌ラットで、卵巣嚢腫の発生率の用量依存的な増加が観察されました。卵巣嚢腫は、最大 1 年間、経口 LIORESAL 25mg で治療された多発性硬化症患者の約 4% で触診によって発見されました。ほとんどの場合、これらの嚢胞は、患者が薬を飲み続けている間に自然に消失しました。卵巣嚢腫は、正常な女性集団の約 1% から 5% で自然発生すると推定されています。
過剰摂取
過量投与の徴候と症状を認識するために特別な注意を払う必要があります。特に、治療の最初のスクリーニングと用量漸増段階で、また治療を中断した後に LIORESAL INTRATHECAL を再導入する際にも注意が必要です。
LIORESAL INTRATHECAL 過剰摂取の症状
眠気、立ちくらみ、めまい、傾眠、呼吸抑制、低体温症、発作、頭側の筋緊張低下の進行、および72時間までの昏睡に至る意識消失。間隔。報告されたほとんどのケースで、昏睡状態は薬物の中止後、後遺症なしに回復可能でした。 LIORESAL 25mg INTRATHECAL の過剰摂取の症状は、敏感な成人患者で 25 mcg の髄腔内ボーラスを受けた後に報告されました。
過剰摂取に対する治療の提案
LIORESAL INTRATHECAL (バクロフェン注射) の過剰摂取を治療するための特定の解毒剤はありません。ただし、通常は次の手順を実行する必要があります。
腰椎穿刺が禁忌でない場合は、CSF バクロフェン濃度を下げるために CSF を 30 ~ 40 mL 採取することを検討する必要があります。
禁忌
バクロフェンに対する過敏症。 LIORESAL INTRATHECAL は、静脈内、筋肉内、皮下または硬膜外投与には推奨されません。
臨床薬理学
筋弛緩剤および鎮痙剤としてのバクロフェンの作用の正確なメカニズムは完全には理解されていません。バクロフェンは、おそらく一次求心性終末からの興奮性神経伝達物質の放出を減少させることによって、脊髄レベルで単シナプス反射と多シナプス反射の両方を阻害しますが、棘上部位での作用も発生し、その臨床効果に寄与する可能性があります。バクロフェンは、抑制性神経伝達物質ガンマアミノ酪酸 (GABA) の構造類似体であり、GABAB 受容体サブタイプの刺激によってその効果を発揮する可能性があります。
LIORESAL INTRATHECAL を髄腔内に直接導入すると、効果的な CSF 濃度が得られ、結果として得られる血漿濃度は経口投与の場合の 100 分の 1 になります。
動物だけでなく人においても、バクロフェンは、寛容を伴う鎮静、傾眠、運動失調、および呼吸および心血管の抑制の生成によって示されるように、一般的な CNS 抑制特性を有することが示されています。
LIORESAL INTRATHECAL の薬力学
髄腔内ボーラス
成人患者
作用の開始は、通常、髄腔内ボーラスの 30 分後から 1 時間後です。鎮痙効果のピークは投与後約 4 時間で見られ、効果は 4 ~ 8 時間持続します。発症、ピーク反応、および作用の持続時間は、用量および症状の重症度に応じて、個々の患者によって異なる場合があります。
小児患者
作用の開始、ピーク応答、および持続時間は、成人患者に見られるものと同様です。
持続注入
LIORESAL 25mg INTRATHECAL の鎮痙作用は、持続注入開始後 6 ~ 8 時間で初めて見られます。最大の活動は 24 ~ 48 時間で観察されます。
持続注入
小児患者に関する追加情報はありません。
リオレサール 25mg イントラシーカルの薬物動態
LIORESAL 25mg INTRATHECAL の CSF クリアランスの薬物動態は、髄腔内ボーラスまたは持続注入研究から計算され、CSF ターンオーバーに近似しており、除去は CSF のバルクフロー除去によるものであることを示唆しています。
髄腔内ボーラス
7 人の患者に 50 または 100 mcg の LIORESAL 10 mg INTRATHECAL を腰椎にボーラス注射した後、平均 CSF 排出半減期は最初の 4 時間で 1.51 時間、平均 CSF クリアランスは約 30 mL/時間でした。
持続注入
LIORESAL 10mg INTRATHECAL (バクロフェン注射) の平均 CSF クリアランスは、10 人の患者が連続髄腔内注入された研究で約 30 mL/時間でした。髄腔内投与中のバクロフェンの同時血漿濃度は低いと予想される(0~5 ng/mL)。
限られた薬物動態データは、バクロフェン注入中に神経軸に沿って約 4:1 の腰椎-大槽濃度勾配が確立されることを示唆しています。これは、治療効果に関連する用量で腰部レベルで持続的なバクロフェン注入を受けている 5 人の患者における大槽および腰部タップを介した同時 CSF サンプリングに基づいています。患者間の変動は大きかった。グラデーションは位置によって変更されませんでした。
77-400 mcg/日の用量で持続的な髄腔内バクロフェン注入を受けた 6 人の小児患者 (年齢 8-18 歳) は、血漿バクロフェンレベルが 10 ng/mL 付近またはそれ以下でした。
患者情報
PrLIORESAL 髄腔内 (バクロフェン) 注射 0.05 mg/mL、0.5 mg/mL、2 mg/mL
髄腔内注射および注入専用
このリーフレットは、カナダで LIORESAL IT の販売が承認されたときに発行された 3 部構成の「製品モノグラフ」の第 3 部であり、消費者向けに特別に設計されています。このリーフレットは概要であり、リオレサール 10mg IT に関するすべてを説明するものではありません。薬についてご不明な点がございましたら、医師または薬剤師にご相談ください。
この薬について
薬の用途:
LIORESAL 25mg Intrathecal は、筋弛緩薬と呼ばれる薬のグループに属します。多発性硬化症、脊髄の病気や損傷、特定の脳障害など、さまざまな病気で発生する過度のこわばりやけいれんを軽減および緩和するために使用されます。
機能:
ソリューションは、腹部の皮膚の下に埋め込まれた特別なポンプを使用して、脊髄の周りの液体スペースに注入または注入されます。ポンプから一定量の溶液が、小さなチューブを通して脊髄の周りの流体空間に送られます。
筋肉の収縮に対する有益な効果とそれに伴う痛みの軽減により、LIORESAL イントラクモ膜下は、身体の可動性と、補助なしで日常活動を管理する能力を向上させます。また、LIORESAL 25mg は、理学療法の効果をさらに高めるのに役立ちます。
使用してはいけない場合:
次の場合は、LIORESAIT で治療しないでください。
- LIORESAL 25mg Intrathecal または下記の LIORESAL 10mg Intrathecal の他の成分にアレルギー(過敏症)がある。
薬用成分とは:
バクロフェン。
非薬用成分とは:
リオレサール 25mg IT 内容:塩化ナトリウム、注射用水
どのような剤形がありますか:
LIORESAL 25mg 髄腔内 (バクロフェン注射) 0.05 mg/mL: 各 1 mL アンプルには、髄腔内投与用のバクロフェン 0.05 mg が含まれています。
LIORESAL 髄腔内 (バクロフェン注射) 0.5 mg/mL: 各 20 mL アンプルには、髄腔内投与用のバクロフェン 10 mg が含まれています。
LIORESAL 25mg 髄腔内 (バクロフェン注射) 2 mg/mL: 各 5 mL アンプルには、髄腔内投与用のバクロフェン 10 mg が含まれています。
警告と注意事項
LIORESAL 10mg Intrathecal は、すべてではありませんが、多くの筋肉痙攣患者に適しています。
次の場合は、LIORESAL 25mgIT を使用する前に、医師または薬剤師に相談してください。
- 何らかの感染症にかかっている
- パーキンソン病または錯乱を伴う特定の精神疾患を患っている
- てんかん(発作)がある
- 糖尿病を持っている
- これまで心臓に問題があった
- 腎臓に問題があった
- 呼吸に問題がある
- 胃や腸に激しい痛みがある
- 脳の血液循環が乱れている
- 膀胱や腸の膨張、皮膚の炎症や痛みなどの刺激に対する神経系の過剰反応による高血圧、不安、過度の発汗、「ガチョウの肉」、ドキドキする頭痛、異常に遅い心拍などの突然のエピソードを経験したことがありますか?
これらのいずれかに該当する場合、医師はこの薬を投与したくないか、特別な予防措置を講じる必要があるかもしれません.これらのことについて医師に伝えていない場合は、LIORESAL 25mg 髄腔内治療を開始する前に医師に伝えてください。
アレルギーの可能性があると思われる場合は、医師に相談してください。
機械の運転と使用: LIORESAL Intrathecal は、眠気やめまいを感じることがあります。車の運転や機械の使用、注意が必要なことをするときは、体調が回復するまで注意してください。
この薬との相互作用
漢方薬や非処方薬 (市販薬) を含む他の薬を服用している、または最近服用したことがある場合は、医師または薬剤師に相談してください。他のいくつかの薬は、LIORESAL 10mgIT と相互作用する可能性があります。医師は投薬量を変更したり、薬の 1 つを中止したりすることがあります。これは、以下の医薬品にとって特に重要です。
- あなたの痙性状態のための他の薬
- パーキンソン病の薬
- てんかんの薬
- 抗うつ薬やリチウムなどの気分障害の治療に使用される薬
- 高血圧の薬
- 腎臓に影響を与える他の薬、例えばイブプロフェン
- 鎮痛剤
- 睡眠を助けたり、落ち着かせたりするために使用される薬
- 抗ヒスタミン薬や鎮静薬など、中枢神経系を遅くする薬(これらの一部は店頭で購入できます)
服用しているすべての薬について、必ず医師または看護師に伝えてください。これは、自分で購入した薬と、医師から処方された薬を意味します。
リオレサール 25mg 髄腔内投与中にアルコール飲料を飲むと、通常よりも眠気やめまいを感じることがありますので注意してください。
この薬の適切な使用
通常の線量
LIORESAL Intrathecal は、特別な医療機器を使用して経験豊富な医師のみが投与できます。少なくとも治療開始時は入院が必要です。
医師は、少量の LIORESAL Intrathecal を脊髄に注射して、筋肉のけいれんが改善するかどうかを確認します。そうであれば、特別なポンプが皮膚の下に埋め込まれます。ポンプは常に少量の薬を与えます。
あなたに最適な薬の量を見つけるには数日かかる場合があります。この間、医師はあなたを注意深く監視します.
その後も、医師は定期的にあなたの経過を確認し、ポンプが正常に機能していることを確認したいと考えています.
ポンプを補充するための予約を守ることが非常に重要です。そうしないと、リオレサールの髄腔内投与量が十分に高くないため、けいれんが再発する可能性があります。筋肉の痙性は改善しないか、結果として悪化する可能性があります。
筋肉のけいれんが改善されない場合、またはけいれんが再発し始めた場合は、徐々にまたは突然、すぐに医師に連絡してください.
ポンプと挿入部位の適切なホーム ケアに関する情報については、ポンプ メーカーの資料を参照してください。
LIORESAL 10mg Intrathecal による治療中のモニタリング
ポンプ埋め込み直後のスクリーニング段階と用量調節期間中、設備が整ったスタッフが配置された環境で綿密に監視されます。投与量の要件、副作用の可能性、または感染の証拠について定期的に評価されます。配信システムの機能もチェックされます。
妊娠と授乳
妊娠中または授乳中の場合は、LIORESAL 25mg 髄腔内注射を使用しないでください。薬を服用する前に、医師または薬剤師に相談してください。
医師は、妊娠中に LIORESAL 25mg の髄腔内投与を行う潜在的なリスクについて話し合います。
医師は、これらの特別な状況で LIORESAL 10mg の髄腔内投与を受けてもよいかどうかを決定します。ごく少量のリオレサール 10mg のみが母乳に移行します。授乳を希望する場合は、医師に相談してください。
過剰摂取
薬物の過剰摂取の場合は、症状がなくても、すぐに医療従事者、病院の救急部門、または地域の毒物管理センターに連絡してください。
過剰摂取の兆候は、ポンプの誤動作などによって、突然または知らず知らずのうちに現れることがあります。あなたとあなたの世話をしている人々が過剰摂取の兆候を認識することは非常に重要です.次の症状のいずれかまたは組み合わせが発生した場合は、受け取った薬の量が多すぎる可能性があるため、遅滞なく医師に相談してください。
- 異常な筋力低下(筋緊張が弱すぎる)
- 眠気
- 立ちくらみやめまい
- 過剰な唾液分泌
- 吐き気または嘔吐
- 呼吸困難、発作または意識喪失
- 異常な低体温
飲み忘れ
LIORESAL 10mg Intrathecal を急に中止すると、重大な医学的問題が発生する可能性があり、まれに致命的なケースもあります。
ポンプが適切に機能していない、または適切な量の薬が投与されていないことを示す兆候には、痙性、かゆみ、低血圧、立ちくらみ、チクチク感、高熱、精神状態の変化、筋肉のこわばりの増加または再発が含まれます。筋力低下または麻痺。上記の症状のいずれかが発生した場合は、すぐに医師に相談することが重要です。
副作用とその対策
すべての医薬品と同様に、LIORESAL 25mg 髄腔内投与で治療された患者は、副作用を経験する可能性がありますが、すべての人が副作用を経験するわけではありません。これらは、入院中の治療開始時により頻繁に発生しますが、後で発生することもあり、医師に確認する必要があります.
ごく普通: 眠気、筋力低下
一般: 不安感、鎮静・倦怠感(疲労感)、足の脱力感、筋肉のこわばり、めまい・ふらつき、頭痛、眠気、吐き気・吐き気、手足のしびれ、不眠、ろれつが回らない、肺炎、脱力感、悪寒、疲労、痛み、口渇、皮膚発疹および/またはかゆみ、足首、足、または下肢のむくみ、顔のむくみ、異常な緊張または落ち着きのなさ、混乱/見当識障害、便秘、下痢、食欲不振、過剰唾液分泌、発熱/震え、排尿障害、性的困難。
アンコモン: 気分や精神の変化、パラノイア、極度の幸福感(多幸感)、筋肉の協調運動失調(運動失調)、体温の異常低下、記憶喪失、制御不能な眼球運動の持続、味覚の低下、嚥下困難、腹痛、脱毛、過度の発汗。
レア: 落ち着きのなさ、異常に遅い呼吸数。
他の影響に気付いた場合は、医師に相談してください。一部の副作用は、配信システムに関連している可能性があります。
深刻な副作用、その頻度、対処法
これは副作用の完全なリストではありません。 LIORESAL IT の服用中に予想外の影響が生じた場合は、医師または薬剤師にご相談ください。
保管方法
LIORESAL 10mg IT アンプルは 15 ~ 30°C で保管してください (熱から保護してください)。凍結しないでください。加熱殺菌しないでください。
すべての薬は子供の手の届かないところに保管してください。
この薬は、あなたの特定の医学的問題のために、あなた自身の使用のみのために処方されています.他の人に与えないでください。
期限切れの薬は使用しないでください。子供の手の届かないところに安全に廃棄するか、薬剤師に持って行って処分してもらってください。
疑わしい副作用の報告
健康製品の使用に関連する副作用の疑いがある場合は、次の 3 つの方法のいずれかでカナダ警戒プログラムに報告できます。
- www.healthcanada.gc.ca/medeffectでオンラインで報告してください
- フリーダイヤル 1-866-234-2345
- カナダ警戒報告書に記入し、次のことを行います。
- フリーダイヤルで 1-866-678-6789 にファックスするか、
- 郵送先: Canada Vigilance Program, Health Canada, Postal Locator 0701E, Ottawa, Ontario, K1A 0K9
郵送料が支払われたラベル、カナダ警戒報告書、および副作用報告ガイドラインは、MedEffect™ Canada の Web サイト (www.healthcanada.gc.ca/medeffect) で入手できます。
ノート: 副作用の管理に関する情報が必要な場合は、医療専門家にお問い合わせください。カナダ警戒プログラムは、医学的アドバイスを提供しません。
詳しくは
医療専門家向けに作成されたこの文書と完全な製品モノグラフは、http://www.novartis.ca で見つけることができます。
