女性の病気の治療: Clomid 100mg, 25mg, 50mg Clomiphene 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
クロミッド50mgとは?
Clomid 100mg は、排卵障害のある女性の不妊症の症状を治療するために使用される処方薬です。クロミッドは、単独で使用することも、他の薬と併用することもできます。
クロミッドは、選択的エストロゲン受容体モジュレーターと呼ばれる薬のクラスに属しています。
クロミッドが子供に安全で効果があるかどうかはわかっていません.
クロミッドの副作用の可能性は?
クロミッドは、次のような重大な副作用を引き起こす可能性があります。
- 胃痛、
- 膨満感、
- 吐き気、
- 嘔吐、
- 下痢、
- 急激な体重増加(特に顔と胴体)
- 排尿がほとんどまたはまったくない、
- 息をするときの痛み、
- 心拍数が速く、
- 呼吸困難
上記の症状がある場合は、すぐに医療機関を受診してください。
クロミッドの最も一般的な副作用は次のとおりです。
- 紅潮(熱感、赤み、チクチク感)、
- 吐き気、
- 嘔吐、
- 膨満感、
- 乳房の痛みや圧痛、
- 頭痛と
- 破綻出血または斑点
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、クロミッドのすべての可能な副作用ではありません.詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
CLOMID (クロミフェン クエン酸塩錠 USP) は、化学的に 2-[p-(2-クロロ-1,2-ジフェニルビニル)フェノキシ] クエン酸トリエチルアミン (1:1) と呼ばれる、経口投与される非ステロイド性の排卵誘発剤です。分子式は C26H28ClNO • C6H8O7 で、分子量は 598.09 です。構造的には次のように表されます。
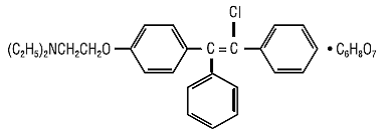
クエン酸クロミフェンは、白色から淡黄色で、本質的に無臭の結晶性粉末です。メタノールに溶けやすい。エタノールに可溶。アセトン、水、クロロホルムにわずかに溶けます。エーテルに不溶。
CLOMID 50mg は、2 つの幾何異性体 [シス (ズクロミフェン) とトランス (エンクロミフェン)] の混合物で、シス異性体が 30% から 50% 含まれています。
各白のスコアの錠剤には、50 mg のクエン酸クロミフェン USP が含まれています。タブレットには、次の不活性成分も含まれています: コーンスターチ、ラクトース、ステアリン酸マグネシウム、アルファ化コーンスターチ、およびスクロース。
適応症
CLOMID 100mg は、妊娠を希望する女性の排卵障害の治療に適応されます。 CLOMID 50mg療法を開始する前に、妊娠を達成するための障害を除外するか、適切に治療する必要があります.クロミフェン療法で成功する可能性が最も高い患者には、多嚢胞性卵巣症候群の患者が含まれます。 警告 : 卵巣過剰刺激症候群 )、無月経-乳汁漏出症候群、心因性無月経、経口避妊後の無月経、および原因不明の続発性無月経の特定の症例。
排卵との関係で適切なタイミングの性交が重要です。基礎体温グラフまたはその他の適切な検査は、排卵が起こったかどうかを患者と医師が判断するのに役立ちます。排卵が確立されたら、クロミッド 100mg の各コースは、周期の 5 日目またはその前後に開始する必要があります。合計約 6 周期 (3 排卵周期を含む) を超える長期周期療法は推奨されません。 (見る 投薬と管理 と 予防 .)
CLOMID は、以下の条件を満たす排卵障害のある患者にのみ適用されます。
さらに、CLOMID 療法に選択された患者は、次の点について評価する必要があります。
男性不妊症の治療におけるCLOMID 100mgの有効性を示す、十分に管理された研究はありません。さらに、精巣腫瘍および女性化乳房がクロミフェンを使用した男性で報告されています。精巣腫瘍の報告とCLOMID 25mgの投与との因果関係は不明です。
医学文献ではさまざまな方法が提案されていますが、併用療法 (すなわち、他の排卵誘発剤と組み合わせた CLOMID) のための普遍的に受け入れられている標準レジメンはありません。同様に、受精および再導入のための卵子を生成するための体外受精プログラムにおける排卵誘発のための標準的な CLOMID レジメンはありません。したがって、CLOMID 50mg はこれらの用途には推奨されません。
投薬と管理
一般的な考慮事項
CLOMID 100mg療法の候補者の精密検査と治療は、婦人科または内分泌障害の管理に経験のある医師によって監督されるべきです.慎重な診断評価( 適応症 )。治療計画は事前に概説する必要があります。 CLOMID を開始する前に、治療の目標を達成するための障害を排除するか、適切に治療する必要があります。治療目的は、潜在的なリスクとバランスを取り、患者および妊娠の達成に関与する他の人と話し合う必要があります。
排卵は、CLOMID の投与後 5 ~ 10 日で最も頻繁に起こります。性交は、排卵の予想時間と一致するように調整する必要があります。排卵を決定するための適切な検査は、この時期に役立つ場合があります。
推奨用量
選択された患者の治療は、低用量の 1 日 50 mg (1 錠) を 5 日間開始する必要があります。 CLOMID 50 mg の周期的な投与に反応して排卵しない患者にのみ、用量を増量する必要があります。多嚢胞性卵巣症候群の患者( 警告 ; 卵巣過剰刺激症候群 )。
各治療サイクルの間に妊娠、卵巣肥大、または卵巣嚢胞形成を除外するために、患者を慎重に評価する必要があります。
プロゲスチン誘発性出血が計画されている場合、または治療前に自然子宮出血が発生した場合は、50 mg を 5 日間毎日投与するレジメンを周期の 5 日目またはその前後に開始する必要があります。治療は、最近子宮出血がない患者ではいつでも開始できます。この投与量で排卵が起こった場合、その後の治療サイクルで投与量を増やしても利点はありません。
初回治療後に排卵が起こらないようであれば、2回目の100mg/日(1日1回50mg錠2錠)を5日間投与する必要があります。このコースは、妊娠の存在を排除するための予防措置が講じられた後、前回のコースから30日後に開始することができます.投与量または治療期間を 1 日 100 mg を超えて 5 日間増やすことは推奨されません。
排卵する予定の患者の大部分は、最初の治療コースの後に排卵します。 3 コースの治療後に排卵が起こらない場合は、CLOMID 50mg によるさらなる治療は推奨されず、患者を再評価する必要があります。排卵反応が 3 回起こっても妊娠に至らない場合は、それ以上の治療は推奨されません。排卵反応後に月経が起こらない場合は、患者を再評価する必要があります。合計で約 6 サイクルを超える長期の循環療法は推奨されません (以下を参照)。 予防 )。
供給方法
NDC 0068-0226-30: 50 mg 錠剤 30 個入りカートン 錠剤は丸型、白色、刻み目があり、型押しされた CLOMID 50 です。錠剤は 59 ~ 86°F (15 ~ 30°C) の制御された室温で保管してください。熱、光、過度の湿気を避け、密閉容器に保管してください。
製造元: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. 改訂: 2017 年 7 月
副作用
臨床試験の有害事象。
CLOMID は、推奨用量で、一般的に十分に許容されます。通常、有害反応は軽度で一過性であり、治療を中止するとほとんどがすぐに消失します。臨床研究中にクエン酸クロミフェンで治療された患者で報告された有害な経験を表2に示します.
次の有害事象は、臨床試験で 1% 未満の患者で報告されています。不眠症、ふらつき、神経の緊張、膣の乾燥、めまい、体重の増減。
CLOMID 25mg 療法を長期にわたって受けている患者は、デスモステロールの血清レベルの上昇を示すことがあります。これは、コレステロール合成への直接的な干渉が原因である可能性が最も高い.ただし、CLOMID 50mg の推奨用量を投与された患者の血清ステロールは、有意に変化していません。卵巣がんは、不妊治療薬を受けた患者でまれに報告されています。不妊症は、卵巣がんの主要な危険因子です。しかし、疫学データは、クロミフェンの長期使用が境界型または浸潤性卵巣腫瘍のリスクを高める可能性があることを示唆しています。
市販後の有害事象
Clomidの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
全身: 発熱、耳鳴り、脱力感
心臓血管: 不整脈、胸痛、浮腫、高血圧、動悸、静脈炎、肺塞栓症、息切れ、頻脈、血栓性静脈炎
中枢神経系: 片頭痛、感覚異常、発作、脳卒中、失神
皮膚科: にきび、アレルギー反応、紅斑、多形紅斑、結節性紅斑、多毛症、かゆみ、蕁麻疹
胎児/新生児の異常:
- 異常な骨の発達: 頭蓋骨、顔、鼻腔、顎、手、四肢 (アメリア、ヘミメリア、フォコメリアを含むエクトロメリア)、足 (内反足)、脊椎、および関節の骨格奇形
- 心臓の異常:心臓中隔欠損症、筋性心室中隔欠損症、動脈管開存症、ファロー四徴症、大動脈縮窄症
- 染色体異常:ダウン症候群
- 耳の異常と難聴
- 消化管異常:口唇口蓋裂、無孔肛門、気管食道瘻、横隔膜ヘルニア、臍ヘルニア
- 生殖器の異常:尿道下裂、排泄腔の外反症
- 肺組織奇形
- 眼と水晶体の奇形(白内障)
- 新生物:神経外胚葉性腫瘍、甲状腺腫瘍、肝芽腫、リンパ球性白血病
- 神経系の異常:神経管欠損症(無脳症、髄膜脊髄瘤)、小頭症、水頭症
- 腎異常:腎無形成および腎形成不全
- その他:小人症、精神遅滞
胃腸: 膵炎
泌尿生殖器: 子宮内膜症、卵巣嚢胞(卵巣の拡大または嚢胞は、付属器のねじれによって複雑になる可能性があります)、卵巣出血、卵管妊娠、子宮出血、子宮内膜の厚さの減少
肝臓: トランスアミナーゼ上昇、肝炎
代謝障害: 高トリグリセリド血症、場合によっては膵炎を伴う
筋骨格: 関節痛、腰痛、筋肉痛
新生物: 肝臓(肝血管肉腫、肝細胞腺腫、肝細胞癌);乳房(線維嚢胞性疾患、乳癌);子宮内膜 (子宮内膜癌);神経系(星細胞腫、下垂体腫瘍、プロラクチノーマ、神経線維腫症、多形性膠芽腫、脳膿瘍);卵巣 (妊娠の黄体腫、卵巣の類皮嚢胞、卵巣癌);絨毛性(胞状奇胎、絨毛癌);その他 (黒色腫、骨髄腫、肛門周囲嚢胞、腎細胞癌、ホジキンリンパ腫、舌癌、膀胱癌)
精神的: 不安、過敏症、気分の変化、精神病
視覚障害: 調節異常、白内障、眼痛、黄斑浮腫、視神経炎、光視症、後部硝子体剥離、網膜出血、網膜血栓症、網膜血管痙攣、一時的または長期にわたる視力喪失、おそらく不可逆的。
他の: 白血球増加症、甲状腺障害
薬物相互作用
CLOMID との薬物相互作用は記録されていません。
薬物乱用と依存
CLOMID による耐性、乱用、または依存は報告されていません。
警告
視覚的な症状
CLOMIDによる治療中に、ぼやけや斑点や閃光(閃光暗点)などの他の視覚症状が時折発生する可能性があることを患者に説明する必要があります。これらの視覚的症状は、総用量または治療期間が長くなるにつれて発生率が高くなります。これらの視覚障害は通常、可逆的です。ただし、長期にわたる視覚障害の症例が報告されており、CLOMID 50mgの中止後に発生したものもあります.視覚障害は、特に投与量または治療期間の増加により、元に戻せない場合があります。患者は、これらの視覚症状により、特に変化する照明の条件下では、車の運転や機械の操作などの活動が通常よりも危険になる可能性があることを警告する必要があります.
これらの視覚症状は、残像の激化と延長によるものと思われる。明るい環境にさらされると、症状が最初に現れるか、または悪化することがよくあります。測定された視力は通常影響を受けていませんが、毎日 200 mg の CLOMID を服用している研究患者は、治療の 7 日目に視力のぼやけを発症し、10 日目までに視力の深刻な低下に進行しました.他に異常はなく、治療中止後3日目で視力は正常に戻りました。
眼科学的に定義可能な暗点および網膜細胞機能 (網膜電図) の変化も報告されています。臨床研究中に治療を受けた患者は、CLOMID 50mgの長期投与中に閃光と暗点を発症し、治療中止後32日目までに消失しました.
有害事象の市販後の調査では、CLOMID 治療中の他の視覚的徴候や症状も明らかになりました ( 有害反応 )。
これらの視覚症状の病因はまだ理解されていませんが、視覚症状のある患者は治療を中止し、速やかに完全な眼科的評価を行う必要があります。
卵巣過剰刺激症候群
卵巣過剰刺激症候群 (OHSS) は、排卵誘発のためにクエン酸クロミフェン療法を受けている患者に発生することが報告されています。 OHSS は急速に進行し (24 時間から数日以内)、深刻な医学的障害になることがあります。場合によっては、クエン酸クロミフェン療法の周期的な使用後、またはクエン酸クロミフェンをゴナドトロピンと組み合わせて使用したときに、OHSSが発生しました. OHSS に関連して、肝機能障害を示唆する一過性の肝機能検査異常が報告されています。
OHSS は、合併症のない卵巣肥大とは異なる医学的事象です。重症例におけるこの症候群の臨床徴候には、肉眼的卵巣肥大、胃腸症状、腹水、呼吸困難、乏尿、胸水などがあります。さらに、この症候群に関連して次の症状が報告されています: 心膜液貯留、無呼吸、水胸、急性腹症、低血圧、腎不全、肺水腫、腹腔内および卵巣出血、深部静脈血栓症、卵巣のねじれ、および急性呼吸器疾患苦痛。 OHSS の早期警告サインは、腹痛と腹部膨満、吐き気、嘔吐、下痢、体重増加です。尿中ステロイド濃度の上昇、さまざまな程度の電解質の不均衡、循環血液量減少、血液濃縮、および低タンパク血症が発生する可能性があります。血液量減少性ショック、血液濃縮、または血栓塞栓症による死亡が発生しています。重症の場合、肥大した卵巣は脆弱であるため、腹部および内診は非常に慎重に行う必要があります。受胎が起こると、重症型の症候群に急速に進行する可能性があります。
CLOMID 100mg 療法に伴う時折の異常な卵巣肥大に伴う危険を最小限に抑えるために、予想される臨床結果と一致する最低用量を使用する必要があります。卵巣の最大拡大は、生理的または異常にかかわらず、CLOMID の推奨用量を中止してから数日後まで発生しない場合があります。ゴナドトロピンに異常に敏感な多嚢胞性卵巣症候群の一部の患者は、CLOMIDの通常の用量に対して誇張された反応を示す可能性があります.したがって、多嚢胞性卵巣症候群の患者は、最初の治療コースを推奨される最低用量と最短の治療期間で開始する必要があります。 投薬と管理 )。
卵巣の拡大が発生した場合は、卵巣が治療前のサイズに戻るまで追加の CLOMID 治療を行うべきではなく、次のコースの投与量または期間を減らす必要があります。 CLOMID 50mg療法に伴う卵巣肥大および嚢胞形成は、通常、治療中止後数日または数週間以内に自然に退行します。これらの場合、その後のCLOMID 25mg療法の潜在的な利益は、リスクを上回るはずです.開腹術の外科的適応がない限り、そのような嚢胞性肥大は常に保守的に管理する必要があります。
卵巣過剰刺激と卵巣がんとの因果関係は特定されていません。しかし、卵巣がんと未経産、不妊症、および年齢との相関関係が示唆されているため、卵巣嚢胞が自然に退行しない場合は、卵巣腫瘍の存在を除外するために徹底的な評価を行う必要があります。
予防
全般的
CLOMID 療法の候補の選択には細心の注意を払う必要があります。 CLOMID治療前およびその後の各コースの前に、内診が必要です(以下を参照)。 禁忌 と 警告 )。
発がん、突然変異誘発、生殖能力の障害
クエン酸クロミフェンの発がん性または変異原性の可能性を評価するために、動物での長期毒性試験は実施されていません。
CLOMID 25mg を雄ラットに 0.3 または 1 mg/kg/日の用量で経口投与すると受胎能が低下し、高用量では一時的な不妊症が生じました。雌ラットに 0.1 mg/kg/日の経口投与を行うと、通常の定期的な膣塗抹パターンが一時的に中断され、受胎が妨げられました。 0.3 mg/kg/日の投与量では、排卵した卵子と黄体の数がわずかに減少しましたが、3 mg/kg/日の投与量では排卵が抑制されました。
妊娠
胎児のリスクのまとめ
CLOMID 25mg 治療は妊婦には効果がないため、妊婦への CLOMID 100mg の使用は禁忌です。
利用可能なヒトのデータは、バックグラウンド人口リスクを超える先天異常のリスク増加を示唆していません。しかし、動物の生殖毒性研究では、子孫の胚・胎児喪失と構造奇形の増加が示されました。妊娠中にこの薬を使用する場合、またはこの薬の服用中に患者が妊娠した場合は、胎児への潜在的なリスクについて患者に通知する必要があります。
臨床上の考慮事項
妊娠初期に CLOMID 25mg を誤って投与することを避けるために、排卵および/または妊娠が発生したかどうかを判断するために、各治療サイクル中に適切な検査を行う必要があります。各治療サイクルの間に卵巣肥大または卵巣嚢胞の形成を除外するために、患者を慎重に評価する必要があります。 CLOMID 治療の次のコースは、これらの状態が除外されるまで延期する必要があります。
ヒトデータ
疫学的研究から入手可能なヒトのデータは、クエン酸クロミフェンの概念外曝露と、全体的な先天異常または特定の異常のリスク増加との間に明らかな因果関係を示していません。しかし、クエン酸クロミフェンで治療された女性に発生する先天性異常の症例は少数であるため、これらの疫学的研究はリスクの大きな違いを除外することしかできませんでした.これらの研究では、女性の生殖能力低下に関連する要因は考慮されておらず、他の重要な交絡因子を調整することができませんでした.さらに、利用可能なデータは、排卵誘発のためにクエン酸クロミフェンで治療された不妊症の女性の自然流産率の増加を支持していません。
動物データ
臓器形成期の妊娠ラットにクエン酸クロミフェンを 1 ~ 2 mg/kg/日の用量で経口投与すると、羊水過多と、肋骨の波状およびその他の一時的な骨変化を伴う弱く浮腫性の胎児が生じました。 8 mg/kg/日以上の用量でも、再吸収の増加、胎児の死亡、難産、分娩遅延が発生し、40 mg/kg/日では妊産婦死亡率が増加しました。 50 mg/kg の単回投与では胎児の白内障が発生し、200 mg/kg では口蓋裂が発生しました。妊娠中のマウスおよびラットへのクエン酸クロミフェン 2 mg/kg の注射後、子孫は生殖管の化生変化を示した。生後数日間に注射された新生児マウスおよびラットも、子宮および膣粘膜の化生変化、ならびに早期膣開口および無排卵卵巣を発症した.これらの発見は、他のエストロゲンおよび抗エストロゲンで説明されている異常な生殖行動および不妊症に似ています。
ウサギでは、妊娠中に 20 または 40 mg/kg/日の経口用量を与えられた母親の胎児に一時的な骨の変化が見られましたが、8 mg/kg/日の後には見られませんでした。これらの研究では、永久的な奇形は観察されませんでした。また、妊娠中のさまざまな期間に 1.5 ~ 4.5 mg/kg/日の経口用量を与えられたアカゲザルには、異常な子孫はありませんでした。
授乳中の母親
CLOMID が母乳中に排泄されるかどうかは不明です。多くの薬物は母乳中に排泄されるため、クロミッドを授乳中の女性に投与する場合は注意が必要です。一部の患者では、CLOMID により授乳が減少する場合があります。
卵巣がん
クエン酸クロミフェン錠剤 USP の長期使用は、境界型または浸潤性卵巣腫瘍のリスクを高める可能性があります ( 有害反応 )。
過剰摂取
徴候と症状
CLOMID 50mg の急性過剰摂取に伴う毒性は報告されていません。 CLOMID 100mg治療中に推奨用量を超えて使用した結果としての過剰摂取の徴候と症状には、吐き気、嘔吐、血管運動性紅潮、視覚のぼやけ、斑点または閃光、暗点、骨盤痛または腹痛を伴う卵巣肥大が含まれます. (見る 禁忌 : 卵巣嚢腫 .)
経口LD50
CLOMID 25mg の急性経口 LD50 は、マウスで 1700 mg/kg、ラットで 5750 mg/kg です。ヒトでの毒性量は不明です。
透析
CLOMID が透析可能かどうかは不明です。
処理
過剰摂取の場合は、胃腸の汚染除去に加えて、適切な支持手段を採用する必要があります。
禁忌
過敏症
CLOMID 100mg は、既知の過敏症またはクエン酸クロミフェンまたはその成分に対するアレルギーのある患者には禁忌です。
妊娠
CLOMID は妊娠中の女性には効果がないため、妊婦への CLOMID の使用は禁忌です。
利用可能なヒトのデータは、指示どおりに使用した場合、バックグラウンド集団のリスクを超えて先天異常のリスクが増加することを示唆していません。しかし、動物の生殖毒性研究では、子孫の胚・胎児喪失と構造奇形の増加が示されました。妊娠中にこの薬を使用する場合、またはこの薬の服用中に患者が妊娠した場合は、胎児への潜在的なリスクについて患者に通知する必要があります。 (見る 予防 : 妊娠 .)
肝疾患
CLOMID 25mg 療法は、肝疾患または肝機能障害の病歴のある患者には禁忌です (以下も参照)。 適応症 と 有害反応 )。
異常な子宮出血
CLOMID 25mg は、原因不明の異常な子宮出血のある患者には禁忌です (以下を参照)。 適応症 )。
卵巣嚢腫
CLOMID は、多嚢胞性卵巣症候群によるものではない卵巣嚢胞または腫大の患者には禁忌です (以下を参照)。 適応症 と 警告 )。
他の
CLOMID は、制御されていない甲状腺または副腎の機能障害のある患者、または下垂体腫瘍などの器質的な頭蓋内病変がある患者には禁忌です( 適応症 )。
臨床薬理学
アクション
CLOMID 25mg は、かなりの薬理学的効力を持つ薬剤です。患者の慎重な選択と適切な管理により、CLOMID 100mg は、妊娠を希望する無排卵患者にとって有用な治療法であることが実証されています。
クエン酸クロミフェンは、視床下部、下垂体、卵巣、子宮内膜、膣、および子宮頸部を含むエストロゲン受容体を含む組織と相互作用することができます。それは、エストロゲン受容体結合部位についてエストロゲンと競合する可能性があり、細胞内エストロゲン受容体の補充を遅らせる可能性があります。クエン酸クロミフェンは一連の内分泌事象を開始し、排卵前ゴナドトロピンの急増とその後の卵胞破裂に至ります。一連のクロミフェン療法に反応した最初の内分泌事象は、下垂体性ゴナドトロピンの放出の増加です。これにより、ステロイド産生と卵胞形成が開始され、卵胞が成長し、エストラジオールの循環レベルが上昇します。排卵後、血漿プロゲステロンとエストラジオールは通常の排卵周期と同様に増減します。
利用可能なデータは、クロミフェンのエストロゲン特性と抗エストロゲン特性の両方が排卵の開始に関与している可能性があることを示唆しています. 2つのクロミフェン異性体は、エストロゲン作用と抗エストロゲン作用が混在していることがわかっており、種によって異なる可能性があります.いくつかのデータは、ズクロミフェンがエンクロミフェンよりもエストロゲン活性が高いことを示唆しています。
クエン酸クロミフェンには明らかなプロゲステロン効果、アンドロゲン効果、または抗アンドロゲン効果がなく、下垂体-副腎または下垂体-甲状腺機能を妨害するようには見えません。 CLOMID の「キャリーオーバー効果」の証拠はありませんが、CLOMID 100mg 治療後に一部の患者で自然排卵月経が認められています。
薬物動態
14C 標識クエン酸クロミフェンを用いた初期の研究に基づいて、この薬物はヒトに経口で容易に吸収され、主に糞便中に排泄されることが示されました。 14C の尿および糞便への累積排泄量は、5 日後に平均して経口投与量の約 50%、静脈内投与量の 37% でした。平均尿中排泄は約 8% で、糞中排泄は約 42% でした。
投与後 6 週間の糞便には 14C 標識がいくらか残っていた。正常なボランティアにおけるその後の単回投与研究では、ズクロミフェン (cis) がエンクロミフェン (trans) よりも長い半減期を持つことが示されました。これらの被験者では、検出可能なレベルのズクロミフェンが 1 か月以上持続しました。これは、ステレオ特異的な腸肝リサイクルまたはズクロミフェンの隔離を示唆している可能性があります。したがって、CLOMID治療中の月経周期で妊娠する女性では、妊娠初期に有効な薬物が体内に残る可能性があります.
臨床研究
臨床調査中、7,578 人の患者が CLOMID の投与を受けましたが、そのうちの何人かは排卵機能障害以外の排卵障害を持っていました。 適応症 )。これらの臨床試験では、妊娠を特徴とする治療の成功は、これらの患者の約 30% で発生しました。
臨床試験期間中、合計 2635 人の妊娠が報告されました。これらの妊娠のうち、転帰に関する情報が得られたのは 2,369 例のみでした。表 1 は、これらのケースの結果をまとめたものです。
報告された妊娠のうち、多胎妊娠の発生率は 7.98% で、双子が 6.9%、三つ子が 0.5%、四つ子が 0.3%、五つ子が 0.1% でした。十分な情報が得られた 165 人の双子の妊娠のうち、一卵性双生児と二卵性双生児の比率は約 1:5 でした。表 1 は、生きている複数の出生の生存率を報告しています。
最初の臨床研究の完了後に六つ子の誕生が報告されました。生き残った六つ子はいなかった(それぞれの体重は 400 g 未満だった)が、いずれも全体的に正常に見えた。
自然流産、死産、新生児死亡を含む多胎妊娠による乳児の全生存率は 73% です。
胎児/新生児の異常と死亡率
臨床試験中のCLOMIDによる排卵誘発療法後の妊娠に続いて、以下の胎児の異常が報告されています。次の胎児の異常のそれぞれが 1% 未満の割合で報告されました (経験は頻度の高い順に記載されています): 先天性心臓病変、ダウン症候群、内反足、先天性腸病変、尿道下裂、小頭症、口唇裂および口蓋裂、先天性股関節、血管腫、停留精巣、多指症、結合双生児および奇形腫、動脈管開存症、黒内障、動静脈瘻、鼠径ヘルニア、臍ヘルニア、合指症、漏斗胸、ミオパシー、頭皮類皮嚢腫、臍帯ヘルニア、潜在性二分脊椎、魚鱗癬、そして永続的な舌小帯。先天異常のある乳児の新生児死亡および胎児死亡/死産も、1%未満の割合で報告されています。臨床試験中の母体のCLOMID 50mg摂取に関連して報告された妊娠からの先天性異常の全体的な発生率は、一般集団について報告されたものの範囲内でした.
さらに、CLOMIDの市販後調査中に先天異常の報告が寄せられています( 有害反応 )。
患者情報
CLOMID 療法の目的とリスクは、治療を開始する前に患者に提示する必要があります。 CLOMID 療法の目標は、次の妊娠のための排卵であることを強調する必要があります。医師は、以下の潜在的なリスクを特に考慮して患者に助言する必要があります。
視覚的な症状
CLOMID治療中または治療直後に、ぼやけやその他の視覚症状が時折発生する可能性があることをアドバイスしてください.場合によっては、視覚障害が長引く可能性があり、特に治療の投与量や期間が長くなると、元に戻せない可能性があることを患者に明確にする必要があります。視覚症状により、車の運転や機械の操作などの活動が通常よりも危険になる可能性があることに注意してください。 警告 )。
異常な視覚症状が発生した場合はいつでも医師に知らせるように患者に指示する必要があります。患者に視覚症状がある場合は、治療を中止し、完全な眼科的評価を実施する必要があります。
腹部/骨盤の痛みまたは膨満
CLOMIDによる治療中または治療直後に卵巣肥大が起こることがあります。卵巣肥大に関連するリスクを最小限に抑えるために、CLOMID の服用後に腹部または骨盤の痛み、体重増加、不快感、または膨満感があれば医師に知らせるように患者に指示する必要があります。 警告 )。
多胎妊娠
CLOMID 療法に関連して受胎が起こった場合、両側卵管妊娠および共存する卵管妊娠と子宮内妊娠を含む、多胎妊娠の可能性が高まることを患者に知らせてください。多胎妊娠の潜在的な合併症と危険性について説明する必要があります。
自然流産と先天異常
入手可能なデータでは、母体の CLOMID 50mg の使用による自然流産(流産)または先天異常の発生率が、一般集団の発生率と比較して増加していないことが示唆されていることを患者に伝えてください。
臨床調査中、妊娠転帰がわかっている患者の経験 (表 1) では、20.4% の自然流産率と 1.0% の死産率が示されています。 (見る 臨床研究 )。クロミッドが市販されて以来、個々の症例として自然発生的に報告された出生異常の中で、クロミッドによって誘発された排卵に関連する妊娠で神経管欠損症の割合が高かったが、これは集団ベースの研究からのデータによって支持されていない.
