Zovirax 200mg, 400mg, 800mg Acyclovir 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Zovirax 800mg とは何ですか?
Zovirax は、ヘルペス (口唇ヘルペス) および性器ヘルペスの症状を治療するために使用される処方薬です。 Zovirax 800mg は、単独で使用することも、他の薬と併用することもできます。
Zovirax 400mg は、抗ウイルス薬、局所薬と呼ばれる薬のクラスに属しています。
Zovirax 200mg が 12 歳未満の子供に安全で有効であるかどうかはわかっていません。
Zovirax 800mg の副作用の可能性は何ですか?
Zovirax 200mg は、次のような重大な副作用を引き起こす可能性があります。
- あざや出血しやすい、
- 皮膚の下の紫または赤のピンポイントスポット、
- 排尿がほとんどまたはまったくない、
- 痛みや排尿困難、
- 足や足首のむくみ、
- 疲労感と
- 呼吸困難
上記の症状がある場合は、すぐに医療機関を受診してください。
Zovirax の最も一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- 下痢、
- 一般的な不快感、
- 頭痛と
- アシクロビル口腔錠使用中の口の痛み
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Zovirax の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
概要製品情報
原薬
正式名称: アシクロビル
化学名: 9-[(2-ヒドロキシエトキシ)メチル]グアニン
ほかの名前: アシクログアノシン
分子式: C8H11N503
分子量: 225.2 構造式:
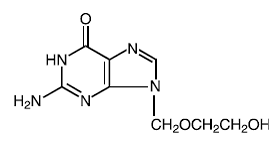
物理化学的特性: アシクロビルは白色の結晶性粉末で、水への最大溶解度は 25°C で 1.3 mg/mL です。
適応症
適応症と臨床使用
ZOVIRAX® (アシクロビル) は、次の条件に適応されます。
- 性器ヘルペスの初期エピソードの治療。
- 性器ヘルペスの異常に頻繁な再発(年間6回以上)の抑制。
- 帯状疱疹(帯状疱疹)と水痘(水ぼうそう)の急性期治療。
臨床研究の結果は、再発性性器ヘルペスの一部の患者が、差し迫ったエピソードの最初の兆候で服用された場合、経口ZOVIRAX®の投与から臨床的利益を得る可能性があることを示唆しています.恩恵を受ける可能性が最も高いのは、重度で長期にわたる再発を経験する患者です。このような間欠的治療は、これらの再発がまれな場合、抑制治療よりも適切である可能性があります。
経口ZOVIRAX®による免疫適格者の急性帯状疱疹(帯状疱疹)の早期治療により、ウイルス排出が減少しました。治癒までの時間の短縮;普及が少ない。そして急性の痛みの緩和。
経口ZOVIRAX®による免疫正常患者の水痘(水ぼうそう)の治療により、病変の総数が減少し、痂皮および治癒段階への病変の進行が加速され、残存する色素沈着病変の数が減少しました。さらに、ZOVIRAX® は、水痘に伴う発熱と全身症状を軽減しました。
水痘におけるアシクロビルの予防的使用は確立されていません。
老年医学(65歳以上): 高齢者集団での使用は、加齢に伴う腎機能の変化による安全性の違いに関連している可能性があり、適切なセクションで簡単な説明を見つけることができます ( 警告と注意事項 )。
小児科 ( データはありません。
投薬と管理
投与に関する考慮事項
- 腎機能障害のある患者では、ZOVIRAX®(アシクロビル)の投与量を減らす必要があります。
- 水痘または帯状疱疹の診断後、または性器ヘルペスの発生の最初の兆候または症状が現れたら、できるだけ早く治療を開始する必要があります。
- 推奨用量と使用期間は適応症によって異なります。
推奨用量と用量調整
性器ヘルペスの初期感染の治療: 200 mg (200 mg の錠剤 1 錠または小さじ 1 杯の懸濁液 [5 mL]) を 4 時間ごとに 1 日 5 回、1 日合計 1 g を 10 日間服用します。徴候や症状の出現後、できるだけ早く治療を開始する必要があります。
再発性性器ヘルペスの抑制療法
最初の推奨用量は 200 mg (200 mg の錠剤 1 錠または小さじ 1 杯の懸濁液 [5 mL]) を 1 日 3 回です。 200 mg の錠剤 1 個または小さじ 1 杯 [5 mL] の懸濁液を 1 日 5 回服用するまでにブレークスルーが発生した場合は、これを増やすことができます。必要に応じて、1 日 2 回 400 mg (200 mg の錠剤 2 錠または小さじ 2 杯の懸濁液 [10 mL]) の用量を考慮することもできます。治療の必要性を定期的に再評価することをお勧めします。
断続的な治療のためのゾビラックス®の投与は、200 mg (200 mg 錠剤 1 つまたは小さじ 1 杯 [5 mL] の懸濁液) を 4 時間ごとに 1 日 5 回、5 日間行います。治療は、再発の最も初期の兆候または症状 (前駆症状) で開始する必要があります。
帯状疱疹の治療
経口ゾビラックス® 800 mg、4 時間ごと、1 日 5 回、7 ~ 10 日間。治療は、病変の発症から 72 時間以内に開始する必要があります。臨床試験では、病変の発症から 48 時間以内に治療を開始した場合に最大の効果が得られました。
水痘の治療
20 mg/kg (800 mg を超えないこと) 経口、1 日 4 回、5 日間。発疹が現れてから 24 時間以内に治療を開始する必要があります。
急性または慢性腎障害のある患者
腎機能障害のある患者にアシクロビルを投与する場合は注意が必要です。十分な水分補給を維持する必要があります。
腎障害のある患者におけるアシクロビルの静脈内注入に続いて、包括的な薬物動態研究が完了しました。
これらの研究に基づいて、性器ヘルペスおよび帯状ヘルペスの適応症について、表 5 で用量調整が推奨されます。
血液透析
血液透析を必要とする患者の場合、血液透析中のアシクロビルの平均血漿半減期は約 5 時間です。これにより、6 時間の透析後に血漿濃度が 60% 低下します。したがって、各透析後に追加の用量が投与されるように、患者の投与スケジュールを調整する必要があります。
腹膜透析
投与間隔を調整した後は、追加投与は必要ないようです。
飲み忘れ
ゾビラックス®の服用を忘れた場合は、気がついたらすぐに服用し、適切な時間間隔で次の服用を続けるよう患者にアドバイスする必要があります。
供給方法
ストレージと安定性
ZOVIRAX® 錠は、制御された室温 (15 ~ 25°C) の乾燥した場所で、遮光して保管する必要があります。
ZOVIRAX® Suspension は、制御された室温 (15 ~ 25°C) で保管する必要があります。
剤形、組成および包装
サスペンション: 小さじ 1 杯 (5 mL) の ZOVIRAX® Suspension には、200 mg のアシクロビルと、バナナの風味、セルロース、グリセリン、メチルパラベン、プロピルパラベン、ソルビトール、バニリン、および水が含まれています。
各 ZOVIRAX® 200 タブレットには、200 mg のアシクロビルと、セルロース、インジゴチン、ラクトース、ステアリン酸マグネシウム、ポビドン、デンプン グリコール酸ナトリウムが含まれています。
ZOVIRAX® Suspension は、125 mL* と 475 mL のボトルでご利用いただけます。茶さじ一杯 (5 mL) のオフホワイトのバナナ風味の懸濁液には、200 mg のアシクロビルが含まれています。
*カナダでは 125 mL ボトルは販売されていません
ZOVIRAX® 200 タブレットは、100 錠入りのボトルで入手できます。青色の盾形で面取りされた圧縮錠剤には、それぞれ 200 mg のアシクロビルが含まれており、片面に「ZOVIRAX」、裏面に三角形が刻印されています。
GlaxoSmithKline Inc.、7333 Mississauga Road、Mississauga、Ontario、L5N 6L4 1-800-387-7374。改訂: 2014 年 11 月 10 日
副作用
薬物有害反応の概要
ZOVIRAX® (アシクロビル) の使用に関連する最も頻繁な副作用は、頭痛と吐き気です。
まれに神経系の副作用も報告されています。高齢患者や腎障害の既往歴のある患者は、これらの影響を発症するリスクが高くなります。報告された症例では、これらの反応は通常、治療を中止すると元に戻りました( 警告と注意事項 と 有害反応 、 市販後の薬物有害反応 )。
臨床試験の薬物有害反応
臨床試験は非常に特殊な条件下で実施されるため、臨床試験で観察された副作用率は、実際に観察された率を反映していない可能性があり、別の薬物の臨床試験での率と比較すべきではありません.臨床試験からの薬物有害反応情報は、薬物関連の有害事象を特定し、発生率を概算するのに役立ちます。
単純ヘルペスの治療
短期投与 (5-10 日): 298 人の患者における経口ゾビラックス®による性器ヘルペスの治療の臨床試験中に報告された最も頻繁な副作用を表 1 に示します。
単純ヘルペスの抑制
長期投与:400mg(200mgカプセル2個)を1日2回連続投与した再発防止臨床試験で報告された主な有害事象を表2に示します。
臨床試験からのこれまでの証拠は、有害事象の重症度と頻度が治療の中止を必要とする可能性が低いことを示唆しています.
帯状疱疹
ゾビラックス® 800 mg を 1 日 5 回、7 日間または 10 日間、またはプラセボで帯状疱疹(帯状疱疹)を治療した 3 つの臨床試験で報告された最も頻繁な副作用を表 3 に示します。
水疱瘡
経口ゾビラックス®またはプラセボによる水痘治療の 3 つの臨床試験で報告された最も頻繁な有害事象を表 4 に示します。
あまり一般的でない臨床試験の薬物有害反応 (
あらゆる臨床試験で ZOVIRAX® を投与された患者の 1% 未満で報告されたその他の副作用には、次のようなものがあります。のど、けいれん性の手の動き、蕁麻疹。
血液学的および臨床化学的異常所見
ZOVIRAX® による水痘および帯状疱疹の治療、ならびに性器ヘルペスの治療および抑制に関する臨床試験では、検査値に臨床的に有意な変化は観察されていません。
市販後の薬物有害反応
以下の事象は、ZOVIRAX®の市販後の臨床現場での使用中に自発的に報告されています。これらのイベントは、その深刻さ、報告の頻度、ZOVIRAX® との潜在的な因果関係、またはこれらの要因の組み合わせにより、含めるために選択されました。市販後の有害事象は、未知数の母集団から自発的に報告されるため、頻度を推定することはできません。
全般的: 発熱、頭痛、痛み、末梢浮腫。
緊張: めまい、感覚異常、動揺、錯乱、振戦、運動失調、構音障害、幻覚、精神病症状、痙攣、傾眠、脳症および昏睡が報告されています。これらの事象は一般に可逆的であり、通常、腎障害のある患者、または他の素因のある患者で報告されます( 警告と注意事項 )。これらの症状は、特に高齢者で顕著になることがあります。
消化器: 下痢、胃腸障害、吐き気。
血液およびリンパ: 貧血、白血球減少症、リンパ節腫脹および血小板減少症。
過敏症と皮膚: 脱毛症、多形紅斑、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、光線過敏症を含む発疹、かゆみ、蕁麻疹、呼吸困難、血管性浮腫およびアナフィラキシー。
肝胆道と膵臓: 可逆性高ビリルビン血症および肝臓関連酵素の上昇の報告。肝炎と黄疸。
筋骨格: 筋肉痛。
特別な感覚: 視覚異常。
泌尿生殖器: 血中クレアチニンと血中尿素窒素(BUN)の上昇。急性腎不全、腎痛、血尿が報告されています。腎痛は腎不全に関連している可能性があります( 警告と注意事項 )。
薬物相互作用
薬物間相互作用
臨床的に重要な相互作用は確認されていません。
アシクロビルは、活性な尿細管分泌を介して、主に変化せずに尿中に排出されます。このメカニズムと競合する薬剤を同時に投与すると、アシクロビルの血漿濃度が上昇する可能性があります。プロベネシドとシメチジンは、このメカニズムによってアシクロビルの曲線下面積 (AUC) を増加させ、アシクロビルの腎クリアランスを減少させます。同様に、アシクロビルおよびミコフェノール酸モフェチルの不活性代謝物(移植患者に使用される免疫抑制剤)の血漿 AUC の増加は、これらの薬物を併用投与した場合に示されています。しかし、アシクロビルの治療指数は広いため、用量調節は必要ありません。
薬と食物の相互作用
食物との既知の相互作用はありません(参照 作用と臨床薬理学 、 薬物動態 )。
薬物とハーブの相互作用
ハーブ製品との相互作用は確立されていません。
薬物検査の相互作用
実験室試験との相互作用は確立されていません。
警告
ZOVIRAX (アシクロビル) カプセル、錠剤、および懸濁液は、経口摂取のみを目的としています。場合によっては死に至る腎不全は、アシクロビル療法で観察されています( 有害反応:臨床診療および過剰摂取中に観察された )。死亡に至った血栓性血小板減少性紫斑病/溶血性尿毒症症候群 (TTP/HUS) は、アシクロビル療法を受けている免疫不全患者に発生しています。
予防
腎機能障害のある患者にゾビラックス(アシクロビル)を投与する場合は、用量調節が推奨されます( 投薬と管理 )。潜在的に腎毒性のある薬剤を投与されている患者に ZOVIRAX (アシクロビル) を投与する場合も注意が必要です。これは、腎機能障害のリスクおよび/または静脈内アシクロビルで治療された患者で報告されているような中枢神経系の可逆的症状のリスクを高める可能性があるためです。 .十分な水分補給を維持する必要があります。
帯状疱疹: 帯状疱疹の発症から 72 時間以上経過してから治療を開始したというデータはありません。帯状疱疹と診断されたら、できるだけ早く治療を開始するよう患者にアドバイスする必要があります。
性器ヘルペス感染症: ZOVIRAX (アシクロビル) は性器ヘルペスの治療法ではないことを患者に知らせる必要があります。 ZOVIRAX (アシクロビル) が他人への感染を防ぐかどうかを評価するデータはありません。性器ヘルペスは性感染症であるため、パートナーへの感染を避けるために、病変や症状がある場合は、患者は病変との接触や性交を避ける必要があります。性器ヘルペスは、無症候性のウイルス排出によって、症状がなくても感染する可能性があります。性器ヘルペス再発の医学的管理が必要な場合、エピソードの最初の徴候または症状で治療を開始するように患者にアドバイスする必要があります。
水疱瘡: それ以外は健康な子供の水痘は、通常、軽度から中等度の重症度の自然治癒する病気です。青年および成人は、より重症化する傾向があります。対照試験では、典型的な水痘の発疹から 24 時間以内に治療が開始されましたが、疾患経過の後半に開始された治療の効果に関する情報はありません。
発がん、突然変異誘発、生殖能力の障害
以下に示すデータには、800 mg を 1 日 5 回経口投与する (帯状疱疹の治療に適切な用量) または 200 mg を 1 日 5 回経口投与する (治療に適切な用量) ヒトで観察されたピーク定常状態血漿アシクロビル濃度への参照が含まれています。性器ヘルペス)。動物実験における血漿薬物濃度は、高用量および低用量スケジュールでのアシクロビルへのヒト曝露の倍数として表されます( 臨床薬理学:薬物動態 )。
アシクロビルは、強制経口投与により最大 450 mg/kg の 1 日 1 回の用量で、ラットおよびマウスの生涯バイオアッセイで試験されました。治療動物と対照動物の間で腫瘍の発生率に統計的に有意な差はなく、アシクロビルは腫瘍の潜伏期間を短縮しませんでした。最大血漿中濃度は、マウスのバイオアッセイではヒトのレベルの 3 ~ 6 倍、ラットのバイオアッセイではヒトのレベルの 1 ~ 2 倍でした。
アシクロビルは、16 の in vitro および in vivo 遺伝毒性アッセイでテストされました。アシクロビルは、5 つのアッセイで陽性でした。
アシクロビルは、マウス (450 mg/kg/日、経口) またはラット (25 mg/kg/日、皮下) で生殖能または生殖を損なわなかった。マウスの研究では、血漿レベルは人間のレベルの 9 ~ 18 倍でしたが、ラットの研究では、人間のレベルの 8 ~ 15 倍でした。高用量 (50 mg/kg/日、皮下) のラットおよびウサギ (それぞれ、ヒトレベルの 11 ~ 22 倍および 16 ~ 31 倍) では、着床効率は低下しましたが、同腹子数は低下しませんでした。 50 mg/kg/日、sc でのラットの出生前および出生後の研究では、群平均黄体数、総着床部位、および生きている胎児に統計的に有意な減少が見られました。
50 mg/kg/日を 1 か月間 IV 投与したイヌ (ヒトレベルの 21 ~ 41 倍) または 60 mg/kg/日を 1 年間経口投与したイヌ (ヒトレベルの 6 ~ 12 倍) では、精巣の異常は見られませんでした。高用量群のラットとイヌで、精巣の萎縮と無精子形成が観察された。
妊娠
催奇形効果: 妊娠カテゴリー B. 器官形成中に投与されたアシクロビルは、マウス (450 mg/kg/日、経口)、ウサギ (50 mg/kg/日、皮下および静脈内)、またはラット (50 mg/kg/日、 sc)。これらの暴露により、血漿レベルはそれぞれヒトレベルの 9 倍と 18 倍、16 倍と 106 倍、11 倍と 22 倍になりました。
妊娠中の女性を対象とした、十分に管理された研究はありません。妊娠中のアシクロビル使用の予測疫学登録は 1984 年に確立され、1999 年 4 月に完了しました。先天性欠損症の発生率は、一般集団に見られるものに近似しています。しかし、レジストリのサイズが小さいため、あまり一般的でない欠陥のリスクを評価したり、妊婦とその発育中の胎児におけるアシクロビルの安全性に関する信頼できる決定的な結論を得るには不十分です.潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中にアシクロビルを使用する必要があります。
授乳中の母親
アシクロビル濃度は、ZOVIRAX (アシクロビル) の経口投与後の 2 人の女性の母乳中に記録されており、対応する血漿レベルの 0.6 ~ 4.1 倍の範囲でした。これらの濃度は、授乳中の乳児を 0.3 mg/kg/日までの用量のアシクロビルにさらす可能性があります。ゾビラックス(アシクロビル)は、授乳中の母親には注意して、必要な場合にのみ投与する必要があります。
小児用
2 歳未満の小児患者におけるアシクロビルの経口製剤の安全性と有効性は確立されていません。
高齢者の使用
50歳以上の免疫正常者を対象とした帯状疱疹治療の臨床試験でゾビラックス(アシクロビル)を投与された376人の被験者のうち、244人が65歳以上、111人が75歳以上でした。新しい病変形成の停止までの時間または治癒までの時間の有効性について、高齢者対象と若年成人対象の間で全体的な差は報告されていません。治癒後の痛みの持続時間は、65 歳以上の患者で長かった。吐き気、嘔吐、およびめまいは、高齢者でより頻繁に報告されました。高齢患者は腎機能が低下している可能性が高く、用量を減らす必要があります。高齢患者はまた、腎臓または中枢神経系の有害事象が発生する可能性が高くなります。臨床現場で観察された中枢神経系の有害事象に関しては、傾眠、幻覚、錯乱、および昏睡が高齢患者でより頻繁に報告されました( 臨床薬理学、有害反応:臨床診療中に観察された、 と 投薬と管理 )。
過剰摂取
薬物の過剰摂取が疑われる場合の管理については、地域の毒物管理センターに連絡してください。
活性炭を投与して、吸収されなかった薬物の除去を助けることができます。一般的な支持手段が推奨されます。
アシクロビルは消化管で部分的にしか吸収されません。患者は一度に最大 20 g のアシクロビルを摂取しましたが、予想外の悪影響はありませんでした。臨床研究では、これらの用量で 1 人の患者で観察された最高血漿濃度は 10.0 μg/mL でした。アシクロビルの経口摂取を数日間にわたって偶発的に繰り返し行うと、胃腸への影響 (吐き気や嘔吐など) や神経への影響 (頭痛や錯乱) が引き起こされます。
ヒトに投与された静脈内投与量は、1,200 mg/m² (28 mg/kg) に達し、1 日 3 回、最大 2 週間続きました。ピーク血漿濃度は 80 μg/mL に達しました。静脈内アシクロビルの過剰投与は、血清クレアチニン、血中尿素窒素の上昇、およびその後の腎不全をもたらしました.錯乱、幻覚、動揺、発作、昏睡などの神経学的影響は、静脈内過剰摂取に関連して報告されています。
毒性の兆候がないか、患者を注意深く観察する必要があります。血液透析は、血液からのアシクロビルの除去を大幅に強化するため、症候性の過剰摂取が発生した場合の管理オプションと見なされる場合があります。尿細管内液の溶解度 (2.5 mg/mL) を超えると、尿細管にアシクロビルが沈殿することがあります。腎不全と無尿の場合、患者は腎機能が回復するまで血液透析の恩恵を受けることができます( 投薬と管理 )。
禁忌
ZOVIRAX® (アシクロビル) は、過敏症を発症した患者、またはアシクロビル、バラシクロビル、または ZOVIRAX® 製剤のその他の成分に対して過敏な患者には禁忌です。完全なリストについては、を参照してください。 剤形 、 組成と包装 製品モノグラフのセクション .
臨床薬理学
作用と臨床薬理学
作用機序
合成非環式プリン ヌクレオシド アナログである ZOVIRAX® (アシクロビル) は、単純ヘルペスおよび水痘帯状疱疹に特異的なチミジン キナーゼに対して高度の特異性を持つ基質です。アシクロビルは、宿主細胞特異的チミジンキナーゼの基質としては不十分です。単純ヘルペスおよび水痘帯状疱疹に特異的なチミジンキナーゼは、アシクロビルをその一リン酸に変換し、その後、多くの細胞酵素によってアシクロビル二リン酸およびアシクロビル三リン酸に変換される。アシクロビル三リン酸は、ヘルペスウイルス特異的 DNA ポリメラーゼの阻害剤であり、基質でもあります。感染細胞の細胞α-DNAポリメラーゼもアシクロビル三リン酸によって阻害される可能性がありますが、これは、ヘルペスウイルス特異的DNAポリメラーゼを阻害する濃度よりも高いアシクロビル三リン酸の濃度でのみ発生します.アシクロビルは、ヘルペスウイルス感染細胞内で選択的に活性型に変換されるため、これらの細胞に優先的に取り込まれます。アシクロビルは、感染していない正常な細胞に対して in vitro で毒性の可能性が非常に低いことを示しています。 2) less はアクティブな形に変換されます。 3) 細胞の α-DNA ポリメラーゼは、薬物の活性型の作用に対する感度が低い。チミジン キナーゼ特異性、DNA ポリメラーゼの阻害、および DNA 合成の早期終結の組み合わせにより、ヘルペス ウイルスの複製が阻害されます。潜在的な非複製ウイルスに対する効果は実証されていません。ウイルスの阻害は、ウイルス排出の期間を短縮し、広がりの程度と病状のレベルを制限し、それによって治癒を促進します。抑制の間、アシクロビルがウイルスの神経移動を妨げるという証拠はありません。再活性化後のウイルス複製の阻害により、再発性ヘルペスのエピソードを中止します。
薬物動態
経口投与後のアシクロビルの薬物動態は、110 人の成人患者を対象とした 6 つの臨床研究で評価されています。
吸収
単純ヘルペスまたは水痘帯状疱疹感染症の免疫不全患者 35 人を対象としたある研究では、ZOVIRAX® カプセルを 200 ~ 1,000 mg の用量で 4 時間ごとに 1 日 6 回、5 日間投与したところ、バイオアベイラビリティは 15 ~ 20% と推定されました。この研究では、投与の 2 日目までに定常状態の血漿レベルに達しました。最後の 200 mg 投与後の平均定常状態ピークおよびトラフ濃度は、それぞれ 0.49 μg/mL (0.47 ~ 0.54 μg/mL) および 0.31 μg/mL (0.18 ~ 0.41 μg/mL) であり、最後の 800 mg 投与後は2.8 μg/mL (2.3 ~ 3.1 μg/mL) および 1.8 μg/mL (1.3 ~ 2.5 μg/mL)。別の研究では、単純性性器ヘルペス感染を再発した免疫正常患者 20 人に、ZOVIRAX® カプセル 800 mg を 6 時間ごとに 1 日 4 回、5 日間投与したところ、定常状態の平均ピーク濃度とトラフ濃度は 1.4 μg/mL (0.66 ~ 1.8 μg/mL) および 0.55 μg/mL (0.14 ~ 1.1 μg/mL)。
23 人のボランティアが 1 日 6 回、200 mg カプセル 1 個、400 mg 錠剤 1 個、800 mg 錠剤 1 個として ZOVIRAX® を摂取した複数回投与クロスオーバー研究では、吸収は用量の増加とともに減少し、アシクロビルの推定バイオアベイラビリティは 20、15、および 10% でした。 、 それぞれ。バイオアベイラビリティの低下は、剤形ではなく用量の関数であると考えられています。アシクロビルは 200 ~ 800 mg の投与範囲にわたって用量に比例しないことが実証されました。この研究では、アシクロビルの定常状態のピーク濃度とトラフ濃度は、200、400、800 mg の投与計画で、それぞれ 0.83 と 0.46 μg/mL、1.21 と 0.63 μg/mL、1.61 と 0.83 μg/mL でした。
6人のボランティアによる別の研究では、アシクロビルの吸収に対する食物の影響は明らかではありませんでした.
23 人の正常なボランティアによる単回経口投与のバイオアベイラビリティ研究では、ZOVIRAX® カプセル 200 mg が水溶液中のアシクロビル 200 mg と生物学的に同等であることが示されました。 20 人のボランティアを対象とした別の研究では、ZOVIRAX® Suspension が ZOVIRAX® Capsules と生物学的に同等であることが示されました。 24 人のボランティアを対象とした別の単回投与バイオアベイラビリティ/生物学的同等性研究では、1 つのゾビラックス® 800 mg 錠剤が 4 つのゾビラックス® 200 mg カプセルと生物学的に同等であることが実証されました。
分布
血漿タンパク質結合は比較的低く (9 ~ 33%)、結合部位の置換を含む薬物相互作用は予想されません。
排除
経口投与後、志願者および腎機能が正常な患者におけるアシクロビルの平均血漿半減期は、2.5 時間から 3.3 時間の範囲でした。未変化体の平均腎排泄量は経口投与量の 14.4%(8.6~19.8%)を占める。唯一の尿中代謝物 (高速液体クロマトグラフィーで同定) は 9-[(カルボキシメトキシ)メチル]グアニンです。
特別な人口と条件
小児科
一般に、小児におけるアシクロビルの薬物動態は成人と同様です。生後 7 か月から 7 歳の小児における 300 および 600 mg/m² の経口投与後の平均半減期は 2.6 時間 (範囲 1.59 から 3.74 時間) でした。
2 歳未満の小児におけるアシクロビルの経口投与は、まだ十分に研究されていません。
老年医学
高齢者では、最終血漿半減期にはほとんど変化がありませんが、クレアチニンクリアランスの減少に関連して、年齢が上がるにつれて全身クリアランスが低下します.腎機能が低下している高齢患者では、減量が必要になる場合があります( 投薬と管理 )。
腎不全
アシクロビルの半減期と全身クリアランスは腎機能に依存します。
腎機能が低下している患者には用量調節が推奨されます( 投薬と管理 )。
臨床試験
最初の性器ヘルペス
二重盲検のプラセボ対照試験では、ZOVIRAX® の経口投与により、急性感染症の期間と病変の治癒期間が大幅に短縮されたことが実証されています。一部の患者グループでは、痛みの持続時間と新しい病変形成が減少しました。
再発性性器ヘルペス
ZOVIRAX® 400 mg を 1 日 2 回 3 年間投与された患者の研究では、1 年目、2 年目、3 年目でそれぞれ 45%、52%、63% の患者が再発していませんでした。患者の 3 か月の再発率の連続分析では、71 ~ 87% が各四半期で無再発であることが示されました。
帯状ヘルペス感染症
限局性皮膚帯状疱疹感染症の免疫正常患者を対象とした二重盲検プラセボ対照試験では、ZOVIRAX® (800 mg を 1 日 5 回、10 日間) により、病変の痂皮形成、治癒、および痛みの完全な停止までの時間が短縮され、ウイルス感染の期間が短縮されました。脱落と新しい病変形成の期間。
同様の二重盲検プラセボ対照試験では、ZOVIRAX® (800 mg を 1 日 5 回、7 日間) は、病変の痂皮化、治癒、および痛みの停止を完了するまでの時間を短縮し、新しい病変形成の期間を短縮しました。
治療は発疹の発症から 72 時間以内に開始され、最初の 48 時間以内に開始すると最も効果的でした。 50 歳以上の成人は、より大きな効果を示しました。
水疱瘡
歳から 18 歳までの水痘の小児患者 993 人を対象に、3 つのランダム化二重盲検プラセボ対照試験が実施されました。すべての患者は、発疹の発症後 24 時間以内に治療を受けました。 2 つの試験では、ZOVIRAX® が 20 mg/kg で 1 日 4 回 (1 日あたり最大 3,200 mg)、5 日間投与されました。 3 番目の試験では、10、15、または 20 mg/kg の用量を 1 日 4 回、5 ~ 7 日間投与しました。 ZOVIRAX® による治療により、治癒までの時間が 50% 短縮され、病変の最大数が減少し、小胞の数の中央値が減少し、28 日目の残存病変の数の中央値が減少し、発熱、食欲不振、嗜眠の患者の割合が減少しました。 ZOVIRAX(登録商標)による処置は、処置後1ヶ月または1年で、水痘帯状疱疹ウイルス特異的体液性または細胞性免疫応答に影響を及ぼさなかった。
詳細な薬理学
見る アクションと臨床薬理学。
ウイルス学
単純ヘルペス ウイルス (HSV) および水痘帯状疱疹ウイルス (VZV) のアシクロビルに対する in vitro 感受性と治療に対する臨床反応との間の定量的関係は、ヒトでは確立されておらず、ウイルス感受性試験は標準化されていません。細胞培養におけるウイルスの増殖を 50% 阻害するのに必要な薬剤の濃度 (ID50) として表される感度試験の結果は、使用される特定のアッセイ、使用される細胞の種類、および試験を実施する研究室によって大きく異なります。 HSV-1 分離株に対するアシクロビルの ID50 は、0.02 μg/mL (Vero 細胞でのプラーク減少) から 5.9-13.5 μg/mL (ミドリザル腎臓 [GMK] 細胞でのプラーク減少) の範囲である可能性があります。 HSV-2 に対する ID50 は 0.01 から 9.9 μg/mL の範囲です (Vero および GMK 細胞でのプラークの減少)。
プラーク減少アッセイよりも約 5 倍から 10 倍高い ID50 値を与える Vero 細胞での色素取り込み法を使用して、約 500 人の患者からの 1,417 の HSV 分離株 (553 の HSV-1 および 864 の HSV-2) を 5 年間にわたって検査しました。年期間。これらのアッセイにより、HSV-1 分離株の 90% が ≤ 0.9 μg/mL アシクロビルに感受性であり、全分離株の 50% が ≤ 0.2 μg/mL アシクロビルに感受性であることがわかりました。 HSV-2 分離株では、90% が ≤ 2.2 μg/mL に感受性であり、全分離株の 50% が ≤ 0.7 μg/mL に感受性でした。感度が著しく低下した分離株が44人の患者で見つかりました。患者も分離株もランダムに選択されたものではなく、したがって一般集団を代表していないことを強調する必要があります。感度の低い HSV 臨床分離株のほとんどは、ウイルスのチミジンキナーゼ (TK) が比較的不足しています。ウイルス TK またはウイルス DNA ポリメラーゼが変化した株も報告されています。
VZV に対する ID50 は、0.17 ~ 1.53 μg/mL (収量の減少、ヒト包皮線維芽細胞) から 1.85 ~ 3.98 μg/mL (病巣の減少、ヒト胚線維芽細胞 [HEF]) の範囲です。重複感染した Raji 細胞または P3HR-1 リンパ芽球様細胞では、1.5 μg/mL アシクロビルによって EBV ゲノムの再生が 50% 抑制されます。サイトメガロウイルス (CMV) はアシクロビルに対して比較的耐性があり、ID50 値は 2.3 ~ 17.6 μg/mL (プラークの減少、HEF 細胞) から 1.82 ~ 56.8 μg/mL (DNA ハイブリダイゼーション、HEF 細胞) の範囲です。ヒト ヘルペス ウイルスのゲノムの潜伏状態がアシクロビルに感受性があることは知られていません。
抵抗
細胞培養中のサブ阻害濃度 (0.1 μg/mL) のアシクロビルに HSV を長時間さらすと、さまざまなアシクロビル耐性株が出現しました。耐性菌株の出現は、アシクロビルに対する感受性が比較的低い天然ウイルスの「選択」によって生じると考えられています。このような株は、いくつかの臨床研究からの治療前の分離株で報告されています。
ウイルスのチミジンキナーゼ (アシクロビルの活性化に必要) が関与する 2 つの耐性メカニズムが報告されています。これらは、(a) 感染後にほとんどまたは全く酵素活性を誘導しないチミジンキナーゼ欠損変異体の選択、および (b) 天然のヌクレオシドであるチミジンをリン酸化できるが、リン酸化できない基質特異性が変化したチミジンキナーゼを有する変異体の選択です。アシクロビル。 in vitro で発生する感受性の低いウイルスの大部分は、チミジンキナーゼ欠損型であり、感染性と病原性が低下しており、動物で潜伏を誘発する可能性が低い.
しかし、長期アシクロビル療法を受けている免疫抑制骨髄移植レシピエントにおけるアシクロビル耐性 HSV 感染は、正常なチミジンキナーゼを持っていたが DNA ポリメラーゼが変化した臨床分離株によるものであることがわかった。単純ヘルペス ウイルス DNA ポリメラーゼが関与するこの 3 番目の耐性メカニズムは、アシクロビル三リン酸による不活性化に耐性のある、変化した酵素をコードする突然変異体の選択によるものです。
VZV は、HSV で見られるメカニズムと同様のメカニズムを介して、アシクロビルに対する耐性を示すようです。
しかし、限られた臨床研究では、アシクロビル療法による VZV の in vitro 感受性の有意な変化の証拠は明らかにされていませんが、このウイルスの耐性変異体は HSV と同様の方法で in vitro で分離できます。急性帯状疱疹に対して経口アシクロビルまたはプラセボを投与された患者からの少数の臨床分離株の分析は、耐性 VZV の in vivo 出現がまれに発生する可能性があることを示唆しています。後天性免疫不全症候群および重度のVZVを伴う高度に免疫不全の患者のアシクロビル治療の長期化は、耐性ウイルスの出現につながる可能性があります。
アシクロビル耐性変異体では、他の抗ウイルス剤に対する交差耐性が in vitro で発生します。ウイルスチミジンキナーゼが存在しないためにアシクロビルに耐性のある HSV 変異体は、ヘルペスウイルスチミジンキナーゼによってリン酸化される他の薬剤、例えばブロモビニルデオキシウリジン、ガンシクロビル、および 2'-フルオロなどの 2'-フルオロピリミジンヌクレオシドに対して交差耐性があります。 -5-ヨードアラビノシル-シトシン (FIAC)。
アシクロビル治療に対する臨床反応は通常、アシクロビルに対する感受性が低下した HSV が治療前、治療中、または治療後に回復した正常な免疫を持つ患者にとって良好でした。しかし、重度の免疫不全患者(特に骨髄移植患者)や慢性的な抑制レジメンを受けている患者などの特定の患者グループは、耐性単純ヘルペス株の出現と最も頻繁に関連していると特定されており、これは反応不良を伴う場合と伴わない場合があります。薬に。そのような患者を治療する際には、感受性の低いウイルスが出現する可能性を認識しなければならず、これらの患者からの臨床分離株の感受性モニタリングを奨励する必要があります。
要約すると、アシクロビルに対する HSV および VZV の in vitro 感受性と治療に対する臨床反応との間の定量的関係は、ヒトでは明確に確立されていません。インビトロでのウイルス感受性とアシクロビル療法に対する臨床反応との間のより正確な相関を可能にするために、ウイルス感受性試験の標準化された方法が必要である。
毒物学
急性毒性試験
成体マウスおよびラット 経口アシクロビルの急性毒性は、表 6 に示すように決定されました。
新生児、未熟、成体ラット
10 匹のオスと 10 匹のメスの Charles River CD (Sprague-Dawley) ラットのグループに、3、10、28、および 71 日の時点で、アシクロビルの溶液 (pH 11.0) を皮下注射により単回大量投与 (5 つの異なる用量レベル) を与えました。年齢の。それらを処置後14日間観察し、LitchfieldおよびWilcoxon法によってLD50値を計算した(以下の表7を参照)。この研究は、暴露時の年齢がアシクロビルの急性毒性に影響するかどうかを判断するために行われました。アシクロビルの急性毒性作用に対して、若いラットが年長のラットよりも敏感であるという証拠はありませんでした。
治療後の生存期間と治療を受けた年齢との間に明らかな関係はありませんでした。 3 日齢および 10 日齢で処置されたラットの臨床徴候には、赤および紫の皮膚水疱、青色の領域、かさぶた、傷跡、壊死および脱落した皮膚、開放創、体の振戦および脱毛症が含まれていました。活動の低下、流涙、まぶたの閉鎖、目、鼻および口の周りの赤褐色または茶色の物質、運動失調、衰弱、体の震え、腹部または生殖器領域の周囲の尿の染み、かさぶたまたは壊死した領域、および脱毛症が、20 時間で処理されたラットで観察されました。生後28日と71日。
亜慢性経口毒性試験
マウス
それぞれ雄 28 匹、雌 28 匹の Charles River CD-1 (ICR) マウスからなる 4 つのグループに、アシクロビルの懸濁液を 33 日間、胃管から経口投与しました。 1 日あたりの用量レベルは、0、50、150、および 450 mg/kg でした。血液学および臨床化学の測定は、投与の第 1 および第 4 週後、および投与後第 3 週の間に、1 グループあたり追加の雄 8 匹および雌 8 匹のマウス (同じ方法で投与) で行われました。
血漿薬物濃度は、投与日 1、15、および 30 に、グループごとに追加の雄 4 匹および雌 4 匹のマウスからプールされたサンプルで測定されました。
ラットとマウスでの予備実験に基づいて、450 mg/kg という高用量が選択され、げっ歯類に経口投与することで実際に達成可能な最高の薬物血漿レベルが得られました。平均薬物血漿濃度は、経口投与後 1 時間で約 3.4 (低用量) から 11.0 (高用量) μg/mL の血漿の範囲でした。
健康、成長率、血液学および臨床化学の測定値には、アシクロビルの投与に明確に起因する可能性のある変化は発生しませんでした.高用量群および対照群の雄 16 匹および雌 16 匹のラットの、投与期間終了時の肉眼的および組織病理学的検査では、特筆すべきことは何も明らかにされなかった。
慢性毒性試験
胃挿管によりアシクロビルを与えられたラットにおける生涯経口毒性試験
Charles River CD (Sprague-Dawley) ラットにアシクロビルの懸濁液を強制経口投与しました。 0、50、150、および 450 mg/kg の用量レベルのそれぞれで、雄 50 匹および雌 50 匹のラットが存在した。 30 週間および 52 週間の投与後、各群の雄 10 匹および雌 10 匹のラットを剖検した。残りのラットには、自然死亡率が試験開始時の試験群に存在する同性の動物の数の約 20% にグループサイズが減少するまで、毎日投与しました。残りのすべてのラットは、20% カットオフ ポイントに達したときに殺され、剖検されました。これは、オスのラットでは 110 週目、メスのラットでは 122 週目でした。対照ラットと高用量群の組織を光学顕微鏡で評価した。腫瘤、小結節または異常病変を有する低および中用量群のラットの組織も、光学顕微鏡で調べた。研究の最初の 52 週間で死亡したラットの固定組織も、光学顕微鏡で評価しました。
中毒症の徴候は観察されなかった。血漿サンプルは、7、90、209、369、771 (男性のみ) および 852 (女性のみ) の投与の 1.5 時間後に収集されました。上記の時点での高用量の雄 (450 mg/kg/日) で検出された平均血漿レベルは次のとおりでした: 1.54、1.63、1.39、1.60、および 1.70 μg/mL (6.84、7.26、6.17、7.10、および 7.56 μM) .対応する期間の高用量雌の対応する平均血漿レベルは、1.76、2.38、2.12、1.71、および 1.81 μg/mL (7.82、10.58、9.44、7.62、および 8.03 μM) でした。 1 年間の治療後のすべての用量レベルでの男性と女性の両方の血漿レベルは、以前のサンプリングで得られた血漿レベルとほぼ同等でした。血液学、臨床化学、眼底検査などの臨床検査値はすべて正常範囲内でした。薬物誘発性の肉眼的または顕微鏡的病変はなく、アシクロビルが生存に影響を与えたという証拠はありませんでした。
ラットにおける生涯経口発がん性試験
Charles River CD (Sprague-Dawley) ラット (100 匹のラット/性別/用量群) にアシクロビルを 50、150、および 450 mg/kg で強制経口投与した生涯経口発がん性試験では、中毒症の徴候はありませんでした。研究中のさまざまなサンプリング時間で投与後 1.5 時間に高用量の雄で得られた平均血漿レベルは次のとおりでした:それぞれ7、90、209、369、771。高用量の雌の対応する平均値は、7、90、209、369、および 852 日で、それぞれ 1.76、2.38、2.12、1.71、および 1.81 μg/mL (7.82、10.58、9.44、7.62、および 8.03 μM) でした。
血液学、臨床化学、尿検査、体重、摂餌量、眼底検査などの臨床検査値はすべて正常範囲内でした。薬物誘発性の肉眼的または顕微鏡的病変はなく、アシクロビルが生存、腫瘍発生率の時間的パターン、または良性または悪性新生物の腫瘍数に影響を与えたという証拠はありませんでした。
この研究の最初の 52 週間に死亡または瀕死状態で発見された比較的少数のラットのほとんどは、胸水、肺炎、または縦隔炎を引き起こす食道穿孔の死後所見によって証明されるように、投与事故に見舞われました。
マウスにおける生涯経口発がん性試験
生涯経口発がん性試験で、50、150、450 mg/kg/日のアシクロビルを強制経口投与された Charles River CD-1 (ICR) マウス (115 匹のマウス/性別/用量群) に中毒症の兆候はありませんでした。研究中のさまざまなサンプリング時間での投与の 1.5 時間後に高用量の雄で得られた平均血漿レベルは次のとおりでした。高用量の雌の対応する平均値は、9.81、5.85、および 4.0 μg/mL (43.60、26.0、および 17.79 μM) でした。
血液学、体重、摂餌量などの臨床検査値はすべて正常範囲内でした。薬物誘発性の肉眼的または顕微鏡的病変はありませんでした。 150 および 450 mg/kg のアシクロビルを投与された雌マウスは、対照の雌マウスよりも有意に長く生存しました。治療を受けた雄の生存率は、対照の雄の生存率と同等でした。良性または悪性新生物の腫瘍発生率および腫瘍数のパターンは、アシクロビルによる治療の影響を受けませんでした。
イヌにおける慢性12ヶ月経口毒性試験
純血種のビーグル犬に、1 年間の研究の最初の 2 週間、毎日 0、15、45、または 150 mg/kg/日のアシクロビルを投与しました。各試験群には雄 9 匹、雌 9 匹の犬がいた。イヌには、適切な用量を含むゼラチンカプセルが与えられました。それらはtidで処置されたので、3つの等間隔の投与期間のそれぞれで投与された投与量は、0、5、15および50mg/kgであった。 45 および 150 mg/kg の用量レベルでは、研究の最初の 2 週間で、オスとメスの両方のイヌで下痢、嘔吐、食物消費量の減少、および体重減少が誘発されました。このため、研究の第 3 週の間に、中用量および高用量レベルを 30 および 60 mg/kg/日 (10 および 20 mg/kg tid) に減らす決定が下されました。 15 mg/kg/日 (5 mg/kg tid) の低用量は変更されませんでした。 60 mg/kg/日を与えられたイヌは時々嘔吐し、時々下痢をしましたが、試験期間中は順調で、体重増加と摂餌量の値は対照値と同等でした.
高用量のアシクロビルによって引き起こされた中毒症の間、薬物の血漿レベルは非常に高かった可能性があります(高用量の男性の初期平均値24.0μg/ mL(106.6μM)および17.4μg/ mL(77.2μM)で示されるように)。高用量の雌については、試験 1 日目の 3 回目の投与の 1 時間後に測定した場合)。 15 日目に測定した場合、高用量の犬 (150 mg/kg/日) のアシクロビルの血漿レベルは依然として非常に高かったが、投与量を減らすとその後減少した.治療の 12 ヶ月後の血漿レベルの値は、治療の 1、3、および 6 ヶ月後に記録された値とほぼ同等でした。このように、慢性治療の結果としてアシクロビルの代謝が促進されたという兆候はありませんでした。
第 13 週の間に、中用量と高用量の両方の雄と雌の犬に、前足の圧痛、足蹠のびらん、爪の破損と緩みという徴候が見られました。失った爪の再生は数週間後に始まりました。爪は 6 か月までに再生し (各群から 3 匹のオスと 3 匹のメスが中間犠牲のために殺されました)、研究の終わりまでには、一般的に良好な品質でした。低用量群(15mg/kg/日)の犬の足や爪への影響の兆候はまったくありませんでした.
爪のケラチンを生成する真皮上皮が損傷すると、ケラチンの生成が停止し、異常なケラチンが生成されることが認められています。研究の最初の 2 週間に与えられた大量のアシクロビル (45 および 150 mg/kg/日) によって引き起こされた一過性の中毒症は、コアリア上皮に影響を与えた可能性があります。珊瑚上皮に一時的な影響があった場合 (研究の最初の 2 週間での直接的な影響または薬物誘発性疾患に続発した可能性があります)、その後の爪の喪失は後遺症である可能性があります。他のケラチン産生組織またはケラチン含有組織に対する識別可能な影響は観察されませんでした。爪の変化は、研究の最初の 2 週間に試験された 50 および 150 mg/kg/日の用量レベルによって誘発された一過性の中毒症に関連しているように見えたことを強調する必要があります。その後テストされた/日の用量レベル。
この研究中に適切な間隔で行われた血清生化学検査、尿検査、および心電図検査の値に重要な薬物誘発性の変化はありませんでした。血清アルブミンと総タンパク質の値は、30 および 60 mg/kg/日を 6 か月および 12 か月間投与した犬でわずかに減少しました。ただし、これらのパラメーターのすべての値は、通常として受け入れられる制限内にとどまりました。
爪の先端にある古いケラチンの残留変化を除いて、光学顕微鏡で調べた組織のいずれにも、治療に関連した影響の兆候はありませんでした.また、剖検時に重さを量った臓器の値に有意な変化はありませんでした。したがって、60 mg/kg/日までの用量レベルは、1 年間十分に許容されました。アシクロビルの「用量効果なし」用量レベルは 15 mg/kg/日 (5 mg/kg tid) でした。しかし、30 または 60 mg/kg/日での唯一の有害作用は、爪と足蹠の変化 (30 および 60 mg/kg/日) と軽度の胃腸症状 (60 mg/kg/日) でした。
生殖研究
奇形学 – ラット
アシクロビルは、器官形成の期間中 (妊娠 6 日目から 15 日目まで) に、1 日 2 回、0.0、6.0、12.5、および 25.0 mg/kg 体重の用量レベルで、妊娠した ARS Sprague-Dawley 雌ラットに皮下注射によって投与されました。
複合効果の評価基準には、母体の体重、体重増加、外見と行動、生存率、目の変化、妊娠率、生殖データが含まれます。子孫の生存率と発達も評価されました。
上記の測定に加えて、薬物濃度の測定のために母体の血液、羊水および胎児のサンプルを収集するために、指定された動物を 15 日目の最初の投与の 1 時間後に屠殺しました。これらのサンプルの平均値を表 8 に示します。
血漿について得られた値は、げっ歯類における血漿半減期から判断すると、初期血漿レベルの約 30% に相当します。
母体の体重値、外見と行動、生存率、妊娠率、または着床効率の比較において、アシクロビルの投与に起因する影響は認められませんでした。さらに、胎児の大きさ、性別、発育の評価において、化合物に関連した差異は見られませんでした。
吸収の発生率と胎児の生存率は、すべての群で正常な変動の範囲内でしたが、妊娠 15 日目と 19 日目にと殺した高用量の動物では、わずかに高い吸収率の発生率が認められました。しかし、明確な用量関連の傾向は最終的には生じませんでした。
したがって、アシクロビルは、器官形成期に 1 日 50.0 mg/kg 体重までのレベルでラットに投与された場合、催奇形性または胚毒性とは見なされませんでした。
奇形学 – ウサギ
奇形学研究は、投与が妊娠 6 日目から 18 日目までであったことを除いて、ラットと本質的に同じ実験計画を使用して、ニュージーランド白ウサギで行われました。また、胎児、羊水、および母体血のサンプルの採取は、15 日目ではなく 18 日目に行われました。
どの用量でも母体毒性の徴候は観察されなかったが、高用量群では統計的に有意な (p
アシクロビルの濃度は、血漿および羊水サンプル、ならびに胎児組織のホモジネートで検出されました。すべてのサンプルは、妊娠 18 日目の初回投与の 1 時間後に採取されました。羊水中の薬物濃度は、血漿よりもかなり高かった (表 9 を参照)。
生殖 – 繁殖力
アシクロビルは、2 世代の受精能試験で、雄 15 匹と雌 30 匹のマウスのグループで受精能または生殖を損なわないことが示されました。この研究のマウスには、50、150、および 450 mg/kg/日の用量レベルで胃挿管によってアシクロビルが投与されました。雄は交配前 64 日間、雌は交配前 21 日間投与された。
20 匹のオスと 20 匹のメスのラットのグループが皮下注射によって 0、12.5、25.0、50.0 mg/kg/日を与えられたラットの受精能研究では、アシクロビルは交尾や受精能に影響を与えないことが示されました。オスは、交配前の 60 日間、および交配スケジュールが完了するまで投与されました。雌ラットには、交配前の 14 日間から妊娠 7 日まで投与した。 50 mg/kg/日の皮下投与では、移植後の損失が統計的に有意に増加しましたが、同腹子数の減少は付随しませんでした。
妊娠 6 ~ 18 日に 50 mg/kg/日のアシクロビルを皮下投与した 25 匹の雌ウサギでは、統計的に有意な着床効率の低下が見られましたが、同腹仔数の減少は見られませんでした。また、すべての薬物治療群で過剰肋骨をもつ胎児の数が用量依存的に増加しました。同腹あたりの過剰肋骨の発生率を調べたところ、この増加は用量に関連していなかった。
妊娠 6 ~ 18 日に 50 mg/kg/日のアシクロビルを静脈内投与した 15 匹の雌ウサギでは、着床効率または産仔数に影響はありませんでした。
ラットの周産期および生後試験(1群20匹の雌ラット)で、アシクロビルを妊娠17日から産後21日まで0、12.5、25、および50mg/kg/日で皮下投与した。 50 mg/kg/日の皮下投与で、F1 世代の黄体数、総着床部位および生きている胎児のグループ平均数が統計的に有意に減少しました。統計的に有意ではありませんが、12.5 mg/kg/日および 25 mg/kg/日の皮下投与で、生存胎児数および着床部位の群平均数も用量依存的に減少しました。
雌ウサギ 5 匹を用いた用量範囲設定試験において、妊娠 6 日から 8 日までの 100 mg/kg/日の用量でのアシクロビルの静脈内投与は、閉塞性腎症を引き起こすことが知られている用量であり、胎児吸収の有意な増加を引き起こし、同腹子のサイズの対応する減少。ウサギの 50 mg/kg/日の最大耐量の静脈内投与では、薬物に関連した生殖への影響はありませんでした。
雄 20 匹と雌 20 匹のラットのグループに 0、20、80、または 320 mg/kg/日のアシクロビルを 1 か月間腹腔内投与し、投与後 1 か月間追跡した亜慢性毒性試験では、精巣に萎縮。精子産生の回復のいくつかの組織学的証拠は投与後 30 日で明らかであったが、これは完全な可逆性を示すには不十分な時間であった.
雄 25 匹と雌 25 匹のラットのグループに、アシクロビルを 0、5、20、または 80 mg/kg/日で 6 か月間腹腔内投与しました。各群の雄 10 匹、雌 10 匹のラットに 13 週間投与を行わなかった。精巣萎縮は、80 mg/kg/日を 6 か月間投与した高用量ラットに限定されていました。臓器重量データと光学顕微鏡検査により、投与後の回復期間の終わりまでに精巣萎縮の完全な可逆性が定義されました。
アシクロビルを 50、100、および 200 mg/kg/日のレベルで静脈内投与した 31 日間のイヌの研究 (1 群あたり 16 匹のオスと 16 匹のメス) では、50 mg/kg のイヌの睾丸は正常でした。 100 または 200 mg/kg/日の用量では、細胞増殖抑制効果 (骨髄および胃腸上皮) および無精巣または散在した無精管を伴う精巣により、一部の犬が死亡した。睾丸の変化が一次的なものであった可能性を排除することはできませんが、同様の変化が瀕死の犬の重度のストレスに二次的に観察される可能性があります.
発生毒性試験
新生児ラット - 亜慢性研究
0.4% 滅菌生理食塩水に溶解したアシクロビルを、分娩後 3 日目から 19 日間連続して Charles River CD (Sprague-Dawley) 新生児ラットに皮下注射で投与しました。テストされた用量レベルは、0、5、20、および 80 mg/kg 体重でした。各用量レベルで 12 匹の同腹子 (それぞれ、自然母動物を授乳している 5 匹のオスと 5 匹のメスの新生児で構成されています) がありました。ダムは処理されませんでした。新生児は、5、12、または 19 日間治療し、投薬後 3 週間の薬物を使用しない期間の後、眼および脳の複数のセクションを含むさまざまな組織の剖検および顕微鏡評価のために各グループから取り除かれました (その時点で彼らは45日齢でした)。血液学的検査(ヘモグロビン、充血細胞量、RBC、WBC および分画細胞数)および臨床化学検査(BUN)は、治療の 16 日後に行われ、最後の(19 回目の)投与から 18 日後に繰り返されました。
血漿中のアシクロビルの濃度を測定するために、1日目、9日目、および投与期間の終わりに、治療の30分後に何人かの新生児から血液を採取した。血漿中のアシクロビルの最大濃度は 99.1 μg/mL (440.5 μM) で、最初の投与から 30 分後に 6 人の女性の高用量 (80 mg/kg) の新生児から採取されたプールされた血漿で検出されました。アシクロビルによる治療は、新生児期の死亡率を増加させませんでした。
低用量グループのラットは、それぞれの対照ラットと同じくらい体重が増えました。平均体重値の有意な (p
目の検査と光学顕微鏡検査では、眼の発達への悪影響は明らかになりませんでした。発達中の脳または中枢神経系の他の部分に対する悪影響の形態学的または機能的証拠がなかったことを強調する必要があります。したがって、アシクロビルは、新生仔ラットにおいて顕著な小脳および網膜異形成を生じることが報告されたシトシンアラビノシドとは明らかに異なる。
変異原性およびその他の短期試験
アシクロビルは、多くの in vitro および in vivo 系で変異原性の可能性について試験されています: 2014 年 11 月 10 日 ページ 27/38
微生物
アシクロビルは、エイムズ サルモネラ プレート アッセイで変異原性についてテストされました。 Ames アッセイのプレインキュベーションの変更。 Rosenkrantz E. coli polA+/polA- DNA 修復アッセイ。および真核生物 S. cerevisiae では、D-4。すべての研究は、外因性の哺乳類の代謝活性化の存在下と非存在下の両方で行われました。アシクロビルは、これらのシステムのいずれにおいても肯定的な反応を示しませんでした。
以前のサルモネラ研究は、毒性を達成するために非常に高い濃度まで拡張されました。 300 mg/プレートまたは 80 mg/mL までのアシクロビル濃度では、外因性の哺乳動物の代謝活性化の有無にかかわらず、正の影響は観察されませんでした。
哺乳類のシステム
アシクロビルは、チミジンキナーゼ (TK) 遺伝子座でヘテロ接合性の培養 L5178Y マウスリンパ腫細胞における変異原活性について、TK 欠乏 (TK+/- → TK-/-) への前方突然変異率を測定することによってテストされました。追加の研究は HGPRT で実施されました。遺伝子座およびこれらの同じ細胞のウアバイン耐性マーカー. すべての研究は、外因性哺乳動物代謝活性化の存在下および非存在下で行われた. 試験化合物は、高濃度 (400 -2,400 μg/mL) で TK 遺伝子座で変異原性を示した. (比較すると、200 mg q4h の経口投与後のアシクロビル ピーク血漿レベルの上限は 0.9 μg/mL です。HGPRT 遺伝子座およびウアバイン耐性マーカーで陰性でした。代謝活性化の有無にかかわらず、同一の結果が得られました。
チャイニーズハムスター卵巣 (CHO) 細胞の 3 つの遺伝子座 (APRT、HGPRT、およびウアバイン耐性) のそれぞれで、外因性代謝活性化の存在下と非存在下の両方で、アシクロビル変異原性を調べたところ、明らかな用量依存性反応のない決定的な結果が得られた。
アシクロビルは、50 μg/mL (222 μM) の濃度で 72 時間暴露すると、in vitro で BALB/C-3T3 細胞を処理した結果、形態学的に変化した病巣の発生率が統計的に有意に増加することが示されています。外因性代謝活性化の欠如。形態学的に変換された病巣は、免疫抑制された同系の離乳マウスへの移植後に腫瘍として成長することが示されています。腫瘍組織は、未分化肉腫またはリンパ肉腫のいずれかであると診断されました。
~ 64 μg/mL の濃度で 18 時間暴露したアシクロビルは、外因性代謝活性化の非存在下で in vitro で処理した C3H/10T 1/2 細胞に形態学的に変化した病巣を誘発しませんでした。
62.5 および 125 μg/mL の濃度で 48 時間暴露したアシクロビルは、外因性代謝活性化が存在しない場合、培養ヒトリンパ球に染色体異常を誘発しませんでした。高濃度の 250 および 500 μg/mL で 48 時間暴露すると、アシクロビルは染色体切断の発生率を有意に増加させました。また、アシクロビルへの曝露により、有糸分裂指数の用量に関連した有意な減少がありました。
アシクロビルは、25 および 50 mg/kg/日 ip の用量で 5 日間連続して、オスの BKA (CPLP) マウスに優性致死効果をもたらさなかった。さらに、2 世代生殖/受胎能試験で要約されているように、50、150、および 450 mg/kg/日の用量レベルで経口投与されたチャールズリバー CD-1 (ICR) 雄および雌マウスに対する優性致死効果の証拠はありませんでした。 .
アシクロビルは、25、50、および 100 mg/kg の単回腹腔内投与で、投与の 24 時間後に調べたところ、チャイニーズハムスターの骨髄細胞に染色体異常を誘発しませんでした。より高い腎毒性用量 (500 および 1,000 mg/kg) では、芽球形成効果が見られました。 (500 mg/kg の腹腔内投与により、チャイニーズハムスターの平均ピーク血漿レベルは 611 μg/mL (2.72 mM) になり、これは、200 mg q4h の経口投与中のヒトのピーク血漿レベルの上限の 680 倍です)。
アシクロビルは、25、50、および 100 mg/kg の単回静脈内投与で、処理後 6、24、および 48 時間で検査した場合、雄および雌ラットの骨髄細胞に染色体異常を誘発しませんでした。
したがって、これらすべての研究は、アシクロビルが単一遺伝子突然変異を引き起こさないが、染色体を破壊することができることを示しました.
免疫毒性研究
アシクロビルは、多くの in vitro および in vivo 免疫学的試験にかけられました。
2 つの in vivo 試験、リンパ球媒介性細胞毒性および好中球走化性で、アシクロビルは 135 μg/mL (600 μM) の高濃度で阻害効果を示さなかった。この化合物は、0.9 μg/mL (4 μM) でロゼット形成を約 50% 阻害しました。
細胞性免疫(補体依存性細胞毒性、補体非依存性細胞毒性、遅発性過敏症および移植片対宿主反応)を測定したマウスの4つのin vivo試験で、アシクロビルは200mg/kgまでの単回投与で阻害効果を示さなかった抗原刺激後2日目。
100 mg/kg/日の 1 日 4 回の投与では、抗原刺激後 7 日目に、ジャーン溶血素プラークまたは循環抗体に有意な影響はありませんでした。抗原投与の 4 日後、および最後の薬物投与の 1 日後に、ジャーン溶血素プラークおよび抗体力価を調べたところ、100 mg/kg はわずかな抑制効果しか示しませんでした。しかし、200 mg/kg では体重がいくらか減少し (-2.2 g)、ジェルン溶血素斑の数が中程度に減少しました (PFC/脾臓は対照の 33% に減少し、PFC/107 WBC は対照の 46.5% に減少しました)。しかし、200 mg/kg では、循環ヘマグルチニン力価 (8.3 から 6.5 へ) および循環溶血素力価 (9.5 から 8.3 へ) がわずかに減少しただけでした。
アシクロビルが抗体形成に対するアザチオプリンの免疫抑制効果を増強するかどうかをテストするために設計されたマウスでの実験では、2 つの薬剤の効果は相加的なものにすぎないことがわかりました。アシクロビルの 200 mg/kg 用量のみが、25 mg/kg を超える用量でアザチオプリンと組み合わせて投与された場合、抗体応答の抑制の増加を示しました。
インビトロでのヒトリンパ球機能に対するアシクロビルの影響を評価するために研究が行われた。胚形成に対する阻害効果は、強力なマイトジェンであるフィトヘマグルチニン (PHA) およびコンカナバリン A (Con A) のピーク濃度を調べるアッセイでのみ見られ、50 μg/mL (222 μM) を超える薬物濃度でのみ見られ、モニリアおよびモニリアでははるかに少なかった。破傷風トキソイド抗原では、芽球形成反応は特徴的にそれほど活発ではありません。直接的な細胞毒性効果がすでに実証されている 200 μg/mL (890 μM) の濃度を除いて、細胞毒性または LIF 産生に対する効果はほとんどありませんでした。これらの阻害濃度は、臨床応用のために選択された用量から予想されるレベルをはるかに超えており、in vitro でヘルペス ウイルスの増殖を阻害するために必要な濃度よりも 1,000 倍以上高くなっています。
ヒト細胞に対するアシクロビルの効果を測定した。 11.2 ~ 22.5 μg/mL (50 ~ 100 μM) の濃度は、実験計画と単層の合流性に応じて、線維芽細胞の分裂をさまざまな程度に抑制します。この効果の大きさは、これら 3 つの抗ウイルス剤を臨床的に適切な濃度で比較した場合、アデニン アラビノシドまたはヒト白血球インターフェロンによって引き起こされる効果よりも小さかった。アシクロビルは、PHA または 3 つの異なるヘルペス ウイルス抗原によって刺激された末梢血単核細胞によるチミジンの取り込みも阻害しました。これらの細胞では線形の用量反応曲線が観察され、それらの増殖は 22.5 μg/mL (100 μM) アシクロビルによって 50% 阻害されました。阻害は、リンホカインの放出または単球機能に明らかな影響を与えることなく、T 細胞増殖に及ぼされました。
また、この要約で前述した詳細な亜慢性および慢性動物試験では、免疫系への悪影響の証拠はなかったということも言及する必要があります。発生した。
参考文献
1. Balfour HH, Jr.、Kelly JM、Suarez CS、Heussner RC、Englund JA、Crane DD 他それ以外は健康な子供の水痘のアシクロビル治療。 J Pediatr 1990; 116(4):633-639。
2. Balfour HH, Jr.、Rotbart HA、Feldman S、Dunkle LM、Feder HM, Jr.、Prober CG 他。それ以外は健康な青年における水痘のアシクロビル治療。共同アシクロビル水痘研究グループ。 J Pediatr 1992; 120(4 Pt 1):627-633.
3. バリー DW、ブラム MR.抗ウイルス薬:臨床薬理学の最近の進歩におけるアシクロビル。ターナー P、シャンド DG (eds) チャーチル リビングストン、エジンバラ 1983 年。
4. Barry DW, Nusinoff-Lehrman S. 臨床診療におけるウイルス耐性: アシクロビルの 5 年間の経験の要約。ヘルペスウイルスおよびウイルス化学療法への薬理学的および臨床的アプローチ、Aiso、日本、1984 年 9 月 10 ~ 13 日。
5. Barry DW、Nusinoff-Lehrman S、Ellis MN、Biron KK、Furman PA。ウイルス耐性、臨床経験。 Scand J Infect Dis Suppl 1985; 47:155-164。
6. Barry DW, Nusinoff-Lehrman S. 臨床診療におけるウイルス耐性: アシクロビルの 5 年間の経験の要約。ヘルペスウイルスおよびウイルス化学療法への薬理学的および臨床的アプローチに関する国際シンポジウムの議事録、Elsever、アムステルダム 1985;269-270。
7. Biron KK、Elion GB。インビトロでの水痘帯状疱疹ウイルスに対する他の抗ヘルペス薬と組み合わせたアシクロビルの効果。アム J メッド 1982; 73(1A):54-57.
8. Boelaert J、Schurgers M、Daneels R、Van Landuyt HW、Weatherley BC。連続外来腹膜透析患者における静脈内アシクロビルの複数回投与薬物動態。 J Antimicrob Chemother 1987; 20(1):69-76。
9. ブライソン YJ、ディロン M、ロベット M、アクーナ G、テイラー S、チェリー JD 他経口アシクロビルによる性器単純ヘルペスウイルス感染の最初のエピソードの治療。健常者を対象としたランダム化二重盲検比較試験。 N Engl J Med 1983; 308(16):916-921。
10. Burns WH、Saral R、Santos GW、Laskin OL、Lietman PS、McLaren C 他。アシクロビル治療後の耐性単純ヘルペスウイルスの分離と特徴付け。ランセット 1982; 1(8269):421-423。
11.クリストファーズJ、サットンRN。免疫不全患者からのアシクロビル耐性および感受性の臨床単純ヘルペスウイルス分離株の特徴付け。 J Antimicrob Chemother 1987; 20(3):389-398。
12. Cole NL, Balfour HH, Jr. 水痘・帯状疱疹ウイルスは、治療中にアシクロビルに対してより耐性になることはありません。 J Infect Dis 1986; 153(3):605-608。
13.コリンズP、バウアーDJ。新しい抗ウイルス剤である9-(2-ヒドロキシエトキシメチル)グアニン(アシクログアノシン)のヘルペスウイルスに対するin vitro活性。 J Antimicrob Chemother 1979; 5(4):431-436。
14. コリンズ P、オリバー NM。アシクロビルを投与されている患者からの単純ヘルペスウイルス分離株の感度モニタリング。 J Antimicrob Chemother 1986; 18 Suppl B:103-112。
15. コリンズ P. アシクロビル導入後のウイルス感受性。アム J メッド 1988; 85(2A):129-134.
16. Collins P、Larder BA、Oliver NM、Kemp S、Smith IW、Darby G. アシクロビルを受けている重度の免疫不全患者からの単純ヘルペスウイルスの DNA ポリメラーゼ変異体の特徴付け。 J Gen Virol 1989; 70 (Pt 2):375-382.
17. Crumpacker CS、Schnipper LE、Zaia JA、Levin MJ。ヒト感染から分離されたヘルペスウイルスのアシクログアノシンによる増殖阻害。 Antimicrob Agents Chemother 1979; 15(5):642-645。
18. クランパッカー CS、シュニッパー LE、マーロウ SI、コワルスキー PN、ハーシー BJ、レビン MJ。アシクロビルで治療された患者から分離された単純ヘルペスウイルスの抗ウイルス薬に対する耐性。 N Engl J Med 1982; 306(6):343-346。
19. ダービー G、イングリス MM、ラーダー BA。単純ヘルペスウイルスのヌクレオシドアナログ阻害剤に対する耐性のメカニズム。 6th Int Congr Virol 1984;(アブストラクト #W34-5).
20. De Clercq E、Descamps J、Verhelst G、Walker RT、Jones AS、Torrence PF 他。単純ヘルペスウイルスの異なる株に対する抗ヘルペス薬の効果の比較。 J Infect Dis 1980; 141(5):563-574。
21. De Clercq E. 異なる細胞株における抗ヘルペス薬の効果の比較。 Antimicrob Agents Chemother 1982; 21(4):661-663。
22. デッカー C、エリス MN、マクラーレン C、ハンター G、ロジャース J、バリー DW。臨床現場におけるウイルス耐性。 J Antimicrob Chemother 1983; 12 Suppl B:137-152。
23. Douglas JM、Davis LG、Remington ML、Paulsen CA、Perrin EB、Goodman P 他。性器ヘルペスを頻繁に再発する男性の精子生産に対する長期投与された経口アシクロビルの効果に対する二重盲検プラセボ対照試験。 J Infect Dis 1988年3月; 157:588-93。
24. Douglas JM、Critchlow C、Benedetti J、Mertz GJ、Connor JD、Hintz MA 他。性器単純ヘルペスウイルス感染の再発抑制のための経口アシクロビルの二重盲検試験。 N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM、Arvin AM、Whitley RJ、Rotbart HA、Feder HM, Jr.、Feldman S ら。健常児の水痘に対するアシクロビルの対照試験。 N Engl J Med 1991; 325(22):1539-1544。
26. Ellis MN、Keller PM、Martin JL、Strauss SE、Nusinoff-Lehrman S ら。基質特異性が変化したチミジンキナーゼを産生する ACV 耐性変異体を含む HSV-2 臨床分離株の特徴付け。第 9 回国際ヘルペス ウイルス ワークショップ、ワシントン州シアトル、1984 年 8 月 24 ~ 29 日。
27. Ellis MN、Keller PM、Fyfe JA、Martin JL、Rooney JF、Straus SE 他。基質特異性が変化したチミジンキナーゼを誘導する単純ヘルペスウイルス 2 型の臨床分離株。 Antimicrob Agents Chemother 1987; 31(7):1117-1125。
28. Englund JA、Zimmerman ME、Swierkosz EM、Goodman JL、Scholl DR、Balfour HH、Jr. アシクロビル耐性の単純ヘルペスウイルス。三次医療センターでの研究。アンインターンメッド 1990; 112(6):416-422。
29. Erlich KS、Jacobson MA、Koehler JE、Follansbee SE、Drennan DP、Gooze L ら。後天性免疫不全症候群(AIDS)患者における重度のアシクロビル耐性単純ヘルペスウイルス2型感染症に対するフォスカルネット療法。制御されていない試験。アンインターンメッド 1989; 110(9):710-713。
30. Erlich KS、Mills J、Chatis P、Mertz GJ、Busch DF、Follansbee SE 他。後天性免疫不全症候群患者におけるアシクロビル耐性単純ヘルペスウイルス感染。 N Engl J Med 1989; 320(5):293-296。
31. フィールド HJ、ダービー G、ワイルド P. 単純ヘルペス ウイルスのアシクロビル耐性突然変異体の分離と特徴付け。 J Gen Virol 1980; 49(1):115-124。
32. フィールド HJ。抗ウイルス療法の問題における、ウイルスの薬剤誘発性耐性の問題。 Stuart-Harris CH、Oxford J (Eds) Academic Press、ロンドン 1983 年。
33. Fyfe K. 慢性的なアシクロビル抑制を 5 年以上中止した後の性器ヘルペスの再発パターン。 VIII Int Conf AIDS/III Std Wrld Cong 1992;(B240).
34. ハフ JC、ビーン B、バルフォア HH、ジュニア、ラスキン OL、コナー JD、コーリー L 他。経口アシクロビルによる帯状疱疹の治療。アム J メッド 1988; 85(2A):84-89.
35. Jacobson MA、Berger TG、Fikrig S、Becherer P、Moohr JW、Stanat SC 他。後天性免疫不全症候群(AIDS)患者における慢性経口アシクロビル療法後のアシクロビル耐性水痘帯状疱疹ウイルス感染症。アンインターンメッド 1990; 112(3):187-191。
36. Kaplowitz LG、Baker D、Gelb L、Blythe J、Hale R、Frost P ら。性器単純ヘルペスウイルス感染症を頻繁に再発する正常な成人のアシクロビル治療の長期継続。アシクロビル研究グループ。自工会 1991; 265(6):747-751。
37. Krasny HC、Liao SH、de Miranda P、Laskin OL、Whelton A、Lietman PS。慢性腎不全患者におけるアシクロビルの薬物動態に対する血液透析の影響。アム J メッド 1982; 73(1A):202-204.
38. Kurtz T. 頻繁に再発する性器ヘルペスの長期抑制シクロビル治療の安全性と有効性: 5 年目の結果。 30th Intersci Conf Antimicrob Agents Chemother 1990;270。
39. Laskin OL、Longstreth JA、Whelton A、Krasny HC、Keeney RE、Rocco L ら。アシクロビルの薬物動態に対する腎不全の影響。アム J メッド 1982; 73(1A):197-201.
40.ラウRJ、エメリーMG、ガリンスキーRE。乳児曝露の推定による母乳中のアシクロビルの予期しない蓄積。 Obstet Gynecol 1987; 69(3 Pt 2):468-471.
41. レーマン SN、ダグラス JM、コーリー L、バリー DW。性器ヘルペスの再発と抑制経口アシクロビル療法。臨床転帰と in vitro 薬物感受性との関係。アンインターンメッド 1986; 104(6):786-790。
42. Marlowe S、Douglas J、Corey L、Schnipper L、Crumpacker C. 経口アシクロビル後の HSV 性器分離株の感受性。第 24 回 Interscience Conf Antimicrob Ag Chemother、ワシントン DC、1984 年 10 月 8 ~ 10 日。
43. Mattison HR、Reichman RC、Benedetti J、Bolgiano D、Davis LG、Bailey-Farchione A 他。再発性性器ヘルペスの管理のための長期抑制療法と短期経口アシクロビル療法を比較する二重盲検プラセボ対照試験。アム J メッド 1988; 85(2A):20-25.
44. マクラーレン C、シブラック CD、バリー DW。単純ヘルペスウイルス臨床分離株のアシクロビルの感受性スペクトル。アム J メッド 1982; 73(1A):376-379。
45. マクラーレン C、エリス MN、ハンター GA。単純ヘルペスウイルスの抗ウイルス剤に対する感受性を測定するための比色アッセイ。 Antiviral Res 1983; 3(4):223-234。
46. マクラーレン C、コーリー L、デケット C、バリー DW。アシクロビル治療患者からの性器単純ヘルペスウイルスにおけるアシクロビルに対するインビトロ感受性。 J Infect Dis 1983; 148(5):868-875。
47. Mertz GJ、Critchlow CW、Benedetti J、Reichman RC、Dolin R、Connor J 他。最初のエピソード性器単純ヘルペスウイルス感染における経口アシクロビルの二重盲検プラセボ対照試験。自工会 1984; 252(9):1147-1151。
48. Mertz GJ、Jones CC、Mills J、Fife KH、Lemon SM、Stapleton JT 他。頻繁に再発する性器単純ヘルペスウイルス感染症の長期アシクロビル抑制。多施設二重盲検試験。自工会 1988; 260(2):201-206.
49. Mertz GJ、Eron L、Kaufman R、Goldberg L、Raab B、Conant M 他。性器単純ヘルペスウイルス感染を頻繁に再発する正常な成人における長期の継続的経口アシクロビル治療と断続的経口アシクロビル治療.アム J メッド 1988; 85(2A):14-19.
50. Meyer LJ、de Miranda P、Sheth N、Spruance S. 母乳中のアシクロビル。 Am J Obstet Gynecol 1988; 158(3 Pt 1):586-588.
51. ミンデル A、ウェラー IV、ファハティ A、サザーランド S、ハインドリー D、フィディアン AP 他。再発性性器ヘルペスにおける予防的経口アシクロビル 日本語アブストラクト The New England Journal of Medicine(日本国内版)ランセット 1984; 2(8394):57-59。
52.モートンP、トムソンAN。一般診療における帯状ヘルペスの治療における経口アシクロビル 日本語アブストラクト The New England Journal of Medicine(日本国内版) NZ Med J 1989; 102(863):93-95.
53. Naib ZM、Nahmias AJ、Josey WE、Zaki SA。生殖器ヘルペスウイルス感染症の細胞組織病理学と子宮頸部退形成との関係。 Cancer Res 1973; 33(6):1452-1463。
54. Nilsen AE、Aasen T、Halsos AM、Kinge BR、Tjotta EA、Wikstrom K 他。初期および再発性の性器ヘルペスの治療における経口アシクロビルの有効性。ランセット 1982; 2(8298):571-573。
55. Nusinoff-Lehrman S、Hunter G、Rogers J、Corey L、Davis G. 抑制経口療法を受けている患者が流すヘルペスウイルスの in vitro アシクロビル感受性。第 24 回 Interscience Conf Antimicrob Ag Chemother、ワシントン DC、1984 年 10 月 8 ~ 10 日;(アブストラクト #1015)。
56. オブライエン JJ、カンポリ リチャーズ DM。アシクロビル。その抗ウイルス活性、薬物動態特性、および治療効果の最新のレビュー。ドラッグ 1989; 37(3):233-309。
57. パーワ S、ビロン K、リム W、スウェンソン P、カプラン MH、サディック N 他。 AIDSの子供におけるアシクロビル耐性に関連した継続的な水痘帯状疱疹感染.自工会 1988; 260(19):2879-2882。
58. パーカー AC、クレイグ JI、コリンズ P、オリバー N、スミス I. DNA ポリメラーゼの変化によるアシクロビル耐性単純ヘルペス ウイルス感染。ランセット 1987; 2(8573):1461.
59. パリス DS、ハリントン JE。高濃度のアシクロビルに抑制された単純ヘルペスウイルス変異体は、臨床分離株に存在します。 Antimicrob Agents Chemother 1982; 22(1):71-77。
60. Preblud SR、Arbeter AM、Proctor EA、Starr SE、Plotkin SA。抗ウイルス化合物に対する水痘帯状疱疹ウイルスのワクチン株の感受性。 Antimicrob Agents Chemother 1984; 25(4):417-421。
61. ライヒマン RC、アナグマ GJ、マーツ GJ、コーリー L、リッチマン DD、コナー JD 他。反復性単純ヘルペス感染症の経口アシクロビルによる治療。対照試験。自工会 1984; 251(16):2103-2107。
62. Shah GM、Winer RL、Krasny HC。連続外来腹膜透析患者におけるアシクロビルの薬物動態。 Am J Kidney Dis 1986; 7(6):507-510。
63. Sibrack CD、Gutman LT、Wilfert CM、McLaren C、St Clair MH、Keller PM 他。免疫不全の子供からのアシクロビル耐性単純ヘルペスウイルス1型の病原性。 J Infect Dis 1982; 146(5):673-682。
64. Straus SE、Seidlin M、Takiff H、Jacobs D、Bowen D、Smith HA。免疫不全患者における単純ヘルペスウイルス感染の再発を抑制するための経口アシクロビル。アンインターンメッド 1984; 100(4):522-524。
65. Straus SE、Takiff HE、Seidlin M、Bachrach S、Lininger L、DiGiovanna JJ 他。頻繁に再発する性器ヘルペスの抑制。経口アシクロビルのプラセボ対照二重盲検試験。 N Engl J Med 1984; 310(24):1545-1550。
66. Straus SE、Croen KD、Sawyer MH、Freifeld AG、Felser JM、Dale JK 他。頻繁に再発する性器ヘルペスのアシクロビル抑制。継続的な治療期間中の有効性と必要性の減少。自工会 1988; 260(15):2227-2230。
67. Vinckier F、Boogaerts M、De Clerck D、De Clercq E. 免疫不全患者における慢性ヘルペス感染: 症例の報告。 J Oral Maxillofac Surg 1987; 45(8):723-728。
68. ウェイド JC、ニュートン B、マクラーレン C、フルノイ N、キーニー RE、マイヤーズ JD。骨髄移植後の粘膜皮膚単純ヘルペスウイルス感染を治療するための静脈内アシクロビル:二重盲検試験。アンインターンメッド 1982; 96(3):265-269。
69. ウェイド JC、マクラーレン C、マイヤーズ JD。アシクロビルによる複数回の治療を受けている骨髄移植患者から分離されたアシクロビル耐性単純ヘルペスウイルスの頻度と意義。 J Infect Dis 1983; 148(6):1077-1082。
患者情報
患者は、重度または厄介な副作用を経験した場合、妊娠しているまたは妊娠する予定がある場合、ゾビラックス(アシクロビル)の経口投与中に授乳する予定がある場合、またはその他の質問がある場合は、医師に相談するように指示されています。
患者は十分な水分補給を維持するようにアドバイスされるべきです。
