Sustiva 200mg, 600mg Efavirenz 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
サスティバ 600mg とは何ですか?
Sustiva は、HIV 感染症の症状を治療するために使用される処方薬です。サスティバは、単独で使用することも、他の薬と併用することもできます。
Sustiva は、HIV、NNRTI と呼ばれる薬物のクラスに属します。
Sustiva が生後 3 か月未満の子供に安全で効果があるかどうかはわかっていません。
サスティバの副作用の可能性は?
サスティバは、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 熱、
- 喉の痛み、
- 燃える目、
- 皮膚の痛み、
- 水ぶくれやはがれを伴う赤または紫の皮膚発疹、
- 発作、
- 幻覚、
- 集中するのが苦手、
- 話したり動いたりするのが困難(薬を飲み始めてから数か月または数年後に発生する可能性があります)、
- めまい、
- 眠気、
- 錯乱、
- 集中するのが苦手、
- 奇妙な夢、
- 不眠症、
- スピーチの問題、
- バランスや筋肉の動きに問題があり、
- 不安、
- パラノイア、
- 異常な行動、
- 悲しかったり、絶望したり、
- 自殺念慮、
- 吐き気、
- 胃痛、
- 食欲減少、
- 暗い尿、
- 粘土色の便、
- 皮膚や目の黄変(黄疸)、
- 寝汗、
- 腫れた腺、
- 口唇ヘルペス、
- 咳、
- 喘鳴、
- 下痢、
- 減量、
- 嚥下困難、
- バランスや眼球運動の問題、
- 弱点、
- チクチク感、
- 首や喉の腫れ(甲状腺肥大)、
- 月経の変化、および
- インポテンス
上記の症状がある場合は、すぐに医療機関を受診してください。
サスティバの最も一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- めまい、
- 眠気、
- 集中するのが苦手、
- 発疹、
- 頭痛、
- 疲れ、
- 睡眠障害(不眠症)、
- 奇妙な夢、そして
- 体脂肪の形や位置の変化(特に腕、脚、顔、首、胸、腰)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、サスティバの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
SUSTIVA® (エファビレンツ) は、HIV-1 特異的な非ヌクレオシド逆転写酵素阻害剤 (NNRTI) です。エファビレンツは、(S)-6-クロロ-4-(シクロプロピルエチニル)-1,4-ジヒドロ4-(トリフルオロメチル)-2H-3,1-ベンゾキサジン-2-オンと化学的に記載されています。その実験式は C14H9ClF3NO2 であり、その構造式は次のとおりです。
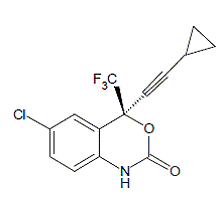
エファビレンツは、分子量 315.68 の白色からわずかにピンク色の結晶性粉末です。水にはほとんど溶けません (
カプセル
SUSTIVA は、50 mg または 200 mg のエファビレンツと次の不活性成分を含む経口投与用のカプセルとして入手できます: ラクトース一水和物、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、デンプン グリコール酸ナトリウム。カプセル シェルには、次の不活性成分と染料が含まれています: ゼラチン、ラウリル硫酸ナトリウム、二酸化チタン、および/または黄酸化鉄。カプセルシェルはまた、二酸化ケイ素を含んでもよい。カプセルは、カーミン 40 ブルー、FD&C ブルー No. 2、二酸化チタンを含むインクで印刷されています。
錠剤
サスティバ 600mg は、600mg のエファビレンツと、クロスカルメロース ナトリウム、ヒドロキシプロピル セルロース、乳糖一水和物、ステアリン酸マグネシウム、微結晶性セルロース、およびラウリル硫酸ナトリウムを含む、経口投与用のフィルムコーティング錠として入手できます。フィルムコーティングには、オパドライイエローとオパドライクリアが含まれています。錠剤はカルナバワックスで磨かれ、紫色のインク Opacode WB で印刷されています。
適応症
SUSTIVA®(エファビレンツ)は、他の抗レトロウイルス薬と併用して、成人および生後 3 か月以上で体重 3.5 kg 以上の小児患者のヒト免疫不全ウイルス 1 型(HIV-1)感染症の治療に適応されます。
投薬と管理
肝機能
SUSTIVAによる治療前および治療中に肝機能をモニタリングする[参照 警告と注意事項 ]。 SUSTIVA 600mg は、中等度または重度の肝障害のある患者 (Child Pugh B または C) には推奨されません [参照 警告と注意事項 と 特定の集団での使用 ]。
大人
SUSTIVA(エファビレンツ)の推奨用量は、プロテアーゼ阻害剤および/またはヌクレオシドアナログ逆転写酵素阻害剤(NRTI)と組み合わせて、1日1回600mgの経口投与です。 SUSTIVA は空腹時に、できれば就寝前に服用することをお勧めします。サスティバ 600mg を食事と一緒に投与した後に観察されたエファビレンツ濃度の上昇は、副作用の頻度の増加につながる可能性があります。 臨床薬理学 ]。就寝時に服用すると、神経系の症状の忍容性が向上する可能性があります [参照 警告と注意事項 、 有害反応 、 と 患者情報 ]。サスティバのカプセルまたは錠剤は、液体と一緒にそのまま飲み込んでください。カプセルや錠剤を飲み込むことができない患者には、カプセルスプリンクル投与方法が推奨されます[参照 カプセルふりかけの投与方法 ]。
併用抗レトロウイルス療法
SUSTIVA は、他の抗レトロウイルス薬と組み合わせて投与する必要があります。 適応症 、 警告と注意事項 、 薬物相互作用 、 と 臨床薬理学 ]。
投与量の調整
サスティバ 200mg をボリコナゾールと併用投与する場合、ボリコナゾールの維持用量を 12 時間ごとに 400mg に増量し、サスティバ 200mg の用量を 1 日 1 回 300mg に減量する必要があります。 mgカプセル)。サスティバ 600mg 錠を割らないでください。 [見る 薬物相互作用 と 臨床薬理学 .]
体重が 50kg 以上の患者にサスティバをリファンピンと併用投与する場合、サスティバの用量を 1 日 1 回 200mg から 800mg に増量することが推奨されます。 薬物相互作用 と 臨床薬理学 ]。
小児患者
サスティバ 600mg は空腹時に、できれば就寝前に服用することをお勧めします。表 1 は、生後 3 か月以上で体重が 3.5 kg から 40 kg の小児患者に対する SUSTIVA の推奨用量を示しています。 臨床薬理学 ]。体重40kg以上の小児患者に対するサスティバの推奨用量は、1日1回600mgです。カプセルを飲み込むことができない小児患者の場合、カプセルの内容物は、カプセル散布投与法を使用して、少量の食品または乳児用調合乳と一緒に投与できます。 カプセルふりかけの投与方法 ]。
カプセルふりかけの投与方法
生後 3 か月以上、体重 3.5 kg 以上の小児患者、およびカプセルまたは錠剤を飲み込めない成人の場合、カプセルの内容物を少量 (ティースプーン 1 ~ 2 杯) の食物と一緒に投与することができます。乳児用調製粉乳の使用は、固形食品を確実に摂取できない幼児に対してのみ考慮されるべきです。患者と介護者は、カプセルの内容物が空気中にこぼれたり分散したりしないように、慎重にカプセルを開けるように指示する必要があります。カプセルは、小さな容器の上に水平に置き、慎重にひねって開けます。固形食品に耐えられる患者の場合、カプセルの内容物全体を、年齢に応じた柔らかい食品 (アップルソース、グレープ ゼリー、ヨーグルトなど) と小さな容器で穏やかに混合する必要があります。カプセルのスプリンクルと乳児用調合乳の混合物を服用している幼児の場合、小さなスプーンで慎重にかき混ぜて、カプセルの内容物全体を、小さじ 2 杯の室温に戻した乳児用調合乳に静かに混ぜます。投与用の mL 経口投与シリンジ。 SUSTIVA と食品または調合乳の混合物の投与後、追加の少量 (約小さじ 2 杯) の食品または調合乳を空の混合容器に加え、撹拌して残っている SUSTIVA 残留物を分散させ、患者に投与する必要があります。 SUSTIVA と食品または調合乳の混合物は、混合後 30 分以内に投与する必要があります。 SUSTIVA 投与後 2 時間は、追加の食物を摂取してはなりません。
カプセル スプリンクルの投与方法に関する患者への指示は、FDA 承認の患者ラベルに記載されています (以下を参照)。 患者情報 と 使用説明書 )。
供給方法
剤形と強度
カプセル
200mgカプセルは金色で、本体に「SUSTIVA」と逆印刷され、キャップに「200mg」と刻印されています。
50mgカプセルは金色と白色で、金色のキャップに「SUSTIVA」、白色の本体に「50mg」と反転印刷されています。
錠剤
600mg錠は黄色のカプセル状のフィルムコーティング錠で、両面に「SUSTIVA」と印字されています。
保管と取り扱い
カプセル
SUSTIVA® (エファビレンツ) カプセルは、次のように入手できます。
カプセル 200 mg は金色で、ボディに「SUSTIVA」と逆印刷され、キャップに「200 mg」と刻印されています。
90本のボトル - NDC 0056-0474-92
カプセル50mgは金色と白色で、金色のキャップに「SUSTIVA」、白色の本体に「50mg」と反転印刷されています。
30本のボトル - NDC 0056-0470-30
錠剤
SUSTIVA®(エファビレンツ)錠は、次のように入手できます。
錠剤600mgは、黄色のカプセル状のフィルムコーティング錠で、両面に「SUSTIVA」と印字されています。
30本のボトル - NDC 0056-0510-30
保管所
SUSTIVA 600mg カプセルおよび SUSTIVA 錠剤は 25°C (77°F) で保管してください。 15°C ~ 30°C (59°F ~ 86°F) [USP 制御室温を参照] まで許容されます。
販売元: Bristol-Myers Squibb Company プリンストン、ニュージャージー州 08543 USA。改訂: 2020 年 10 月
副作用
SUSTIVA で治療された患者で観察された最も重大な副作用は次のとおりです。
- 精神症状[参照 警告と注意事項 ]、
- 神経系の症状 [参照 警告と注意事項 ]、
- 発疹[見る 警告と注意事項 ]。
- 肝毒性[参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、報告された有害反応の発生率を他の臨床試験の発生率と直接比較することはできず、臨床現場で観察された発生率を反映していない可能性があります。
成人における有害反応
ジドブジン/ラミブジンまたはインジナビルと組み合わせた SUSTIVA 200mg で治療された 006 試験の患者で最も一般的 (エファビレンツ治療群で 5% 以上) の中等度以上の副作用は、発疹、めまい、吐き気、頭痛、疲労、不眠症でした。そして嘔吐。
2 つの対照臨床試験で SUSTIVA 治療を受けた患者の 2% 以上で観察された中等度または重度の選択された臨床的有害反応を表 2 に示します。
エファビレンツとの因果関係は確立されていませんが、膵炎が報告されています。エファビレンツ 600 mg で治療された患者の数は、対照患者よりも有意に多く、血清アミラーゼレベルの無症候性上昇が観察されました ( 実験室の異常 )。
神経系の症状
表 3 は、対照試験で SUSTIVA を含むレジメンで治療された 1008 人の患者と対照レジメンで治療された 635 人の患者について、さまざまな重症度の症状の頻度を示し、次の神経系症状の 1 つまたは複数の中止率を示しています。不眠症、集中力の低下、傾眠、異常な夢、多幸感、混乱、激越、記憶喪失、幻覚、昏迷、異常な思考、離人症 [参照] 警告と注意事項 ]。特定の中枢神経系および末梢神経系の症状の頻度を表 2 に示します。
精神症状
SUSTIVAで治療を受けた患者では、深刻な精神医学的有害事象が報告されています。対照試験では、SUSTIVA 600mgまたは対照レジメンで治療された患者で2%以上の頻度で観察された精神症状は、うつ病(19%、16%)、不安(13%、9%)、神経質(7%)でした。 、2%)。
発疹
対照臨床試験では、発疹の頻度(すべてのグレード、因果関係に関係なく)は、SUSTIVA 200 mg を含むレジメンで治療された 1,008 人の成人で 26%、対照レジメンで治療された 635 人の成人で 17% でした。発疹のほとんどの報告は、重症度が軽度または中等度でした。グレード 3 の発疹の頻度は、SUSTIVA 治療を受けた患者で 0.8%、対照群で 0.3% であり、グレード 4 の発疹の頻度は、SUSTIVA で 0.1%、対照群で 0 でした。発疹による中止率は、SUSTIVA 治療を受けた患者で 1.7%、対照群で 0.3% でした。 警告と注意事項 ]。
NNRTIクラスの他の抗レトロウイルス薬を中止した患者におけるSUSTIVAの使用経験は限られています。発疹のためにネビラピンを中止した 19 人の患者が SUSTIVA で治療されました。これらの患者のうち 9 人は、SUSTIVA による治療中に軽度から中等度の発疹を発症し、これらの患者のうち 2 人は発疹のために治療を中止しました。
実験室の異常
つの臨床試験で SUSTIVA 治療を受けた患者の 2% 以上で報告された選択されたグレード 3 ~ 4 の臨床検査値異常を表 4 に示します。
B型またはC型肝炎に同時感染した患者
型肝炎および/または C 型肝炎の既往歴のある患者では、肝機能検査をモニタリングする必要があります。Study 006 の長期データセットでは、SUSTIVA を含むレジメンで治療された 137 人の患者(治療期間の中央値、68 週間)と 84 人の患者が治療を受けました。対照レジメン(期間の中央値、56週間)を使用した患者は、B型肝炎(表面抗原陽性)および/またはC型肝炎(C型肝炎抗体陽性)のスクリーニングで血清陽性でした。これらの重感染患者の中で、AST が ULN の 5 倍以上に上昇したのは SUSTIVA 群の患者の 13%、対照群の患者の 7% であり、ALT が ULN の 5 倍を超えた上昇が 20% の患者で発生したSUSTIVA 群では患者の 7%、対照群では 7% でした。重感染患者のうち、SUSTIVA を含むレジメンで治療された患者の 3%、対照群の 2% が、肝臓または胆道系の障害のために研究を中止しました [参照 警告と注意事項 ]。
脂質
SUSTIVA を投与された一部の感染していないボランティアでは、ベースラインから 10 ~ 20% の総コレステロールの増加が観察されています。 SUSTIVA + ジドブジン + ラミブジンで治療された患者では、非空腹時の総コレステロールと HDL のベースラインからの増加が、それぞれ約 20% と 25% 観察されました。 SUSTIVA + インジナビルで治療された患者では、ベースラインからの非空腹時コレステロールおよび HDL のそれぞれ約 40% および 35% の増加が観察されました。 SUSTIVA + ジドブジン + ラミブジンで治療された患者の 34% と 9% で、それぞれ 240 mg/dL 以上と 300 mg/dL 以上の非絶食時の総コレステロール値が報告されました。 SUSTIVA + インジナビルで治療された患者のそれぞれ 54% と 20%。インジナビル + ジドブジン + ラミブジンで治療された患者のそれぞれ 28% と 4%。サンプルが非絶食患者から採取されたため、この研究におけるトリグリセリドおよび LDL に対する SUSTIVA 600mg の効果は十分に特徴付けられていませんでした。これらの所見の臨床的意義は不明である[参照 警告と注意事項 ]。
小児患者における有害反応
臨床試験はさまざまな条件下で実施されるため、報告された有害反応の発生率を他の臨床試験の発生率と直接比較することはできず、臨床現場で観察された発生率を反映していない可能性があります。
副作用の評価は、HIV-1 に感染した 182 人の HIV-1 感染小児患者 (生後 3 か月から 21 歳まで) を対象とした 3 つの臨床試験に基づいており、SUSTIVA 200mg を他の抗レトロウイルス薬と組み合わせて中央値 123 週間投与しました。 3つの試験で観察された有害反応は、成人の臨床試験で観察されたものと同様でしたが、発疹は小児患者でより一般的であり(因果関係に関係なく、すべてのグレードで32%)、よりグレードの高い(つまり、より重度の)頻度が高かった. 2 名 (1.1%) の小児患者はグレード 3 の発疹 (発熱を伴う合流性発疹、全身性発疹) を経験し、4 名 (2.2%) の小児患者はグレード 4 の発疹 (すべて多形紅斑) を経験しました。 5 人の小児患者 (2.7%) が発疹のために研究を中止した [参照 警告と注意事項 ]。
市販後の経験
サスティバの承認後の使用中に、以下の副作用が確認されました。これらの反応は未知の規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
全身: アレルギー反応、無力症、体脂肪の再分布/蓄積[参照 警告と注意事項 ]
中枢および末梢神経系: 異常な協調、運動失調、脳症、小脳の協調とバランスの乱れ、痙攣、感覚鈍麻、感覚異常、神経障害、振戦、めまい
内分泌: 女性化乳房
胃腸: 便秘、吸収不良
心臓血管: 紅潮、動悸
肝臓と胆道系: 肝酵素上昇、肝不全、肝炎。
代謝と栄養: 高コレステロール血症、高トリグリセリド血症
筋骨格: 関節痛、筋肉痛、ミオパシー
精神的: 攻撃的反応、激越、妄想、情緒不安定、躁病、神経症、パラノイア、精神病、自殺、緊張病
呼吸器: 呼吸困難
皮膚と付属物: 多形紅斑、光アレルギー性皮膚炎、スティーブンス・ジョンソン症候群
特別な感覚: 視力異常、耳鳴り
薬物相互作用
サスティバが他の薬剤に影響を与える可能性
エファビレンツは in vivo で CYP3A および CYP2B6 を誘導することが示されています。 CYP3A または CYP2B6 の基質である他の化合物は、SUSTIVA と併用すると血漿中濃度が低下する可能性があります。
他の薬剤がサスティバに影響を与える可能性
CYP3A 活性を誘導する薬剤 (例、フェノバルビタール、リファンピン、リファブチン) は、エファビレンツのクリアランスを増加させ、血漿濃度を低下させると予想される [ 投薬と管理 ]。
QT延長薬
SUSTIVA 600mg と QTc 間隔を延長する薬剤との間の薬力学的相互作用の可能性について入手できる情報は限られています。エファビレンツの使用によりQTc延長が観察されている[参照 臨床薬理学 ]。 Torsade de Pointesのリスクが知られている薬剤と併用する場合は、SUSTIVA 600mgの代替品を検討してください。
確立された、およびその他の潜在的に重要な薬物相互作用
SUSTIVA との薬物相互作用を表 5 にまとめます。薬物動態データについては、[ 臨床薬理学 ] 表 7 および 8。この表には潜在的に重要な相互作用が含まれていますが、すべてを網羅しているわけではありません。
サスティバと臨床的に有意な相互作用のない薬剤
SUSTIVA 600mg が次の薬と一緒に投与されている場合は、用量調整は推奨されません: 水酸化アルミニウム/水酸化マグネシウム、アジスロマイシン、セチリジン、ファモチジン、フルコナゾール、ロラゼパム、ネルフィナビル、ヌクレオシド系逆転写酵素阻害剤 (アバカビル、エムトリシタビン、ラミブジン、スタブジン、フマル酸テノホビル ジソプロキシル、ジドブジン) )、パロキセチン、およびラルテグラビル。
カンナビノイド試験相互作用
エファビレンツはカンナビノイド受容体に結合しません。偽陽性の尿カンナビノイド検査結果は、エファビレンツを投与された非感染者および HIV 感染者のいくつかのスクリーニングアッセイで報告されています。より具体的な方法によるカンナビノイドの陽性スクリーニング検査の確認が推奨されます。
警告
の一部として含まれています "予防" セクション
予防
薬物相互作用
エファビレンツの血漿中濃度は、CYP3A の基質、阻害剤、または誘導剤によって変化する可能性があります。同様に、エファビレンツは、CYP3A または CYP2B6 によって代謝される薬物の血漿濃度を変化させる可能性があります。定常状態におけるエファビレンツの最も顕著な効果は、CYP3A および CYP2B6 の誘導です [ 投薬と管理 と 薬物相互作用 ]。
QTc延長
エファビレンツの使用によりQTc延長が観察されている[参照 薬物相互作用 と 臨床薬理学 ]。 Torsade de Pointesのリスクが知られている薬剤と併用する場合、またはTorsade de Pointesのリスクが高い患者に投与する場合は、SUSTIVA 600mgの代替品を検討してください。
抵抗
SUSTIVA 200mg は、HIV-1 感染症の治療に単剤として使用したり、失敗したレジメンに単剤として追加したりしてはなりません。エファビレンツを単剤療法として投与すると、耐性ウイルスが急速に出現します。エファビレンツと併用する新しい抗レトロウイルス薬の選択は、ウイルス交差耐性の可能性を考慮に入れる必要があります。
関連製品との併用
サスティバとアトリプラ(エファビレンツ 600 mg/エムトリシタビン 200 mg/フマル酸テノホビル ジソプロキシル 300 mg)の同時投与は、エファビレンツがその有効成分の 1 つであるため、用量調整(リファンピンとの併用など)が必要な場合を除き、推奨されません。
精神症状
SUSTIVAで治療を受けた患者では、深刻な精神医学的有害事象が報告されています。 SUSTIVA 600mg を含むレジメンで平均 2.1 年間治療された 1,008 人の患者と、平均 1.5 年間対照レジメンで治療された 635 人の患者の対照試験では、SUSTIVA または対照レジメンは、それぞれ、重度のうつ病 (2.4%、0.9%)、自殺念慮 (0.7%、0.3%)、致命的でない自殺未遂 (0.5%、0)、攻撃的行動 (0.4%、0.5%)、妄想反応 (0.4%) でした。 %、0.3%)、および躁反応 (0.2%、0.3%)。 006 試験のデータの多因子分析において、上記と同様の精神症状を組み合わせてグループとして評価したところ、エファビレンツによる治療は、これらの選択された精神症状の発生の増加と関連していました。これらの精神医学的症状の発生の増加に関連する他の要因は、注射薬の使用歴、精神病歴、および研究登録時の精神医学的薬の受領でした。同様の関連性が、SUSTIVA と対照治療群の両方で観察されました。 006 試験では、SUSTIVA 治療を受けた患者と対照治療を受けた患者の両方で、試験全体を通して新たな重篤な精神症状の発症が発生しました。 SUSTIVA 治療を受けた患者の 1% が、これらの選択された精神症状の 1 つまたは複数のために治療を中止または中断しました。サスティバの使用との因果関係はこれらの報告から決定することはできませんが、自殺、妄想、および精神病のような行動による死亡の市販後の報告も時折あります.市販後の緊張病の症例も報告されており、エファビレンツへの暴露の増加と関連している可能性があります。重度の精神医学的有害事象を経験した患者は、症状がサスティバの使用に関連している可能性を評価するために、直ちに医学的評価を受けるべきであり、そうであれば、継続的な治療のリスクが利益を上回るかどうかを判断する必要があります. [見る 有害反応 .]
神経系の症状
対照試験でサスティバ 600mg を投与された患者の 53% (531/1008) が中枢神経系の症状 (因果関係に関係なくグレードは問わない) を報告したのに対し、対照レジメンを投与された患者では 25% (156/635) でした [参照 有害反応 ]。これらの症状には、めまい (1008 人の患者の 28.1%)、不眠症 (16.3%)、集中力の低下 (8.3%)、傾眠 (7.0%)、異常な夢 (6.2%)、幻覚 (1.2%) が含まれますが、これらに限定されません。 %)。これらの症状は、患者の 2.0% で深刻でした。その結果、患者の 2.1% が治療を中止しました。これらの症状は通常、治療の 1 日目または 2 日目に始まり、通常は治療の最初の 2 ~ 4 週間後に解消されます。 4 週間の治療後、中等度以上の神経系症状の有病率は、SUSTIVA を含むレジメンで治療された患者で 5% から 9%、対照レジメンで治療された患者で 3% から 5% の範囲でした。患者には、これらの一般的な症状は継続的な治療で改善する可能性が高く、頻度の低い精神症状のその後の発症を予測するものではないことを通知する必要があります[参照 精神症状 ]。就寝時に服用すると、これらの神経系症状の忍容性が改善される可能性があります [参照 投薬と管理 ]。
006 試験の長期データの分析 (SUSTIVA + ジドブジン + ラミブジン、SUSTIVA + インジナビル、およびインジナビル + ジドブジン + ラミブジンで治療された患者の追跡期間の中央値は、それぞれ 180 週間、102 週間、および 76 週間)。治療開始から 24 週間後、SUSTIVA 治療を受けた患者の新たな神経系症状の発生率は、インジナビルを含む対照群の発生率とほぼ同じでした。
運動失調や脳症(意識障害、錯乱、精神運動の鈍化、精神病、せん妄)などの遅発性神経毒性は、エファビレンツ療法の開始から数か月から数年後に発生する可能性があります。 CYP2B6 遺伝子多型を有する患者では、SUSTIVA の標準的な投与量にもかかわらず、エファビレンツ レベルの上昇に関連する遅発性神経毒性のいくつかのイベントが発生しています。深刻な神経学的有害事象の徴候や症状を呈している患者は、これらの事象がエファビレンツの使用に関連している可能性を評価するために、迅速に評価し、SUSTIVA 600mg の中止が正当化されるかどうかを評価する必要があります。
SUSTIVA 600mg を服用している患者は、SUSTIVA 200mg をアルコールまたは向精神薬と併用した場合、中枢神経系への相加作用の可能性があることに注意する必要があります。
めまい、集中力の低下、および/または眠気などの中枢神経系の症状を経験している患者は、運転や機械の操作などの潜在的に危険な作業を避ける必要があります。
胚・胎児毒性
エファビレンツは、妊娠初期に妊娠中の女性に投与すると、胎児に害を及ぼす可能性があります。サスティバ 600mg を投与されている生殖能力のある女性には、妊娠を避けるようにアドバイスしてください。 [見る 特定の集団での使用 .]
発疹
対照臨床試験では、サスティバ 600 mg で治療された成人患者の 26% (266/1008) が、対照群で治療された成人患者の 17% (111/635) と比較して、新たに発症した皮膚発疹を経験しました [参照 有害反応 ]。 SUSTIVA 群の 0.9% (9/1008) で、水ぶくれ、湿性落屑、または潰瘍を伴う発疹が発生しました。すべての研究で、SUSTIVA による治療を受け、アクセスが拡大された成人患者におけるグレード 4 の発疹(多形紅斑、スティーブンス・ジョンソン症候群など)の発生率は 0.1% でした。発疹は通常、エファビレンツによる治療を開始してから最初の 2 週間以内に発生する軽度から中等度の黄斑丘疹の皮膚発疹であり (成人の発疹発症までの時間の中央値は 11 日でした)、エファビレンツによる治療を継続しているほとんどの患者では、発疹は 1 日以内に消失します。月 (期間の中央値、16 日)。成人の臨床試験における発疹の中止率は 1.7% (17/1008) でした。
SUSTIVAで治療を受けた小児患者182人中59人(32%)で発疹が報告された[参照 有害反応 ]。 2 人の小児患者はグレード 3 の発疹 (発熱を伴う合流性発疹、全身性発疹) を経験し、4 人の患者はグレード 4 の発疹 (多形紅斑) を経験しました。小児患者の発疹発症までの期間の中央値は 28 日 (範囲 3 ~ 1642 日) でした。小児患者に SUSTIVA による治療を開始する前に、適切な抗ヒスタミン薬による予防を検討する必要があります。
通常、サスティバ 600mg は、発疹のために治療を中断している患者に再開することができます。水ぶくれ、落屑、粘膜病変、または発熱を伴う重度の発疹を発症している患者では、サスティバ 200mg の投与を中止する必要があります。適切な抗ヒスタミン薬および/またはコルチコステロイドは、忍容性を改善し、発疹の消散を早める可能性があります.生命を脅かす皮膚反応(例、スティーブンス・ジョンソン症候群)を経験した患者には、代替療法を検討する必要があります[ 禁忌 ]。
肝毒性
サスティバで治療された患者では、移植を必要とする肝不全または死亡に至る劇症肝炎を含む市販後の肝炎の症例が報告されています。報告には、B型またはC型肝炎との同時感染を含む基礎となる肝疾患のある患者、および既存の肝疾患または他の特定可能な危険因子のない患者が含まれています。
SUSTIVA 600mg は、中等度または重度の肝障害のある患者には推奨されません。 SUSTIVA の投与を受けている軽度の肝障害患者には、慎重なモニタリングが推奨されます。 [見る 有害反応 と 特定の集団での使用 ]。
治療前および治療中の肝酵素のモニタリングは、すべての患者に推奨される[参照 投薬と管理 ]。
血清トランスアミナーゼが正常範囲の上限の 5 倍を超えて持続的に上昇している患者では、SUSTIVA 600mg の中止を検討してください。血清トランスアミナーゼの上昇が肝炎または肝代償不全の臨床徴候または症状を伴う場合は、SUSTIVA 200mgを中止してください。
痙攣
痙攣は、エファビレンツを投与されている成人および小児患者で観察されており、一般に発作の既往歴がある場合 [ 非臨床毒性学 ]。発作の既往のある患者には注意が必要です。フェニトインやフェノバルビタールなど、主に肝臓で代謝される抗けいれん薬を併用している患者は、血漿レベルの定期的なモニタリングが必要になる場合があります。 薬物相互作用 ]。
脂質上昇
SUSTIVAによる治療により、総コレステロールとトリグリセリドの濃度が上昇しました[参照 有害反応 ]。コレステロールとトリグリセリドの検査は、SUSTIVA 200mg の治療を開始する前と、治療中に定期的に実施する必要があります。
免疫再構築症候群
免疫再構築症候群は、SUSTIVA を含む併用抗レトロウイルス療法で治療された患者で報告されています。併用抗レトロウイルス治療の初期段階では、免疫系が反応する患者は、無痛性または残存する日和見感染(鳥型結核菌感染症、サイトメガロウイルス、ニューモシスチス・イロベチ肺炎[PCP]、または結核など)に対する炎症反応を発症する可能性があり、さらなる評価が必要になる場合があります。と治療。
自己免疫疾患 (バセドウ病、多発性筋炎、ギラン・バレー症候群、自己免疫性肝炎など) も、免疫再構築の状況で発生することが報告されています。ただし、発症までの時間はよりばらつきがあり、治療開始から数か月後に発生する可能性があります。
脂肪の再分配
抗レトロウイルス療法を受けている患者では、中心性肥満、背頸部の脂肪肥大(バッファローハンプ)、末梢の衰弱、顔の衰弱、乳房の肥大、および「クッシング様の外観」を含む体脂肪の再分布/蓄積が観察されています。これらのイベントのメカニズムと長期的な影響は現在不明です。因果関係は確立されていません。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 と 使用説明書 )。
薬物相互作用
製品のボトルラベルには、患者および医療提供者への声明が含まれています。 ALERT: SUSTIVA と一緒に服用してはならない医薬品について調べてください。
SUSTIVA は一部の薬物と相互作用する可能性があります。したがって、他の処方薬または非処方薬の使用について医師に報告するよう患者に助言してください。
患者様向けの一般情報
サスティバ 200mg は HIV-1 感染症の治療法ではなく、日和見感染症を含む HIV-1 感染症に関連する病気が続く可能性があることを患者に伝えてください。サスティバの服用中は、医師の管理下に置く必要があります。
HIV-1 感染を他の人に広める可能性のある行為を避けるように患者に助言します。
- 針やその他の注射器具を共有したり、再利用したりしないでください。
- 歯ブラシやカミソリの刃など、血液や体液が付着している可能性のある身の回り品を共有しないでください。
- 保護なしでいかなる種類のセックスもしないでください。 精液、膣分泌物、または血液との性的接触の可能性を下げるために、ラテックスまたはポリウレタンのコンドームを使用して、より安全なセックスを常に実践してください.
- 授乳しないでください。 HIV-1 に感染している母親は、母乳で赤ちゃんに感染する可能性があるため、母乳で育てるべきではありません。
投与指示
患者には、処方どおりに毎日 SUSTIVA を服用するようにアドバイスしてください。患者が SUSTIVA を服用するのを忘れた場合は、次の服用時間が近い場合を除き、忘れた分をすぐに服用するよう患者に伝えてください。一度に 2 回分を服用せず、定期的にスケジュールされた時間に次の分を服用するように患者に助言してください。薬を服用するのに最適な時期を計画するのに助けが必要な場合は、医療提供者に尋ねるように患者にアドバイスしてください。
SUSTIVA 200mg は必ず他の抗レトロウイルス薬と併用してください。サスティバ 600mg は空腹時に、できれば就寝前に服用するよう患者にアドバイスしてください。サスティバを食事と一緒に服用すると、エファビレンツの濃度が上昇し、副作用の頻度が高くなる可能性があります。就寝時に服用すると、神経系の症状の忍容性が向上する可能性があります [参照 投薬と管理 と 有害反応 ]。ヘルスケア提供者は、親または介護者が乳幼児に最適な SUSTIVA 投与スケジュールを決定するのを支援する必要があります。
カプセルまたは錠剤を飲み込むことができない成人および小児患者の場合、患者またはその介護者は、カプセルの内容物を少量の食品または乳児用調合乳で投与するための指示を読み、注意深く従うようにアドバイスする必要があります。 投薬と管理 および FDA 承認の患者ラベリング ( 患者情報 と 使用説明書 )]。患者は、質問がある場合は、医療提供者または薬剤師に電話する必要があります。
神経系の症状
SUSTIVA による治療の最初の数週間は、めまい、不眠、集中力の低下、眠気、異常な夢などの中枢神経系の症状 (NSS) が一般的に報告されることを患者に伝えてください。 警告と注意事項 ]。就寝時の投与は、これらの症状の忍容性を改善する可能性があり、継続的な治療により改善する可能性があります. SUSTIVA をアルコールまたは向精神薬と併用した場合、相加効果の可能性があることを患者に注意してください。 NSS を経験した場合は、運転や機械の操作などの潜在的に危険な作業を避けるように患者に指示します。
SUSTIVA 療法の開始から数か月から数年後に、運動失調や脳症などの遅発性神経毒性を発症するリスクがあることを患者に知らせてください。 警告と注意事項 ]。
精神症状
SUSTIVA を投与された患者では、重度のうつ病、自殺未遂、攻撃的行動、妄想、パラノイア、精神病様症状、緊張病などの重篤な精神症状が報告されていることを患者に伝えてください。 警告と注意事項 ]。彼らが重度の精神医学的不利な経験を経験した場合、彼らは直ちに医学的評価を受ける必要があります.精神疾患または薬物乱用の病歴を医師に知らせるように患者に助言します。
発疹
一般的な副作用は発疹であることを患者に伝えます [ 警告と注意事項 ]。発疹は通常、治療を変更しなくても治ります。ただし、発疹は深刻な場合があるため、発疹が発生した場合は速やかに医師に連絡するよう患者に助言してください。
肝毒性
疲労、脱力感、食欲不振、吐き気や嘔吐などの肝臓の炎症や機能不全の早期警告徴候、および黄疸、錯乱、腹部膨満、変色した糞便などの後期徴候に注意し、医師に相談するよう患者に伝えます。そのような症状が発生した場合は、遅滞なく医療専門家に相談してください[ 警告と注意事項 と 有害反応 ]。
生殖能力のある女性
生殖能力のある女性には、SUSTIVA 600mg による治療中および SUSTIVA 中止後 12 週間は効果的な避妊法とバリア法を使用するようにアドバイスしてください。妊娠を計画している場合、妊娠している場合、またはサスティバによる治療中に妊娠が疑われる場合は、医療提供者に連絡するように患者にアドバイスしてください。 警告と注意事項 と 特定の集団での使用 ]。
妊娠暴露登録
妊娠中にサスティバに暴露した女性の妊娠転帰を監視する妊娠暴露登録があることを患者に助言する[参照 特定の集団での使用 ]。
脂肪の再分配
抗レトロウイルス療法を受けている患者では体脂肪の再分布または蓄積が起こる可能性があり、これらの状態の原因と長期的な健康への影響は不明であることを患者に知らせる[参照 警告と注意事項 ]。
SUSTIVA は Bristol-Myers Squibb Pharma Company の登録商標です。 ATRIPLA は、Bristol-Myers Squibb & Gilead Sciences, LLC の商標です。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
マウスおよびラットにおける長期発がん性試験がエファビレンツで実施されました。マウスには、0、25、75、150、または 300 mg/kg/日を 2 年間投与しました。肝細胞腺腫および肝細胞がん、ならびに肺胞/細気管支腺腫の発生率は、女性のバックグラウンドを超えて増加しました。男性では、バックグラウンドを超える腫瘍発生率の増加は見られませんでした。腫瘍所見がすべての用量で発生したため、この研究で確立された雌の NOAEL はありませんでした。雄の NOAEL (150 mg/kg) での AUC は、ヒトの推奨臨床用量の約 0.9 倍であった。ラットの研究では、100 mg/kg/日までの用量で腫瘍発生率の増加は観察されず、AUC は、推奨される臨床用量でのヒトの 0.1 (雄) または 0.2 (雌) 倍でした。
突然変異誘発
エファビレンツは一連の in vitro および in vivo 遺伝毒性試験で陰性でした。これらには、S.typhimurium および E. coli における細菌突然変異アッセイ、チャイニーズハムスター卵巣細胞における哺乳類突然変異アッセイ、ヒト末梢血リンパ球またはチャイニーズハムスター卵巣細胞における染色体異常アッセイ、および in vivo マウス骨髄小核アッセイが含まれます。
生殖能力の障害
エファビレンツは、オスまたはメスのラットの交配や生殖能力を損なわず、投与したオスのラットの精子に影響を与えませんでした。エファビレンツを投与された雌ラットから生まれた子孫の生殖能力は影響を受けませんでした。オス (200 mg/kg) およびメス (100 mg/kg) ラットの NOAEL 値での AUC は、推奨される臨床用量でのヒトの約 0.15 倍以下でした。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中に SUSTIVA 600mg に曝露した女性の妊娠転帰を監視する妊娠曝露登録があります。医師は、Antiretroviral Pregnancy Registry (1-800-258-4263) に電話して患者を登録することをお勧めします。
リスクの概要
母親が妊娠の最初の三半期にエファビレンツを含むレジメンにさらされた乳児の神経管欠損のレトロスペクティブな症例報告があります。 Antiretroviral Pregnancy Registry からの予想妊娠データは、このリスクを適切に評価するには不十分です。 Antiretroviral Pregnancy Registry から入手可能なデータは、Metropolitan Atlanta Congenital Defects Program (MACDP) の米国参照母集団における 2.7% の重大な先天性欠損症のバックグラウンド率と比較して、全体的な重大な先天性欠損症のリスクに差がないことを示しています。妊娠初期のエファビレンツ曝露と神経管閉鎖障害との因果関係は確立されていませんが、ヒトと同様の用量でサルを対象に実施された研究では、同様の奇形が観察されています。さらに、推奨される臨床用量でのヒト曝露の 10 分の 1 の用量で、胎児および胚毒性がラットで発生しました。神経管閉鎖障害の潜在的なリスクがあるため、エファビレンツは妊娠初期には使用しないでください。妊娠中の女性には、胎児への潜在的なリスクについてアドバイスしてください。
データ
ヒューマンデータ
髄膜脊髄瘤を含む神経管欠損症と一致する調査結果のレトロスペクティブな市販後報告があり、これらはすべて妊娠初期にエファビレンツを含むレジメンに曝露された母親の乳児に見られます。
エファビレンツを含むレジメンへの暴露後の約 1000 人の生児出生に関する抗レトロウイルス妊娠登録 (APR) からの前向き報告 (妊娠初期に暴露された 800 人以上の生児出生を含む) に基づくと、メトロポリタン アトランタ先天性欠損症プログラムの米国参照集団における 2.7% のバックグラウンド先天性欠損症率。 2014 年 12 月に発行された中間 APR レポートの時点で、妊娠初期の暴露後の先天異常の有病率は 2.3% (95% CI: 1.4%-3.6%) でした。これらの前向きに報告された妊娠初期の暴露による欠陥の 1 つは、神経管欠陥でした。エファビレンツへの妊娠初期の曝露による無眼球症の1例も前向きに報告されています。この症例には、無眼球症との関連が知られている重度の斜め顔面裂および羊膜バンディングも含まれていました。
動物データ
胚・胎児発生に対するエファビレンツの効果は、3 つの非臨床種 (カニクイザル、ラット、およびウサギ) で研究されています。サルでは、エファビレンツ 60 mg/kg/日が妊娠中 (妊娠 20 日から 150 日) の間、妊娠中の雌に投与されました。母体の全身薬物曝露 (AUC) は、推奨される臨床用量 (600 mg/日) でのヒトの曝露の 1.3 倍であり、胎児の臍帯静脈薬物濃度は母体の値の約 0.7 倍でした。 20 人の胎児/乳児のうち 3 人に 1 つ以上の奇形がありました。プラセボで治療された母親から奇形の胎児や幼児はいませんでした。これら 3 匹のサルの胎児に発生した奇形には、1 匹の胎児に無脳症と片側性無眼球症、2 番目の胎児に小眼球症、3 番目に口蓋裂が含まれていました。 1 回の投与量のみが評価されたため、この研究では NOAEL (観察可能な有害影響レベルなし) は確立されませんでした。ラットでは、エファビレンツは、器官形成中 (妊娠 7 ~ 18 日) または妊娠 7 日から授乳 21 日まで、50、100、または 200 mg/kg/日で投与されました。ラットにおける 200 mg/kg/日の投与は、早期吸収の発生率の増加と関連していた。 100 mg/kg/日以上の用量は、早期の新生児死亡率と関連していました。このラット試験の NOAEL (50 mg/kg/日) での AUC は、推奨される臨床用量でのヒトの 0.1 倍でした。授乳 10 日目の母乳中の薬物濃度は、母体血漿中の薬物濃度の約 8 倍でした。妊娠中のウサギでは、エファビレンツは、器官形成の期間 (妊娠 6 日から 18 日) にわたって 25、50、および 75 mg/kg/日の用量で投与された場合、胚致死性でも催奇形性でもありませんでした。ウサギの NOAEL (75 mg/kg/日) での AUC は、推奨される臨床用量でのヒトの 0.4 倍でした。
授乳
リスクの概要
アメリカ疾病予防管理センターは、HIV に感染した母親は、出生後の HIV 感染のリスクを避けるために乳児に母乳を与えないことを推奨しています。母乳で育てられた乳児が HIV に感染する可能性があるため、母乳で育てないように女性にアドバイスしてください。
生殖能力のある雌と雄
催奇形作用の可能性があるため、SUSTIVA を投与されている女性は妊娠を避ける必要があります。 [見る 妊娠 .]
妊娠検査
生殖能力のある女性は、SUSTIVA の開始前に妊娠検査を受ける必要があります。
避妊
生殖能力のある女性は、エファビレンツの半減期が長いため、サスティバ 200mg の投与中およびサスティバ 200mg の投与中止後 12 週間は効果的な避妊を行う必要があります。バリア避妊は、常に他の避妊方法と組み合わせて使用する必要があります。プロゲステロンを含むホルモン法は、効果が低下する可能性があります [参照 薬物相互作用 ]。
小児用
SUSTIVA 600mg の安全性、薬物動態プロファイル、ウイルス学的および免疫学的反応は、3 つの非盲検臨床試験で、生後 3 か月から 21 歳までの HIV-1 感染小児患者を対象に、抗レトロウイルス未治療および経験者を対象に評価されました。 有害反応 、 臨床薬理学 、 と 臨床研究 ]。これらの試験における有害反応の種類と頻度は、大人と比較して小児患者でグレード 3 または 4 の発疹の頻度が高いことを除いて、一般的に成人患者の場合と同様でした [ 警告と注意事項 と 有害反応 ]。
生後 3 か月未満または体重 3.5 kg 未満の患者へのサスティバの使用は推奨されません。サスティバ 600mg の安全性、薬物動態、および抗ウイルス活性は、この年齢層では評価されておらず、HIV 耐性を発症するリスクがあるためです。サスティバが過少投与されている場合。見る 投薬と管理 小児患者の推奨投与量について。
高齢者の使用
SUSTIVA 200mg の臨床試験には、65 歳以上の被験者が十分に含まれておらず、若い被験者と反応が異なるかどうかを判断できませんでした。一般に、高齢患者の用量選択は、肝機能、腎機能、心機能の低下、および付随する疾患やその他の治療の頻度が高いことを反映して、慎重に行う必要があります。
肝障害
用量調整が必要かどうかを判断するにはデータが不十分であるため、中等度または重度の肝障害のある患者には SUSTIVA は推奨されません。軽度の肝障害のある患者は、用量を調整せずにエファビレンツで治療することができます。エファビレンツのシトクロム P450 を介した広範な代謝と、肝障害のある患者の臨床経験が限られているため、これらの患者に SUSTIVA を投与する際には注意が必要です。 警告と注意事項 と 臨床薬理学 ]。
過剰摂取
誤って 600 mg を 1 日 2 回服用した一部の患者は、神経系の症状の増加を報告しています。 1 人の患者は、不随意の筋肉収縮を経験しました。
SUSTIVA 200mg による過剰摂取の治療は、バイタル サインのモニタリングや患者の臨床状態の観察など、一般的な支援措置で構成する必要があります。活性炭の投与は、吸収されなかった薬物の除去を助けるために使用することができます。サスティバの過剰摂取に対する特効薬はありません。エファビレンツはタンパク質と高度に結合しているため、透析によって血液から薬剤が大幅に除去される可能性は低いです。
禁忌
- サスティバは、この製品のいずれかの成分に対して臨床的に重大な過敏症(スティーブンス・ジョンソン症候群、多形紅斑、中毒性皮膚発疹など)が以前に示された患者には禁忌です。
- エファビレンツとエルバスビルおよびグラゾプレビルの併用は禁忌です [ 警告と注意事項 と 薬物相互作用 ]。
臨床薬理学
作用機序
エファビレンツは抗ウイルス薬です [参照 微生物学 ]。
薬力学
心臓電気生理学
QTc 間隔に対する SUSTIVA 600mg の効果は、CYP2B6 多型が豊富な 58 人の健康な被験者を対象に、非盲検、陽性およびプラセボ対照、固定単一シーケンス 3 期間、3 治療クロスオーバー QT 研究で評価されました。 CYP2B6 *6/*6 遺伝子型の被験者におけるエファビレンツの平均 Cmax は、CYP2B6 *1/*1 遺伝子型の被験者で観察された平均 Cmax の 2.25 倍でした。エファビレンツ濃度とQTc延長の間に正の関係が観察されました。濃度と QTc の関係に基づくと、CYP2B6*6/*6 遺伝子型の被験者で 14 日間 600 mg の 1 日用量を投与した後の平均 QTc 延長とその上限 90% 信頼区間は 8.7 ms および 11.3 ms である [参照 警告と注意事項 ]。
薬物動態
吸収
感染していないボランティアに 100 mg から 1600 mg を単回経口投与すると、5 時間後に 1.6 ~ 9.1 μM のピーク エファビレンツ血漿濃度が達成されました。 Cmax と AUC の用量依存的な増加は、1600 mg までの用量で見られました。増加は比例よりも小さく、高用量での吸収の減少を示唆しています。
定常状態の HIV-1 感染患者では、平均 Cmax、平均 Cmin、および平均 AUC は、200 mg、400 mg、および 600 mg の 1 日用量に比例して用量に比例しました。血漿濃度がピークに達するまでの時間は約 3 ~ 5 時間で、6 ~ 10 日で定常状態の血漿濃度に達しました。サスティバ 600 mg を 1 日 1 回投与された 35 人の患者では、定常状態の Cmax は 12.9 ± 3.7 μM (平均値 ± SD)、定常状態の Cmin は 5.6 ± 3.2 μM、AUC は 184 ± 73 μM·h でした。
経口吸収に対する食物の影響:
カプセル
高脂肪/高カロリーの食事 (894 kcal、脂肪 54 g、脂肪から 54% のカロリー) または低脂肪/通常カロリーの食事 (440 kcal、2 g脂肪、脂肪からのカロリー 4%) は、絶食条件下で与えられた場合に達成された曝露と比較して、エファビレンツ AUC∞ の平均 22% および 17% の増加、エファビレンツ Cmax の平均 39% および 51% の増加とそれぞれ関連していた. [見る 投薬と管理 と 患者情報 .]
錠剤
高脂肪/高カロリーの食事 (約 1000 kcal、脂肪から 500 ~ 600 kcal) を含むエファビレンツ 600 mg 錠剤 1 錠の投与は、エファビレンツの平均 AUC∞ の 28% 増加および平均 AUC∞ の 79% 増加と関連していました。絶食条件下で達成された曝露に対するエファビレンツのCmax。 [見る 投薬と管理 と 患者情報 .]
食品ビヒクルと混合したカプセル内容物のバイオアベイラビリティ
健康な成人被験者において、エファビレンツの AUC は、小さじ 2 杯の特定の食品媒体 (アップルソース、グレープ ゼリー、ヨーグルト、または乳児用調合乳) と混合された 3 つの 200 mg カプセルの内容物として投与された場合、投与された無傷のカプセル製剤の AUC の生物学的同等性基準を満たしました。絶食条件下で。
分布
エファビレンツは、主にアルブミンであるヒト血漿タンパク質に強く結合します (約 99.5 ~ 99.75%)。サスティバ 200 ~ 600 mg を 1 日 1 回、少なくとも 1 か月間投与された HIV-1 感染患者 (n=9) の脳脊髄液濃度は、対応する血漿濃度の 0.26 ~ 1.19% (平均 0.69%) の範囲でした。この割合は、血漿中のエファビレンツの非タンパク質結合 (遊離) 画分の約 3 倍です。
代謝
ヒトでの研究およびヒト肝ミクロソームを使用した in vitro 研究により、エファビレンツは主にシトクロム P450 システムによってヒドロキシル化代謝物に代謝され、続いてこれらのヒドロキシル化代謝物がグルクロン酸抱合されることが実証されました。これらの代謝産物は、HIV-1 に対して本質的に不活性です。 in vitro 研究は、CYP3A と CYP2B6 がエファビレンツ代謝に関与する主要なアイソザイムであることを示唆しています。
エファビレンツは CYP 酵素を誘導し、それ自体の代謝を誘導することが示されています。 1 日あたり 200 ~ 400 mg を 10 日間複数回投与すると、蓄積の程度が予測より低くなり (22 ~ 42% 低下)、最終半減期は 40 ~ 55 時間 (単回投与の半減期は 52 ~ 76 時間) に短縮されました。 )。
排除
エファビレンツの終末半減期は、単回投与で 52~76 時間、複数回投与で 40~55 時間です。 1 か月間の物質収支/排泄研究は、1 日あたり 400 mg を使用し、8 日目に C 標識用量を投与して実施されました。放射性標識の約 14 ~ 34% が尿中に回収され、16 ~ 61% が糞便中に回収されました。 .放射性標識された薬物の尿中排泄のほぼすべてが代謝産物の形であった.エファビレンツは、糞便で測定された総放射能の大部分を占めていました。
特別な集団
小児科
小児患者における定常状態でのエファビレンツの薬物動態パラメータは、集団薬物動態モデルによって予測され、推奨用量に対応する重量範囲ごとに表 6 にまとめられています。
性別と人種
患者におけるエファビレンツの薬物動態は、男性と女性の間、および調査された人種間で類似しているようです。
腎障害
エファビレンツの薬物動態は、腎不全患者で研究されていません。ただし、エファビレンツの 1% 未満が変化せずに尿中に排泄されるため、エファビレンツの排泄に対する腎障害の影響は最小限に抑えられるはずです。
肝障害
反復投与試験では、コントロールと比較して、軽度の肝障害 (Child-Pugh クラス A) の患者におけるエファビレンツの薬物動態に対する有意な影響は示されませんでした。中等度または重度の肝障害 (Child-Pugh クラス B または C) がエファビレンツの薬物動態に影響を与えるかどうかを判断するには、データが不十分でした。
薬物相互作用研究
エファビレンツは in vivo で肝酵素誘導を引き起こすことが示されているため、CYP3A および CYP2B6 によって代謝されるいくつかの薬物の生体内変化が増加します。 in vitro 試験では、エファビレンツが CYP アイソザイム 2C9 および 2C19 を、観察されたエファビレンツ血漿濃度範囲の Ki 値 (8.5 ~ 17 μM) で阻害することが示されました。 in vitro 研究では、エファビレンツは CYP2E1 を阻害せず、CYP2D6 および CYP1A2 (Ki 値 82 ~ 160 μM) を阻害したのは、臨床的に達成された濃度をはるかに上回る濃度のみでした。エファビレンツと CYP2C9、CYP2C19、CYP3A、または CYP2B6 アイソザイムによって主に代謝される薬物との同時投与は、同時投与された薬物の血漿濃度の変化をもたらす可能性があります。 CYP3A および CYP2B6 活性を誘導する薬剤は、エファビレンツのクリアランスを増加させ、血漿濃度を低下させると予想されます。
薬物相互作用研究は、エファビレンツと併用される可能性が高い他の薬物、または薬物動態学的相互作用のプローブとして一般的に使用される薬物を使用して実施されました。 Cmax、AUC、および Cmin に対するエファビレンツの同時投与の効果を、表 7 (他の薬物に対するエファビレンツの効果) および表 8 (エファビレンツに対する他の薬物の効果) に要約します。臨床上の推奨事項に関する情報については、以下を参照してください。 薬物相互作用 .
微生物学
作用機序
エファビレンツは HIV-1 の NNRTI です。エファビレンツ活性は、主に HIV-1 逆転写酵素の非競合的阻害によって媒介されます。 HIV-2 逆転写酵素およびヒト細胞 DNA ポリメラーゼ α、β、γ、および δ は、エファビレンツによって阻害されません。
細胞培養における抗ウイルス活性
細胞培養における野生型実験室適合株および臨床分離株の複製を90~95%阻害するエファビレンツの濃度(EC90~95)は、リンパ芽球様細胞株、末梢血単核細胞(PBMC)、およびマクロファージにおいて1.7~25nMの範囲であった/単球培養。エファビレンツは、クレード B およびほとんどの非クレード B 分離株 (サブタイプ A、AE、AG、C、D、F、G、J、N) に対して抗ウイルス活性を示しましたが、グループ O ウイルスに対する抗ウイルス活性は低下していました。エファビレンツは、NNRTI のデラビルジンおよびネビラピン、NRTI(アバカビル、ジダノシン、エムトリシタビン、ラミブジン、スタブジン、テノホビル、ザルシタビン、ジドブジン)、PI(アンプレナビル、インジナビル、ロピナビル、ネルフィナビル、リトナビル、サキナビル)、および融合阻害剤エンフビルチド。エファビレンツは、アタザナビルとの細胞培養において拮抗的な抗ウイルス活性に相加的であることを示しました。エファビレンツは、B型肝炎ウイルス感染症の治療に使用されるアデフォビル、またはC型肝炎ウイルス感染症の治療にインターフェロンと組み合わせて使用されるリバビリンと拮抗しませんでした.
抵抗
細胞培養において
細胞培養では、エファビレンツに対する感受性が低下した (EC90 値が 380 倍以上増加した) HIV-1 分離株が、薬剤の存在下で急速に出現しました。これらのウイルスの遺伝子型の特徴付けにより、逆転写酵素の単一アミノ酸置換 L100I または V179D、二重置換 L100I/V108I、および三重置換 L100I/V179D/Y181C が特定されました。
臨床研究
細胞培養においてエファビレンツに対する感受性が低下した臨床分離株が得られた。逆転写酵素のアミノ酸位置 98、100、101、103、106、108、188、190、225、および 227 での 1 つまたは複数の置換が、エファビレンツとインジナビルの併用、またはジドブジンとラミブジンの併用による治療に失敗した患者で観察されました。 K103N 置換が最も頻繁に観察されました。長期耐性サーベイランス (平均 52 週間、範囲 4 ~ 106 週間) では、28 の一致するベースライン分離株とウイルス学的失敗分離株が分析されました。これらの失敗した分離株の 61% (17/28) は、参照からのエファビレンツ感受性 (EC50 値) の中央値 88 倍の変化で、細胞培養におけるエファビレンツ感受性が減少しました。これらの患者分離株で発生する最も頻繁な NNRTI 置換は K103N (54%) でした。開発されたその他の NNRTI 置換には、L100I (7%)、K101E/Q/R (14%)、V108I (11%)、G190S/T/A (7%)、P225H (18%)、および M230I/L (11 %)。
交差抵抗
NNRTI 間の交差耐性が観察されています。以前にエファビレンツ耐性として特徴付けられた臨床分離株は、ベースラインと比較して、デラビルジンおよびネビラピンに対して細胞培養で表現型的にも耐性がありました。 NNRTI耐性関連置換(A98G、L100I、K101E/P、K103N/S、V106A、Y181X、Y188X、G190X、P225H、F227L、またはM230L)を有するデラビルジンおよび/またはネビラピン耐性臨床ウイルス分離株は、エファビレンツに対する感受性の低下を示した細胞培養で。細胞培養でテストされた NRTI 耐性の臨床分離株の 90% 以上が、エファビレンツに対する感受性を保持していました。
動物毒物学
エファビレンツを投与されたサル 20 匹中 6 匹で非持続性のけいれんが観察され、血漿 AUC 値は推奨用量のヒトよりも 4 倍から 13 倍大きくなりました [参照 警告と注意事項 ]。
臨床研究
大人
研究006 無作為化非盲検試験で、SUSTIVA (600 mg 1 日 1 回) + ジドブジン (ZDV、300 mg q12h) + ラミブジン (LAM、150 mg q12h) または SUSTIVA (600 mg 1 日 1 回) + インジナビル (IDV、1000 mg) を比較q8h) インジナビル (800 mg q8h) + ジドブジン (300 mg q12h) + ラミブジン (150 mg q12h)。 1266 人の患者 (平均年齢 36.5 歳 [範囲 18-81]、白人 60%、男性 83%) が登録されました。すべての患者は、試験登録時にエファビレンツ、ラミブジン、NNRTI、および PI の投与を受けていませんでした。ベースラインの CD4+ 細胞数の中央値は 320 細胞/mm3 で、ベースラインの HIV-1 RNA レベルの中央値は 4.8 log コピー/mL でした。 48 週および 168 週までの標準アッセイ (アッセイ限界 400 コピー/mL) による治療結果を表 9 に示します。血漿 HIV RNA レベルは、標準 (アッセイ限界 400 コピー/mL) および超高感度 (アッセイ限界 50 コピー/mL) で定量化されました。 AMPLICOR HIV-1 MONITOR アッセイのバージョン。研究中に、バージョン 1.5 のアッセイがヨーロッパで導入され、非クレード B ウイルスの検出が強化されました。
SUSTIVA + ジドブジン + ラミブジン、SUSTIVA + インジナビル、またはインジナビル + ジドブジン + ラミブジンで治療された患者では、HIV-1 RNA が 50 コピー/mL 未満の応答者の割合は、48 までにそれぞれ 65%、50%、および 45% でした。週間、および 168 週間まで、それぞれ 43%、31%、および 23%。ウイルス学的反応が失われるまでの時間 (HIV RNA
ACTG 364 これは、2 つの ACTG 研究を完了した NRTI 経験のある患者を対象とした、無作為化、二重盲検、プラセボ対照、48 週間の研究です。 196 人の患者 (平均年齢 41 歳 [範囲 18 ~ 76]、白人 74%、男性 88%) が、SUSTIVA (600 mg 1 日 1 回) またはネルフィナビル (NFV、750 mg 1 日 3 回) と組み合わせて NRTI を投与されました。 )、または SUSTIVA (600 mg 1 日 1 回) + ネルフィナビルを無作為化二重盲検法で投与します。平均ベースライン CD4+ 細胞数は 389 細胞/mm3 であり、平均ベースライン HIV-1 RNA レベルは 8130 コピー/mL でした。研究への登録時に、すべての患者は、以前の NRTI 治療経験に依存する新しい非盲検 NRTI レジメンを割り当てられました。治療群間で平均 CD4+ 細胞数に有意差はありませんでした。試験レジメンを継続した患者では、全体の平均増加は 48 週で約 100 個でした。治療結果を表 10 に示します。血漿 HIV RNA レベルは、500 コピー/mL の定量下限を使用して AMPLICOR HIV-1 MONITOR アッセイで定量化されました。
72 週間にわたる治療失敗までの時間の Kaplan-Meier 分析では、SUSTIVA を含む治療群でより長いウイルス抑制期間 (HIV RNA
小児患者
AI266922 試験は、抗レトロウイルス薬未使用および経験のある小児患者を対象に、ジダノシンおよびエムトリシタビンと組み合わせた SUSTIVA 200mg の薬物動態、安全性、忍容性、および抗ウイルス活性を評価する非盲検試験です。生後 3 か月から 6 歳(中央値 0.7 歳)の 37 人の患者が SUSTIVA で治療されました。ベースラインでは、血漿 HIV-1 RNA の中央値は 5.88 log コピー/mL、CD4+ 細胞数の中央値は 1144 細胞/mm3、CD4+ パーセンテージの中央値は 25% でした。試験治療期間の中央値は 60 週間でした。患者の 27% が 48 週前に中止しました。ITT 分析を使用すると、48 週の時点で HIV RNA が 400 コピー/mL 未満および 50 コピー/mL 未満の患者の全体的な割合は、57% (21/37) および 46% (17/ 37)、それぞれ。 48 週での CD4+ 数のベースラインからの増加の中央値は 196 細胞/mm3 であり、CD4+ パーセンテージの増加の中央値は 6% でした。
PACTG 1021試験は、抗レトロウイルス療法を受けていない小児患者を対象に、ジダノシンおよびエムトリシタビンと併用したSUSTIVA 200mgの薬物動態、安全性、忍容性、および抗ウイルス活性を評価する非盲検試験です。生後 3 か月から 21 歳までの 43 人の患者 (中央値 9.6 歳) に SUSTIVA が投与されました。ベースラインでは、血漿 HIV-1 RNA の中央値は 4.8 log コピー/mL、CD4+ 細胞数の中央値は 367 細胞/mm3、CD4+ パーセンテージの中央値は 18% でした。試験治療期間の中央値は 181 週間でした。患者の 16% が 48 週前に中止しました。ITT 分析を使用すると、48 週の時点で HIV RNA が 400 コピー/mL 未満および 50 コピー/mL 未満の患者の全体的な割合は、77% (33/43) および 70% (30/30/mL) でした。 43)、それぞれ。 48 週間の治療での CD4+ 数のベースラインからの増加の中央値は 238 細胞/mm3 であり、CD4+ パーセンテージの増加の中央値は 13% でした。
PACTG 382 試験は、抗レトロウイルス未治療および NRTI 経験のある小児患者を対象に、ネルフィナビルおよび NRTI と組み合わせた SUSTIVA の薬物動態、安全性、忍容性、および抗ウイルス活性を評価する非盲検試験でした。生後 3 か月から 16 歳までの 102 人の患者 (中央値 5.7 歳) が SUSTIVA で治療されました。患者の 87% は以前に抗レトロ ウイルス療法を受けていた。ベースラインでは、血漿 HIV-1 RNA の中央値は 4.57 log コピー/mL、CD4+ 細胞数の中央値は 755 細胞/mm3、CD4+ パーセンテージの中央値は 30% でした。試験治療期間の中央値は 118 週間でした。患者の 25% が 48 週前に中止しました。ITT 分析を使用すると、48 週の時点で HIV RNA が 400 コピー/mL 未満および 50 コピー/mL 未満であった患者の全体的な割合は、57% (58/102) および 43% (44/ 102)、それぞれ。治療の 48 週間での CD4+ 数のベースラインからの増加の中央値は 128 細胞/mm3 であり、CD4+ パーセンテージの増加の中央値は 5% でした。
患者情報
サスティバ® (sus-TEE-vah) (efavirenz) カプセル
サスティバ® (sus-TEE-vah) (エファビレンツ) 錠
重要:サスティバと一緒に服用してはいけない薬について、医師または薬剤師に相談してください。 詳細については、セクションを参照してください。 「SUSTIVAを服用する前に医師に何を伝えるべきですか?」
サスティバの服用を開始する前、および補充を受けるたびに、この患者情報をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医師と話すことに代わるものではありません。
サスティバとは?
SUSTIVA 600mg は、HIV-1 (ヒト免疫不全ウイルス 1 型) の処方薬であり、成人および生後 3 か月以上で体重が 7 ポンド 12 オンス (3.5 kg)。 HIV は、エイズ (後天性免疫不全症候群) を引き起こすウイルスです。
SUSTIVA が生後 3 か月未満の子供、または体重が 7 ポンド 12 オンス (3.5 kg) 未満の子供に安全で効果があるかどうかはわかっていません。
HIV-1 感染症を治療するために他の抗レトロウイルス薬と併用すると、SUSTIVA 600mg は以下の効果が期待できます。
- 血液中の HIV-1 の量を減らします。これをウイルス負荷と呼びます。
- 血液中の CD4+ (T) 細胞の数を増やし、他の感染症と戦うのに役立ちます。
HIV-1 の量を減らし、血液中の CD4+ (T) 細胞を増やすと、免疫システムが改善される可能性があります。これにより、死亡のリスクや、免疫システムが弱いときに起こりうる感染症 (日和見感染) にかかるリスクを減らすことができます。
SUSTIVA 600mg は HIV-1 感染症や AIDS を治すものではありません。 HIV-1 感染を制御し、HIV 関連の病気を減らすために、HIV-1 薬を服用し続ける必要があります。
HIV-1 感染を他の人に広める可能性のある行為は避けてください。
- 針やその他の注射器具を共有したり、再利用したりしないでください。
- 歯ブラシやカミソリの刃など、血液や体液が付着している可能性のある身の回り品を共有しないでください。
- 保護なしでいかなる種類のセックスもしないでください。ラテックスまたはポリウレタンのコンドームを使用して、精液、膣分泌物、または血液などの体液との性的接触の可能性を下げることにより、より安全なセックスを常に実践してください.
他の人への HIV の感染を防ぐ方法について質問がある場合は、医師に相談してください。
SUSTIVA 600mgを服用してはいけない人は?
エファビレンツまたはサスティバのいずれかの成分にアレルギーがある場合は、サスティバを服用しないでください。サスティバの全成分リストについては、このリーフレットの最後をご覧ください。
現在エルバスビルとグラゾプレビル(ZEPATIER®)を服用している場合は、サスティバを服用しないでください。
SUSTIVA 200mgを服用する前に医師に何を伝えるべきですか?
サスティバを服用する前に、病状があるかどうか、特に次の場合は医師に相談してください。
- 心臓病がある
- メンタルヘルスの問題を抱えたことがある
- ストリートドラッグや大量のアルコールを使用したことがある
- B型またはC型肝炎ウイルス感染を含む肝臓の問題がある
- 発作の歴史がある
- 妊娠している、または妊娠する予定がある。 SUSTIVA 600mg は胎児に害を及ぼす可能性があります。妊娠できる場合は、SUSTIVA を開始する前に、かかりつけの医療提供者が妊娠検査を行う必要があります。サスティバの服用中およびサスティバの服用中止後12週間は妊娠しないでください。 妊娠可能な女性は、治療中およびサスティバの治療中止後 12 週間、2 つの効果的な避妊法を使用する必要があります。 避妊のバリア形式は、常に別のタイプの避妊と一緒に使用する必要があります。
- 避妊のバリア形式には、ラテックスまたはポリウレタンのコンドーム、避妊用スポンジ、殺精子剤を含む横隔膜、および子宮頸管キャップが含まれる場合があります。
- サスティバによる治療中は、経口避妊薬、注射、膣リング、インプラントなどのホルモン剤による避妊が機能しない場合があります。
- サスティバによる治療中に使用できる避妊法については、担当の医師にご相談ください。
- 妊娠登録。 妊娠中に抗レトロウイルス薬を服用している女性のための妊娠登録があります。このレジストリの目的は、あなたと赤ちゃんの健康に関する情報を収集することです。このレジストリに参加する方法については、医師に相談してください。
- サスティバを服用している場合は、授乳しないでください。
- 赤ちゃんに HIV が感染する危険性があるため、HIV に感染している場合は母乳育児を行うべきではありません。
服用しているすべての薬について、医師と薬剤師に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
サスティバ 600mg は他の薬の作用に影響を与える可能性があり、他の薬はサスティバ 600mg の作用に影響を与える可能性があります。 重大な副作用を引き起こす可能性があります。サスティバと一緒に特定の薬を服用している場合、体内のサスティバ 600mg の量が少なすぎて、HIV 感染の制御に役立たない可能性があります。体内の HIV ウイルスは、SUSTIVA や類似の HIV 治療薬に対して耐性を持つようになる可能性があります。
アトリプラを服用している場合は、サスティバ 600mg を服用しないでください。 (エファビレンツ、エムトリシタビン、テノホビル ジソプロキシル フマル酸塩)医師の指示がない限り。
服用しているすべての薬について、医師と薬剤師に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。一部の医薬品はサスティバと相互作用します。
医師や薬剤師に見せるために、あなたの薬のリストを保管してください。
- サスティバと相互作用する薬のリストについては、医師または薬剤師にお尋ねください。
- 医師に告げずに新しい薬の服用を開始しないでください。 SUSTIVA を他の薬と一緒に服用しても安全かどうかは、担当の医師に相談してください。
サスティバの服用方法は?
- サスティバ 600mg を医師の指示どおりに服用してください。
- 医師の指示がない限り、用量を変更したり、SUSTIVA の服用を中止したりしないでください。
- SUSTIVA による治療中は、医師の診察を受けてください。
- SUSTIVA は、他の抗レトロウイルス薬と併用する必要があります。
- サスティバを 1 日 1 回服用してください。
- SUSTIVA は錠剤またはカプセルとして提供されます。
- サスティバ錠は壊れてはいけません。
- サスティバの錠剤またはカプセルを液体と一緒に丸ごと飲み込んでください。
サスティバの服用方法とタイミング。
- サスティバ 600mg は、就寝前の空腹時に服用してください。サスティバ 200mg を食事と一緒に服用すると、体内の薬の量が増加します。 SUSTIVA 600mgを空腹時と就寝前に服用すると、いくつかの副作用が軽減される可能性があります.
- お子様の医師は、お子様の体重に基づいて、サスティバ 200mg の適切な用量を処方します。
- 錠剤やカプセルを飲み込むのが困難な場合は、医師に相談してください。主治医は、SUSTIVA カプセルを開封し、内容物を食品または乳児用調合乳と混合することを推奨する場合があります。 この患者向け情報の最後にある詳細な「使用説明書」を参照して、カプセル散布法を使用した SUSTIVA 600mg の正しい服用方法を学んでください。
- サスティバ 600mg をカプセル散水法で服用する成人および小児は、サスティバ服用後 2 時間は食事を摂らないでください。
- カプセル散布法を使用してサスティバを服用した後、2 時間は乳児に粉ミルクを与えないでください。
- SUSTIVAの服用をお見逃しなく。サスティバを飲み忘れた場合は、次の服用時間が近い場合を除き、すぐに飲み忘れた分を服用してください。一度に2回服用しないでください。定期的に予定されている時間に次の用量を服用してください。薬を服用するのに最適な時期を計画するのに助けが必要な場合は、医師または薬剤師に相談してください.
- SUSTIVA の服用量が多すぎる場合は、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
- SUSTIVA 600mg の供給量が少なくなり始めたら、医師または薬局から追加購入してください。 SUSTIVAを使い切らないことが大切です。たとえ短時間でも薬を中止すると、血液中の HIV-1 の量が増加することがあります。ウイルスはサスティバ 600mg に耐性を持ち、治療が難しくなる可能性があります。
サスティバの副作用の可能性は?
SUSTIVA 600mg は、次のような重大な副作用を引き起こす可能性があります。
めまい、集中力の低下、または眠気がある場合は、車を運転したり、機械を使用したり、注意が必要なことをしたりしないでください。
サスティバ 600mg の投与開始から数か月から数年後に、一部の神経系の症状(錯乱、思考や身体の動きの鈍化、妄想 [誤った信念] または幻覚 [他の人が見たり聞いたりしないものを見たり聞いたりする] など)が発生することがあります。これらの症状のいずれかが発生した場合は、すぐに医療提供者に連絡してください。
次のいずれかの症状が現れた場合は、すぐに医師に相談してください。
- 深刻なメンタルヘルスの問題 サスティバを服用している人に起こる可能性があります。次のいずれかの症状がある場合は、すぐに医師に相談してください。
- 悲しんだり絶望したりする 他人を信用しない
- 不安や落ち着きのなさを感じる 現実ではないものを聞いたり見たりする
- 自分自身を傷つける(自殺)という考えを持っている、または自分自身や他の人を傷つけようとした
- 普通に動いたり話したりできない
- 真実または現実と、虚偽または非現実の違いを見分けることができない
- 神経系の症状 サスティバ 200mg を服用している人によく見られ、重症化する可能性があります。これらの症状は、通常、サスティバ 200mg による治療の 1 日目または 2 日目に始まり、通常、治療の 2 ~ 4 週間後に消失します。サスティバの治療を開始してから数か月から数年後に、いくつかの症状が現れることがあります。これらの症状は、サスティバの治療中にアルコールを飲んだり、メンタルヘルスの問題のための薬を服用したり、特定の市販薬を使用したりすると、悪化する可能性があります.症状には次のものがあります。
- めまい
- 集中できない
- 寝られない
- 眠気
- 珍しい夢
- 調整の欠如またはバランスの難しさ
- 皮膚発疹 サスティバ 600mg で一般的ですが、時には重度になることもあります。皮膚発疹は通常、治療を変更しなくても治ります。次の症状のいずれかを伴う発疹が発生した場合は、すぐに医師に相談してください。
- かゆみの有無にかかわらず、皮膚の発疹
- ピーリングスキン
- 熱
- 口内炎
- お顔のむくみ
- 「ピンクアイ」(結膜炎)のような赤目または炎症を起こした目
- 水疱または皮膚病変
- 肝不全および死亡を含む肝障害 サスティバを服用している人に起こる可能性があります。肝臓の問題は、肝臓の問題の病歴がない人でも発生する可能性があります. SUSTIVA 200mgを開始する前と治療中に、医師は肝臓をチェックするために血液検査を行います.
- 皮膚や白目の部分が黄色くなる(黄疸)
- 数日以上食べ物を食べたくない
- 尿が濃くなる
- 胃がむかつく(吐き気)
- あなたの排便(便)の色が明るくなります
- 下腹部(腹部)が痛い
- 発作 サスティバを服用している人に起こる可能性があります。過去に発作を起こしたことがある場合は、発作が起こる可能性が高くなります。発作を起こしたことがある場合、または発作を防ぐために薬を服用している場合は、医師に相談してください。
- 免疫系の変化 (免疫再構築症候群) HIV-1 の薬を飲み始めると起こります。免疫システムが強化され、長い間体内に隠れていた感染症と闘い始める可能性があります。 HIV-1 薬の服用を開始した後に新たな症状が出始めた場合は、医師に相談してください。
- 体脂肪の変化 HIV-1 の薬を服用している人に起こる可能性があります。これらの変化には、背中上部と首 (「バッファローハンプ」)、胸、および体の主要部分 (胴体) の周りの脂肪量の増加が含まれる場合があります。脚、腕、顔からの脂肪の損失も発生する可能性があります。これらの状態の原因と長期的な健康への影響はわかっていません。
サスティバ 600mg の最も一般的な副作用は次のとおりです。
- 発疹
- 異常な夢
- めまい
- 疲れ
- 吐き気
- 寝られない
- 頭痛
- 嘔吐
- 集中困難
サスティバを服用している一部の患者は、血液中の脂質(コレステロールおよびトリグリセリド)レベルの上昇を経験しています.気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、SUSTIVA の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
サスティバの保管方法は?
- サスティバのカプセルおよび錠剤は、20°C ~ 25°C (68°F ~ 77°F) の室温で保管してください。
サスティバとすべての医薬品は、子供の手の届かないところに保管してください。
サスティバに関する一般情報
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。サスティバ 600mg は、処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、サスティバ 600mg を与えないでください。それらに害を及ぼす可能性があります。
さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた SUSTIVA に関する情報については、薬剤師または医師にお尋ねください。詳細については、www.sustiva.com にアクセスするか、1-800-321-1335 までお電話ください。
サスティバの成分は?
有効成分: エファビレンツ
不活性成分:
サスティバ 600mg カプセル: ラクトース一水和物、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、デンプングリコール酸ナトリウム。カプセルシェルには、ゼラチン、ラウリル硫酸ナトリウム、二酸化チタン、および/または黄酸化鉄が含まれています。カプセルシェルは、二酸化ケイ素も含み得る。カプセルは、カーミン 40 ブルー、FD&C ブルー No. 2、二酸化チタンを含むインクで印刷されています。
サスティバ錠: クロスカルメロースナトリウム、ヒドロキシプロピルセルロース、ラクトース一水和物、ステアリン酸マグネシウム、微結晶性セルロース、およびラウリル硫酸ナトリウム。錠剤のフィルムコーティングには、オパドライイエローとオパドライクリアが含まれています。錠剤はカルナバワックスで磨かれ、紫色のインク Opacode WB で印刷されています。
この患者情報は、米国食品医薬品局によって承認されています。
使用説明書
サスティバ® (sus-TEE-vah) (efavirenz) カプセル
サスティバ 600mg カプセル散布法による調合
カプセル散布法を使用して食品または乳児用調合乳と混合した SUSTIVA の最初の用量を準備する前、補充を入手するたび、および必要に応じて、この使用説明書をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医師に相談する代わりにはなりません。サスティバ 200mg のカプセル散布法による混合または投与方法について不明な点がある場合は、医師または薬剤師に相談してください。
重要な情報:
- SUSTIVA 600mg カプセルの詳細については、患者情報リーフレットを参照してください。
- サスティバカプセルの内容物をソフトフードまたは乳児用調合乳と混合するカプセルスプリンクル法は、カプセルまたは錠剤を飲み込むことができない大人または子供に使用することができます.
- サスティバ 600mg は、就寝前の空腹時に服用してください。
- サスティバを食品に混ぜて服用後、2時間は飲食を控えてください。
- 食べ物を飲み込める年齢になった乳児には、乳児用調製粉乳の代わりに食べ物と混合したカプセル散布法を使用してサスティバを投与する必要があります。
- カプセル散布法を使用して乳児用調合乳と混合したサスティバを赤ちゃんに与えるための最良のスケジュールを決定するために、医師に相談してください。
サスティバ600mgをカプセルふりかけ法で食事に混ぜて調合します。
サスティバ 200mg をカプセル スプリンクル方式で食品と混合して調合する前に、次の備品を用意してください。
- ペーパータオル
- 計量用小さじ
- かき混ぜたり食べたりするための小さなスプーン
- 小さな きれいな容器( 小さな カップまたはボウル)
- アップルソース、グレープゼリー、ヨーグルトなどの柔らかい食べ物
ステップ1。 清潔で平らな作業面を選択してください。作業面にきれいなペーパー タオルを置きます。次に、ペーパー タオルの上に他の用品を置きます。
ステップ2。 手をよく洗って乾かしてください。
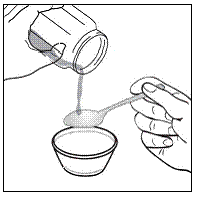
ステップ 3。 アップルソース、ぶどうゼリー、ヨーグルトなどの柔らかい食品をティースプーン 1 ~ 2 杯を小さな容器に入れます( 図A )。薬との混合により、食品の色や厚みが変化することがあります。
図A
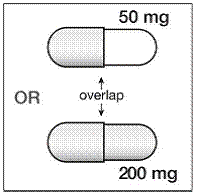
ステップ 4。 SUSTIVA 200mg カプセルは 2 つの部分で構成されています。 SUSTIVA カプセルを見て、カプセルのどの部分が他の部分と重なっているかを確認します ( 図 B )。
図 B
ステップ 5。 SUSTIVA カプセルを食品容器の真上で横向き (水平) の位置に保持します。親指と人差し指(人差し指)でサスティバカプセルの両端を持ちます。 図 C )。
図 C
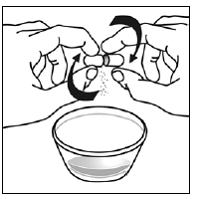
ステップ6。 親指と人差し指で、サスティバ 600mg カプセルの重なっている部分の端付近をつまみます (参照)。 図 D )。
図 D
次に、サスティバ 600mg カプセルの両端を慎重に反対方向にひねり、カプセルを開きます (参照)。 図E )。カプセルの内容物をこぼしたり、空気中にまき散らさないようご注意ください。
図E

ステップ 7。 サスティバカプセルの中身を食品にふりかけます(参照) 図 F )。
- カプセルの殻が空であることを確認してください。
- 空のカプセル シェルを捨てます。
図 F

総処方量が 1 カプセルを超える場合は、カプセルごとにステップ 4 から 7 に従ってください。それ以上食べ物を追加しないでください。
手順 8 ~ 11 を完了する必要があります。 30分以内 薬を混合する(を参照) 図G )。
図G

ステップ 8. 小さなスプーンを使用して、カプセルの内容物と食品を穏やかに混ぜ合わせます (参照)。 図 H )。ふりかけは溶けません。混合物は粒状に見えますが、塊になってはいけません。
図 H
ステップ 9。 小さなスプーンを使用して、食品とカプセルの内容物の混合物を与えたり、摂取したりします。混合物がすべて飲み込まれたことを確認してください。
ステップ10。 空の容器に約小さじ 2 杯の食品を追加し、小さなスプーンでやさしくかき混ぜて、まだ容器に残っている可能性のあるカプセルの内容物と混ぜ合わせます。
ステップ11。 小さなスプーンを使用して、食品とカプセルの内容物の混合物を与えたり、摂取したりします。混合物がすべて飲み込まれたことを確認してください。
ステップ12。 容器とスプーンを洗います。ペーパー タオルを捨てて、作業面をきれいにします。手を洗いなさい。
サスティバ 600mg をカプセルスプリンクル法で調合乳に調合
赤ちゃんがすべての薬を確実に摂取できるように、SUSTIVA カプセルの内容物を哺乳瓶で赤ちゃんに与えないでください。
カプセル散布法を使用して乳児用調合乳と混合した SUSTIVA の用量を準備する前に、次の備品を用意してください。
- ペーパータオル
- かき混ぜて計量するためのティースプーン
- 小さな きれいな容器( 小さな カップまたはボウル)(参照 図Ⅰ )。
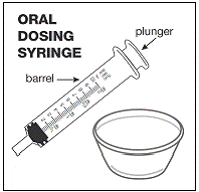
- 10 mL の経口投与シリンジ (これについては薬剤師にお尋ねください) ( 図Ⅰ )。
- 乳児用調合乳を室温で。
図Ⅰ
ステップ1。 粉ミルクのパッケージの指示に従って、粉ミルクを準備します。約 1 オンスのフォーミュラを使用して薬を投与します。残りの調合乳は 2 時間子供に与えてはなりません。
ステップ2。 清潔で平らな作業面を選択してください。作業面にきれいなペーパー タオルを置きます。必要な備品をペーパータオルの上に置きます。
ステップ 3。 手をよく洗って乾かしてください。
ステップ 4。 小さじ 2 杯の室温の乳児用調合乳を容器に注ぎます( 図J )。
図J
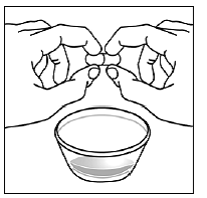
ステップ 5。 SUSTIVA カプセルは 2 つのパーツで構成されています。 SUSTIVA カプセルを見て、カプセルのどの部分が他の部分と重なっているかを確認します ( 図K )。
図K
ステップ6。 サスティバ カプセルを乳児用調合乳の入った容器の真上で横向き (水平) の位置に置きます。サスティバ 600mg カプセルの両端を親指と人差し指で持ちます。 図L )。
図L
ステップ 7。 親指と人差し指で、SUSTIVA カプセルの重なっている部分の端付近をつまみます (参照)。 図M )。
図M
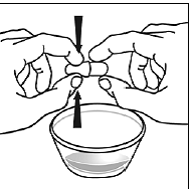
次に、SUSTIVA カプセルの両端を慎重に反対方向にひねり、カプセルを開きます (参照)。 図N )。カプセルの内容物をこぼしたり、空気中にまき散らさないようご注意ください。
図N
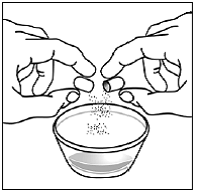
ステップ 8. サスティバ 600mg カプセルの内容物を粉ミルクにふりかけます。 図 O )。
- カプセルの殻が空であることを確認してください。
- 空のカプセル シェルを捨てます。
図 O
総処方量が 1 カプセルを超える場合は、カプセルごとにステップ 5 から 8 に従ってください。乳児用調合乳を追加しないでください。
手順 9 ~ 12 を完了する必要があります。 30分以内 薬を混合する(を参照) 図 P )。
図 P

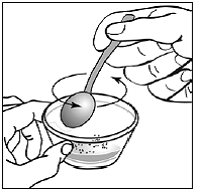
ステップ 9。 片手で容器を持ちます。もう一方の手で、小さじ 1 杯を使って、カプセルの内容物と乳児用調合乳をそっと混ぜます ( 図Q )。ふりかけは溶けません。混合物は粒状に見えますが、塊になってはいけません。
図Q
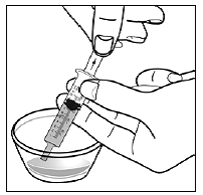
ステップ10。 すべての混合物を経口投与シリンジに吸引するには:
図 R
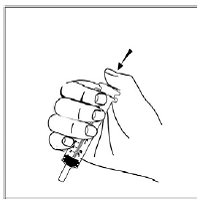
図 S
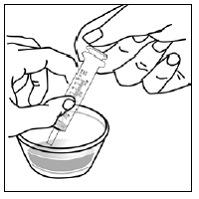
図 T
- プランジャーがシリンジのバレルに完全に押し込まれていることを確認します ( 図 R )。
- 注射器の先端を容器内の混合物に入れます(参照 図 S )。
- ゆっくりとプランジャーを引き戻し、すべての混合物を吸い上げます( 図 T )。
ステップ11。 注射器の先端を頬の内側に沿って赤ちゃんの口に入れます( 図 U )。ゆっくりとプランジャーを押して、赤ちゃんにすべての混合物を与えます。
図 U
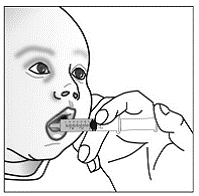
ステップ 12. すべての薬が赤ちゃんに投与されていることを確認するには:
- 上記の手順 4 を繰り返します。
- ティースプーンでかき混ぜます。
- その後、繰り返します 上記の手順 10 と 11 (見る 図Ⅴ )。
図Ⅴ
ステップ13。 経口投与シリンジからプランジャーを取り外します。容器、ティースプーン、経口投与シリンジを洗浄します。プランジャーとシリンジ バレルを乾燥させてから、元に戻します。
ステップ14。 ペーパー タオルを捨てて、作業面をきれいにします。手を洗いなさい。
サスティバ 600mg カプセルの保管方法を教えてください。
- SUSTIVA カプセルは、20°C ~ 25°C (68°F ~ 77°F) の室温で保管してください。
サスティバ 600mg カプセルおよびすべての医薬品は、子供の手の届かないところに保管してください。
この使用説明書は、米国食品医薬品局によって承認されています。
