Famvir 250mg, 500mg Famciclovir 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ファムビルとは何ですか、またどのように使用されますか?
ファムビルは、急性帯状疱疹(帯状疱疹)、口唇ヘルペス、性器ヘルペスの症状を治療するために使用される処方薬です。ファムビル 250mg は、単独で使用することも、他の薬と併用することもできます。
Famvir 250mg は、抗ウイルス薬、その他と呼ばれる薬のクラスに属します。
Famvir が 18 歳未満の子供に安全で有効であるかどうかはわかっていません。
ファムビル 250mg で起こりうる副作用は何ですか?
ファムビル 250mg は、次のような重大な副作用を引き起こす可能性があります。
- 錯乱、
- 排尿がほとんどまたはまったくない、
- 足や足首のむくみ、
- 疲労感と
- 呼吸困難
上記の症状がある場合は、すぐに医療機関を受診してください。
Famvir 500mg の最も一般的な副作用は次のとおりです。
- 頭痛と
- 吐き気
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Famvir の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
FAMVIR 500mg錠の有効成分は、抗ウイルス剤ペンシクロビルの経口投与プロドラッグであるファムシクロビルです。化学的には、ファムシクロビルは 2-[2-(2-アミノ-9H-プリン-9-イル)エチル]-1,3-プロパンジオール ジアセテートとして知られています。その分子式は C14H19N5O4 です。その分子量は 321.3 です。合成非環式グアニン誘導体であり、次の構造を持っています
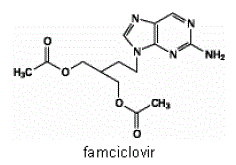
ファムシクロビルは白色から淡黄色の固体です。アセトン、メタノールに溶けやすく、エタノール、イソプロパノールにやや溶けにくい。 25°C では、ファムシクロビルは最初は水に自由に溶けます (>25% w/v) が、わずかに溶ける (2% ~ 3% w/v) 一水和物として急速に沈殿します。ファムシクロビルは、相対湿度 85% 未満では吸湿性がありません。分配係数は、オクタノール/水 (pH 4.8) P=1.09 およびオクタノール/リン酸緩衝液 (pH 7.4) P=2.08 です。
FAMVIR 250mg 錠剤には、125mg、250mg、または 500mg のファムシクロビルと、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ラクトース、ステアリン酸マグネシウム、ポリエチレングリコール、デンプングリコール酸ナトリウム、および二酸化チタンが含まれています。
適応症
免疫不全の成人患者
口唇ヘルペス(口唇ヘルペス)
FAMVIR は、再発性口唇ヘルペスの治療に適応されます。
性器ヘルペス
再発エピソード:
FAMVIR は、性器ヘルペスの再発エピソードの治療に適応されます。症状または病変の発症から 6 時間以上経過してから開始した場合の FAMVIR の有効性は確立されていません。
抑制療法:
FAMVIR 250mg は、性器ヘルペスの再発性エピソードの慢性的な抑制療法に適応されます。 1年以上の性器ヘルペスの再発抑制に対するFAMVIRの有効性と安全性は確立されていません。
帯状疱疹(帯状疱疹)
ファムビル 500mg は、帯状疱疹の治療を適応としています。発疹の発症から 72 時間以上経過してから開始した場合の FAMVIR の有効性は確立されていません。
HIV に感染した成人患者
口唇ヘルペスまたは性器ヘルペスの再発
FAMVIR は、HIV に感染した成人における口唇ヘルペスまたは性器ヘルペスの再発エピソードの治療に適応されます。症状または病変の発症から 48 時間以上経過してから開始した場合の FAMVIR の有効性は確立されていません。
使用制限
FAMVIR の有効性と安全性は、以下について確立されていません。
- 18歳未満の患者
- 性器ヘルペスの最初のエピソードを持つ患者
- 帯状疱疹患者
- HIV感染患者における口唇ヘルペスまたは性器ヘルペスの再発の治療以外の免疫不全患者
- 性器ヘルペスを再発した黒人およびアフリカ系アメリカ人の患者
投薬と管理
FAMVIR 500mg は食事の有無にかかわらず服用できます。
免疫不全の成人患者における推奨用量
口唇ヘルペス(口唇ヘルペス)
再発性口唇ヘルペスの治療におけるファムビア 500mg の推奨用量は、1 回 1500mg です。治療は、口唇ヘルペスの最初の徴候または症状 (例、うずき、かゆみ、灼熱感、痛み、または病変) で開始する必要があります。
性器ヘルペス
再発エピソード
性器ヘルペスの再発エピソードの治療のための FAMVIR の推奨投与量は、1 日 2 回、1 日 1000 mg です。治療は、再発エピソードの最初の徴候または症状 (例、うずき、かゆみ、灼熱感、痛み、または病変) で開始する必要があります。
抑制療法
性器ヘルペスの再発エピソードの慢性抑制療法のための FAMVIR 500mg の推奨投与量は、1 日 2 回 250mg です。
帯状疱疹(帯状疱疹)
帯状疱疹の治療のためのFAMVIR 250mgの推奨投与量は、7日間、8時間ごとに500mgです。帯状疱疹と診断されたらすぐに治療を開始する必要があります。
HIV 感染成人患者における推奨用量
口唇ヘルペスまたは性器ヘルペスの再発
HIV 感染患者の口唇ヘルペスまたは性器ヘルペスの再発の治療における FAMVIR の推奨投与量は、1 日 2 回、7 日間、500 mg です。治療は、再発エピソードの最初の徴候または症状 (例、うずき、かゆみ、灼熱感、痛み、または病変) で開始する必要があります。
腎障害患者における推奨投与量
腎機能障害のある成人患者に対する推奨用量を表 1 に示します [参照 特定の集団での使用 、 臨床薬理学 ]。
供給方法
剤形と強度
FAMVIR 錠には 3 つの強度があります。
- 125 mg: 白色、丸いフィルムコーティング、両凸、面取りエッジ、片面に「FAMVIR」、反対面に「125」のデボス加工
- 250 mg: 白色、丸いフィルムコーティング、両凸、面取りエッジ、片面に「FAMVIR」、反対面に「250」のデボス加工
- 500 mg: 白色、楕円形フィルムコーティング、両凸、片面に「FAMVIR」、反対面に「500」のデボス加工
保管と取り扱い
ファムヴィール 錠剤は、次のようにフィルムコーティングされた錠剤として提供されます。 30本のボトルで250mg。 30 個入りのボトルで 500 mg、および 50 個入りの単一ユニット パッケージ (施設での使用のみを目的としています)。
- FAMVIR 125 mg 錠剤: 白色、丸いフィルム コーティング、両凸、面取りエッジ、片面に「FAMVIR」、もう片面に「125」のデボス加工。 125mg 30代 NDC 0078-0366-15
- ファムビア錠250mg : ホワイト、ラウンド フィルム コーティング、両凸、面取りエッジ、片面に「FAMVIR」、もう片面に「250」のデボス加工。 250mg 30代 NDC 0078-0367-15
- ファムビア錠500mg : ホワイト、オーバル フィルム コーティング、両凸、片面に「FAMVIR」、もう片面に「500」のデボス加工。 500mg 30代 NDC 0078-0368-15 500mg SUP 50's NDC 0078-0368-64
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) [USP 制御室温を参照してください] まで許容されます。
販売元: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. 改訂: 2016 年 9 月
副作用
急性腎不全については、ラベルの他のセクションで詳しく説明されています [参照 警告と注意事項 ]。
FAMVIR 250mg で治療された成人患者の 10% 以上が少なくとも 1 つの適応症で報告した最も一般的な有害事象は、頭痛と吐き気です。
成人患者における臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
免疫不全患者
FAMVIR 250mg の安全性は、816 人の FAMVIR で治療された帯状ヘルペス患者を対象とした実薬対照およびプラセボ対照の臨床試験で評価されています (FAMVIR、250 mg を 1 日 3 回から 750 mg を 1 日 3 回)。再発性性器ヘルペスを有する 163 人の FAMVIR 治療患者 (FAMVIR、1000 mg を 1 日 2 回)。再発性性器ヘルペス患者 1,197 人が抑制療法として FAMVIR 250mg (1 日 1 回 125mg から 250mg を 1 日 3 回) で治療され、そのうち 570 人の患者が FAMVIR (オープンラベルおよび/または二重盲検) を少なくとも 10 か月間受けました。口唇ヘルペスの FAMVIR 治療患者 447 人 (FAMVIR 500mg、1500mg を 1 日 1 回、または 750mg を 1 日 2 回)。表 2 に、選択した有害事象を示します。
表 3 に、性器ヘルペス抑制試験で選択された臨床検査値の異常を示します。
HIV感染患者
HIV 感染患者において、FAMVIR (500 mg、1 日 2 回; n=150) およびアシクロビル (400 mg、1 日 5 回; n=143) で最も頻繁に報告された有害事象は、それぞれ頭痛 (17% 対 15%) でした。 )、吐き気 (11% 対 13%)、下痢 (7% 対 11%)、嘔吐 (5% 対 4%)、疲労 (4% 対 2%)、腹痛 (3% 対 2%) 6%)。
市販後の経験
FAMVIR の承認後の使用中に、以下の有害事象が報告されています。これらの事象は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
血液およびリンパ系の障害 血小板減少症
肝胆道障害 :肝機能検査異常、胆汁うっ滞性黄疸
免疫系障害 :アナフィラキシーショック、アナフィラキシー反応
神経系障害 :めまい、傾眠、けいれん
精神障害 :錯乱(高齢者に多いせん妄、見当識障害、錯乱状態を含む)、幻覚
皮膚および皮下組織の障害 :蕁麻疹、多形紅斑、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、血管性浮腫(顔面、まぶた、眼窩周囲、咽頭浮腫など)、過敏性血管炎
心疾患 動悸
薬物相互作用
FAMVIR 250mg が他の薬剤に影響を与える可能性
ジゴキシンの定常状態の薬物動態は、ファムシクロビルの複数回投与 (1 日 3 回 500 mg) の同時投与によって変化しませんでした。ジドブジン、その代謝産物であるジドブジングルクロニド、またはエムトリシタビンの薬物動態に対する臨床的に有意な影響は、ジドブジンまたはエムトリシタビンと同時投与された 500 mg のファムシクロビルの単回経口投与後に観察されませんでした。
ヒト肝ミクロソームを使用した in vitro 研究では、ファムシクロビルが CYP3A4 酵素の阻害剤ではないことが示唆されています。
他の薬剤がペンシクロビルに影響を与える可能性
アロプリノール、シメチジン、テオフィリン、ジドブジン、プロメタジンの複数回投与による前処理後にファムシクロビル 500 mg を単回投与した後、制酸剤 (水酸化マグネシウムおよび水酸化アルミニウム) の直後に投与した場合、または制酸剤 (水酸化マグネシウムおよび水酸化アルミニウム) を併用した場合、ペンシクロビルの薬物動態に臨床的に有意な変化は観察されませんでした。エムトリシタビン。ジゴキシンの複数回投与によるファムシクロビル(500 mg)の複数回投与(1 日 3 回)後、ペンシクロビルの薬物動態に対する臨床的に有意な影響は観察されませんでした。
プロベネシドまたは腎尿細管の活発な分泌によって大幅に排除される他の薬剤との同時使用は、ペンシクロビルの血漿濃度の上昇をもたらす可能性があります。
6-デオキシ ペンシクロビルからペンシクロビルへの変換は、アルデヒド オキシダーゼによって触媒されます。この酵素によって代謝される、および/またはこの酵素を阻害する他の薬物との相互作用が発生する可能性があります。ファムシクロビルと、アルデヒドオキシダーゼの in vitro 阻害剤であるシメチジンおよびプロメタジンとの臨床的相互作用研究では、ペンシクロビルの形成に関連する影響は示されませんでした。インビトロでの強力なアルデヒドオキシダーゼ阻害剤であるラロキシフェンは、ペンシクロビルの形成を減少させる可能性があります。ただし、ペンシクロビルとラロキシフェン間の相互作用の大きさを決定するための臨床薬物間相互作用研究は実施されていません。
警告
の一部として含まれています "予防" セクション
予防
急性腎不全
急性腎不全の症例は、腎機能のレベルに対して不適切に高用量の FAMVIR を投与された基礎腎疾患のある患者で報告されています。 FAMVIR を腎障害のある患者に投与する場合は、減量が推奨される [参照 投薬と管理 、 特定の集団での使用 ]。
患者相談情報
FDA 承認の患者ラベル (患者情報) を読むよう患者に助言します。
FAMVIR が患者の運転能力や機械の使用能力に影響を与えるという証拠はありません。ただし、FAMVIR 500mgの服用中にめまい、傾眠、錯乱、その他の中枢神経系障害を経験した患者は、自動車の運転や機械の操作を控えてください。
FAMVIR にはラクトースが含まれているため (FAMVIR 125 mg、250 mg、および 500 mg 錠剤には、それぞれラクトース 26.9 mg、53.7 mg、および 107.4 mg が含まれています)、ガラクトース不耐症、重度のラクターゼ欠乏症、またはグルコース - ガラクトース吸収不良のまれな遺伝的問題がある患者は、 FAMVIR を服用する前に、医療提供者と話し合うことをお勧めします。
口唇ヘルペス(口唇ヘルペス)
口唇ヘルペスの再発の徴候または症状(例、ヒリヒリ感、かゆみ、灼熱感、痛み、または病変)が最も早期に現れたら、治療を開始するよう患者に助言する必要があります。口唇ヘルペスの治療は 1 回の投与量を超えてはならないことを患者に指示する必要があります。 FAMVIR は口唇ヘルペスの治療法ではないことを患者に知らせる必要があります。
性器ヘルペス
FAMVIR は性器ヘルペスの治療法ではないことを患者に知らせる必要があります。 FAMVIR が他人への感染を防ぐかどうかを評価するデータはありません。性器ヘルペスは性感染症であるため、パートナーへの感染を避けるために、病変や症状がある場合は、患者は病変との接触や性交を避ける必要があります。性器ヘルペスは、無症候性ウイルス排出を通じて無症状で感染することがよくあります。したがって、より安全な性行為を行うように患者に助言する必要があります。
再発性性器ヘルペスの一時的な治療が必要な場合は、エピソードの最初の徴候または症状で治療を開始するように患者にアドバイスする必要があります。
1年以上の慢性抑制療法の安全性または有効性に関するデータはありません。
帯状疱疹(帯状疱疹)
帯状疱疹の発症から 72 時間以上経過してから治療を開始したというデータはありません。帯状疱疹と診断されたら、できるだけ早く治療を開始するよう患者にアドバイスする必要があります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
ファムシクロビルによる 2 年間の食事による発がん性試験が、ラットとマウスで実施されました。 600 mg/kg/日の高用量 (推奨される 1 日総経口用量でのヒトの全身暴露の 1.1 ~ 4.5 倍) を投与された雌ラットで、乳腺癌 (この種の動物によく見られる腫瘍) の発生率の増加が見られました。ペンシクロビルの血漿濃度曲線下面積比較 [24 時間 AUC] に基づいて、500 mg から 2000 mg の範囲)。 240 mg/kg/日 (ヒト AUC の 0.7 ~ 2.7 倍) までの用量で処理された雄ラット、または 600 mg/kg/日 (0.3 ~人間の AUC の 1.2 倍)。
突然変異誘発
ファムシクロビルとペンシクロビル (ファムシクロビルの活性代謝物) は、一連の in vitro および in vivo アッセイで遺伝毒性の可能性についてテストされました。ファムシクロビルとペンシクロビルは、バクテリア (S. typhimurium と E. coli) の遺伝子突然変異と哺乳動物 HeLa 83 細胞の不定期 DNA 合成 (それぞれ最大 10,000 と 5,000 mcg/プレートの用量で) の in vitro 試験で陰性でした。ファムシクロビルは、L5178Y マウスリンパ腫試験 (5000 mcg/mL)、in vivo マウス小核試験 (4800 mg/kg)、およびラット優性致死試験 (5000 mg/kg) でも陰性でした。ファムシクロビルは、染色体損傷がない場合 (1200 mcg/mL)、in vitro でヒトリンパ球の倍数性の増加を誘発しました。ペンシクロビルは、代謝活性化の有無にかかわらず、L5178Y マウスリンパ腫アッセイで遺伝子突然変異/染色体異常について陽性でした (1000 mcg/mL)。ヒトリンパ球では、ペンシクロビルは代謝活性化の非存在下で染色体異常を引き起こしました (250 mcg/mL)。ペンシクロビルは、骨髄に対して非常に毒性の高い用量 (500 mg/kg) で静脈内投与された場合、in vivo でマウスの骨髄における小核の発生率が増加しましたが、経口投与された場合は増加しませんでした。
生殖能力の障害
ファムシクロビルまたはペンシクロビルの反復投与後、ラット、マウス、およびイヌで精巣毒性が観察された。精巣の変化には、精細管の萎縮、精子数の減少、および/または異常な形態または運動性の低下を伴う精子の発生率の増加が含まれます。雄の生殖に対する毒性の程度は、用量と暴露期間に関連していた。雄ラットでは、500 mg/kg/日を 10 週間投与した後に受胎能の低下が観察されました (ヒト AUC の 1.4 ~ 5.7 倍)。慢性投与 (26 週間) 後のラットにおける精子および精巣毒性の観察されない影響レベルは 50 mg/kg/日 (AUC 比較に基づくヒトの全身暴露の 0.15 ~ 0.6 倍) でした。マウス (104 週) およびイヌ (26 週) に 600 mg/kg/日 (ヒト AUC の 0.3 から 1.2 倍) および 150 mg/kg/日 (ヒト AUC の 1.3 から 5.1 倍) の用量で慢性投与した後、精巣毒性が観察された。ヒト AUC)、それぞれ。
ファムシクロビルは、1000 mg/kg/日 (ヒト AUC の 2.7 から 10.8 倍) までの用量で、雌ラットの一般的な生殖能力または生殖能力に影響を与えませんでした。
合計 130 人のその他の点では健康な男性で、8 週間のベースライン期間にわたって正常な精子プロファイルを持ち、性器ヘルペスを再発し、経口 FAMVIR (250 mg 1 日 2 回) (n=66) またはプラセボ (n=64) を投与された 2 つのプラセボ対照試験18週間の治療は、治療中または8週間のフォローアップ中に、精子数、運動性、または形態に有意な影響を与えるという証拠を示しませんでした.
特定の集団での使用
妊娠
妊娠カテゴリーB
経口投与後、ファムシクロビル (プロドラッグ) はペンシクロビル (活性薬物) に変換されます。妊娠中の女性におけるファムシクロビルまたはペンシクロビルの使用に関する十分に管理された研究はありません。ヒトの最大推奨用量(MRHD)およびヒト曝露よりも高い用量でファムシクロビルおよびペンシクロビルを使用した動物生殖研究では、胚胎児の発育に対する悪影響は観察されませんでした。動物の繁殖研究は常にヒトの反応を予測できるわけではないため、ファムシクロビルは必要な場合にのみ妊娠中に使用する必要があります。
動物の生殖研究では、妊娠中のラットとウサギは、AUC に基づくヒトの全身暴露の 2.7 から 10.8 倍 (ラット) および 1.4 から 5.4 倍 (ウサギ) の用量 (最大 1000 mg/kg/日) のファムシクロビルを経口投与されました。胚・胎児の発育への悪影響は観察されませんでした。他の研究では、妊娠中のラットとウサギに静脈内ファムシクロビル (360 mg/kg/日) を 1.5 ~ 6 回 (ラット) および (120 mg/kg/日) を 1.1 ~ 4.5 回 (ウサギ)、またはペンシクロビルを (80 mg/kg/日) 0.3 から 1.3 倍 (ラット) および (60 mg/kg/日) 0.5 から 2.1 倍 (ウサギ) 体表面積の比較に基づく MRHD。胚・胎児の発育への悪影響は観察されませんでした。
妊娠暴露報告
ノバルティス ファーマシューティカルズ コーポレーションは、FAMVIR 500mg にさらされた妊婦の母体と胎児の転帰を監視するために、FAMVIR 妊娠報告システムを維持しています。医師は、1-888-NOW-NOVA (669-6682) に電話して患者を報告することをお勧めします。
授乳中の母親
ファムシクロビル (プロドラッグ) またはペンシクロビル (活性薬物) が母乳中に排泄されるかどうかは不明です。授乳中のラットにファムシクロビルを経口投与した後、ペンシクロビルは血漿中よりも高い濃度で母乳中に排泄された。乳児におけるFAMVIR 250mgの安全性に関するデータはありません。 FAMVIR 500mg は、潜在的な利益が治療に伴う潜在的なリスクを上回ると考えられる場合を除き、授乳中の母親には使用しないでください。
小児用
小児患者におけるFAMVIR 250mgの有効性は確立されていません。ファムシクロビル(OraSweet®または錠剤と混合した実験的顆粒)の薬物動態プロファイルと安全性は、3 つの非盲検試験で検討されました。
研究 1 は、活動性単純ヘルペスウイルス (HSV) 感染症または HSV 感染のリスクがある生後 1 か月から 1 歳未満の乳児を対象とした単回投与の薬物動態および安全性研究でした。 18人の被験者が登録され、患者の体重に基づいてOraSweetと混合されたファムシクロビル実験用顆粒の単回投与を受けました(投与量は25mgから175mgの範囲でした)。これらの用量は、ファムシクロビル 500 mg の投与後に成人で観察されるペンシクロビル全身曝露と同様のペンシクロビル全身曝露を提供するように選択されました。ファムシクロビルの有効性と安全性は、新生児 HSV 感染後の乳児における抑制療法として確立されていません。また、成人では同様の疾患がないため、成人から乳幼児への有効性を外挿することはできません。したがって、ファムシクロビルは乳児には推奨されません。
研究 2 は、臨床的に HSV または水痘帯状疱疹ウイルス (VZV) 感染が疑われる 1 歳から 12 歳未満の小児を対象に、OraSweet と混合したファムシクロビル実験用顆粒の非盲検、単回投与薬物動態、複数回投与の安全性研究でした。 51 人の被験者が研究の薬物動態部分に登録され、ファムシクロビルの体重調整用量 (125 mg から 500 mg の範囲) を 1 回投与されました。これらの用量は、ファムシクロビル 500 mg の投与後に成人で観察されるペンシクロビル全身曝露と同様のペンシクロビル全身曝露を提供するように選択されました。小児におけるこれらの投与量で観察された薬物動態データに基づいて、新しい体重ベースの投与アルゴリズムが設計され、研究の複数回投与の安全性部分で使用されました。薬物動態データは、改訂された体重ベースの投薬アルゴリズムでは得られませんでした。
合計 100 人の患者が、研究の反復投与安全性部分に登録されました。活動性または潜伏性 HSV 感染症の 47 人の被験者と、水痘の 53 人の被験者。活動性または潜在性 HSV 感染症の患者は、ファムシクロビルを 1 日 2 回、7 日間投与されました。ファムシクロビルの 1 日用量は、患者の体重に応じて 1 日 2 回 150 mg から 500 mg の範囲でした。水ぼうそうの患者は、ファムシクロビルを 1 日 3 回、7 日間投与されました。ファムシクロビルの 1 日用量は、患者の体重に応じて 1 日 3 回、150 mg から 500 mg の範囲でした。この研究で観察された臨床的有害事象と臨床検査の異常は、成人に見られるものと同様でした。以下の理由から、水痘または HSV による感染症に罹患している 1 歳から 12 歳未満の小児の治療にファムシクロビルを使用することを支持するには、入手可能なデータが不十分です。
水疱瘡
水痘の治療に対するファムシクロビルの有効性は、小児患者または成人患者のいずれにおいても確立されていません。ファムシクロビルは、成人患者の帯状疱疹の治療に承認されています。ただし、帯状疱疹の成人から水痘の子供への有効性データの外挿は適切ではありません。水痘と帯状疱疹は同じウイルスが原因ですが、病気は異なります。
性器ヘルペス
子供の性器ヘルペスに関する臨床情報は限られています。したがって、成人の有効性データをこの集団に外挿することはできません。さらに、ファムシクロビルは、性器ヘルペスを再発する 1 歳から 12 歳未満の小児では研究されていません。研究 2 の子供は誰も性器ヘルペスを持っていませんでした。
口唇ヘルペス
歳から 12 歳未満の小児では、1500 mg の単回投与後の成人のペンシクロビル全身曝露に匹敵するペンシクロビル全身曝露を提供するファムシクロビル用量を支持する薬物動態および安全性データはありません。さらに、口唇ヘルペスを再発した 1 歳から 12 歳未満の小児に対する有効性データは得られていません。
試験 3 は、口唇ヘルペスを再発した 12 歳から 18 歳未満の小児を対象に、ファムシクロビル 1500 mg 単回投与(500 mg 錠 3 錠)の薬物動態、安全性、および抗ウイルス活性を評価する非盲検単群試験でした。合計53人の被験者が研究に登録されました。研究の薬物動態部分の10人の被験者と、研究の非薬物動態部分の43人の被験者。登録されたすべての被験者の体重は40kg以上でした。研究の非薬物動態部分に登録された 43 人の被験者は、活動性の再発性口唇ヘルペスを有し、症状の発症後 24 時間以内に 1500 mg のファムシクロビルを単回投与されました (治療開始までの時間の中央値は 21 時間でした)。この研究で観察されたファムシクロビルの安全性プロファイルは、成人で見られたものと同様でした。中止されていない病変を有する患者の治癒までの時間の中央値は 5.9 日でした。
患者が 1500 mg のファムシクロビルまたはプラセボを単回投与された成人を対象とした第 3 相試験では、中絶されていない病変を有する患者の治癒までの時間の中央値は、ファムシクロビル 1500 mg の単回投与群で 4.4 日、単回投与群で 6.2 日でした。プラセボ群。注目すべきは、成人の研究では、症状の発症後 1 時間以内に患者が治療を開始したことです。 臨床研究 ]。研究 3 の有効性の結果に基づいて、ファムシクロビルは、口唇ヘルペスを再発する 12 歳から 18 歳未満の子供には推奨されません。
高齢者の使用
臨床研究で FAMVIR による治療を受けた帯状疱疹患者 816 人のうち、248 人 (30.4%) が 65 歳以上、103 人 (13%) が 75 歳以上でした。若年患者と高齢患者の間で、有害事象の発生率またはタイプに全体的な違いは観察されませんでした。 FAMVIR 500mgで治療された臨床研究における再発性単純ヘルペス(1型または2型)患者610人のうち、26人(4.3%)が65歳以上、7人(1.1%)が75歳以上でした。再発性性器ヘルペス患者を対象とした FAMVIR 500mg の臨床試験には、65 歳以上の被験者が十分に含まれておらず、若い被験者と比較して反応が異なるかどうかを判断できませんでした。
腎機能が損なわれていない限り、年齢に基づいたファムシクロビルの投与量の調整は推奨されません。 投薬と管理 、 臨床薬理学 ]。一般に、高齢患者におけるFAMVIR 250mgの投与および監視には、腎機能の低下および他の薬物の併用の頻度が高いことを反映して、適切な注意を払う必要があります。
腎障害のある患者
見かけの血漿クリアランス、腎クリアランス、およびペンシクロビルの血漿排出速度定数は、腎機能の低下とともに直線的に減少しました。 500 mg ファムシクロビルの単回経口投与 (n=27) を健康なボランティアとさまざまな程度の腎障害 (CLCR の範囲は 6.4 ~ 138.8 mL/min) のボランティアに投与した後、次の結果が得られました (表 4)。
腎機能障害の程度が異なる被験者 (n=18) を対象に実施されたファムシクロビルの複数回投与試験では、ペンシクロビルの薬物動態は単回投与後のものと同等でした。
腎障害のある患者には投与量の調整が推奨される[参照 投薬と管理 ]。
肝障害のある患者
軽度または中等度の肝障害 (慢性肝炎 [n=6]、慢性エタノール乱用 [n=8]、または原発性胆汁性肝硬変 [n=1]) は、単回投与後のペンシクロビルの利用可能範囲 (AUC) に影響を与えませんでした。ファムシクロビル500mg。しかし、ペンシクロビルの平均最大血漿濃度 (Cmax) は 44% 減少し、最大血漿濃度 (tmax) までの時間は、正常なボランティアと比較して肝機能障害のある患者で 0.75 時間増加しました。軽度または中等度の肝障害のある患者には、用量調整は推奨されません。ペンシクロビルの薬物動態は、重度の肝障害のある患者では評価されていません。これらの患者では、ファムシクロビルから活性代謝物であるペンシクロビルへの変換が損なわれる可能性があり、その結果、ペンシクロビルの血漿中濃度が低下し、ファムシクロビルの有効性が低下する可能性があります。 臨床薬理学 ]。
黒人およびアフリカ系アメリカ人の患者
性器ヘルペスを再発した 304 人の免疫正常な黒人およびアフリカ系アメリカ人成人を対象に実施されたランダム化二重盲検プラセボ対照試験では、FAMVIR またはプラセボを投与された患者間で治癒までの時間の中央値に差はありませんでした。一般に、有害反応プロファイルは、成人患者を対象とした他の FAMVIR 臨床試験で観察されたものと同様でした [ 有害反応 ]。黒人およびアフリカ系アメリカ人患者におけるこれらの研究結果の他の適応症との関連性は不明である[参照 臨床研究 ]。
過剰摂取
適切な対症療法と支持療法を行う必要があります。ペンシクロビルは血液透析によって除去されます。
禁忌
FAMVIR 250mg は、製品、その成分、または Denavir® (ペンシクロビル クリーム) に対して既知の過敏症のある患者には禁忌です。
臨床薬理学
作用機序
ファムシクロビルは、抗ウイルス剤ペンシクロビルの経口投与されるプロドラッグです。 微生物学 ]。
薬物動態
ファムシクロビルは、活性抗ウイルス化合物ペンシクロビルのジアセチル 6-デオキシ アナログです。経口投与後、ファムシクロビルはペンシクロビルへの急速かつ広範な代謝を受け、血漿または尿中にファムシクロビルはほとんどまたはまったく検出されません。ペンシクロビルは主に腎臓によって変化せずに排泄されます。したがって、FAMVIR 500mg の投与量は、さまざまな程度の腎障害のある患者で調整する必要があります。 投薬と管理 ]。
成人における薬物動態
吸収とバイオアベイラビリティ:
ペンシクロビルの絶対バイオアベイラビリティは、12 人の健康な男性被験者に 500 mg のファムシクロビルの経口投与と 400 mg のペンシクロビルの静脈内投与を行った後に決定されるように、77 ± 8% です。
ペンシクロビル濃度は、ファムシクロビルの単回投与量が 125 mg から 1000 mg の範囲で、用量に比例して増加しました。表 5 は、健康な男性ボランティアに FAMVIR を単回投与した後のペンシクロビルの平均薬物動態パラメータを示しています。
帯状疱疹患者 7 例にファムシクロビル 500 mg を単回経口投与したときの AUC(平均値±標準偏差)、Cmax、tmax は 12.1±1.7 mcg hr/mL、4.0±0.7 mcg/mL、0.7±0.2 時間であった。 、 それぞれ。ペンシクロビルの AUC は、健康なボランティアと比較して、帯状ヘルペス患者で約 35% 大きかった。この違いの一部は、2 つのグループ間の腎機能の違いによる可能性があります。
ファムシクロビル 500 mg を 1 日 3 回、7 日間投与した後、ペンシクロビルの蓄積はありません。
ペンシクロビルの Cmax は約 50% 減少し、ファムシクロビルのカプセル製剤を食事と一緒に投与すると、tmax は 1.5 時間遅延しました (栄養成分は約 910 Kcal で脂肪は 26% でした)。ペンシクロビルの利用可能範囲 (AUC) に影響はありませんでした。食事の 2 時間前にファムシクロビルを投与した場合と比較して、ファムシクロビルを食事の 2 時間後に投与した場合、Cmax が 18% 減少し、tmax が約 1 時間遅れました。ペンシクロビルの全身利用可能性の程度に影響がなかったため、FAMVIR 250mg は食事に関係なく服用できます。
分布:
1時間の静脈内注入として投与された400mgのペンシクロビルの単回静脈内投与後の12人の健康な男性被験者における分布容積(Vdβ)は、1.08±0.17L/kgであった。ペンシクロビルは、0.1 ~ 20 mcg/mL の濃度範囲で血漿タンパク質に 20% 未満結合します。ペンシクロビルの血液/血漿比は約 1 です。
代謝:
経口投与後、ファムシクロビルは脱アセチル化および酸化されてペンシクロビルを形成します。不活性な代謝物には、6-デオキシ ペンシクロビル、モノアセチル化ペンシクロビル、および 6-デオキシ モノアセチル化ペンシクロビルが含まれます (それぞれ、尿中の用量の 5%、 薬物相互作用 ]。
除去:
人の健康な男性ボランティアに 5 mg/kg の放射標識ペンシクロビルを 1 時間注入した後、投与された放射能の約 94% が 24 時間にわたって尿中に回収された (最初の 6 時間で用量の 83% が排泄された)。ペンシクロビルは、尿中に排泄された放射能の 91% を占めていました。
放射性標識ファムシクロビル 500 mg を 3 人の健康な男性ボランティアに単回経口投与した後、投与した放射能の 73% と 27% がそれぞれ 72 時間にわたって尿と糞から回収されました。尿中に排泄された放射能の 82% をペンシクロビルが占め、6-デオキシ ペンシクロビルが 7% を占めた。投与された放射性標識線量の約 60% が、最初の 6 時間で尿中に収集されました。
48 人の健康な男性ボランティアにペンシクロビルを静脈内投与した後、ペンシクロビルの平均 ± SD 総血漿クリアランスは 36.6±6.3 L/hr (0.48±0.09 L/hr/kg) でした。ペンシクロビルの腎クリアランスは、全血漿クリアランスの 74.5±8.8% を占めていました。
109 人の健康な男性ボランティアに 500 mg のファムシクロビルを単回経口投与した後のペンシクロビルの腎クリアランスは、27.7±7.6 L/hr でした。活発な尿細管分泌は、ペンシクロビルの腎排泄に寄与します。
ペンシクロビルの血漿消失半減期は、48 人の健康な男性ボランティアへのペンシクロビルの静脈内投与後 2.0±0.3 時間、124 人の健康な男性ボランティアへの 500 mg ファムシクロビルの経口投与後 2.3±0.4 時間でした。帯状疱疹患者 17 例の半減期は、単回投与後 2.8±1.0 時間、反復投与後 2.7±1.0 時間でした。
特別な集団
高齢患者
クロススタディの比較に基づいて、ペンシクロビルの AUC は 40% 高く、ペンシクロビルの腎クリアランスは、若い被験者と比較して高齢者 (n=18、年齢 65-79 歳) で 22% 低かった。この違いの一部は、2 つのグループ間の腎機能の違いによる可能性があります。腎機能が損なわれていない限り、年齢に基づいたファムシクロビルの投与量の調整は推奨されません。 投薬と管理 、 特定の集団での使用 ]
腎障害のある患者
さまざまな程度の腎障害を持つ被験者では、ペンシクロビルの見かけの血漿クリアランス、腎クリアランス、および血漿排出速度定数は、単回および反復投与の両方の後、腎機能の低下とともに直線的に減少しました[ 特定の集団での使用 ]。腎障害のある患者には投与量の調整が推奨される[参照 投薬と管理 ]。
肝障害のある患者
軽度または中等度の肝障害は、ペンシクロビルの利用可能範囲 (AUC) に影響を与えませんでした [参照 特定の集団での使用 ]。軽度または中等度の肝障害のある患者には、用量調整は推奨されません。ペンシクロビルの薬物動態に対する重度の肝障害の影響は評価されていません。
HIV感染患者
HIV 陽性患者に 500 mg のファムシクロビルを単回経口投与した後、ペンシクロビルの薬物動態パラメーターは、健康な被験者で観察されたものと同等でした。
性別
ペンシクロビルの薬物動態は、500 mg のファムシクロビルを単回経口投与した後、18 人の健康な男性と 18 人の健康な女性のボランティアで評価されました。ペンシクロビルの AUC は、男性で 9.3±1.9 mcg hr/mL、女性で 11.1±2.1 mcg hr/mL であった。ペンシクロビルの腎クリアランスは、それぞれ 28.5±8.9 L/hr および 21.8±4.3 L/hr でした。これらの違いは、2 つのグループ間の腎機能の違いによるものでした。性別に基づいたファムシクロビルの投与量の調整は推奨されません。
人種
ファムシクロビル 500 mg を 1 日 1 回、1 日 2 回、または 1 日 3 回投与した後、黒人および白人の被験者で得られた薬物動態パラメータを比較するために遡及的評価が行われました。健康なボランティアの研究(単回投与)、さまざまな程度の腎障害のある被験者の研究(単回および反復投与)、および肝障害のある被験者の研究(単回投与)のデータは、黒人と白人の間のペンシクロビル。
微生物学
作用機序
ファムシクロビルはペンシクロビルのプロドラッグであり、単純ヘルペス ウイルス 1 型 (HSV-1) および 2 型 (HSV-2) と水痘帯状疱疹ウイルス (VZV) に対して阻害活性を示しています。 HSV-1、HSV-2、または VZV に感染した細胞では、ウイルスのチミジンキナーゼがペンシクロビルを一リン酸にリン酸化し、細胞キナーゼによって活性型のペンシクロビル三リン酸に変換されます。生化学的研究は、ペンシクロビル三リン酸がデオキシグアノシン三リン酸と競合して HSV-2 DNA ポリメラーゼを阻害することを示しています。その結果、ヘルペス ウイルスの DNA 合成、したがって複製が選択的に阻害されます。ペンシクロビル三リン酸の細胞内半減期は、HSV-1 で 10 時間、HSV-2 で 20 時間、培養で増殖した VZV 感染細胞で 7 時間です。ただし、細胞内半減期の臨床的意義は不明です。
抗ウイルス活性
細胞培養研究では、ペンシクロビルは次のヘルペス ウイルスに対して阻害性があります: HSV-1、HSV-2、および VZV。ヒト包皮線維芽細胞で増殖した野生型株に対するペンシクロビルの抗ウイルス活性は、プラーク減少アッセイと、HSV の場合は感染後 3 日、VZV の場合は感染後 10 日のクリスタル バイオレットによる染色で評価されました。 HSV-1、HSV-2、および VZV の実験室および臨床分離株に対するペンシクロビルの中央 EC50 値は、2 μM (範囲 1.2 ~ 2.4 μM、n=7)、2.6 μM (範囲 1.6 ~ 11 μM、n=6) でした。 、および 34 μM (範囲 6.7 ~ 71 μM、n=6)、それぞれ。
抵抗
HSV および VZV のペンシクロビル耐性変異体は、ウイルスのチミジンキナーゼ (TK) および DNA ポリメラーゼ遺伝子の変異に起因する可能性があります。ウイルス TK 遺伝子の変異は、TK 活性の完全な喪失 (TK 陰性)、TK 活性レベルの低下 (TK 部分的)、または同等のリン酸化能力の喪失なしに薬物をリン酸化するウイルス TK の能力の変化につながる可能性があります。チミジン (TK 変更)。ペンシクロビル耐性 HSV-1、HSV-2、および VZV を用いたプラーク減少アッセイで観察された EC50 の中央値は、69 μM (範囲 14 ~ 115 μM、n = 6)、46 μM (範囲 4 ~ >395 μM、n = 9)、および 92 μM (範囲 51 ~ 148 μM、n=4)、それぞれ。ペンシクロビルに対するウイルス耐性の可能性は、治療中に反応しない、または再発性ウイルス排出を経験する患者で考慮されるべきです.
交差抵抗
HSV DNA ポリメラーゼ阻害剤の間で交差耐性が観察されています。最も一般的に遭遇する TK 陰性のアシクロビル耐性突然変異体は、ペンシクロビルにも耐性があります。
臨床研究
口唇ヘルペス(口唇ヘルペス)
無作為化、二重盲検、プラセボ対照試験が、口唇ヘルペスを再発した701人の免疫正常成人で実施されました。再発性口唇ヘルペスの徴候または症状の最初の発症から 1 時間以内に、FAMVIR 1500 mg を単回投与 (n=227)、FAMVIR 750 mg を 1 日 2 回投与 (n=220)、またはプラセボ (n= 254) 1 日。中止されていない病変 (丘疹段階を超えて進行) を有する患者の治癒までの時間の中央値は、FAMVIR 1500 mg 単回投与群 (n=152) で 4.4 日、プラセボ群 (n=168) で 6.2 日でした。 .プラセボ群と FAMVIR 1500 mg 群の治癒までの時間の中央値の差は 1.3 日でした (95% CI: 0.6–2.0)。 FAMVIR 250mgまたはプラセボを投与された患者の間で、中止された病変(丘疹段階を超えて進行していない)を有する患者の割合に違いは観察されませんでした.FAMVIR 1500mgの単回投与では33%、プラセボでは34%でした.痛みと圧痛が消失するまでの時間の中央値は、FAMVIR 1500 mg の単回投与患者で 1.7 日、プラセボ治療患者で 2.9 日でした。
性器ヘルペス
再発エピソード
無作為化、二重盲検、プラセボ対照試験が、再発性性器ヘルペスを有する免疫正常成人329人で実施されました。患者は、再発性性器ヘルペス エピソードの最初の徴候または症状から 6 時間以内に、1 日 2 回の FAMVIR 1000 mg (n=163) またはプラセボ (n=166) のいずれかによる治療を自己開始しました。中止されていない病変 (丘疹段階を超えて進行) を有する患者の治癒までの時間の中央値は、FAMVIR 治療を受けた患者 (n=125) で 4.3 日、プラセボ治療を受けた患者 (n=145) で 6.1 日でした。プラセボ群と FAMVIR 群の治癒までの時間の差の中央値は 1.2 日でした (95% CI: 0.5 ~ 2.0)。 FAMVIR 治療を受けた患者の 23% は病変が中止されました (紅斑を超える病変の発生はありません) 対プラセボ治療を受けた患者では 13% でした。すべての症状(うずき、かゆみ、灼熱感、痛み、圧痛など)が消失するまでの時間の中央値は、FAMVIR 投与患者で 3.3 日、プラセボ投与患者で 5.4 日でした。
無作為化 (2:1)、二重盲検、プラセボ対照試験が、再発性性器ヘルペスを有する 304 人の免疫正常な黒人およびアフリカ系アメリカ人の成人で実施されました。患者は、再発性性器ヘルペス エピソードの最初の徴候または症状から 6 時間以内に、1 日 2 回の FAMVIR 1000 mg (n=206) またはプラセボ (n=98) のいずれかによる治療を自己開始しました。中止されていない病変を有する患者の治癒までの時間の中央値は、FAMVIR 治療を受けた患者 (n=152) では 5.4 日であったのに対し、プラセボ治療を受けた患者 (n=78) では 4.8 日でした。プラセボ群と FAMVIR 群の治癒までの時間の中央値の差は、-0.26 日でした (95% CI: -0.98 ~ 0.40)。
抑制療法
年に 6 回以上性器ヘルペスの再発を経験した免疫正常成人 934 人を対象に、2 つのランダム化二重盲検プラセボ対照 12 か月試験を実施しました。比較には、FAMVIR 125 mg 1 日 3 回、250 mg 1 日 2 回、250 mg 1 日 3 回、およびプラセボが含まれていました。 12 か月の時点で、患者の 60% から 65% はまだ FAMVIR を受けており、25% はプラセボ治療を受けていました。 250 mg を 1 日 2 回投与した患者の 6 か月および 12 か月の再発率を表 6 に示します。
FAMVIR 治療を受けた患者は、プラセボ治療を受けた患者と比較して、再発数の中央値が約 1/5 でした。 FAMVIR 250mg の高用量は、有効性の増加とは関連していませんでした。
HIV感染患者における口唇ヘルペスまたは性器ヘルペスの再発
無作為化二重盲検試験では、ファムシクロビル 500 mg を 1 日 2 回 7 日間 (n=150) と経口アシクロビル 400 mg を 1 日 5 回 7 日間 (n = 143) 比較した。 48時間の病変発症。患者の約 40% が 200 細胞/mm3 未満の CD4 + 数を有し、患者の 54% が肛門生殖器病変を有し、35% が口唇病変を有していた。ファムシクロビル療法は、新しい病変の形成を減らし、治癒を完了するまでの時間において、経口アシクロビルに匹敵しました。
帯状疱疹(帯状疱疹)
1つはプラセボ対照、もう1つは実薬対照の2つの無作為化二重盲検試験が、合併症のない帯状疱疹の免疫正常成人964人を対象に実施されました。治療は、最初の病変の出現から 72 時間以内に開始され、7 日間継続されました。
プラセボ対照試験では、419 人の患者が FAMVIR 500 mg 1 日 3 回 (n=138)、FAMVIR 750 mg 1 日 3 回 (n=135)、またはプラセボ (n=146) のいずれかで治療されました。完全痂皮形成までの時間の中央値は、FAMVIR 500 mg 投与患者では 5 日であったのに対し、プラセボ投与患者では 7 日でした。完全痂皮化、小胞の喪失、潰瘍の喪失、および痂皮の喪失までの時間は、研究集団全体のプラセボ治療患者よりもFAMVIR 500 mg治療患者の方が短かった. FAMVIR 500mg の効果は、発疹の発症から 48 時間以内に治療を開始した場合に大きくなりました。また、50歳以上の患者でより深刻でした。ウイルス培養陽性の患者が 1 人以上いた 65.2% の患者のうち、FAMVIR 治療を受けた患者は、プラセボ治療を受けた患者よりもウイルス排出期間の中央値が短かった (それぞれ 1 日と 2 日)。
FAMVIR 治療群とプラセボ治療群の間で、発疹が治癒するまでの痛みの持続時間に全体的な差はありませんでした。さらに、発疹治癒後の痛み(帯状疱疹後神経痛)の発生率には、治療群間で差はありませんでした。帯状疱疹後神経痛を発症した 186 人の患者 (全研究集団の 44.4%) において、帯状疱疹後神経痛の期間の中央値は、プラセボで治療された患者よりも FAMVIR 500 mg で治療された患者で短かった (それぞれ 63 日と 119 日)。高用量の FAMVIR では、追加の有効性は示されませんでした。
実薬対照試験では、545 人の患者が 1 日 3 回の FAMVIR の 3 回投与のうちの 1 回、または 1 日 5 回のアシクロビル 800 mg で治療されました。完全な病変の痂皮化までの時間と急性疼痛の消失までの時間は、すべてのグループで同等であり、FAMVIR とアシクロビル治療群の間で帯状疱疹後神経痛の消失までの時間に統計的に有意な差はありませんでした。
患者情報
ファムビア® (ファムビア)(ファムシクロビル)錠
FAMVIR の服用を開始する前、および補充を受けるたびに、この患者情報をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
ファムビアとは?
ファムビルは、次の目的で使用される処方抗ウイルス薬です。
- 健康な成人の口唇ヘルペス(熱性水疱)の発生を治療する
- 健康な成人の性器ヘルペスの発生を治療する
- 健康な成人の性器ヘルペスの発生数を減らす
- HIVに感染した人々の口、性器、および肛門領域の中または周囲の単純ヘルペス病変の発生を治療する
- 免疫系が正常な成人の帯状疱疹(帯状疱疹)の治療
FAMVIR 500mg が 18 歳未満の子供に安全で有効であるかどうかはわかっていません。
FAMVIR 250mg は、ヘルペスの治療法ではありません。 FAMVIR が他の人へのヘルペスの広がりを止めることができるかどうかはわかっていません。性的に活発な場合は、FAMVIR を服用していてもパートナーにヘルペスをうつす可能性があります。ヘルペスは、活動的な症状がなくても感染する可能性があります。性器ヘルペスを他人に広める可能性を下げるために、より安全なセックスを実践し続ける必要があります。性器ヘルペスの発生中、または性器ヘルペスの症状がある場合は、パートナーと性的接触をしないでください.性的接触がある場合は、ラテックスまたはポリウレタン製のコンドームを使用してください。より安全な性行為の詳細については、医療提供者にお尋ねください。
FAMVIR を服用してはいけない人は?
FAMVIR 250mg の成分または Denavir® (ペンシクロビル クリーム) にアレルギーがある場合は、FAMVIR 250mg を服用しないでください。 FAMVIR の成分の完全なリストについては、この患者情報リーフレットの最後を参照してください。
FAMVIR 500mg を服用する前に医療提供者に何を伝えるべきですか?
FAMVIR 500mg の服用を開始する前に、次の場合は医療提供者に伝えてください。
- 腎臓または肝臓に問題がある
- ガラクトース不耐症、重度のラクターゼ欠乏症、またはグルコース - ガラクトースを吸収しない(吸収不良)というまれな遺伝的問題がある
- 妊娠中または妊娠を計画している。 FAMVIR 250mgが胎児に害を及ぼすかどうかは不明です
- 妊娠暴露報告: ノバルティス ファーマシューティカルズ コーポレーションは、自発的に報告される妊娠報告を収集します。妊娠の場合は、妊娠の報告について医療提供者に相談してください
- 母乳育児をしている、または母乳育児を計画している
処方薬、非処方薬、ビタミン、ハーブのサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。特に以下を服用している場合は、医療提供者に伝えてください。
- ヘルペスの発生を治療するために使用するその他の医薬品や製品
- プロベネシド(プロバラン)
服用している薬を知る。それらのリストを手元に置いて、新しい薬を入手するたびに医療従事者や薬剤師に見せてください.
ファムビアはどのように服用すればよいですか?
- FAMVIR を処方されたとおりに服用する
- 担当の医療提供者は、FAMVIR の服用量と服用時期を教えてくれます。 FAMVIR 250mgの服用量と服用頻度は、状態によって異なる場合があります
- FAMVIR は食事の有無にかかわらず服用できます
- 気分が良くなったとしても、処方された薬をすべて飲み終えることが重要です
- FAMVIR をすべて終了しても症状が続く場合があります。これは、FAMVIR 500mg のフル コースをすでに終了しており、体内で引き続き作用するため、さらに薬が必要という意味ではありません。自分の状態や治療について質問がある場合は、医療提供者に相談してください
FAMVIR 250mg で起こりうる副作用は何ですか?
FAMVIR 500mg の最も一般的な副作用は次のとおりです。
- 頭痛
- 吐き気
気になる副作用や治らない副作用がある場合は、医療提供者に相談してください。
これらは、FAMVIR の考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医療提供者に連絡してください。 1-800-FDA1088 で副作用を FDA に報告できます。
ファムビア 500mg の保存方法を教えてください。
- FAMVIR は 59°F ~ 86°F (15°C ~ 30°C) の室温で保管してください。
FAMVIR およびすべての医薬品は、子供の手の届かないところに保管してください。
FAMVIRに関する一般情報
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。 FAMVIR が処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、FAMVIR 500mg を与えないでください。それらに害を及ぼす可能性があります。
このリーフレットには、FAMVIR に関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療提供者または薬剤師は、医療専門家向けに書かれた FAMVIR 500mg に関する情報を提供できます。詳細については、www.FAMVIR.com にアクセスするか、1-888-669-6682 までお電話ください。
ファムビアの成分は?
有効成分: ファムシクロビル
不活性成分: ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、乳糖、ステアリン酸マグネシウム、ポリエチレングリコール、デンプングリコール酸ナトリウム、二酸化チタン
