Epivir 150mg Lamivudine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
エピビルとは何ですか?また、どのように使用されますか?
Epivir 150mg は、HIV 感染症および慢性 B 型肝炎の症状を治療するために使用される処方薬です。Epivir 150mg は、単独で、または他の薬と併用して使用できます。
エピビルは、B型肝炎/C型肝炎薬と呼ばれる薬のクラスに属しています。 HIV、NRTI。
Epivir が生後 3 か月未満の子供に安全で効果があるかどうかはわかっていません。
Epivir 150mg の副作用の可能性は何ですか?
Epivir は、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 異常な筋肉痛、
- 胃痛、
- 嘔吐、
- 不規則な心拍数、
- めまい、
- 寒いです、
- 弱点、
- 疲れ、
- 上腹部の激しい痛みが背中に広がり、
- 吐き気、
- 速い心拍数、
- あなたの中央部の周りの腫れ、
- 右上腹部の痛み、
- 食欲減少、
- 暗い尿、
- 粘土色の便、
- 皮膚や目の黄変(黄疸)、
- 熱、
- 寝汗、
- 腫れた腺、
- 口唇ヘルペス、
- 咳、
- 喘鳴、
- 下痢、
- 減量、
- 話したり飲み込んだりするのに問題があり、
- バランスや眼球運動の問題、
- チクチク感、
- 首や喉の腫れ(甲状腺肥大)、
- 月経の変化、および
- インポテンス
上記の症状がある場合は、すぐに医療機関を受診してください。
エピビルの最も一般的な副作用は次のとおりです。
- 吐き気、
- 下痢、
- 頭痛、
- 熱、
- 疲れ、
- 一般的な不快感、
- 耳の痛みや満腹感、
- 難聴、
- 耳からの排水、
- 子供のうるさい、
- 鼻づまり、
- くしゃみ、
- 喉の痛み、そして
- 咳
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、エピビルの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
B型肝炎の悪化、およびエピビルのさまざまな処方。
B型肝炎の増悪
型肝炎ウイルス (HBV) とヒト免疫不全ウイルス (HIV-1) に同時感染し、EPIVIR を中止した患者では、B 型肝炎の重度の急性増悪が報告されています。 EPIVIR の使用を中止し、HIV-1 と HBV に同時感染している患者では、少なくとも数か月間、臨床および臨床検査の両方で肝機能を綿密に監視する必要があります。適切な場合、抗 B 型肝炎治療の開始が正当化される場合があります [警告と注意事項を参照]。
ラミブジン含有製品間の重要な違い
EPIVIR 150mg 錠剤および経口液剤 (HIV-1 感染症の治療に使用) には、EPIVIR-HBV 錠剤および経口液剤 (慢性 HBV 感染症の治療に使用) よりも高用量の有効成分 (ラミブジン) が含まれています。 HIV-1 感染患者は、HIV-1 の治療に適した剤形のみを服用する必要があります [警告と注意事項を参照]。
説明
EPIVIR (別名 3TC) は、HIV-1 および HBV に対する活性を持つ合成ヌクレオシド類似体であるラミブジンの商品名です。ラミブジンの化学名は、(2R,cis)-4-アミノ-1(2-ヒドロキシメチル-1,3-オキサチオラン-5-イル)-(1H)-ピリミジン-2-オンです。ラミブジンは、シチジンのジデオキシ類似体の (-) エナンチオマーです。ラミブジンは、(-)2',3'-ジデオキシ、3'チアシチジンとも呼ばれています。分子式は C8H11N3O3S で、分子量は 1 モルあたり 229.3 g です。次の構造式があります。
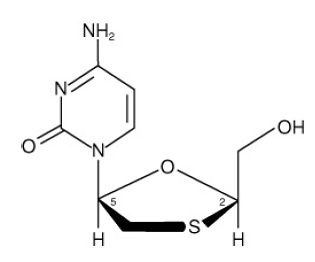
ラミブジンは白色からオフホワイトの結晶性固体で、20°C の水に約 70 mg/mL の溶解度があります。
EPIVIR 150mg錠は経口投与用です。スコアリングされた 150 mg の各フィルムコーティング錠には、150 mg のラミブジンと、不活性成分であるヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、ポリソルベート 80、デンプン グリコール酸ナトリウム、および二酸化チタンが含まれています。
各 300 mg フィルムコーティング錠には、300 mg のラミブジンと、不活性成分である黒色酸化鉄、ヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、ポリソルベート 80、デンプン グリコール酸ナトリウム、および二酸化チタンが含まれています。
EPIVIR 経口溶液は、経口投与用です。 1 ミリリットル (1 mL) の EPIVIR 経口溶液には、水溶液中に 10 mg のラミブジン (1 mL あたり 10 mg) と、不活性成分である人工のイチゴとバナナのフレーバー、クエン酸 (無水)、メチルパラベン、プロピレングリコール、プロピルパラベン、クエン酸ナトリウムが含まれています。 (二水和物)、およびスクロース (200 mg)。
適応症
EPIVIR 150mg は、ヒト免疫不全ウイルス 1 型 (HIV-1) 感染症の治療のために、他の抗レトロウイルス薬との併用が適応となるヌクレオシド アナログです。
使用制限
- この製品の投与量は HIV-1 に対するものであり、HBV に対するものではありません。
投薬と管理
成人患者の推奨用量
HIV-1 に感染した成人における EPIVIR 150mg の推奨用量は、1 日 300 mg であり、1 日 2 回 150 mg を経口摂取するか、1 日 1 回 300 mg を食物の有無にかかわらず経口摂取します。 HIV-1 と HBV に感染した患者にラミブジンを投与する場合、HIV-1 治療に示された用量を適切な併用レジメンの一部として使用する必要があります。 警告と注意事項 ]。
小児患者の推奨用量
EPIVIR 150mg スコア付き錠剤は、少なくとも 14 kg の体重があり、固形剤形が適切な HIV-1 に感染した小児患者に適した製剤です。 EPIVIR スコア付き錠剤を処方する前に、小児患者の錠剤を飲み込む能力を評価する必要があります。 EPIVIR 150mg錠を安全かつ確実に飲み込むことができない患者には、経口溶液製剤が処方されることがあります[ 警告と注意事項 ]。 HIV-1 に感染した小児患者に対する EPIVIR 150mg 錠剤の推奨経口投与量を表 1 に示します。
内服液
生後 3 か月以上の HIV-1 に感染した小児患者における EPIVIR 150mg 経口溶液の推奨投与量は、1 日 2 回経口投与で 1 kg あたり 5 mg、または 1 日 1 回経口投与で 1 kg あたり 10 mg です (1 日最大 300 mg まで)。他の抗レトロウイルス剤と組み合わせて投与する[参照 臨床薬理学 ]。経口溶液による治療を開始する患者の投与間隔を選択する際は、HIV-1 ウイルス量および CD4+ 細胞数/パーセンテージを考慮してください [参照 警告と注意事項 、 臨床薬理学 ]。
腎障害のある患者
EPIVIR 150mgの投与量は、腎機能に応じて調整されます。投与量の調整を表 2 に示します [ 臨床薬理学 ]。
通常の(4 時間の)血液透析または腹膜透析の後に、EPIVIR 150mg を追加投与する必要はありません。
腎機能障害のある小児患者に EPIVIR の特定の用量調整を推奨するにはデータが不十分ですが、用量の削減および/または投与間隔の延長を検討する必要があります。
供給方法
剤形と強度
EPIVIRスコア付き錠剤
EPIVIR スコア付き錠剤には、150 mg のラミブジンが含まれています。錠剤は、両面に「GX CJ7」とデボス加工された白色のひし形のスコア付きフィルムコーティング錠です。
エピビル錠
EPIVIR 錠剤には 300 mg のラミブジンが含まれています。タブレットは灰色で、修正された菱形で、フィルムコーティングされており、片面に「GX EJ7」と刻印され、裏面には無地です。
エピビア内用液
EPIVIR 内用液には、1 mL あたり 10 mg のラミブジンが含まれています。溶液は無色透明から淡黄色のストロベリー バナナ風味の透明な液体です。
保管と取り扱い
エピビル 刻みのある錠剤は 150 mg のラミブジンを含み、白色のひし形で、フィルム コーティングが施され、両面に「GX CJ7」と刻印されています。次のようにパッケージ化されています。
60錠入りボトル( NDC 49702-203-18) チャイルド レジスタント クロージャー付き。
エピビル 錠剤は 300 mg のラミブジンを含み、灰色で変形したひし形で、フィルムコーティングされており、片面に「GX EJ7」と刻印され、裏面には無地です。次のようにパッケージ化されています。
30粒入りボトル( NDC 49702-204-13) チャイルド レジスタント クロージャー付き。
推奨ストレージ
EPIVIR 錠剤は 25°C (77°F) で保管してください。 15° から 30°C (59° から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。
EPIVIR 内服液は、無色透明から淡黄色のストロベリー バナナ風味の液体です。溶液の各 mL には、10 mg のラミブジンが含まれています。次のようにパッケージ化されています。
240 mL のプラスチック ボトル (NDC 49702-205-48) で、チャイルド レジスタント クロージャー付き。この製品は再構成を必要としません。
密閉したボトルに入れ、25°C (77°F) で保管してください [参照 USP制御の室温 ]。
製造元: ViiV Healthcare Research Triangle Park, NC 27709. by: GlaxoSmithKline Research Triangle Park, NC 27709, Shire Pharmaceuticals Group plc. の契約に基づいて製造。改訂: 2018 年 4 月
副作用
次の有害反応は、ラベルの他のセクションで説明されています。
- B型肝炎の増悪[参照 囲み警告 、 警告と注意事項 ]。
- 乳酸アシドーシスおよび脂肪症を伴う重度の肝腫大[参照 警告と注意事項 ]。
- HIV-1 と C 型肝炎の同時感染患者における肝代償不全 [参照 警告と注意事項 ]。
- 膵炎 [参照 警告と注意事項 ]。
- 免疫再構築症候群 [参照 警告と注意事項 ]。
臨床試験の経験
成人被験者での臨床試験経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
成人における EPIVIR 150mg の安全性プロファイルは、主に 7 つの臨床試験における 3,568 人の HIV-1 感染者に基づいています。
最も一般的な副作用は、頭痛、吐き気、倦怠感、疲労、鼻の兆候と症状、下痢、咳です。
EPIVIR 150 mg を 1 日 2 回、RETROVIR 200 mg を 1 日 3 回、最大 24 週間の治療中に被験者の 5% 以上で選択された臨床的有害反応を表 3 に示します。
膵炎
対照臨床試験 EPV20001、NUCA3001、NUCB3001、NUCA3002、NUCB3002、および NUCB3007 で EPIVIR 150mg を投与された 2,613 人の成人被験者のうち 9 人 (0.3%) で膵炎が観察された [参照 警告と注意事項 ]。
EPIVIR 300 mg 1 日 1 回
EPIVIR 300 mg を 1 日 1 回または EPIVIR 150 mg を 1 日 2 回 (EPV20001 および EPV40001 の 3 剤併用レジメンで) 48 週間投与された被験者で報告された臨床的副作用の種類と頻度は同様でした。
治療中に観察された選択された臨床検査値の異常を表 4 にまとめます。
EPIVIR 300 mg を 1 日 1 回または EPIVIR 150 mg を 1 日 2 回(EPV20001 および EPV40001 の 3 剤併用レジメンで)投与された被験者で報告された特定の臨床検査値異常の頻度は同様でした。
小児被験者における臨床試験の経験
EPIVIR 経口溶液は、3 つの臨床試験で生後 3 か月から 18 歳までの 638 人の小児被験者で研究されています。
選択された臨床的有害反応および身体所見が5%以上の頻度で、EPIVIR 4 mg / kgを1日2回、およびRETROVIR 160 mg / m²を1日3回、治療未経験(56日以下の抗レトロウイルス薬)治療)小児対象は表5に記載されています。
膵炎
場合によっては致命的な膵炎が、EPIVIR 単独または他の抗レトロウイルス剤と組み合わせて投与された抗レトロウイルスヌクレオシド経験のある小児被験者で観察されています。非盲検用量漸増試験 (NUCA2002) では、14 人の被験者 (14%) が EPIVIR の単剤療法を受けている間に膵炎を発症しました。これらの被験者のうち 3 人は、膵炎の合併症で死亡しました。 2 番目の非盲検試験 (NUCA2005) では、12 人の被験者 (18%) が膵炎を発症しました。 ACTG300 試験では、EPIVIR 150mg と RETROVIR に無作為に割り付けられた 236 人の被験者で膵炎は観察されませんでした。ジダノシン単剤療法の中止後に非盲検 EPIVIR と RETROVIR およびリトナビルを併用投与されたこの試験の被験者 1 人に膵炎が観察された [参照 警告と注意事項 ]。
感覚異常と末梢神経障害
感覚異常および末梢神経障害は、NUCA2002 試験で 15 例(15%)、NUCA2005 試験で 6 例(9%)、ACTG300 試験で 2 例(1%未満)で報告されました。
未治療(56 日以下の抗レトロウイルス療法)の小児被験者が経験した選択された臨床検査値の異常を表 6 に示します。
小児被験者の 1 日 1 回投与と 1 日 2 回投与の比較 (COL105677)
ARROW試験では、EPIVIR 150mgの1日2回投与と比較した1日1回投与の安全性が評価されました。 ARROW 試験の一次安全性評価は、グレード 3 およびグレード 4 の有害事象に基づいていました。グレード 3 および 4 の有害事象の頻度は、1 日 2 回投与に無作為化された被験者と比較して、1 日 1 回投与に無作為化された被験者間で同様でした。 1 日 1 回のコホートにおけるグレード 4 の肝炎の 1 つのイベントは、研究者によって不確実な因果関係と見なされ、他のすべてのグレード 3 または 4 の有害事象は研究者によって関連がないと見なされました。
新生児
妊娠 38 週または 36 週から母体治療を開始した後、生後 1 週間、ジドブジンを併用または併用せずにラミブジンを投与された新生児を対象とした 2 件の小規模な非対照試験から、限られた短期の安全性情報が得られています。 臨床薬理学 ]。これらの新生児で報告された主な副作用には、肝機能検査の増加、貧血、下痢、電解質障害、低血糖、黄疸および肝腫大、発疹、呼吸器感染症、および敗血症が含まれます。 3 人の新生児が死亡した (1 人はアシドーシスと痙攣を伴う胃腸炎、1 人は外傷、1 人は原因不明)。致命的ではない胃腸炎または下痢の症例が他に 2 例報告されており、そのうち 1 例は痙攣を伴うものでした。 1 人の乳児は、脱水に伴う一過性の腎不全を起こしていました。対照群が存在しないため、因果関係の評価が制限されますが、周産期に曝露された乳児は、ラミブジンを含む併用レジメンで治療された小児および成人の HIV-1 感染患者で報告された副作用に匹敵する副作用のリスクがあると想定する必要があります。子宮内および乳児のラミブジン曝露の長期的な影響は不明です。
市販後の経験
EPIVIRの承認後の使用中に、次の副作用が確認されました。これらの反応は未知の規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。これらの反応は、その深刻さ、報告の頻度、またはラミブジンとの潜在的な因果関係の組み合わせにより、含めるために選択されました。
体全体
体脂肪の再分配/蓄積。
内分泌および代謝
高血糖。
全般的
弱点。血行性貧血およびリンパ性貧血(純粋な赤血球形成不全および治療中に進行する重度の貧血を含む)。
肝臓および膵臓
乳酸アシドーシスおよび脂肪肝 [参照 警告と注意事項 ]、B型肝炎の治療後の増悪[参照 警告と注意事項 ]。
過敏症
アナフィラキシー、蕁麻疹。
筋骨格
筋力低下、CPK 上昇、横紋筋融解症。皮膚脱毛症、かゆみ。
薬物相互作用
有機陽イオン輸送体を阻害する薬剤
ラミブジンは、活発な有機カチオン分泌によって主に尿中に排出されます。同時に投与される他の薬物との相互作用の可能性を考慮する必要があります。特に、それらの主な排泄経路が有機陽イオン輸送系(例、トリメトプリム)を介した能動的な腎分泌である場合は注意が必要です。 臨床薬理学 ]。ラミブジンと同様の腎クリアランス メカニズムを持つ他の薬剤との相互作用に関するデータはありません。
ソルビトール
ラミブジンとソルビトールの単回投与の同時投与により、ラミブジン曝露がソルビトールの用量依存的に減少しました。可能であれば、ラミブジンと一緒にソルビトールを含む薬を使用することは避けてください。 警告と注意事項 、 臨床薬理学 ]。
警告
の一部として含まれています 予防 セクション。
予防
B型肝炎ウイルスの同時感染患者
肝炎の治療後の増悪
ラミブジンの中止後に、肝炎の増悪の臨床的および実験的証拠が発生しています。これらの増悪は、主に HBV DNA の再出現に加えて、血清 ALT 上昇によって検出されています。ほとんどのイベントは自然に収束したように見えますが、死亡例がいくつか報告されています。 HIV-1 と HBV の両方に感染した患者において、ラミブジンを含む HIV-1 治療レジメンからラミブジンを含まないレジメンに変更した後の市販後の経験から、同様の事象が報告されています。ラミブジン治療中止との因果関係は不明です。患者は、治療を中止してから少なくとも数か月間、臨床および検査室でのフォローアップにより注意深く監視する必要があります。
ラミブジン含有製品間の重要な違い
EPIVIR 150mg 錠剤および経口溶液には、EPIVIR-HBV 錠剤および EPIVIR-HBV 経口溶液よりも高用量の同じ有効成分 (ラミブジン) が含まれています。 EPIVIR-HBV は、慢性 B 型肝炎患者向けに開発されました。EPIVIR-HBV のラミブジンの処方と投与量は、HIV-1 と HBV に同時感染した患者には適していません。ラミブジンの安全性と有効性は、HIV-1 と HBV の同時感染患者における慢性 B 型肝炎の治療について確立されていません。 EPIVIR-HBV による治療が、認識されていない、または治療されていない HIV-1 感染を有する患者の慢性 B 型肝炎に処方された場合、HIV-1 治療の単剤療法は治療量以下で不適切であるため、HIV-1 耐性が急速に出現する可能性があります。 HIV-1 と HBV の同時感染患者にラミブジンを投与する決定が下された場合、EPIVIR 150mg 錠剤、EPIVIR 150mg 経口溶液、またはより高用量のラミブジンを含む別の製品を、適切な併用レジメンの一部として使用する必要があります。
ラミブジン耐性HBVの出現
ラミブジンの安全性と有効性は、HIV-1 と HBV に二重感染している被験者の慢性 B 型肝炎の治療について確立されていません (EPIVIR-HBV の完全な処方情報を参照してください)。ラミブジンに対する耐性に関連する B 型肝炎ウイルス変異体の出現は、B 型肝炎ウイルスの同時感染の存在下でラミブジンを含む抗レトロウイルス療法を受けた HIV-1 感染者でも報告されています。
乳酸アシドーシスおよび脂肪症を伴う重度の肝腫大
EPIVIR を含むヌクレオシド類似体の使用により、乳酸アシドーシスおよび脂肪症を伴う重度の肝腫大が報告されています。これらの症例の大半は女性でした。女性の性別と肥満は、抗レトロウイルスヌクレオシドアナログで治療された患者における乳酸アシドーシスおよび脂肪症を伴う重度の肝腫大の発症の危険因子である可能性があります。 EPIVIR による治療は、乳酸アシドーシスまたは明らかな肝毒性を示唆する臨床所見または臨床検査所見を示す患者には中止する必要があります。
インターフェロンおよびリバビリンベースのレジメンでの使用
インビトロ研究は、リバビリンがラミブジンなどのピリミジンヌクレオシド類似体のリン酸化を減少させることができることを示しています。 HIV-1/HCV 同時感染患者にリバビリンをラミブジンと併用投与した場合、薬物動態学的または薬力学的相互作用 (例えば、HIV-1/HCV ウイルス抑制の喪失) の証拠は見られなかったが [ 臨床薬理学 ]、リバビリンを併用するまたは併用しないHIV-1とインターフェロンアルファの併用抗レトロウイルス療法を受けているHIV-1/HCV同時感染患者で、肝代償不全(致命的なものもある)が発生しています。リバビリンおよび EPIVIR の併用または非併用でインターフェロン アルファを投与されている患者は、治療に関連する毒性、特に肝代償不全について注意深く監視する必要があります。 EPIVIR 150mg の中止は、医学的に適切であると考えるべきです。インターフェロンアルファ、リバビリン、またはその両方の減量または中止も、肝代償不全などの臨床毒性の悪化が観察された場合(例、Child-Pughが6を超える場合)を考慮する必要があります。インターフェロンとリバビリンの完全な処方情報を参照してください。
膵炎
以前に抗レトロウイルスヌクレオシドに曝露した病歴、膵炎の病歴、または膵炎発症のその他の重大な危険因子を持つ小児患者では、EPIVIR 150mg を慎重に使用する必要があります。 EPIVIR 150mgによる治療は、臨床徴候、症状、または膵炎を示唆する検査値異常が発生した場合は直ちに中止する必要があります[ 有害反応 ]。
免疫再構築症候群
免疫再構築症候群は、EPIVIR を含む併用抗レトロウイルス療法で治療された患者で報告されています。併用抗レトロウイルス治療の初期段階では、免疫系が反応する患者は、無痛性または残存する日和見感染症(マイコバクテリウム・アビウム感染症、サイトメガロウイルス、ニューモシスチス・ジロベチ肺炎[PCP]、または結核など)に対する炎症反応を発症する可能性があり、さらなる評価が必要になる場合があります。と治療。
自己免疫障害 (バセドウ病、多発性筋炎、ギラン・バレー症候群など) も免疫再構築の状況で発生することが報告されていますが、発症までの時間はよりばらつきがあり、治療開始から数か月後に発生する可能性があります。
ウイルス学的抑制率の低下と経口溶液によるウイルス耐性のリスクの増加
ARROW 試験の任意の時点で、EPIVIR 150mg 経口溶液 (1 日あたり 1 kg あたり約 8 mg の体重帯ベースの用量) を他の抗レトロウイルス経口溶液と同時に投与された小児被験者は、ウイルス学的抑制の割合が低く、血漿ラミブジン曝露が低く、 EPIVIR 錠剤を投与された患者よりもウイルス耐性が高い [参照 臨床薬理学 、 微生物学 、 臨床研究 ]。
EPIVIR スコア付き錠剤は、少なくとも 14 kg の体重があり、固形剤形が適切な HIV-1 に感染した小児患者に適した製剤です。可能であれば、ソルビトールとの潜在的な相互作用を避けるために、すべての錠剤のレジメンを使用する必要があります。 臨床薬理学 ]。 EPIVIR 150mg 経口溶液で治療する場合は、HIV-1 ウイルス量をより頻繁にモニタリングすることを検討してください。
患者相談情報
FDA 承認の患者ラベル (患者情報) を読むよう患者に助言します。
B型肝炎またはC型肝炎の重複感染の患者
HIV-1 と HBV に重複感染している患者には、ラミブジンによる治療を中止したときに肝疾患の悪化が見られたことを伝えてください。レジメンの変更については、担当の医療提供者と話し合うように患者に助言する [参照 警告と注意事項 ]。
HIV-1/HCV 重複感染患者に、HIV-1 とリバビリンを併用するまたは併用しない抗レトロウイルス療法とインターフェロン アルファの併用療法を受けている HIV-1/HCV 重複感染患者で、肝代償不全(致命的な場合もある)が発生したことを知らせる。 警告と注意事項 ]。
EPIVIRの処方の違い
EPIVIR 150mg 錠剤および経口液剤には、EPIVIR-HBV 錠剤および経口液剤と同じ有効成分 (ラミブジン) が高用量で含まれていることを患者に伝えてください。 HIV-1 と HBV に重複感染している患者の HIV-1 治療レジメンにラミブジンを含める決定が下された場合、EPIVIR (EPIVIR-HBV ではなく) のラミブジンの処方と投与量を使用する必要があります [ 警告と注意事項 ]。
乳酸アシドーシス/脂肪肝を伴う肝腫大
ヌクレオシド類似体やその他の抗レトロウイルス薬の使用により、乳酸アシドーシスや脂肪症を伴う重度の肝腫大が報告されていることを患者に助言する。乳酸アシドーシスまたは顕著な肝毒性を示唆する臨床症状が現れた場合は、EPIVIR の服用を中止するよう患者に助言する [ 警告と注意事項 ]。
膵炎のリスク
親または保護者に、小児患者の膵炎の徴候と症状を監視するように助言する [参照 警告と注意事項 ]。
免疫再構築症候群
EPIVIR の開始時を含め、併用抗レトロウイルス療法の直後に以前の感染による炎症が発生する可能性があるため、感染の徴候や症状があればすぐに医療従事者に知らせるよう患者に助言する [ 警告と注意事項 ]。
ウイルス学的抑制率の低下と経口溶液によるウイルス耐性のリスクの増加
他の抗レトロウイルス経口液剤と同時に EPIVIR 経口液剤を投与された小児被験者では、治療失敗率が増加するため、可能であれば全錠レジメンを使用する必要があることを患者に助言する [ 警告と注意事項 ]。
EPIVIR 経口液剤のショ糖含有量
糖尿病患者には、EPIVIR 経口溶液 15 mL の各用量に 3 グラムのスクロースが含まれていることをアドバイスします (1 mL = 200 mg のスクロース) [参照 説明 ]。
妊娠登録簿
妊娠中に EPIVIR に暴露した女性の妊娠転帰を監視する妊娠暴露レジストリがあることを患者に助言する [ 特定の集団での使用 ]。
授乳
HIV-1 は母乳を通じて赤ちゃんに感染する可能性があるため、HIV-1 に感染している女性には母乳を与えないように指導してください [ 特定の集団での使用 ]。
飲み忘れ
EPIVIR 150mgを飲み忘れた場合は、気がついたらすぐに服用するように患者に指示してください。次回の服用量を 2 倍にしたり、処方された服用量を超えて服用したりしないように患者に助言する [参照 投薬と管理 ]。
EPIVIR および RETROVIR は、ヴィーブ ヘルスケア グループ企業が所有またはライセンス供与している商標です。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
マウスおよびラットにおけるラミブジンの長期発がん性研究では、推奨用量 300 mg でのヒト曝露の最大 10 倍 (マウス) および 58 倍 (ラット) の曝露で発がん性の証拠は示されませんでした。
突然変異誘発
ラミブジンは、L5178Y マウスリンパ腫アッセイで変異原性を示し、培養ヒトリンパ球を使用した細胞遺伝学的アッセイで染色体異常誘発性を示しました。ラミブジンは、微生物変異原性試験、in vitro 細胞形質転換試験、ラット小核試験、ラット骨髄細胞遺伝学的試験、およびラット肝臓における不定期 DNA 合成試験において変異原性を示さなかった。ラミブジンは、1 kg あたり最大 2,000 mg の経口用量でラットに in vivo 遺伝毒性活性の証拠を示さず、HIV-1 感染の推奨用量でヒトの血漿レベルの 35 ~ 45 倍を生成しました。
生殖能力の障害
生殖能力の研究では、ラミブジンをラットに 1 日 1 kg あたり最大 4,000 mg の用量で投与すると、血漿レベルがヒトの 47 ~ 70 倍になりましたが、生殖能力の障害の証拠はなく、生存、成長、発達に影響がないことが明らかになりました。子孫の離乳に。
特定の集団での使用
妊娠
妊娠暴露登録
妊娠中に EPIVIR に暴露した女性の妊娠転帰を監視する妊娠暴露レジストリがあります。医療提供者は、Antiretroviral Pregnancy Registry (APR) (1-800-258-4263) に電話して患者を登録することをお勧めします。
リスクの概要
APR から入手可能なデータは、メトロポリタン アトランタ先天性欠損症プログラム (MACDP) 参照母集団における 2.7% の先天性欠損症のバックグラウンド率と比較して、ラミブジンの先天性欠損症の全体的なリスクに違いがないことを示しています (以下を参照)。 データ )。 APR は、MACDP を一般集団の先天性欠損症の米国参照母集団として使用します。 MACDP は、限られた地域の女性と乳児を評価するものであり、妊娠 20 週未満で発生した出産の結果は含まれていません。 APR では流産率は報告されていません。米国の一般集団における臨床的に認識された妊娠における流産の推定背景率は、15%~20%です。示された集団の重大な先天性欠損症および流産の背景リスクは不明です。
動物生殖研究では、器官形成期の妊娠ウサギへのラミブジンの経口投与は、推奨される臨床用量と同様の全身暴露 (AUC) で胚致死をもたらしました。しかし、ラミブジンを妊娠中のラットに器官形成中に推奨臨床用量の 35 倍の血漿中濃度 (Cmax) で経口投与した場合、有害な発生効果は観察されませんでした。 データ )。
データ
ヒューマンデータ
妊娠中に 11,000 人以上がラミブジンに暴露されて生児が出生した (妊娠初期に暴露された 4,500 人以上を含む) という APR への前向き報告に基づくと、バックグラウンドの先天性欠損症率と比較して、ラミブジンの先天性欠損症の全体的なリスクに差はありませんでした。 MACDP の米国参照母集団では 2.7% です。生児出生における欠陥の有病率は、ラミブジン含有レジメンへの第 1 トリメスター曝露後では 3.1% (95% CI: 2.6% ~ 3.6%)、第 2/3 トリメスター曝露後では 2.8% (95% CI: 2.5% ~ 3.3%) でした。ラミブジンを含むレジメンへ。
ラミブジンの薬物動態は、南アフリカで実施された 2 つの臨床試験で妊婦を対象に研究されました。試験では、妊娠 36 週の女性 16 例でラミブジン 150 mg を 1 日 2 回ジドブジンと併用し、妊娠 38 週の女性 10 例でラミブジン 150 mg とジドブジンを 1 日 2 回併用し、妊娠 38 週の女性 10 例でラミブジン 300 mg を 2 回使用して薬物動態を評価しました。他の抗レトロウイルス薬なしで毎日。これらの試験は、有効性に関する情報を提供するように設計または強化されていません。ラミブジン濃度は、母体、新生児、および臍帯血清サンプルで一般的に類似していました。被験者のサブセットでは、膜の自然破裂後に羊水検体が採取され、ラミブジンがヒトの胎盤を通過することが確認されました。分娩時の限られたデータに基づくと、ラミブジンの羊水濃度の中央値 (範囲) は、対になった母体血清濃度 (n = 8) と比較して 3.9 (1.2 ~ 12.8) 倍高かった。
動物データ
ラミブジンは、妊娠ラット (90、600、および 4,000 mg/kg/日) およびウサギ (90、300、および 1,000 mg/kg/日、および 15、40、および 90 mg/kg/日) に経口投与されました。器官形成中(妊娠7日目から16日目[ラット]および8日目から20日目[ウサギ])。ラミブジンによる胎児の奇形の証拠は、ラットとウサギで、推奨される 1 日用量でのヒト曝露よりも約 35 倍高い血漿中濃度 (Cmax) を生成する用量で観察されませんでした。初期の胎児致死の証拠は、ヒトで観察されたものと同様のシステム暴露 (AUC) でウサギに見られたが、推奨される 1 日用量でのヒト暴露よりも 35 倍高い血漿濃度 (Cmax) では、ラットではこの影響の徴候はなかった。 .妊娠中のラットを対象とした研究では、ラミブジンが胎盤を通じて胎児に移行することが示されました。ラットの受胎能/出生前および出生後の発育試験では、ラミブジンが 180、900、および 4,000 mg/kg/日 (交配前から生後 20 日目まで) の用量で経口投与されました。この研究では、繁殖力や生殖能力を含む子孫の発育は、母体へのラミブジン投与による影響を受けませんでした。
授乳
リスクの概要
疾病管理予防センターは、米国の HIV-1 に感染した母親が、出生後の HIV-1 感染の伝染のリスクを回避するために乳児に母乳を与えないことを推奨しています。ラミブジンは母乳に含まれています。母乳で育てられた乳児に対するラミブジンの影響、または乳生産に対する薬剤の影響に関する情報はありません。 (1) HIV-1 感染 (HIV 陰性の乳児)、(2) ウイルス耐性の発生 (HIV 陽性の乳児)、および (3) 母乳で育てられた乳児における有害反応の可能性があるため、母親に母乳で育てないように指示するEPIVIR を受け取っている場合。
小児用
EPIVIR 150mg を他の抗レトロウイルス薬と併用した場合の安全性と有効性は、生後 3 か月以上の小児患者で確立されています。 EPIVIR スコア付き錠剤は、少なくとも 14 kg の体重があり、EPIVIR 150 mg 経口溶液を投与された小児被験者はウイルス抑制率が低く、血漿ラミブジン曝露が少ないため、固形剤形が適切な HIV-1 感染小児患者に適した製剤です。 、ARROW 試験で EPIVIR 150mg 錠剤を投与された患者よりも頻繁にウイルス耐性を発症した [参照 投薬と管理 、 警告と注意事項 、 有害反応 、 臨床薬理学 、 臨床研究 ]。
高齢者の使用
EPIVIR の臨床試験には、65 歳以上の被験者が若い被験者と異なる反応を示すかどうかを判断するのに十分な数の被験者が含まれていませんでした。一般に、高齢患者への EPIVIR の投与は、肝機能、腎機能、心機能の低下、および付随する疾患や他の薬物療法の頻度が高いことを反映して、注意を払う必要があります。 投薬と管理 、 臨床薬理学 ]。
腎機能障害のある患者
腎機能障害のある患者には、EPIVIR 150mg の減量が推奨される [参照 投薬と管理 、 臨床薬理学 ]。
過剰摂取
EPIVIR の過剰摂取に対する特定の治療法は知られていません。過剰摂取が発生した場合は、患者を監視し、必要に応じて標準的な支持療法を適用する必要があります。無視できる量のラミブジンが (4 時間の) 血液透析、連続携帯型腹膜透析、および自動腹膜透析によって除去されたため、連続血液透析がラミブジンの過剰摂取イベントで臨床的利益をもたらすかどうかは不明です。
禁忌
EPIVIR 150mg は、以前にラミブジンに対する過敏症反応のある患者には禁忌です。
臨床薬理学
作用機序
ラミブジンは抗レトロウイルス剤です [参照 微生物学 ]。
薬物動態
成人における薬物動態
ラミブジンの薬物動態特性は、無症候性の HIV-1 感染成人被験者を対象に、1 kg あたり 0.25 ~ 8 mg の範囲の単回静脈内 (IV) 用量、および単回および複数回 (1 日 2 回のレジメン) の経口用量を投与した後に研究されています。 1kgあたり0.25から10mgの範囲です。
ラミブジンの薬物動態特性は、HBV 感染患者に 1 日あたり 5 mg から 600 mg の範囲の単回および複数回の経口投与としても研究されています。
EPIVIR 150 mg 錠剤を 1 日 2 回 7 日間投与した場合と比較して、EPIVIR 300 mg 錠剤を 1 日 1 回 7 日間投与した場合の定常状態の薬物動態特性は、60 人の健康な被験者を対象としたクロスオーバー試験で評価されました。 EPIVIR 300 mg を 1 日 1 回投与した結果、血漿 AUC24,ss に関して、EPIVIR 150 mg を 1 日 2 回投与した場合と同様のラミブジン曝露が得られました。ただし、Cmax,ss は 66% 高く、トラフ値は 150 mg 1 日 2 回のレジメンと比較して 53% 低かった。末梢血単核細胞における細胞内ラミブジン三リン酸暴露も、AUC24,ss および Cmax24,ss に関して同様でした。ただし、トラフ値は、150 mg を 1 日 2 回投与するレジメンと比較して低かった。被験者間のばらつきは、細胞内ラミブジン三リン酸濃度とラミブジン血漿トラフ濃度のほうが大きかった。
ラミブジンの薬物動態は、他の抗レトロウイルス剤と組み合わせてラミブジン 150 mg を 1 日 2 回投与された 12 人の成人 HIV-1 感染被験者で評価されました。 AUC(0-12) の幾何平均 (95% CI) は 5.53 (4.58, 6.67) mcg.h/mL で、Cmax は 1.40 (1.17, 1.69) mcg/mL でした。
吸収とバイオアベイラビリティ
12 人の成人被験者における絶対バイオアベイラビリティは、150 mg 錠剤で 86% ± 16% (平均 ± SD)、経口溶液で 87% ± 13% でした。 HIV-1 の成人 9 人に 2 mg/kg を 1 日 2 回経口投与した後、最高血清ラミブジン濃度 (Cmax) は 1.5 ± 0.5 mcg/mL (平均 ± SD) でした。血漿濃度対時間曲線下面積 (AUC) および Cmax は、0.25 ~ 10 mg/kg の範囲で経口投与量に比例して増加しました。
腎機能が正常な HIV-1 陽性の無症候性成人におけるラミブジンの蓄積率は、2 mg/kg を 1 日 2 回、15 日間経口投与した後、1.50 でした。
経口吸収に対する食物の影響
EPIVIR 150mg 錠剤および経口溶液は、食事の有無にかかわらず投与できます。ラミブジンの 25 mg 剤形が 12 人の無症候性の HIV-1 感染被験者に 2 回、1 回は絶食状態で、もう 1 回は食事とともに経口投与されました (1,099 kcal; 脂肪 75 グラム、タンパク質 34 グラム、炭水化物 72 グラム)。 )。ラミブジンの吸収は、絶食状態 (Tmax: 0.9 ± 0.3 時間) と比較して、摂食状態 (Tmax: 3.2 ± 1.3 時間) で遅かった。摂食状態の Cmax は、絶食状態よりも 40% ± 23% (平均値 ± SD) 低かった。摂食状態と絶食状態で、全身暴露 (AUC∞) に有意差はありませんでした。
分布
ラミブジンを 20 人の被験者に IV 投与した後の見かけの分布容積は 1.3 ± 0.4 L/kg であり、ラミブジンが血管外空間に分布することを示唆しています。分布量は用量とは無関係であり、体重とは相関していませんでした。
ラミブジンのヒト血漿タンパク質への結合は 36% 未満です。 In vitro 研究では、1 mL あたり 0.1 ~ 100 mcg の濃度範囲で、赤血球に関連するラミブジンの量は 53% ~ 57% の範囲であり、濃度とは無関係であることが示されました。
代謝
ラミブジンの代謝はマイナーな排出経路です。ヒトでは、ラミブジンの唯一知られている代謝物はトランススルホキシド代謝物です (12 時間後の経口投与量の約 5%)。この代謝物の血清中濃度は測定されていません。ラミブジンは、シトクロム P450 酵素によって有意に代謝されません。
排除
ラミブジンの大部分は、活発な有機カチオン分泌によって変化せずに尿中に排泄されます。ラミブジン 300 mg を単回経口投与された 9 人の健康な被験者では、腎クリアランスは毎分 199.7 ± 56.9 mL (平均 ± SD) でした。 1 回の IV 投与を受けた 20 人の HIV-1 感染被験者では、腎クリアランスは毎分 280.4 ± 75.2 mL (平均 ± SD) であり、ラミブジンの総クリアランスの 71% ± 16% (平均 ± SD) に相当します。
HIV-1 感染被験者、HBV 感染被験者、または投与後 24 時間の血清サンプリングを行った健康な被験者を対象としたほとんどの単回投与試験では、観察された平均消失半減期 (t½) は 5 ~ 7 時間の範囲でした。 HIV-1 感染者では、総クリアランスは毎分 398.5 ± 69.1 mL (平均 ± SD) でした。経口クリアランスおよび排泄半減期は、0.25~10 mg/kg の経口投与範囲で、用量および体重とは無関係でした。
特定の集団
腎障害のある患者
ラミブジンの薬物動態特性は、腎機能障害のある HIV-1 感染成人の小グループで決定されています (表 7)。
Tmax は腎機能の影響をあまり受けませんでした。これらの観察に基づいて、腎機能障害のある患者ではラミブジンの投与量を変更することが推奨されます。 投薬と管理 ]。
腎機能障害のある健康な被験者を対象とした試験に基づくと、血液透析により、ラミブジンクリアランスが平均 64 mL/分から 88 mL/分に増加しました。しかし、血液透析の長さ (4 時間) は、単回投与後の平均ラミブジン曝露を有意に変化させるには不十分でした。連続外来腹膜透析および自動腹膜透析は、ラミブジンクリアランスにほとんど影響を与えません。したがって、クレアチニン クリアランスのための用量の補正後は、通常の血液透析または腹膜透析の後に追加の用量変更を行わないことが推奨されます。
小児患者におけるラミブジンの薬物動態に対する腎障害の影響は知られていない。
肝障害のある患者
ラミブジンの薬物動態特性は、肝機能障害のある成人で測定されています。薬物動態パラメータは、肝機能の低下によって変化しませんでした。非代償性肝疾患の存在下でのラミブジンの安全性と有効性は確立されていません。
妊娠中の女性
ラミブジンの薬物動態は、南アフリカで実施された 2 つの臨床試験中に 36 人の妊婦で研究されました。妊娠中の女性におけるラミブジンの薬物動態は、妊娠していない成人および産後の女性に見られるものと同様でした。ラミブジン濃度は、母体、新生児、および臍帯血清サンプルで一般的に類似していました。
小児患者
ラミブジンの薬物動態は、210 人の小児被験者に EPIVIR を単回または反復投与した後に研究されています。ラミブジン経口溶液 (1 日あたり約 8 mg/kg を投与) を投与された小児被験者は、HIV-1 に感染した成人と比較して、ラミブジンの血漿中濃度が約 25% 低下しました。ラミブジン経口錠剤を投与された小児被験者は、成人で観察されたものと同等またはわずかに高い血漿濃度を達成しました。 EPIVIR 錠剤と経口溶液の両方の絶対的なバイオアベイラビリティは、大人よりも子供の方が低くなっています。 EPIVIR 経口溶液の相対的バイオアベイラビリティは、成人では差がないにもかかわらず、小児対象ではラミブジンを含む錠剤よりも約 40% 低くなります。 EPIVIR 150mg 経口溶液を投与された小児患者におけるラミブジン曝露の低下は、ラミブジンとソルビトールを含む併用溶液 (ZIAGEN など) との相互作用によるものと思われます。薬物動態データのモデリングは、ラミブジンの十分な濃度を達成するために、EPIVIR 経口溶液の投与量を 1 日 2 回経口投与で 1 kg あたり 5 mg、または 1 日 1 回経口投与で 10 mg/kg に増やす必要があることを示唆しています (1 日最大 300 mg まで)。 投薬と管理 ]。この用量でソルビトール含有医薬品と同時投与された HIV-1 感染小児患者の臨床データはありません。
HIV-1 に感染した生後 3 か月から 12 歳までの小児被験者に 1 日 1 回投与されるラミブジンの薬物動態は、3 つの試験 (PENTA-15 [n = 17]、PENTA 13 [n = 19]、および ARROW PK [n = 35])。 3 つの試験はすべて、アバカビルとラミブジンの 1 日 2 回投与と 1 日 1 回投与の 2 期間、クロスオーバー、非盲検薬物動態試験でした。これらの 3 つの試験では、同じ製剤 (すなわち、経口液剤または錠剤製剤) 内の投与レジメンを比較すると、ラミブジンの 1 日 1 回投与は、同じ 1 日総投与量で 1 日 2 回投与と同様の AUC0-24 を提供することが実証されました。平均 Cmax は、ラミブジンを 1 日 2 回投与した場合と比較して、1 日 1 回投与した場合で約 80% から 90% 高かった。
脳脊髄液 (CSF) へのラミブジンの分布は、ラミブジンを複数回経口投与した後、38 人の小児被験者で評価されました。 CSFサンプルは、投与後2時間から4時間の間に収集されました。 1 日 1 kg あたり 8 mg の用量で、8 人の被験者の CSF ラミブジン濃度は、同時血清サンプル中の濃度の 5.6% から 30.9% (平均 ± SD 14.2% ± 7.9%) の範囲であり、CSF ラミブジン濃度は0.04 ~ 0.3 mcg/mL。
南アフリカでの 2 つの試験で、生後 1 週間までの 36 人の乳児にラミブジン (およびジドブジン) を投与した場合の限定的で管理されていない薬物動態および安全性データが入手可能です。これらの試験では、ラミブジンのクリアランスは、以前に研究された小児被験者 (生後 3 か月以上) と比較して、生後 1 週間の新生児で大幅に減少しました。新生児期と生後 3 か月以上の年齢層との間のクリアランスの変化の経時変化を確立するには、情報が不十分である [参照 有害反応 ]。
高齢患者
65 歳以上の被験者に EPIVIR 150mg を投与した後のラミブジンの薬物動態は研究されていない [ 特定の集団での使用 ]。
男性と女性の患者
ラミブジンの薬物動態には、有意または臨床的に関連する性差はありません。
人種グループ
ラミブジンの薬物動態には、有意または臨床的に関連する人種差はありません。
薬物相互作用研究
他の薬剤の薬物動態に対するラミブジンの効果
in vitro 試験の結果に基づいて、治療薬曝露時のラミブジンは、次のトランスポーターの基質である薬物の薬物動態に影響を与えるとは予想されていません。 P-糖タンパク質 (P-gp)、多剤および毒素排出タンパク質 1 (MATE)1、MATE2-K、有機陽イオン輸送体 1 (OCT)1、OCT2、または OCT3。
ラミブジンの薬物動態に対する他の薬剤の影響
ラミブジンは、in vitro で MATE1、MATE2-K、および OCT2 の基質です。トリメトプリム (これらの薬物輸送体の阻害剤) は、ラミブジンの血漿濃度を増加させることが示されています。ラミブジンの用量調整が必要ないため、この相互作用は臨床的に重要であるとは見なされません。
ラミブジンは、P-gp および BCRP の基質です。ただし、その絶対的なバイオアベイラビリティ (87%) を考慮すると、これらのトランスポーターがラミブジンの吸収に重要な役割を果たすとは考えにくいです。したがって、これらの排出トランスポーターの阻害剤である薬物の同時投与は、ラミブジンの体内動態および排泄に影響を与える可能性は低いです。
インターフェロンアルファ
19 人の健康な男性被験者を対象とした試験では、ラミブジンとインターフェロン α の間に有意な薬物動態学的相互作用はありませんでした [参照 警告と注意事項 ]。
リバビリン
in vitro データは、リバビリンがラミブジン、スタブジン、およびジドブジンのリン酸化を減少させることを示しています。しかし、リバビリンとラミブジン (n = 18)、スタブジン (n = 10) の場合、薬物動態 (例、血漿中濃度または細胞内三リン酸化活性代謝物濃度) または薬力学 (例、HIV-1/HCV ウイルス抑制の喪失) の相互作用は観察されませんでした。 、またはジドブジン (n = 6) が、HIV-1/HCV 同時感染被験者への多剤レジメンの一部として同時投与された [参照 警告と注意事項 ]。
ソルビトール(賦形剤)
ラミブジンとソルビトールの溶液は、非盲検、ランダム化シーケンス、4 期間、クロスオーバー試験で 16 人の健康な成人被験者に同時投与されました。各被験者は、ラミブジン経口溶液 300 mg を単回投与するか、溶液中のソルビトール 3.2 グラム、10.2 グラム、または 13.4 グラムの単回投与と同時投与しました。ラミブジンとソルビトールの同時投与は、AUC(0-24) で 20%、39%、および 44%、AUC(∞) で 14%、32%、および 36%、および 28% の用量依存的な減少をもたらしました。 52%、Cmax で 55%。それぞれラミブジンの。
トリメトプリム/スルファメトキサゾール
ラミブジンと TMP/SMX は、単一施設、非盲検、無作為化、クロスオーバー試験で 14 人の HIV-1 陽性被験者に同時投与されました。各被験者は、ラミブジン 300 mg と TMP 160 mg/SMX 800 mg を 1 日 1 回 5 日間、5 回目のクロスオーバー デザインでラミブジン 300 mg と併用投与されました。 TMP/SMX とラミブジンの同時投与により、ラミブジンの AUC∞ が 43% ± 23% (平均値 ± SD) 増加し、ラミブジンの経口クリアランスが 29% ± 13% 減少し、ラミブジンの経口クリアランスが 30% ± 36% 減少しました。ラミブジン腎クリアランス。 TMP および SMX の薬物動態特性は、ラミブジンとの同時投与によって変化しませんでした。 PCP の治療に使用されるような高用量の TMP/SMX のラミブジン薬物動態への影響に関する情報はありません。
ジドブジン
ラミブジンまたはジドブジンの薬物動態の臨床的に有意な変化は、ラミブジンの複数回投与(12時間ごとに300mg)と組み合わせてジドブジンの単回投与(200mg)を投与された12人の無症候性HIV-1感染成人被験者で観察されませんでした。
微生物学
作用機序
ラミブジンは合成ヌクレオシド類似体です。細胞内で、ラミブジンはその活性な 5'-三リン酸代謝物であるラミブジン三リン酸 (3TC-TP) にリン酸化されます。 3TC-TP の主な作用機序は、ヌクレオチド類似体の取り込み後の DNA 鎖終結による HIV-1 逆転写酵素 (RT) の阻害です。
抗ウイルス活性
HIV-1 に対するラミブジンの抗ウイルス活性は、標準的な感受性アッセイを使用して、単球および新鮮なヒト末梢血リンパ球 (PBMC) を含む多くの細胞株で評価されました。 EC50 値は 0.003 ~ 15 microM の範囲でした (1 microM = 0.23 mcg/mL)。ラミブジンの EC50 中央値は、60 nM (範囲: 20 から 70 nM)、35 nM (範囲: 30 から 40 nM)、30 nM (範囲: 20 から 90 nM)、20 nM (範囲: 3 から 40 nM) でした。 、30 nM (範囲: 1 から 60 nM)、30 nM (範囲: 20 から 70 nM)、30 nM (範囲: 3 から 70 nM)、および 30 nM (範囲: 20 から 90 nM) HIV-1 クレードに対してそれぞれAGおよびグループOウイルス(クレードBのn = 2を除くn = 3)。 HIV-2 分離株 (n = 4) に対する EC50 値は、PBMC で 0.003 から 0.120 microM の範囲でした。ラミブジンは、テストされたすべての抗 HIV 剤に対して拮抗的ではありませんでした。慢性 HCV 感染症の治療に使用されるリバビリン (50 microM) は、MT-4 細胞でラミブジンの抗 HIV-1 活性を 3.5 倍減少させました。
抵抗
HIV-1 のラミブジン耐性バリアントは、細胞培養で選択されています。遺伝子型解析により、耐性は HIV-1 逆転写酵素のコドン 184 の特定のアミノ酸置換によるものであり、メチオニンがバリンまたはイソロイシン (M184V/I) に変化したことが原因であることが示されました。
ラミブジンとジドブジンの両方に耐性のある HIV-1 株が被験者から分離されています。ラミブジンおよびジドブジンに対する臨床分離株の感受性は、対照臨床試験でモニターされました。ラミブジン単剤療法またはラミブジンとジドブジンの併用療法を受けた被験者では、ほとんどの被験者からの HIV-1 分離株は、12 週間以内にラミブジンに対する表現型および遺伝子型の耐性を示しました。
治療中の HIV-1 分離株の遺伝子型および表現型分析は、ウイルス学的失敗の被験者から
トライアル EPV20001
EPV20001 に登録された 554 人の対象者のうち 53 人 (10%) が、48 週までにウイルス学的失敗 (血漿 HIV-1 RNA レベルが 1 mL あたり 400 コピー以上) であると特定されました。 1 日 2 回投与群とラミブジン 1 日 2 回投与群 25 人。ラミブジン 1 日 1 回投与群およびラミブジン 1 日 2 回投与群の被験者のベースライン血漿 HIV-1 RNA レベルの中央値は、それぞれ 4.9 log10 コピー/mL および 4.6 log10 コピー/mL でした。
ラミブジンを 1 日 1 回投与した群でウイルス学的失敗と特定された 22 人の被験者からの治療中の分離株の遺伝子型分析では、22 人の被験者のうち 8 人からの分離株が治療下で出現したラミブジン耐性関連置換 (M184V または M184I) を含み、22 人中 0 人の分離株が含まれていることが示された被験者には、ジドブジン耐性に関連する治療で発生したアミノ酸置換 (M41L、D67N、K70R、L210W、T215Y/F、または K219Q/E) が含まれており、被験者 22 人中 10 人からの分離株には、エファビレンツ耐性に関連する治療で発生したアミノ酸置換が含まれていました ( L100I、K101E、K103N、V108I、または Y181C)。
ラミブジンを 1 日 2 回投与するグループの被験者 (n = 22) からの治療中の分離株の遺伝子型分析では、22 人の被験者のうち 5 人からの分離株が治療下で出現したラミブジン耐性置換を含み、22 人の被験者のうち 1 人からの分離株が治療下で出現したジドブジン耐性を含むことが示された置換、および 22 人の被験者のうち 7 人の分離株には、治療によって出現したエファビレンツ耐性置換が含まれていました。
ラミブジンを 1 日 1 回投与された被験者 (n = 13) からのベースラインが一致した治療中の HIV-1 分離株の表現型分析では、13 人の被験者のうちの 7 人の被験者からの分離株は、ラミブジンに対する感受性が 85 から 299 倍減少したことが示されました。 13人の被験者がジドブジンに感受性があり、13人の被験者のうち8人からの分離株は、エファビレンツに対する感受性の25~295倍の減少を示しました。
ラミブジンを 1 日 2 回投与された被験者 (n = 13) からのベースラインが一致した治療中の HIV-1 分離株の表現型分析では、13 人の被験者のうち 4 人の被験者からの分離株は、ラミブジンに対する感受性が 29 倍から 159 倍減少したことが示されました。被験者はジドブジンに感受性があり、被験者 13 人中 3 人の分離株は、エファビレンツに対する感受性が 21 倍から 342 倍減少しました。
トライアルEPV40001
50 人の被験者がラミブジン 300 mg を 1 日 1 回+ジドブジン 300 mg を 1 日 2 回+アバカビル 300 mg を 1 日 2 回投与され、50 人の被験者がラミブジン 150 mg +ジドブジン 300 mg +アバカビル 300 mg をすべて 1 日 2 回投与されました。 2 つのグループの被験者のベースライン血漿 HIV-1 RNA レベルの中央値は、それぞれ 1 mL あたり 4.79 log10 コピーおよび 1 mL あたり 4.83 log10 コピーでした。ラミブジンを 1 日 1 回投与したグループでは 50 人中 14 人、ラミブジンを 1 日 2 回投与したグループでは 50 人中 9 人がウイルス学的失敗と特定されました。
ラミブジンを 1 日 1 回投与するグループの被験者 (n = 9) からの治療中の HIV-1 分離株の遺伝子型解析では、6 人の被験者からの分離株がアバカビルおよび/またはラミブジン耐性に関連する置換 M184V のみを持っていることが示されました。ラミブジンを 1 日 2 回投与された被験者 (n = 6) からの治療中の分離株は、2 人の被験者からの分離株が M184V のみを有し、2 人の被験者からの分離株が、ジドブジン耐性関連アミノ酸置換と組み合わせて M184V 置換を保有していることを示しました。
ラミブジンを 1 日 1 回投与された被験者 (n = 6) からの治療中の分離株の表現型分析では、4 人の被験者からの HIV-1 分離株は、ラミブジンに対する感受性が 32 から 53 倍低下したことが示されました。これら 6 人の被験者からの HIV-1 分離株は、ジドブジンに感受性がありました。
ラミブジンを 1 日 2 回投与された被験者 (n = 4) からの治療中の分離株の表現型分析では、1 人の被験者からの HIV-1 分離株は、ラミブジンに対する感受性が 45 倍減少し、ジドブジンに対する感受性が 4.5 倍減少したことが示されました。
小児科
ARROWでラミブジン経口溶液を他の抗レトロウイルス経口溶液(アバカビル、ネビラピン/エファビレンツ、またはジドブジン)と同時に投与された小児被験者は、錠剤を投与された小児よりも頻繁にウイルス耐性を発症しました. EPIVIR とアバカビルの 1 日 1 回投与または 1 日 2 回投与への無作為化では、錠剤で開始した被験者の 13%、溶液で開始した被験者の 32% が耐性置換を有していました。小児科で観察された耐性プロファイルは、検出された遺伝子型置換と相対頻度の点で成人で観察されたプロファイルと類似しており、最も一般的に検出された置換は M184 (V または I) にあります。 臨床研究 ]。
交差抵抗
ヌクレオシド逆転写酵素阻害剤 (NRTI) の間で交差耐性が観察されています。ラミブジン耐性 HIV-1 変異体は、細胞培養においてジダノシン (ddI) に対して交差耐性でした。これらはM184V置換を選択するため、アバカビルとエムトリシタビンでも交差耐性が期待されます。
臨床研究
EPIVIR の使用は、HIV-1 感染者を対象とした他の抗レトロウイルス薬との併用レジメンにおける臨床試験の結果に基づいています。臨床エンドポイントまたは CD4+ 細胞数と HIV-1 RNA 測定値の組み合わせによる試験からの情報は、対照試験における併用療法へのラミブジンの寄与の証拠として以下に含まれています。
成人対象
臨床エンドポイント試験
NUCB3007 (CAESAR) は、現在の治療の継続 (ジドブジン単独 [被験者の 62%] または ジドブジンとジダノシンまたはザルシタビン [被験者の 38%]) を EPIVIR 150mg または EPIVIR の追加と比較した、多施設二重盲検プラセボ対照試験でした。 150mg と研究中の非ヌクレオシド系逆転写酵素阻害剤 (NNRTI) を 1:2:1 の割合で無作為化。ベースラインで 25 ~ 250 個の CD4+ 細胞/mm³ (中央値 = 122 個/mm³) を持つ合計 1,816 人の HIV-1 感染成人が登録されました。 16%は未治療でした。試験期間の中央値は 12 か月でした。結果を表 9 にまとめます。
代理エンドポイント試験
デュアル ヌクレオシド アナログ試験
ラミブジンの初期開発における主要な臨床試験では、ラミブジン/ジドブジンの併用療法と、ジドブジン単剤療法またはジドブジンとザルシタビンの併用療法が比較されました。これらの試験では、ラミブジンの 2 剤併用による抗ウイルス効果が実証されました。 HIV-1 感染症の治療におけるラミブジンの最近の使用では、ウイルス抑制を強化するために、少なくとも 3 つの抗レトロウイルス薬を含む多剤併用レジメンにラミブジンが組み込まれています。
治療未経験の成人における用量レジメン比較サロゲートエンドポイント試験
EPV20001 は多施設共同二重盲検対照試験で、被験者は EPIVIR 300 mg を 1 日 1 回または EPIVIR 150 mg を 1 日 2 回投与する群に 1:1 で無作為に割り付けられ、ジドブジン 300 mg を 1 日 2 回およびエファビレンツ 600 mg を 1 日 1 回投与されました。合計 554 人の抗レトロウイルス治療を受けていない HIV-1 に感染した成人が登録されました: 男性 (79%)、白人 (50%)、年齢の中央値 35 歳、ベースラインの CD4+ 細胞数は mm³ あたり 69 ~ 1,089 細胞 (中央値 = 362 細胞)あたり mm³)、およびベースライン血漿 HIV-1 RNA の中央値は、mL あたり 4.66 log10 コピーです。 48 週間までの治療結果を図 1 と表 10 にまとめます。
図 1: 48 週までのウイルス学的反応、EPV20001a,b (Intent-to-Treat) 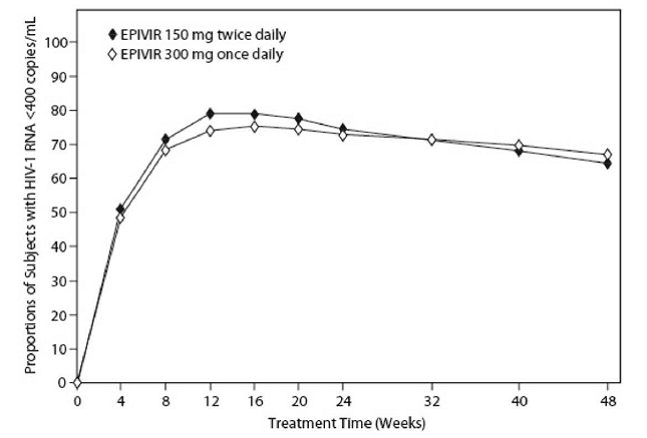
Roche AMPLICOR HIV-1 MONITOR。 b 各来院時のレスポンダーは、その来院までに中断することなく、HIV-1 RNA を 400 コピー/mL 未満に達成し、維持した被験者です。
48 週までの HIV-1 RNA が 1 mL あたり 50 コピー未満 (Roche Ultrasensitive アッセイによる) 未満の被験者の割合は、EPIVIR 300 mg を 1 日 1 回投与された被験者で 61%、EPIVIR 150 mg を 1 日 2 回投与された被験者で 63% でした。 CD4+ 細胞数の増加の中央値は、EPIVIR 300 mg を 1 日 1 回投与された被験者では 48 週目で 144 細胞/mm3、EPIVIR 150 mg を 1 日 2 回投与された被験者では 146 細胞/mm3 でした。
小規模な無作為化非盲検パイロット試験 EPV40001 がタイで実施されました。合計 159 人の治療経験のない成人被験者 (男性 32%、アジア人 100%、年齢の中央値 30 歳、ベースラインの CD4+ 細胞数の中央値 380 細胞/mm³、血漿 HIV-1 RNA の中央値 4.8 log10 コピー/mL) が登録されました。この試験の 2 つの治療群では、ラミブジン 300 mg 1 日 1 回投与 (n = 54) とラミブジン 150 mg 1 日 2 回投与 (n = 52) の比較が行われ、それぞれジドブジン 300 mg 1 日 2 回投与とアバカビル 300 mg 1 日 2 回投与が行われました。 48週間のデータのintent-to-treat分析では、1mLあたり400コピー未満のHIV-1 RNAを有する被験者の割合は、1日1回のラミブジンに無作為化されたグループで61%(54人中33人)、75%(39人中39人)でした。 52) 3 つの薬剤すべてを 1 日 2 回投与するように無作為化されたグループ。 1 mL あたり 50 コピー未満の HIV-1 RNA の割合は、1 日 1 回のラミブジン群で 54% (54 中 29)、1 日 2 回のみの群で 67% (52 中 35) でした。 CD4+ 細胞数の増加の中央値は、ラミブジンを 1 日 1 回投与したグループで 1 mm3 あたり 166 細胞、1 日 2 回投与したグループで 1 mm3 あたり 216 細胞でした。
小児科
臨床エンドポイント試験
ACTG300 は、EPIVIR + RETROVIR (ジドブジン) とジダノシン単剤療法との比較を提供する、多施設無作為化二重盲検試験でした。合計 471 人の症候性で HIV-1 に感染した未治療 (56 日以下の抗レトロウイルス療法) の小児被験者が、これら 2 つの治療群に登録されました。年齢の中央値は 2.7 歳 (範囲: 6 週間から 14 歳) で、58% が女性、86% が非白人でした。平均ベースライン CD4+ 細胞数は 868 細胞/mm3 (平均: 1,060 細胞/mm3、範囲: 0 ~ 4,650 細胞/mm3、年齢が 5 歳以下の被験者の場合、平均: 419 細胞/mm3、範囲: 0 ~ 1,555) 5 歳以上の被験者では mm3 あたりの細胞数)、平均ベースライン血漿 HIV-1 RNA は 1 mL あたり 5.0 log10 コピーでした。試験期間の中央値は、EPIVIR 150mg と RETROVIR を併用した被験者で 10.1 か月、ジダノシン単剤療法を受けた被験者で 9.2 か月でした。結果を表 11 にまとめます。
1日1回の投与
ARROW (COL105677) は、5 年間のランダム化された多施設試験で、小児被験者における HIV-1 感染の臨床管理の複数の側面を評価しました。 HIV-1 に感染し、治療を受けていない生後 3 か月から 17 歳の被験者が登録され、世界保健機関の推奨に従って、EPIVIR 150mg とアバカビルを含む第一選択レジメンで治療されました。最低 36 週間の治療後、被験者は ARROW 試験の無作為化 3 に参加するオプションを与えられ、3 番目の抗レトロウイルス薬と組み合わせた EPIVIR とアバカビルの 1 日 1 回投与と 1 日 2 回投与の安全性と有効性が比較されました。さらに96週間。 1,206 人の最初の ARROW 被験者のうち、669 人が無作為化 3 に参加しました。ウイルス学的抑制は参加の要件ではありませんでした。 1 日 1 回のコホートでは 71% の被験者がウイルス学的に抑制されていました。
96 週までの HIV-1 RNA が 1 mL あたり 80 コピー未満の被験者の割合を表 12 に示します。
製剤別の分析では、無作為化時に HIV-1 RNA が 80 コピー/mL 未満の被験者の割合が示され、96 週目には EPIVIR 150mg とアバカビルの錠剤製剤を投与された被験者の方が高かった (75% [458/610] および 72% [434/601]) 任意の時点で溶液製剤 (EPIVIR 150 mg 溶液を体重帯ベースの用量で、1 日あたり 1 kg あたり約 8 mg で投与) を投与された患者よりも (52% [29/56] および 54 % [30/56])、それぞれ [参照 警告と注意事項 ]。これらの違いは、評価された各年齢層で観察されました。
患者情報
エピビル (EP-i-veer)(ラミブジン)錠
エピビル (EP-i-veer) (ラミブジン) 内服液
EPIVIR 150mg について知っておくべき最も重要な情報は何ですか?
EPIVIR は、次のような重大な副作用を引き起こす可能性があります。
- HIV-1 感染者の B 型肝炎ウイルスの悪化。 HIV-1 (ヒト免疫不全ウイルス 1 型) および B 型肝炎ウイルス (HBV) に感染している場合、EPIVIR の使用を中止すると、HBV が悪化する (フレアアップ) 可能性があります。 「再燃」とは、HBV 感染が以前よりも悪化して突然再発することです。肝疾患の悪化は深刻な場合があり、死に至ることもあります。
- EPIVIR を使い切らないでください。 EPIVIR がすべてなくなる前に、処方箋を補充するか、医療提供者に相談してください。
- 最初に医療提供者に相談せずに EPIVIR を中止しないでください。
- EPIVIR の使用を中止した場合、医療提供者は頻繁に健康状態をチェックし、肝臓をチェックするために数か月間定期的に血液検査を行う必要があります。
- 耐性 B 型肝炎ウイルス (HBV)。 HIV-1 と B 型肝炎を患っている場合、EPIVIR 150mg による治療中に B 型肝炎ウイルスが変化 (変異) し、治療が困難 (耐性) になる可能性があります。
- インターフェロンおよびリバビリンベースのレジメンと併用してください。 HIV-1 と C 型肝炎ウイルスの両方に感染し、抗レトロウイルス薬を服用しており、リバビリンを併用するまたは併用しないインターフェロンによる C 型肝炎の治療を受けている人々で、死に至る肝疾患の悪化が起こっています。リバビリンの有無にかかわらず、EPIVIR 150mg とインターフェロンを服用している場合は、新たな症状があるかどうかを医療提供者に伝えてください。
EPIVIRとは?
EPIVIR は、ヒト免疫不全ウイルス (HIV-1) 感染を治療するために他の抗レトロウイルス薬と併用される処方薬です。
HIV-1 は後天性免疫不全症候群 (AIDS) を引き起こすウイルスです。
EPIVIR 錠剤および経口溶液 (HIV-1 感染症の治療に使用) には、EPIVIR-HBV 錠剤および経口溶液 (HBV の治療に使用) よりも高用量の同じ有効成分 (ラミブジン) が含まれています。 HIV-1 と HBV の両方を持っている場合は、感染症の治療に EPIVIR-HBV を使用しないでください。
EPIVIR の安全性と有効性は、生後 3 か月未満の子供では確立されていません。
EPIVIR 150mg を服用してはいけない人は?
EPIVIR を服用しないでください ラミブジンまたは EPIVIR のいずれかの成分にアレルギーがある場合。 EPIVIR の成分の完全なリストについては、この患者情報リーフレットの最後を参照してください。
EPIVIR を服用する前に医療提供者に何を伝えるべきですか?
EPIVIR 150mg を服用する前に、次の場合は医療提供者に伝えてください。
- B型肝炎またはC型肝炎ウイルス感染を含む肝臓の問題を抱えている、または患ったことがある。
- 腎臓に問題があります。
- 糖尿病です。 EPIVIR 経口溶液の各 15 mL 用量 (150 mg) には、3 グラムのスクロースが含まれています。
- 妊娠している、または妊娠する予定がある。妊娠中に EPIVIR を服用しても、先天異常のリスクが増加することはありません。妊娠中または妊娠を計画している場合は、医療提供者に相談してください。 妊娠登録。 妊娠中に抗レトロウイルス薬を服用している女性のための妊娠登録があります。このレジストリの目的は、あなたと赤ちゃんの健康に関する情報を収集することです。このレジストリへの参加方法については、かかりつけの医療提供者に相談してください。
- 授乳中または授乳を計画している。 EPIVIR を服用している場合は、授乳しないでください。
- 赤ちゃんに HIV-1 が感染するリスクがあるため、HIV-1 に感染している場合は母乳で育てないでください。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
一部の薬は EPIVIR と相互作用します。服用している薬のリストを保管し、新しい薬を入手したときに、医療従事者や薬剤師に提示してください。 EPIVIR と相互作用する医薬品のリストについては、医療提供者または薬剤師にお尋ねください。
医療提供者に告げずに新しい薬の服用を開始しないでください。 EPIVIR を他の薬と一緒に服用しても安全かどうかは、かかりつけの医療提供者が教えてくれます。
EPIVIR の服用方法は?
- EPIVIR は、担当の医療提供者が指示したとおりに服用してください。
- EPIVIR 150mg を飲み忘れた場合は、気がついたらすぐに服用してください。同時に 2 回分を服用したり、医療提供者が指示した量を超えて服用したりしないでください。
- EPIVIR による治療中は、医療提供者のケアを受けてください。
- EPIVIR は食事の有無にかかわらず服用できます。
- 3 か月以上の子供の場合、医療機関は子供の体重に基づいて EPIVIR 150mg を処方します。
- あなたまたはあなたの子供が錠剤を飲み込むのに問題がある場合は、医療提供者に伝えてください. EPIVIR 150mg は液体(経口溶液)としても提供されます。
- EPIVIR を使い切らないでください。血液中のウイルスが増加し、ウイルスの治療が難しくなる可能性があります。在庫が少なくなり始めたら、医療提供者または薬局からより多くを入手してください。
- EPIVIR 150mg の服用量が多すぎる場合は、すぐに医療提供者に連絡するか、最寄りの病院の緊急治療室に行ってください。
EPIVIR 150mg の副作用の可能性は何ですか?
- EPIVIR 150mg は、次のような重大な副作用を引き起こす可能性があります。
- 「EPIVIR 150mg について知っておくべき最も重要な情報は何ですか?」を参照してください。
- 血液中の酸の蓄積(乳酸アシドーシス)。 乳酸アシドーシスは、EPIVIR を服用している一部の人に発生する可能性があります。乳酸アシドーシスは、死に至る深刻な医学的緊急事態です。 乳酸アシドーシスの徴候である可能性のある次の症状のいずれかが現れた場合は、すぐに医療提供者に連絡してください。
- 非常に弱いまたは疲れている
- 特に腕や足が冷える
- 異常な(正常ではない)筋肉痛
- めまいやふらつきを感じる
- 呼吸困難
- 速いまたは不規則な心拍がある
- 吐き気と嘔吐を伴う胃の痛み
- 深刻な肝臓の問題 EPIVIR を服用している人に起こる可能性があります。場合によっては、これらの深刻な肝臓の問題は死に至る可能性があります。肝臓が大きくなり(肝腫大)、肝臓に脂肪が蓄積する(脂肪症)ことがあります。 肝臓の問題の次の徴候または症状のいずれかが見られた場合は、すぐに医療提供者に連絡してください。
- 皮膚や白目の部分が黄色くなる(黄疸)
- 食欲不振が数日以上続く
- 吐き気
- 暗いまたは「茶色」の尿
- 胃の右側の痛み、うずき、または圧痛
- 薄い色の便(排便)
女性または非常に太りすぎ(肥満)の場合、乳酸アシドーシスまたは深刻な肝臓障害を発症する可能性が高くなります.
- 膵臓の炎症(膵炎)のリスク。 以下の場合、子供は EPIVIR による治療中に膵炎を発症するリスクがあります。
- ヌクレオシドアナログ薬を服用している
- 過去に膵炎の病歴がある
- 膵炎の他の危険因子がある
吐き気や嘔吐の有無にかかわらず、重度の胃上部の痛みを含む膵炎の徴候や症状がお子様に現れた場合は、すぐに医療提供者に連絡してください。 症状と血液検査の結果、子供が膵炎の可能性があることが示された場合、医療提供者は、子供に EPIVIR 150mg を与えるのをやめるように指示する場合があります。
- 免疫系の変化 (免疫再構築症候群) HIV-1 の薬を飲み始めると起こります。免疫システムが強化され、長い間体内に隠れていた感染症と闘い始める可能性があります。 EPIVIR の服用を開始した後に新たな症状が出始めた場合は、すぐに医療提供者に伝えてください。
成人における EPIVIR 150mg の最も一般的な副作用は次のとおりです。
- 頭痛
- 鼻の兆候と症状
- 吐き気
- 下痢
- 一般的に気分が悪い
- 疲れ
- 咳
小児における EPIVIR 150mg の最も一般的な副作用には、発熱と咳が含まれます。
気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。
これらは、EPIVIR の考えられるすべての副作用ではありません。副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
EPIVIR はどのように保管すればよいですか?
- EPIVIR 150mg 錠剤および経口溶液は、20°C ~ 25°C (68°F ~ 77°F) の室温で保管してください。
- EPIVIR 150mg 経口溶液のボトルは密閉して保管してください。
EPIVIR とすべての医薬品は子供の手の届かないところに保管してください。
EPIVIR の安全で効果的な使用に関する一般的な情報。
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。 EPIVIR が処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っていたとしても、EPIVIR を他の人に与えないでください。それらに害を及ぼす可能性があります。
医療従事者向けに書かれた EPIVIR 150mg に関する情報については、医療提供者または薬剤師にお尋ねください。
詳細については、www.viivhealthcare.com にアクセスするか、1-877-844-8872 に電話してください。
EPIVIR 150mg の成分は何ですか?
有効成分:ラミブジン
不活性成分:
EPIVIR 150mg は、150mg のフィルムコーティング錠を採点しました: ヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、ポリソルベート 80、デンプングリコール酸ナトリウム、および二酸化チタン。
EPIVIR 300 mg フィルムコーティング錠: 黒酸化鉄、ヒプロメロース、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、ポリソルベート 80、デンプン グリコール酸ナトリウム、および二酸化チタン。
EPIVIR 150mg 経口溶液: 人工のイチゴとバナナのフレーバー、クエン酸 (無水)、メチルパラベン、プロピレングリコール、プロピルパラベン、クエン酸ナトリウム (二水和物)、およびスクロース (1 mL あたり 200 mg)。
この患者情報は、米国食品医薬品局によって承認されています。
