Copegus 100mg Ribavirin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
コペガス100mgとは?
Copegus 100mg は慢性 C 型肝炎の症状を治療するために使用される処方薬です。
Copegus は、B 型肝炎/C 型肝炎薬と呼ばれる薬のクラスに属しています。 RSV エージェント。
コペガスの副作用の可能性は何ですか?
Copegus は、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- あなたの視力の問題、
- 上腹部の激しい痛みが背中に広がり、
- 吐き気、
- 嘔吐、
- 下痢、
- 新しいまたは悪化した咳、
- 熱、
- 刺すような胸の痛み、
- 喘鳴、
- 呼吸困難、
- 憂鬱症、
- 自傷行為や他人を傷つける考え、
- 肌が白くなったり、黄ばんだり、
- 濃い色の尿、
- 錯乱、
- 弱点、
- 寒気、
- 風邪のような症状、
- 腫れた歯茎、
- 口内炎、
- 皮膚のただれ、
- あざができやすい、
- 不正出血と、
- 立ちくらみ
上記の症状がある場合は、すぐに医療機関を受診してください。
コペガスの最も一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- 食欲減少、
- 熱、
- 悪寒や震え、
- 低血球数、
- 貧血、
- 弱点、
- 疲れ、
- 頭痛、
- 筋肉痛、
- 気分の変化、
- 不安、そして
- 過敏性
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Copegus の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
重篤な疾患およびリバビリン関連作用のリスク
COPEGUS (リバビリン) の単剤療法は、慢性 C 型肝炎ウイルス感染症の治療には有効ではなく、この適応症に対して単独で使用すべきではありません。
リバビリンの主な臨床毒性は溶血性貧血です。リバビリン療法に関連する貧血は、心疾患の悪化をもたらし、致死的および非致死的な心筋梗塞につながる可能性があります。重大または不安定な心疾患の既往歴のある患者は、COPEGUS で治療すべきではありません [警告と予防措置、有害反応、および用量と管理を参照してください]。
リバビリンに暴露されたすべての動物種で、重大な催奇形性および/または殺胚効果が実証されています。さらに、リバビリンの反復投与半減期は 12 日間であり、非血漿コンパートメントでは 6 か月も持続する可能性があります。したがって、COPEGUS 100mgを含むリバビリンは、妊娠中の女性および妊娠中の女性の男性パートナーには禁忌です.リバビリン療法を受けている女性患者および男性患者の女性パートナーの両方において、治療中および治療終了後 6 か月間は、妊娠を避けるために細心の注意を払う必要があります。治療中および治療後 6 か月のフォローアップ期間中に、少なくとも 2 つの信頼できる有効な避妊法を使用する必要があります [禁忌、警告および注意事項、特定集団での使用を参照]。
説明
COPEGUS 100mg、リバビリンは、抗ウイルス活性を持つヌクレオシド類似体です。リバビリンの化学名は 1-β-ドリボフラノシル-1H-1,2,4-トリアゾール-3-カルボキサミドで、次の構造式を持っています。
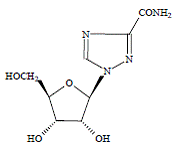
リバビリンの実験式は C8H12N4O5 で、分子量は 244.2 です。リバビリンは白色からオフホワイトの粉末です。水に溶けやすく、無水アルコールに溶けにくい。
COPEGUS (リバビリン) は、薄いピンク色からピンク色の、平らな楕円形のフィルムコーティングされた経口投与用錠剤として入手できます。各錠剤には 200 mg のリバビリンと次の不活性成分が含まれています: アルファ化デンプン、微結晶性セルロース、デンプン グリコール酸ナトリウム、コーンスターチ、ステアリン酸マグネシウム。錠剤のコーティングには、Chromatone-P または Opadry Pink (ヒドロキシプロピル メチル セルロース、タルク、二酸化チタン、合成黄酸化鉄、および合成赤酸化鉄を使用して製造)、エチル セルロース (ECD-30)、およびトリアセチンが含まれています。
適応症
COPEGUS 100mg と PEGASYS (peginterferon alfa-2a) の併用は、5 歳以上の慢性 C 型肝炎 (CHC) ウイルス感染症で、肝疾患が代償され、以前にインターフェロン α による治療を受けていない患者の治療に適応されます。
COPEGUS 100mg と PEGASYS の併用療法を開始する際には、次の点を考慮する必要があります。
- この適応症は、CHC および代償性肝疾患を有する患者の併用療法の臨床試験に基づいており、その患者の一部には肝硬変の組織学的証拠がありました (Child-Pugh クラス A)、および臨床的に安定した HIV 疾患および CD4 数が 100 を超える成人患者セル/mm³ .
- この適応症は、HCV 遺伝子型に基づいて 24 週間または 48 週間の治療後に検出不能な HCV RNA を達成し、最後の投与から 24 週間後に持続的ウイルス学的反応 (SVR) を維持することに基づいています。
- 48 週間を超える治療については、安全性と有効性のデータはありません。
- COPEGUS 100mg と PEGASYS 療法の安全性と有効性は、肝臓または他の臓器移植レシピエント、非代償性肝疾患の患者、または以前にインターフェロン療法に反応しなかった患者では確立されていません。
- アデノウイルス、RSV、パラインフルエンザ、またはインフルエンザ感染症の治療における COPEGUS 療法の安全性と有効性は確立されていません。 COPEGUS は、これらの適応症には使用しないでください。吸入用リバビリンには別の添付文書があります。リバビリン吸入療法を検討している場合は、これを参照してください。
投薬と管理
COPEGUS 100mg は食事と一緒に服用してください。 COPEGUS は PEGASYS と組み合わせて投与する必要があります。 COPEGUS 100mg を単剤療法として投与してはならないことに注意することが重要です。見る PEGASYSの投薬および投与に関するすべての指示については、PEGASYSの添付文書。
慢性C型肝炎単一感染症
成人患者
COPEGUS 100mg 錠剤の推奨用量を表 1 に示します。リバビリンとインターフェロンによる治療歴のない患者の推奨治療期間は 24 ~ 48 週間です。
コペガス 100mg の 1 日量は 800mg から 1200mg を 2 回に分けて経口投与する。用量は、ベースラインの疾患特性(遺伝子型など)、治療への反応、レジメンの忍容性に応じて、患者ごとに個別化する必要があります( を参照)。
小児患者
PEGASYS は 180 mcg/1.73m² x BSA として週 1 回皮下投与され、最大用量は 180 mcg であり、リバビリンと組み合わせて投与する必要があります。遺伝子型 2 または 3 の患者の推奨治療期間は 24 週間で、その他の遺伝子型の患者では 48 週間です。
COPEGUS は PEGASYS と組み合わせて投与する必要があります。 COPEGUS 100mg は 200mg の錠剤としてのみ入手可能であるため、小児患者がこのサイズの錠剤を飲み込めるかどうかは、医療従事者が判断する必要があります。 COPEGUS の推奨用量を表 2 に示します。18 歳の誕生日より前に治療を開始した患者は、治療が完了するまで小児用用量を維持する必要があります。
HIV重複感染を伴う慢性C型肝炎
成人患者
HIV に重複感染している患者の C 型慢性肝炎の治療に推奨される用量は、HCV 遺伝子型に関係なく、PEGASYS 180 mcg を週 1 回皮下投与し、COPEGUS 800 mg を毎日経口で合計 48 週間投与することです。
用量変更
成人および小児患者
COPEGUS/PEGASYS 併用療法中に重度の副作用または臨床検査値の異常が発生した場合は、副作用が弱まるか重症度が低下するまで、必要に応じて用量を変更または中止する必要があります。用量調整後も不耐性が続く場合は、COPEGUS/PEGASYS 療法を中止する必要があります。表 3 は、患者のヘモグロビン濃度と心臓の状態に基づいた用量変更と中止のガイドラインを示しています。
COPEGUS 100mg は、心疾患の既往がある患者には慎重に投与する必要があります。治療開始前に患者を評価し、治療中は適切にモニタリングする必要があります。心血管状態の悪化がある場合は、治療を中止する必要があります[参照 警告と注意事項 ]。
この表に概説されている COPEGUS 100mg の用量変更に関するガイドラインは、ヘモグロビン値の減少以外の検査異常または有害反応にも適用されます。
成人患者
実験室の異常または臨床的副作用のために COPEGUS 100mg を差し控えた場合、COPEGUS 100mg を 1 日 600mg で再開し、さらに 1 日 800mg に増量する試みを行うことができます。ただし、COPEGUS を元の割り当てられた用量 (1000 mg から 1200 mg) まで増量することはお勧めしません。
小児患者
臨床検査値の異常または臨床的な副作用が解消されると、医師の判断に応じて、COPEGUS 100mg の用量を元の用量まで増量することが試みられる場合があります。実験室の異常または臨床的副作用のためにCOPEGUSが差し控えられた場合、COPEGUS 100mgを全用量の半分で再開する試みが行われる場合があります。
腎障害
クレアチニンクリアランスが 50 mL/min 以下の患者では、COPEGUS の 1 日総投与量を減らす必要があります。また、クレアチニンクリアランスが 30 mL/分未満の場合は、次の表 4 に示すように、PEGASYS の毎週の投与量を減らす必要があります [参照 特定の集団での使用 、 薬物動態 、 と ペガシス添付文書 ]。
COPEGUS 100mg の投与量は、腎機能障害のある患者ではさらに変更しないでください。重度の有害反応または臨床検査値の異常が発生した場合、適切であれば、有害反応が弱まるか重症度が低下するまで COPEGUS を中止する必要があります。 COPEGUS 100mg を再開した後も不耐性が続く場合は、COPEGUS/PEGASYS 療法を中止する必要があります。
腎機能障害のある小児患者についてはデータがありません。
投薬の中止
PEGASYS/COPEGUS 100mg 療法の中止は、患者が 12 週間の治療までにベースラインから少なくとも 2 log10 の HCV RNA の減少を示さない場合、または治療の 24 週間後に HCV RNA レベルが検出されない場合に検討する必要があります。
治療中に肝代償不全を発症した患者では、PEGASYS/COPEGUS 100mg療法を中止する必要があります[参照 警告と注意事項 ]。
供給方法
剤形と強度
COPEGUS (リバビリン) は、薄いピンク色からピンク色の、平らな楕円形のフィルムコーティングされた経口投与用錠剤として入手できます。 1錠にリバビリン200mgが含まれています。
COPEGUS®(リバビリン) 経口投与用の錠剤として入手できます。各錠剤には 200 mg のリバビリンが含まれており、薄いピンク色からピンク色で、平らな楕円形で、フィルム コーティングが施され、片面に RIB 200 が、もう片面に ROCHE が刻印されています。それらは168錠のボトルとして包装されています( NDC 0004-0086-94)。
保管と取り扱い
COPEGUS® Tablets ボトルは 25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) の間でのエクスカーションが許可されます [参照 USP制御の室温 ]。ボトルをしっかり閉めてください。
製造元: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Roche Group のメンバー、1 DNA Way、South San Francisco、CA 94080-4990。改訂: 2015 年 8 月
副作用
PEGASYS と COPEGUS の併用は、さまざまな重篤な副作用を引き起こします [参照 囲み警告 と 警告と注意事項 ]。 COPEGUS/PEGASYS によって誘発または悪化される最も一般的な重篤または生命を脅かす副作用には、うつ病、自殺、薬物乱用/過剰摂取の再発、および細菌感染があり、それぞれ 1% 未満の頻度で発生します。肝代償不全は、2% (10/574) の CHC/HIV 患者で発生した [参照 警告と注意事項 ]。
臨床研究経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
成人患者
重要な登録試験 NV15801 および NV15942 では、886 人の患者が、体重に基づいて 1000/1200 mg の用量で 48 週間 COPEGUS を投与されました。これらの試験では、ペガシスを単独またはコペガスと組み合わせて投与された CHC 単感染患者の 10% および CHC/HIV 患者の 19% で、1 つまたは複数の重篤な副作用が発生しました。最も一般的な重篤な有害事象 (CHC で 3%、CHC/HIV で 5%) は細菌感染 (例、敗血症、骨髄炎、心内膜炎、腎盂腎炎、肺炎) でした。
その他の重篤な副作用は 1% 未満の頻度で発生し、自殺、自殺念慮、精神病、攻撃性、不安、薬物乱用および薬物過剰摂取、狭心症、肝機能障害、脂肪肝、胆管炎、不整脈、真性糖尿病、自己免疫現象が含まれます。 (例、甲状腺機能亢進症、甲状腺機能低下症、サルコイドーシス、全身性エリテマトーデス、関節リウマチ)、末梢神経障害、再生不良性貧血、消化性潰瘍、消化管出血、膵炎、大腸炎、角膜潰瘍、肺塞栓症、昏睡、筋炎、脳出血、血栓性血小板減少性紫斑病、精神障害、幻覚。
つ以上の有害事象を経験した臨床試験の患者の割合は 98% でした。主な副作用として、抑うつ、不眠、易怒性、不安、疲労感、発熱、筋肉痛、頭痛、悪寒などの風邪様症状などの精神症状が報告されています。他の一般的な反応は、食欲不振、吐き気と嘔吐、下痢、関節痛、注射部位反応、脱毛症、およびそう痒症でした.
CHC 臨床試験、NV15801 で、ペグ化インターフェロンとリバビリンの併用療法を受けた被験者の 5% 以上で発生した有害事象の割合を示しています。
COPEGUS 100mgの中止された治療と組み合わせたPEGASYSによる48週間の治療を受けたCHC単一感染患者の10%。 CHC/HIV 重複感染患者の 16% が治療を中止しました。治療中止の最も一般的な理由は、精神医学的、インフルエンザ様症候群 (例、無気力、疲労、頭痛)、皮膚および胃腸障害、検査値異常 (血小板減少症、好中球減少症、および貧血) でした。
CHC または CHC/HIV 患者の全体で 39% が、PEGASYS および/または COPEGUS 療法の変更を必要としました。 CHC および CHC/HIV 患者における PEGASYS の用量変更の最も一般的な理由は、臨床検査値の異常によるものでした。好中球減少症 (それぞれ 20% および 27%) および血小板減少症 (それぞれ 4% および 6%)。 CHC および CHC/HIV 患者における COPEGUS の用量変更の最も一般的な理由は、貧血でした (それぞれ 22% および 16%)。
ペガシスの用量は、1000 mg から 1200 mg の COPEGUS 100 mg を 48 週間投与された患者の 12% で、800 mg の COPEGUS を 24 週間投与された患者の 7% で減少しました。 COPEGUS の用量は、1000 mg から 1200 mg の COPEGUS 100mg を 48 週間投与された患者の 21% で、800 mg の COPEGUS 100mg を 24 週間投与された患者の 12% で減少しました。
PEGASYS と 800 mg COPEGUS 100 mg で 24 週間治療された慢性 C 型肝炎単一感染患者は、重篤な有害事象の発生率が低く (3% 対 10%)、ヘモグロビンが 10 g/dL 未満 (3% 対 15%) であることが観察されました。 、PEGASYS と 1000 mg で 48 週間治療された患者と比較した、PEGASYS (30% 対 36%) と COPEGUS (19% 対 38%) の用量変更 (19% 対 38%)、および治療からの離脱 (5% 対 15%) または1200mgのコペガス。一方、有害事象の全体的な発生率は、2 つの治療群で類似しているように見えました。
小児患者
ペガシス単独またはコペグス 100mg と組み合わせて治療された 114 人の小児被験者 (5 歳から 17 歳) を対象とした臨床試験では、約 3 分の 1 の被験者で用量変更が必要であり、最も一般的なのは好中球減少症と貧血です。一般に、小児被験者で観察された安全性プロファイルは、成人で観察されたものと同様でした.小児科の研究では、48 週間まで PEGASYS と COPEGUS 100mg の併用療法で治療された被験者で最も一般的な有害事象は、インフルエンザ様疾患 (91%)、上気道感染症 (60%)、頭痛 (64%) でした。胃腸障害 (56%)、皮膚障害 (47%)、および注射部位反応 (45%)。 PEGASYS と COPEGUS の併用治療を 48 週間受けた 7 人の被験者は、安全上の理由で治療を中止しました (うつ病、精神医学的評価異常、一過性失明、網膜滲出液、高血糖、1 型糖尿病、および貧血)。重篤な有害事象は、ペガシスとコペガス 100mg の併用療法群(高血糖および胆嚢摘出術)の 2 例で報告されました。
併用療法に無作為に割り付けられた小児被験者では、最初の 24 週間と比較して、治療期間全体 (最大 48 週間と 24 週間のフォローアップ) でほとんどの有害反応の発生率が類似しており、頭痛、胃腸障害の発生率はわずかに増加しました。 、過敏症および発疹。有害反応の大部分は、治療の最初の 24 週間で発生しました。
小児被験者の成長阻害
[見る 警告と注意事項 ]。
PEGASYS とリバビリンの併用療法で治療された小児患者は、ベースラインと比較して最大 48 週間の治療で体重と身長の増加が遅れました。年齢の体重と年齢の z スコアの身長の両方、および被験者の体重と身長の標準母集団のパーセンタイルは、治療中に減少しました。治療後 2 年間のフォローアップの終わりに、ほとんどの被験者は、体重 (ベースラインで平均 64 パーセンタイル、治療後 2 年で平均 60 パーセンタイル) および身長 (ベースラインで平均 54 パーセンタイル、治療後 2 年での平均パーセンタイル)。治療終了時に、被験者の 43% (53 人中 23 人) が 15 パーセンタイルを超える体重パーセンタイルの減少を経験し、25% (53 人中 13 人) が標準的な成長曲線で 15 パーセンタイルを超える身長パーセンタイルの減少を経験しました。治療後 2 年で、被験者の 16% (38 人中 6 人) はベースラインの体重曲線を 15 パーセンタイル以上下回り、11% (38 人中 4 人) はベースラインの身長曲線を 15 パーセンタイル以上下回りました。
114 人の被験者のうち 38 人が、治療後 6 年間にわたる長期追跡調査に登録されました。ほとんどの対象について、治療後2年での成長の治療後の回復は、治療後6年まで維持された。
HIV 重複感染を伴う CHC における一般的な有害反応(成人)
NR15961 試験で PEGASYS/COPEGUS で治療された重感染患者の有害事象プロファイルは、NV15801 試験で単一感染患者に示されたものとほぼ同様でした (表 5)。重感染患者でより頻繁に発生するイベントは、好中球減少症 (40%)、貧血 (14%)、血小板減少症 (8%)、体重減少 (16%)、および気分の変化 (9%) でした。
臨床検査の異常
成人患者
溶血による貧血は、リバビリン療法の最も重大な毒性です。貧血 (ヘモグロビン 10 g/dL 未満) は、臨床試験で COPEGUS と PEGASYS の併用療法を受けた患者の 13% で観察されました。ヘモグロビンの最大の低下は、リバビリン療法の開始から最初の 8 週間の間に発生しました [ 投薬と管理 ]。
小児患者
ヘモグロビン、好中球、血小板の減少により、用量を減らすか、治療を永久に中止する必要がある場合があります [参照 投薬と管理 ]。臨床試験中に認められた臨床検査値の異常のほとんどは、治療の中止後すぐにベースラインレベルに戻りました。
併用療法に無作為に割り付けられた患者では、最初の 24 週間と比較して、治療段階全体 (最大 48 週間と 24 週間のフォローアップ) 中の異常の発生率は、好中球が 500 ~ 1,000 細胞/mm³ で、ヘモグロビン値が8.5 および 10 g/dL。血液学的異常の大部分は、治療の最初の 24 週間で発生しました。
市販後の経験
ペガシス/コペガス100mg併用療法の承認後の使用中に、以下の副作用が確認され、報告されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系の疾患
赤芽球癆
耳と迷路の障害
聴覚障害、難聴
眼疾患
漿液性網膜剥離
免疫疾患
肝臓および腎移植片の拒絶反応
代謝と栄養障害
脱水
皮膚および皮下組織の疾患
スティーブンス・ジョンソン症候群 (SJS)
中毒性表皮壊死融解症(TEN)
薬物相互作用
薬物動態サブスタディの結果は、PEGASYS(ペグインターフェロンアルファ-2a)とリバビリンの間に薬物動態相互作用がないことを示しました。
ヌクレオシド逆転写酵素阻害剤 (NRTI)
in vitro データは、リバビリンがラミブジン、スタブジン、およびジドブジンのリン酸化を減少させることを示しています。しかし、リバビリンとラミブジン(n=18)、スタブジン(n=10)、またはジドブジン (n=6) は、HCV/HIV 重複感染患者への多剤レジメンの一部として同時投与されました。
NR15961 試験では、NRTI を投与された CHC/HIV 重感染肝硬変患者で、肝代償不全(一部は致命的)の症例が観察された [参照 警告と注意事項 ]。
PEGASYS/COPEGUS 100mg と NRTI を投与されている患者は、治療に関連する毒性について注意深く監視する必要があります。医師は、毒性管理に関するガイダンスについて、それぞれの NRTI の処方情報を参照する必要があります。さらに、肝代償不全を含む毒性の悪化が観察された場合は、PEGASYS、COPEGUS 100mg、またはその両方の減量または中止も考慮する必要があります(例、Child-Pugh 6 以上)[ 警告と注意事項 と 投薬と管理 ]。
ジダノシン
COPEGUS とジダノシンの併用は禁忌です。ジダノシンまたはその活性代謝物 (ジデオキシアデノシン 5'-三リン酸) の濃度は、ジダノシンをリバビリンと同時投与すると増加し、臨床毒性を引き起こしたり悪化させたりする可能性があります。致命的な肝不全、末梢神経障害、膵炎、症候性高乳酸血症/乳酸アシドーシスの報告が臨床試験で報告されている[参照 禁忌 ]。
ジドブジン
NR15961 試験では、ジドブジンを PEGASYS/COPEGUS と組み合わせて投与された患者は、重度の好中球減少症 (ANC 500 未満) と重度の貧血 (ヘモグロビン 8 g/dL 未満) を、ジドブジンを投与されていない同様の患者 (好中球減少症 15% vs. 9%) (貧血 5% 対 1%)。ジドブジンの中止は、医学的に適切であると考えるべきです。
シトクロム P450 によって代謝される薬物
インビトロ研究は、リバビリンが CYP 2C9、CYP 2C19、CYP 2D6 または CYP 3A4 を阻害しないことを示しています。
アザチオプリン
アザチオプリンを投与されている患者の C 型慢性肝炎を治療するためのリバビリンの使用は、重度の汎血球減少症を誘発することが報告されており、アザチオプリン関連の骨髄毒性のリスクを高める可能性があります。イノシン一リン酸デヒドロゲナーゼ (IMDH) は、アザチオプリンの代謝経路の 1 つに必要です。リバビリンは IMDH を阻害することが知られているため、骨髄毒性 (好中球減少症、血小板減少症、および貧血) に関連するアザチオプリン代謝産物である 6-メチルチオイノシン一リン酸 (6-MTITP) が蓄積されます。アザチオプリンとリバビリンの併用療法を受けている患者は、血小板数を含む完全な血球計算を、治療の最初の 1 か月間は毎週、2 か月目と 3 か月目は 1 か月に 2 回、その後は 1 か月に 1 回、または投与量や他の治療法の変更が必要な場合はより頻繁に行う必要があります。 警告と注意事項 ]。
警告
の一部として含まれています 予防 セクション。
予防
COPEGUS/PEGASYS 併用療法に関連する重大な副作用には、重度のうつ病および自殺念慮、溶血性貧血、骨髄機能の抑制、自己免疫疾患および感染症、眼科疾患、脳血管障害、肺機能障害、大腸炎、膵炎、および糖尿病が含まれます。
併用療法を開始する前に、追加の安全性情報について PEGASYS 添付文書全体を確認する必要があります。
妊娠
COPEGUS 100mg は、先天異常および/または暴露された胎児の死亡を引き起こす可能性があります。 リバビリンは、適切な研究が実施されたすべての動物種において、重大な催奇形性および/または殺胚性効果を示しています。これらの効果は、推奨されるリバビリンのヒト用量の 20 分の 1 という低用量で発生しました。
計画された治療開始の直前に妊娠検査で陰性の報告が得られない限り、COPEGUS 治療を開始すべきではありません。 女性患者および男性患者の女性パートナーの妊娠を避けるために、細心の注意を払う必要があります。治療中および治療中止後 6 か月間は、少なくとも 2 種類の効果的な避妊法を使用するよう患者に指示する必要があります。妊娠検査は、COPEGUS 100mg 治療中および治療中止後 6 か月間、毎月行う必要があります [参照 囲み警告 、 禁忌 、 特定の集団での使用 、 と 患者情報 ]。
貧血
リバビリンの主な毒性は溶血性貧血であり、これは臨床試験で COPEGUS/PEGASYS で治療された被験者の約 13% で観察されました。 COPEGUS 100mg に伴う貧血は、治療開始から 1 ~ 2 週間以内に発生します。ヘモグロビンの初期低下が著しい場合があるため、ヘモグロビンまたはヘマトクリットを治療前および治療の 2 週目と 4 週目に、または臨床的に必要な場合はより頻繁に取得することをお勧めします。その後、患者は臨床的に適切な経過をたどらなければなりません。ベースラインで重度の貧血のリスクがある患者(例、球状赤血球症、消化管出血の既往)で治療を開始する際には注意が必要です。 投薬と管理 ]。
COPEGUS による貧血患者では、致命的および非致命的な心筋梗塞が報告されています。リバビリン療法を開始する前に、基礎にある心疾患について患者を評価する必要があります。既存の心疾患のある患者は、治療前に心電図を投与する必要があり、治療中は適切に監視する必要があります。心血管状態の悪化があれば、治療を中断または中止する必要があります[参照 投薬と管理 ]。心疾患は薬剤性貧血によって悪化する可能性があるため、重度または不安定な心疾患の既往歴のある患者は、COPEGUS を使用しないでください。 囲み警告 と 投薬と管理 ]。
肝不全
肝硬変を伴う慢性 C 型肝炎 (CHC) 患者は、PEGASYS を含むアルファ インターフェロンで治療すると、肝代償不全および死亡のリスクにさらされる可能性があります。高活性抗レトロウイルス療法(HAART)およびリバビリンの有無にかかわらずインターフェロンアルファ-2aを受けているHIVに同時感染した肝硬変CHC患者は、HAARTを受けていない患者と比較して、肝代償不全の発症リスクが高いようです。研究NR15961で[参照 臨床研究 ]、HAART を受けている 129 人の CHC/HIV 肝硬変患者のうち、すべての治療群でこれらの患者の 14 人 (11%) が肝代償不全を発症し、6 人が死亡しました。 14人の患者全員が、スタブジン、ジダノシン、アバカビル、ジドブジン、およびラミブジンを含むNRTIを服用していました。これらの少数の患者では、特定の NRTI または関連するリスクを区別することはできません。治療中は、患者の臨床状態と肝機能を綿密に監視して、肝代償不全の徴候と症状を確認する必要があります。肝代償不全の患者では、PEGASYS/COPEGUS 100mgによる治療を直ちに中止する必要があります[ 禁忌 ]。
過敏症
重度の急性過敏症反応(蕁麻疹、血管性浮腫、気管支収縮、アナフィラキシーなど)が、アルファ インターフェロンおよびリバビリン療法中に観察されています。このような反応が生じた場合、PEGASYS および COPEGUS 100mg による治療を直ちに中止し、適切な治療を開始する必要があります。リバビリンの有無にかかわらずペガシスを投与された患者で、小胞水疱性発疹、さまざまな程度の皮膚と粘膜の関与を伴うスティーブンス・ジョンソン症候群(大多形紅斑)のスペクトルの反応、および剥脱性皮膚炎(紅皮症)を含む深刻な皮膚反応が報告されています。重度の皮膚反応の徴候または症状が現れた患者は、治療を中止しなければなりません [参照 有害反応 ]。
肺疾患
リバビリンおよびインターフェロンによる治療中に、呼吸困難、肺浸潤、肺炎、肺高血圧症、および肺炎が報告されています。致命的な肺炎の時折のケースが発生しました。また、サルコイドーシスやサルコイドーシスの増悪が報告されています。肺浸潤または肺機能障害の証拠がある場合、患者を綿密に監視し、適切な場合は COPEGUS/PEGASYS 併用療法を中止する必要があります。
骨髄抑制
ペグ化インターフェロン/リバビリンとアザチオプリンの同時投与後 3 ~ 7 週間以内に、汎血球減少症 (RBC、好中球、および血小板の顕著な減少) および骨髄抑制が起こることが文献で報告されています。この限られた数の患者 (n=8) では、骨髄毒性は、HCV 抗ウイルス療法と併用アザチオプリンの両方を中止すると 4 ~ 6 週間以内に回復し、いずれかの治療のみを再開しても再発しませんでした。 PEGASYS、COPEGUS 100mg、およびアザチオプリンは、汎血球減少のために中止する必要があり、ペグ化インターフェロン/リバビリンは、併用アザチオプリンと一緒に再導入すべきではありません[ 薬物相互作用 ]。
膵炎
COPEGUS および PEGASYS 療法は、膵炎の徴候および症状がある患者では中止し、膵炎が確認された患者では中止する必要があります。
小児患者の成長への影響
PEGASYS とリバビリンによる最大 48 週間の併用療法では、5 歳から 17 歳の小児被験者で成長阻害が観察されました。ベースラインと比較して、最大 48 週間の治療で、年齢 z スコアの体重と年齢 z スコアの身長の減少が観察されました。治療後 2 年で、小児被験者の 16% はベースラインの体重曲線を 15 パーセンタイル以上下回り、11% はベースラインの身長曲線を 15 パーセンタイル以上下回りました。
治療後 6 年間追跡された被験者に関する入手可能な長期データは、一部の患者の成人身長の減少のリスクを決定するにはあまりにも限られている [参照 臨床研究経験 ]。
臨床検査
PEGASYS/COPEGUS 併用療法を開始する前に、すべての患者に標準的な血液学的および生化学的臨床検査を行うことをお勧めします。出産の可能性のある女性の妊娠スクリーニングを実施する必要があります。既存の心臓の異常がある患者は、PEGASYS/COPEGUS による治療の前に心電図を投与する必要があります。
治療開始後、血液学的検査は 2 週間目と 4 週間目に、生化学的検査は 4 週間目に実施する必要があります。追加のテストは、治療中に定期的に実行する必要があります。成人の臨床研究では、CBC(ヘモグロビンレベル、白血球および血小板数を含む)および化学(肝機能検査および尿酸を含む)を1、2、4、6、および8週間で測定し、その後4週間ごとに測定しました異常が認められた場合は6週間以上の頻度で。小児臨床試験では、血液学的および化学的評価は 1、3、5、および 8 週間で行われ、その後は 4 週間ごとに行われました。甲状腺刺激ホルモン (TSH) は 12 週間ごとに測定されました。併用療法中および治療中止後 6 か月間は、毎月の妊娠検査を実施する必要があります。
COPEGUS 100mg と PEGASYS の臨床試験に使用された開始基準は、治療開始の許容可能なベースライン値のガイドラインと見なすことができます。
- -血小板数が90,000細胞/mm³以上(肝硬変のHCV患者では75,000細胞/mm³、CHCおよびHIV患者では70,000細胞/mm³)
- -絶対好中球数(ANC)が1500細胞/ mm³以上
- TSHおよびT4が正常範囲内、または甲状腺機能が適切に制御されている
- -CD4+細胞数が200細胞/mm³以上、またはCD4+細胞数が100細胞/mm³以上で200細胞/mm³未満、およびHIVに同時感染した患者のHIV-1 RNAが5,000コピー/mL未満
- CHC単感染患者のヘモグロビンは、女性で12 g/dL以上、男性で13 g/dL以上
- -CHCおよびHIV患者のヘモグロビンが女性で11 g/dL以上、男性で12 g/dL以上
患者相談情報
- 見る FDA 承認の患者ラベリング (投薬ガイド)
妊娠
患者は、リバビリンが先天性欠損症および/または暴露された胎児の死亡を引き起こす可能性があることを知らされなければなりません. COPEGUS 100mg 療法は、妊娠中の女性、または女性パートナーが妊娠している男性は使用しないでください。女性患者、COPEGUS 治療を受けている男性患者の女性パートナー、および治療後 6 か月間は、妊娠を避けるために細心の注意を払う必要があります。患者は、COPEGUS 治療中および治療後 6 か月間、2 つの信頼できる避妊方法を使用する必要があります。 COPEGUS 治療は、治療開始直前に妊娠検査で陰性の報告が得られるまで開始しないでください。患者は、治療中および治療後 6 か月間、毎月妊娠検査を実施する必要があります。
出産の可能性のある女性患者、および出産の可能性のある女性パートナーを持つ男性患者は、催奇形性/胚死のリスクについて知らされ、COPEGUS 治療中および治療後 6 か月間、効果的な避妊を実践するように指示されなければなりません。患者は、妊娠した場合はすぐに医療提供者に通知するようにアドバイスする必要があります[を参照してください 禁忌 と 警告と注意事項 ]。
貧血
リバビリンに関連する最も一般的な有害事象は貧血であり、重度の場合があります[ 囲み警告 、 警告と注意事項 と 有害反応 ]。患者は、COPEGUS 治療を開始する前とその後定期的に検査室での評価が必要であることを知らされるべきである [参照 警告と注意事項 ]。特に治療の初期段階では、十分に水分を補給することをお勧めします。
めまい、錯乱、傾眠、および疲労を発症した患者は、運転や機械の操作を避けるように注意する必要があります。
患者には、COPEGUS 100mg を食事と一緒に服用するようにアドバイスする必要があります。
インターフェロンで治療された患者では、薬物中毒の再発と薬物の過剰摂取が報告されているため、COPEGUS/PEGASYS を開始する前に、薬物乱用の前歴について患者に質問する必要があります。
アルコールは慢性C型肝炎感染を悪化させる可能性があるため、患者はアルコールを飲まないようにアドバイスされるべきです.
患者は、COPEGUS の投与量を逃した場合に何をすべきかについて知らされるべきです。逃した線量は、同じ日にできるだけ早く服用する必要があります。患者は次の用量を 2 倍にしないでください。質問がある場合は、医療提供者に電話するよう患者に助言する必要があります。
C 型肝炎感染症の PEGASYS/COPEGUS 治療が感染に及ぼす影響は不明であり、治療中または治療が失敗した場合に C 型肝炎ウイルスの感染を防ぐための適切な予防措置を講じる必要があることを患者に知らせる必要があります。
患者は、COPEGUS の使用に付随する潜在的な利益とリスクについて知らされるべきです。同封の内容の確認を含め、適切な使用に関する指示を与える必要があります。 投薬ガイド これは、すべてのまたは起こり得る悪影響の開示ではありません。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
100 mg/kg/日の最大耐用量までの p53 (+/-) マウスの発がん性研究では、リバビリンは発がん性がありませんでした。リバビリンは、ラットの 2 年間の発がん性試験でも、最大耐用量 60 mg/kg/日までの用量で発がん性がありませんでした。体表面積に基づいて、これらの用量は、リバビリンの最大推奨日用量のそれぞれ約 0.5 倍および 0.6 倍です。
突然変異誘発
リバビリンは、in vitro マウスリンパ腫アッセイで変異原活性を示しました。 2000 mg/kg までの用量での in vivo マウス小核アッセイでは、染色体異常誘発活性は観察されませんでした。しかし、文献に発表された研究の結果は、2000 mg/kg までの経口用量での in vivo マウス小核アッセイで染色体異常誘発活性を示しています。ラットの優性致死アッセイは陰性であり、ラットに突然変異が発生した場合、それらは雄の配偶子を介して伝達されなかったことを示しています.
受胎能障害
ラットの受胎能研究では、リバビリンは受精能に影響を与えずに、100 mg/kg/日の用量で精子数のわずかな減少を示しました。治療を中止すると、1回の精子形成サイクル後に完全に回復しました。リバビリンによる精巣変性の時間経過と可逆性を評価するために設計されたマウスの研究で、15~150mg/kg/日(リバビリンのヒトの最大推奨1日用量の約0.1~0.8倍)を投与した研究で、精子の異常が観察されました。 3ヶ月から6ヶ月。治療を中止すると、リバビリン誘発性精巣毒性からの本質的に完全な回復が、1または2回の精子形成周期内で明らかになりました。
出産の可能性のある女性患者と、出産の可能性のある女性パートナーを持つ男性患者は、患者とそのパートナーが効果的な避妊法(信頼できる 2 つの方法)を使用していない限り、COPEGUS を受けるべきではありません。リバビリンの反復投与半減期 (t½) が 12 日間であることから、治療後 6 か月間は有効な避妊法を使用する必要があります (すなわち、リバビリンのクリアランスの半減期は 15 回)。
PEGASYS と COPEGUS を組み合わせて使用した生殖毒性試験は実施されていません。ただし、ペグインターフェロン アルファ-2a とリバビリンを別々に投与すると、それぞれ生殖に悪影響を及ぼします。いずれかの薬剤単独で得られる効果は、2 つの薬剤の組み合わせによっても引き起こされると想定する必要があります。
特定の集団での使用
妊娠
カテゴリーX [見る 禁忌 ]。リバビリンは、適切な研究が実施されたすべての動物種において、有意な殺胚および/または催奇形効果をもたらしました。頭蓋骨、口蓋、目、顎、手足、骨格、消化管の奇形が認められました。催奇形性の影響の発生率と重症度は、薬剤の用量が増加するにつれて増加しました。胎児と子孫の生存率が低下した[参照 禁忌 と 警告と注意事項 ]。
ラットおよびウサギにおける従来の胚毒性/催奇形性試験では、観察された無影響用量レベルは、提案された臨床使用の用量レベルをはるかに下回っていました (ラットおよびウサギの両方で 0.3 mg/kg/日; リバビリンの推奨されるヒトの 1 日用量の約 0.06 倍)。 . 1 mg/kg/日まで経口投与されたラットの周産期/出生後毒性試験で、母体毒性または子孫への影響は観察されませんでした (リバビリンの最大推奨 1 日用量の約 0.01 倍)。
治療と治療後:胎児への潜在的なリスク
リバビリンは、細胞内成分に蓄積することが知られており、そこから非常にゆっくりと除去されます。リバビリンが精子に含まれているかどうかは不明であり、含まれている場合、卵子の受精に潜在的な催奇形性効果を発揮する.しかし、リバビリンの潜在的なヒト催奇形作用のため、男性患者は、女性パートナーの妊娠のリスクを回避するためにあらゆる予防策を講じるようにアドバイスされるべきです.
COPEGUS は、妊娠中の女性、または女性パートナーが妊娠している男性は使用しないでください。妊娠の可能性のある女性患者、および出産の可能性のある女性パートナーを持つ男性患者は、治療中および治療後 6 か月間、患者とそのパートナーが効果的な避妊法(信頼できる 2 つの方法)を使用していない限り、COPEGUS を受けるべきではありません。 禁忌 ]。
リバビリン妊娠登録
リバビリン妊娠登録は、治療中および治療中止後 6 か月間、リバビリンにさらされた女性患者および男性患者の女性パートナーの妊娠の母体胎児転帰を監視するために確立されました。医療提供者と患者は、1-800-593-2214 に電話してそのような事例を報告することをお勧めします。
授乳中の母親
リバビリンが母乳中に排泄されるかどうかは不明です。多くの薬物が母乳中に排泄されるため、リバビリンによる授乳中の乳児に深刻な副作用が生じる可能性を避けるために、母親に対する治療の重要性に基づいて、授乳を中止するか、COPEGUS 100mg による治療を中止するかを決定する必要があります。
小児用
小児患者における薬物動態評価は実施されていません。
COPEGUS の安全性と有効性は、5 歳未満の患者では確立されていません。
高齢者の使用
COPEGUS 100mg と PEGASYS の臨床試験には、65 歳以上の被験者が十分に含まれておらず、若い被験者と反応が異なるかどうかを判断できませんでした。高齢者におけるリバビリンの特異的な薬物動態評価は実施されていません。この薬に対する毒性反応のリスクは、腎機能が低下している患者で大きくなる可能性があります。クレアチニンクリアランスが 50 mL/min 以下の患者では、COPEGUS 100 mg の投与量を減らす必要があります。クレアチニンクリアランスが 30 mL/min 未満の患者では、PEGASYS の投与量を減らす必要があります [参照 投薬と管理 ; 特定の集団での使用 ]。
人種
42 人の被験者を対象とした薬物動態研究では、黒人 (n=14)、ヒスパニック系 (n=13)、白人 (n=15) の被験者の間でリバビリンの薬物動態に臨床的に有意な差がないことが示されました。
腎障害
患者のクレアチニンクリアランスを推定することにより、COPEGUS の開始前にすべての患者の腎機能を評価する必要があります。
臨床試験では、慢性血液透析を必要とする中等度 (クレアチニンクリアランス 30 ~ 50 mL/分) または重度 (クレアチニンクリアランス 30 mL/分未満) の腎障害または末期腎疾患 (ESRD) を有する 50 人の CHC 被験者における COPEGUS および PEGASYS による治療が評価されました。 (HD)。慢性 HD を受けている ESRD の 18 人の被験者に、COPEGUS を 1 日 200 mg の用量で投与し、腎機能が正常な被験者と比較して有害事象プロファイルに明らかな違いはありませんでした。 COPEGUS の減量と一時的な中断 (COPEGUS 関連の有害反応、主に貧血による) が、治療中に最大 3 分の 1 の ESRD/HD 被験者で観察されました。そして、これらの被験者の 3 分の 1 だけが COPEGUS を 48 週間受けました。リバビリンの血漿曝露は、標準的な 1000/1200 mg COPEGUS の 1 日用量を投与されている正常な腎機能の被験者と比較して、HD で ESRD を有する被験者では約 20% 低かった。
中等度 (n=17) または重度 (n=14) の腎障害のある被験者は、主に貧血である COPEGUS 関連の有害反応のために、それぞれ 600 mg または 400 mg の COPEGUS の 1 日用量に耐えられず、20% から 30% を示しました。標準用量の COPEGUS を投与された腎機能が正常な被験者 (クレアチニンクリアランスが 80 mL/分を超える) と比較して、リバビリンの血漿曝露量が高かった (頻繁な用量変更にもかかわらず)。中止率は、中等度の腎障害または正常な腎機能の被験者で観察されたものと比較して、重度の腎障害の被験者で高かった。薬物動態モデリングとシミュレーションは、重度の腎障害のある患者に 1 日 200 mg の用量を、中等度の腎障害のある患者に 1 日 200 mg を 400 mg と交互に 1 日 200 mg 投与すると、腎機能が正常な患者と同様の血漿リバビリン曝露が得られることを示しています。 COPEGUSの承認されたレジメンを受けています。これらの用量は、患者で研究されていない[参照 投薬と管理 と 臨床薬理学 ]。
この試験の薬物動態と安全性の結果に基づいて、クレアチニンクリアランスが 50 mL/min 以下の患者は、COPEGUS の用量を減らして投与する必要があります。クレアチニンクリアランスが 30 mL/min 未満の患者は、PEGASYS の投与量を減らしてください。 COPEGUS 100mgを投与されているクレアチニンクリアランスが50mL/分以下の患者の臨床的および血液学的状態を注意深く監視する必要があります。臨床的に重大な臨床検査値異常または有害反応が持続的に重度または悪化している患者は、治療を中止する必要があります[参照 投薬と管理 、 臨床薬理学 、 と ペガシス添付文書 ]。
肝障害
COPEGUS投与後のリバビリンの薬物動態に対する肝機能障害の影響は評価されていません。 COPEGUS 100mg の臨床試験は、Child-Pugh クラス A 疾患の患者に限定されていました。
性別
リバビリンの薬物動態における臨床的に有意な差は、男性と女性の被験者間で観察されませんでした。
リバビリンの薬物動態は、体重で補正すると、男性患者と女性患者で類似しています。
臓器移植レシピエント
PEGASYS および COPEGUS 100mg 治療の安全性と有効性は、肝臓やその他の移植患者では確立されていません。他のアルファ インターフェロンと同様に、PEGASYS 単独または COPEGUS との併用で、肝臓および腎臓移植片の拒絶反応が報告されています。 有害反応 ]。
過剰摂取
臨床試験では、COPEGUS の過剰摂取の事例は報告されていません。低カルシウム血症および低マグネシウム血症は、リバビリンの推奨投与量を超えて投与された人で観察されています。これらのケースのほとんどで、リバビリンは、推奨される最大経口 1 日用量の 4 倍まで、場合によってはそれを超える用量で静脈内投与されました。
禁忌
COPEGUS (リバビリン) は以下の患者には禁忌です:
- 妊娠中の女性。 COPEGUS を妊婦に投与すると、胎児に害を及ぼす可能性があります。 COPEGUS は、妊娠中または妊娠する可能性のある女性には禁忌です。妊娠中にこの薬を使用する場合、または患者がこの薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきです[ 警告と注意事項 、 特定の集団での使用 、 と 患者情報 ]。
- 女性パートナーが妊娠している男性。
- 異常ヘモグロビン症(例、サラセミア・メジャーまたは鎌状赤血球貧血)の患者。
- ジダノシンとの組み合わせ。致命的な肝不全、末梢神経障害、膵炎、症候性高乳酸血症/乳酸アシドーシスの報告が臨床試験で報告されている[参照 薬物相互作用 ]。
COPEGUS と PEGASYS の併用療法は、以下の患者には禁忌です。
- 自己免疫性肝炎。
- 治療前の肝硬変CHC単感染患者における肝代償不全(Child-Pughスコア6以上、クラスBおよびC)[参照 警告と注意事項 ]。
- 治療前にHIVに同時感染した肝硬変CHC患者における肝代償不全(Child-Pughスコアが6以上)[参照 警告と注意事項 ]。
臨床薬理学
作用機序
リバビリンは抗ウイルス薬です [ 微生物学 ]。
薬物動態
ペグインターフェロン アルファ-2a と組み合わせてリバビリンを投与された HCV 患者について、リバビリンの複数回投与の薬物動態データが入手可能です。 1200 mg/日を食事とともに 12 週間投与した後、平均±SD (n=39; 体重 75 kg 超) の AUC0-12hr は 25,361±7110 ng·hr/mL であり、Cmax は 2748±818 ng/mL でした。 Cmax に到達するまでの平均時間は 2 時間でした。 12 週間の食事による投与後のリバビリンのトラフ血漿濃度は、800 mg/日を投与された HCV 感染患者 (n=89) で 1662±545 ng/mL、1200 mg/日を投与された患者で 2112±810 ng/mL ( n=75; 体重が 75 kg を超える場合)。
COPEGUS の単回経口投与後のリバビリンの終末半減期は、約 120 ~ 170 時間です。 COPEGUS 100mgの単回経口投与後の総見かけクリアランスは約26L/hです。定常状態での Cmax が単回投与の 4 倍になるように、複数回投与 (1 日 2 回) 後にはリバビリンが大量に蓄積されます。
リバビリンの吸収に対する食物の影響
リバビリンの単回経口投与のバイオアベイラビリティは、高脂肪食との同時投与によって増加しました。 COPEGUS を高脂肪食と一緒に摂取した場合、絶食状態と比較して、吸収が遅くなり (Tmax が 2 倍になり)、AUC0-192h と Cmax がそれぞれ 42% と 66% 増加しました [ 投薬と管理 と 患者情報 ]。
排泄と代謝
COPEGUS 100mg投与後のリバビリン排泄への腎臓および肝臓経路の寄与は知られていない. in vitro 研究は、リバビリンが CYP450 酵素の基質ではないことを示しています。
腎障害
ある臨床試験では、慢性血液透析 (HD) を必要とする中等度 (クレアチニンクリアランス 30 ~ 50 mL/分) または重度 (クレアチニンクリアランス 30 mL/分未満) の腎障害または末期腎疾患 (ESRD) を有する 50 人の CHC 被験者が評価されました。リバビリンの見かけのクリアランスは、クレアチニンクリアランスが 50 mL/min 以下の被験者 (HD の ESRD の被験者を含む) で減少し、正常な腎機能を持つ被験者で見られる値の約 30% を示しました。薬物動態モデリングとシミュレーションは、重度の腎障害のある患者に 1 日 200 mg の用量を、中等度の腎障害のある患者に 1 日 200 mg と 400 mg を交互に 1 日 200 mg 投与すると、以下の患者で観察されるのと同様の血漿リバビリン曝露が得られることを示しています。標準的な 1000/1200 mg の COPEGUS 1 日用量を投与された正常な腎機能。これらの用量は、患者で研究されていません。
慢性 HD を受けている ESRD の 18 人の被験者に、COPEGUS を 1 日 200 mg の用量で投与しました。これらの対象におけるリバビリンの血漿曝露は、標準的な 1000/1200 mg の COPEGUS の 1 日用量を投与されている正常な腎機能を持つ対象と比較して、約 20% 低かった [参照 投薬と管理 、 特定の集団での使用 ]。
血漿リバビリンは、血液透析によって約 50% の抽出率で除去されます。しかし、リバビリンの分布量が大きいため、血漿暴露は血液透析によって変化しないと予想されます。
微生物学
作用機序
リバビリンが臨床における抗ウイルス効果に寄与するメカニズムは完全には理解されていません。リバビリンは、組織培養において多くの RNA ウイルスに対して直接的な抗ウイルス活性を示します。リバビリンはいくつかの RNA ウイルスのゲノムの変異頻度を増加させ、リバビリン三リン酸は生化学反応で HCV ポリメラーゼを阻害します。
細胞培養における抗ウイルス活性
安定した HCV 細胞培養モデル系 (HCV レプリコン) では、リバビリンは 11 ~ 21 mcM の 50% 有効濃度 (EC50) 値で自律的な HCV RNA 複製を阻害しました。同じモデルで、PEG-IFN α-2a も HCV RNA 複製を阻害し、EC50 値は 0.1 ~ 3 ng/mL でした。 PEG-IFN α-2a とリバビリンの組み合わせは、HCV RNA 複製の阻害において、いずれかの薬剤単独よりも効果的でした。
抵抗
異なる HCV 遺伝子型は、PEG-IFN-α およびリバビリン療法に対する反応においてかなりの臨床的変動を示します。可変応答に関連するウイルスの遺伝的決定要因は、決定的に特定されていません。
交差抵抗
IFN α とリバビリンとの間の交差耐性は観察されていません。
動物毒物学
ラットでの研究では、リバビリンを 200 mg/kg までの用量で 5 日間 (リバビリンの最大推奨ヒト用量の 1.7 倍まで) 投与しても優性致死は誘発されなかったと結論付けられました。
マウスとラットでの長期試験(18~24ヶ月;用量はそれぞれ20~75および10~40mg/kg/日、ヒトのリバビリン最大1日用量の約0.1~0.4倍)は、マウスにおけるリバビリンの慢性曝露と血管病変(顕微鏡的出血)の発生率の増加。ラットでは、対照群で網膜変性が発生したが、リバビリン投与ラットでは発生率が増加した。
臨床研究
C型慢性肝炎患者
成人患者
C型肝炎ウイルス感染症の治療のためのCOPEGUSと組み合わせたPEGASYSの安全性と有効性は、2つのランダム化比較臨床試験で評価されました。すべての患者は成人であり、代償性肝疾患、検出可能な C 型肝炎ウイルス、慢性肝炎の肝生検診断、および以前にインターフェロンによる治療を受けていませんでした。両方の研究で、患者の約 20% が代償性肝硬変 (Child-Pugh クラス A) を持っていました。 HIVに同時感染した患者は、これらの研究から除外されました。
NV15801 試験では、患者は無作為に割り当てられ、PEGASYS 180 mcg を週 1 回経口プラセボとともに皮下投与する群、PEGASYS 180 mcg を週 1 回経口投与する COPEGUS 1000 mg (体重 75 kg 未満) または 1200 mg を経口投与する群 (体重がまたはインターフェロン アルファ-2b 3 MIU を週 3 回皮下投与し、リバビリン 1000 mg または 1200 mg を経口投与します。すべての患者が 48 週間の治療を受け、続いて 24 週間の無治療のフォローアップが行われました。 COPEGUS またはプラセボ治療の割り当ては盲検化されました。持続的なウイルス学的反応は、研究の 68 週目以降に検出不能 (50 IU/mL 未満) の HCV RNA として定義されました。 COPEGUS 100mg と組み合わせた PEGASYS は、PEGASYS 単独またはインターフェロン α-2b およびリバビリンと比較して、より高い SVR をもたらしました (表 9)。 .すべての治療群において、ウイルス量に関係なく、ウイルス遺伝子型 1 の患者は、他のウイルス遺伝子型の患者と比較して、ペガシスと COPEGUS 100mg の併用に対する反応率が低かった。
全体的な治療効果の差 (PEGASYS/COPEGUS – インターフェロン α-2b/リバビリン) は 9% (95% CI 2.3, 15.3) でした。
NV15942 試験では、すべての患者が PEGASYS 180 mcg を週 1 回皮下投与され、24 週間または 48 週間の治療と、800 mg または 1000 mg/1200 mg の COPEGUS 用量に無作為に割り付けられました (体重が 75 kg 未満/または75kgに等しい)。 4 つの治療群への割り当ては、ウイルスの遺伝子型とベースラインの HCV ウイルス力価によって階層化されました。遺伝子型 1 でウイルス力価が高い患者 (2 x 106 HCV RNA コピー/mL 血清以上と定義) は、48 週間の治療に優先的に割り当てられました。
持続的ウイルス学的反応 (SVR) および HCV 遺伝子型
HCV 1 および 4 — ベースラインのウイルス力価に関係なく、PEGASYS と 1000 mg または 1200 mg の COPEGUS による 48 週間の治療は、より短い治療と比較して、より高い SVR (24 週間の無治療追跡期間の終わりに HCV RNA が検出されないこととして定義) をもたらしました。 (24 週間) および/または 800 mg COPEGUS。
HCV 2 および 3 — ベースラインのウイルス力価に関係なく、PEGASYS と 800 mg の COPEGUS による 24 週間の治療は、より長い治療 (48 週間) および/または 1000 mg または 1200 mg の COPEGUS と比較して同様の SVR をもたらしました (表 10 を参照)。
遺伝子型 5 および 6 の患者数は少なすぎて、意味のある評価を行うことができませんでした。
小児患者
未治療の 5 ~ 17 歳 (55% が 12 歳未満) の慢性 C 型肝炎、代償性肝疾患、および検出可能な HCV RNA を有する小児被験者が、COPEGUS 100mg 約 15 mg/kg/日と PEGASYS 180 mcg/1.73 m² で治療されました。 x 体表面積を週 1 回、48 週間。すべての被験者は、治療後 24 週間追跡されました。持続的ウイルス学的反応 (SVR) は、研究の 68 週目以降に HCV RNA が検出不能 (50 IU/mL 未満) であると定義されました。 24 週以降に PEGASYS 単剤療法に失敗した被験者は、非盲検の COPEGUS と PEGASYS を受けることができました。最初の無作為化されたアームは、人口統計学的要因のバランスが取れていました。 55 人の被験者が COPEGUS 100mg と PEGASYS の最初の併用療法を受け、59 人の被験者が PEGASYS とプラセボの併用療法を受けました。治療目的集団全体では、45% が女性、80% が白人、81% が HCV 遺伝子型 1 に感染していた。SVR の結果を表 11 に要約する。
その他の治療反応予測因子
ペグ化インターフェロンアルファ療法を受けている予後不良因子を有する患者では、治療反応率が低くなります。研究 NV15801 および NV15942 では、40 歳以上の患者 (50% 対 66%)、肝硬変患者 (47% 対 59%)、体重 85 kg を超える患者 (49% 対60%)、および遺伝子型 1 の患者で、ウイルス量が多い場合と少ない場合 (43% 対 56%)。アフリカ系アメリカ人の患者は、白人に比べて反応率が低かった。
研究 NV15801 および NV15942 では、12 週間までに初期のウイルス学的反応が得られないこと (HCV RNA が検出されない、またはベースラインより 2 log10 以上低いと定義) が治療中止の理由でした。 12 週間までに早期ウイルス反応が得られず、プロトコルで定義された治療中止オプションにもかかわらず、推奨される治療コースを完了した患者のうち、5/39 (13%) が SVR を達成しました。 24 週までに早期のウイルス反応を示さなかった患者のうち、19 人が治療の全コースを完了し、SVR を達成した患者はいませんでした。
慢性 C 型肝炎/HIV 重複感染患者
NR15961 試験では、CHC/HIV の患者は、週 1 回の PEGASYS 180 mcg 皮下投与と経口プラセボ、週 1 回の PEGASYS 180 mcg と毎日の経口 COPEGUS 800 mg、またはインターフェロン α-2a、3 MIU 週 3 回の皮下投与のいずれかに無作為に割り付けられました。さらに、COPEGUS 800 mg を毎日経口摂取。すべての患者は 48 週間の治療を受け、24 週間の無治療追跡調査で持続的ウイルス学的反応 (SVR) が評価されました。 COPEGUS 100mg またはプラセボ治療の割り当ては、PEGASYS 治療群では盲検化されました。すべての患者は成人であり、代償性肝疾患、検出可能な C 型肝炎ウイルス、慢性 C 型肝炎の肝生検診断、および以前にインターフェロンによる治療を受けていませんでした。患者はまた、CD4+細胞数が200細胞/mm³以上、またはCD4+細胞数が100細胞/mm³以上200細胞/mm³未満であり、HIV-1 RNAが5000コピー/mL未満であり、状態が安定していたHIVの。この研究の患者の約 15% が肝硬変でした。結果を表 12 に示します。
予後不良因子 (HCV 遺伝子型 1、HCV RNA が 800,000 IU/mL を超える、および肝硬変を含む) を有する CHC/HIV 患者でペグ化インターフェロン アルファ療法を受けた場合、治療反応率は低かった。
12 週間の PEGASYS と COPEGUS の併用療法により、HCV RNA が検出されないことも、HCV RNA 力価がベースラインから少なくとも 2 log10 減少することも示さなかった患者のうち、2% (2/85) が SVR を達成しました。
PEGASYS単独またはCOPEGUS 100mg治療と組み合わせて48週間投与されたHIV重複感染のCHC患者では、平均および中央値のHIV RNA力価は、治療中または治療後24週間でベースラインを超えて増加しませんでした。
患者情報
コペガス® (Co-PEG-UHS) (リバビリン) 錠
COPEGUS 100mg の服用を開始する前にこの投薬ガイドを注意深く読み、さらに COPEGUS を摂取するたびに投薬ガイドを読んでください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
PEGASYS (peginterferon alfa-2a) の投薬ガイドもお読みください。
COPEGUS について知っておくべき最も重要な情報は何ですか?
- 女性は、コペガスの開始前、コペガス 100mg の投与中は毎月、コペガスの投与後 6 か月間は毎月、妊娠検査を受ける必要があります。
- あなたまたはあなたの女性の性的パートナーが妊娠した場合 COPEGUS 100mg の服用中、または COPEGUS の服用を中止してから 6 か月以内に、すぐに医療提供者に伝えてください。あなたまたはあなたの医療提供者に連絡する必要があります 1-800-593-2214 に電話して、リバビリン妊娠登録。 Ribavirin Pregnancy Registry は、母親が妊娠中に COPEGUS を服用した場合、母親とその赤ちゃんに何が起こるかについての情報を収集します。
コペガス100mgとは?
COPEGUS 100mg は、ペガシス (ペグインターフェロン アルファ-2a) と呼ばれる別の薬と併用される処方薬であり、肝臓がまだ正常に機能している 5 歳以上の人々の慢性 (長期間持続する) C 型肝炎感染を治療するために使用されます。インターフェロンαという薬。 COPEGUS が安全で、5 歳未満の子供に効果があるかどうかはわかっていません。
COPEGUS 100mgを服用してはいけない人は?
見る 「COPEGUS 100mg について知っておくべき最も重要な情報は何ですか?」
次の場合は COPEGUS を服用しないでください。
- 特定の種類の肝炎を持っている 免疫系が肝臓を攻撃することによって引き起こされる(自己免疫性肝炎)
- サラセミアメジャーまたは鎌状赤血球貧血(ヘモグロビン症)などの特定の血液疾患がある
- ジダノシンを取る (バイデックスまたはバイデックス EC)
これらの病状がある場合は、COPEGUS 100mg による治療を開始する前に、医療提供者に相談してください。
COPEGUS 100mg を服用する前に、医療提供者に何を伝えるべきですか?
COPEGUS を服用する前に、次のことを持っているか、持っていたかどうかを医療提供者に伝えてください。
- あなたに効かなかったC型肝炎の治療
- COPEGUSまたはCOPEGUSのいずれかの成分に対する深刻なアレルギー反応。 成分のリストについては、この投薬ガイドの最後を参照してください。
- 呼吸の問題。 COPEGUS 100mg は、すでに持っている呼吸の問題を引き起こしたり、悪化させたりする可能性があります。
- 視力の問題。 コペガスは目の問題を引き起こしたり、すでに持っている目の問題を悪化させる可能性があります。 COPEGUS による治療を開始する前に、目の検査を受ける必要があります。
- 貧血などの特定の血液疾患
- 高血圧、心臓の問題、または心臓発作を起こしたことがある。 COPEGUS による治療を開始する前に、医療提供者は血液と心臓を検査する必要があります。
- 甲状腺の問題
- 糖尿病。 COPEGUS 100mg と PEGASYS の併用療法により、糖尿病が悪化したり、治療が困難になったりする可能性があります。
- 肝臓の問題 C型肝炎ウイルス感染症以外
- ヒト免疫不全ウイルス (HIV) またはその他の免疫の問題
- メンタルヘルスの問題、 うつ病や自殺の考えを含む
- 腎臓の問題
- 臓器移植
- 薬物中毒または乱用
- B型肝炎ウイルスの感染
- その他の病状
- 授乳中です。 COPEGUS 100mg が母乳に移行するかどうかは不明です。 COPEGUS を服用するか、母乳で育てるかは、あなたとかかりつけの医療提供者が決定する必要があります。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。コペガスを服用中に服用すると、深刻な副作用を引き起こす可能性のある薬もあります。一部の医薬品は、COPEGUS 100mg の作用に影響を与える可能性があり、COPEGUS 100mg は他の医薬品の作用に影響を与える可能性があります。
特に、ジダノシン (Videx または Videx EC) を含む HIV を治療する薬を服用している場合、またはアザチオプリン (Imuran または Azasan) を服用している場合は、医療提供者に伝えてください。
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医療提供者または薬剤師に見せてください。
COPEGUS 100mg の服用方法は?
- COPEGUS は、担当の医療提供者の指示どおりに服用してください。担当の医療提供者は、COPEGUS の服用量と服用時期を教えてくれます。 5 歳以上の子供の場合、医療提供者は体重に基づいて COPEGUS 100mg の用量を処方します。
- コペガスを食事と一緒に服用してください。
- コペガス 100mg を飲み忘れた場合は、その日のうちにできるだけ早く服用してください。次の用量を倍増しないでください。何をすべきかについて質問がある場合は、医療提供者に電話してください。
- COPEGUS 100mg の服用量が多すぎる場合は、すぐに医療提供者または地域の毒物管理センターに連絡するか、最寄りの病院の緊急治療室にすぐに行ってください。
- 担当の医療提供者は、COPEGUS による治療を開始する前、治療の 2 週間目と 4 週間目に血液検査を行い、その後は必要に応じて、治療への耐性を確認し、副作用を確認する必要があります。かかりつけの医療提供者は、血液検査の結果や副作用に基づいて、COPEGUS 100mg の投与量を変更する場合があります。
- 心臓に問題がある場合は、COPEGUS による治療を開始する前に、必要に応じて治療中に心電図検査を行って心臓をチェックする必要があります。
COPEGUS を服用している間、何を避けるべきですか?
COPEGUS 100mg は、疲労感、めまい、または混乱を引き起こす可能性があります。これらの症状がある場合は、機械を運転したり操作したりしないでください。
アルコールを飲まないでください。 ビール、ワイン、リキュールを含む。これにより、肝臓病が悪化する可能性があります。
COPEGUS の副作用にはどのようなものがありますか?
COPEGUS 100mg は、次のような重大な副作用を引き起こす可能性があります。
「COPEGUS 100mg について知っておくべき最も重要な情報は何ですか?」を参照してください。
- 膵臓の腫れと刺激(膵炎)。 胃の痛み、吐き気、嘔吐、下痢を伴うことがあります。
- 重度のアレルギー反応。 症状には、蕁麻疹、喘鳴、呼吸困難、胸痛、口、舌、または唇の腫れ、重度の発疹などがあります。
- 深刻な呼吸の問題。 呼吸困難は、死に至る可能性がある深刻な肺感染症 (肺炎) の徴候である可能性があります。
- 深刻な目の問題 視力低下や失明につながる可能性があります。
- 肝臓の問題。 人によっては肝機能が悪化することがあります。胃の膨満感、錯乱、茶色の尿、黄色い目などの症状がある場合は、すぐに医療提供者に伝えてください。
- 憂鬱症
- 自殺念慮と試み
- 子供の成長への影響。 PEGASYSおよびCOPEGUSで治療されている間、子供は体重増加と身長の増加の遅れを経験する可能性があります.治療を中止すると成長が追いつきますが、治療前に期待されていた身長に達しない子供もいます。 PEGASYS および COPEGUS による治療中のお子様の成長に懸念がある場合は、かかりつけの医療提供者にご相談ください。
上記の症状のいずれかがある場合は、医療提供者に電話するか、すぐに医療援助を受けてください。これらは、COPEGUS 100mg 治療の重大な副作用の徴候である可能性があります。
PEGASYSと一緒に服用したCOPEGUSの一般的な副作用は次のとおりです。
- 風邪のような症状 - 疲労感、頭痛、高熱に伴う震え(発熱)、筋肉や関節の痛み
- 気分の変化、いらいら、不安、睡眠障害
- 食欲不振、吐き気、嘔吐、下痢
- 脱毛
- かゆみ
気になる副作用や治らない副作用については、かかりつけの医療提供者に伝えてください。
これらは、COPEGUS 治療の副作用のすべてではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
1-888-835-2555 で Genentech に副作用を報告することもできます。
COPEGUS 100mgの保存方法を教えてください。
- COPEGUS タブレットは 59°F ~ 86°F (15°C ~ 30°C) で保管してください。
- ボトルをしっかりと閉めておいてください。
COPEGUS 100mg およびすべての医薬品は、子供の手の届かないところに保管してください。
COPEGUS の安全で効果的な使用に関する一般情報
COPEGUS 100mg と PEGASYS の併用による治療が、治療中に感染者が C 型肝炎ウイルスを他の人に拡散するのを防ぐかどうかはわかっていません。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 COPEGUS 100mg を処方されていない状態に使用しないでください。他の人があなたと同じ症状であっても、コペガスを与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、COPEGUS に関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療専門家向けに書かれた COPEGUS に関する情報については、医療提供者または薬剤師にお尋ねください。
コペガス100mgの成分は?
有効成分:リバビリン
不活性成分: 錠剤のコアには、アルファ化デンプン、微結晶性セルロース、デンプン グリコール酸ナトリウム、コーンスターチ、ステアリン酸マグネシウムが含まれています。錠剤のコーティングには、Chromatone-P または Opadry Pink (ヒドロキシプロピル メチル セルロース、タルク、二酸化チタン、合成黄酸化鉄、および合成赤酸化鉄を使用して製造)、エチル セルロース (ECD-30)、およびトリアセチンが含まれています。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
