Symbicort 160/4.5mcg Budesonide 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Symbicort 4.5mcg とは何ですか? どのように使用されますか?
Symbicort 4.5mcg は、喘息および慢性閉塞性肺疾患の症状を治療するために使用される処方薬です。 Symbicort は、単独で使用することも、他の薬剤と併用することもできます。
Symbicort は、Respiratory Inhalant Combos と呼ばれる薬物のクラスに属します。
Symbicort 4.5mcg が 6 歳未満の子供に安全で効果的かどうかはわかっていません。
Symbicort 4.5mcg の副作用の可能性は何ですか?
Symbicort は、次のような重大な副作用を引き起こす可能性があります。
- 呼吸障害の悪化、
- 口やのどの痛みや白い斑点、
- 飲み込むときの痛み、
- 震え、
- 緊張感、
- 胸痛、
- 心臓の鼓動が速くなったり、ドキドキしたり、
- 粘液で咳をする、
- 息切れを感じ、
- 喘鳴、
- 窒息、
- その他の呼吸の問題、
- ぼやけた視界、
- 視野狭窄、
- 目の痛みや赤み、
- ライトの周りにハローが見える
- 熱、
- 寒気、
- 体の痛み、
- 異常な疲労感
- 喉の渇きが増し、
- 排尿の増加、
- 口渇、
- フルーティーな口臭、
- 足のけいれん、
- 便秘、
- 不規則な心拍、
- 胸の中でときめき、
- しびれやうずき、
- 筋力低下、
- ぐったり感、
- 疲れ、
- 弱点、
- 立ちくらみ、
- 吐き気と
- 嘔吐
上記の症状がある場合は、すぐに医療機関を受診してください。
Symbicort の最も一般的な副作用は次のとおりです。
- 喉の痛みや刺激、
- 口やのどの白い斑点、
- 胃の不快感、
- 嘔吐、
- 背中の痛み、
- 頭痛、
- インフルエンザの症状など
- かぜの症状(鼻づまりや鼻水、くしゃみ、副鼻腔の痛み、のどの痛み)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Symbicort の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
SYMBICORT 80/4.5 および SYMBICORT 160/4.5 はそれぞれ、微粉化ブデソニドおよび微粉化フマル酸ホルモテロール二水和物を含み、経口吸入専用です。
SYMBICORT 80/4.5 および SYMBICORT 160/4.5 の各キャニスターは、ハイドロフルオロアルカン (HFA 227; 1,1,1,2,3,3,3-ヘプタフルオロプロパン) として処方されており、60 回または 120 回の作動を含む [参照 剤形と強度 と 供給方法 / 保管と取り扱い ]。プライミング後、各作動はバルブから 91/5.1 mcg または 181/5.1 mcg のいずれかを計測し、アクチュエータから 80/4.5 mcg または 160/4.5 mcg (微粉化ブデソニド/微粉化ホルモテロール フマル酸二水和物) を送達します。肺に送達される薬物の実際の量は、デバイスの作動と送達システムを介した吸気との間の調整など、患者の要因に依存する場合があります。 SYMBICORT 160mg には、懸濁剤としてポビドン K25 USP、潤滑剤としてポリエチレングリコール 1000 NF も含まれています。
SYMBICORT 160mg は、初めて使用する前に、2 回のテスト スプレーを顔から離れた空気中に放出し、各スプレーの前に 5 秒間よく振って下塗りする必要があります。吸入器が 7 日以上使用されていない場合、または吸入器を落とした場合は、各スプレーの前に 5 秒間よく振って、顔から離れた空気中に 2 回のテスト スプレーを放出することにより、吸入器を再度プライミングします。
SYMBICORT 4.5mcg の有効成分の 1 つはブデソニドで、化学的に (RS)11β, 16α, 17,21-テトラヒドロキシプレグナ-1,4-ジエン-3,20-ジオン環状 16,17-アセタールとブチルアルデヒドで表されるコルチコステロイドです。ブデソニドは、2 つのエピマー (22R および 22S) の混合物として提供されます。ブデソニドの実験式は C25H34O6 で、分子量は 430.5 です。その構造式は次のとおりです。
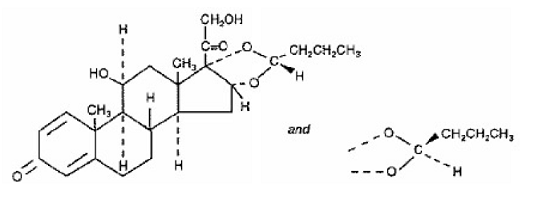
ブデソニドは白色からオフホワイトの無味無臭の粉末で、水やヘプタンにはほとんど溶けず、エタノールにはほとんど溶けず、クロロホルムには溶けやすい。 pH 7.4 でのオクタノールと水の分配係数は 1.6 x 103 です。
SYMBICORT 160mg の他の有効成分は、化学的に (R*,R*)-(±)-N-[2-ヒドロキシ-5-[1-ヒドロキシ-2-[[ 2-(4-メトキシフェニル)-1メチルエチル]アミノ]エチル]フェニル]ホルムアミド、(E)-2-ブテンジオエート(2:1)、二水和物。ホルモテロールの実験式は C42H56N4O14 で、分子量は 840.9 です。その構造式は次のとおりです。
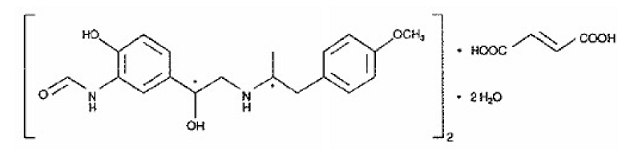
ホルモテロール フマル酸塩二水和物は、水にわずかに溶ける粉末です。 pH 7.4 でのオクタノール-水分配係数は 2.6 です。フマル酸フォルモテロール二水和物の 25°C での pKa は、フェノール基で 7.9、アミノ基で 9.2 です。
適応症
喘息の治療
SYMBICORT 4.5mcg は、6 歳以上の患者の喘息の治療に適応されます。
SYMBICORT は、吸入コルチコステロイド (ICS) などの長期の喘息コントロール薬で適切にコントロールされていない患者、または吸入コルチコステロイドと長時間作用型ベータ 2 アドレナリン作動薬 (LABA) の両方による治療の開始が必要な患者に使用する必要があります。
使用上の重要な制限
- SYMBICORT は、急性気管支痙攣の緩和には適応されません。
慢性閉塞性肺疾患の維持治療
SYMBICORT 160/4.5 は、慢性気管支炎および/または肺気腫を含む慢性閉塞性肺疾患 (COPD) 患者の気流閉塞の維持治療を適応としています。 SYMBICORT 160/4.5 は、COPD の増悪を軽減することも示されています。 SYMBICORT 160/4.5 は、COPD の治療を適応とする唯一の強度です。
使用上の重要な制限
- SYMBICORT 4.5mcg は、急性気管支痙攣の緩和には適応されません。
投薬と管理
管理情報
SYMBICORT 160mg は、1 日 2 回 (朝と夕方、約 12 時間間隔で) 2 吸入として、毎日経口吸入経路のみで投与する必要があります。吸入後、患者は飲み込まずに水で口をすすぐ必要があります。
SYMBICORT 4.5mcg を初めて使用する前に、2 回のテスト スプレーを顔から離れた空気中に放出し、各スプレーの前に 5 秒間よく振ります。吸入器が 7 日以上使用されていない場合、または落とした場合は、各スプレーの前に十分に振って、顔から離れた空気中に 2 回のテスト スプレーを放出して、吸入器を再びプライミングします。
一部の患者はフォルモテロールの高用量で副作用を経験する可能性が高いため、SYMBICORT の規定強度のより頻繁な投与またはより多くの吸入 (1 日 2 回以上の吸入) は推奨されません。 SYMBICORT を使用している患者は、何らかの理由で追加の LABA を使用しないでください [ 警告と注意事項 ]。
喘息
服用の合間に喘息の症状が現れた場合は、すぐに緩和するために吸入式の短時間作用型ベータ 2 アゴニストを服用する必要があります。
成人および思春期の患者 12 歳以上
12 歳以上の患者の場合、投与量は SYMBICORT 80/4.5 または SYMBICORT 160/4.5 を 1 日 2 回 2 回吸入します。
12 歳以上の患者に対する SYMBICORT の推奨開始用量は、患者の喘息の重症度または喘息症状のコントロールのレベル、および現在の吸入コルチコステロイドによる増悪のリスクに基づいています。
12 歳以上の成人および思春期患者の最大推奨用量は、SYMBICORT 160/4.5 で、1 日 2 回 2 回吸入します。
SYMBICORT の吸入投与後の喘息コントロールの改善は、治療開始から 15 分以内に生じる可能性がありますが、治療開始後 2 週間以上は最大の効果が得られない場合があります。個々の患者は、発症までの時間と症状の緩和の程度が異なります。
SYMBICORT 80/4.5 による治療の 1 ~ 2 週間後に開始用量に十分な反応が得られない患者の場合、SYMBICORT 160/4.5 との交換により、追加の喘息コントロールが得られる可能性があります。
以前有効だったSYMBICORT 4.5mcgの投薬レジメンが喘息の適切なコントロールを提供できない場合、治療レジメンを再評価し、追加の治療オプションを使用する必要があります(例えば、SYMBICORT 4.5mcgの強度の低いものを強度の高いものに置き換え、さらに吸入薬を追加するなど)。コルチコステロイド、または経口コルチコステロイドの開始)を考慮する必要があります。
6歳から12歳未満の小児患者
歳以上 12 歳未満の患者では、シンビコート 80/4.5 を 1 日 2 回 2 回吸入します。
慢性閉塞性肺疾患
COPD 患者の推奨用量は SYMBICORT 160/4.5 で、1 日 2 回 2 回吸入します。
服用の合間に息切れが発生した場合は、すぐに緩和するために吸入式の短時間作用型ベータ 2 アゴニストを服用する必要があります。
供給方法
剤形と強度
SYMBICORT は、ブデソニド (80 または 160 mcg) とホルモテロール (4.5 mcg) の組み合わせを吸入エアロゾルとして含む定量吸入器として入手できます。各用量強度には、キャニスターあたり 60 回または 120 回の作動が含まれます。 SYMBICORT 160mg の各強度には、灰色のダスト キャップが付いた赤色のプラスチック製アクチュエータが付属しています。
保管と取り扱い
SYMBICORT には 2 つの強度があり、次のパッケージ サイズで提供されます。
剤形と強度
各ストレングスは、計数装置が取り付けられた加圧アルミニウム製キャニスター、白いマウスピースが付いた赤いプラスチック製アクチュエーター本体、および取り付けられた灰色のダスト キャップとして提供されます。各 120 吸入キャニスターの正味充填重量は 10.2 グラムで、各 60 吸入キャニスターの正味充填重量は 6.9 グラム (SYMBICORT 80/4.5) または 6 グラム (SYMBICORT 160/4.5) です。各キャニスターは、乾燥剤サシェと一緒にホイル オーバーラップ パウチに梱包され、カートンに入れられます。各カートンには、1 つのキャニスターと患者情報リーフレットが含まれています。
SYMBICORT 4.5mcg キャニスターは SYMBICORT 4.5mcg アクチュエーターとのみ使用し、SYMBICORT アクチュエーターは他の吸入医薬品と一緒に使用しないでください。
吸入器が完全に空に感じられず、作動し続ける場合でも、キャニスターからの表示された吸入回数が使用された後は、各吸入の正しい量の薬剤を確保することはできません。吸入器は、表示された回数の吸入が使用された後、またはフォイル パウチから取り出してから 3 か月以内に廃棄する必要があります。キャニスター内の残量を測定するためにキャニスターを水に浸さないでください (「フロート テスト」)。
20°C から 25°C (68°F から 77°F) に制御された室温で保管してください [USP を参照]。吸入器はマウスピースを下にして保管してください。
最良の結果を得るには、使用前にキャニスターを室温にする必要があります。使用前に5秒間よく振ってください。
子供の手の届かないところに保管してください。目にスプレーしないでください。
圧力下のコンテンツ。
穴を開けたり、焼却したりしないでください。熱や裸火の近くに保管しないでください。 120°F を超える温度にさらされると破裂することがあります。容器を火や焼却炉に投入しないでください。
製造元: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 By: AstraZeneca Dunkerque Production, Dunkerque, France.改訂: 2017 年 12 月
副作用
LABA を使用すると、次のような結果になる可能性があります。
- 重篤な喘息関連事象 – 入院、挿管、死亡 [参照 警告と注意事項 ]。
- 心血管および中枢神経系への影響 [参照 警告と注意事項 ]。
コルチコステロイドの全身および吸入使用は、以下の結果をもたらす可能性があります。
- カンジダ・アルビカンス感染症 [参照 警告と注意事項 ]
- COPD患者における肺炎または下気道感染症[参照 警告と注意事項 ]
- 免疫抑制 [参照 警告と注意事項 ]
- 皮質機能亢進症および副腎抑制 [参照 警告と注意事項 ]
- 小児患者における成長効果 [参照 警告と注意事項 ]
- 緑内障および白内障 [参照 警告と注意事項 ]
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
喘息における臨床試験の経験
成人および思春期の患者 12 歳以上
成人および青年における全体的な安全性データは、12 歳以上のさまざまな重症度の喘息患者 3,393 人 (女性 2,052 人、男性 1,341 人) が SYMBICORT 80/4.5 または 160 で治療された 10 件の実薬およびプラセボ対照臨床試験に基づいています。 /4.5 を 12 ~ 52 週間、1 日 1 回または 2 回 2 回吸入。これらの試験では、SYMBICORT の患者の平均年齢は 38 歳で、主に白人 (82%) でした。
以下の表 2 の一般的な有害事象の発生率は、12 歳以上の 401 人の成人および思春期患者 (男性 148 人、女性 253 人) を対象とした 3 つの 12 週間二重盲検プラセボ対照臨床試験からプールされたデータに基づいています。 SYMBICORT 80/4.5 または SYMBICORT 160/4.5 を 1 日 2 回 2 回吸入して治療します。 SYMBICORT グループは、ほとんどが白人 (84%) の患者で構成され、平均年齢は 38 歳で、平均パーセントは、ベースラインで 80/4.5 mcg および 160/4.5 mcg 治療グループでそれぞれ 76 および 68 の FEV1 を予測しました。比較のための対照群には、ブデソニド HFA 定量吸入器 (MDI) 80 または 160 mcg、ホルモテロール乾燥粉末吸入器 (DPI) 4.5 mcg、またはプラセボ (MDI および DPI) の 1 日 2 回の 2 回の吸入が含まれていました。表 2 には、いずれかの SYMBICORT グループで 3% を超える発生率で発生し、1 日 2 回投与のプラセボ グループよりも一般的に発生したすべての有害事象が含まれています。これらのデータを考慮する際には、治療期間の不均衡について発生率が調整されていないため、SYMBICORT 患者の患者の平均曝露期間の増加を考慮に入れる必要があります。
長期的な安全性 - 12 歳以上の患者を対象とした喘息の臨床試験
12 歳以上の思春期および成人患者を対象とした長期安全性試験では、最大 1280/36 mcg/日 (640/18 mcg を 1 日 2 回) までの用量で最長 1 年間治療されましたが、発生率に臨床的に重要な変化は見られませんでした。長期間の治療後に出現する新しいタイプの有害事象もありません。同様に、化学、血液学、心電図、ホルター モニター、および HPA 軸の評価を含む安全対策において、最大 1 年間、異常の重大なパターンまたは予想外のパターンは観察されませんでした。
6歳から12歳未満の小児患者
歳から 12 歳未満の小児患者の安全性データは、12 週間の治療期間の 1 つの試験に基づいています。試験登録時に吸入コルチコステロイドを投与された患者 (女性 79 名、男性 105 名) は、SYMBICORT 80/4.5 (n=92) またはブデソニド pMDI 80 mcg (n=92) に無作為に割り付けられ、1 日 2 回 2 回吸入されました。これらの患者の全体的な安全性プロファイルは、同様のデザインの研究で SYMBICORT 80/4.5 を 1 日 2 回投与された 12 歳以上の患者で観察されたものと同様でした。 SYMBICORT 80/4.5 で治療された患者に発生した一般的な副作用は、3% 以上の頻度であり、ブデソニド pMDI 80 mcg のみで治療された患者よりも頻繁に上気道感染症、咽頭炎、頭痛、および鼻炎が含まれていました。
慢性閉塞性肺疾患における臨床試験の経験
下記の安全性データは、1783 人の患者における SYMBICORT 160/4.5 への曝露を反映しています。 SYMBICORT 160/4.5 は、COPD 患者を対象とした 2 つのプラセボ対照肺機能研究 (期間 6 および 12 か月) と 2 つの実薬対照増悪研究 (期間 6 および 12 か月) で研究されました。
以下の表 3 の一般的な有害事象の発生率は、771 人の成人 COPD 患者 (男性 496 人、女性 275 人) を対象とした 2 つの二重盲検プラセボ対照肺機能臨床研究 (期間 6 か月および 12 か月) からプールされたデータに基づいています 40。歳以上の患者は、SYMBICORT 160/4.5 を 1 日 2 回 2 回吸入して治療を受けました。これらの患者のうち、651 人が 6 か月間、366 人が 12 か月間治療を受けました。 SYMBICORT グループは、ほとんどが白人 (93%) の患者で構成され、平均年齢は 63 歳で、平均パーセントはベースラインで 33% の FEV1 を予測しました。比較のための対照群には、ブデソニド HFA (MDI) 160 mcg、ホルモテロール (DPI) 4.5 mcg、またはプラセボ (MDI および DPI) の 1 日 2 回の 2 回の吸入が含まれていました。表 3 には、SYMBICORT グループで 3% 以上の発生率で発生し、プラセボ グループよりも一般的に発生したすべての有害事象が含まれています。これらのデータを考慮する際、SYMBICORT 4.5mcg への患者の平均曝露期間の増加を考慮に入れる必要があります。これは、発生率が治療期間の不均衡に対して調整されていないためです。
プラセボと比較して、SYMBICORT 160/4.5 で治療された被験者では、肺炎以外の肺感染症 (主に気管支炎) がより高い割合で発生しました (それぞれ 7.9% 対 5.1%)。化学、血液学、心電図、心電図 (ホルター) モニタリング、HPA 軸、骨塩密度、および眼科の評価において、最大 1 年間観察された臨床的に重要または予期しない異常のパターンはありませんでした。
40 歳以上の成人 COPD 患者 1,012 人(男性 616 人、女性 396 人)が SYMBICORT 160/4.5 で治療された 2 つの二重盲検実薬対照増悪研究(期間 6 か月および 12 か月)から得られた安全性の知見は、 1 日 2 回の 2 回の吸入は、肺機能研究と一致していました。
市販後の経験
SYMBICORTの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.これらの有害反応の一部は、SYMBICORT の臨床試験でも観察されている可能性があります。
心疾患: 狭心症、頻脈、心房および心室性頻脈性不整脈、心房細動、期外収縮、動悸
内分泌障害: 皮質機能亢進症、小児患者の成長速度の低下
眼疾患: 白内障、緑内障、眼圧上昇
胃腸障害: 口腔咽頭カンジダ症、吐き気
免疫系障害: アナフィラキシー反応、血管性浮腫、気管支痙攣、蕁麻疹、発疹、皮膚炎、かゆみなどの即時型および遅延型の過敏反応
代謝および栄養障害: 高血糖、低カリウム血症
筋骨格、結合組織、および骨の障害: 筋肉のけいれん
神経系障害: 振戦、めまい
精神障害: 行動障害、睡眠障害、神経過敏、動揺、抑うつ、落ち着きのなさ
呼吸器、胸部、縦隔の障害: 発声障害、咳、喉の炎症
皮膚および皮下組織の障害: 皮膚のあざ
血管障害: 低血圧、高血圧
薬物相互作用
臨床研究では、SYMBICORT と短時間作用型ベータ 2 アゴニスト、鼻腔内コルチコステロイド、抗ヒスタミン薬/うっ血除去薬などの他の薬を同時に投与しても、副作用の頻度が増加することはありませんでした。 SYMBICORT を使用した正式な薬物相互作用研究は実施されていません。
シトクロム P4503A4 の阻害剤
SYMBICORT の成分であるブデソニドを含むコルチコステロイドの主な代謝経路は、シトクロム P450 (CYP) アイソザイム 3A4 (CYP3A4) を経由します。 CYP3A4 の強力な阻害剤であるケトコナゾールの経口投与後、経口投与されたブデソニドの平均血漿濃度が増加しました。 CYP3A4 の同時投与は、ブデソニドの代謝を阻害し、全身暴露を増加させる可能性があります。 SYMBICORT 4.5mcg と長期ケトコナゾールおよび他の既知の強力な CYP3A4 阻害剤 (例、リトナビル、アタザナビル、クラリスロマイシン、インジナビル、イトラコナゾール、ネファゾドン、ネルフィナビル、サキナビル、テリスロマイシン) との同時投与を検討する場合は注意が必要です。 警告と注意事項 ]。
モノアミンオキシダーゼ阻害剤および三環系抗うつ剤
SYMBICORT 160mg の成分であるフォルモテロールの血管系への作用は、これらの薬剤によって増強される可能性があるため、モノアミンオキシダーゼ阻害剤または三環系抗うつ薬で治療を受けている患者、またはこれらの薬剤の中止後 2 週間以内に SYMBICORT を慎重に投与する必要があります。 . SYMBICORT による臨床試験では、限られた数の COPD および喘息患者が三環系抗うつ薬を投与されたため、有害事象に関して臨床的に意味のある結論を出すことはできません。
βアドレナリン受容体遮断薬
ベータ遮断薬(点眼薬を含む)は、SYMBICORT の成分であるホルモテロールなどのベータ作動薬の肺への影響を遮断するだけでなく、喘息患者に重度の気管支痙攣を引き起こす可能性があります。したがって、喘息患者は通常、ベータ遮断薬で治療されるべきではありません。しかし、特定の状況下では、喘息患者におけるベータアドレナリン遮断薬の使用に代わる許容可能な選択肢がない場合があります。この設定では、心選択的ベータ遮断薬を考慮することができますが、慎重に投与する必要があります.
利尿薬
非カリウム保持性利尿薬(ループ利尿薬やサイアザイド利尿薬など)の投与に起因する可能性のある心電図の変化および/または低カリウム血症は、特にベータ作動薬の推奨用量を超えた場合に、ベータ作動薬によって急激に悪化する可能性があります。これらの作用の臨床的意義は不明ですが、SYMBICORT と非カリウム保持性利尿薬との併用には注意が必要です。
警告
の一部として含まれています 予防 セクション。
予防
深刻な喘息関連のイベント – 入院、挿管、および死亡
喘息の単剤療法 (ICS なし) としての LABA の使用は、喘息関連死のリスク増加と関連しています [Salmeterol Multicenter Asthma Research Trial (SMART) を参照]。対照臨床試験から入手可能なデータは、LABA を単剤療法として使用すると、小児および青年患者の喘息関連の入院のリスクが高まることも示唆しています。これらの調査結果は、LABA のクラス効果と見なされます。 LABA を固定用量で ICS と組み合わせて使用する場合、大規模な臨床試験のデータでは、ICS 単独と比較して、重篤な喘息関連の事象 (入院、挿管、死亡) のリスクが有意に増加することは示されていません (重篤な喘息関連の事象を参照)。 ICS/LABA を使用)。
ICS/LABAによる重篤な喘息関連事象
つの大規模な 26 週間の無作為化盲検実薬対照臨床安全性試験が実施され、喘息患者において ICS 単独と比較して LABA を固定用量で ICS と組み合わせて使用した場合の重篤な喘息関連イベントのリスクが評価されました。 3 件の試験には 12 歳以上の成人および思春期の患者が含まれていました。 臨床研究 ]; 1件の試験では、プロピオン酸フルチカゾン/サルメテロール吸入粉末とプロピオン酸フルチカゾン吸入粉末を比較しました。モメタゾンフロエート/フォルモテロールとモメタゾンフロエートを比較した試験が1件ありました。 4 番目の試験には 4 ~ 11 歳の小児患者が含まれ、プロピオン酸フルチカゾン/サルメテロール吸入粉末とプロピオン酸フルチカゾン吸入粉末を比較しました。 4 つの試験すべての主要な安全性評価項目は、重篤な喘息関連の事象 (入院、挿管、および死亡) でした。盲検化された裁定委員会は、イベントが喘息に関連しているかどうかを判断しました。
成人および思春期の 3 つの試験は、2.0 のリスク マージンを除外するように設計され、小児の試験は 2.7 のリスクを除外するように設計されました。個々の試験はそれぞれ、事前に指定された目的を達成し、ICS 単独に対する ICS/LABA の非劣性を示しました。成人および青年期の 3 つの試験のメタ分析では、ICS 単独と比較して、ICS/LABA 固定用量併用による重篤な喘息関連イベントのリスクの有意な増加は示されませんでした (表 1)。これらの試験は、ICS と比較して ICS/LABA による重篤な喘息関連イベントのすべてのリスクを排除するようには設計されていません。
小児安全性試験には、ICS/LABA (プロピオン酸フルチカゾン/サルメテロール吸入粉末) または ICS (プロピオン酸フルチカゾン吸入粉末) を受けた 4 ~ 11 歳の 6,208 人の小児患者が含まれていました。この試験では、ICS/LABA に無作為に割り付けられた 27/3107 (0.9%) の患者と ICS/LABA に無作為に割り付けられた 21/3101 (0.7%) の患者が重篤な喘息関連イベントを経験しました。喘息関連の死亡や挿管はありませんでした。 ICS/LABA は、最初のイベントまでの時間の推定ハザード比 1.29 (95% CI: 0.73) で、事前に指定されたリスク マージン (2.7) に基づいて、ICS と比較して重篤な喘息関連イベントの有意な増加リスクを示さなかった、2.27)。
サルメテロール多施設喘息研究試験(SMART)
サルメテロールの安全性を通常の喘息治療にそれぞれ追加したプラセボと比較した 28 週間のプラセボ対照米国試験では、サルメテロールを投与された患者で喘息関連の死亡が増加したことが示されました (サルメテロールで治療された患者で 13/13,176 vs. 3 で治療された患者で)。 /13,179 プラセボで治療された患者; 相対リスク: 4.37 [95% CI 1.25, 15.34])。 SMART では、バックグラウンド ICS の使用は必要ありませんでした。喘息関連の死亡リスクの増加は、LABA 単剤療法のクラス効果と考えられています。
ホルモテロール単剤療法の研究
フォルモテロールを単剤療法として使用した臨床研究では、フォルモテロールを投与された患者では、プラセボを投与された患者よりも重篤な喘息増悪の発生率が高いことが示唆されました。これらの研究の規模は、治療群間の重篤な喘息増悪の違いを正確に定量化するのに十分ではありませんでした。
病気の悪化と急性エピソード
SYMBICORT 4.5mcg は、喘息または COPD の急速に悪化している、または生命を脅かす可能性のあるエピソードの患者に開始すべきではありません。 SYMBICORT は、喘息または COPD の急性増悪患者では研究されていません。この設定で SYMBICORT 4.5mcg を開始することは適切ではありません。
吸入式の短時間作用型ベータ 2 アゴニストの使用の増加は、喘息悪化のマーカーです。この状況では、患者は治療レジメンの再評価を伴う即時の再評価を必要とし、SYMBICORT の現在の強度をより高い強度に置き換える、追加の吸入コルチコステロイドを追加する、または全身性コルチコステロイドを開始する必要がある可能性を特に考慮します。患者は SYMBICORT を 1 日 2 回 (朝と夜) 2 回以上吸入しないでください。
SYMBICORT 160mg は、急性症状の緩和、すなわち気管支痙攣の急性エピソードの治療のためのレスキュー療法として使用しないでください。息切れなどの急性症状の緩和には、SYMBICORT ではなく、吸入式の短時間作用型ベータ 2 アゴニストを使用する必要があります。
SYMBICORT 4.5mcg による治療を開始する際、経口または吸入の短時間作用型ベータ 2 作動薬を定期的に (例えば、1 日 4 回) 服用している患者には、これらの薬剤の常用を中止するように指示する必要があります。
SYMBICORT 4.5mcg の過度の使用と他の長時間作用型ベータ 2 アゴニストとの併用
ベータ 2 アドレナリン作動薬を含む他の吸入薬と同様に、SYMBICORT 4.5mcg は、推奨よりも頻繁に使用したり、推奨よりも高用量で使用したり、LABA を含む他の医薬品と組み合わせて使用したりすると、過剰摂取になる可能性があります。吸入交感神経刺激薬の過剰使用に関連して、臨床的に重大な心血管系への影響と死亡が報告されています。 SYMBICORT を使用している患者は、運動誘発性気管支痙攣 (EIB) の予防または喘息または COPD の治療を含む、何らかの理由で追加の LABA (サルメテロール、フマル酸ホルモテロール、酒石酸アルホルモテロールなど) を使用しないでください。
局所効果
臨床研究では、カンジダ・アルビカンスによる口と咽頭の局所感染症の発症が、SYMBICORTで治療された患者で発生しました。このような感染症が発生した場合は、SYMBICORT 160mg による治療を継続しながら、適切な局所または全身(経口抗真菌薬)療法で治療する必要がありますが、場合によっては SYMBICORT 4.5mcg による治療を中断する必要があります。口腔咽頭カンジダ症のリスクを軽減するために、吸入後に飲み込まずに水で口をすすぐように患者にアドバイスします。
肺炎およびその他の下気道感染症
医師は、肺炎と増悪の臨床的特徴がしばしば重複するため、COPD 患者が肺炎を発症する可能性に注意を払う必要があります。肺炎を含む下気道感染症は、コルチコステロイドの吸入投与後に報告されています。
COPD 患者 1,704 人を対象とした 6 か月間の肺機能研究では、SYMBICORT 160/4.5 を投与された患者では、肺炎以外の肺感染症 (気管支炎、ウイルス性下気道感染症など) の発生率が高かった (7.6%)。 SYMBICORT 80/4.5 (3.2%)、ホルモテロール 4.5 mcg (4.6%)、またはプラセボ (3.3%) を投与された患者よりも高かった。プラセボ (1.3%) と比較して、SYMBICORT 160/4.5 グループ (1.1%) ではより高い発生率で肺炎は発生しませんでした。 1964 人の COPD 患者を対象とした 12 か月間の肺機能研究では、SYMBICORT 80/4.5 を投与された患者 (6.9%) よりも SYMBICORT 160/4.5 を投与された患者 (8.1%) の方が、肺炎以外の肺感染症の発生率が高かった。フォルモテロール 4.5 mcg (7.1%) またはプラセボ (6.2%)。 6 か月間の試験と同様に、プラセボ (5.0%) と比較して SYMBICORT 160/4.5 グループ (4.0%) でより高い発生率で肺炎は発生しませんでした。
免疫抑制
免疫系を抑制する薬を服用している患者は、健康な人よりも感染しやすくなります。たとえば、水ぼうそうやはしかは、コルチコステロイドを使用している感受性の高い子供や成人では、より深刻な、または致命的な経過をたどる可能性があります.これらの病気にかかっていない、または適切に予防接種を受けていない子供や大人は、曝露を避けるために特に注意する必要があります。コルチコステロイド投与の用量、経路、および期間が、播種性感染症の発症リスクにどのように影響するかはわかっていません。リスクに対する基礎疾患および/または以前のコルチコステロイド治療の寄与も知られていません。ばく露した場合は、水痘帯状疱疹免疫グロブリン (VZIG) またはプール静脈内免疫グロブリン (IVIG) による治療が必要な場合があります。麻疹にさらされた場合は、プールされた筋肉内免疫グロブリン (IG) による予防が必要になる場合があります (完全な VZIG および IG 処方情報については、それぞれの添付文書を参照してください)。水疱瘡が発症した場合、抗ウイルス剤による治療が考慮されることがあります。水痘ワクチンに対する免疫応答性は、ブデソニド吸入懸濁液を使用して、12 か月から 8 歳までの小児喘息患者で評価されました。
非盲検の非ランダム化臨床試験では、12 か月から 8 歳までの 243 人の喘息患者を対象に、毎日 0.25 mg から 1 mg のブデソニド吸入懸濁液 (n=151) または非コルチコステロイド喘息療法 (n = =92) (すなわち、ベータ 2 アゴニスト、ロイコトリエン受容体アンタゴニスト、クロモン)。ワクチン接種に反応して5.0以上の血清防御抗体価(gpELISA値)を示した患者の割合は、ブデソニド吸入懸濁液で治療された患者(85%)と非コルチコステロイド喘息療法で治療された患者(90%)で同様でした。ブデソニド吸入懸濁液で治療された患者は、ワクチン接種の結果として水痘を発症しませんでした。
吸入コルチコステロイドは、気道の結核感染が活動性または休止状態にある患者では、使用する場合でも注意して使用する必要があります。未治療の全身性真菌、細菌、ウイルス、または寄生虫感染;または単純ヘルペス。
全身性コルチコステロイド療法から患者を移す
全身活性コルチコステロイドから吸入コルチコステロイドに移行した患者には、特に注意が必要です。なぜなら、全身性コルチコステロイドから全身的に利用できる吸入コルチコステロイドへの移行中および移行後に、副腎不全による死亡が喘息患者で発生しているためです。全身性コルチコステロイドからの離脱後、視床下部-下垂体-副腎 (HPA) 機能の回復には数ヶ月が必要です。
以前にプレドニゾン(またはその同等物)を 1 日 20 mg 以上で維持していた患者は、特に全身性コルチコステロイドがほぼ完全に中止された場合に、最も影響を受けやすい可能性があります。この HPA 抑制期間中、患者は、外傷、手術、感染症 (特に胃腸炎)、または重度の電解質喪失に関連するその他の状態にさらされると、副腎機能不全の徴候や症状を示すことがあります。 SYMBICORT はこれらのエピソード中に喘息の症状をコントロールする可能性がありますが、推奨される用量では、全身に供給されるグルココルチコイドの通常の生理学的量よりも少なく、これらの緊急事態に対処するために必要なミネラルコルチコイド活性を提供しません.
ストレス、重度の喘息発作または重度の COPD 増悪の期間中、全身性コルチコステロイドを中止した患者は、経口コルチコステロイド(大量)を直ちに再開し、医師に連絡してさらなる指示を受けるように指示されるべきである.これらの患者は、ストレス、重度の喘息発作、または重度の COPD 増悪の期間中、全身性コルチコステロイドの補充が必要になる可能性があることを示す警告カードを携帯するように指示する必要があります。
経口コルチコステロイドを必要とする患者は、SYMBICORT への移行後、全身コルチコステロイドの使用からゆっくりと離脱する必要があります。プレドニゾンの減量は、SYMBICORT による治療中、プレドニゾンの 1 日量を毎週 2.5 mg 減らすことで達成できます。肺機能 (1 秒間の平均強制呼気量 [FEV1] または朝の最大呼気流量 [PEF])、ベータ作動薬の使用、喘息または COPD の症状は、経口コルチコステロイドの離脱中は注意深く監視する必要があります。さらに、疲労、倦怠感、脱力感、吐き気と嘔吐、低血圧などの副腎機能不全の徴候と症状について、患者を観察する必要があります。
全身性コルチコステロイド療法から吸入コルチコステロイドまたはSYMBICORTへの患者の移行は、全身性コルチコステロイド療法によって以前に抑制された状態(例、鼻炎、結膜炎、湿疹、関節炎、好酸球性状態)を明らかにする可能性があります。一部の患者は、呼吸機能の維持または改善にもかかわらず、全身的に活性なコルチコステロイド離脱の症状(例えば、関節および/または筋肉痛、倦怠感、抑うつ)を経験する場合があります。
皮質機能亢進症と副腎抑制
SYMBICORT の成分であるブデソニドは、治療的に同等の経口プレドニゾンよりも HPA 機能の抑制が少なく、喘息および COPD の症状を制御するのに役立ちます。ブデソニドは循環に吸収され、高用量で全身的に活性化される可能性があるため、HPA 機能不全を最小限に抑えるという SYMBICORT の有益な効果は、推奨用量を超えず、個々の患者が最小有効用量に漸増される場合にのみ期待できます。
吸入コルチコステロイドの全身吸収の可能性があるため、SYMBICORT 160mg で治療された患者は、全身コルチコステロイド効果の証拠がないか注意深く観察する必要があります。不十分な副腎反応の証拠がないかどうか、術後またはストレス期間中の患者の観察には特に注意を払う必要があります。
特にブデソニドが推奨用量よりも高い用量で長期間投与された場合、皮質機能亢進や副腎抑制(副腎クリーゼを含む)などの全身性コルチコステロイド効果が少数の患者に現れる可能性があります。そのような影響が生じた場合は、SYMBICORT の投与量をゆっくりと減らし、全身性コルチコステロイドを減らし、喘息症状を管理するために受け入れられている手順に従ってください。
強力なシトクロム P450 3A4 阻害剤との薬物相互作用
SYMBICORT 4.5mcg とケトコナゾール、および他の既知の強力な CYP3A4 阻害剤 (例、リトナビル、アタザナビル、クラリスロマイシン、インジナビル、イトラコナゾール、ネファゾドン、ネルフィナビル、サキナビル、テリスロマイシン) との同時投与を検討する場合は注意が必要です。ブデソニドに発生する可能性があります[を参照してください 薬物相互作用 と 臨床薬理学 ]。
逆説的な気管支痙攣と上気道の症状
他の吸入薬と同様に、SYMBICORT 160mg は逆説的な気管支痙攣を引き起こす可能性があり、生命を脅かす可能性があります。 SYMBICORT 160mgの投与後に逆説的な気管支痙攣が発生した場合は、吸入式の短時間作用型気管支拡張剤で直ちに治療し、SYMBICORTを直ちに中止し、代替療法を開始する必要があります.
即時型過敏反応
蕁麻疹、血管性浮腫、発疹、および気管支痙攣の症例によって示されるように、SYMBICORT 160mgの投与後に即時の過敏症反応が起こることがあります。
心血管および中枢神経系への影響
過度のベータアドレナリン刺激は、発作、狭心症、高血圧または低血圧、毎分 200 回までの頻脈、不整脈、神経過敏、頭痛、振戦、動悸、吐き気、めまい、疲労、倦怠感、および不眠症と関連しています。 過剰摂取 ]。したがって、SYMBICORT 160mg は、交感神経作動性アミンを含むすべての製品と同様に、心血管障害、特に冠動脈不全、心不整脈、高血圧の患者には注意して使用する必要があります。
SYMBICORT の成分であるフォルモテロールは、脈拍数、血圧、および/または症状によって測定されるように、一部の患者で臨床的に重要な心血管効果を生み出す可能性があります。このような影響は、推奨用量でのホルモテロールの投与後にはまれですが、発生した場合は、薬を中止する必要がある場合があります.さらに、ベータ アゴニストは、T 波の平坦化、QTc 間隔の延長、および ST セグメントの低下などの ECG 変化を引き起こすことが報告されています。これらの所見の臨床的意義は不明です。吸入交感神経刺激薬の過剰使用に関連した死亡例が報告されています。
骨密度の減少
吸入コルチコステロイドを含む製品を長期間投与すると、骨密度 (BMD) の低下が観察されています。骨折などの長期的な影響に関する BMD の小さな変化の臨床的意義は不明です。長期の不動、骨粗鬆症の家族歴、閉経後の状態、喫煙、高齢、栄養不良、または骨量を減少させる可能性のある薬物(例、抗けいれん薬、経口コルチコステロイド) を監視し、確立された標準的なケアで治療する必要があります。 COPD 患者は BMD 低下の危険因子が複数あることが多いため、SYMBICORT 160mg の投与を開始する前、およびその後は定期的に BMD を評価することをお勧めします。 BMD の大幅な減少が見られ、SYMBICORT がその患者の COPD 治療にとって依然として医学的に重要であると考えられる場合は、骨粗鬆症の治療または予防のための薬物療法の使用を強く検討する必要があります。
SYMBICORT 160/4.5、SYMBICORT 80/4.5、ホルモテロール 4.5 mcg、またはプラセボによる治療の BMD に対する効果は、12 か月の肺機能における COPD 患者 326 人のサブセット (41 歳から 88 歳までの女性および男性) で評価されました。勉強。二重エネルギー X 線吸収法 (DEXA) スキャンを使用して、ベースライン時と 52 週目に股関節と腰椎領域の BMD 評価を実施しました。ベースラインから治療終了までの BMD の平均変化は小さかった (平均変化の範囲は -0.01 -0.01 g/cm²)。治療終了時点に基づく全脊椎および全股関節 BMD の ANCOVA 結果は、ペアワイズ治療群比較のすべての幾何学的 LS 平均比が 1 に近いことを示し、12 の全股関節および全脊椎領域の全体的な BMD を示しています。 -月の時点は、治療期間全体にわたって安定していました。
成長への影響
経口吸入コルチコステロイドは、小児患者に投与すると成長速度の低下を引き起こす可能性があります。定期的に SYMBICORT を投与されている小児患者の成長を監視します (例: スタディオメトリーによる)。 SYMBICORT を含む経口吸入コルチコステロイドの全身への影響を最小限に抑えるために、各患者の用量を、症状を効果的に制御する最低用量まで漸増する [参照 投薬と管理 と 特定の集団での使用 ]。
緑内障と白内障
緑内障、眼圧上昇、および白内障は、SYMBICORT の成分であるブデソニドを含む吸入コルチコステロイドの長期投与後の喘息および COPD 患者で報告されています。したがって、視力の変化がある患者、または眼圧上昇、緑内障、および/または白内障の病歴がある患者では、綿密なモニタリングが必要です。
白内障または緑内障の発症に対する SYMBICORT 160/4.5、SYMBICORT 80/4.5、ホルモテロール 4.5 mcg、またはプラセボによる治療の効果は、12 か月の肺機能研究で COPD 患者 461 人のサブセットで評価されました。眼科検査は、ベースライン、24 週、および 52 週に実施されました。無作為化された治療期間中に、ベースラインから最大値(> 0.7)まで後嚢下スコアが増加した被験者は26人(6%)いました。 SYMBICORT 160/4.5 群で 11 例 (9.0%)、SYMBICORT 80/4.5 群で 4 例 (3.8%)、フォルモテロール群、およびプラセボ群の6人の患者(5.2%)。
好酸球性疾患とチャーグ・ストラウス症候群
まれに、吸入コルチコステロイドを服用している患者が全身性好酸球性状態を呈することがあります。これらの患者の一部は、Churg-Strauss 症候群と一致する血管炎の臨床的特徴を持っています。これは、全身性コルチコステロイド療法で治療されることが多い状態です。これらの事象は通常、吸入コルチコステロイドの導入後の経口コルチコステロイド療法の減少および/または中止に関連していますが、常にではありません。医師は、好酸球増加症、血管炎性発疹、肺症状の悪化、心臓の合併症、および/または患者に現れる神経障害に注意する必要があります。ブデソニドとこれらの基礎疾患との因果関係は確立されていません。
共存する条件
SYMBICORT 4.5mcgは、交感神経刺激アミンを含むすべての医薬品と同様に、痙攣性疾患または甲状腺中毒症の患者、および交感神経刺激アミンに異常に反応する患者には注意して使用する必要があります.関連するベータ 2 アドレナリン受容体アゴニストであるアルブテロールの用量を静脈内投与すると、既存の真性糖尿病およびケトアシドーシスを悪化させることが報告されています。
低カリウム血症と高血糖
ベータアドレナリンアゴニスト薬は、おそらく細胞内シャントを介して、一部の患者で重大な低カリウム血症を引き起こす可能性があり、これは有害な心血管効果を引き起こす可能性があります[参照 臨床薬理学 ]。血清カリウムの減少は通常一過性であり、補給は必要ありません。 SYMBICORT の推奨用量での臨床試験中に、臨床的に有意な血糖値および/または血清カリウム値の変化がまれに見られました。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報と使用説明書 )。
重篤な喘息関連のイベント
LABAを単独で使用すると、喘息関連の入院または喘息関連の死亡のリスクが高まることを喘息患者に知らせてください。利用可能なデータによると、ICS と LABA を SYMBICORT などと一緒に使用した場合、これらのイベントのリスクが大幅に増加することはありません。
急性症状には不向き
SYMBICORT 160mg は喘息または COPD の急性症状を緩和することを意図したものではなく、その目的で追加の用量を使用すべきではないことを患者に知らせてください。アルブテロールなどの吸入式短時間作用型ベータ 2 アゴニストで急性症状を治療するように患者に助言します。そのような薬を患者に提供し、それがどのように使用されるべきかを患者に指示します。
次のいずれかが発生した場合は、直ちに医師の診察を受けるよう患者に指示してください。
- 吸入式の短時間作用型ベータ 2 作動薬の有効性の低下
- 吸入式の短時間作用型ベータ 2 作動薬を通常よりも多く吸入する必要がある
- 医師が概説した肺機能の著しい低下
中止後に症状が再発する可能性があるため、医師/プロバイダーの指導なしに SYMBICORT による治療を中止すべきではないことを患者に伝えてください。
追加の長時間作用型ベータ 2 アゴニストを使用しないでください
喘息および COPD のために他の LABA を使用しないように患者に指示します。
局所効果
一部の患者では、カンジダ・アルビカンスによる局所感染が口と咽頭で発生したことを患者に知らせます。口腔咽頭カンジダ症が発症した場合は、SYMBICORT 4.5mcgによる治療を継続しながら、適切な局所または全身(すなわち、経口)抗真菌療法で治療する必要がありますが、医学的監督の下でSYMBICORTによる治療を一時的に中断する必要がある場合があります.ツグミのリスクを減らすために、吸入した後は飲み込まずに水で口をすすぐことをお勧めします。
肺炎
COPD 患者は肺炎のリスクが高くなります。肺炎の症状が現れた場合は、医療提供者に連絡するように指示してください。
免疫抑制
コルチコステロイドの免疫抑制剤を服用している患者には、水疱瘡またははしかへの曝露を避けるように警告し、曝露した場合は遅滞なく医師に相談する.既存の結核、真菌、細菌、ウイルス、または寄生虫感染症、または単純眼ヘルペスの潜在的な悪化について患者に知らせます。
皮質機能亢進症と副腎抑制
SYMBICORT が皮質機能亢進症および副腎抑制の全身性コルチコステロイド効果を引き起こす可能性があることを患者に助言します。さらに、全身性コルチコステロイドからの移行中および移行後に副腎不全による死亡が発生したことを患者に知らせます。 SYMBICORT に移行する場合、患者は全身性コルチコステロイドからゆっくりと漸減する必要があります。
骨密度の減少
BMD の減少のリスクが高い患者には、コルチコステロイドの使用が追加のリスクをもたらす可能性があることを助言します。
成長速度の低下
SYMBICORT の成分であるコルチコステロイドを経口吸入すると、小児患者に投与すると成長速度が低下する可能性があることを患者に知らせてください。医師は、あらゆる経路でコルチコステロイドを服用している小児および青年の成長を綿密に追跡する必要があります。
眼への影響
吸入コルチコステロイドの長期使用は、いくつかの眼の問題(白内障または緑内障)のリスクを高める可能性があります。定期的な眼科検査を検討してください。
ベータ作動薬療法に伴うリスク
動悸、胸痛、心拍数の増加、振戦、神経過敏など、ベータ 2 アゴニストに関連する副作用について患者に知らせてください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
ブデソニド
ブデソニドの発がん性を評価するために、経口投与を使用してラットとマウスで長期試験が実施されました。
Sprague-Dawley ラットでの 2 年間の研究で、ブデソニドは 50 mcg/kg の経口用量で雄ラットの神経膠腫の発生率を統計的に有意に増加させました (mcg/m² の成人および子供の MRHDID にほぼ相当します)。基本)。 25 および 50 mcg/kg (mcg/m² ベースで成人および小児の MRHDID とほぼ同等) までのそれぞれの経口用量で、雄および雌のラットに腫瘍形成性は見られませんでした。雄の Fischer ラットと Sprague-Dawley ラットを対象とした追加の 2 年間の 2 つの研究では、ブデソニドは 50 mcg/kg の経口投与でグリオーマを引き起こさなかった (mcg/m² ベースで成人と子供の MRHDID にほぼ等しい)。しかし、オスの Sprague-Dawley ラットでは、ブデソニドは 50 mcg/kg の経口投与で統計的に有意な肝細胞腫瘍の発生率の増加を引き起こしました (mcg/m² ベースで成人および子供の MRHDID にほぼ等しい)。これら 2 つの研究における同時参照コルチコステロイド (プレドニゾロンとトリアムシノロン アセトニド) は、同様の所見を示しました。
マウスでの 91 週間の研究では、ブデソニドは 200 mcg/kg (mcg/m² ベースで成人および子供の MRHDID の約 2 倍) までの経口用量で、治療に関連した発がん性を引き起こしませんでした。
ブデソニドは、次の 6 つの異なる試験システムで変異原性または染色体異常誘発性を示さなかった:エイムズ・サルモネラ/ミクロソームプレート試験、マウス小核試験、マウスリンパ腫試験、ヒトリンパ球における染色体異常試験、キイロショウジョウバエにおける伴性劣性致死試験、およびラットにおける DNA 修復分析。肝細胞培養。
受胎能および生殖能力は、最大 80 mcg/kg (mcg/m² ベースの MRHDID にほぼ等しい) までの皮下用量で、ラットの影響を受けませんでした。しかし、20 mcg/kg 以上 (mcg/m² ベースで MRHDID 未満) の皮下投与では、母体の体重増加の減少とともに、出産時および授乳中の仔の出生前生存率および生存率の低下を引き起こしました。 )。そのような影響は 5 mcg/kg (mcg/m² ベースで MRHDID 未満) では認められませんでした。
ホルモテロール
フォルモテロール フマル酸塩の発がん性を評価するために、経口投与を使用したマウスと吸入投与を使用したラットで長期試験が実施されました。
CD-1 マウスでの 24 か月の発がん性研究では、100 mcg/kg 以上の経口用量のフォルモテロール (mcg/m² ベースで、成人と子供の MRHDID のそれぞれ約 30 倍と 15 倍) は、用量-関連する子宮平滑筋腫の発生率の増加。
Sprague-Dawley ラットでの 24 か月の発がん性試験では、130 mcg/kg の吸入用量で中卵巣平滑筋腫と子宮平滑筋肉腫の発生率の増加が観察されました (成人と小児の MRHDID のそれぞれ約 70 倍と 35 倍)。 mcg/㎡ベース)。 22 mcg/kg では腫瘍は見られませんでした (mcg/m² ベースで、それぞれ成人と子供の MRHDID の約 12 倍と 6 倍)。
他のベータ作動薬も同様に、メスのげっ歯類の生殖管の平滑筋腫の増加を示しています。これらの調査結果と人間の使用との関連性は不明です。
フォルモテロールは、エイムズ・サルモネラ/ミクロソームプレート試験、マウスリンパ腫試験、ヒトリンパ球における染色体異常試験、およびラット小核試験において、変異原性または染色体異常誘発性を示さなかった.
15,000 mcg/kg (AUC ベースで MRHDID の約 2200 倍) の経口用量でフォルモテロールを投与した雄ラットで、生殖能力および/または生殖能力の低下が確認されました。そのような影響は 3000 mcg/kg (mcg/m² ベースで MRHDID の約 1600 倍) では見られませんでした。雄ラットに 15,000 mcg/kg (mcg/m² ベースで MRHDID の約 8000 倍) を経口投与した別の研究では、精巣における精巣尿細管萎縮および精巣破片、ならびに精巣上体における精子減少症の所見がありました。 15,000 mcg/kg (AUC ベースで MRHDID の約 1100 倍) までの用量の雌ラットでは、生殖能力への影響は検出されませんでした。
特定の集団での使用
妊娠
リスクの概要
SYMBICORT 160mg またはその個々の成分の 1 つであるフマル酸フォルモテロールについて、妊娠中の女性を対象とした十分に管理された研究はありません。ただし、他の成分のブデソニドについては研究が利用可能です。動物繁殖研究では、吸入経路で投与された SYMBICORT 4.5mcg は、mcg/m² ベースでの最大推奨ヒト 1 日吸入量 (MRHDID) 未満で、ラットにおいて催奇形性、殺胚性、および胎児体重の減少を示しました。皮下経路で投与されたブデソニド単独は、催奇形性、殺胚性であり、MRHDID 未満でラットとウサギの胎児体重を減少させたが、MRHDID の 4 倍までの吸入用量を受けたラットでは、これらの効果は見られなかった。妊娠中の女性を対象とした研究では、ブデソニドの吸入だけでは、妊娠中に投与した場合に異常のリスクが高まることが示されていません。経口コルチコステロイドの経験から、げっ歯類はヒトよりもコルチコステロイド暴露による催奇形性の影響を受けやすいことが示唆されています。経口経路で投与された単独のホルモテロール フマル酸塩は、それぞれ MRHDID の 1600 倍および 65,000 倍で、ラットおよびウサギで催奇形性を示しました。フォルモテロール フマル酸塩は殺胚性でもあり、MRHDID の 110 倍でラットの出生時および授乳中の仔の損失を増加させ、仔の体重を減少させた。これらの有害作用は、高い全身暴露を達成するためにフマル酸ホルモテロールを経口経路で投与した場合、MRHDID の大きな倍数で一般に発生しました。 MRHDID の最大 375 倍の吸入用量を受けたラットでは、催奇形性、殺胚性、または発生への影響は見られませんでした。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
喘息のコントロールが不十分または中程度の女性では、母親の子癇前症、未熟児、低出生体重、新生児の在胎週数が小さいなど、いくつかの周産期の有害転帰のリスクが高くなります。喘息の妊婦は注意深く監視し、最適な喘息コントロールを維持するために必要に応じて投薬を調整する必要があります。
労働または配達
分娩中の SYMBICORT 4.5mcg の効果を調査した、十分に管理されたヒト研究はありません。 β作動薬が子宮収縮を阻害する可能性があるため、分娩中のSYMBICORT 4.5mcgの使用は、利益が明らかにリスクを上回る患者に限定する必要があります。
データ
ヒューマンデータ
妊娠中の女性を対象とした研究では、ブデソニドの吸入が妊娠中に投与された場合に異常のリスクが高まることは示されていません。 1995 年から 1997 年までの妊娠の約 99% をカバーする 3 つのスウェーデンのレジストリ (つまり、スウェーデンの医療出生登録、先天奇形の登録、小児心臓病登録) のデータを再検討した大規模な集団ベースの前向きコホート疫学研究の結果は、リスクの増加がないことを示しています。妊娠初期の吸入ブデソニドの使用による先天性奇形について。先天性奇形は、ほとんどの主要な臓器奇形が発生する時期である妊娠初期(通常、最終月経の 10 ~ 12 週間後)に喘息のために吸入ブデソニドを使用したと報告した母親から生まれた 2014 年の乳児で研究されました。記録された先天性奇形の割合は、一般人口の割合と比較して同様でした (それぞれ 3.8% 対 3.5%)。さらに、吸入されたブデソニドへの曝露後、口腔顔面裂を持って生まれた乳児の数は、正常な集団で予想される数とほぼ同じでした(それぞれ4人の子供と3.3人の子供)。
これらの同じデータは、吸入されたブデソニドに暴露された母親の合計 2534 人の乳児を対象とした 2 番目の研究で利用されました。この研究では、母親が妊娠初期にブデソニドの吸入に暴露された乳児の先天性奇形の割合は、同時期のすべての新生児の割合 (3.6%) と差がありませんでした。
動物データ
シンビコート
妊娠6日目から16日目までの器官形成期に投与された妊娠ラットの胚・胎児発生研究では、SYMBICORT 160mgはMRHDIDよりも少ない用量で胎児に臍ヘルニアを引き起こした(母親の吸入用量12/ 0.66 mcg/kg/日以上)。胎児の体重は、それぞれ MRHDID の約 5 倍および 3 倍減少しました (80/4.4 mcg/kg (ブデソニド/ホルモテロール) の母体吸入用量での AUC ベースで)。 MRHDID 未満の用量では、催奇形性または殺胚作用は検出されませんでした (2.5/0.14 mcg/kg/日の母体吸入用量での mcg/m² ベースで)。
ブデソニド
受胎能および繁殖試験では、オスのラットに 9 週間、メスのラットにペアリング前の 2 週間および交配期間全体にわたって皮下投与しました。メスは子孫が離乳するまで投与された。ブデソニドは、MRHDID よりも少ない用量で (mcg/m² ベースで、母体皮下用量 20 mcg/ kg/日以上)。 MRHDID よりも少ない用量では、そのような影響は認められませんでした (5 mcg/kg/日の母体皮下用量での mcg/m² ベースで)。
妊娠 6 日から 18 日までの器官形成期に投与された妊娠ウサギの胚・胎児発生研究において、ブデソニドは MRHDID よりも少ない用量で胎児喪失、胎児体重の減少、および骨格異常を引き起こした (mcg/m² ベースで母体の皮下投与量は 25 mcg/kg/日)。妊娠 6 日から 15 日までの器官形成期に投与された妊娠ラットの胚・胎児発生研究では、ブデソニドは MRHDID の約 8 倍の用量で同様の有害な胎児影響を引き起こした (500 の母体皮下用量で mcg/m² ベースで)。 mcg/kg/日)。妊娠中のラットにおける別の胚・胎児発生研究では、MRHDID の 4 倍までの用量で催奇形性または殺胚性効果は見られませんでした (250 mcg/kg/日までの母体の吸入用量で mcg/m² ベースで)。
妊娠15日目から産後21日目まで投与されたラットの周産期および出生後の発育研究では、ブデソニドは分娩に影響を与えませんでしたが、子孫の成長と発育には影響を及ぼしました.子孫の生存率は低下し、生き残った子孫は出生時および授乳中の平均体重が MRHDID よりも少ない用量または授乳中に減少した (20 mcg/kg/日以上の母親の皮下用量での mcg/m² ベースで)。これらの発見は、母体毒性の存在下で発生しました。
ホルモテロール
受胎能および生殖に関する研究では、オスのラットに 9 週間、メスのラットにペアリング前の 2 週間、および交配期間全体にわたって経口投与しました。メスは、妊娠 19 日目まで、または子孫が離乳するまで投与されました。雄は 25 週間まで投与された。臍ヘルニアは、MRHDID の 1600 倍以上の経口用量でラット胎児に観察された (3000 mcg/kg/日以上の母体経口用量での mcg/m² ベースで)。小顎症は、MRHDID の 8000 倍の用量でラット胎児に観察された (15,000 mcg/kg/日の母体経口用量での mcg/m² ベースで)。 MRHDID の 8000 倍の用量で妊娠期間が延長されました (15,000 mcg/kg/日の母体経口用量での mcg/m² ベースで)。妊娠中の胎児および仔の死亡は、MRHDID の約 1600 倍以上の用量で発生しました (3000 mcg/kg/日以上の経口用量での mcg/m² ベースで)。
妊娠 6 日目から 15 日目までの器官形成期に投与された妊娠ラットの胚・胎児発生試験では、MRHDID の 375 倍までの用量で催奇形性、殺胚性または発生効果は見られませんでした (mcg/m² ベースで母体吸入による)。 690 mcg/kg/日までの用量)。
妊娠 6 日目から 18 日目までの器官形成期に投与された妊娠ウサギの胚・胎児発生研究では、MRHDID の 65,000 倍の用量で胎児に肝臓の被膜下嚢胞が観察された (母体との mcg/m² ベースで)。 60,000 mcg/kg/日の経口投与量)。 MRHDID の 3800 倍までの用量で催奇形性の影響は観察されませんでした (3500 mcg/kg/日までの母親の経口用量での mcg/m² ベースで)。
出生前および出生後の発育試験では、妊娠した雌ラットにフォルモテロールを妊娠 6 日目から授乳期まで 0、210、840、および 3400 mcg/kg/日の経口用量で投与しました。仔の生存率は、MRHDID の 110 倍以上の用量で (210 mcg/kg/日以上の母体経口用量での mcg/m² ベースで)、生後から産後 26 日まで減少しましたが、用量反応の証拠はありませんでした。関係。子ラットの身体的、機能的、行動的発達に対する治療に関連した影響はありませんでした。
授乳
リスクの概要
SYMBICORT 4.5mcg、ブデソニドまたはフマル酸ホルモテロールの母乳育児または乳生産への影響に関する入手可能なデータはありません。ブデソニドは、他の吸入コルチコステロイドと同様に、母乳中に存在します。 データ ]。母乳中のフマル酸ホルモテロールの存在に関する利用可能なデータはありません。フォルモテロール フマル酸塩は、ラットのミルクに含まれています [参照 データ ]。母乳育児の発達上および健康上の利点は、SYMBICORT 4.5mcg に対する母親の臨床的必要性、および SYMBICORT 160mg または母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
データ
乾燥粉末吸入器を介して送達されたブデソニドに関するヒトのデータは、乳児が母乳で利用できるブデソニドの 1 日総経口投与量が、母親が吸入した投与量の約 0.3% から 1% であることを示しています [ 臨床薬理学 ]。 SYMBICORT 4.5mcg の場合、母乳中の乳児が利用できるブデソニドの用量は、母親の用量のパーセンテージとして、同様であると予想されます。
ラットの受胎能と生殖に関する研究では、出生後 15 日の子犬のホルモテロールの血漿レベルが測定された [参照 特定の集団での使用 ]。仔動物が授乳後に母動物から受け取った最高用量の 15 mg/kg の最大血漿濃度は 4.4% (同腹子で 0.24 nmol/L 対 母親で 5.5 nmol/L) であると推定されました。 .
小児用
12 歳以上の喘息患者における SYMBICORT の安全性と有効性は、12 か月までの研究で確立されています。 2 つの 12 週間二重盲検プラセボ対照米国ピボタル研究では、12 歳から 17 歳の 25 人の患者が 1 日 2 回 SYMBICORT で治療されました [ 臨床研究 ]。この年齢層における有効性の結果は、18 歳以上の患者で観察された結果と同様でした。 18 歳以上の患者と比較して、この年齢層で報告された有害事象の種類や頻度に明らかな違いはありませんでした。
6 歳から 12 歳未満の喘息患者における SYMBICORT 80/4.5 の安全性と有効性は、最大 12 週間の試験で確立されています [参照 臨床研究 ]。これらの患者の安全性プロファイルは、同じく SYMBICORT を受けた 12 歳以上の患者で観察されたものと一致していました [参照 有害反応 ]。
6歳未満の喘息患者におけるSYMBICORT 160mgの安全性と有効性は確立されていません。
制御された臨床研究では、SYMBICORT の成分であるブデソニドを含む経口吸入コルチコステロイドが、小児患者の成長速度の低下を引き起こす可能性があることが示されています。この効果は、HPA 軸抑制の実験室での証拠がない場合に観察されており、HPA 軸機能のいくつかの一般的に使用されるテストよりも、成長速度が小児患者の全身コルチコステロイド曝露のより敏感な指標であることを示唆しています。最終的な身長への影響を含む、経口吸入コルチコステロイドに関連するこの成長速度の低下の長期的な影響は不明です。経口吸入コルチコステロイドによる治療を中止した後の「キャッチアップ」成長の可能性は、十分に研究されていません。
歳から 12 歳の喘息の子供を対象とした研究では、ブデソニド DPI 200 mcg を 1 日 2 回投与した患者 (n=311) は、プラセボを投与した患者 (n=418) と比較して、1 年後に 1.1 cm の成長の低下が見られました。 ;これら 2 つの治療群の差は、3 年間の追加治療でさらに増加することはありませんでした。 4年の終わりまでに、ブデソニドDPIで治療された子供とプラセボで治療された子供は、同様の成長速度を示しました.この研究から導き出された結論は、治療群におけるコルチコステロイドの不平等な使用と、研究の過程で思春期に達した患者からのデータを含めることによって混乱する可能性があります.
SYMBICORT を含む経口吸入コルチコステロイドを投与されている小児患者の成長を監視する必要があります。コルチコステロイドを服用している子供または青年が成長抑制を起こしているように見える場合は、この効果に特に敏感である可能性を考慮する必要があります.長期治療の潜在的な成長効果は、得られる臨床的利益と比較検討する必要があります。 SYMBICORT を含む経口吸入コルチコステロイドの全身への影響を最小限に抑えるために、各患者は、喘息を効果的に制御する最低の強度に調整する必要があります [ 投薬と管理 ]。
高齢者の使用
2 つの 12 週間の研究と 26 週間の市販後研究で SYMBICORT 160mg を 1 日 2 回投与された喘息患者の総数のうち、791 人が 65 歳以上で、そのうち 141 人が 75 歳以上でした。
~ 12 か月間の COPD 研究では、810 人の患者が SYMBICORT 160/4.5 で治療され、1 日 2 回の吸入が 65 歳以上で、そのうち 177 人の患者が 75 歳以上でした。これらの患者と若い患者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢の患者と若い患者の間の反応の違いは確認されていません。
ベータ 2 作動薬を含む他の製品と同様に、ベータ 2 作動薬によって悪影響を受ける可能性のある心血管疾患を併発している高齢患者に SYMBICORT を使用する場合は、特別な注意が必要です。
SYMBICORT またはその有効成分に関する入手可能なデータに基づくと、高齢患者における SYMBICORT 4.5mcg の投与量の調整は正当化されません。
肝障害
SYMBICORT を使用した正式な薬物動態研究は、肝障害のある患者では実施されていません。しかし、ブデソニドとフマル酸ホルモテロールはどちらも主に肝代謝によって除去されるため、肝機能障害は血漿中のブデソニドとフマル酸ホルモテロールの蓄積につながる可能性があります。したがって、肝疾患のある患者は注意深く監視する必要があります。
腎障害
SYMBICORT を使用した正式な薬物動態研究は、腎障害のある患者では実施されていません。
過剰摂取
シンビコート
SYMBICORT にはブデソニドとホルモテロールの両方が含まれています。したがって、以下に説明する個々のコンポーネントの過剰摂取に関連するリスクが SYMBICORT に適用されます。薬物動態研究では、960/54 mcg (SYMBICORT 80/4.5 の 12 回の作動) および 1280/36 mcg (160/4.5 の 8 回の作動) の単回用量が COPD 患者に投与されました。合計 1920/54 mcg (SYMBICORT 160/4.5 の 12 回の作動) が、健康な被験者と喘息患者の両方に単回投与されました。 12 歳以上の思春期および成人の喘息患者を対象とした長期実薬対照安全性試験では、SYMBICORT 160/4.5 が 1 日最高推奨用量の 2 倍までの用量で最長 12 か月間投与されました。これらの研究のいずれにおいても、臨床的に重大な副作用は観察されませんでした。
ブデソニド
ブデソニドの過剰摂取による急性毒性の可能性は低いです。過剰な用量で長期間使用すると、皮質機能亢進症などの全身性コルチコステロイド効果が発生する可能性があります。 警告と注意事項 ]。最高推奨用量の 5 倍のブデソニド (1 日 3200 mcg) を 6 週間ヒトに投与すると、プラセボ (+1%) と比較して、ACTH の 6 時間注入に対する血漿コルチゾール応答が大幅に減少 (27%) しました。 1日10mgのプレドニゾンの対応する効果は、ACTHに対する血漿コルチゾール反応の35%の減少でした。
ホルモテロール
フォルモテロールの過剰摂取は、発作、狭心症、高血圧、低血圧、頻脈、心房性および心室性頻脈性不整脈、神経過敏、頭痛、振戦、動悸、筋肉痙攣、吐き気、めまい、睡眠障害など、ベータ 2 アゴニストに典型的な影響の誇張につながる可能性があります。 、代謝性アシドーシス、高血糖、低カリウム血症。すべての交感神経刺激薬と同様に、ホルモテロールの乱用は心停止や死に至ることさえあります。ホルモテロールを急性気管支収縮の成人患者に 90 mcg/日の用量で 3 時間にわたって投与した場合、または安定した喘息患者に 1 日 3 回、合計用量 54 mcg/日を 3 日間投与した場合、臨床的に重大な有害反応は見られませんでした。
ホルモテロールの過剰摂取の治療は、投薬の中止と、適切な対症療法および/または支持療法の開始から成ります。心選択的ベータ受容体遮断薬の賢明な使用は、そのような薬が気管支痙攣を引き起こす可能性があることを念頭に置いて考慮することができます.ホルモテロールの過剰摂取に対して透析が有益かどうかを判断するには、証拠が不十分です。過剰摂取の場合には、心臓モニタリングが推奨されます。
禁忌
SYMBICORT の使用は、次の条件では禁忌です。
- 喘息重積状態または喘息または COPD のその他の急性エピソードの一次治療で、集中的な対策が必要な場合。
- SYMBICORT のいずれかの成分に対する過敏症。
臨床薬理学
作用機序
シンビコート
SYMBICORT にはブデソニドとホルモテロールの両方が含まれています。したがって、個々のコンポーネントについて以下に説明する作用機序が SYMBICORT に適用されます。これらの薬物は、COPD および喘息の臨床的、生理学的、および炎症性指標に対して異なる効果を持つ 2 つのクラスの薬物療法 (合成コルチコステロイドおよび長時間作用型の選択的ベータ 2 アドレナリン受容体アゴニスト) を表しています。
ブデソニド
ブデソニドは、強力なグルココルチコイド活性と弱いミネラルコルチコイド活性を示す抗炎症性コルチコステロイドです。標準的な in vitro および動物モデルでは、ブデソニドはグルココルチコイド受容体に対して約 200 倍高い親和性を持ち、コルチゾールよりも 1000 倍高い局所抗炎症効力を持っています (ラット クロトン油耳浮腫アッセイ)。全身活性の尺度として、ブデソニドは、ラット胸腺退縮アッセイで皮下投与した場合、コルチゾールよりも 40 倍強力であり、経口投与した場合は 25 倍強力です。
グルココルチコイド受容体親和性研究では、ブデソニドの 22R 型は 22S エピマーの 2 倍活性でした。 In vitro 研究では、ブデソニドの 2 つの形態が相互変換しないことが示されました。
炎症は、COPD および喘息の病因における重要な要素です。コルチコステロイドは、アレルギー性および非アレルギー性媒介性疾患に関与する複数の細胞型(例、マスト細胞、好酸球、好中球、マクロファージ、およびリンパ球)およびメディエーター(例、ヒスタミン、エイコサノイド、ロイコトリエン、およびサイトカイン)に対して広範囲の阻害活性を有する炎症。コルチコステロイドのこれらの抗炎症作用は、COPD および喘息におけるその有効性に寄与している可能性があります。
喘息患者を対象とした研究では、広範囲のブデソニド投与量にわたって、局所抗炎症活性と全身性コルチコステロイド効果との間の良好な比率が示されています。これは、比較的高い局所抗炎症効果、経口吸収された薬物の広範な初回通過肝臓分解 (85%-95%)、および形成された代謝物の低い効力の組み合わせによって説明されます。
ホルモテロール
ホルモテロール フマル酸塩は、急速に作用を開始する長時間作用型の選択的ベータ 2 アドレナリン アゴニスト (ベータ 2 アゴニスト) です。吸入されたホルモテロール フマル酸塩は、気管支拡張剤として肺に局所的に作用します。 in vitro 研究では、フォルモテロールは、ベータ 1 受容体よりもベータ 2 受容体で 200 倍以上のアゴニスト活性を有することが示されています。ベータ 1 アドレナリン受容体に対する in vitro 結合選択性は、アルブテロールよりもフォルモテロールの方が高く (5 倍)、サルメテロールはフォルモテロールよりも高い (3 倍) ベータ 2 選択比を持っています。
ベータ 2 受容体は気管支平滑筋の主要なアドレナリン受容体であり、ベータ 1 受容体は心臓の主要な受容体ですが、ヒトの心臓にもベータ 2 受容体があり、ベータ アドレナリン受容体全体の 10% から 50% を占めています。これらの受容体の正確な機能は確立されていませんが、非常に選択的なベータ 2 アゴニストでさえ心臓に影響を与える可能性があります。
フォルモテロールを含むベータ 2 アドレナリン受容体アゴニスト薬の薬理学的効果は、少なくとも部分的には、アデノシン三リン酸 (ATP) から環状-3', 5'-アデノシン一リン酸 (サイクリック AMP)。増加したサイクリック AMP レベルは、気管支平滑筋の弛緩と、細胞、特にマスト細胞からの即時型過敏症のメディエーターの放出の阻害を引き起こします。
インビトロ試験は、ホルモテロールがヒトの肺からのヒスタミンやロイコトリエンなどのマスト細胞メディエーターの放出の阻害剤であることを示しています。フォルモテロールはまた、麻酔したモルモットでヒスタミン誘発性血漿アルブミン漏出を阻害し、気道過敏症の犬でアレルゲン誘発性好酸球流入を阻害します。これらの in vitro および動物での知見とヒトとの関連性は不明です。
薬力学
喘息
心血管への影響
持続性喘息患者 201 人を対象とした単回投与クロスオーバー研究では、SYMBICORT を介して送達される 320 mcg のブデソニドと組み合わせた 4.5、9、および 18 mcg のホルモテロールの単回投与治療が、ブデソニド 320 mcg 単独と比較されました。ブデソニドと比較した場合、FEV1 の用量依存的な改善が実証されました。投与後に、グルコースおよびカリウムの心電図および血液サンプルを採取した。 SYMBICORT 4.5mcg では、ブデソニドと比較して、ホルモテロールの用量が増加するにつれて、血清グルコースのわずかな平均増加と血清カリウムの減少 (最高用量でそれぞれ +0.44 mmol/L と -0.18 mmol/L) が観察されました。心電図では、ブデソニド単独と比較して、SYMBICORT は心拍数 (最高用量で約 3 bpm) と QTc 間隔 (3 ~ 6 ミリ秒) の用量に関連した平均増加をわずかに示しました。 QT または QTc 値が 500 ミリ秒以上の被験者はいなかった。
米国では、5 つの 12 週間の実薬およびプラセボ対照研究と 1 つの 6 か月の実薬対照研究で、6 歳以上の喘息患者 2,976 人が評価されました。ホルモテロールの全身薬力学的効果 (心拍数/脈拍数、血圧、QTc 間隔、カリウム、およびグルコース) は、フォルモテロール乾燥吸入粉末 4.5 mcg、1 日 2 回 2 回吸入で治療された患者と比較して、SYMBICORT で治療された患者で同様でした。治療中にQT値またはQTc値が500ミリ秒以上の患者はいませんでした。
12 歳以上の青年および喘息の成人を対象とした 3 つのプラセボ対照研究では、合計 1,232 人の患者 (SYMBICORT 160mg 群の 553 人の患者) が評価可能な連続 24 時間心電図モニタリングを受けました。全体として、SYMBICORT 160mg群では、プラセボと比較して、心室または上室性転位の発生に重要な差はなく、臨床的に重大な不整脈のリスクが増加したという証拠もありませんでした。
HPA軸効果
全体として、ブデソニドと比較して、最大 640/18 mcg/日の用量で SYMBICORT で治療された成人または思春期の患者では、24 時間尿中コルチゾールによって測定される HPA 軸に対する臨床的に重要な影響は観察されませんでした。
慢性閉塞性肺疾患
心血管への影響
3,668 人の COPD 患者を対象とした 6 か月および 12 か月にわたる 2 つの COPD 肺機能研究では、SYMBICORT、SYMBICORT 160mg の個々の成分、およびプラセボの間で、脈拍数、血圧、カリウム、およびグルコースに臨床的に重要な違いは見られませんでした。 臨床研究 ]。
両方の研究の治療に関する複数の診療所訪問で記録されたECGは、心拍数、PR間隔、QRS持続時間、心拍数、心臓虚血または不整脈の兆候について、SYMBICORT 160/4.5単剤とプラセボの間で臨床的に重要な違いを示さず、すべて2回の吸入として投与されました1日2回。心電図に基づいて、SYMBICORT 160/4.5 で治療された 6 人の患者、フォルモテロール 4.5 mcg で治療された 6 人の患者、およびプラセボ群の 6 人の患者が、ベースラインでは存在しなかった心房細動または粗動を経験しました。 SYMBICORT 160/4.5、フォルモテロール 4.5 mcg、またはプラセボ群では、非持続性心室頻拍の症例はありませんでした。
この 12 か月の研究では、520 人の患者が、最初の投与前、および治療の約 1 か月後と 4 か月後に、評価可能な連続 24 時間心電図 (ホルター) モニタリングを受けました。 SYMBICORT 160/4.5、ホルモテロール、またはプラセボを 1 日 2 回 2 回吸入投与した群では、心室性または上室性不整脈、心室性または上室性異所性拍動、または心拍数に臨床的に重要な差は観察されませんでした。心電図 (ホルター) モニタリングに基づいて、SYMBICORT 160/4.5 の 1 人の患者、フォルモテロール 4.5 mcg の患者はなく、プラセボ群の 3 人の患者は、ベースラインでは存在しなかった心房細動または粗動を経験しました。
HPA軸効果
24 時間の尿中コルチゾール測定値は、2 つの COPD 肺機能研究からの患者のプールされたサブセット (n=616) で収集されました。データは、プラセボと比較して、SYMBICORT の長期投与 (> 6 か月) 後の平均 24 時間尿中遊離コルチゾール値が約 30% 低いことを示しました。 SYMBICORT 4.5mcg は、ブデソニド 160 mcg 単独、またはブデソニド 160 mcg とホルモテロール 4.5 mcg の同時投与に匹敵するコルチゾール抑制を示すように見えました。 SYMBICORT 160mgまたはプラセボで最大12か月間治療を受けた患者の場合、この測定で正常から低に移行した患者の割合は、ほぼ同等でした.
その他のブデソニド製品
全身吸収が吸入ブデソニドの臨床効果における重要な要因ではないことを確認するために、喘息患者を対象とした臨床試験が実施され、チューブスペーサーを備えた加圧定量吸入器を介して投与された 400 mcg のブデソニドと、1400 mcg の経口ブデソニドおよびプラセボが比較されました。 .この研究は、同等の全身レベルにもかかわらず、吸入ブデソニドの有効性を実証しましたが、経口摂取ブデソニドの有効性は実証しませんでした。このように、経口吸入ブデソニドの従来用量の治療効果は、気道への直接作用によって大きく説明される。
ブデソニドの吸入は、気道過敏症患者のヒスタミン、メタコリン、メタ重亜硫酸ナトリウム、アデノシン一リン酸など、さまざまなチャレンジモデルに対する気道反応性を低下させることが示されています。これらのモデルの臨床的関連性は確かではありません。
吸入ブデソニドによる前処置、毎日 1600 mcg (800 mcg を 1 日 2 回) を 2 週間使用すると、吸入アレルゲン チャレンジ後の FEV1 の急性 (初期反応) および遅延 (後期反応) 減少が減少しました。
吸入コルチコステロイドの全身作用は、そのような薬物への全身暴露に関連しています。薬物動態研究では、喘息の成人と小児の両方において、ブデソニドへの全身暴露は、乾燥粉末吸入器を介して同じ送達用量で投与された吸入ブデソニドと比較して、SYMBICORT 160 mg の方が低いことが実証されています [参照 臨床薬理学 ]。したがって、SYMBICORT から送達されたブデソニドの全身効果 (HPA 軸および成長) は、乾燥粉末吸入器を介して同等の用量で投与された場合、吸入されたブデソニドについて報告されているものよりも大きくないと予想されます。 特定の集団での使用 ]。
HPA軸効果
乾燥粉末吸入器を介して投与された吸入ブデソニドの HPA 軸への影響が、喘息の成人 905 人と小児患者 404 人で研究されました。コシントロピン(ACTH)刺激試験によって評価されるように、ほとんどの患者にとって、ストレスに応答してコルチゾール産生を増加させる能力は、推奨用量でのブデソニド治療で損なわれなかった. 100、200、400、または 800 mcg を 1 日 2 回 12 週間投与された成人患者では、それぞれ 4%、2%、6%、および 13% に異常な刺激コルチゾール反応が見られました (ピーク コルチゾール
その他のホルモテロール製品
薬力学的効果はベータアドレナリン受容体の刺激によるものですが、これらの受容体の過剰な活性化は、一般に骨格筋の震えやけいれん、不眠症、頻脈、血漿カリウムの減少、および血漿グルコースの増加につながります。ホルモテロールの吸入は、他のベータ 2 アドレナリン作動薬と同様に、用量に関連した心血管系への影響と、血糖および/または血清カリウムへの影響を引き起こす可能性があります。 警告と注意事項 ]。 SYMBICORT 160mg の場合、これらの効果については、臨床薬理学、薬力学、SYMBICORT (12.2) のセクションに詳述されています。
LABA 薬を使用すると、気管支保護作用および気管支拡張作用に対する耐性が生じる可能性があります。
慢性長時間作用型ベータ作動薬療法の中止後のリバウンド気管支過敏症は観察されていません。
薬物動態
シンビコート
吸収
ブデソニド
健常者
経口吸入ブデソニドは急速に肺に吸収され、通常 20 分以内に最高濃度に達します。ブデソニドの経口投与後、ピーク血漿濃度は約1~2時間で達成され、絶対的な全身利用率は広範な初回通過代謝により6%~13%でした。対照的に、肺に送達されたブデソニドのほとんどは全身に吸収されました。健康な被験者では、定量投与量の 34% が肺に沈着し (血漿濃度法およびブデソニド含有乾燥粉末吸入器を使用して評価)、定量投与量の 39% の絶対的な全身利用率がありました。
健康な被験者に SYMBICORT 160/4.5 を 1 日 2 回、5 日間、2 回または 4 回吸入投与した後、ブデソニドの血漿濃度は一般に用量に比例して増加しました。 1 日 2 回 2 回の吸入を受けたグループの蓄積指数は、ブデソニドで 1.32 でした。
喘息患者
単回投与試験では、推奨用量よりも高い SYMBICORT (SYMBICORT 160/4.5 の 12 回吸入) が中等度喘息患者に投与されました。 4.5 nmol/L のブデソニド血漿濃度のピークは、投与後 20 分で発生しました。この研究は、SYMBICORT 4.5mcg からのブデソニドへの総全身曝露が、同じ送達用量で乾燥粉末吸入器 (DPI) を介して吸入されたブデソニドよりも約 30% 低いことを示しました。 SYMBICORT の投与後、ブデソニド成分の半減期は 4.7 時間でした。
反復投与研究では、SYMBICORT の最高推奨用量 (160/4.5、1 日 2 回 2 回吸入) が、中等度の喘息患者と健康な被験者に 1 週間投与されました。 1.2 nmol/L のブデソニド血漿濃度のピークは、喘息患者の 21 分で発生しました。ブデソニドのピーク血漿濃度は、健常者と比較して喘息患者で27%低かった。しかし、ブデソニドの総全身曝露量は喘息患者と同等でした。
喘息の成人に DPI によって投与されたブデソニドのピーク定常状態血漿濃度は、1 日 2 回 180 mcg および 360 mcg の用量で、それぞれ平均 0.6 および 1.6 nmol/L でした。喘息患者において、ブデソニドは、ブデソニド吸入の単回投与および反復投与の両方で、用量の増加に伴って AUC および Cmax が直線的に増加することを示しました。
COPD患者
単回投与試験では、SYMBICORT 80/4.5 の 12 回の吸入 (総用量 960/54 mcg) が COPD 患者に投与されました。 3.3 nmol/L の平均ブデソニド ピーク血漿濃度は、投与後 30 分で発生しました。ブデソニドの全身暴露は、SYMBICORT pMDI と定量吸入器によるブデソニドおよび乾燥粉末吸入器によるホルモテロールの同時投与 (ブデソニド 960 mcg およびホルモテロール 54 mcg) との間で同等でした。同じ研究で、中等度の喘息患者の非盲検群も、同じ高用量の SYMBICORT を投与されました。ブデソニドの場合、COPD 患者は喘息患者と比較して AUC が 12% 高く、Cmax が 10% 低いことが示されました。
か月間の極めて重要な肺機能の臨床試験では、ブデソニドの定常状態の薬物動態データが、SYMBICORT 4.5mcg pMDI 160/4.5、SYMBICORT 160mg pMDI 80/4.5、ブデソニド 160 mcg、ブデソニドの治療アームを使用した COPD 患者のサブセットで得られました。 160 mcg とフォルモテロール 4.5 mcg を一緒に投与し、すべて 1 日 2 回 2 回吸入します。ブデソニドの全身暴露 (AUC および Cmax) は、80 mcg から 160 mcg までの用量に比例して増加し、同じ用量のブデソニド (SYMBICORT 4.5mcg pMDI 160/4.5、ブデソニド 160 mcg、ブデソニド 160 mcg およびホルモテロール 4.5 mcg を同時に投与)。
ホルモテロール
吸入されたホルモテロールは急速に吸収されます。ピーク血漿濃度は通常、投与後 5 ~ 10 分以内の最初の血漿サンプリング時に到達します。経口吸入用の多くの医薬品と同様に、吸入されたフォルモテロールの大部分は飲み込まれ、消化管から吸収される可能性があります。
健常者
健康な被験者に SYMBICORT (160/4.5、1 日 2 回 2 回または 4 回吸入) を 5 日間投与した後、ホルモテロールの血漿濃度は一般に用量に比例して増加しました。 1 日 2 回 2 回吸入したグループの蓄積指数は、フォルモテロールで 1.77 でした。
喘息患者
単回投与試験では、推奨用量よりも高い SYMBICORT (SYMBICORT 160/4.5 の 12 回吸入) が中等度喘息患者に投与されました。 136 pmol のホルモテロールのピーク血漿濃度は、投与後 10 分で発生しました。フォルモテロールの投与量の約 8% が未変化の薬物として尿中に回収されました。
反復投与研究では、SYMBICORT の最高推奨用量 (160/4.5、1 日 2 回 2 回吸入) が、中等度の喘息患者と健康な被験者に 1 週間投与されました。喘息患者では、ホルモテロール血漿濃度のピークが 10 分で 28 pmol/L に達しました。ホルモテロールのピーク血漿濃度は、健常者と比較して喘息患者で約 42% 低かった。しかし、ホルモテロールの全身暴露は、喘息患者と同等でした。
COPD患者
SYMBICORT 80/4.5 の 12 回吸入の単回投与後、投与後 15 分で 167 pmol/L の平均ピーク ホルモテロール血漿濃度が急速に達成されました。定量吸入器によるブデソニドと乾燥粉末吸入器によるフォルモテロールの同時投与 (ブデソニド 960 mcg とホルモテロール 54 mcg) の同時投与と比較して、SYMBICORT 160 mg pMDI からのホルモテロール曝露はわずかに多かった (~16-18%)。同じ研究で、中程度の喘息患者の非盲検群が同じ用量の SYMBICORT を投与されました。 COPD 患者は、喘息患者と比較して、ホルモテロールの AUC および Cmax が 12 ~ 15% 高い値を示しました。
か月間の極めて重要な肺機能の臨床試験では、SYMBICORT 160mg pMDI 160/4.5、SYMBICORT 160mg pMDI 80/4.5、ホルモテロール 4.5 mcg、ブデソニド 160 の治療群を使用した COPD 患者のサブセットで、ホルモテロールの定常状態の薬物動態データが得られました。 mcg とホルモテロール 4.5 mcg を一緒に投与し、すべて 1 日 2 回 2 回吸入します。 AUCによって証明されるホルモテロールの全身暴露は、ホルモテロール単独治療群およびブデソニドとホルモテロールの個々の成分の同時投与群と比較して、SYMBICORT pMDIでそれぞれ約30%および16%高かった。
分布
ブデソニド
ブデソニドの分布量は約 3 L/kg でした。それは、血漿タンパク質に85%~90%結合していた。タンパク質結合は、推奨される吸入用量を超えて達成された濃度範囲 (1 ~ 100 nmol/L) にわたって一定でした。ブデソニドは、コルチコステロイド結合グロブリンへの結合をほとんどまたはまったく示さなかった。ブデソニドは、約 0.8 の血漿比で、濃度に依存しない方法で赤血球と急速に平衡化しました。
ホルモテロール
10 ~ 500 nmol/L の濃度範囲で、フォルモテロールの RR および SS エナンチオマーの血漿タンパク質結合は、それぞれ 46% および 58% でした。血漿タンパク質結合を評価するために使用されたホルモテロールの濃度は、54 mcg を 1 回吸入した後の血漿で得られた濃度よりも高かった。
代謝
ブデソニド
ヒト肝臓ホモジネートを用いた in vitro 研究では、ブデソニドが迅速かつ広範囲に代謝されることが示されています。シトクロム P450 (CYP) アイソザイム 3A4 (CYP3A4) 触媒による生体内変化によって形成される 2 つの主要な代謝物が分離され、16α-ヒドロキシプレドニゾロンと 6β-ヒドロキシブデソニドとして同定されました。これら 2 つの代謝物のそれぞれのコルチコステロイド活性は、親化合物の 1% 未満でした。 in vitro と in vivo の代謝パターンの間に質的な違いは検出されませんでした。ヒトの肺および血清調製物では、ごくわずかな代謝不活性化が観察されました。
ホルモテロール
フォルモテロールの一次代謝は、直接グルクロン酸抱合および O-脱メチル化とその後の不活性代謝物への抱合によるものです。二次代謝経路には、デホルミル化と硫酸抱合が含まれます。 CYP2D6 と CYP2C は、主に Odemethylation の原因であると特定されています。
排除
ブデソニド
ブデソニドは、代謝物の形で尿と糞に排泄されました。静脈内放射性標識線量の約 60% が尿中に回収されました。
尿中には未変化のブデソニドは検出されませんでした。ブデソニドの 22R 型は、22S 型の 1.0 L/min に対して 1.4 L/min の全身クリアランスで肝臓によって優先的に除去されました。終末半減期である 2 ~ 3 時間は、両方のエピマーで同じであり、用量とは無関係でした。
ホルモテロール
ホルモテロールの排泄は、4 人の健康な被験者を対象に、放射能標識されたホルモテロールを経口および IV 経路で同時に投与した後に調べられました。その研究では、放射標識されたホルモテロールの 62% が尿中に排泄され、24% が糞便中に排泄されました。
特別な集団
高齢者
高齢患者における SYMBICORT 4.5mcg の薬物動態は、特に研究されていません。
小児科
ブデソニドの血漿中濃度は、6 歳から 12 歳未満の喘息の小児患者を対象とした単回投与試験で、SYMBICORT 160/4.5 を 4 回吸入投与した後に測定されました。 1.4 nmol/L のブデソニド濃度のピークは、投与後 20 分で発生しました。この研究では、SYMBICORT 4.5mcg からのブデソニドへの総全身曝露は、同じ送達用量で評価された乾燥粉末吸入器による吸入ブデソニドよりも約 30% 低いことも実証されました。 6 歳から 12 歳未満の小児における単回吸入後のブデソニドの用量正規化 Cmax および AUC0-inf は、成人で観察された値より数値的に低かった。
SYMBICORT 160/4.5 を 1 日 2 回 2 回吸入した後、6 歳から 12 歳未満の小児の定常状態でのホルモテロールの Cmax と AUC0-6 は、成人で観察された値と同等でした。
性別・人種
SYMBICORT の薬物動態に対する性別および人種の影響を調べる特定の研究は実施されていません。 SYMBICORT 4.5mcg データの母集団 PK 分析は、性別がブデソニドとフォルモテロールの薬物動態に影響を与えないことを示しています。 PK について評価された非白人の数が少ないため、人種の影響について結論を出すことはできません。
授乳中の母親
少なくとも 3 か月間、200 または 400 mcg の用量で 1 日 2 回、乾燥粉末吸入器からの吸入によって送達された場合のブデソニドの体内動態が、産後 1 か月から 6 か月までの喘息を持つ 8 人の授乳中の女性で研究されました。これらの女性のブデソニドへの全身曝露は、他の研究による喘息の非授乳女性の曝露に匹敵するようです。投与後 8 時間にわたって得られた母乳は、400 および 800 mcg の 1 日総投与量に対するブデソニドの最大濃度がそれぞれ 0.39 および 0.78 nmol/L であり、投与後 45 分以内に発生したことを明らかにしました。母乳から乳児へのブデソニドの推定経口 1 日量は、この研究で使用された 2 つの用量レジメンで約 0.007 および 0.014 mcg/kg/日であり、母親が吸入した用量の約 0.3% から 1% に相当します。母乳育児後約 90 分 (および母親への薬物投与後約 140 分) に 5 人の乳児から得られた血漿サンプル中のブデソニド濃度は、定量可能なレベルを下回っていました (4 人の乳児で 特定の集団での使用 ]。
腎不全または肝不全
肝障害または腎障害のある患者における SYMBICORT の特定の使用に関するデータはありません。肝機能の低下は、コルチコステロイドの除去に影響を与える可能性があります。ブデソニドの薬物動態は、経口摂取後の 2 倍の全身利用可能性によって証明されるように、肝機能の低下によって影響を受けました。しかし、ブデソニドの静脈内薬物動態は、肝硬変患者と健常者で類似していた。ホルモテロールに関する具体的なデータは入手できませんが、ホルモテロールは主に肝代謝によって排出されるため、重度の肝障害のある患者では暴露の増加が予想されます。
薬物間相互作用
ブデソニド、フォルモテロール、ブデソニドとフォルモテロールの同時投与の 8 つの吸入の薬物動態を比較するために、単回投与クロスオーバー研究が実施されました。この研究の結果は、SYMBICORT の 2 つの成分間に薬物動態学的相互作用の証拠がないことを示しました。
シトクロム P450 酵素の阻害剤
ケトコナゾール
シトクロム P450 (CYP) イソ酵素 3A4 (CYP3A4)、コルチコステロイドの主要な代謝酵素の強力な阻害剤であるケトコナゾールは、経口摂取されたブデソニドの血漿レベルを増加させました。
シメチジン
CYP 酵素の非特異的阻害剤であるシメチジンは、推奨用量で経口ブデソニドの薬物動態にわずかではあるが臨床的に重要ではない影響を及ぼしました。
ホルモテロールとの特定の薬物間相互作用研究は実施されていません。
動物毒物学および/または薬理学
前臨床
実験動物 (ミニブタ、げっ歯類、およびイヌ) での研究では、ベータ作動薬とメチルキサンチンを同時に投与すると、心不整脈と突然死 (心筋壊死の組織学的証拠を伴う) の発生が実証されています。これらの所見の臨床的意義は不明です。
臨床研究
喘息
12歳以上の喘息患者
SYMBICORT 4.5mcg と個々の成分を比較した 2 つの臨床研究では、ブデソニドまたはフォルモテロールのいずれかを単独で使用した場合よりも、SYMBICORT を使用した場合の方が、ほとんどの有効性エンドポイントでより大きな改善が見られました。さらに、1 つの臨床研究では、SYMBICORT と、ブデソニドとホルモテロールを別々の吸入器から対応する用量で同時に使用した場合とで、同様の結果が示されました。
SYMBICORT 160mg の安全性と有効性は、12 歳以上の患者 1,076 人を対象とした 2 つのランダム化二重盲検プラセボ対照米国臨床試験で実証されました。 SYMBICORT 160/9 mcg および 320/9 mcg の固定用量を 1 日 2 回 (各用量は、それぞれ 80/4.5 および 160/4.5 mcg 強度の 2 回の吸入として投与)、単一成分 (ブデソニドおよびホルモテロール) およびプラセボと比較して、喘息の重症度の範囲をカバーするための適切な投薬に関する情報を提供します。
研究 1: SYMBICORT 160/4.5 の臨床研究
この 12 週間の研究では、12 歳以上の 596 人の患者を評価し、ブデソニド 160 mcg とフォルモテロール 4.5 mcg を別々の吸入器で自由に組み合わせた SYMBICORT 160/4.5、ブデソニド 160 mcg、フォルモテロール 4.5 mcg、およびプラセボを比較しました。それぞれ 1 日 2 回 2 回の吸入として投与されます。この研究には、ブデソニド 80 mcg を 1 日 2 回 2 回吸入する 2 週間の慣らし期間が含まれていました。ほとんどの患者は中等度から重度の喘息を患っており、試験に参加する前に中等度から高用量の吸入コルチコステロイドを使用していました。無作為化は、以前の吸入コルチコステロイド治療によって層別化されました(中程度の吸入コルチコステロイドで71.6%、高用量の吸入コルチコステロイドで28.4%)。ベースラインで予測された FEV1 の平均パーセントは 68.1% で、治療群間で同様でした。共同主要有効性エンドポイントは、2 週目の 12 時間平均投与後 FEV1 であり、試験期間中の平均投与前 FEV1 でした。また、この研究では、事前に定義された喘息悪化基準を満たした患者は中止する必要がありました。定義済みの喘息悪化基準は、FEV1 または PEF の臨床的に重要な減少、レスキュー アルブテロール使用の増加、喘息による夜間の覚醒、喘息による緊急介入または入院、またはプロトコルで許可されていない喘息薬の必要性でした。喘息による夜間覚醒の基準については、他の喘息悪化基準のいずれも満たされない場合、研究者の裁量で患者を研究にとどめることを許可した。喘息悪化のため、または事前に定義された基準を満たすために中止した患者の割合を表4に示します。
12 週間にわたる投与直前 (投与前) に測定された FEV1 のベースラインからの平均変化率を図 1 に示します。利用可能な最後の試験来院時(治療終了、EOT)の用量 FEV1 結果も提供されます。 SYMBICORT 160/4.5 を投与された患者は、ブデソニド 160 mcg (0.10 L、4.9%)、フォルモテロール 4.5 mcg (-0.12 L、-4.8%)、およびプラセボ (-0.17 L、-6.9%)。
図 1 : 12 週間にわたる投与前 FEV1 のベースラインからの平均変化率 (研究 1)
患者情報
シンビコート (SIM-bi-kort) (ブデソニド 80 mcg およびフマル酸ホルモテロール二水和物 4.5 mcg) 吸入 エアゾール
シンビコート (SIM-bi-kort) (ブデソニド 160 mcg およびフマル酸ホルモテロール二水和物 4.5 mcg) 吸入 エアゾール
シンビコートとは?
SYMBICORT は、吸入コルチコステロイド薬 (ICS) であるブデソニドと長時間作用型ベータ 2 アドレナリン作動薬 (LABA) 薬であるフォルモテロールを組み合わせたものです。
- 吸入コルチコステロイドは、肺の炎症を軽減するのに役立ちます。肺の炎症は、呼吸の問題を引き起こす可能性があります。
- LABA 薬は、慢性閉塞性肺疾患 (COPD) および喘息患者に使用されます。 LABA薬は、肺の気道周辺の筋肉をリラックスさせ、喘鳴、咳、胸の圧迫感、息切れなどの症状を防ぎます.これらの症状は、気道の周りの筋肉が緊張すると起こります。これにより、呼吸が困難になります。重症の場合、喘鳴により呼吸が停止し、すぐに治療しないと死に至る可能性があります。
SYMBICORT 4.5mcg は、突然の呼吸障害の緩和には使用されず、レスキュー吸入器の代わりにはなりません。 SYMBICORT は、喘息および COPD に対して次のように使用されます。
- 喘息: SYMBICORT は、喘息の症状をコントロールし、成人および 6 歳以上の子供の喘鳴などの症状を予防するために使用されます。 SYMBICORT 4.5mcgにはホルモテロールが含まれています。ホルモテロールなどの LABA 薬を単独で使用すると、喘息による死亡や入院のリスクが高まります。 SYMBICORT には、ICS と LABA が含まれています。 ICS と LABA を併用しても、喘息による入院や死亡のリスクが大幅に増加することはありません。 SYMBICORT 160mg は、低用量から中用量の ICS などの喘息コントロール薬で十分にコントロールされている喘息の成人および子供には適していません。 SYMBICORT 160mg は、ICS と LABA の両方の薬を必要とする喘息の成人および小児向けです。 SYMBICORT が 6 歳未満の喘息の子供に安全で有効であるかどうかはわかっていません。
- COPD: COPD は、慢性気管支炎、肺気腫、またはその両方を含む長期 (慢性) 肺疾患です。 SYMBICORT 160/4.5 mcg は、COPD の症状を改善して呼吸を改善し、フレアアップ (COPD の症状が数日間悪化すること) を減らすために、1 日 2 回 2 回の吸入として長期間使用されます。
SYMBICORT を使用しない:
- 喘息や COPD の突然の重篤な症状の治療に。
- SYMBICORT のいずれかの成分にアレルギーがある場合。 SYMBICORT の成分リストについては、このリーフレットの最後を参照してください。
SYMBICORT を使用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 心臓に問題があります。
- 高血圧です。
- 発作があります。
- 甲状腺に問題があります。
- 糖尿病です。
- 肝臓に問題があります。
- 骨粗鬆症があります。
- 免疫システムに問題があります。
- 眼圧の上昇、緑内障、白内障などの眼の問題がある。
- どんな薬にもアレルギーがあります。
- あらゆる種類のウイルス、細菌、真菌、または寄生虫に感染している。
- 水疱瘡またははしかにさらされている。
- 妊娠している、または妊娠する予定がある。 SYMBICORT 4.5mcg が胎児に害を及ぼす可能性があるかどうかはわかっていません。
- 授乳中です。 SYMBICORT の有効成分の 1 つであるブデソニドは母乳に移行します。授乳中に SYMBICORT 160mg を服用するかどうかは、あなたと担当の医療提供者が決定する必要があります。
処方薬や市販薬、ビタミン、ハーブサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。 SYMBICORT と特定の他の医薬品は相互に作用する可能性があります。これは深刻な副作用を引き起こす可能性があります。特に、抗真菌薬または抗 HIV 薬を服用している場合は、医療提供者に伝えてください。
あなたが服用しているすべての薬を知っています。リストを作成し、新しい薬を入手するたびに、担当の医療従事者や薬剤師に提示してください。
SYMBICORT はどのように使用すればよいですか?
この患者情報リーフレットの最後にある SYMBICORT を使用するための段階的な説明を参照してください。 あなたの医療提供者があなたに教え、あなたがすべてを理解していない限り、SYMBICORT 4.5mcgを使用しないでください.ご不明な点がございましたら、医療提供者または薬剤師にお尋ねください。
- SYMBICORT は規定どおりに使用してください。 SYMBICORT 160mg を処方されたよりも頻繁に使用しないでください。 SYMBICORTには2つの強みがあります。あなたの医療提供者は、あなたに最適な強度を処方しています。 SYMBICORT と他の吸入薬との違いに注意してください。これには、処方された用途や外観の違いが含まれます。
- 子供は、子供の医療提供者の指示に従って、大人の助けを借りて SYMBICORT を使用する必要があります。
- SYMBICORT 160mg は、朝 2 パフ、夕方 2 パフとして、約 12 時間間隔で毎日服用する必要があります。
- SYMBICORT 160mg を飲み忘れた場合は、通常と同じ時間に次の用量を服用してください。
- SYMBICORT 1回分(2パフ)ごとに口をすすぎ、水を吐き出してください。水を飲み込まないでください。これにより、口や喉に真菌感染症(鵞口瘡)が発生する可能性を減らすことができます.
- SYMBICORT の服用量が多すぎる場合は、息切れの悪化、胸の痛み、心拍数の増加、震えなどの異常な症状がある場合は、医療提供者に連絡するか、最寄りの病院の緊急治療室にすぐに行ってください。
- SYMBICORT 4.5mcg を目にスプレーしないでください。 SYMBICORT 160mg が誤って目に入った場合は、目を水で洗い流し、赤みや刺激が続く場合は、医療提供者に相談してください。
- 呼吸の問題を制御または治療するために使用される薬を変更したり、中止したりしないでください。医療提供者は、必要に応じて薬を変更します。
- SYMBICORT を 1 日 2 回使用している間は、理由の如何を問わず、LABA を含む他の医薬品を使用しないでください。他の薬がLABA薬であるかどうか、医療提供者または薬剤師に尋ねてください.
- SYMBICORT 4.5mcg は突然の症状を緩和するものではありません。突然の症状に対応するため、常にレスキュー吸入薬を携帯してください。レスキュー吸入器を持っていない場合は、医療提供者に連絡して処方してもらってください。
- 次の場合は、すぐに医療提供者に連絡するか、医療を受けてください。
- SYMBICORT を使用すると、呼吸の問題が悪化します。
- 通常よりも頻繁にレスキュー吸入薬を使用する必要があります。
- あなたのレスキュー吸入器の薬は、症状を緩和するのにうまく機能しません.
- ピークフローメーターの結果が減少します。担当の医療提供者が、あなたに適した数値を教えてくれます。
- SYMBICORT 160mgを1週間定期的に使用しても症状が改善しない.
SYMBICORT の考えられる副作用は何ですか?
SYMBICORT 4.5mcg は、次のような重大な副作用を引き起こす可能性があります。
- LABA薬を過剰に使用すると、次の原因になる可能性があります。
- 胸痛
- 血圧上昇
- 速くて不規則な心拍
- 頭痛
- 身震い
- 緊張感
- 口や喉の真菌感染症(ツグミ)。 SYMBICORT 4.5mcg を使用した後は、飲み込まずに水で口をすすぎ、鵞口瘡になる可能性を減らしてください。
- 肺炎およびその他の下気道感染症。 COPD 患者は、肺炎やその他の肺感染症にかかる可能性が高くなります。コルチコステロイドの吸入は、肺炎になる可能性を高める可能性があります。これらの症状のいずれかに気付いた場合は、医療提供者に連絡してください。
- 粘液(痰)産生の増加
- 粘液の色の変化
- 熱
- 寒気
- 咳の増加
- 呼吸障害の増加
- 免疫系への影響と感染の可能性が高くなります。 次のような感染の兆候について、医療提供者に伝えてください。
- 熱
- 痛み
- 体の痛み
- 寒気
- 疲労感
- 吐き気
- 嘔吐
- 副腎不全。 副腎不全は、副腎が十分なステロイドホルモンを作らない状態です。これは、経口コルチコステロイド薬の服用を中止し、吸入コルチコステロイド薬を開始したときに発生する可能性があります.
- SYMBICORTを服用した直後の喘鳴の増加. 突然の喘鳴に対処するために、常にレスキュー吸入器を携帯してください。
- 発疹、蕁麻疹、顔、口、舌の腫れ、呼吸障害などの深刻なアレルギー反応。 深刻なアレルギー反応の症状が現れた場合は、医療提供者に連絡するか、緊急医療を受けてください。
- 骨密度の低下。 これは、骨密度が低い(骨粗鬆症)可能性が高い人に発生する可能性があります。担当の医療提供者は、SYMBICORT による治療中にこれについてチェックする必要があります。
- 子供の成長が遅い。 SYMBICORTを使用している間は、子供の成長を定期的にチェックする必要があります。
- 緑内障や白内障などの眼病。 SYMBICORT を使用している間は、定期的に目の検査を受ける必要があります。
- 血管の腫れ。 これは喘息の人に起こります。以下の場合は、すぐに医療提供者に伝えてください。
- ピンと針の感覚または
- 風邪のような症状 手足のしびれ
- 副鼻腔の痛みと腫れ
- 発疹
- 血中カリウム濃度の低下(低カリウム血症)。
- 血糖値の上昇(高血糖)。
SYMBICORT の最も一般的な副作用は次のとおりです。
喘息の人:
- 喉の炎症
- 頭痛
- 上気道感染症
- 喉の痛み
- 副鼻腔の粘膜の炎症
- インフルエンザ(副鼻腔炎)
- 鼻詰まり
- 背中の痛み
- 嘔吐
- 胃の不快感
- 口と喉のツグミ。ツグミ予防のため、使用後は飲み込まずに水で口をゆすぐ
COPD患者:
- 喉の刺激。
- 口と喉のツグミ。使用後は飲み込まずに水で口をゆすぐことで、ツグミの予防に役立ちます。
- 気管支の粘膜の感染および炎症(気管支炎)。
- 副鼻腔の粘膜の炎症(副鼻腔炎)。
- 上気道感染症。
気になる副作用や治らない副作用については、かかりつけの医療提供者に伝えてください。
これらは、SYMBICORT の考えられるすべての副作用ではありません。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
また、1-800-236-9933 でアストラゼネカに副作用を報告することもできます。
SYMBICORT はどのように保管すればよいですか?
- SYMBICORT は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
- SYMBICORT はマウスピースを下にして保管してください。
- SYMBICORT キャニスターの中身は圧力を受けています。キャニスターに穴を開けたり、火や焼却炉に投げ入れたりしないでください。火気や火気の近くで使用・保管しないでください。 120°F 以上で保管すると、キャニスターが破裂する可能性があります。
- SYMBICORT 160mg は、カウンターがゼロ (「0」) になったとき、または SYMBICORT をフォイル パウチから取り出してから 3 か月経過した時点のいずれか早い方で廃棄してください。
- SYMBICORT 4.5mcg とすべての医薬品は子供の手の届かないところに保管してください。
SYMBICORT の安全で効果的な使用に関する一般情報。
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。 SYMBICORT 4.5mcg は、処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、SYMBICORT を与えないでください。それらに害を及ぼす可能性があります。
医療従事者向けに書かれた SYMBICORT 4.5mcg に関する情報については、医療提供者または薬剤師にお尋ねください。
SYMBICORT 4.5mcgの成分は何ですか?
有効成分: 微粉化ブデソニドおよび微粉化フマル酸ホルモテロール二水和物
不活性成分: ヒドロフルオロアルカン (HFA 227)、ポビドン K25 USP、およびポリエチレングリコール 1000 NF
使用説明書
シンビコート (SIM-bi-kort)(ブデソニド 80 mcg およびフマル酸ホルモテロール二水和物 4.5 mcg) 吸入 エアゾール
シンビコート (SIM-bi-kort) (ブデソニド 160 mcg およびフマル酸ホルモテロール二水和物 4.5 mcg) 吸入 エアゾール
図1  直立姿勢
直立姿勢
シンビコートの使い方
SYMBICORT を使用するには、以下の手順に従ってください。息を吸い込みます(吸い込みます)。ご不明な点がございましたら、医師または薬剤師にお尋ねください。
SYMBICORT 吸入器の使用準備
図 2 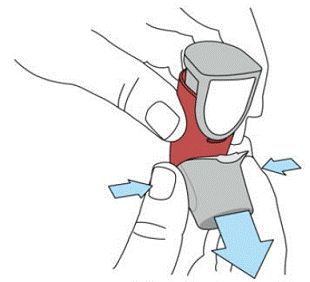
5. SYMBICORT 吸入器のプライミング
SYMBICORT を初めて使用する前に、プライミングする必要があります。 SYMBICORT 160mg をプライミングするには、直立させます。図 1 を参照してください。SYMBICORT 4.5mcg 吸入器を 5 秒間よく振ってください。 SYMBICORT 160mg 吸入器を反対側に向けて持ち、SYMBICORT 160mg 吸入器のカウンターの上部をしっかりと完全に押し下げて、テスト スプレーを放出します。その後、もう一度 5 秒間振ってから、2 回目のテスト スプレーを放します。 SYMBICORT 160mg 吸入器が準備され、使用できるようになりました。初めて SYMBICORT 吸入器をプライミングした後、提供されたサイズに応じて、カウンターは 120 または 60 のいずれかを読み取ります。
SYMBICORT 吸入器を 7 日以上使用しない場合、または落とした場合は、再度プライミングする必要があります。
SYMBICORT 160mg吸入器の使用時の持ち方
図 3 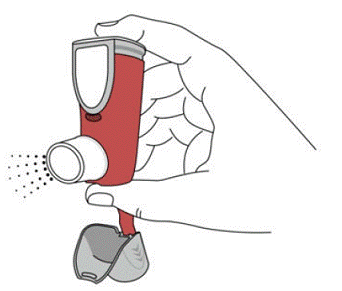
また
図 4 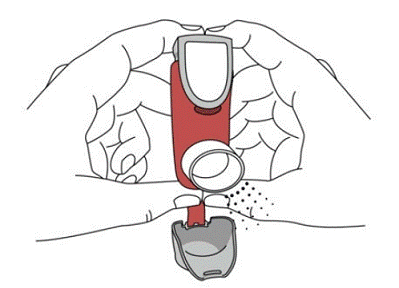
SYMBICORT 吸入器の使用
6. SYMBICORT 160mg 吸入器を 5 秒間よく振ってください。マウスピースカバーを取り外します。マウスピースに異物がないか確認してください。
7.完全に息を吐きます(息を吐きます)。 SYMBICORT 吸入器を口に近づけます。白いマウスピースを口の中に完全に入れ、唇を閉じます。 SYMBICORT 4.5mcg 吸入器が直立していて、マウスピースの開口部が喉の奥に向いていることを確認してください (図 5 を参照)。
図 5 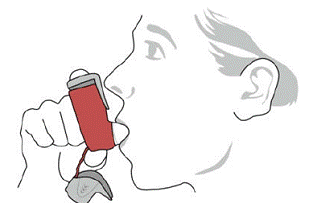
8. 口から深くゆっくりと息を吸い込みます。 SYMBICORT 吸入器のカウンターの上部をしっかりと完全に押し下げて、薬を放出します (図 3 および 4 を参照)。
9. 息を吸い続け(吸い込み)、約 10 秒間、または快適に息を止めます。息を吐く(息を吐く)前に、カウンターの上から指を離します。 SYMBICORT 吸入器を直立させ、口から取り出します。
10. SYMBICORT 吸入器を再度 5 秒間振って、ステップ 7 から 9 を繰り返します。
SYMBICORT 吸入器の使用後
11. 使用後はマウスピースカバーをカチッと音がするまで押して閉めてください。
12. SYMBICORT (2 パフ) の服用後、水で口をすすいでください。水を吐き出します。飲み込まないでください。
カウンターの読み方
- SYMBICORT 吸入器の上部にあるカウンターの矢印は、吸入器に残っている吸入 (パフ) の回数を示しています。
カウンター 
- カウンターは、薬を一吹きするたびにカウントダウンします (SYMBICORT 吸入器をプライミングするとき、または薬を服用するとき)。
- カウンターの矢印が 20 に近づくと、医療提供者に連絡して補充を求める時期であることを知らせる黄色の領域の始まりに気付くでしょう。
カウンター 
- カウンターを読んで、SYMBICORT 160mg 吸入器に残っている吸入 (パフ) の回数に注意を払うことが重要です。カウンターがゼロ (「0」) を示したとき、または SYMBICORT 160mg 吸入器をフォイル パウチから取り出してから 3 か月が経過した時点のいずれか早い方で、SYMBICORT を廃棄してください。 SYMBICORT 吸入器が空っぽに感じられず、作動し続ける場合がありますが、使用し続けると、適切な量の薬が得られなくなります。新しい SYMBICORT 吸入器を使用し、プライミングの指示に従います (上記の指示 5 を参照)。
SYMBICORT 吸入器の洗浄方法
SYMBICORT 4.5mcg 吸入器の白いマウスピースは 7 日ごとに清掃してください。マウスピースをクリーニングするには:
- 灰色のマウスピースカバーを取り外します
- 白いマウスピースの開口部の内側と外側をきれいな乾いた布で拭いてください。
- マウスピースカバーを交換する
- SYMBICORT吸入器を水に入れないでください
- 分解しようとしないでください シンビコート 吸入器
この患者情報および使用説明書は、米国食品医薬品局によって承認されています。
