Singulair 10mg, 4mg, 5mg Montelukast 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Singulair とは何ですか? どのように使用されますか?
Singulair 5mg は、喘息、運動誘発性気管支痙攣、およびアレルギー性または通年性 (通年性) 鼻炎の症状を治療するために使用される処方薬です。 Singulair は、単独で使用することも、他の薬剤と併用することもできます。
- シングレアはロイコトリエン受容体拮抗薬と呼ばれる種類の薬です。
- Singulair が 1 歳未満の子供に安全で有効であるかどうかはわかっていません。
シングレアの副作用は?
Singulair は、次のような重大な副作用を引き起こす可能性があります。
- 気分や行動の異常な変化、
- 皮膚発疹、
- あざ、
- 激しいうずき、
- しびれ、
- 痛み、
- 筋力低下、
- 耳の痛み、
- 腫れ、
- 暖かさ、
- 熱、
- 喉の痛み、
- 顔や舌の腫れ、
- あなたの目に燃えている、そして
- 皮膚の痛みに続いて、赤または紫の発疹が上半身に広がり、水ぶくれやはがれを引き起こします
上記の症状がある場合は、すぐに医療機関を受診してください。
Singulairの最も一般的な副作用は次のとおりです。
- 胃痛、
- 下痢、
- 熱、
- インフルエンザの症状、
- かぜの症状(鼻づまり、副鼻腔の痛み、せき、のどの痛み)、
- 頭痛と
- 子供の夜尿または膀胱制御の喪失
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Singulair の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
SINGULAIR 4mgの有効成分であるモンテルカストナトリウムは、システイニルロイコトリエンCysLT1受容体を阻害する選択的かつ経口的に活性なロイコトリエン受容体アンタゴニストです。
モンテルカスト ナトリウムは化学的に [R-(E)]-1-[[[1-[3-[2-(7-クロロ-2-キノリニル)エテニル]フェニル]-3-[2-(1-ヒドロキシ) -1-メチルエチル)フェニル]プロピル]チオ]メチル]シクロプロパン酢酸、一ナトリウム塩。
実験式は C35H35ClNNaO3S で、分子量は 608.18 です。構造式は次のとおりです。
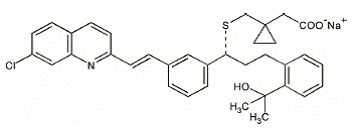
モンテルカスト ナトリウムは、吸湿性の光学活性な白色からオフホワイトの粉末です。モンテルカストナトリウムは、エタノール、メタノール、水に溶けやすく、アセトニトリルにはほとんど溶けません。
各 10 mg のフィルムコーティングされた SINGULAIR 錠剤には、10 mg のモンテルカストに相当する 10.4 mg のモンテルカスト ナトリウムと、微結晶セルロース、ラクトース一水和物、クロスカルメロース ナトリウム、ヒドロキシプロピル セルロース、およびステアリン酸マグネシウムが含まれています。フィルムコーティングは、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、二酸化チタン、赤色三二酸化鉄、黄色三二酸化鉄、およびカルナバワックスで構成されています。
mg および 5 mg のチュアブル SINGULAIR 錠剤には、それぞれ 4.2 mg および 5.2 mg のモンテルカスト ナトリウムが含まれており、これはそれぞれ 4 mg および 5 mg のモンテルカストに相当します。どちらのチュアブル タブレットにも、次の不活性成分が含まれています: マンニトール、微結晶性セルロース、ヒドロキシプロピル セルロース、紅酸化鉄、クロスカルメロース ナトリウム、チェリー フレーバー、アスパルテーム、ステアリン酸マグネシウム。
SINGULAIR 4 mg 経口顆粒の各パケットには、4 mg のモンテルカストに相当する 4.2 mg のモンテルカスト ナトリウムが含まれています。経口顆粒製剤には、次の不活性成分が含まれています:マンニトール、ヒドロキシプロピルセルロース、およびステアリン酸マグネシウム。
適応症
喘息
SINGULAIR® は、成人および生後 12 か月以上の小児患者の喘息の予防および慢性治療に適応しています。
運動誘発性気管支収縮 (EIB)
SINGULAIR は、6 歳以上の患者の運動誘発性気管支収縮 (EIB) の予防を適応としています。
アレルギー性鼻炎
SINGULAIR 10mg は、2 歳以上の患者の季節性アレルギー性鼻炎および生後 6 か月以上の患者の通年性アレルギー性鼻炎の症状の緩和に適応されます。 SINGULAIR 4mgの利点は、アレルギー性鼻炎患者の神経精神症状のリスクを上回るとは限らないため[ 警告と注意事項 ]、代替療法に対する反応が不十分または不耐性の患者のための予備使用。
使用制限
SINGULAIR は、急性喘息発作の治療には適応されていません。
投薬と管理
喘息
喘息の場合は、食事の有無にかかわらず、SINGULAIR を 1 日 1 回、夕方に経口投与してください。喘息患者を対象に、朝と夜の投与の相対的有効性を評価する臨床試験は行われていません。
次の用量が推奨されます。
飲み忘れた患者は、通常の時間に次の用量を服用し、同時に 2 回服用しないでください。
運動誘発性気管支収縮 (EIB)
EIBの予防には、運動の少なくとも2時間前にSINGULAIR 10mgを1回経口投与してください。次の用量が推奨されます。
前回の服用から 24 時間以内に SINGULAIR を追加服用しないでください。別の適応症(慢性喘息を含む)のためにすでにシングレアを毎日服用している患者は、EIBを予防するために追加の服用をしてはいけません。すべての患者は、短時間作用型のβ-アゴニストを救出できるようにしておく必要があります。
喘息の慢性治療のための SINGULAIR の毎日の投与は、EIB の急性エピソードを予防するために確立されていません。
アレルギー性鼻炎
アレルギー性鼻炎の場合は、食物摂取の時間に関係なく、1日1回、SINGULAIR 5mgを経口投与してください。アレルギー性鼻炎患者の投与時期は、患者のニーズに合わせて個別化できます。
季節性アレルギー性鼻炎の症状の治療には、次の用量が推奨されます。
表 3: 季節性アレルギー性鼻炎における推奨用量
飲み忘れた患者は、通常の時間に次の用量を服用し、同時に 2 回服用しないでください。
喘息とアレルギー性鼻炎
喘息とアレルギー性鼻炎の両方を患っている患者には、1 日 1 回夕方に SINGULAIR を 1 回だけ経口投与してください。
飲み忘れた患者は、通常の時間に次の用量を服用し、同時に 2 回服用しないでください。
経口顆粒剤の投与方法
SINGULAIR 4 mg 経口顆粒剤は、口の中に直接投与するか、小さじ 1 杯 (5 mL) の冷製または室温の粉ミルクまたは母乳に溶かすか、スプーン 1 杯の冷製または室温の軟らかい食品と混合して投与することができます。安定性の研究に基づいて、アップルソース、ニンジン、米、またはアイスクリームのみを使用する必要があります.パケットは、使用する準備が整うまで開封しないでください。パケットを開封した後、15 分以内に全用量 (粉ミルク、母乳、または食品と混合するかどうかにかかわらず) を投与する必要があります。粉ミルク、母乳、または食品と混合した場合、SINGULAIR 4mg経口顆粒は、将来の使用のために保管してはなりません.未使用部分は廃棄してください。 SINGULAIR経口顆粒剤は、粉ミルクまたは母乳以外の液体に溶解して投与することを意図していません。しかしながら、投与後に液体を摂取することができる。シングレア経口顆粒は、食事の時間に関係なく投与できます。
供給方法
剤形と強度
錠剤
10 mg、ベージュ色、丸みを帯びた正方形のフィルムコーティング錠で、片面にコード MSD 117、もう片面に SINGULAIR 4mg が記載されています。
チュアブル錠
mg、ピンク色、丸型、両凸型、片面にコード MSD 275、もう片面に SINGULAIR。
チュアブル錠
4 mg、ピンク色、楕円形、両凸型、片面にコード MSD 711、もう片面に SINGULAIR。
経口顆粒
mg、正味重量 500 mg の白色の顆粒で、子供に安全なホイル パケットに梱包されています。
保管と取り扱い
シングレア4mg経口顆粒 正味重量 500 mg の白色の顆粒で、子供に安全なホイル パケットに梱包されています。
NDC 0006-3841-30 30 パケット入りの使用単位カートン。
シングレア4mg錠 ピンク色、楕円形、両凸形状のチュアブル錠で、片面にコード MSD 711、もう片面に SINGULAIR 10mg が記載されています。
NDC 0006-1711-31 高密度ポリエチレン (HDPE) ボトル 30 本入り、ポリプロピレンのチャイルド レジスタント キャップ、アルミ ホイル インダクション シール、シリカゲル乾燥剤付き。
シングレア5mg錠 片面にコード MSD 275、もう片面に SINGULAIR が記載された、ピンク色の丸い両凸形状のチュアブル タブレット。
NDC 0006-9275-31 高密度ポリエチレン (HDPE) ボトル 30 本入り、ポリプロピレン製チャイルド レジスタント キャップ、アルミ ホイル インダクション シール、およびシリカゲル乾燥剤付き。
シングレア10mg錠 ベージュ色の丸みを帯びた正方形のフィルムコーティング錠で、片面にコード MSD 117、もう片面に SINGULAIR 4mg が記載されています。
NDC 0006-9117-31 使用単位 高密度ポリエチレン (HDPE) ボトル 30 本入り、ポリプロピレン製チャイルド レジスタント キャップ、アルミ ホイル インダクション シール、およびシリカゲル乾燥剤付き
NDC 0006-9117-54 高密度ポリエチレン (HDPE) ボトル 90 本入り、ポリプロピレン製チャイルド レジスタント キャップ、アルミ ホイル インダクション シール、シリカゲル乾燥剤付き。
保管所
SINGULAIR 4 mg 経口顆粒、4 mg チュアブル錠、5 mg チュアブル錠、および 10 mg フィルムコーティング錠は 20°C ~ 25°C (68°F ~ 77°F) で保管してください。 C ~ 30°C (59°F ~ 86°F) [USP 制御室温を参照]。湿気や光から保護してください。元のパッケージに保管してください。
販売元: MERCK & CO., INC., Whitehouse Station, USA の子会社である Merck Sharp & Dohme Corp.。改訂: 2021 年 2 月
副作用
以下の臨床的に重大な副作用は、ラベルの別の場所に記載されています。
- 神経精神医学的事象 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。以下の臨床試験の経験の説明では、因果関係の評価に関係なく副作用がリストされています。
対照臨床試験で最も一般的な有害反応(発生率が5%以上でプラセボより多い、頻度の高い順に記載)は、上気道感染症、発熱、頭痛、咽頭炎、咳、腹痛、下痢、中耳炎、インフルエンザ、鼻漏、副鼻腔炎、中耳炎。
15 歳以上の成人および青年の喘息患者
SINGULAIR 10mg は、臨床試験で 15 歳以上の約 2,950 人の成人および青年患者で安全性が評価されています。プラセボ対照臨床試験では、SINGULAIR 4mgで報告された以下の有害反応が患者の1%以上で発生し、プラセボで治療された患者よりも高い発生率で発生しました:
あまり一般的でない副作用の頻度は、SINGULAIR とプラセボの間で同程度でした。
SINGULAIR 10mg の安全性プロファイルは、15 歳以上の成人および思春期患者の EIB 予防のために単回投与した場合、SINGULAIR について前述した安全性プロファイルと一致していました。
累計で、569 人の患者が SINGULAIR 10mg で少なくとも 6 か月間、480 人が 1 年間、49 人が 2 年間、臨床試験で治療を受けました。治療が長期化しても、有害反応プロファイルは有意に変化しませんでした。
6~14歳の喘息の小児患者
SINGULAIR 10mg は、6 歳から 14 歳までの 476 人の小児患者で安全性が評価されています。累積的に、289 人の小児患者が SINGULAIR 10mg で少なくとも 6 か月間、241 人が臨床試験で 1 年以上治療を受けました。 8週間の二重盲検小児有効性試験におけるSINGULAIRの安全性プロファイルは、成人の安全性プロファイルとほぼ同様でした。 SINGULAIR 5mg を投与された 6 歳から 14 歳の小児患者では、以下の反応が 2% 以上の頻度で発生し、プラセボを投与された小児患者よりも頻繁に発生しました: 咽頭炎、インフルエンザ、発熱、副鼻腔炎、吐き気、下痢、消化不良、中耳炎、ウイルス感染、喉頭炎。あまり一般的でない副作用の頻度は、SINGULAIR 4mg とプラセボの間で同程度でした。治療が長期化しても、有害反応プロファイルは有意に変化しませんでした。
SINGULAIR 4mg の安全性プロファイルは、6 歳以上の小児患者の EIB 予防のために単回投与した場合、前述の SINGULAIR の安全性プロファイルと一致していました。
成長率を評価した研究では、これらの小児患者の安全性プロファイルは、SINGULAIR について以前に説明した安全性プロファイルと一致していました。 SINGULAIRを投与されている6歳から8歳の小児患者の成長率を評価する56週間の二重盲検試験では、この年齢層でSINGULAIRを使用したことで以前に観察されなかった以下の反応が2%以上の頻度で発生しました。プラセボを受けた小児患者よりも、頭痛、鼻炎(感染性)、水痘、胃腸炎、アトピー性皮膚炎、急性気管支炎、歯の感染症、皮膚感染症、および近視.
2~5歳の喘息の小児患者
SINGULAIR は、2 歳から 5 歳の 573 人の小児患者を対象に、単回および複数回投与試験で安全性が評価されています。累積的に、臨床試験では、2 歳から 5 歳の 426 人の小児患者が SINGULAIR 10mg で少なくとも 3 か月間、230 人が 6 か月以上、63 人の患者が 1 年以上治療を受けました。 SINGULAIR を投与された 2 ~ 5 歳の小児患者では、以下の反応が 2% 以上の頻度で発生し、プラセボを投与された小児患者よりも頻繁に発生しました: 発熱、咳、腹痛、下痢、頭痛、鼻漏、副鼻腔炎、中耳炎、インフルエンザ、発疹、耳の痛み、胃腸炎、湿疹、蕁麻疹、水痘、肺炎、皮膚炎、結膜炎。
喘息のある生後6~23ヶ月の小児患者
生後 12 か月未満の喘息の小児患者における安全性と有効性は確立されていません。
SINGULAIR 4mg は、生後 6 ~ 23 か月の 175 人の小児患者で安全性が評価されています。 6 週間の二重盲検プラセボ対照臨床試験における SINGULAIR の安全性プロファイルは、2 歳から 14 歳の成人および小児患者における安全性プロファイルとほぼ同様でした。 SINGULAIR 5 mg を投与された生後 6 ~ 23 か月の小児患者では、以下の反応が 2% 以上の頻度で発生し、プラセボを投与された小児患者よりも頻繁に発生しました。上気道感染症、喘鳴。中耳炎;咽頭炎、扁桃炎、咳;そして鼻炎。あまり一般的でない副作用の頻度は、SINGULAIR とプラセボの間で同程度でした。
15歳以上の季節性アレルギー性鼻炎の成人および青年
SINGULAIR は、臨床試験で 15 歳以上の 2,199 人の成人および青年患者の安全性が評価されています。 SINGULAIR 10mg を 1 日 1 回朝または晩に投与すると、プラセボと同様の安全性プロファイルが得られました。プラセボ対照臨床試験では、SINGULAIR 5mg の頻度が 1% 以上で、プラセボよりも高い発生率で次のような反応が報告されました。 4 週間のプラセボ対照臨床研究では、安全性プロファイルは 2 週間の研究で観察されたものと一致していました。傾眠の発生率は、すべての研究でプラセボの発生率と同様でした。
2歳から14歳の季節性アレルギー性鼻炎の小児患者
SINGULAIR 5mg は、2 週間から 14 歳までの 280 人の小児患者を対象に、2 週間の多施設共同二重盲検プラセボ対照並行群間安全性試験で評価されました。 SINGULAIR を 1 日 1 回夕方に投与すると、プラセボと同様の安全性プロファイルが得られました。この研究では、次の反応が 2% 以上の頻度で発生し、発生率はプラセボよりも高かった: 頭痛、中耳炎、咽頭炎、および上気道感染症。
15歳以上の通年性アレルギー性鼻炎の成人および青年
SINGULAIR は、15 歳以上の通年性アレルギー性鼻炎患者 3,357 人の成人および思春期患者の安全性が評価されており、そのうち 1,632 人が 2 つの 6 週間の臨床試験で SINGULAIR を投与されました。 SINGULAIR 10mgを1日1回投与した場合、季節性アレルギー性鼻炎患者で観察されたものと一致し、プラセボと同様の安全性プロファイルが得られました。これらの 2 つの研究では、次の反応が SINGULAIR で 1% 以上の頻度でプラセボより高い発生率で報告されました: 副鼻腔炎、上気道感染症、副鼻腔頭痛、咳、鼻出血、および ALT の上昇。傾眠の発生率は、プラセボの発生率と同様でした。
通年性アレルギー性鼻炎の6ヶ月から14歳の小児患者
歳から 14 歳の通年性アレルギー性鼻炎患者における安全性は、2 歳から 14 歳の季節性アレルギー性鼻炎患者における安全性によって裏付けられています。生後 6 ~ 23 か月の患者における安全性は、この小児集団における喘息の薬物動態および安全性と有効性の研究からのデータ、および成人の薬物動態研究からのデータによって裏付けられています。
市販後の経験
SINGULAIRの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系の障害 出血傾向の増加、血小板減少症
免疫系障害 アナフィラキシー、肝好酸球浸潤を含む過敏反応
精神障害 動揺、攻撃的行動または敵意、不安、抑うつ、方向感覚の喪失、注意力の障害、夢の異常、失血(吃音)、幻覚、不眠症、神経過敏、記憶障害、強迫神経症の症状、落ち着きのなさ、夢遊病、自殺念慮および行動(自殺を含む)、チック、振戦[参照] 囲み警告 、 警告と注意事項 ]
神経系障害 眠気、感覚異常/感覚鈍麻、発作
心疾患 動悸
呼吸器、胸部および縦隔の障害 鼻出血、肺好酸球増加症
胃腸障害 下痢、消化不良、吐き気、膵炎、嘔吐
肝胆道障害 SINGULAIRで治療された患者では、胆汁うっ滞性肝炎、肝細胞性肝障害、および混合型肝障害の症例が報告されています。これらのほとんどは、他の薬の使用などの他の交絡因子との組み合わせで発生したか、アルコール使用や他の形態の肝炎などの肝疾患の潜在的な可能性がある患者に SINGULAIR を投与した場合に発生しました。
皮膚および皮下組織の障害 血管性浮腫、あざ、多形紅斑、結節性紅斑、かゆみ、スティーブンス・ジョンソン症候群/中毒性表皮壊死融解症、蕁麻疹
筋骨格および結合組織障害 関節痛、筋肉痛を含む筋肉痛
腎および泌尿器疾患 子供の夜尿症
全身疾患および投与部位の状態 浮腫
SINGULAIRによる治療を受けている喘息患者は、全身性好酸球増加症を呈することがあり、全身性コルチコステロイド療法で治療されることが多い状態であるChurg-Strauss症候群と一致する血管炎の臨床的特徴を示すこともあります。これらの反応は、経口コルチコステロイド療法の減少と関連している場合があります。医師は、好酸球増加症、血管炎性発疹、肺症状の悪化、心臓の合併症、および/または患者に現れる神経障害に注意する必要があります[参照 警告と注意事項 ]。
薬物相互作用
SINGULAIR 5mg をテオフィリン、プレドニゾン、プレドニゾロン、経口避妊薬、フェキソフェナジン、ジゴキシン、ワルファリン、ゲムフィブロジル、イトラコナゾール、甲状腺ホルモン、鎮静催眠薬、非ステロイド性抗炎症薬、ベンゾジアゼピン、うっ血除去薬、およびチトクローム P450 (CYP) 酵素インデューサー [参照 臨床薬理学 ]。
警告
の一部として含まれています "予防" セクション
予防
神経精神イベント
SINGULAIRの使用により、深刻な神経精神医学的(NP)イベントが報告されています。これらの市販後の報告は非常に多様であり、興奮、攻撃的行動または敵意、不安、抑うつ、見当識障害、注意障害、夢の異常、失血(吃音)、幻覚、不眠症、過敏症、記憶障害、強迫性症状、落ち着きのなさ、夢遊病、自殺念慮および行動(自殺を含む)、チック、振戦。 NP イベントは、精神障害の既往歴の有無にかかわらず、成人、思春期、および小児患者で報告されています。 NPイベントは主にSINGULAIR 10mgの治療中に報告されていますが、SINGULAIR 5mgの中止後に報告されたものもあります.動物研究は、モンテルカストがラットの脳に分布することを示しました[ 臨床薬理学 ];ただし、SINGULAIR関連のNPイベントの根底にあるメカニズムは現在よく理解されていません。入手可能なデータに基づくと、SINGULAIR 10mg の使用による NP イベントの危険因子を特定したり、リスクを定量化することは困難です。
NP 事象のリスクがあるため、一部の患者では、特に疾患の症状が軽度で、代替療法で適切に治療されている場合、SINGULAIR の利点がリスクを上回らない場合があります。代替療法に対する反応が不十分または不耐性のアレルギー性鼻炎患者には、SINGULAIR 4mg の使用を控えてください。 適応症 ]。喘息または運動誘発性気管支収縮の患者では、SINGULAIR を処方する前に利点とリスクを考慮してください。
SINGULAIR を処方する際は、SINGULAIR 10mg の使用の利点とリスクについて患者や介護者と話し合ってください。 SINGULAIRを服用する際には、行動の変化や新たなNP症状に注意するよう、患者および/または介護者に助言してください。行動の変化が観察された場合、または新しい NP 症状または自殺念慮および/または行動が発生した場合は、SINGULAIR 10mg の使用を中止し、直ちに医療提供者に連絡するよう患者に助言してください。多くの場合、SINGULAIR 治療を中止すると症状が改善しました。ただし、SINGULAIRの中止後も症状が持続する場合がありました。したがって、症状が治まるまで監視と支持療法を続けてください。このような事象が発生した場合は、SINGULAIR 10mg による治療を再開することの利点とリスクを再評価してください。
急性喘息
SINGULAIR は、喘息重積症を含む急性喘息発作の気管支痙攣の逆転には使用できません。患者には、適切なレスキュー薬を利用できるようにアドバイスする必要があります。 SINGULAIR 4mgによる治療は、喘息の急性増悪中も継続できます。運動後に喘息が増悪した患者は、短時間作用型の吸入β-アゴニストを救出できるようにしておく必要があります。
コルチコステロイドの併用
吸入コルチコステロイドの用量は、医師の監督下で徐々に減らすことができますが、吸入または経口コルチコステロイドの代わりに SINGULAIR を急激に使用するべきではありません。
アスピリン感受性
既知のアスピリン過敏症の患者は、SINGULAIR を服用している間、アスピリンまたは非ステロイド性抗炎症剤を避け続ける必要があります。 SINGULAIR は、アスピリン過敏症が報告されている喘息患者の気道機能の改善に有効ですが、アスピリン過敏症患者のアスピリンやその他の非ステロイド性抗炎症薬に対する気管支収縮反応を遮断することは示されていません [参照 臨床研究 ]。
好酸球性疾患
SINGULAIRによる治療を受けている喘息患者は、全身性好酸球増加症を呈することがあり、全身性コルチコステロイド療法で治療されることが多い状態であるChurg-Strauss症候群と一致する血管炎の臨床的特徴を示すこともあります。これらのイベントは、経口コルチコステロイド療法の減少と関連している場合があります。医師は、好酸球増加症、血管炎性発疹、肺症状の悪化、心臓の合併症、および/または患者に現れる神経障害に注意する必要があります。 SINGULAIR 10mg とこれらの基礎疾患との因果関係は確立されていません。 有害反応 ]。
フェニルケトン尿症患者のリスク
SINGULAIR 4mgには、フェニルアラニンの供給源であるアスパルテームが含まれています。フェニルアラニンは、フェニルケトン尿症 (PKU) の患者に有害な場合があります。各 4 mg および 5 mg のチュアブル タブレットには、それぞれ 0.674 mg および 0.842 mg のフェニルアラニンが含まれています。 PKU 患者に SINGULAIR を処方する前に、SINGULAIR を含むすべての供給源からのフェニルアラニンの合計 1 日量を考慮してください。
患者相談情報
錠剤およびチュアブル錠については、患者および/または介護者に FDA 承認の患者ラベル ( 投薬ガイド )。
経口顆粒については、患者および/または介護者に、FDA 承認の患者ラベル ( 投薬ガイドと使用説明書 )。
- SINGULAIRの使用による重篤な精神神経症状および行動変化の潜在的リスクについて患者に助言する[参照 警告と注意事項 ]。
- SINGULAIR を処方する場合、または治療を継続する場合は、SINGULAIR の利点とリスクについて患者と話し合ってください [参照 警告と注意事項 ]。
- SINGULAIRを服用している患者の行動または神経精神症状の変化を監視するよう患者に助言する[参照 警告と注意事項 ]。
- 患者に典型的ではない行動または思考の変化が生じた場合、または患者が自殺念慮または自殺行動を起こした場合は、SINGULAIR を中止し、直ちに医療提供者に連絡するよう患者に指示します [参照]。 警告と注意事項 ]。
- 無症状の場合や喘息が悪化している場合でも、処方どおりに毎日 SINGULAIR を服用し、喘息が十分にコントロールされていない場合は医師に連絡するよう患者にアドバイスしてください。
- 経口SINGULAIRは急性喘息発作の治療には使用できないことを患者に伝えてください。彼らは、喘息の増悪を治療するために利用可能な適切な短時間作用型吸入β-アゴニスト薬を持っているべきです.運動後に喘息が増悪した患者には、短時間作用型の吸入β-アゴニストを救助できるように指示する必要があります。喘息の慢性治療のための SINGULAIR の連日投与は、EIB の急性エピソードを予防するために確立されていません。 警告と注意事項 ]。
- 短時間作用型吸入気管支拡張薬が通常よりも頻繁に必要な場合、または 24 時間に処方された短時間作用型気管支拡張薬治療の最大吸入回数を超えて必要な場合は、医師の診察を受けるよう患者に助言してください。
- 医師の指示がない限り、処方された他の抗喘息薬を継続するように患者に指示してください。
- 既知のアスピリン過敏症の患者には、SINGULAIR の服用中はアスピリンまたは非ステロイド性抗炎症薬を避け続けるように指導してください [ 警告と注意事項 ]。
- フェニルケトン尿症の患者には、4 mg および 5 mg のチュアブル錠にフェニルアラニン (アスパルテームの供給源) が含まれていることを伝えてください [ 警告と注意事項 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
Sprague-Dawley ラットでの 2 年間またはマウスでの 92 週間の発がん性試験で、それぞれ最大 200 mg/kg/日または 100 mg/kg/日までの経口強制経口投与で、腫瘍形成性の証拠は見られませんでした。ラットの推定曝露量は、1 日最大推奨経口用量で、成人および小児の AUC のそれぞれ約 120 倍および 75 倍でした。マウスの推定曝露量は、1 日最大推奨経口用量で、成人および小児の AUC のそれぞれ約 45 倍および 25 倍でした。
モンテルカストは、次のアッセイで変異原性または染色体異常誘発活性の証拠を示さなかった: 微生物変異誘発アッセイ、V-79 哺乳類細胞変異誘発アッセイ、ラット肝細胞でのアルカリ溶出アッセイ、チャイニーズハムスター卵巣細胞での染色体異常アッセイ、および生体内マウス骨髄染色体異常アッセイ。
メスのラットでの受胎能研究では、モンテルカストは 200 mg/kg の経口用量で受精率と繁殖力指数の低下をもたらしました (推定暴露量は、推奨される最大 1 日経口投与量で成人の AUC の約 70 倍でした)。 100 mg/kg の経口用量では、女性の受胎能または繁殖力に対する影響は観察されませんでした (推定暴露量は、1 日最大推奨経口用量での成人の AUC の約 20 倍でした)。モンテルカストは、最大 800 mg/kg の経口用量で雄ラットの生殖能力に影響を与えませんでした (推定暴露量は、最大推奨 1 日経口用量で成人の AUC の約 160 倍でした)。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性におけるモンテルカストの使用に関する数十年にわたる公表された前向きおよび後ろ向きのコホート研究から入手可能なデータは、主要な先天性欠損症の薬物関連リスクを確立していない[参照 データ ]。動物の繁殖研究では、器官形成期の妊娠中のラットとウサギにモンテルカストを経口投与した場合、AUC に基づくヒトの最大推奨 1 日経口投与量 (MRHDOD) のそれぞれ約 100 倍と 110 倍の用量で、発達への悪影響は観察されませんでした。 データ ]。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。の中に
米国の一般集団では、臨床的に認識された妊娠における主要な先天異常および流産の推定バックグラウンド リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の喘息のコントロールが不十分または中等度であると、子癇前症および乳児の未熟児、低出生体重、在胎週数の割に小さいなどの周産期の有害転帰の母体リスクが増加します。
データ
ヒューマンデータ
前向きおよび後ろ向きのコホート研究から発表されたデータでは、妊娠中の SINGULAIR の使用と主要な先天性欠損症との関連は確認されていません。利用可能な研究には、サンプルサイズが小さい、場合によってはレトロスペクティブなデータ収集、対照群の一貫性がないなど、方法論的な制限があります。
動物データ
胚・胎児発生研究では、器官形成期(ラットでは妊娠 6 ~ 17 日、ウサギでは妊娠 6 ~ 18 日)に妊娠したラットとウサギに投与されたモンテルカストは、400 および 300 mg/kg までの母体経口用量で、いかなる有害な発達効果も引き起こさなかった。 /日、それぞれラットとウサギで (それぞれ MRHDOD でのヒトの AUC の約 100 倍と 110 倍)。
授乳
リスクの概要
公開された臨床授乳研究では、母乳中のモンテルカストの存在が報告されています。乳児に対する薬物の効果に関する入手可能なデータは、直接[参照] 小児用 または母乳を通じて、SINGULAIR への暴露による有害反応の重大なリスクを示唆していません。牛乳生産に対する薬剤の影響は不明です。母乳育児の発達上および健康上の利点は、母親のSINGULAIR 5mgの臨床的必要性、およびSINGULAIR 10mgまたは基礎となる母体の状態から母乳で育てられた乳児に対する潜在的な有害反応とともに考慮されるべきです.
小児用
喘息に対する SINGULAIR の安全性と有効性は、6 歳から 14 歳の小児患者で確立されています。この適応症に対するSINGULAIR 4mgの使用は、十分に管理された研究から得られた証拠によって裏付けられています。この年齢層における安全性と有効性のデータは、成人で見られるものと同様です [参照 有害反応 、 臨床薬理学 、 特定の集団 、 と 臨床研究 ]。
歳から 14 歳の小児患者の季節性アレルギー性鼻炎の治療、および生後 6 か月から 14 歳の小児患者の通年性アレルギー性鼻炎の治療に対する SINGULAIR の有効性は確立されており、実証された有効性からの外挿によって裏付けられています。アレルギー性鼻炎の 15 歳以上の患者において、疾患の経過、病態生理学、および薬剤の効果がこれらの集団間で実質的に類似しているという仮定。
2 歳から 5 歳の喘息の小児患者における SINGULAIR 4 mg チュアブル錠の安全性は、十分に管理された適切なデータによって実証されています [参照 有害反応 ]。この年齢層における SINGULAIR 5mg の有効性は、6 歳以上の喘息患者で実証された有効性から外挿され、同様の薬物動態データ、ならびに疾患の経過、病態生理学および薬剤の効果が実質的に類似しているという仮定に基づいています。これらの集団の間で。この年齢層における有効性は、2 歳から 5 歳の患者を対象に実施された、十分に管理された大規模な安全性試験の探索的有効性評価によって裏付けられています。
生後 12 ~ 23 か月の喘息の小児患者における SINGULAIR 4 mg 経口顆粒の安全性は、172 人の小児患者の分析で実証されており、そのうち 124 人が SINGULAIR で治療され、6 週間の二重盲検プラセボ試験が行われました。対照研究 [参照 有害反応 ]。この年齢層におけるSINGULAIRの有効性は、同様の平均全身曝露量(AUC)に基づいて、6歳以上の喘息患者で実証された有効性から外挿され、疾患経過、病態生理学、および薬の効果はこれらの集団間で実質的に類似している. 、有効性が探索的評価であった安全性試験からの有効性データによって裏付けられています。
アレルギー性鼻炎の 2 歳から 14 歳の小児患者における SINGULAIR 4 mg および 5 mg チュアブル錠の安全性は、2 歳から 14 歳の喘息の小児患者で実施された研究のデータによって裏付けられています。 2 歳から 14 歳の季節性アレルギー性鼻炎の小児患者を対象とした安全性研究では、同様の安全性プロファイルが示されました [ 有害反応 ]。通年性アレルギー性鼻炎の生後 6 か月の小児患者における SINGULAIR 4 mg 経口顆粒の安全性は、喘息の生後 6 か月から 23 か月の小児患者で実施された研究から得られた安全性データおよび薬物動態データからの外挿によって裏付けられています。生後 6 か月から 23 か月の患者の全身曝露と成人の全身曝露の比較。
生後 12 か月未満の喘息患者、6 か月の通年性アレルギー性鼻炎患者、6 歳未満の運動誘発性気管支収縮患者における安全性と有効性は確立されていません。
小児患者の成長率
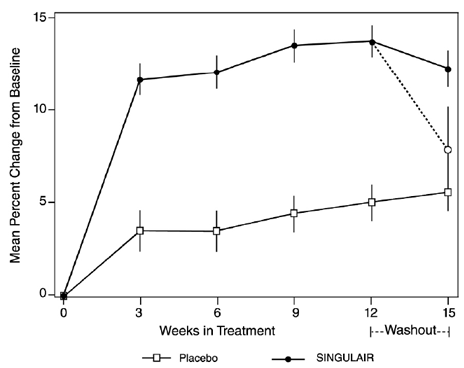
6~8歳の軽度喘息患者360名の成長率に対するSINGULAIR 4mgの効果を評価するために、56週間の多施設二重盲検無作為化実薬対照およびプラセボ対照並行群間試験が実施されました。治療グループには、SINGULAIR 5 mg 1 日 1 回、プラセボ、スペーサー装置を使用して 168 mcg を 1 日 2 回投与するジプロピオン酸ベクロメタゾンが含まれていました。各被験者の成長率は、56 週間にわたる身長測定値に適合する線形回帰直線の傾きとして定義されました。主な比較は、SINGULAIR 群とプラセボ群の成長率の差でした。 SINGULAIR、プラセボ、およびベクロメタゾン治療群の最小二乗 (LS) 平均 (95% CI) (cm/年) として表される成長率は、5.67 (5.46、5.88)、5.64 (5.42、5.86)、および 4.86 ( 4.64、5.08)、それぞれ。 SINGULAIR 5mg からプラセボ、ベクロメタゾンからプラセボ、および SINGULAIR 5mg からベクロメタゾンを投与した群の最小二乗 (LS) 平均 (95% CI) (cm/年) で表される成長率の差は 0.03 (-0.26, 0.31) でした。 、-0.78 (-1.06、-0.49);および 0.81 (0.53、1.09)、それぞれ。各治療グループの成長率(経時的な身長の平均変化として表される)を図1に示します。
図 1: 予定された週ごとの無作為化来院からの身長 (cm) の変化 (治療群の平均値 ± 平均値の標準誤差*)
高齢者の使用
モンテルカストの臨床試験の全被験者数のうち、65 歳以上が 3.5%、75 歳以上が 0.4% でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.モンテルカストの 10 mg 単回経口投与の薬物動態プロファイルと経口バイオアベイラビリティは、高齢者と若年成人で類似しています。モンテルカストの血漿半減期は、高齢者ではわずかに長くなります。高齢者の用量調整は必要ありません。
肝障害
軽度から中等度の肝不全の患者では、用量調整は推奨されない[参照 臨床薬理学 ]。
腎障害
腎不全の患者には投与量の調整は推奨されない[参照 臨床薬理学 ]。
過剰摂取
SINGULAIRによる過剰摂取の治療に関する具体的な情報はありません.過剰摂取の場合は、通常の支持手段を採用するのが合理的です。例えば、吸収されなかった物質を胃腸管から取り除き、臨床モニタリングを採用し、必要に応じて支持療法を開始します。モンテルカストが腹膜透析または血液透析のどちらによって除去されるかは不明です。
禁忌
SINGULAIR は、その成分のいずれかに過敏症のある患者には禁忌です。
臨床薬理学
作用機序
システイニル ロイコトリエン (LTC4、LTD4、LTE4) は、アラキドン酸代謝の産物であり、マスト細胞や好酸球を含むさまざまな細胞から放出されます。これらのエイコサノイドは、システイニル ロイコトリエン (CysLT) 受容体に結合します。 CysLT type-1 (CysLT1) 受容体は、ヒトの気道 (気道平滑筋細胞および気道マクロファージを含む) および他の炎症誘発性細胞 (好酸球および特定の骨髄幹細胞を含む) に見られます。 CysLT は、喘息およびアレルギー性鼻炎の病態生理と相関しています。喘息では、ロイコトリエンが介在する影響には、気道浮腫、平滑筋収縮、および炎症過程に関連する細胞活動の変化が含まれます。アレルギー性鼻炎では、CysLT は初期および後期反応の両方でアレルゲンに曝露された後に鼻粘膜から放出され、アレルギー性鼻炎の症状に関連しています。
モンテルカストは、CysLT1受容体に高い親和性と選択性で結合する経口活性化合物です(プロスタノイド、コリン作動性、またはβ-アドレナリン受容体などの他の薬理学的に重要な気道受容体に優先して)。モンテルカストは、アゴニスト活性なしに、CysLT1 受容体で LTD4 の生理学的作用を阻害します。
薬力学
モンテルカストは、喘息患者における吸入LTD4による気管支収縮を阻害する能力によって示されるように、気道システイニルロイコトリエン受容体の阻害を引き起こします。 5 mg という低用量でも、LTD4 による気管支収縮が実質的に遮断されます。プラセボ対照のクロスオーバー試験(n=12)では、SINGULAIR 4mgは、抗原チャレンジによる初期および後期の気管支収縮をそれぞれ75%および57%抑制しました。
末梢血中の好酸球に対するSINGULAIR 5mgの効果は、臨床試験で調べられました。 SINGULAIR 10mg を投与された 2 歳以上の喘息患者では、二重盲検治療期間中、プラセボと比較して平均末梢血好酸球数が 9% から 15% 減少したことが認められました。 SINGULAIR 4mgを投与された15歳以上の季節性アレルギー性鼻炎患者では、末梢血好酸球数が平均0.2%増加したのに対し、プラセボ投与患者では二重盲検治療より平均12.5%増加しました。期間;これは、SINGULAIR に有利な 12.3% の平均差を反映しています。これらの観察結果と、臨床試験で指摘されたモンテルカストの臨床的利点との関係は不明です[参照 臨床研究 ]。
薬物動態
吸収
モンテルカストは、経口投与後に急速に吸収されます。 10 mg フィルムコーティング錠を絶食した成人に投与した後、モンテルカスト血漿濃度の平均ピーク値 (Cmax) は 3 ~ 4 時間 (Tmax) で達成されます。平均経口バイオアベイラビリティは 64% です。経口バイオアベイラビリティと Cmax は、朝の標準的な食事の影響を受けません。
チュアブル錠 5mg の場合、成人空腹時投与後 2~2.5 時間で平均 Cmax に到達する。平均経口バイオアベイラビリティは、朝の標準的な食事と一緒に投与した場合の 63% に対して、絶食状態で 73% です。
4 mg チュアブル錠の場合、空腹状態の 2 ~ 5 歳の小児患者では、投与後 2 時間で平均 Cmax に達します。
mg の経口顆粒製剤は、絶食状態で成人に投与した場合、4 mg のチュアブル錠と生物学的に同等です。経口顆粒製剤とアップルソースの同時投与は、モンテルカストの薬物動態に臨床的に有意な影響を与えませんでした。朝の高脂肪食は、モンテルカスト経口顆粒の AUC に影響を与えませんでした。しかし、この食事は Cmax を 35% 減少させ、Tmax を 2.3 ± 1.0 時間から 6.4 ± 2.9 時間に延長しました。
喘息患者におけるSINGULAIRの安全性と有効性は、食物摂取の時間に関係なく、10mgのフィルムコーティング錠と5mgのチュアブル錠製剤を夕方に投与した臨床試験で実証されました。喘息患者におけるSINGULAIR 4mgの安全性は、4mgのチュアブル錠と4mgの経口顆粒製剤を食事の摂取時間に関係なく夕方に投与した臨床試験でも実証されました。季節性アレルギー性鼻炎患者におけるシングレアの安全性と有効性は、食物摂取の時間に関係なく、フィルムコーティング錠 10 mg を朝または夕方に投与した臨床試験で実証されました。
2 つの 5 mg チュアブル錠と 10 mg フィルムコーティング錠 1 つとして投与した場合のモンテルカストの薬物動態の比較は評価されていません。
分布
モンテルカストは 99% 以上が血漿タンパク質に結合しています。モンテルカストの定常状態の分布量は、平均して 8 ~ 11 リットルです。経口投与されたモンテルカストは、ラットの脳に分布します。
排除
モンテルカストの血漿クリアランスは、健康な成人で平均 45 mL/min です。放射性標識モンテルカストの経口投与後、放射能の 86% が 5 日間の糞便で回収され、
いくつかの研究では、モンテルカストの平均血漿半減期は、健康な若年成人で 2.7 ~ 5.5 時間の範囲でした。モンテルカストの薬物動態は、50 mg までの経口投与量でほぼ線形です。モンテルカスト 10 mg の 1 日 1 回投与中、血漿中の親薬物の蓄積はほとんどありません (14%)。
代謝
モンテルカストは広範囲に代謝されます。治療用量を用いた研究では、モンテルカストの代謝産物の血漿濃度は、成人および小児患者の定常状態では検出できません。
ヒト肝ミクロソームを使用した in vitro 研究では、CYP3A4、2C8、および 2C9 がモンテルカストの代謝に関与していることが示されています。臨床的に適切な濃度では、2C8 はモンテルカストの代謝に主要な役割を果たしているようです。
特定の集団
肝障害のある患者
軽度から中等度の肝不全および肝硬変の臨床的証拠を有する患者は、モンテルカストの代謝低下の証拠があり、10 mg の単回投与後の平均モンテルカスト AUC が 41% (90% CI=7%、85%) 高くなりました。モンテルカストの消失は、健常者に比べてわずかに長引いた(平均半減期 7.4 時間)。軽度から中等度の肝不全患者では、用量調整は必要ありません。より重度の肝障害または肝炎患者におけるSINGULAIRの薬物動態は評価されていません。
腎障害のある患者
モンテルカストとその代謝物は尿中に排泄されないため、モンテルカストの薬物動態は腎不全患者では評価されませんでした。これらの患者には用量調整は推奨されません。
男性と女性の患者
モンテルカストの薬物動態は、男性と女性で類似しています。
人種グループ
人種による薬物動態の違いは研究されていません。
青少年および小児患者
薬物動態研究では、生後 6 ~ 23 か月の小児患者における 4 mg 経口顆粒製剤、2 ~ 5 歳の小児患者における 4 mg チュアブル錠、小児患者における 5 mg チュアブル錠の全身曝露が評価されました 6。 14 歳まで、および 15 歳以上の若年成人および青年の 10 mg フィルムコーティング錠。
10 mg フィルムコーティング錠の投与後のモンテルカストの血漿中濃度プロファイルは、15 歳以上の青少年と若年成人で類似しています。 10mgフィルムコーティング錠は、15歳以上の患者さんへの使用が推奨されています。
2 歳から 5 歳の小児患者における 4 mg チュアブル錠の平均全身暴露と、6 歳から 14 歳の小児患者における 5 mg チュアブル錠剤の平均全身暴露は、10 mg フィルムの平均全身暴露に類似しています。成人のコーティング錠。 5 mg のチュアブル錠は 6 ~ 14 歳の小児患者に使用し、4 mg のチュアブル錠は 2 ~ 5 歳の小児患者に使用する必要があります。
生後 6 ~ 11 か月の小児では、モンテルカストへの全身暴露および血漿モンテルカスト濃度の変動性は、成人で観察されたものよりも高かった。集団分析に基づくと、平均 AUC (4296 ng•hr/mL [範囲 1200 ~ 7153]) は 60% 高く、平均 Cmax (667 ng/mL [範囲 201 ~ 1058]) は 89% 高かった。成人 (平均 AUC 2689 ng•hr/mL [範囲 1521 ~ 4595]) および平均 Cmax (353 ng/mL [範囲 180 ~ 548])。生後 12 ~ 23 か月の小児の全身暴露は、変動が少なかったものの、成人で観察されたものよりも依然として高かった.平均 AUC (3574 ng•hr/mL [範囲 2229 ~ 5408]) は 33% 高く、平均 Cmax (562 ng/mL [範囲 296 ~ 814]) は成人で観察された値より 60% 高かった。 6 から 23 ヶ月齢の 26 人の子供を対象とした単回投与の薬物動態研究におけるモンテルカストの安全性と忍容性は、2 歳以上の患者と同様でした [参照 有害反応 ]。 4 mg 経口顆粒製剤は、喘息の治療では生後 12 ~ 23 カ月の小児患者、通年性アレルギー性鼻炎の治療では生後 6 ~ 23 カ月の小児患者に使用する必要があります。 4mg経口顆粒製剤は、4mgチュアブル錠と生物学的に同等であるため、2~5歳の小児患者においても4mgチュアブル錠の代替製剤として使用することができます。
薬物相互作用研究
テオフィリン、プレドニゾン、プレドニゾロン
SINGULAIRは、喘息の予防および慢性治療に日常的に使用されている他の治療法と併用して投与されており、明らかな副作用の増加はありません.薬物相互作用研究では、モンテルカストの推奨臨床用量は、テオフィリン、プレドニゾン、およびプレドニゾロンの薬物動態に臨床的に重要な影響を与えませんでした。
薬物動態が定常状態になるまで 10 mg を 1 日 1 回投与したモンテルカストは、テオフィリン [主にシトクロム P450 (CYP) 1A2 基質] の単回静脈内投与の動態に臨床的に有意な変化を引き起こしませんでした。薬物動態が定常状態になるまで 1 日 100 mg 以上の用量のモンテルカストは、経口プレドニゾンまたは静脈内プレドニゾロンのいずれかの投与後に、プレドニゾンまたはプレドニゾロンの血漿プロファイルに臨床的に有意な変化を引き起こしませんでした。
経口避妊薬、フェキソフェナジン、ジゴキシン、ワルファリン
薬物相互作用研究では、モンテルカストの推奨臨床用量は、経口避妊薬(ノルエチンドロン 1 mg/エチニルエストラジオール 35 mcg)、ジゴキシン、およびワルファリンの薬物動態に臨床的に重要な影響を与えませんでした。薬物動態が定常状態になるまで 1 日 100 mg 以上の用量のモンテルカストは、ノルエチンドロン 1 mg/エチニルエストラジオール 35 mcg を含む経口避妊薬のいずれの成分の血漿濃度も有意に変化させませんでした。薬物動態の定常状態に 1 日 1 回 10 mg の用量で投与されたモンテルカストは、フェキソフェナジンの血漿濃度プロファイルを変化させず、免疫反応性ジゴキシンの薬物動態プロファイルまたは尿中排泄を変化させませんでした。は、ワルファリン (主に CYP2C9、3A4、および 1A2 の基質) の薬物動態プロファイルを変更せず、プロトロンビン時間または国際正規化比 (INR) に対するワルファリンの単回 30 mg 経口投与の効果に影響を与えませんでした。
甲状腺ホルモン、鎮静催眠薬、非ステロイド性抗炎症薬、ベンゾジアゼピン、うっ血除去薬
追加の特定の相互作用研究は実施されていませんが、SINGULAIR は、臨床研究で一般的に処方されているさまざまな薬物と併用して使用されましたが、臨床的な有害相互作用の証拠はありませんでした。これらの薬には、甲状腺ホルモン、鎮静催眠薬、非ステロイド性抗炎症薬、ベンゾジアゼピン、うっ血除去薬が含まれていました。
シトクロム P450 (CYP) 酵素インデューサー
肝代謝を誘導するフェノバルビタールは、モンテルカストの 10 mg 単回投与後、モンテルカストの血漿濃度曲線下面積 (AUC) を約 40% 減少させました。 SINGULAIR の投与量調整は推奨されません。フェノバルビタールやリファンピンなどの強力な CYP 酵素誘導剤が SINGULAIR と併用投与されている場合は、適切な臨床モニタリングを採用することが合理的です。
シトクロム P450 (CYP) 酵素に対するモンテルカストの効果
モンテルカストは、in vitro で CYP2C8 の強力な阻害剤です。しかし、12人の健康な個人におけるモンテルカストとロシグリタゾン(主にCYP2C8によって代謝される薬物を代表するプローブ基質)を含む臨床薬物間相互作用研究からのデータは、薬物が同時投与されたときにロシグリタゾンの薬物動態が変化しないことを実証し、モンテルカストがin vivo で CYP2C8 を阻害しません。したがって、モンテルカストは、この酵素によって代謝される薬物(パクリタキセル、ロシグリタゾン、レパグリニドなど)の代謝を変化させるとは予想されていません。ヒト肝ミクロソームにおけるさらなる in vitro の結果に基づいて、モンテルカストの治療血漿濃度は CYP 3A4、2C9、1A2、2A6、2C19、または 2D6 を阻害しません。
シトクロム P450 (CYP) 酵素阻害剤
in vitro 研究では、モンテルカストが CYP 2C8、2C9、および 3A4 の基質であることが示されています。モンテルカストと強力な CYP 3A4 阻害剤であるイトラコナゾールとの同時投与では、モンテルカストの全身暴露に有意な増加は見られませんでした。モンテルカストとゲムフィブロジル (CYP 2C8 と 2C9 の両方の阻害剤) を含む臨床薬物相互作用研究のデータは、治療用量のゲムフィブロジルがモンテルカストの全身曝露を 4.4 倍増加させることを示しました。イトラコナゾール、ゲムフィブロジル、およびモンテルカストの同時投与は、モンテルカストの全身暴露をさらに増加させませんでした。利用可能な臨床経験に基づくと、ゲムフィブロジルとの同時投与時にモンテルカストの用量調整は必要ありません。 過剰摂取 ]。
臨床研究
喘息
15 歳以上の成人および青年の喘息患者
15 歳以上の成人および青年を対象とした臨床試験では、1 日 1 回 10 mg を超えるモンテルカストの用量に追加の臨床的利益がないことが示されました。
15 歳以上の成人および青年の喘息の慢性治療に対する SINGULAIR の有効性は、1,576 人の患者を対象とした、同様に設計された 12 週間の無作為化二重盲検プラセボ対照試験 2 件 (米国および多国籍企業) で実証されました ( 795 人が SINGULAIR で治療され、530 人がプラセボで治療され、251 人が実薬で治療された)。年齢の中央値は 33 歳 (範囲 15 から 85 歳) でした。 56.8% が女性で、43.2% が男性でした。これらの研究における民族/人種分布は、71.6% 白人、17.7% ヒスパニック系、7.2% 他の起源、3.5% 黒人でした。患者は軽度または中等度の喘息を患っており、非喫煙者であり、「必要に応じて」1 日あたり約 5 パフのβ-アゴニストの吸入が必要でした。患者の 1 秒間の予測強制呼気量 (FEV1) の平均ベースライン パーセントは 66% (おおよその範囲、40 ~ 90%) でした。これらの試験の主要評価項目は、FEV1 と日中の喘息症状でした。両方の研究で、12 週間後に SINGULAIR 5mg を投与された患者の無作為なサブセットが、潜在的なリバウンド効果を評価するために、さらに 3 週間の二重盲検治療のためにプラセボに切り替えられました。
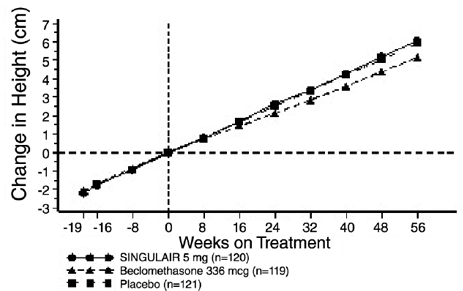
主要評価項目である朝の FEV1 に関する米国での試験の結果は、12 週間の治療期間にわたって平均化されたベースラインからの平均変化率として表され、図 2 に示されています。夕方には、ベースラインからのFEV1パーセント変化が統計的に有意に増加しました(SINGULAIR 4mgで治療されたグループで13.0%の変化対プラセボグループで4.2%の変化、p
図 2: ベースラインからの FEV1 平均変化率 (米国試験: SINGULAIR 5mg N=406; プラセボ N=270) (ANOVA モデル)
多国籍研究で代表される、その他の主要評価項目および副次評価項目に対する SINGULAIR 5mg の効果を表 6 に示します。これらの評価項目に対する結果は、米国の研究でも同様でした。
どちらの研究でも、喘息発作(予定外の診療所、緊急治療室、病院への訪問などの医療資源の利用、または経口、静脈内、またはコルチコステロイドの筋肉内投与)、および喘息救助のための経口コルチコステロイドの使用。多国籍研究では、SINGULAIR を使用した患者では、プラセボを使用した患者と比較して喘息発作を起こした患者が有意に少なかった (患者の 15.6%) (27.3%、p
作用の発現と効果の持続
成人を対象とした各プラセボ対照試験において、SINGULAIR 4mgの治療効果は、症状スコア、「必要に応じた」β-アゴニストの使用、およびPEFR測定を含む毎日の日誌カードパラメーターによって測定され、初回投与後に達成され、維持されました投与間隔全体 (24 時間)。最長 1 年間の非プラセボ対照延長試験では、1 日 1 回の連続夜間投与中に治療効果に有意な変化は観察されませんでした。喘息患者がSINGULAIR 4mgを12週間連続使用した後に中止しても、喘息のリバウンド悪化は起こらなかった.
6~14歳の喘息の小児患者
6歳から14歳の小児患者におけるSINGULAIR 5mgの有効性は、吸入β刺激薬を使用した336人の患者(SINGULAIRで治療された201人およびプラセボで治療された135人)を対象とした8週間の二重盲検プラセボ対照試験で実証されました。 「必要に応じて」ベースで。患者の平均ベースライン予測 FEV1 パーセントは 72% (おおよその範囲、45 ~ 90%) であり、アルブテロールの 3.4 パフの 1 日平均吸入 β アゴニスト要件がありました。患者の約 36% が吸入コルチコステロイドを使用していました。年齢の中央値は 11 歳 (範囲は 6 から 15 歳) でした。 35.4% が女性で、64.6% が男性でした。この研究における民族/人種の分布は、白人が 80.1%、黒人が 12.8%、ヒスパニック系が 4.5%、その他の出身が 2.7% でした。
プラセボと比較して、5 mg の SINGULAIR 4 mg チュアブル錠を 1 日 1 回服用すると、朝の平均 FEV1 のベースラインからの変化率が大幅に改善されました (SINGULAIR 4 mg で治療したグループでは 8.7%、プラセボ グループではベースラインから 4.2% の変化、 p
成人試験と同様に、プラセボ群を併用しない非盲検延長試験では、1 日 1 回の連続投与で最大 6 か月間、治療効果に有意な変化は観察されませんでした。
2~5歳の喘息の小児患者
2 歳から 5 歳の小児患者の喘息の慢性治療に対する SINGULAIR の有効性は、689 人の患者を対象とした 12 週間のプラセボ対照安全性および忍容性試験で調査され、そのうち 461 人が SINGULAIR で治療されました。年齢の中央値は 4 歳 (範囲 2 から 6) でした。 41.5% が女性で、58.5% が男性でした。この研究における民族/人種の分布は、56.5% 白人、20.9% ヒスパニック系、14.4% 他の起源、および 8.3% 黒人でした。
主な目的は、この年齢層におけるSINGULAIR 10mgの安全性と忍容性を判断することでしたが、この研究には、日中および夜間の喘息症状スコア、β-アゴニストの使用、経口コルチコステロイドレスキュー、および医師の全体的な評価を含む探索的有効性評価が含まれていました.これらの探索的有効性評価の結果は、薬物動態および高齢患者の有効性データの外挿とともに、SINGULAIR が 2 歳から 5 歳の患者の喘息の維持治療に有効であるという全体的な結論を裏付けています。
併用吸入コルチコステロイドに対する患者の効果
成人を対象とした別の試験では、SINGULAIR 10mg が吸入コルチコステロイドの臨床効果を増強し、併用時に吸入コルチコステロイドの漸減を可能にする能力が評価されました。
つの無作為化プラセボ対照並行群試験 (n=226) では、平均 FEV1 が予測値の約 84% で、以前にさまざまな吸入コルチコステロイド (定量エアロゾルまたは乾燥粉末吸入器によって送達) で維持されていた、安定した喘息の成人が登録されました。 )。年齢の中央値は 41.5 歳 (範囲 16 から 70) でした。 52.2% が女性で、47.8% が男性でした。この研究における民族/人種の分布は、92.0% 白人、3.5% 黒人、2.2% ヒスパニック系、2.2% アジア人でした。吸入コルチコステロイドの種類とそれらの平均ベースライン必要量には、ジプロピオン酸ベクロメタゾン (平均用量、1203 mcg/日)、トリアムシノロン アセトニド (平均用量、2004 mcg/日)、フルニソリド (平均用量、1971 mcg/日)、プロピオン酸フルチカゾン (平均用量、1971 mcg/日) が含まれます。用量、1083 mcg/日)、またはブデソニド (平均用量、1192 mcg/日)。これらの吸入コルチコステロイドの一部は、米国で承認されていない製剤であり、表現された用量は元アクチュエータではない可能性があります.研究前の吸入コルチコステロイドの必要量は、最低有効吸入コルチコステロイド用量に向けて患者を滴定するように設計された 5 ~ 7 週間のプラセボ導入期間中に約 37% 減少しました。 SINGULAIR 4mg による治療では、12 週間の実薬治療期間において、プラセボ群の平均 30% の減少と比較して、平均吸入コルチコステロイド用量がさらに 47% 減少しました (p≤0.05)。この研究の結果が、高用量の吸入コルチコステロイドまたは全身性コルチコステロイドを必要とする喘息患者に一般化できるかどうかは不明です。
別の無作為化プラセボ対照並行群間試験 (n=642) では、以前に吸入コルチコステロイド (ベクロメタゾン 336 mcg/日) を維持していたが十分に制御されていなかった同様の成人患者集団を対象に、ベクロメタゾンに SINGULAIR を追加した結果、 16 週間の盲検治療期間の最後の 10 週間で、ベクロメタゾンのみを継続した患者、またはベクロメタゾンを中止してモンテルカストまたはプラセボのみで治療した患者と比較して、統計的に有意な FEV1 の改善が見られました。ベクロメタゾンを含む治療群に無作為に割り付けられた患者は、FEV1、日中の喘息症状、PEFR、喘息による夜間の覚醒、および「必要に応じて」βアゴニストの要件。
アスピリン過敏症が報告されている喘息の成人患者で、ほぼ全員が吸入および/または経口コルチコステロイドを併用していた4週間の無作為化並行群間試験(n=80)では、プラセボと比較してSINGULAIR 10mgが喘息コントロールのパラメータが大幅に改善されました。アスピリン感受性患者におけるSINGULAIR 4mgの効果の大きさは、調査対象の喘息患者の一般集団で観察された効果と同様でした。アスピリン感受性の喘息患者におけるアスピリンまたはその他の非ステロイド性抗炎症薬に対する気管支収縮反応に対する SINGULAIR の効果は評価されていません。 警告と注意事項 ]。
運動誘発性気管支収縮 (EIB)
運動誘発性気管支収縮(6歳以上の成人、青年、および小児患者)
SINGULAIR 5mg、10mg を運動の 2 時間前に単回投与した場合の EIB 予防効果が、3 つの無作為化二重盲検プラセボ対照クロスオーバー研究 (米国および多国籍) で調査されました。 15 歳以上の EIB の成人および青年患者 160 人。試験薬(SINGULAIR 10mgまたはプラセボ)の単回投与後、2時間、8.5時間または12時間、および24時間後に運動負荷試験を行った。主要評価項目は、3 つの研究すべて (研究 A、研究 B、および研究 C) における、投与後 2 時間の運動負荷後の FEV1 の平均最大低下率でした。研究 A では、SINGULAIR 10 mg の単回投与は、運動の 2 時間前に服用した場合、EIB に対して統計的に有意な保護効果を示しました。一部の患者は、投与後 8.5 時間および 24 時間で EIB から保護されました。しかし、一部の患者はそうではありませんでした。研究 A の各時点での平均最大落下率の結果を表 7 に示し、他の 2 つの研究の結果を代表しています。
SINGULAIR 5mg チュアブル錠を、運動の 2 時間前に単回投与して EIB を予防した場合の有効性は、合計 64 人の小児患者を対象とした多国籍無作為化二重盲検プラセボ対照クロスオーバー研究で調査されました。 6歳から14歳のEIB患者。運動負荷試験は、治験薬(SINGULAIR 5 mgまたはプラセボ)の単回投与の2時間後および24時間後に実施されました。主要評価項目は、投与後 2 時間の運動負荷後の FEV1 の平均最大低下率でした。 SINGULAIR 5 mg の単回投与は、運動の 2 時間前に服用した場合、EIB に対して統計的に有意な保護効果を示しました (表 8)。同様の結果が、投与後 24 時間 (二次エンドポイント) で示されました。一部の患者は、投与後 24 時間で EIB から保護されました。しかし、一部の患者はそうではありませんでした。投与後 2 時間から 24 時間の間の時点は評価されませんでした。
6歳未満の患者におけるEIBの予防に対するSINGULAIR 5mgの有効性は確立されていません。
喘息の慢性治療のための SINGULAIR 4mg の毎日の投与は、EIB の急性エピソードを予防するために確立されていません。
15 歳以上の成人および思春期の喘息患者 110 人を対象とした 12 週間の無作為化二重盲検並行群間研究では、予測値の平均ベースライン FEV1 パーセントが 83% で、運動による喘息の悪化が記録されています。 SINGULAIR 10 mg を 1 日 1 回夕方に服用すると、FEV1 の平均最大低下率と平均回復時間が運動前の FEV1 の 5% 以内に統計的に有意に減少しました。投与間隔の終わり(すなわち、前の投与の20~24時間後)に運動負荷を行った。この効果は 12 週間の治療期間を通じて維持され、耐性が生じなかったことを示しています。しかし、SINGULAIR 4mg は、研究対象患者の 52% において、運動後の FEV1 の最大低下率の臨床的に有意な悪化 (すなわち、運動前のベースラインから 20% 以上の減少) を防止しませんでした。成人を対象とした別のクロスオーバー試験では、SINGULAIR 10 mg を 1 日 1 回 2 回投与した後に同様の効果が観察されました。
歳から 14 歳の小児患者を対象に、5 mg のチュアブル錠を使用した 2 日間のクロスオーバー試験で、投与間隔の最後 (つまり、20 から 24前回の投与から数時間後)。
アレルギー性鼻炎(季節性および多年性)
季節性アレルギー性鼻炎
季節性アレルギー性鼻炎の治療に対する SINGULAIR 錠の有効性は、北米で実施された 5 つの同様に設計された無作為化二重盲検並行群間プラセボおよび実薬対照 (ロラタジン) 試験で調査されました。 5 つの試験に合計 5029 人の患者が登録され、そのうち 1799 人が SINGULAIR 錠で治療されました。患者は 15 歳から 82 歳で、季節性アレルギー性鼻炎の病歴があり、少なくとも 1 つの関連する季節性アレルゲンに対する皮膚検査が陽性であり、研究登録時に季節性アレルギー性鼻炎の活動性症状がありました。
無作為化治療の期間は、4 試験で 2 週間、1 試験で 4 週間でした。主要アウトカム変数は、患者が0~3のカテゴリスケールで評価した、日中の鼻症状スコア(鼻づまり、鼻漏、鼻のかゆみ、くしゃみの個々のスコアの平均)のベースラインからの平均変化でした。
5件の試験のうち4件では、プラセボと比較して、SINGULAIR 10mg錠で日中の鼻症状スコアが大幅に減少したことが示されました。 1回の試行結果を以下に示します。この試験の年齢の中央値は 35.0 歳 (15 歳から 81 歳の範囲) でした。 65.4% が女性で、34.6% が男性でした。この研究における民族/人種の分布は、83.1% 白人、6.4% 他の起源、5.8% 黒人、および 4.8% ヒスパニック系でした。 SINGULAIR 4mg錠、ロラタジン、およびプラセボを受けた治療群における日中の鼻症状スコアのベースラインからの平均変化を表9に示します。有効性を実証した残りの3つの試験は、同様の結果を示しました。モンテルカストを朝または夕方に投与すると、季節性アレルギー性鼻炎に対して有効性が示されました。
多年性アレルギー性鼻炎
通年性アレルギー性鼻炎の治療に対する SINGULAIR 5mg 錠剤の有効性は、北米とヨーロッパで実施された 2 つのランダム化二重盲検プラセボ対照試験で調査されました。 2 つの試験には合計 3,357 人の患者が登録され、そのうち 1,632 人が SINGULAIR 10 mg 錠を投与されました。 -歴史によって確認された通年性アレルギー性鼻炎の15〜82歳の患者および少なくとも1つの関連する通年性アレルゲン(チリダニ、動物のふけ、および/またはカビの胞子)に対する陽性の皮膚テスト、研究時に活動的な症状があったエントリ、登録されました。
有効性が実証された研究では、年齢の中央値は 35 歳 (範囲 15 から 81) でした。 64.1% が女性で、35.9% が男性でした。この研究における民族/人種の分布は、白人が 83.2%、黒人が 8.1%、ヒスパニック系が 5.4%、アジア系が 2.3%、その他の出身が 1.0% でした。 SINGULAIR 10 mg 錠を 1 日 1 回服用すると、6 週間の治療期間で通年性アレルギー性鼻炎の症状が大幅に軽減されることが示されました (表 10)。この研究では、主な結果変数は、日中の鼻症状スコア (鼻づまり、鼻漏、およびくしゃみの個々のスコアの平均) のベースラインからの平均変化でした。
他の 6 週間の研究では、SINGULAIR 10 mg (n=626)、プラセボ (n=609)、および実薬対照 (セチリジン 10 mg; n=120) が評価されました。一次分析では、治療の最初の 4 週間にわたって、SINGULAIR とプラセボの日中の鼻症状スコアのベースラインからの平均変化を比較しました。この研究は、SINGULAIR と実薬対照との統計的比較を目的として設計されたものではありません。主要な結果変数には、鼻づまり、鼻漏、くしゃみに加えて、鼻のかゆみが含まれていました。 SINGULAIR とプラセボの推定差は -0.04 で、95% CI は (-0.09, 0.01) でした。実対照群とプラセボの推定差は -0.10 で、95% CI は (-0.19, -0.01) でした。
患者情報
SINGULAIR® (SING-u-lair)(モンテルカストナトリウム)チュアブル錠
SINGULAIR 4mgについて知っておくべき最も重要な情報は何ですか?SINGULAIRを服用している人々に深刻なメンタルヘルスの問題が発生しています または治療が中止された後でも。
これは、メンタルヘルスの問題の病歴がある人にもない人にも起こります。 SINGULAIR の使用を中止し、あなたまたはあなたの子供が次の症状のいずれかを含め、行動や思考に異常な変化が見られた場合は、すぐに医療提供者に伝えてください。
- 攻撃的な行動や敵意を含む動揺
- 注意の問題
- 悪い夢や鮮やかな夢
- うつ
- 見当識障害(混乱)
- 不安な気持ち
- 過敏性
- 幻覚(実際には存在しないものを見たり聞いたりする)
- メモリの問題
- 強迫神経症の症状
- 落ち着きのなさ
- 寝歩き
- どもる
- 自殺念慮および自殺行為(自殺を含む)
- 身震い
- 寝られない
- 制御されていない筋肉の動き
シングレア10mgとは?
SINGULAIR 4mg は、ロイコトリエンと呼ばれる体内の物質をブロックする処方薬です。これは、喘息や鼻の粘膜の炎症(アレルギー性鼻炎)の症状を改善するのに役立ちます. SINGULAIRにはステロイドは含まれていません。 SINGULAIR は次の目的で使用されます。
- 成人および 2 歳以上の子供に年間の一部で発生する屋外アレルギー (季節性アレルギー性鼻炎)、 と
- 成人および生後 6 か月以上の子供に一年中発生する屋内アレルギー (通年性アレルギー性鼻炎)。
しない SINGULAIR の成分にアレルギーがある場合は、SINGULAIR を服用してください。 SINGULAIR の成分の完全なリストについては、この医薬品ガイドの最後を参照してください。
SINGULAIR 4mgを服用する前に、以下の場合を含め、すべての病状について医療提供者に伝えてください。
- アスピリンアレルギーです。
- フェニルケトン尿症があります。 SINGULAIR チュアブル タブレットには、フェニルアラニンの供給源であるアスパルテームが含まれています。
- メンタルヘルスの問題を抱えている、または抱えていた。
- 妊娠している、または妊娠する予定がある。妊娠中または妊娠を計画している場合は、かかりつけの医療提供者に相談してください。
- 授乳中または授乳を計画している。 SINGULAIR が母乳に移行するかどうかは不明です。 SINGULAIR を服用している間、赤ちゃんに食事を与える最善の方法について、かかりつけの医療提供者に相談してください。
処方薬や市販薬、ビタミン、ハーブサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。一部の医薬品は SINGULAIR の作用に影響を与える可能性があり、SINGULAIR 4mg は他の医薬品の作用に影響を与える可能性があります。
SINGULAIR 10mgはどのように服用すればよいですか?
為に 誰でも 誰が SINGULAIR を服用していますか:
- 詳細を読む 使用説明書 SINGULAIR経口顆粒が付属しています。
- SINGULAIR 4mg を医療提供者の処方どおりに服用してください。 SINGULAIRの摂取量は医療提供者が教えてくれます。 いつ服用するか。
- SINGULAIR 5mg の服用を中止し、あなたまたはあなたの子供が行動や思考に異常な変化が見られた場合は、すぐに医療提供者に伝えてください。
- SINGULAIR 5mg は食事と一緒に、または食事なしで服用できます。セクションを参照 「SINGULAIR経口顆粒を子供に与えるにはどうすればよいですか?」 の中に 使用説明書 SINGULAIR 10mg経口顆粒で摂取できる食品および液体に関する情報については、.
- あなたまたはあなたの子供がSINGULAIRの用量を逃した場合は、通常の時間に次の用量を服用してください. 2回分を同時に服用しないでください。
- SINGULAIR の服用量が多すぎる場合は、すぐに医療提供者に連絡してください。
大人と 12 か月以上の喘息の子供の場合:
- SINGULAIR を 1 日 1 回、夕方に服用してください。喘息の症状がなくても、医療提供者が処方している限り、SINGULAIR 5mg を毎日服用し続けてください。
- 喘息の症状が悪化した場合、または喘息発作のためにレスキュー吸入薬をより頻繁に使用する必要がある場合は、すぐに医療提供者に伝えてください。
- 喘息発作に備えて、レスキュー吸入薬を常に携帯してください。
- 医療提供者がこれらの薬の服用方法を変更するように指示しない限り、処方された他の喘息薬を服用し続けてください.
運動誘発性喘息の予防のための6歳以上の人々の場合:
- 運動の少なくとも2時間前にSINGULAIRを服用してください。
- 喘息発作に備えて、レスキュー吸入薬を常に携帯してください。
- 慢性喘息やアレルギー性鼻炎でシングレア10mgを毎日服用すると、 しない 運動誘発性喘息を予防するために、もう 1 回服用してください。運動誘発性喘息の治療については、担当の医療提供者に相談してください。
- 24時間(1日)以内にSINGULAIR 5mgを2回服用しないでください。
2 歳以上の季節性アレルギー性鼻炎患者、または生後 6 か月以上の通年性アレルギー性鼻炎患者:
- SINGULAIR を 1 日 1 回、毎日ほぼ同じ時間に服用してください。
SINGULAIR 10mgを服用している間、何を避けるべきですか?
喘息を患っており、アスピリンが喘息の症状を悪化させる場合は、SINGULAIR を服用している間、アスピリンまたは非ステロイド性抗炎症薬 (NSAID) と呼ばれる他の薬の服用を引き続き避けてください。
SINGULAIRの考えられる副作用は何ですか?
SINGULAIR は、次のような重大な副作用を引き起こす可能性があります。
- 見る 「SINGULAIR 4mgについて知っておくべき最も重要な情報は何ですか?」
- 特定の白血球 (好酸球) の増加と、全身の血管の炎症 (全身性血管炎) の可能性。 まれに、SINGULAIR を服用している喘息患者に起こることがあります。これは、中止されているか、用量が減らされている経口ステロイド薬も服用している人に時々起こります.
これらの症状が 1 つ以上ある場合は、すぐに医療提供者に伝えてください。
- 腕や脚のピンと針の感覚またはしびれ
- インフルエンザのような病気
- 発疹
- 副鼻腔の重度の炎症(痛みと腫れ)(副鼻腔炎)
SINGULAIRの最も一般的な副作用は次のとおりです。
- 上気道感染症
- 熱
- 頭痛
- 喉の痛み
- 咳
- 胃痛
- 下痢
- 耳痛または耳の感染症
- インフルエンザ
- 鼻水が出る
- 副鼻腔感染症
これらは、SINGULAIR の考えられるすべての副作用ではありません。副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
SINGULAIRの保管方法を教えてください。
- SINGULAIR 10mg は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
- SINGULAIR 4mgはパッケージに入れたまま保管してください。
- SINGULAIR 4mg を乾燥した場所に保管し、光を避けて保管してください。
- SINGULAIR およびすべての医薬品は、子供の手の届かないところに保管してください。
SINGULAIRの安全で効果的な使用に関する一般情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない症状には SINGULAIR を使用しないでください。他の人があなたと同じ症状を持っている場合でも、SINGULAIR を与えないでください。それらに害を及ぼす可能性があります。
医療専門家向けに書かれた SINGULAIR 10mg に関する情報については、薬剤師または医療提供者にお尋ねください。
SINGULAIRの成分は何ですか?
有効成分: モンテルカストナトリウム
不活性成分:
- 経口顆粒4mg: マンニトール、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム。
- 4mgおよび5mgのチュアブル錠: マンニトール、微結晶性セルロース、ヒドロキシプロピルセルロース、紅酸化鉄、クロスカルメロースナトリウム、チェリーフレーバー、アスパルテーム、ステアリン酸マグネシウム。
- フェニルケトン尿症の人: SINGULAIR 4mg チュアブル錠 0.674mgのフェニルアラニンを含み、 SINGULAIR 5mg チュアブル錠 0.842mgのフェニルアラニンが含まれています。
- 10mg錠: 微結晶性セルロース、ラクトース一水和物、クロスカルメロース ナトリウム、ヒドロキシプロピル セルロース、およびステアリン酸マグネシウム。フィルムコーティングには、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、二酸化チタン、赤色三二酸化鉄、黄色三二酸化鉄、およびカルナウバワックスが含まれています。
使用説明書
SINGULAIR® (SING-u-lair)(モンテルカストナトリウム)経口顆粒
この使用説明書には、SINGULAIR 10mg経口顆粒の使用方法に関する情報が含まれています。
重要な情報:
- SINGULAIR 経口顆粒剤を投与する前に、この使用説明書を読み、経口顆粒剤を正しく準備して投与してください。
- かかりつけの医療提供者の指示に従って、お子様に SINGULAIR 経口顆粒を与えてください。
- SINGULAIR 5mg の投与を中止し、お子様の行動や思考に異常な変化が見られた場合は、すぐに医療提供者に伝えてください。
- 医療提供者がこれらの薬の投与方法を変更するように指示しない限り、処方されたとおりに子供に喘息薬を与え続けてください.
- SINGULAIR 5mg 経口顆粒は、食物と一緒に、または食物なしで与えることができます。
SINGULAIR 4mg経口顆粒を子供に与えるにはどうすればよいですか?
- しない 使用する準備が整うまでパケットを開けます。
- SINGULAIR 4 mg 経口顆粒剤を投与するには、さまざまな方法があります。お子様に最適な方法を選択する必要があります。
- そのまま口へ
- 小さじ 1 杯 (5 mL) の冷たいまたは室温の粉ミルクまたは母乳に溶かす
- 冷たいまたは室温で次の柔らかい食品の1つをスプーン1杯と混ぜます:アップルソース、つぶしたニンジン、米、またはアイスクリーム.
- 15分以内にすべての混合物を子供に与えます。
- 残った SINGULAIR 混合物 (食品、粉ミルク、または母乳と混合した経口顆粒) を後で使用するために保管しないでください。 未使用部分は廃棄してください。
- SINGULAIR経口顆粒を粉ミルクまたは母乳以外の液体飲料と混ぜないでください。 混合物を飲み込んだ後、お子様が他の液体を飲むことがあります。
SINGULAIR 5mgの保管方法は?
- SINGULAIR 4mg は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
- SINGULAIR はパッケージに入れたまま保管してください。
- SINGULAIR 5mg は乾燥した場所に保管し、光を避けて保管してください。
- SINGULAIR およびすべての医薬品は、子供の手の届かないところに保管してください。
この使用説明書は、米国食品医薬品局によって承認されています
