Spiriva 9mcg Tiotropium Bromide 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Spiriva 9mcg HandiHaler とは何ですか?
Spiriva HandiHaler (臭化チオトロピウム) 吸入粉末は、気管支炎、肺気腫、または COPD (慢性閉塞性肺疾患) の人の気管支痙攣 (肺の気道の狭窄) を予防するために使用される抗コリン薬です。
Spiriva 9mcg HandiHalerの副作用は何ですか?
Spiriva 9mcg HandiHalerの一般的な副作用は次のとおりです。
- 口渇、
- 便秘、
- 胃のむかつき、
- 嘔吐、
- かぜの諸症状(鼻づまり、くしゃみ、のどの痛み)、
- 鼻血、または
- 筋肉痛。
Spiriva 9mcg HandiHaler の重大な副作用がある場合は、医師に相談してください。
- 困難または痛みを伴う排尿、または
- 速い心拍。
説明
SPIRIVA 9mcg HANDIHALERは、SPIRIVAカプセルとHANDIHALERデバイスで構成されています。薄緑色の硬質ゼラチン SPIRIVA 9mcg カプセルには、18 mcg のチオトロピウム (22.5 mcg 臭化チオトロピウム一水和物に相当) とラクトース一水和物 (乳タンパク質を含む場合があります) が混合された乾燥粉末が含まれています。
SPIRIVA カプセルの内容物は、経口吸入のみを目的としており、HANDIHALER デバイスによる投与のみを目的としています。
SPIRIVA HANDIHALERの有効成分はチオトロピウムです。原薬である臭化チオトロピウム一水和物は、ムスカリン受容体に特異的な抗コリン薬です。化学的には (1α, 2β, 4β, 5α, 7β)-7-[(ヒドロキシジ-2-チエニルアセチル)オキシ]-9,9-ジメチル-3-オキサ-9-アゾニアトリシクロ[3.3.1.02,4] と表されます。臭化ノナン一水和物。これは、合成の非キラルな第 4 級アンモニウム化合物です。臭化チオトロピウムは白色または黄白色の粉末です。水にやや溶けにくく、メタノールに溶ける。
構造式は次のとおりです。
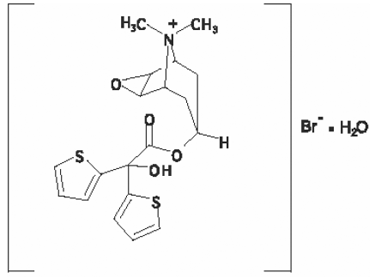
臭化チオトロピウム(一水和物)の分子量は 490.4 で、分子式は C19H22NO4S2Br • H2O です。
HANDIHALERデバイスは、SPIRIVA 9mcgカプセルに含まれる乾燥粉末を吸入するために使用される吸入デバイスです。乾燥粉末は、HANDIHALER デバイスから 20 L/min という低流量で供給されます。標準化された in vitro 試験では、HANDIHALER デバイスは、流量 39 L/分で 3.1 秒間試験した場合 (合計 2 L)、平均 10.4 mcg のチオトロピウムを供給します。 COPD と重度の肺機能障害を有する 26 人の成人患者を対象とした研究では、[平均 FEV1 1.02 L (範囲 0.45 ~ 2.24 L);予測値の 37.6% (範囲 16% から 65%)]、HANDIHALER デバイスを通過する最大吸気流量 (PIF) の中央値は 30.0 L/分 (範囲 20.4 から 45.6 L/分) でした。肺に送達される薬剤の量は、吸気流量や HANDIHALER 装置を通過する最大吸気流量などの患者の要因によって異なります。これは患者ごとに異なる可能性があり、ブリスターの外側にある SPIRIVA 9mcg カプセルの曝露時間によって異なる可能性があります。パック。
適応症
SPIRIVA HANDIHALER (臭化チオトロピウム吸入粉末) は、慢性気管支炎や肺気腫を含む慢性閉塞性肺疾患 (COPD) に伴う気管支痙攣の長期、1 日 1 回の維持治療に適応されます。 SPIRIVA 9mcg HANDIHALER は、COPD 患者の増悪を軽減することが示されています。
投薬と管理
経口吸入のみ。 SPIRIVA 9mcgカプセルは、意図した肺への効果が得られませんので飲み込まないでください。 SPIRIVA カプセルの内容物は、HANDIHALER デバイスでのみ使用してください [見る 過剰摂取 ]。
SPIRIVA HANDIHALER の推奨用量は、1 日 1 回、1 つの SPIRIVA カプセルの粉末内容物を HANDIHALER デバイスで 2 回吸入することです。 患者情報 ]。 24 時間以内に複数回服用しないでください。
SPIRIVA HANDIHALER を投与するには、SPIRIVA 9mcg カプセルを HANDIHALER デバイスの中央チャンバーに入れます。 SPIRIVA 9mcg カプセルは、HANDIHALER デバイスの側面にある緑色のピアシング ボタンを押して放すことでピアシングされます。チオトロピウム製剤は、患者がマウスピースから吸入すると、気流中に分散されます [参照 患者情報 ]。
高齢者、肝障害、または腎障害のある患者には、投与量の調整は必要ありません。ただし、スピリーバ 9mcg ハンディヘラーを投与された中等度から重度の腎機能障害のある患者は、抗コリン作用について注意深く監視する必要があります。 警告と注意事項 、 特定の集団での使用 、 と 臨床薬理学 ]。
供給方法
剤形と強度
吸入パウダー
SPIRIVA 9mcg HANDIHALER は、経口吸入用のチオトロピウム粉末を含む SPIRIVA カプセルと HANDIHALER デバイスで構成されています。 SPIRIVA 9mcg カプセルには、片面に TI 01 が印刷され、もう片面に Boehringer Ingelheim 社のロゴが印刷された薄緑色のハード ゼラチン カプセルに 18 mcg のチオトロピウムが含まれています。 HANDIHALER デバイスは、SPIRIVA カプセルでの使用のみを目的としています。
保管と取り扱い
SPIRIVA HANDIHALERは、SPIRIVA 9mcgカプセルとHANDIHALERデバイスで構成されています。 SPIRIVA 9mcg カプセルには 18 mcg のチオトロピウムが含まれており、明るい緑色で、SPIRIVA カプセルのキャップには Boehringer Ingelheim 社のロゴが、SPIRIVA カプセルの本体には TI 01 が、またはその逆になっています。
HANDIHALER デバイスはグレーで、緑色のピアス ボタンが付いています。ベーリンガーインゲルハイム社のロゴであるSPIRIVA HANDIHALER(臭化チオトロピウム吸入粉末)が刻印されています。また、SPIRIVA カプセルは HANDIHALER デバイスに保管してはならず、HANDIHALER デバイスは SPIRIVA 9mcg カプセルとのみ使用する必要があることを示すために刻印されています。
SPIRIVA 9mcg カプセルは、アルミニウム/アルミニウム ブリスター カードにパッケージされ、ミシン目で結合されています。 SPIRIVA 9mcg カプセルは常にブリスターに保管し、使用直前に取り出してください。個々の SPIRIVA カプセルのパッケージを開封したら、すぐに薬を使用する必要があります。
次のパッケージが利用可能です。
- SPIRIVA 9mcgカプセル5個(単位用量ブリスターカード1枚)とHANDIHALER吸入器1個( NDC 0597-0075-75) (機関パック)
- SPIRIVA 9mcg カプセル 30 個 (単位用量ブリスターカード 3 枚) と HANDIHALER 吸入器 ( NDC 0597-0075-41)
- SPIRIVA カプセル 90 個 (単位用量ブリスター カード 9 個) と HANDIHALER 吸入器 ( NDC 0597-0075-47)
小児の手の届かない場所に保管。粉末が目に入らないようにしてください。
保管所
25°C (77°F) で保管してください。 15° ~ 30°C (59° ~ 86°F) [USP 制御室温を参照してください] まで許容されます。
SPIRIVA カプセルは極端な温度や湿気にさらさないでください。 SPIRIVA 9mcg カプセルを HANDIHALER デバイスに保管しないでください。
販売元: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA.改訂: 2018 年 2 月
副作用
次の副作用については、別のセクションで説明されているか、より詳細に説明されています。
- 即時型過敏反応 [参照 警告と注意事項 ]
- 逆説的気管支痙攣 [参照 警告と注意事項 ]
- 狭隅角緑内障の悪化 [参照 警告と注意事項 ]
- 尿閉の悪化 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験での発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
6ヶ月から1年間のトライアル
下記のデータは、2663 人の患者における SPIRIVA 9mcg HANDIHALER への曝露を反映しています。 SPIRIVA 9mcg HANDIHALER は、COPD 患者を対象とした 2 つの 1 年間のプラセボ対照試験、2 つの 1 年間の実薬対照試験、および 2 つの 6 か月間のプラセボ対照試験で研究されました。これらの試験では、1,308 人の患者が推奨用量 18 mcg の SPIRIVA HANDIHALER で 1 日 1 回治療を受けました。集団の年齢は 39 歳から 87 歳で、男性が 65% から 85%、白人が 95% で、気管支拡張薬を使用する前の 1 秒間の強制呼気量 (FEV1) の平均パーセントが 39% から 43% と予測される COPD を患っていました。狭隅角緑内障、または症候性前立腺肥大または膀胱出口閉塞の患者は、これらの試験から除外されました。重篤な有害事象のみが収集されたため、退役軍人の環境で実施された追加の6か月の試験は、この安全性データベースには含まれていません。
最も多く報告された副作用は口渇でした。口渇は通常軽度であり、治療を継続するうちにしばしば解消されました。個々の患者で報告され、抗コリン作用の可能性と一致するその他の反応には、便秘、頻脈、かすみ目、緑内障(新たな発症または悪化)、排尿障害、および尿閉が含まれていました。
4 つの多施設、1 年間のプラセボ対照および実薬対照試験で、COPD 患者における SPIRIVA HANDIHALER が評価されました。表1は、1年間のプラセボ対照試験において、スピリーバ ハンディヘラー群で発生率がプラセボよりも1%以上高かったすべての有害反応を示しています。イプラトロピウム対照試験における対応する反応の頻度は、比較のために含まれています。
関節炎、咳、およびインフルエンザ様症状は、スピリーバ 9mcg ハンディヘラー治療群で 3% 以上の割合で発生しましたが、プラセボ群より 1% 未満でした。
SPIRIVA HANDIHALER グループで 1% から 3% の頻度でプラセボ対照試験で発生したその他の反応には、プラセボ群を上回ったものがあります。
全身: アレルギー反応、足の痛み;
中枢および末梢神経系: 発声障害、感覚異常;
消化器系疾患: 他に特定されない胃腸障害(NOS)、胃食道逆流、口内炎(潰瘍性口内炎を含む);
代謝および栄養障害: 高コレステロール血症、高血糖;
筋骨格系障害: 骨格痛;
心臓イベント: 狭心症(悪化した狭心症を含む);
精神障害: うつ;感染症: 帯状疱疹;
呼吸器系障害(上): 喉頭炎;
視覚障害: 白内障。
さらに、1%未満の発生率で臨床試験で観察された副作用の中には、心房細動、上室性頻脈、血管性浮腫、および尿閉がありました。
1年間の試験では、口渇、便秘、および尿路感染症の発生率は年齢とともに増加しました[参照 特定の集団での使用 ]。
件の多施設共同 6 か月対照試験で、COPD 患者における SPIRIVA 9mcg HANDIHALER が評価されました。副作用と発生率は、1 年間の対照試験で見られたものと同様でした。
4年間のトライアル
下記のデータは、4 年間のプラセボ対照試験における 5992 人の COPD 患者における SPIRIVA 9mcg HANDIHALER への曝露を反映しています。この試験では、2986 人の患者が SPIRIVA 9mcg HANDIHALER を 1 日 1 回 18mcg の推奨用量で治療されました。集団の年齢範囲は 40 歳から 88 歳で、75% が男性、90% が白人で、気管支拡張薬を使用する前の平均 FEV1 パーセントが 40% と予測される COPD を患っていました。狭隅角緑内障、または症候性前立腺肥大または膀胱出口閉塞の患者は、これらの試験から除外されました。 SPIRIVA 9mcg HANDIHALER群の頻度が3%以上であり、SPIRIVA 9mcg HANDIHALER群の発生率がプラセボを1%以上上回っていると分析された場合、有害反応は含まれていました (スピリーバ 9mcg HANDIHALER、プラセボ): 咽頭炎 (12.5% 、10.8%)、副鼻腔炎 (6.5%、5.3%)、頭痛 (5.7%、4.5%)、便秘 (5.1%、3.7%)、口渇 (5.1%、2.7%)、うつ病 (4.4%、3.3%) 、不眠症 (4.4%、3.0%)、および関節痛 (4.2%、3.1%)。
追加の有害反応
プラセボよりも SPIRIVA 9mcg ハンディヘラーで治療された COPD 患者でより頻繁に報告された、これまでに記載されていないその他の副作用には、脱水、皮膚潰瘍、口内炎、歯肉炎、口腔咽頭カンジダ症、皮膚乾燥、皮膚感染症、および関節腫脹が含まれます。
市販後の経験
SPIRIVA HANDIHALER の承認後の世界的な使用中に有害反応が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.副作用としては、塗布部位の刺激感(舌炎、口内潰瘍、咽頭痛)、めまい、嚥下障害、嗄声、イレウス麻痺などの腸閉塞、眼圧上昇、口腔カンジダ症、動悸、かゆみ、頻脈、咽頭痛、蕁麻疹などがあります。
薬物相互作用
交感神経刺激薬、メチルキサンチン、ステロイド
SPIRIVA 9mcg HANDIHALER は、短時間作用型および長時間作用型の交感神経刺激薬 (ベータ作動薬) 気管支拡張薬、メチルキサンチン、経口および吸入ステロイドと併用して使用されており、有害反応の増加はありません。
抗コリン薬
併用される抗コリン薬との相加的相互作用の可能性があります。したがって、スピリーバ 9mcg ハンディヘラーと他の抗コリン薬を含む薬との併用は、抗コリン薬の副作用が増加する可能性があるため避けてください。 警告と注意事項 と 有害反応 ]。
警告
の一部として含まれています "予防" セクション
予防
緊急用ではありません
SPIRIVA 9mcg HANDIHALER は、COPD の 1 日 1 回の維持療法として意図されており、急性症状の緩和、つまり気管支痙攣の急性エピソードの治療のためのレスキュー療法として使用すべきではありません。
即時型過敏反応
SPIRIVA 9mcg HANDIHALERの投与後、蕁麻疹、血管性浮腫(唇、舌、または喉の腫れを含む)、発疹、気管支痙攣、アナフィラキシー、またはかゆみを含む即時の過敏症反応が起こることがあります.このような反応が生じた場合は、スピリーバ 9mcg ハンディヘラーによる治療を直ちに中止し、別の治療法を検討する必要があります。アトロピンとチオトロピウムは構造式が似ているため、アトロピンまたはその誘導体に対する過敏反応の既往歴のある患者は、スピリーバ ハンドヘラーに対する同様の過敏反応について注意深く監視する必要があります。さらに、SPIRIVA HANDIHALER は、乳タンパク質に対する重度の過敏症の患者には注意して使用する必要があります。
逆説的気管支痙攣
SPIRIVA HANDIHALER を含む吸入薬は逆説的な気管支痙攣を引き起こす可能性があります。これが発生した場合は、アルブテロールなどの吸入短時間作用型ベータ 2 アゴニストで直ちに治療する必要があります。 SPIRIVA HANDIHALER による治療を中止し、他の治療法を考慮する必要があります。
狭隅角緑内障の悪化
SPIRIVA 9mcg HANDIHALER は、狭隅角緑内障患者には慎重に使用する必要があります。処方者と患者は、急性狭隅角緑内障の徴候と症状に注意する必要があります(例、眼の痛みまたは不快感、かすみ目、視覚ハロー、または結膜充血および角膜浮腫による赤目と関連するカラー画像)。これらの徴候や症状が現れた場合は、直ちに医師に相談するよう患者に指示してください。
尿閉の悪化
SPIRIVA HANDIHALER は、尿閉のある患者には注意して使用する必要があります。処方者と患者は、特に前立腺肥大症または膀胱頸部閉塞の患者において、尿閉の徴候と症状(例、排尿困難、排尿時の痛み)に注意する必要があります。これらの徴候や症状が現れた場合は、直ちに医師に相談するよう患者に指示してください。
腎障害
主に腎から排泄される薬剤であるため、中等度から重度の腎機能障害 (クレアチニンクリアランスが 60 mL/分未満) の患者に SPIRIVA HANDIHALER を投与した場合は、抗コリン作用の副作用について注意深く監視する必要があります [ 臨床薬理学 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報と使用説明書 )。
緊急用ではありません
SPIRIVA HANDIHALER は 1 日 1 回の維持気管支拡張剤であり、呼吸の問題を直ちに緩和するために (つまり、レスキュー薬として) 使用すべきではないことを患者に説明してください。
即時型過敏反応
SPIRIVA 9mcg HANDIHALERの投与後に、アナフィラキシー、血管浮腫(唇、舌、または喉の腫れを含む)、蕁麻疹、発疹、気管支痙攣、またはかゆみが発生する可能性があることを患者に知らせてください.これらの徴候や症状が現れた場合は、直ちに治療を中止し、医師に相談するよう患者に助言してください。
逆説的気管支痙攣
SPIRIVA HANDIHALER が逆説的な気管支痙攣を引き起こす可能性があることを患者に知らせてください。逆説的な気管支痙攣が発生した場合、患者は SPIRIVA HANDIHALER を中止する必要があることを患者に助言します。
狭隅角緑内障の悪化
狭隅角緑内障の徴候や症状(例えば、目の痛みや不快感、かすみ目、視覚ハロー、または結膜充血や角膜浮腫による赤目と関連するカラー画像)に注意するように患者に指示します。これらの兆候や症状が現れた場合は、直ちに医師に相談するよう患者に指示してください。
粉末が目に入らないように注意する必要があることを患者に伝えてください。
SPIRIVA HANDIHALERを使用すると、めまいやかすみ目が生じることがありますので、車の運転や電化製品や機械の操作などの活動に従事することには注意してください。
尿閉の悪化
尿閉の徴候や症状(例,排尿困難,排尿痛)に注意するよう患者に指導する。これらの徴候や症状が現れた場合は、直ちに医師に相談するよう患者に指示してください。
SPIRIVA HANDIHALERの投与方法
HANDIHALER 装置を使用して SPIRIVA 9mcg カプセルを正しく投与する方法を患者に指導する [ 患者情報 ]。 SPIRIVA 9mcg カプセルは HANDIHALER 装置を介してのみ投与し、HANDIHALER 装置を他の薬剤の投与に使用しないことを患者に指示してください。 SPIRIVA 9mcg カプセルの内容物は経口吸入専用であり、飲み込んではいけないことを患者に注意してください。
SPIRIVA 9mcg カプセルは常に密閉ブリスターに保管し、使用直前に SPIRIVA カプセルを 1 つだけ取り出すように患者に指示してください。そうしないと、その有効性が低下する可能性があります。空気にさらされた未使用の追加の SPIRIVA カプセルを廃棄するように患者に指示します (つまり、すぐに使用するつもりはありません)。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
チオトロピウムを 59 mcg/kg/日までの用量でラットに 104 週間吸入させた試験、雌マウスに 145 mcg/kg/日までの用量を用いた 83 週間の吸入試験、および2 mcg/kg/日までの用量での雄マウスにおける 101 週間の吸入試験。これらの用量は、mcg/m2 ベースで、それぞれ推奨されるヒトの 1 日吸入用量 (MRHDID) の約 30、40、および 0.5 倍に相当します。
臭化チオトロピウムは、以下のアッセイにおいて変異原性または染色体異常誘発性の証拠を示さなかった: バクテリア遺伝子突然変異アッセイ、V79 チャイニーズハムスター細胞突然変異誘発アッセイ、in vitro でのヒトリンパ球および in vivo でのマウス小核形成における染色体異常アッセイ、および不定期 DNA 合成。初代ラット肝細胞の in vitro アッセイ。
ラットでは、チオトロピウムの吸入用量が 78 mcg/kg/日以上 (mcg/m2 ベースで MRHDID の約 40 倍) で、黄体数とインプラントの割合の減少が認められました。そのような影響は、9 mcg/kg/日 (mcg/m2 ベースで MRHDID の約 5 倍) では観察されませんでした。しかし受胎能指数は、最大 1689 mcg/kg/日 (mcg/m2 ベースで MRHDID の約 910 倍) までの吸入量では影響を受けませんでした。
特定の集団での使用
妊娠
リスクの概要
妊娠中に SPIRIVA 9mcg HANDIHALER を使用した限られたヒトのデータは、妊娠に関連した有害転帰の薬物関連リスクを知らせるには不十分です。動物の生殖研究に基づいて、チオトロピウムを妊娠中のラットとウサギに器官形成期に、ヒトの最大推奨 1 日吸入量 (MRHDID) のそれぞれ 790 倍と 8 倍の用量で吸入投与した場合、構造異常は観察されませんでした。母体毒性用量のチオトロピウムをそれぞれ MRHDID の 430 倍および 40 倍投与したラットおよびウサギで、着床後の損失の増加が観察された [参照 データ ]。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
データ
動物データ
つの別個の胚・胎児発生研究で、妊娠中のラットとウサギは、器官形成期にそれぞれ MRHDID の約 790 倍と 8 倍の用量でチオトロピウムを投与された (mcg/m2 ベースで 1471 と 7 mcg/kg の吸入用量で)。 /日、それぞれラットとウサギ)。ラットまたはウサギでは、構造異常の証拠は観察されませんでした。しかし、ラットでは、チオトロピウムは MRHDID の約 40 倍のチオトロピウム用量 (mcg/m2 で78 mcg/kg/日の母体吸入量に基づく)。ウサギでは、チオトロピウムは MRHDID の約 430 倍のチオトロピウム用量で着床後損失の増加を引き起こした (400 mcg/kg/日の母体吸入用量での mcg/m2 ベースで)。このような影響は、それぞれ MRHDID の約 5 倍および 95 倍では観察されませんでした (ラットおよびウサギでそれぞれ 9 および 88 mcg/kg/日の吸入用量で mcg/m2 ベースで)。
授乳
リスクの概要
母乳中のチオトロピウムの存在、母乳育児への影響、または乳生産への影響に関するデータはありません。チオトロピウムは授乳中のラットのミルクに含まれています。しかし、泌乳生理学における種特異的な違いにより、これらのデータの臨床的関連性は明確ではありません[ データ ]。母乳育児の発達上および健康上の利点は、母親が SPIRIVA 9mcg HANDIHALER を臨床的に必要とすること、および SPIRIVA HANDIHALER または母体の基礎疾患による授乳中の子供への潜在的な悪影響と併せて考慮する必要があります。
データ
乳汁中への臭化チオトロピウムの分布は、授乳中のラットに 10 mg/kg を単回静脈内投与した後に調査されました。チオトロピウムおよび/またはその代謝物は、授乳中のラットの乳中に、血漿中の濃度より高い濃度で存在します。
小児用
SPIRIVA HANDIHALER は、子供への使用は適応されていません。小児患者における SPIRIVA 9mcg HANDIHALER の安全性と有効性は確立されていません。
高齢者の使用
入手可能なデータに基づくと、高齢患者における SPIRIVA HANDIHALER の投与量の調整は正当化されません [参照 臨床薬理学 ]。
年間の臨床試験で SPIRIVA 9mcg HANDIHALER を投与された患者の総数のうち、426 人が 65 歳未満、375 人が 65 ~ 74 歳、105 人が 75 歳以上でした。各年齢サブグループ内で、スピリーバ 9mcg ハンディヘラーと対照群で有害事象を起こした患者の割合に、ほとんどの事象で差はありませんでした。 SPIRIVA 9mcg HANDIHALER群では年齢とともに口腔乾燥症が増加しました(プラセボとの差は、前述の年齢サブグループで9.0%、17.1%、16.2%でした)。プラセボ対照試験においてスピリーバ ハンディヘラー群では、加齢に伴う便秘と尿路感染症の頻度が高くなることが観察されました。便秘のプラセボとの差は、各年齢層で 0%、1.8%、7.8% でした。尿路感染症のプラセボとの差は、-0.6%、4.6%、および 4.5% でした。これらのグループ間で有効性の全体的な違いは観察されませんでした。
腎障害
SPIRIVA HANDIHALER で治療された中等度から重度の腎機能障害 (クレアチニンクリアランスが 60 mL/分未満) の患者は、抗コリン作動性の副作用について注意深く監視する必要があります [ 投薬と管理 、 警告と注意事項 、 と 臨床薬理学 ]。
肝障害
チオトロピウムの薬物動態に対する肝障害の影響は研究されていません。
過剰摂取
高用量のチオトロピウムは、抗コリン作動性の徴候や症状を引き起こす可能性があります。しかし、健康なボランティア 6 人に最大 282 mcg のチオトロピウムを 1 回吸入投与しても、全身的な抗コリン作用の副作用はありませんでした。 12 人の健康なボランティアの研究では、141 mcg のチオトロピウムを 1 日 1 回繰り返し吸入した後、両側結膜炎と口渇が見られました。
過剰摂取の治療は、スピリーバ ハンディヘラーの中止と、適切な対症療法および/または支持療法の開始で構成されます。
誤飲
SPIRIVA カプセルは全身に十分に吸収されないため、不注意による経口摂取による急性中毒の可能性は低いです。
市販後の経験から過剰摂取の事例が報告されています。女性患者は、2.5 日間にわたって 30 カプセルを吸入し、精神状態の変化、振戦、腹痛、および重度の便秘を発症したと報告されています。患者は入院し、スピリーバ ハンディヘラーを中止し、便秘は浣腸で治療されました。患者は回復し、同日退院した。
禁忌
SPIRIVA 9mcg HANDIHALER は、チオトロピウム、イプラトロピウム、またはこの製品の成分に対する過敏症の患者には禁忌です [参照 警告と注意事項 ]。 SPIRIVA 9mcg HANDIHALERの臨床試験および市販後の経験では、血管性浮腫(唇、舌、または喉の腫れを含む)、かゆみ、または発疹を含む即時の過敏反応が報告されています[ 警告と注意事項 ]。
臨床薬理学
作用機序
チオトロピウムは長時間作用型の抗ムスカリン剤で、しばしば抗コリン剤と呼ばれます。これは、ムスカリン受容体のサブタイプである M1 から M5 に類似した親和性を持っています。気道では、気管支拡張につながる平滑筋の M3 受容体を阻害することにより、薬理学的効果を示します。拮抗作用の競合的で可逆的な性質は、ヒトおよび動物由来の受容体と分離された臓器の準備で示されました。前臨床の in vitro および in vivo 研究では、メタコリン誘発性気管支収縮効果の予防は用量依存的であり、24 時間以上持続しました。チオトロピウム吸入後の気管支拡張は、主に部位特異的効果である。
薬力学
心臓電気生理学
COPD 患者 198 人を登録した吸入用チオトロピウム乾燥粉末を使用した多施設無作為化二重盲検試験では、ベースライン補正 QT 間隔が 30 ミリ秒から 60 ミリ秒に変化した被験者の数は、スピリーバ 9mcg ハンディヘラー群と比較して多かったプラセボで。この違いは、Bazett (QTcB) [20 (20%) 患者 vs. 12 (12%) 患者] と Fredericia (QTcF) [16 (16%) 患者 vs. 1 (1%) 患者] 補正の両方を使用して明らかでした。心拍数の QT。どちらのグループにも、QTcB または QTcF が 500 ミリ秒を超える患者はいなかった。 SPIRIVA HANDIHALER を使用したその他の臨床試験では、QTc 間隔に対する薬剤の効果は検出されませんでした。
チオトロピウム乾燥粉末の吸入による QT 間隔への影響も、53 人の健康なボランティアを対象とした無作為化、プラセボおよび陽性対照クロスオーバー研究で評価されました。被験者は、吸入用のチオトロピウム乾燥粉末 18 mcg、54 mcg (推奨用量の 3 倍)、またはプラセボを 12 日間受け取りました。 ECG評価は、ベースラインで、および研究薬物の最初および最後の投与に続く投与間隔全体にわたって実施した。プラセボと比較して、研究固有の QTc 間隔のベースラインからの最大平均変化は、吸入 18 mcg および 54 mcg のチオトロピウム乾燥粉末で、それぞれ 3.2 ミリ秒および 0.8 ミリ秒でした。 500 ミリ秒を超える QTc の新規発症、またはベースラインからの 60 ミリ秒以上の QTc 変化を示した被験者はいなかった。
薬物動態
チオトロピウムは乾燥粉末吸入によって投与されます。以下に説明する薬物動態データの一部は、推奨される治療よりも高い用量で得られたものです。 RESPIMAT 吸入器 (5 mcg) から、および HANDIHALER 装置からの吸入粉末 (18 mcg) として送達される 1 日 1 回のチオトロピウムを評価する COPD 患者を対象とした専用の薬物動態研究では、2 つの製品間で同様の全身曝露が得られました。
吸収
若い健康なボランティアによる乾燥粉末の吸入後、19.5% の絶対バイオアベイラビリティは、肺に到達する部分が高度にバイオアベイラブルであることを示唆しています。チオトロピウムの経口溶液の絶対バイオアベイラビリティは 2 ~ 3% です。食事がチオトロピウムの吸収に影響を与えるとは考えられていません。チオトロピウムの最大血漿濃度は、吸入の 7 分後に観察されました。
分布
チオトロピウムは血漿タンパク質に 72% 結合しており、若い健康なボランティアに静脈内投与した後、32 L/kg の分布容積を有していました。肺での局所濃度は不明ですが、投与方法から、肺での濃度がかなり高いことが示唆されます。ラットでの研究は、チオトロピウムが血液脳関門を容易に通過しないことを示しています。
排除
5 mcg のチオトロピウムを 1 日 1 回吸入した後の COPD 患者におけるチオトロピウムの終末半減期は、約 25 時間でした。若い健康なボランティアの静脈内投与後の総クリアランスは 880 mL/min でした。 COPD 患者による 1 日 1 回の慢性的な乾燥粉末吸入後、薬物動態は 7 日目までに定常状態に達し、その後蓄積はありませんでした。
代謝
新陳代謝の程度は小さい。これは、若い健康なボランティアに静脈内投与した後、変化していない物質の 74% が尿中に排泄されることから明らかです。エステルであるチオトロピウムは、非酵素的にアルコール N-メチルスコピンとジチエニルグリコール酸に切断されますが、どちらもムスカリン受容体には結合しません。
ヒト肝ミクロソームとヒト肝細胞を用いた in vitro 実験では、投与量の一部 (静脈内投与量の 74% が変化せずに尿中に排泄され、25% が代謝のために残される) がシトクロム P450 依存性の酸化とその後のグルタチオン抱合によって代謝されることが示唆されています。さまざまなフェーズ II 代謝物に。この酵素経路は、CYP450 2D6 および 3A4 阻害剤 (キニジン、ケトコナゾール、ゲストデンなど) によって阻害される可能性があります。したがって、CYP450 2D6 および 3A4 は、投与された用量のごく一部を排出する役割を担う代謝経路に関与しています。ヒト肝ミクロソームを用いた in vitro 試験では、治療濃度を超えるチオトロピウムが CYP450 1A1、1A2、2B6、2C9、2C19、2D6、2E1、または 3A4 を阻害しないことが示されました。
排泄
静脈内投与された臭化チオトロピウムは、主に未変化のまま尿中に排泄されます (74%)。定常状態で COPD 患者に乾燥粉末を吸入させた後、尿中排泄は 24 時間にわたって未変化用量の 7% (1.3mcg) でした。チオトロピウムの腎クリアランスはクレアチニンクリアランスを上回り、尿中への分泌を示します。
特定の集団
高齢患者
主に腎から排泄されるすべての薬剤で予想されるように、加齢はチオトロピウム腎クリアランスの減少と関連していました (65 歳未満の COPD 患者では 365 mL/分、65 歳以上の COPD 患者では 271 mL/分)。これは、HANDIHALER デバイスによる投与後の AUC0-6,ss および Cmax,ss 値の対応する増加をもたらしませんでした。
腎障害
COPD 患者に SPIRIVA 9mcg HANDIHALER または SPIRIVA 9mcg RESPIMAT を 1 日 1 回 4 週間投与した後、軽度の腎機能障害 (クレアチニンクリアランス 60 ~
肝障害
チオトロピウムの薬物動態に対する肝障害の影響は研究されていません。
薬物相互作用
チオトロピウム (14.4 mcg を 15 分間かけて静脈内注入) とシメチジン 400 mg を 1 日 3 回またはラニチジン 300 mg を 1 日 1 回投与する相互作用試験が実施されました。シメチジンとチオトロピウムの併用投与により、AUC0-4h が 20% 増加し、チオトロピウムの腎クリアランスが 28% 減少し、96 時間にわたって Cmax と尿中排泄量に有意な変化はありませんでした。チオトロピウムとラニチジンの同時投与は、チオトロピウムの薬物動態に影響を与えませんでした。
COPD 患者が使用する一般的な併用薬(長時間作用型ベータ 2 アドレナリン作動薬(LABA)、吸入コルチコステロイド(ICS))は、チオトロピウムへの曝露を変化させることがわかりませんでした。
臨床研究
SPIRIVA 9mcg HANDIHALER (臭化チオトロピウム吸入粉末) の臨床開発プログラムは、COPD 患者 2,663 人 (1,308 人が SPIRIVA 9mcg HANDIHALER を投与) を対象とした 6 つの第 III 相試験で構成されていました。研究および 2 つの 1 年間のイプラトロピウム対照研究。これらの研究では、COPD の臨床診断を受け、40 歳以上で、10 パックイヤーを超える喫煙歴があり、1 秒間の努力呼気量 (FEV1) が 60% 以下の患者が登録されました。または予測の 65%、および FEV1/FVC の比率が 0.7 以下。
これらの研究では、SPIRIVA HANDIHALER を 1 日 1 回朝に投与すると、肺機能 (FEV1) が改善され、最初の投与から 3 時間以内に効果がピークに達しました。
追加の 2 つの試験で増悪が評価されました。米国退役軍人局の設定で 1,829 人の COPD 患者を対象とした 6 か月間、無作為化、二重盲検、プラセボ対照、多施設共同臨床試験、および 4 年間、無作為化、二重盲検、プラセボ対照、 5992 人の COPD 患者を対象とした多施設臨床試験。肺機能およびその他の転帰に対する長期的な影響も、4 年間の多施設共同試験で評価されました。
肺機能に対する6か月から1年の影響
年間のプラセボ対照試験では、30 分での FEV1 の平均改善は 0.13 リットル (13%) であり、最初の投与 (1 日目) 後のベースラインと比較して最大改善は 0.24 リットル (24%) でした。 FEV1 と努力肺活量 (FVC) のさらなる改善が観察され、1 日 1 回の治療で 8 日目までに薬力学的な定常状態に達しました。ベースラインと比較した FEV1 の平均ピーク改善は、1 日 1 回の治療の 1 週間後 (8 日目) で 0.28 ~ 0.31 リットル (28% ~ 31%) でした。肺機能の改善は、単回投与後 24 時間維持され、1 年間の治療期間にわたって一貫して維持され、耐性の証拠はありませんでした。
つの 6 か月間のプラセボ対照試験では、シリアル スパイロメトリック評価が、トライアル A (12 時間) では日中の時間全体にわたって実行され、トライアル B では 3 時間に制限されました。12 時間にわたるシリアル FEV1 値 (トライアル A) は、図 1. これらの試験は、SPIRIVA 9mcg HANDIHALER による肺機能 (FEV1) の改善をさらに裏付けています。有効性は、6 か月の治療期間にわたって投与後 24 時間維持されました。
図 1: 試験 A の 1 日目と 169 日目の (治験薬の投与前と投与後) 平均 FEV1 (6 か月間プラセボ対照試験)* 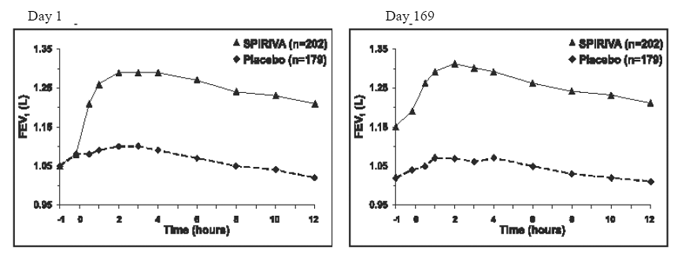
*センター、治療、およびベースライン効果に対して調整された平均値。 169 日目に、SPIRIVA HANDIHALER 群とプラセボ群のそれぞれ合計 183 名と 149 名の患者が試験を完了しました。残りの患者のデータは、最後の観測または繰り越された最も好ましくない観測を使用して帰属されました。
年間のイプラトロピウム対照試験のそれぞれの結果は、1 年間のプラセボ対照試験の結果と同様でした。これらの試行の 1 つの結果を図 2 に示します。
図 2: 2 つのイプラトロピウム対照研究の 1 つについて、それぞれ 1 日目と 92 日目の経時的平均 FEV1 (投与後 0 ~ 6 時間) (投与後 0 ~ 6 時間)* 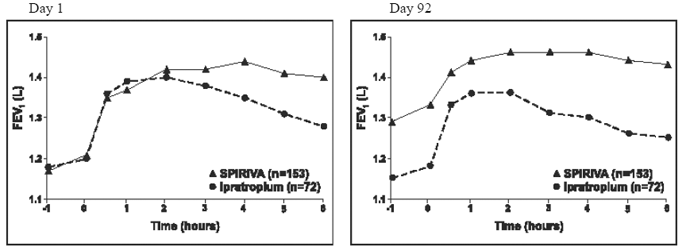
*センター、治療、およびベースライン効果に対して調整された平均値。 92 日目 (主要評価項目) に、スピリーバ ハンディヘラー群 151 人、イプラトロピウム群 69 人が 3 か月間の観察を完了しました。残りの患者のデータは、最後の観測または繰り越された最も好ましくない観測を使用して帰属されました。
COPD 患者 105 人を対象とした無作為化プラセボ対照臨床試験では、SPIRIVA 9mcg ハンディヘラーが朝または夕方に投与されたかどうかに関係なく、プラセボと比較して 24 時間の投与間隔を通して気管支拡張が維持されたことが示されました。
つのプラセボ対照試験の 1 年間の治療期間の各週を通して、スピリーバ 9mcg ハンディヘラーを服用している患者は、レスキュー短時間作用型ベータ 2 アゴニストの使用の必要性が減少しました。プラセボと比較して、レスキュー短時間作用型ベータ 2 アゴニストの使用の減少は、2 つの 6 か月の研究の 1 つで実証されました。
肺機能に対する4年間の影響
5,992 人の COPD 患者を対象とした 4 年間の無作為化二重盲検プラセボ対照多施設臨床試験を実施し、疾患の進行に対する SPIRIVA HANDIHALER の長期効果 (FEV1 の低下率) を評価しました。患者は、吸入抗コリン薬以外のすべての呼吸薬(短時間作用型および長時間作用型ベータ作動薬、吸入および全身ステロイド、およびテオフィリンを含む)の使用を許可されました。患者は 40 ~ 88 歳で、75% が男性、90% が白人で、COPD と診断されており、気管支拡張薬投与前の平均 FEV1 は研究登録時に 39% 予測されました (範囲 = 9% ~ 76%)。時間の経過に伴う FEV1 の低下の傾きが類似していることからもわかるように、共同主要な有効性評価項目である気管支拡張薬投与前および投与後の FEV1 の年間低下率のいずれにおいても、グループ間に差はありませんでした (図 3)。
SPIRIVA HANDIHALER は、4 年間の試験を通じてトラフ (投与前) FEV1 (経時調整平均値: 87 ~ 103 mL) の改善を維持しました (図 3)。
図 3: 各時点でのトラフ (投与前) FEV1 平均値 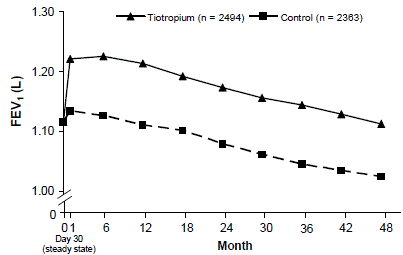
反復測定ANOVAを使用して平均を推定しました。平均は、ベースライン測定のために調整されます。ベースライン トラフ FEV1 (観察平均) = 1.12。 30 日目以降に 3 回以上の許容可能な肺機能検査があり、ベースライン値が欠落していない患者が分析に含まれました。
増悪
COPD 増悪に対する SPIRIVA 9mcg HANDIHALER の効果は、2 つの臨床試験で評価されました。上記の 4 年間の臨床試験と、1,829 人の COPD 患者を対象とした 6 か月間の臨床試験です。 6 か月の試験では、COPD 増悪は、少なくとも 3 日間持続する咳、喀痰、喘鳴、呼吸困難、または胸部圧迫感のうちの 1 つ以上の呼吸器症状 (増加または新たな発症) の複合体として定義されました。抗生物質、全身ステロイド、または入院による治療が必要です。集団の年齢は 40 ~ 90 歳で、男性 99%、白人 91%、気管支拡張前 FEV1 予測率の平均が 36% (範囲 = 8% ~ 93%) の COPD でした。患者は、吸入抗コリン薬以外の呼吸薬(短時間作用型および長時間作用型ベータ作動薬、吸入および全身ステロイド、およびテオフィリンを含む)の使用を許可されました。 6 か月の試験では、共同主要評価項目は、COPD 増悪患者の割合と、COPD 増悪による入院患者の割合でした。 SPIRIVA 9mcg HANDIHALER は、プラセボと比較して増悪を経験した COPD 患者の割合を有意に減少させました (それぞれ 27.9% 対 32.3%; オッズ比 (OR) (チオトロピウム/プラセボ) = 0.81; 95% CI = 0.66, 0.99; p = 0.037) )。プラセボと比較して、スピリーバ 9mcg ハンディヘラーを使用した患者における COPD 増悪による入院患者の割合は、それぞれ 7.0% 対 9.5% でした。または = 0.72; 95% CI = 0.51、1.01; p = 0.056。
増悪は、4 年間の多施設試験で副次的結果として評価されました。この試験では、COPD 増悪は、次の呼吸器症状 (咳、喀痰、喀痰化膿、喘鳴、呼吸困難) の 1 つ以上の増加または新たな発症として定義され、抗生物質による治療および/または全身(経口、筋肉内、または静脈内)ステロイド。 SPIRIVA HANDIHALER は、増悪のリスクを 14% 有意に減少させ (ハザード比 (HR) = 0.86; 95% CI = 0.81、0.91; p
全死因死亡率
上記の 4 年間のプラセボ対照肺機能試験では、プラセボと比較した全死因死亡率が評価されました。 SPIRIVA 9mcg HANDIHALER とプラセボの間で全死因死亡率に有意差はありませんでした。
SPIRIVA HANDIHALER の全死因死亡率は、追加の無作為化二重盲検二重ダミー実薬対照試験で最大 3 年間の観察期間で、チオトロピウム吸入スプレー 5 mcg (SPIRIVA RESPIMAT 5 mcg) と比較されました。 SPIRIVA 9mcg HANDIHALERとSPIRIVA RESPIMATの間で全死因死亡率は同程度でした。
患者情報
スピリバ 9mcgR® (speh REE vah) ハンドヘラー® (臭化チオトロピウム)吸入粉末、経口吸入用
SPIRIVA カプセルを飲み込まないでください。
重要な情報: SPIRIVA カプセルを飲み込まないでください。 SPIRIVA 9mcg カプセルは、HANDIHALER デバイスでのみ使用し、口から吸入 (経口吸入) する必要があります。
SPIRIVA HANDIHALER を使用する前、および処方箋を補充するたびに、SPIRIVA HANDIHALER に付属の情報をお読みください。新しい情報があるかもしれません。このリーフレットは、あなたの病状や治療について医師と話すことに代わるものではありません.
SPIRIVA ハンドヘラーとは?
- SPIRIVA HANDIHALERは、慢性気管支炎や肺気腫などの慢性閉塞性肺疾患(COPD)の症状をコントロールするために毎日使用する処方薬(維持薬)です。
- SPIRIVA HANDIHALER は、肺の働きを 24 時間改善します。 SPIRIVA 9mcg HANDIHALER は、気道を弛緩させ、気道を開いた状態に保ちます。初日は呼吸が楽になったと感じるかもしれませんが、薬の効果を十分に感じるには時間がかかる場合があります。 SPIRIVA HANDIHALER は最もよく機能し、毎日使用すると呼吸が楽になります。
- SPIRIVA 9mcg HANDIHALER は、COPD 症状の再燃および悪化 (COPD 増悪) の可能性を減らします。 COPD 増悪は、咳、粘液、息切れ、喘鳴などの複数の COPD 症状の増加または新たな発症として定義され、救急薬以上の薬が必要です。
SPIRIVA 9mcg HANDIHALER はレスキュー薬ではなく、突然の呼吸障害の治療には使用しないでください。 医師は、突然の呼吸障害に使用する他の薬を処方する場合があります。
SPIRIVA 9mcg HANDIHALER が子供に安全で効果的かどうかは不明です。
SPIRIVA 9mcg HANDIHALERを服用してはいけない人は?
次の場合は、スピリーバ 9mcg ハンドヘラーを使用しないでください。
- チオトロピウム、イプラトロピウム (Atrovent®)、または SPIRIVA 9mcg HANDIHALER のいずれかの成分にアレルギーがある。 SPIRIVA 9mcg HANDIHALER の全成分リストについては、このリーフレットの最後をご覧ください。
SPIRIVA 9mcg HANDIHALER に対する深刻なアレルギー反応の症状には、次のようなものがあります。
- 皮膚に隆起した赤い斑点 (蕁麻疹)
- かゆみ
- 発疹
- 呼吸や嚥下困難を引き起こす可能性のある顔、唇、舌、喉の腫れ
アレルギー反応のこれらの症状がある場合は、スピリーバ ハンディヘラーの使用を中止し、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
SPIRIVA HANDIHALERを使用する前に医師に何を伝えるべきですか?
SPIRIVA HANDIHALER を服用する前に、次の場合を含め、すべての病状について医師に相談してください。
- 腎臓に問題があります。
- 緑内障があります。 SPIRIVA HANDIHALER は緑内障を悪化させる可能性があります。
- 前立腺肥大、排尿障害、または膀胱の閉塞があります。 SPIRIVA 9mcg HANDIHALER は、これらの問題を悪化させる可能性があります。
- 妊娠している、または妊娠する予定がある。 SPIRIVA HANDIHALER が胎児に害を及ぼす可能性があるかどうかは不明です。
- 授乳中または授乳を計画している。 SPIRIVA HANDIHALER が母乳に移行するかどうかは不明です。 SPIRIVA 9mcg HANDIHALER が授乳中のあなたに適しているかどうかは、あなたと主治医が判断します。
- 乳タンパク質に対する重度のアレルギーがあります。よくわからない場合は、医師に尋ねてください。
服用しているすべての薬について医師に伝えてください。 処方薬と非処方薬、点眼薬、ビタミン、ハーブサプリメントを含みます。他の医薬品やサプリメントの一部は、スピリーバ ハンディヘラーの働きに影響を与える可能性があります。 SPIRIVA 9mcg HANDIHALERは抗コリン薬です。 SPIRIVA 9mcg HANDIHALER を使用している間は、イプラトロピウムを含む他の抗コリン薬を服用しないでください。使用している薬が抗コリン薬かどうかわからない場合は、医師または薬剤師に相談してください。
服用している薬を知る。新しい薬を入手したときに医師や薬剤師に見せるために、あなたの薬のリストを保管してください。
SPIRIVA 9mcg HANDIHALER の服用方法は?
- SPIRIVA 9mcg HANDIHALER を処方されたとおりに使用してください。 SPIRIVA HANDIHALERを毎日1回使用してください。
- SPIRIVA HANDIHALERをご使用になる前に、このリーフレットの最後にある「使用上の注意」をお読みください。指示を理解できない場合は、医師に相談してください。
- SPIRIVA 9mcgカプセルを飲み込まないでください。
- HANDIHALER 装置では SPIRIVA 9mcg カプセルのみを使用してください。
- HANDIHALER 装置を他の薬の服用に使用しないでください。
- SPIRIVA 9mcg HANDIHALER は、HANDIHALER デバイスに適合する SPIRIVA 9mcg カプセルに入った粉末です。少量の SPIRIVA 粉末のみを含む SPIRIVA カプセルの各カプセルは、1 回分の薬です。
- ブリスター カードから 1 つのブリスターを分離します。 SPIRIVA 9mcg カプセルの 1 つを使用する直前にブリスター パッケージから取り出します。
- カプセルに穴を開けた後、ハンディヘラー装置を使用して口から粉末を 2 回吸い込むことにより、スピリーバ ハンディヘラーの全用量を服用します (1 つのスピリーバ カプセルから 2 回吸入します)。を参照してください 「使用上の注意」 このリーフレットの最後に。
- ブリスター包装から取り出した後、すぐに使用しないSPIRIVAカプセルは廃棄してください。 SPIRIVA カプセルを空気にさらしたままにしないでください。それらはうまくいかないかもしれません。
- 飲み忘れた場合は、気がついたらすぐに服用してください。 SPIRIVA HANDIHALER を 24 時間ごとに 1 回以上使用しないでください。 ? SPIRIVA HANDIHALER の処方量を超えて使用する場合は、医師または毒物管理センターに連絡してください。
SPIRIVA 9mcg HANDIHALERを使用している間、何を避けるべきですか?
- SPIRIVAカプセルの粉末が目に入らないようにしてください。視界がぼやけたり、瞳孔が大きくなる(散大する)ことがあります。このような場合は、医師に連絡してください。
- SPIRIVA 9mcg HANDIHALER は、めまいやかすみ目を引き起こす可能性があります。これらの症状を経験した場合は、車の運転や電化製品やその他の機械の操作などの活動に従事する際には注意が必要です.
SPIRIVA HANDIHALERの考えられる副作用は何ですか?
SPIRIVA 9mcg HANDIHALER は、次のような重大な副作用を引き起こす可能性があります。 アレルギー反応。症状には次のものがあります。
- 皮膚に隆起した赤い斑点 (蕁麻疹)
- かゆみ
- 発疹
- 呼吸や嚥下の困難を引き起こす可能性のある唇、舌、または喉の腫れ
アレルギー反応のこれらの症状がある場合は、スピリーバ ハンディヘラーの使用を中止し、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
- 肺への気道の突然の狭窄および閉塞(気管支痙攣) .呼吸が急に悪くなる。
気管支痙攣のこれらの症状がある場合は、スピリーバ 9mcg ハンディヘラーの服用を中止し、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
- 眼圧の上昇または悪化(急性狭隅角緑内障)。 急性狭隅角緑内障の症状には次のようなものがあります。
- 眼の痛み
- ぼやけた視界
- ハロー(ビジュアルハロー)または色付きの画像と赤い目を見る
これらの症状を治療するために点眼薬だけを使用しても効果がない場合があります。これらの症状がある場合は、スピリーバ ハンディヘラーの使用を中止し、直ちに医師に連絡してください。
- 尿閉の新規または悪化。 膀胱の閉塞および/または前立腺肥大の症状には、排尿困難、排尿時の痛みなどがあります。
このような尿閉の症状がある場合は、スピリーバ ハンディヘラーの使用を中止し、直ちに医師に連絡してください。
SPIRIVA 9mcg HANDIHALER のその他の副作用は次のとおりです。
- 上気道感染症
- 口渇
- 副鼻腔感染症
- 喉の痛み
- 非特異的な胸の痛み
- 尿路感染
- 消化不良
- 鼻水が出る
- 便秘
- 心拍数の増加
- ぼやけた視界
SPIRIVA HANDIHALER の副作用はこれだけではありません。気になる副作用や治らない副作用がある場合は、医師に相談してください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
SPIRIVA HANDIHALER の保管方法を教えてください。
- SPIRIVA カプセルを HANDIHALER デバイスに保管しないでください。
- SPIRIVA カプセルは、密封されたブリスター パッケージに入れ、室温 68°F ~ 77°F (20°C ~ 25°C) で保管してください。
- SPIRIVA カプセルは、高温と低温を避けて保管してください (凍結しないでください)。
- SPIRIVA 9mcg カプセルは乾燥した場所に保管してください。空気に触れた未使用の SPIRIVA 9mcg カプセルは廃棄してください。
SPIRIVA 9mcg カプセルの保管について質問がある場合は、医師または薬剤師にお尋ねください。
SPIRIVA HANDIHALER、SPIRIVA 9mcg カプセル、およびすべての医薬品は、子供の手の届かないところに保管してください。
SPIRIVA HANDIHALERに関する一般情報
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。 SPIRIVA 9mcg HANDIHALER を処方されていない目的で使用しないでください。他の人があなたと同じ症状を持っている場合でも、SPIRIVA HANDIHALER を与えないでください。それらに害を及ぼす可能性があります。
SPIRIVA HANDIHALER の詳細については、医師にご相談ください。医療専門家向けに書かれた SPIRIVA 9mcg HANDIHALER に関する情報については、医師または薬剤師にお尋ねください。
SPIRIVA 9mcg HANDIHALER の詳細については、www.SPIRIVA.com にアクセスするか、以下のコードをスキャンするか、Boehringer Ingelheim Pharmaceuticals, Inc. (1-800-542-6257 または (TTY) 1-800-459-9906) に電話してください。
SPIRIVA 9mcg HANDIHALERの成分は何ですか?
有効成分: チオトロピウム
不活性成分: 乳糖一水和物
COPD(慢性閉塞性肺疾患)とは?
COPD は、慢性気管支炎、肺気腫、またはその両方を含む重篤な肺疾患です。 COPDの多くは喫煙が原因です。 COPDになると気道が狭くなります。そのため、空気は肺からゆっくりと排出されます。これにより、呼吸が困難になります。
この患者情報は、米国食品医薬品局によって承認されています。
使用説明書スピリバ® (speh REE vah) ハンドヘラー® (臭化チオトロピウム)吸入粉末、経口吸入用
SPIRIVA カプセルを飲み込まないでください。
SPIRIVA HANDIHALER の使用に関する重要な情報
- SPIRIVA 9mcgカプセルを飲み込まないでください。
- SPIRIVA カプセルは、HANDIHALER デバイスでのみ使用し、口から吸入 (経口吸入) する必要があります。
- 他の薬を服用するために HANDIHALER デバイスを使用しないでください。
SPIRIVA HANDIHALER の使用を開始する前、および処方箋を補充するたびに、まず患者情報を読み、次にこの使用説明書をお読みください。新しい情報があるかもしれません。
HANDIHALER デバイスと SPIRIVA カプセルに慣れる:
SPIRIVA HANDIHALER には、ブリスター包装の SPIRIVA 9mcg カプセルと HANDIHALER デバイスが付属しています。薬に付属している新しい HANDIHALER デバイスを使用してください。
HANDIHALER デバイスの部品には以下が含まれます。
(図 A 参照)
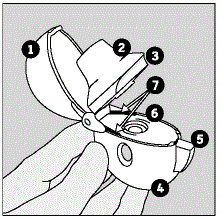
図A
各 SPIRIVA 9mcg カプセルはブリスターに包装されています。 (図 B 参照)
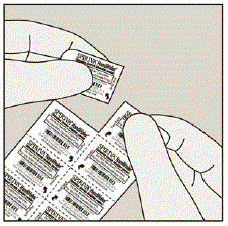
図 B
- SPIRIVA の各カプセルには少量の粉末しか含まれていません。 (図 C 参照) これは 1 回分です。
- SPIRIVA 9mcgカプセルを開けないでください または動作しない場合があります。

図 C
1 日分の薬を完全に服用するには、主に 4 つのステップが必要です。
ステップ 1. HANDIHALER デバイスを開く:
ポーチから HANDIHALER デバイスを取り出した後:
- 緑のピアスボタンを押して、ダストキャップ(ふた)を開けます。 (図 D 参照)
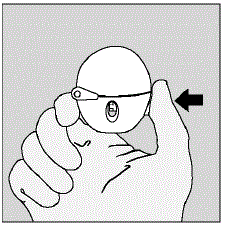
図 D
- ダスト キャップ (蓋) をベースから上に引き上げて、マウスピースを露出させます。 (図 E 参照)
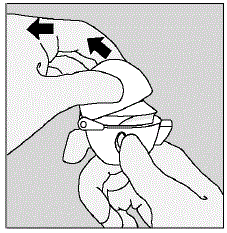
図E
- 中央のチャンバーが見えるように、マウスピースのリッジをベースから引き上げてマウスピースを開きます。 (図 F 参照)

図 F
ステップ 2. SPIRIVA 9mcg カプセルを HANDIHALER デバイスに挿入します。
毎日、ミシン目に沿って引き裂いて、ブリスター カードからブリスターを 1 つだけ分離します。 (図 G を参照)
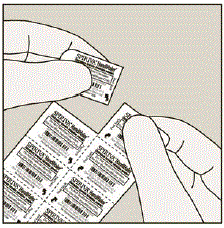
図G
ブリスターから SPIRIVA カプセルを取り出します。
- しない ブリスターから SPIRIVA カプセルを取り出すには、ホイルを切るか、鋭利な器具を使用します。
- ブリスターの角の 1 つを矢印で曲げ、アルミ ホイルの層を分離します。
- SPIRIVA カプセル全体が見えるまで、印刷されたホイルをはがします。 (図H参照)
- 1 つ以上のブリスターを空中に開いた場合、余分な SPIRIVA 9mcg カプセルは使用せず、廃棄する必要があります。
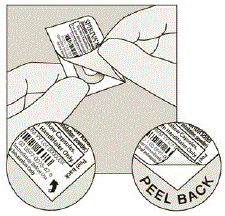
図 H
SPIRIVA 9mcg カプセルを HANDIHALER デバイスの中央チャンバーに入れます。 (図 I 参照)
図Ⅰ
カチッと音がするまで、マウスピースを灰色のベースにしっかりと閉じます。ダストキャップ(ふた)は開けたままにしてください。 (図 J 参照)
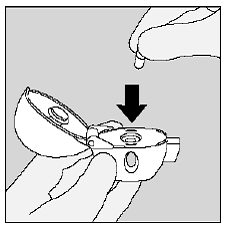
図J
ステップ 3. SPIRIVA 9mcg カプセルのピアシング:
- マウスピースを上に向けて HANDIHALER デバイスを持ちます。 (図K参照)
- 緑色のピアス ボタンをベースに対して平らになるまで (平らになるまで) 1 回押してから離します。このようにスピリーバのカプセルに穴を開けて、息を吸ったときに薬が出るようにします。
- しない 緑色のボタンを複数回押します。
- しない HANDIHALER デバイスを振ってください。
- SPIRIVA 9mcg カプセルのピアシングは、小さい ゼラチン片。これらの小さな破片の一部は、薬を吸い込んだときに HANDIHALER デバイスの画面を通り抜けて口や喉に入ることがあります。これは正常です。ゼラチンの小片はあなたに害を及ぼすべきではありません.
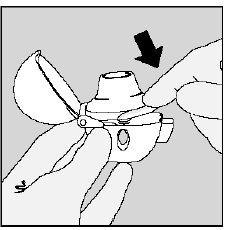
図K
ステップ 4. 1 日量を完全に摂取する (同じ SPIRIVA 9mcg カプセルから 2 回吸入):
1回の息で完全に息を吐き、 肺の空気を空にします。 (図 L 参照)
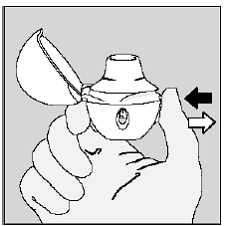
図L
重要: しないでください HANDIHALER デバイスに息を吹き込みます。
次の呼吸で、薬を服用してください。
- まっすぐ前を見ながら、頭を直立させます。 (図M参照)
- HANDIHALER デバイスを水平位置で口まで持ち上げます。 しない 吸気口をふさいでください。
- マウスピースの周りで唇をしっかり閉じます。
- 深く息を吸う 肺がいっぱいになるまで。あなたがすべき SPIRIVAカプセルの振動を聞いたり感じたりする (ガラガラ)。 (図M参照)
- 数秒間息を止め、同時に HANDIHALER デバイスを口から取り出します。
- 再び通常の呼吸をします。
図M
ガラガラは、正しく息を吸ったことを知らせます。ガタガタ音を聞いたり感じたりしない場合は、「薬を吸い込んだときにスピリーバカプセルのガタガタ音を聞いたり感じたりしない場合」のセクションを参照してください。
図N
1 日量を完全に摂取するには、もう一度完全に息を吐き (図 N を参照)、同じ SPIRIVA カプセルからもう一度息を吸います (図 O を参照)。
重要: しないでください 緑のピアスボタンをもう一度押します。
図 O
覚えて: 毎日完全な薬用量を得るには、同じ SPIRIVA 9mcg カプセルから 2 回息を吸う必要があります。 HANDIHALER デバイスから息を吸う前に、毎回完全に息を吐き出すようにしてください。
SPIRIVA HANDIHALER のお手入れと保管:
図 P
- 1日量を服用した後、マウスピースを開き、使用済みのSPIRIVA 9mcgカプセルを触れずにゴミ箱に捨ててください.
- SPIRIVA 9mcg カプセルの破片または SPIRIVA 9mcg 粉末の蓄積を、HANDIHALER デバイスを上下逆さまにして軽く、しかししっかりと叩いて取り除きます。 (図 P 参照) 次に、マウスピースとダストキャップを閉じて保管します。
- しない HANDIHALER デバイスと SPIRIVA 9mcg カプセル (ブリスター) を湿気の多い場所に保管してください。 SPIRIVA カプセルは、常に密封されたブリスターに保管してください。
薬を吸い込んだときに SPIRIVA 9mcg カプセルのガタガタ音が聞こえない、または感じない場合:
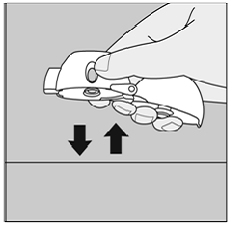
図Q
しない 緑のピアスボタンをもう一度押します。
マウスピースを上に向けて HANDIHALER デバイスを持ち、HANDIHALER デバイスをテーブルの上で軽くたたきます。 (図Q参照)
マウスピースが完全に閉じていることを確認してください。息を完全に吐ききってから、マウスピースをくわえた状態で再び深く息を吸い込みます。 (図 O 参照)
上記の手順を繰り返しても SPIRIVA カプセルのガタガタ音が聞こえない、または感じない場合:
- SPIRIVAカプセルは捨ててください。
- 緑色のピアス ボタンを持ち上げてベースを開き、中央のチャンバーに SPIRIVA 9mcg カプセルの破片がないか確認します。中央のチャンバーに SPIRIVA 9mcg カプセルの破片があると、SPIRIVA 9mcg カプセルがガタガタ鳴らなくなることがあります。
- HANDIHALER デバイスを逆さにして、静かに、しかししっかりと、SPIRIVA カプセルの破片を取り出します。医師に連絡して指示を受けてください。
HANDIHALER デバイスのクリーニング:
必要に応じて HANDIHALER デバイスをクリーニングしてください。 (図R参照)
- HANDIHALER デバイスを洗浄した後、風乾するには 24 時間かかります。
- しない 洗浄剤または洗剤を使用してください。
- しない HANDIHALER デバイスを食器洗い機に入れて洗浄します。
クリーニング手順:
- ダストキャップとマウスピースを開けます。
- 緑のピアスボタンを持ち上げてベースを開きます。
- SPIRIVA 9mcg カプセルの破片または粉末の蓄積がないか、中央のチャンバーを調べます。表示された場合は、タップしてください。
- HANDIHALER デバイスをぬるま湯ですすぎ、緑色のピアス ボタンを数回押して、中央のチャンバーとピアス針が流水の下にくるようにします。粉末の蓄積や SPIRIVA カプセルの破片が取り除かれていることを確認してください。
- 余分な水分をペーパー タオルに落として、HANDIHALER デバイスをよく乾かします。その後、ダストキャップ、マウスピース、ベースを開いたまま、完全に広げて完全に乾かします。
- しない ヘアドライヤーを使用して HANDIHALER デバイスを乾かしてください。
- しない HANDIHALER デバイスは濡れた状態で使用してください。必要に応じて、マウスピースの外側をきれいな湿った布で拭いてください。
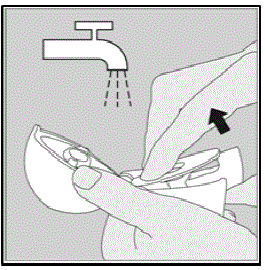
図 R
SPIRIVA 9mcg HANDIHALER の 1 日量を適切に摂取するためのヒント:
- プレス 緑のピアスボタン 1回; 2回息を吸います。完全に息を吐く 2回の吸入のそれぞれの前。
- 常に、薬に付属の新しい HANDIHALER デバイスを使用してください。
- 緑色のピアス ボタンを押すときは、マウスピースを上に向けて HANDIHALER デバイスを保持してください。
- 緑のピアスボタンを1回押す SPIRIVA カプセルを突き刺します。
- HANDIHALER 装置に息を吹き込まないでください。
- 息を吸うときは、HANDIHALER デバイスを水平位置に保ち、頭を直立させ、まっすぐ前を見てください。
- SPIRIVA 9mcgカプセルの破片または粉末の蓄積がないか、HANDIHALERデバイスの中央チャンバーを確認してください。破片や粉末が見られる場合は、タップしてから使用してください。
- ハンドヘラーは必要に応じて洗浄し、完全に乾かしてください。
詳細については、医師または薬剤師に尋ねるか、www.spiriva.com にアクセスするか、以下のコードをスキャンするか、1-800-542-6257 または (TTY) 1-800-459-9906 に電話してください。
この使用説明書は、米国食品医薬品局によって承認されています。
