Pulmicort 100mcg, 200mcg Budesonide 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
パルミコート 100mcg タービュヘイラーとは何ですか? また、どのように使用されますか?
Pulmicort 100mcg Turbuhaler は、喘息の症状を治療するために使用される処方薬です。パルミコート 100mcg タービュヘイラーは、単独で使用することも、他の薬剤と併用することもできます。
Pulmicort Turbuhaler は、コルチコステロイド、吸入剤と呼ばれる薬物のクラスに属します。
Pulmicort Turbuhaler が 1 歳未満の子供に安全で効果的かどうかはわかっていません。
Pulmicort 200mcg Turbuhaler の副作用の可能性は何ですか?
パルミコート 100mcg タービュヘイラーは、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 異常な疲労感
- 視力の問題、
- あざや出血しやすい、
- むくんだ顔、
- 異常な発毛、
- 気分の変化、
- うつ、
- 気分のむら、
- 攪拌、
- 筋力低下や痛み、
- 皮膚が薄くなる、
- 傷の治りが遅く、
- 喉の渇きや排尿の増加
上記の症状がある場合は、すぐに医療機関を受診してください。
パルミコート 100mcg タービュヘイラーの最も一般的な副作用は次のとおりです。
- 乾燥、炎症、または喉の痛み、
- 嗄声、
- 声変わり、
- 口に悪い味、
- 鼻水や鼻づまりなど
- 鼻血
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Pulmicort Turbuhaler の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
経口吸入専用。
説明
PULMICORT TURBUHALER (ブデソニド) 200 mcg の有効成分であるブデソニドは、化学的に (RS)-11β, 16α, 17,21-テトラヒドロキシプレグナ-1,4-ジエン-3,20-ジオン環状 16,17- と呼ばれるコルチコステロイドです。アセタールとブチルアルデヒド。ブデソニドは、2 つのエピマー (22R および 22S) の混合物として提供されます。ブデソニドの実験式は C25H34O6 で、分子量は 430.5 です。その構造式は次のとおりです。
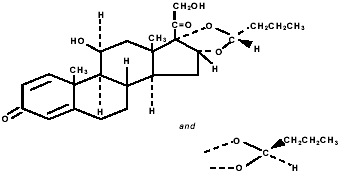
ブデソニドは白色からオフホワイトの無味無臭の粉末で、水やヘプタンにはほとんど溶けず、エタノールにはほとんど溶けず、クロロホルムには溶けやすい。 pH 7.4 でのオクタノールと水の分配係数は 1.6 x 103 です。
PULMICORT 100mcg TURBUHALER (ブデソニド) は、微粉化されたブデソニドのみを含む、吸入駆動の複数回用量乾燥粉末吸入器です。 PULMICORT 100mcg TURBUHALER を作動させるたびに、計量用量あたり 200 mcg のブデソニドが提供され、マウスピースから約 160 mcg のブデソニドが送達されます (60 L/分で 2 秒間の in vitro テストに基づく)。
インビトロ試験では、PULMICORT 100mcg TURBUHALER (ブデソニド) の投与量は、デバイスを通過する気流に大きく依存することが示されています。吸気流量などの患者要因も、実際の使用時に患者の肺に送達される線量に影響します( 患者の使用説明書 )。喘息の成人患者 (平均 FEV1 2.9 L [0.8 - 5.1 L]) では、パルミコート ターブヘイラー (ブデソニド) による平均最大吸気流量 (PIF) は 78 (40-111) L/分でした。同様の結果 (平均 PIF 82 [43-125] L/分) が喘息の子供 (6 ~ 15 歳、平均 FEV1 2.1 L [0.9 ~ 5.4 L]) で得られました。患者は、最適な用量送達を保証するために、この医薬品の使用について慎重に指示されるべきです.
適応症
PULMICORT TURBUHALER (ブデソニド) は、6 歳以上の成人および小児患者における予防療法としての喘息の維持治療に適応されます。また、喘息のために経口コルチコステロイド療法が必要な患者にも適応されます。これらの患者の多くは、時間の経過とともに経口コルチコステロイドの必要性を減らしたり、なくしたりすることができるかもしれません.
PULMICORT 100mcg TURBUHALER (ブデソニド) は、急性気管支痙攣の緩和には適応されません。
投薬と管理
PULMICORT 200mcg TURBUHALER (ブデソニド) は、6 歳以上の喘息患者に経口吸入経路で投与する必要があります。個々の患者は、さまざまな発症および症状緩和の程度を経験します。一般に、パルミコート ターブヘラー (ブデソニド) は、吸入コルチコステロイドとして比較的迅速に作用を開始します。 PULMICORT 200mcg TURBUHALER (ブデソニド) の吸入投与後の喘息コントロールの改善は、治療開始から 24 時間以内に起こる可能性がありますが、1 ~ 2 週間以上は最大の効果が得られない場合があります。 PULMICORT TURBUHALER (ブデソニド) の推奨用量を超えて投与した場合の安全性と有効性は確立されていません。
以前の喘息治療に基づいた PULMICORT TURBUHALER (ブデソニド) の推奨開始用量と最高推奨用量を次の表に示します。
*吸入コルチコステロイドで十分にコントロールされている軽度から中等度の喘息患者では、パルミコート 100mcg ターブヘラー (ブデソニド) 200 mcg または 400 mcg を 1 日 1 回投与することを検討してください。 PULMICORT 200mcg TURBUHALER (ブデソニド) は、朝または夕方に 1 日 1 回投与できます。
PULMICORT 200mcg TURBUHALER (ブデソニド) による 1 日 1 回の治療で喘息の症状が十分にコントロールされない場合は、1 日あたりの総投与量を増やすか、分割して投与する必要があります。
慢性経口コルチコステロイドで維持されている患者
最初は、PULMICORT TURBUHALER (ブデソニド) を、患者の通常の全身性コルチコステロイドの維持用量と同時に使用する必要があります。約 1 週間後、1 日または 1 日おきの投与量を減らして、全身性コルチコステロイドの段階的な中止を開始します。次の減量は、患者の反応に応じて、1 週間または 2 週間の間隔の後に行われます。一般に、これらの減少は、プレドニゾンまたはその同等物の 2.5 mg を超えてはなりません。ゆっくりとした撤退速度を強くお勧めします。経口コルチコステロイドの減量中は、気道機能の客観的測定を含む喘息の不安定性、および副腎不全について患者を注意深く監視する必要があります。 警告 )。離脱中、一部の患者は、肺機能の維持または改善にもかかわらず、全身性コルチコステロイド離脱の症状、例えば、関節および/または筋肉痛、倦怠感、および抑うつを経験する場合がある.このような患者には、パルミコート ターブヘラー(ブデソニド)を継続するように勧める必要がありますが、副腎機能不全の客観的な兆候がないか監視する必要があります。副腎機能不全の証拠が発生した場合、全身コルチコステロイドの投与量を一時的に増やし、その後、離脱をよりゆっくりと継続する必要があります。ストレスまたは重度の喘息発作の期間中、移送患者は全身性コルチコステロイドによる補足治療が必要になる場合があります。
ノート: すべての患者において、喘息の安定が達成されたら、最低有効用量まで滴定することが望ましい。
使用方法
患者の指示の図解 PULMICORT 200mcg TURBUHALER (ブデソニド) の各パッケージに添付されています。
患者は、最初に使用する前にパルミコート ターブヘラー (ブデソニド) をプライミングするように指示され、ユニットを使用するたびに深く力強く吸入するように指示されます。吸入後に口をすすぐこともお勧めします。
供給方法
PULMICORT TURBUHALER (ブデソニド) は、いくつかの組み立てられたプラスチックの詳細で構成されています。主な部品は、投与機構、原薬の保管ユニット、およびマウスピースです。吸入器は、吸入器にねじ込まれた白い外側の管状カバーによって保護されています。吸入器の本体は白、回転グリップは茶色です。次の文言は、「Pulmicort™ 200 mcg」という隆起した文字でグリップに印刷されています。 TURBUHALER 吸入器は補充できず、空になったら廃棄する必要があります。
PULMICORT TURBUHALER (ブデソニド) は、200 mcg/用量、200 用量 (NDC 0186-0915-42) として入手可能で、目標充填重量は 104 mg です。
PULMICORT 200mcg TURBUHALER (ブデソニド) の残りが 20 回分になると、インジケーター ウィンドウに赤いマークが表示されます。ウィンドウ下部の赤いマークが表示された時点を超えて使用すると、正しい量の薬剤が得られない場合があります。ユニットは廃棄する必要があります。
カバーを締めた状態で、室温 20 ~ 25°C (68 ~ 77°F) に制御された乾燥した場所に保管してください [USP を参照]。子供の手の届かないところに保管してください。
すべての商標はアストラゼネカ グループの所有物です。 ©AstraZeneca 2001, 2006. 製造元: AstraZeneca LP, Wilmington, DE 19850 By: AstraZeneca AB, Sodertalje, Sweden 33020-00. Rev. 10/06。 FDA 改訂日: 2007 年 8 月 20 日
副作用
PULMICORT 100mcg TURBUHALER(ブデソニド)を投与された患者において、以下の副作用が報告されました。
一般的な有害事象の発生率は、6 歳から 70 歳の成人および小児患者 1,116 人 (女性 472 人、男性 644 人) がプルミコート ターブヘイラー (ブデソニド) (200 ~ 800 mcg を 1 日 2 回、12 ~ 20 週間) またはプラセボ。
次の表は、以前に気管支拡張薬および/または吸入コルチコステロイドを投与された患者における有害事象の発生率を、米国の対照臨床試験で示しています。この集団には、232 人の男性と 62 人の女性の小児患者 (6 ~ 17 歳) と、332 人の男性と 331 人の女性の成人患者 (18 歳以上) が含まれていました。
PULMICORT 100mcg TURBUHALER(ブデソニド)の患者から報告された発生率が 3% 以上の有害事象
上の表には、いずれかのパルミコート タービュヘラー(ブデソニド)群で 3% 以上の割合で発生し、プラセボ群よりも一般的であったすべての事象(研究者が薬物関連または非薬物関連とみなした場合)が含まれています。これらのデータを考慮する際には、プルミコート 200mcg ターブヘラー (ブデソニド) 患者の平均曝露期間の増加を考慮に入れる必要があります。
PULMICORT 100mcg TURBUHALER (ブデソニド) を使用したこれらの臨床試験では、以下の他の有害事象が 1 ~ 3% の発生率で発生し、プラセボよりも PULMICORT 200mcg TURBUHALER (ブデソニド) でより一般的でした。
全身: 首の痛み
心臓血管: 失神
消化器: 腹痛、口渇、嘔吐
代謝と栄養: 体重の増加
筋骨格: 骨折、筋肉痛
緊張: 筋緊張亢進、片頭痛
血小板、出血および凝固: 斑状出血
精神的: 不眠症
抵抗メカニズム: 感染
特別な感覚: 味の倒錯
以前に経口コルチコステロイドを必要とした成人の喘息患者を対象とした 20 週間の試験で、プルミコート ターブヘラー (ブデソニド) 400 mcg を 1 日 2 回 (N=53) および 800 mcg を 1 日 2 回 (N=53) 投与した場合の効果を、プラセボ (N=53) と比較しました。 ) 報告された有害事象の頻度について。治験責任医師が薬物関連または非薬物関連とみなした有害事象は、パルミコート 200mcg ターブヘラー (ブデソニド) 群の 5 人以上の患者で報告され、プラセボよりもパルミコート ターブヘラー (ブデソニド) でより頻繁に発生しました ( % PULMICORT TURBUHALER (ブデソニド) および % プラセボ)。これらのデータを考慮する際には、プルミコート 200mcg ターブヘラー (ブデソニド) 患者の平均曝露期間の増加 (パルミコート ターブヘラー (ブデソニド) で 78 日間、プラセボで 41 日間) を考慮する必要があります。
PULMICORT TURBUHALER(ブデソニド)を1日1回投与されている患者
PULMICORT 100mcg TURBUHALER (ブデソニド) 200mcg および 400mcg とプラセボの 1 日 1 回投与の有害事象プロファイルは、18 週間の研究で 309 人の成人喘息患者で評価されました。研究集団には、以前に吸入コルチコステロイドで治療された患者と、以前にコルチコステロイド療法を受けていない患者の両方が含まれていました。 PULMICORT 200mcg TURBUHALER (ブデソニド) を 1 日 1 回投与した場合と 1 日 2 回投与した場合では、有害事象のパターンに臨床的に関連する違いはありませんでした。
小児科研究: 以前に吸入コルチコステロイドで維持されていた 6 歳から 18 歳の小児患者 404 人を対象とした 12 週間のプラセボ対照試験では、各年齢カテゴリー (6 歳から 12 歳、13 歳から 18 歳) の有害事象の頻度は、パルミコート ターブヘイラーと同等でした。 (ブデソニド) (100、200、400 mcg を 1 日 2 回) とプラセボ。成人で報告されたものと比較して、子供の有害事象のパターンまたは重症度に臨床的に関連する違いはありませんでした。
他の情報源からの有害事象報告: 出版された文献または吸入ブデソニドの製剤に関する世界的なマーケティング経験から報告されたまれな有害事象には、次のものがあります。皮質機能低下症および皮質機能亢進症の症状;緑内障、白内障;うつ病、攻撃的な反応、過敏症、不安、精神病などの精神症状。
薬物相互作用
臨床研究では、喘息の治療に一般的に使用されるブデソニドと他の薬剤の同時投与は、有害事象の頻度の増加をもたらしませんでした.ブデソニドや他のコルチコステロイドの主な代謝経路は、シトクロム P450 (CYP) アイソザイム 3A4 (CYP3A4) を経由するものです。 CYP3A4 の強力な阻害剤であるケトコナゾールの経口投与後、経口投与されたブデソニドの平均血漿濃度が増加しました。 CYP3A4 の他の既知の阻害剤 (例えば、イトラコナゾール、クラリスロマイシン、エリスロマイシンなど) の同時投与は、ブデソニドの代謝を阻害し、全身暴露を増加させる可能性があります。ブデソニドを長期のケトコナゾールや他の既知の CYP3A4 阻害剤と併用する場合は注意が必要です。
警告
全身活性コルチコステロイドからプルミコート 200mcg TURBUHALER (ブデソニド) に移行する患者には、特に注意が必要です。これは、喘息患者において、全身性コルチコステロイドから全身的に利用できる吸入コルチコステロイドへの移行中および移行後に、副腎不全による死亡が発生しているためです。全身性コルチコステロイドからの離脱後、視床下部-下垂体-副腎 (HPA) 機能の回復には数ヶ月が必要です。
以前にプレドニゾン(またはその同等物)を 1 日 20 mg 以上で維持していた患者は、特に全身性コルチコステロイドがほぼ完全に中止された場合に、最も影響を受けやすい可能性があります。この HPA 抑制期間中、患者は、外傷、手術、感染症 (特に胃腸炎)、または重度の電解質喪失に関連するその他の状態にさらされると、副腎機能不全の徴候や症状を示すことがあります。 PULMICORT TURBUHALER (ブデソニド) は、これらの発作中に喘息症状をコントロールする可能性がありますが、推奨用量では、全身に通常の生理学的量よりも少ないグルココルチコイドを供給し、これらの緊急事態に対処するために必要なミネラルコルチコイド活性を提供しません.
ストレスまたは重度の喘息発作の期間中、全身性コルチコステロイドから離脱した患者は、経口コルチコステロイドを(大量に)直ちに再開し、医師に連絡してさらなる指示を受けるように指示されるべきである.これらの患者はまた、ストレスや重度の喘息発作の期間中に全身コルチコステロイドの補充が必要になる可能性があることを示す医療 ID カードを携帯するように指示する必要があります。
経口コルチコステロイドを必要とする患者は、PULMICORT 100mcg TURBUHALER (ブデソニド) に移行した後、全身コルチコステロイドの使用からゆっくりと離乳する必要があります。経口コルチコステロイドの離脱中は、肺機能 (FEV1 または AM PEF)、ベータ作動薬の使用、および喘息の症状を注意深く監視する必要があります。喘息の徴候と症状のモニタリングに加えて、疲労、倦怠感、脱力感、吐き気と嘔吐、低血圧などの副腎機能不全の徴候と症状について患者を観察する必要があります。
全身性コルチコステロイド療法からパルミコート 200mcg ターブヘラー (ブデソニド) に患者を移行すると、全身性コルチコステロイド療法によって以前に抑制されていたアレルギー状態、例えば、鼻炎、結膜炎、関節炎、好酸球性状態、および湿疹 (参照 投薬と管理 )。
免疫系を抑制する薬を服用している患者は、健康な人よりも感染しやすくなります。たとえば、水ぼうそうや麻疹は、影響を受けやすい小児患者やコルチコステロイドの免疫抑制剤を服用している成人では、より深刻な、または致命的な経過をたどる可能性があります。これらの疾患にかかったことのない小児または成人の患者では、曝露を避けるために特に注意を払う必要があります。コルチコステロイド投与の用量、経路、および期間が、播種性感染症の発症リスクにどのように影響するかはわかっていません。リスクに対する基礎疾患および/または以前のコルチコステロイド治療の寄与も知られていません。ばく露した場合は、水痘帯状疱疹免疫グロブリン (VZIG) またはプール静脈内免疫グロブリン (IVIG) による治療が必要な場合があります。麻疹にさらされた場合は、プールされた筋肉内免疫グロブリン(IG)による予防が必要になる場合があります。 (完全な VZIG および IG 処方情報については、それぞれの添付文書を参照してください。) 水痘が発生した場合は、抗ウイルス剤による治療が考慮される場合があります。
PULMICORT 200mcg TURBUHALER (ブデソニド) は気管支拡張剤ではなく、気管支痙攣または喘息の他の急性エピソードの迅速な緩和には適応されません。
他の吸入喘息薬と同様に、服用後すぐに喘鳴が増加する気管支痙攣が起こることがあります。 PULMICORT TURBUHALER (ブデソニド) の投与後に気管支痙攣が発生した場合は、即効性の吸入気管支拡張剤で直ちに治療する必要があります。 PULMICORT TURBUHALER(ブデソニド)による治療を中止し、代替療法を開始する必要があります。
PULMICORT TURBUHALER(ブデソニド)による治療中に、気管支拡張薬の通常の用量に反応しない喘息のエピソードが発生した場合は、直ちに医師に連絡するよう患者に指示する必要があります。このようなエピソードの間、患者は経口コルチコステロイドによる治療を必要とする場合があります。
予防
全般的
経口コルチコステロイドからの離脱中、一部の患者は、呼吸機能の維持または改善にもかかわらず、全身的に活性なコルチコステロイド離脱の症状、例えば、関節痛および/または筋肉痛、倦怠感、および抑うつを経験する場合があります。 投薬と管理 )。
応答性の患者では、PULMICORT TURBUHALER (ブデソニド) は、プレドニゾンの治療的に同等の経口投与よりも HPA 軸機能の抑制が少なく、喘息の症状を制御できる可能性があります。ブデソニドは循環に吸収され、全身的に活性化する可能性があるため、HPA 機能障害を最小限に抑えるというプルミコート 100mcg ターブヘラー (ブデソニド) の有益な効果は、推奨用量を超えず、個々の患者が最低有効用量まで漸増された場合にのみ期待できます。コルチゾール産生への影響に対する個人の感受性が存在するため、医師はパルミコート 100mcg TURBUHALER (ブデソニド) を処方する際にこの情報を考慮する必要があります。
吸入コルチコステロイドの全身吸収の可能性があるため、PULMICORT 200mcg TURBUHALER (ブデソニド) で治療された患者は、全身コルチコステロイド効果の証拠がないか注意深く観察する必要があります。不十分な副腎反応の証拠がないかどうか、術後またはストレス期間中の患者の観察には特に注意を払う必要があります。
皮質機能亢進症、骨密度の低下、副腎抑制などの全身性コルチコステロイド効果が少数の患者で、特に高用量で現れる可能性があります。そのような変化が生じた場合、PULMICORT 100mcg TURBUHALER (ブデソニド) は、喘息症状の管理および全身性ステロイドの漸減のために受け入れられている手順に従って、ゆっくりと減らす必要があります。
ブデソニドを含む経口吸入コルチコステロイドは、小児患者に投与すると成長速度の低下を引き起こす可能性があります。成長速度の低下は、喘息の不適切なコントロールや治療のためのコルチコステロイドの使用の結果として発生する可能性があります.成長速度に対する長期治療の潜在的な影響は、得られる臨床的利益および代替療法に関連するリスクと比較検討する必要があります。 PULMICORT 200mcg TURBUHALER (ブデソニド) を含む経口吸入コルチコステロイドの全身への影響を最小限に抑えるために、各患者は最低有効用量まで滴定する必要があります (以下を参照)。 注意事項、小児への使用 )。
臨床試験中の患者は 1 ~ 2 年間継続的に PULMICORT TURBUHALER (ブデソニド) の投与を受けていますが、ヒト被験者における PULMICORT 200mcg TURBUHALER (ブデソニド) の長期的な局所および全身効果は完全にはわかっていません。特に、PULMICORT TURBUHALER (ブデソニド) の長期使用による、口、咽頭、気管、および肺の発達過程または免疫過程への影響は不明です。
PULMICORT TURBUHALER (ブデソニド) を用いた臨床試験では、カンジダ・アルビカンスによる局所感染が一部の患者の口と咽頭で発生しました。これらの感染症は、適切な抗真菌療法による治療および/または PULMICORT TURBUHALER (ブデソニド) による治療の中止を必要とする場合があります。
吸入コルチコステロイドは、気道の活動性または休止期の結核感染、未治療の全身性真菌、細菌、ウイルスまたは寄生虫感染、または単純眼ヘルペスの患者に使用する場合は、注意して使用する必要があります。
緑内障、眼圧上昇、および白内障のまれな例が、コルチコステロイドの吸入投与後に報告されています。
患者様向け情報
PULMICORT TURBUHALER (ブデソニド) で治療を受けている患者は、次の情報と指示を受け取る必要があります。この情報は、患者が薬を安全かつ効果的に使用できるようにすることを目的としています。考えられるすべての悪影響または意図された影響を開示するものではありません。 PULMICORT 200mcg TURBUHALER (ブデソニド) を適切に使用し、最大の改善を達成するために、患者は付属の説明書を読み、それに従う必要があります。 患者の指示 慎重に使用してください。
- その有効性は定期的な使用に依存するため、患者は指示に従って定期的に PULMICORT 200mcg TURBUHALER (ブデソニド) を使用する必要があります。患者は、医師の指示がない限り、処方された用量を変更してはなりません。
- PULMICORT 100mcg TURBUHALER (ブデソニド) は気管支拡張剤ではなく、喘息の急性または生命を脅かすエピソードの治療を意図したものではないことを患者に説明する必要があります。
- PULMICORT 100mcg TURBUHALER(ブデソニド)の有効性は、デバイスの適切な使用と吸入投与技術に依存することを患者に説明する必要があります。
- 1. PULMICORT TURBUHALER (ブデソニド) は、正しい用量を提供するために、装填中は直立位置 (マウスピースが上) にある必要があります。
- 2. ユニットを初めて使用するときは、PULMICORT 100mcg TURBUHALER (ブデソニド) をプライミングする必要があります。ユニットをプライミングするには、ユニットを直立させ、茶色のグリップを完全に右に回してから、カチッと音がするまで完全に左に回します。繰り返す。
- 3. 最初の投与量を装填するには、カチッと音がするまでグリップを右に完全に回し、左に完全に回します。
- 4. 最初の投与後、ユニットをプライミングする必要はありません。ただし、上記のように、使用直前に直立位置にロードする必要があります。
- 5. 吸入器を振らないよう患者に指導すること。
- 患者はマウスピースを唇の間に置き、力強く深く吸い込む必要があります。その後、粉末は肺に送達されます。
- PULMICORT TURBUHALER (ブデソニド) から息を吐いてはいけません。
- 粉末の量が少ないため、TURBUHALER 吸入器から吸入したときに、患者が肺に入る薬剤の存在を味わったり感じたりしない場合があります。この感覚の欠如は、患者が PULMICORT TURBUHALER (ブデソニド) の恩恵を受けていないことを示すものではありません。
- 患者は、各投与後に飲み込まずに水で口をすすぐことで、口腔カンジダ症の発症リスクが低下する可能性があることを説明する必要があります。
- 患者には、処方箋を補充するたびに新しい PULMICORT TURBUHALER (ブデソニド) ユニットを受け取るように指示する必要があります。患者は、表示された回数の吸入が使用された後、装置全体を廃棄するようにアドバイスされるべきです。 PULMICORT TURBUHALER (ブデソニド) の残りが 20 回分になると、インジケータ ウィンドウに赤いマークが表示されます。
- PULMICORT TURBUHALER (ブデソニド) はスペーサーと一緒に使用しないでください。
- マウスピースを噛んだり噛んだりしないでください。
- カバーは、開けるたびにしっかりと元に戻す必要があります。
- 患者は、PULMICORT TURBUHALER (ブデソニド) を常に清潔で乾燥した状態に保つ必要があります。
- PULMICORT TURBUHALER (ブデソニド) の吸入後、治療開始から 24 時間以内に喘息コントロールの改善が見られる可能性があることを患者に説明する必要があります。その期間内に症状が改善しない場合、または状態が悪化した場合は、患者に投与量を増やさずに医師に連絡するように指示する必要があります.
- 全身性コルチコステロイドを減量または中止した患者は、気管支拡張薬に反応しないストレスまたは喘息発作の期間中、全身性コルチコステロイドの補充が必要になる可能性があることを示す警告カードを携帯するように指示する必要があります。
- 患者は、PULMICORT TURBUHALER (ブデソニド) の使用を突然中止しないようにアドバイスされるべきです。
- 患者は、水ぼうそうや麻疹への曝露を避けるように警告され、曝露された場合は、遅滞なく医師に相談する必要があります.
- ブデソニドを含む吸入コルチコステロイドの長期使用は、一部の眼の問題(白内障または緑内障)のリスクを高める可能性があります。定期的な眼科検査を考慮する必要があります。
- PULMICORT TURBUHALER (ブデソニド) の使用を検討している女性は、妊娠中または妊娠の予定がある場合、または授乳中の場合は医師に相談してください。
- PULMICORT TURBUHALER (ブデソニド) の使用を検討している患者は、ブデソニドまたはその他の経口吸入コルチコステロイドにアレルギーがある場合は、医師に相談してください。
- PULMICORT 100mcg TURBUHALER(ブデソニド)は状況によっては適切でなく、医師が別の薬を使用したい場合があるため、患者は他の薬を服用していることを医師に知らせる必要があります。
発がん、突然変異誘発、生殖能力の障害
ブデソニドの発がん性を評価するために、経口投与を使用してラットとマウスで長期試験が実施されました。
Sprague-Dawley ラットでの 104 週間の経口研究では、雄ラットに 50 mcg/kg/日 (成人の最大推奨 1 日吸入量より少なく、 mcg/m2 に基づく)。 25 および 50 mcg/kg (mcg/m2 に基づく成人および小児の最大推奨 1 日吸入量未満) までのそれぞれの経口用量で、雄および雌のラットに腫瘍形成性は見られませんでした。オスの Fischer ラットと Sprague-Dawley ラットを対象とした 2 つの追加の 2 年間の研究では、ブデソニドは 50 mcg/kg の経口用量でグリオーマを引き起こさなかった (mcg/m2 ベースで成人と子供の最大推奨 1 日吸入量よりも少ない)。しかし、オスの Sprague-Dawley ラットでは、ブデソニドは 50 mcg/kg の経口用量で肝細胞腫瘍の発生率を統計的に有意に増加させました (mcg/m2 ベースで成人および子供の最大推奨 1 日吸入量よりも少ない)。 )。これら 2 つの研究における同時参照コルチコステロイド (プレドニゾンおよびトリアムシノロン アセトニド) は、同様の結果を示しました。
ブデソニドを 200 mcg/kg/日までの用量でマウスに 91 週間経口投与した場合、発がん作用の証拠はありませんでした (mcg/m2 ベースで成人および子供の最大推奨 1 日吸入量よりも少ない)。
ブデソニドは、次の 6 つの異なる試験システムで変異原性または染色体異常誘発性を示さなかった:エイムズ・サルモネラ/ミクロソームプレート試験、マウス小核試験、マウスリンパ腫試験、ヒトリンパ球における染色体異常試験、キイロショウジョウバエにおける伴性劣性致死試験、およびラットにおける DNA 修復分析。肝細胞培養。
ラットでは、ブデソニドは 80 mcg/kg (mcg/m2 に基づくヒトの 1 日最大推奨吸入量よりも少ない) までの皮下投与では生殖能力に影響を与えませんでした。
20 mcg/kg/日 (mcg/m2 に基づく人間の 1 日最大推奨吸入量未満) で、母体の体重増加、出生前の生存率、出生時および授乳中の子の生存率の低下が観察されました。そのような影響は 5 mcg/kg (mcg/m2 に基づく成人の最大推奨ヒト 1 日吸入量未満) では認められませんでした。
妊娠:催奇形作用
妊娠カテゴリー B: 他のグルココルチコイドと同様に、ブデソニドは、ウサギに 25 mcg/kg/日の皮下投与で胎児喪失、子犬の体重減少、および骨格異常を引き起こした (mcg/m2 に基づく最大推奨ヒト 1 日吸入量未満)。ラットでは 500 mcg/kg/日 (mcg/m2 に基づくヒトの最大推奨 1 日吸入量の約 3 倍)。
ブデソニドを最大 250 mcg/kg/日 (mcg/m2 に基づくヒトの最大推奨 1 日吸入量に相当) の用量で吸入投与した場合、ラットで催奇形性または殺胚性効果は観察されませんでした。
生理学的用量とは対照的に、薬理学的に導入されて以来の経口コルチコステロイドの経験は、げっ歯類が人間よりもコルチコステロイドによる催奇形性の影響を受けやすいことを示唆しています.
しかし、妊娠中の女性を対象とした研究では、妊娠中にパルミコート ターブヘラー (ブデソニド) を投与した場合に異常のリスクが高まることは示されていません。 1995 年から 1997 年までの妊娠の約 99% をカバーする 3 つのスウェーデンのレジストリ (つまり、スウェーデンの医療出生登録、先天奇形の登録、小児心臓病登録) のデータを再検討した大規模な集団ベースの前向きコホート疫学研究の結果は、リスクの増加がないことを示しています。妊娠初期の吸入ブデソニドの使用による先天性奇形について。先天性奇形は、ほとんどの主要な臓器奇形が発生する時期である妊娠初期 (通常、最終月経の 10 ~ 12 週間後) に喘息のために吸入ブデソニドを使用したと報告した母親から生まれた 2,014 人の乳児で研究されました。記録された先天性奇形の割合は、一般人口の割合と比較して同様でした (それぞれ 3.8% 対 3.5%)。さらに、吸入されたブデソニドへの曝露後、口腔顔面裂を持って生まれた乳児の数は、正常な集団で予想される数とほぼ同じでした(それぞれ4人の子供と3.3人の子供)。
これらの同じデータは、母親がブデソニドの吸入にさらされた合計 2,534 人の乳児を対象とした 2 番目の研究で利用されました。この研究では、母親が妊娠初期にブデソニドの吸入に暴露された乳児の先天性奇形の割合は、同時期のすべての新生児の割合 (3.6%) と差がありませんでした。
動物の調査結果にもかかわらず、この薬が妊娠中に使用された場合、胎児への害の可能性はほとんどないように思われます.それにもかかわらず、ヒトでの研究では害の可能性を排除できないため、明らかに必要な場合にのみ、妊娠中に PULMICORT TURBUHALER (ブデソニド) を使用する必要があります。

非催奇形効果
副腎機能低下症は、妊娠中にコルチコステロイドを服用している母親から生まれた乳児に発生することがあります。このような乳児は注意深く観察する必要があります。
授乳中の母親
コルチコステロイドは母乳に分泌されます。コルチコステロイドによる授乳中の乳児への副作用の可能性があるため、母親にとっての薬剤の重要性を考慮して、授乳を中止するか薬剤を中止するかを決定する必要があります。ブデソニドの実際のデータは不足しています。
小児用
6歳未満の小児患者におけるPULMICORT 100mcg TURBUHALER(ブデソニド)の安全性と有効性は確立されていません。
小児喘息患者において、プルミコート 100mcg ターブヘラー(ブデソニド)で観察された有害事象の頻度は、13 歳から 17 歳のグループ(N=124)と比較して、6 歳から 12 歳のグループ(N=172)の間で類似していました。 .
制御された臨床研究は、経口吸入コルチコステロイドが小児患者の成長速度の低下を引き起こす可能性があることを示しています。この効果は、視床下部-下垂体-副腎 (HPA) 軸抑制の実験室での証拠がない場合に観察されており、成長速度は、HPA 軸機能のいくつかの一般的に使用されるテストよりも、小児患者の全身コルチコステロイド曝露のより敏感な指標であることを示唆しています。最終的な成人の身長への影響を含む、経口吸入コルチコステロイドに関連するこの成長速度の低下の長期的な影響は不明です。経口吸入コルチコステロイドによる治療を中止した後の「キャッチアップ」成長の可能性は、十分に研究されていません。
~ 12 歳の喘息の子供を対象とした研究では、パルミコート 200mcg のターブヘラー (ブデソニド) 200 mcg を 1 日 2 回投与した患者 (n=311) は、プラセボを投与した患者 (n=418) と比較して、1.1 cm の成長の低下が見られました。 1年の終わり;これら 2 つの治療群の差は、3 年間の追加治療でさらに増加することはありませんでした。 4 年の終わりまでに、パルミコート ターブヘラー (ブデソニド) で治療された子供とプラセボで治療された子供は、同様の成長速度を示しました。この研究から導き出された結論は、治療群におけるコルチコステロイドの不平等な使用と、研究の過程で思春期に達した患者からのデータを含めることによって混乱する可能性があります.
PULMICORT TURBUHALER (ブデソニド) を含む経口吸入コルチコステロイドを投与されている小児患者の成長は、日常的に監視する必要があります (例、スタディオメトリーによる)。長期治療の潜在的な成長効果は、得られる臨床的利益、および代替療法に関連するリスクと利益と比較検討する必要があります。 PULMICORT 100mcg TURBUHALER (ブデソニド) を含む吸入コルチコステロイドの全身への影響を最小限に抑えるために、各患者の最低有効用量まで滴定する必要があります。
高齢者の使用
PULMICORT 100mcg TURBUHALER (ブデソニド) の米国および米国以外の対照臨床試験には、65 歳以上の 100 人の患者が含まれていました。若い患者に見られるものと比較して、薬の安全性と有効性に違いはありませんでした。
一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
過剰摂取
PULMICORT 100mcg TURBUHALER(ブデソニド)の過剰摂取による急性毒性の可能性は低いです。過剰な用量で長期間使用すると、皮質機能亢進症などの全身性コルチコステロイド効果が発生する可能性があります。 予防 )。 PULMICORT TURBUHALER を最高推奨用量の 2 倍 (1 日 3200 mcg) で 6 週間投与したところ、プラセボ (+1%) と比較して、ACTH の 6 時間注入に対する血漿コルチゾール応答が大幅に減少 (27%) しました。 1日10mgのプレドニゾンの対応する効果は、ACTHに対する血漿コルチゾール反応の35%の減少でした。
マウスの最小吸入致死量は 100 mg/kg でした (mcg/m2 ベースで、成人の最大推奨 1 日吸入量の約 320 倍、小児の最大推奨 1 日吸入量の約 380 倍)。ラットに 68 mg/kg の吸入用量を投与した後の死亡例はなかった (mcg/m2 ベースで、成人の最大推奨 1 日吸入用量の約 430 倍、小児の最大推奨 1 日吸入用量の約 510 倍)。最小経口致死量は、マウスで 200 mg/kg (mcg/m2 に基づいて、成人の最大推奨 1 日吸入量の約 630 倍、小児の最大推奨 1 日吸入量の約 750 倍) で、100 mg/kg 未満でした。 (mcg/m2 に基づくと、成人の最大推奨 1 日吸入量の約 630 倍、小児の最大推奨 1 日吸入量の約 750 倍)。
市販後の経験から、吸入ブデソニドの急性過剰摂取を経験した患者は、一般的に無症候性のままであることが示された.過剰な用量 (1 日最大 6400 mcg) を長期間使用すると、皮質機能亢進症などの全身性コルチコステロイド効果が示されました。
禁忌
PULMICORT TURBUHALER (ブデソニド) は、集中的な対策が必要な喘息状態またはその他の喘息の急性エピソードの一次治療には禁忌です。
ブデソニドに対する過敏症は、パルミコート ターブヘラー (ブデソニド) の使用を禁忌とします。
臨床薬理学
作用機序
ブデソニドは、強力なグルココルチコイド活性と弱いミネラルコルチコイド活性を示す抗炎症性コルチコステロイドです。標準的な in vitro および動物モデルでは、ブデソニドはグルココルチコイド受容体に対して約 200 倍高い親和性を持ち、コルチゾールよりも 1000 倍高い局所抗炎症効力を持っています (ラット クロトン油耳浮腫アッセイ)。全身活性の尺度として、ブデソニドは、ラット胸腺退縮アッセイで皮下投与した場合、コルチゾールよりも 40 倍強力であり、経口投与した場合は 25 倍強力です。
PULMICORT 100mcg TURBUHALER の活性は、親薬であるブデソニドによるものです。糖質コルチコイド受容体の親和性研究では、22R 型は 22S エピマーの 2 倍活性でした。 In vitro 研究では、ブデソニドの 2 つの形態が相互変換しないことが示されました。
喘息の炎症に対するコルチコステロイド作用の正確な機序はわかっていません。炎症は、喘息の病因における重要な要素です。コルチコステロイドは、アレルギーおよび非免疫疾患に関与する複数の細胞型 (例、マスト細胞、好酸球、好中球、マクロファージ、およびリンパ球) およびメディエーター (例、ヒスタミン、エイコサノイド、ロイコトリエン、およびサイトカイン) に対して幅広い阻害活性を有することが示されています。・アレルギー性炎症。コルチコステロイドのこれらの抗炎症作用は、喘息におけるその有効性に寄与している可能性があります。
喘息患者を対象とした研究では、パルミコート 200mcg ターブヘイラー (ブデソニド) の幅広い用量範囲で、局所抗炎症作用と全身性コルチコステロイド作用の良好な比率が示されています。これは、比較的高い局所抗炎症効果、経口吸収された薬物の広範な初回通過肝臓分解 (85-95%)、および形成された代謝産物の低い効力 (以下を参照) の組み合わせによって説明されます。
薬物動態
吸収:
ブデソニドの経口投与後、約 1 ~ 2 時間でピーク血漿濃度に達し、絶対的な全身利用率は 6 ~ 13% でした。対照的に、肺に送達されたブデソニドのほとんどは全身に吸収されます。健康な被験者では、測定用量の 34% が肺に沈着し (血漿濃度法で評価)、測定用量の 39% の絶対的な全身利用能がありました。ブデソニドの薬物動態は、健康なボランティアと喘息患者で有意な差はありません。ブデソニドのピーク血漿濃度は、プルミコート 200mcg ターブヘラーの吸入から 30 分以内に発生しました。喘息患者において、ブデソニドは、プルミコート 200mcg TURBUHALER (ブデソニド) の単回投与と反復投与の両方で、用量の増加に伴い AUC と Cmax が直線的に増加することを示しました。
分布:
ブデソニドの分布量は約 3 L/kg でした。それは、血漿タンパク質に 85 ~ 90% 結合していました。タンパク質結合は、PULMICORT TURBUHALER の推奨用量を超えて達成された濃度範囲 (1 ~ 100 nmol/L) にわたって一定でした。ブデソニドは、コルチコステロイド結合グロブリンへの結合をほとんどまたはまったく示さなかった。ブデソニドは、約 0.8 の血液/血漿比で、濃度に依存しない方法で赤血球と急速に平衡化しました。代謝:
ヒト肝臓ホモジネートを用いた in vitro 研究では、ブデソニドが迅速かつ広範囲に代謝されることが示されています。シトクロム P450 (CYP) アイソザイム 3A4 (CYP3A4) 触媒による生体内変化によって形成される 2 つの主要な代謝産物が分離され、16α-ヒドロキシプレドニゾロンおよび 6β-ヒドロキシブデソニドとして同定されました。これら 2 つの代謝産物のそれぞれのコルチコステロイド活性は、親化合物の 1% 未満です。 in vitro と in vivo の代謝パターンの間に質的な違いは検出されていません。ヒトの肺および血清調製物では、ごくわずかな代謝不活性化が観察されました。排泄・排泄:
ブデソニドの 22R 型は、22S 型の 1.0 L/min に対して 1.4 L/min の全身クリアランスで肝臓によって優先的に除去されました。終末半減期である 2 ~ 3 時間は、両方のエピマーで同じであり、用量とは無関係でした。ブデソニドは、代謝物の形で尿と糞に排泄されました。静脈内放射性標識線量の約 60% が尿中に回収されました。尿中には未変化のブデソニドは検出されませんでした。特殊集団:
人種、性別、または高齢による薬物動態の違いは確認されていません。小児科:
10~14 歳の小児患者の静脈内投与後、血漿半減期は成人よりも短かった (1.5 時間対成人の 2.0 時間)。加圧定量吸入器によるブデソニドの吸入後の同じ集団では、絶対的な全身利用可能性は成人の場合と同様でした。肝不全:
肝機能の低下は、コルチコステロイドの除去に影響を与える可能性があります。ブデソニドの薬物動態は、経口摂取後の 2 倍の全身利用可能性によって証明されるように、損なわれた肝機能によって影響を受けました。しかし、ブデソニドの静脈内薬物動態は、肝硬変患者と健常者で同様でした。薬物間相互作用:
シトクロム P450 (CYP) イソ酵素 3A4 (CYP3A4)、コルチコステロイドの主要な代謝酵素の強力な阻害剤であるケトコナゾールは、経口摂取されたブデソニドの血漿レベルを増加させました。推奨用量では、シメチジンは経口ブデソニドの薬物動態にわずかではあるが臨床的に重要ではない影響を及ぼしました。薬力学
全身吸収が吸入ブデソニドの臨床効果における重要な要因ではないことを確認するために、喘息患者を対象とした臨床研究が実施され、チューブスペーサーを備えた加圧定量吸入器を介して投与された 400 mcg のブデソニドと 1400 mcg の経口ブデソニドおよびプラセボ。この研究では、吸入ブデソニドの有効性が示されましたが、全身レベルが同等であるにもかかわらず、経口摂取されたブデソニドの有効性は示されませんでした。このように、経口吸入ブデソニドの従来用量の治療効果は、気道への直接作用によって大きく説明される。
一般に、パルミコート ターブヘラー (ブデソニド) は、吸入コルチコステロイドとして比較的迅速に作用を開始します。 PULMICORT TURBUHALER (ブデソニド) の吸入後の喘息コントロールの改善は、治療開始から 24 時間以内に発生する可能性がありますが、最大の効果は 1 ~ 2 週間、またはそれ以上得られない場合があります。
PULMICORT TURBUHALER (ブデソニド) は、気道過敏症患者のヒスタミン、メタコリン、メタ重亜硫酸ナトリウム、アデノシン一リン酸など、さまざまなチャレンジ モデルで気道反応性を低下させることが示されています。これらのモデルの臨床的関連性は確かではありません。
PULMICORT 200mcg TURBUHALER (ブデソニド) 1600 mcg を毎日 (800 mcg を 1 日 2 回) 2 週間前処理すると、吸入アレルゲン チャレンジ後の FEV1 の急性 (初期段階の反応) および遅延型 (後期反応) の減少が減少しました。
視床下部-下垂体-副腎 (HPA) 軸に対する PULMICORT 200mcg TURBUHALER (ブデソニド) の効果が、喘息の成人 905 人と小児患者 404 人で研究されました。コシントロピン(ACTH)刺激試験によって評価されるように、ほとんどの患者にとって、ストレスに反応してコルチゾール産生を増加させる能力は、推奨用量でのパルミコート ターブヘイラー(ブデソニド)治療で損なわれませんでした。 100、200、400、または 800 mcg を 1 日 2 回 12 週間投与された成人患者では、それぞれ 4%、2%、6%、および 13% に異常な刺激コルチゾール反応が見られました (最高コルチゾール
PULMICORT 200mcg TURBUHALER (ブデソニド) を介した最大 800 mcg/日 (平均 1 日量 445 mcg/日) のブデソニドの投与、または最大 1200 mcg/日 (平均 1 日量 620 mcg) の用量の加圧定量吸入器によるブデソニドの投与/日) を 216 人の小児患者 (3 歳から 11 歳) に 2 年間から 6 年間投与しても、62 人のマッチした対照患者の非コルチコステロイド療法と比較して、体格の成長に有意な影響はありませんでした。しかし、パルミコート ターブヘラー (ブデソニド) の成長に対する長期的な影響は完全にはわかっていません。
クリニカルトレイル
PULMICORT 100mcg TURBUHALER (ブデソニド) の治療効果は、さまざまな疾患期間 (20 年) および重症度の喘息患者 (6 歳以上) 1,300 人以上を対象とした対照臨床試験で評価されています。
12 週間以上の二重盲検並行プラセボ対照臨床試験では、プラセボと比較して、パルミコート ターブヘイラー (ブデソニド) が肺機能 (PEF および FEV1 で測定) を大幅に改善し、喘息の朝と夕方の症状を大幅に軽減したことが示されました。 、成人では 1 日 400 mcg から 1600 mcg (200 mcg から 800 mcg を 1 日 2 回)、1 日あたり 400 mcg から 800 mcg (200 mcg から 400 mcg) の用量で、必要に応じて吸入β2 アゴニストを使用する必要性が大幅に減少しました。 1 日 2 回) 6 歳以上の小児患者。
6 歳以上の成人患者と小児患者の両方で、治療開始から 24 時間以内に肺機能の改善 (朝の PEF) が観察されましたが、治療開始後 1 ~ 2 週間以上は最大の効果が得られませんでした。改善された肺機能は、試験の二重盲検部分の 12 週間を通して維持されました。
コルチコステロイド療法を受けていない患者
軽度から中等度の喘息患者 273 人を対象とした 12 週間の臨床試験 (平均ベースライン FEV1 2.27 L) で、気管支拡張薬だけでは十分にコントロールできなかった場合、PULMICORT 200mcg TURBUHALER (ブデソニド) が 200 mcg を 1 日 2 回、400 mcg を 2 回の用量で評価されました。毎日対プラセボ。この試験の FEV1 の結果を下の図に示します。肺機能は、プラセボと比較して、プルミコート 100mcg ターブヘラー (ブデソニド) の両方の用量で有意に改善しました。
研究登録前にコルチコステロイド療法を受けていない患者における12週間の試験
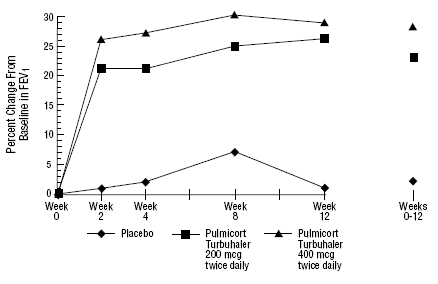
以前にコルチコステロイドを投与されたことのない 75 人の患者を対象とした 12 か月間の対照試験では、200 mcg の PULMICORT TURBUHALER (ブデソニド) を 1 日 2 回投与すると、肺機能が改善され (PEF で測定)、プラセボと比較して気管支過敏症が減少しました。
以前に吸入コルチコステロイドで維持されていた患者
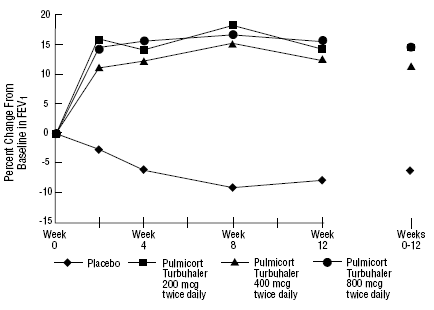
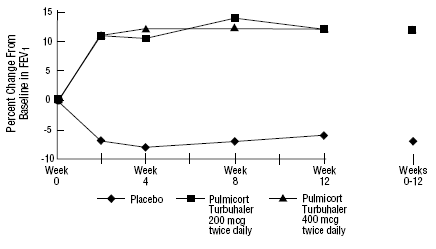
PULMICORT 200mcg TURBUHALER (ブデソニド) の安全性と有効性は、以前に吸入コルチコステロイドで維持されていた成人および小児患者 (6 ~ 18 歳) においても評価されました (成人: N=473、平均ベースライン FEV1 2.04 L、ベクロメタゾンジプロピオン酸 126 のベースライン用量)。 -1008 mcg/日; 小児科: N=404、平均ベースライン FEV1 2.09 L、ベクロメタゾン ジプロピオネートのベースライン用量 126-672 mcg/日またはトリアムシノロン アセトニド 300-1800 mcg/日)。これら 2 つの試験の FEV1 の結果は、どちらも期間が 12 週間で、次の図に示されています。肺機能は、両方の試験でプラセボと比較して、パルミコート ターブヘラー(ブデソニド)のすべての用量で有意に改善しました。
以前に吸入コルチコステロイドで維持されていた成人患者
以前に吸入コルチコステロイドで維持されていた6歳から18歳の小児患者
PULMICORT TURBUHALER(ブデソニド)を1日1回投与されている患者
PULMICORT 100mcg TURBUHALER (ブデソニド) 200 mcg および 400 mcg とプラセボの 1 日 1 回投与の有効性と安全性も、18 週間の研究で 309 人の成人喘息患者 (平均ベースライン FEV1 2.7 L) で評価されました。プラセボと比較して、パルミコート 200 または 400 mcg を 1 日 1 回投与された患者は、最初の 6 週間の治療期間で PEF および FEV1 によって評価されるように、有意に優れた喘息安定性を示し、その後の 12 週間にわたって 200 mcg の 1 日用量で維持されました。研究集団には、以前に吸入コルチコステロイドで治療された患者と、以前にコルチコステロイド療法を受けていない患者の両方が含まれていましたが、結果は、以前に経口吸入コルチコステロイドで維持されていた患者に対して、1日1回の投与が最も明確に効果的であることを示しました。 投薬と管理 )。
以前に経口コルチコステロイドで維持されていた患者
慢性経口プレドニゾン療法を必要とする 159 人の重度の喘息患者を対象とした臨床試験 (平均ベースライン プレドニゾン用量 19.3 mg/日) で、400 mcg を 1 日 2 回、800 mcg を 1 日 2 回の用量で PULMICORT TURBUHALER (ブデソニド) を 20 週間にわたってプラセボと比較しました。限目。 PULMICORT TURBUHALER (ブデソニド) で治療された患者の約 3 分の 2 (400 mcg を 1 日 2 回で 68%、800 mcg を 1 日 2 回で 64%) が、持続的な (少なくとも 2 週間の) 経口コルチコステロイドの中止を達成することができました。プラセボ治療患者)と改善された喘息コントロール。コルチコステロイドの平均経口投与量は、400 mcg 1 日 2 回投与で 83%、800 mcg 1 日 2 回投与で 79% 減少したのに対し、PULMICORT TURBUHALER (ブデソニド) で治療した患者では、プラセボで 27% 減少しました。さらに、試験の二重盲検期に経口コルチコステロイドを完全に排除した 64 人の患者のうち 58 人 (91%) は、PULMICORT 200mcg TURBUHALER (ブデソニド) を投与されている間、さらに 12 か月間経口コルチコステロイドを使用しなかった.
患者情報
患者の使用説明書
薬の服用を開始する前に、このリーフレットをよくお読みください。お薬に関する情報をまとめたものです。これらの指示に従うことで、薬を正しく吸入していることを確認できます。
詳細については、医師または薬剤師にお尋ねください。
PULMICORT TURBUHALER(ブデソニド)について知っておくべきこと
あなたの医師は、パルミコート ターブヘラー 200 mcg を処方しました。合成コルチコステロイドであるブデソニドと呼ばれる薬が含まれています。コルチコステロイドは、体内にある天然の物質で、炎症と闘うのに役立ちます。それらは、肺の小さな気道の壁の腫れや炎症を軽減し、呼吸の問題を緩和するため、喘息の治療に使用されます.コルチコステロイドを定期的に吸入すると、喘息発作の予防にも役立ちます。
PULMICORT TURBUHALER (ブデソニド) は、喘息の「静かな部分」である炎症を治療します。炎症を治療せずに放置すると、喘息の症状と発作が増加する可能性があります。 PULMICORT 200mcg TURBUHALER (ブデソニド) は、喘息の症状と発作を予防および軽減する働きをします。
PULMICORT TURBUHALER(ブデソニド)について覚えておくべき重要なポイント
この薬があなたに適していることを確認してください(「PULMICORT TURBUHALER(ブデソニド)を使用する前に」を参照)。
医師の指示に従って、各用量を吸入することが重要です。
タービュヘイラーは医師の指示に従って使用してください。 気分が良くなったとしても、治療を中止したり、用量を減らしたりしないでください。 医師の指示がない限り。
しない 医師の指示よりも多くの量を吸入するか、Turbuhaler をより頻繁に使用してください。
この薬は いいえ 喘息発作中の呼吸困難を迅速に緩和することを目的としています。緊急措置としてではなく、医師の推奨に従って定期的に服用する必要があります。
あなたの医師は、急性の場合、緊急の救済のために追加の薬(気管支拡張薬など)を処方することがあります。
吸入によって別の薬も使用する場合は、PULMICORT 100mcg TURBUHALER (ブデソニド) の使用に関連していつ使用するかについて医師に相談してください。
PULMICORT TURBUHALER (ブデソニド) を使用する前に
次の場合は、この薬の服用を開始する前に医師に相談してください。
- 妊娠している(または妊娠しようとしている)、
- 赤ちゃんに母乳を与えている、
- ブデソニドまたはその他の経口吸入コルチコステロイドにアレルギーがある、
- 何らかの感染症を患っており、
- 結核を持っているか持っていた、
- 骨粗しょう症になり、
- 最近、水ぼうそうやはしかにかかった人の周りにいたり、
- 手術を予定している、
- プレドニゾンのような経口コルチコステロイド薬を服用しています。これらの種類の医薬品の使用を中止することに伴う健康上のリスクを避けるために、特定の指示に従う必要がある場合があります。
状況によっては、この薬が適切でなく、医師が別の薬を処方することを希望する場合があります。処方薬や非処方薬、ビタミン、栄養補助食品、ハーブサプリメントなど、あなたが服用している他の薬を医師が知っていることを確認してください.
PULMICORT TURBUHALER (ブデソニド) の考えられる副作用は何ですか?
すべての吸入コルチコステロイドと同様に、次の副作用に注意する必要があります。
- PULMICORT 100mcg TURBUHALER (ブデソニド) を服用した直後に喘鳴が増加しました。突然の喘鳴を治療するために、常に短時間作用型の気管支拡張薬を携帯してください。 短時間作用型気管支拡張薬は、肺の気道周辺の筋肉を弛緩させるのに役立ちます。喘鳴は、気道の周りの筋肉が緊張すると起こります。これにより、呼吸が困難になります。重症の場合、喘鳴は呼吸を停止させ、すぐに治療しないと死に至る可能性があります。
- 免疫系への影響と感染の可能性が高くなります。
- 緑内障や白内障などの眼病。 PULMICORT TURBUHALER (ブデソニド) を使用している間は、目の検査を考慮する必要があります。
- 成長が遅くなる可能性があるため、PULMICOR TURBUHALERを服用している間は、子供の成長を定期的にチェックする必要があります。
臨床試験に基づくと、PULMICORT 100mcg TURBUHALER (ブデソニド) を使用している患者から報告された最も一般的な副作用は次のとおりです。
- 呼吸器感染
- 頭痛
- インフルエンザの症状
- 喉の痛み
- 副鼻腔炎
これらは、パルミコート ターブヘラー (ブデソニド) の考えられるすべての副作用ではありません。詳細については、医師、医療専門家、または薬剤師にお尋ねください。
PULMICORT TURBUHALER (ブデソニド) の使用
- 「PULMICORT 200mcg TURBUHALER の使用方法」セクションに示されている指示に従ってください。何か問題がある場合は、医師または薬剤師に伝えてください。
- 医師の指示に従って、各用量を吸入することが重要です。薬局のラベルには、通常、服用する用量と頻度が記載されています。そうでない場合、またはわからない場合は、医師または薬剤師に相談してください。
投与量
- 医師の指示に従って使用してください。
- それは 非常に重要 吸入回数とパルミコート タービュヘラー (ブデソニド) の使用頻度については、医師の指示に従ってください。
- しない 医師のアドバイスよりも多くの量を吸入するか、PULMICORT TURBUHALER (ブデソニド) をより頻繁に使用してください。
- 最大の改善を感じるまでに1〜2週間以上かかる場合がありますので、 PULMICORT 100mcg TURBUHALER (ブデソニド) を定期的に使用することが非常に重要です。気分が良くなっても、治療を中止したり、用量を減らしたりしないでください。 医師の指示がない限り。
- 飲み忘れた場合は、次の定期的な服用時間に合わせて服用してください。用量を 2 倍にしないでください。
PULMICORT TURBUHALER (ブデソニド) の使用方法
完全な指示を注意深く読み、指示に従ってのみ使用してください。
プライミング手順:
新しい PULMICORT 200mcg TURBUHALER (ブデソニド) を初めて使用する前に、プライミングする必要があります。 これを行うには、カバーを回して持ち上げます。 PULMICORT TURBUHALER (ブデソニド) を直立させ (マウスピースを上にして)、茶色のグリップを完全に右にひねり、再び左に戻します。繰り返す。これで、最初の用量を摂取する準備が整いました(「用量の摂取」の指示を参照してください)。 長期間放置しても、この後はプライミングする必要はありません。
服用:
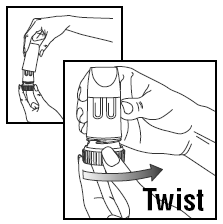
投与量のロード
- カバーをひねって持ち上げます。
- 正確な投与量を提供するために、 PULMICORT TURBUHALER (ブデソニド) は、投薬中は必ず直立位置 (マウスピースを上) に保持する必要があります。
- 茶色のグリップを右にいっぱいまでひねります。もう一度完全に左にひねります。
- クリック音が聞こえます。
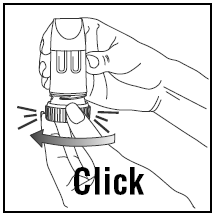
用量の吸入
- 吸入するときは、PULMICORT 200mcg TURBUHALER (ブデソニド) を直立 (マウスピースを上に) または水平に保持する必要があります。
- 頭を吸入器から離し、息を吐きます。 装填後は吸入器を振らないでください。
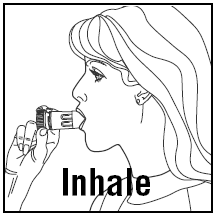
- マウスピースを唇の間に置き、深く力強く息を吸い込みます。薬の味がしない、または感じない場合があります。
- マウスピースを噛んだり噛んだりしないでください。
- 吸入器を口から離し、息を吐き出します。マウスピースに息を吹きかけたり吐いたりしないでください。
- 複数回の投与が必要な場合は、上記の手順を繰り返してください。
- 終了したら、カバーを吸入器に戻し、ねじって閉じます。水で口をすすぐ。飲み込まないでください。
- PULMICORT TURBUHALER (ブデソニド) は常に清潔で乾燥した状態に保ってください。
- PULMICORT TURBUHALER (ブデソニド) が損傷している場合、またはマウスピースが外れている場合は使用しないでください。
PULMICORT TURBUHALER (ブデソニド) の保管
- 使用後は、白いカバーを元に戻し、しっかりとねじって固定してください。
- PULMICORT TURBUHALER (ブデソニド) は、制御された室温、68-77°F (20-25°C) の乾燥した場所に保管してください。
- PULMICORT TURBUHALER (ブデソニド) を安全な場所に保管してください。 幼児の手の届く範囲。
- しない タービュヘイラーの本体に表示されている日付以降に使用してください。
PULMICORT TURBUHALER (ブデソニド) が空になったことを知る方法
ボックスまたはカバーのラベルには、PULMICORT TURBUHALER に含まれる用量が記載されています。 PULMICORT TURBUHALER (ブデソニド) には、マウスピースのすぐ下に便利な用量表示ウィンドウがあります。
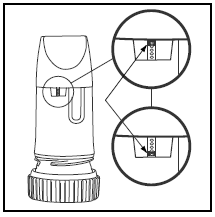
- ウィンドウの上部に赤いマークが表示されたら、薬が 20 回分残っています。 次の PULMICORT 100mcg TURBUHALER (ブデソニド) を手に入れるなら今がチャンスです。
- 赤いマークがウィンドウの底に達すると、吸入器は正しい量の薬剤を供給できなくなる可能性があるため、廃棄する必要があります。 (振ると音が聞こえる場合があります。この音は薬ではありません。この音は、タービュヘイラー内の乾燥剤によって生成されます。)
- 処方箋を補充するたびに、新しい吸入器が手に入ります。
- 空かどうかを確認するために水に浸さないでください。線量表示ウィンドウを確認するだけです。
PULMICORT TURBUHALER(ブデソニド)に関する追加情報
- PULMICORT 200mcg TURBUHALER (ブデソニド) は、非常に細かい粉末として薬を届けます。このため、 味、匂い、または感触 PULMICORT TURBUHALER (ブデソニド) から吸入したときに肺に入った薬は、薬を服用していないという意味ではありません。
- PULMICORT 100mcg TURBUHALER (ブデソニド) はスペーサーと一緒に使用しないでください。
- PULMICORT 100mcg TURBUHALERにはブデソニドのみが含まれており、不活性成分は一切含まれていません。
- PULMICORT TURBUHALER (ブデソニド) は、茶色のグリップをどれだけ頻繁にクリックしても、一度に 1 回分しか投与できないように特別に設計されています。 1回分を装填した後に誤って吸入器に息を吹き込んでしまった場合は、新しい1回分を装填するための指示に従ってください。
このリーフレットには、あなたの薬に関する完全な情報は含まれていません。ご不明な点やご不明な点がございましたら、医師または薬剤師にご相談ください。
このリーフレットをもう一度読みたいと思うかもしれません。薬が飲み終わるまで捨てないでください。
覚えておいてください:この薬はあなたの医者によって処方されています.この薬を他の人に渡さないでください。
医師の指示がない限り、この製品は指示どおりに使用してください。
PULMICORT 100mcg TURBUHALER (ブデソニド) の使用についてさらに質問がある場合は、1-800-236-9933 までお電話ください。
