Clozaril 25mg, 50mg, 100mg Clozapine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
クロザリルとは何ですか?
クロザリル 100mg は、統合失調症の症状を治療するために使用される処方薬です。クロザリル 50mg は、単独で使用することも、他の薬と併用することもできます。
クロザリル 100mg は、第 2 世代の抗精神病薬と呼ばれるクラスの薬に属します。
クロザリル 25mg が子供に安全で効果的かどうかはわかっていません。
クロザリルの副作用の可能性は何ですか?
クロザリルは、次のような重大な副作用を引き起こす可能性があります。
- 弱点、
- 熱、
- 腫れた歯茎、
- 喉の痛み、
- 痛い口内炎、
- 飲み込むときの痛み、
- 皮膚のただれ、
- 風邪やインフルエンザの症状、
- 咳、
- 呼吸困難、
- 唇、舌、目、顔、腕、脚の制御不能な筋肉の動き、
- 胸の痛みと激しいめまいを伴う頭痛、
- ドキドキする心臓の鼓動、
- 胸の中でときめき、
- 立ちくらみ、
- 突然の咳、
- 速い呼吸、
- 喀血、
- 首やあごが引き締まる感じ
- けいれんまたは制御不能な筋肉の動き、
- 発作(停電または痙攣)、
- 排尿がほとんどまたはまったくない、
- 足や足首のむくみ、
- 疲れ、
- 呼吸困難、
- 吐き気、
- 上腹部の痛み、
- 食欲減少、
- 不正出血、
- 暗い尿、
- 粘土色の便、
- 皮膚や目の黄変(黄疸)、
- 非常に硬い(硬い)筋肉、
- 高熱、
- 発汗、
- 錯乱、
- 速いまたは不均一な心拍、
- 震え、
- 喉の渇きが増し、
- 排尿の増加、
- 飢え、
- 口渇、
- フルーティーな口臭、
- 眠気、
- 乾燥肌、
- ぼやけた視界、
- 減量、
- あざや出血しやすい、
- 重度のうずきやしびれ、
- 筋力低下、
- 上腹部の痛み、
- 胸痛、
- 新たな咳または悪化する咳、および
- 呼吸困難
上記の症状がある場合は、すぐに医療機関を受診してください。
クロザリルの最も一般的な副作用は次のとおりです。
- 体重の増加、
- 身震い、
- めまい、
- 回転する感覚、
- 頭痛、
- 眠気、
- 吐き気、
- 便秘、
- 口渇、
- 唾液分泌の増加、
- ぼやけた視界、
- 心拍数が速く、
- 発汗の増加
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、クロザリルの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
重度の好中球減少症;起立性低血圧、徐脈、失神;発作;心筋炎および心筋症;認知症関連精神病の高齢患者における死亡率の増加
重度の好中球減少症
クロザリル治療は、好中球絶対数(ANC)が500/μL未満と定義される重度の好中球減少症を引き起こしました。重度の好中球減少症は、重篤な感染症や死亡につながる可能性があります。 CLOZARIL による治療を開始する前に、ベースラインの ANC は一般集団で少なくとも 1500/μL でなければなりません。文書化された良性民族性好中球減少症 (BEN) の患者では、少なくとも 1000/μL でなければなりません。治療中、患者は定期的に ANC モニタリングを受けなければなりません。重度の好中球減少症または感染症に一致する症状(例、発熱、脱力感、無気力、または喉の痛み)を直ちに報告するように患者に助言する[用法・用量および警告および注意事項を参照]。
重度の好中球減少症のリスクがあるため、CLOZARIL は、クロザピン REMS プログラムと呼ばれるリスク評価軽減戦略 (REMS) の下で制限されたプログラムを通じてのみ入手できます。 [警告と注意事項を参照]。
起立性低血圧、徐脈、失神
クロザリル投与により、起立性低血圧、徐脈、失神、心停止が発生しています。リスクは最初の滴定期間中に最も高くなり、特に用量が急激に増加する場合に顕著です。これらの反応は、1 日あたり 12.5 mg という低用量で、最初の用量で発生する可能性があります。 1 日 1 回または 2 回 12.5 mg で治療を開始します。ゆっくりと滴定します。分割された投与量を使用します。心血管疾患または脳血管疾患、または低血圧の素因となる状態(例、脱水症、降圧薬の使用)のある患者には、クロザリルを慎重に使用してください [用法・用量および警告と注意事項を参照]。
発作
クロザリル25mgで発作が起きました。リスクは用量に関連しています。 12.5 mg で治療を開始し、徐々に滴定し、分割投与を使用します。発作の既往歴または発作の素因となる危険因子(CNS の病理、発作閾値を下げる薬、アルコール乱用)のある患者にクロザリル 50mg を投与する場合は注意してください。突然の意識喪失が自分自身や他の人に深刻なリスクを引き起こす可能性がある活動に従事することについて、患者に注意してください [用法・用量、警告および注意事項を参照]。
心筋炎および心筋症
クロザリル治療により、致命的な心筋炎および心筋症が発生しています。これらの反応が疑われる場合は、クロザリル 25mg を中止し、心臓の評価を受けてください。一般に、クロザリル関連の心筋炎または心筋症の患者には、クロザリルを再投与すべきではありません。胸痛、頻脈、動悸、呼吸困難、発熱、インフルエンザ様症状、低血圧、または心電図の変化が生じた場合は、心筋炎または心筋症の可能性を考慮してください [警告と予防措置を参照]。
認知症関連精神病の高齢患者における死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。 CLOZARIL は、認知症関連の精神病患者への使用は承認されていません [警告と注意事項を参照]。
説明
非定型抗精神病薬である CLOZARIL® (クロザピン) は、三環式ジベンゾジアゼピン誘導体、8-クロロ-11-(4-メチル-1-ピペラジニル)-5H-ジベンゾ [b,e] [1,4] ジアゼピンです。構造式は
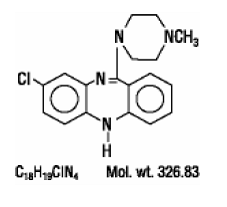
CLOZARIL は、経口投与用に 25 mg および 100 mg の淡黄色の錠剤で入手できます。
有効成分: クロザピン
不活性成分は、コロイド状二酸化ケイ素、ラクトース、ステアリン酸マグネシウム、ポビドン、デンプン (トウモロコシ)、およびタルクです。
適応症
治療抵抗性統合失調症
クロザリル 50mg は、標準的な抗精神病薬治療に十分な効果が得られない統合失調症の重症患者の治療に適応されます。重度の好中球減少症およびその使用に伴う発作のリスクがあるため、クロザリルは、標準的な抗精神病治療に十分に反応しなかった患者にのみ使用する必要があります[ 警告と注意事項 ]。
治療抵抗性統合失調症におけるクロザリルの有効性は、他の抗精神病薬で効果がなかった患者を対象に、クロザリルとクロルプロマジンを比較した6週間の無作為化二重盲検実薬対照試験で実証されました。 臨床研究 ]。
統合失調症または統合失調感情障害における自殺行動の再発リスクの低減
クロザリルは、病歴および最近の臨床状態に基づいて、自殺行動を再経験する慢性的なリスクがあると判断された統合失調症または統合失調感情障害の患者における再発自殺行動のリスクを低減することを適応としています。自殺行動とは、患者が自分自身を死の危険にさらす行為を指します。
InterSePT™ 試験では、2 年間の治療期間にわたって、自殺行動の再発のリスクを軽減するクロザリルの有効性が実証されました。 臨床研究 ]。
投薬と管理
開始前および治療中に必要な臨床検査
CLOZARIL による治療を開始する前に、ベースラインの ANC を取得する必要があります。ベースラインの ANC は、一般集団では少なくとも 1500/μL、文書化された良性民族性好中球減少症 (BEN) の患者では少なくとも 1000/μL でなければなりません。治療を継続するには、ANC を定期的に監視する必要があります [参照 警告と注意事項 ]。
投与情報
開始用量は、1 日 1 回または 1 日 2 回 12.5 mg です。忍容性が良好であれば、1 日あたりの総投与量を 25 mg から 50 mg ずつ増やして、2 週間の終わりまでに 1 日あたり 300 mg から 450 mg の目標用量 (分割投与) を達成することができます。その後、週1回または週2回、100mgまで増量することができます。 1日の最大摂取量は900mgです。起立性低血圧、徐脈、および失神のリスクを最小限に抑えるために、この低い開始用量、段階的な漸増スケジュール、および分割用量を使用する必要があります。 警告と注意事項 ]。
クロザリルは食事の有無にかかわらず服用できます[参照] 薬物動態 ]。
維持治療
一般に、クロザリルに反応する患者は、急性エピソードの後も有効用量で維持療法を継続する必要があります。
治療の中止
治療中止の方法は、患者の最後の ANC によって異なります。
- 中等度から重度の好中球減少症のために突然の治療中止が必要な場合、好中球減少症のレベルに基づく適切な ANC モニタリングについては、表 2 または 3 を参照してください。
- クロザリル 50mg の治療を中止する予定で、中等度から重度の好中球減少症の証拠がない場合は、1 ~ 2 週間かけて徐々に用量を減らしてください。
- 好中球減少症とは無関係の理由によるクロザピンの突然の中止については、ANC が 1500/μL 以上になるまで一般集団の患者には、ANC が 1000/μL 以上になるまで BEN 患者には既存の ANC モニタリングの継続が推奨される。
- 中止後 2 週間の間に患者が発熱 (38.5°C または 101.3°F 以上) を報告した場合は、追加の ANC モニタリングが必要です [ 警告と注意事項 ]。
- 多量の発汗、頭痛、吐き気、嘔吐、下痢などのコリン作動性リバウンドに関連する精神病症状や症状の再発について、すべての患者を注意深く監視します。
治療の再開
クロザリルを中止した患者(最終投与から2日以上経過した患者)でクロザリルを再開する場合は、12.5mgを1日1回または1日2回から再開してください。これは、低血圧、徐脈、および失神のリスクを最小限に抑えるために必要です [参照 警告と注意事項 ]。その用量が十分に許容される場合、用量は、最初の治療で推奨されているよりも早く以前の治療用量まで増加する可能性があります.
CYP1A2、CYP2D6、CYP3A4阻害剤またはCYP1A2、CYP3A4誘導剤の併用による用量調節
以下のものを併用している患者では、用量調節が必要になる場合があります。中程度または弱い CYP1A2 阻害剤 (例えば、経口避妊薬、またはカフェイン); CYP2D6 または CYP3A4 阻害剤 (例、シメチジン、エスシタロプラム、エリスロマイシン、パロキセチン、ブプロピオン、フルオキセチン、キニジン、デュロキセチン、テルビナフィン、またはセルトラリン); CYP3A4 誘導物質 (例、フェニトイン、カルバマゼピン、セントジョーンズワート、およびリファンピン);または CYP1A2 インデューサー (例えば、喫煙) (表 1) [ 薬物相互作用 ]。
腎障害または肝障害またはCYP2D6代謝不良
重大な腎臓または肝臓障害のある患者、または CYP2D6 の代謝不良のある患者では、クロザリル 50mg の用量を減らす必要があるかもしれません。 特定の集団での使用 ]。
供給方法
剤形と強度
CLOZARIL (クロザピン) は、25 mg、50 mg、および 100 mg の円形の薄黄色のコーティングされていない錠剤として入手でき、片側に促進されたスコアがあります。クロザリル (クロザピン) 200 mg 錠剤は、カプセル型の淡黄色のコーティングされていない錠剤で、片側に促進されたスコアがあります。
クロザリル®(クロザピン)錠
25mg
丸くて淡黄色のコーティングされていない錠剤。片面外周に一度「CLOZARIL」の型押し。ファシリテート スコアと「25」が反対側に 1 回デボス加工されています。 100本のボトル........ NDC 69809-0126-05
50mg
丸くて淡黄色のコーティングされていない錠剤。片面外周に一度「CLOZARIL」の型押し。デボス加工された「50」、促進されたスコア、反対側に「mg」。 100本のボトル........ NDC 69809-0130-05
100mg
丸くて淡黄色のコーティングされていない錠剤。片面外周に一度「CLOZARIL」の型押し。反対側にファシリテート スコアと「100」が一度デボス加工されています。 100本のボトル........ NDC 69809-0127-05
200mg
カプセル状の淡黄色の素錠。片面に一度「CLOZARIL」の型押し。 「200」、促進されたスコア、反対側に「mg」のデボス加工。 100本のボトル........ NDC 69809-0135-05
保管と取り扱い
保管温度は 30°C (86°F) を超えないようにしてください。
小児の手の届かない場所に保管。
販売元: HLS Therapeutics (USA), Inc., Rosemont, PA 19010, (844) 457-8721.改訂:2021年2月
副作用
次の副作用については、ラベルの他のセクションで詳しく説明しています。
- 重度の好中球減少症 [参照 警告と注意事項 ]
- 起立性低血圧、徐脈、および失神 [参照 警告と注意事項 ]
- 滝 [参照 警告と注意事項 ]
- 発作 [参照 警告と注意事項 ]
- 心筋炎、心筋症、および僧帽弁閉鎖不全症 [参照 警告と注意事項 ]
- 認知症関連精神病の高齢患者における死亡率の増加 [参照 警告と注意事項 ]
- 重度の合併症を伴う消化管運動低下 [参照 警告と注意事項 ]
- 好酸球増加症 [参照 警告と注意事項 ]
- QT 間隔の延長 [参照 警告と注意事項 ]
- 代謝の変化(高血糖および真性糖尿病、脂質異常症、および体重増加)[参照 警告と注意事項 ]
- 神経弛緩性悪性症候群 [参照 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- 発熱[見る 警告と注意事項 ]
- 肺塞栓症 [参照 警告と注意事項 ]
- 抗コリン毒性 [参照 警告と注意事項 ]
- 認知機能および運動機能への干渉 [参照 警告と注意事項 ]
- 遅発性ジスキネジア [参照 警告と注意事項 ]
- 脳血管有害反応 [参照 警告と注意事項 ]
- 突然の中止後の精神病およびコリン作動性リバウンドの再発[参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
クロザリルの臨床試験で最も多く報告された副作用 (5%以上) は次のとおりです。頻脈、低血圧、失神などの心血管反応;唾液分泌亢進、発汗、口渇、視覚障害などの自律神経系反応;便秘や吐き気などの胃腸反応;そして発熱。表 9 は、治療抵抗性統合失調症における重要な 6 週間対照試験において、クロザリル治療患者 (クロルプロマジン治療患者と比較して) で最も一般的に報告された副作用 (≥5%) をまとめたものです。
表 10 は、すべてのクロザリル試験 (2 年間の InterSePT™ スタディを除く) で 2% 以上の頻度でクロザリル治療を受けた患者で報告された有害反応をまとめたものです。これらのレートは、暴露期間に対して調整されていません。
表 11 は、InterSePT™ Study で最も一般的に報告された副作用 (CLOZARIL またはオランザピン群の 10% 以上) をまとめたものです。これは、統合失調症または統合失調感情障害患者の自殺行動のリスクを軽減する上で、オランザピンと比較したクロザリルの有効性を評価する、適切かつ十分に管理された 2 年間の試験でした。レートは曝露期間に対して調整されていません。
ジストニア
クラス効果
ジストニアの症状、筋肉群の長期にわたる異常な収縮は、治療の最初の数日間に影響を受けやすい個人に発生する可能性があります.ジストニアの症状には、首の筋肉のけいれん、時には喉の圧迫感、嚥下困難、呼吸困難、および/または舌の突出が含まれます.これらの症状は低用量でも発生する可能性がありますが、第 1 世代の抗精神病薬の用量が多いほど、より頻繁に発生し、重症度が高くなります。急性ジストニアのリスクの上昇は、男性および若い年齢層で観察されます。
市販後の経験
クロザピンの承認後の使用中に、次の有害反応が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
中枢神経系
せん妄、脳波異常、ミオクローヌス、感覚異常、脱力発作の可能性、てんかん重積症、強迫性症状、むずむず脚症候群、および中止後のコリン作動性リバウンド副作用。
心臓血管系
心房または心室細動、心室頻脈、動悸、QT間隔延長、トルサード・ド・ポアント、クロザピン関連心筋症、心筋梗塞、心停止、心筋炎、および眼窩周囲浮腫に関連する僧帽弁閉鎖不全。
内分泌系
偽褐色細胞腫
消化器系
急性膵炎、嚥下障害、唾液腺腫脹、大腸炎、巨大結腸、腸管虚血または梗塞。
肝胆道系
胆汁うっ滞、肝炎、黄疸、肝毒性、脂肪肝、肝壊死、肝線維症、肝硬変、肝障害(肝、胆汁うっ滞、および混合)、および肝不全。
免疫系疾患
血管性浮腫、白血球破砕性血管炎。
泌尿生殖器系
急性間質性腎炎、夜尿症、持続勃起症、腎不全、逆行性射精。
皮膚および皮下組織の疾患
過敏反応:光線過敏症、血管炎、多形紅斑、皮膚色素沈着障害、およびスティーブンス・ジョンソン症候群。
筋骨格系と結合組織障害
筋無力症症候群、横紋筋融解症、全身性エリテマトーデス。
呼吸器系
誤嚥、胸水、肺炎、下気道感染症、睡眠時無呼吸。
血液とリンパ系
軽度、中等度、または重度の白血球減少症、無顆粒球症、顆粒球減少症、WBC の減少、深部静脈血栓症、ヘモグロビン/ヘマトクリットの上昇、赤血球沈降速度 (ESR) の増加、敗血症、血小板増加症、および血小板減少症。
視覚障害
狭隅角緑内障。
その他
クレアチンホスホキナーゼ上昇、高尿酸血症、低ナトリウム血症、多発性漿液性炎、および体重減少。
薬物相互作用
他の薬剤がクロザリルに影響を与える可能性
クロザピンは、多くのシトクロム P450 アイソザイム、特に CYP1A2、CYP3A4、および CYP2D6 の基質です。これらの酵素の誘導剤または阻害剤である薬剤とクロザリル100mgを併用する場合は注意してください。
CYP1A2阻害剤
CLOZARIL と CYP1A2 阻害剤を併用すると、クロザピンの血漿中濃度が上昇し、有害反応を引き起こす可能性があります。クロザリルを強力な CYP1A2 阻害剤(フルボキサミン、シプロフロキサシン、エノキサシンなど)と併用する場合は、クロザリルの投与量を元の投与量の 3 分の 1 に減らしてください。強力な CYP1A2 阻害薬の併用を中止する場合は、クロザリルの用量を元の用量に増量する必要があります。 投薬と管理 、 臨床薬理学 ]。
中程度または弱い CYP1A2 阻害剤には、経口避妊薬とカフェインが含まれます。クロザリルをこれらの阻害剤と併用する場合は、患者を注意深く観察してください。必要に応じて、クロザリル 25mg の減量を検討してください。 投薬と管理 ]。
CYP2D6 および CYP3A4 阻害剤
CLOZARIL と CYP2D6 または CYP3A4 阻害剤 (例、シメチジン、エスシタロプラム、エリスロマイシン、パロキセチン、ブプロピオン、フルオキセチン、キニジン、デュロキセチン、テルビナフィン、またはセルトラリン) による併用治療は、クロザピンのレベルを上昇させ、有害反応を引き起こす可能性があります [参照 臨床薬理学 ]。このような阻害剤を使用する場合は、注意して患者を注意深く監視してください。クロザリル100mgの減量を検討してください。 投薬と管理 ]。
CYP1A2 および CYP3A4 インデューサー
CYP1A2 または CYP3A4 を誘導する薬剤を併用すると、クロザピンの血漿中濃度が低下し、クロザリルの有効性が低下する可能性があります。タバコの煙は CYP1A2 の中程度の誘導因子です。強力な CYP3A4 誘導物質には、カルバマゼピン、フェニトイン、セントジョーンズワート、およびリファンピンが含まれます。これらの酵素の誘導物質と併用する場合は、クロザリル50mgの用量を増やす必要があるかもしれません。ただし、CLOZARIL と強力な CYP3A4 誘導剤の併用は推奨されません。 投薬と管理 ]。
酵素誘導剤の併用を中止する場合は、クロザリル50mgの減量を検討してください。インデューサーの中止により、クロザピンの血漿中濃度が上昇し、有害反応のリスクが高まる可能性があるため[参照 投薬と管理 ]。
抗コリン薬
クロザピンおよび抗コリン作用を有する他の薬剤(例、ベンズトロピン、シクロベンザプリン、ジフェンヒドラミン)による併用治療は、抗コリン作動性毒性および運動低下に関連する重度の胃腸の有害反応のリスクを高める可能性があります。可能な限りクロザリルと抗コリン薬の併用は避けてください。 警告と注意事項 ]。
QT間隔延長を引き起こす薬剤
QT間隔を延長する、またはクロザピンの代謝を阻害する併用薬を投与する場合は注意してください。 QT延長を引き起こす薬物には、特定の抗精神病薬(例、ジプラシドン、イロペリドン、クロルプロマジン、チオリダジン、メソリダジン、ドロペリドール、およびピモジド)、特定の抗生物質(例、エリスロマイシン、ガチフロキサシン、モキシフロキサシン、スパルフロキサシン)、クラス1A抗不整脈薬(例、キニジン、プロカインアミド)またはクラス III 抗不整脈薬(例、アミオダロン、ソタロール)、およびその他(例、ペンタミジン、酢酸レボメタジル、メタドン、ハロファントリン、メフロキン、メシル酸ドラセトロン、プロブコールまたはタクロリムス)[ 警告と注意事項 ]。
クロザリルが他の薬剤に影響を与える可能性
クロザリル 25mg を CYP2D6 によって代謝される他の薬物と併用すると、これらの CYP2D6 基質のレベルが上昇する可能性があります。クロザリル 50mg を CYP2D6 によって代謝される他の薬剤と併用する場合は注意してください。そのような薬は、通常処方されるよりも低用量で使用する必要があるかもしれません。そのような薬には、特定の抗うつ薬、フェノチアジン、カルバマゼピン、および 1C 型抗不整脈薬(例、プロパフェノン、フレカイニド、およびエンカイニド)が含まれます。
警告
の一部として含まれています 予防 セクション。
予防
重度の好中球減少症
バックグラウンド
クロザリルは好中球減少症(好中球絶対数(ANC)の低下)を引き起こす可能性があり、これは治療前の血中好中球の正常レベルを下回ることとして定義されます。 ANC は通常、分画を含む全血球計算 (CBC) の構成要素として利用でき、白血球 (WBC) 数よりも薬剤性好中球減少症に関連しています。 ANC は、次の式を使用して計算することもできます。ANC は、合計 WBC 数に、差分 (好中球の「セグ」と好中球の「バンド」) から得られた好中球の合計パーセンテージを掛けた値に等しくなります。他の顆粒球(好塩基球と好酸球)は好中球減少症にほとんど寄与せず、それらの測定は必要ありません。 有害反応 ]。好中球減少症は、軽度、中等度、または重度の場合があります (表 2 および 3 を参照)。理解を向上させ、標準化するために、「重度の好中球減少症」は、以前の用語である重度の白血球減少症、重度の顆粒球減少症、または無顆粒球症に取って代わります。
ANC が 500/μL 未満 (
2 つの個別の管理アルゴリズムを以下に示します。1 つ目は一般集団の患者用で、2 つ目はベースラインの好中球減少症であると特定された患者用です。
一般患者集団におけるクロザリルの治療とモニタリング(表2を参照)
クロザリル 25mg による治療を開始する前に、ANC 値を含む CBC を取得して、ベースラインの好中球数が正常であることを確認し (1500/μL 以上)、後で比較できるようにします。 ANCが1500/μL以上(≧)の一般集団の患者は、正常範囲内(表2)とみなされ、治療を開始する資格があります。治療の最初の 6 か月間は、すべての患者に毎週の ANC モニタリングが必要です。患者の ANC が治療の最初の 6 か月で 1500/μL 以上のままである場合、次の 6 か月間は監視頻度を 2 週間ごとに減らすことができます。 ANC が継続治療の 2 回目の 6 か月で 1500/μL 以上のままである場合、その後は ANC モニタリングの頻度を 4 週間に 1 回に減らすことができます。
良性民族性好中球減少症患者におけるクロザリルの治療とモニタリング(表3を参照)
良性民族性好中球減少症 (BEN) は、平均 ANC 値が好中球の「標準」検査範囲よりも低い特定の民族グループで観察される状態です。これは、アフリカ系の個人(有病率は約 25 ~ 50%)、一部の中東の民族グループ、および肌の色が濃い白人以外の民族グループで最も一般的に観察されます。 BENは男性に多くみられます。 BEN の患者は、正常な造血幹細胞数と骨髄成熟度を持ち、健康で、繰り返しまたは重度の感染症に苦しむことはありません。クロザリルによる好中球減少症を発症するリスクは高くありません。ベースラインの好中球減少症が BEN によるものかどうかを判断するには、追加の評価が必要になる場合があります。必要に応じて、クロザリル 50mg の投与を開始する前または投与中に、血液学のコンサルテーションを検討してください。
BEN の患者さんは、ベースラインの ANC レベルが低いため、クロザリルの管理には別の ANC アルゴリズムが必要です。表 3 は、BEN 患者におけるクロザリル 100mg 治療の管理と ANC モニタリングのガイドラインを示しています。
発熱または好中球減少症のすべての患者を管理するための一般的なガイドライン
- 発熱: 38.5°C [101.3°F] 以上の体温と定義される発熱を発症した患者では、予防措置としてクロザリルの投与を中断し、ANC レベルを取得します。発熱は好中球減少症感染症の最初の徴候であることがよくあります。
- ANC が 1000/μL 未満: ANC が 1000/μL 未満の患者に発熱が発生した場合は、適切な精密検査と感染症の治療を開始し、管理については表 2 または 3 を参照してください。
- 血液内科の受診を検討してください。
- 下の神経弛緩性悪性症候群 [NMS] および発熱を参照してください。 警告と注意事項 および患者への指示、 患者情報 .
ANC が 500/μL 未満になった後の再チャレンジ (重度の好中球減少症)
クロザリル関連の重度の好中球減少症を経験した一部の患者では、クロザリル治療の中止による深刻な精神疾患のリスクが、再投与のリスクよりも高くなる可能性があります(例:クロザリル以外の治療選択肢がない重度の統合失調症患者)。血液学の相談は、患者に再チャレンジするかどうかを決定する際に役立つ場合があります。ただし、一般に、重度の好中球減少症を発症した患者には、CLOZARIL またはクロザピン製品を再投与しないでください。
患者が再投与を受ける場合、臨床医は、表 2 および 3 に示す閾値、患者の病歴および精神病歴、クロザリル 50mg 再投与の利点とリスクについて患者およびその介護者と話し合うことを考慮する必要があります。好中球減少エピソードの重症度と特徴。
好中球減少症に関連する他の薬剤とクロザリルの併用
好中球減少症を引き起こすことが知られている他の薬剤の同時使用が、クロザリル誘発性好中球減少症のリスクまたは重症度を増加させるかどうかは不明です。これらの薬剤を同時に投与されている患者にクロザリルの投与を避ける強い科学的根拠はありません。 CLOZARIL 100mg を好中球減少症を引き起こすことが知られている薬剤 (例えば、一部の化学療法剤) と同時に使用する場合は、表 2 および 3 に示す治療ガイドラインよりも綿密に患者を監視することを検討してください。
クロザピンREMSプログラム
クロザリルは、重度の好中球減少症のリスクがあるため、クロザピン REMS プログラムと呼ばれる REMS の下で制限されたプログラムを通じてのみ入手できます。
クロザピン REMS プログラムの注目すべき要件には、以下が含まれます。
- CLOZARIL 25mg を処方する医療従事者は、プログラムに登録してトレーニングを完了することにより、プログラムの認定を受ける必要があります。
- CLOZARIL 100mg を投与された患者は、プログラムに登録され、ANC の検査とモニタリングの要件を遵守する必要があります。
- クロザリル 50mg を調剤する薬局は、プログラムに登録してトレーニングを修了することにより、プログラムの認定を受ける必要があり、クロザリルを受ける資格のある患者にのみ調剤する必要があります。
詳細については、www.clozapinerems.com または 1-844-267-8678 をご覧ください。
起立性低血圧、徐脈、および失神
クロザピン治療により、低血圧、徐脈、失神、および心停止が発生しました。リスクは、特に急速な用量漸増の場合、最初の滴定期間中に最も高くなります。これらの反応は、12.5 mg という低用量での最初の投与で発生する可能性があります。これらの反応は致命的となる可能性があります。この症候群は、神経媒介性反射性徐脈 (NMRB) と一致しています。
治療は、1 日 1 回または 1 日 2 回の最大用量 12.5 mg から開始する必要があります。忍容性が良好であれば、1 日あたりの総投与量を 25 mg から 50 mg ずつ増加させて、2 週間の終わりまでに 1 日あたり 300 mg から 450 mg の目標用量 (分割投与) にすることができます。その後、100 mg まで、週 1 回または週 2 回まで増量できます。 1日の最大摂取量は900mgです。重篤な心血管反応のリスクを最小限に抑えるために、慎重な滴定と分割投与スケジュールを使用してください[ 投薬と管理 ]。低血圧が発生した場合は、用量を減らすことを検討してください。クロザリルの投与を少しでも中断した患者(つまり、最後の投与から 2 日以上)を再開する場合は、12.5 mg を 1 日 1 回または 1 日 2 回投与して治療を再開してください。 投薬と管理 ]。
心血管疾患(心筋梗塞または虚血の既往、心不全、または伝導異常)、脳血管疾患、および患者が低血圧になりやすい状態(例:降圧薬の併用、脱水および循環血液量減少)のある患者には、クロザリルを慎重に使用してください。
滝
クロザリル 25mg は、傾眠、起立性低血圧、運動および感覚の不安定性を引き起こし、転倒につながる可能性があり、その結果、骨折またはその他の損傷を引き起こす可能性があります。これらの影響を悪化させる可能性のある疾患、状態、または薬を服用している患者については、抗精神病薬治療を開始するとき、および長期の抗精神病薬治療を受けている患者については、転倒リスク評価を完了してください。
発作
発作は、国内販売前の臨床試験中にクロザピンに暴露された 1743 人の患者のうち 61 人に 1 回以上の発作が発生したことに基づいて、約 5% の累積発生率でクロザピンの使用に関連して発生すると推定されています (つまり、 、3.5%の原油レート)。発作のリスクは用量に関連しています。低用量 (12.5 mg) で治療を開始し、ゆっくりと滴定し、分割投与を使用します。
発作の既往歴がある患者、または発作の素因となるその他の危険因子(例えば、頭部外傷または他の中枢神経系の病状、発作閾値を下げる薬の使用、アルコール乱用など)を有する患者にクロザリル 50mg を投与する場合は注意してください。クロザリルの使用に伴う発作の危険性が高いため、突然の意識喪失が自分自身や他の人に深刻な危険をもたらす可能性のある活動(例:自動車の運転、複雑な機械の操作、水泳、登山)に従事することについて患者に注意してください.
心筋炎、心筋症、僧帽弁閉鎖不全症
クロザリルの使用により、心筋炎や心筋症が発生しています。これらの反応は致命的となる可能性があります。心筋炎または心筋症の疑いがある場合は、クロザリル 25mg の投与を中止し、心臓の評価を受けてください。一般に、クロザピン関連心筋炎または心筋症の既往歴のある患者には、クロザリルを再投与すべきではありません。しかし、CLOZARIL 25mg治療の利点が再発性心筋炎または心筋症の潜在的なリスクを上回ると判断された場合、臨床医は心臓専門医と相談し、完全な心臓評価の後、綿密なモニタリングの下でCLOZARILの再投与を検討することがあります.
胸痛、呼吸困難、安静時の持続性頻脈、動悸、発熱、インフルエンザ様症状、低血圧、その他の心不全の徴候や症状、または心電図所見(低電圧、 ST-T異常、不整脈、右軸偏位、R波進行不良など)。心筋炎は、クロザピン治療の最初の 2 か月以内に最も頻繁に現れます。心筋症の症状は、一般に、クロザピン関連心筋炎よりも遅く、通常は 8 週間の治療後に発生します。しかし、心筋炎および心筋症は、クロザリルによる治療中のどの時期にも発生する可能性があります。倦怠感、筋肉痛、胸膜炎性胸痛、微熱などの非特異的なインフルエンザ様症状が、心不全のより明白な兆候に先行することはよくある.典型的な検査所見には、トロポニン I または T の上昇、クレアチニンキナーゼ MB の上昇、末梢好酸球増加症、および C 反応性タンパク質 (CRP) の上昇が含まれます。胸部レントゲン写真は心臓のシルエットの拡大を示すことがあり、心臓の画像検査(心エコー図、放射性核種検査、または心臓カテーテル法)により、左心室機能障害の証拠が明らかになる場合があります。クロザリル50mgを服用中に心筋症と診断された患者さんでは、僧帽弁閉鎖不全症が報告されています。これらの症例は、二次元心エコー検査で軽度または中等度の僧帽弁逆流を報告しました。心筋症が疑われる患者では、僧帽弁閉鎖不全症を特定するために 2D エコー ドップラー検査を検討してください。
認知症関連精神病の高齢患者における死亡率の増加
抗精神病薬で治療されている認知症関連精神病の高齢患者は、死亡リスクが高くなります。主に非定型抗精神病薬を服用している患者を対象とした 17 のプラセボ対照試験 (モーダル期間 10 週間) の分析により、薬物治療を受けた患者の死亡リスクは、プラセボ治療を受けた患者の死亡リスクの 1.6 ~ 1.7 倍であることが明らかになりました。典型的な 10 週間の対照試験の過程で、薬物治療を受けた患者の死亡率は約 4.5% であり、プラセボ群では約 2.6% でした。死因はさまざまであるが、ほとんどの死因は心血管疾患(例、心不全、突然死)または感染症(例、肺炎)のいずれかであると思われた。観察研究は、非定型抗精神病薬と同様に、従来の抗精神病薬による治療がこの集団の死亡率を増加させる可能性があることを示唆しています。観察研究における死亡率の増加の所見が、患者のいくつかの特徴とは対照的に、抗精神病薬に起因する可能性がある程度は明らかではありません.クロザリルは、認知症に関連した精神病患者の治療には承認されていません。 囲み警告 ]。
重度の合併症を伴う消化管運動低下
クロザリルの使用により、主にその強力な抗コリン作用とその結果生じる胃腸の運動低下により、重度の胃腸の有害反応が発生しています。市販後の経験では、報告された影響は便秘から麻痺性イレウスまでさまざまです。便秘の頻度が高くなり、診断と治療が遅れると、胃腸の運動機能低下による重篤な合併症のリスクが高まり、腸閉塞、宿便、巨大結腸、腸虚血または梗塞を引き起こす [参照 有害反応 ]。これらの反応は、入院、手術、および死亡をもたらしました。重度の副作用のリスクは、抗コリン薬(および胃腸の蠕動運動を減少させる他の薬)でさらに増加します。したがって、可能な限り併用を避ける必要があります [参照 警告と注意事項 、 薬物相互作用 ]。
クロザリル 50mg の投与を開始する前に、便秘をスクリーニングし、必要に応じて治療してください。便秘の自覚症状は、クロザリル治療患者の胃腸運動機能低下の程度を正確に反映していない可能性があります。したがって、排便の頻度や特徴の変化、および運動低下の合併症の徴候や症状(例、吐き気、嘔吐、腹部膨満、腹痛)に注意して、腸機能を頻繁に再評価してください。便秘または胃腸の運動低下が確認された場合は、綿密に監視し、必要に応じて適切な下剤で迅速に治療して、重篤な合併症を防ぎます。リスクの高い患者では、予防的下剤を検討してください。
好酸球増加症
クロザリル100mg投与により、血中好酸球数が700/μLを超える好酸球増加症と定義されています。臨床試験では、患者の約 1% が好酸球増加症を発症しました。クロザピン関連の好酸球増加症は、通常、治療の最初の 1 か月の間に発生します。一部の患者では、心筋炎、膵炎、肝炎、大腸炎、および腎炎に関連しています。このような臓器の関与は、薬物誘発性過敏症症候群 (DIHS) としても知られる、好酸球増加症および全身症状症候群 (DRESS) による薬物反応と一致している可能性があります。クロザリル治療中に好酸球増多症が発症した場合は、発疹やその他のアレルギー症状、心筋炎、好酸球増多症に関連する他の臓器特異的疾患などの全身反応の徴候や症状がないか速やかに評価してください。クロザリル関連の全身性疾患が疑われる場合は、直ちにクロザリル50mgを中止してください。
クロザリル 50mg とは関係のない好酸球増加症の原因(喘息、アレルギー、膠原病、寄生虫感染症、特定の新生物など)が特定された場合は、根本的な原因を治療し、クロザリルの投与を継続してください。
クロザピン関連の好酸球増加症は、臓器の関与がない場合にも発生しており、介入なしで解決できます。好酸球増加症の再発なしに、クロザピンの中止後に成功した再投与の報告があります。臓器障害がない場合は、注意深いモニタリングの下でクロザリルを継続してください。全身性疾患がないにもかかわらず総好酸球数が数週間にわたって増加し続ける場合、好酸球数が減少した後にクロザリル 25mg の治療を中断し、再投与するという決定は、総合的な臨床評価に基づいて、内科医または血液専門医と相談して行う必要があります。
QT間隔延長
クロザリル100mgの投与により、QT延長、トルサード・ド・ポアンツなどの生命を脅かす心室性不整脈、心停止、突然死が発生しています。 CLOZARIL を処方する際には、QT 延長および重篤な心血管反応の追加の危険因子の存在を考慮してください。これらのリスクを高める条件には、以下が含まれます:QT延長の病歴、QT延長症候群、QT延長症候群または心臓突然死の家族歴、重大な心不整脈、最近の心筋梗塞、非代償性心不全、QT延長を引き起こす他の薬による治療、クロザピンの代謝を阻害する薬による治療、および電解質異常。
クロザリル25mgによる治療を開始する前に、慎重な健康診断、病歴、および併用薬歴を実施してください。ベースラインの心電図と血清化学パネルの取得を検討してください。電解質異常を修正します。 QTc 間隔が 500 ミリ秒を超える場合は、クロザリル 25mg を中止してください。 Torsades de Pointes に一致する症状、またはその他の不整脈(例、失神、失神前、めまい、または動悸)を経験した場合は、心臓の評価を受け、CLOZARIL を中止してください。
QT延長やクロザリルの代謝を阻害する併用薬の投与には注意すること。 QT延長を引き起こす薬物には、特定の抗精神病薬(例、ジプラシドン、イロペリドン、クロルプロマジン、チオリダジン、メソリダジン、ドロペリドール、ピモジド)、特定の抗生物質(例、エリスロマイシン、ガチフロキサシン、モキシフロキサシン、スパルフロキサシン)、クラス1A抗不整脈薬(例、キニジン、プロカインアミド)またはクラス III 抗不整脈薬(例、アミオダロン、ソタロール)、およびその他(例、ペンタミジン、酢酸レボメタジル、メタドン、ハロファントリン、メフロキン、メシル酸ドラセトロン、プロブコールまたはタクロリムス)。クロザピンは、主に CYP アイソザイム 1A2、2D6、および 3A4 によって代謝されます。これらの酵素の阻害剤による併用治療は、クロザリルの濃度を高めることができます[ 薬物相互作用 と 臨床薬理学 ]。
低カリウム血症と低マグネシウム血症は、QT延長のリスクを高めます。低カリウム血症は、利尿薬療法、下痢、およびその他の原因によって生じる可能性があります。重大な電解質障害、特に低カリウム血症のリスクがある患者を治療する場合は注意してください。血清カリウムおよびマグネシウムレベルのベースライン測定値を取得し、電解質を定期的に監視します。クロザリルによる治療を開始する前に電解質異常を是正してください。
代謝変化
クロザリル50mgを含む非定型抗精神病薬は、心血管および脳血管のリスクを高める可能性のある代謝変化と関連しています。これらの代謝変化には、高血糖症、脂質異常症、および体重増加が含まれます。非定型抗精神病薬は何らかの代謝変化を引き起こす可能性がありますが、クラス内の各薬には固有のリスクプロファイルがあります。
高血糖と糖尿病
クロザリルを含む非定型抗精神病薬で治療された患者では、ケトアシドーシスまたは高浸透圧性昏睡または死亡を伴う場合もある極度の高血糖が報告されています。非定型抗精神病薬の使用とグルコース異常との関係の評価は、統合失調症患者における真性糖尿病のバックグラウンドリスクの増加の可能性と、一般集団における真性糖尿病の発生率の増加の可能性によって複雑になっています。これらの交絡因子を考慮すると、非定型抗精神病薬の使用と高血糖関連の有害反応との関係は完全には理解されていません。しかし、疫学的研究は、非定型抗精神病薬で治療された患者において、治療に起因する高血糖関連の副作用のリスクが高いことを示唆しています。非定型抗精神病薬で治療された患者における高血糖関連の有害反応の正確なリスク推定値は入手できません。
糖尿病と確定診断され、クロザリル100mgの投与を開始した患者は、血糖コントロールの悪化について定期的にモニタリングする必要があります。糖尿病の危険因子(例、肥満、糖尿病の家族歴)を持ち、非定型抗精神病薬による治療を開始する患者は、治療開始時と治療中定期的に空腹時血糖検査を受けるべきです。非定型抗精神病薬で治療された患者は、多飲、多尿、多食、衰弱などの高血糖の症状を監視する必要があります。非定型抗精神病薬による治療中に高血糖の症状を発症した患者は、空腹時血糖検査を受ける必要があります。場合によっては、非定型抗精神病薬を中止すると高血糖が解消されます。しかし、一部の患者は、疑わしい薬物の中止にもかかわらず、抗糖尿病治療の継続を必要としました。
成人の統合失調症患者を対象とした8試験のプールデータ解析では、クロザリル50mg群とクロルプロマジン群の空腹時血糖値の平均変化量は、それぞれ+11mg/dLと+4mg/dLでした。クロルプロマジン群と比較して、クロザリル群のより高い割合で空腹時血糖値がベースラインから明確に上昇したことが示されました(表4)。クロザリル 25mg の投与量は、1 日あたり 100 ~ 900 mg でした (平均モーダル投与量: 1 日あたり 512 mg)。クロルプロマジンの最大用量は 1 日あたり 1800 mg でした (平均モーダル用量: 1 日あたり 1029 mg)。暴露期間の中央値は、クロザリルとクロルプロマジンで 42 日でした。
脂質異常症
脂質の望ましくない変化は、CLOZARIL を含む非定型抗精神病薬で治療された患者で発生しました。 CLOZARILを使用している患者のベースラインおよび定期的なフォローアップ脂質評価を含む臨床モニタリングが推奨されます。
統合失調症の成人被験者を対象とした 10 件の研究のプールされたデータ分析では、クロザリル治療は血清総コレステロールの増加と関連していました。 LDL および HDL コレステロールに関するデータは収集されませんでした。総コレステロールの平均増加量は、クロザリル25mg群で13mg/dL、クロルプロマジン群で15mg/dLでした。統合失調症の成人患者を対象とした 2 つの研究のプールされたデータ解析では、クロザリル 50mg の治療は空腹時血清トリグリセリドの増加と関連していました。空腹時トリグリセリドの平均増加量は、クロザリル100mg群で71mg/dL(54%)、クロルプロマジン群で39mg/dL(35%)でした(表5)。さらに、クロザリル治療は、表 6 に示すように、血清総コレステロールおよびトリグリセリドのカテゴリ別増加と関連していました。総コレステロールまたは空腹時トリグリセリドのカテゴリ別増加を示した患者の割合は、曝露期間とともに増加しました。クロザリル50mgとクロルプロマジンの曝露期間の中央値は、それぞれ45日と38日でした。クロザリルの用量範囲は、1 日 100 mg から 900 mg でした。クロルプロマジンの最大用量は、1 日あたり 1800 mg でした。
体重の増加
クロザリルを含む抗精神病薬の使用により、体重増加が起こりました。クロザリル投与中は体重をモニターしてください。表 7 は、CLOZARIL と実際の対照薬を用いた 11 の研究からプールされた暴露期間による体重増加に関するデータをまとめたものです。暴露期間の中央値は、クロザリル25mg群、オランザピン群、クロルプロマジン群でそれぞれ609日、728日、42日でした。
表 8 は、ベースラインと比較して体重の 7% 以上の体重増加を示す統合失調症の成人被験者の 11 の研究からプールされたデータをまとめたものです。曝露期間の中央値は、クロザリル群、オランザピン群、クロルプロマジン群でそれぞれ609日、728日、42日でした。
悪性症候群
クロザリル 50mg を含む抗精神病薬は、神経弛緩性悪性症候群 (NMS) と呼ばれる潜在的に致命的な症状の複合体を引き起こす可能性があります。 NMS の臨床症状には、高熱、筋肉のこわばり、精神状態の変化、および自律神経系の不安定性 (不規則な脈拍または血圧、頻脈、発汗、および不整脈) が含まれます。関連する所見には、クレアチンホスホキナーゼ(CPK)の上昇、ミオグロビン尿症、横紋筋融解症、急性腎不全などがあります。
この症候群の患者の診断評価は複雑です。他の重篤な病状(重度の好中球減少症、感染症、熱射病、原発性CNS病理、中枢性抗コリン作動性毒性、錐体外路症状、薬物熱など)の存在を考慮することが重要です。
NMS の管理には、(1) 抗精神病薬および同時治療に必須ではない他の薬の即時中止、(2) 集中的な対症療法および医学的モニタリング、および (3) 併存疾患の治療が含まれる必要があります。 NMS の特定の薬理学的治療については、一般的な合意はありません。
患者が NMS からの回復後に抗精神病薬治療を必要とする場合、薬物療法の再導入の可能性を慎重に検討する必要があります。 NMS は再発する可能性があります。抗精神病薬による治療を再開する場合は、注意深く監視してください。
NMSは、クロザリル単剤療法およびリチウムを含むCNS活性薬の併用で発生しています。
肝毒性
重篤で生命を脅かす、場合によっては致命的な肝不全、肝不全、肝壊死、肝炎などの肝毒性が、クロザピンで治療された患者の市販後の研究で報告されています[ 有害反応 ]。疲労、倦怠感、食欲不振、吐き気、黄疸、ビリルビン血症、凝固障害、肝性脳症などの肝毒性の徴候や症状の出現を監視します。肝障害の血清検査を実施し、クロザピンが原因で肝炎またはトランスアミナーゼ上昇が他の全身症状と組み合わさっている場合は、治療を永久に中止することを検討してください。
熱
クロザピン治療中、患者は一過性のクロザピン関連の発熱を経験しています。発生率のピークは、治療の最初の 3 週間以内です。この発熱は一般的に良性で自然治癒しますが、治療の中止が必要になる場合があります。発熱は、白血球数の増加または減少に関連している可能性があります。重度の好中球減少症や感染症を除外するために、発熱のある患者を慎重に評価します。 NMS の可能性を検討する [参照 警告と注意事項 ]。
肺塞栓症
クロザリルで治療された患者では、肺塞栓症と深部静脈血栓症が発生しています。深部静脈血栓症、急性呼吸困難、胸痛、またはその他の呼吸器の徴候や症状を呈する患者では、肺塞栓症の可能性を考慮してください。肺塞栓症と深部静脈血栓症がクロザピンに起因するのか、それとも患者のいくつかの特徴に起因するのかは明らかではありません。
抗コリン毒性
クロザリル 50mg には、強力な抗コリン作用があります。クロザリルによる治療は、特に高用量または過剰摂取の状況で、中枢神経系および末梢の抗コリン作動性毒性を引き起こす可能性があります[ 過剰摂取 ]。便秘、尿閉、臨床的に重大な前立腺肥大症、または抗コリン作用が重大な副作用を引き起こす可能性があるその他の状態の現在の診断または既往歴のある患者には注意して使用してください。可能であれば、他の抗コリン薬との併用は避けてください。抗コリン薬の毒性または重度の胃腸の有害反応のリスクが高まるためです。 警告と注意事項 、 薬物相互作用 ]。
認知機能および運動機能への干渉
クロザリルは、鎮静作用や認知機能や運動機能の障害を引き起こす可能性があります。クロザリルが患者に悪影響を及ぼさないことが合理的に確信できるまで、自動車を含む危険な機械の操作について患者に注意してください。これらの反応は、用量に関連している可能性があります。それらが発生した場合は、用量を減らすことを検討してください。
遅発性ジスキネジア
遅発性ジスキネジア(TD)は、クロザリルを含む抗精神病薬で治療された患者に発生しています。この症候群は、潜在的に不可逆的で、不随意の、運動異常の動きで構成されています。 TD のリスクとそれが不可逆的になる可能性は、治療期間が長くなり、総累積線量が高くなるにつれて増加すると考えられています。しかし、この症候群は、低用量での比較的短い治療期間の後に発症する可能性があります。 TDを発症するリスクを最小限に抑える可能性が最も高い方法でクロザリルを処方してください。症状をコントロールするのに必要な最低有効用量と最短期間を使用してください。継続的な治療の必要性を定期的に評価します。 TD が発生した場合は、治療の中止を検討してください。しかし、症候群の存在にもかかわらず、一部の患者はクロザリル100mgによる治療を必要とする場合があります。
TD の既知の治療法はありません。ただし、治療を中止すると、この症候群は部分的または完全に寛解することがあります。抗精神病治療自体が徴候や症状を抑制 (または部分的に抑制) する可能性があり、根底にあるプロセスを覆い隠す可能性があります。 TDの長期経過に対する症状抑制の効果は不明です。
脳血管有害反応
対照試験では、いくつかの非定型抗精神病薬で治療された認知症関連精神病の高齢患者は、死亡を含む脳血管有害反応(例、脳卒中、一過性虚血発作)のリスクが(プラセボと比較して)増加しました。このリスク増加のメカニズムはわかっていません。クロザリルやその他の抗精神病薬、その他の患者集団では、リスクの増加を排除することはできません。クロザリル 50mg は、脳血管副作用の危険因子を有する患者には慎重に使用する必要があります。
クロザリルの突然の中止後の精神病とコリン作動性リバウンドの再発
クロザリルの突然の中止が必要な場合(例えば、重度の好中球減少症または別の病状のため)[参照 投薬と管理 、 警告と注意事項 ]、多量の発汗、頭痛、吐き気、嘔吐、下痢などのコリン作動性リバウンドに関連する精神病症状や有害反応の再発を注意深く監視します。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
マウスとラットを用いた長期試験では、体表面積1m²当たりの最大推奨用量(MRHD)900mg/日の最大推奨用量(MRHD)のそれぞれ最大0.3倍と0.4倍の用量で、発がん性の可能性は示されませんでした。
突然変異誘発
クロザピンは、次の遺伝子変異および染色体異常試験で試験した場合、遺伝毒性を示さなかった: バクテリア Ames 試験、チャイニーズハムスター細胞における in vitro 哺乳動物 V79、ラット肝細胞における in vitro 不定期 DNA 合成、またはマウスにおける in vivo 小核試験。
生殖能力の障害
交尾の 70 日前にオスのラットに、交尾の 14 日前にメスのラットに 900 mg/日の MRHD の最大 0.4 倍の用量を経口投与した場合、クロザピンは生殖能力、妊娠、胎児の体重、または出生後の発育のいずれのパラメーターにも影響を与えませんでした。 mg/m² 体表面積ベース。
特定の集団での使用
妊娠
妊娠カテゴリーB
リスクの概要
妊娠中の女性におけるクロザピンの適切または十分に管理された研究はありません。
繁殖研究は、ラットとウサギでそれぞれ 0.4 倍と 0.9 倍までの用量で行われました。これは、mg/m² 体表面積ベースで 900 mg/日の最大推奨用量 (MRHD) です。研究では、クロザピンによる受胎能の障害や胎児への害の証拠は明らかにされていません。動物の生殖研究は常にヒトの反応を予測できるわけではないため、クロザリルは明らかに必要な場合にのみ妊娠中に使用されるべきです.
臨床上の考慮事項
妊娠中および産後に抗精神病薬による治療を中止または変更する場合は、精神病の悪化のリスクを考慮してください。抗精神病薬で治療を受けている患者には、妊娠糖尿病の早期スクリーニングを検討する [参照 警告と注意事項 ]。妊娠後期に抗精神病薬にさらされた新生児は、分娩後に錐体外路症状および/または禁断症状のリスクがあります。興奮、筋緊張亢進、筋緊張低下、振戦、傾眠、呼吸困難、および摂食困難の症状について新生児を監視します。合併症の重症度は、自己限定的な症状から、集中治療室のサポートや長期の入院を必要とする一部の新生児までさまざまです。
動物データ
胚胎児発生研究では、クロザピンは、器官形成期に妊娠中のラットとウサギにそれぞれ 0.4 倍と 0.9 倍の用量 (MRHD 900 mg/日) を経口投与した場合、母体のパラメーター、同腹子のサイズ、または胎児のパラメーターに影響を与えませんでした。 mg/m² 体表面積ベースで。
周産期/出生後の発生研究では、妊娠中の雌ラットに、妊娠の最後の 3 分の 1 から産後 21 日までクロザピンを投与しました。出生時および出生後の胎児について観察が行われました。子孫は性的成熟に達し、交配させられました。クロザピンは母体の体重の減少を引き起こしましたが、mg/m² 体表面積ベースで 900 mg/日の MRHD の最大 0.4 倍の用量で F1 または F2 世代の同腹子数または体重に影響を与えませんでした。
授乳中の母親
クロザリル 50mg は母乳に含まれています。クロザリルは授乳中の乳児に重篤な副作用を引き起こす可能性があるため、母親にとっての薬剤の重要性を考慮して、授乳を中止するか、薬剤を中止するかを決定する必要があります。
小児用
小児患者における安全性と有効性は確立されていません。
高齢者の使用
クロザリル 50mg を使用した臨床研究では、65 歳以上の患者とそれより若い患者とでクロザリルに対する反応が異なるかどうかを判断するのに十分な数の高齢者患者がいませんでした。
起立性低血圧および頻脈は、クロザリル 50mg の治療で発生する可能性があります [参照 囲み警告 と 警告と注意事項 ]。高齢の患者、特に心血管機能が損なわれている患者は、これらの影響を受けやすい可能性があります。
高齢患者は、尿閉や便秘など、クロザリルの抗コリン作用を特に受けやすい可能性があります。 警告と注意事項 ]。
高齢者では、肝機能、腎機能、心機能の低下の頻度が高く、他の併発疾患や他の薬物療法を考慮して、クロザリル 50mg の用量を慎重に選択してください。臨床経験によると、遅発性ジスキネジアの有病率は高齢者で最も高いようです。特に年配の女性[参照] 警告と注意事項 ]。
腎障害または肝障害のある患者
腎機能または肝機能に重大な障害がある患者では、用量の減量が必要になる場合があります。クロザピンはほぼ完全に代謝されてから排泄されるため、これらの患者ではクロザピン濃度が上昇する可能性があります[ 投薬と管理 、 臨床薬理学 ]。
CYP2D6 代謝不良者
CYP2D6 の代謝が低い患者では、減量が必要になる場合があります。クロザピンはほぼ完全に代謝されてから排泄されるため、これらの患者ではクロザピン濃度が上昇する可能性があります[ 投薬と管理 、 臨床薬理学 ]。
ホスピス患者
ホスピス患者 (つまり、推定余命が 6 か月以下の末期患者) の場合、処方者は、患者とその介護者との話し合いの後、ANC モニタリングの頻度を 6 か月に 1 回に減らすことができます。個々の治療法を決定する際には、精神症状や患者の末期症状をコントロールする必要性という観点から、ANC を監視することの重要性を検討する必要があります。
過剰摂取
過剰摂取経験
クロザピンの過剰摂取に関連する最も一般的に報告されている兆候と症状は次のとおりです。鎮静、せん妄、昏睡、頻脈、低血圧、呼吸抑制または呼吸不全。そして過唾液分泌。誤嚥性肺炎、不整脈、発作の報告があります。致命的な過剰摂取がクロザピンで報告されており、一般に 2500 mg を超える用量で. 4gをはるかに超える過剰摂取から回復した患者の報告もある.
過剰摂取の管理
クロザリルの過剰摂取に対する特定の解毒剤はありません。気道を確立して維持します。十分な酸素供給と換気を確保します。心臓の状態とバイタル サインを監視します。一般的な対症療法と支持療法を使用してください。多剤併用の可能性を考慮してください。
過剰摂取の管理に関する最新情報については、認定毒物管理センターにお問い合わせください (1-800Â222-1222)。
禁忌
クロザピンは、クロザピンに対する重度の過敏症(例えば、光線過敏症、血管炎、多形紅斑、またはスティーブンス・ジョンソン症候群)またはクロザリルの他の成分に対する重篤な過敏症の既往歴のある患者には禁忌です。 有害反応 ]。
臨床薬理学
作用機序
クロザピンの作用機序は不明です。ただし、統合失調症におけるクロザピンの治療効果は、ドーパミン 2 型 (D2) とセロトニン 2A 型 (5 HT2A) 受容体の拮抗作用を介して媒介されることが提案されています。クロザリルはまた、アドレナリン、コリン作動性、ヒスタミン作動性、その他のドーパミン作動性およびセロトニン作動性受容体のアンタゴニストとしても作用します。
薬力学
クロザピンは、次の受容体に対する結合親和性を示しました: ヒスタミン H1 (Ki 1.1 nM)、アドレナリン α1A (Ki 1.6 nM)、セロトニン 5-HT6 (Ki 4 nM)、セロトニン 5-HT2A (Ki 5.4 nM)、ムスカリン M1 (Ki 6.2) nM)、セロトニン 5-HT7 (Ki 6.3 nM)、セロトニン 5-HT2C (Ki 9.4 nM)、ドーパミン D4 (Ki 24 nM)、アドレナリン α2A (Ki 90 nM)、セロトニン 5-HT3 (Ki 95 nM)、セロトニン5-HT1A (Ki 120 nM)、ドーパミン D2 (Ki 160 nM)、ドーパミン D1 (Ki 270 nM)、ドーパミン D5 (Ki 454 nM)、およびドーパミン D3 (Ki 555 nM)。
クロザピンは、プロラクチンの上昇をほとんどまたはまったく引き起こしません。
臨床脳波(EEG)研究では、クロザピンがデルタおよびシータ活動を増加させ、支配的なアルファ周波数を遅くすることが実証されました。強化された同期が発生します。鋭い波の活動とスパイクと波の複合体も発生する可能性があります。患者は、クロザピン療法中に夢の活動が激化したと報告しています。レム睡眠は総睡眠時間の85%まで増加することがわかった.これらの患者では、入眠直後にレム睡眠が始まりました。
薬物動態
吸収
ヒトでは、クロザリル錠 (25 mg および 100 mg) は、クロザリル溶液と比較して生物学的に同等に利用可能です。クロザリル 100 mg を 1 日 2 回経口投与した場合、平均定常状態のピーク血漿中濃度は 319 ng/mL (範囲: 102 から 771 ng/mL) であり、投与後平均 2.5 時間 (範囲: 1 から 6 時間) で発生しました。投薬。定常状態での平均最小濃度は、100 mg を 1 日 2 回投与した後、122 ng/mL (範囲: 41 ~ 343 ng/mL) でした。食物はクロザリルの全身バイオアベイラビリティーに影響を与えないようです。したがって、クロザリル 50mg は食事の有無にかかわらず投与できます。
分布
クロザピンは、約 97% が血清タンパク質に結合しています。クロザピンと他の高度にタンパク質結合した薬物との相互作用は十分に評価されていませんが、重要である可能性があります[ 薬物相互作用 ]。
代謝と排泄
クロザピンは、排泄前にほぼ完全に代謝され、尿や糞便中に微量の未変化の薬物しか検出されません。クロザピンは、多くのシトクロム P450 アイソザイム、特に CYP1A2、CYP2D6、および CYP3A4 の基質です。投与量の約 50% が尿中に排泄され、30% が糞中に排泄されます。脱メチル化、ヒドロキシル化、および N-オキシド誘導体は、尿と糞の両方の成分です。薬理学的試験では、デスメチル代謝物 (ノルクロザピン) の活性は限定的であることが示されましたが、ヒドロキシル化および N-オキシド誘導体は不活性でした。 75 mg 単回投与後のクロザピンの平均排出半減期は 8 時間 (範囲: 4 から 12 時間) であったのに対し、定常状態に達した後の平均排出半減期は 12 時間 (範囲: 4 から 66 時間) でした。 100mgを1日2回服用。
クロザピンの単回投与と複数回投与の比較では、単回投与後と比較して複数回投与後に排泄半減期が大幅に増加することが示され、濃度依存的な薬物動態の可能性が示唆されました。しかし、定常状態では、1 日 2 回 37.5、75、および 150 mg の投与後に、AUC (曲線下面積)、ピークおよび最小クロザピン血漿濃度に関して、ほぼ用量に比例した変化が観察されました。
薬物間相互作用研究
フルボキサミン
薬物動態研究は、定常状態でクロザピンを投与された 16 人の統合失調症患者で実施されました。フルボキサミンを 14 日間同時投与した後、クロザピンとその代謝物である N-デスメチルクロザピンおよびクロザピン N-オキシドの平均トラフ濃度は、ベースラインの定常状態濃度と比較して約 3 倍上昇しました。
パロキセチン、フルオキセチン、セルトラリン
定常状態でクロザピンを投与された統合失調症患者 (n=14) の研究では、パロキセチンの同時投与は、クロザピンとその代謝物のレベルにわずかな変化しかもたらしませんでした。ただし、他の公開されたレポートでは、クロザピンをパロキセチン、フルオキセチン、およびセルトラリンと一緒に摂取した場合、クロザピンおよび代謝物濃度のわずかな上昇 (2 倍未満) が記載されています。
特定の人口調査
腎障害または肝障害
クロザピンの薬物動態に対する腎臓または肝臓の障害の影響を調査するための特定の薬物動態研究は実施されていません。クロザピンの血漿中濃度は、通常の用量で与えられた場合、重大な腎障害または肝障害のある患者で高くなる可能性があります。
CYP2D6 代謝不良者
人口のサブセット (3% ~ 10%) は、CYP2D6 (CYP2D6 低代謝者) の活性が低下しています。これらの個人は、通常の用量を与えられた場合、クロザピンの予想される血漿濃度よりも高くなる可能性があります.
臨床研究
治療抵抗性統合失調症
治療抵抗性統合失調症に対するクロザリル100mgの有効性は、DSM-Ⅲで統合失調症と診断され、少なくとも3種類の抗精神病薬で効果が不十分な患者を対象とした多施設無作為化二重盲検実薬対照試験(クロルプロマジン)で確立されました。過去 5 年間に少なくとも 2 つの異なる化学クラスから)。抗精神病薬の試験は適切であると判断されている必要があります。抗精神病薬の投与量は、少なくとも 6 週間にわたって 1 日あたり 1000 mg のクロルプロマジンと同等またはそれ以上である必要があり、それぞれの投与で症状が大幅に軽減されることはありません。過去 5 年間に良好に機能した期間はなかったはずです。患者は、研究者評価の簡易精神医学評価尺度 (BPRS) で少なくとも 45 のベースライン スコアを持っている必要があります。 18 項目の BPRS で、1 は症状がないことを示し、7 は重度の症状を示します。潜在的な最大総BPRSスコアは126です。ベースラインでの平均BPRSスコアは61でした。さらに、患者は、次の4つの個々のBPRS項目のうち少なくとも2つで少なくとも4のスコアを持っている必要があります:概念の混乱、疑わしさ、幻覚行動、異常な思考内容。患者は、Clinical Global Impressions – Severity Scale スコアが少なくとも 4 (中程度の病気) である必要があります。
試験の前向き導入段階では、すべての患者 (N=305) が最初にハロペリドール (平均用量は 1 日あたり 61 mg) による単盲検治療を 6 週間受けました。患者の 80% 以上が 6 週間の試験を完了しました。ハロペリドールに対する反応が不十分な患者 (n=268) は、クロザリル (N=126) またはクロルプロマジン (N=142) による二重盲検治療に無作為に割り付けられました。クロザリルの 1 日最大投与量は 900 mg でした。 1 日あたりの平均投与量は 600 mg を超えていました。クロルプロマジンの 1 日最大用量は 1800 mg でした。 1 日あたりの平均投与量は 1200 mg を超えていました。
主要評価項目は、BPRS スコアが少なくとも 20% 減少し、(1) CGI-S スコアが 3 未満 (軽度の病気)、または (2) BPRS スコアが 35 未満のいずれかとして事前定義された治療反応でした。 6週間の治療の終わり。クロザリル群とクロルプロマジン群の約88%の患者が6週間の試験を完了しました。 6週間後、クロザリル群の30%が治療に反応し、クロルプロマジン群の4%が治療に反応しました。差は統計的に有意でした (p
統合失調症または統合失調感情障害における再発性自殺行動
再発自殺行動のリスクを軽減するクロザリルの有効性は、国際自殺予防試験(InterSePT™、ノバルティス ファーマシューティカルズ コーポレーションの商標)で評価されました。これは、統合失調症または統合失調感情障害( DSM-IV) は、自殺行動を繰り返すリスクがあると判断されました。これらの患者の約 4 分の 1 (27%) のみが、標準的な抗精神病薬治療に耐性があると考えられていました。試験に参加するには、患者は次の基準のいずれかを満たしている必要があります。
- 彼らは、ベースライン評価の前の 3 年以内に自殺未遂をしたことがありました。
- 彼らは、ベースライン評価の前の 3 年以内に自殺未遂を防ぐために入院していました。
- 彼らは、ベースライン評価の前の 1 週間以内に、抑うつ要素を伴う中等度から重度の自殺念慮を示しました。
- 彼らは、ベースライン評価の1週間前に自傷行為を命じる幻覚を伴う中度から重度の自殺念慮を示しました。
各治療グループの投与計画は、個々の研究者によって決定され、患者ごとに個別化されました。投与量は柔軟で、クロザリルは 200 ~ 900 mg/日、オランザピンは 5 ~ 20 mg/日でした。この研究でクロザリルまたはオランザピンを投与された 956 人の患者では、向精神薬の併用が広範囲に見られました。84% が抗精神病薬、65% が抗不安薬、53% が抗うつ薬、28% が気分安定薬でした。オランザピン群の患者では、向精神薬の併用が有意に多かった。
主要な有効性の尺度は、(1) 自殺の完了を含む重大な自殺未遂までの時間でした。 (2) 差し迫った自殺リスクによる入院。これには、すでに入院している患者に対する自殺傾向の監視レベルの増加が含まれます。または(3)盲検精神科医Â(CGI-SS-BP)スケールによって評価される自殺の重症度の臨床的全体的印象のベースラインからの「大幅に悪化」または「非常に悪化」によって示される自殺の重症度の悪化。報告された事象が上記の基準 1 または 2 を満たしているかどうかの判断は、患者データを知らされていない専門家グループである自殺監視委員会 (SMB) によって行われました。
合計 980 人の患者が研究に無作為に割り付けられ、956 人が研究投薬を受けました。患者の 62% は統合失調症と診断され、残り (38%) は統合失調感情障害と診断されました。ベースライン時に「治療抵抗性」と特定されたのは、全患者集団の約 4 分の 1 (27%) のみでした。この研究では、女性よりも男性の方が多かった (全患者の 61% が男性であった)。研究に参加した患者の平均年齢は 37 歳 (範囲 18-69) でした。ほとんどの患者は白人 (71%) で、15% が黒人、1% がアジア人、13% が「その他の」人種に分類されました。
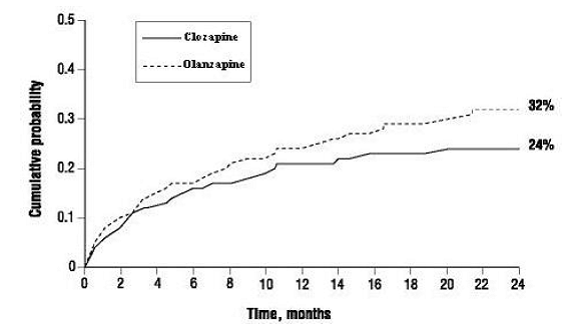
クロザリル100mgで治療された患者は、オランザピンと比較して、自殺行動を再発するまでの時間が統計的に有意に長くなりました。この結果は、クロザリル 50mg のオランザピンに対する優れた有効性を示すものではなく、自殺行動の再発を遅らせるクロザリルの有効性の証拠としてのみ解釈されるべきです。
(1) 自殺の完遂を含む重大な自殺企図、または (2) すでに入院している患者に対する自殺傾向の監視レベルの増加を含む、切迫した自殺のリスクによる入院を経験する確率は、オランザピン患者よりもクロザリル患者で低かった。 104 週目: クロザリル 24% 対オランザピン 32%。差の 95% CI: 2%、14% (図 1)。
図1:自殺の危険性が高い統合失調症または統合失調感情障害患者における自殺予防のための重大な自殺企図または入院の累積確率
患者情報
以下の問題について、患者と介護者と話し合ってください。
- 重度の好中球減少症:
- クロザリルによる治療を開始する患者(および介護者)には、重度の好中球減少症および感染症を発症するリスクについて説明してください。
- 感染の症状または徴候(例、インフルエンザ様疾患、発熱、無気力、全身の衰弱または倦怠感、粘膜潰瘍、皮膚、咽頭、膣、尿路、または肺の感染症、または極度の衰弱)を直ちに医師に報告するよう患者に指示する好中球減少症の評価を支援し、迅速かつ適切な管理を開始するために、CLOZARIL 100mgの治療中にいつでも発生する. [見る 警告と注意事項 ]。
- 患者と介護者に知らせる CLOZARIL 25mg は、重度の好中球減少症を発症するリスクを軽減するために、必要な血液モニタリングを確実に行うように設計された、Clozapine REMS プログラムと呼ばれる制限付きプログラムを通じてのみ入手できます。以下のように、血液検査を受けることの重要性を患者と介護者に伝えてください。
- 最初の 6 か月間は毎週の血液検査が必要です。
- 継続治療の最初の 6 か月間に許容可能な ANC が維持される場合、次の 6 か月間は 2 週間ごとに ANC が必要です。
- ANC は、その後の 6 か月間の継続治療中に許容可能な ANC が維持される場合、4 週間ごとに 1 回必要です。
- クロザリル 50mg は、プログラムに参加している認定薬局からのみ入手できます。患者 (および介護者) に、製品の入手方法に関する Web サイト情報と電話番号を提供します (www.clozapinerems.com または 1-844-267-8678) [参照 警告と注意事項 ]。
- 起立性低血圧、徐脈、および失神: 患者および介護者に、起立性低血圧および失神のリスクについて、特に初回用量漸増期間中に知らせる。用法・用量については、医師の指示に厳密に従うように指示してください。失神を感じたり、意識を失ったり、徐脈や不整脈を示唆する徴候や症状がある場合は、直ちに医師に相談するよう患者に助言する[参照 投薬と管理 、 警告と注意事項 ]。
- 発作:クロザリル100mg投与中の重大な発作のリスクについて、患者と介護者に知らせてください。クロザリルを服用している間は、運転やその他の潜在的に危険な活動について注意してください[ 警告と注意事項 ]。
- 重度の合併症を伴う胃腸運動機能低下: 可能であれば避けるべき薬物療法 (例: 抗コリン作用のある薬物) を含め、クロザピン誘発性便秘のリスク、予防、治療について患者と介護者を教育します。適切な水分補給、身体活動、および繊維の摂取を奨励し、便秘やその他の胃腸症状の発生に迅速に注意し、治療することが重度の合併症を防ぐために重要であることを強調します.便秘の症状(排便困難、排便の不完全、排便回数の減少など)または胃腸の運動機能低下に関連するその他の症状(吐き気、腹部膨満または痛み、嘔吐)[参照 警告と注意事項 、 薬物相互作用 ]。
- QT 間隔の延長: 失神を感じたり、意識を失ったり、不整脈を示唆する徴候や症状がある場合は、直ちに医師に相談するよう患者に助言してください。 QT間隔延長を引き起こす他の薬剤と一緒にクロザリルを服用しないように患者に指導してください。患者に、新薬の前にクロザリル 25 mg を服用していることを臨床医に知らせるように指示します [ 警告と注意事項 、 薬物相互作用 ]。
- 代謝変化(高血糖および真性糖尿病、脂質異常症、体重増加):代謝変化のリスクと特定のモニタリングの必要性について、患者と介護者を教育します。リスクには、高血糖、真性糖尿病、脂質異常症、体重増加、心血管反応などがあります。高血糖症(高血糖)および真性糖尿病(例、多飲症、多尿症、多食症、衰弱)の症状について、患者および介護者を教育する。これらの症状についてすべての患者を監視します。糖尿病と診断された患者、または糖尿病の危険因子(肥満、糖尿病の家族歴)を有する患者は、治療開始前および治療中は定期的に空腹時血糖をモニタリングする必要があります。高血糖の症状を発症した患者は、空腹時血糖値を評価する必要があります。体重の臨床モニタリングが推奨される [ 警告と注意事項 ]。
- 認知機能および運動機能への干渉: クロザリルは判断力、思考力、または運動能力を損なう可能性があるため、クロザリル療法が患者に悪影響を及ぼさないことが合理的に確信できるまで、患者は自動車を含む危険な機械の操作について注意を払う必要があります[ 警告と注意事項 ]。
- 飲み忘れと治療の再開: 患者がクロザリル 50mg を 2 日以上飲み忘れた場合は、同じ用量で投薬を再開するべきではなく、医師に連絡して投薬の指示を受けるべきであることを患者と介護者に伝えてください。 投薬と管理 、 警告と注意事項 ]。
- 妊娠:治療中に患者が妊娠した場合、または妊娠する予定がある場合、患者と介護者は臨床医に通知する必要があります[ 特定の集団での使用 ]。
- 看護:クロザリルを服用している場合、乳児に母乳を与えるべきではないことを患者と介護者に助言する[ 特定の集団での使用 ]。
- 併用薬:患者が処方薬または市販薬を服用している、または服用する予定がある場合は、医療提供者に知らせるよう患者に助言します。重大な薬物間相互作用の可能性があります [参照 投薬と管理 、 薬物相互作用 ]。
