Protonix 20mg, 40mg Pantoprazole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Protonix 40mg とは何ですか? また、どのように使用されますか?
Protonix 40mg は、胃食道逆流症または GERD およびゾリンジャー・エリソン症候群、または過剰な胃酸を引き起こすその他の状態による胃酸によって引き起こされる食道炎の症状を治療するために使用される処方薬です。 Protonix 40mg は、単独で使用することも、他の薬と併用することもできます。
Protonix は、プロトン ポンプ阻害剤 (PPI) と呼ばれる薬物のクラスに属します。
Protonix が 5 歳未満の子供に安全で効果的であるかどうかは不明です。
プロトニクスの副作用の可能性は何ですか?
Protonix は、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 水っぽい、または血が混じった下痢
- 突然の痛みや股関節、手首、または背中の動きの困難、
- 注射部位のあざや腫れ、
- 排尿がほとんどまたはまったくない、
- 尿中の血、
- 腫れ、
- 急激な体重増加、
- めまい、
- 速いまたは不規則な心拍数、
- 震え(揺れ)またはぎくしゃくした動き、
- ぎくしゃくした感じ、
- 手や足の筋肉のけいれんやけいれん、
- 咳、
- 窒息感、
- 関節痛など
- 夜に悪化する頬や腕の皮膚発疹
上記の症状がある場合は、すぐに医療機関を受診してください。
プロトニクスの最も一般的な副作用は次のとおりです。
- 頭痛、
- めまい、
- 胃痛、
- ガス、
- 吐き気、
- 嘔吐、
- 下痢、
- 関節痛、
- 熱、
- 発疹、および
- 風邪の症状(子供に多い)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、プロメトリウムの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
PROTONIX (パントプラゾール ナトリウム) 遅延放出経口懸濁液および PROTONIX (パントプラゾール ナトリウム) 遅延放出錠剤 (PPI) の有効成分は、置換ベンズイミダゾール、ナトリウム 5-(ジフルオロメトキシ)-2-[[(3,4-ジメトキシ-2-ピリジニル)メチル]スルフィニル]-1H-ベンゾイミダゾールセスキ水和物、胃酸分泌を阻害する化合物。その実験式は C16H14F2N3NaO4S x 1.5 H2O で、分子量は 432.4 です。構造式は次のとおりです。
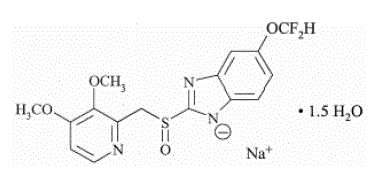
パントプラゾール ナトリウム セスキ水和物は、白色からオフホワイトの結晶性粉末で、ラセミ体です。パントプラゾールには、弱塩基性および酸性の特性があります。パントプラゾールナトリウムセスキ水和物は、水に溶けやすく、pH 7.4 のリン酸緩衝液にはほとんど溶けず、n-ヘキサンにはほとんど溶けません。
水溶液中の化合物の安定性は、pH に依存します。分解速度は、pH の低下とともに増加します。周囲温度での分解半減期は、pH 5 で約 2.8 時間、pH 7.8 で約 220 時間です。
PROTONIX 40mg は、1 つの強度 (40 mg) のパントプラゾール (45.1 mg のパントプラゾール ナトリウムに相当) で入手可能な単位用量パケットの遅延放出経口懸濁液として、および 2 つの強度で入手可能な遅延放出錠剤として提供されます 20。 mg パントプラゾール (パントプラゾール ナトリウム 22.56 mg に相当) および 40 mg パントプラゾール (パントプラゾール ナトリウム 45.1 mg に相当)。
PROTONIX 遅延放出錠には、ステアリン酸カルシウム、クロスポビドン、ヒプロメロース、酸化鉄、マンニトール、メタクリル酸コポリマー、ポリソルベート 80、ポビドン、プロピレングリコール、炭酸ナトリウム、ラウリル硫酸ナトリウム、二酸化チタン、クエン酸トリエチルの不活性成分が含まれています。 PROTONIX 遅延放出錠 (40 mg および 20 mg) は、USP 溶出試験 2 に準拠しています。
PROTONIX 40mg for Delayed-Release Oral Suspension には、次の不活性成分が含まれています: クロスポビドン、ヒプロメロース、メタクリル酸コポリマー、微結晶性セルロース、ポリソルベート 80、ポビドン、炭酸ナトリウム、ラウリル硫酸ナトリウム、タルク、二酸化チタン、クエン酸トリエチル、黄色酸化鉄。
適応症
PROTONIX for Delayed-Release Oral Suspension および PROTONIX 40mg Delayed-Release Tablets は、以下の用途に適応されます。
胃食道逆流症(GERD)に伴うびらん性食道炎の短期治療
PROTONIX 20mg は、びらん性食道炎 (EE) の治癒および症状緩和における短期治療 (最大 8 週間) のために、5 歳以上の成人および小児患者に適応されます。 8 週間の治療後に治癒しなかった成人患者の場合、8 週間の PROTONIX の追加コースが考慮される場合があります。小児患者における 8 週間を超える治療の安全性は確立されていません。
びらん性食道炎の治癒の維持
PROTONIX は、EE の治癒を維持し、GERD の成人患者における日中および夜間の胸やけ症状の再発率を低下させることが示されています。対照研究は 12 か月を超えませんでした。
Zollinger-Ellison 症候群を含む病的な過剰分泌状態
PROTONIX 20mg は、Zollinger-Ellison (ZE) 症候群を含む病理学的過剰分泌状態の長期治療に適応されます。
投薬と管理
推奨投与スケジュール
PROTONIX は、経口懸濁液の調製用のパケットに入った遅延放出顆粒として、または遅延放出錠剤として提供されます。推奨用量を表 1 に示します。
管理手順
各剤形の投与方法の指示を表 2 に示します。
飲み忘れた分はできるだけ早く服用してください。次の服用時間が近い場合は、飲み忘れた分を飛ばして、次の通常の時間に服用してください。 2回分を同時に服用しないでください。
PROTONIX 徐放錠
PROTONIX Delayed-Release Tablets を、食物の有無にかかわらず、丸ごと飲み込んでください。 40mgの錠剤を飲み込むことができない患者には、20mgの錠剤を2錠服用することができます.制酸剤の同時投与は、PROTONIX 遅延放出錠の吸収に影響しません。
遅延放出経口懸濁液用プロトニックス
遅延放出経口懸濁液用の PROTONIX は、食事の約 30 分前にリンゴ ジュースまたはリンゴソースで経口投与するか、リンゴ ジュースのみで経鼻胃管で投与します。安定性には適切な pH が必要であるため、PROTONIX 20mg for Delayed-Release Oral Suspension をアップル ジュース以外の液体、またはアップル ソース以外の食品で投与しないでください。
錠剤製剤を服用できない小児患者のために、遅延放出経口懸濁液用の 40 mg PROTONIX 20 mg パケットを分割して 20 mg の用量を作成しないでください。
遅延放出経口懸濁液のためのPROTONIX - アップルソースでの経口投与
- パケットを開きます。
- 小さじ1杯のアップルソースに顆粒をふりかけます。他の食品を使用したり、顆粒をつぶしたり、噛んだりしないでください。
- 準備から10分以内に服用してください。
- 顆粒が胃に洗い流されるように、水を一口飲みます。必要に応じて水を一口飲みます。
遅延放出経口懸濁液のためのPROTONIX - アップルジュースでの経口投与
- パケットを開きます。
- 小さじ1杯のリンゴジュースを含む小さなカップまたは小さじ1杯に顆粒を空にします.
- 5秒間かき混ぜ(顆粒は溶けません)、すぐに飲み込んでください。
- 確実に全量服用するには、容器をリンゴジュースで1~2回洗い流し、残りの顆粒を取り除いてください。すぐに飲み込む。
PROTONIX 40mg for Delayed-Release Oral Suspension -経鼻胃(NG)チューブまたは胃瘻チューブ投与
経鼻胃管または胃瘻管が挿入されている患者には、遅延放出経口懸濁液用の PROTONIX 40mg を次のように投与できます。
- 2 オンス (60 mL) のカテーテル チップ シリンジのバレルからプランジャーを取り外します。プランジャーを廃棄します。
- 注射器のカテーテル先端を 16 フレンチ (またはそれ以上) のチューブに接続します。
- PROTONIX For Delayed-Release Oral Suspension を投与する間、チューブに取り付けられたシリンジをできるだけ高く保持して、チューブが曲がらないようにします。
- シリンジのバレルにパケットの内容を空にします。
- 10 mL (小さじ 2 杯) のリンゴ ジュースを加え、注射器のバレルを軽く叩いたり振ったりして、注射器とチューブをすすぎます。毎回同じ量のリンゴジュース (10 mL または小さじ 2 杯) を使用して、少なくとも 2 回以上繰り返します。顆粒が注射器に残ってはいけません。
供給方法
剤形と強度
遅延放出錠剤:
- 40 mg パントプラゾール、片面に PROTONIX (茶色のインク) で刻印された黄色の楕円形の両凸錠剤
- パントプラゾール 20 mg、片面に P20 (茶色のインク) で刻印された黄色の楕円形の両凸錠剤
遅延放出経口懸濁液の場合:
- パントプラゾール 40 mg、淡黄色から暗褐色、腸溶性コーティング顆粒、単位用量パケット
保管と取り扱い
プロトニクス(パントプラゾールナトリウム)徐放錠 片面に 40 mg のパントプラゾールを含む PROTONIX (茶色のインク) が刻印された黄色の楕円形の両凸型遅延放出錠剤として提供され、次のように入手できます。
NDC 0008-0841-81 90本入
プロトニクス(パントプラゾールナトリウム)徐放錠 片面に P20 (茶色のインク) が刻印された、20 mg のパントプラゾールを含む黄色の楕円形の両凸型遅延放出錠剤として提供され、次のように入手できます。
NDC 0008-0843-81 90本入
PROTONIX(パントプラゾールナトリウム)遅延放出経口懸濁液用 は、単位用量パケットに 40 mg のパントプラゾールを含む、淡黄色から暗褐色の腸溶性コーティングされた顆粒として供給され、次のように入手できます。
NDC 0008-0844-02、30 の単位用量カートン
保管所
PROTONIX 40mg 遅延放出経口懸濁液および PROTONIX 20mg 遅延放出錠剤は 20° ~ 25°C (68° ~ 77°F) で保管してください。 15° から 30°C (59° から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。
販売元: Wyeth Pharmaceuticals LLC, Pfizer Inc. の子会社, Philadelphia, PA 19101. 改訂: 2020 年 11 月
副作用
次の重篤な有害反応は、以下およびラベルの他の場所で説明されています。
- 急性尿細管間質性腎炎 [参照 警告と注意事項 ]
- クロストリジウム・ディフィシル関連下痢[参照 警告と注意事項 ]
- 骨折 [参照 警告と注意事項 ]
- 皮膚および全身性エリテマトーデス [参照 警告と注意事項 ]
- シアノコバラミン (ビタミン B-12) 欠乏症 [参照 警告と注意事項 ]
- 低マグネシウム血症 [参照 警告と注意事項 ]
- 胃底ポリープ [参照 警告と注意事項 ]
臨床試験の経験
プロトニックス(パントプラゾールナトリウム)遅延放出経口懸濁液とプロトニックス(パントプラゾールナトリウム)遅延放出錠剤の有害反応プロファイルは類似しています。
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
大人
GERD 患者を対象とした 9 つのランダム化比較米国臨床試験における安全性には、経口 PROTONIX (20 mg または 40 mg) の 1,473 人の患者、H2 受容体拮抗薬の 299 人の患者、別の PPI の 46 人の患者、およびプラセボの 82 人の患者が含まれていました。最も頻繁に発生する副作用を表 3 に示します。
臨床試験で PROTONIX 20mg について報告された、2% 以下の頻度で報告された追加の副作用は、身体システムごとに以下にリストされています。
全身: アレルギー反応、発熱、光線過敏反応、顔面浮腫
胃腸: 便秘、口渇、肝炎
血液学: 白血球減少症、血小板減少症
代謝/栄養: CK(クレアチンキナーゼ)の上昇、全身性浮腫、トリグリセリドの上昇、肝酵素の上昇
筋骨格: 筋肉痛
緊張: うつ病、めまい
皮膚と付属物: 蕁麻疹、かぶれ、かゆみ
特別な感覚: ぼやけた視界
小児患者
GERD に関連する EE の治療における PROTONIX の安全性は、3 つの臨床試験で 1 歳から 16 歳までの小児患者で評価されました。安全性試験には、EE の小児患者が参加しました。ただし、EE は小児集団ではまれであるため、内視鏡的に証明された、または症候性 GERD を有する 249 人の小児患者も評価されました。 PROTONIX 20mg に対するすべての成人の副作用は、小児患者に関連すると考えられています。 1 歳から 16 歳までの患者で最も一般的に報告されている (>4%) 副作用には、URI、頭痛、発熱、下痢、嘔吐、発疹、および腹痛が含まれます。
1 歳未満の患者の安全性情報については、 特定の集団での使用 .
臨床試験で小児患者の PROTONIX 20mg について報告された追加の副作用は、頻度が 4% 以下で、身体システム別に以下にリストされています。
全身: アレルギー反応、顔面浮腫
胃腸: 便秘、鼓腸、吐き気
代謝/栄養: トリグリセリドの上昇、肝酵素の上昇、CK(クレアチンキナーゼ)の上昇
筋骨格: 関節痛、筋肉痛
緊張: めまい、めまい
皮膚と付属物: 蕁麻疹
臨床試験で成人に見られた次の有害反応は、臨床試験で小児患者では報告されていませんが、小児患者に関連すると考えられています: 光線過敏反応、口渇、肝炎、血小板減少症、全身性浮腫、うつ病、そう痒症、白血球減少症、およびかすみ目.
ゾリンジャー・エリソン(ZE)症候群
ZE 症候群の臨床研究では、PROTONIX 80 mg/日から 240 mg/日を最大 2 年間服用した 35 人の患者で報告された副作用は、GERD の成人患者で報告されたものと同様でした。
市販後の経験
PROTONIXの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
これらの有害反応は、体のシステムごとに以下にリストされています。
胃腸障害: 胃底腺ポリープ
一般的な障害および投与条件: 無力症、疲労、倦怠感
血液学: 汎血球減少症、無顆粒球症
肝胆道疾患: 黄疸および肝不全につながる肝細胞損傷
免疫系障害: アナフィラキシー(アナフィラキシーショックを含む)、全身性エリテマトーデス
感染症と蔓延: クロストリジウム・ディフィシルによる下痢
調査: 体重変化
代謝と栄養障害: 低ナトリウム血症、低マグネシウム血症
筋骨格障害: 横紋筋融解症、骨折
緊張: 摂食障害、味覚障害
精神障害: 幻覚、錯乱、不眠症、傾眠
腎および尿路疾患: 急性尿細管間質性腎炎
皮膚および皮下組織の疾患: 多形紅斑、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症(TEN、致命的なものもある)、血管性浮腫(Quincke's edema)、皮膚エリテマトーデスなどの重度の皮膚反応(致命的なものもある)
薬物相互作用
表 4 には、PROTONIX と同時に投与した場合に臨床的に重要な薬物相互作用および診断薬との相互作用を伴う薬物と、それらを予防または管理するための指示が含まれています。
PPI との相互作用に関する詳細な情報を得るには、併用薬のラベルを参照してください。
警告
の一部として含まれています 予防 セクション。
予防
胃悪性腫瘍の存在
成人では、PROTONIX による治療に対する症候性反応は、胃の悪性腫瘍の存在を排除するものではありません。 PPIによる治療を完了した後、最適ではない反応または初期の症状の再発がある成人患者では、追加のフォローアップおよび診断テストを検討してください.高齢の患者さんでは、内視鏡検査も考慮してください。
急性尿細管間質性腎炎
急性尿細管間質性腎炎 (TIN) は、PPI を服用している患者で観察されており、PPI 治療中の任意の時点で発生する可能性があります。患者は、症候性過敏症反応から腎機能低下の非特異的症状(例、倦怠感、吐き気、食欲不振)まで、さまざまな徴候や症状を示すことがあります。報告された症例シリーズでは、一部の患者は生検で診断され、腎外症状(例、発熱、発疹、関節痛)がない状態で診断されました。 PROTONIX 20mg を中止し、急性 TIN が疑われる患者を評価する [参照 禁忌 ]。
クロストリジウム・ディフィシル関連下痢症
発表された観察研究は、PROTONIX 20mg のような PPI 療法が、特に入院患者において、クロストリジウム・ディフィシル関連下痢のリスク増加と関連している可能性があることを示唆しています。この診断は、下痢が改善しない場合に考慮する必要があります [参照 有害反応 ]。
患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。
骨折
いくつかの公開された観察研究は、PPI 療法が股関節、手首、または脊椎の骨粗鬆症関連骨折のリスク増加と関連している可能性があることを示唆しています。骨折のリスクは、高用量(1 日複数回の投与と定義)および長期の PPI 療法(1 年以上)を受けた患者で増加しました。患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。骨粗鬆症関連の骨折のリスクがある患者は、確立された治療ガイドラインに従って管理する必要があります[参照 投薬と管理 、 有害反応 ]。
皮膚および全身性エリテマトーデス
皮膚エリテマトーデス (CLE) および全身性エリテマトーデス (SLE) は、パントプラゾール ナトリウムを含む PPI を服用している患者で報告されています。これらの事象は、既存の自己免疫疾患の新たな発症と悪化の両方として発生しています。 PPI 誘発性の紅斑性狼瘡症例の大部分は CLE でした。
PPI で治療された患者で報告された CLE の最も一般的な形態は亜急性 CLE (SCLE) であり、乳児から高齢者までの範囲の患者で継続的な薬物療法の後、数週間から数年以内に発生しました。一般に、組織学的所見は臓器の関与なしに観察されました。
全身性エリテマトーデス (SLE) は、PPI を投与されている患者では CLE ほど一般的ではありません。 PPI 関連の SLE は通常、非薬物誘発性 SLE よりも軽度です。 SLE の発症は、通常、主に若年成人から高齢者までの範囲の患者で、治療を開始してから数日から数年以内に発生しました。発疹を呈した患者の大部分。しかし、関節痛と血球減少症も報告されました。
医学的に指示されているよりも長い PPI の投与は避けてください。 PROTONIX 40mg を服用している患者に CLE または SLE と一致する徴候または症状が認められた場合は、薬剤の使用を中止し、評価のために適切な専門医に患者を紹介してください。ほとんどの患者は、4 ~ 12 週間で PPI のみを中止すると改善します。血清学的検査 (ANA など) は陽性である場合があり、血清学的検査結果の上昇は、臨床症状よりも解消に時間がかかる場合があります。
シアノコバラミン (ビタミン B-12) 欠乏症
一般に、酸抑制薬を長期間(例えば、3年以上)毎日服用すると、低酸症または酸欠乏症によるシアノコバラミン(ビタミンB-12)の吸収不良につながる可能性があります。酸抑制療法で発生するシアノコバラミン欠乏症のまれな報告が文献で報告されています.シアノコバラミン欠乏症と一致する臨床症状が観察された場合、この診断を考慮する必要があります。
低マグネシウム血症
症候性および無症候性の低マグネシウム血症は、少なくとも 3 か月間 PPI で治療された患者ではめったに報告されておらず、ほとんどの場合、1 年間の治療後に報告されています。重篤な有害事象には、テタニー、不整脈、および発作が含まれます。ほとんどの患者で、低マグネシウム血症の治療にはマグネシウムの補充と PPI の中止が必要でした。
長期の治療が予想される患者、またはジゴキシンなどの薬剤または低マグネシウム血症を引き起こす可能性のある薬剤(利尿薬など)と一緒に PPI を服用している患者の場合、医療専門家は、PPI 治療の開始前および定期的にマグネシウム濃度をモニタリングすることを検討してもよい [参照 有害反応 ]。
腫瘍原性
GERD の慢性的な性質のため、PROTONIX の長期投与の可能性があります。げっ歯類の長期研究では、パントプラゾールは発がん性があり、まれなタイプの胃腸腫瘍を引き起こしました。これらの所見とヒトの腫瘍発生との関連性は不明です[ 非臨床毒性学 ]。
胃底ポリープ
PPI の使用は、特に 1 年以上の長期使用に伴って増加する胃底腺ポリープのリスク増加と関連しています。胃底腺ポリープを発症したほとんどの PPI ユーザーは無症候性であり、内視鏡検査で偶発的に胃底腺ポリープが特定されました。治療中の状態に適した最短期間の PPI 療法を使用してください。
神経内分泌腫瘍の調査への干渉
血清クロモグラニン A (CgA) レベルは、薬物による胃酸の減少に続いて増加します。増加した CgA レベルは、神経内分泌腫瘍の診断調査で偽陽性の結果を引き起こす可能性があります。医療提供者は、CgA レベルを評価する少なくとも 14 日前に PROTONIX 20mg 治療を一時的に中止し、最初の CgA レベルが高い場合はテストを繰り返すことを検討する必要があります。一連の試験を実施する場合(モニタリングなど)、試験間の参照範囲が異なる可能性があるため、同じ商用試験所を試験に使用する必要があります [参照 臨床薬理学 ]。
THCの尿スクリーニングへの干渉
PROTONIX [ 薬物相互作用 ]。
PROTONIX とメトトレキサートの併用
文献によると、PPI とメトトレキサートの併用 (主に高用量。メトトレキサート処方情報を参照) は、メトトレキサートおよび/またはその代謝産物の血清レベルを上昇および延長させ、メトトレキサート毒性を引き起こす可能性があることを示唆しています。高用量のメトトレキサート投与では、一部の患者では PPI の一時的な中止が考慮される場合があります [ 薬物相互作用 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイドと使用説明書 )。
胃の悪性腫瘍
最適ではない反応または初期の症状の再発がある場合は、医療提供者に戻るように患者にアドバイスします[参照 警告と注意事項 ]。
急性尿細管間質性腎炎
急性尿細管間質性腎炎に関連する徴候および/または症状を経験した場合は、すぐに医療提供者に連絡するよう患者に助言する[参照 禁忌 、 警告と注意事項 ]。
クロストリジウム・ディフィシル関連下痢症
改善しない下痢を経験した場合は、すぐに医療提供者に連絡するよう患者に助言する[参照 警告と注意事項 ]。
骨折
骨折、特に股関節、手首、または脊椎の骨折については、医療提供者に報告するように患者に助言してください。 警告と注意事項 ]。
皮膚および全身性エリテマトーデス
皮膚または全身性エリテマトーデスに関連する新たな症状または症状の悪化については、すぐに医療提供者に連絡するよう患者に助言する[参照 警告と注意事項 ]。
シアノコバラミン (ビタミン B-12) 欠乏症
PROTONIX 40mgを3年以上服用している場合は、シアンコバラミン欠乏症に関連する可能性のある臨床症状を医療提供者に報告するように患者にアドバイスしてください[ 警告と注意事項 ]。
低マグネシウム血症
少なくとも 3 か月間 PROTONIX 40mg を投与されている場合は、低マグネシウム血症に関連する可能性のある臨床症状を医療提供者に報告するよう患者に助言します [ 警告と注意事項 ]。
薬物相互作用
リルピビリンを含む製品を含め、現在服用している他の薬を医療提供者に知らせるように患者に指示する[ 禁忌 ] ジゴキシン [参照 警告と注意事項 ]および高用量メトトレキサート[参照 警告と注意事項 ]。
妊娠
妊娠中の女性には、胎児への潜在的なリスクについてアドバイスしてください。妊娠の可能性がある女性に、妊娠が判明している、または妊娠の疑いがあることを医療提供者に知らせるようにアドバイスする[参照 特定の集団での使用 ]。
管理
- PROTONIX for Delayed-Release Oral Suspension および PROTONIX 20mg Delayed-Release Tablets を割ったり、砕いたり、噛んだりしないでください。
- プロトニックス経口懸濁剤は固定用量であり、分割して少量にすることはできません。
- PROTONIX 20mg 遅延放出錠を丸ごと飲み込みます。食物の有無にかかわらず、胃の中で飲み込んでください。
- 制酸剤の同時投与は、PROTONIX 遅延放出錠の吸収に影響しません。
- 食事の約 30 分前に遅延放出経口懸濁液用の PROTONIX 20mg を服用してください。
- 使用説明書に記載されているように、アップル ジュースまたはアップルソースで遅延放出経口懸濁液用の PROTONIX を投与します。水、他の液体、または食品に投与しないでください。
- 経鼻胃管 (NG) または胃瘻チューブを使用している患者の場合、PROTONIX for Delayed-Release Oral Suspension は、使用説明書に記載されているように、アップル ジュースと一緒に投与できます。
- 飲み忘れた分はできるだけ早く服用してください。次の服用時間が近い場合は、飲み忘れた分を飛ばして、次の通常の時間に服用してください。 2回分を同時に服用しないでください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
24 か月の発がん性試験では、Sprague-Dawley ラットに 0.5 ~ 200 mg/kg/日のパントプラゾールを経口投与しました。これは、40 mg を投与した 50 kg の人の体表面積ベースでの曝露の約 0.1 ~ 40 倍です。 /日。胃底では、0.5 から 200 mg/kg/日での治療により、腸クロム親和性 (ECL) 細胞過形成および良性および悪性の神経内分泌細胞腫瘍が用量依存的に生じました。前胃では、50 および 200 mg/kg/日 (体表面積ベースでヒトの推奨用量の約 10 倍および 40 倍) での治療により、良性扁平上皮乳頭腫および悪性扁平上皮癌が発生しました。パントプラゾール治療に関連するまれな胃腸腫瘍には、50 mg/kg/日で十二指腸の腺癌、200 mg/kg/日で胃底の良性ポリープと腺癌が含まれていました。肝臓では、0.5 ~ 200 mg/kg/日での治療により、肝細胞腺腫および肝細胞がんの発生率が用量依存的に増加しました。甲状腺では、200 mg/kg/日での処理により、雄と雌の両方のラットで濾胞細胞腺腫と癌腫の発生率が増加しました。
24 か月の発がん性試験では、Fischer 344 ラットにパントプラゾール 5 ~ 50 mg/kg/日の用量を経口投与しました。これは、体表面積に基づくヒトの推奨用量の約 1 ~ 10 倍です。胃底では、5 ~ 50 mg/kg/日での治療により、腸クロム親和性 (ECL) 細胞過形成および良性および悪性の神経内分泌細胞腫瘍が生じました。この研究の用量選択は、パントプラゾールの発がん性を包括的に評価するのに十分ではなかった可能性があります。
24 か月の発がん性試験では、B6C3F1 マウスに 5 ~ 150 mg/kg/日の用量のパントプラゾールを経口投与しました。これは体表面積に基づくヒトの推奨用量の 0.5 ~ 15 倍です。肝臓では、150 mg/kg/日での処理により、雌マウスの肝細胞腺腫および肝細胞癌の発生率が増加しました。 5 ~ 150 mg/kg/日での治療でも、胃底 ECL 細胞過形成が生じました。
26 週間の p53 +/- トランスジェニック マウスの発がん性試験は陽性ではありませんでした。
パントプラゾールは、in vitro ヒトリンパ球染色体異常試験、染色体異常誘発作用に関する 2 つのマウス小核試験の 1 つ、および突然変異誘発作用に関する in vitro チャイニーズハムスター卵巣細胞/HGPRT 前方突然変異試験で陽性でした。 in vivo ラット肝臓 DNA 共有結合アッセイでは、あいまいな結果が観察されました。パントプラゾールは、in vitro Ames 変異試験、ラット肝細胞を用いた in vitro 不定期 DNA 合成 (UDS) 試験、in vitro AS52/GPT 哺乳動物細胞順方向遺伝子変異試験、マウスリンパ腫 L5178Y を用いた in vitro チミジンキナーゼ変異試験で陰性であった細胞、および in vivo ラット骨髄細胞染色体異常アッセイ。
パントプラゾールを雄ラットで最大 500 mg/kg/日 (体表面積に基づくヒトの推奨用量の 98 倍) および雌ラットで 450 mg/kg/日まで経口投与した場合、生殖能または生殖能力に影響はありませんでした。 (体表面積に基づくヒトの推奨用量の 88 倍)。
特定の集団での使用
妊娠
リスクの概要
公開された観察研究から入手可能なデータは、パントプラゾールとの主要な奇形またはその他の有害な妊娠転帰との関連を示していませんでした。
動物の繁殖研究では、パントプラゾールで有害な発達結果の証拠は観察されませんでした.ラットでは最大 450 mg/kg/日 (ヒトの推奨用量の約 88 倍)、ウサギでは最大 40 mg/kg/日 (ヒトの推奨用量の約 16 倍) の経口用量で生殖試験が実施されています。妊娠中の動物の器官形成中にパントプラゾールを投与し、この研究ではパントプラゾールによる胎児への害の証拠がないことを明らかにしました( データ )。
骨の発達に対する効果を評価するための追加のエンドポイントを用いたラットの出生前および出生後の発生毒性試験が、パントプラゾールナトリウムで実施されました。経口パントプラゾール用量 5、15、および 30 mg/kg/日 (人間の用量である 40 mg/日の約 1、3、および 6 倍) を妊娠中の女性に、妊娠日 (GD) 6 から授乳日 (LD) まで投与しました。 ) 21. 出産後 (PND) 4 日から PND 21 までの経口投与と同様に、授乳期間中の子宮内および乳汁を介してパントプラゾールに曝露された仔動物において、骨形態の変化が観察された [参照 特定の集団での使用 ]。母動物に薬物関連の所見はありませんでした。妊娠中の女性には、胎児への危害の潜在的なリスクについてアドバイスしてください。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における重大な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
データ
ヒューマンデータ
公表された観察研究から得られた入手可能なデータは、妊娠関連の有害転帰とパントプラゾールの使用との関連性を示すことができませんでした。これらの観察研究の方法論的限界により、妊娠中の薬物関連リスクを確実に確立または除外することはできません。 European Network of Teratology Information Services による前向き研究では、1 日平均 40 mg のパントプラゾールを投与された 53 人の妊婦のグループの結果が、プロトンポンプ阻害剤 (PPI) を服用していない 868 人の妊婦の対照グループと比較されました。 . PPI にさらされた女性と対照群の間で重大な奇形の発生率に差はなく、相対リスク (RR) = 0.55、[95% 信頼区間 (CI) 0.08-3.95] に相当します。 1996 年から 2008 年までのデンマークのすべての出生を対象とした人口ベースのレトロスペクティブ コホート研究では、549 例の出生におけるパントプラゾールへの妊娠第 1 期の暴露の分析中に、重大な出生異常の有意な増加はありませんでした。少なくとも妊娠第 1 期に PPI に曝露した 1,530 人の妊婦と、曝露していない 133,410 人の妊婦を比較したメタ分析では、先天性奇形または PPI への曝露による自然流産のリスクに有意な増加は見られませんでした (重大な奇形の場合、OR=1.12 ([95% CI 0.86-1.45]、自然流産の場合は OR=1.29 [95% CI 0.84-1.97])。
動物データ
ラットでは最大 450 mg/kg/日 (体表面積に基づく推奨ヒト用量の約 88 倍) の経口パントプラゾール用量で、また最大 40 mg/kg/日 (約 16体表面積に基づいたヒトの推奨用量の 2 倍)、妊娠中の動物の器官形成中にパントプラゾール ナトリウムを投与した場合。研究では、パントプラゾールによる受胎能の障害や胎児への害の証拠は明らかにされていません。
骨の発達に対する効果を評価するための追加のエンドポイントを用いたラットの出生前および出生後の発生毒性試験が、パントプラゾールナトリウムで実施されました。経口パントプラゾール 5、15、および 30 mg/kg/日 (体表面積ベースでヒトの用量 40 mg/日の約 1、3、および 6 倍) が、妊娠日 (GD) から妊娠中の女性に投与されました。 6 から授乳日 (LD) 21. 生後 (PND 4) から PND 21 まで、子犬に 5、15、および 30 mg/kg/日 (暴露量の約 1、2.3、および 3.2 倍) を経口投与した ( AUC) 40 mg の用量でのヒトにおける)。母動物に薬物関連の所見はありませんでした。子犬の離乳前投与期 (PND 4 から 21) の間、5 mg/kg/日で死亡率および/または瀕死状態が増加し、体重および体重増加が減少した (40 を投与されたヒトではほぼ等しい暴露 (AUC))。 mg 用量)およびそれ以上の用量。生後 21 日に、5 mg/kg/日 (ヒトでは 40 mg 用量でほぼ等しい暴露量 (AUC)) およびそれ以上の用量で、平均大腿骨長および重量の減少ならびに大腿骨の骨量および形状の変化が子孫で観察された。大腿骨の調査結果には、総面積、骨ミネラル含有量と密度、骨膜と骨内膜の円周、および断面慣性モーメントの低下が含まれていました。遠位大腿骨、近位脛骨、または膝関節に微視的な変化はありませんでした。骨パラメーターの変化は、回復期間後に部分的に可逆的であり、PND 70 での所見は、5 mg/kg/日での雌の仔の大腿骨骨幹端皮質/皮質下骨ミネラル密度の低下に限定されていました (ヒトでは 40 でほぼ等しい暴露 (AUC) mg 用量)およびそれ以上の用量。
授乳
リスクの概要
パントプラゾールは、40 mg のパントプラゾールを 1 回経口投与した後、授乳中の母親の母乳から検出されました。母乳で育てられた乳児への影響はありませんでした( データ )。牛乳生産に対するパントプラゾールの影響に関するデータはありません。

母乳育児の発達上および健康上の利点は、PROTONIX 40mg に対する母親の臨床的必要性、およびパントプラゾールまたは基礎となる母体の状態から授乳中の子供への潜在的な悪影響とともに考慮されるべきです。
データ
分娩後 10 か月で 40 mg の経口パントプラゾールを投与された 42 歳の女性の母乳を 24 時間調査し、母乳中に存在するパントプラゾールのレベルが低いことを示しました。パントプラゾールは、それぞれ約 36 mcg/L および 24 mcg/L の乳レベルで、投与後わずか 2 および 4 時間で乳中に検出されました。 0.022 の乳と血漿の比率は、薬物投与後 2 時間で観察されました。パントプラゾールは、投与後 6、8、および 24 時間で乳汁中に検出されませんでした (
小児用
GERDに関連するEEの短期治療(最大8週間)に対するPROTONIXの安全性と有効性は、1歳から16歳までの小児患者で確立されています。 EE の有効性は、1 歳未満の患者では実証されていません。さらに、5 歳未満の患者には、利用可能な年齢に適した処方で適切な用量強度がありません。したがって、PROTONIX は、5 歳以上の患者の GERD に関連する EE の短期治療に適応されます。 EE 以外の小児用 PROTONIX の安全性と有効性は確立されていません。
1歳から16歳まで
GERD に関連する EE の短期治療 (最大 8 週間) のための 1 歳から 16 歳までの小児患者における PROTONIX の使用は、以下によってサポートされます。成人の GERD に関連する EE の治療のための PROTONIX、および b) 小児患者で実施された安全性、有効性、および薬物動態の研究 [参照 臨床研究 、 臨床薬理学 ]。
歳から 16 歳までの小児患者における GERD に関連する EE の治療における PROTONIX 40mg の安全性は、249 人の小児患者を含む 3 つの多施設、無作為化、二重盲検、並行治療研究で評価され、そのうち 8 人は EE (4 人の患者) 1 歳から 5 歳までの患者と 5 歳から 11 歳までの 4 人の患者)。内視鏡検査で EE と診断された 1 歳から 5 歳の子供 (内視鏡検査で Hetzel-Dent スコアが 2 以上と定義) を 1 日 1 回、8 週間にわたって PROTONIX の 2 つの用量レベル (約 0.6 mg/kg または 1.2 mg/kg) のいずれかで治療しました。 )。これらの EE 患者 4 人全員が 8 週間で治癒しました (Hetzel-Dent スコア 0 または 1)。 EEは小児集団ではまれであるため、主に内視鏡的に証明された、または症候性のGERDを有する小児患者もこれらの研究に含まれました。患者は、さまざまな用量の PROTONIX 20mg を 1 日 1 回 8 週間投与されました。安全性に関する調査結果については、 有害反応 .これらの小児試験には、プラセボ、実薬対照、または用量反応の証拠がなかったため、小児集団における症候性GERDに対するPROTONIX 20mgの臨床的利点に関して、試験は決定的ではありませんでした.小児患者の症候性GERDの治療に対するPROTONIX 40mgの有効性は確立されていません。
臨床試験のデータは、1 歳から 5 歳までの小児患者における GERD に関連する EE の短期治療に PROTONIX を使用することを支持していますが、5 歳未満の患者に適した市販の投与製剤はありません [ 投薬と管理 ]。
母集団の薬物動態分析では、内視鏡検査で GERD と証明された 1 ~ 5 歳の子供のクリアランス値の中央値は 2.4 L/h でした。 1.2 mg/kg 相当の用量 (12.5 kg 未満の場合は 15 mg、12.5 kg を超えて 25 kg 未満の場合は 20 mg) の後、パントプラゾールの血漿濃度は大きく変動し、血漿濃度がピークに達するまでの時間の中央値は 3 ~ 6 時間でした。 1 歳から 5 歳の患者の推定 AUC は、40 mg の錠剤を 1 錠服用している成人よりも 37% 高く、AUC の幾何平均値は 6.8 μg·hr/mL でした。
1歳未満の新生児
PROTONIX 20mg は、生後 1 ~ 11 か月の 129 人の小児患者を対象とした多施設無作為化二重盲検プラセボ対照治療中止試験で有効であることがわかりませんでした。患者は、病歴に基づいて症候性 GERD を有し、GERD に対する非薬理学的介入に 2 週間反応しなかった場合に登録されました。患者は非盲検期に 4 週間毎日 PROTONIX を投与され、その後 4 週間は二重盲検法で PROTONIX 40mg 治療またはプラセボを等比率で無作為に割り付けられました。有効性は、無作為化から 4 週間の治療中止期間中に症状が悪化したために試験が中止されるまでの時間を観察することによって評価されました。プロトニックス 20mg とプラセボとの間に、中止率に統計的に有意な差はありませんでした。
この試験で、プラセボ集団と比較して治療集団でより一般的に報告された副作用 (4% 以上の差) は、CK の上昇、中耳炎、鼻炎、および喉頭炎でした。
母集団の薬物動態分析では、40 mg の単回投与を受けた成人と比較して、1 歳未満の GERD 患者の全身暴露が高かった (幾何平均 AUC は、2.5 mg の単回投与を受けた早産児および新生児で 103% 高かった)約 1.2 mg/kg の単回投与を受けた生後 1 ~ 11 か月の乳児では 23% 高くなります)。これらの患者では、見かけのクリアランス (CL/F) は年齢とともに増加しました (クリアランスの中央値: 0.6 L/hr、範囲: 0.03 ~ 3.2 L/hr)。
これらの用量は、胃のpHには薬力学的効果をもたらしましたが、食道のpHには効果をもたらしませんでした。早産児と新生児に 2.5 mg の PROTONIX 20 mg を 1 日 1 回投与した後、胃の平均 pH が上昇し (ベースラインの 4.3 から定常状態の 5.2 に)、胃の pH が 4 を超える平均時間 (%) が増加しました (ベースラインの 60% から定常状態の 80% まで)。生後 1 ~ 11 か月の乳児に約 1.2 mg/kg の PROTONIX 20 mg を 1 日 1 回投与した後、胃の平均 pH が上昇し (ベースラインの 3.1 から定常状態の 4.2 に)、平均時間 % が上昇しました。胃の pH は 4 を超えていました (ベースラインの 32% から定常状態の 60% まで)。しかし、平均食道内 pH または食道 pH が 4 未満であった時間の割合には、いずれの年齢層でも有意な変化は観察されませんでした。
PROTONIX 20mg は、この年齢層の無作為化プラセボ対照試験で有効であることが示されていないため、1 歳未満の乳児の症候性 GERD の治療に PROTONIX を使用することは示されていません。
動物毒性データ
ラットの出生前および出生後の発育試験で、子犬にパントプラゾールを 5、15、および 30 mg/kg/日で経口投与しました (年長児の曝露量 (AUC) の約 1、2.3、および 3.2 倍)。 40 mg の用量で 6 ~ 11 年間、生後 (PND 4) から PND 21 まで、母乳による授乳中の暴露に加えて。生後 21 日に、平均大腿骨長と重量の減少、および大腿骨の骨量と形状の変化が 5 mg/kg/日で子孫に観察された (40 mg 用量で 6 歳から 11 歳の子供の暴露量 (AUC) はほぼ等しい)。そしてより高い線量。骨パラメータの変化は、回復期間後に部分的に可逆的でした。
新生児/若年動物 (ラットおよびイヌ) の毒性は、胃の変化、赤血球量の減少、脂質の増加、酵素誘導および肝細胞肥大など、成体動物で観察されたものと同様でした。成体および新生児/若年ラットにおける好酸球主細胞の発生率の増加、および成体ラットおよび新生児/若年犬における主細胞の萎縮が、反復投与試験で胃の底部粘膜に観察された。これらの効果の完全または部分的な回復は、回復期間の後、両方の年齢グループの動物で認められました。
高齢者の使用
米国の短期臨床試験では、PROTONIX で治療された 107 人の高齢患者 (65 歳以上) の EE 治癒率は、65 歳未満の患者と同様でした。 65 歳以上の患者は、65 歳未満の患者と同様でした。
過剰摂取
非常に高用量の PROTONIX (240 mg 以上) を服用している患者の経験は限られています。過剰摂取の自発的な市販後の報告は、一般に、PROTONIX の既知の安全性プロファイルの範囲内です。
パントプラゾールは血液透析では除去されません。過剰摂取の場合、治療は対症療法および支持療法でなければなりません。
709 mg/kg、798 mg/kg、および 887 mg/kg のパントプラゾールの単回経口投与は、それぞれマウス、ラット、およびイヌに対して致死的でした。急性毒性の症状は、活動低下、運動失調、背を丸めて座る、手足を広げる、側臥位、分離、耳反射の欠如、振戦であった。
PROTONIX 20mg への過剰暴露が発生した場合は、毒物管理センター (1-800-222-1222) に電話して、中毒または過剰摂取の管理に関する最新情報を入手してください。
禁忌
- PROTONIX は、製剤のいずれかの成分または代替ベンズイミダゾールに対する既知の過敏症のある患者には禁忌です。過敏症反応には、アナフィラキシー、アナフィラキシーショック、血管性浮腫、気管支痙攣、急性尿細管間質性腎炎、蕁麻疹などがあります。 警告と注意事項 、 有害反応 ]。
- PROTONIX を含むプロトンポンプ阻害薬 (PPI) は、リルピビリン含有製品を投与されている患者には禁忌です [ 薬物相互作用 ]。
臨床薬理学
作用機序
パントプラゾールは、胃壁細胞の分泌表面で (H+, K+)-ATPase 酵素系に共有結合することにより、胃酸産生の最終段階を抑制する PPI です。この効果により、刺激に関係なく、胃酸分泌の基礎および刺激の両方が抑制されます。 (H+, K+)-ATPase への結合により、試験したすべての用量 (20 mg から 120 mg) で 24 時間以上持続する抗分泌効果が持続します。
薬力学
PROTONIX 20mg 遅延放出経口懸濁液の場合、40 mg は、逆流性食道炎および EE の病歴のある患者 (n = 49) のペンタガストリン刺激 MAO の抑制において、PROTONIX 遅延放出錠に匹敵することが示されています。この多施設の薬力学的クロスオーバー研究では、ティースプーン 1 杯のアップルソースで投与された遅延放出経口懸濁液用の PROTONIX 40 mg の経口投与量と、各製剤を 1 日 1 回 7 日間投与した後の PROTONIX 遅延放出錠剤 40 mg の経口投与量が比較されました。日々。どちらの薬も朝食の 30 分前に投与されました。ペンタガストリン刺激 (MAO) は、定常状態で 23 時間から 24 時間まで評価されました。
抗分泌活動
ペンタガストリンを使用した最大酸刺激条件下では、健康な被験者にパントプラゾールを経口 (20 ~ 80 mg) で単回投与または静脈内 (20 ~ 120 mg) で単回投与すると、胃酸分泌量が用量依存的に減少します。パントプラゾールを 1 日 1 回投与すると、胃酸分泌の抑制が増加します。パントプラゾール 40 mg の初回経口投与後、2.5 時間までに平均 51% の阻害が達成されました。 1日1回、7日間投与すると、平均阻害率は85%に増加しました。パントプラゾールは、被験者の半数で酸分泌を 95% 以上抑制しました。パントプラゾールの最後の投与後、酸分泌は1週間以内に正常に戻りました。リバウンド過分泌の証拠はありませんでした。
一連の用量反応研究において、パントプラゾールは、20 から 120 mg の経口用量で、胃の基礎 pH の中央値の用量依存的な増加を引き起こし、胃の pH が >3 および >4 である時間の割合で. 40 mg のパントプラゾールによる治療では、20 mg の投与量よりも胃の pH が大幅に増加しました。 40 mg (60、80、120 mg) を超える用量では、胃の pH の中央値がさらに有意に上昇することはありませんでした。 1 つの二重盲検クロスオーバー試験からの中央値 pH に対するパントプラゾールの効果を表 5 に示します。
血清ガストリン効果
胃食道逆流症 (GERD) の 682 人の患者が最大 8 週間、10、20、または 40 mg の PROTONIX 20 mg を投与された EE の急性治癒に関する 2 つの二重盲検試験で、空腹時血清ガストリン レベルが評価されました。 4 週間の治療で、10、20、および 40 mg の治療群で、治療前の値よりも平均ガストリン レベルがそれぞれ 7%、35%、および 72% 増加しました。血清ガストリンレベルの同様の増加が 8 週間の来院時に認められ、3 つのパントプラゾール投与群で平均 3%、26%、および 84% 増加しました。 PROTONIX 遅延放出錠による維持療法中、血清ガストリン濃度の中央値は正常範囲内に留まりました。
800 人以上の患者を対象とした長期の国際研究では、GERD 維持研究と 40 mg/日の用量のパントプラゾールによる治療の最初の数か月で、治療前の空腹時血清ガストリン レベルから 2 ~ 3 倍の平均増加が観察されました。難治性GERD患者では1日あたりmg以上。空腹時血清ガストリンレベルは、臨床試験での定期的なフォローアップの最大4年間、一般にベースラインの約2〜3倍のままでした.
PROTONIX 20mgによる短期間の治療後、上昇したガストリンレベルは少なくとも3ヶ月で正常に戻ります.
エンテロクロマフィン様 (ECL) 細胞の効果
経口パントプラゾール 40 ~ 240 mg を 1 日 40 ~ 240 mg で最長 5 年間投与された 39 人の患者 (大多数は 40 ~ 80 mg を投与) では、使用開始から 1 年後に ECL 細胞密度が中程度に増加しました。 4年後は安定。
Sprague-Dawley ラットでの非臨床研究では、パントプラゾールを 0.5 ~ 200 mg/kg/日の用量で生涯暴露 (24 か月) すると、胃 ECL 細胞増殖および胃神経内分泌 (NE) 細胞腫瘍が用量依存的に増加しました。 .ラットの胃 NE 細胞腫瘍は、血清ガストリン濃度の慢性的な上昇が原因である可能性があります。ラット胃内の ECL 細胞の密度が高いため、この種は、PPI によって生成されるガストリン濃度の上昇による増殖効果の影響を非常に受けやすくなっています。しかしながら、0.5mg/kg/日の用量でパントプラゾールを投与した後、血清ガストリンの上昇は観察されなかった。別の研究では、5 mg/kg/日のパントプラゾールを 12 か月間投与した後、1 匹の雌ラットで、ECL 細胞の増殖性変化を伴わない胃 NE 細胞腫瘍が観察され、9 か月間は投与を中止して回復した [参照 非臨床毒性学 ]。
内分泌への影響
臨床薬理研究では、PROTONIX 40 mg を 1 日 1 回 2 週間投与しても、次のホルモンのレベルに影響はありませんでした: コルチゾール、テストステロン、トリヨードサイロニン (T3)、サイロキシン (T4)、甲状腺刺激ホルモン (TSH)、チロニン-結合タンパク質、副甲状腺ホルモン、インスリン、グルカゴン、レニン、アルドステロン、卵胞刺激ホルモン、黄体形成ホルモン、プロラクチン、および成長ホルモン。
PROTONIX 40 mg または 20 mg で治療された GERD 患者の 1 年間の研究では、T3、T4、および TSH の全体的なレベルにベースラインからの変化はありませんでした。
薬物動態
PROTONIX 40mg 遅延放出錠剤は、錠剤が胃を出た後にのみパントプラゾールの吸収が始まるように、腸溶性コーティングされた錠剤として調製されています。ピーク血清濃度 (Cmax) および血清濃度時間曲線下面積 (AUC) は、10 mg から 80 mg までの経口および静脈内投与量に比例して増加します。パントプラゾールは蓄積せず、その薬物動態は毎日複数回投与しても変化しません。経口または静脈内投与後、パントプラゾールの血清濃度は 2 指数関数的に低下し、最終的な消失半減期は約 1 時間です。
腸溶性コーティングされた 40 mg パントプラゾール錠剤の経口投与を受けている正常な肝機能を持つ高代謝者では、ピーク濃度 (Cmax) は 2.5 μg/mL です。ピーク濃度 (tmax) に達するまでの時間は 2.5 h であり、血漿濃度対時間曲線 (AUC) の下の平均総面積は 4.8 μgh/mL (範囲 1.4 から 13.3 μgh/mL) です。高代謝者へのパントプラゾールの静脈内投与後、その総クリアランスは 7.6 ~ 14.0 L/h であり、見かけの分布容積は 11.0 ~ 23.6 L です。
徐放性経口懸濁液用プロトニックス 40 mg の単回経口投与は、健康な被験者 (N = 22) に小さじ 1 杯のアップルソースに顆粒を振りかけた場合、リンゴ ジュースと混合した顆粒、またはリンゴジュースを飲み、経鼻胃管から投与します。健康な被験者のクロスオーバー研究からの血漿薬物動態パラメーターを表 6 にまとめます。
吸収
PROTONIX 20mg 遅延放出錠の 40mg を単回または複数回経口投与した後、パントプラゾールのピーク血漿濃度は約 2.5 時間で達成され、Cmax は 2.5 μg/mL でした。パントプラゾールは初回通過代謝がほとんどないため、絶対バイオアベイラビリティは約 77% になります。パントプラゾールの吸収は、制酸剤の同時投与による影響を受けません。
PROTONIX Delayed-Release Tablets を食物と一緒に投与すると、その吸収が最大 2 時間またはそれ以上遅れる場合があります。ただし、Cmax とパントプラゾール吸収の程度 (AUC) は変わりません。したがって、PROTONIX 40mg 遅延放出錠は、食事のタイミングに関係なく服用できます。
パントプラゾール顆粒 40 mg を高脂肪食とともに投与すると、血漿濃度がピークに達するまでの時間の中央値が 2 時間遅れました。付随する高脂肪食では、アップルソースに振りかけたパントプラゾール顆粒 40 mg の Cmax と AUC は、それぞれ 51% と 29% 減少しました。したがって、遅延放出経口懸濁液用の PROTONIX 20mg は、食事の約 30 分前に服用する必要があります。
分布
パントプラゾールの見かけの分布体積は約 11 ~ 23.6 L で、主に細胞外液に分布します。パントプラゾールの血清タンパク質結合は、主にアルブミンに対して約 98% です。
排除
代謝
パントプラゾールは、シトクロム P450 (CYP) システムを介して肝臓で広範囲に代謝されます。パントプラゾールの代謝は、投与経路(静脈内または経口)とは無関係です。主な代謝経路は、CYP2C19 による脱メチル化とそれに続く硫酸化です。他の代謝経路には、CYP3A4 による酸化が含まれます。パントプラゾール代謝物のいずれにも有意な薬理学的活性があるという証拠はありません。
排泄
健康で代謝が正常な被験者に 14C 標識パントプラゾールを単回経口または静脈内投与した後、投与量の約 71% が尿中に排泄され、18% が胆汁排泄によって糞便中に排泄されました。未変化体パントプラゾールの腎排泄はなかった。
特定の集団
高齢患者
パントプラゾールの AUC (43%) および Cmax (26%) のわずかから中等度の増加のみが、若い被験者と比較して、反復経口投与後の高齢被験者 (64 ~ 76 歳) で見られました [ 特定の集団での使用 ]。
小児患者
パントプラゾールの薬物動態は、推定/証明された GERD の小児患者を対象とした 4 つの無作為化非盲検臨床試験で、16 歳未満の子供を対象に研究されました。小児用顆粒製剤は 5 歳までの子供で研究され、PROTONIX 40mg 遅延放出錠は 5 歳以上の子供で研究されました。
母集団 PK 分析では、総クリアランスは体重の増加とともに非線形的に増加しました。総クリアランスも、3 歳未満の子供でのみ年齢の増加とともに増加しました。
5歳までの新生児
[見る 特定の集団での使用 ]
6歳から16歳までの子供と青年
PROTONIX 遅延放出錠の薬物動態は、GERD の臨床診断を受けた 6 歳から 16 歳の子供で評価されました。 6 歳から 16 歳の小児における PROTONIX 40 mg 錠 20 mg または 40 mg の単回経口投与後の PK パラメータは、大きく変動しました (%CV は 40 から 80% の範囲)。小児患者における 40 mg PROTONIX 40 mg 錠剤の集団 PK 分析から推定された幾何平均 AUC は、成人と比較して、6 ~ 11 歳および 12 ~ 16 歳の子供でそれぞれ約 39% および 10% 高かった (表 7)。 .
男性と女性の患者
男性と比較して、女性のパントプラゾールの AUC と Cmax はわずかに増加しています。ただし、体重で正規化されたクリアランス値は、女性と男性で類似しています。
1 歳から 16 歳までの小児患者では、集団薬物動態分析で示されるように、パントプラゾールのクリアランスに対する性別の臨床的に関連する影響はありませんでした。
腎障害のある患者
重度の腎障害のある患者では、パントプラゾールの薬物動態パラメータは健常者と同様でした。
肝障害のある患者
軽度から重度の肝障害 (Child-Pugh A から C 肝硬変) の患者では、最大パントプラゾール濃度は、健康な被験者と比較してわずかに (1.5 倍) 増加しました。血清半減期は 7 ~ 9 時間に増加し、AUC 値は肝障害患者で 5 ~ 7 倍に増加しましたが、これらの増加は、CYP2C19 の低代謝者で観察されたものよりも大きくなく、用量調整が保証されていません。肝障害患者におけるこれらの薬物動態の変化により、1日1回の複数回投与後の薬物蓄積が最小限に抑えられます。 40 mg/日を超える用量は、肝障害のある患者では研究されていません。
薬物相互作用研究
パントプラゾールに対する他の薬剤の効果
パントプラゾールは、主に CYP2C19 によって代謝され、CYP 3A4、2D6、および 2C9 によってわずかに代謝されます。 CYP2C19 基質 (ジアゼパム [CYP3A4 基質でもある] およびフェニトイン [CYP3A4 インデューサーでもある] およびクロピドグレル)、ニフェジピン、ミダゾラム、およびクラリスロマイシン (CYP3A4 基質)、メトプロロール (CYP2D6 基質)、ジクロフェナクを用いた in vivo 薬物間相互作用研究、ナプロキセンとピロキシカム (CYP2C9 基質)、およびテオフィリン (CYP1A2 基質) を健康な被験者に投与した場合、パントプラゾールの薬物動態は有意に変化しませんでした。
他の薬に対するパントプラゾールの効果
クロピドグレル
クロピドグレルは、CYP2C19 によって一部活性代謝物に代謝されます。クロスオーバー臨床試験では、66 人の健康な被験者にクロピドグレル (300 mg の負荷量に続いて 1 日あたり 75 mg) を単独で投与し、パントプラゾール (クロピドグレルと同時に 80 mg) を 5 日間投与しました。 5 日目に、パントプラゾールとクロピドグレルを併用投与した場合、クロピドグレルを単独投与した場合と比較して、クロピドグレルの活性代謝物の平均 AUC は約 14% 減少しました (幾何平均比は 86%、90% CI は 79 ~ 93%)。薬力学的パラメーターも測定され、血小板凝集の阻害の変化 (5 μM ADP によって誘導される) がクロピドグレル活性代謝物への曝露の変化と相関することが実証されました。この所見の臨床的意義は明らかではありません。
ミコフェノール酸モフェチル (MMF)
クロスオーバー研究で、12 人の健康な被験者にパントプラゾール 40 mg を 1 日 2 回 4 日間投与し、パントプラゾールの最後の投与の約 1 時間後に MMF 1000 mg を 1 回投与すると、Cmax が 57% 減少し、27% 減少しました。 MPAのAUCで。 MMF を 1 日あたり約 2000 mg 投与された移植患者 (n = 12) を、ほぼ同じ用量の MMF とパントプラゾール 40 mg を 1 日あたり 40 mg 投与された移植患者 (n = 21) と比較しました。パントプラゾールと MMF の両方を投与された患者では、MPA の Cmax が 78% 減少し、AUC が 45% 減少した [参照 薬物相互作用 ]。
その他の薬
In vivo 研究では、パントプラゾールが次の薬物の動態に有意な影響を与えないことも示唆されています (シサプリド、テオフィリン、ジアゼパム [およびその活性代謝物であるデスメチルジアゼパム]、フェニトイン、メトプロロール、ニフェジピン、カルバマゼピン、ミダゾラム、クラリスロマイシン、ジクロフェナク、ナプロキセン、ピロキシカム、および経口避妊薬 [レボノルゲストレル/エチニルエストラジオール])。他の in vivo 研究では、ジゴキシン、エタノール、グリブリド、アンチピリン、カフェイン、メトロニダゾール、およびアモキシシリンは、パントプラゾールとの臨床的に関連する相互作用はありませんでした。
臨床研究では有意な薬物間相互作用は観察されていませんが、高用量のパントプラゾールを 1 日 1 回以上投与した場合の有意な薬物間相互作用の可能性は、代謝不良者または肝障害のある個人では研究されていません。
制酸剤
同時に投与された制酸剤との相互作用もありませんでした。
ファーマコゲノミクス
CYP2C19 は、いくつかの亜集団における欠乏による既知の遺伝子多型を示します (例えば、白人およびアフリカ系アメリカ人の約 3%、アジア人の 17% から 23% は代謝不良者です)。これらのパントプラゾール低代謝体の亜集団は、成人での排泄半減期が 3.5 ~ 10 時間ですが、1 日 1 回の投与では蓄積は最小限 (23% 以下) です。 CYP2C19 の低代謝である成人患者の場合、用量調整は必要ありません。
成人と同様に、CYP2C19 の低代謝遺伝子型 (CYP2C19 *2/*2) を持つ小児患者は、小児の広範な (CYP2C19 *1/*1) および中間 (CYP2C19 *1) と比較して、AUC の 6 倍以上の増加を示しました。 /*x) メタボライザー。低代謝者は、高代謝者と比較して、約 10 倍低い見かけの経口クリアランスを示しました。
既知の低代謝の小児については、減量を検討する必要があります。
臨床研究
PROTONIX 20mg 遅延放出錠は、次の臨床試験で使用されました。
胃食道逆流症(GERD)に伴うびらん性食道炎(EE)
成人患者
PROTONIX 10 mg、20 mg、または 40 mg を 1 日 1 回投与する米国の多施設共同二重盲検プラセボ対照試験が、逆流症状があり、内視鏡検査でグレード 2 以上の EE と診断された患者 603 人を対象に実施されました (Hetzel-Dent スケール)。この研究では、登録患者の約 25% がグレード 3 の重度の EE であり、10% がグレード 4 でした。この研究で治癒した患者の割合 (プロトコルごと、n = 541) を表 8 に示します。
この研究では、すべての PROTONIX 治療群で、プラセボ群よりも有意に高い治癒率が得られました。これは、40 mg および 20 mg PROTONIX 40 mg 治療群のピロリ菌の状態に関係なく当てはまりました。 PROTONIX 20mg の 40 mg の投与量は、20 mg または 10 mg の投与量で見られる治癒率よりも大幅に高い治癒率をもたらしました。
プラセボと比較して、PROTONIX 40 mg を服用している患者の割合が、治療の初日から日中と夜間の胸やけの完全な軽減と逆流の欠如を経験しました。 PROTONIX を服用している患者は、プラセボを服用している患者よりも 1 日あたりの制酸剤錠剤の摂取量が大幅に少なくなりました。
PROTONIX 40 mg および 20 mg を 1 日 1 回投与する場合も、ニザチジン 150 mg を 1 日 2 回投与する場合と、逆流症状があり、内視鏡検査でグレード 2 以上の EE と診断された 243 人の患者を対象とした米国の多施設二重盲検試験で比較しました。治癒した患者のパーセンテージ (プロトコルあたり、n = 212) を表 9 に示します。
PROTONIX 40 mg または 20 mg による 1 日 1 回の治療は、150 mg のニザチジンによる 1 日 2 回の治療と比較して、4 週間と 8 週間の両方で有意に優れた治癒率をもたらしました。 40 mg の治療群では、ヘリコバクター ピロリの状態に関係なく、ニザチジンと比較して有意に高い治癒率が達成されました。
ニザチジン 150 mg を 1 日 2 回服用している患者と比較して、PROTONIX 治療群の患者の有意に多くの割合で、1 日目から夜間の胸やけと逆流が完全に緩和され、2 日目には日中の胸やけが完全に緩和されました。 PROTONIX を服用している患者は、ニザチジンを服用している患者よりも、1 日あたりの制酸剤錠剤の摂取量が大幅に少なくなりました。
5歳から16歳までの小児患者
歳から 16 歳までの小児患者における GERD に関連する EE の治療における PROTONIX の有効性は、病態生理学が同じであると考えられているため、成人を対象とした適切かつ十分に実施された試験から推測されます。内視鏡検査で EE と診断された 4 人の小児患者が、多施設、無作為化、二重盲検、並行治療試験で研究されました。内視鏡検査で診断された EE (内視鏡検査で Hetzel-Dent スコアが 2 以上と定義) の小児は、1 日 1 回、8 週間にわたって PROTONIX の 2 つの用量レベル (20 mg または 40 mg) のいずれかで治療されました。 4 人の EE 患者全員が 8 週間で治癒しました (Hetzel-Dent スコア 0 または 1)。
びらん性食道炎の治癒の長期維持
治癒の長期維持における PROTONIX の有効性を実証するために、内視鏡検査で治癒した EE が確認された成人 GERD 患者を対象に、同一デザインの 2 つの独立した多施設無作為化二重盲検比較対照試験が実施されました。米国の 2 つの研究では、それぞれ 386 名と 404 名の患者が登録され、PROTONIX 40mg 遅延放出錠 10 mg、20 mg、または 40 mg を 1 日 1 回、またはラニチジン 150 mg を 1 日 2 回投与されました。表 10 に示すように、PROTONIX 40 mg および 20 mg は、治癒の維持に関して、すべての時点でラニチジンよりも有意に優れていました。さらに、PROTONIX 40 mg は、研究された他のすべての治療法よりも優れていました。
PROTONIX 40 mg は、治療の最初の月から 12 か月目まで、日中および夜間の胸やけエピソードの数を減らす点で、ラニチジンよりも優れていました。表 11 に示すように、1 日 1 回投与される PROTONIX 20 mg は、1 つの試験で日中および夜間の胸やけのエピソードを減らすのにも効果的でした。
Zollinger-Ellison 症候群を含む病的な過剰分泌状態
ゾリンジャー・エリソン症候群などの病的な過剰分泌状態の患者 35 人を対象とした多施設非盲検試験で、多発性内分泌腫瘍 I 型の有無にかかわらず、PROTONIX は胃酸分泌をうまく制御しました。 1 日 80 mg から 240 mg の範囲の用量は、胃酸減少手術の前の患者で 10 mEq/h 未満、胃酸減少手術の前の患者で 5 mEq/h 未満に維持されました。
用量は、最初に個々の患者のニーズに合わせて滴定され、時間の経過に伴う臨床反応に基づいて一部の患者で調整されました[参照 投薬と管理 ]。 PROTONIX 40mg は、これらの用量レベルで長期間 (一部の患者では 2 年以上) 耐容性が良好でした。
患者情報
プロトニクス (pro-TAH-nix)(パントプラゾールナトリウム)遅延放出錠剤および遅延放出経口懸濁液用のPROTONIX(pro-TAH-nix)(パントプラゾールナトリウム)
PROTONIX について知っておくべき最も重要な情報は何ですか?
PROTONIX 20mg は、処方されたとおりに、可能な限り低用量で、必要な最短時間で服用する必要があります。
PROTONIX は胃酸関連の症状を改善する可能性がありますが、それでも深刻な胃の問題を抱えている可能性があります。 医師に相談してください。
PROTONIX は、次のような重大な副作用を引き起こす可能性があります。
- 腎臓の問題の一種(急性尿細管間質性腎炎)。 PROTONIX 40mg を含むプロトンポンプ阻害薬 (PPI) 薬を服用している一部の人々は、PROTONIX による治療中にいつでも発生する可能性のある急性尿細管間質性腎炎と呼ばれる腎臓の問題を発症する可能性があります。尿の量が減ったり、尿に血が混じったりした場合は、すぐに医師に連絡してください。
- 腸内の感染症 (クロストリジウム ディフィシル) によって引き起こされる下痢。 水様便や胃の痛みが治まらない場合は、すぐに医師に連絡してください。熱がある場合とない場合があります。
- 骨折(股関節、手首、または背骨)。 股関節、手首、または脊椎の骨折は、PPI 薬を 1 日複数回、長期間 (1 年以上) 服用している人に発生する可能性があります。特に股関節、手首、脊椎に骨折がある場合は、医師に相談してください。
- 特定の種類のエリテマトーデス。 エリテマトーデスは自己免疫疾患です (体の免疫細胞が体内の他の細胞や臓器を攻撃します)。 PROTONIX 40mgを含むPPI薬を服用している人の中には、特定の種類のエリテマトーデスを発症したり、すでに持っているループスが悪化したりすることがあります.関節痛が新たに発生したり、悪化したり、頬や腕に発疹ができたり、太陽の下で悪化したりする場合は、すぐに医師に連絡してください.
これらの深刻な副作用のリスクについて医師に相談してください。
PROTONIX には、他にも深刻な副作用がある場合があります。見る 「PROTONIX の副作用の可能性は何ですか?」
プロトニクス20mgとは?
胃酸の量を減らすために使用されるプロトンポンプ阻害剤 (PPI) と呼ばれる処方薬。
成人では、 PROTONIX は次の用途に使用されます。
- 食道の内層への酸関連の損傷(びらん性食道炎またはEEと呼ばれる)の治癒と症状の軽減のために最大8週間。医師は、EE が治癒しない患者に PROTONIX 20mg をさらに 8 週間処方することがあります。
- EE の治癒を維持し、GERD によって引き起こされる胸焼け症状の再発を防ぐのに役立ちます。この目的で12か月以上使用した場合、PROTONIX 40mgが安全で効果的であるかどうかは不明です.
- 胃酸過多状態の長期治療。これには、ゾリンジャー・エリソン症候群と呼ばれるまれな状態が含まれます。
5歳以上の子供では、 PROTONIX は次の用途に使用されます。
- EE の治癒と症状緩和には最大 8 週間。子供に8週間以上使用した場合、PROTONIX 20mgが安全かどうかは不明です.
PROTONIX 20mg は 5 歳未満の子供には使用できません。 PROTONIX 40mg が子供の EE 以外の治療に安全かつ有効であるかどうかは不明です。
次の場合は、PROTONIX 20mg を服用しないでください。
- パントプラゾールナトリウム、他のPPI薬、またはPROTONIXの成分にアレルギーがある.成分の完全なリストについては、この投薬ガイドの最後を参照してください。
- HIV-1(ヒト免疫不全ウイルス)の治療に使用されるリルピビリン(EDURANT、COMPLERA、ODEFSEY、JULUCA)を含む薬を服用している。
PROTONIX を服用する前に、次の場合を含め、すべての病状について医師に相談してください。
- 血中のマグネシウム濃度が低い。
- 妊娠している、または妊娠する予定がある。 PROTONIX 40mg は胎児に害を及ぼす可能性があります。 PROTONIXによる治療中に妊娠した場合、または妊娠している可能性がある場合は、医師に相談してください.
- 授乳中または授乳を計画している。 PROTONIX は母乳に移行する可能性があります。 PROTONIX を服用している場合は、赤ちゃんに与える最善の方法について医師に相談してください。
服用しているすべての薬について医師に伝えてください。 処方薬、市販薬、ビタミン、ハーブサプリメントを含みます。 特に服用する場合は医師に伝えてください メトトレキサート (Otrexup、Rasuvo、Trexall、XATMEP)、ジゴキシン (LANOXIN)、またはウォーター ピル (利尿薬)。
プロトニックス 20mg の服用方法は?
- PROTONIX 40mg を医師の指示どおりに服用してください。
プロトニクス徐放錠(プロトニクス20mg錠):
-
- PROTONIX 40mg 錠を割ったり、噛んだり、つぶしたりしないでください。
- 食物の有無にかかわらず、PROTONIX 20mg の錠剤を丸ごと飲み込んでください。
- PROTONIX 20mg 錠を飲み込めない場合は、医師に相談してください。
- PROTONIX 40mg 錠剤を服用している間は、制酸剤を使用することができます。
徐放性経口懸濁液用プロトニックス 40mg (経口用懸濁液用プロトニックス):
-
- 経口懸濁液用の PROTONIX 20mg を割ったり、噛んだり、つぶしたりしないでください。
- プロトニックス40mgを食事の約30分前に経口懸濁剤として服用してください。
- 経口懸濁液用の PROTONIX は、リンゴ ジュースまたはリンゴソースに混ぜて経口投与するか、リンゴ ジュースに混ぜて経鼻胃管 (NG) チューブまたは胃瘻チューブからのみ投与する必要があります。アップル ジュース以外の液体またはアップル ソース以外の食品に経口懸濁用の PROTONIX を混ぜないでください。
- PROTONIX 20mg のパケットを経口懸濁液用に分割して、より少ない用量を作成しないでください。
- を参照してください 「使用上の注意」 PROTONIX 40mg をアップルソースまたはアップル ジュースに経口懸濁するために混合して服用する方法、またはリンゴ ジュースに混合した NG チューブまたは胃瘻チューブを介して懸濁液を混合および投与する方法については、この投薬ガイドの最後を参照してください。
- PROTONIX を飲み忘れた場合は、できるだけ早く服用してください。次の服用時間が近い場合は、飲み忘れた分は飲まないでください。次の1回量をいつもの時間に服用してください。 2回分を同時に服用しないでください。
- PROTONIX を過剰に摂取した場合は、すぐに医師または毒物管理センター (1-800-222-1222) に電話するか、最寄りの緊急治療室に行ってください。
PROTONIX 40mg の副作用の可能性は何ですか?
PROTONIX 20mg は、次のような重大な副作用を引き起こす可能性があります。
- 見る 「PROTONIX について知っておくべき最も重要な情報は何ですか?」
- 体内のビタミン B-12 レベルが低い PROTONIX 40mg を長期間 (3 年以上) 服用している人に起こる可能性があります。息切れ、立ちくらみ、不整脈、筋力低下、肌の青白さ、疲労感、気分の変化、腕や脚のうずきやしびれなど、ビタミン B-12 レベルの低下の症状がある場合は、医師に相談してください。
- 体内のマグネシウム濃度が低い PROTONIX を 3 か月以上服用している場合に発生する可能性があります。痙攣、めまい、不整脈、神経質、筋肉痛、筋力低下、手、足、声のけいれんなど、低マグネシウム レベルの症状がある場合は、医師に相談してください。
- 胃の成長(胃底腺ポリープ)。 PPI薬を長期間服用している人は、特にPPI薬を1年以上服用した後、胃底腺ポリープと呼ばれる特定の種類の胃の成長を発症するリスクが高くなります.
成人におけるPROTONIX 40mgの最も一般的な副作用は次のとおりです。 頭痛、下痢、吐き気、胃部(腹部)の痛み、嘔吐、ガス、めまい、関節痛。
子供のPROTONIX 40mgの最も一般的な副作用は次のとおりです。 上気道感染症、頭痛、発熱、下痢、嘔吐、発疹、胃部(腹部)の痛み。これらは、PROTONIX の考えられるすべての副作用ではありません。副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
PROTONIX 40mg の保管方法を教えてください。
PROTONIX 20mg は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
PROTONIX およびすべての医薬品は、子供の手の届かないところに保管してください。
PROTONIX の安全で効果的な使用に関する一般的な情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 PROTONIX が処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、PROTONIX 20mg を与えないでください。それらに害を及ぼす可能性があります。医療専門家向けに書かれた PROTONIX 20mg に関する情報については、医師または薬剤師にお尋ねください。
プロトニクスの成分は?
有効成分: パントプラゾールナトリウムセスキ水和物
PROTONIX 遅延放出錠剤の不活性成分: ステアリン酸カルシウム、クロスポビドン、ヒプロメロース、酸化鉄、マンニトール、メタクリル酸コポリマー、ポリソルベート80、ポビドン、プロピレングリコール、炭酸ナトリウム、ラウリル硫酸ナトリウム、二酸化チタン、クエン酸トリエチル。
徐放性経口懸濁液用 PROTONIX 40mg の不活性成分: クロスポビドン、ヒプロメロース、メタクリル酸コポリマー、微結晶セルロース、ポリソルベート80、ポビドン、炭酸ナトリウム、ラウリル硫酸ナトリウム、タルク、二酸化チタン、クエン酸トリエチル、黄色三二酸化鉄。
使用説明書
プロトニクス (pro-TAH-nix) (パントプラゾールナトリウム) 遅延放出経口懸濁液用
徐放性プロトニクス 40mg 経口懸濁液(経口懸濁液用PROTONIX 40mg):
重要な情報:
- 経口懸濁液用の PROTONIX を割ったり、噛んだり、つぶしたりしないでください。
- 食事の約 30 分前に経口懸濁液として PROTONIX を服用してください。
- 経口懸濁液用プロトニクス:
- したほうがいい アップルソースまたはアップルジュースでのみ摂取してください。
- したほうがいい 水や他の液体、または他の食品に混ぜないでください。
- より少ない用量を作るために、パケットを分割しないでください。
アップルソースを含む経口懸濁液として PROTONIX 20mg を服用する場合:
PROTONIX 40mg をリンゴジュースと一緒に経口懸濁液として服用する場合:
経鼻胃(NG)チューブまたは胃瘻チューブを介した経口懸濁用の PROTONIX 40mg の投与:
- 経口懸濁液用の PROTONIX は、NG チューブまたは胃瘻チューブを介して投与できます。 サイズ16フレンチ以上。 サイズ 16 フレンチよりも小さい NG チューブまたは胃瘻チューブを介して、経口懸濁液として PROTONIX 20mg を投与しないでください。
- ミックス プロトニックス 20mg 経口懸濁剤 りんごジュースのみ NG チューブまたは胃瘻チューブから投与する場合。
PROTONIX 20mg の保管方法を教えてください。
PROTONIX 20mg は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
PROTONIX 40mg およびすべての医薬品は、子供の手の届かないところに保管してください。
この投薬ガイドと使用説明書は、米国食品医薬品局によって承認されています。
