Pentasa 400mg Mesalamine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ペンタサとは何ですか?どのように使用されますか?
ペンタサは、潰瘍性大腸炎の症状を治療するために使用される処方薬です。 Pentasa 400mg は、単独で使用することも、他の薬と併用することもできます。
ペンタサは、5-アミノサリチル酸誘導体と呼ばれる種類の薬に属しています。
Pentasa が 5 歳以上の子供に安全で効果があるかどうかはわかっていません。
ペンタサの副作用の可能性は?
ペンタサは、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 胃痙攣、
- 血便、
- 熱、
- 頭痛、
- 皮膚発疹、
- 血便またはタール便
- 喀血、
- コーヒーかすのような嘔吐物、
- 排尿がほとんどまたはまったくない、
- 痛みや排尿困難、
- 足や足首のむくみ、
- 疲労感や息切れ、
- 食欲減少、
- 上腹部の痛み、
- 疲れ、
- あざや出血しやすい、
- 暗い尿、
- 粘土色の便、および
- 皮膚や目の黄変
上記の症状がある場合は、すぐに医療機関を受診してください。
ペンタサ 400mg の最も一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- 胃痛、
- 下痢、
- 消化不良、
- ガス、
- 頭痛、
- 発疹、および
- 異常な肝機能検査
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ペンタサの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
説明
経口投与用のペンタサ(メサラミン)は、胃腸用のアミノサリチル酸系抗炎症剤であるメサラミンの放出制御製剤です。
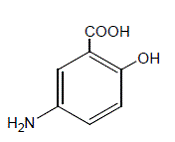
化学的には、メサラミンは 5-アミノ-2-ヒドロキシ安息香酸です。分子量は 153.14 です。
構造式は次のとおりです。
各 250 mg カプセルには 250 mg のメサラミンが含まれています。次の不活性成分も含まれています:アセチル化モノグリセリド、ヒマシ油、コロイド状二酸化ケイ素、エチルセルロース、ヒドロキシプロピルメチルセルロース、デンプン、ステアリン酸、砂糖、タルク、ホワイトワックス.カプセルシェルには、D&C イエロー #10、FD&C ブルー #1、FD&C グリーン #3、ゼラチン、二酸化チタン、およびその他の成分が含まれています。
各 500 mg カプセルには 500 mg のメサラミンが含まれています。次の不活性成分も含まれています:アセチル化モノグリセリド、ヒマシ油、コロイド状二酸化ケイ素、エチルセルロース、ヒドロキシプロピルメチルセルロース、デンプン、ステアリン酸、砂糖、タルク、ホワイトワックス.カプセルシェルには、FD&C Blue #1、ゼラチン、二酸化チタン、およびその他の成分が含まれています。
適応症
ペンタサ 400mg は、軽度から中等度の活動性潰瘍性大腸炎の成人患者の寛解導入および治療に適応されます。
投薬と管理
成人の軽度から中等度の活動性潰瘍性大腸炎の寛解導入および対症療法の推奨用量は、1g(ペンタサ 250mg カプセル 4 個またはペンタサ 500mg カプセル 2 個)を 1 日 4 回、1 日合計 4 錠です。 g.対照試験での治療期間は最大 8 週間でした。
ペンタサのカプセルは丸ごと飲み込むことも、カプセルを開けて中身をアップルソースやヨーグルトにふりかけることもできます。内容物全体をすぐに消費する必要があります。カプセルおよびカプセルの内容物をつぶしたり、噛んだりしないでください。
十分な量の水分を摂取してください。
小児患者におけるペンタサ 400mg の安全性と有効性は確立されていません。
供給方法
ペンタサ徐放剤 250mg カプセルは、240 カプセルのボトルで提供されます ( NDC 54092-189-81)。緑と青の各カプセルには、徐放性ビーズに 250 mg のメサラミンが含まれています。 PENTASA 徐放性カプセルは、五角形のスターバースト ロゴとカプセルの緑の部分に 2010 の数字、青の部分に S429 250 mg で識別されます。
ペンタサ徐放性500mg カプセルは、120 カプセル入りのボトルで提供されます ( NDC 54092-191-12)。各青いカプセルには、徐放性ビーズに 500 mg のメサラミンが含まれています。 PENTASA 400mg 徐放性カプセルは、五角形のスターバースト ロゴとカプセル上の S429 500 mg で識別されます。
25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) までの許容範囲 [USP 制御室温を参照]。
疑わしい有害反応を報告するには、1800-828-2088 で武田薬品に連絡するか、1-800-FDA-1088 で FDA または www.fda.gov/medwatch に連絡してください。
販売元:Takeda Pharmaceuticals America, Inc. レキシントン、マサチューセッツ州 02421、USA。改訂: 2021 年 11 月
副作用
国内外を合わせた臨床試験では、潰瘍性大腸炎やクローン病の患者さん2,100人以上がPENTASA治療を受けました。一般的に、PENTASA 療法は忍容性が良好でした。最も一般的なイベント (つまり、1% 以上) は、下痢 (3.4%)、頭痛 (2.0%)、吐き気 (1.8%)、腹痛 (1.7%)、消化不良 (1.6%)、嘔吐 (1.5%) でした。 %)、発疹 (1.0%)。
600 人を超える潰瘍性大腸炎の患者を対象とした 2 つの国内のプラセボ対照試験では、プラセボ群よりも PENTASA (メサラミン) で治療された患者の方が有害事象が少なく (PENTASA 14% 対 プラセボ 18%)、用量に関連していませんでした。 1% 以上で発生するイベントを以下の表に示します。これらのうち、吐き気と嘔吐のみが PENTASA グループでより頻繁でした。有害事象による治療の中止は、PENTASA よりもプラセボでより一般的でした (7% 対 4%)。
臨床検査室の測定では、血液学的、肝臓、および腎臓機能の測定を含む、どの検査でも有意な異常傾向は示されませんでした。
体のシステムによって提示される次の有害事象は、国内の潰瘍性大腸炎およびクローン病の治験中にまれに (すなわち、1% 未満) 報告されました。多くの場合、ペンタサとの関係は確立されていません。
胃腸: 腹部膨満、食欲不振、便秘、十二指腸潰瘍、嚥下障害、おくび、食道潰瘍、便失禁、GGTP上昇、消化管出血、アルカリホスファターゼ上昇、LDH上昇、口内潰瘍、口内炎、膵炎、直腸出血、SGOT上昇、SGPT上昇、便の異常(色や質感の変化)、喉の渇き
皮膚科: にきび、脱毛症、乾燥肌、湿疹、結節性紅斑、爪障害、光線過敏症、かゆみ、発汗、蕁麻疹
神経系: うつ病、めまい、不眠症、傾眠、感覚異常
心臓血管: 動悸、心膜炎、血管拡張
他の: 蛋白尿、無月経、アミラーゼ増加、関節痛、無力症、乳房痛、結膜炎、斑状出血、浮腫、発熱、血尿、月経不順、川崎様症候群、脚のけいれん、扁平苔癬、リパーゼ増加、倦怠感、月経過多、子宮出血、筋肉痛、肺浸潤、血小板血症、血小板減少症、頻尿
週間の潰瘍性大腸炎の研究が完了してから 1 週間後、72 歳の男性で、肺の問題の既往歴がなく、呼吸困難を発症しました。患者はその後、一人の医師から好酸球増多を伴わない間質性肺線維症と診断され、別の医師から器質性肺炎を伴う閉塞性細気管支炎と診断されました。本事象とメサラミン療法との因果関係は確立されていません。
公表された症例報告および/または自発的な市販後調査では、心膜炎、致命的な心筋炎、胸痛および T 波異常、過敏性肺炎、膵炎、ネフローゼ症候群、間質性腎炎、肝炎、再生不良性貧血、汎血球減少症、白血球減少症、無顆粒球症、またはメサラミン療法を受けている間の貧血。貧血は、炎症性腸疾患の臨床症状の一部である可能性があります。好酸球増加症を伴う可能性のあるアレルギー反応は、ペンタサ 400mg 療法に関連して見られることがあります。
市販後レポート
以下の事象は、臨床現場におけるメサラミンの PENTASA ブランドの承認後の使用中に確認されました。それらは未知のサイズの母集団から自発的に報告されるため、頻度の推定はできません。これらのイベントは、深刻さ、報告の頻度、またはメサラミンとの潜在的な因果関係の組み合わせにより、含めるために選択されました。
胃腸: 肝酵素(SGOT/AST、SGPT/ALT、GGT、LDH、アルカリホスファターゼ、ビリルビン)の上昇、肝炎、黄疸、胆汁うっ滞性黄疸、肝硬変、肝壊死や肝不全などの肝細胞損傷の可能性など、肝毒性の報告。これらのケースのいくつかは致命的でした。肝機能の変化を伴う川崎様症候群の 1 例も報告されています。
他の: アナフィラキシー反応、SJS/TEN、DRESS、AGEP、胸膜炎・胸膜炎、肺炎、顆粒球減少症、全身性エリテマトーデス、ループス様症候群、急性腎不全、間質性肺疾患、過敏性肺炎(間質性肺炎、アレルギー性肺胞炎、好酸球性肺炎を含む)、慢性腎不全、腎性尿崩症、腎結石症、頭蓋内圧亢進症、血管性浮腫、および精子減少症(可逆性)。
薬物相互作用
ペンタサ 400mg と他の薬剤との相互作用に関する調査は行われていません。ただし、メサラミンを含む製品については、次の薬物間相互作用が報告されています。
非ステロイド性抗炎症薬を含む腎毒性薬
非ステロイド系抗炎症薬(NSAID)を含む既知の腎毒性薬とメサラミンを併用すると、腎毒性のリスクが高まる可能性があります。腎機能の変化およびメサラミン関連の有害反応について、腎毒性薬を服用している患者を監視します。

アザチオプリンまたは6-メルカプトプリン
メサラミンとアザチオプリンまたは 6-メルカプトプリンおよび/または骨髄毒性を引き起こすことが知られているその他の薬物との同時使用は、血液障害、骨髄不全、および関連する合併症のリスクを高める可能性があります。 PENTASA とアザチオプリンまたは 6-メルカプトプリンの併用が避けられない場合は、全血球数や血小板数などの血液検査を監視してください。
警告
情報提供なし
予防
腎障害
ペンタサまたはメサラミンを含む、またはメサラミンに変換される他の製品を投与された患者では、最小変化病、急性および慢性間質性腎炎、腎不全などの腎障害が報告されています。
メサラミンは腎臓から実質的に排泄されることが知られており、腎機能障害のある患者では副作用のリスクが高くなる可能性があります。すべての患者の腎機能を、開始前および PENTASA による治療中に定期的に評価します。既知の腎機能障害または腎疾患の病歴がある患者、または腎毒性薬を併用している患者に PENTASA を使用することのリスクと利点を評価します。
メサラミン誘発性急性不耐症症候群
メサラミンは、炎症性腸疾患の再発と区別するのが難しいかもしれない急性不耐性症候群と関連しています.症状には、けいれん、急性腹痛、血性下痢、ときに発熱、頭痛、発疹などがあります。治療中は、これらの症状の悪化について患者を監視してください。急性不耐症症候群が疑われる場合は、PENTASA による治療を速やかに中止してください。
過敏反応
スルファサラジンを服用している患者では、過敏反応が報告されています。一部の患者は、ペンタサまたはメサラミンを含む、またはメサラミンに変換される他の化合物に対して同様の反応を示すことがあります.
スルファサラジンと同様に、メサラミン誘発性の過敏反応は、心筋炎、心膜炎、腎炎、肝炎、肺炎、および血液学的異常を含む内臓の関与として現れることがあります。過敏反応の徴候または症状が存在する場合は、直ちに患者を評価してください。徴候や症状の別の病因が確立できない場合は、PENTASA を中止してください。
肝不全
メサラミンを含む他の製品を投与された既存の肝疾患を持つ患者の肝不全の報告があります.既知の肝障害のある患者にペンタサ 400mg を使用することのリスクと利点を評価します。
重度の皮膚有害反応
スティーブンス・ジョンソン症候群 (SJS) や中毒性表皮壊死融解症 (TEN)、好酸球増加症や全身症状を伴う薬物反応 (DRESS)、急性汎発性発疹性膿疱症 (AGEP) などの重度の皮膚有害反応が、メサラミンの使用で報告されています。 (見る 有害反応 )。重度の皮膚有害反応の最初の兆候または症状、または過敏症の他の兆候が見られた場合は、PENTASA の使用を中止し、さらなる評価を検討してください。
感光性
アトピー性皮膚炎やアトピー性湿疹などの既存の皮膚疾患を持つ患者は、より深刻な光過敏反応を報告しています.日光への露出を避け、防護服を着用し、屋外では広域スペクトルの日焼け止めを使用するよう患者に助言します。
腎結石症
メサラミンを 100% 含有する結石を含むメサラミンの使用により、腎結石症の症例が報告されています。メサラミン含有結石は放射線透過性であり、標準的な X 線撮影やコンピューター断層撮影 (CT) では検出できません。治療中は十分な水分補給を心がけてください。
臨床検査への干渉
ノルメタネフリンとメサラミンの主な代謝物である N-アセチル-5-アミノサリチル酸 (N-Ac-5-ASA) のクロマトグラムが類似しているため、メサラミンを使用すると、尿中のノルメタネフリンを電気化学的検出器を備えた液体クロマトグラフィーで測定する際に、疑似的に高い検査結果が得られる可能性があります。 )。ノルメタネフリンの代替の選択的アッセイを検討してください。
発がん、突然変異誘発、生殖能力の障害
メサラミンの 104 週間の食事による発がん性研究では、CD-1 マウスを 2500 mg/kg/日までの用量で処理しましたが、腫瘍形成性はありませんでした。平均身長が 50 kg の人 (体表面積 1.46 m2) の場合、これは、体表面積に基づく推奨用量 (2960 mg/m2/日) の 2.5 倍に相当します。 Wistar ラットでの 104 週間の食事による発がん性試験では、800 mg/kg/日の用量までのメサラミンは発がん性がありませんでした。この用量は、体表面積ベースで推奨される人間の用量の 1.5 倍に相当します。
in vitro Ames 試験および in vivo マウス小核試験では、変異原性の証拠は観察されなかった。
メサラミンを 400 mg/kg/日 (体表面積に基づくヒトの推奨用量の 0.8 倍) まで経口投与した雄または雌のラットで、受胎能または生殖能への影響は観察されませんでした。
スルファサラジンに関連して報告されている男性の精液異常および不妊症は、対照臨床試験中にペンタサ 400mg カプセルでは見られませんでした。
妊娠
催奇形性効果
妊娠中のメサラミンの使用に関するメタアナリシス、コホート研究、および症例シリーズからの公表されたデータは、メサラミンと主要な先天性欠損症、流産、または母体または胎児の有害転帰との関連を確実に通知していません.妊娠初期のメサラミン曝露が、心奇形を含む重大な先天性奇形のリスク増加と関連しているという明確な証拠はありません。発表された疫学研究には、基礎となる母体疾患、母体による併用薬の使用、メサラミン製品の用量と使用期間に関する情報の欠落などの交絡因子を制御できないなど、データの解釈を妨げる重要な方法論的制限があります。メリットがリスクを上回る場合、PENTASA は妊娠中にのみ使用する必要があります。
動物の繁殖研究では、妊娠中のラットに最大 1000 mg/kg/日 (5900 mg/m²) の用量でメサラミンを器官形成中に経口投与し、800 mg/kg/日 (6856 mg/m²) の用量でウサギに経口投与したところ、証拠は示されなかった催奇形作用またはメサラミンによる胎児への害。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
非催奇形効果
発表されたデータは、疾患活動性の増加が、潰瘍性大腸炎の女性における有害な妊娠転帰を発症するリスクと関連していることを示唆しています。有害な妊娠転帰には、早産(妊娠 37 週未満)、出生時低体重(2500 g 未満)の乳児、および出生時の在胎週数に比べて小さい乳児が含まれます。
授乳中の母親
公開された文献からのデータは、メサラミンとその代謝産物である N-アセチル-5-アミノサリチル酸が母乳中に少量存在し、メサラミンの相対乳児用量 (RID) が 0.1% 以下であることを報告しています。これの臨床的意義は特定されておらず、メサラミンを使用して女性を看護した経験は限られています.
メサラミンにさらされた母乳で育てられた乳児で観察された下痢の報告があります.牛乳生産に対するペンタサ 400mg の効果は不明です。授乳中の女性にペンタサ 400mg を投与する場合は注意し、授乳中の乳児の下痢を監視してください。
公開された授乳研究では、さまざまな経口および直腸製剤および製品からの母体のメサラミン用量は、1日あたり500 mgから4.8 gの範囲でした.牛乳中のメサラミンの平均濃度は、検出不能から 0.5 mg/L の範囲でした。牛乳中の N-アセチル-5-アミノサリチル酸の平均濃度は、0.2 から 9.3 mg/L の範囲でした。これらの濃度に基づくと、母乳だけで育てられた乳児の推定 1 日量は、メサラミン 0 ~ 0.075 mg/kg/日 (RID 0% ~ 0.1%) および N-アセチル-5-アミノサリチル酸 0.03 ~ 1.4 mg/kg/日です。酸。
小児用
小児患者におけるペンタサの安全性と有効性は確立されていません。
高齢者の使用
PENTASA 400mg の臨床試験には、65 歳以上の患者が十分に含まれておらず、若い患者との反応が異なるかどうかを判断できませんでした。制御されていない臨床試験および市販後報告システムからの報告では、ペンタサ 400 mg などのメサラミン含有製品を投与されている 65 歳以上の患者では、若い患者と比較して、血液疾患(すなわち、無顆粒球症、好中球減少症、および汎血球減少症)の発生率が高いことが示唆されました。 PENTASA による治療中は、高齢患者の全血球数と血小板数をモニターしてください。
一般に、ペンタサを処方する際には、高齢患者では肝機能、腎機能、または心機能の低下、併発疾患または他の薬物治療の頻度が高いことを考慮してください。
過剰摂取
ペンタサ 400mg はアミノサリチル酸塩であり、吐き気、嘔吐、腹痛、頻呼吸、過呼吸、耳鳴り、および神経学的症状 (頭痛、めまい、錯乱、発作) などのサリチル酸塩毒性の症状が現れる可能性があります。サリチル酸による重度の中毒は、電解質と血液の pH のバランスを崩し、潜在的に他の臓器 (腎臓や肝臓など) に損傷を与える可能性があります。
過剰摂取の治療
メサラミンの過剰摂取に対する特定の解毒剤はありません。しかし、サリチル酸毒性に対する従来の治療法は、急性の過剰摂取の場合に有益である可能性があり、さらなる吸収を防ぐために胃腸管の除染が含まれる場合があります。適切な静脈内療法を実施することにより、体液と電解質の不均衡を修正し、適切な腎機能を維持します。
禁忌
PENTASA は、サリチル酸、アミノサリチル酸、またはこの薬剤の成分に対する過敏症が既知または疑われる患者には禁忌です。
臨床薬理学
スルファサラジンは、結腸内の細菌の作用によって、スルファピリジン (SP) とメサラミン (5-ASA) に分割されます。成人の活動性潰瘍性大腸炎に対するスルファサラジンの通常の経口投与量は、1日2~4gを分割して服用する。 4グラムのスルファサラジンは、結腸に1.6グラムの遊離メサラミンを提供します。
メサラミン (およびスルファサラジン) の作用機序は完全には理解されていませんが、結腸上皮細胞に対する局所抗炎症効果のようです。潰瘍性大腸炎の患者では、シクロオキシゲナーゼ経路(すなわち、プロスタノイド)およびリポキシゲナーゼ経路(すなわち、ロイコトリエン(LT)およびヒドロキシエイコサテトラエン酸(HETE))の両方を介したアラキドン酸(AA)代謝産物の粘膜産生が増加しており、メサラミンは、シクロオキシゲナーゼをブロックし、結腸でのプロスタグランジン (PG) 産生を阻害することにより、炎症を軽減する可能性があります。
ヒトの薬物動態と代謝
吸収
PENTASA は、消化管全体に治療量のメサラミンを放出するように設計された、エチルセルロースでコーティングされたメサラミンの徐放性製剤です。尿中排泄データに基づくと、ペンタサのメサラミンの 20% ~ 30% が吸収されます。対照的に、メサラミンを未処方の 1 g 水性懸濁液として経口投与すると、メサラミンは約 80% 吸収されます。
血漿メサラミン濃度は、ペンタサ 1 g の投与から 3 時間後に約 1 mcg/mL でピークに達し、二相性で減少しました。文献には、静脈内投与後のメサラミンの平均終末半減期が 42 分であることが記載されています。 PENTASA からのメサラミンは消化管全体で継続的に放出および吸収されるため、経口投与後の真の消失半減期を決定することはできません。メサラミン (5-アミノサリチル酸) の主要な代謝産物である N-アセチル-5-アミノサリチル酸は、約 3 時間後に 1.8 mcg/mL でピークに達し、その濃度は二相性の低下に続きました。 N-アセチル-5-アミノサリチル酸の薬理活性は不明であり、他の代謝物は特定されていません。
PENTASA カプセルを 250 mg から 1 g に 1 日 4 回投与した場合、メサラミンの経口薬物動態は非線形であり、定常状態のメサラミン血漿濃度は 0.14 mcg/mL から 1.21 mcg/mL に約 9 倍増加し、飽和初回通過代謝が示唆されました。 N-アセチル-5-アミノサリチル酸の薬物動態は線形でした。
排除
1gのPENTASA 400mgを1回投与した後、約130mgの遊離メサラミンが糞便中に回収されました。糞便中の遊離メサラミンとサリチル酸の排泄は、ペンタサの投与量に比例して増加しました。 N-アセチル-5-アミノサリチル酸は、ペンタサ 400mg の投与後に尿中に排泄された主要な化合物 (19% から 30%) でした。
臨床試験
軽度から中等度の活動性潰瘍性大腸炎患者 625 人を対象とした 2 つの無作為化二重盲検プラセボ対照用量反応試験 (UC-1 および UC-2) では、PENTASA 400mg を 1 日 4 g の経口投与で投与しました。 g を 1 日 4 回投与すると、以下の表に示すように、前向きに特定された主要な有効性パラメーター、PGA、Tx F、および SI が一貫して改善されました。
PENTASA の 4 g 投与量はまた、副次的有効性パラメーター、すなわちトイレへの移動の頻度、便の硬さ、直腸出血、腹部/直腸の痛み、切迫感において一貫した改善をもたらしました。内視鏡および症状のエンドポイントによって評価されるように、ペンタサの 4 g 用量は寛解を誘発しました。
一部の患者では、PENTASA 400mg の 2 g 用量が、測定された有効性パラメーターを改善することが観察されました。ただし、2 g の用量では、2 つの適切で十分に管理された試験で、主要な有効性パラメーターに一貫性のない結果が得られました。
患者情報
情報提供なし。を参照してください。 予防 セクション。
