Prilosec 40mg, 10mg, 20mg Omeprazole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Prilosec 40mg とは何ですか?
Prilosec 40mg は、胃食道逆流症 (GERD)、胃潰瘍、および過剰な胃酸によって引き起こされるその他の状態の症状を治療するために使用される処方薬および市販薬です。 Prilosec 10mg は、単独で使用することも、他の薬と併用することもできます。
Prilosec は、プロトン ポンプ阻害剤と呼ばれる薬物のクラスに属します。
Prilosec 40mg が生後 1 か月未満の子供に安全で効果的かどうかはわかっていません。
Prilosec 10mg の副作用の可能性は何ですか?
Prilosec は、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 水様または血様の下痢、
- 手首、太もも、腰、または背中の新しいまたは異常な痛み、
- 発作(けいれん)、
- 排尿がほとんどまたはまったくない、
- 尿に血が混じる
- 腫れ、
- 急激な体重増加、
- めまい、
- 不規則な心拍、
- ぎくしゃくした感じ、
- 筋肉のけいれん、
- 筋肉のけいれん、
- 咳、
- 窒息感、
- 関節痛など
- 日光で悪化する頬や腕の皮膚発疹
上記の症状がある場合は、すぐに医療機関を受診してください。
Prilosec の最も一般的な副作用は次のとおりです。
- 胃痛、
- ガス、
- 吐き気、
- 嘔吐、
- 下痢、および
- 頭痛
説明
PRILOSEC (オメプラゾール) 遅延放出カプセルの有効成分は、置換ベンズイミダゾール、5-メトキシ-2-[[(4-メトキシ-3, 5-ジメチル-2-ピリジニル) メチル] スルフィニル]-1H-ベンズイミダゾールです。胃酸の分泌を抑える成分。その実験式は C17H19N3O3S で、分子量は 345.42 です。構造式は次のとおりです。
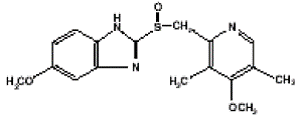
オメプラゾールは白色からオフホワイトの結晶性粉末で、約 155°C で分解して融解します。弱塩基で、エタノールとメタノールに溶けやすく、アセトンとイソプロパノールに溶けにくく、水にはほとんど溶けません。オメプラゾールの安定性は pH の関数です。酸性媒体では急速に分解されますが、アルカリ性条件下では許容可能な安定性があります。
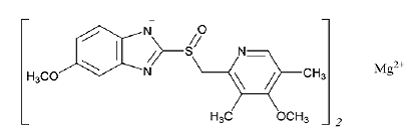
遅延放出経口懸濁液用プリロセック (オメプラゾール マグネシウム) の有効成分は、5-メトキシ-2-[[(4-メトキシ-3,5-ジメチル-2-ピリジニル)メチル]スルフィニル]-1H-ベンズイミダゾール、マグネシウムです。塩 (2:1)
オメプラゾール マグネシウムは白色からオフホワイトの粉末で、融点は 200°C で分解します。この塩は、25°C の水にわずかに溶け (0.25 mg/mL)、メタノールに溶けます。半減期は pH に大きく依存します。
オメプラゾール マグネシウムの実験式は (C17H18N3O3S)2 Mg、分子量は 713.12、構造式は次のとおりです。
PRILOSEC は、経口投与用の遅延放出カプセルとして供給されます。各遅延放出カプセルには、10 mg、20 mg、または 40 mg のオメプラゾールが腸溶コーティング顆粒の形で含まれており、次の不活性成分が含まれています: セルロース、リン酸水素二ナトリウム、ヒドロキシプロピルセルロース、ヒプロメロース、ラクトース、マンニトール、ラウリル硫酸ナトリウム、他の材料。カプセル シェルには、次の不活性成分が含まれています: ゼラチン-NF、FD&C ブルー #1、FD&C レッド #40、D&C レッド #28、二酸化チタン、合成黒色酸化鉄、イソプロパノール、ブチル アルコール、FD&C ブルー #2、D&C レッド #7カルシウム レーキ、さらに 10 mg と 40 mg のカプセル シェルには、D&C イエロー #10 も含まれています。
PRILOSEC for Delayed-Release Oral Suspension の各パケットには、2.8 mg または 11.2 mg のオメプラゾール マグネシウム (オメプラゾール 2.5 mg または 10 mg に相当) が、次の不活性成分とともに腸溶性コーティングされた顆粒の形で含まれています: グリセリル モノステアレート、ヒドロキシプロピルセルロース、ヒプロメロース、ステアリン酸マグネシウム、メタクリル酸コポリマーC、ポリソルベート、糖球、タルク、クエン酸トリエチル、および不活性顆粒。不活性顆粒は、クエン酸、クロスポビドン、デキストロース、ヒドロキシプロピルセルロース、酸化鉄、キサンタンガムの成分で構成されています。オメプラゾール顆粒および不活性顆粒は、水で構成されて懸濁液を形成し、経口、経鼻胃または直接胃投与によって与えられる。
適応症
活動性十二指腸潰瘍の治療
PRILOSEC 20mg は、成人の活動性十二指腸潰瘍の短期治療に適応されます。ほとんどの患者は 4 週間以内に治癒します。患者によっては、さらに 4 週間の治療が必要になる場合があります。
十二指腸潰瘍再発のリスクを減らすためのヘリコバクター・ピロリ除菌
H. pylori の除菌は、十二指腸潰瘍の再発リスクを低下させることが示されています。
トリプルセラピー
クラリスロマイシンおよびアモキシシリンと組み合わせた PRILOSEC 40mg は、H. pylori 感染および十二指腸潰瘍疾患 (活動性または 1 年以内の病歴) を有する患者の治療に適応され、成人の H. pylori を根絶します。
デュアルセラピー
PRILOSEC とクラリスロマイシンの併用は、H. pylori 感染症および十二指腸潰瘍患者の治療に適応し、成人の H. pylori を根絶します。
治療に失敗した患者では、クラリスロマイシンを併用した PRILOSEC は、3 剤併用療法と比較して、クラリスロマイシン耐性の発生と関連している可能性が高くなります。治療に失敗した患者では、感受性試験を実施する必要があります。クラリスロマイシンに対する耐性が示された場合、または感受性試験が不可能な場合は、代替の抗菌療法を開始する必要があります[ 臨床薬理学 およびクラリスロマイシン処方情報、微生物学セクション]。
活動性良性胃潰瘍の治療
PRILOSEC は、成人の活動性良性胃潰瘍の短期治療 (4 ~ 8 週間) に適応されます。
症候性胃食道逆流症(GERD)の治療
PRILOSEC は、1 歳以上の患者の胸やけおよび GERD に関連するその他の症状の最大 4 週間の治療に適応されます。
酸媒介GERDによるびらん性食道炎(EE)の治療
小児患者 1歳から成人
PRILOSEC 20mg は、1 歳以上の患者の内視鏡検査によって診断された酸媒介性 GERD による EE の短期治療 (4 ~ 8 週間) に適応されます。
PRILOSEC 10mg を EE 患者に 8 週間以上使用した場合の有効性は確立されていません。患者が 8 週間の治療に反応しない場合は、さらに 4 週間の治療が行われることがあります。 EE または GERD の症状 (胸やけなど) が再発した場合は、4 ~ 8 週間の PRILOSEC の追加コースが考慮される場合があります。
生後1ヶ月~1歳未満の小児患者
PRILOSEC は、生後 1 か月から 1 歳未満の小児患者における酸媒介性 GERD による EE の短期治療 (最大 6 週間) に適応されます。
酸媒介GERDによるEEの治癒の維持
PRILOSEC 40mg は、1 歳以上の患者の酸媒介性 GERD による EE の治癒の維持に適応されます。
対照研究は 12 か月を超えない。
病的な過剰分泌状態
PRILOSEC 40mg は、成人の病理学的過剰分泌状態 (例えば、ゾリンジャー・エリソン症候群、多発性内分泌腺腫、全身性肥満細胞症) の長期治療に適応されます。
投薬と管理
適応症別の推奨される成人用投与量レジメン
表 1 は適応症ごとの成人患者における PRILOSEC 40mg の推奨用量を示しています。
適応症別の推奨される小児用用量レジメン
表 2 は、適応症ごとの小児患者における PRILOSEC の推奨用量を示しています。
管理手順
- PRILOSEC 40mg は、水中で調製され、経口または経鼻胃管 (NG) または胃管を介して投与されることを意図しています。
- 食前にプリロセック40mgを服用してください。
- 制酸剤は PRILOSEC と同時に使用することができます。
- 飲み忘れ:飲み忘れた場合は、できるだけ早く服用してください。ただし、次回の服用予定日が迫っている場合は、飲み忘れた分は服用せず、時間通りに次の服用を行ってください。飲み忘れを補うために一度に 2 回分服用しないでください。
水中経口投与
NGまたは胃管(サイズ6以上)による水による投与
供給方法
剤形と強度
PRILOSEC 遅延放出経口懸濁液用: 2.5 mg および 10 mg のオメプラゾールを、白色から茶色がかったオメプラゾール マグネシウム顆粒と淡黄色の不活性顆粒からなる、細かい黄色の粉末を含む単位用量パケットに入れます。
保管と取り扱い
プリロセック (オメプラゾール マグネシウム) 徐放性経口懸濁液用のオメプラゾール 2.5 mg または 10 mg は、白色から茶色がかったオメプラゾール マグネシウム顆粒と淡黄色の不活性顆粒からなる微細な黄色の粉末を含む単位用量パケットとして提供されます。 PRILOSEC 単位用量パケットは、次のように提供されます。
NDC 70515-625-01 30 単位用量パッケージ: 2.5 mg パケット NDC 70515-610-01 30 個の単位用量パッケージ: 10 mg パケット
保管所
遅延放出経口懸濁液用の PRILOSEC は 25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション。 [見る USP制御の室温 .]
製造元: Covis Pharma, Zug, 6300 Switzerland.改訂: 2022 年 3 月
副作用
次の重篤な有害反応は、以下およびラベルの他の場所で説明されています。
- 急性尿細管間質性腎炎 [参照 警告と注意事項 ]
- クロストリジウム・ディフィシル関連下痢[参照 警告と注意事項 ]
- 骨折 [参照 警告と注意事項 ]
- 重度の皮膚有害反応 [参照 警告と注意事項 ]
- 皮膚および全身性エリテマトーデス [参照 警告と注意事項 ]
- シアノコバラミン (ビタミン B-12) 欠乏症 [参照 警告と注意事項 ]
- 低マグネシウム血症とミネラル代謝 [参照 警告と注意事項 ]
- 胃底ポリープ [参照 警告と注意事項 ]
PRILOSECの臨床試験経験
単剤療法
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
下記の安全性データは、世界規模の臨床試験からの 3096 人の患者 (米国の研究からの 465 人の患者および国際研究からの 2631 人の患者) におけるオメプラゾールマグネシウム遅延放出カプセルへの曝露を反映しています。米国の試験で臨床的に研究された適応症には、十二指腸潰瘍、難治性潰瘍、およびゾリンジャー・エリソン症候群が含まれます。国際的な臨床試験は、設計上、二重盲検および非盲検でした。これらの研究に登録された PRILOSEC 治療を受けた患者から報告された最も一般的な副作用 (発生率 ≥2%) には、頭痛 (7%)、腹痛 (5%)、吐き気 (4%)、下痢 (4%) が含まれていました。 )、嘔吐 (3%)、鼓腸 (3%)。
発生率が 1% 以上で報告されたその他の副作用には、酸逆流 (2%)、上気道感染症 (2%)、便秘 (2%)、めまい (2%)、発疹 (2%)、無力症 (1%) が含まれます。 )、背中の痛み (1%)、咳 (1%)。
65 歳以上の患者における臨床試験の安全性プロファイルは、65 歳以下の患者と同様でした。
オメプラゾールマグネシウム遅延放出カプセルを投与された小児患者における臨床試験の安全性プロファイルは、成人患者と同様でした。しかし、小児集団に特有の呼吸器系の有害反応は、生後 1 か月から 1 歳未満のグループ、1 歳から 2 歳未満のグループ、および 2 歳から 16 歳のグループで頻繁に報告されました (42%、75 %、および 19%、それぞれ)。また、中耳炎は生後1ヶ月~1歳未満(22%)、発熱は1~2歳未満(33%)、外傷は2歳未満が多かった。 16 歳までの年齢層 (4%) [参照 特定の集団での使用 ]。
ヘリコバクター ピロリ除菌のための併用療法における PRILOSEC 20mg の臨床試験経験
オメプラゾールマグネシウム遅延放出カプセルとクラリスロマイシンによる二重療法、またはオメプラゾールマグネシウム遅延放出カプセル、クラリスロマイシン、およびアモキシシリンによる三重療法のいずれかを使用した臨床試験では、これらの薬物の組み合わせに特有の有害反応は観察されませんでした.観察された有害反応は、オメプラゾール、クラリスロマイシン、またはアモキシシリン単独で以前に報告されたものに限定されていました。
二重療法(オメプラゾールマグネシウム遅延放出カプセル/クラリスロマイシン)
オメプラゾールマグネシウム遅延放出カプセルとクラリスロマイシンの併用療法を使用した対照臨床試験で観察された有害反応(n = 346)は、オメプラゾールマグネシウム遅延放出カプセルのみについて以前に報告されたものとは異なり、味覚異常(15%)、舌の変色(2 %)、鼻炎 (2%)、咽頭炎 (1%)、インフルエンザ症候群 (1%)。 (クラリスロマイシンの詳細については、クラリスロマイシンの処方情報、副作用のセクションを参照してください。)
トリプル セラピー (オメプラゾール マグネシウム遅延放出カプセル/クラリスロマイシン/アモキシシリン)
オメプラゾールマグネシウム遅延放出カプセル、クラリスロマイシン、およびアモキシシリン(n = 274)との併用療法を使用した臨床試験で観察された最も頻繁な副作用は、下痢(14%)、味覚倒錯(10%)、および頭痛(7%)でした.これらのいずれも、抗菌薬のみを服用している患者で報告された頻度よりも高い頻度では発生しませんでした。 (クラリスロマイシンまたはアモキシシリンの詳細については、それぞれの処方情報、副作用のセクションを参照してください。)
市販後の経験
オメプラゾールの承認後の使用中に、次の副作用が確認されました。これらの反応は不確実な規模の集団から自発的に報告されるため、実際の頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
全身: アナフィラキシー、アナフィラキシーショック、血管性浮腫、気管支痙攣、間質性腎炎、蕁麻疹を含む過敏反応(下記の皮膚も参照);熱;痛み;倦怠感;沈滞;全身性エリテマトーデス
心臓血管: 胸痛または狭心症、頻脈、徐脈、動悸、血圧上昇、末梢浮腫
内分泌: 女性化乳房
胃腸: 膵炎(致命的なものもあります)、食欲不振、過敏性結腸、糞便の変色、食道カンジダ症、舌の粘膜萎縮、口内炎、腹部腫脹、口渇、顕微鏡的結腸炎、胃底腺ポリープ。
胃十二指腸カルチノイドは、オメプラゾールによる長期治療中のZE症候群患者で報告されています。この所見は、そのような腫瘍に関連することが知られている基礎疾患の徴候であると考えられています。
肝臓: 肝不全(致命的なものもある)、肝壊死(致命的なものもある)、肝性脳症、肝細胞性疾患、胆汁うっ滞性疾患、混合性肝炎、黄疸、肝機能検査の上昇などの肝疾患[ALT、AST、GGT、アルカリホスファターゼ、ビリルビン]
感染症と蔓延: クロストリジウム・ディフィシルによる下痢
代謝および栄養障害: 低マグネシウム血症、低カルシウム血症、低カリウム血症 [警告と注意事項 5.9]、低ナトリウム血症、低血糖、体重増加
筋骨格: 筋力低下、筋肉痛、筋肉のけいれん、関節痛、足の痛み、骨折
神経系/精神医学: うつ病、動揺、攻撃性、幻覚、混乱、不眠症、神経過敏、無関心、傾眠、不安、夢異常などの精神障害および睡眠障害。振戦、感覚異常;めまい
呼吸器: 鼻出血、咽頭痛
肌: 有毒な SJS/TEN (致死的なものもある)、DRESS、AGEP、皮膚性エリテマトーデス、多形紅斑などの重度の全身性皮膚反応。光過敏症;蕁麻疹;発疹;皮膚の炎症;かゆみ;点状出血;紫斑;脱毛症;乾燥肌;多汗症
特別な感覚: 耳鳴り、味覚異常
眼球: 視神経萎縮、前部虚血性視神経症、視神経炎、ドライアイ症候群、眼刺激、かすみ目、複視
泌尿生殖器: 間質性腎炎、血尿、タンパク尿、血清クレアチニン上昇、顕微鏡的膿尿、尿路感染症、糖尿、頻尿、精巣痛
血液学: 無顆粒球症(致死的なものもある)、溶血性貧血、汎血球減少症、好中球減少症、貧血、血小板減少症、白血球減少症、白血球増加症
薬物相互作用
表 3 および 4 には、オメプラゾールと併用投与した場合に臨床的に重要な薬物相互作用および診断薬との相互作用を伴う薬物と、それらを予防または管理するための指示が含まれています。
PPI との相互作用に関する詳細な情報を得るには、併用薬のラベルを参照してください。
警告
の一部として含まれています 予防 セクション。
予防
胃悪性腫瘍の存在
成人では、PRILOSEC による治療に対する症候性反応は、胃の悪性腫瘍の存在を排除するものではありません。 PPIによる治療を完了した後、最適ではない反応または初期の症状の再発がある成人患者では、追加のフォローアップおよび診断テストを検討してください.高齢の患者さんでは、内視鏡検査も考慮してください。
急性尿細管間質性腎炎
急性尿細管間質性腎炎 (TIN) は、PPI を服用している患者で観察されており、PPI 治療中の任意の時点で発生する可能性があります。患者は、症候性過敏症反応から腎機能低下の非特異的症状(例、倦怠感、吐き気、食欲不振)まで、さまざまな徴候や症状を示すことがあります。報告された症例シリーズでは、一部の患者は生検で診断され、腎外症状(例、発熱、発疹、関節痛)がない状態で診断されました。 PRILOSEC 40mg を中止し、急性 TIN が疑われる患者を評価する [参照 禁忌 ]。
クロストリジウム・ディフィシル関連下痢症
公開された観察研究は、PRILOSEC のような PPI 療法が、特に入院患者において、クロストリジウム・ディフィシル関連下痢のリスク増加と関連している可能性があることを示唆しています。この診断は、下痢が改善しない場合に考慮する必要があります [参照 有害反応 ]。
患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。
クロストリジウム ディフィシル関連下痢症 (CDAD) は、ほぼすべての抗菌剤の使用で報告されています。 PRILOSEC との併用が指示されている抗菌薬 (クラリスロマイシンおよびアモキシシリン) に固有の詳細については、対応する処方情報の警告および使用上の注意のセクションを参照してください。
骨折
いくつかの公開された観察研究は、プロトンポンプ阻害剤 (PPI) 療法が骨粗鬆症に関連した股関節、手首、または脊椎の骨折のリスク増加と関連している可能性があることを示唆しています。骨折のリスクは、高用量(1 日複数回の投与と定義)および長期の PPI 療法(1 年以上)を受けた患者で増加しました。患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。骨粗鬆症関連の骨折のリスクがある患者は、確立された治療ガイドラインに従って管理する必要があります[参照 投薬と管理 、 有害反応 ]。
重度の皮膚有害反応
PPI の使用に関連して、スティーブンス・ジョンソン症候群 (SJS) や中毒性表皮壊死融解症 (TEN)、好酸球増加症や全身症状を伴う薬物反応 (DRESS)、急性汎発性発疹性膿疱症 (AGEP) などの重度の皮膚副作用が報告されています。 [見る 有害反応 ]。重度の皮膚有害反応の最初の兆候または症状、または過敏症の他の兆候が見られた場合は、PRILOSEC を中止し、さらなる評価を検討してください。
皮膚および全身性エリテマトーデス
オメプラゾールを含む PPI を服用している患者では、皮膚エリテマトーデス (CLE) および全身性エリテマトーデス (SLE) が報告されています。これらの事象は、既存の自己免疫疾患の新たな発症と悪化の両方として発生しています。 PPI 誘発性エリテマトーデスの症例の大部分は CLE でした。
PPI で治療された患者で報告された CLE の最も一般的な形態は亜急性 CLE (SCLE) であり、乳児から高齢者までの範囲の患者で継続的な薬物療法の後、数週間から数年以内に発生しました。一般に、組織学的所見は臓器の関与なしに観察されました。
全身性エリテマトーデス (SLE) は、PPI を投与されている患者では CLE ほど一般的ではありません。 PPI 関連の SLE は通常、非薬物誘発性 SLE よりも軽度です。 SLE の発症は、通常、主に若年成人から高齢者までの範囲の患者で、治療を開始してから数日から数年以内に発生しました。発疹を呈した患者の大部分。しかし、関節痛と血球減少症も報告されました。
医学的に指示されているよりも長い PPI の投与は避けてください。 PRILOSEC 10mg を投与されている患者に CLE または SLE と一致する徴候または症状が認められた場合は、薬剤の投与を中止し、評価のために適切な専門医に患者を紹介してください。ほとんどの患者は、4 ~ 12 週間で PPI のみを中止すると改善します。血清学的検査(例、ANA)は陽性である可能性があり、血清学的検査結果の上昇は、臨床症状よりも解消に時間がかかる場合があります。
クロピドグレルとの相互作用
PRILOSEC 10mg とクロピドグレルの併用は避けてください。クロピドグレルはプロドラッグです。クロピドグレルによる血小板凝集の阻害は、完全に活性代謝物によるものです。クロピドグレルの活性代謝物への代謝は、CYP2C19 活性を阻害するオメプラゾールなどの併用薬との併用によって損なわれる可能性があります。クロピドグレルと 80 mg のオメプラゾールを併用すると、12 時間間隔で投与した場合でも、クロピドグレルの薬理活性が低下します。
PRILOSEC を使用する場合は、代替の抗血小板療法を検討してください [ 薬物相互作用 と 臨床薬理学 ]。
シアノコバラミン (ビタミン B-12) 欠乏症
長期間(例えば、3年以上)にわたる酸抑制薬による毎日の治療は、低酸症または酸欠乏症によって引き起こされるシアノコバラミン(ビタミンB-12)の吸収不良につながる可能性があります.酸抑制療法で発生するシアノコバラミン欠乏症のまれな報告が文献で報告されています. PRILOSEC で治療された患者にシアノコバラミン欠乏症と一致する臨床症状が観察された場合、この診断を考慮する必要があります。
低マグネシウム血症とミネラル代謝
症候性および無症候性の低マグネシウム血症は、ほとんどの場合、1 年間の治療後に、少なくとも 3 か月間 PPI で治療された患者でまれに報告されています。重篤な有害事象には、テタニー、不整脈、および発作が含まれます。低マグネシウム血症は、低カルシウム血症および/または低カリウム血症につながる可能性があり、リスクのある患者の潜在的な低カルシウム血症を悪化させる可能性があります。ほとんどの患者で、低マグネシウム血症の治療にはマグネシウムの補充と PPI の中止が必要でした。
長期の治療が予想される患者、またはジゴキシンなどの薬剤または低マグネシウム血症を引き起こす可能性のある薬剤(利尿薬など)と一緒に PPI を服用している患者の場合、医療専門家は、PPI 治療の開始前および定期的にマグネシウム濃度をモニタリングすることを検討してもよい [参照 有害反応 ]。
PRILOSEC の開始前、および低カルシウム血症のリスクがある患者 (副甲状腺機能低下症など) の治療中は定期的にマグネシウムとカルシウムのレベルをモニタリングすることを検討してください。必要に応じて、マグネシウムやカルシウムを補給してください。低カルシウム血症が治療に抵抗性である場合は、PPI の中止を検討してください。
セントジョーンズワートまたはリファンピンとの相互作用
CYP2C19 または CYP3A4 を誘導する薬剤 (セントジョーンズワートまたはリファンピンなど) は、オメプラゾール濃度を大幅に低下させることができます [参照 薬物相互作用 ]。 PRILOSEC とセントジョーンズワートまたはリファンピンの併用は避けてください。
神経内分泌腫瘍の診断調査との相互作用
血清クロモグラニン A (CgA) レベルは、薬物による胃酸の減少に続いて増加します。増加した CgA レベルは、神経内分泌腫瘍の診断調査で偽陽性の結果を引き起こす可能性があります。医療提供者は、CgA レベルを評価する少なくとも 14 日前に PRILOSEC 20mg 治療を一時的に中止し、最初の CgA レベルが高い場合はテストを繰り返すことを検討する必要があります。一連の試験を実施する場合(例:モニタリング用)、試験間の参照範囲が異なる可能性があるため、同じ商用試験所を試験に使用する必要があります [参照 薬物相互作用 ]。
メトトレキサートとの相互作用
文献によると、PPI とメトトレキサート (主に高用量) を併用すると、メトトレキサートおよび/またはその代謝産物の血清レベルが上昇および延長し、メトトレキサート毒性につながる可能性があることが示唆されています。高用量のメトトレキサート投与では、一部の患者では PPI の一時的な中止が考慮される場合があります [ 薬物相互作用 ]。
胃底ポリープ
PPI の使用は、特に 1 年以上の長期使用に伴って増加する胃底腺ポリープのリスク増加と関連しています。胃底腺ポリープを発症したほとんどの PPI ユーザーは無症候性であり、内視鏡検査で偶発的に胃底腺ポリープが特定されました。治療中の状態に適した最短期間の PPI 療法を使用してください。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイドと使用説明書 )。
急性尿細管間質性腎炎
患者または介護者に、急性尿細管間質性腎炎に関連する徴候および/または症状が見られた場合は、直ちに患者の医療提供者に電話するようにアドバイスします[参照 警告と注意事項 ]。
クロストリジウム・ディフィシル関連下痢症
下痢が改善しない場合は、直ちに患者の医療提供者に電話するよう患者または介護者に助言する[参照 警告と注意事項 ]。
骨折
患者または介護者に、骨折、特に股関節、手首、または脊椎の骨折については、患者の医療提供者に報告するように助言してください [ 警告と注意事項 ]。
重度の皮膚有害反応
患者または介護者に、PRILOSEC 40mg の使用を中止し、重度の皮膚有害反応または過敏症の他の徴候が最初に現れた場合は、担当の医療提供者に報告するようアドバイスしてください [参照 警告と注意事項 ]。
皮膚および全身性エリテマトーデス
患者または介護者に、皮膚または全身性エリテマトーデスに関連する新たな症状または症状の悪化については、直ちに患者の医療提供者に連絡するようにアドバイスしてください。 警告と注意事項 ]
シアノコバラミン (ビタミン B-12) 欠乏症
PRILOSECを3年以上受けている場合は、シアノコバラミン欠乏症に関連する可能性のある臨床症状を患者の医療提供者に報告するように患者または介護者に助言してください[ 警告と注意事項 ]。
低マグネシウム血症とミネラル代謝
PRILOSEC を 3 か月以上受けている場合は、低マグネシウム血症、低カルシウム血症、および/または低カリウム血症に関連する可能性のある臨床症状を患者の医療提供者に報告するよう、患者または介護者に助言してください [ 警告と注意事項 ]。
薬物相互作用
リルピビリン含有製品、クロピドグレル、セントジョーンズワート、またはリファンピンで治療を開始する場合は、医療提供者に報告するよう患者にアドバイスしてください。または、高用量のメトトレキサートを服用している場合[ 禁忌 、 警告と注意事項 ]。
管理
- PRILOSEC は、医薬品ガイドに記載されているように、水中で調製し、経口または経鼻胃管 (NG) または胃管を介して投与することを意図しています。
- 食前にプリロセックを服用してください。
- 制酸剤は PRILOSEC と同時に使用することができます。
- 飲み忘れ:飲み忘れた場合は、できるだけ早く服用してください。ただし、次回の服用予定日が迫っている場合は、飲み忘れた分は服用せず、時間通りに次の服用を行ってください。飲み忘れた分を補うために、一度に 2 回分を服用しないでください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
ラットにおける 24 か月の 2 つの発がん性試験では、1.7、3.4、13.8、44.0、および 140.8 mg/kg/日のオメプラゾールの 1 日用量 (体表で表したヒトの用量 40 mg/日の約 0.4 から 34 倍)面積ベース) 雄と雌の両方のラットで用量依存的に胃 ECL 細胞カルチノイドを産生した。この影響の発生率は、オメプラゾールの血中濃度が高い雌ラットで著しく高かった。胃カルチノイドは、未治療のラットではめったに発生しません。さらに、ECL 細胞の過形成は、両方の性別のすべての治療グループに存在しました。これらの研究の 1 つでは、メスのラットにオメプラゾール 13.8 mg/kg/日 (体表面積に基づいて、ヒトの用量である 40 mg/日の約 3.4 倍) を 1 年間投与し、その後、オメプラゾールを投与せずにさらに 1 年間追跡しました。薬。これらのラットにはカルチノイドは見られませんでした。治療に関連した ECL 細胞過形成の発生率の増加が 1 年の終わりに観察されました (治療群 94% 対 対照群 10%)。 2 年目までに、治療ラットと対照ラットの差はかなり小さくなりました (46% 対 26%) が、それでも治療群ではより多くの過形成が見られました。胃腺癌が 1 匹のラット (2%) に見られた。同様の腫瘍は、2 年間投与されたオスまたはメスのラットに見られませんでした。この系統のラットでは、歴史的に同様の腫瘍は記録されていませんが、1 つの腫瘍のみに関する発見は解釈が困難です。 Sprague-Dawley ラットでの 52 週間の毒性試験では、0.4、2、および 16 mg/kg/日の用量レベルでオメプラゾールを投与された少数の雄で脳星細胞腫が発見されました (人間の用量の約 0.1 から 3.9 倍)。体表面積ベースで 40 mg/日)。この研究では、雌ラットに星状細胞腫は観察されませんでした。 Sprague-Dawley ラットでの 2 年間の発がん性試験では、140.8 mg/kg/日の高用量 (体表面積ベースでヒトの用量 40 mg/日の約 34 倍) で雄または雌に星状細胞腫は見られませんでした。 .オメプラゾールの 78 週間のマウス発がん性研究では、腫瘍発生の増加は示されませんでしたが、この研究は決定的なものではありませんでした。 26 週間の p53 (+/-) トランスジェニック マウスの発がん性試験は陽性ではありませんでした。
オメプラゾールは、in vitro ヒトリンパ球染色体異常試験、2 つの in vivo マウス小核試験の 1 つ、および in vivo 骨髄細胞染色体異常試験で、染色体異常誘発作用について陽性であった。オメプラゾールは、in vitro Ames 試験、in vitro マウスリンパ腫細胞前方突然変異試験、および in vivo ラット肝 DNA 損傷試験で陰性でした。
オメプラゾールは、ラットで 138 mg/kg/日までの経口用量 (体表面積ベースでヒトの経口用量 40 mg の約 34 倍) で、受胎能および生殖能力に影響を及ぼさないことがわかった。
ラットでの 24 か月の発がん性試験では、雄と雌の両方の動物で、胃カルチノイド腫瘍と ECL 細胞過形成の用量依存性の有意な増加が観察された [参照 警告と注意事項 ]。カルチノイド腫瘍は、眼底切除術を受けたラット、または他のプロトンポンプ阻害剤または高用量のH2受容体拮抗薬による長期治療を受けたラットでも観察されています。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性を対象としたオメプラゾールの十分に管理された研究はありません。利用可能な疫学的データは、妊娠初期のオメプラゾール使用による主要な先天性奇形またはその他の妊娠の有害転帰のリスク増加を実証していません。ラットとウサギの生殖研究では、オメプラゾールの用量依存性胚致死率は、ヒトの経口用量 40 mg の約 3.4 ~ 34 倍でした (体重 60 kg の人の体表面積に基づく)。
催奇形性は、器官形成期のラットとウサギにエソメプラゾール(オメプラゾールのエナンチオマー)マグネシウムを経口投与した動物の生殖研究で観察されなかった.40mgのエソメプラゾールまたは40mgのオメプラゾールのヒト経口用量のそれぞれ約68倍と42倍の用量で( 60 kg の人の体表面積に基づく)。
骨形態の変化は、エソメプラゾール 40 mg またはオメプラゾール 40 mg の人間の経口投与量の約 34 倍以上の用量で、妊娠中および授乳期のほとんどを通じて投与されたラットの子孫で観察されました。母体への投与が妊娠期間のみに限定された場合、どの年齢の子においても骨端の形態に影響はありませんでした。 データ ]。
示された母集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
データ
ヒューマンデータ
発表された 4 つの疫学研究では、妊娠中にオメプラゾールを使用した女性から生まれた乳児の先天異常の頻度と、H2 受容体拮抗薬または他の対照にさらされた女性の乳児の異常の頻度が比較されました。
1995 年から 99 年までの妊娠の約 99% をカバーする、Swedish Medical Birth Registry の集団ベースのレトロスペクティブ コホート疫学研究では、955 人の乳児が報告されました (824 人は妊娠初期に暴露され、そのうち 39 人は妊娠初期に暴露され、131 人は妊娠初期に暴露されました)。妊娠中にオメプラゾールを使用した母親。子宮内でオメプラゾールに曝露され、奇形、低出生体重、低アプガースコア、または入院した乳児の数は、この集団で観察された数と同様でした.心室中隔欠損症で生まれた乳児の数と死産児の数は、オメプラゾールに曝露された乳児では、この集団で予想される数よりもわずかに高かった.
1996 年から 2009 年までのデンマークのすべての出生を対象とした人口ベースのレトロスペクティブ コホート研究では、母親が妊娠の最初の三半期にオメプラゾールを使用した 1,800 の出生と、母親がプロトン ポンプ阻害剤を使用しなかった 837,317 の出生が報告されました。妊娠初期にオメプラゾールに曝露された母親から生まれた乳児の先天性欠損症の全体的な割合は、妊娠初期にプロトンポンプ阻害剤に曝露されていない母親から生まれた乳児で2.9%および2.6%でした.
レトロスペクティブ コホート研究では、妊娠第 1 期に H2 遮断薬またはオメプラゾールのいずれかに暴露された 689 人の妊婦 (オメプラゾールに暴露された 134 人) と、妊娠第 1 期にいずれにも暴露されていない 1,572 人の妊婦が報告されました。 H2ブロッカーであるオメプラゾールに妊娠初期に曝露した、または曝露しなかった母親から生まれた子孫の全体的な奇形率は、それぞれ3.6%、5.5%、および4.1%でした。
小規模な前向き観察コホート研究では、妊娠中にオメプラゾールに暴露された 113 人の女性が追跡されました (妊娠初期の暴露では 89%)。主要な先天性奇形の報告された割合は、オメプラゾール群で 4%、非催奇形物質に暴露された対照群で 2%、疾患対対照群で 2.8% でした。自然流産と選択的流産、早産、出産時の在胎週数、平均出生時体重の割合は、グループ間で同様でした。
いくつかの研究では、全身麻酔下で帝王切開の前投薬として 200 人以上の妊婦にオメプラゾールの経口または静脈内単回投与を行った場合、乳児に対する明らかな短期的な悪影響は報告されていません。
動物データ
オメプラゾール
138 mg/kg/日までの経口投与量(体表面積ベースでヒトの経口投与量 40 mg の約 34 倍)でオメプラゾールを使用し、ウサギで 69.1 mg/kg/日までの投与量でオメプラゾールを用いて実施された生殖試験(体表面積ベースで 40 mg のヒトの経口投与量の約 34 倍) は、器官形成中にオメプラゾールの催奇形性の可能性に関する証拠を開示していませんでした。ウサギでは、6.9 から 69.1 mg/kg/日の用量範囲のオメプラゾール (体表面積ベースでヒトの経口用量 40 mg の約 3.4 から 34 倍) を器官形成中に投与すると、胚致死率が用量依存的に増加した。胎児吸収、および妊娠の混乱。ラットでは、親がオメプラゾール 13.8 ~ 138.0 mg/kg/日(体表でのヒト経口用量 40 mg の約 3.4 ~ 34 倍)で処理された親から生まれた子孫に、用量に関連した胚/胎児毒性および出生後の発生毒性が観察された。面積ベース)、授乳期間を通じて交配前に投与されます。
エソメプラゾール
下記のデータは、オメプラゾールのエナンチオマーであるエソメプラゾールを使用した研究から生成されました。動物からヒトへの用量倍数は、エソメプラゾール 40 mg またはオメプラゾール 40 mg の経口投与後のヒトにおけるエソメプラゾールへの等しい全身暴露の仮定に基づいています。
エソメプラゾール マグネシウムをラットに 280 mg/kg/日まで経口投与した場合(体表面積ベースでヒトの経口投与量 40 mg の約 68 倍)または器官形成中に投与される最大86mg/kg/日の経口用量(体表面積ベースで40mgのエソメプラゾールまたは40mgのオメプラゾールのヒトの経口用量の約42倍)。
骨の発達を評価するためのエンドポイントを追加したラットの出生前および出生後の発生毒性試験が、エソメプラゾール マグネシウムを 14 ~ 280 mg/kg/日の経口用量で実施されました (人間の経口用量である 40 mg エソメプラゾールまたは 40 mg の約 3.4 ~ 68 倍)。 mgオメプラゾールを体表面積に基づいて)。新生児/生後早期 (出生から離乳) の生存率は、138 mg/kg/日以上の用量で減少しました (体表面積ベースで、ヒトの経口用量である 40 mg エソメプラゾールまたは 40 mg オメプラゾールの約 34 倍)。体重と体重増加は減少し、離乳直後の時間枠における神経行動または一般的な発達の遅延は、69 mg/kg/日以上の用量で明らかでした (40 mg のエソメプラゾールまたは 40 mg の経口ヒト用量の約 17 倍)。 mgオメプラゾールを体表面積に基づいて)。さらに、大腿骨の長さ、皮質骨の幅および厚さの減少、脛骨成長板の厚さの減少、および軽度から軽度の骨髄低細胞性が、14 mg/kg/日以上の用量で認められました (経口ヒトの約 3.4 倍)。体表面積ベースで40mgのエソメプラゾールまたは40mgのオメプラゾールの用量)。大腿骨の骨端異形成は、138 mg/kg/日以上の用量のエソメプラゾール マグネシウムの経口用量で処置されたラットの子孫で観察されました (体に 40 mg のエソメプラゾールまたは 40 mg のオメプラゾールのヒトの経口用量の約 34 倍)。表面積ベース)。
エソメプラゾール マグネシウムを 14 ~ 280 mg/kg/日 (ヒトの経口用量であるエソメプラゾール 40 mg の約 3.4 ~ 68 倍) の経口用量で投与した場合、妊娠中および授乳中のラットの出生前および出生後の毒性試験で、母体の骨への影響が観察されました。または体表面積ベースで40mgのオメプラゾール)。ラットに妊娠 7 日から生後 21 日の離乳まで投与した場合、138 mg/kg/日以上の投与量で母体の大腿骨重量が最大 14% (プラセボ治療と比較して) 統計的に有意に減少したことが観察されました。 (体表面積に基づいて、40mgのエソメプラゾールまたは40mgのオメプラゾールのヒトの経口用量の約34倍)。
エソメプラゾール ストロンチウムを用いたラットの出生前および出生後の発育研究 (エソメプラゾール マグネシウムの研究と比較して等モル用量を使用) では、上記のように、母動物と仔動物で同様の結果が得られました。
生後 2 日目から成体期までの子犬の骨の発達を評価するためのさらなる時点でのラットにおける追跡発生毒性研究が、280 mg/kg/日の経口用量のエソメプラゾール マグネシウムで実施されました (ヒトの経口用量 40 mg の約 68 倍)。エソメプラゾールの投与は、妊娠7日目または妊娠16日目から分娩までであった。母体への投与が妊娠期間のみに限定された場合、どの年齢の子孫でも骨端線の形態に影響はありませんでした。
授乳
リスクの概要
限られたデータは、オメプラゾールが母乳に存在する可能性があることを示唆しています。母乳で育てられた乳児または乳生産に対するオメプラゾールの影響に関する臨床データはありません。母乳育児の発達上および健康上の利点は、プリロセック 40 mg に対する母親の臨床的必要性、およびプリロセック 20 mg または母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
小児用
PRILOSEC 40mg の安全性と有効性は、症候性 GERD の治療、酸媒介性 GERD による EE の治療、および酸媒介性 GERD による EE の治癒の維持について、1 ~ 16 歳の小児患者で確立されています。この年齢層における PRILOSEC 10mg の使用は、成人を対象とした適切かつ十分に管理された研究と、小児および青年患者を対象に実施された管理されていない安全性、有効性、および薬物動態研究によって裏付けられています。 臨床薬理学 、 臨床研究 ]。
プリロセック 10mg の安全性と有効性は、生後 1 か月から 1 歳未満の小児患者において、酸媒介性 GERD による EE の治療のために確立されており、成人および安全性、薬物動態、および小児患者で実施された薬力学研究 [参照 臨床薬理学 ]。
小児集団では、呼吸器系の有害反応が全年齢層 (1 か月から 16 歳) で頻繁に報告されました。中耳炎は生後 1 か月から 1 歳未満のグループで報告されることが多く、発熱は 1 歳から 2 歳未満のグループで頻繁に報告され、偶発的な外傷は 2 歳から 16 歳のグループで頻繁に報告されています。 有害反応 ]。
PRILOSEC の安全性と有効性は、以下では確立されていません。
- 1歳未満の患者:
- 症候性GERDの治療
- 酸を介した GERD による EE の治癒の維持
- 小児患者:
- 活動性十二指腸潰瘍の治療
- ピロリ菌の除菌で十二指腸潰瘍の再発リスクを低減
- 活動性良性胃潰瘍の治療
- 病的な過剰分泌状態
- 適応症を問わず、生後1か月未満の患者。
幼獣データ
オメプラゾールのエナンチオマーであるエソメプラゾールは、体重、体重増加、大腿骨重量、大腿骨長、および全体的な成長を、体重に基づいてエソメプラゾール 40 mg またはオメプラゾール 40 mg の 1 日ヒト用量の約 34 ~ 68 倍の経口用量で減少させることが示されました。幼若ラット毒性試験における表面積。動物からヒトへの用量倍数は、エソメプラゾール 40 mg またはオメプラゾール 40 mg の経口投与後のヒトにおけるエソメプラゾールへの等しい全身暴露の仮定に基づいています。
14 日間の回復期を伴う 28 日間の毒性試験が、70 ~ 280 mg/kg/日 (40 mg のエソメプラゾールまたは 40 mg の 1 日経口ヒト用量の約 17 ~ 68 倍) の用量でエソメプラゾール マグネシウムを用いて幼若ラットで実施されました。体表面積に基づくオメプラゾール)。幼若ラットに生後 7 日から生後 35 日までエソメプラゾールマグネシウムを投与した場合、280 mg/kg/日の高用量で死亡数の増加が観察されました。 1 日 (体表面積ベースで 40 mg エソメプラゾールまたは 40 mg オメプラゾールの 1 日経口ヒト用量の約 34 倍)、治療に関連した体重の減少 (約 14%) および体重増加、大腿骨重量および大腿骨の減少をもたらした長さ、および全体的な成長に影響を与えました。エソメプラゾールの等モル用量で、別のエソメプラゾール塩であるエソメプラゾールストロンチウムを用いたこの研究でも、上記の同等の所見が観察された。
高齢者の使用
オメプラゾールは、米国とヨーロッパでの臨床試験で 2000 人以上の高齢者 (65 歳以上) に投与されました。高齢者と若年者の間で安全性と有効性に違いはありませんでした。他の報告された臨床経験では、高齢者と若年者の間の反応の違いは確認されていませんが、一部の高齢者の感受性が高いことは除外できません.
薬物動態研究では、排泄率が高齢者でやや減少し、バイオアベイラビリティが増加したことが示されています。オメプラゾールの血漿クリアランスは 250 mL/分 (若いボランティアの約半分) で、その血漿半減期は平均 1 時間で、若い健康なボランティアの約 2 倍でした。ただし、高齢者では用量調節の必要はない[参照] 臨床薬理学 ]。
肝障害
肝機能障害 (Child-Pugh クラス A、B、または C) の患者では、オメプラゾールへの曝露が健康な被験者と比較して大幅に増加しました。肝機能障害のある患者には、EE の治癒を維持するために PRILOSEC 10mg を 10mg に 1 日 1 回減量することが推奨される [ 投薬と管理 、 臨床薬理学 ]。
アジアの人口
健康な被験者を対象とした研究では、アジア人は白人よりも約 4 倍多く暴露していました。 EE の治癒を維持するために、アジアの患者には PRILOSEC 20mg を 10mg に 1 日 1 回減量することが推奨される [ 投薬と管理 、 臨床薬理学 ]。
過剰摂取
ヒトにおけるオメプラゾールの過剰摂取の報告が寄せられています。用量は 2400 mg (通常の推奨臨床用量の 120 倍) までの範囲でした。症状はさまざまでしたが、錯乱、眠気、かすみ目、頻脈、吐き気、嘔吐、発汗、紅潮、頭痛、口渇、および通常の臨床経験で見られるものと同様のその他の有害反応が含まれていました[ 有害反応 ]。症状は一過性であり、PRILOSEC 20mg を単独で服用した場合、重大な臨床転帰は報告されていません。オメプラゾールの過剰摂取に対する特定の解毒剤は知られていません。
オメプラゾールは広範囲にタンパク質に結合しているため、容易に透析できません。過剰摂取の場合、治療は対症療法および支持療法でなければなりません。
過剰暴露が発生した場合は、毒物管理センター (1-800-222-1222) に電話して、中毒または過剰摂取の管理に関する最新情報を入手してください。
禁忌
- PRILOSEC は、代替ベンズイミダゾールまたは製剤のいずれかの成分に対して既知の過敏症のある患者には禁忌です。過敏症反応には、アナフィラキシー、アナフィラキシーショック、血管性浮腫、気管支痙攣、急性尿細管間質性腎炎、蕁麻疹などがあります。 警告と注意事項 、 有害反応 ]。
- PRILOSEC 10mgを含むプロトンポンプ阻害薬(PPI)は、リルピビリン含有製品を投与されている患者には禁忌です[ 薬物相互作用 ]。
- プリロセック 40mg と併用する抗菌薬(クラリスロマイシンおよびアモキシシリン)の禁忌については、それぞれの添付文書の「禁忌」セクションを参照してください。
臨床薬理学
作用機序
オメプラゾールは、胃壁細胞の分泌面で H+/K+ ATPase 酵素系を特異的に阻害することによって胃酸分泌を抑制する、抗分泌性化合物である置換ベンズイミダゾールのクラスに属します。この酵素系は、胃粘膜内の酸 (プロトン) ポンプと見なされているため、オメプラゾールは、酸産生の最終段階をブロックするという点で、胃酸ポンプ阻害剤として特徴付けられています。この効果は用量に関連しており、刺激に関係なく、基礎酸分泌と刺激酸分泌の両方を阻害します。
薬力学
抗分泌活動
経口投与後、オメプラゾールの抗分泌効果は 1 時間以内に発現し、最大効果は 2 時間以内に発現します。分泌の抑制は 24 時間で最大値の約 50% であり、抑制の持続時間は 72 時間まで続きます。このように、抗分泌効果は、非常に短い (1 時間未満) 血漿半減期から予想されるよりもはるかに長く持続します。これは、明らかに頭頂部の H+/K+ ATPase 酵素への長時間の結合によるものです。薬を中止すると、分泌活動は 3 ~ 5 日かけて徐々に元に戻ります。オメプラゾールの酸分泌抑制効果は、1 日 1 回の反復投与で増加し、4 日後にプラトーに達します。
健常者および患者におけるオメプラゾール 20 mg および 40 mg の複数回投与の抗分泌効果に関する多数の研究の結果を以下に示します。 「最大」値は最大効果の時点(投与後 2 ~ 6 時間)での測定値を表し、「最小」値はオメプラゾールの最終投与から 24 時間後の測定値を表します。
10 mg から 40 mg の用量範囲のオメプラゾールを 1 日 1 回経口投与すると、一部の患者で 24 時間の胃内酸性度が 100% 抑制されました。
血清ガストリン効果
200 人以上の患者を対象とした研究では、酸分泌の抑制と並行して、治療用量のオメプラゾールを 1 日 1 回投与した最初の 1 ~ 2 週間で、血清ガストリン濃度が上昇しました。治療を継続しても、血清ガストリンのさらなる増加は見られませんでした。ヒスタミン H2 受容体アンタゴニストと比較して、20 mg のオメプラゾール投与量による増加の中央値は高かった (1.3 から 3.6 倍対 1.1 から 1.8 倍の増加)。ガストリン値は、通常、治療中止後 1 ~ 2 週間以内に治療前のレベルに戻りました。
ガストリンの増加は、腸クロム親和性細胞の過形成と血清クロモグラニン A (CgA) レベルの増加を引き起こします。上昇した CgA レベルは、神経内分泌腫瘍の診断調査で偽陽性の結果を引き起こす可能性があります [参照 警告と注意事項 ]。
腸クロム親和性 (ECL) 細胞効果
ヒト胃生検標本は、長期臨床試験でオメプラゾールで治療された 3000 人以上の患者 (子供と大人の両方) から得られました。これらの研究における ECL 細胞過形成の発生率は、時間とともに増加しました。ただし、これらの患者では、ECL細胞カルチノイド、異形成、または新形成の症例は見つかっていません。しかし、これらの研究は、オメプラゾールの長期投与が前がん状態または悪性状態の発症に及ぼす影響の可能性を排除するには、期間と規模が不十分です。
その他の効果
中枢神経系、心血管系および呼吸器系におけるオメプラゾールの全身作用は、これまで発見されていません。オメプラゾールは、30 または 40 mg の経口用量で 2 ~ 4 週間投与されましたが、甲状腺機能、炭水化物代謝、または副甲状腺ホルモン、コルチゾール、エストラジオール、テストステロン、プロラクチン、コレシストキニン、またはセクレチンの循環レベルに影響を与えませんでした。
オメプラゾール 90 mg の単回投与後、試験食の固体および液体成分の胃排出に対する影響は示されませんでした。健康な被験者では、オメプラゾール (0.35 mg/kg) の単回静脈内投与は、内因子の分泌に影響を与えませんでした。ヒトの基礎または刺激ペプシン出力に対する系統的な用量依存効果は観察されていません。
しかし、胃内pHが4.0以上に維持されると、ペプシンの基礎生産量が低くなり、ペプシン活性が低下します。
胃内 pH を上昇させる他の薬剤と同様に、オメプラゾールを健康な被験者に 14 日間投与すると、生菌の胃内濃度が大幅に増加しました。細菌種のパターンは、唾液で一般的に見られるパターンと変わりませんでした。すべての変化は、治療を中止してから 3 日以内に回復しました。
106 人の患者におけるバレット食道の経過は、米国の二重盲検比較試験で評価されました。PRILOSEC 40 mg を 1 日 2 回、12 か月間、続いて 20 mg を 1 日 2 回、12 か月間、またはラニチジン 300 mg を 1 日 2 回、24 か月間投与しました。抗分泌療法によるバレットの粘膜への臨床的に有意な影響は観察されませんでした。抗分泌療法中に新扁平上皮が発達したが、バレットの粘膜の完全な除去は達成されなかった.バレット粘膜の異形成の発症において治療群間に有意差は認められず、治療中に食道癌を発症した患者はいなかった. ECL 細胞過形成、体部萎縮性胃炎、体部腸上皮化生、または直径 3 mm を超える結腸ポリープの発生において、治療群間で有意差は観察されませんでした。
薬物動態
吸収
徐放性経口懸濁剤プリロセック 20mg は、オメプラゾール マグネシウム顆粒と水で投与する不活性顆粒を含んでいます。オメプラゾールの吸収は、胃耐性顆粒が胃を出た後にのみ始まります。オメプラゾールの薬物動態は時間依存性であり、単回投与後と比較して定常状態でより高い血漿濃度を示します。 20 mg の遅延放出経口懸濁液を 5 日間 1 日 1 回投与した後のオメプラゾールへの全身暴露 (AUC および Cmax) は、初回投与後よりもそれぞれ 51% および 58% 高い。遅延放出経口懸濁液の反復投与後のオメプラゾールのピーク血漿濃度は、1.5〜2時間以内に発生します。健康な被験者では、血漿半減期は 0.5 ~ 1 時間です。
分布
タンパク質結合率は約 95% です。
排除
代謝
オメプラゾールは、シトクロム P450 (CYP) 酵素系によって広範囲に代謝されます。その代謝の大部分は、多形的に発現する CYP2C19 に依存しており、血漿中の主要な代謝産物であるヒドロキシオメプラゾールの形成に関与しています。残りの部分は、オメプラゾールスルホンの形成に関与する別の特定のアイソフォームである CYP3A4 に依存しています。
排泄
オメプラゾールの緩衝溶液を単回経口投与した後、未変化の薬物が尿中に排泄されたとしても、ほとんどありませんでした。投与量の大部分 (約 77%) は、少なくとも 6 つの代謝物として尿中に排出されました。 2 つはヒドロキシオメプラゾールと対応するカルボン酸として識別されました。投与量の残りは糞便で回収可能でした。これは、オメプラゾールの代謝物のかなりの胆汁排泄を意味します。オメプラゾールの硫化物およびスルホン誘導体、およびヒドロキシオメプラゾールの 3 つの代謝物が血漿中で同定されています。これらの代謝産物には、抗分泌活性がほとんどまたはまったくありません。
抗菌薬との併用療法
オメプラゾール 40 mg を毎日 500 mg のクラリスロマイシンと組み合わせて、8 時間ごとに健康な成人男性被験者に投与しました。クラリスロマイシンの同時投与により、オメプラゾールの定常状態の血漿濃度が増加した (Cmax、AUC0-24、および T1/2 がそれぞれ 30%、89%、および 34% 増加)。観察されたオメプラゾール血漿濃度の増加は、以下の薬理学的効果と関連していました。平均 24 時間胃内 pH 値は、オメプラゾールを単独で投与した場合、クラリスロマイシンと併用投与した場合で 5.7 でした。
クラリスロマイシンおよび14-ヒドロキシ-クラリスロマイシンの血漿中濃度は、オメプラゾールの同時投与によって増加した。クラリスロマイシンについては、クラリスロマイシンをオメプラゾールと一緒に投与した場合、クラリスロマイシンを単独で投与した場合よりも、平均 Cmax が 10% 大きく、平均 Cmin が 27% 大きく、平均 AUC0-8 が 15% 大きかった。 14-ヒドロキシ-クラリスロマイシンについても同様の結果が見られ、平均 Cmax は 45% 大きく、平均 Cmin は 57% 大きく、平均 AUC0-8 は 45% 大きかった。胃組織および粘液中のクラリスロマイシン濃度もまた、オメプラゾールの同時投与によって増加した。
特定の集団
高齢患者
高齢者ではオメプラゾールの排泄率がやや低下し、バイオアベイラビリティが増加しました。オメプラゾールの生物学的利用能は、40 mg のオメプラゾール (緩衝溶液) を健康な高齢者ボランティアに単回経口投与した場合に 76% であったのに対し、同じ用量を投与した若いボランティアでは 58% でした。投与量のほぼ 70% がオメプラゾールの代謝物として尿中に回収され、未変化の薬物は検出されませんでした。オメプラゾールの血漿クリアランスは 250 mL/分 (若いボランティアの約半分) で、その血漿半減期は平均 1 時間で、若い健康なボランティアの約 2 倍でした。
小児患者
2歳から16歳
オメプラゾールの薬物動態は、2 ~ 16 歳の小児患者で調査されています。
同等の mg/kg 用量のオメプラゾールを投与した後、年少の子供 (2 ~ 5 歳) は、6 ~ 16 歳の子供または成人よりも AUC が低くなります。後者の 2 つのグループの AUC に違いはありませんでした [ 投薬と管理 ]。
生後1~11ヶ月
集団薬物動態モデルを使用して、小児患者におけるPRILOSEC 40mgの適切な用量を決定しました
酸媒介GERDによるびらん性食道炎の治療(最大6週間)のための生後1か月から1歳未満。このモデルは、生後 0.5 か月から 16 歳までの 64 人の子供のデータに基づいています。 1 歳未満の子供については限られたデータしか入手できませんでした。オメプラゾールは、これらの研究で遅延放出カプセルから調製された経口懸濁液として小児患者に投与されました。小児用量は、1 日 1 回 20 mg の治療後に成人と同等のオメプラゾール曝露を達成するために、1 ~ 11 ヶ月の年齢グループでシミュレートされました [ 投薬と管理 ]。
人種または民族グループ
[見る 臨床薬理学 ]。
腎障害のある患者
慢性腎障害 (クレアチニンクリアランス 10 ~ 62 mL/min/1.73 m²) の患者では、バイオアベイラビリティがわずかに増加したものの、オメプラゾールの体内動態は健康な被験者の体内動態と非常に似ていました。尿中排泄はオメプラゾール代謝産物の主要な排泄経路であるため、クレアチニンクリアランスの減少に比例して排泄が遅くなります。このバイオアベイラビリティの増加は、臨床的に意味があるとは考えられていません。
肝障害のある患者
Child-Pugh クラス A (n=3)、B (n=4)、および C (n=1) に分類される慢性肝疾患の患者では、バイオアベイラビリティが健康な被験者と比較して約 100% に増加しました。効果、および薬物の血漿半減期は、健康な被験者の半減期が 0.5 ~ 1 時間であるのに比べて、ほぼ 3 時間に増加しました。血漿クリアランスは、健常者の値が 500 ~ 600 mL/min であるのと比較して、平均 70 mL/min でした [参照 投薬と管理 、 特定の集団での使用 ]。
薬物相互作用研究
他の薬に対するオメプラゾールの効果
オメプラゾールは CYP2C19 の時間依存的阻害剤であり、CYP2C19 基質である同時投与薬物の全身曝露を増加させる可能性があります。さらに、オメプラゾールの投与は胃内 pH を上昇させ、pH 依存性の溶解度を示す特定の薬物の全身曝露を変化させる可能性があります。
抗レトロウイルス薬
リルピビリン、アタザナビル、ネルフィナビルなどの一部の抗レトロウイルス薬では、オメプラゾールと一緒に投与すると血清濃度の低下が報告されている[参照 薬物相互作用 ]。
リルピビリン: リルピビリン(毎日 150 mg)とオメプラゾール(毎日 20 mg)の複数回投与後、リルピビリンでは AUC が 40%、Cmax が 40%、Cmin が 33% 減少しました。
ネルフィナビル: ネルフィナビル (1250 mg、1 日 2 回) とオメプラゾール (1 日 40 mg) の複数回投与後、AUC は 36% と 92% 減少し、Cmax は 37% と 89% 減少し、Cmin はネルフィナビルと M8 でそれぞれ 39% と 75% 減少しました。 .
アタザナビル: アタザナビル (毎日 400 mg) とオメプラゾール (毎日 40 mg、アタザナビルの 2 時間前) の複数回投与後、AUC は 94%、Cmax は 96%、Cmin は 95% 減少しました。
サキナビル: サキナビル/リトナビル (1000/100 mg) を 1 日 2 回、15 日間反復投与した後、オメプラゾール 40 mg を 11 日目から 15 日目に毎日同時投与。
AUC は 82%、Cmax は 75%、Cmin は 106% 増加しました。この相互作用の背後にあるメカニズムは完全には解明されていません。
クロピドグレル
クロスオーバー臨床試験では、72 人の健康な被験者に、クロピドグレル (300 mg の負荷量に続いて 1 日あたり 75 mg) を単独で、およびオメプラゾール (クロピドグレルと同時に 80 mg) とともに 5 日間投与しました。クロピドグレルとオメプラゾールを一緒に投与した場合、クロピドグレルの活性代謝物への曝露は 46% (1 日目) および 42% (5 日目) 減少しました。
健康な被験者を対象とした別のクロスオーバー研究の結果は、30 日間同時投与した場合、クロピドグレル (負荷用量 300 mg/日維持用量 75 mg) とオメプラゾール 80 mg/日との間で同様の薬物動態学的相互作用を示しました。クロピドグレルの活性代謝物への曝露は、この期間で 41% から 46% 減少しました。
別の研究では、72人の健康な被験者に同じ用量のクロピドグレルと80mgのオメプラゾールが投与されましたが、薬物は12時間間隔で投与されました。結果は類似しており、クロピドグレルとオメプラゾールを異なる時間に投与しても、それらの相互作用が妨げられないことを示しています [ 警告と注意事項 、 薬物相互作用 ]。
ミコフェノール酸モフェチル
オメプラゾール 20 mg を 1 日 2 回 4 日間投与し、オメプラゾールの最後の投与の約 1 時間後に 1000 mg の MMF を 1 回投与したクロスオーバー試験では、12 人の健康な被験者に Cmax が 52% 減少し、23% が減少しました。 MPA の AUC [参照 薬物相互作用 ]。
シロスタゾール
オメプラゾールは CYP2C19 の阻害剤として作用します。クロスオーバー試験で 20 人の健康な被験者に 1 週間、毎日 40 mg の用量で投与されたオメプラゾールは、シロスタゾールの Cmax と AUC をそれぞれ 18% と 26% 増加させました。シロスタゾールの 4 ~ 7 倍の活性を持つ活性代謝物の 1 つである 3,4-ジヒドロシロスタゾールの Cmax と AUC は、それぞれ 29% と 69% 増加しました。シロスタゾールとオメプラゾールの同時投与は、シロスタゾールと上記の活性代謝物の濃度を増加させると予想される[ 薬物相互作用 ]。
ジアゼパム
オメプラゾール 20 mg を 1 日 1 回投与し、ジアゼパム 0.1 mg/kg を静脈内投与すると、クリアランスが 27% 減少し、ジアゼパムの半減期が 36% 増加しました。 薬物相互作用 ]。
ジゴキシン
健康な被験者にオメプラゾール 20 mg を 1 日 1 回投与し、ジゴキシンを併用投与すると、ジゴキシンのバイオアベイラビリティが 10% 増加しました (被験者 2 人で 30%) [参照 薬物相互作用 ]。
オメプラゾールに対する他の薬剤の効果
ボリコナゾール
オメプラゾールとボリコナゾール (CYP2C19 と CYP3A4 の複合阻害剤) の同時投与により、オメプラゾール曝露が 2 倍以上になりました。健康な被験者にボリコナゾール (400 mg を 12 時間ごとに 1 日、その後 200 mg を 1 日 1 回、6 日間) をオメプラゾール (40 mg を 1 日 1 回、7 日間) とともに投与した場合、オメプラゾールの定常状態の Cmax および AUC0-24有意に増加: ボリコナゾールなしでオメプラゾールを投与した場合と比較して、それぞれ平均 2 倍 (90% CI: 1.8、2.6) および 4 倍 (90% CI: 3.3、4.4) 薬物相互作用 ]。
微生物学
オメプラゾールとクラリスロマイシンの 2 剤療法、およびオメプラゾール、クラリスロマイシン、アモキシシリンの 3 剤療法は、in vitro および臨床感染症において、ほとんどのヘリコバクター ピロリ菌株に対して有効であることが示されています [ 適応症と使用法 、 臨床研究 ]。
ヘリコバクター・ピロリ
H. pylori 分離株の感受性試験は、アモキシシリンとクラリスロマイシンについて、寒天希釈法 1 を使用して実施され、最小発育阻止濃度 (MIC) が決定されました。
標準化された感受性試験手順では、実験室手順の技術的側面を管理するために実験室管理微生物を使用する必要があります。
前処理耐性
クラリスロマイシン治療前の耐性率は、オメプラゾール/クラリスロマイシンの二重療法の研究 (4 および 5) で 3.5% (4/113)、オメプラゾール/クラリスロマイシン/アモキシシリンの三剤療法の研究 (1、2、および 3) で 9.3% (41/439) でした。
オメプラゾール/クラリスロマイシン/アモキシシリンの 3 剤併用療法研究では、患者の 99.3% (436/439) でアモキシシリン前処理感受性分離株 (≤ 0.25 μg/mL) が検出されました (1、2、および 3)。アモキシシリン治療前の最小発育阻止濃度 (MIC) > 0.25 μg/mL は患者の 0.7% (3/439) で発生し、その全員がクラリスロマイシンおよびアモキシシリン研究群に属していました。 1 人の患者は、Etest® による未確認の治療前アモキシシリン最小発育阻止濃度 (MIC) > 256 μg/mL でした。
オメプラゾール/クラリスロマイシン/アモキシシリンの 3 剤併用療法またはオメプラゾール/クラリスロマイシンの 2 剤併用療法後にピロリ菌が根絶されなかった患者は、クラリスロマイシン耐性のピロリ菌分離株を有する可能性が高い。したがって、可能であれば、クラリスロマイシン感受性試験を行う必要があります。クラリスロマイシン耐性 H. pylori の患者は、次のいずれの治療も行うべきではありません。
アモキシシリン感受性試験の結果と臨床的/細菌学的結果
剤療法の臨床試験では、オメプラゾール/クラリスロマイシン/アモキシシリン治療群の患者の 84.9% (157/185) で、治療前にアモキシシリン感受性 MIC (≤ 0.25 μg/mL) があり、ピロリ菌が除菌され、15.1% (28 /185) 治療に失敗しました。 3 剤併用療法に失敗した 28 人の患者のうち、11 人は治療後の感受性試験の結果がなく、17 人は治療後にアモキシシリン感受性 MIC を含むピロリ菌分離株がありました。 3 剤併用療法に失敗した 11 人の患者は、治療後にクラリスロマイシン耐性 MIC を伴うピロリ菌分離株も持っていました。
ヘリコバクター・ピロリの感受性試験
ヘリコバクター ピロリに関する感受性試験の情報については、クラリスロマイシンおよびアモキシシリンの処方情報の微生物学のセクションを参照してください。
消化管微生物生態への影響
プロトンポンプ阻害剤を含む何らかの手段による胃酸の減少は、胃腸管に通常存在する細菌の胃内数を増加させます.プロトンポンプ阻害剤による治療は、サルモネラ菌やカンピロバクターなどの胃腸感染症のリスクをわずかに増加させる可能性があり、入院患者ではクロストリジウム・ディフィシルも発生する可能性があります.
ファーマコゲノミクス
多型酵素であるCYP2C19は、オメプラゾールの代謝に関与しています。 CYP2C19*1 対立遺伝子は完全に機能しますが、CYP2C19*2 および *3 対立遺伝子は機能しません。酵素機能がない、または酵素機能の低下に関連する他の対立遺伝子があります。 2 つの完全に機能する対立遺伝子を持つ患者は高代謝型であり、2 つの機能喪失型対立遺伝子を持つ患者は低代謝型です。広範代謝者では、オメプラゾールは主に CYP2C19 によって代謝されます。
オメプラゾールへの全身暴露は、患者の代謝状態によって異なります: 低代謝者 > 中間代謝者 > 高代謝者.白人の約 3%、アジア人の 15 ~ 20% が CYP2C19 の代謝不良者です。
オメプラゾール 20 mg 単回投与の薬物動態研究では、アジア人被験者のオメプラゾールの AUC は、白人の約 4 倍でした [ 投薬と管理 、 特定の集団での使用 ]。
臨床研究
活動性十二指腸潰瘍
内視鏡検査で十二指腸潰瘍が確認された 147 人の患者を対象とした多施設二重盲検プラセボ対照研究では、2 週間および 4 週間で治癒した患者の割合 (プロトコルごと) は、オメプラゾール マグネシウム遅延放出カプセル 20 mg を 1 日 1 回投与した場合よりも有意に高かった。プラセボ (p ≤ 0.01)。
活動性十二指腸潰瘍の治療 治癒した患者の割合
オメプラゾールマグネシウム遅延放出カプセル20 mgで治療された患者では、プラセボで治療された患者よりも、完全な日中および夜間の疼痛緩和が有意に速く発生しました(p ≤ 0.01)。研究の最後に、オメプラゾール マグネシウム遅延放出カプセルを投与された有意に多くの患者が、日中の痛み (p ≤ 0.05) と夜間の痛み (p ≤ 0.01) を完全に緩和しました。
内視鏡検査で記録された十二指腸潰瘍の 293 人の患者を対象とした多施設二重盲検研究では、4 週間で (プロトコルごとに) 治癒した患者の割合は、オメプラゾール マグネシウム遅延放出カプセル 20 mg を 1 日 1 回投与した場合の方が、ラニチジン 150 mg を 1 日 2 回投与した場合よりも有意に高かった ( p
活動性十二指腸潰瘍の治療 治癒した患者の割合
オメプラゾールマグネシウム遅延放出カプセルで治療された患者では、ラニチジン 150 mg 1 日 2 回で治療された患者よりも治癒が有意に速く発生しました (p
内視鏡検査で記録された十二指腸潰瘍を有する 105 人の患者を対象とした外国の多国籍無作為化二重盲検試験では、20 mg および 40 mg のオメプラゾール マグネシウム遅延放出カプセルが、2、4、および 8 週間でラニチジン 150 mg の 1 日 2 回投与と比較されました。 2 週間と 4 週間の時点で、PRILOSEC 10 mg の用量はいずれもラニチジンより統計的に優れていましたが (プロトコルに従って)、40 mg は 20 mg のオメプラゾール マグネシウム遅延放出カプセルよりも優れていませんでした。アクティブな薬。
活動性十二指腸潰瘍の治療 治癒した患者の割合
十二指腸潰瘍患者におけるピロリ菌の除菌
トリプル セラピー (オメプラゾール マグネシウム遅延放出カプセル/クラリスロマイシン/アモキシシリン)
ピロリ菌感染症および十二指腸潰瘍疾患の患者(n = 558)を対象とした 3 つの米国の無作為化二重盲検臨床試験では、オメプラゾール マグネシウム遅延放出カプセルとクラリスロマイシンおよびアモキシシリンをクラリスロマイシンとアモキシシリンと比較しました。 2 つの研究 (1 および 2) は、活動性の十二指腸潰瘍を有する患者で実施され、もう 1 つの研究 (3) は、過去 5 年間に十二指腸潰瘍の病歴があり、登録時に潰瘍が存在しない患者で実施されました。 .研究における投与レジメンは、オメプラゾールマグネシウム遅延放出カプセル20mgを1日2回、クラリスロマイシン500mgを1日2回、アモキシシリン1gを1日2回、10日間投与した。または、クラリスロマイシン 500 mg を 1 日 2 回、アモキシシリン 1 g を 1 日 2 回、10 日間。研究 1 および 2 では、オメプラゾール レジメンを服用した患者は、オメプラゾール マグネシウム遅延放出カプセル 20 mg を 1 日 1 回、さらに 18 日間投与されました。調査されたエンドポイントは、ピロリ菌の根絶と十二指腸潰瘍の治癒でした (調査 1 と 2 のみ)。ヘリコバクター ピロリの状態は、3 つの研究すべてにおいて、CLOtest®、組織学、および培養によって決定されました。特定の患者について、これらの検査のうち少なくとも 2 つが陰性で、陽性が 1 つもなかった場合、H. pylori は根絶されたと見なされます。
オメプラゾールとクラリスロマイシンとアモキシシリンの組み合わせは、ピロリ菌の根絶に効果的でした。
二重療法(オメプラゾールマグネシウム遅延放出カプセル/クラリスロマイシン)
つのランダム化二重盲検多施設研究 (4、5、6、および 7) では、オメプラゾール マグネシウム遅延放出カプセル 40 mg を 1 日 1 回投与し、さらにクラリスロマイシン 500 mg を 1 日 3 回 14 日間投与した後、オメプラゾール マグネシウム遅延放出カプセルを評価しました。 H. pyloriに関連する活動性十二指腸潰瘍の患者に、カプセル20mgを1日1回(研究4、5、および7)、またはオメプラゾールマグネシウム遅延放出カプセル40mgを1日1回(研究6)さらに14日間投与した。研究 4 と 5 は米国とカナダで実施され、それぞれ 242 名と 256 名の患者が登録されました。 H. pylori 感染と十二指腸潰瘍は、研究 4 では 219 人の患者、研究 5 では 228 人の患者で確認されました。研究 6 と 7 はヨーロッパで実施され、それぞれ 154 名と 215 名の患者が登録されました。 H. pylori 感染および十二指腸潰瘍は、研究 6 では 148 人の患者、研究 7 では 208 人の患者で確認されました。これらの研究では、併用レジメンとオメプラゾール単剤療法を比較しました。これらの研究の有効性分析の結果を以下に示します。 H. pylori の根絶は、治療終了後 4 週間で陽性検査 (培養または組織学) がないことと定義され、H. pylori が根絶されたと見なされるには 2 つの陰性検査が必要でした。プロトコルごとの分析では、次の患者は除外されました:脱落者、治療後にピロリ菌検査が欠落している患者、および治療の最後に潰瘍があることが判明したためにピロリ菌の除菌が評価されなかった患者。 .
オメプラゾールとクラリスロマイシンの組み合わせは、ピロリ菌の根絶に効果的でした。
オメプラゾール単独療法と比較して、オメプラゾール療法にクラリスロマイシンを追加した場合、潰瘍の治癒に有意差はありませんでした。
オメプラゾールとクラリスロマイシンの組み合わせは、ピロリ菌の根絶と十二指腸潰瘍の再発の減少に効果的でした。
活動性良性胃潰瘍
内視鏡的に胃潰瘍と診断された 520 人の患者を対象に、オメプラゾール 40 mg を 1 日 1 回、20 mg を 1 日 1 回、プラセボを投与した米国の多施設二重盲検試験では、次の結果が得られました。
胃潰瘍の治療 治癒した患者の割合 (すべての患者が治療を受けた)
潰瘍のサイズが 1 cm 以下の層別グループでは、40 mg と 20 mg の間で治癒率の差は 4 週間または 8 週間で検出されませんでした。潰瘍の大きさが 1 cm を超える患者では、8 週間で 40 mg が 20 mg よりも有意に効果的でした。
内視鏡的に胃潰瘍と診断された 602 人の患者を対象とした海外の多国籍二重盲検試験では、オメプラゾール 40 mg 1 日 1 回、20 mg 1 日 1 回、およびラニチジン 150 mg 1 日 2 回が評価されました。
胃潰瘍の治療 治癒した患者の割合 (すべての患者が治療を受けた)
症候性GERD
スカンジナビアでプラセボ対照試験が実施され、EE のない GERD 患者の胸やけやその他の症状の治療において、オメプラゾール 20 mg または 10 mg を 1 日 1 回、最大 4 週間投与した場合の有効性が比較されました。結果を以下に示します。
% 成功した症候性転帰1
酸媒介GERDによるEE
GERD の症状があり、内視鏡的に診断されたグレード 2 以上の EE を有する患者を対象とした 20 mg または 40 mg のオメプラゾール マグネシウム遅延放出カプセルの米国多施設二重盲検プラセボ対照研究では、治癒率 (プロトコルごと) のパーセンテージは次のとおりでした。 :
この研究では、40 mg の用量は、オメプラゾール マグネシウム遅延放出カプセルの 20 mg の用量よりも治癒率のパーセンテージが優れていませんでした。他の対照臨床試験でも、オメプラゾール マグネシウム遅延放出カプセルが重度の GERD に有効であることが示されています。グレード 2 以上の EE 患者におけるヒスタミン H2 受容体拮抗薬との比較では、20 mg のオメプラゾール マグネシウム遅延放出カプセルは、アクティブ コントロールよりも有意に効果的でした。オメプラゾールマグネシウム遅延放出カプセルで治療された患者では、プラセボまたはヒスタミンH2受容体拮抗薬を服用している患者よりも、日中および夜間の胸やけの完全な軽減が有意に速く発生しました(p
このおよび他の 5 つの管理された GERD 研究では、20 mg のオメプラゾールを服用した患者 (84%) が、プラセボを服用した患者 (12%) よりも有意に多くの GERD 症状の完全な軽減を報告しました。
酸媒介GERDによるEEの治癒の維持
米国の二重盲検無作為化多施設プラセボ対照試験では、内視鏡検査で食道炎が治癒したことが確認された患者を対象に、オメプラゾールマグネシウム遅延放出カプセルの 2 つの用量レジメンが試験されました。 EE の治癒の維持を決定するための結果を以下に示します。
生命表分析
国際的な多施設二重盲検試験では、内視鏡検査で食道炎の治癒が確認された患者を対象に、オメプラゾール マグネシウム遅延放出カプセル 1 日 20 mg および 1 日 10 mg をラニチジン 150 mg 1 日 2 回と比較しました。以下の表は、EE の治癒の維持に関するこの研究の結果を示しています。
生命表分析
最初にグレード3または4のびらん性食道炎を患っていた患者では、治癒後の維持のために、オメプラゾールマグネシウム遅延放出カプセルの1日20 mgが有効でしたが、10 mgでは有効性が示されませんでした.
病的な過剰分泌状態
多発性内分泌腺腫を伴うまたは伴わないゾリンジャー・エリソン (ZE) 症候群などの病理学的過剰分泌状態を有する 136 人の患者を対象とした公開研究では、オメプラゾールマグネシウム遅延放出カプセルが胃酸分泌を有意に抑制し、関連する下痢、食欲不振、および痛みの症状を制御しました。一日おきに 20 mg から 1 日 360 mg の用量で、胃手術歴のない患者では基礎酸分泌を 10 mEq/hr 未満に、胃手術歴のある患者では 5 mEq/hr 未満に維持しました。
初期用量は個々の患者のニーズに合わせて漸増され、一部の患者では時間の経過とともに調整が必要になりました[参照 投薬と管理 ]。オメプラゾール マグネシウム遅延放出カプセルは、これらの高用量レベルで長期間 (一部の患者では 5 年以上) 耐容性が良好でした。ほとんどの ZE 患者では、血清ガストリン レベルはオメプラゾール マグネシウム遅延放出カプセルによって変更されませんでした。しかし、一部の患者では、血清ガストリンがオメプラゾール療法の開始前よりも高いレベルまで上昇しました。オメプラゾールマグネシウム遅延放出カプセルによる長期治療を受けているZE症候群の少なくとも11人の患者が、胃カルチノイドを発症しました。これらの所見は、オメプラゾール マグネシウム遅延放出カプセルの投与の結果ではなく、そのような腫瘍に関連することが知られている基礎疾患の徴候であると考えられています。 有害反応 ]。
症候性 GERD の治療、酸媒介性 GERD による EE の治療、および酸媒介性 GERD による EE の治癒の維持に関する小児研究
症候性GERDの治療
~ 16 歳の小児患者における症候性 GERD の治療に対するオメプラゾール マグネシウム遅延放出カプセルの有効性は、2 つの非対照臨床試験で 125 人の小児患者から得られたデータに部分的に基づいています。
最初の研究では、臨床的にGERDと診断された病歴のある1~2歳の小児患者12人が登録されました。患者は、8.4%重炭酸ナトリウム溶液中のオープンカプセルとして、オメプラゾール(0.5mg/kg、1mg/kg、または1.5mg/kg)の単回用量を8週間投与されました。患者の 75% (9/12) で、嘔吐/逆流のエピソードがベースラインから少なくとも 50% 減少しました。
番目の研究では、症候性 GERD を示唆する症状の病歴を持つ 2 歳から 16 歳までの 113 人の小児患者が登録されました。患者は、オメプラゾール (体重に基づいて 10 mg または 20 mg) の単回投与を、無傷のカプセルまたはアップルソースのオープン カプセルとして 4 週間投与されました。有効な応答は、治療の最後の 4 日間に、痛みに関連する症状または嘔吐/逆流のいずれかの中等度または重度のエピソードがないこととして定義されました。結果は、それぞれ 60% (9/15; オメプラゾール 10 mg) および 59% (58/98; オメプラゾール 20 mg) の成功率を示しました。
酸媒介GERDによるEEの治療
制御されていない非盲検の用量漸増研究では、1 ~ 16 歳の小児患者の EE の治療には、0.7 ~ 3.5 mg/kg/日 (80 mg/日) の範囲の用量が必要でした。用量は、0.7 mg/kg/日で開始されました。用量は、0.7 mg/kg/日の増分で増加されました (24 時間試験の 6% 未満で食道内 pH が
酸媒介GERDによるEEの治癒の維持
歳から 16 歳までの 46 人の小児患者における EE の治癒の維持に関する非対照の非盲検試験では、患者の 54% が治癒用量の半分を必要としました。残りの患者は、維持期間全体にわたって治癒用量を増加させるか (0.7 から最大 2.8 mg/kg/日)、または完了前に用量の半分に戻しました。維持期に入った 46 人の患者のうち、19 人 (41%) は追跡期間中 (範囲 4 ~ 25 か月) 再発しませんでした。さらに、EE 患者の維持療法により、63% の患者で全体的な症状がなくなりました。
参考文献
1. Clinical and Laboratory Standards Institute (CLSI)。好気的に増殖する細菌の希釈抗菌薬感受性試験の方法。承認された標準 - 第 10 版。 CLSI ドキュメント M07-A10、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania、19087、USA 2015。
患者情報
PRILOSEC® (pry-lo-sec) (オメプラゾール マグネシウム) 遅延放出経口懸濁液用
PRILOSEC について知っておくべき最も重要な情報は何ですか?
PRILOSEC 10mg は胃酸関連の症状を改善する可能性がありますが、深刻な胃の問題が残る可能性があります。医師に相談してください。
PRILOSEC は、次のような重大な副作用を引き起こす可能性があります。
- 腎臓の問題の一種(急性尿細管間質性腎炎)。 PRILOSEC を含むプロトンポンプ阻害薬 (PPI) 薬を服用している一部の人々は、PRILOSEC による治療中にいつでも発生する可能性のある急性尿細管間質性腎炎と呼ばれる腎臓の問題を発症する可能性があります。尿の量が減ったり、尿に血が混じったりした場合は、すぐに医師に連絡してください。
- 腸内の感染症 (クロストリジウム ディフィシル) によって引き起こされる下痢。 水様便や胃の痛みが治まらない場合は、すぐに医師に連絡してください。熱がある場合とない場合があります。
- 骨折(股関節、手首、または背骨)。 股関節、手首、または脊椎の骨折は、PPI 薬を 1 日複数回、長期間 (1 年以上) 服用している人に発生する可能性があります。特に股関節、手首、脊椎に骨折がある場合は、医師に相談してください。
- 特定の種類のエリテマトーデス。 エリテマトーデスは自己免疫疾患です (体の免疫細胞が体内の他の細胞や臓器を攻撃します)。 PRILOSEC 10mgを含むPPI薬を服用している一部の人々は、特定の種類のエリテマトーデスを発症するか、すでに持っているループスが悪化する可能性があります.関節痛が新たに発生したり、悪化したり、頬や腕に発疹ができたり、太陽の下で悪化したりする場合は、すぐに医師に連絡してください.
これらの深刻な副作用のリスクについて医師に相談してください。 PRILOSEC 10mg には、他にも重大な副作用がある可能性があります。 「PRILOSEC 20mg で考えられる副作用は何ですか?」を参照してください。
プリロセック20mgとは?
胃酸の量を減らすために使用されるプロトンポンプ阻害剤 (PPI) と呼ばれる処方薬。
成人では、 PRILOSEC 20mg は以下の目的で使用されます。
- 十二指腸潰瘍の治癒には最大8週間。
- ピロリ菌と呼ばれる細菌によって引き起こされる感染症を治療するために、特定の抗生物質を 10 ~ 14 日間使用します。必要に応じて、医師は抗生物質による治療後、さらに 14 ~ 18 日間の PRILOSEC を処方することがあります。
- 胃潰瘍の治癒には最大8週間。
- 胃食道逆流症(GERD)で起こる胸やけやその他の症状を治療するために最大4週間。
- 食道の内層への酸関連の損傷(びらん性食道炎またはEEと呼ばれる)の治癒と症状の軽減のために最大8週間。医師は、EE が治癒しない患者に PRILOSEC 20mg をさらに 4 週間処方することがあります。
- EE の治癒を維持し、GERD によって引き起こされる胸焼け症状の再発を防ぐのに役立ちます。この目的で 12 か月以上使用した場合、PRILOSEC が安全で効果的であるかどうかは不明です。
- 胃酸過多状態の長期治療。これには、ゾリンジャー・エリソン症候群と呼ばれるまれな状態が含まれます。
1歳から16歳の子供では、 PRILOSEC 20mg は以下の目的で使用されます。
- GERDで起こる胸やけやその他の症状を治療するために最大4週間。
- EEでGERDを治療するのに最大8週間。
- EE の治癒を維持し、GERD によって引き起こされる胸焼け症状の再発を防ぐのに役立ちます。この目的で 12 か月以上使用した場合の PRILOSEC の安全性と有効性は不明です。
生後1ヶ月から12ヶ月未満のお子様は、 PRILOSEC 10mg は以下の目的で使用されます。
- EEでGERDを治療するのに最大6週間。 PRILOSEC が生後 1 か月から 12 か月未満の子供、または生後 1 か月未満の子供の他の用途に安全かつ有効であるかどうかはわかっていません。
次の場合はプリロセックを服用しないでください。
- オメプラゾール、他のPPI薬、またはPRILOSECの成分のいずれかにアレルギーがある.成分の完全なリストについては、この投薬ガイドの最後を参照してください。
- HIV-1(ヒト免疫不全ウイルス)の治療に使用されるリルピビリン(EDURANT、COMPLERA、ODEFSEY)を含む薬を服用している。
PRILOSEC 20mg を服用する前に、次の場合を含め、すべての病状について医師に相談してください。
- 血液中のマグネシウム濃度、カルシウム濃度、カリウム濃度が低い。
- 妊娠している、または妊娠する予定がある。 PRILOSEC 10mg が胎児に害を及ぼすかどうかは不明です。
- 授乳中または授乳を計画している。 PRILOSEC 40mg は母乳に移行する可能性があります。 PRILOSEC を服用する場合は、赤ちゃんに与える最善の方法について医師に相談してください。
- 服用しているすべての薬について医師に伝えてください。 処方薬、市販薬、ビタミン、ハーブサプリメントを含みます。 特に服用する場合は医師に伝えてください クラリスロマイシンまたはアモキシシリン、クロピドグレル(Plavix)、メトトレキサート(Otrxup、Rasuvo、Trexall、XATMEP)、ジゴキシン(LANOXIN)、ウォーターピル(利尿薬)、セントジョーンズワート(Hypericum perforatum)、またはリファンピンを含む薬(Rimactane、Rifater、Rifamate)。
PRILOSEC 20mg の服用方法は?
- PRILOSEC 20mg を医師の指示どおりに服用してください。
- 医師に相談せずに、用量を変更したり、PRILOSEC 40mg を中止したりしないでください。
- PRILOSEC は通常、1 日 1 回服用します。
- 食前にプリロセック20mgを服用してください。
- PRILOSEC と一緒に制酸剤を服用することもできます。
- PRILOSEC は水と混合し、経口摂取するか、経鼻胃管 (NG) チューブまたは胃管を通して投与することができます。
- を参照してください 「使用上の注意」 PRILOSEC 10mg を水に混ぜて口から服用する方法、または水に混ぜた NG チューブまたは胃管を介して PRILOSEC を混ぜて投与する方法については、この投薬ガイドの最後を参照してください。
- PRILOSEC を飲み忘れた場合は、気がついたらすぐに服用してください。次の服用時間が近い場合は、飲み忘れた分は飲まないでください。次の1回量をいつもの時間に服用してください。 2回分を同時に服用しないでください。
- PRILOSEC の服用量が多すぎる場合は、すぐに医師または毒物管理センター (1-800-222-1222) に電話するか、最寄りの緊急治療室に行ってください。
PRILOSEC 40mg の副作用の可能性は何ですか?
PRILOSEC は、次のような重大な副作用を引き起こす可能性があります。
- 見る 「PRILOSEC 40mg について知っておくべき最も重要な情報は何ですか?」
- 低ビタミン B-12 レベル PRILOSEC 40mgを長期間(3年以上)服用している人は、体に異常が起こることがあります。息切れ、立ちくらみ、不整脈、筋力低下、肌の青白さ、疲労感、気分の変化、腕や脚のうずきやしびれなど、ビタミン B-12 レベルの低下の症状がある場合は、医師に相談してください。
- 体内のマグネシウムレベルとミネラル代謝が低い PRILOSEC を 3 か月以上服用している場合に発生する可能性があります。痙攣、めまい、不整脈、神経質、筋肉痛、筋力低下、手、足、声のけいれんなど、低マグネシウム レベルの症状がある場合は、医師に相談してください。
- 胃の成長(胃底腺ポリープ)。 長期間 PPI 薬を服用している人は、特に PPI 薬を 1 年以上服用した後に、胃底腺ポリープと呼ばれる特定のタイプの胃の成長を発症するリスクが高くなります.
- 重度の皮膚反応。 PRILOSEC は、体のあらゆる部分に影響を与える可能性のある、まれではあるが重度の皮膚反応を引き起こす可能性があります。これらの深刻な皮膚反応は、病院で治療する必要があり、生命を脅かす可能性があります。
- 皮膚のあらゆる部分(唇、目、口、鼻、性器、手または足を含む)に水ぶくれ、はがれ、または出血がある皮膚発疹。
- また、発熱、悪寒、体の痛み、息切れ、またはリンパ節の腫大がみられることもあります。
PRILOSEC 20mg の服用を中止し、すぐに医師に連絡してください。これらの症状は、重度の皮膚反応の最初の兆候である可能性があります。
成人における PRILOSEC 40mg の最も一般的な副作用は次のとおりです。 頭痛、胃部(腹部)の痛み、吐き気、下痢、嘔吐、ガス。
1 歳から 16 歳までの小児における PRILOSEC の最も一般的な副作用は次のとおりです。 上気道感染、発熱、頭痛、胃部(腹部)の痛み、吐き気、下痢、嘔吐、ガス。これらは、PRILOSEC の考えられるすべての副作用ではありません。副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
PRILOSEC 40mg の保存方法を教えてください。
PRILOSEC は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
PRILOSEC 20mg およびすべての医薬品は、子供の手の届かないところに保管してください。
PRILOSEC の安全で効果的な使用に関する一般的な情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 PRILOSEC が処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、プリロセック 40mg を与えないでください。それらに害を及ぼす可能性があります。医療従事者向けに書かれた PRILOSEC 20mg に関する情報については、医師または薬剤師にお尋ねください。
PRILOSECの成分は何ですか?
有効成分: オメプラゾールマグネシウム
不活性成分: グリセリルモノステアレート、ヒドロキシプロピルセルロース、ヒプロメロース、ステアリン酸マグネシウム、メタクリル酸コポリマーC、ポリソルベート、糖球、タルク、クエン酸トリエチル、および不活性顆粒。不活性顆粒は、クエン酸、クロスポビドン、デキストロース、ヒドロキシプロピルセルロース、酸化鉄、キサンタンガムで構成されています。
使用説明書
PRILOSEC® (pry-lo-sec) (オメプラゾール マグネシウム) 遅延放出経口懸濁液用
プリロセック 40mg を水で服用する場合:
経鼻胃管(NG)または胃管を通してプリロセックに水を与える:
サイズ 6 以上の NG チューブまたは胃チューブを使用している人には、次のように PRILOSEC を投与できます。
この投薬ガイドは、米国食品医薬品局によって承認されています
